Мутантный fsh и способы его применения
Формула / Реферат
1. Нуклеиновая кислота, кодирующая мутантную a-субъединицу ФСГ, где a-субъединица содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:4-5.
2. Вектор, содержащий нуклеиновую кислоту по п.1.
3. Вектор по п.2, который представляет собой вектор экспрессии.
4. Вектор по п.2, дополнительно содержащий нуклеиновую кислоту, кодирующую b-субъединицу ФСГ, содержащую последовательность SEQ ID NO:3.
5. Клетка-хозяин, содержащая вектор по п.2.
6. Клетка-хозяин по п.5, которая представляет собой клетку млекопитающего.
7. Мутантный ФСГ, в котором b-субъединица содержит последовательность ID NO:3 и a-субъединица кодируется нуклеиновой кислотой по п.1 и содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:4-5.
8. Мутантный ФСГ по п.7, в котором любые из 1-6 остатков аспарагина гликозилированы.
9. Мутантный ФСГ по п.7, в котором a-субъединица содержит последовательность ID NO:4, в которой N5 гликозилирован.
10. Мутантный ФСГ по п.7, в котором a-субъединица содержит последовательность SEQ ID NO:5, в которой N5 гликозилирован.
11. Способ получения мутантного ФСГ, включающий:
(a) получение клетки, содержащей нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую b-субъединицу ФСГ, содержащую SEQ ID NO:3;
(b) культивирование клетки в условиях, которые делают возможной экспрессию первой и второй нуклеиновых кислот;
(c) получение мутантного ФСГ.
12. Способ по п.11, в котором клетка способна гликозилировать белок.
13. Способ по п.11, в котором клетка содержит один вектор, включающий нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую b-субъединицу ФСГ, включающую SEQ ID NO:3.
14. Способ по п.11, в котором клетка содержит вектор, включающий нуклеиновую кислоту по п.1, и, кроме того, содержит второй вектор, включающий нуклеиновую кислоту, кодирующую b-субъединицу ФСГ, включающую SEQ ID NO:3.
15. Фармацевтическая композиция, включающая мутантный ФСГ по п.7 и, при необходимости, фармацевтически приемлемый носитель или эксципиент.
16. Способ лечения инфертильных млекопитающих, включающий введение млекопитающему, нуждающемуся в указанном лечении, фармацевтической композиции по п.15.
17. Способ стимуляции фолликулогенеза у млекопитающих, включающий введение млекопитающему, нуждающемуся в указанной стимуляции, фармацевтической композиции по п.15.
18. Способ индукции овариальной гиперстимуляции у млекопитающих, включающий введение млекопитающему, нуждающемуся в указанной индукции, фармацевтической композиции по п.15.
Текст
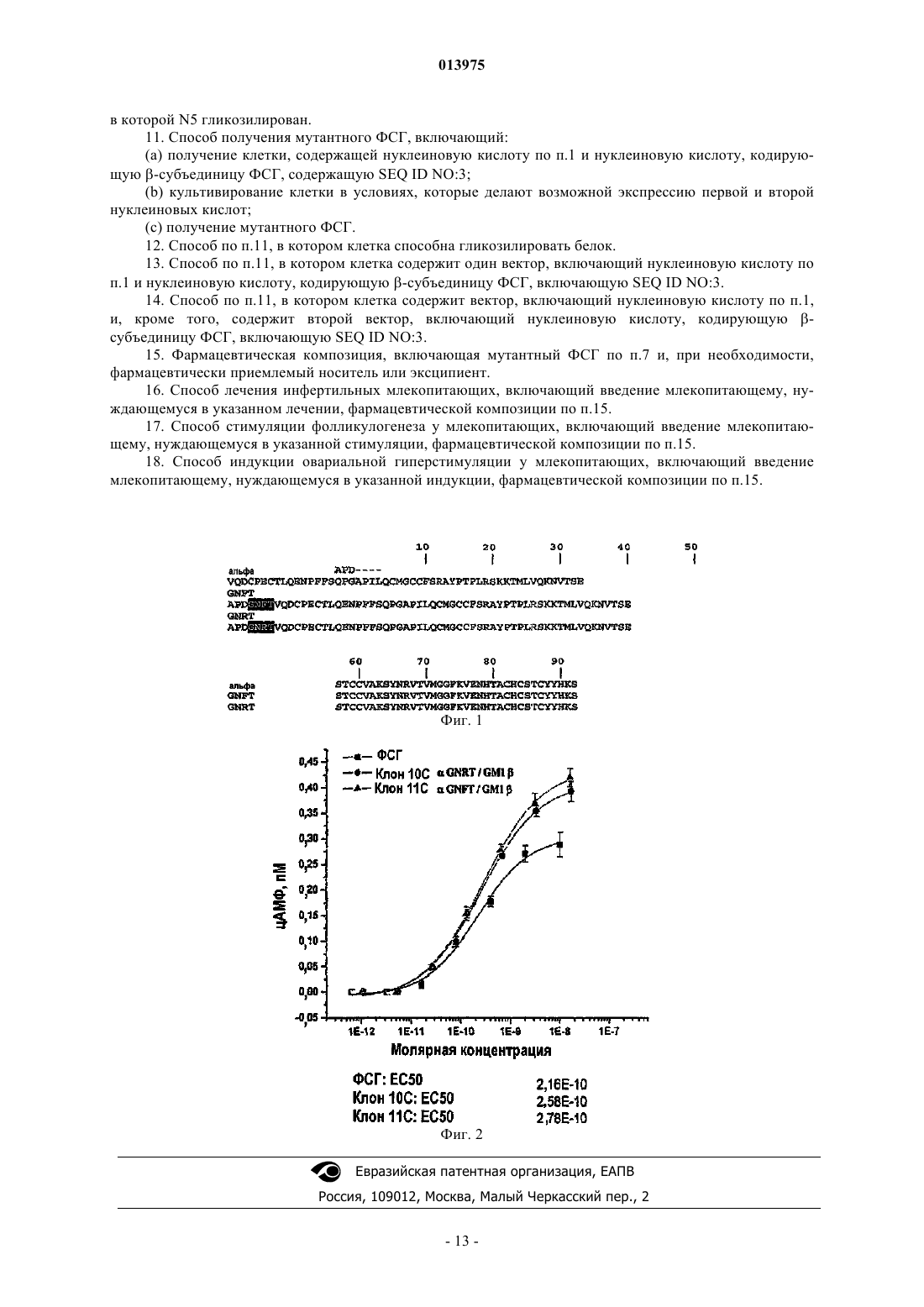
Настоящее изобретение относится к мутантному ФСГ, в котором -субъединица содержит последовательность SEQ ID NO:3, а -субъединица содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:4 или 5. Кроме того, настоящее изобретение относится к мутантному ФСГ, описанному выше, в котором любой из шести аспарагиновых остатков гликозилирован. Также заявлены способ получения мутантного ФСГ, нуклеиновая кислота, кодирующая-субъединицу мутантого ФСГ, соответствующий вектор и клетка-хозяин. Настоящее изобретение также относится к фармацевтической композиции, содержащей мутантный ФСГ, а также к способу лечения инфертильных млекопитающих, к способу стимуляции фолликулогенеза у млекопитающего и к способу индукции овариальной гиперстимуляции у млекопитающего, в которых млекопитающему вводят фармацевтическую композицию, содержащую указанный мутантный ФСГ. 013975 Область техники, к которой относится изобретение Настоящее изобретение относится к репродукции человека. Более точно, настоящее изобретение относится к фертилизирующей терапии. Описание предшествующего уровня техники а. Гонадотропины Фолликулостимулирующий гормон (ФСГ) является членом семейства гонадотропинов, которое играет ключевые роли в фертильности человека. Гонадотропины, которые также включают лютеинизирующий гормон (ЛГ) и хорионический гонадотропин (ХГ), представляют собой гетеродимеры, каждый состоит из общей -субъединицы (92 аминокислоты) и уникальной -субъединицы (111 аминокислот в ФСГ). Аминокислотные последовательности зрелых форм - и -субъединиц ФСГ представлены в SEQID NO:1 и SEQ ID NO:2 соответственно. ФСГ человека был выделен из мозговых придатков и из постменопаузной мочи (европейский патент 322438) и был получен рекомбинантным путем в клетках млекопитающих (патент США 5639640, патент США 5156957, патент США 4923805, патент США 4840896, патент США 576725, европейский патент 211894 и европейский патент 521586). Последняя ссылка также описывает ген -субъединицы ФСГ человека. Патент США 5405945 описывает модифицированный ген человеческой -субъединицы, содержащий только один интрон.Liu et al., J Biol. Chem. 1993,15; 268 (2): 21613-7, Grossmann et al., Mol. Endocrinol. 1996 10 (6): 76979, Roth and Dias (Mol. Cell Endocrinol. 1995 1; 109 (2): 143-9, Valove et al., Endocrinology 1994; 135 (6): 2657-61, Yoo et al., J Biol. Chem. 1993 25; 268 (18): 13034-42, патент США 5508261 и Chappel et al.,1998, Human Reproduction, 13 (3): 1835 описывают разнообразные исследования взаимосвязи структуры и функции и определяют аминокислотные остатки, участвующие в связывании с рецептором и его активации и в димеризации ФСГ.b. Применение гонадотропинов во вспомогательных репродуктивных технологиях Гонадотропины играют решающую роль в репродуктивном цикле, и их применение в экзогенной терапии является существенным для вспомогательных репродуктивных технологий (ВРТ), таких как оплодотворение in vitro (ЭКО), ЭКО в сочетании с интрацитоплазматическим впрыскиванием спермы(ЭКО/ИКСИ) и пересадкой эмбриона (ПЭ), а также для стимуляции овуляции (OI) у пациентов с ановуляцией, подвергающихся оплодотворению in vivo, или естественным путем, или посредством внутриматочного осеменения (ВМО). Патент США 4589402 и патент США 4845077 описывают очищенный ФСГ человека без примеси ЛГ и его применение для оплодотворения in vitro. Европейский патент 322438 описывает белок с по меньшей мере 6200 ед. активности ФСГ на мг, у которого практически отсутствует активность ЛГ и у которого -субъединица и -субъединица ФСГ, соответственно, могут быть дикого типа или его определенных процессированных форм. Для достижения терапевтического эффекта необходимо продолжительное лечение обычно в течение 8-10 последовательных дней, а иногда вплоть до 21 дня, чтобы стимулировать фолликулогенез у женщин, и в течение вплоть до 18 месяцев у мужчин с гипогонадотропизмом, чтобы стимулировать сперматогенез. Рекомбинантный чФСГ обычно вводят в виде внутримышечной или подкожной ежедневной инъекции, что влечет дискомфорт и возможность локальной реакции в месте инъекции. Уменьшение частоты применения облегчило бы лечение и сделало бы введение гонадотропина более удобным, более переносимым и безвредным для пациента. с. Гликозилирование ФСГ Гонадотропины представляют собой гликопротеины, у которых к каждой субъединице присоединены аспарагин-связанные (N-связанные) олигосахаридные боковые цепи, которые существенны для активности и функционирования in vivo. Присоединение углеводов (гликозилирование) к полипептидам представляет собой посттрансляционное событие, которое приводит к присоединению цепи сахаров к определенным аминокислотам, аспарагину (N-связанные) или серину/треонину (О-связанные). В противоположность неизменной аминокислотной последовательности белковой части гликопротеинов, углеводные структуры изменчивы, эта особенность называется микрогетерогенностью. Например, Nсвязанные сайты гликозилирования того же самого белка могут нести различные углеводные структуры. Более того, даже на том же сайте гликозилирования данного гликопротеина могут быть обнаружены различные углеводные структуры. Данная гетерогенность является следствием нематричного синтеза углеводов.N-гликозилирование белков происходит специфически по консенсусной последовательности AsnXaa-Ser/Thr, и в меньшей степени по консенсусной последовательности Asn-Xaa-Cys, где Хаа может представлять собой любой аминокислотный остаток. Однако наличие консенсусного трипептида еще недостаточно для того, чтобы гарантировать, что остаток аспарагина будет гликозилирован. Например,N-гликозилирование последовательности Asn-Pro-Ser/Thr происходит со скоростью в 50 раз более низкой, чем других консенсусных последовательностей Asn-Xaa-Ser/Thr. ФСГ человека содержит четыре N-связанных сайта гликозилирования: два в общей -субъединице-1 013975 в положениях 52 и 78 и два в -субъединице в положениях 7 и 24. Углеводы, присоединенные к субъединице, ФСГ существенны для образования и целостности димера, секреции и передачи сигнала,тогда как углеводы -субъединицы важны для образования димера, секреции и выведения гетеродимера из циркуляции.Galway et al., Endocrinology 1990; 127 (1): 93-100 продемонстрировал, что варианты ФСГ, получаемые в клеточной линии СНО с N-ацетилглюкозаминтрансферазой-1 или клеточной линии СНО с дефектом в транспорте сиаловой кислоты, являются столь же активными in vitro, как и ФСГ, секретируемый клетками дикого типа, или очищенный гипофизный ФСГ, но им недостает активности in vivo, предположительно из-за быстрого выведения неадекватно гликозилированных вариантов в сыворотке. D'Antonioet al., Human Reprod 1999; 14 (5): 1160-7 описали различные изоформы ФСГ, циркулирующие в кровотоке. Изоформы имеют идентичные аминокислотные последовательности, но различаются степенью посттрансляционной модификации. Установлено, что группа менее кислотных изоформ быстрее выводитсяin vivo no сравнению с группой кислотных изоформ, вероятно из-за различий в содержании сиаловой кислоты между изоформами. Более того, Bishop et al. Endocrinology 1995; 136 (6): 2635-40 пришли к выводу, что циркуляционное время полужизни является первостепенным определяющим фактором активности in vivo. Данные наблюдения привели к предположению, что время полужизни ФСГ может быть увеличено путем введения дополнительных сайтов гликозилирования, чтобы увеличить содержание сиаловой кислоты в полипептиде.d. Варианты ФСГ Агонисты ФСГ с увеличенным временем полужизни были получены путем слияния карбоксиконцевого пептида чХГ (СТР) с нативным рекомбинантным ФСГ человека (рчФСГ). Фрагмент СТР состоит из аминокислот 112-118 до 145 с четырьмя O-связанными сайтами гликозилирования, расположенными в положениях 121, 127, 132 и 138. Патент США 5338835 и патент США 5585345 описывают модифицированную -субъединицу ФСГ, удлиненную по С-концевой Glu СТР-фрагментом чХГ. Полученный в результате модифицированный аналог начал демонстрировать биологическую активность нативного ФСГ, но с увеличенным циркуляционным временем полужизни. Патент США 5405945 раскрывает,что карбоксиконцевая часть -субъединицы чХГ или ее вариант оказывает значительный эффект на выведение ХГ, ФСГ и ЛГ. В патенте США 5883073 описаны одноцепочечные белки, состоящие из двух -субъединиц с агонистической или антагонистической активностью по отношению к ХГ, ТТГ, ЛГ и ФСГ. В патенте США 5508261 описаны гетеродимерные полипептиды с аффинностью связывания с рецепторами ЛГ и ФСГ, содержащие -субъединицу гликопротеинового гормона, и не встречающийся в природе полипептид -субъединицы, где полипептид -субъединицы представляет собой цепочку аминокислот, содержащую четыре объединенные подпоследовательности, каждую из которых выбирают из списка определенных последовательностей. Klein et al. (2003) описывает одноцепочечный аналог ФСГ с увеличенным временем полужизни, в котором - и -субъединицы соединены олигопептидом, несущим два Nсвязанных сайта гликозилирования. В WO 01/58493 описано 77 мутаций, которые могут быть произведены в -субъединице ФСГ, и 51 мутация, которые могут быть произведены в -субъединице ФСГ, с целью улучшения времени полужизни ФСГ in vivo. Кроме того, в WO 01/58493 раскрыто, что один или несколько сайтов гликозилирования можно добавить к N-концу ФСГ, для того чтобы улучшить время его полужизни, или встроить в различных участках полипептида ФСГ. В WO 01/58493, при том, что в ней раскрыто, что сайты гликозилирования могут быть встроены в полипептид ФСГ, не дано таких рекомендаций, как указание определенного участка (участков), в котором можно вставить сайт гликозилирования и поддержать активность ФСГ. ВWO 01/584 93, кроме того, раскрыто, что мутантные - и -субъединицы можно применять по отдельности (1 дополнительный сайт гликозилирования) или в сочетании (2 дополнительных сайта гликозилирования). 128 возможных мутантов идентифицировали при помощи 50 моделей трехмерной структуры ФСГ, которые были созданы только на основании структуры чХГ и сравнительного анализа последовательностей ФСГ и чХГ, несмотря на только 32% идентичности между -субъединицами чХГ и ФСГ. WO 01/58493 не описывает получение или тестирование ни одной - или -субъединицы ФСГ, в которой сайт гликозилирования был бы введен с помощью сайтнаправленного мутагенеза. В WO 05/020934 описан GM1 с мутациями как в -, так и в -субъединицах ФСГ, включая двойную мутацию вE55N/V57T, т.е. остаток Е в аминокислотном положении 55 мутировал в N, а остаток V в аминокислотном положении 57 мутировал в Т. Аминокислотная последовательностьE55N/V57T показана в SEQ ID NO:3. Существует клиническая потребность в продукте, который бы обеспечил часть или все терапевтические эффекты ФСГ и который можно было бы вводить с более редкими интервалами по сравнению с доступными в настоящее время продуктами ФСГ, и который предпочтительно обеспечил бы более стабильный уровень активности циркулирующего ФСГ по сравнению с тем, который удается получить с помощью доступных в настоящее время способов лечения. Настоящее изобретение относится к таким продуктам, а также к способам получения таких продуктов.-2 013975 Сущность изобретения Настоящее изобретение относится к мутантным молекулам ФСГ, в которых -субъединица ФСГ включает последовательность, выбранную из группы, состоящей из SEQ ID NO:4-5, и в которых субъединица ФСГ включает SEQ ID NO:3. ФСГ может быть N-гликозилирован по 0, 1, 2, 3, 4, 5 или 6 остаткам аспарагина указанного мутантного ФСГ. В одном из вариантов осуществления N5 мутантной-субъединицы SEQ ID NO:4 может быть гликозилирован. В другом варианте осуществления N5 мутантной -субъединицы SEQ ID NO:5 может быть гликозилирован. В одном из вариантов осуществленияN55 мутантной -субъединицы SEQ ID NO:3 может быть гликозилирован. Настоящее изобретение также относится к выделенным молекулам ДНК, кодирующим мутанты субъединицы ФСГ, выбранные из группы, состоящей из SEQ ID NO:4-5. Настоящее изобретение также относится к выделенной ДНК, кодирующей -субъединицу ФСГ, содержащую последовательность SEQID NO:3. Настоящее изобретение также относится к вектору, содержащему ДНК, кодирующую мутант субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5. Такой вектор может представлять собой вектор экспрессии. Настоящее изобретение также относится к вектору, содержащему ДНК, кодирующую мутант, содержащий -субъединицы ФСГ, последовательность SEQ ID NO:3. Такой вектор может представлять собой вектор экспрессии. Настоящее изобретение также относится к вектору, содержащему первую ДНК и вторую ДНК, где первая ДНК кодирует мутант -субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5,и где вторая ДНК кодирует мутант -субъединицы ФСГ, содержащий последовательность SEQ ID NO:3. Такой вектор может представлять собой вектор экспрессии. Настоящее изобретение также относится к клетке, содержащей вектор, содержащий ДНК, кодирующую мутант -субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5. Такой вектор может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающего, например клетку CHO. Настоящее изобретение также относится к клетке, содержащей вектор, содержащий ДНК, кодирующую мутант -субъединицы ФСГ, содержащий последовательность SEQ ID NO:3. Вектор может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающего, например, клетку СНО. Настоящее изобретение также относится к клетке, содержащей вектор, содержащий первую ДНК и вторую ДНК, где первая ДНК кодирует мутант -субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5, и где вторая ДНК кодирует мутант -субъединицы ФСГ, содержащий последовательность SEQ ID NO:3. Вектор может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающего, например клетку СНО. Настоящее изобретение также относится к клетке, содержащей первый и второй векторы, где первый вектор содержит ДНК, кодирующую мутант -субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5, а второй вектор содержит ДНК, кодирующую мутант -субъединицы ФСГ, содержащий последовательность SEQ ID NO:3. Вектор (векторы) может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающего, например, клетку СНО. Настоящее изобретение также относится к способу получения мутанта ФСГ, включающему культивирование клеток млекопитающего, способных к гликозилированию, где указанные клетки содержат первый вектор экспрессии, содержащий ДНК, кодирующую мутант -субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5, и второй вектор экспрессии, содержащий ДНК, кодирующую мутант -субъединицы ФСГ, содержащий последовательность SEQ ID NO:3. В другом варианте осуществления настоящего изобретения указанные клетки содержат один вектор, содержащий ДНК, кодирующую мутант -субъединицы ФСГ, выбранный из группы, состоящей из SEQ ID NO:4-5, и, кроме того, содержащий ДНК, кодирующую мутант -субъединицы ФСГ, содержащий последовательность SEQ ID NO:3. Настоящее изобретение также относится к композиции, включающей мутант ФСГ и фармацевтически приемлемый носитель или эксципиент, в которой -субъединица ФСГ содержит последовательность,выбранную из группы, состоящей из SEQ ID NO:4-5, и в которой -субъединица ФСГ содержит SEQ IDNO:3. Настоящее изобретение также относится к способу лечения инфертильных млекопитающих, включающему введение млекопитающему, при необходимости, эффективного количества мутанта ФСГ, в котором -субъединица ФСГ содержит последовательность, выбранную из группы, состоящей из SEQ IDNO:4-5, и в котором -субъединица ФСГ содержит SEQ ID NO:3. Настоящее изобретение также относится к способу стимуляции фолликулогенеза у млекопитающих, включающему введение млекопитающему, при необходимости, эффективного количества мутанта ФСГ, в котором -субъединица ФСГ содержит последовательность, выбранную из группы, состоящей из-3 013975 относится к способу вызывания овариальной гиперстимуляции у млекопитающих, включающему введение млекопитающему, при необходимости, эффективного количества мутанта ФСГ, в котором субъединица ФСГ содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:4-5, и в котором -субъединица ФСГ содержит SEQ ID NO:3. Краткое описание чертежей На фиг. 1 показан сравнительный анализ мутантов -субъединицы GNFT (SEQ ID NO:4) и GNRT(SEQ ID NO:5) с -субъединицей ФСГ человека (SEQ ID NO:1). Нумерация остатков относится к субъединице ФСГ человека (SEQ ID NO:1), причем 1 является первой аминокислотой зрелого полипептида. На фиг. 2 показана кривая зависимости от дозы для мутантных -субъединиц ФСГ по сравнению с ФСГ дикого типа. Клон 10 с -GNRT/GM1 . Клон 11 с -GNFT/GM1 . Подробное описание изобретения Несмотря на то, что было показано, что увеличение содержания углеводов в ФСГ может вести к увеличению времени полужизни in vivo, улучшение времени полужизни ФСГ является более сложным,чем простое добавление дополнительных сайтов гликозилирования. Несмотря на то, что гликозилирование консенсусной последовательности необходимо для присоединения углеводов, этого недостаточно для гарантии того, что сайт присоединения углевода будет использован. Другие факторы, такие как локальная укладка и конформация белка во время биосинтеза, определяют, присоединится ли олигосахарид в данном сайте консенсусной последовательности. Кроме того, для того чтобы дополнительное гликозилирование привело к увеличению времени полужизни in vivo, консенсусная последовательность должна быть в таком положении, чтобы гликозилирование сайта не мешало связыванию с рецептором или не нарушало укладку, конформацию или стабильность гликопротеина. До сих пор аналоги ФСГ с увеличенным временем полужизни главным образом представляли собой слитые белки, в которых слитая часть полипептида включала дополнительные сайты гликозилирования. 1. Мутантный ФСГ Предложен мутант ФСГ, который был модифицирован, для создания дополнительных сайтов распознавания для гликозилирования. -Субъединица мутанта ФСГ может содержать одну из следующих мутаций по сравнению с -субъединицей дикого типа: вставку аминокислотной последовательностиGNFT между аминокислотными остатками 3 и 4 -субъединицы дикого типа или вставку аминокислотной последовательности GNRT между аминокислотными остатками 3 и 4 -субъединицы дикого типа. Мутантный ФСГ может содержать любую из вышеуказанных мутантных -субъединиц в сочетании с мутантной -субъединицей, например сGM1, содержащей следующую мутацию: E55N/V57T. Один или несколько дополнительных сайтов гликозилирования рекомбинантного ФСГ могут быть гликозилированы. Такие один или несколько дополнительных сайтов гликозилирования рекомбинантного ФСГ могут быть гликозилированы in vitro или in vivo. Как применяется здесь, термин "мутант GNFT" относится к мутантному ФСГ, содержащему -субъединицу, как представлено в SEQ ID NO:4, и субъединицу, как представлено в SEQ ID NO:3. Как применяется здесь, термин "мутант GNRT" относится к мутантному ФСГ, содержащему -субъединицу, как представлено в SEQ ID NO:5, и -субъединицу,как представлено в SEQ ID NO:3. Мутант ФСГ может быть получен любым подходящим способом, известным в данной области. Такие способы включают конструирование нуклеотидных последовательностей, кодирующих соответствующие мутанты ФСГ и экспрессирующих аминокислотные последовательности в подходящем трансфицированном хозяине. Мутант ФСГ может также быть получен при помощи химического синтеза или при помощи комбинации химического синтеза и технологии рекомбинантной ДНК. Мутант ФСГ может содержать - и -субъединицы ФСГ в виде двух отдельных полипептидных цепочек, где две цепочки димеризуются in vivo таким образом, что образуют димерный полипептид, или он может содержать одноцепочечную конструкцию, содержащую две субъединицы, ковалентно связанные пептидной связью или пептидным линкером. Аминокислотные остатки линкерного пептида могут проявлять свойства, которые не по существу влияют на активность мутанта ФСГ. Мутант ФСГ может обладать увеличенным временем полужизни по сравнению с ФСГ дикого типа. Мутант ФСГ может также обладать увеличенной стабильностью по сравнению с ФСГ дикого типа. Мутант ФСГ может содержать олигосахариды в 0, 1, 2, 3, 4, 5 или 6 N-связанных сайтах гликозилирования. Также предлагается популяция мутантов ФСГ, которая может включать одну или несколько изоформ мутанта ФСГ, где каждая изоформа содержит олигосахариды в 0, 1, 2, 3, 4, 5 или 6 N-связанных сайтах гликозилирования. Нуклеотидная последовательность, кодирующая - или -субъединицы мутанта ФСГ, может быть сконструирована путем выделения или синтеза нуклеотидной последовательности, кодирующей исходную субъединицу ФСГ, такую как чФСГ-альфа или чФСГ-бета, с аминокислотными последовательностями, показанными в SEQ ID NO:1 и 2, соответственно. Нуклеотидная последовательность затем может быть изменена так, чтобы воздействовать на замещение или вставку соответствующих аминокислотных остатков. Нуклеотидная последовательность может быть модифицирована при помощи сайтнаправлен-4 013975 ного мутагенеза. В качестве альтернативы нуклеотидная последовательность может быть получена путем химического синтеза, в котором олигонуклеотиды конструируют на основании определенной аминокислотной последовательности мутанта ФСГ. Нуклеотидная последовательность, кодирующая полипептид, может быть встроена в рекомбинантный вектор и функционально связана с контрольной последовательностью, необходимой для экспрессии полипептида в желаемой трансфицированной клетке-хозяине. Контрольные последовательности могут представлять собой любой компонент, который необходим или благоприятен для экспрессии полипептида. Примеры подходящих контрольных последовательностей для направления транскрипции в клетках млекопитающих включают ранний и поздний промоторы SV40 и аденовирусов, например главный поздний промотор аденовируса 2, промотор МТ-1 (гена металлотионеина) и промотор предраннего гена цитомегаловируса человека (CMV). Специалист в данной области может сделать выбор среди указанных векторов, последовательностей контроля экспрессии и хозяев без лишних экспериментов. Рекомбинантный вектор может представлять собой автономно реплицирующийся вектор, т.е. вектор, который существует в виде экстрахромосомной единицы, репликация которой не зависит от репликации хромосом, например плазмиды. В ином случае, вектор может представлять собой такой вектор, который при введении в клетку-хозяина интегрируется в геном клетки-хозяина и реплицируется вместе с хромосомой (хромосомами), в которую он интегрирован. Вектор может представлять собой вектор экспрессии, в котором нуклеотидная последовательность,кодирующая полипептид по настоящему изобретению, функционально связана с дополнительными сегментами, необходимыми для транскрипции нуклеотидной последовательности. Вектор может быть получен из плазмиды или вирусной ДНК. Ряд подходящих векторов экспрессии для экспрессии в клеткаххозяевах, отмеченных в настоящем описании, являются коммерчески доступными или описаны в литературе. Рекомбинантный вектор может, кроме того, содержать последовательность ДНК, позволяющую вектору реплицироваться в исследуемой клетке-хозяине. Примером такой последовательности (когда клетка-хозяин является клеткой млекопитающего) является точка начала репликации SV40. Вектор может также содержать селектируемый маркер, например ген, продукт которого восполняет дефект клеткихозяина, такой как ген, кодирующий дигидрофолатредуктазу (ДГФР), или такой, который придает устойчивость к препарату, например ампициллину, канамицину, тетрациклину, хлорамфениколу, неомицину, гидромицину или метотрексату. Вектор может также содержать амплифицируемый ген, такой как ДГФР, так что клетки, несущие множественные копии амплифицируемого гена и фланкирующие последовательности, включая ДНК мутантного ФСГ, можно селектировать в соответствующей среде. Также предлагается ДНК, кодирующая -субъединицу мутанта ФСГ. Нуклеотидная последовательность, кодирующая субъединицы альфа и бета мутанта ФСГ, если она получена при помощи сайтнаправленного мутагенеза, синтеза, ПЦР или другими способами, может необязательно включать нуклеотидную последовательность, которая кодирует сигнальный пептид. Сигнальный пептид может присутствовать в процессе секреции полипептида клетками, в которых он экспрессируется. Такой сигнальный пептид, если он присутствует, может распознаваться клеткой, выбранной для экспрессии полипептида. Сигнальный пептид может быть гомологичным (например, таким, который обычно связан с субъединицей чФСГ) или гетерологичным (т.е. происходящим из иного источника, чем чФСГ) полипептиду или может быть гомологичным или гетерологичным клетке-хозяину, т.е. представлять собой сигнальный пептид,обычно экспрессируемый клеткой-хозяином, или пептид, который обычно не экспрессируется клеткойхозяином. Для получения полипептидов можно использовать любого подходящего хозяина, включая клетки или клеточные линии бактерий, грибов (включая дрожжи), растений, насекомых, млекопитающих или других подходящих животных, а также трансгенных животных или растений. Примеры подходящих клеток-хозяев млекопитающих включают клеточные линии яичника китайского хомячка (СНО), (например,CHO-KL; ATCC CCL-61), клеточные линии зеленой мартышки (COS) (например, COS 1 (ATCC CRL1650), COS 7 (ATCC CRL-1651; клетки мышей (например, NSIO), клеточные линии почек новорожденного хомячка (BI-EK) (например, ATCC CRL-1632 или ATCC CCL-10) и клетки человека (например,ВЕК 293 (ATCC CRL-1573, а также клетки растений в тканевой культуре. Дополнительные подходящие клеточные линии хорошо известны в данной области и доступны в открытых хранилищах, таких как Американское собрание культур штаммов, США. Способы введения экзогенной ДНК в клетки-хозяев,происходящие от млекопитающих, включают опосредованную фосфатом кальция трансфекцию, электропорацию, опосредованную ДЭАЭ-декстраном трансфекцию, опосредованную липосомами трансфекцию и вирусные векторы. Клетки можно культивировать в питательной среде, подходящей для получения полипептида, способами, хорошо известными в данной области. Например, клетки можно культивировать при помощи культивирования во встряхиваемой колбе, маломасштабного или крупномасштабного культивирования(включая непрерывное, периодическое, периодическое с подпиткой или твердофазное культивирование)-5 013975 в лаборатории или промышленных ферментерах, проводимого в подходящей среде и в условиях, делающих возможными экспрессию и/или выделение полипептида. Культивирование проводят в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, способами, хорошо известными в данной области. Подходящие среды доступны от коммерческих поставщиков или могут быть получены в соответствии с опубликованными композициями (например, в каталогах Американского собрания культур штаммов). Если полипептид секретируется в питательную среду, то его можно выделить непосредственно из среды. Если полипептид не секретируется, то его можно выделить из клеточных лизатов. Одним способом получения мутантов ФСГ по настоящему изобретению с высоким выходом является получение посредством применения амплификации дигидрофолатредуктазы (ДГФР) в клетках СНО, дефектных по ДГФР, с применением последовательно возрастающего уровня метотрексата, как описано в патенте США 4889803. Полученный в результате мутантный полипептид ФСГ можно выделить способами, известными в данной области. Например, его можно выделить из питательной среды общепринятыми способами,включающими, но ими не ограничивающимися, центрифугирование, фильтрацию, экстракцию, сушку распылением, выпаривание или преципитацию. Мутантные полипептиды ФСГ могут быть очищены при помощи разнообразных способов, известных в данной области, включая, но ими не ограничиваясь, хроматографию (например, ионообменную, аффинную, гидрофобную, хроматофокусирование и размерноэксклюзионную), электрофоретические способы (например, препаративное изоэлектрическое фокусирование), дифференциальную растворимость (например, фракционирование сульфатом аммония), ДСНПААГ или экстракцию. Также предлагается фармацевтическая композиция, включающая мутант ФСГ. Такую фармацевтическую композицию можно применять для стимуляции фолликулогенеза, например, в сочетании со стимуляцией овуляции или вспомогательными репродуктивными технологиями (ВРТ). Поскольку мутант ФСГ по настоящему изобретению может эффективно стимулировать развитие и созревание многочисленных фолликул, то он может оказаться особенно эффективным для применения в ВРТ, при которых требуется получить много ооцитов. Мутант ФСГ можно применять для стимуляции монофолликулогенеза для OI, или пауцифолликулогенеза (вплоть до приблизительно трех фолликул) для ВМО, для оплодотворения in vivo. Монофолликулогенез можно также получить при помощи уменьшенной дозы мутанта ФСГ или менее частом применении по сравнению с общеупотребительными препаратами ФСГ. Например, при OI препарат ФСГ по настоящему изобретению можно применять по 225-400 ME каждые три дня или в более низкой дозе, в зависимости от реакции пациента. За реакцией пациента можно следить с помощью сонографии. Мутант ФСГ по настоящему изобретению можно применять в процедуре контролируемой овариальной гиперстимуляции (КОГ). Стандартные схемы применения для КОГ включают стадию отрицательной регуляции, на которой эндогенный лютеинизирующий гормон (ЛГ) подавляется путем применения агониста гонадотропин-высвобождающего гормона (GnRH), за чем следует стадия стимуляции, на которой развитие фолликул (фолликулогенез) стимулируют посредством ежедневного применения фолликулостимулирующего гормона (ФСГ), обычно приблизительно по 150-225 МЕ/день. В ином случае стимуляция может быть начата с ФСГ после спонтанной или индуцированной менструации, за чем следует применение антагониста GnRH (обычно начиная приблизительно с шестого дня стадии стимуляции). Когда появляются по меньшей мере 3 фолликулы 16 мм (одна 18 мм), может быть введен отдельный болюс чХГ (5-10000 ME), чтобы имитировать природный выброс ЛГ и стимулировать овуляцию. Образование ооцитов может происходить в течение 36-38 ч после введения чХГ. Мутант ФСГ можно также применять для OI и ВМО. Например, начало стимуляции с помощью ФСГ можно проводить после спонтанной или индуцированной менструации с ежедневной дозой 75-150ME. Когда 1 или 3 фолликулы достигнут диаметра по меньшей мере 16 мм, то может быть введен отдельный болюс чХГ для стимуляции овуляции. Оплодотворение может быть произведено in vivo путем обычного полового контакта или ВМО. Поскольку мутант ФСГ может обладать увеличенным временем полужизни по сравнению с препаратами ФСГ дикого типа, в схемах применения, таких как описанная выше, можно использовать более низкие ME дозы ФСГ и/или их можно модифицировать, уменьшив период стимуляции с помощью ФСГ,при этом достигая такой же или лучшей реакции в отношении количества и жизнеспособности фолликул. Например, достаточный фолликулогенез может быть достигнут с ежедневными дозами, равными или приблизительно равными 50-150, 50-100 или 50-75 ME ФСГ. Дозирование ФСГ можно осуществлять на ежедневной или полуежедневной основе. Период дозирования может составлять меньше или приблизительно 14, 12, 11 или 10 дней. Для OI препарат мутанта ФСГ можно применять в дозах 25-150 или 50125 ME ФСГ/день. Для лечения мужского бесплодия препарат мутанта ФСГ можно применять в количестве 3-х 150-300 ME в неделю, до тех пор, пока сперматогенез не достигнет уровня, достаточного для оплодотворения, или посредством обычных половых отношений, или технологии ВРТ. Из-за более продолжительного времени полужизни мутантного ФСГ его можно применять в качестве препарата пролонгированного действия, который можно применять менее часто, чем каждые два-6 013975 дня. Обычный ФСГ можно применять в количестве, равном или приблизительно равном 300 ME каждый второй день, достигая тех же результатов, что и при применении каждый день в количестве, равном или приблизительно равном 150 ME. Мутантный ФСГ можно применять каждые 3, 4, 5, 6 или 7 дней, достигая тех же или лучших результатов, что и при ежедневном применении обычного ФСГ. Мутант ФСГ можно применять для получения лекарственного средства для лечения заболеваний,нарушений или патологических состояний. В другом аспекте полипептид или фармацевтическую композицию в соответствии с настоящим изобретением применяют в способе лечения млекопитающего, в частности человека, включающем введение млекопитающему, при необходимости, таких полипептида или фармацевтической композиции. Специалисту в данной области ясно, что эффективное количество полипептида, препарата или композиции зависит помимо прочего от заболевания, дозы, графика применения, того, применяют ли полипептид или препарат, или композицию отдельно или в сочетании с другими терапевтическими средствами, времени полужизни композиций в сыворотке и общего состояния здоровья пациента. Обычно эффективная доза препарата или композиции достаточна для того, чтобы гарантировать терапевтический эффект. Мутант ФСГ можно применять в композиции, включающей один или несколько фармацевтически приемлемых носителей или эксципиентов. "Фармацевтически приемлемый" обозначает носитель или эксципиент, который не оказывает никаких нежелательных воздействий на пациентов, у которых он используется. Такие фармацевтически приемлемые носители и эксципиенты хорошо известны в данной области, и полипептид может быть включен в фармацевтические композиции благодаря хорошо известным способам (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. R. Gennaro, Ed., MackL. Hovgaard, Eds., TaylorFrancis (2000); and Handbook of Pharmaceutical Excipients, 3rd edition, A. Kibbe,Ed., Pharmaceutical Press (2000. Фармацевтически приемлемые эксципиенты, которые можно применять в композициях, содержащих полипептид, включают, например, буферные вещества, стабилизаторы, консерваторы, изотонирующие средства, неионные поверхностно-активные вещества или детергенты ("увлажняющие средства"), антиоксиданты, наполняющие средства или наполнители, хелатирующие агенты и сорастворители. Фармацевтическая композиция, содержащая мутант ФСГ, может быть составлена в различных формах, включая жидкости, например готовые к применению растворы или суспензии, гели, лиофилизированную или любую другую подходящую форму, например порошок или кристаллы, подходящие для получения раствора. Форма композиции может зависеть от конкретных показаний к лечению и ясна для специалиста в данной области. Фармацевтическая композиция, содержащая мутант ФСГ, может применяться внутривенно, внутримышечно, внутрибрюшинно, внутрикожно, подкожно, сублингвально, буккально, интраназально,трансдермально, путем ингаляции или любым другим приемлемым способом, например, при помощи технологии PowderJect или ProLease или системы для впрыскивания карандашного типа. Способ применения может зависеть от конкретных показаний к лечению и будет ясен специалисту в данной области. Композицию можно применять подкожно, что может позволить пациенту проводить самовведение. Фармацевтические композиции можно применять в сочетании с другими терапевтическими средствами. Эти средства могут быть введены в ту же самую фармацевтическую композицию как ее часть или могут применяться отдельно от полипептидов, или одновременно, или в соответствии с любым другим приемлемым графиком лечения. Кроме того, полипептид, препарат или фармацевтическая композиция могут применяться в качестве вспомогательного вещества к другим способам лечения. Настоящее изобретение включает многочисленные аспекты, иллюстрируемые следующими неограничивающими примерами. Пример 1. Мутанты ФСГ Кристаллическую трехмерную структуру ФСГ человека использовали, для того чтобы определить участки молекулы ФСГ, в которых можно вставить возможный сайт гликозилирования. В каждой асимметричной единице кристаллической структуры присутствуют две молекулы ФСГ (четыре субъединицы). Две молекулы ФСГ наложили и сравнили, причем каждый остаток визуально исследовали, для того чтобы определить возможные участки, где можно вставить сайт N-гликозилирования, не нарушив при этом соответствующую укладку полипептида ФСГ или не уменьшив активность ФСГ. Кристаллографическую структуру ФСГ объединили со знаниями о взаимодействии ФСГ/ФСГР рецептора, для того чтобы облегчить выбор возможных сайтов N-гликозилирования. Принципиальными критериями конструирования были минимизация нарушения трехмерной структуры, минимизация нарушения расчетных сайтов связывания и активации и прогнозируемой трехмерной структуры, совместимой с гликозилированием. На основании вышеуказанных критериев были получены следующие два вставочных мутанта субъединицы ФСГ: Пример 2. Морфологический анализ мутантов ФСГ Аликвоты концентрированного культурального супернатанта от транзиторной экспрессии мутантов 1-2 -субъединицы ФСГ анализировали посредством ДСН-ПААГ в невосстанавливающих условиях, что позволяет отделить интактные гетеродимеры ФСГ от свободных - и -субъединиц. Путем сравнения наблюдаемых молекулярных весов каждого мутантного гетеродимера с молекулярным весом ФСГ дикого типа можно определить, является ли мутантный ФСГ гипергликозилированным по отношению к ФСГ дикого типа. Коротко говоря, после электрофореза белки электрофоретически переносили на ПВДФ и визуализировали при помощи антитела Serono 9-14, направленного против -субъединицы ФСГ. В качестве контроля также анализировали ФСГ человека дикого типа, мутантный GM1, ФСГ-СТР и Гонал Ф. В табл. 1 показан наблюдаемый молекулярный вес гетеродимера, образованного мутантами субъединицы и -субъединицы дикого типа, рассчитанный по стандартам молекулярного веса. Таблица 1 Как показано в табл. 1, каждый из двух экспрессируемых мутантов ФСГ, т.е. со вставками GNFT иGNRT, демонстрирует увеличенную степень гликозилирования, что доказывает сдвиг распределения наблюдаемого молекулярного веса гетеродимера по сравнению с ФСГ человека дикого типа. Пример 3. Функционирование мутантов ФСГ in vitro Для того чтобы определить активность мутантов ФСГ, каждый мутант тестировали на способность стимулировать производство цАМФ в клеточной линии СНО, которая рекомбинантно экспрессирует рецептор ФСГ человека. Клетки СНО-ФСГР выдерживали в ФСГР среде для выращивания [MEM (-)(Gibco, каталожный 12561-056)+10% диализированной FBS (Gibco, каталожный 26300-020)4-600 мкг/мл генетицина (Gibco, каталожный 10131-035)+0,02 мкМ МТХ]. Клетки СНО-ФСГР посеяли по 2104 клеток на лунку в 100 мкл на лунку (2106 клеток/10 мл=1 планшет) и инкубировали при 37 С в течение 24 ч до анализа. Клетки использовали для анализа, если по меньшей мере 70% сливались. Производили 12-кратное последовательное разбавление 1:3, начиная с 67,5 нМ, для всех образцов и внутреннего стандарта (в качестве внутреннего стандарта применяли Гонал Ф). Все разбавления проводили в среде для анализа [DMEM/F12 (без фенола, Gibco, каталожный 11039-021)+1 мг/мл БСА(Sigma, А-6003)+0,1 мМ ИБМК (ингибитор фосфодиэстеразы 3-изобутил-1-метилксантин, Sigma, каталожный 1-7018)]. Среду для выращивания удаляли из планшета для анализа, добавляли 25 мкл среды для анализа (дополненной набором МА 6000 cAMP MSD, Meso Scale Discovery, Gaithersburg, MD), планшет возвращали и инкубировали при 37 С в течение 15 мин. Затем в лунки добавляли по 25 мкл на лунку тестируемого образца, перемешивали, планшет возвращали и инкубировали в течение 1 ч при 37 С. После 1 ч инкубации образец и среду удаляли из лунок. Затем добавляли 25 мкл стандартного лизирующего буфера (дополненного набором МА 6000 Meso Scale Discovery) в каждую лунку, планшет закрывали с помощью приспособления для заклеивания планшетов (Packard, каталожный 6005185) и встряхивали в течение 5 мин. После 5-минутной лизирующей инкубации 25 мкл лизированного клеточного материала переносили в планшет cAMP Meso Scale Discovery (дополненный набором МА 6000 MSD) и инкубировали при осторожном встряхивании при комнатной температуре в течение 30 мин. Добавляли 25 мкл конъюгата цАМФ-АР в каждую лунку и перемешивали. Затем добавляли по 25 мкл антитела против цАМФ в каждую лунку, планшет закрывали с помощью приспособления для заклеивания планшетов и встряхивали в течение 30 мин при комнатной температуре. Затем планшет промывали шесть раз в автоматической машине для мойки планшетов с помощью 350 мкл на лунку буфера для промывания. Затем добавляли 100 мкл усилителя субстрата Sapphire II RTU (готового к использованию) в каждую лунку,планшет закрывали с помощью приспособления для заклеивания планшетов и инкубировали в течение 30 мин в темноте при 25 С. Затем планшет считывали со скоростью 1 с на лунку, причем низкий уровень цАМФ давал высокий сигнал, а высокий уровень цАМФ давал низкий сигнал. Кривые дозовой зависи-8 013975 мости мутантов ФСГ показаны на фиг. 2. Значения ЕС 50 были вычислены и показаны в табл. 2. Как показано на фиг. 2 и в табл. 2, каждый из мутантов ФСГ обладает активностью in vitro, сравнимой с активностью ФСГ дикого типа. Таблица 2 Пример 4. Время полужизни мутантов ФСГ in vivo Две различные партии мутанта GNFT и мутанта GNRT анализировали в отдельных фармакокинетических (ФК) исследованиях. Два исследования были проведены по одной схеме: 33 неполовозрелых самки крысы SD возраста 21 день (вес тела приблизительно 40 г; Charles River Laboratories, Wilmington,MA) случайным образом разделили на 5 экспериментальных групп (n=6) и 1 контрольную группу (n=3). Выбор неполовозрелых самок крысы основан на использовании данного возраста и пола для биологического определения активности ФСГ in vivo. Животные в экспериментальных группах получали подкожные (п/к) инъекции по 4 мкг GM1 (контроль), мутанта GNFT, мутанта GNRT или 8 мкг Гонала-Ф рчФСГ(контроль). Кровь из ретроорбитального синуса собирали через 0 ч у контрольной группы и через 1, 2, 4,6, 10, 24, 48 и 72 ч у животных из экспериментальных групп (в один момент времени n=3; крыс заменяли так, чтобы они не отдавали кровь в 2 последовательных момента отбора проб). Приблизительно 0,1 мл крови собирали у каждой крысы за каждое кровопускание, плазму собирали и сохраняли при -80 С до тех пор, пока не проводили анализ с помощью ТИФА. Для измерения белков ФСГ в сыворотке в обоих исследованиях применяли анализ DSL FSH Coated Well ELISA (Diagnostics Systems Laboratories, Webster,TX). Каждый образец сыворотки анализировали в трех параллелях. Время полужизни мутанта GNFT и мутанта GNRT составило приблизительно 17 ч, тогда как для контрольных GM1 и Гонала-Ф оно приблизительно составило, соответственно, 12 и 8 ч. Это указывает на то, что мутант GNFT и мутант GNRT обладают большим временем полужизни, чем ФСГ дикого типа. Пример 5. Биологическая активность in vivoIn vivo модель, использованная для того, чтобы определить биологическую активность мутантовGNRT и GNFT, представляет собой анализ увеличения веса яичников крыс. Обработка неполовозрелых самок крысы возраста 21 день ФСГ или молекулами с ФСГ-подобной активностью, например, мутантамиGNRT и GNFT, вызывает рост овариальных фолликул и производство ооцитов. Данный рост легко может быть детектирован при помощи измерения веса яичников в конце периода обработки. В данной модели тестируемую субстанцию вводят при помощи инъекции в течение трех дней, яичники собирают и взвешивают после последней дозы. Данный анализ применяли в течение нескольких десятилетий как основу для установления ФСГ-активности для клинических продуктов в целях классификации. Он измеряет соответствующее физиологическое действие ФСГ и прямо коррелирует с эффективностью продуктов в клинике.In vivo активность мутантов GNRT и GNFT сравнивали с активностью ФСГ дикого типа. Все дозы определяли на основании расчетной эквивалентности ФСГ, принимая в расчет активность in vitro и время полужизни в крысах. Было обнаружено, что мутанты GNRT и GNFT обладают высокой ФСГактивностью с величиной, близкой к ФСГ дикого типа. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Нуклеиновая кислота, кодирующая мутантную -субъединицу ФСГ, где -субъединица содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:4-5. 2. Вектор, содержащий нуклеиновую кислоту по п.1. 3. Вектор по п.2, который представляет собой вектор экспрессии. 4. Вектор по п.2, дополнительно содержащий нуклеиновую кислоту, кодирующую -субъединицу ФСГ, содержащую последовательность SEQ ID NO:3. 5. Клетка-хозяин, содержащая вектор по п.2. 6. Клетка-хозяин по п.5, которая представляет собой клетку млекопитающего. 7. Мутантный ФСГ, в котором -субъединица содержит последовательность ID NO:3 и субъединица кодируется нуклеиновой кислотой по п.1 и содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:4-5. 8. Мутантный ФСГ по п.7, в котором любые из 1-6 остатков аспарагина гликозилированы. 9. Мутантный ФСГ по п.7, в котором -субъединица содержит последовательность ID NO:4, в которой N5 гликозилирован. 10. Мутантный ФСГ по п.7, в котором -субъединица содержит последовательность SEQ ID NO:5,- 12013975 в которой N5 гликозилирован. 11. Способ получения мутантного ФСГ, включающий:(a) получение клетки, содержащей нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую -субъединицу ФСГ, содержащую SEQ ID NO:3;(b) культивирование клетки в условиях, которые делают возможной экспрессию первой и второй нуклеиновых кислот;(c) получение мутантного ФСГ. 12. Способ по п.11, в котором клетка способна гликозилировать белок. 13. Способ по п.11, в котором клетка содержит один вектор, включающий нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую -субъединицу ФСГ, включающую SEQ ID NO:3. 14. Способ по п.11, в котором клетка содержит вектор, включающий нуклеиновую кислоту по п.1,и, кроме того, содержит второй вектор, включающий нуклеиновую кислоту, кодирующую субъединицу ФСГ, включающую SEQ ID NO:3. 15. Фармацевтическая композиция, включающая мутантный ФСГ по п.7 и, при необходимости,фармацевтически приемлемый носитель или эксципиент. 16. Способ лечения инфертильных млекопитающих, включающий введение млекопитающему, нуждающемуся в указанном лечении, фармацевтической композиции по п.15. 17. Способ стимуляции фолликулогенеза у млекопитающих, включающий введение млекопитающему, нуждающемуся в указанной стимуляции, фармацевтической композиции по п.15. 18. Способ индукции овариальной гиперстимуляции у млекопитающих, включающий введение млекопитающему, нуждающемуся в указанной индукции, фармацевтической композиции по п.15.
МПК / Метки
МПК: C07K 14/59, C12N 15/16, A61K 38/24
Метки: применения, способы, мутантный
Код ссылки
<a href="https://eas.patents.su/14-13975-mutantnyjj-fsh-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Мутантный fsh и способы его применения</a>