Способ селективной регуляции клеточного роста и клеточной дифференцировки и применение фармацевтической композиции, содержащей арил- и гетероарилхиназолиновые соединения для этой цели.
Номер патента: 840
Опубликовано: 24.04.2000
Авторы: Магир Мартин П., Спада Альфред П., Майерз Майкл Р., Персонз Пол Е.
Формула / Реферат
1. Способ селективной регуляции клеточного роста и клеточной дифференцировки, характеризующийся активностью рецептора типа 2 человеческого эпидермального фактора роста (HER2), причем указанный способ предусматривает введение пациенту, нуждающемуся в такой регуляции, эффективного HER2-ингибирующего количества соединения формулы
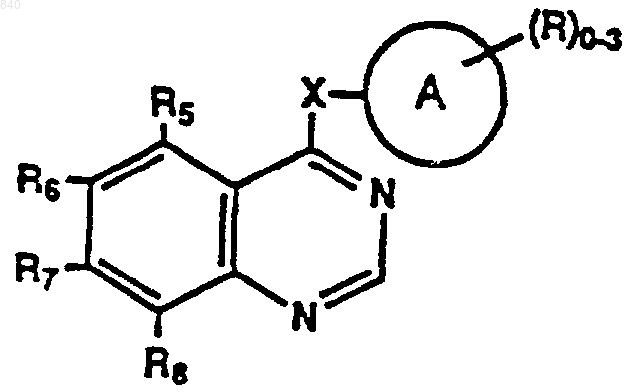
где А представляет замещенную или незамещенную моно- или бициклическую арильную, гетероарильную, циклоалкильную или гетероциклоалкильную кольцевую систему, состоящую из 5-12 атомов, при этом заместители могут присутствовать в любом подходящем положении кольцевой системы и обозначаются R;
Х представляет связь, О, S, SO, SО2, OCH2, CR4=CR4, CуC, NR4 или NR4CH2;
R независимо представляет водород, алкил, фенил, галогенфенил, аралкил, гидрокси, алкокси, арилокси, ацилокси, галоген, галогеналкил, амино, моно- и диалкиламино, ациламино, карбокси, амидо, моно- и диалкиламидо, алкилтио, алкилсульфинил и алкилсульфонил;
R4 представляет водород, алкил или аралкил; и
R5, R6, R7 и R8 независимо представляют водород, алкокси или аралкокси; или
фармацевтически приемлемой соли указанного соединения.
2. Способ по п.1, в котором А представляет замещенное или незамещенное моноциклическое арильное или гетероарильное кольцо, выбранное из фенила, пирролила, тиенила, фурила, тиазолила, имидазолила, пиразолила, пиридила, пиразинила, пиримидинила, пиридазинила, изотиазолила, изоксазолила и оксазолила.
3. Способ по п.1, в котором А представляет замещенное или незамещенное бициклическое арильное или гетероарильное кольцо, выбранное из нафтила, тетралинила, 1,2,3,4-тетрагидрохинолинила, бензофурила, бензотиенила, инданила, индолила, индолинила, 1,3-бензодиоксолила, бензодиоксанила, хинолинила, тетрагидрохинолинила, изохинолинила, хиназолинила и хиноксалинила.
4. Способ по п.1, в котором А представляет замещенное или незамещенное моноциклическое циклоалкильное или гетероциклоалкильное кольцо, выбранное из циклопентила, циклогексила, циклогептила, декалинила, пиперидинила, пиперазинила, морфолинила или декагидрохинолинила.
5. Способ по п.1, в котором А представляет замещенное или незамещенное бициклическое циклоалкильное или гетероциклоалкильное кольцо, выбранное из декалинила или декагидрохинолинила.
6. Способ по п.1, в котором А представляет замещенный или незамещенный фенил, пиридил, тиенил, фурил, пиразолил, нафтил, тетралинил, 1,2,3,4-тетрагидрохинолинил, инданил, индолил, индолинил, хинолинил, тетрагидрохинолинил, циклогексил, пиперидинил или пиперазинил;
Х представляет связь О, S или NR4;
R представляет водород, алкил, алкокси, галоген, галогеналкил, алкилтио, алкилсульфинил, алкилсульфонил, фенил и аралкил;
R4 представляет водород, алкил или аралкил; и
R5, R6, R7 и R8 независимо представляют водород или алкокси.
7. Способ по п.6, в котором А представляет замещенный или незамещенный фенил, нафтил или индолил;
Х представляет связь;
R представляет водород, метокси, этокси, хлор, трифторметил, метилсульфонил, фенил и бензил;
R4 представляет водород, метил или бензил; и
R5, R6, R7 и R8 независимо представляют водород или метокси.
8. Способ по п.2, в котором вводимым соединением является 4-(2-фенилэтиленил)-6,7-диметоксихиназолин или его фармацевтически приемлемая соль.
9. Способ по п.3, в котором вводимым соединением является 6,7-диметокси-4-нафталин-1-ил-этинилхиназолин или его фармацевтически приемлемая соль.
10. Способ по п.6, в котором указанное вводимое соединение выбирают из
4-(2-метоксипиридин-5-ил)-6,7-диметоксихиназолина;
4-(4-фенилпиперидин-1-ил)-6,7-диметоксихиназолина;
4-[4-(3-хлорфенил)пиперазин-1-ил]-6,7-диметоксихиназолина; и
4-(1,2,3,4-тетрагидрохинолин-1-ил)-6,7-диметоксихиназолина;
или их фармацевтически приемлемой соли.
11. Способ по п.6, в котором указанное вводимое соединение выбирают из
6,7-диметокси-4- (b -нафтиламино) хиназолина,
4-[N-(5-инданил)амино]-6,7-диметоксихиназолина,
N-бензил-N-(6,7-диметоксихиназолин-4-ил)-N-фениламина,
6,7-диметокси-4-(N-метиланилино)хиназолина,
N-(3-хлорфенил)-N-(6,7-диметоксихиназолин-4-ил)-N-метиламина,
4-(3-аминопиразолил)-6,7-диметоксихиназолина и
4-(циклогексиланилино)-6,7-диметоксихиназолина или их фармацевтически приемлемой соли.
12. Способ по п.6, в котором вводимым соединением является 6,7-диметокси-4-(a -нафтиламино)хиназолин или его фармацевтически приемлемая соль.
13. Способ по п.6, в котором указанным вводимым соединением является 6,7-диметокси-4-(a -нафтиламино)хиназолин или его фармацевтически приемлемая соль.
14. Способ по п.7, в котором указанное вводимое соединение выбирают из
4-(нафталин-1-ил)-6,7-диметоксихиназолина,
4-(нафталин-2-ил)-6,7-диметоксихиназолина,
4-(3-фенилфенил)-6,7-диметоксихиназолина,
4-(индол-3-ил)-6,7-диметоксихиназолина и
4-(метилиндол-3-ил)-6,7-диметоксихиназолина или их фармацевтически приемлемой соли.
15. Способ по п.7, в котором вводимым соединением является 4-(1-бензилиндол-3-ил)-6,7-диметоксихиназолин или его фармацевтически приемлемая соль.
16. Применение фармацевтической композиции, включающей эффективное НЕR2-ингибирующее количество соединения формулы
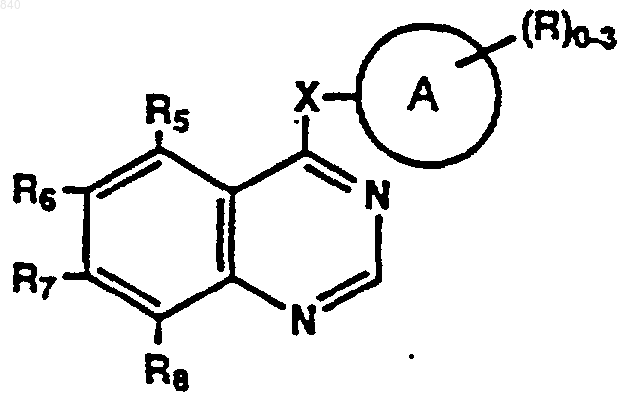
где А представляет замещенную или незамещенную моно- или бициклическую арильную, гетероарильную, циклоалкильную или гетероциклоалкильную кольцевую систему, состоящую приблизительно из 5-12 атомов, при этом заместители могут присутствовать в любом подходящем положении кольцевой системы и обозначаются R;
Х представляет связь, О, S, SO, SO2, OCH2, CR4=CR4, CуC, NR4 или NR4CH2;
R независимо представляет водород, алкил, фенил, галогенфенил, аралкил, гидрокси, алкокси, арилокси, ацилокси, галоген, галогеналкил, амино, моно- и диалкиламино, ациламино, карбокси, амидо, моно- и диалкиламидо, алкилтио, алкилсульфинил и алкилсульфонил;
R4 представляет водород, алкил или аралкил; и
R5, R6, R7 и R8 независимо представляют водород, алкокси или аралкокси; или
фармацевтически приемлемой соли указанного соединения в смеси с фармацевтически приемлемым носителем, для селективной регуляции клеточного роста и клеточной дифференцировки.
17. Применение композиции по п.16, отличающееся тем, что в соединении
А представляет замещенный или незамещенный фенил, пиридил, тиенил, фурил, пиразолил, нафтил, тетралинил, 1,2,3,4-тетрагидрохинолинил, инданил, индолил, индолинил, хинолинил, тетрагидрохинолинил, циклогексил, пиперидинил или пиперазинил;
Х представляет связь О, S или NR4;
R представляет водород, алкил, алкокси, галоген, галогеналкил, алкилтио, алкилсульфинил, алкилсульфонил, фенил и аралкил;
R4 представляет водород, алкил или аралкил; и
R5, R6, R7 и R8 независимо представляют водород или алкокси.
18. Применение композиции по п.17, в которой указанным соединением является 6,7-диметокси-4-(a -нафтиламино)хиназолин или его фармацевтически приемлемая соль.
19. Применение композиции по п.17, в которой указанным соединением является 4-(1-бензилиндол-3-ил)-6,7-диметоксихиназолин или его фармацевтически приемлемая соль.
Текст
1 Настоящая заявка является заявкой в частичное продолжение Международной заявки(дата международной подачи), указанной заявкой США, и заявки США 08/166199, поданной 10 декабря 1993 г., которая является заявкой в частичное продолжение заявки США 07/988515, поданной 10 декабря 1992 г., которая является заявкой в частичное продолжение заявки США 07/698420, поданной 10 мая 1991 г. и Международной заявки PCT/US 92/03736,поданной 6 мая 1992 г., которая является указанной заявкой США, по которой выдан патент США 5409930. Область техники, к которой относится изобретение Настоящее изобретение относится к селективной регуляции клеточного роста и клеточной дифференциации, обусловленных активностью рецептора типа 2 человеческого эпидермального фактора роста (НЕR2). Более конкретно, настоящее изобретение относится к использованию замещенных или незамещенных моно- или бициклических арильных, гетероарильных, циклоалкильных или гетероциклоалкильных соединений для селективной регуляции клеточного роста. Нормальное репродуцирование клеток,очевидно, стимулируется воздействием на клеточный субстрат одним или несколькими факторами роста, примерами которых могут служить инсулин, эпидермальный фактор роста(EGF) и тромбоцитарный фактор роста (PDGF). Рецепторы указанных факторов роста внедрены в клеточную мембрану и пронизывают ее. Инициация репродуцирования клеток происходит,очевидно, в тот момент, когда фактор роста связывается с соответствующим рецептором на внешней поверхности клеточной мембраны. Это связывание фактора роста с рецептором приводит к изменению химических свойств той части рецептора, которая находится внутри клетки, и которая функционирует как фермент, катализирующий фосфорилирование либо внутриклеточного субстрата, либо самого рецептора; причем, последнее явление будет далее именоваться самофосфорилированием. Примерами таких фосфорилирующих ферментов являются тирозинкиназы, которые катализируют фосфорилирование тирозиновых аминокислотных остатков субстратных белков. Многие патологические состояния обусловлены неконтролируемой пролиферацией клеток. В развитии указанных патологических состояний могут участвовать клетки различных типов, и примерами этих состояний являются такие заболевания, как лейкоз, рак, псориаз,воспалительные болезни, болезни костей, атеросклероз и рестеноз после пластической операции на сосудах. Очевидно, что способ регуляции неконтролируемой пролиферации клеток,т.е. способ предупреждения заболеваний, обу 000840 2 словленных клеточной пролиферацией, предусматривает ингибирование тирозинкиназы. Инициирование самофосфорилирования,т.е. фосфорилирования самого рецептора фактора роста, и фосфорилирования внутриклеточных субстратов хозяина являются до некоторой степени биохимическими процессами, участвующими в митогенезе с высвобождением медиатора и пролиферации клеток. Самофосфорилирование рецептора инсулина и фосфорилирование субстратных белков другими рецепторами являются наиболее ранними из идентифицируемых биохимических гормональных ответов. Элиминация протеин-тирозин-киназной(РТК) активности рецептора инсулина и рецептора эпидермального фактора роста (EGF) посредством сайт-направленного мутагенеза клеточного генетического материала, являющегося ответственным за продуцирование инсулина иEGF, приводит к полной элиминации биологической активности рецептора. Этот факт является весьма нежелательным, поскольку инсулин необходим организму для осуществления других биологических функций, не относящихся к пролиферации клеток. В соответствии с этим можно ожидать, что соединения, которые ингибируют РТК-область EGF и/или PDGFрецептора при концентрациях меньших, чем концентрации, необходимые для ингибирования РТК-области рецептора инсулина, могут быть с успехом использованы для селективного лечения расстройств, обусловленных клеточной пролиферацией. Описание предшествующего уровня техники Принято считать, что протеин-тирозинкиназная (РТК) активность, ассоциируемая с рецепторами факторов роста, имеет большое значение для лиганд-индуцированных биологических реакций, таких как рост и дифференцировка клеток. В работах J.M. Bishop, (1985) Cell,42: 23-38 и Т. Hunter (1987) Cell, 50: 823-829 сообщается, что при фосфорилировании по остаткам тирозина наблюдается аномальный рост и морфологическая трансформация клеток, при этом рецепторы факторов роста принадлежат к семейству онкогенов bonafide. Среди этих онкогенных продуктов был идентифицирован рецептор типа 2 человеческого эпидермального фактора роста (НЕR2; c-erbB-2). Carpenter и др. 1987) Аnnu. Rev. Biochem., 56: 881-) и Gill и др. 1987) Mol. Cell Endocrinol., 51: 169-) сообщают, что ген c-erbB-1 кодирует трансмембранный 170 кДа-гликопротеин. Как сообщают C.I.(Nature, 319: 226-229), ген HER2 является человеческим гомологом крысиного протоонкогенаneu, а его продукт представляет собой трансмембранный 185 кДа-гликопротеин клеточной поверхности, называемый p185HER2 (как описано 3 Этот рецептор обеспечивает характерную тирозин-специфическую киназную активность, катализирующую реакцию самофосфорилирования,а также опосредующую фосфорилирование эндогенного субстрата при связывании их соответствующих лигандов на внеклеточных доменах рецепторов. Неизмененный амплифицированный генHER2 был обнаружен в различных опухолях человека. Кроме того, для пациентов с некоторыми типами рака была установлена корреляция между повышенными уровнями экспрессииp185HER2 и плохим прогнозом или непродолжительным временем жизни. Если учесть, что использование антител, продуцируемых противp185HER2 (которые блокируют функции рецептора), приводит к прекращению роста опухолевых клеточных линий и к противоопухолевому действию у мышей, то методика, предусматривающая применение химически синтезированных агентов, которые селективно ингибируютp185HER2-ассоциированную РТК, может оказаться эффективной для лечения рака. Как сообщают С. Workman, V.G. Brunton и D.J. Robins(1992) в seminars in Cancer Biology, 3: 369-381 и С. Wasylyk, A. Gutman, R. Nicholson и В. Wasylyk (1991) в ЕМВО J., 10: 1127-1134, в настоящее время имеется документальное подтверждение тому, что множество натуральных и синтетических аналогов ингибиторов РТК было систематически проанализировано на их потенциальную противоопухолевую активность. Авторами настоящей заявки описаны идентификация и характеризация серии хиназолиновых производных, которые являются ингибиторами тирозин-киназы, и которые обладают селективностью в отношении p185HER2. В частности, заявители показали, что для сохранения трансформированного фенотипа клетки, индуцированного сверхэкспрессией p185HER2, необходимо наличие тирозинкиназной активности,ассоциированной с НЕR2-генным продуктом. Краткое описание изобретения Настоящее изобретение относится к способу селективной регуляции клеточного роста и клеточной дифференциации, обусловленных активностью рецептора типа 2 человеческого эпидермального фактора роста (HER2), где указанный способ предусматривает введение пациенту, нуждающемуся в такой регуляции, эффективного НЕR2-ингибирующего количества хиназолинового соединения, описанного в настоящем изобретении. В другом своем аспекте настоящее изобретение относится к фармацевтическим композициям для селективной регуляции клеточного роста и клеточной дифференциации, обусловленных активностью рецептора типа 2 человеческого эпидермального фактора роста (HER2),где указанные композиции содержат фармацевтически эффективное количество соединения 4 вышеуказанного типа в сочетании с фармацевтически приемлемым носителем. В еще одном своем аспекте настоящее изобретение относится к новым соединениям,используемым для осуществления вышеуказанного способа. Во всех указанных аспектах соединения,описанные нижеприведенной формулой I, относятся к классу выше упомянутых хиназолиновых соединений, используемых для осуществления настоящего изобретения, а именно: где А представляет замещенную или незамещенную моно- или бициклическую арильную,гетероарильную, циклоалкильную или гетероциклоалкильную кольцевую систему, состоящую приблизительно из 5-12 атомов, при этом заместители могут присутствовать в любом подходящем положении кольцевой системы и обозначаются R; Х представляет связь, О, S, SO, SO2, OCH2,CR4=CR4, CC, NR4 или NR4CH2;R5, R6, R7 и R8 независимо представляют водород, алкокси или аралкокси; или к их фармацевтически приемлемой соли. Подробное описание и предпочтительные варианты осуществления изобретения Следует отметить, что используемые в настоящем описании термины, если это не оговорено особо, имеют следующие значения."Моноциклический арил" или "моноциклический гетероарил" означает карбоциклическое или гетероциклическое ароматическое кольцо. Предпочтительными кольцами являются фенил, пирролил, тиенил, фурил, тиазолил,имидазолил, пиразолил, пиридил, пиразинил,пиримидинил, пиридазинил, изотиазолил, изоксазолил и оксазолил."Бициклический арил" или "бициклический гетероарил" означает бициклическую кольцевую систему, состоящую из двух конденсированных колец, из которых, по крайней мере, одно является карбоциклическим или гетероциклическим ароматическим кольцом. Предпочтительными кольцами являются замещенные и незамещенные нафтил, тетралинил, 1,2,3,4 тетрагидрохинолинил, бензофурил, бензотиенил, индолил, индолинил, 1,3-бензодиоксолил,бензодиоксанил, хинолинил, тетрагидрохиноли 5 нил, изохинолинил, хиназолинил и хиноксалинил."Моноциклический циклоалкил" означает циклическое алифатическое кольцо, состоящее примерно из 4-7 атомов углерода, такое как замещенный и незамещенный циклопентил, циклогексил и циклогептил."Бициклический циклоалкил" означает насыщенную бициклическую кольцевую систему,состоящую из двух конденсированных алифатических колец, имеющих примерно 8-12 атомов углерода, таких как замещенный и незамещенный декалинил."Моноциклический гетероциклоалкил" означает насыщенное циклическое алифатическое кольцо, состоящее примерно из 4-7 атомов углерода и имеющее 1-2 гетероатома, выбранных из N, О и S, при условии, что указанные гетероатомы являются не смежными атомами кислорода и/или серы; при этом, указанным кольцом является замещенный и незамещенный пиперидинил, пиперазинил и морфолинил."Бициклический гетероциклоалкил"' означает насыщенную бициклическую кольцевую систему, состоящую из двух конденсированных алифатических колец из 8-12 атомов и имеющую 1-3 гетероатома, выбранных из N, О и S,при условии, что указанные гетероатомы не являются смежными атомами кислорода и/или серы; где указанной кольцевой системой является замещенный или незамещенный декагидрохинолинил."Алкил" означает насыщенный алифатический углеводород с разветвленной или прямой цепью. Предпочтительным алкилом является"низший алкил", имеющий примерно 1-6 атомов углерода. Примерами алкила являются метил,этил, н-пропил, изопропил, бутил, втор-бутил,трет-бутил, амил и гексил."Алкокси" означает алкил-O-группу. Предпочтительными алкоксигруппами являются метокси, этокси, пропокси и бутокси."Арилокси" означает арил-O-группу. Предпочтительной арилоксигруппой является феноксигруппа."Аралкил" означает алкильную группу, замещенную арильным радикалом. Предпочтительными аралкильными группами являются бензил или фенетил. Предпочтительными аралкоксигруппами являются бензилокси и фенетокси. Предпочтительными ацилоксигруппами являются ацетокси и бензилокси."Галоген" означает галоген. При этом предпочтительным галогеном является хлор,бром и фтор. Предпочтительными галогеналкильными группами являются моно-, ди- и трифторметил. Более конкретно, предпочтительными моноциклическими арильными или гетероарильными кольцами, обозначенными А, являются замещенный или незамещенный фенил, пирро 000840 6 лил, тиенил, фурил, тиазолил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил,пиридазинил, изотиазолил, изоксазолил и оксазолил. Предпочтительными бициклическими арильными или гетероарильными кольцами,обозначенными А, являются замещенные и незамещенные нафтил, тетралинил, 1,2,3,4 тетрагидрохинолинил, бензофурил, бензотиенил, индолил, индолинил, 1,3-бензодиоксолил,бензодиоксанил, хинолинил, тетрагидрохинолинил, изохинолинил, хиназолинил и хиноксалинил. Предпочтительными моноциклическими циклоалкильными или гетероциклоалкильными кольцами, обозначенными А, являются замещенные и незамещенные циклопентил, циклогексил, циклогептил, декалинил, пиперидинил,пиперазинил,морфолинил или декагидрохинолинил. Предпочтительными бициклическими циклоалкильными или гетероциклоалкильными кольцами, обозначенными А, являются замещенные и незамещенные декалинил или декагидрохинолинил. Более предпочтительными являются соединения, в которых А представляет замещенный и незамещенный фенил, пиридил, тиенил, фурил, пиразолил,нафтил,тетралинил,1,2,3,4-тетрагидрохинолинил, индолил, индолинил, хинолинил,тетрагидрохинолинил, циклогексил, пиперидинил или пиперазинил; Х представляет связь, О, S или NR4;R5, R6, R7 и R8 независимо представляют водород или алкокси. Наиболее предпочтительными являются соединения, в которых А представляет замещенный и незамещенный фенил, нафтил или индолил; Х представляет связь;R5, R6, R7 и R8 независимо представляют Н или метокси. Соединения, входящие в объем настоящего изобретения, являются селективными тирозинкиназа-специфическими ингибиторами рецептора типа 2 человеческого эпидермального фактора роста (HER2). Очевидно, что терапевтически ценные РТК-ингибирующие соединения обладают специфичностью по отношению к тирозинкиназной активности, способной катализировать самофосфорилирование. Кроме того, 7 указанные соединения способны ингибировать индуцированную фактором роста пролиферацию клеток. Соединения, отвечающие этим критериям, являются особенно эффективными и могут быть с успехом использованы в целях настоящего изобретения. В настоящей заявке описаны соединения, обладающие селективностью в отношении вышеуказанных рецепторов. Соединения настоящего изобретения могут быть использованы в форме свободного основания, в форме солей и в форме гидрата. Все указанные формы входят в объем настоящего изобретения. Могут быть получены кислотные аддитивные соли, которые являются более удобными для использования, и на практике их использование является, по существу, эквивалентным использованию свободного основания. Для получения кислотных аддитивных солей предпочтительно использовать кислоты, которые при реакции со свободным основанием образуют фармацевтически приемлемые соли, т.е. соли, анионы которых являются нетоксичными для организма животного в соответствующих фармацевтических дозах этих солей, так, чтобы полезные свойства, присущие свободному основанию, не подвергались неблагоприятному воздействию из-за побочных эффектов, которые могут быть вызваны указанными анионами. Хотя фармацевтически приемлемые соли упомянутых основных соединений являются предпочтительными, однако, все кислотные аддитивные соли могут быть использованы в качестве источников для свободной основной формы, даже если конкретная соль per se желательна лишь в качестве промежуточного продукта, например, в случае, когда соль получают лишь в целях очистки и идентификации, или когда эту соль используют в качестве промежуточного продукта для получения фармацевтически приемлемой соли посредством ионообменной реакции. Фармацевтически приемлемые соли настоящего изобретения могут быть получены из таких кислот, как минеральные кислоты, например, соляная кислота, серная кислота, фосфорная кислота и сульфаминовая кислота; органические кислоты, например, уксусная кислота,лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метасульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота,циклогексилсульфаминовая кислота, хинная кислота и т. п. Подходящими кислотными аддитивными солями являются гидрохлорид, сульфат, фосфат,сульфамат, ацетат, цитрат, лактат, тартрат, метансульфонат, этансульфонат, бензолсульфонат,паратолуолсульфонат, циклогексилсульфамат и хинат соответственно. Кислотные аддитивные соли соединений настоящего изобретения получают либо путем растворения свободного основания в водном или в водно-спиртовом растворе или в других 8 подходящих растворителях, содержащих соответствующую кислоту, и последующего выделения соли путем выпаривания раствора; либо путем реакции свободного основания с кислотой в органическом растворителе, и в этом случае соль может быть непосредственно выделена или получена путем концентрирования раствора. Соединения настоящего изобретения могут быть получены стандартными способами, описанными в литературе, с использованием в качестве исходных соединений известных соединений или легко получаемых промежуточных соединений. В основном, соединения, используемые для селективной регуляции роста и дифференцировки клеток, характеризующихся активностью рецептора типа 2 человеческого эпидермального фактора роста, могут быть получены посредством катализируемой палладием реакции сочетания арил- или гетероарилстаннана с арил- или гетероарилгалогенидом или трифторацетатом (трифлатом). где Y представляет галоген или трифторацетат,Z представляет триалкилстаннан, a R является таким, как он был определен выше. 4-Галогенхиназолиновые исходные соединения получают классическим способом с использованием антраниловокислотных производных и формамида при нагревании с обратным холодильником, в результате чего образуются промежуточные хиназолиноны. После примерно 2-часовой обработки РОСl3 при температуре около 110 С получают хлорхиназолины. Конечные продукты получают путем конденсации с соответствующим анилиновым производным в полярном растворителе, таком как этанол. В случае фенокси- или тиофеноксипроизводных получают соль металла (предпочтительно Na) и нагревают с обратным холодильником в течение нескольких часов с соответствующим галогенхиназолином в растворителе, таком как ТГФ. 9 Арил- и гетероарилстаннаны могут быть получены из соответствующего галогенида(предпочтительно бромида или иодида) путем его превращения в ариллитий с помощью реакции с трет-бутиллитием, проводимой при пониженной температуре, предпочтительно около Очевидно, что эти продукты могут быть также получены в обратном порядке с использованием арил- или гетероарилгалогенидов с соответствующим станнаном. Промежуточные соединения хиназолинстаннанов могут быть получены путем обработки арилгалогенидов триметилоловонатрием, как описано в Chem. Pharm. Bull. 1982, 30, 17311737. Получение соединений, используемых в настоящем изобретении, описано заявителями в их одновременно рассматриваемых заявках(дата международной подачи), с указанием США как страны-участницы договора, заявке США 08/166199, поданной 10 декабря 1993 г. и заявке США 08/229886, поданной 19 апреля 1994 г.; при этом все указанные заявки имеют притязание на приоритет. Заявки PCT/US 94/14180, США 08/166199 и США 08/229886 указаны в настоящем описании в качестве ссылок. Кроме того, в нижеследующих примерах описаны способы, используемые для синтеза соединений настоящего изобретения. Нижеследующие примеры и примеры,описанные в заявке PCT/US 94/14180 и в заявке США 08/166199, могут быть использованы для получения любого нужного соединения настоящего изобретения. Список репрезентативных соединений настоящего изобретения, которые могут быть получены описанными способами, представлен ниже. Пример 1. 4-(3-Хлорфенокси)-6,7-диметоксихиназолин. Тетрагидрофуран (5 мл) и гидрид натрия(60%-ная дисперсия в масле, примерно 28 мг) вводили в сухую колбу в инертной атмосфере при комнатной температуре. Затем добавляли раствор 3-хлорфенола (0,09 г) в тетрагидрофуране (1 мл) и перемешивание продолжали до тех пор, пока раствор не становился прозрачным. К 10 полученному раствору добавляли сразу весь 4 хлор-6,7-диметоксихиназолин (в виде твердого вещества) и перемешивание продолжали в течение ночи при комнатной температуре. После этого раствор распределяли между метиленхлоридом и 5%-ным гидроксидом натрия. Органический слой промывали солевым раствором,осушали сульфатом натрия и концентрировали. В результате очистки с помощью колоночной флэш-хроматографииEtOAc/гексан) было получено чистое соединение. Аналитический образец перекристаллизовывали из EtOAc/гексана, в результате чего получали 4-(3-хлорфенокси)-6,7-диметоксихиназолин (0,05 г) в виде белых игольчатых кристаллов, т. пл. 152-153 С. Пример 2. 4-(1-Метилсульфонилиндол-3 ил)-6,7-диметоксихиназолин. Стадия А. N-Метилсульфонил-3-триметилстаннилиндол. Раствор 5 гNметилсульфонил-3-иодиндола (5,1 г, 15,57 ммоль) в гексаметилдиолове и 0,89 г (0,78 ммоль) Рd(РРh3)4 в 75 мл безводного толуола тщательно продували азотом и нагревали до 90 С в течение четырех часов. Затем смесь выпаривали и хроматографировали на силикагеле(элюируя сначала гексаном, а затем 10%-ным этилацетатом/гексаном), в результате чего получали N-метилсульфонил-3-триметилстаннилиндол, который использовали непосредственно в последующей стадии. Стадия В. 4-(1-Метилсульфонилиндол-3 ил)-6,7-диметоксихиназолин. Раствор, содержащий 1,33 г (4,01 ммоль)(3,34 ммоль) 4-хлор-6,7 диметоксихиназолина и 0,19 г (5 мол.%, 0,16 ммоль) Рd(РРh3)4 в 10 мл безводного диметилформамида, энергично продували азотом и нагревали до 90 С в течение 12 ч. Реакционную смесь разводили метиленхлоридом, промытым 10% гидроксидом аммония, и энергично перемешивали, а затем промывали водой. Объединенные органические экстракты промывали солевым раствором (75 мл), осушали сульфатом магния и выпаривали досуха. После перекристаллизации из этилацетата был получен 4-(1 метилсульфонилиндол-3-ил)-6,7-диметоксихиназолин (т. пл.220 С). Вышеуказанные примеры могут быть использованы для получения любых нужных соединений настоящего изобретения. Ниже приводится список соединений, которые могут быть получены вышеописанными способами. 6,7-Диметокси-4-нафталин-2-илэтинилхиназолин, т. пл 158-161 С; 4-(4-Гидроксифенил)-6,7-диметоксихиназолина гидрохлорид, т. пл.270 С (с разл.); 4-(Нафталин-1-ил)-6,7-диметоксихиназолин, т. пл. 144-147 С;N-(6,7-Диметоксихиназолин-4-ил)-N(нафт-2-ил)-N-этиламина гидрохлорид, т. пл. 236-239 С (с разл.); 6,7-Диметокси-4-(нафталин-2-сульфинил) хиназолин, т. пл. 182,5-185 С; 6,7-Димeтoкcи-4-(нaфтaлин-2-cyльфoнил) хиназолин; 4-(3-Хлоранилино)-6,7-диметилхиназолина гидрохлорид, т. пл. 271-274 С; 4-(3,5-Диметиланилино)-6,7-диметилхиназолина гидрохлорид, т. пл.275 С; 4-(N-Метил-4-метиланилино)-6,7-диметилхиназолина гидрохлорид, т. пл. 235-238 С; 6,7-Диметил-4-(1-нафтиламино)хиназолина гидрохлорид, т. пл. 244-247 С; 6,7-Димeтил-4-(7-трифторметил-3,4 дигидро-2 Н-хинолин-1-ил)хиназолина гидрохлорид, т. пл. 240 С; 4-(N-Метил-3-метиланилино)-6,7-диметилхиназолина гидрохлорид, т. пл. 205-207 С; 4-(3-Хлорфенилтио)-6,7-диметилхиназолина гидрохлорид, т. пл. 197-202 С; 4-(1-Нафтилтио)-6,7-диметилхиназолина гидрохлорид, т. пл. 204-209 С; и 4-(3,4-Диметоксифенилтио)хиназолин, т. пл. 115-117 С. Получение фармацевтических композиций и фармакологические испытания Для оценки эффективности соединений настоящего изобретения были проведены фармакологические испытания, описанные ниже,которые обычно осуществляются специалистами для установления корреляции с фармакологической активностью в организме млекопитающих. Соединения настоящего изобретения были подвергнуты различным тестам, и результаты этих тестов показали, что эти соединения являются эффективными ингибиторами пролиферации клеток, индуцированной фактором роста. Для оценки ингибирующей способности соединений настоящего изобретения были использованы тесты, описанные ниже. Экспериментальные методы Материалы. Тест-материал растворяли без какой-либо предварительной обработки в ДМСО, в результате чего получали маточные растворы, которые затем разводили в культуральной среде для достижения нужной концентрации соединения (конечная концентрация наполнителя составляет 0,1%). При этом были использованы следующие материалы: модифицированная по способу Дульбекко Среда Игла(DMEM), RPMI 1640, фетальная телячья сыворотка (FCS) и раствор пенициллина и стрептомицина (10000 МЕ/мл пенициллина и 10000 мкг/мл стрептомицина), которые были получе 000840 14 ны от GIBCO BRL. 3-(4,5-Диметилтиазол-2-ил)2,5-дифенилтетразолия бромид (МТТ) и генетицин получали от Sigma. Радиоактивно меченыйScience. Мышиные моноклональные антитела против фосфотирозинаIgG2bk) поставлялись от UBI, а конъюгированные с пероксидазой хрена кроличьи антитела против мышиных иммуноглобулинов IgG были получены из лаборатории Nordic IimnunologicalLaboratories. Стромелизин-САТ-плазмидную ДНК-конструкцию, состоящую из кДНК хлорамфениколацетилтрансферазы под контролем стромелизинового промоторного фрагмента-1100/+8, получали методом, описанным С. Wasylyk, A. Gutman, R. Nicholson и В. Wasylyk,(1991) EMBO J., 10: A127-A134. Все остальные химические реагенты имели качества, удовлетворяющие самым высоким требованиям. Клеточные линии и клеточные культуры. Фибробласты мышиных эмбрионов (NIH3T3),клеточную линию плоскоклеточного рака человека (А 431), и клеточные линии аденокарциномы молочной железы человека (SK-BR-3) и яичника (SK-OV-3), и клеточные линии карциномы легких человека (А 549) и молочной железы человека (ВТ 474 и ВТ 20) поставлялись из АТСС. Клетки NIH3T3, трансфецированные НЕR2-конструкцией,сверхэкспрессировали р 185HER2. NIH/HER2 получали способом, описанным R.M. Hudziak, J. Schlessinger и A. Ullrich(1987), Proc. Natl. Acad. Sci. USA, 84: 7159-7163. Клеточную линию NIH/Ha-Ras получали путем трансформации клеток NIH3T3 val2Ha-гas в соответствии с I. Barlat, F. Schweighoffer, M.C.Y527F (NIH/v-Src), были получены от Dr. В.Wasylyk. Клеточная линия HIR3,5 (NIH/IR) представляет собой клетки NIH3T3, сверхэкспрессирующие рецептор инсулина человека, и была получена от Dr. J. Whitaker. Все клеточные линии были культивированы при 37 С в СО 2 инкубаторе (5% СO2/95% влажность атмосферы воздуха) в среде, в которую были добавлены 10% FCS и 1% раствор пенициллинстрептомицина. Если в тексте не оговорено особо, то культуральную среду заменяли через день.In vitro-анализ на самофосфорилирование р 185HER2. В качестве источников для p185HER2 были использованы клеточные линии ЕР 22 или А 431 и NIH/HER2. Субконфлюентные монослои клеток лизировали в течение 10 мин при 4 С в буфере HNEG (HNEG: 50 мм Hepes-буфер, рН 7,5, 150 мM NaCl, 1 мM EDTA и 10% глицерин),содержащем 1% Тритон Х-100 и 1 мМ PMSF. Затем клеточные лизаты разводили буферомBSA (буфер для лизиса), и клеточные экстракты осветляли путем центрифугирования в течение 5 мин при 12000 г. Анализ на самофосфорилирование проводили в соответствии с описаниемMed. Chem., 36: 3010-3014. Для этого 96 луночные пластиковые планшеты, имеющие дно формы U, покрывали в течение 2 ч при 37 С 100 микролитрами козьих антител против мышиных иммуноглобулинов (Biosys) при концентрации 10 мкг/мл. После нескольких промывок PBSсодержащим 0,05% Твином, 100 мкл антител против c-neu инкубировали в течение 2 ч при 37 С (оба эти антитела были использованы в концентрации 1 мкг/мл). Незанятые сайты связывания блокировали путем инкубирования с 2% BSA в PBS в течение 2 ч. Клеточные лизаты инкубировали в покрытых лунках в течение 1 ч при 4 С. После нескольких промывок буфером для лизиса осуществляли анализ на самофосфорилирование непосредственно в лунках в 25 мМ буфере Нереs, рН 7,4, содержащем 2 мМ MnCl2,0,1% Тритон и 5 мкКи [-32P]ATP, в течение 20 мин при комнатной температуре в отсутствие или в присутствии заявленных соединений. Реакцию фосфорилирования прекращали путем добавления буфера Лэммли для образца, полученного в соответствии с описанием U.K.Laemmli (1970) (Nature, 225: 680-685), и [32P]меченые рецепторы анализировали с помощью электрофореза в ПААГ с ДСН на 4-12% полиакриламидных градиентных гелях. Интенсивность фосфорилирования оценивали путем сканирования осушенных гелей с помощью устройства для формирования изображения Instant Imager(Packard). Фосфорилирование по остаткам тирозина интактных клеток. Клеточные монослои выдерживали в бессывороточной среде в течение ночи, после этого клеточные монослои инкубировали с соединением, взятым в нужной концентрации, в течение 2 ч. Затем среду отсасывали и клетки гасили путем добавления ДСН-буфера Лэммли для образца непосредственно на клеточные монослои. Образцы обрабатывали в течение 5 мин при 100 С, а затем анализировали на фосфотирозинсодержащие белки. Белки фракционировали с помощью электрофореза в ДСН-ПААГ на 4-20% полиакриламидных градиентных гелях, после чего эти белки электрофоретически переносили на поливинилидендифторидные мембраны (PVDF-мембраны,PolyScreen, NEN). Иммунологическую детекцию фосфотирозинсодержащих белков осуществляли с использованием мышиного моноклонального антитела против фосфотирозина. Блоты проявляли методом интенсивной хемилюминесценции (ECL, NEN) с использованием конъюгированных с пероксидазой хрена кроличьих 16 антител против мышиных иммуноглобулиновIgG. Пролиферация клеток. Клетки засевали на 24-луночные планшеты для культивирования клеток с плотностью примерно 20000 клеток на лунку. Затем клетки оставляли на 8 ч в 1 мл культуральной среде для их прилипания к пластиковым лункам, после чего клетки культивировали в присутствии различных концентраций соединений в течение 72-96 ч. По истечении указанного времени инкубирования подсчитывали число клеток в каждой лунке. Для оценки числа относительно жизнеспособных клеток использовали митохондриальное восстановление МТТ по методу, описанному М.С. Alley,D.A. Scudiero, A. Monks, M.L. Hursey, M.J.Shoemaker и M.R. Boyd (1988) Cancer Res. 48: 589-601. Для этого в каждую лунку добавляли 100 мкл 5 мг/мл-раствора МТТ в забуференном фосфатом физиологическом растворе, после чего планшеты инкубировали в течение 4 ч при 37 С в СО 2-инкубаторе. Затем 650 мкл среды удаляли и заменяли 750 мкл раствора изопропилового спирта/НСl (1 н) (25:1) для того, чтобы растворились темно-красные кристаллы формазана, образующиеся в митохондриях живых клеток. После инкубирования в течение 5-10 мин при комнатной температуре и при размешивании из каждой лунки брали 200 мклаликвоты и переносили в 96-луночные планшеты для культивирования клеток, и поскольку степень полученной синеватой окраски прямо пропорциональна числу клеток, то оценку проводили спектрофотометрически при 590 нм в автоматическом микропланшет-ридере. Свободный ("безъякорный") рост клеток. Свободный рост клеток исследовали путем оценки колониеобразующей способности исследуемых клеток, суспендированных в мягком агаре. Эксперименты проводили с использованием чашек для культивирования клеток диаметром 50 мм. 4-миллилитровый бесклеточный питающий подслой состоял из 0,5% агара в среде, в которую были добавлены 10% FCS и указанные концентрации соединений. 4 миллилитровый верхний слой содержал около 10000 клеток в 0,3% агаре в среде, в которую были добавлены 10% FCS и соответствующие концентрации соединений. После 2-недельного инкубирования при 37 С определяли число колоний. Трансфекция клеток и САТ-анализ. Стромелизин-САТ-плазмидную ДНК-конструкцию(STRM-CAT) вводили в клетки путем трансфекции с использованием реагента lipofectAmine. Для этого чашки (3,5 см), содержащие клеточную культуру с конфлюентностью 50-70%, обрабатывали 1 мкг плазмидной ДНК и 10 мкг реагента lipofectAmine в 1 мл бессывороточной среде DMEM в течение 4 ч при 37 С. Затем клетки инкубировали в течение 36 ч при 37 С со 17 средой DMEM, в которую были добавлены 0,5%FCS и соответствующие количества соединений. Клетки отделяли от чашек путем инкубирования с PBS, содержащим 3 мМ EDTA, и осаждали путем центрифугирования при 1500 об./мин в течение 5 мин. Затем клетки ресуспендировали в 0,25 М Трис/НСl-буфере (рН 7,9) и подвергали нескольким циклам замораживания-оттаивания. Клеточные экстракты нагревали в течение 15 мин до 65 С, а затем, после охлаждения, подвергали микроцентрифугированию при 14000 об./мин в течение 15 мин. Супернатанты анализировали на САТ-активность по методу, описанному J.R. Neumann, С.А. Могеnсу и К.О. Russian (1987), BioTechniques, 5: 444-447. Соединения настоящего изобретения обнаруживают значительную специфическую активность как ингибиторы протеинтирозинкиназы и обладают терапевтическим действием, направленным на ингибирование пролиферации клеток, индуцируемой фактором роста. Кроме того, соединения настоящего изобретения являются специфическими ингибиторами рецептора типа 2 эпидермального фактора роста, а поэтому они могут быть использованы для регуляции роста и дифференцировки клеток. В нижеследующей таблице представлены соединения настоящего изобретения и результаты их испытаний, проведенные путем вышеописанного ингибирования рецептора типа 2 человеческого эпидермального фактора роста. Результаты, полученные вышеописанными экспериментальными методами, показали, что соединения настоящего изобретения способны ингибировать тирозинкиназную активность белкарецептора HER2 и обладают терапевтическим действием, направленным на регуляцию аномального клеточного роста. Соединения настоящего изобретения могут быть введены млекопитающему хозяину в различных формах, подходящих для выбранного способа введения, т.е. для перорального или парентерального введения. Под парентеральным способом введения в настоящем описании подразумевается внутривенное, внутримышечное, 000840 18 подкожное, внутриглазное, внутрисуставное,трансэпителиальное введение, включая чрескожное, офтальмическое, подъязычное и трансбуккальное введение; местное применение,включая офтальмическое введение, нанесение на кожу, закапывание в глаза, ректальное введение и ингаляции через нос путем вдувания или с использованием аэрозольных препаратов; а также системное ректальное введение. Активное соединение может быть введено перорально, например, в сочетании с инертным разбавителем или с приемлемым пищевым носителем, либо оно может быть введено в виде твердых или мягких желатиновых капсул, или спрессованных таблеток; либо оно может быть введено непосредственно вместе с пищей. Для перорального терапевтического применения активное соединение может быть введено в сочетании с наполнителем и изготовлено в форме фармацевтически приемлемых таблеток, таблеток для растворения в щечном кармане, пастилок, капсул, эликсиров, суспензий, сиропов,облаток и т.п. Эти композиции и препараты должны содержать, по крайней мере, 0,1% активного соединения. Процентное содержание активного соединения в композициях и препаратах может, конечно, варьироваться, но, в основном, оно составляет от около 2 до около 6 мас.%. Количество активного соединения в указанных терапевтических композициях должно быть таким, которое позволяет достичь нужную дозу. Предпочтительные композиции или препараты настоящего изобретения получают так,чтобы пероральная стандартная лекарственная форма содержала примерно 1-1000 мг активного соединения. Таблетки, пастилки, драже, капсулы и т.п. могут также содержать связующее вещество,такое как трагакантовая камедь, аравийская камедь, кукурузный крахмал или желатин; наполнители, такие как дикальцийфосфат; дезинтегрирующий агент, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; смазывающее вещество, такое как стеарат магния; подслащивающие агенты, такие как сахароза, лактоза или сахарин; или корригенты,такие как перечная мята, винтергреновое масло,или вишневый корригент. Если стандартной лекарственной формой является капсула, то,помимо вышеуказанных компонентов, она может также содержать жидкий носитель. Стандартная лекарственная форма может также содержать другие вещества, присутствующие в качестве покрытия или как-нибудь иначе модифицирующие физическую форму лекарственного препарата. Так, например, таблетки, драже или капсулы могут быть покрыты шеллаком,сахаром, или тем и другим. Сироп или эликсир может содержать активное соединение, сахарозу в качестве подслащивающего агента, метил- и пропилпарабены в качестве консервантов, краситель и корригент, такой как вишневая или 19 апельсиновая отдушка. Очевидно, что любой материал, используемый для получения любой лекарственной формы, должен быть фармацевтически чистым, и в основном, нетоксичным в используемых количествах. Кроме того, активное соединение может быть включено в препараты и композиции замедленного высвобождения. Активное соединение может быть также введено парентерально или внутрибрюшинно. Растворы активного соединения, используемого в виде свободного основания или фармакологически приемлемой соли, могут быть получены в воде, соответствующим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсия может быть также получена в глицерине, жидком полиэтиленгликоле, их смесях или в масле. Если эти препараты хранятся и используются в обычных условиях, то для предотвращения роста микроорганизмов эти препараты содержат консерванты. Фармацевтические формы, предназначенные для инъекций, представляют собой стерильные водные растворы или дисперсии, либо стерильные порошки для непосредственного получения стерильных инъецируемых растворов или дисперсий. Во всех случаях эти препараты должны быть стерильными и достаточно текучими так, чтобы их можно было легко вводить через шприц. При этом они могут быть стабильными в условиях производства и хранения и должны быть защищены от заражения микроорганизмами, такими как бактерии или грибки. В качестве носителя может быть использован растворитель или диспергирующая среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), их соответствующие смеси и растительные масла. Нужная текучесть может поддерживаться, например, путем использования покрытий, таких как лецитин; путем сохранения нужного размера частиц в случае использования дисперсий; и путем применения поверхностно-активных веществ. Предохранение от воздействия микроорганизмов может быть осуществлено путем использования различных антибактериальных и противогрибковых агентов, например, таких как парабены,хлорбутанол, фенол, сорбиновая кислота, тимерозал и т.п. Во многих случаях предпочтительно использовать изотонические агенты, например,сахара или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может быть достигнута путем использования агентов,замедляющих абсорбцию, например, таких как моностеарат алюминия и желатин. Стерильные инъецируемые растворы получают путем введения нужного количества активного соединения в соответствующий растворитель, содержащий другие ингредиенты,перечисленные выше, и, если это необходимо, 000840 20 стерилизованный путем фильтрации. Дисперсии обычно получают путем введения стерилизованного активного ингредиента в стерильный наполнитель, который содержит основную среду для дисперсий и другие необходимые ингредиенты, перечисленные выше. В случае использования стерильных порошков, предназначенных для получения стерильных инъецируемых растворов, предпочтительными методами их получения являются вакуумная сушка и лиофилизация, в результате чего из предварительно простерилизованного путем фильтрации раствора получают порошок, содержащий активный ингредиент и другие необходимые добавки. Терапевтически соединения настоящего изобретения могут быть введены млекопитающему как отдельно, так и в сочетании с фармацевтически приемлемыми носителями, перечисленными выше; при этом, соотношения ингредиентов зависят от растворимости и химической природы соединения, а также от способа введения и стандартной фармацевтической схемы применения. Дозы терапевтических агентов настоящего изобретения, предназначенные для использования в целях профилактики или лечения, могут варьироваться в зависимости от формы введения конкретно выбранного соединения и от физиологических данных конкретного пациента,подвергающегося лечению. Если необходимо,то сначала могут быть использованы небольшие дозы, которые могут затем постепенно увеличиваться до тех пор, пока не будет достигнут оптимальный эффект при данных условиях. С учетом физиологических исследований, проводимых на крысах, терапевтическая доза для человека может составлять, в основном, от примерно 0,01 мг до примерно 100 мг на кг массы тела в день, либо от примерно 0,4 мг до примерно 10 г или выше; при этом, указанная доза может быть введена в виде дробных доз от одного до нескольких раз в день. Для перорального введения могут быть использованы более высокие дозы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ селективной регуляции клеточного роста и клеточной дифференцировки, характеризующийся активностью рецептора типа 2 человеческого эпидермального фактора роста(HER2), причем указанный способ предусматривает введение пациенту, нуждающемуся в такой регуляции,эффективногоHER2 ингибирующего количества соединения формулы где А представляет замещенную или незамещенную моно- или бициклическую арильную, 21 гетероарильную, циклоалкильную или гетероциклоалкильную кольцевую систему, состоящую из 5-12 атомов, при этом заместители могут присутствовать в любом подходящем положении кольцевой системы и обозначаются R; Х представляет связь, О, S, SO, SО 2, OCH2,CR4=CR4, CC, NR4 или NR4CH2;R5, R6, R7 и R8 независимо представляют водород, алкокси или аралкокси; или фармацевтически приемлемой соли указанного соединения. 2. Способ по п.1, в котором А представляет замещенное или незамещенное моноциклическое арильное или гетероарильное кольцо, выбранное из фенила, пирролила, тиенила, фурила,тиазолила, имидазолила, пиразолила, пиридила,пиразинила, пиримидинила, пиридазинила, изотиазолила, изоксазолила и оксазолила. 3. Способ по п.1, в котором А представляет замещенное или незамещенное бициклическое арильное или гетероарильное кольцо, выбранное из нафтила,тетралинила,1,2,3,4 тетрагидрохинолинила, бензофурила, бензотиенила, инданила, индолила, индолинила, 1,3 бензодиоксолила, бензодиоксанила, хинолинила, тетрагидрохинолинила, изохинолинила, хиназолинила и хиноксалинила. 4. Способ по п.1, в котором А представляет замещенное или незамещенное моноциклическое циклоалкильное или гетероциклоалкильное кольцо, выбранное из циклопентила, циклогексила, циклогептила, декалинила, пиперидинила,пиперазинила, морфолинила или декагидрохинолинила. 5. Способ по п.1, в котором А представляет замещенное или незамещенное бициклическое циклоалкильное или гетероциклоалкильное кольцо, выбранное из декалинила или декагидрохинолинила. 6. Способ по п.1, в котором А представляет замещенный или незамещенный фенил, пиридил, тиенил, фурил, пиразолил, нафтил, тетралинил, 1,2,3,4-тетрагидрохинолинил, инданил,индолил, индолинил, хинолинил, тетрагидрохинолинил, циклогексил, пиперидинил или пиперазинил; Х представляет связь О, S или NR4;R5, R6, R7 и R8 независимо представляют водород или алкокси. 22 7. Способ по п.6, в котором А представляет замещенный или незамещенный фенил, нафтил или индолил; Х представляет связь;R5, R6, R7 и R8 независимо представляют водород или метокси. 8. Способ по п.2, в котором вводимым соединением является 4-(2-фенилэтиленил)-6,7 диметоксихиназолин или его фармацевтически приемлемая соль. 9. Способ по п.3, в котором вводимым соединением является 6,7-диметокси-4-нафталин 1-ил-этинилхиназолин или его фармацевтически приемлемая соль. 10. Способ по п.6, в котором указанное вводимое соединение выбирают из 4-(2-метоксипиридин-5-ил)-6,7-диметоксихиназолина; 4-(4-фенилпиперидин-1-ил)-6,7-диметоксихиназолина; 4-[4-(3-хлорфенил)пиперазин-1-ил]-6,7 диметоксихиназолина; и 4-(1,2,3,4-тетрагидрохинолин-1-ил)-6,7 диметоксихиназолина; или их фармацевтически приемлемой соли. 11. Способ по п.6, в котором указанное вводимое соединение выбирают из 6,7-диметокси-4-(-нафтиламино)хиназолина,4-[N-(5-инданил)амино]-6,7-диметоксихиназолина,N-бензил-N-(6,7-диметоксихиназолин-4 ил)-N-фениламина,6,7-диметокси-4-(N-метиланилино) хиназолина,N-(3-хлорфенил)-N-(6,7-диметоксихиназолин-4-ил)-N-метиламина,4-(3-аминопиразолил)-6,7-диметоксихиназолина и 4-(циклогексиланилино)-6,7-диметоксихиназолина или их фармацевтически приемлемой соли. 12. Способ по п.6, в котором вводимым соединением является 6,7-диметокси-4-(нафтиламино)хиназолин или его фармацевтически приемлемая соль. 13. Способ по п.6, в котором указанным вводимым соединением является 6,7-диметокси 4-(-нафтиламино)хиназолин или его фармацевтически приемлемая соль. 14. Способ по п.7, в котором указанное вводимое соединение выбирают из 4-(нафталин-1-ил)-6,7-диметоксихиназолина,4-(нафталин-2-ил)-6,7-диметоксихиназолина, 23 4-(3-фенилфенил)-6,7-диметоксихиназолина,4-(индол-3-ил)-6,7-диметоксихиназолина и 4-(метилиндол-3-ил)-6,7-диметоксихиназолина или их фармацевтически приемлемой соли. 15. Способ по п.7, в котором вводимым соединением является 4-(1-бензилиндол-3-ил)-6,7 диметоксихиназолин или его фармацевтически приемлемая соль. 16. Применение фармацевтической композиции, включающей эффективное НЕR2 ингибирующее количество соединения формулы где А представляет замещенную или незамещенную моно- или бициклическую арильную,гетероарильную, циклоалкильную или гетероциклоалкильную кольцевую систему, состоящую приблизительно из 5-12 атомов, при этом заместители могут присутствовать в любом подходящем положении кольцевой системы и обозначаются R; Х представляет связь, О, S, SO, SO2, OCH2,CR4=CR4, CC, NR4 или NR4CH2;R5, R6, R7 и R8 независимо представляют водород, алкокси или аралкокси; или фармацевтически приемлемой соли указанного соединения в смеси с фармацевтически приемлемым носителем, для селективной регуляции клеточного роста и клеточной дифференцировки. 17. Применение композиции по п.16, отличающееся тем, что в соединении А представляет замещенный или незамещенный фенил, пиридил, тиенил, фурил, пиразолил,нафтил,тетралинил,1,2,3,4 тетрагидрохинолинил, инданил, индолил, индолинил, хинолинил, тетрагидрохинолинил, циклогексил, пиперидинил или пиперазинил; Х представляет связь О, S или NR4;R5, R6, R7 и R8 независимо представляют водород или алкокси. 18. Применение композиции по п.17, в которой указанным соединением является 6,7 диметокси-4-(-нафтиламино)хиназолин или его фармацевтически приемлемая соль. 19. Применение композиции по п.17, в которой указанным соединением является 4-(1 бензилиндол-3-ил)-6,7-диметоксихиназолин или его фармацевтически приемлемая соль.
МПК / Метки
МПК: A61K 31/535
Метки: содержащей, клеточного, соединения, способ, композиции, регуляции, арил, дифференцировки, селективной, гетероарилхиназолиновые, роста, этой, цели, фармацевтической, клеточной, применение
Код ссылки
<a href="https://eas.patents.su/13-840-sposob-selektivnojj-regulyacii-kletochnogo-rosta-i-kletochnojj-differencirovki-i-primenenie-farmacevticheskojj-kompozicii-soderzhashhejj-aril-i-geteroarilhinazolinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ селективной регуляции клеточного роста и клеточной дифференцировки и применение фармацевтической композиции, содержащей арил- и гетероарилхиназолиновые соединения для этой цели.</a>
Предыдущий патент: Липосомальная вакцинная композиция, применение липосомальной вакцинной композиции, способ приготовления липосомальной вакцинной композиции и способ лечения млекопитающего.
Следующий патент: Антисмысловые олигонуклеотиды к ил-8 и рецептору ил-8 и способ лечения злокачественных опухолей.
Случайный патент: Способ получения спектральных пустот при передаче сигналов по электрической сети

















