Фармацевтическая композиция для лечения повреждения тканей, вызванного недостаточностью артериального кровотока
Номер патента: 7466
Опубликовано: 27.10.2006
Авторы: Суарес Альба Хосе, Мартинес Родригес Ребека, Гарсия Дель Барко Эррера Диана, Гильен Ньето Херардо Энрике, Гильен Перес Исабель, Эстрада Гарсия Марио Пабло, Берланга Акоста Хорхе, Фернандес Массо Хулио Рауль
Формула / Реферат
Фармацевтическая композиция, характеризующаяся тем, что она содержит гексапептид, усиливающий секрецию гормона роста GHRP-6, и подходящий наполнитель, для профилактики ишемического повреждения тканей, такой как профилактика повреждений тканей, вызванных нарушением артериального кровотока, у человека и животных.
Текст
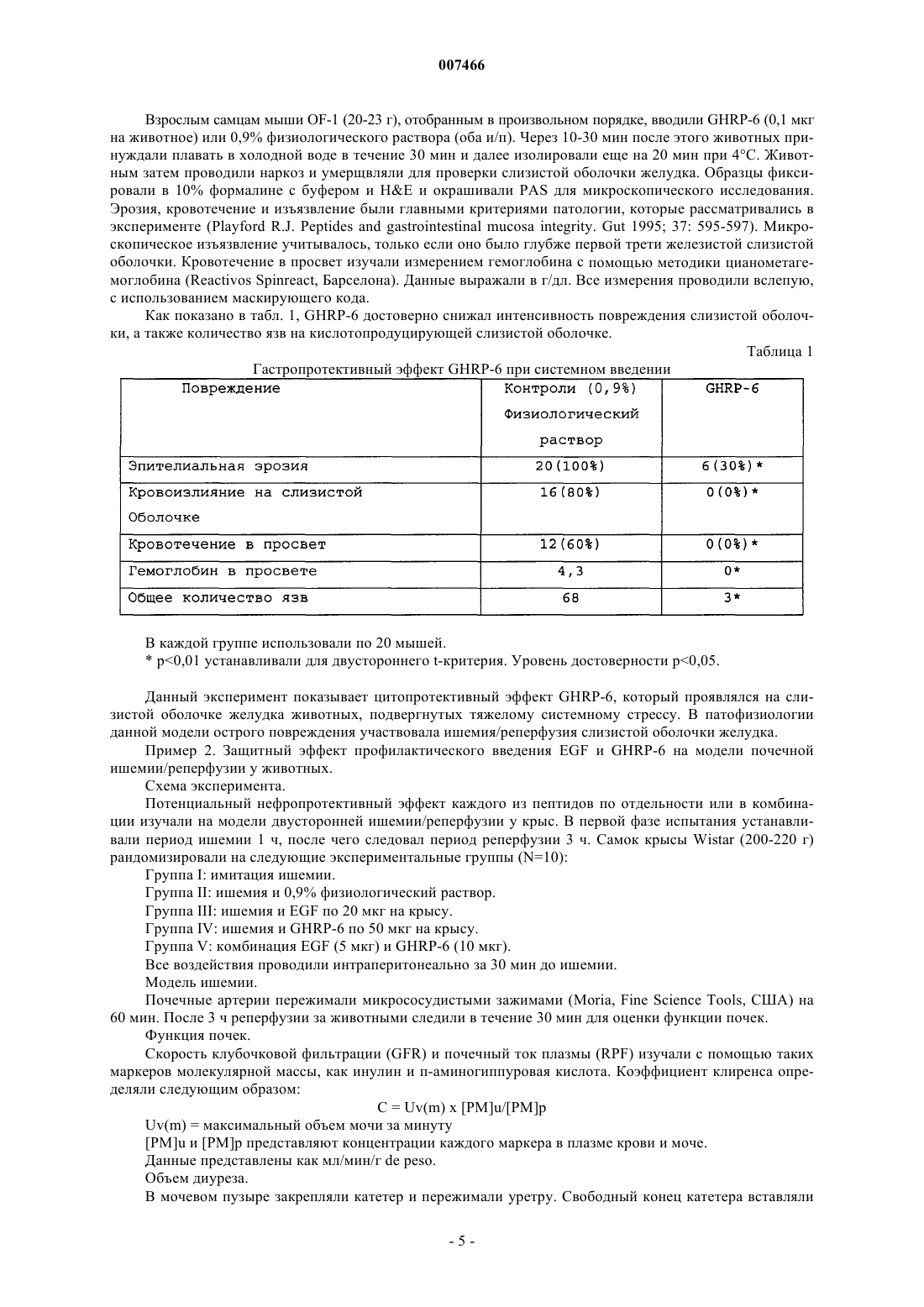
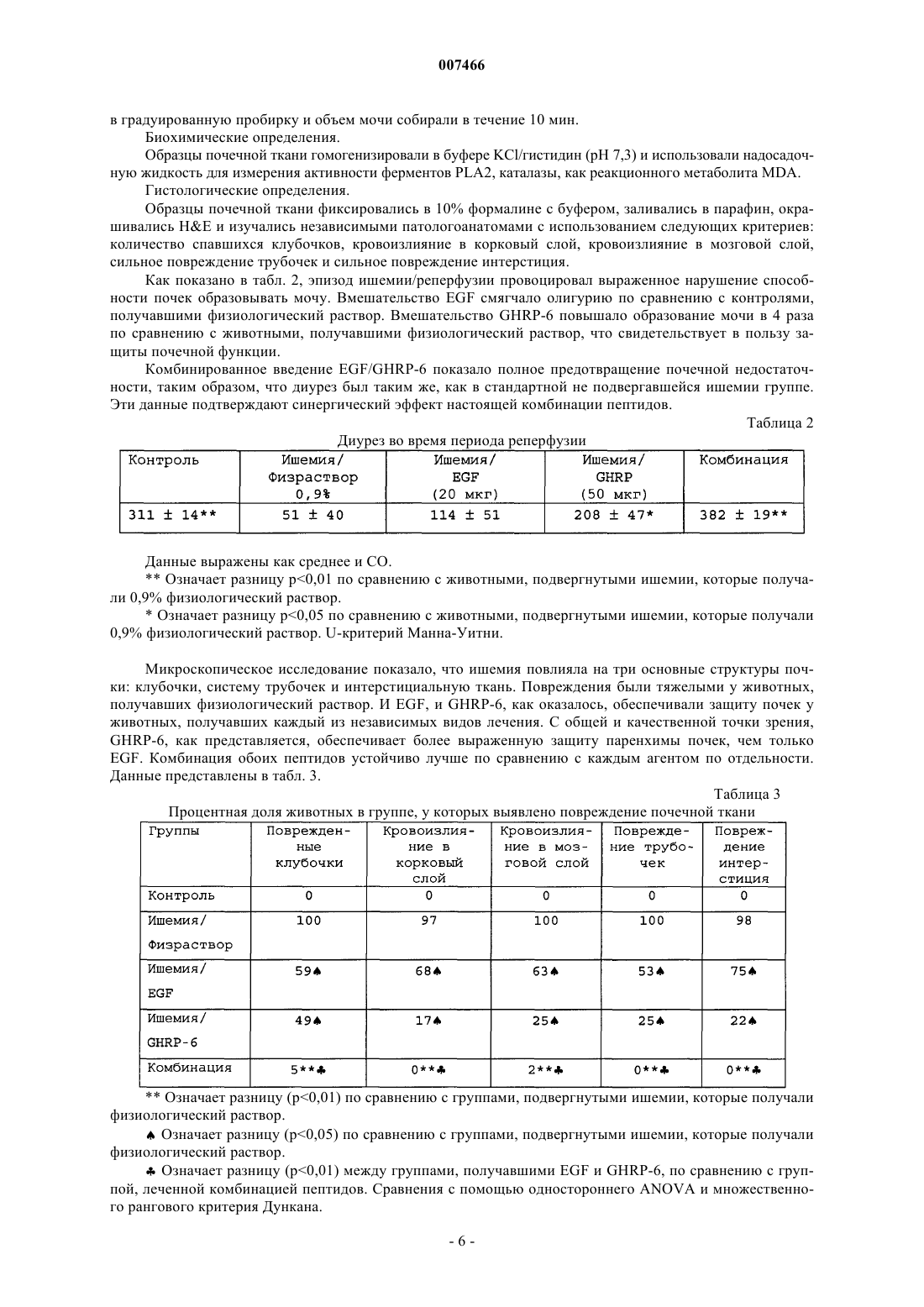
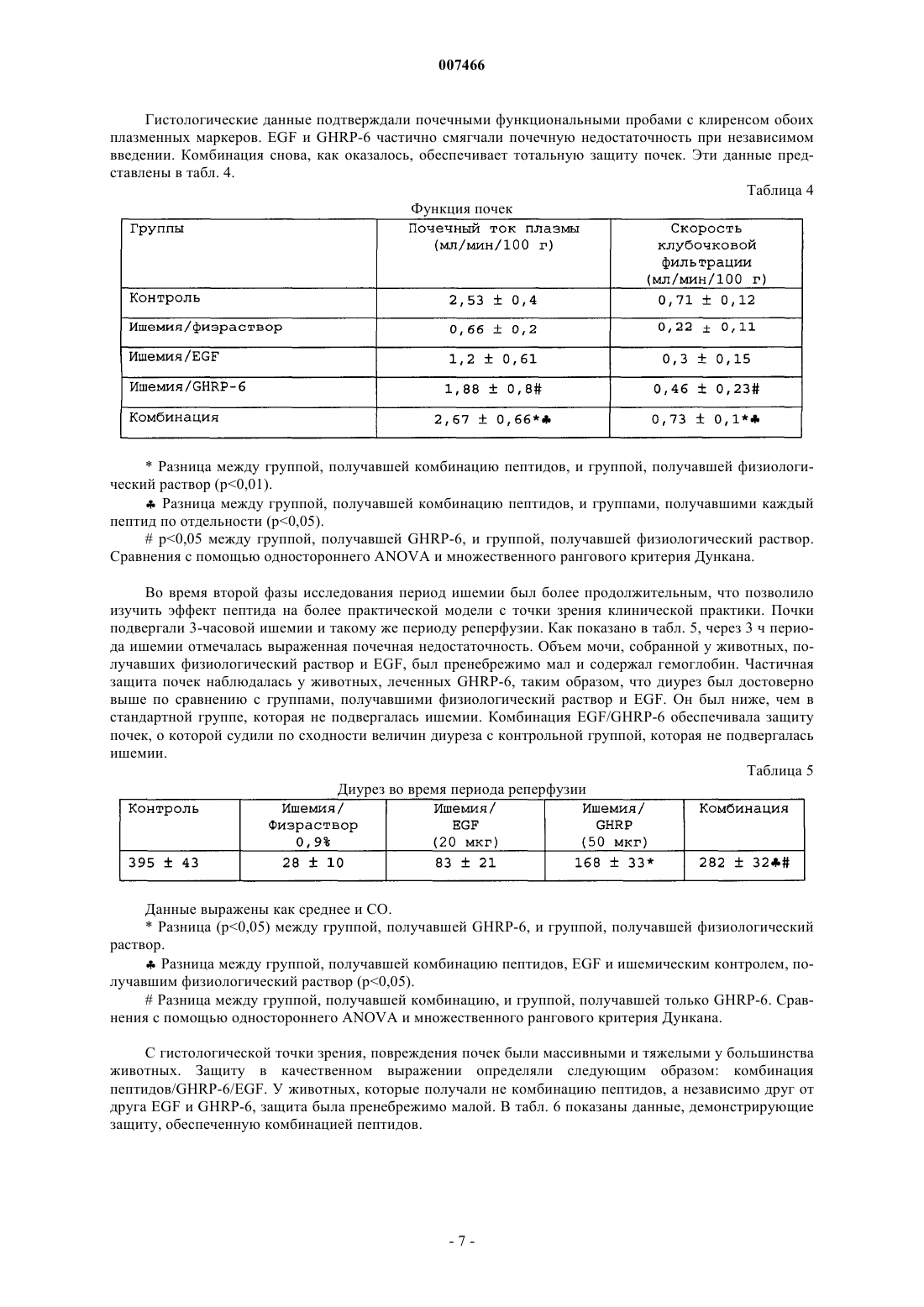
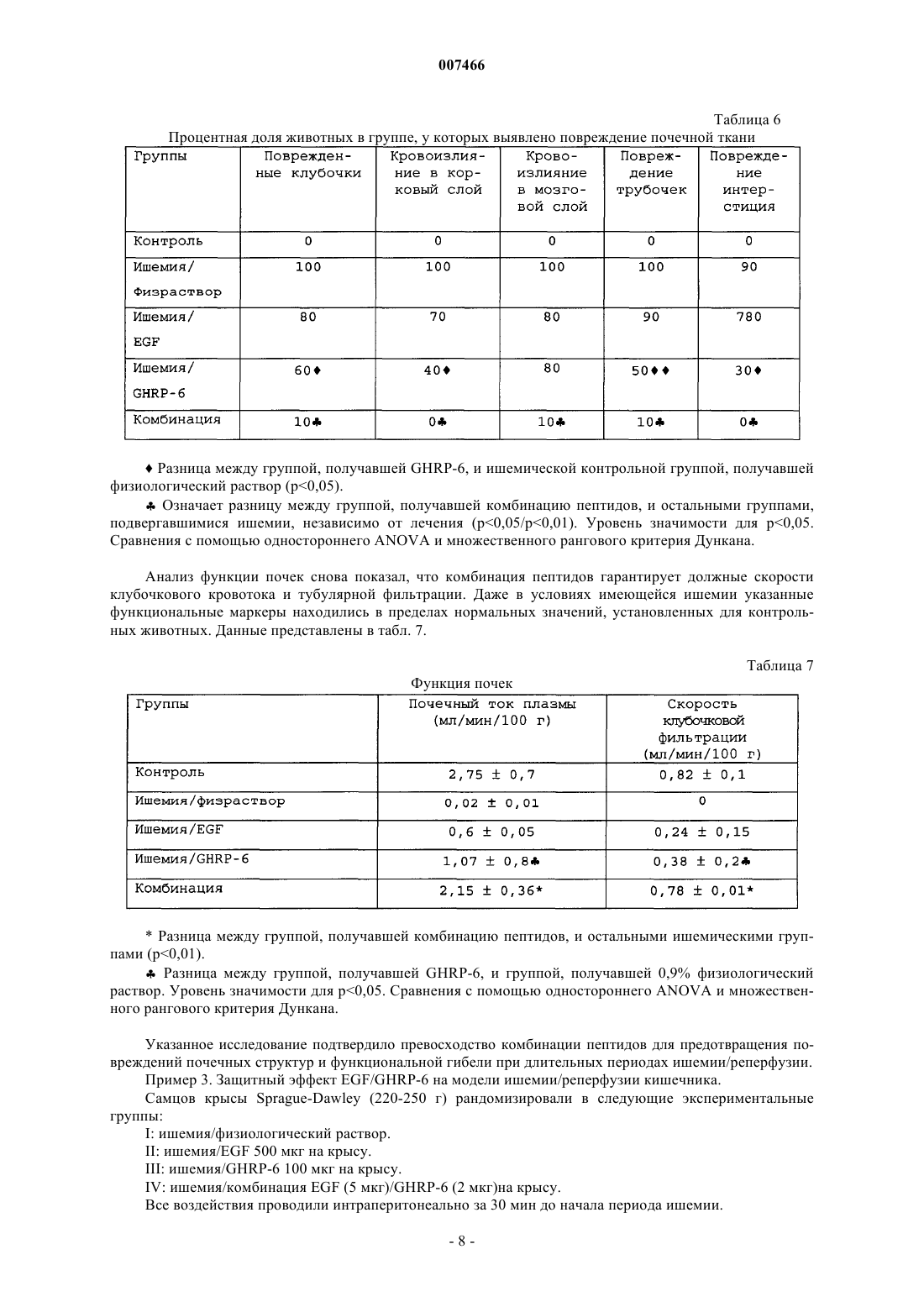
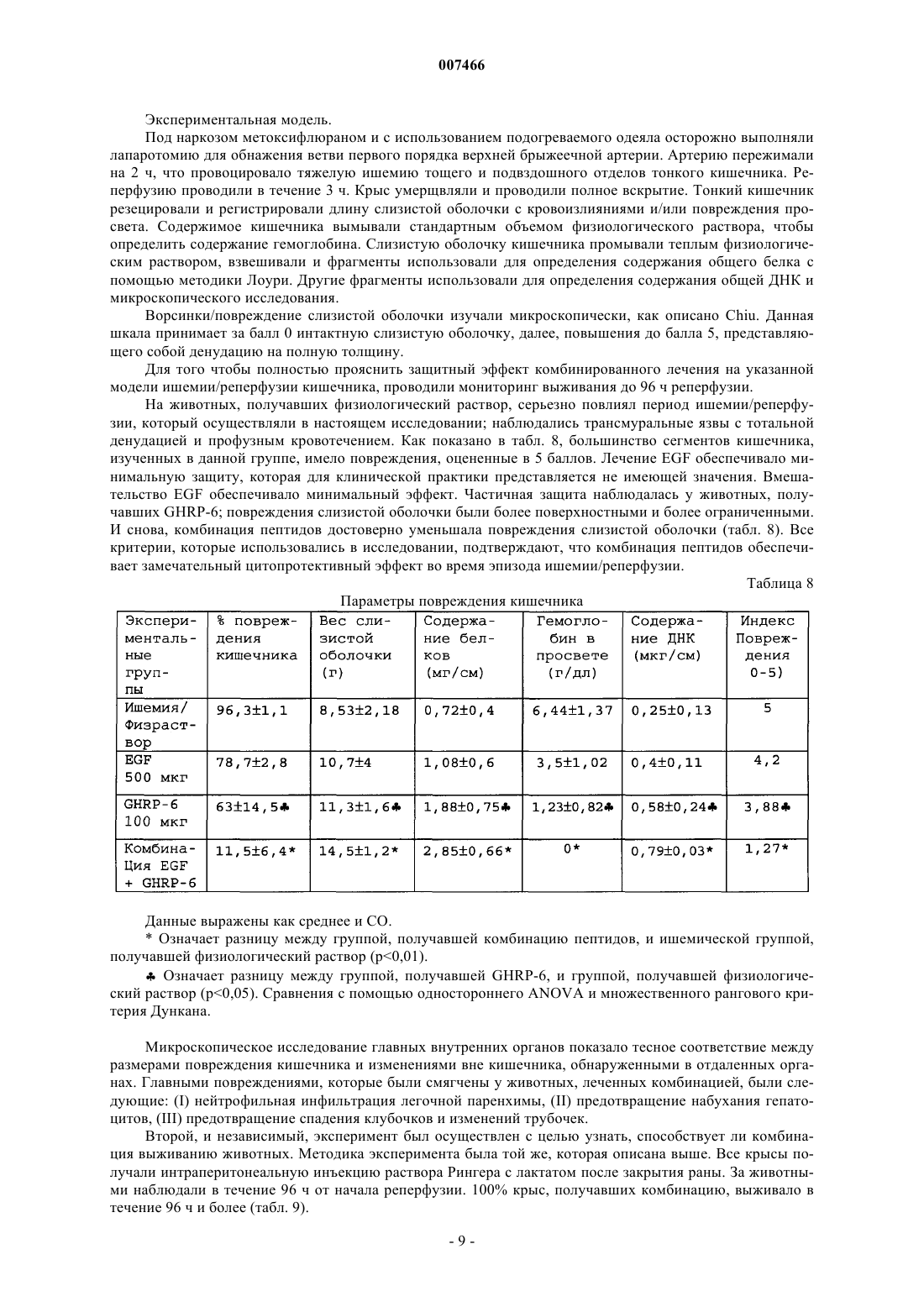
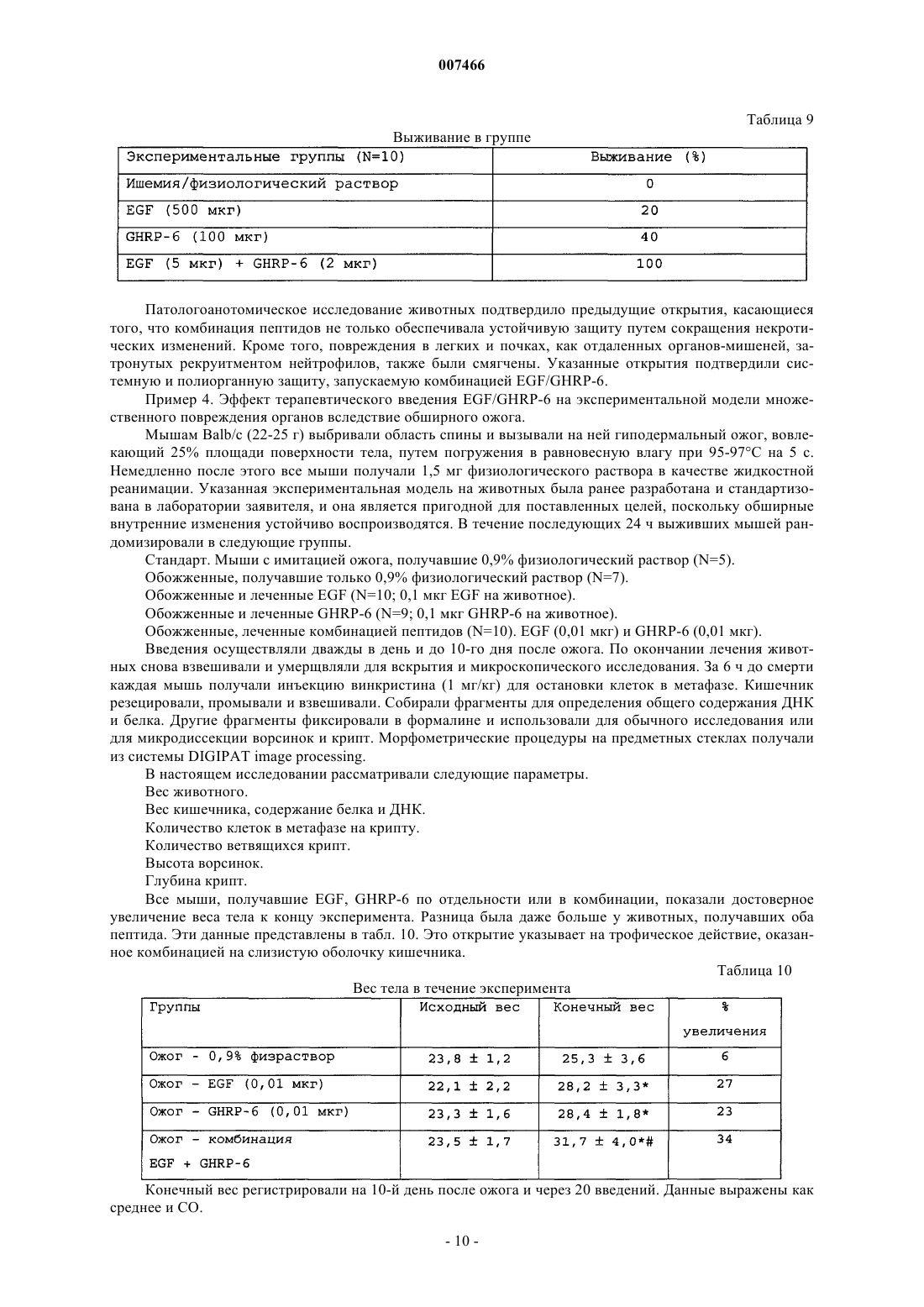
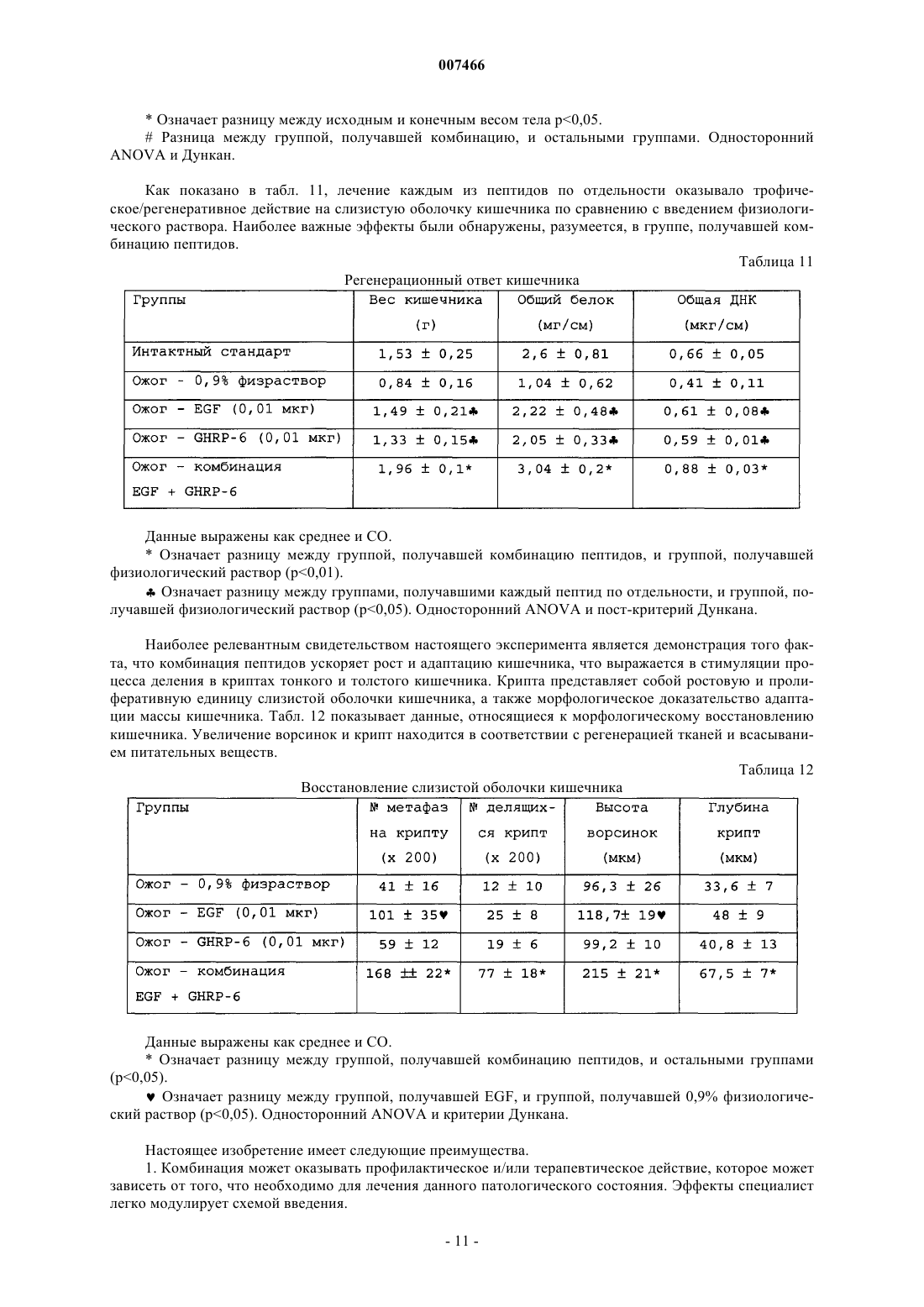
007466 Настоящее изобретение относится к медицине, и особенно к фармацевтической комбинации эпидермального фактора роста (EGF) и гексапептида, усиливающего секрецию гормона роста (GHRP), которая является пригодной для профилактики повреждения тканей, вызванного подавлением кровотока, а также для усиления регенерации тканей после ишемических повреждений. Все органы в организме животного являются чувствительными к летальным необратимым повреждениям тканей после частичного и полного прекращения артериального кровотока, или вызванным недостаточностью венозного оттока. В указанных случаях гибель клеток является следствием прогрессирующего каскада патофизиологических изменений, которые в конечном итоге могут грозить нарушением функции множества органов и гибелью организма. Повышение выработки ROS представляет собой главное патологическое следствие бесчисленного множества процессов, связанных с тканевой гипоперфузией, ишемией/реперфузией и воспалением (перитонитом, панкреатитом и т.п.). Тканевая гипоперфузия и чрезмерная выработка ROS связаны также с большими хирургическими вмешательствами, хирургическими вмешательствами с целью восстановления сосудистой сети, обширными ожогами и множественными травмами. Реакции перекисного окисления липидов в мембранах, вызванные атакой ROS, являются причиной гибели клеток при многих патологических состояниях (T.D. Lucas and I.L. Szweda. Cardiac reperfusion injury. Aging, lipid peroxidation and mitochondrial dysfunction. Proc. Natl. Acad. Sci. USA 1998, 95 (2): 510-514). Истощение запасов АТФ в клетке представляет собой наиболее острое и угрожающее следствие ишемии (Burns T.A., Davies R.D., McLaren J.A., Cerundolo L., Morris J.P., Fuggle V.S. Apoptosis in ischemia/reperfusion injury of human renal allografts. Transplantation. 1998, 66 (7): 872-876). Во время ишемического процесса запасы АТФ разлагаются до гипоксантина и ксантина, которые служат субстратом для фермента ксантиноксидазы (ХО). Большая доступность поступающего молекулярного кислорода во время периода реперфузии приводит к окислению пуринов через активацию ХО, в результате чего вырабатывается супероксид-анион и пероксид водорода (Paller M.S., Hoidall J.R., Ferris J.E. Oxygen free radicals in ischaemicacute renal failure in the rat. J. Clin. Invest. 1994, 74: 1156-1164). Во время периодов ишемии/реперфузии выработка ROS и недостаточность микроциркуляции объединяются, образуя порочный круг, в котором активированные эндотелиальные клетки и рекрутмент/адгезия циркулирующих лейкоцитов еще более увеличивают местную перфузию тканей и, следовательно, гипоксию клеток (Redl H., Hallstrom S., Schlag G.ROS могут активировать NF-kB в тканях, инфильтрированных клетками воспаления (Conner E.M.,Brand S.J., Davis J.M., Kang D.Y., Grisham M.B. Role of reactive metabolites of oxygen and nitrogen ininflammatory bowel disease: toxins, mediators, and modulators of gene expression. Inflamm. Bowel Dis. 1996,2: 133-147), в то время как ферментная система миелопероксидазы (МРО) активируется в полиморфноядерных клетках, инфильтрирующих ткани в состоянии гипоксии, что еще более усиливает каскад повреждения тканей (Kurose I., Argenbright L.W., Wolf R., Lianxi L., Grander D.N. Ischemia/reperfusioninduced microvascular dysfunction: role of oxidants and lipid mediators. Am. J. Physiol. 1997, 272: H2976H2982). В указанном враждебном окружении местные тромбогенные механизмы активируются, что приводит к капиллярному тромбозу и территориальной экспансии гипоксии. Как следствие указанного каскада, наступает гибель клеток в результате некроза и/или апоптоза, что может повредить жизнеспособности органа (Tredger M.J. Ischemia-reperfusion injury of the liver: treatment in theory and practice. Biofactors 1998, 8 (1-2): 161-164). Реактивность эндотелиальных клеток/клеток воспаления обеспечивается большим количеством химических растворимых медиаторов, таких как оксид азота, провоспалительные цитокины,прокоагулянты и вазоактивные агенты, которые могут запускать синдром системного воспалительного ответа (SIRS), если организм не способен противостоять своему иммунному диссонансу (Kowal-Vern A.,McGill V., Gamelli R.L. Ischemic necrotic bowel disease in thermal injury. Archives of Surgery 1997, 132 (4): 440-443). Обширные ожоги представляют собой неотложные состояния в медицине, которые требуют интенсивных и многокомпонентных усилий для спасения жизни пациента. У обожженных пациентов гипоперфузия/ишемия кишечника, как представляется, играет главную роль в запуске SRIS (Wang P., Ba Z.F.,Cioffi W.G., Bland K.I., and Chaudry I.H. Is gut the "motor" for producing hepatocellular dysfunction aftertrauma and hemorrhagic shock Journal of Surgical Research 1998, 74: 141-148). Недостаточность кишечного барьера имеет первостепенное клиническое значение, поскольку эпителий кишечника действует как преграда между септическим/токсичным просветом и стерильной внутренней средой (Sheridan R.L., Ryan С.М., Yin L.M., Hurley L., Tompkins R.G. Death in the burn unit. Sterilemultiple organ failure. Burns 1998, 24 (4): 307-311). В данном вопросе экспериментальные и клинические данные сходятся, что свидетельствует о важности адекватной перфузии кишечника во время системного стресса для сохранения целостности барьераafter burn ingury and gut ischemia. Journal of Burn Care and Rehabilitation 1996, 17 (3): 231-236). Кроме того,недавно полученные данные также указывают, что ткань кишечника действует как источник образования-1 007466 провоспалительных цитокинов, когда связанная с кишечником лимфоидная ткань активируется ишемией. ПОН (MOF) представляет собой главную причину смерти пациентов в условиях отделений интенсивной терапии, и она является наиболее частым осложнением у ожоговых пациентов, которое поражает до 70% пациентов высокоспециализированных ожоговых стационаров. Для того чтобы смягчить последствия процесса ишемии/реперфузии в определенных органах,большой ряд синтетических или натуральных соединений прошел доклинические или клинические испытания. В случае ишемии кишечника экспериментально оценивали ингибиторы ангиотензина II (Tadros Т., Taber D.L., Heggers J.P., Herndon D.N. Angiotensin II inhibitor DuP753 attenuates burn and endotoxininduced gut ischemia, lipid peroxidation, mucosal permeability and bacterial translocation. Ann. Surg. 2000; 231: 566-576). Также изучались ингибиторы фактора активации тромбоцитов (Sun Z., Wang X., Deng X.,Lasson A., Soltesz V., Borjesson A., Andersson R. Beneficial effects of lexipafant, a PAF antagonist on gut barrierdysfunction caused by intestinal ischemia and reperfusion in rats. Dig. Surg. 2000; 17: 57-65) и усилители высвобождения оксида азота (Ward D.T., Lawson S.A., Gallagher С.М., Conner W.C., Shea-Donohue D.T. SustainedSurg. Res. 2000; 89: 13-19). Другие подходы включают антиоксидантную терапию, такую как аллопуринол в отдельности или в комбинации с витаминами С и Е (Kacmaz M., Otzurk H.S., Karaayvaz M., Guven С., Durak I. Enzymatic antioxidant defense mechanism in rat intestinal tissue is changed after ischemiareperfusion. Effects of allopurinol plus antioxidant combination. Can. J. Surg. 1999; 42: 427-431). Несмотря на это, попытки, направленные на стимуляцию естественных защитных механизмов клеток, предпринимаются редко (Pialli S.B., Hinmn C.E., Luquette M.N., Nowicki P.Т., Besner G.E. Heparinbinding epidermal growth factor-like growth factor protects rat intestine from ischemia/reperfusion injury. J.Surg. Res. 1999; 87: 225-231). Гибель почек после ишемии/реперфузии побудила к поиску нефропротективных агентов, включая генерацию так называемых лазароидов, которые, как было показано, обеспечивают глобальную защиту ишемизированной почке (De Vecchi E., Lubatti L., Beretta C., Ferrero S., RinaldiP., Galli K.M., Trazzi R., Paroni R. Protection from renal ischemia-reperfusion injury by the 2-methylaminochroman U83836. Kidney Int. 1998; 54: 857-863). В других исследованиях показаны благоприятные эффекты теофиллина для защиты почек, главным образом, как антагониста аденозиновых рецепторов (Jenik A.G.,Geriani J.M., Gorenstein A., Ramirez J.A., Vain N., Armadans M., Ferraris J.R. Randomized, double-blind, placebo-controlled trial of the effect of theophylline on renal function in term neonates with perinatal asphyxia.Pediatrics 2000; 105: E45). Введение предсердного натрийуретического пептида (аурикулин) не показало снижения смертности у пациентов с острой почечной недостаточностью. Осложнения со стороны отдаленных органов также не уменьшались (Weisberg L.S., Allgren R.L., Genter F.C., Kurnik B.R. Cause of acute tubular necrosis affects itsprognosis. The Auriculin Anaritide Acute Renal Failure Study Group. Arch. Intern. Med. 1997; 157: 18331839). Свойство защиты почек приписывают ферменту супероксиддисмутазе (SOD) при его инъецировании в высоких дозах пациентам, подвергающимся пересадке почки (Schneeberger H., Schleibner S., Illner W.D.,Messmer К., Land W. The impact of free-radical mediated reperfusion injury on acute and chronic rejectionevents following cadaveric renal transplantation. Clin. Transpl. 1993; 219-232). Благоприятное действие EGF и TGF-альфа на улучшение состояния при токсической и ишемической острой почечной недостаточности показано в патенте СШАUS 5360790. Несмотря на то, что парентеральное введение некоторых факторов роста, демонстрирующих нефропротективные эффекты,оказалось эффективным на экспериментальных моделях, клинические результаты до сих пор обескураживают. Контролируемое многоцентровое клиническое испытание не показало ожидавшегося благоприятного действия IGF-I у пациентов с острой почечной недостаточностью по сравнению с группой плацебо (Hirschberg R., Kopple J., Lipsett P., Benjamin E., Minei J., Albertson Т., Munger M., Meztler M., Zaljga G.,Murray M., Lowry S., et al. Multicenter clinical trial of recombinant human insulin-like growth factor I in patientswith acute renal failure. Kidney Int. 1999; 55:2423-2432). Еще в одном клиническом испытании, в котором при острой почечной недостаточности использовали IGF-I, отсутствие эффекта подтвердилось (KoppleJ.D., Hirschberg R., Guler H.P., Pike M., and Chiron Study Group: lack of effect of recombinant human insulinlike growth factor-1 (IGF-1) in patients with acute renal failure (ARF). J. Am. Soc. Nephrol. 1996; 7: 1375). Скудный прогресс в технологии сохранения органов, который был достигнут к настоящему времени, остается наиболее важным ограничением доступности новых органов для трансплантации. Кроме того, ex-vivo сохраняющие агенты дают противоречивые эффекты (Schlumpf-R; Candinas-D; Weber-M;Swiss-Surg. 1995(4): 175-80; обсуждение 180-1); а биохимическое и функциональное повреждение органов после имплантации реципиенту остается главной причиной неиммунного отторжения (Barber E.,Menendez S., Leon O.S., Barber M.O., Merino N., Calunga J.L., Cruz E., and Bocci V. Prevention of renal injuryafter induction of ozone tolerance in rats submitted to warm ischemia. Mediators of Inflammation 1999; 8: 3741). Неблагоприятный эффект некоторых сохраняющих агентов, о котором имеются сообщения, представляет собой его вмешательство в механизм агрегации тромбоцитов, что приводит к профузному кровотечению (Salat A., Mueller M.R., Boehm D., Stangl P., Pulaki S., Laengle F. Influence of UW solution on invitro platelet aggregability. Transpl. Int. 1996; 9 Suppl. 1: S429-431). Вазоспазм и тромбоз в постреперфузи-2 007466 онном органе представляют собой неудобства, среди прочих, о которых сообщается (Jeng-LB; Lin-PJ;after preservation with the University of Wisconsin solution. Arch-Surg. 1997 Jan; 132(1): 7-12). Медицинское сообщество все еще ожидает появления более эффективных и менее дорогостоящих растворов для сохранения органов (Rentsch M., Post S., Palma P., Gonzalez A.P., Menger M.D., Messmer K. Intravital studieson beneficial effects of warm Ringer's lactate rinse in liver transplantation. Transpl. Int. 1996; 9(5): 461-7). Неспособность IGF-I обеспечить эффективное нефропротективное действие в клинической практике породила точку зрения о том, что терапия только фактором роста является недостаточной для стимуляции выживания клеток во время ишемии/реперфузии и что коктейли из факторов роста будут более эффективными (Playford R.J. Peptides and gastrointestinal mucosa integrity. Gut 1995, 37: 595-597). Благоприятное действие эпидермального фактора роста (EGF) в отношении защиты органов от повреждения во время эпизодов ишемии/реперфузии было заявлено в европейском патенте ЕР 0 357 240B1. Однако церебральная защита достигается только при очень высоких концентрациях EGF (1 мг/кг). Более низкая доза 0,1 мг/кг показала только скромный защитный эффект, несмотря на то, что доза все еще оставалась высокой для такого вещества, как фактор роста. Данные факты ограничивают указанное изобретение; первое ограничение касается высокой стоимости лечения, поскольку для достижения эффекта у животного требуются повторные инъекции (от 4 до 5). Например, человеку с массой тела 70 кг потребуется 70 мг EGF для одной инъекции, которая должна будет периодически повторяться, чтобы гарантировать клинический эффект. Вторым ограничением является фармакология. Примеры, приведенные в патенте, предполагают очень узкий терапевтический интервал, что препятствует возможности определения эффективной дозы 50 (ED50) и кривой доза-ответ. Третье ограничение касается высоких дозEGF. Имеются сообщения, которые показывают, что у крыс и обезьян EGF может подавлять минутный сердечный выброс и артериальное давление (Keiser J.A., Ryan N.J. Hemodynamic effect of EGF in consciousrats and monkeys. PNAS USA 1996; 93(10): 4957-4961). Нормальный ход клеточного цикла также может нарушаться высокими концентрациями EGF (Bennet N.T., Schultz G.S. Growth factors and wound healing:Biochemical properties of growth factors and their receptors. Am. J. Surg. 1993, 165:728-737). Потенциальные преимущества вмешательства EGF с целью защиты печени и кишечника от ишемии/реперфузии, как представляется, еще ожидают своего освещения. Все возрастающее количество данных указывает на то,что парентеральное введение EGF, как представляется, обеспечивает защиту различным эпителиальным внутренним органам после острого подавления кровотока. В условиях эксперимента на животных, на которых действовали химическим агентом, который блокирует синтез АТФ или повышает скорость выработки ERO, вмешательство EGF оказалось полезным, так как оно уменьшало повреждения органов. Кроме того, повторные введения EGF помогают усилению регенерации, адаптации и функционирования тканей. Все указанные преимущества лечения с помощью EGF могут достигаться только в случае режимов повторного введения и высоких концентраций полипептида. Часто указанные преимущества являются умеренными, что еще более усиливает ту точку зрения, что комбинированная терапия факторами роста является гораздо более предпочтительной. В контексте ишемии, EGF, как представляется, смягчает повреждение тканей, если время ишемии составляет менее 60 мин. При более продолжительных периодах ишемии терапия с помощью EGF бесполезна. Это является очевидным ограничением терапии с помощью EGF, поскольку в хирургической практике требуется защита для более продолжительных периодов ишемии. Несмотря на то, что длительное время подчеркивалась необходимость комбинации факторов роста,на вооружении врачей до сих пор нет подобной комбинации. Новизну настоящей фармацевтической композиции придает фармакологический синергизм, который обеспечивается комбинацией эпидермального фактора роста (EGF) и пептида (из шести аминокислот), усиливающего секрецию гормона роста (GHRP-6). Указанная комбинация повышает жизнеспособность клеток в органах или тканях, в которых частично или полностью отсутствует кровоток в течение периода времени от минут до часов. Указанная комбинация сокращает или предотвращает выработкуERO, как и других токсичных метаболитов в гипоксических или аноксических органах, что стимулирует выживание клеток во время периодов ишемии. Комбинация указанных двух пептидов обладает мощной синергической активностью в отношении усиления адаптации органов, т.е. адаптации кишечника после обширных травм и процесса восстановления. Посредством профилактического упреждающего вмешательства комбинация данных пептидов активирует механизмы клеточной самозащиты, повышая, таким образом, устойчивость клеток к цитотоксическим агентам или стрессовым условиям. Таким образом, путем упреждающего воздействия на клетки указанная комбинация превращает в несмертельное то, что в обычных условиях было бы смертельным. Это позволяет применять указанную комбинацию для органов или организмов, которые подвергаются воздействию критических или угрожающих условий, таких как ишемия, состояния сниженного кровотока, шок, гемодинамическая недостаточность и т.п. Помимо защитных эффектов, данная комбинация усиливает восстановление, регенерацию и функциональную адаптацию тканей после травм. Субъекты с обширными ожоговыми поражениями, множественными травмами, шоком должны получать указанную комбинацию как можно раньше, чтобы ослабить продолжающийся каскад повреждений внут-3 007466 ренних органов, т.е. предотвратить или отсрочить наступление полиорганной недостаточности. Субъекты, которым предстоит обширное или длительное хирургическое вмешательство, экстракорпоральная циркуляторная аппаратная поддержка и т.п., должны получать настоящую комбинацию, чтобы уменьшить риски повреждений паренхиматозных и других внутренних органов, например смягчить синдром системного воспалительного ответа. Указанную комбинацию можно применять также для того, чтобы уменьшить повреждения органов/тканей, связанные с тромбозом и эмболией, после подбора соответствующей тромболитической терапии. В силу синергического эффекта указанных пептидов в отношении трофического/регенеративного действия, указанная комбинация является пригодной для ускорения адаптации кишечника у пациентов с коротким кишечником. Указанная комбинация может стимулировать также регенерацию массы печени и тубулярной системы почки. В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция объединяет EGF GHRP-6 в одном продукте, который обладает мощным цитопротективным действием на ткани и органы, подвергшиеся гипоксическим или аноксическим событиям. Указанная комбинация обеспечивает защиту клеток с помощью различных механизмов, положительно регулируемых однократным упреждающим дозированием. Указанную комбинацию можно сочетать с любой из стандартных антиоксидантных терапевтических схем. С другой стороны, терапевтическое введение комбинации, ориентированное на стимуляцию регенерации тканей, требует повторных введений. Упоминающийся EGF включает таковой природного, синтетического или рекомбинантного происхождения. Упоминающийся пептид, усиливающий секрецию,представляет собой гексапептид, имеющий следующую аминокислотную последовательность: His-DTrp-Ala-Trp-D-Phe-Lys-NH2. Его называют GHRP-6, сокращенно от релизинг-пептида гормона роста. Комбинация касается также независимого введения обоих пептидов отдельному индивидууму, но в рамках одной терапевтической схемы. В случае, когда указанную комбинацию применяют профилактически, для предупреждения ишемического повреждения тканей, концентрация EGF в фармацевтической комбинации составляет от 0,5 до 50 мкг/мл, независимо от того, в каком виде, лиофилизованной соли или раствора, она представлена. Концентрация GHRP-6 может варьировать от 2 до 100 мкг/мл в том же носителе. Для профилактических целей рекомендуются пределы доз от 0,5 до 1 мкг/кг, как для EGF, так и для GHRP-6. Комбинацию нужно вводить в виде болюса. Пути введения могут включать периферические или глубокие вены, внутриартериальный и/или интраперитонеальный пути. Носители, которые следует использовать для введения, включают физиологический раствор, раствор Рингера с лактатом, человеческую плазму, раствор человеческого альбумина, 5% декстрозу или их смеси. Для того чтобы гарантировать наиболее высокую эффективность терапии, первое введение следует осуществлять как можно быстрее, когда ишемия диагностирована, подозревается или будет создана хирургическим путем. Для пациентов с обширными ожогами, множественными травмами, шоком и т.п. лечение должно быть начато, несмотря на отсутствие каких бы то ни было клинических или дополнительных указаний на ишемию внутренних органов, в качестве профилактического вмешательства. Пациенты с несептическим панкреатитом также нуждаются в описанном выше лечении. Схема профилактического введения может изменяться в зависимости от тяжести клинической картины и/или силы агрессивного воздействия, которые оцениваются специалистом. Болюсное введение можно повторять каждые 6 ч, чтобы выполнить четыре введения за сутки. Между введениями необходимо поддерживать лаг-фазу продолжительностью 6 ч. Комбинацию пептидов можно вводить с использованием устройств для медленного высвобождения. Если комбинация продуктов лиофилизована, ее перед применением нужно ресуспендировать. Как описывалось ранее, в случае, когда комбинацию применяют в терапевтических целях, что означает направленность ее использования на стимуляцию регенерации и адаптации, введение, предпочтительно, следует осуществлять посредством систем замедленного высвобождения или альтернативными средствами, чтобы гарантировать двухфазное равновесие. Болюсные инфузии не эффективны для стимуляции регенерации тканей. Если используются внутривенные катетеры, период введения можно продлить приблизительно до 4 ч. За период 24 ч можно осуществлять более двух введений, если период клиренса по меньшей мере 8 ч попадает на интервал между введениями. Рекомендуемые дозы обоих пептидов для регенерации составляют до 0,01 до 5 мкг/кг/ч. Указанное введение и схемы дозирования позволяют восстановить повреждения тканей, вызванные ишемией, в которых участвует некроз и/или апоптоз. Когда ткани подвергаются кратковременным периодам ишемии, введение комбинации прерывает дальнейшие осложнения. Применение комбинации рекомендуется после трансплантации для усиления заживления анастомоза, регенерации тканей и реадаптации имплантированного органа. Повторные введения комбинации рекомендуются также для лечения синдрома короткого кишечника и острой кишечной недостаточности после обширных хирургических вмешательств на кишечнике. Примеры Пример 1. Цитопротективный эффект гексапептида, усиливающего секрецию GH (GHRP-6) на модели острого стрессогенного повреждения желудка у животных.-4 007466 Взрослым самцам мыши OF-1 (20-23 г), отобранным в произвольном порядке, вводили GHRP-6 (0,1 мкг на животное) или 0,9% физиологического раствора (оба и/п). Через 10-30 мин после этого животных принуждали плавать в холодной воде в течение 30 мин и далее изолировали еще на 20 мин при 4 С. Животным затем проводили наркоз и умерщвляли для проверки слизистой оболочки желудка. Образцы фиксировали в 10% формалине с буфером и НЕ и окрашивали PAS для микроскопического исследования. Эрозия, кровотечение и изъязвление были главными критериями патологии, которые рассматривались в эксперименте (Playford R.J. Peptides and gastrointestinal mucosa integrity. Gut 1995; 37: 595-597). Микроскопическое изъязвление учитывалось, только если оно было глубже первой трети железистой слизистой оболочки. Кровотечение в просвет изучали измерением гемоглобина с помощью методики цианометагемоглобина (Reactivos Spinreact, Барселона). Данные выражали в г/дл. Все измерения проводили вслепую,с использованием маскирующего кода. Как показано в табл. 1, GHRP-6 достоверно снижал интенсивность повреждения слизистой оболочки, а также количество язв на кислотопродуцирующей слизистой оболочке. Таблица 1 Гастропротективный эффект GHRP-6 при системном введении В каждой группе использовали по 20 мышей.р 0,01 устанавливали для двустороннего t-критерия. Уровень достоверности р 0,05. Данный эксперимент показывает цитопротективный эффект GHRP-6, который проявлялся на слизистой оболочке желудка животных, подвергнутых тяжелому системному стрессу. В патофизиологии данной модели острого повреждения участвовала ишемия/реперфузия слизистой оболочки желудка. Пример 2. Защитный эффект профилактического введения EGF и GHRP-6 на модели почечной ишемии/реперфузии у животных. Схема эксперимента. Потенциальный нефропротективный эффект каждого из пептидов по отдельности или в комбинации изучали на модели двусторонней ишемии/реперфузии у крыс. В первой фазе испытания устанавливали период ишемии 1 ч, после чего следовал период реперфузии 3 ч. Самок крысы Wistar (200-220 г) рандомизировали на следующие экспериментальные группы (N=10): Группа I: имитация ишемии. Группа II: ишемия и 0,9% физиологический раствор. Группа III: ишемия и EGF по 20 мкг на крысу. Группа IV: ишемия и GHRP-6 по 50 мкг на крысу. Группа V: комбинация EGF (5 мкг) и GHRP-6 (10 мкг). Все воздействия проводили интраперитонеально за 30 мин до ишемии. Модель ишемии. Почечные артерии пережимали микрососудистыми зажимами (Moria, Fine Science Tools, США) на 60 мин. После 3 ч реперфузии за животными следили в течение 30 мин для оценки функции почек. Функция почек. Скорость клубочковой фильтрации (GFR) и почечный ток плазмы (RPF) изучали с помощью таких маркеров молекулярной массы, как инулин и п-аминогиппуровая кислота. Коэффициент клиренса определяли следующим образом: С = Uv(m) х [PM]u/[PM]pUv(m) = максимальный объем мочи за минуту[РМ]u и [РМ]р представляют концентрации каждого маркера в плазме крови и моче. Данные представлены как мл/мин/г de peso. Объем диуреза. В мочевом пузыре закрепляли катетер и пережимали уретру. Свободный конец катетера вставляли-5 007466 в градуированную пробирку и объем мочи собирали в течение 10 мин. Биохимические определения. Образцы почечной ткани гомогенизировали в буфере KCl/гистидин (рН 7,3) и использовали надосадочную жидкость для измерения активности ферментов PLA2, каталазы, как реакционного метаболита MDA. Гистологические определения. Образцы почечной ткани фиксировались в 10% формалине с буфером, заливались в парафин, окрашивались НЕ и изучались независимыми патологоанатомами с использованием следующих критериев: количество спавшихся клубочков, кровоизлияние в корковый слой, кровоизлияние в мозговой слой,сильное повреждение трубочек и сильное повреждение интерстиция. Как показано в табл. 2, эпизод ишемии/реперфузии провоцировал выраженное нарушение способности почек образовывать мочу. Вмешательство EGF смягчало олигурию по сравнению с контролями,получавшими физиологический раствор. Вмешательство GHRP-6 повышало образование мочи в 4 раза по сравнению с животными, получавшими физиологический раствор, что свидетельствует в пользу защиты почечной функции. Комбинированное введение EGF/GHRP-6 показало полное предотвращение почечной недостаточности, таким образом, что диурез был таким же, как в стандартной не подвергавшейся ишемии группе. Эти данные подтверждают синергический эффект настоящей комбинации пептидов. Таблица 2 Диурез во время периода реперфузии Данные выражены как среднее и СО.Означает разницу р 0,01 по сравнению с животными, подвергнутыми ишемии, которые получали 0,9% физиологический раствор.Означает разницу р 0,05 по сравнению с животными, подвергнутыми ишемии, которые получали 0,9% физиологический раствор. U-критерий Манна-Уитни. Микроскопическое исследование показало, что ишемия повлияла на три основные структуры почки: клубочки, систему трубочек и интерстициальную ткань. Повреждения были тяжелыми у животных,получавших физиологический раствор. И EGF, и GHRP-6, как оказалось, обеспечивали защиту почек у животных, получавших каждый из независимых видов лечения. С общей и качественной точки зрения,GHRP-6, как представляется, обеспечивает более выраженную защиту паренхимы почек, чем толькоEGF. Комбинация обоих пептидов устойчиво лучше по сравнению с каждым агентом по отдельности. Данные представлены в табл. 3. Таблица 3 Процентная доля животных в группе, у которых выявлено повреждение почечной ткани Означает разницу (р 0,01) по сравнению с группами, подвергнутыми ишемии, которые получали физиологический раствор.Означает разницу (р 0,05) по сравнению с группами, подвергнутыми ишемии, которые получали физиологический раствор.Означает разницу (р 0,01) между группами, получавшими EGF и GHRP-6, по сравнению с группой, леченной комбинацией пептидов. Сравнения с помощью одностороннего ANOVA и множественного рангового критерия Дункана.-6 007466 Гистологические данные подтверждали почечными функциональными пробами с клиренсом обоих плазменных маркеров. EGF и GHRP-6 частично смягчали почечную недостаточность при независимом введении. Комбинация снова, как оказалось, обеспечивает тотальную защиту почек. Эти данные представлены в табл. 4. Таблица 4 Функция почек Разница между группой, получавшей комбинацию пептидов, и группой, получавшей физиологический раствор (р 0,01).Разница между группой, получавшей комбинацию пептидов, и группами, получавшими каждый пептид по отдельности (р 0,05).р 0,05 между группой, получавшей GHRP-6, и группой, получавшей физиологический раствор. Сравнения с помощью одностороннего ANOVA и множественного рангового критерия Дункана. Во время второй фазы исследования период ишемии был более продолжительным, что позволило изучить эффект пептида на более практической модели с точки зрения клинической практики. Почки подвергали 3-часовой ишемии и такому же периоду реперфузии. Как показано в табл. 5, через 3 ч периода ишемии отмечалась выраженная почечная недостаточность. Объем мочи, собранной у животных, получавших физиологический раствор и EGF, был пренебрежимо мал и содержал гемоглобин. Частичная защита почек наблюдалась у животных, леченных GHRP-6, таким образом, что диурез был достоверно выше по сравнению с группами, получавшими физиологический раствор и EGF. Он был ниже, чем в стандартной группе, которая не подвергалась ишемии. Комбинация EGF/GHRP-6 обеспечивала защиту почек, о которой судили по сходности величин диуреза с контрольной группой, которая не подвергалась ишемии. Таблица 5 Диурез во время периода реперфузии Данные выражены как среднее и СО.Разница (р 0,05) между группой, получавшей GHRP-6, и группой, получавшей физиологический раствор.Разница между группой, получавшей комбинацию пептидов, EGF и ишемическим контролем, получавшим физиологический раствор (р 0,05).Разница между группой, получавшей комбинацию, и группой, получавшей только GHRP-6. Сравнения с помощью одностороннего ANOVA и множественного рангового критерия Дункана. С гистологической точки зрения, повреждения почек были массивными и тяжелыми у большинства животных. Защиту в качественном выражении определяли следующим образом: комбинация пептидов/GHRP-6/EGF. У животных, которые получали не комбинацию пептидов, а независимо друг от друга EGF и GHRP-6, защита была пренебрежимо малой. В табл. 6 показаны данные, демонстрирующие защиту, обеспеченную комбинацией пептидов.-7 007466 Таблица 6 Процентная доля животных в группе, у которых выявлено повреждение почечной ткани Разница между группой, получавшей GHRP-6, и ишемической контрольной группой, получавшей физиологический раствор (р 0,05).Означает разницу между группой, получавшей комбинацию пептидов, и остальными группами,подвергавшимися ишемии, независимо от лечения (р 0,05/р 0,01). Уровень значимости для р 0,05. Сравнения с помощью одностороннего ANОVA и множественного рангового критерия Дункана. Анализ функции почек снова показал, что комбинация пептидов гарантирует должные скорости клубочкового кровотока и тубулярной фильтрации. Даже в условиях имеющейся ишемии указанные функциональные маркеры находились в пределах нормальных значений, установленных для контрольных животных. Данные представлены в табл. 7. Таблица 7 Функция почек Разница между группой, получавшей комбинацию пептидов, и остальными ишемическими группами (р 0,01).Разница между группой, получавшей GHRP-6, и группой, получавшей 0,9% физиологический раствор. Уровень значимости для р 0,05. Сравнения с помощью одностороннего ANOVA и множественного рангового критерия Дункана. Указанное исследование подтвердило превосходство комбинации пептидов для предотвращения повреждений почечных структур и функциональной гибели при длительных периодах ишемии/реперфузии. Пример 3. Защитный эффект EGF/GHRP-6 на модели ишемии/реперфузии кишечника. Самцов крысы Sprague-Dawley (220-250 г) рандомизировали в следующие экспериментальные группы:IV: ишемия/комбинация EGF (5 мкг)/GHRP-6 (2 мкг)на крысу. Все воздействия проводили интраперитонеально за 30 мин до начала периода ишемии.-8 007466 Экспериментальная модель. Под наркозом метоксифлюраном и с использованием подогреваемого одеяла осторожно выполняли лапаротомию для обнажения ветви первого порядка верхней брыжеечной артерии. Артерию пережимали на 2 ч, что провоцировало тяжелую ишемию тощего и подвздошного отделов тонкого кишечника. Реперфузию проводили в течение 3 ч. Крыс умерщвляли и проводили полное вскрытие. Тонкий кишечник резецировали и регистрировали длину слизистой оболочки с кровоизлияниями и/или повреждения просвета. Содержимое кишечника вымывали стандартным объемом физиологического раствора, чтобы определить содержание гемоглобина. Слизистую оболочку кишечника промывали теплым физиологическим раствором, взвешивали и фрагменты использовали для определения содержания общего белка с помощью методики Лоури. Другие фрагменты использовали для определения содержания общей ДНК и микроскопического исследования. Ворсинки/повреждение слизистой оболочки изучали микроскопически, как описано Chiu. Данная шкала принимает за балл 0 интактную слизистую оболочку, далее, повышения до балла 5, представляющего собой денудацию на полную толщину. Для того чтобы полностью прояснить защитный эффект комбинированного лечения на указанной модели ишемии/реперфузии кишечника, проводили мониторинг выживания до 96 ч реперфузии. На животных, получавших физиологический раствор, серьезно повлиял период ишемии/реперфузии, который осуществляли в настоящем исследовании; наблюдались трансмуральные язвы с тотальной денудацией и профузным кровотечением. Как показано в табл. 8, большинство сегментов кишечника,изученных в данной группе, имело повреждения, оцененные в 5 баллов. Лечение EGF обеспечивало минимальную защиту, которая для клинической практики представляется не имеющей значения. Вмешательство EGF обеспечивало минимальный эффект. Частичная защита наблюдалась у животных, получавших GHRP-6; повреждения слизистой оболочки были более поверхностными и более ограниченными. И снова, комбинация пептидов достоверно уменьшала повреждения слизистой оболочки (табл. 8). Все критерии, которые использовались в исследовании, подтверждают, что комбинация пептидов обеспечивает замечательный цитопротективный эффект во время эпизода ишемии/реперфузии. Таблица 8 Параметры повреждения кишечника Данные выражены как среднее и СО.Означает разницу между группой, получавшей комбинацию пептидов, и ишемической группой,получавшей физиологический раствор (р 0,01).Означает разницу между группой, получавшей GHRP-6, и группой, получавшей физиологический раствор (р 0,05). Сравнения с помощью одностороннего ANOVA и множественного рангового критерия Дункана. Микроскопическое исследование главных внутренних органов показало тесное соответствие между размерами повреждения кишечника и изменениями вне кишечника, обнаруженными в отдаленных органах. Главными повреждениями, которые были смягчены у животных, леченных комбинацией, были следующие: (I) нейтрофильная инфильтрация легочной паренхимы, (II) предотвращение набухания гепатоцитов, (III) предотвращение спадения клубочков и изменений трубочек. Второй, и независимый, эксперимент был осуществлен с целью узнать, способствует ли комбинация выживанию животных. Методика эксперимента была той же, которая описана выше. Все крысы получали интраперитонеальную инъекцию раствора Рингера с лактатом после закрытия раны. За животными наблюдали в течение 96 ч от начала реперфузии. 100% крыс, получавших комбинацию, выживало в течение 96 ч и более (табл. 9). Патологоанотомическое исследование животных подтвердило предыдущие открытия, касающиеся того, что комбинация пептидов не только обеспечивала устойчивую защиту путем сокращения некротических изменений. Кроме того, повреждения в легких и почках, как отдаленных органов-мишеней, затронутых рекруитментом нейтрофилов, также были смягчены. Указанные открытия подтвердили системную и полиорганную защиту, запускаемую комбинацией EGF/GHRP-6. Пример 4. Эффект терапевтического введения EGF/GHRP-6 на экспериментальной модели множественного повреждения органов вследствие обширного ожога. Мышам Balb/c (22-25 г) выбривали область спины и вызывали на ней гиподермальный ожог, вовлекающий 25% площади поверхности тела, путем погружения в равновесную влагу при 95-97 С на 5 с. Немедленно после этого все мыши получали 1,5 мг физиологического раствора в качестве жидкостной реанимации. Указанная экспериментальная модель на животных была ранее разработана и стандартизована в лаборатории заявителя, и она является пригодной для поставленных целей, поскольку обширные внутренние изменения устойчиво воспроизводятся. В течение последующих 24 ч выживших мышей рандомизировали в следующие группы. Стандарт. Мыши с имитацией ожога, получавшие 0,9% физиологический раствор (N=5). Обожженные, получавшие только 0,9% физиологический раствор (N=7). Обожженные и леченные EGF (N=10; 0,1 мкг EGF на животное). Обожженные и леченные GHRP-6 (N=9; 0,1 мкг GHRP-6 на животное). Обожженные, леченные комбинацией пептидов (N=10). EGF (0,01 мкг) и GHRP-6 (0,01 мкг). Введения осуществляли дважды в день и до 10-го дня после ожога. По окончании лечения животных снова взвешивали и умерщвляли для вскрытия и микроскопического исследования. За 6 ч до смерти каждая мышь получали инъекцию винкристина (1 мг/кг) для остановки клеток в метафазе. Кишечник резецировали, промывали и взвешивали. Собирали фрагменты для определения общего содержания ДНК и белка. Другие фрагменты фиксировали в формалине и использовали для обычного исследования или для микродиссекции ворсинок и крипт. Морфометрические процедуры на предметных стеклах получали из системы DIGIPAT image processing. В настоящем исследовании рассматривали следующие параметры. Вес животного. Вес кишечника, содержание белка и ДНК. Количество клеток в метафазе на крипту. Количество ветвящихся крипт. Высота ворсинок. Глубина крипт. Все мыши, получавшие EGF, GHRP-6 по отдельности или в комбинации, показали достоверное увеличение веса тела к концу эксперимента. Разница была даже больше у животных, получавших оба пептида. Эти данные представлены в табл. 10. Это открытие указывает на трофическое действие, оказанное комбинацией на слизистую оболочку кишечника. Таблица 10 Вес тела в течение эксперимента Конечный вес регистрировали на 10-й день после ожога и через 20 введений. Данные выражены как среднее и СО.- 10007466 Означает разницу между исходным и конечным весом тела р 0,05.Разница между группой, получавшей комбинацию, и остальными группами. ОдностороннийANOVA и Дункан. Как показано в табл. 11, лечение каждым из пептидов по отдельности оказывало трофическое/регенеративное действие на слизистую оболочку кишечника по сравнению с введением физиологического раствора. Наиболее важные эффекты были обнаружены, разумеется, в группе, получавшей комбинацию пептидов. Таблица 11 Регенерационный ответ кишечника Данные выражены как среднее и СО.Означает разницу между группой, получавшей комбинацию пептидов, и группой, получавшей физиологический раствор (р 0,01).Означает разницу между группами, получавшими каждый пептид по отдельности, и группой, получавшей физиологический раствор (р 0,05). Односторонний ANOVA и пост-критерий Дункана. Наиболее релевантным свидетельством настоящего эксперимента является демонстрация того факта, что комбинация пептидов ускоряет рост и адаптацию кишечника, что выражается в стимуляции процесса деления в криптах тонкого и толстого кишечника. Крипта представляет собой ростовую и пролиферативную единицу слизистой оболочки кишечника, а также морфологическое доказательство адаптации массы кишечника. Табл. 12 показывает данные, относящиеся к морфологическому восстановлению кишечника. Увеличение ворсинок и крипт находится в соответствии с регенерацией тканей и всасыванием питательных веществ. Таблица 12 Восстановление слизистой оболочки кишечника Данные выражены как среднее и СО.Означает разницу между группой, получавшей комбинацию пептидов, и остальными группами(р 0,05).Означает разницу между группой, получавшей EGF, и группой, получавшей 0,9% физиологический раствор (р 0,05). Односторонний ANOVA и критерии Дункана. Настоящее изобретение имеет следующие преимущества. 1. Комбинация может оказывать профилактическое и/или терапевтическое действие, которое может зависеть от того, что необходимо для лечения данного патологического состояния. Эффекты специалист легко модулирует схемой введения.- 11007466 2. Способ индуцировать защиту клеток основан на стимуляции механизма самозащиты в каждой клетке организма. Механизмы, подлежащие активации, различны, но функционально дублируют друг друга. Многие предыдущие решения по защите клеток включали инородные химические структуры (ксенобиотики). 3. Для индукции ожидаемого терапевтического ответа достаточно малых доз, при отсутствии риска токсичности. Пептиды оказались безопасными в очень высоких дозах для различных видов млекопитающих. Ранее существовавшие вмешательства требовали более высоких доз для достижения умеренного эффекта. 4. Биологический ответ быстро активируется путем взаимодействия как EGF, так и GHRP-6 со специфичным клеточным рецептором. Это устраняет потребность в пролонгированном воздействии пептидами, снижая риск токсичности. 5. Комбинация пептидов не имеет противопоказаний и может применяться для любого субъекта без всякого риска. Нежелательного лекарственного взаимодействия не наблюдается. 6. Указанный способ следует применять для широкого ряда распространенных клинических состояний и сопутствующих заболеваний, многие из которых до сих пор не имеют доступного терапевтического выбора. 7. Указанный способ показан по ряду патологических состояний, включая пациентов, получающих трансплантацию органов. 8. Цитопротективные эффекты настоящего изобретения имеют широкий терапевтический интервал с точки зрения времени защиты от ишемии/реперфузии. Время защиты отвечает современным клиническим нуждам для трансплантации, реваскуляризации, диагностических маневров, организационных процедур и т.п. 9. С механистической точки зрения комбинация может противодействовать каскаду повреждений,связанных с ишемией/реперфузией, по различных критическим пунктам, что делает ее фармакологические механизмы поливалентными и, следовательно, эффективными. 10. Применение настоящей комбинации является уникальным в качестве применения трофического/регенерирующего агента для многих эпителиальных органов, таких как кишечник, печень, поджелудочная железа и почка. 11. Настоящая комбинация оказалась пригодной для коррекции синдрома короткого кишечника/адаптации кишечника. В современной клинической практике указанный процесс не имеет никакого альтернативного выбора. ФОРМУЛА ИЗОБРЕТЕНИЯ Фармацевтическая композиция, характеризующаяся тем, что она содержит гексапептид, усиливающий секрецию гормона роста GHRP-6, и подходящий наполнитель, для профилактики ишемического повреждения тканей, такой как профилактика повреждений тканей, вызванных нарушением артериального кровотока, у человека и животных.
МПК / Метки
МПК: A61K 38/18, A61K 38/08, A61P 9/00
Метки: композиция, вызванного, фармацевтическая, кровотока, лечения, недостаточностью, тканей, повреждения, артериального
Код ссылки
<a href="https://eas.patents.su/13-7466-farmacevticheskaya-kompoziciya-dlya-lecheniya-povrezhdeniya-tkanejj-vyzvannogo-nedostatochnostyu-arterialnogo-krovotoka.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция для лечения повреждения тканей, вызванного недостаточностью артериального кровотока</a>
Предыдущий патент: Процедура получения клеточных линий в безбелковых средах и клеточные линии, полученные этим способом
Следующий патент: Применение cd23 антагонистов для лечения опухолевых заболеваний
Случайный патент: Защищенное стыковое соединение и способ защиты от коррозии