6-(2,6-дифторфенил)триазолопиримидины
Номер патента: 7150
Опубликовано: 25.08.2006
Авторы: Заутер Хуберт, Штратманн Зигфрид, Гевер Маркус, Райнхаймер Йоахим, Штирль Райнхард, Аммерманн Эберхард, Шэфер Петер, Мюллер Бернд, Лоренц Гизела, Грамменос Вассилиос, Шивекк Франк, Тормо И Бласко Хорди, Гроте Томас, Розе Инго, Гипзер Андреас
Формула / Реферат
1. 6-(2,6-Дифторфенил)триазолопиримидины формулы I
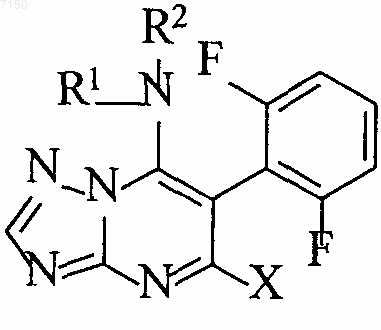
в которой R1 и R2 независимо означают водород или C1-С10-алкил, C2-С10-алкенил, C3-С10-циклоалкил или фенил, который может нести от одной до трех групп Ra, или
R1 и R2 вместе с находящимся между ними атомом азота представляют собой 5- или 6-членное гетероциклическое кольцо, которое может дополнительно содержать 1 атом серы или кислорода и которое может быть замещено радикалами Ra в количестве от одного до трех;
где Ra означает C1-С6-алкил или C1-С4-алкилендиокси; и
Х означает галоген, циано или C1-С6-алкокси.
2. Соединения формулы I по п.1, в которых
R1 означает линейный или разветвленный C1-С6-алкил, С2-С6-алкенил или С3-С9-циклоалкил, и
R2 означает водород или C1-С6-алкил, или
R1 и R2 вместе с находящимся между ними атомом азота представляют собой гетероциклическое кольцо с 5 или 6 атомами углерода, которое необязательно замещено одной или двумя C1-С6-алкильными группами.
3. Соединения по п.1 или 2, в которых R2 означает водород.
4. Соединения по любому из пп.1-3, в которых Х означает галоген.
5. Способ получения соединений формулы I, определенных в п.4, который заключается во взаимодействии 5,7-дигалоген-6-(2,6-дифторфенил)триазолопиримидинов формулы II
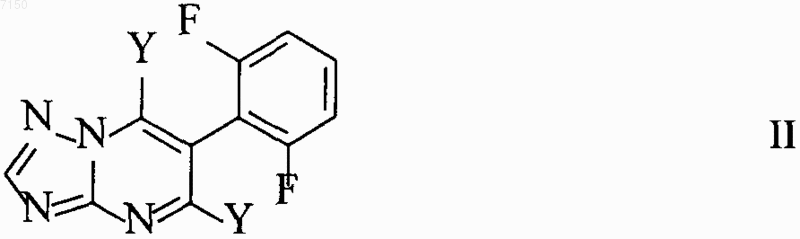
в которой Y означает галоген, с амином формулы III

в которой R1 и R2 являются такими, как определено для формулы I, для получения соединений формулы I.
6. Композиция для борьбы с фитопатогенными грибами, содержащая твердый или жидкий носитель и соединение формулы I по п.1.
7. Способ борьбы с фитопатогенными грибками, который заключается в обработке грибков или материалов, растений, почвы или семян, которые подлежат защите от грибков, эффективным количеством соединения формулы I по п.1.
Текст
007150 Настоящее изобретение относится к 6-(2,6-дифторфенил)триазолопиримидинам формулы IR1 и R2 независимо означают водород или C1-С 10-алкил, C2-С 10-алкенил, C3-С 10-циклоалкил или фенил, который может нести от одной до трех групп Ra, илиR1 и R2 вместе с находящимся между ними атомом азота представляют собой 5- или 6-членное гетероциклическое кольцо, которое может дополнительно содержать 1 атом серы или кислорода и которое может быть замещено радикалами Ra в количестве от одного до трех; гдеRa означает C1-С 6-алкил или C1-С 4-алкилендиокси; и Х означает галоген, циано или C1-С 6-алкокси. Изобретение также касается способов получения соединений формулы I, композиций, которые содержат соединения формулы I, а также их использования для борьбы с патогенными грибами. Кроме того, в описании представлены следующие соединения формулыR1 и R2 независимо означают водород или C1-С 10-алкил, C2-С 10-алкенил, C2-С 10-алкинил или C4-С 10 алкадиенил, C3-С 10-циклоалкил, фенил, нафтил или 5- или 6-членный гетероциклил, содержащий от 1 до 4 атомов азота или от 1 до 3 атомов азота и 1 атом серы или кислорода, или 5- или 6-членный гетероарил, содержащий от 1 до 4 атомов азота или от 1 до 3 атомов азота и 1 атом серы или кислорода,где радикалы R1 и R2 могут быть ненасыщенными или могут иметь от одной до трех групп Ra,Ra означает циано, нитро, гидроксил, C1-С 6-алкил, C3-С 6-циклоалкил, C1-С 6-алкокси, C1-С 6-алкилтио, C1-С 6-алкиламино, ди-C1-С 6-алкиламино, С 2-С 6-алкенил, C2-С 6-алкенилокси, C2-С 6-алкинил, C3-С 6 алкинилокси и С 1-С 4-алкилендиокси; илиR1 и R2 вместе с находящимся между ними атомом азота представляют собой 5- или 6-членное гетероциклическое кольцо, содержащее от 1 до 4 атомов азота или от 1 до 3 атомов азота и 1 атом серы или кислорода, которое может быть замещено радикалами Ra в количестве от одного до трех; Х означает галоген, циано, C1-С 6-алкокси, C1-С 6-галогеналкокси или C3-С 8-алкенилокси. 6-Фенил-7-аминотриазолопиримидины, в основном, известны из патентов US 4,567,262 и US 5,593,996. Триазолопиримидины с трифторфенильной группой в 6-положении описаны в WO-A 98/46607 и ЕР-А 945 453. Из WO-A 98/46608 известны некоторые 6-(2,6-дифторфенил)триазолопиримидины, которые замещены в положении 7 фторированными алкиламинами. Соединения, описанные в вышеприведенных документах, активны против различных фитопатогенных грибов. Целью данного изобретения является получение соединений, имеющих улучшенную фунгицидную активность. Было установлено, что указанная цель достигается вышеприведенными соединениями. Кроме того,были разработаны способ их получения, композиции, содержащие их, и способы борьбы с фитопатогенными грибами с использованием соединений I. Соединения формулы I отличаются от соединений, известных из документа WO-A 98/46608, комбинацией 2,6-дифторфенильной группы со свободной от галогена аминогруппой в положении 7 триазолопиримидиновой системы. Настоящее изобретение охватывает также способ получения соединений формулы I, приведенной выше, который заключается в обработке 5,7-дигалогенсоединения формулы II, в которой Х означает галоген, амином формулы III.-1 007150 Реакция между 5,7-дигалогенсоединениeм II и амином формулы III может быть проведена в условиях, известных из WO-A 98/46608. Соединения формулы II известны из документа ЕР-А 550 113; их можно получить известными способами [см. ЕР-А 550 113 или ЕР-А 770 615]. Реакцию проводят преимущественно в присутствии растворителя. Подходящие растворители включают простые эфиры, такие как диоксан, диэтиловый эфир и особенно тетрагидрофуран, галогенированные углеводороды, такие как дихлорметан, и ароматические углеводороды, например толуол. Реакцию соответствующим образом проводят при температуре в интервале от 0 до 70 С, предпочтительно температурой реакции является интервал от 10 до 35 С. Также предпочтительно реакцию проводят в присутствии основания. Подходящие основания включают третичные амины, такие как триэтиламин, и неорганические основания, такие как карбонат калия или карбонат натрия. Альтернативно, основанием может служить избыток соединения формулы III. Реакционную смесь подвергают обработке обычным образом, например путем смешивания с водой,разделения фаз и, если необходимо, хроматографической очистки сырых продуктов. Некоторые из конечных продуктов получают в форме бесцветных или слегка вязких коричневатых масел, которые очищают или освобождают от летучих компонентов при сниженном давлении и умеренно повышенных температурах. Если конечные продукты получаются в виде твердых веществ, очистку могут также проводить перекристаллизацией или дигерированием. Соединения формулы II известны из литературы и могут быть получены путем синтеза, описанного в ЕР-А 550 113, ЕР-А 770 615 и WO-A 98/46608. Соединения формулы I, в которой Х означает циано, C1-С 6-алкокси, C1-С 6-галогеналкокси или C3 С 8-алкенилокси, могут быть получены взаимодействием соединений I, в которых Х означает галоген,предпочтительно хлор, с соединениями формулы IV, которые, в зависимости от значений X', которые должны быть введены для получения соединений формулы I, представляют собой неорганическую цианосоль, алкоксилат, галогеналкоксилат или алкенилоксилат, соответственно, предпочтительно в присутствии растворителя. Катион М в формуле IV имеет незначительное влияние; по практическим и экономическим причинам обычно предпочтительными являются соли аммония, тетраалкиламмония или щелочных и щелочно-земельных металлов. Реакцию соответствующим образом проводят при температуре от 0 до 120 С, предпочтительным температурным интервалом реакции является интервал от 10 до 40 С [см. J. Heterocycl. Chem., том 12, с. 861-863 (1975)]. Подходящие растворители включают простые эфиры, такие как диоксан, диэтиловый эфир, в особенности тетрагидрофуран, галогенированные углеводороды, такие как дихлорметан, и ароматические углеводороды, например толуол. Если индивидуальные соединения I невозможно получить путями, описанными выше, они могут быть получены путем синтеза производных других соединений формулы I. В определениях символов, указанных в формулах, приведенных выше, используют общие термины,которые обычно представляют собой следующие заместители: галоген: фтор, хлор, бром и йод;C1-С 10-алкил: насыщенные углеводородные радикалы с линейной или разветвленной цепью, имеющие от 1 до 10, главным образом, от 1 до 6 атомов углерода, например С 1-С 4-алкил, упомянутый выше,или пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1 диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1 диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил;C2-С 10-алкенил: ненасыщенные углеводородные радикалы с линейной или разветвленной цепью,имеющие от 2 до 10, главным образом, от 2 до 6 атомов углерода и двойную связь в любом положении,например этенил, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1 пропенил, 2-метил-1-пропенил, 1-метил-2-пропенил и 2-метил-2-пропенил;C2-С 10-алкинил: углеводородные радикалы с линейной или разветвленной цепью, имеющие от 2 до 10, главным образом, от 2 до 4 атомов углерода и тройную связь в любом положении, например этинил,1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил и 1-метил-2-пропинил; галогеналкильные остатки C1-С 6-галогеналкоксигруппы: алкильные группы с линейной или разветвленной цепью, имеющие от 1 до 6, преимущественно от 1 до 4 атомов углерода (как упоминалось-2 007150 выше), где атомы водорода в этих группах могут быть частично или полностью замещены атомами галогена, как упоминалось выше, например С 1-С 2-галогеналкоксигруппа, такая как хлорметокси, бромметокси, дихлорметокси, трихлорметокси, фторметокси, дифторметокси, трифторметокси, хлорфторметокси,дихлорфторметокси, хлордифторметокси, 1-хлорэтокси, 1-бромэтокси, 1-фторэтокси, 2-фторэтокси, 2,2 дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2-фторэтокси, 2-хлор-2,2-дифторэтокси, 2,2-дихлор-2-фторэтокси, 2,2,2-трихлорэтокси и пентафторэтокси;C3-С 10-циклоалкил: моно- или бициклические циклоалкильные группы, имеющие от 3 до 10 атомов углерода; моноциклические группы предпочтительно имеют от 3 до 8, главным образом, от 3 до 6 атомов в кольце, бициклические группы предпочтительно имеют от 8 до 10 атомов в кольце; 5- или 6-членная гетероциклильная группа, содержащая от 1 до 4 атомов азота или от 1 до 3 атомов азота и 1 атом серы или кислорода, предпочтительно 1 атом кислорода; 5-членный гетероарил, содержащий от 1 до 4 атомов азота или от 1 до 3 атомов азота и 1 атом серы или кислорода: 5-членные гетероарильные группы, которые, кроме атомов углерода, могут содержать от 1 до 4 атомов азота или от 1 до 3 атомов азота и 1 атом серы или кислорода в качестве элементов кольца,например 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пирролил, 3-пирролил, 3-изоксазолил, 4-изоксазолил,5-изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2 оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-имидазолил, 4-имидазолил,1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,4-триазол-3 ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиадиазол-2-ил и 1,3,4-триазол-2-ил; 6-членный гетероарил, содержащий от 1 до 4 атомов азота: 6-членные гетероарильные группы, которые, кроме атомов углерода, могут содержать от 1 до 3 или от 1 до 4 атомов азота в качестве элементов кольца, например 2-пиридинил, 3-пиридинил, 4-пиридинил, 3-пиридазинил, 4-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 2-пиразинил, 1,3,5-тиазин-2-ил и 1,2,4-триазин-3-ил. Что касается их намеченного использования, то преимущество отдается триазолопиримидинам формулы I, имеющим следующие заместители, где преимущество в каждом случае применимо для их собственных заместителей или их комбинации. Предпочтительным циклоалкильным остатком является циклопентил, необязательно замещенный одной или несколькими нитро, циано, C1-С 6-алкильными, C1-С 6-алкоксильными группами. Предпочтительным гетероарильным остатком является пиридил, пиримидил, пиразолил или тиенил. Предпочтение отдается соединениям формулы I, в которых любая алкильная часть групп R1 или R2,которая может быть линейной или разветвленной, содержит от 1 до 9 атомов углерода, более предпочтительно от 2 до 6 атомов углерода, любая алкенильная или алкинильная часть заместителей R1 или R2 содержит от 2 до 9 атомов углерода, более предпочтительно от 3 до 6 атомов углерода, любая циклоалкильная часть заместителей R1 или R2 содержит от 3 до 10 атомов углерода, предпочтительно от 3 до 8 атомов углерода, более предпочтительно от 3 до 6 атомов углерода, и любая бициклоалкильная часть заместителей R1 или R2 содержит от 7 до 9 атомов углерода. Любая алкильная, алкенильная или алкинильная группа может быть линейной или разветвленной. Предпочтение отдается соединениям формулы I, в которой R1 не является водородом. Кроме того, предпочтительными соединениями формулы I являются соединения, в которых R1 представляет собой C1-С 10-алкил с линейной или разветвленной цепью, особенно разветвленный C3-С 10 алкил, C3-С 8-циклоалкил, С 5-С 9-бициклоалкил, C3-С 8-циклоалкил-C1-С 6-алкил, C1-С 10-алкокси-C1-С 6 алкил или фенильную группу, необязательно замещенную от 1 до 3 раз C1-С 10-алкильной или C1-С 10 алкоксильной группами. Особое предпочтение отдается соединениям формулы I, в которой R2 представляет собой водород или C1-С 10-алкильную группу, особенно водород. Кроме того, особое предпочтение отдается соединениям формулы I, в которой R2 представляет собой метил или этилы. Если R1 означает необязательно замещенную C3-С 8-циклоалкильную группу, предпочтительно циклопентильную или циклогексильную группу, R2 преимущественно означает водород или C1-С 6-алкильную группу. Более того, особое предпочтение отдается соединениям I, в которых R1 и R2 вместе с находящимся между ними атомом азота образуют необязательно замещенное гетероциклическое кольцо, предпочтительно необязательно замещенное С 3-С 7-гетероциклическое кольцо, в частности пирролидиновое, пиперидиновое, тетрагидропиридиновое, особенно 1,2,3,6-тетрагидропиридиновое или азепановое кольцо,которое необязательно замещено одной или несколькими C1-С 10-алкильными группами. Кроме того, особое предпочтение отдается соединениям формулы I, в которой Х представляет собой хлор или бром, особенно хлор. Более того, предпочтение отдается соединениям I, в которых Х означает циано или метокси. Кроме того, особое предпочтение отдается соединениям формулы I, в которой Х означает этокси, нпропокси, изопропокси, аллилокси или 3-метилаллилокси. В объем настоящего изобретения включены (R) и (S) изомеры соединений общей формулы I, имеющие хиральный центр, а также их рацематы, соли, N-оксиды и кислотно-аддитивные соединения.-3 007150 Что касается их использования, то особое предпочтение отдается соединениям I, скомпилированным в таблицах ниже. Группы, упомянутые в таблице для заместителя, и, кроме того, их часть, независимо от комбинации, в которой они упоминаются, являются особенно предпочтительным воплощением соответствующих заместителей. Таблица 1. Соединения формулы I, в которой Х означает хлор, a R1 и R2 соответствуют одному ряду в табл. А. Таблица 2. Соединения формулы I, в которой Х означает бром, а R1 и R2 соответствуют одному ряду в табл. А. Таблица 3. Соединения формулы I, в которой Х означает циано, а R1 и R2 соответствуют одному ряду в табл. А. Таблица 4. Соединения формулы I, в которой Х означает метокси, a R1 и R2 соответствуют одному ряду в табл. А. Таблица 5. Соединения формулы I, в которой Х означает этокси, a R1 и R2 соответствуют одному ряду в табл. А. Таблица 6. Соединения формулы I, в которой Х означает н-пропокси, a R1 и R2 соответствуют одному ряду в табл. А. Таблица 7. Соединения формулы I, в которой Х означает изопропокси, a R1 и R2 соответствуют одному ряду в табл. А. Таблица 8. Соединения формулы I, в которой Х означает аллилокси, а R1 и R2 соответствуют одному ряду в табл. А. Таблица 9. Соединения формулы I, в которой Х означает 3-метилаллилокси, a R1 и R2 соответствуют одному ряду в табл. А. Таблица А Соединения I пригодны в качестве фунгицидов. Они обладают прекрасной активностью против широкого спектра фитопатогенных грибов, в частности против классов Ascomycetes, Deuteromycetes,Phycomycetes и Basidiomycetes. Некоторые из них действуют системно и могут применяться при защите растений в качестве лиственных и почвенных фунгицидов. Они имеют особое значение при борьбе со множеством фитопатогенных грибов на различных культурных растениях, таких как пшеница, рожь, ячмень, овес, рис, кукуруза, злаки, бананы, хлопчатник,соевые, кофе, сахарный тростник, виноград, плодовые и декоративные растения, и на овощных культурах, таких как огурцы, бобовые, томаты, картофель и тыквенные, а также на семенах этих растений. Особенно они пригодны для борьбы против следующих болезней растений: виды Alternaria, Podosphaera, Sclerotinia, Physalospora canker на овощных и плодовых растениях,Botrytis cinerea (серая гниль) на клубничных, овощных, декоративных культурах и на виноградных лозах,Corynespora cassiicola на огурцах,виды Colletotrichum на плодовых растениях и овощах,Diplocarpon rosae на розах,Elsinoe fawcetti и Diaporthe citri на цитрусовых плодовых растениях,виды Sphaerotheca на тыквенных, клубнике и розах,-5 007150 виды Cercospora на земляных орехах, сахарной свекле и баклажанах,Erysiphe cichoracearum на тыквенных,Leveillula taurica на паприке, томатах и баклажанах,виды Mycosphaerella на яблоневых и японских абрикосовых деревьях,Phyllactinia kakicola, Gloesporium kaki на японских абрикосовых деревьях,Gymnosporangium yamadae, Leptothyrium pomi, Podosphaera leucotricha и Gloedes pomigena на яблоневых деревьях,Cladosporium carpophilum на грушевых и японских абрикосовых деревьях,виды Phomopsis на грушевых деревьях,виды Phytophthora на цитрусовых плодах, картофеле, луке, особенно Phytophthora infestans на картофеле и томатах,Blumeria graminis (пылевидная ложномучнистая роса) на зерновых,виды Fusarium- и Verticillium на различных растениях,Glomerella cingulata на чае,виды Drechslera- и Bipolaris на зерновых и рисе,виды Mycosphaerella на бананах и земляных орехах,Plasmopara viticola на виноградных лозах,виды Personospora на луке, шпинате и хризантемах,Phaeoisariopsis vitis и Sphaceloma ampelina на грейпфрутах,Pseudocercosporella herpotrichoides на пшенице и ячмене,виды Pseudoperonospora на хмеле и огурцах,виды Puccinia и Typhula на зерновых и дернине,Pyricularia oryzae на рисе,виды Rhizoctonia на хлопчатнике, рисе и дернине,Stagonospora nodorum и Septoria tritici на пшенице,Uncinula necator на виноградных лозах,виды Ustilago на зерновых и сахарном тростнике, а также виды Venturia (парша) на яблоневых и грушевых деревьях. Кроме того, соединения I пригодны для борьбы с вредными грибами, такими как Paecilomyces variotii при защите материалов (например, древесины, бумаги, дисперсий для покрытий, волокон и тканей) и при защите находящихся на хранении продуктов. Соединения I применяют путем обработки грибов или подлежащих защите от грибковой инфекции растений, семян, материалов или почвы фунгицидно активным количеством действующих компонентов. Применение может осуществляться как перед, так и после поражения грибами материалов, растений или семян. В общем, фунгицидные композиции содержат от 0,1 до 95 мас.%, предпочтительно от 0,5 до 90 мас.% действующего компонента. При применении для защиты культурных растений нормы расхода, в зависимости от желаемого эффекта, составляют между 0,01 и 2,0 кг действующего компонента на гектар. При обработке посевного зерна, в общем, требуется от 0,001 до 0,1 г, предпочтительно от 0,01 до 0,05 г действующего вещества на кг посевного материала. При использованиидля защиты материалов или находящихся на хранении продуктов норма расхода действующего компонента зависит от области применения и желаемого результата. Обычные нормы расхода при защите материалов составляют, например, от 0,001 г до 2 кг, предпочтительно от 0,005 г до 1 кг действующего вещества на кубометр обрабатываемого материала. Соединения I могут быть переведены в обычные препаративные формы, например растворы,эмульсии, суспензии, дусты, порошки, пасты и гранулы. Используемая форма зависит от конкретной цели; в любом случае она должна обеспечивать тонкое и равномерное распределение соединения согласно изобретению. Препаративные формы получают известным образом, например разбавлением действующего компонента растворителями и/или носителями, по желанию с применением эмульгаторов или диспергаторов, причем при применении в качестве разбавителя воды возможно также использование и других органических растворителей в качестве вспомогательных растворителей. В качестве вспомогательных растворителей пригодны, в основном, растворители, такие как ароматические соединения (например, ксилол), хлорированные ароматические соединения (например, хлорбензолы), парафины (например, фракции нефти), спирты (например, метанол, бутанол), кетоны (например, циклогексанон), амины (например,этаноламин, диметилформамид) и вода; носители, такие как естественные измельченные породы (например, каолин, глинозем, тальк, мел) и искусственные измельченные породы (например, высокодисперсный кремнезем, силикаты); эмульгаторы, такие как неионогенные и анионные эмульгаторы (например,эфиры полиоксиэтилена и жирных спиртов, алкилсульфонаты и арилсульфонаты) и диспергаторы, такие как отработанный лигнинсульфитный щелок и метилцеллюлоза.-6 007150 В качестве поверхностно-активных веществ применяются соли щелочных, щелочно-земельных металлов и аммониевые соли лигносульфоновой кислоты, нафталинсульфокислота, фенолсульфокислота,дибутилнафталинсульфокислота, алкиларилсульфонаты, алкилсульфаты, алкилсульфонаты, сульфаты жирных спиртов и жирные кислоты, а также их соли щелочных и щелочно-земельных металлов, соли сульфатированного эфира жирного спирта и гликоля, продукты конденсации сульфонированного нафталина и производных нафталина с формальдегидом, продукты конденсации нафталина или нафталинсульфокислоты с фенолом или формальдегидом, полиоксиэтиленоктилфениловый эфир, этоксилированный изооктилфенол, октилфенол, нонилфенол, алкилфенолполигликолевые эфиры, трибутилфенилполигликолевые эфиры, алкиларилполиэфирные спирты, изотридециловый спирт, продукты конденсации этиленоксида и спирта жирного спирта, этоксилированное касторовое масло, полиоксиэтиленалкиловые эфиры, этоксилированный полиоксипропилен, ацеталь полигликолевого эфира лаурилового спирта,сложные эфиры сорбита, отработанный лигнинсульфитный щелок и метилцеллюлоза. Веществами, пригодными для получения непосредственно разбрызгиваемых растворов, эмульсий,паст или масляных дисперсий, являются фракции перегонки нефти со средней и высокой точками кипения, такие как керосин или дизельное масло, дегтярные масла или масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например бензол, толуол,ксилол, парафин, тетрагидронафталин, алкилированные нафталины или их производные, метанол, этанол, пропанол, бутанол, хлороформ, тетрахлоруглерод, циклогексанол, циклогексанон, хлорбензол, изофорон, сильнополярные растворители, например диметилформамид, диметилсульфоксид, N-метилпирролидон и вода. Порошковые препараты, препараты для опыливания и опудривания могут быть изготовлены путем смешивания или совместного размалывания действующих веществ с твердым носителем. Гранулы, например покрытые оболочкой гранулы, импрегнированные гранулы или гомогенные гранулы, могут быть получены путем связывания действующих веществ с твердыми носителями. Примерами твердых наполнителей служат минеральные земли, такие как кремнезем, силикагели, силикаты,тальк, каолин, аттаклау, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция, сульфат магния, окись магния, измельченные синтетические материалы, удобрения, например сульфат аммония, фосфат аммония, нитрат аммония, мочевины и продукты растительного происхождения, такие как зерновая мука, мука из древесной коры, древесная мука и мука из ореховой скорлупы,порошки целлюлозы и другие твердые носители. В общем, композиции содержат от 0,01 до 95 мас.%, предпочтительно от 0,1 до 90 мас.% действующего вещества. Применяют действующие вещества с чистотой от 90 до 100%, предпочтительно от 95 до 100% (по спектру ЯМР). Примеры композицийI. 5 вес.долей соединения согласно изобретению тщательно перемешивают с 95 вес.долями тонкоизмельченного коалина. Таким образом получают средство опыливания, содержащее 5 мас.% действующего вещества.II. 30 вес.долей соединения согласно изобретению тщательно перемешивают со смесью, состоящей из 92 вес.долей порошкообразного силикагеля и 8 вес.долей парафинового масла, которое напыляют на поверхность этого силикагеля. Таким образом получают композицию действующего вещества с хорошими адгезионными свойствами (содержание действующего вещества 23 мас.%).III. 10 вес.долей соединения согласно изобретению растворяют в смеси, которая состоит из 90 вес.долей ксилола, 6 вес.долей аддукта 8-10 молей этиленоксида и 1 моля N-моноэтаноламида олеиновой кислоты, 2 вес.долей додецилбензолсульфоната кальция и 2 вес.долей аддукта 40 молей этиленоксида и 1 моля касторового масла (содержание действующего вещества 9 мас.%).IV. 20 вес.долей соединения согласно изобретению растворяют в смеси, которая состоит из 60 вес.долей циклогексанона, 30 вес.долей изобутанола, 5 вес.долей аддукта 7 молей этиленоксида и 1 моля изооктилфенола и 5 вес.долей аддукта 40 молей этиленоксида и 1 моля касторового масла (содержание действующего вещества 16 мас.%).V. 80 вес.долей соединения согласно изобретению тщательно перемешивают с 3 вес.долями диизобутилнафталинсульфоната натрия, 10 вес.долями натриевой соли лигносульфоновой кислоты из отработанного сульфитного щелока и 7 вес.долями порошкообразного силикагеля и смесь перемалывают в молотковой мельнице (содержание действующего вещества 80 мас.%).VI. 90 вес.долей соединения согласно изобретению смешивают с 10 вес.долями N-метилпирролидона и получают раствор, который пригоден для применения в форме мельчайших капель (содержание действующего вещества 90 мас.%).VII. 20 вес.долей соединения согласно изобретению растворяют в смеси, состоящей из 40 вес.долей циклогексанона, 30 вес.долей изобутанола, 20 вес.долей аддукта 7 молей этиленоксида и 1 моля изооктилфенола и 10 вес. долей аддукта 40 молей этиленоксида и 1 моля касторового масла. Путем выливания раствора в 100000 вес.долей воды и тонкого распределения в ней получают водную дисперсию, содержащую 0,02 вес.% действующего вещества.VIII. 20 вес.долей соединения согласно изобретению тщательно перемешивают с 3 вес.долями диизобутилнафталинсульфоната натрия, 17 вес.долями натриевой соли лигносульфоновой кислоты из отработанного сульфитного щелока и 60 вес.долями порошкообразного силикагеля и смесь перемалывают в молотковой мельнице. Путем тонкого распределения смеси в 20000 вес.долях воды получают раствор для опрыскивания, который содержит 0,1 мас.% действующего вещества. Действующие вещества могут применяться как таковые в форме их композиций или же в приготовленной из них форме применения, например в форме подлежащих непосредственному распылению растворов, порошков, суспензий или дисперсий, эмульсий, масляных дисперсий, паст, дустов, препаратов для опудривания или гранул, путем опрыскивания, мелкокапельного опрыскивания, опыливания, опудривания или полива. Используемые формы зависят от цели применения, но во всех случаях должно быть обеспечено максимально тонкое распределение действующих веществ по изобретению. Используемые водные формы могут быть приготовлены из концентратов эмульсий, паст или смачиваемых порошков(порошки для разбрызгивания, масляные дисперсии) путем добавления воды. Для изготовления эмульсий, паст или масляных дисперсий вещества как таковые, или же растворенные в масле или растворителе, могут быть гомогенизированы в воде с помощью смачивающих агентов, активаторов адгезии, диспергаторов или эмульгаторов. Альтернативно, возможно приготовление концентратов, состоящих из действующего вещества, смачивающего агента, активатора адгезии, диспергатора или эмульгатора и, при необходимости, растворителя или масла, которые пригодны для разбавления водой. Концентрация действующего вещества в готовых к применению препаратах может варьироваться в значительных пределах. В общем, она составляет от 0,0001 до 10%, предпочтительно от 0,01 до 1%. Действующие вещества могут также с успехом применяться при особенно низких нормах расхода(ULV), причем имеется возможность использовать составы с более чем 95 мас.% действующего вещества или даже применять действующее вещество без добавок. К действующим веществам могут добавляться различного типа масла, гербициды, фунгициды, другие пестициды или бактерициды, в случае необходимости, также и непосредственно перед применением(смеси в баке). Эти средства могут примешиваться к соединениям по изобретению в весовом соотношении от 1:10 до 10:1. При использовании в форме фунгицидов соединения согласно изобретению могут содержаться вместе с другими действующими веществами, например гербицидами, инсектицидами, регуляторами роста, фунгицидами или же удобрениями. При смешивании соединений I или композиций, содержащих их в форме фунгицидных средств, с другими фунгицидами во многих случаях достигается расширение спектра фунгицидного действия. Нижеприведенный перечень фунгицидов, которые можно применять вместе с соединениями по изобретению, предназначен для иллюстрации возможности их комбинирования, однако, не налагает никаких ограничений: сера, дитиокарбонаты и их производные, такие как диметилдитиокарбамат железа(III), диметилдитиокарбамат цинка, этиленбисдитиокарбамат цинка, этиленбисдитиокарбамат марганца, этилендиаминбисдитиокарбамат марганца-цинка, дисульфид тетраметилтиурама, аммиачный комплекс цинк(N,Nэтиленбисдитиокарбамата), аммиачный комплекс цинк-(N,N'-пропиленбисдитиокарбамата), (N,N'-пропиленбисдитиокарбамат)цинка, N,N'-пропиленбис(тиокарбамоил)дисульфид; нитропроизводные, такие как динитро(1-метилгептил)фенилкротонат, 2-втор-бутил-4,6-динитрофенил-3,3-диметилакрилат, 2-втор-бутил-4,6-динитрофенилизопропилкарбонат, диизопропиловый эфир 5-нитроизофталевой кислоты; гетероциклические соединения, такие как 2-гептадецил-2-имидазолинацетат, 2,4-дихлор-6-(о-хлоранилино)-s-триазин, O,O-диэтилфталимидфосфонотиоат, 5-амино-1-[бис(диметиламино)фосфинил]-3-фенил-1,2,4-триазол, 2,3-дициано-1,4-дитиоантрахинон, 2-тио-1,3-дитиоло[4,5-b]хиноксалин, метиловый эфир 1-(бутилкарбамоил)-2-бензимидазолкарбаминовой кислоты, 2-метоксикарбониламинобензимидазол,2-(2-фурил)бензимидазол, 2-(4-тиазолил)бензимидазол, N-(1,1,2,2-тетрахлорэтилтио)тетрагидрофталимид,N-трихлорметилтиотетрагидрофталимид, N-трихлорметилтиофталимид, диметиламид 5-хлор-2-циано-4 п-толилимидазол-1-сульфоновой кислоты, N-дихлорфторметилтио-N',N'-диметил-N-фенилсульфодиамид,5-этокси-3-трихлорметил-1,2,3-тиадиазол, 2-тиоцианатометилтиобензотиазол, 1,4-дихлор-2,5-диметоксибензол, 4-(2-хлорфенилгидразоно)-3-метил-5-изоксазолон, пиридин-2-тиол-1-оксид, 8-гидроксихинолин или его медная соль, 2,3-дигидро-5-карбоксанилидо-6-метил-1,4-оксатиин, 2,3-дигидро-5-карбоксанилидо 6-метил-1,4-оксатиин-4,4-диоксид, 2-метил-5,6-дигидро-4 Н-пиран-3-карбоксанилид, 2-метилфуран-3 карбоксанилид, 2,5-диметилфуран-3-карбоксанилид, 2-хлор-N-(4'-хлорбифенил-2-ил)никотинамид, 2,4,5 триметилфуран-3-карбоксанилид, N-циклогексил-2,5-диметилфуран-3-карбоксамид, N-циклогексил-Nметокси-2,5-диметилфуран-3-карбоксамид, 2-метилбензанилид, 2-иодобензанилид, N-формил-N-морфолин 2,2,2-трихлорэтилацеталь, пиперазин-1,4-диилбис-1-(2,2,2-трихлорэтил)формамид, 1-(3,4-дихлоранилино)1-формиламино-2,2,2-трихлорэтан, 2,6-диметил-N-тридецилморфолин или его соли, 2,6-диметил-N-циклододецилморфолин или его соли, N-[3-(п-трет-бутилфенил)-2-метилпропил]-цис-2,6-диметилморфолин,N-[3-(п-трет-бутилфенил)-2-метилпропил]пиперидин, 1-[2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-ил-8 007150 этил]-1 Н-1,2,4-триазол, 1-[2-(2,4-дихлорфенил)-4-н-пропил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, N(н-пpoпил)-N-(2,4,6-тpиxлopфeнoкcиэтил)-N'-имидазолилмочевина, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н 1,2,4-триазол-1-ил)-2-бутанон, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанол, (2RS,3RS)1-[3-(2-хлорфенил)-2-(4-фторфенил)оксиран-2-илметил]-1 Н-1,2,4-триазол, -(2-хлорфенил)(4-хлорфенил)5-пиримидинметанол, 5-бутил-2-диметиламино-4-гидрокси-6-метилпиримидин, бис-(п-хлорфенил)-3-пиридинметанол, 1,2-бис-(3-этоксикарбонил-2-тиоуреидо)бензол, 1,2-бис-(3-метоксикарбонил-2-тиоуреидо) бензол,стробилмочевины, такие как азоксистробин, метилкрезоксим, метил-Е-метоксиимино-[-(2-феноксифенил)]ацетамид, метил-Е-метоксиимино-[-(2,5-диметилфенокси)-о-толил]ацетамид, пикоксистробин,пираклостробин, трифлоксистробин,анилинопиримидины, такие как N-(4,6-димeтилпиpимидин-2-ил)aнилин, N-[4-метил-6-(1-пропинил) пиримидин-2-ил]анилин, N-[4-метил-6-циклопропилпиримидин-2-ил]анилин,фенилпирролы, такие как 4-(2,2-дифтор-1,3-бензодиоксол-4-ил)пиррол-3-карбонитрил,амиды коричной кислоты, такие как морфолид 3-(4-хлорфенил)-3-(3,4-диметоксифенил)акриловой кислоты, морфолид 3-(4-фторфенил)-3-(3,4-диметоксифенил)акриловой кислоты,а также различные фунгициды, такие как додецилгуанидинацетат, 3-[3-(3,5-диметил-2-оксициклогексил)-2-гидроксиэтил]глутаримид, гексахлорбензол, метил N-(2,6-диметилфенил)-N-(2-фуроил)-DLаланинат, метиловый эфир DL-N-(2,6-диметилфенил)-N-(2'-метоксиацетил)аланина, N-(2,6-диметилфенил)-N-хлорацетил-D,L-2-аминобутиролактон, метиловый эфир DL-N-(2,6-диметилфенил)-N-(фенилацетил)аланина, 5-метил-5-винил-3-(3,5-дихлорфенил)-2,4-диоксо-1,3-оксазолидин, 3-[3,5-дихлорфенил 5-метил-5-метоксиметил]-1,3-оксазолидин-2,4-дион, 3-(3,5-дихлорфенил)-1-изопропилкарбамоилгидантоин,N-(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2-дикарбоксимид, 2-циано-[N-(этиламинокарбонил)-2 метоксиимино]ацетамид, 3,5-дихлор-N-(3-хлор-1-этил-1-метил-2-оксопропил)-4-метилбензамид, 1-(3 бром-6-метокси-2-метилфенил)-1-(2,3,4-триметокси-6-метилфенил)метанон, 1-[2-(2,4-дихлорфенил)пентил]1 Н-1,2,4-триазол, 2,4-дифтор(1 Н-1,2,4-триазолил-1-метил)бензгидриловый спирт, N-(3-хлор-2,6-динитро 4-трифторметилфенил)-5-трифторметил-3-хлор-2-аминопиридин, 1-бис-(4-фторфенил)метилсилил)метил)1 Н-1,2,4-триазол. Примеры синтеза При надлежащей модификации исходных соединений протоколы, приведенные в нижеследующих примерах синтеза, были использованы для получения соединений I. Полученные соединения вместе с их физическими характеристиками приведены в табл. I далее. Пример 1. Получение 5,7-дигидрокси-6-(2,6-дифторфенил)-[1,2,4]триазоло[1,5-а]пиримидина. Смесь 3-амино-1,2,4-триазола (14 г), диэтилового эфира (2,6-дифторфенил)малоновой кислоты(0,17 моль, см. ЕР-А 10 02 788) и трибутиламина (50 мл) нагревали при температуре около 180 С в течение 6 ч. Реакционную смесь охлаждали до температуры примерно 70 С. Прибавляли 200 мл 10% водного раствора гидроксида натрия и реакционную смесь перемешивали в течение 30 мин. Фазы разделяли,водную фазу экстрагировали диэтиловым эфиром. Затем водную фазу подкисляли. Осадок отфильтровывали и высушивали с получением 40 г указанного в заглавии соединения. Пример 2. Получение 5,7-дихлор-6-(2,6-дифторфенил)-[1,2,4]триазоло[1,5-а]пиримидина. Смесь 5,7-дигидрокси-6-(2,6-дифторфенил)-[1,2,4]триазоло[1,5-а]пиримидина (30 г, полученного в примере 1) и оксихлорида фосфора (50 мл) кипятили в течение примерно 8 ч. Оксихлорид фосфора частично отгоняли. Остаток выливали в смесь дихлорметана и воды. Органический слой отделяли, сушили и фильтровали. Фильтрат концентрировали в вакууме с получением 28 г указанного в заглавии соединения с т.пл. 121 С. Пример 3. Получение 5-хлор-6-(2,6-дифторфенил)-7-изопропиламино[1,2,4]триазоло[1,5-а]пиримидина [I-3]. Смесь изопропиламина (1,5 ммоль), триэтиламина (1,5 ммоль) и дихлорметана (10 мл) прибавляли при перемешивании к смеси 5,7-дихлор-6-(2,6-дифторфенил)-[1,2,4]триазоло[1,5-а]пиримидина (1,5 ммоль,полученного в примере 2) и дихлорметана (20 мл). Реакционную смесь перемешивали в течение примерно 16 ч при температуре от примерно 20 до 25 С и потом промывали разбавленной соляной кислотой(5%). Органический слой отделяли, сушили и фильтровали. Фильтрат упаривали при пониженном давлении и остаток подвергали хроматографической очистке с получением 0,43 г указанного в заглавии соединения с т.пл. 169 С. Пример 4. Получение 5-циано-6-(2,6-дифторфенил)-7-(4-метилпиперидин-1-ил)-[1,2,4]триазоло[1,5 а]пиримидина [I-18]. Смесь 5-хлор-6-(2,6-дифторфенил)-7-(4-метилпиперидин-1-ил)-[1,2,4]триазоло[1,5-а]пиримидина(0,1 моль; I-4) и цианида тетраэтиламмония (0,25 моль) в 750 мл диметилформамида (DMF) (750 мл) перемешивали в течение 16 ч при температуре от примерно 20 до 25 С. К этой смеси прибавляли воду и метил-трет-бутиловый эфир (МТВЕ), органическую фазу отделяли, промывали водой, сушили и фильтровали. Фильтрат упаривали и остаток подвергали хроматографической очистке с получением 6,95 г указанного в заглавии соединения с т.пл. 212 С.I-6) в 400 мл сухого метанола прибавляли 30% раствор метанолата натрия (71,5 ммоль) при температуре от примерно 20 до 25 С. Эту смесь в дальнейшем перемешивали в течение 16 ч. Метанол отгоняли и остаток растворяли в дихлорметане. Органическую фазу промывали водой, сушили и фильтровали. Фильтрат упаривали и остаток подвергали хроматографической очистке с получением 16,3 г указанного в заглавии соединения с т.пл. 153 С. Таблица I Примеры действия против фитопатогенных вредных грибов Фунгицидное действие соединений формулы I демонстрируется в следующих экспериментах. Из действующих веществ, взятых отдельно или вместе, была составлена рецептура в виде 10% эмульсии в смеси с 70 вес.% циклогексанона, 20 вес.% Nekanil LN (Lutensol AP6, смачивающий агент,проявляющий действие эмульгатора и диспергатора, на основе этоксилированных алкилфенолов) и 10 вес.%Wettol ЕМ (неионогенный эмульгатор на основе этоксилированного касторового масла) и разбавлена водой до требуемой концентрации. Испытание биологической активности - фунгицидное действие на ранних стадиях заболевания томатов (Alternaria solani). Молодую рассаду томатов сорта "Grое Fleischtomate St.Pierre" выращивали в горшках до стадии 24 листка. Эти растения опрыскивали избыточным количеством водной суспензии, содержащей действующее вещество в концентрации, упомянутой в таблице ниже, при этом суспензию готовили из стандартного раствора, содержащего 10% действующего вещества, 85% циклогексанона и 5% эмульгатора. На следующий день обработанные растения инокулировали водной суспензией спор Alternaria solani,содержащей 0,2 х 106 спор на мл. Затем опытные растения немедленно переносили в увлажнительную камеру. Через 6 дней после выдержки при температуре от 20 до 23 С и относительной влажности, близкой к 100%, визуально оценивали степень поражения грибками листьев как % пораженного участка листьев.- 10007150 В этом испытании растения, которые были обработаны 250 мил.дол. соединений от I-2 до I-9, I-11,I-12, I-14, I-15 и I-17, показали инфицированность не более чем 1%, в то время как необработанные растения были инфицированы до 90%. Активные соединения А и В, известные из WO-A 98/46608, служили в качестве сравнительных активных соединений: Сравнительный опыт - действие на серую гниль (Botrytis cinerea) на срезах плодов зеленого перца. Срезы плодов зеленого перца опрыскивали избыточным количеством водной суспензии, содержащей действующее вещество, при этом суспензию готовили из стандартного раствора, содержащего 10% действующего вещества, 85% циклогексанона и 5% эмульгатора. Через 2 ч напыленный слой высушивали, срезы инокулировали суспензией спор Botrytis cinerea, содержащей 1,7 х 106 спор на мл в 2 вес.% водном растворе биосолода. Инфицированные срезы плодов затем инкубировали в камерах с высокой влажностью в течение 4 дней при температуре 18-20 С. Затем визуально оценивали в процентах степень поражения грибком площади срезов плодов. В этом испытании растения, которые были обработаны 500 мил.дол. соединений I-2, I-8 и I-14, соответственно, показали инфицированность не более чем 3%, в то время как растения, обработанные 500 мил.дол. сравнительных соединений А и В, соответственно, были инфицированы до 100 и 20%, а необработанные растения были инфицированы до 100%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 6-(2,6-Дифторфенил)триазолопиримидины формулы I в которой R1 и R2 независимо означают водород или C1-С 10-алкил, C2-С 10-алкенил, C3-С 10 циклоалкил или фенил, который может нести от одной до трех групп Ra, илиR1 и R2 вместе с находящимся между ними атомом азота представляют собой 5- или 6-членное гетероциклическое кольцо, которое может дополнительно содержать 1 атом серы или кислорода и которое может быть замещено радикалами Ra в количестве от одного до трех; где Ra означает C1-С 6-алкил или C1-С 4-алкилендиокси; и Х означает галоген, циано или C1-С 6-алкокси. 2. Соединения формулы I по п.1, в которыхR1 означает линейный или разветвленный C1-С 6-алкил, С 2-С 6-алкенил или С 3-С 9-циклоалкил, иR2 означает водород или C1-С 6-алкил, илиR1 и R2 вместе с находящимся между ними атомом азота представляют собой гетероциклическое кольцо с 5 или 6 атомами углерода, которое необязательно замещено одной или двумя C1-С 6-алкильными группами. 3. Соединения по п.1 или 2, в которых R2 означает водород. 4. Соединения по любому из пп.1-3, в которых Х означает галоген. 5. Способ получения соединений формулы I, определенных в п.4, который заключается во взаимодействии 5,7-дигалоген-6-(2,6-дифторфенил)триазолопиримидинов формулы II в которой R1 и R2 являются такими, как определено для формулы I, для получения соединений формулы I. 6. Композиция для борьбы с фитопатогенными грибами, содержащая твердый или жидкий носитель и соединение формулы I по п.1. 7. Способ борьбы с фитопатогенными грибками, который заключается в обработке грибков или материалов, растений, почвы или семян, которые подлежат защите от грибков, эффективным количеством соединения формулы I по п.1.
МПК / Метки
МПК: C07D 487/04, A01N 43/90
Метки: 6-(2,6-дифторфенил)триазолопиримидины
Код ссылки
<a href="https://eas.patents.su/13-7150-6-26-diftorfeniltriazolopirimidiny.html" rel="bookmark" title="База патентов Евразийского Союза">6-(2,6-дифторфенил)триазолопиримидины</a>









