Липосомная композиция
Формула / Реферат
1. Липосомная композиция, отличающаяся тем, что она содержит
эфирное масло цитрусового типа (Aurantioideae) фармацевтического сорта - 0,5-5,0 мас.ч.;
лавандовое масло фармацевтического сорта - 0,5-5,0 мас.ч.;
витамин E - 0,1-1,5 мас.ч.;
витамин A - 0,1-1,5 мас.ч.;
этоксилированное касторовое масло - 1,0-6,0 мас.ч.;
фосфолипид - 0,1-1,0 мас.ч.;
дистиллированная вода - 15-30 мас.ч.;
этанол 96% - 65-75 мас.ч.
2. Композиция по п.1, отличающаяся тем, что она содержит 1,5 мас.ч. эфирного масла цитрусового типа.
3. Композиция по п.1, отличающаяся тем, что она содержит 2,0 мас.ч. лавандового масла.
4. Композиция по п.1, отличающаяся тем, что она содержит 0,5 мас.ч. витамина E.
5. Композиция по п.1, отличающаяся тем, что она содержит 0,5 мас.ч. витамина A.
6. Композиция по п.1, отличающаяся тем, что она содержит 0,5 мас.ч. фосфолипида.
7. Композиция по п.1, отличающаяся тем, что она содержит 3,5 мас.ч. этоксилированного касторового масла.
8. Композиция по п.1, отличающаяся тем, что она содержит 23 мас.ч. дистиллированной воды.
9. Композиция по п.1, отличающаяся тем, что она содержит 68 мас.ч. этилового спирта.
10. Композиция по п.1, отличающаяся тем, что она содержит лимонное масло в качестве эфирного масла цитрусового типа.
11. Композиция по п.1, отличающаяся тем, что она содержит соевый лецитин в качестве фосфолипида.
12. Способ получения композиции по п.1, отличающийся тем, что к смеси 0,5-5,0 мас.ч. эфирного масла цитрусового типа и 0,5-5,0 мас.ч. лавандового масла добавляют смесь 0,1-1,0 мас.ч. витамина E и 0,1-1,5 мас.ч. витамина A, затем добавляют 1,0-6,0 мас.ч. этоксилированного касторового масла, в полученной масляной фазе растворяют 0,1-1,0 мас.ч. фосфолипида и
а) путем добавления 15-30 мас.ч. дистиллированной воды с температурой 45°C образуют липосомную гидрофильную фазу, которую превращают в липосомную липофильную композицию путем обращения фаз, вызываемого добавлением 65-75 мас.ч. 96% этанола, или
б) путем добавления 65-75 мас.ч. 96% этанола образуют липосомную липофильную фазу, которую превращают в липосомную гидрофильную композицию путем обращения фаз, вызываемого добавлением 15-30 мас.ч. дистиллированной воды с температурой 45°C.
13. Способ по п.12, отличающийся тем, что композицию получают путем гидрофильно-липофильного обращения фаз.
14. Применение композиции по п.1 для лечения кожных повреждений.
15. Применение по п.14 для лечения раневых, ожоговых, обмороженных, инфицированных кожных поверхностей.
Текст
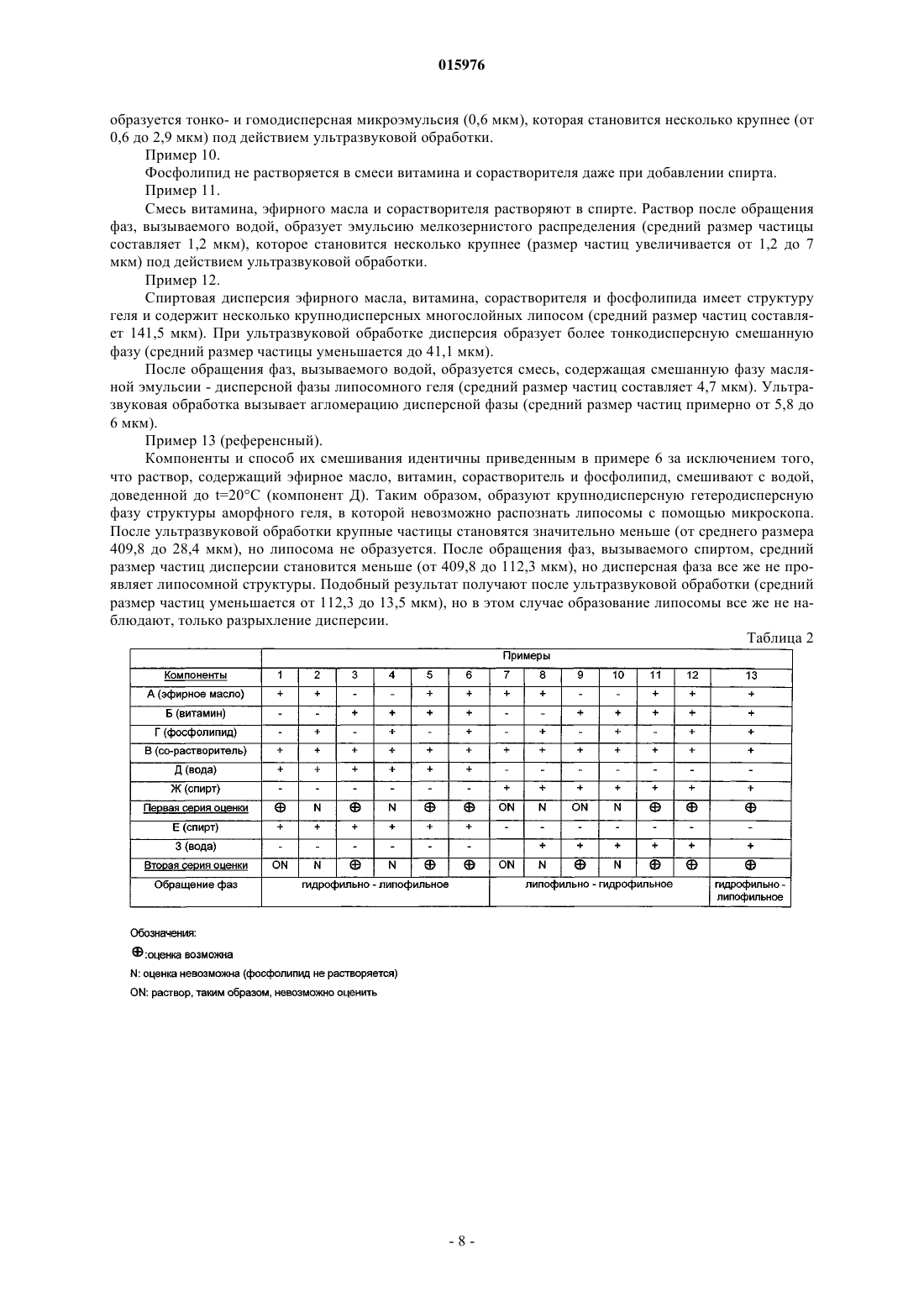
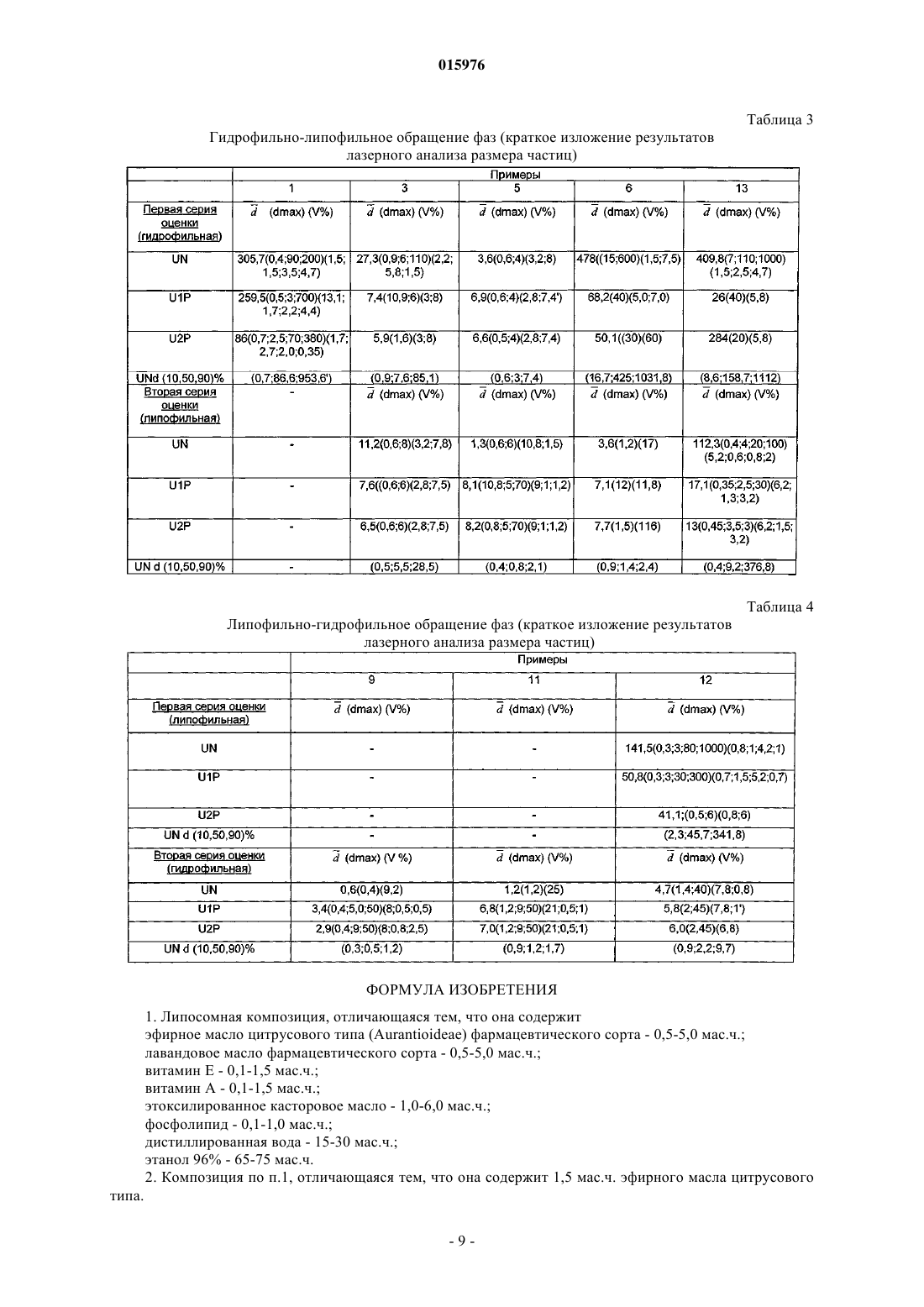
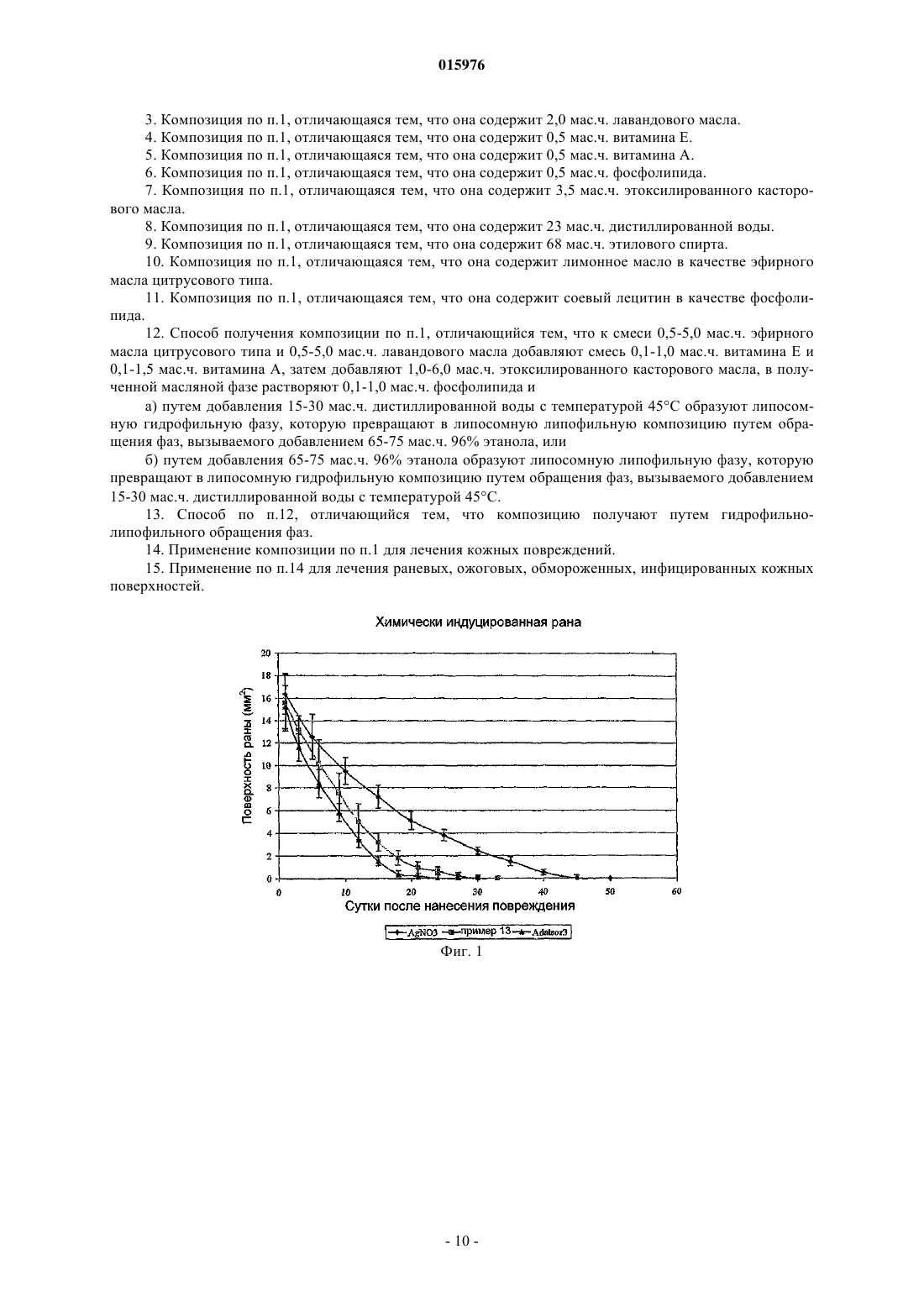
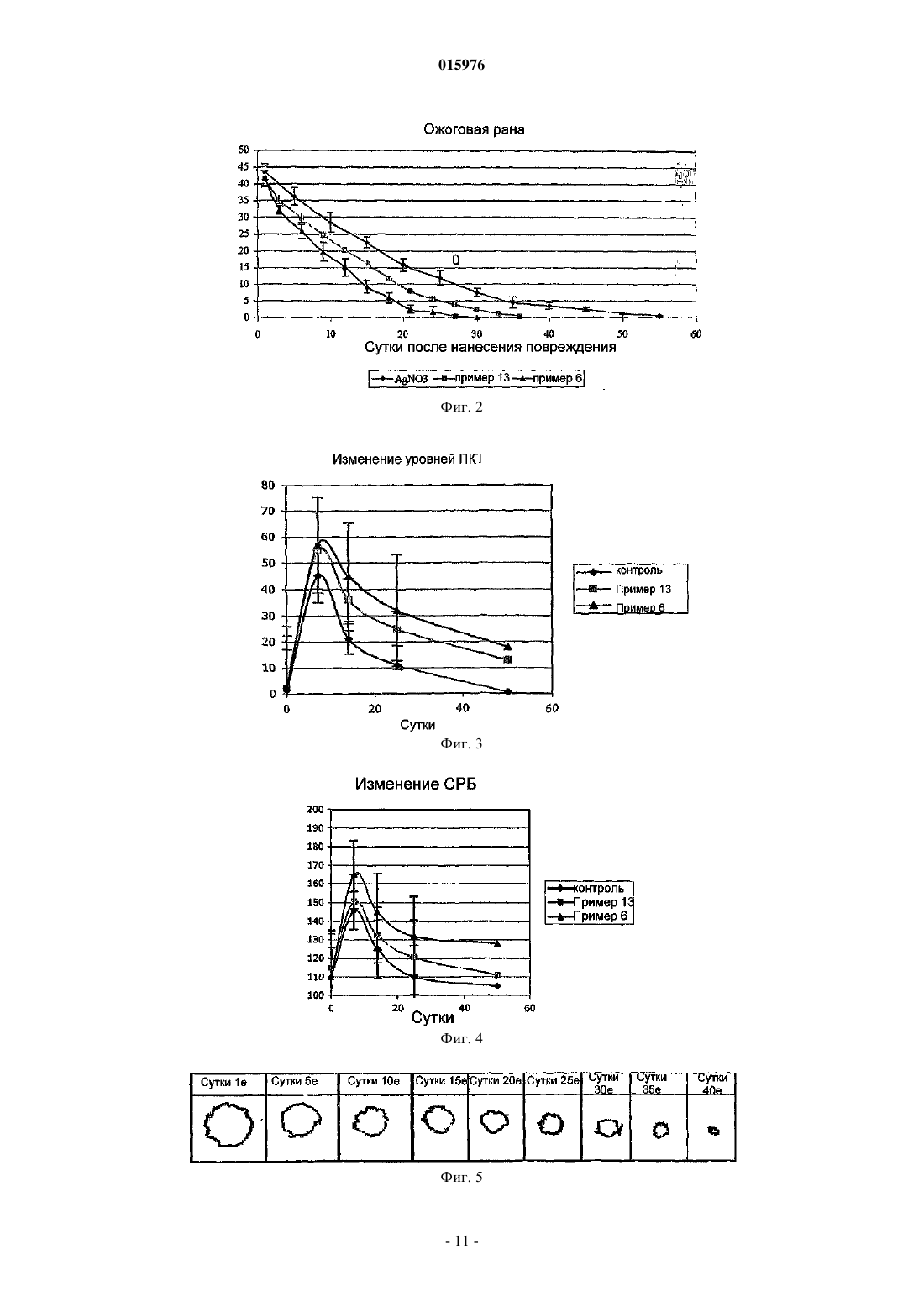
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Изобретение относится к липосомной композиции, содержащей 0,5-5,0 мас.ч. эфирного масла цитрусового типа (Aurantioideae) фармацевтического сорта; 0,5-5,0 мас.ч. лавандового масла фармацевтического сорта; 0,1-1,5 мас.ч. витамина E; 0,1-1,5 мас.ч. витамина A; 1,0-6,0 мас.ч. этоксилированного касторового масла; 0,1-1,0 мас.ч. фосфолипида; 15-30 мас.ч. дистиллированной воды; 65-75 мас.ч. этанола 96%. Эту композицию можно применять для обработки раневых,ожоговых, обмороженных, инфицированных кожных поверхностей.(71)(73) Заявитель и патентовладелец: ИНВЕНЦИО-21 ДЬДЬХАТАШУ КЕСИТМЕНЬЕКЕТ ДЬЯРТО КФТ 015976 Настоящее изобретение относится к липосомной композиции, содержащей эфирные масла и витамины. Известно, что о применении лекарственных средств и лечебных композиций либо натурального происхождения, либо полученных синтетическим путем спорят с 19 века. Несмотря на дебаты, фактом является то, что фармакопеи развитых стран содержат несколько зарегистрированных композиций,имеющих активный ингредиент растительного происхождения. К настоящему времени эти дебаты привели врачей к принятию таких фактов, что композиции натурального, прежде всего растительного происхождения выпускаются в продажу во все возрастающем количестве. Применение композиций, получаемых из веществ природного происхождения, известно еще с начала истории человечества. Многие вещества, обнаруживаемые в частях растений, можно рассматривать в качестве активного ингредиента только тогда, когда их применяют в концентрированном состоянии. В этом смысле белки,углеводы, растительные жиры, витамины, находящиеся в растениях, сами по себе не могут рассматриваться в качестве активных ингредиентов. Существенный аспект выбора эффективного вещества состоит в том, является ли эффективное вещество однородным соединением, либо комбинацией нескольких сходных соединений, либо смесью экстрактов многих различных лекарственных средств (соединений). Порядок важности аспектов выбора определяется терапевтической ценностью, технологическими возможностями и экономическими соображениями. Технологии экстракции эффективных растительных веществ основаны на физических операциях. В некоторых специальных случаях ценные вещества экстрагируют путем химического процесса из концентратов, полученных с помощью физических процессов, с последующими дополнительными манипуляциями физического разделения. После сбора лекарственного растения и удаления частей растения, не содержащих лечебных веществ, применяют процессы высушивания, нарезания, измельчения или выжимки. Процесс выжимки предполагают для экстракции масляной (липофильной) фазы из подходящих частей растения. Путем экстракции, проводимой водой, спиртом или редко маслом, разделяют вещества гидрофильного и гидрофобного (липофильного) характера. Вещество, полученное путем экстракционных операций (экстракт), концентрируют и/или очищают с помощью дополнительных физических способов или их комбинации. В большинстве случаев они включают выпаривание, перегонку или перегонку с водяным паром. Вещества, не растворимые в спирте, можно осаждать путем добавления спирта к водному экстракту. Путем выпаривания настоек спиртовых экстрактов можно получать масла. Эти масла можно перегонять в целях достижения дополнительной очистки или разделения (фракционирования). Перегонка с водяным паром представляет собой специальный процесс, с помощью которого могут быть отделены наиболее ценные компоненты растительных масел: маслорастворимые соединения. С помощью этого процесса можно экстрагировать вплоть до 30-50% эффективных веществ. Эфирные масла или их концентраты являются наиболее хорошо известными активными веществами растительного происхождения в химии, фармацевтике, технологии. Они получили свое собирательное название благодаря их свойству, что после их выпаривания не остается никакого остатка. Они представляют собой интенсивно испаряющиеся вещества, обладающие сильным ароматом. Почти все из них могут свободно смешиваться друг с другом. Почти все из них можно свободно разбавлять жирами, растительными маслами. Эфирные масла могут быть выделены из соответственно выбранной части растения с помощью перегонки с водяным паром, холодного отжима, спиртовой экстракции (примерно 75% с помощью перегонки с водяным паром, 20% спиртовой экстракт, 5% масло холодного отжима). На рынке существует примерно 100 типов эфирных масел, из которых примерно 50 типов применяют в ароматерапии, терапии запахами. 10-20 типов масел являются зарегистрированными продуктами в государственных фармакопеях для лекарственной терапии человека. (В некоторых фармакопеях Дальнего Востока зарегистрировано более 20 активных веществ.) Они проявляют свой физиологический эффект в 2-50 мг однократной, 10-500 мг суточной дозах. В зависимости от географических условий и культур их часто применяют в препаратах для личной гигиены и в косметических препаратах. Авторы изобретения сравнили терапевтический эффект 14 эфирных масел на кожу человека (в случае 8 показаний: воспаление, регенерация, экзема, выпадение волос, микоз стоп, полосы после беременности (растяжки), целлюлит, герпес). Результаты суммированы в табл. 1."Эффект на кожу отдельно" означает число показаний из 8 показаний, при которых данное эфирное масло обладает эффектом само по себе."Эффект на кожу в смеси" означает число дополнительных показаний из 8 показаний, при которых данное эфирное масло обладает эффектом в комбинации с другим эфирным маслом.+: данное эфирное масло обладает снижающим эффектом.-: данное эфирное масло неэффективно.+: данное эфирное масло обладает ингибирующим эффектом.-: данное эфирное масло неэффективно.-: неэффективно. В табл. 1 показано, что лимонное масло и лавандовое масло обладают наиболее разносторонними терапевтическими эффектами на кожу. Лавандовое масло может быть получено из свежей цветущей верхней части растения Lavandula angustifolia путем перегонки с водяным паром с последующей подходящей очисткой. Содержание эфирного масла растения составляет 1%. Фармакопейное качество: Lavandulae Aetheroleum. Идентифицированные компоненты в соответствии с европейской фармакопеей 4.1: линалилацетат - 25-46%; линалоол - 20-45%; терпинен-4-ол - макс. 6%; а также компоненты лимонен, цинеол, камфара, лавандулилацетат, лавандулол, -терпинеол, 3-октанон - от нескольких тысячных до макс. 2,5%. Согласно венгерской фармакопее VII (Ph. Hg. VII) оно должно содержать линалоол и эфир линалоола и уксусной кислоты в количестве 35-60%. В фармакопеях для масел, которые можно применять, даны несколько физических параметров(плотность, показатель преломления, вращение плоскости поляризации света и т.д.). В ароматерапии лавандовое масло является универсальным эфирным маслом, применяемым в широчайшей области показаний, используемым с давних времен. Его применяют для лечения любой раны, особенно такой, которая длительно заживает, воспалена, гноится; обожженной, изъязвленной, экзематозной кожной поверхности и кожи с солнечными ожогами. В специальных фармакопеях допустимая суточная терапевтическая доза составляет 70-300 мг. Лимонное масло выжимают в холодном состоянии из кожуры свежего плода Citrus medica L. ssp.limonon. Данная часть растения содержит 1,5% эфирного масла. Идентифицированные компоненты согласно европейской фармакопее 4.1: лимонен - 56-78%, -пирен - 7-17%, -терпинен - 6-12%, нераль, нераля ацетат (цитраль B) - 0,3-2 015976 1,5%, гераналь, гераналя ацетат - 1-2,3% (цитраль A), сабинен, -cariofeilмакс. 3%. Согласно венгерской фармакопее VII (Ph. Hg. VII) компонент цитраля должен составлять 3-6%. Как и в случае лавандового масла, в фармакопеях для применения лимонного масла указаны физические параметры. Применение лимонного масла в ароматерапии обладает двумя специальными свойствами. Данное масло представляет собой единственный тип масла среди масел, применяемых во всем мире, который получают путем холодной выжимки (без помощи нагревания) из шести представителей семейства цитрусовых [лимона (Citrus limonum), апельсина [Citrus aurantium eulcia), мандарина (Citrusmadiurensis), грейпфрута или помпельмуса (Citrus maxima), лиметты (Citrus aurantifolia Swingle), бергамота (Citrus aurantium). В эфирном масле, выжатом из кожуры свежих плодов растений, принадлежащих к данному растительному семейству, можно обнаружить одни и те же химические вещества и примерно в одинаковом соотношении. В ароматерапии применение лимонного масла было предложено для многих показаний. Заявлены превосходные активности как для кожи, так и в отношении бактерий, грибов и вирусов. Эти свойства также были описаны для паров эфирного масла. Согласно одному описанию 210 бактериальных культур, включающих 12 плесневых грибов и культуру стафилококка, подвергали воздействию пара эфирного масла, и через 15 мин только 14, через полчаса только 4 бактериальные культуры оставались живыми. Все культуры плесневых грибов и стафилококка были уничтожены. Согласно другому описанию пары эфирного масла уничтожали менингококк за 15 мин, возбудителя тифа за 1 ч, пневмококк за 2-3 ч, Steptococcus hemolyticus за 3-12 ч. Посредством прямого контакта эфирное масло уничтожало стафилококк и возбудитель тифа за 5 мин, возбудитель дифтерии за 20 мин. Французские источники (Griffoln, Rochix and Morel). Как и в случае лавандового масла, были описаны эффекты заживления ран, противовоспалительный, гемостатический эффекты, эффект заживления гнойных ран и применение для лечения обморожений. В фармакопеях допущены суточные терапевтические дозы 60-120 мг. Биологическая активность витаминов известна. Прежде всего, в малых дозах они играют физиологическую роль в предупреждении патологических процессов, а также при ускорении выздоровления и реабилитации. Таким образом, витамин A повышает устойчивость кожи и слизистой оболочки; ускоряет заживление язв; регулирует функцию сальных желез; защищает эпителий и повышает его устойчивость к инфекциям. Витамин E усиливает эффект витамина A; ингибирует грубое рубцевание; ускоряет заживление ожога; обладает сосудорасширяющим, антикоагулянтным эффектом и является антиоксидантом. Лецитины (фосфатидилхолин, фосфоглицерид холина) являются важными компонентами органических строительных блоков мира живых организмов. Основными элементами лецитинов являются молекулы глицерина, фосфорной кислоты и молекулы жирных кислот. В связи с вариабельностью групп жирных кислот можно синтезировать большое число соединений. В живом мире лецитин в наибольшей степени содержится в сое и яйцах. Молекула лецитина обладает гидрофильным характером благодаря структуре группы фосфорной кислоты (в форме свободной кислоты или соли) и липофильным характером благодаря присутствию жирной кислоты (липида). Этот двойной признак обеспечивает значительные физические, химические и биологические эффекты. Молекулы лецитина образуют хорошо упорядоченную структуру (мицеллы) сами по себе (уменьшение межфазного натяжения) и путем связывания друг с другом. При образовании этой хорошо упорядоченной структуры гидрофильно-липофильный характер среды, окружающей лецитин, играет важную роль. Форма и размер этих хорошо упорядоченных структур зависит от химической структуры лецитина и среды, в которой они образуются. Согласно наиболее оригинальной аналогии "лецитины являются поверхностно-активными веществами живого мира". Из мицелл в результате образования замкнутой структуры можно получить липосому. Подобно синтетическим поверхностно-активным веществам хорошо упорядоченные структуры способны заключать в себе инородные вещества. Это часто подразумевает не только физическую упорядоченность, но также образование связи между лецитином и инородным веществом, где степень и тип связи зависят от химических, поверхностных, физико-химических свойств инородного вещества. Конфигурация лецитина на плоскости является слоистой, но в дополнительном пространственном расположении лецитин может образовать множество геометрических форм. Простейшей структурой является слоистая структура. Эти структуры могут создать один слой или более одного в зависимости от того, насколько хорошо они упорядочены.-3 015976 Они представляют собой так называемые малые монослойные везикулы (ММВ); крупные монослойные везикулы (КМВ); мультиламеллярные многослойные (ММЛ) липосомы. При получении таких липосом можно использовать то, что в подходящих условиях (в зависимости от структуры, pH, температуры и полярности среды) липиды приходят в переходное жидкокристаллическое состояние. В результате достижения этого переходного состояния можно образовать липосому. Целью способов получения также является достижение этого переходного состояния. Соответственно, процесс включения "инородного вещества" в лецитиновую липосому является сложным и зависит от многих параметров. Типичные способы получения липосом: растворение компонентов в растворителе, выпаривание растворителя, затем образование липосом путем гидратации; изменение полярности растворителя; обработка ультразвуком (полумеханическая); эмульсионный способ с изменением полярности среды; диализ. Особая биологическая активность инородного вещества, заключенного в липосому, основана на том факте, что строение организма и липосомы имеет сходную структуру. Эта сходная структура дает возможность избирательного "нацеливания"; непосредственного направления к мишени. Инородное вещество, заключенное в липосому, способно проявлять свой эффект избирательно или на более высоком уровне активности. Использование этого наблюдения может открыть новые перспективы для применения липосом из веществ, которые сами по себе известны. Объектом настоящего изобретения является включение двух веществ (эфирного масла, витамина),охарактеризованных в липосоме в качестве "инородных веществ", в особую структуру липосомы. Объектом данного изобретения, в частности, является липосомная композиция, отличающаяся тем,что она содержит нижеследующие компоненты: эфирное масло цитрусового типа (Aurantioideae) фармацевтического сорта - 0,5-5,0 мас.ч.; лавандовое масло фармацевтического сорта - 0,5-5,0 мас.ч.; витамин E - 0,1-1,5 мас.ч.; витамин A - 0,1-1,5 мас.ч.; этоксилированное касторовое масло - 1,0-6,0 мас.ч.; фосфолипид - 0,1-1,0 мас.ч.; дистиллированная вода - 15-30 мас.ч.; этанол 96% - 65-75 мас.ч. Композиция согласно изобретению содержит независимо предпочтительно 1,5 мас.ч. эфирного масла цитрусового типа; 2,0 мас.ч. лавандового масла; 0,5 мас.ч. витамина E; 0,5 мас.ч. витамина A; 0,5 мас.ч. фосфолипида; 3,5 мас.ч. этоксилированного касторового масла; 23 мас.ч. дистиллированной воды; 68 мас.ч. этанола 96%. Композиция согласно изобретению содержит независимо предпочтительно лимонное масло в качестве эфирного масла цитрусового типа, лецитин в качестве фосфолипида. В композиции согласно изобретению этоксилированное касторовое масло содержит предпочтительно 30-40 моль, более предпочтительно 35 моль оксида этилена. Композиция согласно изобретению может быть получена приведенным ниже путем: к смеси 0,5-5,0 мас.ч. эфирного масла цитрусового типа и 0,5-5,0 мас.ч. лавандового масла добавляют смесь 0,1-1,0 мас.ч. витамина Е и 0,1-1,5 мас.ч. витамина A, затем добавляют 1,0-6,0 мас.ч. этоксилированного касторового масла, в полученной масляной фазе растворяют 0,1-1,0 мас.ч. фосфолипида и путем добавления 15-30 мас.ч. дистиллированной воды с температурой 45C образуют липосомную гидрофильную фазу,которую превращают в липосомную липофильную композицию путем обращения фаз, вызываемого добавлением 65-75 мас.ч. 96% этанола, или путем добавления 65-75 мас.ч. 96% этанола образуют липосомную липофильную фазу, которую превращают в липосомную гидрофильную композицию путем обращения фаз, вызываемого добавлением 15-30 мас.ч. дистиллированной воды с температурой 45C. Композицию согласно изобретению предпочтительно получают путем гидрофильно-липофильного обращения фаз. Композицию согласно изобретению можно применять для лечения кожных повреждений, таких как раневые, ожоговые, обмороженные или инфицированные кожные поверхности, более эффективно, чем-4 015976 композиции, имеющиеся в продаже. Композиции примера 6 (липосомный препарат) и примера 13 (не липосомный препарат) и AgNO3 (в качестве сравнительной группы) тестировали в случае заживления открытой раны у крыс в нижеследующих моделях. 1. Химически инициированная рана (язва, уксусная кислота). 2. Ожоговые раны. 3. Диабетическая рана. Методики. Всю работу (содержание животных, эксперименты, эвтаназию, уничтожение) проводили, по существу, в соответствии с Международными руководящими принципами биохимических исследований с вовлечением животных, как предусмотрено Европейским советом (Директива 86/609/ЕЭС). Химически инициированная рана. Экспериментальная кожная язва была инициирована путем внутрикожной инъекции уксусной кислоты. Инъекция ледяной уксусной кислоты в кожу в предплюсну левой задней лапы крыс приводила в результате к некрозу кожи, и кожная язва развивалась за 3 суток. Площадь язвы достигала своего пика(примерно 15 мм 2) на 5-е сутки, и она была некротизированной. Она восстанавливалась до контрольного уровня в течение 6 недель. 30 крыс делили на 3 группы. Каждая группа содержала 10 животных. После химического индуцирования язв в соответствии с вышеописанной методикой, каждую крысу помещали в индивидуальную клетку. Группа 1. 10 крыс обрабатывали дважды в сутки 3,5 мг композиции примера 6. Группа 2. 10 крыс обрабатывали дважды в сутки 3,5 мг композиции примера 13. Группа 3. 10 крыс обрабатывали таким же количеством 1,5% раствора AgNO3 (контроль).Животных обрабатывали с помощью спрея 4 воздействиями с расстояния 5 см. Доза была вычислена на основании активного ингредиента, доставляемого на поврежденную поверхность. Из каждой группы на 7, 14 и 21 сутки одну крысу умерщвляли для гистопатологического исследования. На 50-е сутки умерщвляли остальных крыс из каждой группы. Умерщвление крыс проводили, используя передозировку пентобарбитала натрия. В течение 50 суток всех животных оценивали на следующие параметры заживления: образование струпа, воспаление, образование грануляционной ткани и восстановление эпителизации. На фиг. 1 показано излечение после химически индуцированной раны. Результат. Обе обработанные группы животных давали существенно более быструю регенерацию по сравнению с контролем. Липосомный препарат более эффективен в таком же диапазоне концентраций. Ожоговые раны. Каждое животное анестезировали пентобарбиталом натрия, вводимым интраперитонеально (5 мг/25 г). Шерсть на спине выстригали ножницами для животных. Животное помещали на спину на устройство для прижигания. Десяти секунд воздействия было достаточно для получения глубокого ожога. После извлечения из воды спину быстро высушивали путем оборачивания в полотенце и животное освобождали и помещали в индивидуальную клетку. Такая методика дает однородный ожог площадью примерно 40 мм 2 с острыми краями. 30 крыс делили на 3 группы. Каждая группа содержала 10 животных. После нанесения ожога крысам в соответствии с вышеописанной методикой каждую крысу помещали в индивидуальную клетку. Группа 1. 10 крыс обрабатывали дважды в сутки 3,5 мг композиции примера 6. Группа 2. 10 крыс обрабатывали дважды в сутки 3,5 мг композиции примера 13. Группа 3. 10 крыс обрабатывали таким же количеством 1,5% раствора AgNO3 (контроль).Животных обрабатывали с помощью спрея 4 воздействиями с расстояния 5 см. Доза была вычислена на основании активного ингредиента, доставляемого на поврежденную поверхность. На 7, 14, 25 и 50 сутки после нанесения ожога животных умерщвляли передозировкой пентобарбитала натрия и брали образцы кожи для гистопатологического исследования и кровь для исследования на прокальцитонин (ПКТ) и для определения C-реактивного белка (СРБ). Уровень ПКТ определяли на автоматическом хемилюминесцентном оборудовании LIAISON, используя иммунологический анализ на ПКТ компании Brahms (Brahms PCT immunoassay).C-реактивный белок измеряли в соответствии с Hutchinson et al., Clin. Chem. 2000; 46:934-8. В ходе микроскопических и макроскопических наблюдений оценивали четыре параметра заживле-5 015976 ния раны: образование струпа, восстановление эпителизации, образование грануляционной ткани и воспаление. Результаты. Между группами отсутствовали значимые различия в образовании струпа. Но противовоспалительный эффект в процессе заживления раны был более выраженным в группах 1 и 2. Грануляционная ткань выражено развивалась в группах 1 и 2. Восстановление эпителизации в срединной части ожоговых ран было более быстрым для всех крыс групп 1 и 2 по сравнению с контролемAgNO3. Временной интервал заживления раны кратко показан на фиг. 2. За сутки проведения гистопатологического исследования был также измерен уровень прокальцитонина и C-реактивного белка. Результаты этих исследований кратко изложены на фиг. 3 и 4. Значения как воспалительного, так и септического параметра были лучшими в обрабатываемых группах, что указывает на положительные эффекты обработки и преимущество липосомного препарата. Диабетическая рана. Сначала путем инъекции стрептозотоцина у животного моделировали диабет. Затем стандартные раны наносили на стопы у крыс, подверженных диабету (Eur Surg Res. 2008 Apr 2; 41(1):15-23). Использованными субъектами были самцы крыс линии Спраг Доули (Sprague-Dawley) в возрасте от 5 до 6 недель. Средняя площадь язвы, развившейся после 10 суток с момента первоначальной обработки, составляла примерно 20 мм 2 во всех группах. После данного периода (на фигуре - в момент времени 0) животных обрабатывали (с помощью спрея 4 воздействиями с расстояния 5 см) композицией примера 6 и примера 13, в сумме 3,5 мг активного ингредиента. Сравнивали время излечения. Площадь поверхности раны измеряли в контрольной группе каждые десятые сутки, а в обработанных группах - каждые пятые сутки. На фиг. 5 показаны типичные показатели излечения диабетических язв. На фиг. 6 показан временной интервал заживления диабетических ран. Результат. Регенерация в обработанных группах проходила существенно быстрее. Липосомный препарат в связи с лучшим проникновением активного ингредиента оказывает дополнительный положительный эффект. Дополнительные подробности изобретения приведены в следующих неограничивающих объем изобретения примерах. Примеры. Общий. Компонент А (эфирное масло) 1,5 г лимонного масла с температурой 20C смешивают с 2 г лавандового масла. Получают гомогенный раствор. Компонент Б 0,5 г витамина A с температурой 20C смешивают с 0,5 г витамина E. Получают гомогенный раствор. Компонент В (сорастворитель) взвешивают 3,5 г этоксилированного касторового масла. Компонент Г (фосфолипид) взвешивают 0,5 г соевого лецитина. Компонент Д (вода) взвешивают 23 г дистиллированной воды с температурой 45C. Компонент Е (спирт) взвешивают 68,5 г 96% этанола с температурой 20C. Компонент Ж (спирт) взвешивают 68,5 г 96% этанола с температурой 20C. Компонент З (вода) взвешивают 23 г дистиллированной воды с температурой 45C. Компоненты, выбранные из представленных выше 8 компонентов, смешивают, как указано в примерах 1-12 в табл. 2. Смешивание компонентов проводят в алфавитном порядке. Композиция и способ получения примера 13 идентичны композиции и способу получения примера 6 за исключением того, что температура воды, используемой в качестве компонента Д, составляет t = 20C. В примерах 1-6 после различного смешивания компонентов (А, Б, В, Г) путем приведения смеси в контакт с компонентом Д получают гидрофильную фазу (водную фазу), затем путем приведения смеси в контакт с компонентом Ж за счет обращения фаз получают липофильную фазу. Первая серия оценки представляет собой субъективную оценку, проводимую с помощью микро-6 015976 скопа. С помощью нанолазерного анализатора для измерения размера частиц определяют распределение размера частиц по массе. В примерах 7-12 способ смешивания компонентов А, Б, В, Г идентичен таковому для примеров 1-6 за исключением того, что последующее приведение в контакт проводят с компонентом Е и, таким образом, получают липидные (спиртовые) фазы. Эти липидные фазы приводят в контакт с (водным) компонентом З, чтобы вызвать обращение фаз, и, таким образом, образуют гидрофильные фазы. Вторую серию оценки также проводят с помощью микроскопа и анализатора размера частиц. Оценка. Важные параметры измерения оценок суммированы в табл. 3 и 4. Приборы. 1. Лазерный анализатор размера частиц типа Malvern Mastersizer 2000. Диапазон измерения: 0,02-2000 мкм. Прибор измеряет распределение массы дисперсной системы авторов изобретения в зависимости от размера частиц. 2. Поляризационный микроскоп Carl Zeiss. Расшифровка обозначений, используемых в таблице:UN = обозначение образца дисперсной системы, не подвергнутого ультразвуковой обработке;UN1 = обозначение образца, подвергаемого ультразвуковой обработке в течение 1 мин;UN2 = обозначение образца, подвергаемого ультразвуковой обработке в течение 2 мин; средний размер частицы, измеренный в зависимости от массы, в [мкм]dmax (d1, d2, d3, , dn) = размер максимума дифференциального распределения, соответствующего компонентам d1, d2, d3, , dn, в [мкм];VNd (10, 50, 90)% = размер частиц в [мкм], соответствующий 10, 50 и 90 об.% образца, не подвергаемым ультразвуковой обработке. Пример 1. Образец, содержащий эфирное масло и сорастворитель, образует нестабильную эмульсию гетерогенной фазы в воде (компонент Д). В грубой дисперсии находятся компоненты, относящиеся к 4 различным распределениям по размеру, которые после добавления спирта (компонента Ж) растворяются. Пример 2. В компоненте эфирного масла фосфолипид (компонент Г) не растворяется даже в присутствии сорастворителя. Пример 3. Раствор, содержащий витамин и сорастворитель, образует с водой (компонентом Д) более мелкую гетеродисперсную спонтанную эмульсию, чем эфирное масло, которая становится даже более мелкодисперсной после ультразвуковой обработки. Средний размер капли эмульсии уменьшается (от 27,6 до 11,2 мкм) после добавления спирта (компонента Ж). Дальнейшая ультразвуковая обработка увеличивает степень дисперсности (размер капли уменьшается от 11,2 до 6,5 мкм). Пример 4. Фаза, содержащая витамин и сорастворитель, не может растворить фосфолипидный (Г) компонент. Пример 5. Раствор витамина, эфирного масла и со-растворителя образует мелкодисперсную эмульсию, которая становится более крупнодисперсной после ультразвуковой обработки. Обращение фаз, вызываемое спиртом, в дальнейшем уменьшает размер капли эмульсии (от 3,6 до 1,3 мкм). Образец, не подвергаемый ультразвуковой обработке, образует стабильную микроэмульсию. Пример 6. Раствор образуют при добавлении фосфолипида к гидрофильной фазе, содержащей эфирное масло,витамин и сорастворитель. При приведении этого раствора в контакт с водой получают крупнозернистую, многослойную липосому из гетерогенной фазы. Эту крупнозернистую дисперсию путем ультразвуковой обработки можно преобразовать в более мелкодисперсную гомодисперсную большую многослойную липосому (размер уменьшается от 478 до 50,1 мкм). В результате обращения фаз, вызываемого спиртом, получают многослойную липосому с распределением мелких частиц (со средним размером 3,6 мкм]. Ультразвуковая обработка вызывает процесс коагуляции, который приводит в результате к возрастанию размера частиц (он возрастает от 3,6 до 7,7 мкм). Пример 7. Эфирное масло и сорастворитель растворяют в спирте. После обращения фаз, вызываемого водой,раствор остается прозрачным. Пример 8. Фосфолипид не растворяется в смеси эфирного масла и сорастворителя даже при добавлении спирта. Пример 9. Смесь витамина и сорастворителя растворяют в спирте. После обращения фаз, вызываемого водой,-7 015976 образуется тонко- и гомодисперсная микроэмульсия (0,6 мкм), которая становится несколько крупнее (от 0,6 до 2,9 мкм) под действием ультразвуковой обработки. Пример 10. Фосфолипид не растворяется в смеси витамина и сорастворителя даже при добавлении спирта. Пример 11. Смесь витамина, эфирного масла и сорастворителя растворяют в спирте. Раствор после обращения фаз, вызываемого водой, образует эмульсию мелкозернистого распределения (средний размер частицы составляет 1,2 мкм), которое становится несколько крупнее (размер частиц увеличивается от 1,2 до 7 мкм) под действием ультразвуковой обработки. Пример 12. Спиртовая дисперсия эфирного масла, витамина, сорастворителя и фосфолипида имеет структуру геля и содержит несколько крупнодисперсных многослойных липосом (средний размер частиц составляет 141,5 мкм). При ультразвуковой обработке дисперсия образует более тонкодисперсную смешанную фазу (средний размер частицы уменьшается до 41,1 мкм). После обращения фаз, вызываемого водой, образуется смесь, содержащая смешанную фазу масляной эмульсии - дисперсной фазы липосомного геля (средний размер частиц составляет 4,7 мкм). Ультразвуковая обработка вызывает агломерацию дисперсной фазы (средний размер частиц примерно от 5,8 до 6 мкм). Пример 13 (референсный). Компоненты и способ их смешивания идентичны приведенным в примере 6 за исключением того,что раствор, содержащий эфирное масло, витамин, сорастворитель и фосфолипид, смешивают с водой,доведенной до t=20C (компонент Д). Таким образом, образуют крупнодисперсную гетеродисперсную фазу структуры аморфного геля, в которой невозможно распознать липосомы с помощью микроскопа. После ультразвуковой обработки крупные частицы становятся значительно меньше (от среднего размера 409,8 до 28,4 мкм), но липосома не образуется. После обращения фаз, вызываемого спиртом, средний размер частиц дисперсии становится меньше (от 409,8 до 112,3 мкм), но дисперсная фаза все же не проявляет липосомной структуры. Подобный результат получают после ультразвуковой обработки (средний размер частиц уменьшается от 112,3 до 13,5 мкм), но в этом случае образование липосомы все же не наблюдают, только разрыхление дисперсии. Таблица 2-8 015976 Таблица 3 Гидрофильно-липофильное обращение фаз (краткое изложение результатов лазерного анализа размера частиц) Таблица 4 Липофильно-гидрофильное обращение фаз (краткое изложение результатов лазерного анализа размера частиц) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Липосомная композиция, отличающаяся тем, что она содержит эфирное масло цитрусового типа (Aurantioideae) фармацевтического сорта - 0,5-5,0 мас.ч.; лавандовое масло фармацевтического сорта - 0,5-5,0 мас.ч.; витамин E - 0,1-1,5 мас.ч.; витамин A - 0,1-1,5 мас.ч.; этоксилированное касторовое масло - 1,0-6,0 мас.ч.; фосфолипид - 0,1-1,0 мас.ч.; дистиллированная вода - 15-30 мас.ч.; этанол 96% - 65-75 мас.ч. 2. Композиция по п.1, отличающаяся тем, что она содержит 1,5 мас.ч. эфирного масла цитрусового типа.-9 015976 3. Композиция по п.1, отличающаяся тем, что она содержит 2,0 мас.ч. лавандового масла. 4. Композиция по п.1, отличающаяся тем, что она содержит 0,5 мас.ч. витамина E. 5. Композиция по п.1, отличающаяся тем, что она содержит 0,5 мас.ч. витамина A. 6. Композиция по п.1, отличающаяся тем, что она содержит 0,5 мас.ч. фосфолипида. 7. Композиция по п.1, отличающаяся тем, что она содержит 3,5 мас.ч. этоксилированного касторового масла. 8. Композиция по п.1, отличающаяся тем, что она содержит 23 мас.ч. дистиллированной воды. 9. Композиция по п.1, отличающаяся тем, что она содержит 68 мас.ч. этилового спирта. 10. Композиция по п.1, отличающаяся тем, что она содержит лимонное масло в качестве эфирного масла цитрусового типа. 11. Композиция по п.1, отличающаяся тем, что она содержит соевый лецитин в качестве фосфолипида. 12. Способ получения композиции по п.1, отличающийся тем, что к смеси 0,5-5,0 мас.ч. эфирного масла цитрусового типа и 0,5-5,0 мас.ч. лавандового масла добавляют смесь 0,1-1,0 мас.ч. витамина E и 0,1-1,5 мас.ч. витамина A, затем добавляют 1,0-6,0 мас.ч. этоксилированного касторового масла, в полученной масляной фазе растворяют 0,1-1,0 мас.ч. фосфолипида и а) путем добавления 15-30 мас.ч. дистиллированной воды с температурой 45C образуют липосомную гидрофильную фазу, которую превращают в липосомную липофильную композицию путем обращения фаз, вызываемого добавлением 65-75 мас.ч. 96% этанола, или б) путем добавления 65-75 мас.ч. 96% этанола образуют липосомную липофильную фазу, которую превращают в липосомную гидрофильную композицию путем обращения фаз, вызываемого добавлением 15-30 мас.ч. дистиллированной воды с температурой 45C. 13. Способ по п.12, отличающийся тем, что композицию получают путем гидрофильнолипофильного обращения фаз. 14. Применение композиции по п.1 для лечения кожных повреждений. 15. Применение по п.14 для лечения раневых, ожоговых, обмороженных, инфицированных кожных поверхностей.
МПК / Метки
МПК: A61K 9/00, A61K 9/127, A61K 36/752
Метки: композиция, липосомная
Код ссылки
<a href="https://eas.patents.su/13-15976-liposomnaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Липосомная композиция</a>
Предыдущий патент: Охлаждающее устройство для листовой заготовки
Следующий патент: Композиция и способ для очистки воды
Случайный патент: Водная текучая среда для гидроразрыва пласта