Комбинированные препараты, содержащие slv308 и l-dopa
Номер патента: 15073
Опубликовано: 29.04.2011
Авторы: Маккрири Эндрю К., Тюлп Мартинус Т.М., Ван Схарренбург Гюстаф Й.М.
Формула / Реферат
1. Комбинированный препарат, содержащий
(i) N-оксид SLV308
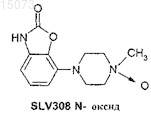
или его фармакологически приемлемые соли и
(ii) L-DOPA или его фармакологически приемлемые соли, для одновременного применения для терапии нарушений, требующих восстановления дофаминергической функции.
2. Комбинированный препарат, содержащий
(i) SLV308 или его N-оксид
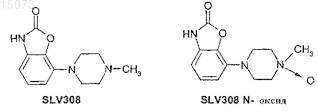
или фармакологически приемлемые соли этих соединений и
(ii) L-DOPA или его фармакологически приемлемые соли,
дополнительно содержащий ингибитор декарбоксилазы, для одновременного применения для терапии нарушений, требующих восстановления дофаминергической функции.
3. Препарат по п.1 или 2, дополнительно содержащий ингибитор COMT.
4. Препарат по любому из пп.1, 2 или 3, дополнительно содержащий ингибитор MAO-B.
5. Применение препарата по любому из пп.1-4 для изготовления лекарственного средства для лечения нарушений, требующих восстановления дофаминергической функции.
6. Применение по п.5, где указанное нарушение представляет собой болезнь Паркинсона.
7. Применение по п.5, где указанное нарушение представляет собой синдром усталых ног.
8. Фармацевтическая композиция, содержащая в дополнение к фармацевтически приемлемому носителю и/или по меньшей мере одному фармацевтически приемлемому вспомогательному веществу фармакологически активное количество препарата, как заявлено по любому из пп.1-4, в качестве активных ингредиентов.
Текст
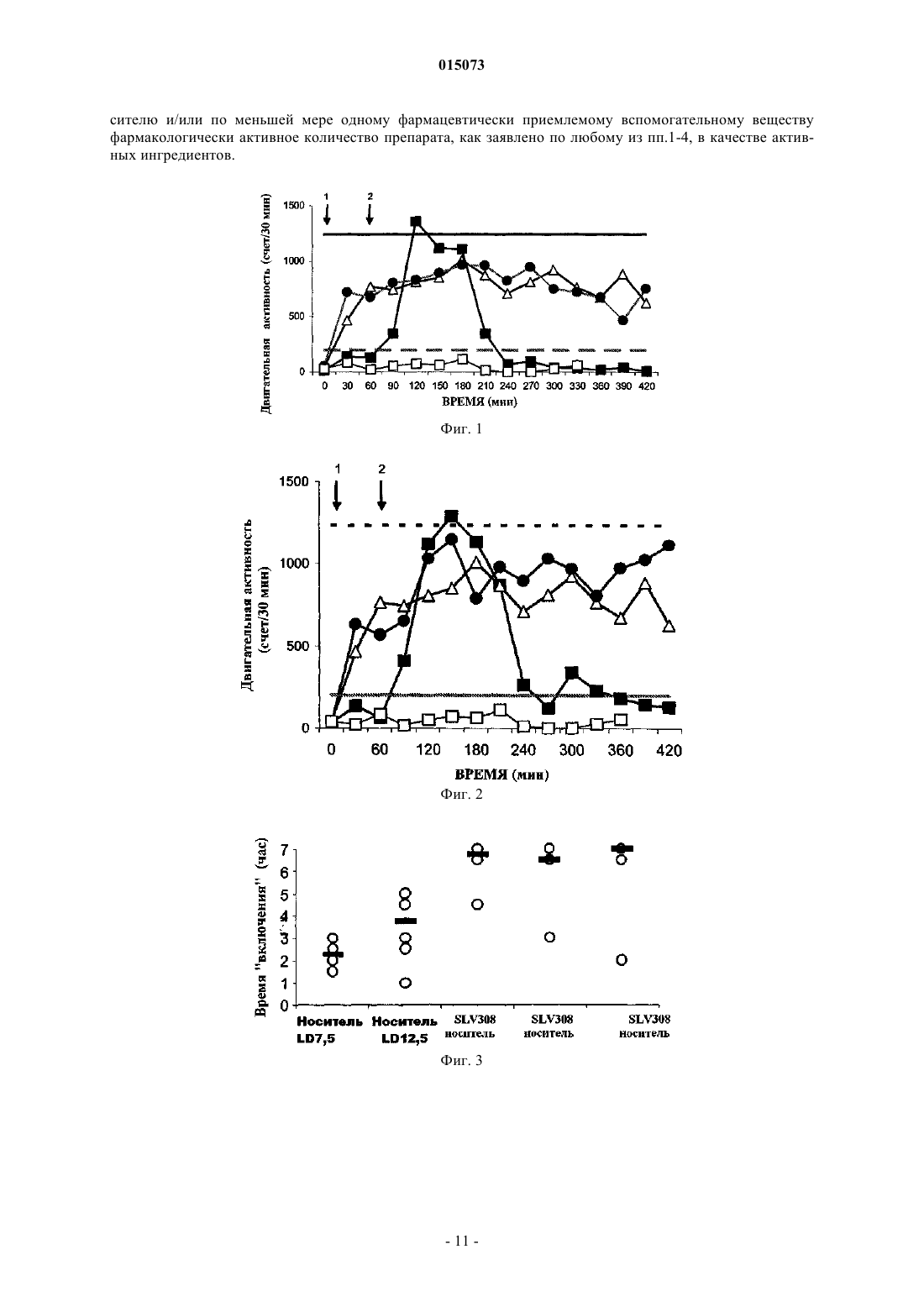
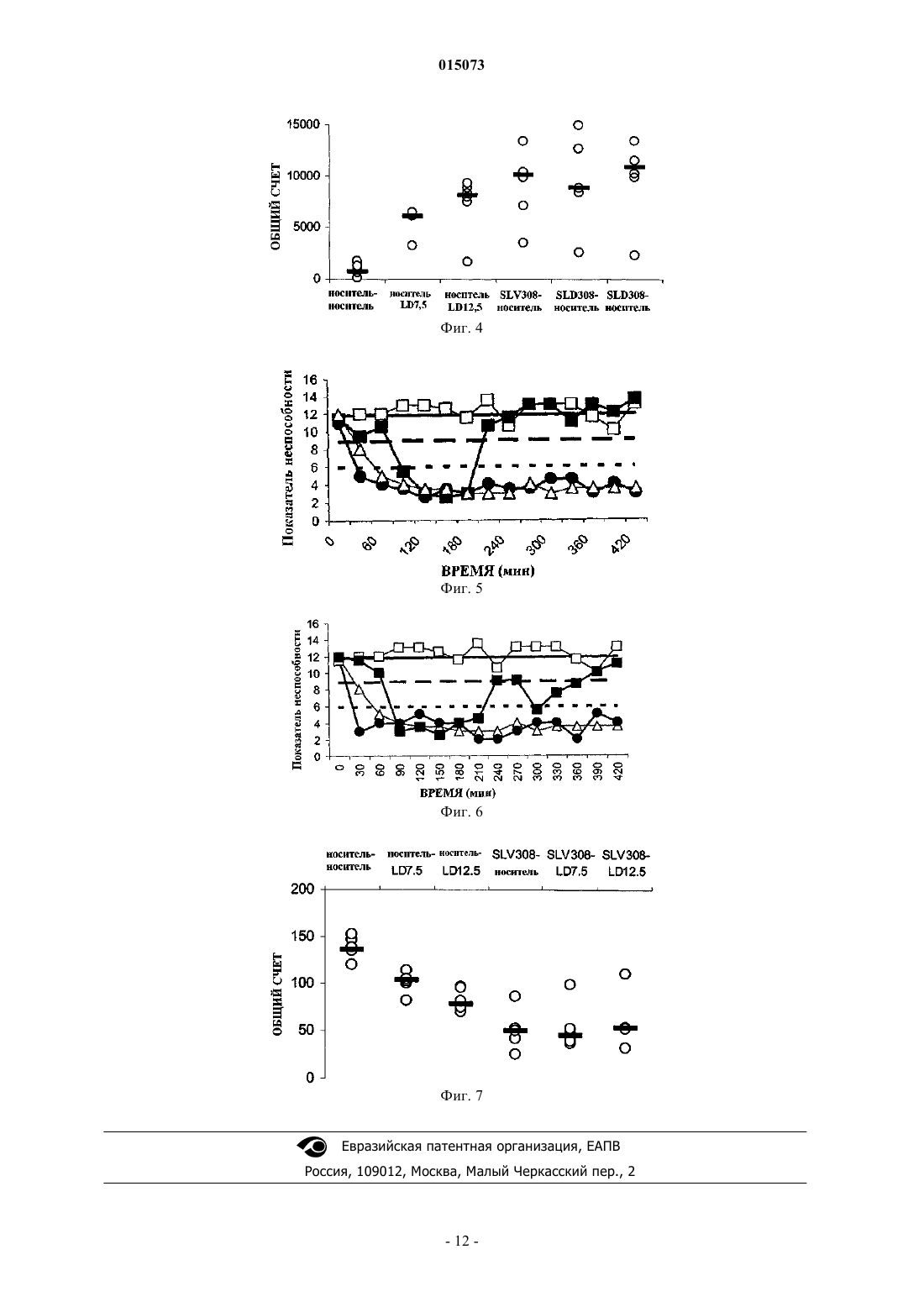
Маккрири Эндрю К., Ван Схарренбург Гюстаф Й.М., Тюлп Мартинус Т.М. (NL) Изобретение относится к применению комбинированного препарата SLV308, или его N-оксида,или фармакологически приемлемых солей этих соединений (I), (II) и L-DOPA для одновременного, отдельного или последовательного применения для лечения нарушений, требующих восстановления дофаминергической функции, в частности болезни Паркинсона и синдрома усталых ног. 015073 Область изобретения Изобретение относится к применению комбинированного препарата SLV308, или его N-оксида, или фармакологически приемлемых солей этих соединений и L-DOPA для одновременного, отдельного или последовательного применения для лечения нарушений,требующих восстановления дофаминергической функции, в частности болезни Паркинсона и синдрома усталых ног. Предпосылки изобретения Постоянное дрожание рук и ног, движения тела, которые постепенно становятся более скованными,медленными и слабыми, и выражения лица, подобные маске, представляют собой симптомы, которые наблюдали в течение истории человечества. В 1817 г. Джеймс Паркинсон описал эту группу симптомов как дрожательный паралич, и вскоре после этого заболевание назвали именем врача, впервые описавшего его подробно. Патологическая причина болезни Паркинсона вовлекает разрушение нервных клеток в черном веществе, части мозга, вовлеченной в движение мышц. Потеря приблизительно 80% дофамина в полосатом теле при болезни Паркинсона приводит к главным симптомам акинезии, ригидности и брадикинезии (Hornykiewicz, 1966). Пациенты имеют проблемы с началом движения и проявляют нестабильность поз и потерю координации. Современная фармакотерапия болезни Паркинсона основана на восстановлении дофаминергической функции (Blandini, 2000; Lled, 2000). Дофамин не пересекает гематоэнцефалический барьер и, таким образом, его нельзя использовать для лечения болезни Паркинсона, вместо него используют его ближайший предшественник, L-DOPA (левовращающий энантиомер 3,4-дигидроксифенилаланина, обозначаемый также как леводопа), поскольку он проникает в мозг, где он декарбоксилируется до дофамина. Однако леводопа декарбоксилируется также в периферических тканях. Таким образом, только небольшая часть введенного леводопа переносится к мозгу. Карбидопа ингибирует декарбоксилирование периферического леводопа, но сам по себе не может пересекать гематоэнцефалический барьер и не влияет на метаболизм леводопа в мозге. Считают, что сочетание карбидопа и леводопа является наиболее эффективным лечением для симптомов болезни Паркинсона. Тем не менее, определенные ограничения становятся очевидными в течение от одного до пяти лет после начала терапии. С прогрессированием заболевания благоприятный эффект от каждой дозы становится короче (эффект изнашивания), и у некоторых пациентов присутствуют непредсказуемые колебания между подвижностью и неподвижностью эффект включения-выключения). Периоды включения обычно связаны с высокими концентрациями леводопа в плазме и часто включают в себя аномальные непроизвольные движения, т.е. дискинезии. Периоды выключения коррелируют с низким уровнем леводопа в плазме и брадикинетическими приступами (Jankovic, 1993; Rascol, 2000). Это вынуждает клиницистов откладывать начало лечения L-DOPA посредством предварительного лечения дофаминергическими агонистами. Однако применение полных агонистов дофаминовых рецепторов, таких как апоморфин, бромкриптин, лизурид, перголид, прамипексол или ропинирол, также обладает своими ограничениями. Они вызывают дискинезии, индуцируют симптомы, подобные психотическим, включая галлюцинации, ортостатическую гипотензию, сонливость и другие побочные эффекты (Lozano, 1998; Bennett, 1999). Предположили, что это можно преодолеть с использованием частичных агонистов дофаминовых рецепторов D2/3 (т.е. соединений, которые не до максимума стимулируют рецепторы дофамина D2/3) (Jenner 2002). Такие соединения гипотетически будут способны стимулировать дофаминовые рецепторы D2/3, когда дофаминергический тонус является низким, в то же время являясь способными препятствовать избыточной стимуляции рецептора дофамина D2, когда дофаминергический тонус является высоким, таким образом приводя к стабилизации дофаминергической передачи в мозге (Jenner, 2002). Агонисты рецептора 5-HT1A могут снижать индукцию дискинезии, поскольку агонист рецептора 5HT1A тандоспирон уменьшал дискинезию у пациентов с болезнью Паркинсона после лечения L-DOPA(Kannari, 2002) и индуцированные галоперидолом экстрапирамидальные побочные эффекты у приматов(Christoffersen, 1998). Совсем недавно предположили, что саризотан, агонист рецептора 5-HT1A и лиганд дофаминового рецептора могут облегчать дискинетические симптомы (Olanow, 2004; Bara-Jimenez, 2005;Bibbiani, 2001). Присутствие агониста рецептора 5-HT1A может являться благоприятным для терапевтических эффектов частичного агониста рецептора D2/3 (Johnston, 2003). Недавно были представлены различные комбинированные препараты, содержащие L-DOPA и один или несколько других ингибиторов ферментов. Хорошо известными являются сочетания LDOPA/карбидопа (например, Sinemet), L-DOPA/бензеразид (например, Madopar) и L-1 015073DOPA/карбидопа/энтакапон (например, Stalevo (Jost, 2005. Совсем недавно ингибиторы катехоламинО-метилтрансферазы (COMT), такие как толкапон и энтакапон, предложены в качестве дополнительной терапии для L-DOPA. Эти соединения увеличивают время полужизни в плазме L-DOPA без значительного увеличения Cmax. Таким образом, они снижают продолжительность изнашивания, однако, проявляют тенденцию увеличивать интенсивность побочных эффектов максимальной дозы, включая дискинезии при максимальной дозе. Толкапон, по-видимому, индуцирует значительную токсичность для печени у небольшого процента пациентов. Другим способом, целью которого является замедление метаболизма дофамина, является применение ингибиторов моноаминоксидазы-B (MAO-B) в сочетании с L-DOPA. Однако введение ингибиторов MAO связано с рядом истощающих побочных эффектов, которые ограничивают их применение. Эти эффекты включают в себя, например, тошноту, головокружение, предобморочное состояние, обморок, боли в области живота, спутанность, галлюцинации, сухость во рту, образные сновидения, дискинезии и головную боль. Характерным для комбинированных препаратов является то, что они существуют во многих различных сочетаниях доз, поскольку в течение курса заболевания обычно необходимы более высокие дозы L-DOPA, чтобы поддерживать симптомы под контролем. Комбинированные препараты в форме таблеток, содержащие фиксированные количества лекарственных средств, являются простыми в использовании, однако, в то же время предоставляют также ограниченную гибкость. Иллюстрацией того факта, что фиксированные сочетания не являются универсально применимыми, является, например, использование избирательного ингибитора MAO-B селегилина для лечения болезни Паркинсона. На ранней стадии заболевания селегилин можно вводить в качестве монотерапии: соединение будет замедлять метаболизм эндогенного дофамина в достаточной степени, чтобы поддерживать симптомы в переносимых пределах. На более поздних стадиях заболевания использование LDOPA может стать необходимым. Когда эффективность L-DOPA начинает изнашиваться, обычно первым решением этой проблемы является использование ингибитора декарбоксилазы, подобного карбидопа (см. выше), и когда это также становится недостаточным, совместная терапия с селегилином будет возмещать эффективность L-DOPA, уменьшая разрушение дофамина, полученного из L-DOPA. Таким образом, на практике L-DOPA и селегилин вводят в отдельных препаратах, которые можно вводить одновременно или последовательно. Жертвы, серьезно пораженные синдромом усталых ног (RLS; известный также как синдром Экбона), практически неспособны оставаться сидящими или даже спокойно стоять. Действия, которые требуют поддержания двигательного спокойствия и ограниченной когнитивной стимуляции, такие как транспортировка (в автомобиле, самолете, поезде и т.д.) или посещение более длинных встреч, лекций, кинофильмов или других представлений, становятся трудными, если не невозможными. Измученные этими ощущениями, которые становятся более тяжелыми ночью, пациенты с RLS находят сон практически невозможным, что добавляет снижение качества их жизни. Побуждение к движению, которое увеличивается во время периодов отдыха, может полностью рассеиваться движением, таким как ходьба. Однако как только движение прекращается, симптомы возвращаются с увеличивающейся интенсивностью. Если пациент с RLS вынужден лежать спокойно, симптомы будут продолжать развиваться, подобно напряженной пружине, и со временем ноги начинают непроизвольно двигаться, немедленно облегчая симптомы. Ритмические или полуритмические движения ног наблюдают, если пациент старается оставаться лежащим (Pollmacher, 1993). Эти движения обозначают как дискинезии при пробуждении (DWA) (Hening, 1986) или более часто как периодические движения конечностей при пробуждении (PLMW). Клинически, о RLS свидетельствуют при соблюдении четырех диагностических критериев: (1) ощущение побуждения к движению конечностей (обычно ног); (2) двигательное возбуждение для уменьшения ощущений; (3) во время отдыха симптомы возвращаются или ухудшаются; и (4) заметные циркадные изменения в проявлении или тяжести симптомов RLS; то есть симптомы ухудшаются вечером и ночью (Allen,2001). Современные способы лечения RLS разнообразны и страдают нежелательными побочными эффектами. Способы терапии включают в себя введение агонистов дофамина, других дофаминергических средств, бензодиазепинов, опиатов и средств против судорог. В случаях, когда RLS является результатом вторичного состояния, такого как беременность, терминальная стадия почечной недостаточности, лечение эритропоэтином или недостаток железа, удаление состояния, такого как роды или лечение общепринятым пополнением железа, может уменьшить или прекратить симптомы, по меньшей мере, в некоторых случаях (Allen, 2001). Однако RLS, не являющийся результатом вторичных состояний (идиопатическийRLS), представляет собой более сложную задачу для лечения. Дофаминергические средства, такие как леводопа, как правило, обеспечивают эффективное начальное лечение, но при продолжительном использовании устойчивость и нарастание симптомов возникает приблизительно у 80% пациентов с RLS (Allen,1996); это осложнение также является общераспространенным для агонистов дофамина (Earley, 1996). Другие альтернативы, бензодиазепины, опиаты и средства против судорог, не являются настолько постоянно эффективными, как дофаминергические средства (Chesson, 1999; Hening, 1999). Несмотря на изменения в режимах их лечения, 15-20% пациентов находят, что все лекарственные средства являются неадекватными из-за неблагоприятных эффектов и ограниченного благоприятного эффекта лечения.SLV308, моногидрохлорид 7-[4-метил-1-пиперазинил]-2(3H)-бензоксазолона, связывается с D2 подобными дофаминовыми рецепторами и рецепторами 5-HT1A. Он является частичным агонистом дофаминовых рецепторов D2/3 и полным агонистом рецепторов серотонина 5-HT1A. На клонированные дофаминовые рецепторы D2/L человека SLV308 действовал как сильный, но частичный агонист рецептораD2 (pEC50=8,0 и pA2=8,4) с эффективностью 50% для стимулированного форсколином накопления сАМР. На рекомбинантные дофаминовые рецепторы D3 человека SLV308 действовал как частичный агонист для индукции связывания [35S]GTPS (67% индукции дофамина), обладает более высокой степенью активности по сравнению с квинпиролом (pEC50=9,2) и является антагонистом индукции дофамином связывания [35S]GTPS (pA2=9,0). SLV308 действовал как полный агонист рецептора 5-HT1A на индуцированное форсколином накопление сАМР для клонированных рецепторов 5-НТ 1 А человека (pEC50=6,3),подобно агонисту рецептора 5-HT1A 8-OH-DPAT. В срезах полосатого тела крысы SLV308 зависимым от концентрации образом ослаблял стимулированное форсколином накопление сАМР, как ожидали для агониста дофаминового рецептора D2/3. SLV308 являлся антагонистом ингибирующего эффекта квинпирола на стимулированное K+ высвобождение [3H]дофамина (pA2=8,5) из срезов полосатого тела крысы. В той же самой системе для частичного агониста D2 тергурида показали более высокую степень антагонизма в присутствии квинпирола (pA2=10,3), сходную с антагонистом D2 галоперидолом (pA2=9,3), но меньшую, чем для SLV308 (pA2=8,5). В заключение, SLV308 сочетает высокую активность частичного агонизма для дофаминовых рецепторов D2/3 (действует как стабилизатор дофамина) с полной эффективностью низкой активности агонизма рецептора серотонина 5-HT1A (WO 00/29397; Feenstra, 2001; Johnston, 2001a,b; Hesselink, 2001, 2003, McCreary, 2001, 2006; Wolf, 2003). В WO 2007/023141 описано, что invivo N-оксид SLV308 быстро превращается в SLV308, таким образом функционируя как пролекарство. Подробное описание изобретения Целью настоящего изобретения являлось развитие лечения такого эффективного, как L-DOPA, но без его побочных эффектов. В частности, без характерного для него эффекта включения-выключения,вызывающего дискинезии во время периодов включения и брадикинетические приступы во время периодов выключения. Неожиданно в исследованиях на игрунках после обработки МРТР, модели на животных с предсказательной ценностью для болезни Паркинсона, обнаружили, что комбинированное лечение с помощьюL-DOPA и SLV308 снижает максимальную локомоторную активность, какую наблюдали после одного LDOPA, так что гиперактивности не наблюдали. Продолжительность активности (время включения) после L-DOPA увеличивали совместным ведением SLV308. Объектом изобретения являются комбинированные препараты SLV308, или его N-оксида, или их фармакологически приемлемых солей, гидратов и сольватов, и L-DOPA и, необязательно, ингибитора декарбоксилазы, и/или, необязательно, ингибитора COMT, и/или, необязательно, ингибитора MAO-B,для одновременного, отдельного или последовательного применения для лечения нарушений, требующих восстановления дофаминергической функции, в частности болезни Паркинсона и синдрома усталых ног. Изобретение относится к применению SLV308 или его N-оксида, истинного пролекарства, в случаях, в которых L-DOPA индуцирует дискинезии или предположительно может индуцировать дискинезии. В таких случаях специфические фармакологические активности соединения, а именно частичный агонизм для рецепторов дофамина-D2 и дофамина-D3, так же как полный агонизм для рецепторов серотонина 5-HT1A, приводят к блокаде дискинезий без снижения терапевтического эффекта L-DOPA. Настоящее изобретение относится к фармацевтическим составам, содержащим:(i) SLV308, его N-оксид или их фармакологически приемлемые соли, гидраты и сольваты и(ii) L-DOPA в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Дополнительный аспект настоящего изобретения относится к наборам, содержащим:(i) емкость, содержащую SLV308, его N-оксид или их фармакологически приемлемые соли, гидраты и сольваты, необязательно, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем,(ii) емкость, содержащую L-DOPA, необязательно, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем, и(iii) инструкции для последовательного, отдельного или одновременного введения SLV308 и LDOPA нуждающемуся в этом пациенту.-3 015073 Согласно дополнительному аспекту изобретения предоставлен способ получения набора компонентов, который включает приведение компонента (i), как определено выше, в контакт с соединением с компонентом (ii), как определено выше, таким образом, приводя два компонента в состояние, пригодное для введения в сочетании друг с другом. Приведение двух компонентов в сочетание друг с другом включает то, что компоненты (i) и (ii) могут являться:(i) предоставленными в виде отдельных составов (т.е. независимо друг от друга), которые затем соединяют вместе для применения в сочетании друг с другом для комбинированной терапии; или(ii) упакованными и предоставленными вместе как отдельные компоненты комбинированной упаковки для применения в сочетании друг с другом для комбинированной терапии. Другой аспект изобретения относится к способам лечения пациента, страдающего от состояния или чувствительного к состоянию, при котором является необходимым или желательным восстановление дофаминергической функции, где способ включает введение пациенту терапевтически эффективного общего количества:(i) SLV308, его N-оксида или их фармакологически приемлемых солей, гидратов и сольватов, необязательно, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем; в сочетании с(ii) L-DOPA, необязательно, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Другой аспект изобретения относится к применению фармацевтических составов, содержащих:(i) SLV308, его N-оксид или их фармакологически приемлемые соли, гидраты и сольваты и(ii) L-DOPA в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем,для изготовления лекарственного средства для лечения состояния, при котором является необходимым или желательным восстановление дофаминергической функции. Определения Примерами ингибиторов декарбоксилазы являются карбидопа и бензеразид. Примерами ингибиторов катехоламин-O-метилтрансферазы (COMT) являются энтакапон, нитекапон и толкапон, и ингибиторы моноаминоксидазы-B (MAO-B) включают в себя депренил, (-)-депренил (селегилин), десметилдепренил, N-пропаргил-1-(R)-аминоиндан (разагалин), фенелзин (нардил), транилципромин (парнат),CGP3466, фуразолидон, изокарбоксазид, паргилин, метиклотиазид и прокарбазин. Для предоставления более точного описания некоторые из количественных выражений, приведенных здесь, не модифицируют термином приблизительно. Понятно, что используют ли термин приблизительно в прямой форме или нет, каждое количество, приведенное здесь, предназначено, чтобы относится к фактическому данному значению, и оно также предназначено, чтобы относится к приближению такого данного значения, которое будет разумно выведено на основании обычных познаний в данной области, включая приближения из-за экспериментальных условий и/или условий измерения для такого данного значения. В описании и формуле изобретения слово содержать и варианты этого слова, такие как содержащий и содержит, не предназначены, чтобы исключать другие добавки, компоненты, целые числа или интервалы. Термин композиция, относится к продукту, содержащему конкретные ингредиенты в предопределенных количествах или пропорциях, так же как любой продукт, полученный, напрямую или опосредованно, в результате объединения конкретных ингредиентов в определенных количествах. По отношению к фармацевтическим композициям этот термин относится к продукту, содержащему один или несколько активных ингредиентов и необязательный носитель, содержащий инертные ингредиенты, так же как любой продукт, полученный, напрямую или опосредованно, в результате объединения, комплексообразования или агрегации любых двух или более из ингредиентов, или диссоциации одного или нескольких из ингредиентов, или других типов реакций или взаимодействий одного или нескольких из ингредиентов. Как правило, фармацевтические композиции получают, приводя активный ингредиент в равномерное и тесное взаимодействие с жидким носителем или с тонко измельченным твердым носителем, или и с тем,и с другим, и затем, если необходимо, придавая продукту форму желательного состава. Фармацевтическая композиция содержит достаточно рассматриваемого активного соединения для получения желаемого эффекта при прогрессировании или состоянии заболеваний. Соответственно, фармацевтические композиции по настоящему изобретению относятся к любой композиции, полученной смешиванием соединения по настоящему изобретению и фармацевтически приемлемого носителя. Под фармацевтически приемлемым понимают, что носитель, разбавитель или наполнитель должен являться совместимым с другими ингредиентами состава и не являться вредным для его реципиента. В контексте этой заявки термин комбинированный препарат относится как к сочетаниям, означающим SLV308 и другие лекарственные средства, физически объединенные в одном препарате, таком как таблетка или жидкость для инъекции, так и к набору компонентов, содержащему SLV308 и LDOPA в отдельных лекарственных формах, вместе с инструкциями для применения, необязательно, с дополнительными средствами для облегчения соответствия с введением соединений-компонентов, на-4 015073 пример ярлыком или рисунками. В случае истинных сочетаний, фармакотерапия по определению является одновременной. Содержимое набора компонентов можно вводить либо одновременно, либо в различные интервалы времени. Будет ли терапия одновременной или последовательной, зависит от характеристик других применяемых лекарственных средств, таких характеристик, как начало и продолжительность действия, уровни в плазме, клиренс и т.д., так же как от заболевания, его стадии и характеристик индивидуального пациента. Доза композиции, подлежащая введению, будет зависеть от показания, возраста, массы и пола пациента, и ее может определить терапевт. Доза предпочтительно будет в диапазоне от 0,01 до 10 мг/кг. Типичная ежесуточная доза активных ингредиентов меняется в широком диапазоне и будет зависеть от различных факторов, таких как значимое показание, способ введения, возраст, масса и пол пациента, и ее может определить терапевт. Как правило, пероральные и парентеральные дозы будут находиться в диапазоне от 0,1 до 1000 мг в сутки общего количества активных ингредиентов. Термин терапевтически эффективное количество относится к количеству лекарственного средства для лечения состояния, которое можно лечить введением композиции по изобретению. Это количество представляет собой количество, достаточное, чтобы для него показали поддающийся детекции терапевтический или благоприятный ответ в системе ткани, животного или человека. Эффект может включать в себя, например, лечение состояний, перечисленных здесь. Точное эффективное количество для субъекта будет зависеть от размеров тела и состояния здоровья субъекта, природы и степени состояния, подлежащего лечению, рекомендаций лечащего терапевта (исследователя, ветеринара, лечащего врача или другого клинициста) и лекарственного средства или сочетания лекарственных средств, выбранных для введения. Таким образом, не является целесообразным заранее указывать точное эффективное количество. Термин фармацевтически приемлемая соль относится к тем солям, которые в рамках высказанного медицинского суждения являются пригодными для применения в контакте с тканями человека и низших животных без чрезмерной токсичности, раздражения, аллергического ответа и т.п. и являются соизмеримыми с целесообразным соотношением благоприятный эффект/риск. Фармацевтически приемлемые соли являются хорошо известными в данной области. Их можно получить in situ при окончательном выделении и очистке соединений по изобретению или отдельно посредством их реакции с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты. Фармацевтически приемлемые соли можно получить с использованием общепринятых способов, хорошо известных в данной области, например смешиванием соединения по настоящему изобретению с подходящей кислотой, например неорганической кислотой или органической кислотой. Введение в сочетании с включает в себя то, что соответствующие составы, содержащие SLV308 иL-DOPA, вводят последовательно, отдельно и/или одновременно в курсе лечения соответствующего состояния, где состояние может являться острым или хроническим. Предпочтительно термин включает в себя то, что два состава вводят (необязательно, неоднократно) достаточно близко по времени для присутствия благоприятного эффекта для пациента, который является более сильным в течение курса лечения соответствующего состояния, чем если бы любой из двух составов вводили (необязательно, неоднократно) отдельно в отсутствие другого состава, в течение такого же курса лечения. Определение того,предоставляет ли сочетание больший благоприятный эффект по отношению к конкретному состоянию и в курсе его лечения, будет зависеть от состояния, подлежащего лечению или предупреждению, однако может быть проведено общепринятым образом специалистом в данной области. Таким образом, термин в сочетании с включает в себя то, что один или другой из двух составов можно вводить (необязательно,неоднократно) до, после введения и/или в то же самое время, что и введение другого компонента. При использовании в этом контексте термины введенный одновременно и введенный в то же самое время,что включают в себя то, что отдельные дозы SLV308 и L-DOPA вводят в течение 48 ч, например 24, 18,12, 6, 3, 2, 1 ч или 30 мин друг от друга. Термин лечение относится к любому лечению состояния или заболевания млекопитающего,предпочтительно человека, и включает в себя: (1) ингибирование заболевания или состояния, т.е. прекращение его развития, (2) облегчение заболевания или состояния, т.е. вызывание регрессии состояния,или (3) остановку симптомов заболевания. Термин медицинская терапия предназначен, чтобы включать в себя профилактические, диагностические и терапевтические режимы, выполняемые in vivo или ex vivo для людей или других млекопитающих. Термин субъект относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, которое является объектом лечения, исследования или эксперимента. Примеры Лечение нейротоксином МРТР (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) приводит к истощению дофамина в скорлупе-хвостатом ядре и поведению, подобному поведению при болезни Паркинсона у нечеловекообразных и человекообразных приматов (Lange, 1992; Langston, 1984; Langston, 1986).-5 015073 Пример 1. Взаимодействие между SLV308 и L-DOPA в терапевтически релевантных дозах. Животные. Для этого исследования использовали взрослых обыкновенных игрунок любого пола(Callithrix jacchus; n=6, массой 320-450 г, в возрасте 2-3 лет). Животных содержали по отдельности или в парах в стандартных условиях при температуре 242C и относительной влажности 50%, применяя 12 часовой цикл свет-темнота, со свободным доступом к пище и воде. Всю экспериментальную работу проводили согласно Animals (Scientific Procedures Act) 1986, лицензия проекта nr PPL 70/4986. Введение МРТР. Гидрохлорид 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (Research BiochemicalInternational, UK) растворяли в 0,9% стерильном солевом растворе и вводили подкожной (sc) инъекцией(Реагсе, 1998). Для индукции полного повреждения МРТР (2,0 мг/кг, sc) вводили один раз в сутки в течение 5 последовательных суток. В течение МРТР-обработки и в течение последующих от шести до восьми недель животных кормили вручную желеобразным питанием для игрунок, пока они не восстанавливались достаточно, чтобы питаться самостоятельно, и их массы тела не стабилизировались. Перед использованием всех животных определили как отвечающих на введение L-DOPA. Тестирование начинали,только когда животные восстанавливались после острых эффектов обработки МРТР. В этом исследовании это составляло 70 суток после начала обработки МРТР. Лекарственные средства. SLV308 растворяли в 10% сахарозе, выдавали в объеме 2 мл/кг и вводили посредством перорального зонда. Дозы выражали как мг/кг свободного основания. Метиловый эфир LDOPA (Sigma, UK) растворяли в 10% сахарозе, выдавали в объеме 2 мл/кг и вводили посредством перорального зонда. Карбидопа (Merck Sharp and Dohme, UK) суспендировали в 10% сахарозе, выдавали в объеме 2 мл/кг и вводили непосредственно в рот животного. Домперидон (Sigma, UK) суспендировали в 10% сахарозе, выдавали в объеме 2 мл/кг и вводили непосредственно в рот животного. Дозы основаны на предыдущем исследовании с SLV308, в котором показали, что оптимального эффекта SLV308 на локомоторную активность и показатели неспособности достигали при 0,26 мг/кг, ро. Выбирали дозы LDOPA, чтобы отражать умеренную и высокую дозу L-DOPA (7,5 и 12,5 мг/кг, ро соответственно). Способ. На сутки эксперимента животных взвешивали, обрабатывали домперидоном (2 мг/кг, ро) непосредственно через рот и спустя 60 мин обрабатывали либо SLV308 (0,26 мг/кг, ро), либо носителем посредством перорального зонда. Спустя 30 мин вводили карбидопа (12,5 мг/кг, ро), и спустя 30 мин вводили L-DOPA (7,5 или 12,5 мг/кг, ро) или его носитель. Применяли модифицированный дизайн латинских квадратов с периодами вымывания одна неделя между обработками. Животных оценивали по локомоторной активности и неспособности, как описано ниже. Оценка двигательной активности. Животных помещали по отдельности в клетки для исследования активности (506070 см), снабженные прозрачными плексигласовыми дверьми, чтобы обеспечивать ясную видимость для наблюдения. Каждая клетка являлась оборудованной 8 горизонтально ориентированными инфракрасными излучающими фотоэлементами и соответствующими им детекторами, расположенными так, чтобы позволять максимальную оценку движения. Двигательную активность оценивали как число прерываний луча света, вызванных движением животных, накопленных в 10-минутных интервалах за время вплоть до 7 ч. Животным обеспечивали 60-минутный период акклиматизации в клетках для исследования активности, в течение которого оценивали исходную активность, перед введением лекарственного средства. Порог включения определяли как 3-кратную исходную активность у обработанных МРТР игрунок. Гиперактивность определяли как 3-кратную нормальную активность у не подвергавшихся воздействию игрунок. Время включения представляло собой период времени в минутах, когда активность превышала порог включения. Оценка неспособности. Опытные наблюдатели, не осведомленные об обработке, контролировали животных через прозрачное с одной стороны зеркало и оценивали по степени двигательной дисфункции. Двигательную дисфункцию оценивали по шкале оценки неспособности; внимательность (нормальная = 0, сниженная = 1, сонливость = 2); проверка (присутствует = 0, снижена = 1, отсутствует = 2); положение(нормальное = 0, аномальное туловище +1, аномальный хвост +1, аномальные конечности +1, согнутое = 4); равновесие (нормальное = 0, нарушенное = 1, нестабильное = 2, спонтанные падения = 3); реакция на стимулы (нормальная = 0, сниженная = 1, замедленная = 2, отсутствует = 3); вокализация (нормальная = 0, сниженная = 1, отсутствует = 2); подвижность (нормальная = 0, брадикинезия или гиперкинез = 1, акинезия или тяжелый гиперкинез = 2). Эти значения суммировали с получением максимального балла 18. Анализ и статистика. Общий счет локомоторной активности и общие показатели неспособности анализировали по эффекту обработки с использованием теста Фридмана (SPSS, версия 10) с последующими апостериорными тестами Уилкоксона или Манна-Уитни для определения индивидуальных различий. Уровень значимости устанавливали на 5%. Пример 2. Эффекты SLV308 на индуцированную L-DOPA обратимость двигательной неспособности. Спонтанная двигательная активность: SLV308 (0,26 мг/кг, ро) увеличивал локомоторную активность через 30 мин после введения (фиг. 1). Максимальную активность наблюдали через 180 мин после обработки и локомоторной активности, и она продолжалась в течение 7-часового периода наблюдений.L-DOPA (7,5 и 12,5 мг/кг, ро) приводил к немедленному увеличению локомоторной активности с макси-6 015073 мумом через 60-90 мин после введения (фиг. 1 и 2). Продолжительность активности составляла 150-240 мин. Максимальная активность после L-DOPA (7,5 и 12,5 мг/кг, ро) являлась более высокой, чем активность, наблюдаемая после одного SLV308 (0,26 мг/кг, ро). После предварительной обработки SLV308(0,26 мг/кг, ро) максимум и продолжительность активности после L-DOPA (7,5 мг/кг, ро) являлись сходными с наблюдаемыми после одного SLV308 (0,26 мг/кг, ро) (фиг. 1). Комбинированная обработка LDOPA (7,5 мг/кг, ро) плюс SLV308 (0,26 мг/кг, ро) снижала максимальную локомоторную активность после одного L-DOPA (7,5 мг/кг, ро) до уровня, сходного с уровнем, наблюдаемым после одного SLV308(0,26 мг/кг, ро), так что не наблюдали гиперактивности (фиг. 1). SLV308 (0,26 мг/кг, ро) не смог снизить,однако не увеличивал, максимальную активность, наблюдаемую после L-DOPA (12,5 мг/кг, ро). Однако продолжительность активности (время включения) после L-DOPA (7,5 и 12,5 мг/кг, ро) увеличивали посредством совместного введения SLV308 (0,26 мг/кг, ро), что отражает продолжительность активностиSLV308 (фиг. 3). Общая локомоторная активность увеличивалась после всех обработок по сравнению с обработанной носителем группой (фиг. 4), хотя других отличий не наблюдали. Двигательная неспособность. L-DOPA (7,5 и 12,5 мг/кг, ро) приводила к немедленному обращению неспособности, которое достигало максимума через 90 мин после введения, с показателем 2,5 (фиг. 5 и 6). Продолжительность этого эффекта составляла 150 и 180 мин для L-DOPA при 7,5 и 12,5 мг/кг, ро соответственно. SLV308 (0,26 мг/кг, ро) снижал показатели неспособности немедленно после введения(фиг. 5). Максимальное улучшение для неспособности (показатель 3) поддерживалось от 1 до 7 ч после введения. После предварительной обработки SLV308 (0,26 мг/кг) с последующим L-DOPA (7,5 и 12,5 мг/кг, ро) продолжительность обращения неспособности являлась сходной с продолжительностью, наблюдаемой после одного SLV308 (0,26 мг/кг, ро) (медианная продолжительность активности 420 мин,420 мин и 390 мин соответственно). Общие показатели неспособности являлись сниженными в течение 7 ч после введения SLV308 (0,26 мг/кг, ро), введенного отдельно или в сочетании с L-DOPA (7,5 мг/кг или 12,5 ро) (фиг. 7). Добавление SLV308 (0,26 мг/кг, ро) к L-DOPA (7,5 мг/кг, ро) вызывало увеличение общего показателя неспособности по сравнению с одним L-DOPA (7,5 мг/кг, ро) (фиг. 7). Заключение. Эти данные подтверждают, что как L-DOPA (7,5 и 12,5 мг/кг, ро), так и SLV308 (0,26 мг/кг, ро) обращают индуцированную МРТР акинезию и неспособность. Как высокие, так и низкие дозыL-DOPA обладали короткой продолжительностью действия и вызывали периоды гиперактивности. Продолжительность активности SLV308 являлась значительно более длительной, чем продолжительность активности для L-DOPA, однако гиперактивности не наблюдали. При введении в сочетании предварительная обработка SLV308 предупреждала гиперактивность после L-DOPA. Не обнаружено таких взаимодействий между SLV308 и L-DOPA для показателей нарушения функций, поскольку эффект сочетанияSLV308 и L-DOPA являлся сходным с эффектом одного SLV308. Пример 3. Фармацевтические препараты. Типы фармацевтических композиций, которые можно использовать, включают в себя в качестве неограничивающих примеров таблетки, жевательные таблетки, капсулы (включая микрокапсулы), растворы, парентеральные растворы, мази (кремы и гели), суппозитории, суспензии и другие типы, описанные здесь или очевидные специалисту в данной области из описания и общих знаний в данной области. Композиции используют для перорального, внутривенного, подкожного, трахеального, бронхиального,интраназального, легочного, чрескожного, буккального, ректального, парентерального или других способов введения. Фармацевтический состав содержит по меньшей мере один препарат по изобретению в смеси с фармацевтически приемлемым адъювантом, разбавителем и/или носителем. Общее количество активных ингредиентов целесообразно лежит в диапазоне от приблизительно 0,1% (мас./мас.) до приблизительно 95% (мас./мас.) состава, целесообразно от 0,5 до 50% (мас./мас.) и предпочтительно от 1 до 25%(мас./мас.). Молярное соотношение между SLV308 (или его N-оксидом) и L-DOPA может лежать в диапазоне от приблизительно 1000:1 до приблизительно 1:1000, целесообразно лежит в диапазоне от 300:1 до 1:300 и предпочтительно от 50:1 до 1:50. Препараты по изобретению можно перевести в формы, подходящие для введения средствами обычных способов с использованием вспомогательных веществ, таких как жидкие или твердые, порошкообразные ингредиенты, такие как общепринятые в фармацевтике жидкие или твердые наполнители и расширители, растворители, эмульгаторы, смазывающие вещества, ароматизирующие вещества, окрашивающие вещества и/или буферные вещества. Часто применяемые вспомогательные вещества включают в себя карбонат магния, диоксид титана, лактозу, сахарозу, сорбит, маннит и другие сахара или сахарные спирты, тальк, лактопротеин, желатин, крахмал, амилопектин, целлюлозу и ее производные, животные и растительные масла, такие как масло печени рыбы, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, например, такие как стерильная вода и одно- или многоатомные спирты, такие как глицерин, так же как дезинтегрирующие вещества и смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарилфумарат натрия и полиэтиленгликолевые воски. Затем смесь можно перерабатывать в гранулы или прессовать в таблетки. Активные ингредиенты можно по отдельности предварительно смешивать с другими неактивными ингредиентами, перед смешиванием для получения состава. Активные ингредиенты можно также смешивать друг с другом, перед смешиванием с неактивными ингредиентами для получения состава.-7 015073 Мягкие желатиновые капсулы можно получать как капсулы, содержащие смесь активных ингредиентов по изобретению, растительное масло, жир или другой подходящий носитель для мягких желатиновых капсул. Твердые желатиновые капсулы могут содержать гранулы активных ингредиентов. Твердые желатиновые капсулы могут также содержать активные ингредиенты вместе с твердыми порошкообразными ингредиентами, такими как лактоза, сахароза, сорбит, маннит, картофельный крахмал, кукурузный крахмал, амилопектин, производные целлюлозы или желатин. Единицы дозирования для ректального введения можно получать (i) в форме суппозиториев, содержащих активное вещество, смешанное с нейтральной жировой основой; (ii) в форме желатиновой ректальной капсулы, содержащей активное вещество в смеси с растительным маслом, парафиновым маслом или другим подходящим носителем для желатиновых ректальных капсул; (iii) в форме заранее подготовленной микроклизмы; или (iv) в форме сухого состава для микроклизмы для разведения в подходящем растворителе непосредственно перед введением. Жидкие препараты можно получать в форме сиропов, эликсиров, концентрированных капель или суспензий, например растворов или суспензий, содержащих активные ингредиенты, где остаток состоит,например, из сахара или сахарных спиртов и смеси из этанола, воды, глицерина, пропиленгликоля и полиэтиленгликоля. Если желательно, такие жидкие препараты могут содержать окрашивающие средства,ароматизирующие средства, консерванты, сахарин и карбоксиметилцеллюлозу или другие загустители. Жидкие препараты можно получать также в форме сухого порошка, разведенного в подходящем растворителе перед использованием. Растворы для парентерального введения можно получать в виде раствора состава по изобретению в фармацевтически приемлемом растворителе. Эти растворы могут также содержать стабилизирующие ингредиенты, консерванты и/или забуферивающие ингредиенты. Растворы для парентерального введения можно также получать в виде сухого препарата, разведенного подходящим растворителем перед использованием. В соответствии с настоящим изобретением представлены также составы и наборы компонентов,содержащие один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтической композиции по изобретению, для применения в медицинской терапии. К такому контейнеру(контейнерам) можно прикреплять различные письменные материалы, такие как инструкции для применения или предупреждение в форме, предписанной государственным органом, регулирующим изготовление, применение или продажу фармацевтических продуктов, где предупреждение отражает одобрение органом изготовления, применения или продажи для введения людям или ветеринарного введения. Применение составов по настоящему изобретению в изготовлении лекарственных средств для применения для лечения состояния, при котором восстановление дофаминергической функции является необходимым или желательным, и способы медицинского лечения или способы, включающие в себя введение терапевтически эффективного общее количество по меньшей мере одного препарата по изобретению пациенту, страдающему от состояния или чувствительного к состоянию, при котором восстановление дофаминергической функции является необходимым или желательным. Перечень чертежей Фиг. 1. Эффект SLV308 (0,26 мг/кг ро) на двигательную активность после обработки L-DOPA (7,5 мг/кг, ро) у обыкновенных игрунок с вызванными МРТР повреждениями (n=6). Точки представляют медианы общего счета локомоторной активности в 30-минутных интервалах в течение 7 ч. Стрелка 1 - обработка SLV308, стрелка 2 - обработка L-DOPA. Символы: незакрашенные квадраты - группа носителя,закрашенные квадраты - L-DOPA 7,5 мг/кг, ро, незакрашенный треугольник - SLV308 0,26 мг/кг, ро и закрашенные круги - SLV308 с последующим L-DOPA 7,5 мг/кг, ро. Фиг. 2. Эффект SLV308 (0,26 мг/кг ро) на двигательную активность после обработки L-DOPA (12,5 мг/кг, ро) у обыкновенных игрунок с вызванными МРТР повреждениями (n=6). Точки представляют медианы общего счета двигательной активности в 30-минутных интервалах в течение 7 ч. Стрелка 1 SLV308, стрелка 2 - обработка L-DOPA. Символы: незакрашенные квадраты - группа носителя, закрашенные (черные) квадраты - L-DOPA 12,5 мг/кг, ро, незакрашенные треугольники - SLV308 0,26 мг/кг,ро и закрашенные круги - SLV308 с последующим L-DOPA 12,5 мг/кг, ро. Штриховые линии: пунктирная линия - порог включения, сплошная линия - порог гиперактивности. Планки погрешностей исключены для ясности. Фиг. 3. Эффект SLV308 (0,26 мг/кг, ро) на время двигательного включения после обработки LDOPA (7,5 и 12,5 мг/кг, ро). Полосы представляют медианы общего счета в течение 6 ч после перорального введения SLV308 (0,26 мг/кг, ро; n=6). Полосы представляют медианное время включения в часах. Присутствовало увеличение времени включения между обработками (p 0,001, тест Фридмана).p0,02, значимая разница по сравнению с одним L-DOPA (тест Уилкоксона). Фиг. 4. Эффект SLV308 (0,26 мг/кг, ро) на суммарный счет двигательной активности после обработки L-DOPA (7,5 и 12,5 мг/кг, ро). Полосы представляют медианы общего счета в течение 6 ч после перорального введения SLV308 (0,26 мг/кг, ро; n=6). Увеличение счета являлось значимым между обработками (p 0,001, Крускал-Уоллис).p0,002, значимая разница по сравнению с носителем (тест Манна-Уитни).-8 015073 Фиг. 5. Эффект SLV308 (0,26 мг/кг, ро) на обращение двигательной неспособности посредством LDOPA (7,5 мг/кг, ро) у обыкновенных игрунок после МРТР (n=6). Отдельные точки представляют медианы общих показателей неспособности в 30-минутных интервалах в течение 7 ч после обработки LDOPA. Стрелка 1 - обработка SLV308, стрелка 2 - обработка L-DOPA. Символы: незакрашенные квадраты - группа носителя, закрашенные квадраты - L-DOPA (7,5 мг/кг ро), незакрашенный треугольник SLV308 (0,26 мг/кг, ро) и закрашенные круги - SLV308 с последующим L-DOPA (7,5 мг/кг, ро). Планки погрешностей исключены для ясности. Фиг. 6. Эффект SLV308 (0,26 мг/кг, ро) на обращение двигательной неспособности посредством LDOPA (12,5 мг/кг, ро) у обыкновенных игрунок после МРТР (n=6). Отдельные точки представляют медианы общих показателей неспособности в 30-минутных интервалах в течение 7 ч после обработки LDOPA. Стрелка 1 - обработка SLV308, стрелка 2 - обработка L-DOPA. Символы: незакрашенные квадраты - группа носителя, закрашенные квадраты - L-DOPA (12,5 мг/кг, ро), незакрашенные треугольники SLV308 (0,26 мг/кг ро) и закрашенные круги - SLV308 с последующим L-DOPA 12,5 мг/кг, ро. Планки погрешностей исключены для ясности. Фиг. 7. Эффект SLV308 (0,26 мг/кг, ро) на суммарную двигательную неспособность после обработки L-DOPA (7,5 и 12,5 мг/кг, ро). Полосы представляют медианы общего счета в течение 6 ч после перорального введения SLV308 (0,26 мг/кг, ро; n=6). Уменьшение неспособности являлось значимым между обработками (p 0,0005, Крускал-Уоллис).p0,001 - значимая разница по сравнению с носителем (тест Манна-Уитни).p0,002 по сравнению с L-DOPA (7,5 мг/кг, ро) (тест Манна-Уитни). Ссылки или его фармакологически приемлемые соли и(ii) L-DOPA или его фармакологически приемлемые соли, для одновременного применения для терапии нарушений, требующих восстановления дофаминергической функции. 2. Комбинированный препарат, содержащий или фармакологически приемлемые соли этих соединений и(ii) L-DOPA или его фармакологически приемлемые соли,дополнительно содержащий ингибитор декарбоксилазы, для одновременного применения для терапии нарушений, требующих восстановления дофаминергической функции. 3. Препарат по п.1 или 2, дополнительно содержащий ингибитор COMT. 4. Препарат по любому из пп.1, 2 или 3, дополнительно содержащий ингибитор MAO-B. 5. Применение препарата по любому из пп.1-4 для изготовления лекарственного средства для лечения нарушений, требующих восстановления дофаминергической функции. 6. Применение по п.5, где указанное нарушение представляет собой болезнь Паркинсона. 7. Применение по п.5, где указанное нарушение представляет собой синдром усталых ног. 8. Фармацевтическая композиция, содержащая в дополнение к фармацевтически приемлемому но- 10015073 сителю и/или по меньшей мере одному фармацевтически приемлемому вспомогательному веществу фармакологически активное количество препарата, как заявлено по любому из пп.1-4, в качестве активных ингредиентов.
МПК / Метки
МПК: A61K 31/496, A61K 31/198
Метки: содержащие, l-dopa, slv308, комбинированные, препараты
Код ссылки
<a href="https://eas.patents.su/13-15073-kombinirovannye-preparaty-soderzhashhie-slv308-i-l-dopa.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированные препараты, содержащие slv308 и l-dopa</a>
Предыдущий патент: Динамическая пресс-форма
Следующий патент: Химический способ создания давления
Случайный патент: Композиция для кондиционирования волос, включающая три вида силиконов