Рекомбинантный поксвирус, содержащий по меньшей мере два промотора ati вируса коровьей оспы, и его применение
Формула / Реферат
1. Рекомбинантный поксвирус, содержащий в вирусном геноме по меньшей мере две экспрессионные кассеты, каждая из которых содержит промотор ATI вируса коровьей оспы или его производное или субпоследовательность промотора ATI или ее производное и кодирующую последовательность, где экспрессия кодирующей последовательности регулируется указанным промотором, производным или субпоследовательностью и где производное промотора ATI коровьей оспы является последовательностью, которая имеет гомологию по меньшей мере 60% при сравнении с последовательностью
SEQ ID NO:1, и/или последовательностью, в которой не более чем 6 нуклеотидов заменены, делетированы и/или инсертированы в последовательности SEQ ID NO:1, причем длина субпоследовательности промотора ATI составляет по меньшей мере 10 нуклеотидов последовательности SEQ ID NO:1, и промотор, производное или субпоследовательность имеют такую же биологическую активность, что и активность исходного промотора.
2. Рекомбинантный поксвирус по п.1, где промотор, производное или субпоследовательность являются поздним промотором вируса осповакцины.
3. Рекомбинантный поксвирус по любому из пп.1, 2, где промотор, производное или субпоследовательность содержат нуклеотиды 25-29 или 22-29 SEQ ID NO:1.
4. Рекомбинантный поксвирус по любому из пп.1-3, в котором экспрессия каждой кодирующей последовательности в каждой экспрессионной кассете находится под контролем каждого промотора ATI, или каждого производного, или каждой субпоследовательности, причем производные или субпоследовательности имеют одинаковую структуру.
5. Рекомбинантный поксвирус по любому из пп.1-4, где по меньшей мере две экспрессионные кассеты встроены в один и тот же сайт инсерции в геноме поксвируса.
6. Рекомбинантный поксвирус по любому из пп.1-5, где промотор по меньшей мере в одной из экспрессионных кассет имеет последовательность SEQ ID NO:1.
7. Рекомбинантный поксвирус по любому из пп.1-6, где промотор по меньшей мере в одной из экспрессионных кассет является производным промотора ATI, или субпоследовательностью промотора ATI, или ее производным.
8. Рекомбинантный поксвирус по любому из пп.1-7, полученный на основе поксвируса, выбранного из группы, состоящей из ортопоксвирусов и авипоксвирусов.
9. Рекомбинантный поксвирус по п.8, где ортопоксвирус является вирусом осповакцины и где авипоксвирус выбран из поксвируса канареек и поксвируса домашней птицы.
10. Рекомбинантный поксвирус по п.9, где вирус осповакцины является модифицированным штаммом вируса осповакцины Ankara (MVA), в частности MVA-BN V00083008 и MVA 575 V00120707 соответственно.
11. Рекомбинантный поксвирус по п.10, где по меньшей мере одна из экспрессионных кассет встроена в природный сайт делеции генома MVA относительно генома штамма Copenhagen вируса осповакцины.
12. Рекомбинантный поксвирус по любому из пп.1-11, где по меньшей мере одна из экспрессионных кассет встроена в межгенную область генома поксвируса.
13. Рекомбинантный поксвирус по любому из пп.1-12, где по меньшей мере одна из кодирующих последовательностей кодирует по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение.
14. Применение рекомбинантного поксвируса по любому из пп.1-13 в качестве вакцины или лекарственного средства для индукции иммунного ответа.
15. Вакцина или фармацевтическая композиция, содержащая рекомбинантный поксвирус по любому из пп.1-13, для индукции иммунного ответа.
16. Применение рекомбинантного поксвируса по любому из пп.1-13 для получения вакцины или лекарственного средства для индукции иммунного ответа.
17. Способ введения кодирующих последовательностей в клетки-мишени, предусматривающий инфицирование этих клеток-мишеней вирусом по любому из пп.1-13.
18. Способ получения пептида, белка и/или вируса, предусматривающий:
a) инфицирование клетки-хозяина рекомбинантным поксвирусом по любому из пп.1-13;
b) культивирование инфицированной клетки-хозяина в подходящих условиях и
c) выделение и/или обогащение пептида, и/или белка, и/или вируса, продуцируемых указанной клеткой-хозяином.
19. Способ индукции иммунного ответа в организме животного, в том числе человека, включающий введение вируса по любому из пп.1-13, или композиции, или вакцины по п.15 подлежащему лечению животному или человеку.
20. Способ по п.19, включающий введение по меньшей мере 102 TCID50 (инфекционных доз культуры ткани) вируса.
21. Клетка, содержащая вирус по любому из пп.1-13.
22. Способ получения рекомбинантного вируса по любому из пп.1-13, включающий встраивание по меньшей мере двух экспрессионных кассет в геном поксвируса.
Текст
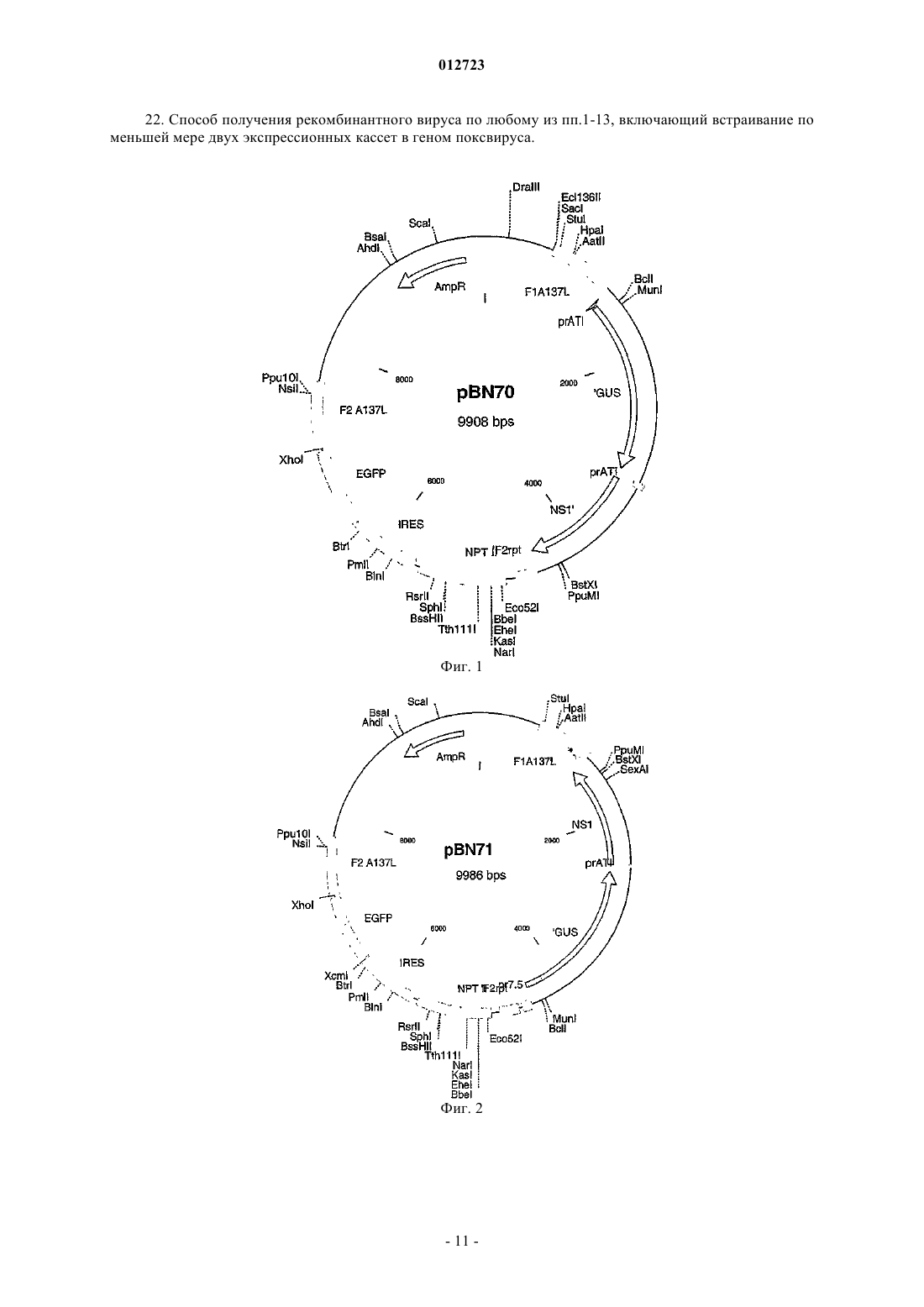
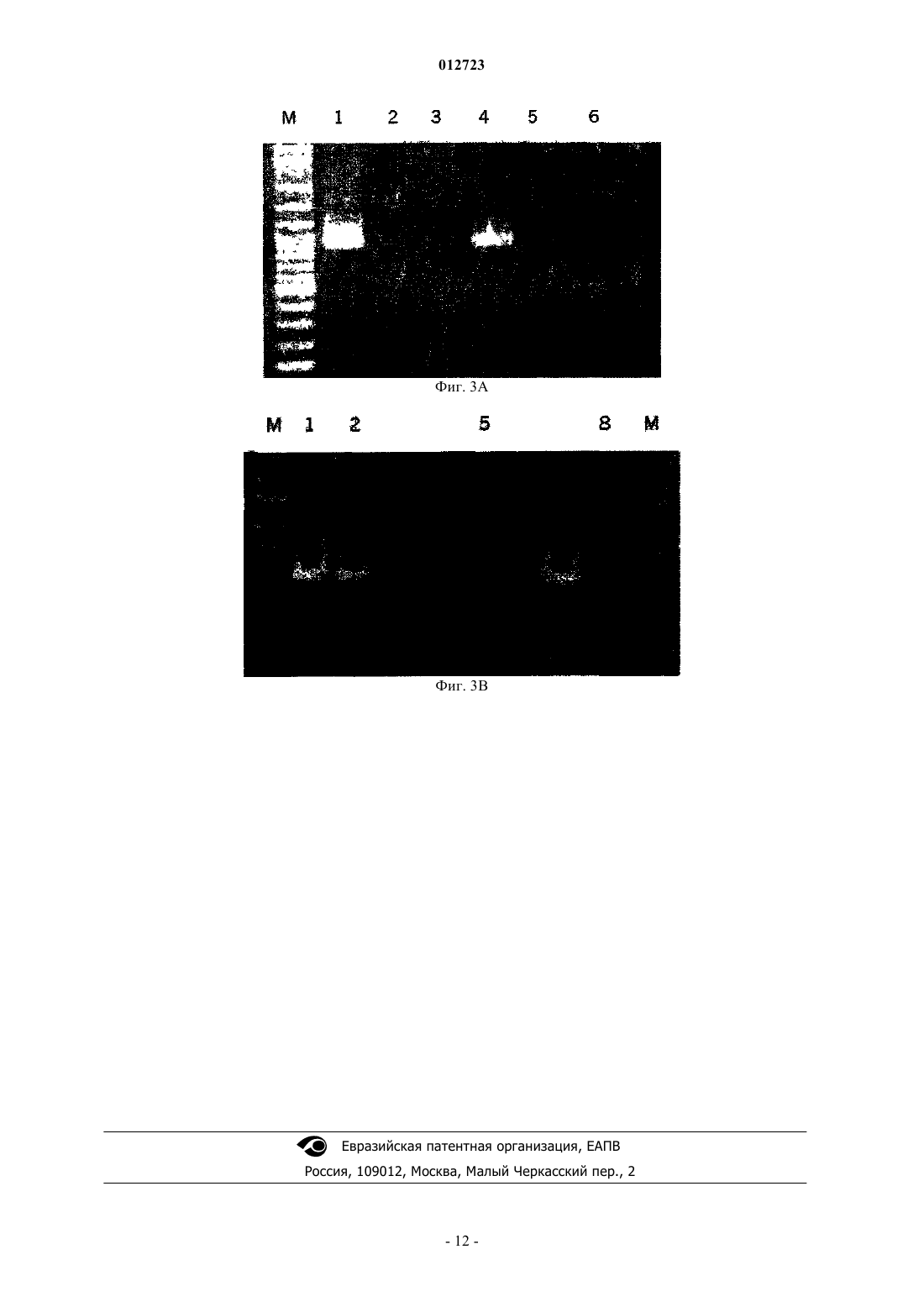
012723 Изобретение относится к рекомбинантным поксвирусам, содержащим в вирусном геноме по меньшей мере две экспрессионные кассеты, каждая из которых содержит промотор ATI коровьей оспы или его производное и кодирующую последовательность, причем экспрессия этой кодирующей последовательности регулируется указанным промотором или его производным. Этот вирус может быть применим в качестве вакцины или в качестве части фармацевтической композиции. Уровень техники Рекомбинантные поксвирусы широко используются для экспрессии чужеродных антигенов в инфицированных клетках. Кроме того, рекомбинантные поксвирусы испытываются в настоящее время в качестве очень многообещающих вакцин для индукции иммунной реакции против чужеродных антигенов,экспрессируемых из поксвирусного вектора. Наиболее популярны, с одной стороны, авипоксвирусы и, с другой стороны, вирусы коровьей оспы. В US 5736368 и US 6051410 описан рекомбинантный штаммWyeth вируса коровьей оспы, который экспрессирует антигены и белки ВИЧ. В US 5747324 описан рекомбинантный штамм NYCBH вируса коровьей оспы, экспрессирующий гены лентивируса. В ЕР 0243029 описан рекомбинантный штамм Western Reserve вируса коровьей оспы, экспрессирующий гены ретровируса человека. Поксвирусы домашней птицы, содержащие гены ВИЧ в вирусном геноме,описаны в US 5736368 и US 6051410. Для индукции эффективной иммунной реакции желательно экспрессировать не только единственный белок агента, против которого должна быть индуцирована иммунная реакция. Вместо этого предпочтительно экспрессировать настолько много различных белков и эпитопов указанного агента, насколько это возможно для получения широкого и эффективного иммунитета против указанного агента. Таким образом, может быть выгодным инсертирование нескольких различных экспрессионных кассет в один и тот же поксвирусный геном, если предполагается применение этого поксвируса в качестве вектора для вакцинации. В US 5736368 описано конструирование несущих рекомбинантный поксвирус экспрессионных кассет для гена env ВИЧ-1 и гена gag-pol ВИЧ-1. Для экспрессии белков, кодируемых этими различными экспрессионными кассетами, используют различные промоторы, а именно промотор D1 и промотор 40K вируса коровьей оспы. Недостатком этой стратегии является то, что активности этих различных промоторов не являются идентичными, что приводит к разному уровню белков, экспрессируемых из этих различных экспрессионных кассет. Почти идентичный уровень экспрессии мог бы быть получен, если бы промоторы в различных экспрессионных кассетах в поксвирусном геноме были идентичными. Однако недостатком этой стратегии является то, что существует риск, что могут иметь место нежелательные события рекомбинации между гомологичными/идентичными промоторными последовательностями. Действительно, Howley et al. (Gene(1996) 172, 233-237) было показано, что может быть генерирован рекомбинантный вирус коровьей оспы,который содержит три промотора р 7.5 в различных местоположениях вирусного генома; однако имела место рекомбинация между этими гомологичными промоторными последовательностями, приводящая к смешанной геномной популяции этого рекомбинантного поксвируса. Такая смешанная и неопределенная геномная популяция, которая отражает нестабильность вирусного генома, является неприемлемой, если она предназначается для использования рекомбинантного поксвируса для вакцинации, в частности для вакцинации людей. Цель изобретения Целью данного изобретения является обеспечение стабильных рекомбинантных поксвирусов, несущих по меньшей мере две экспрессионные кассеты, предпочтительно для генов, которые природно не являются частью поксвирусного генома, причем должно быть возможным получение белков, кодируемых указанными по меньшей мере двумя различными экспрессионными кассетами, в одинаковых количествах. Подробное описание изобретения Эта цель была достигнута обеспечением рекомбинантных поксвирусов, содержащих в вирусном геноме по меньшей мере две экспрессионные кассеты, каждая из которых содержит промотор ATI коровьей оспы или его производное и кодирующую последовательность, причем экспрессия этой кодирующей последовательности регулируется указанным промотором или его производным. Авторами данного изобретения было показано, что поксвирусы, содержащие две или более копий промотора ATI, являются неожиданно стабильными; было показано, что не происходили детектируемые события рекомбинации между этими гомологичными или даже идентичными последовательностями промотора ATI. Это находится в противоречии с вирусами коровьей оспы, содержащими два или более промоторов р 7.5 в вирусном геноме. Согласно данному изобретению поксвирус может быть любым поксвирусом, в котором экспрессия генов должна регулироваться промотором ATI или его производным. Таким образом, поксвирус может быть любым вирусом подсемейства Chordopoxvirinae и Entomopoxvirinae (см. Fields Virology 3rd edition,Lippincott-Raven Publishers, Philadelphia, USA, Chapter: 83, ISBN 0-7817-0253-4). Вирусы из подсемействаChordopoxvirinae являются особенно предпочтительными, если рекомбинантный поксвирус используется для экспрессии генов в млекопитающих животных, в том числе людях. Особенно предпочтительными родами, принадлежащими к подсемейству Chordopoxvirinae, являются ортопоксвирусы, парапоксвирусы,-1 012723 авипоксвирусы, каприпоксвирусы, лепорипоксвирусы и суипоксвирусы. Наиболее предпочтительными являются ортопоксвирусы и авипоксвирусы. Примерами авипоксвирусов являются поксвирусы канареек и поксвирусы домашней птицы. Примером ортопоксвируса является вирус коровьей оспы. Штаммом вируса коровьей оспы, который может быть использован в соответствии с данным изобретением, может быть любой штамм вируса коровьей оспы, такой как штаммы Copenhagen, Temple of Heaven, Wyeth,Western Reserve, Elstree, NYCBH и т.д. Особенно предпочтительным является штамм вируса Modified Vaccinia Ankara (MVA). MVA был получен 516 серийными пассажами на фибробластах куриных эмбрионов штамма Ankara вируса коровьей оспы (CVA) (в отношении обзора см. Mayr, A., et al. Infection 3, 6-14, 1975). Вследствие этих долгосрочных пассажей полученный вирус MVA делетировал приблизительно 31 т.п.н. из его геномной последовательности и, следовательно, был описан как высокорестриктированный в отношении клеткихозяина, а именно в отношении клеток птиц (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038, 1991). Было показано на различных моделях животных, что полученный MVA был значимо авирулентным (Mayr, A.Danner, K. Dev. Biol. Stand. 41: 225-34,1978). Кроме того, этот штамм MVA был испытан в клинических испытаниях в качестве вакцины для иммунизации против заболевания оспы (натуральной) человека(Mayr et al., Zbl. Bact. Hyg. I, Abt. Org. В 167, 375-390, 1987), Stickl et al., Dtsch. med. Wschr. 99, 23862392, 1974). В соответствии с изобретением может быть использован любой штамм MVA. Примерами штаммов вируса MVA, используемых в соответствии с изобретением и депонированных в соответствии с требованиями Будапештского Договора, являются штаммы MVA 572 и MVA 575, депонированные в Европейской Коллекции Культур Клеток Животных (ЕСАСС), Salisbury (UK) с номерами депозитов ЕСАСС V94012707 и ЕСАСС V00120707 соответственно и MVA-BN с номером депозита ЕСАСС V00083008. Наиболее предпочтительным MVA-штаммом является MVA-BN или его производное. ПризнакиMVA-BN, описание биологических анализов, позволяющих оценить, является ли штамм MVA штаммомMVA-BN или его производным, и способы, позволяющие получать MVA-BN или его производное, описаны в WO 02/42480. Содержание этой заявки включено в настоящее описание в виде ссылки. В общих чертах, предпочтительно использовать вирусы, которые не являются вредными для животного, в том числе человека, если вирус используют для вакцинации или лечения животного, в том числе человека. Для людей особенно безопасными поксивирусами являются различные штаммы вируса коровьей оспы, такие как MVA, и авипоксвирусы, такие как поксвирус домашней птицы и поксвирус канареек. Для размножения поксвирусов эукариотические клетки инфицируют вирусом. Такими эукариотическими клетками являются клетки, которые восприимчивы к инфекции соответствующим поксвирусом и делают возможными репликацию и продуцирование инфекционного вируса. Такие клетки известны специалисту с квалификацией в данной области для каждого вида поксвируса. Для MVA примером этого типа клеток являются фибробласты куриного эмбриона (CEF) и клетки BHK (Drexler I., Heller K., Wahren В., Erfle V. and Sutter G., J. Gen. Virol. (1998), 79, 347-352). Клетки CEF могут культивироваться при условиях, известных лицу с квалификацией в данной области. Предпочтительно клетки CEF культивируют в бессывороточной среде в стационарных колбах или роллерных флаконах. Инкубирование происходит предпочтительно в течение 48-96 ч при 372 С. Для инфицирования MVA предпочтительно используют при множественности заражения (MOI) 0,05-1 TCID50, и инкубирование предпочтительно происходит в течение 48-72 ч при 372 С. Последовательность промотора гена белка включения А-типа вируса коровьей оспы (промотораATI) известна лицу с квалификацией в данной области. В этой связи делается ссылка на номер доступаGenebank entry accession number D00319. Предпочтительная последовательность промотора ATI показана в виде SEQ ID NO:1 и является следующей: 5' GTTTT GAATA АААТТ ТТТТТ АТААТ АААТ 3' В соответствии с изобретением можно использовать промотор ATI в том виде, как указано вSEQ ID NO:1, или использовать производное этого промотора ATI, которое может быть субпоследовательностью последовательности SEQ ID NO:1. Термин субпоследовательность последовательностиSEQ ID NO:1 относится к более коротким фрагментам последовательности SEQ ID NO:1, которые все еще являются активными в качестве промотора, в частности позднего промотора вируса коровьей оспы. Типичный фрагмент последовательности SEQ ID NO:1 имеет длину по меньшей мере 10 нуклеотидов,более предпочтительно по меньшей мере 15 нуклеотидов, еще более предпочтительно по меньшей мере 20 нуклеотидов, наиболее предпочтительно по меньшей мере 25 нуклеотидов последовательностиSEQ ID NO:1. Эта субпоследовательность предпочтительно может содержать нуклеотиды 25-29SEQ ID NO:1, т.е. последовательность 5'-ТАААТ-3', локализованную на 3'-конце SEQ ID NO:1. Эта субпоследовательность может также содержать нуклеотиды 22-29 SEQ ID NO:1, т.е. последовательность 5'-ТААТАААТ-3', расположенную на 3'-конце SEQ ID NO:1.-2 012723 Промотор может быть встроен слева от кодирующей последовательности таким образом, что нуклеотиды 28-29 SEQ ID NO:1 (подчеркнутые в последовательности, приведенной выше) являются частью стартового кодона трансляции 5'-ATG-3'. Альтернативно, этот промотор может быть отделен несколькими нуклеотидами от стартового кодона трансляции. Спейсер между 3'-концом промотора в соответствии с SEQ ID NO:1 и А в стартовом кодоне 5'-ATG-3' содержит предпочтительно менее чем 100 нуклеотидов,более предпочтительно менее чем 50 нуклеотидов и еще более предпочтительно менее чем 25 нуклеотидов. Однако этот спейсер может быть даже еще более длинным, пока этот промотор все еще способен управлять экспрессией кодирующей последовательности, расположенной справа от этого промотора. Производным промотора ATI может быть также последовательность, которая имеет одну или более нуклеотидных замен, делеций и/или инсерций относительно последовательности SEQ ID NO:1 или ее субпоследовательности, причем указанные производные все еще являются активными в качестве промотора, в частности позднего промотора вируса коровьей оспы. Последовательность, имеющая одну или несколько нуклеотидных замен, является последовательностью, в которой один или несколько нуклеотидов последовательности, соответствующей SEQ ID NO:1, заменен отличающимися нуклеотидами. Последовательность, имеющая одну или несколько инсерций, является последовательностью, в которой один или несколько нуклеотидов инсертирован в одном или нескольких местоположениях последовательности, соответствующей SEQ ID NO:1. Последовательность, имеющая одну или несколько нуклеотидных делеций, является последовательностью, в которой один или несколько нуклеотидов последовательности, соответствующей SEQ ID NO:1, делетирован в одном или нескольких местоположениях. В производных SEQ ID NO:1 делеции, замены и инсерции могут быть объединены в одной последовательности. Предпочтительно это производное имеет гомологию по меньшей мере 40%, более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 80%, наиболее предпочтительно по меньшей мере 90% в сравнении с последовательностью SEQ ID NO:1. В соответствии с наиболее предпочтительным вариантом осуществления в последовательности SEQ ID NO:1 заменены, делетированы и/или инсертированы не более чем 6 нуклеотидов, даже более предпочтительно не более чем 3 нуклеотида. В частности, может быть предпочтительным сохранение нуклеотидов 25-29 SEQ ID NO:1, т.е. последовательности 5'-ТАААТ-3', в промоторе для получения максимальной промоторной активности. Может быть предпочтительным сохранение нуклеотидов 22-29 SEQ ID NO:1, т.е. последовательности 5'-ТААТАААТ-3', в этом промоторе. Приведенные выше замечания относительно местоположения промотора ATI или его субпоследовательностей приложимы также к определенным выше последовательностям, имеющим одну или несколько замен, делеций и/или инсерций относительно последовательности, соответствующейSEQ ID NO:1, или относительно ее субпоследовательности. Большое количество документов известного уровня техники позволяет лицу с квалификацией в данной области предсказывать, какие производные SEQ ID NO:1 все еще имеют биологическую активность, являясь активными в качестве промотора поксвируса, в частности в качестве позднего промотора вируса коровьей оспы. В этой связи делается ссылка на Chakrarbarti et al., Biotechniques (1997), 23, 10941097 и Davison and Moss, J. Mol. Biol. (1989), 210, 771-784. Кроме того, лицо с квалификацией в данной области может легко проверить, является ли фрагмент все еще активным в качестве промотора поксвируса, в частности позднего промотора вируса коровьей оспы. В частности, это производное последовательности может быть клонировано слева от репортерного гена в плазмидной конструкции. Указанная конструкция может быть трансфицирована в эукариотическую клетку или клеточную линию, такую как клетки CEF или BHK, которые были инфицированы поксвирусом. Поксивирусом, используемым для инфицирования, является предпочтительно поксвирус из того же самого рода и даже более предпочтительно тот же самый поксвирус, что и поксвирус, в геном которого должен быть инсертирован этот промотор. Затем определяют экспрессию репортерного гена и сравнивают с экспрессией этого репортерного гена, регулируемой промотором в соответствии с SEQ ID NO:1. Производное в соответствии с данным изобретением является предпочтительно производным, имеющим промоторную активность в указанной тест-системе по меньшей мере 10%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 50%, даже более предпочтительно по меньшей мере 70%, наиболее предпочтительно 90% в сравнении с активностью промоторной последовательности SEQ ID NO:1. В объеме данного изобретения находятся также производные SEQ ID NO:1, которые имеют более высокую активность, чемSEQ ID NO:1. Согласно изобретению рекомбинантный поксвирус содержит по меньшей мере две экспрессионные кассеты, каждая из которых содержит промотор ATI или его производное. Другими словами, геном рекомбинантного поксвируса может содержать два или более промоторов ATI или их производных. Таким образом, может быть случай, когда все из промоторов ATI имеют последовательность, соответствующуюSEQ ID NO:1. Может быть также, что все промоторы ATI являются одним и тем же производным последовательности, соответствующей SEQ ID NO:1. Альтернативно, один или несколько промоторов ATI может иметь последовательность SEQ ID NO:1, а один или несколько промоторов ATI в том же самом поксвирусном геноме может быть производными последовательности, соответствующей SEQ ID NO:1.-3 012723 Если такой поксвирусный геном содержит два или несколько производных промотора ATI, эти производные могут быть одинаковыми или различными. В соответствии с дополнительной альтернативой все промоторы ATI в поксвирусном геноме могут быть различными производными последовательности, соответствующей SEQ ID NO:1. В общих чертах изобретение относится к рекомбинантным поксвирусам, содержащим по меньшей мере два промотора ATI или их производных в поксвирусном геноме. Таким образом, вирусный геном может содержать, например, два, три, четыре, пять, шесть или более промоторов ATI или их производных в вирусном геноме. Промоторы ATI или их производные являются обычно частью экспрессионных кассет, каждая из которых содержит промотор ATI вируса коровьей оспы или его производное и кодирующую последовательность, экспрессия которой регулируется указанными промоторами. Этими кодирующими последовательностями могут быть любые последовательности, экспрессия которых должна контролироваться промотором ATI или его производным. В соответствии с одной альтернативой по меньшей мере один из промоторов ATI в поксвирусном геноме может быть использован для экспрессии гена, который уже является частью поксвирусного генома. Таким геном может быть ген, который является природной частью этого вирусного генома, или чужеродный ген, который уже был встроен в поксвирусный геном. В этих случаях промотор ATI встраивают слева от этого гена в поксвирусном геноме, экспрессия которого должна регулироваться этим промотором ATI. Альтернативно или дополнительно, по меньшей мере один из промоторов ATI или их производных может быть частью экспрессионной кассеты, которую вводят в поксвирусный геном. Экспрессионные кассеты, содержащие промотор ATI или его производное и кодирующую последовательность, могут быть встроены в любом подходящем местоположении вирусного генома. Без связывания со следующими примерами подходящие сайты инсерций могут быть выбраны из (i) несущественных генов, таких какTK-ген; (ii) генов, которые необходимы для репликации вируса, если функция указанного гена дополняется клеткой, которую используют для размножения этого вируса; (iii) межгенных районов поксвирусного генома, где термин межгенный район обозначает предпочтительно части вирусного генома, расположенные между двумя соседними генами, которые не содержат кодирующих последовательностей; (iv) природно встречающихся сайтов делеции поксвирусного генома. Примером вирусного генома, имеющего природно встречающийся сайт делеции, является геном MVA, в котором некоторые районы являются делетированными относительно генома штамма Copenhagen вируса коровьей оспы. Как указывалось выше, сайты инсерции не ограничиваются этими предпочтительными сайтами инсерции, так как в рамках изобретения находится то, что экспрессионная кассета может быть встроена в любом месте вирусного генома, пока можно получить рекомбинанты, которые могут быть амплифицированы и размножены по меньшей мере в одной системе культуры клеток, такой как фибробласты куриного эмбриона (клетки CEF), в случае MVA и других поксвирусов, таких как вирусы коровьей оспы в целом и авипоксвирусы. Различные экспрессионные кассеты/промоторы ATI или их производные могут быть инсертированы в различные сайты инсерции в поксвирусном геноме. По разным причинам может быть предпочтительно инсертирование двух или более экспрессионных кассет в один и тот же сайт инсерции поксвирусного генома. Однако в таком случае должна быть исключена возможность осуществления гомологичной рекомбинации между этими различными экспрессионными кассетами. Гомологичная рекомбинация приводила бы к рекомбинантным вирусам, в которых части экспрессионных кассет являются делетированными. Поскольку делетируются несущественные части генома поксвирусного вектора, полученные рекомбинанты являются все еще жизнеспособными. Таким образом, не может проводиться отбор на вирусы, сохранившие две или более экспрессионных кассет в одном и том же сайте инсерции. Во избежание таких нежелательных событий рекомбинации в существующем состоянии данной области использовали различные промоторы, если две или более экспрессионных кассет встраивали в один и тот же сайт инсерции. Согласно изобретению теперь можно встраивать две или более экспрессионных кассет, каждая из которых содержит промотор ATI или его производное, в один и тот же сайт инсерции, так как не происходит гомологичная рекомбинация между этими промоторами в этих экспрессионных кассетах. Таким образом, в соответствии с предпочтительным вариантом осуществления по меньшей мере две, если не все, экспрессионные кассеты встраивают в один и тот же сайт инсерции в поксвирусном геноме. В этом случае различные экспрессионные кассеты находятся непосредственно рядом с не принадлежащими поксвирусу последовательностями между различными экспрессионными кассетами или, по меньшей мере, только с короткими поксвирусными последовательностями между различными экспрессионными кассетами. Способы, необходимые для конструирования рекомбинантных поксвирусов, известны лицу с квалификацией в данной области. В качестве примера экспрессионная кассета и/или промотор ATI или его производное могут быть встроены в поксвирусный геном гомологичной рекомбинацией. Для этой цели нуклеиновую кислоту трансфицируют в пермиссивную клеточную линию, причем эта нуклеиновая ки-4 012723 слота содержит экспрессионную кассету и/или промотор ATI или его производное, фланкированные нуклеотидными отрезками, которые являются гомологичными району поксвирусного генома, в который должная быть инсертирована эта экспрессионная кассета и/или промотор ATI или его производное. ДляMVA пермиссивными клетками являются клетки CEF и клетки BHK. Эти клетки инфицируют поксвирусом, и в этих инфицированных клетках происходит гомологичная рекомбинация между этой нуклеиновой кислотой и вирусным геномом. Альтернативно, можно сначала инфицировать эти клетки поксвирусом и затем трансфицировать нуклеиновую кислоту в инфицированные клетки. В этом случае опять происходит рекомбинация в этих клетках. Затем рекомбинантные поксвирусы отбирают способами, известными в данной области. Конструирование рекомбинантных поксвирусов не ограничивается этим конкретным способом. Вместо этого для этой цели может быть использован любой подходящий способ, известный лицу с квалификацией в данной области. Промотор ATI в рекомбинантном поксвирусе может быть использован для контроля экспрессии любой кодирующей последовательности (любых кодирующих последовательностей). Эта кодирующая последовательность может предпочтительно кодировать по меньшей мере один антигенный эпитоп или антиген. В этом случае рекомбинантный поксвирус может быть использован для экспрессии указанного антигена после инфицирования клеток в организме, например, млекопитающего животного, в том числе человека. Презентация указанного антигена/эпитопа может индуцировать иммунную реакцию в организме, которая может приводить к вакцинации этого организма против агента, из которого получен этот антиген/эпитоп. Более конкретно, этот эпитоп/антиген может быть частью большей аминокислотной последовательности, такой как полиэпитоп, пептид или белок. Примерами таких полиэпитопов, пептидов или белков могут быть полиэпитопы, пептиды или белки, полученные из (i) вирусов, таких как ВИЧ,HTLV, герпесвирус, вирус денге, полиовирус, вирус кори, вирус паротита, вирус коревой краснухи, вирусы гепатита и т.д.; (ii) бактерий; (iii) грибов. Эти белки, пептиды или эпитопы, экспрессируемые из различных экспрессионных кассет, могут происходить из одного и того же агента, такого как вирус, бактерия или гриб. В качестве примера все продукты, экспрессируемые из этих экспрессионных кассет, могут быть белками ВИЧ. Если все продукты происходят из одного и того же агента, можно индуцировать очень широкую иммунную реакцию против указанного агента. Альтернативно, возможным является также, что эти белки, пептиды или эпитопы, экспрессируемые из различных экспрессионных кассет, происходят из различных агентов. В качестве примера продукты, полученные из экспрессионных кассет в одном поксвирусном геноме, происходят из различных вирусов, таких как вирус паротита, вирус кори и вирус коревой краснухи. Согласно этому варианту осуществления можно использовать один рекомбинантный поксвирус для индукции иммунной реакции против нескольких антигенов. Альтернативно, по меньшей мере одна из кодирующих последовательностей может кодировать терапевтическое соединение, такое как интерлейкины, интерфероны, рибозимы, ферменты и т.д. Рекомбинантный поксвирус в соответствии с изобретением может быть введен в организм животного или человека в соответствии со знаниями лица с квалификацией в данной области. Таким образом,рекомбинантный поксвирус в соответствии с изобретением может быть применим в качестве медикамента (т.е. фармацевтической композиции) или вакцины. Фармацевтическая композиция или вакцина может обычно включать в себя один или несколько фармацевтически приемлемых и/или одобренных носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов, наряду с рекомбинантным поксвирусом. Такими вспомогательными веществами могут быть вода, солевой раствор, глицерин, этанол, увлажняющие или эмульгирующие агенты, буферящие рН вещества или т.п. Подходящими носителями являются обычно большие,медленно метаболизирующиеся молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты или т.п. Для приготовления фармацевтических композиций или вакцин рекомбинантный поксвирус превращают в физиологически приемлемую форму. Это может быть выполнено на основании опыта в приготовлении поксвирусных вакцин, используемых для вакцинации против оспы (натуральной) (как описано Stickl, H. et al. Dtsch. med. Wschr. 99, 2386-2392, 1974). Например, если поксвирусом является MVA,этот очищенный вирус может храниться при -80 С с титром 5108 TCID50/мл, приготовленный в приблизительно 10 мМ Трис, 140 мМ NaCl рН 7,4. Для приготовления вакцинных доз, например, 101-109 частиц рекомбинантного вируса данного изобретения лиофилизируют в забуференном фосфатом солевом растворе (ЗФР) в присутствии 2% пептона и 1% человеческого альбумина в ампуле, предпочтительно стеклянной ампуле. Альтернативно, вакцинные дозы могут быть получены ступенчатой лиофилизацией вируса в препарате. Этот препарат может содержать дополнительные добавки, такие как маннит, декстран,сахар, глицин, лактозу или поливинилпирролидон, или другие добавки, такие как антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, человеческий сывороточный альбумин), пригодные для введения in vivo. Типичный препарат, пригодный для лиофилизации рекомбинантного MVA, содержит 100 мМ Трис-буфер, 140 мМ NaCl, 18,9 г/л декстрана (молекулярная масса 36000-40000), 45 г/л сахарозы, 0,108 г/л моногидрата монокалиевой соли L-глутаминовой кислоты рН 7,4. Затем стеклянную ампулу запаивают, и она может храниться при 4 С комнатной температуры в те-5 012723 чение нескольких месяцев. Однако пока нет необходимости ее применения, эту ампулу хранят предпочтительно при температуре ниже -20 С. Для вакцинации или терапии этот лиофилизат может быть растворен в 0,1-0,5 мл водного раствора,предпочтительно воды, физиологического солевого раствора или Трис-буфера, и введен либо системно,либо локально, т.е. парентеральным, внутримышечным или любым другим способом введения, известным квалифицированному практику. Способ введения, доза и количество введений могут быть оптимизированы специалистами с квалификацией в данной области известным образом. Таким образом, в соответствии с родственным вариантом осуществления изобретение относится к способу воздействия на иммунологическую реакцию, предпочтительно индукции иммунологической реакции в теле живого животного, в том числе человека, предусматривающему введение вируса, композиции или вакцины в соответствии с изобретением животному или человеку, которые должны лечиться. Если рекомбинантным поксвирусом является рекомбинантный MVA, вакцинная доза обычно содержит по меньшей мере 102, предпочтительно по меньшей мере 104, более предпочтительно по меньшей мере 106, даже более предпочтительно 108-109 TCID50 (инфекционных доз для культуры ткани) этого вируса. Изобретение дополнительно относится к способу введения по меньшей мере двух кодирующих последовательностей в клетки-мишени, предусматривающему инфицирование клеток-мишеней вирусом по изобретению. Клеткой-мишенью может быть клетка, в которой этот вирус способен реплицироваться,или клетка, которая может быть инфицирована этим рекомбинантным вирусом, но в которой этот вирус не реплицируется, такой как все типы клеток человека, в случае рекомбинантного MVA. Далее, изобретение относится к способу получения пептида, белка и/или вируса, предусматривающему инфицирование клетки-хозяина рекомбинантным вирусом по изобретению с последующим культивированием инфицированной клетки-хозяина при подходящих условиях с последующим выделением и/или обогащением этого пептида, и/или белка, и/или вирусов, продуцируемых указанной клеткойхозяином. Если предполагается продуцировать, т.е. размножать, вирус в соответствии с изобретением,этой клеткой должна быть клетка, в которой этот вирус способен реплицироваться, такая как клетка CEF или BHK, в случае рекомбинантного MVA. Если предполагается продуцировать пептид/белок, кодируемый этим вирусом, предпочтительно белок/пептид, кодируемый кодирующей последовательностью, экспрессия которой регулируется промотором ATI или его производным, этой клеткой может быть любая клетка, которая может быть инфицирована этим рекомбинантным вирусом и которая делает возможной экспрессию кодируемых поксвирусом белков/пептидов. Изобретение дополнительно относится к клеткам, инфицированным вирусом по изобретению. Краткое описание чертежей Фиг. 1 и 2. Схематическое представление рекомбинантных векторов pBN70 (фиг. 1) и pBN71F1A137L = боковая сторона Flank 1 района инсерции; F2A1371 = боковая сторона Flank 2 района инсерции; F2rpt = повтор боковой стороны Flank 2; prATI = промотор ATI; pr7.5 = промотор р 7.5;IRES = внутренний сайт вхождения рибосом; EGFP - район, кодирующий белок усиленной зеленой флуоресценции; AmpR = ген устойчивости к ампициллину. Фиг. 3. ОТ-ПЦР-анализ для определения экспрессии гена NS1 в клетках, инфицированныхMVA-mBN30 (фиг. 3 А) или MVA-mBN31 (фиг. 3 В). Во всех случаях, в которых выполняли ПЦР, праймер был специфическим в отношении гена NS1: А) М: маркер молекулярных масс; дорожка 1: анализ с плазмидой pBN70 (положительный контроль); дорожка 2: анализ без добавленных нуклеиновых кислот (отрицательный контроль); дорожка 3: ПЦР с РНК, выделенной из BHK-клеток, инфицированных MVA-mBN30, без добавления обратной транскриптазы; дорожка 4: ОТ-ПЦР с РНК, выделенной из BHK-клеток, инфицированных MVA-mBN30; дорожка 5: ПЦР с РНК, выделенной из клеток BHK, инфицированных MVA-BN, без добавления обратной транскриптазы; дорожка 6: ОТ-ПЦР с РНК, выделенной из клеток BHK, инфицированных MVA-BN; В) М: маркер молекулярных масс; дорожка 1: ОТ-ПЦР с РНК, выделенной из клеток, инфицированных mBN31; дорожка 2: ОТ-ПЦР с РНК, выделенной из клеток, инфицированных различными рекомбинантнымиMVA, содержащими ген NS1 в геноме; дорожка 3: ОТ-ПЦР с РНК из клеток, инфицированных MVA-BN; дорожка 4: ПЦР с РНК, выделенной из клеток, инфицированных mBN31 (без добавленной обратной транскриптазы); дорожка 5: ПЦР с РНК из клеток, инфицированных различными рекомбинантными MVA, содержащими ген NS1 в геноме (без добавленной обратной транскриптазы); дорожка 6: ПЦР с РНК из клеток, инфицированных MVA-BN (без добавленной обратной транскриптазы);-6 012723 дорожка 7: анализ с плазмидой pBN71 (положительный контроль); дорожка 8: анализ без добавленных нуклеиновых кислот (отрицательный контроль). Пример Следующий пример будет дополнительно иллюстрировать изобретение. Специалисту будет понятно, что представленный пример никоим образом не может рассматриваться как ограничение только этим примером применимости технологии, обеспечиваемой изобретением. Стабильное инсертирование двух чужеродных генов, регулируемых промотором ATI коровьей оспы, в единственный сайт генома MVA Целью этого примера была демонстрация того, что инсерция двух чужеродных генов, оба из которых регулируются промотором ATI, является стабильной. Резюме. Следующий пример демонстрирует стабильность рекомбинантного MVA, содержащего две копии промотора ATI в вирусном геноме. Для этой цели промотор ATI коровьей оспы сливали с геном GUSGUS сливали также с природно встречающимся промотором pr7.5 вируса коровьей оспы. Экспрессионную кассету промотор ATI-ген NS1, либо экспрессионную кассету промотор ATI-ген GUS, либо экспрессионную кассету промотор р 7.5-ген GUS встраивали в рекомбинантный вектор, содержащий последовательности, гомологичные геному MVA (фиг. 1 и 2). В полученных плазмидах pBN70 (экспрессионная кассета промотор ATI-ген NS1 и экспрессионная кассета промотор ATI-ген GUS) и pBN71 (экспрессионная кассета промотор ATI-ген NS1 и экспрессионная кассета промотор р 7.5-ген GUS) эти экспрессионные кассеты были фланкированы последовательностями, гомологичными последовательностям в геномеMVA, в который должна была инсертироваться эта экспрессионная кассета. Эти гомологичные последовательности направляют инсертирование этих экспрессионных кассет в межгенный район (IGR) 136-137 генома MVA. Клетки CEF инфицировали MVA-BN и трансфицировали в pBN70 и pBN71 соответственно. В этих клетках происходила гомологичная рекомбинация, имеющая место между геномом MVA и плазмидами рекомбинации, приводя к рекомбинантным геномам MVA. Рекомбинанты подвергали нескольким раундам очистки из бляшек и пассировали в клетках CEF (общее число пассажей, в том числе очисток из бляшек: 20). Эти рекомбинанты испытывали на стабильность, экспрессию инсертированных генов и последовательность рекомбинантных конструкций MVA, содержащих две различные комбинации этих двух промоторов. Анализ этой последовательности ПЦР и функциональные тесты показали, что эти рекомбинантные фрагменты инсертируются правильно и что инсерции, даже в том случае, когда промотор ATI встраивали два раза в геном, являются стабильными и функциональными. Материалы и оборудование. Первичные клетки CEF; MVA-BN с титром 108 TCID50/мл; набор Effectene transfection kit (Qiagen); среда для культуры клеток VP-SFM (Gibco BRL); G418 (Gibco BRL); набор DNA Nucleospin Blood QuickPure Kit (Macherey Nagel); ДНК-полимераза Triple Master (Eppendorf); олигонуклеотиды (олиго) (MWG); набор для секвенирования DCTS Quickstart (Beckman Coulter). Способы. Векторы рекомбинации pBN70 и pBN71 (фиг. 1 и 2) клонировали в соответствии со стандартными протоколами, известными лицам с квалификацией в данной области. 5105 клеток высевали на одну реакцию трансфекции в лунку 6-луночного планшета и поддерживали в среде VP-SFM в течение ночи при 37 С и 5% CO2. Эти клетки инфицировали MVA-BN (moi 1,0) в 0,5 мл среды VP-SFM на лунку и инкубировали в течение 1 ч при комнатной температуре на шейкере. Трансфекцию линеаризованных плазмид pBN70 и 71 выполняли, как описано в протоколе изготовителя(Qiagen). Полученные рекомбинантные вирусы пассировали несколько раз при селективных условиях (G418,300 мкг/мл) и выделяли отдельные бляшки, размножали и анализировали, пока не получали очищенные клоны. Анализированный вирус был пассирован в конечном счете 20 раз. Результаты. 1. Конструирование рекомбинантных вирусов. Были созданы два рекомбинантных MVA, экспрессирующих последовательности NS1 и GUS под контролем двух различных промоторных комбинаций (ATI-NS1/ATI-GUS или ATI-NS1/p7.5-GUS). Эти последовательности вместе с кассетой отбора IRES/EGFP (внутренний сайт вхождения рибосом/усиленный зеленый флуоресцентный белок) встраивали в сайт IGR 136-137 (межгенный район между ORF A136L и A137L генома MVA) генома MVA в соответствии со способами, известными лицу с квалификацией в данной области. Эти вирусы очищали и пассировали 20 раз при селективных условиях. Оба рекомбинантных MVA амплифицировали до степени неочищенного исходного материала (бутыль 1175 см 2). Последовательность промотора ATI в этом примере соответствовала последовательности-7 012723 2. Экспрессия кодирующего EGFP района. Для определения функциональности инсертированного тест-гена в IGR 136-137 во время пассирования наблюдали флуоресценцию. Если бы инсертированный ген не был функциональным, экспрессияEGFP должна была бы быть недетектируемой. Клетки BHK, инфицированные MVA-mBN30 и MVAmBN31, явно обнаружили, что ген, инсертированный в IGR 136-137, транскрибировался. 3. ПЦР-анализ IGR 136-137 MVA-mBN30 и MVA-mBN31. Для исключения возможных примесей пустого вектора в сайте IGR 136-137 и для проверки, содержит ли вирусный геном инсерты ожидаемого размера, проводили ПЦР-анализ. Для этой цели использовали праймеры, которые связываются в районах, фланкирующих сайт инсерции. Ожидаемые ПЦРполосы для праймеров, связывающихся в сайтах фланкирующих последовательностей flank1 и flank2,равны (i) 3,4 т.п.н. для рекомбинантного MVA-mBN30; (ii) 3,5 т.п.н. для рекомбинантного MVA-mBN31 и (iii) 212 п.н. для пустого вектора MVA-BN. Были обнаружены полосы ожидаемого размера для MVAmBN30 и MVA-mBN31, указывающие на то, что эти рекомбинанты имели ожидаемую структуру генома. Вирус дикого типа не был обнаружен ни в одном из испытанных ДНК-препаратов MVA-mBN30 илиMVA-mBN31. Далее, контроль пустого вектора MVA-BN (пустой вектор) давал ожидаемый продукт 212 п.н. в обоих рекомбинантных MVA. Таким образом, посредством давления отбора достигнуты эффективный отбор и отделение рекомбинантного вектора от пустого вектора MVA-BN. 4. Секвенирование области 136-137. Результаты секвенирования показали, что для mBN30 и mBN31 промоторы и GUS были инсертированы без изменений пар оснований в IGR 136-137. Для NS1 в mBN30 также не были обнаружены изменения в последовательности пар оснований. В mBN31 NS1 имел четыре точковые мутации в последовательности пар оснований (положение 1315: С вместо G, положение 1582: G вместо А, положение 1961: А вместо С и положение 1963: G вместо Т). Два из них (в положении 1582 и 1963) не приводили к изменению аминокислот. Независимо от этих минорных отклонений последовательности из результатов секвенирования ясно, что оба рекомбинанта, mBN30 и mBN31, содержат полные последовательности NS1. Кроме того, из результатов секвенирования был сделан вывод, что ген NS1 стабильно содержится в рекомбинантном mBN30, который содержит два промотора ATI. Эти эксперименты демонстрируют стабильность этого рекомбинанта, хотя в вирусном геноме включены две идентичные последовательности промотора ATI. 5. Анализ экспрессии гена NS1 и гена GUS в рекомбинантах mBN30 и mBN31. Описанные выше результаты ПЦР и секвенирования обнаружили, что ген NS1 и ген GUS содержатся в геноме рекомбинантов MVA-mBN30 и MVA-mBN31. Для испытания, экспрессируются ли эти гены из вирусного генома, выполняли ОТ-ПЦР района NS1 и функциональный тест и количественное определение продуцированных белков GUS. 5.1. ОТ-ПЦР района NS1. Этот эксперимент проводили для демонстрации того, что рекомбинантные MVA-mBN30 и MVAmBN31, которые оба содержат ген NS1, встроенный в сайте IGR 136-137, функционально экспрессируютNS1 в виде мРНК. Клетки BHK инфицировали вирусами MVA-mBN30 и MVA-mBN31 соответственно. РНК выделяли из этих клеток и использовали для ОТ-ПЦР-анализа. Результаты ясно показывают, чтоNS1 экспрессируется из обоих вирусов в инфицированных BHK-клетках. Загрязнение вирусной ДНК могло быть исключено, поскольку ПЦР-сигнал не детектировался в отсутствие стадии обратной транскрипции. Водный контроль был отрицательным, а для положительного в отношении плазмиды контроля обоих вирусов можно было обнаружить ясную ПЦР-полосу (фиг. 3). 5.2. Измерение активности GUS. Для демонстрации экспрессии GUS, инсертированного в MVA-mBN30 и MVA-mBN31 после 20 раундов пассирования, активность GUS определяли количественно. В таблице ясно показано, что GUS экспрессировался в обоих рекомбинантных вирусах, тогда как в MVA-BN без инсерции не удавалось измерить экспрессию GUS. Измерение активности GUS в MVA-mBN30, MBa-mBN31 и MVA-BN после 20 пассажей. MVAmBN30 и MVA-mBN31 пассировали в целом 20 раз. Клетки инфицировали обоими рекомбинантными вирусами и собирали после 24 ч в лизисном буфере. Активность GUS измеряли в соответствии со способами, известными лицу с квалификацией в данной области. Величины активности измеряли по оптической плотности при 415 нм. Величины 0,05 и 2,0 находятся за пределами диапазона-8 012723 Критерии приемлемости. ПЦР-анализ IGR 136-137. В дорожках отрицательного контроля не должны наблюдаться полосы, а в положительном контроле должна наблюдаться только полоса ожидаемого размера. Для MVA-BN ожидается фрагмент 212 п.н. Секвенирование и ПЦР района 136-137. ПЦР-амплификация вирусной ДНК-мишени с праймерами должна обнаруживать единственный фрагмент ожидаемой длины. Сборка этих последовательностей должна приводить к одной непрерывной последовательности, представляющей двухцепочечный ДНК-фрагмент ожидаемой длины. Допускаются короткие одноцепочечные отрезки, если в данном районе не произошла мутация. Кроме того, допускается, что концы этой непрерывной последовательности являются лишь одноцепочечными, вследствие гетерогенной природы продуктов ПЦР-амплификации. Последовательность тест-пробы должна обнаруживать гомологию /=97% относительно ссылочной последовательности или соответствующей последовательности базы данных. ОТ-ПЦР NS1. Не должны наблюдаться полосы в дорожках отрицательных контролей и только одна полоса ожидаемого контроля должна наблюдаться в положительном контроле. Для pBN71 ожидается фрагмент 909 п.н., а для pBN70 ожидается фрагмент 907 п.н. Заключение. После 20 пассажей при селективных условиях ПЦР-анализ IGR 136-137 не обнаружил загрязнения пустым вектором для MVA-mBN31 (ATI-NS1/p7.5-GUS) или MVA-mBN30 (ATI-NS1/ATI-GUS). ДляMVA-mBN30 ПЦР обнаружила, что в сайте ATI не происходила гомологичная рекомбинация.MVA-mBN30 и MVA-mBN31 испытывали (1) конечной ПЦР для демонстрации, что исходный материал не содержит пустого вектора и что оба гена являются все еще инсертированными, даже когда оба находятся под контролем одного и того же промотора в одном и том же сайте IGR (для mBN30); (2) секвенированием этого района для демонстрации неизмененной последовательности оснований и (3) функциональной экспрессией GUS посредством количественного анализа GUS и ОТ-ПЦР для NS1. Результаты этого исследования показывают, что двойная инсерция двух различных генов в одном и том же IGR под контролем одного и того же промотора не приводит к событию рекомбинации в этом сайте промотора даже после высокого числа пассажей. Было показано, что оба инсертированных гена экспрессировались. Список последовательностей-9 012723 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный поксвирус, содержащий в вирусном геноме по меньшей мере две экспрессионные кассеты, каждая из которых содержит промотор ATI вируса коровьей оспы или его производное или субпоследовательность промотора ATI или ее производное и кодирующую последовательность, где экспрессия кодирующей последовательности регулируется указанным промотором, производным или субпоследовательностью и где производное промотора ATI коровьей оспы является последовательностью,которая имеет гомологию по меньшей мере 60% при сравнении с последовательностьюSEQ ID NO:1, и/или последовательностью, в которой не более чем 6 нуклеотидов заменены, делетированы и/или инсертированы в последовательности SEQ ID NO:1, причем длина субпоследовательности промотора ATI составляет по меньшей мере 10 нуклеотидов последовательности SEQ ID NO:1, и промотор,производное или субпоследовательность имеют такую же биологическую активность, что и активность исходного промотора. 2. Рекомбинантный поксвирус по п.1, где промотор, производное или субпоследовательность являются поздним промотором вируса осповакцины. 3. Рекомбинантный поксвирус по любому из пп.1, 2, где промотор, производное или субпоследовательность содержат нуклеотиды 25-29 или 22-29 SEQ ID NO:1. 4. Рекомбинантный поксвирус по любому из пп.1-3, в котором экспрессия каждой кодирующей последовательности в каждой экспрессионной кассете находится под контролем каждого промотора ATI,или каждого производного, или каждой субпоследовательности, причем производные или субпоследовательности имеют одинаковую структуру. 5. Рекомбинантный поксвирус по любому из пп.1-4, где по меньшей мере две экспрессионные кассеты встроены в один и тот же сайт инсерции в геноме поксвируса. 6. Рекомбинантный поксвирус по любому из пп.1-5, где промотор по меньшей мере в одной из экспрессионных кассет имеет последовательность SEQ ID NO:1. 7. Рекомбинантный поксвирус по любому из пп.1-6, где промотор по меньшей мере в одной из экспрессионных кассет является производным промотора ATI, или субпоследовательностью промотора ATI,или ее производным. 8. Рекомбинантный поксвирус по любому из пп.1-7, полученный на основе поксвируса, выбранного из группы, состоящей из ортопоксвирусов и авипоксвирусов. 9. Рекомбинантный поксвирус по п.8, где ортопоксвирус является вирусом осповакцины и где авипоксвирус выбран из поксвируса канареек и поксвируса домашней птицы. 10. Рекомбинантный поксвирус по п.9, где вирус осповакцины является модифицированным штаммом вируса осповакцины Ankara (MVA), в частности MVA-BN V00083008 и MVA 575 V00120707 соответственно. 11. Рекомбинантный поксвирус по п.10, где по меньшей мере одна из экспрессионных кассет встроена в природный сайт делеции генома MVA относительно генома штамма Copenhagen вируса осповакцины. 12. Рекомбинантный поксвирус по любому из пп.1-11, где по меньшей мере одна из экспрессионных кассет встроена в межгенную область генома поксвируса. 13. Рекомбинантный поксвирус по любому из пп.1-12, где по меньшей мере одна из кодирующих последовательностей кодирует по меньшей мере один антиген, антигенный эпитоп и/или терапевтическое соединение. 14. Применение рекомбинантного поксвируса по любому из пп.1-13 в качестве вакцины или лекарственного средства для индукции иммунного ответа. 15. Вакцина или фармацевтическая композиция, содержащая рекомбинантный поксвирус по любому из пп.1-13, для индукции иммунного ответа. 16. Применение рекомбинантного поксвируса по любому из пп.1-13 для получения вакцины или лекарственного средства для индукции иммунного ответа. 17. Способ введения кодирующих последовательностей в клетки-мишени, предусматривающий инфицирование этих клеток-мишеней вирусом по любому из пп.1-13. 18. Способ получения пептида, белка и/или вируса, предусматривающий:a) инфицирование клетки-хозяина рекомбинантным поксвирусом по любому из пп.1-13;c) выделение и/или обогащение пептида, и/или белка, и/или вируса, продуцируемых указанной клеткой-хозяином. 19. Способ индукции иммунного ответа в организме животного, в том числе человека, включающий введение вируса по любому из пп.1-13, или композиции, или вакцины по п.15 подлежащему лечению животному или человеку. 20. Способ по п.19, включающий введение по меньшей мере 102 TCID50 (инфекционных доз культуры ткани) вируса. 21. Клетка, содержащая вирус по любому из пп.1-13.- 10012723 22. Способ получения рекомбинантного вируса по любому из пп.1-13, включающий встраивание по меньшей мере двух экспрессионных кассет в геном поксвируса.
МПК / Метки
МПК: C12N 15/863, A61K 39/275, C12N 5/10, A61K 39/285
Метки: меньшей, промотора, применение, содержащий, рекомбинантный, оспы, поксвирус, вируса, мере, два, коровьей
Код ссылки
<a href="https://eas.patents.su/13-12723-rekombinantnyjj-poksvirus-soderzhashhijj-po-menshejj-mere-dva-promotora-ati-virusa-korovejj-ospy-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантный поксвирус, содержащий по меньшей мере два промотора ati вируса коровьей оспы, и его применение</a>
Предыдущий патент: Массообменное контактное устройство
Следующий патент: Применение бензоильного производного 3-аминокарбазола для лечения расстройства, связанного с продукцией простагландина e2(pge2)
Случайный патент: Способ малоинвазивной перинеопластики