Композиции с микрочастицами бупренорфина для инъекций и их применение
Номер патента: 9080
Опубликовано: 26.10.2007
Авторы: Тайс Томас Р., Феррелл Тереза М., Марклэнд Питер, Стаас Джей К.
Формула / Реферат
1. Композиция микрочастиц, включающих бупренорфин, в виде свободного основания в количестве от 10 до 70 мас.%, поли(D,L-лактид) в качестве носителя и менее чем примерно 3 мас.% этилацетата, способная обеспечить физиологически эффективный уровень для уменьшения употребления героина и/или алкоголя при внутримышечном введении млекопитающим в течение периода примерно 28 суток, где по меньшей мере 90 мас.% указанной композиции микрочастиц включает микрочастицы, имеющие диаметр от 20 до 125 мкм.
2. Композиция микрочастиц по п.1, в которой указанный бупренорфин присутствует в количестве от 15 до 50 мас.%, указанный поли(D,L-лактид) имеет характеристическую вязкость в интервале примерно от 0,3 до 0,4 дл/г, и указанный этилацетат присутствует в количестве примерно от 0,1 до 3 мас.%.
3. Композиция микрочастиц по п.1, в которой указанный бупренорфин присутствует в количестве от 30 до 65 мас.%, указанный поли(D,L-лактид) имеет характеристическую вязкость в интервале примерно от 1,0 до 1,1 дл/г и указанный этилацетат присутствует в количестве примерно от 0,1 до 3 мас.%.
4. Композиция микрочастиц по п.1, в которой указанный поли(D,L-лактид) представляет собой смесь поли(D,L-лактидов) с различной характеристической вязкостью.
5. Композиция микрочастиц по п.1, где указанный поли(D,L-лактид) представляет собой смесь микрочастиц, которые отличаются друг от друга содержанием бупренорфина (в массовых процентах) и/или содержат поли(D,L-лактиды) с различной характеристической вязкостью.
6. Композиция микрочастиц по п.1, где указанные микрочастицы получают путем ввода раствора указанного бупренорфина и поли(D,L-лактида) в этилацетате в водный раствор поливинилового спирта, содержащий этилацетат, для образования эмульсии, и добавления указанной эмульсии в воду для экстракции этилацетата для того, чтобы образовать микрочастицы, и выделения полученных микрочастиц.
7. Фармацевтическая форма для инъекций, включающая композицию микрочастиц по п.1, карбоксиметилцеллюлозу, Твин и маннит.
8. Способ снижения употребления героина и/или алкоголя субъектом, зависящим по меньшей мере от одного из героина и алкоголя, включает внутримышечное введение эффективной дозы композиции микрочастиц по п.1 в таком количестве, чтобы затормозить потребление героина и алкоголя и, тем самым, уменьшить потребление героина и/или алкоголя.
9. Способ снижения употребления героина и/или алкоголя субъектом, зависящим по меньшей мере от одного из героина и алкоголя, включает
введение эффективной дозы композиции микрочастиц по п.1, которая продолжает высвобождать указанный бупренорфин в течение периода, большего чем 28 суток, по меньшей мере, в эффективной дозе;
введение второй дозы указанной композиции микрочастиц перед тем, как уровень указанного бупренорфина упадет ниже эффективной дозы, благодаря чему сочетание указанной первоначальной эффективной дозы и указанной второй дозы обеспечивает эффективную дозу указанного бупренорфина в течение второго периода по меньшей мере в добавочные 28 суток;
повторение указанного введения, чтобы обеспечить высвобождение указанного бупренорфина и из предшествующего введения указанной композиции микрочастиц, и из введенной позднее композиции микрочастиц для того, чтобы поддерживать указанную эффективную дозу указанного бупренорфина.
10. Способ по п.9, в котором по меньшей мере один из указанных периодов и указанный второй период составляют примерно 60 дней.
Текст
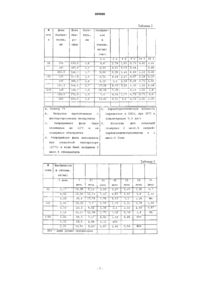
009080 Предпосылки изобретения Заболевание злоупотребления химическими веществами остается общественным бедствием. Поскольку становится более очевидно, что наследственность играет значительную роль в превращении субъекта в наркомана, помощь наркозависимым субъектам в том, чтобы покончить с их зависимостью или, по меньшей мере, в их становлении функциональными членами общества, вместо оценки злоупотребления химическими веществами просто как моральной проблемы, становится все более одобряемой политикой. Различные программы были введены в действие в общественном и частном секторах. В частном секторе существуют такие организации, как Общества анонимных алкоголикиков и анонимных наркоманов, которые играют важную роль в психосоциальной поддержке. Кроме того, существует много частных клиник, которые служат для предоставления как психосоциальной поддержки, так и медицинской помощи при использовании довольно ограниченного набора доступных лекарств. В обществе существуют широкие программы для того, чтобы привлечь внимание молодых людей и родителей к риску зависимости от химических веществ и предостеречь подростка от начала применения наркотика. Кроме того, существуют метадоновые программы, которые, главным образом, поддержаны общественностью. Число зависимых от химических веществ субъектов в США совершенно ошеломляет. Считают, что около 15 млн людей имеют алкогольную зависимость, около 1,3 млн людей страдают зависимостью от кокаина в различных его модификациях, около 0,8 млн людей зависимы от амфетаминов, примерно 0,50,8 млн зависимы от героина, и это помимо применения других наркотиков, таких как психоделические наркотики. Попытки снизить число людей, пользующихся запрещенными препаратами и алкоголем,предпринимались непрерывно, но были относительно тщетными. Те субъекты, которые входили в программы, имели мрачный список рецидивов, так что лишь малая часть людей, вошедших в программы и выдержавших программы, оставались "чистыми" длительное время после завершения программы. Одним из важных факторов в недостаточном воздержании и рецидивах является необходимость соблюдения схемы лечения. Повторяющийся акт, такой как ежедневный прием таблетки, это не простое дело, даже когда субъект не имеет сомнений в необходимости приема таблетки. Человеку, зависимому от вещества, который может иметь физиологическую и эмоциональную потребность в веществе, от которого он зависит, выдержать терапевтическую рутину намного труднее. Терапевтические методики, которые требуют настойчивости со стороны субъекта, уменьшают вероятность успеха лечения. Поэтому очень важно иметь возможность понизить уровень вовлеченности пациента в схему лечения в тех случаях, когда привлечено медицинское лечение, в особенности лечение, которое может включать график посещений, контроль за соблюдением схемы приема лекарств и соблюдение определенного режима. Для того чтобы уменьшить нестабильность соблюдения режима, были предприняты попытки предложить методологии замедленного высвобождения. Они включают насосы, пластыри, депо и т.п. Однако, если устройство ввода доступно для пациента, всегда существует искушение удалить это устройство во время сильного позыва. Такая возможность, которая может быть показателем силы воли, тем не менее подвергает риску того пациента, который поддается искушению. При наличии лекарства медленного высвобождения, которое вводят внутрь тела, это искушение устраняется, и лекарство высвобождается в соответствии с предписанным графиком в течение длительного периода времени. Можно иметь имплантируемые стержни, которые введены хирургически, или микрочастицы, которые вводятся инъекцией. Стержни или микрочастицы могут быть разработаны так, чтобы высвобождать лекарство регулируемым образом в течение длительного периода времени. Микрокапсулы и микросферы обычно представляют собой порошки, состоящие из сферических частиц диаметром 2 мм или менее, обычно диаметром 500 мкм или менее. Если частицы меньше 1 мкм,их часто называют нанокапсулами или наносферами. Большей частью различие между микрокапсулами и нанокапсулами или различие между микросферами и наносферами заключается в их размере. Микрокапсула или нанокапсула содержит инкапсулированный в ней материал (называемый далее агентом), который локализован по центру внутри единственной мембраны, обычно полимерной. Такая мембрана может быть названа стенкообразующей и обычно состоит из полимерного материала. Благодаря своей внутренней структуре проницаемые микрокапсулы, предназначенные для применения с регулируемым высвобождением, высвобождают свой агент с постоянной скоростью (скорость высвобождения нулевого порядка). Проницаемые микрокапсулы могут также использоваться для применений с высвобождением при разрыве. Микросфера содержит свой агент диспергированным по частице, т.е. внутренняя структура представляет собой матрицу агента и носителя, обычно полимерного носителя. Обычно микросферы регулируемого высвобождения высвобождают свой агент с убывающей скоростью (первый порядок). Однако микросферы могут быть разработаны так, чтобы высвобождать агент со скоростью почти нулевого порядка. Микросферы проявляют меньшую склонность к разрыву по сравнению с микрокапсулами, благодаря тому, что их внутренняя структура более прочна. Далее здесь термин "микрочастицы" будет включать наносферы, микросферы, микрокапсулы, нанокапсулы, микропузырьки (полые частицы), пористые микропузырьки, наночастицы, микрогубки (пористые микросферы) и частицы вообще.-1 009080 Различные микрочастицы замедленного высвобождения были разработаны для множества лекарств,но очень немногие из них были доведены до коммерческого применения. Существует много ограничений для удовлетворительных рецептур замедленного высвобождения, пригодных для инъекций: высвобождение лекарства должно происходить в течение длительного периода времени; во время лечения поддерживаемая концентрация лекарства у субъекта должна быть на эффективном уровне, не достигающем опасного значения; лекарство должно высвобождаться медленно без катастрофического выброса лекарства; используемый для микрочастиц полимерный носитель должен быть биоразлагаемым и биосовместимым; содержание любых остаточных химических веществ должно быть ниже максимально допустимого уровня; микрочастицы должны быть малыми и пригодными для введения шприцом с иглой такого размера,который приемлем для пациента; результаты должны быть воспроизводимыми, что требует, чтобы процесс был точно контролируемым и не слишком чувствительным к небольшим изменениям условий; вводимая инъекцией композиция должна быть стерильной и должна иметь другие характеристики,которые могут иметь общий характер или быть специфичными для конкретного лекарства. Свойства микрочастиц чувствительны ко многим свойствам лекарства и носителя, а также к выбору способа и условий, при которых получают и затем перерабатывают микрочастицы. Литература по данному вопросу Сообщалось, что бупренорфин (N-циклопропилметил-7-[1-(s)-гидрокси-1,2,2-триметилпропил]6,14-эндоэтано-6,7,8,14-тетрагидронорорипавин) является эффективным при лечении опиатной наркомании при использовании подъязычного введения (патент США 4935428). О назальном введении бупренорфина сообщалось в патенте США 4464378. О пролонгированных лекарственных антагонистах сообщалось в патентах США 5716631 и 5858388. Применение бупренорфина для лечения наркозависимости описано в многочисленных публикациях. Статьи Kuhlman et al. Addiction 1998, 93:549-59; Schottenfeld etal., Arch Gen. Psychiatry 1997, 54:713-20; Strain et al. J. Clin. Psychopharmacol. 1996, 16:58-67 являются примерами из нескольких таких сообщений. Сочетание бупренорфина и налоксона описано O'Connor etKrantzler, et al. Alcoholism: Clin. and Exp. Res. 1998, 22:1074-1079 сообщает о лечении алкоголиков композицией для инъекций с частицами налтрексона замедленного высвобождения. Ряд исследований,касающихся налтрексона и его форм замедленного высвобождения, был выполнен в лабораторииYamaguchi and Anderson. J. Control. Release, 1992, 19(1-3), pp. 299-314. Применение налтрексона при лечении алкоголизма описано O'Malley, et al. Psychiatric Annals, Nov. 1995, 11, pp. 681-688, а также в других многочисленных публикациях. Представляющие интерес патенты включают USP 4568559, 4623588, 4897267 и 5486362. Патент США 5407609 описывает процесс, подходящий к способу, примененному в рассматриваемом изобретении. Применение полилактида при получении микрочастиц, содержащих лекарственное соединение,описано Benita, et al. J. Pharm. Sci., Dec. 1984, 73(12), pp. 1271-1274; Speniehauer et al., ibid, Aug. 1986,75(8), pp. 750-755 и Nihant et al. Oct. 1994, 11(10), pp. 1479-84.-2 009080 Краткое описание изобретения Предложены инъецируемые композиции замедленного высвобождения бупренорфина, включающие терапевтически эффективное количество бупренорфина (именуемого здесь далее "лекарством" или"агентом"), высвобождающееся в течение длительного периода времени, и носитель, например поли(D,Lлактидный) полимер. Микрочастицы имеют диаметр ниже 125 мкм и могут легко вводиться внутримышечной инъекцией, обеспечивая по меньшей мере около 0,5 нг/мл лекарства в течение длительного периода. Получены различные профили высвобождения в зависимости от молекулярной массы полимера,лекарства и массовой доли лекарства. Микрочастицы получают путем жидкостной экстракции полимерного раствора диспергированного или растворенного лекарства. Смеси микрочастиц бупренорфина могут быть применены для того, чтобы сократить любое неразрешенное использование микрочастиц бупренорфина. Краткое описание чертежей На фиг. 1 приводится сравнение фармакокинетических профилей трех различных форм микрочастиц бупренорфина после единичного введения (25 мг/кг) собакам. Описание конкретных вариантов осуществления Предложены инъецируемые формы бупренорфина замедленного высвобождения для применения при лечении алкоголиков и приверженных к героину субъектов и при других показаниях, для которых обнаружено, что бупренорфин является эффективным. Предложены мелкие стерилизованные микрочастицы, которые могут пройти через иглу шприца и могут быть введены внутримышечно и остаться в месте инъекции на продолжительный период времени,непрерывно высвобождая терапевтически эффективное количество лекарства по меньшей мере в течение примерно 28 суток. Было обнаружено, что профиль высвобождения чувствителен к природе и количеству лекарства в микрочастицах, к использованию свободного основания в сравнении с солью и характеристической вязкости поли(D,L-лактидного) носителя. Оказалось, что профиль высвобождения менее чувствителен к условиям процесса получения микрочастиц, к распределению частиц по размеру (до тех пор,пока композиция включает преимущественно микрочастицы в интервале от 20 до 125 мкм) и количеству остаточного растворителя (до тех пор, пока количество остаточного органического растворителя менеее 3 мас.%. Как установлено методом сканирующей электронной микроскопии (СЭМ), микрочастицы содержат лекарство, распределенное по полимерному носителю. Микрочастицы содержат менее 3 мас.% этилацетата, растворителя, использованного при получении микрочастиц. Массовое процентное содержание лекарства составляет от 10 до 70, обычно от 15 до 65 мас.% и варьируется в этом интервале в зависимости от характеристической вязкости носителя. Характеристическая вязкость полимерного носителя составляет примерно от 0,3 до 1,2 дл/г по измерению в хлороформе при 30 С и концентрации 0,5 г/дл. Если полимерный носитель имеет характеристическую вязкость в интервале примерно 0,3-0,4 дл/г, количество лекарства должно находиться в интервале примерно от 10 до 50, обычно от 15 до 50 мас.%, тогда как при характеристической вязкости в интервале примерно 1,0-1,2, обычно 1,0-1,1 дл/г количество лекарства должно находиться в интервале примерно от 30 до 70, обычно от 35 до 65 мас.%. По большей части не должны применяться полимеры, имеющие вязкость в интервале от 0,45 до 0,95 дл/г, обычно используют только полимеры с более низкой молекулярной массой и с более высокой молекулярной массой. Смеси полимеров и микрочастицы, изготовленные из таких полимеров или из смесей таких полимеров, могут быть использованы так, чтобы доставлять эффективное количество лекарства в течение требуемого периода лечения. Таким образом, массовый процент двух различных полимеров может меняться от 1:99 до 99:1, более предпочтительно от 10:90 до 90:10, где полимер с более низкой молекулярной массой должен присутствовать в меньшем количестве, чем полимер с более высокой молекулярной массой. Аналогично, микрочастицы с низким содержанием лекарства и низкомолекулярным носителем(0,3-0,4 дл/г) могут быть смешаны с микрочастицами с высоким содержанием лекарства и высокомолекулярным носителем (1,0-1,2 дл/г) в массовом соотношении от 5:95 до 95:5, где микрочастицы носителя с более низкой молекулярной массой должны предпочтительно присутствовать в количестве от 10 до 65 мас.%. Более 90 мас.% микрочастиц должны иметь диаметр в интервале примерно от 20 до 100 мкм и менее 5 мас.% микрочастиц должны иметь диаметр менее чем примерно 10 мкм. Для того чтобы уменьшить агломерацию, микрочастицы могут быть покрыты противоагломерационным агентом, таким как маннит, который следует применять в количестве менее чем примерно 50,предпочтительно менее чем примерно 20 мас.% от массы микрочастиц. Микрочастицы готовят в подходящем носителе для того, чтобы обеспечить в зависимости от лекарства примерно от 10 мг до 1 г, предпочтительно от 50 до 750 мг лекарства на единичную дозу. Для бупренорфина количество в общем случае должно быть в интервале примерно от 20 мг до 1 г, более предпочтительно примерно от 20 до 750 мг, в то время как для метадона количество должно быть примерно от 100 до 350 мг, более предпочтительно примерно от 150 до 250 мг, а для налтрексона количество должно быть в интервале примерно от 150 до 300 мг. Носителем может быть стерильная вода, фосфатный буферный солевой раствор или другой обычный носитель для введения микрочастиц. Для улучше-3 009080 ния суспендируемости микрочастиц, замедления осаждения микрочастиц и снижения дискомфорта при инъекции могут вводиться добавки. Обычно маннит может присутствовать в количестве примерно от 2 до 10, в частности от 4 до 7 мас.% от массы носителя. Другие физиологически приемлемые добавки могут включать неионные детергенты, например Твин, который, если он используется, может присутствовать в количестве примерно от 0,05 до 0,2 мас.% от массы носителя, агенты, улучшающие вязкость, например карбоксиметилцеллюлоза в количестве примерно от 0,1 до 1 мас.% от массы носителя, и другие обычные подходящие добавки. Количество носителя должно в общем случае быть в интервале примерно от 1 до 5 мл, обычно от 1 до 3,5 мл. Микрочастицы диспергируют в носителе непосредственно перед применением. Обычно стерильные микрочастицы должны храниться в стерильном сосуде с перегородкой, в котором микрочастицы могут быть смешаны с носителем и затем отобраны в шприц. Микрочастицы получают практически таким же способом, как описанный в патенте США 5407609. Способ представляет собой процесс на основе эмульсии, который включает приготовление эмульсии,включающей водную непрерывную фазу (вода и сурфактант и/или загуститель) и гидрофобную фазу(растворитель полимера, полимер и лекарство). После образования эмульсии растворитель полимера извлекают в водную экстракционную фазу. После того как экстрагировано достаточное количество растворителя полимера для того, чтобы микрочастицы затвердели, микрочастицы собирают на сита и промывают, чтобы удалить любой сурфактант, оставшийся на поверхности микрочастиц. Затем микрочастицы сушат в токе азота в течение длительного периода, например около 12 ч, затем сушат под вакуумом при комнатной температуре до тех пор, пока они не станут практически сухими, обычно в течение примерно 3 суток. Для получения микрочастиц может быть применена сравнительно простая аппаратура. Систему легко собрать, используя емкости для хранения различных потоков, систему трубок, трехходовые краны и гомогенизатор. В дополнение могут быть включены различные устройства для регулирования, такие как расходомеры, приборы для контроля температуры, приборы для контроля размера частиц, и т.д. Органический раствор вводят в первую трубку, соединенную с трехходовым краном, который соединяет с непрерывной водной фазой и с гомогенизатором. Регулируя расход двух потоков в линию, соединенную с гомогенизатором, можно регулировать соотношение двух потоков, а также время пребывания в гомогенизаторе. Вывод из гомогенизатора осуществляется через линию, которая соединена с трехходовым краном, через который вводят водный поток. Опять-таки, соотношение расходов потоков регулирует количество воды в выходном потоке из гомогенизатора. Время пребывания на стадии водной экстракции регулируется длиной трубки и расходом объединенных потоков. Затем микрочастицы сегрегируют по размеру пропусканием через два или более сит, которые удаляют микрочастицы, выходящие из требуемого интервала размеров. Для получения требуемых микрочастиц дисперсная фаза содержит примерно 1-10 мас.% лекарства и примерно 20 мас.% диспергированного или растворенного в этилацетате полимера (далее имеются в виду и тот, и другой, когда речь идет о полимере в растворителе, как о диспергированном). Непрерывная фаза представляет собой водный раствор примерно 1-10 мас.% поли(винилового спирта) и содержит от 1 до 7,5 мас.% этилацетата. Экстракционной фазой является вода. Обычно количество используемого лекарства должно быть примерно 10-50 мас.% в избытке от конечного количества лекарства в микрочастицах. Температура может быть температурой окружающей среды, обычно от 15 до 30 С. После того как микрочастицы отобраны и высушены, их можно хранить при температуре окружающей среды предпочтительно в интервале около 0-20 С в среде, свободной от воды и кислорода, или хранить разделенными на аликвоты в подходящие контейнеры и стерилизованными. Могут быть применены различные способы стерилизации, причем обычной является стерилизация гамма-облучением. Основным способом применения для предлагаемых форм являются внутримышечные инъекции,хотя могут быть также применены подкожные инъекции. Предлагаемый способ обычно применяется к субъектам, зависимым от химического вещества, такого как алкоголь или героин, но рассматриваемые композиции могут быть использованы при других показаниях, таких как тучность. Соответствующее количество рассматриваемой формы непосредственно вводят в удобное место, например в ягодицу. После этого пациент может наблюдаться для контроля за концентрацией лекарства в плазме для того, чтобы быть уверенными, что количество лекарства находится в терапевтическом интервале. Если концентрация лекарства в плазме опустилась ниже терапевтического уровня, может быть сделана следующая инъекция,и процесс может повторяться во время периода лечения. В случае приверженности к героину пациент обычно должен быть подвергнут детоксикации любым одним из многочисленных различных способов с использованием бупренорфина, клонидина, налтрексона и т.д. и проверке налоксоном. Реакция на налоксон показывает, что пациент не был полностью детоксифицирован. В зависимости от лекарства, которое должно вводиться, ежедневный прием дозы лекарства должен проводиться в течение по меньшей мере около 3 дней и не более чем в течение 2 недель для того, чтобы пациент не имел отрицательной реакции на детоксификационное лекарство замедленного высвобождения. После того как установлено отсутствие отрицательной реакции, может быть введена депонированная форма лекарства.-4 009080 Располагая микрочастицами, которые имеют способность к пролонгированному высвобождению,т.е. за период более 14 суток, обычно более чем примерно 28 суток, предпочтительно более примерно 56 суток, можно "наслаивать" введение так, чтобы, осуществляя инъекции периодическим образом, достичь аддитивного эффекта. Таким образом, после первой дозы можно вводить меньшие дозы, поскольку пациент продолжает получать высвобождающееся лекарство из ранее введенных микрочастиц, к которому прибавляется высвобождение из введенных позднее микрочастиц, или пациент может получить удовлетворение от повышенной концентрации бупренорфина без увеличения количества введенных микрочастиц. Располагая микрочастицами, которые могут продолжать высвобождение, создавая концентрацию в крови, превышающую 0,5 нг/мл, обычно более 1,0 нг/мл, и в зависимости от предписанных концентраций в плазме, предпочтительно не превышающую примерно 5 нг/мл, более предпочтительно не превышающую примерно 3 нг/мл, в течение более чем примерно 28 суток после инъекции, предпочтительно по меньшей мере около 36 суток, более предпочтительно по меньшей мере около 42 суток, можно обеспечить постоянную концентрацию в плазме, где концентрацию лекарства в плазме можно поддерживать в терапевтическом интервале. Таким образом, существенно улучшается защита, поскольку пациент постоянно подвергается воздействию защитной концентрации лекарства и можно обеспечить концентрации лекарства, которые должны ослабить реакцию на 50 мг провокационную дозу героина. Нижеследующие примеры предложены для иллюстрации изобретения, а не для его ограничения. Примеры Пример 1. Общий способ получения микрочастиц налтрексона. Следующий пример поясняет способ получения в общем виде, где индивидуальные условия приведены в следующей таблице. Химические компоненты готовили следующим образом. Поли(D,L-лактид) растворяли в этилацетате при перемешивании. К раствору полимера добавляли лекарство и растворяли при перемешивании. Поливиниловый спирт (ПВС) растворяли в стерильной воде, медленно добавляя ПВС при перемешивании к нагретой до температуры 90 С стерильной воде. После полного растворения ПВС раствору давали остыть и фильтровали его через 0,2 мкм фильтр, после чего следовало добавление этилацетата к раствору ПВС при 3 мас.%. Использованная система была практически такой же, как описанная выше, где для партии в 15 г при использовании полимера с вязкостью 1,07 дл/г и при теоретической концентрации лекарства 50% (относительно суммарной массы полимера и лекарства) применяли трубки с внутренним диаметром 0,5 дюйма и длина трубки для конечной водной экстракции составляла 200 футов (6096 см). Установка работала следующим образом. Органический раствор с температурой около 20 С подавали насосом во входную трубку с расходом около 6 г/мин. Раствор ПВС с температурой около 20 С подавали насосом во входную трубку нисходящим потоком от органического раствора с расходом около 65 г/мин. При непрерывной подаче этого раствора в гомогенизатор образовывалась эмульсия. Выходящий поток разбавляли стерильной водой с температурой около 20 С, которую подавали насосом со скоростью около 2000 г/мин через трубку, имеющую достаточную длину для того, чтобы обеспечить время экстракции около 6 мин. Полученные микрочастицы собирали как частицы, которые проходят через сито 125 мкм и собираются на сите 20 мкм. Микрочастицы непрерывно перемешивали и промывали стерильной водой, чтобы предотвратить преждевременную сушку. После того как убедились, что в гомогенизаторе больше нет микрочастиц, гомогенизатор останавливали и микрочастицы промывали стерильной водой до полного удаления ПВС. После промывки стерильной водой собранные на сите 20 мкм микрочастицы сушили под вакуумом при комнатной температуре в течение примерно 3 суток. Высушенный продукт получали после конечного просеивания микрочастиц через сито 125 мкм. Для того чтобы уменьшить какую-либо агломерацию, микрочастицы могут быть смешаны с маннитом или покрыты тонким слоем маннита. Затем микрочастицы могут быть диспергированы в подходящем носителе из стерильной воды, включающей 0,5% карбоксиметилцеллюлозы, 0,1% Твин 80 и 5,0% маннита. Объем должен находиться в интервале 1-3,5 мл для того, чтобы получить удовлетворительную дисперсию и выход через иглу 18-го размера. Следующая таблица показывает специфические параметры для получения микрочастиц и свойства и поведение микрочастиц in vitro и in vivo. В опытах in vivo собакам вводили внутримышечно иглой размера 18 около 2 мл раствора, содержавшего микрочастицы с массой, указанной в таблице. Плазму контролировали на содержание налтрексона в указанное время. Для опытов in vitro микрочастицы держали в 0,01 М фосфатном буфере, рН 7,4 при 37 С, и в указанное время определяли остаточный налтрексон в микрочастицах. Лот 98 был выше уровня количественного определения 0,5 нг/мл вплоть до 140 суток, тогда как лоты 82 и 142 были выше уровня количественного определения до 49 суток. Пример 2. Получение микрочастиц бупренорфина (свободное основание). Типичную партию размером 10 г готовили следующим образом. Готовили 7% раствор полимера, растворяя 5 г полимера в 66,2 г этилацетата. К данному раствору добавляли 5 г бупренорфина. Данную смесь (дисперсную фазу, ДФ) перемешивали, пока лекарство не растворялось. Готовили раствор 2 мас.% поливинилового спирта в воде. К этому раствору добавляли достаточное количество этилацетата для того, чтобы конечная концентрация этилацетата составила 2,5 мас.%. Этот раствор (непрерывную фазу, НФ) называли СФ-фазой. ДФ подавали насосом в смеситель со скоростью 27,2 г/мин. Используя отдельную линию, в смеситель закачивали также НФ при расходе 124 г/мин. Два раствора держали раздельно до тех пор, пока не происходило смешивание в головной части смесителя непрерывного потока. Смешивание проводили при скорости мешалки 870 об/мин. Выходящую из смесителя эмульсию экстрагировали, используя воду, которую подавали насосом со скоростью 2050 г/мин, для того чтобы получить суспензию микрочастиц. Суспензию собирали вручную через 125 и 25 мкм сита. Часть микрочастиц, собранных на сите 25 мкм,вводили в емкость со свежей водой и перемешивали в течение 3 ч при условиях окружающей среды. Микрочастицы вновь собирали просеиванием и часть, собранную на сите 25 мкм, удаляли и сушили лиофилизацией. Конечный сухой порошок пропускали через сито 125 мкм и снимали его характеристики относительно содержания лекарства и распределения размера частиц (см. табл. 4). Пример 3. Получение микрочастиц бупренорфина (свободное основание). Типичную партию размером 20 г готовили следующим образом. Готовили 4,1% раствор полимера, растворяя 6,3 г полимера в 146,6 г этилацетата. К данному раствору добавляли 11,6 г бупренорфина. Данную смесь (дисперсную фазу, ДФ) перемешивали, пока лекарство не растворялось. Готовили раствор 1 мас.% поливинилового спирта в воде. К этому раствору добавляли достаточное количество этилацетата для того, чтобы конечная концентрация этилацетата составила 2,5 мас.%. Этот раствор (непрерывную фазу, НФ) называли НФ-фазой. ДФ подавали насосом в смеситель со скоростью 25,9 г/мин. Используя отдельную линию, в смеситель закачивали также НФ при расходе 127,2 г/мин. Два раствора держали раздельно до тех пор, пока не происходило смешивание в головной части смесителя непрерывного потока. Смешивание проводили при скорости мешалки 726 об/мин. Выходящую из смесителя эмульсию экстрагировали, используя воду, которую подавали насосом со скоростью 2038 г/мин, для того, чтобы получить суспензию микрочастиц. Суспензию собирали вручную через 125 и 25 мкм сита. Часть микрочастиц, собранную на сите 25 мкм,вводили в емкость со свежей водой и перемешивали в течение 3 ч при условиях окружающей среды. Микрочастицы опять собирали просеиванием и часть, собранную на сите 25 мкм, удаляли и сушили лиофилизацией. Конечный сухой порошок пропускали через сито 125 мкм и снимали его характеристики относительно содержания лекарства и распределения размера частиц (см. табл. 4).IV = характеристическая вязкость (хлороформ, 0,5 г/дл, 30 С). Фармакокинетика единичного введения собакам (25 мг/кг бупренорфина) была определена при использовании микрочастиц, получивших примерно 2,5 мрад гамма-облучения. Н.У.О. = ниже уровня количественного определения 0,5 нг/мл.-9 009080 Из приведенных выше результатов очевидно, что долговременное снабжение бупренорфином в физиологически эффективной концентрации может быть осуществлено in vivo. Таким образом, можно избежать проблем соблюдения режима при лечении, связанных с необходимостью ежедневного приема таблеток. Контроль для определения того, принял ли пациент ежедневную таблетку, становится ненужным. Пациент способен лучше справиться с проблемой приверженности к химическому веществу, поскольку есть уверенность, что пациент имеет лучший контроль в случае алкоголизма и не получит желаемой эйфории от героина. Убеждение может быть более эффективным, поскольку пациент будет избавлен от необходимости приема героина, а в случае алкоголизма будет более способен ограничить себя меньшим количеством выпивки. Таким образом, пациенты будут способны функционировать и выполнять свои обязанности перед их семьями и обществом. Все публикации и патентные описания, упомянутые в данном изобретении, включены в него в качестве ссылки в такой же степени, как если бы было указано, что каждая отдельная публикация или патентное описание введено ссылкой. Изобретение является теперь описанным полностью, и специалисту должно быть ясно, что в нем могут быть сделаны многие изменения и модификации без отклонения от духа и объема прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция микрочастиц, включающих бупренорфин, в виде свободного основания в количестве от 10 до 70 мас.%, поли(D,L-лактид) в качестве носителя и менее чем примерно 3 мас.% этилацетата,способная обеспечить физиологически эффективный уровень для уменьшения употребления героина и/или алкоголя при внутримышечном введении млекопитающим в течение периода примерно 28 суток,где по меньшей мере 90 мас.% указанной композиции микрочастиц включает микрочастицы, имеющие диаметр от 20 до 125 мкм. 2. Композиция микрочастиц по п.1, в которой указанный бупренорфин присутствует в количестве от 15 до 50 мас.%, указанный поли(D,L-лактид) имеет характеристическую вязкость в интервале примерно от 0,3 до 0,4 дл/г, и указанный этилацетат присутствует в количестве примерно от 0,1 до 3 мас.%. 3. Композиция микрочастиц по п.1, в которой указанный бупренорфин присутствует в количестве от 30 до 65 мас.%, указанный поли(D,L-лактид) имеет характеристическую вязкость в интервале примерно от 1,0 до 1,1 дл/г и указанный этилацетат присутствует в количестве примерно от 0,1 до 3 мас.%. 4. Композиция микрочастиц по п.1, в которой указанный поли(D,L-лактид) представляет собой смесь поли(D,L-лактидов) с различной характеристической вязкостью. 5. Композиция микрочастиц по п.1, где указанный поли(D,L-лактид) представляет собой смесь микрочастиц, которые отличаются друг от друга содержанием бупренорфина (в массовых процентах) и/или содержат поли(D,L-лактиды) с различной характеристической вязкостью. 6. Композиция микрочастиц по п.1, где указанные микрочастицы получают путем ввода раствора указанного бупренорфина и поли(D,L-лактида) в этилацетате в водный раствор поливинилового спирта,содержащий этилацетат, для образования эмульсии, и добавления указанной эмульсии в воду для экстракции этилацетата для того, чтобы образовать микрочастицы, и выделения полученных микрочастиц. 7. Фармацевтическая форма для инъекций, включающая композицию микрочастиц по п.1, карбоксиметилцеллюлозу, Твин и маннит. 8. Способ снижения употребления героина и/или алкоголя субъектом, зависящим по меньшей мере от одного из героина и алкоголя, включает внутримышечное введение эффективной дозы композиции микрочастиц по п.1 в таком количестве, чтобы затормозить потребление героина и алкоголя и, тем самым, уменьшить потребление героина и/или алкоголя. 9. Способ снижения употребления героина и/или алкоголя субъектом, зависящим по меньшей мере от одного из героина и алкоголя, включает введение эффективной дозы композиции микрочастиц по п.1, которая продолжает высвобождать указанный бупренорфин в течение периода, большего чем 28 суток, по меньшей мере, в эффективной дозе; введение второй дозы указанной композиции микрочастиц перед тем, как уровень указанного бупренорфина упадет ниже эффективной дозы, благодаря чему сочетание указанной первоначальной эффективной дозы и указанной второй дозы обеспечивает эффективную дозу указанного бупренорфина в течение второго периода по меньшей мере в добавочные 28 суток; повторение указанного введения, чтобы обеспечить высвобождение указанного бупренорфина и из предшествующего введения указанной композиции микрочастиц, и из введенной позднее композиции микрочастиц для того, чтобы поддерживать указанную эффективную дозу указанного бупренорфина. 10. Способ по п.9, в котором по меньшей мере один из указанных периодов и указанный второй период составляют примерно 60 дней.
МПК / Метки
МПК: A61K 9/16, A61K 9/08, A61K 47/34, A61K 31/485, A61P 25/32, A61P 25/36
Метки: микрочастицами, инъекций, бупренорфина, композиции, применение
Код ссылки
<a href="https://eas.patents.su/12-9080-kompozicii-s-mikrochasticami-buprenorfina-dlya-inekcijj-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции с микрочастицами бупренорфина для инъекций и их применение</a>