Хондроитинсульфат акульего типа и способ его получения
Номер патента: 23370
Опубликовано: 31.05.2016
Авторы: Бацца Паола, Валоти Эрманно, Бьянки Давиде, Миралья Никколо, Валетти Марко
Формула / Реферат
1. Хондроитинсульфат акульего типа, не содержащий три-, тетра- и 2,4-дисульфатированные дисахариды, состоящий из 60-99% 6-сульфата, 0,5-30% 2,6-дисульфата, 0,1-5% 4,6-дисульфата, 0,1-5% несульфатированного хондроитина и 0,1-1% 4-сульфата, где все процентные содержания выражены относительно общего содержания дисахаридов хондроитинсульфата акульего типа, где среднечисловая молекулярная масса (Mn) последнего составляет 40-85 кДа и средневзвешенная молекулярная масса (Mw) составляет 50-95 кДа.
2. Хондроитинсульфат акульего типа по п.1, состоящий из 70-90% 6-сульфата, 8,5-20% 2,6-дисульфата, 0,1-5% 4,6-дисульфата, 0,1-5% несульфатированного хондроитина и 0,1-1% 4-сульфата, где все процентные содержания выражены относительно общего содержания дисахаридов хондроитинсульфата акульего типа, где среднечисловая молекулярная масса (Mn) последнего составляет 40-65 кДа и средневзвешенная молекулярная масса (Mw) составляет 50-70 кДа.
3. Хондроитинсульфат акульего типа по п.1 или 2, где сумма 2,6-дисульфата и 4,6-дисульфата составляет 10-25% от общего содержания дисахаридов.
4. Применение хондроитинсульфата акульего типа по любому из пп.1-3 для профилактики или лечения остеоартрита или для поддержания здорового состояния скелетно-мышечной системы.
5. Композиция для профилактики или лечения остеоартрита или для поддержания здорового состояния скелетно-мышечной системы, содержащая хондроитинсульфат акульего типа по любому из пп.1-3 и фармацевтически или нутрицевтически приемлемый носитель.
6. Применение композиции по предшествующему пункту для профилактики или лечения остеоартрита или для поддержания здорового состояния скелетно-мышечной системы.
7. Способ получения хондроитинсульфата акульего типа по любому из пп.1-3, включающий:
а) высаливание несульфатированного хондроитина в виде свободной кислоты, предварительно растворенного в водной среде, солью, выбранной из группы, состоящей из солей тетраметил-, тетраэтил- и тетрабутиламмония или солей тетраметил-, тетраэтил- и тетрабутилпиридиния;
b) сушку высаливаемого несульфатированного хондроитина в виде свободной кислоты и/или натриевой соли, получаемой на стадии а) до содержания воды 5-15%;
c) сушку высаливаемого несульфатированного хондроитина, получаемого на стадии b), при температуре 100-170°C до содержания воды 0,1-3%;
d) избирательное сульфатирование 6 положения высаливаемого несульфатированного хондроитина, получаемого на стадии с), растворенного в N-метилпирролидоне или диметилформамиде при температуре 0-30°C, добавлением 1-2 экв. комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы, с последующим добавлением с интервалами времени 1-3 ч комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы до полных 2-15 экв.; оставление получаемого раствора при перемешивании в течение 2-24 ч;
e) гашение реакции, проводимой на стадии d), водным бикарбонатом натрия или карбонатным раствором, фильтрование и выпаривание досуха получаемого раствора с получением сухого твердого вещества;
f) растворение сухого твердого вещества в водном растворе хлорида натрия, ультрафильтрацию и диализ получаемого раствора;
g) выделение продукта из раствора, получаемого на стадии f);
h) очистку продукта, получаемого на стадии g), и получение последнего в форме кислоты или в виде его натриевой соли;
i) выделение продукта, получаемого на стадии h).
8. Способ по п.7, где высаливание несульфатированного хондроитина на стадии а) проводят солью, выбранной из группы, состоящей из солей тетраметил-, тетраэтил- и тетрабутиламмония.
9. Способ по п.7 или 8, где высаливание несульфатированного хондроитина на стадии а) проводят солью тетрабутиламмония.
10. Способ по любому из пп.7-9, где сушку несульфатированного хондроитина на стадии b) проводят лиофилизацией или сушкой распылением.
11. Способ по любому из пп.7-10, где сушку соли несульфатированного хондроитина на стадии с) проводят до содержания воды 0,5-2%.
12. Способ по любому из пп.7-11, где солюбилизацию соли несульфатированного хондроитина, получаемой на стадии с), проводят в диметилформамиде.
13. Способ по любому из пп.7-12, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 6-12 экв. комплекса пиридина с триоксидом серы.
14. Способ по любому из пп.7-13, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 6-9 экв. комплекса пиридина с триоксидом серы.
15. Способ по любому из пп.7-12, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 1-9 экв. комплекса диметилформамида с триоксидом серы.
16. Способ по п.15, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 2-4 экв. комплекса диметилформамида с триоксидом серы.
17. Способ по любому из пп.7-16, где сульфатирование на стадии d) проводят при температуре 10-20°C.
18. Способ по любому из пп.7-17, где в конце стадии d) получаемый раствор оставляют при перемешивании в течение 2-6 ч.
19. Способ по любому из пп.7-18, где на стадии g) продукт выделяют лиофилизацией, сушкой распылением или осаждением в спиртовой среде.
20. Способ лечения или профилактики остеоартрита или поддержания здорового состояния скелетно-мышечной системы, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества хондроитинсульфата по любому из пп.1-3 или композиции по п.5.
Текст
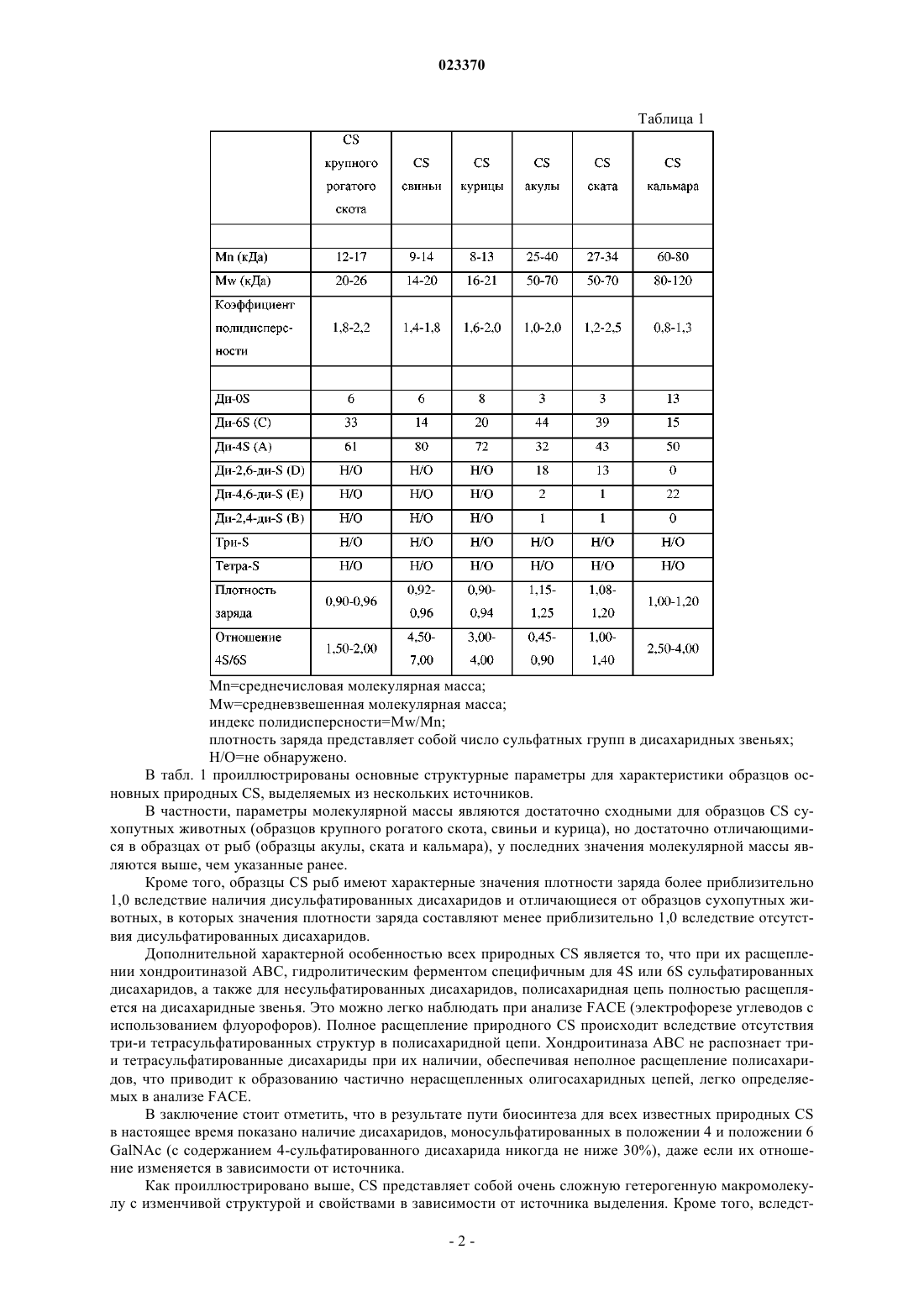
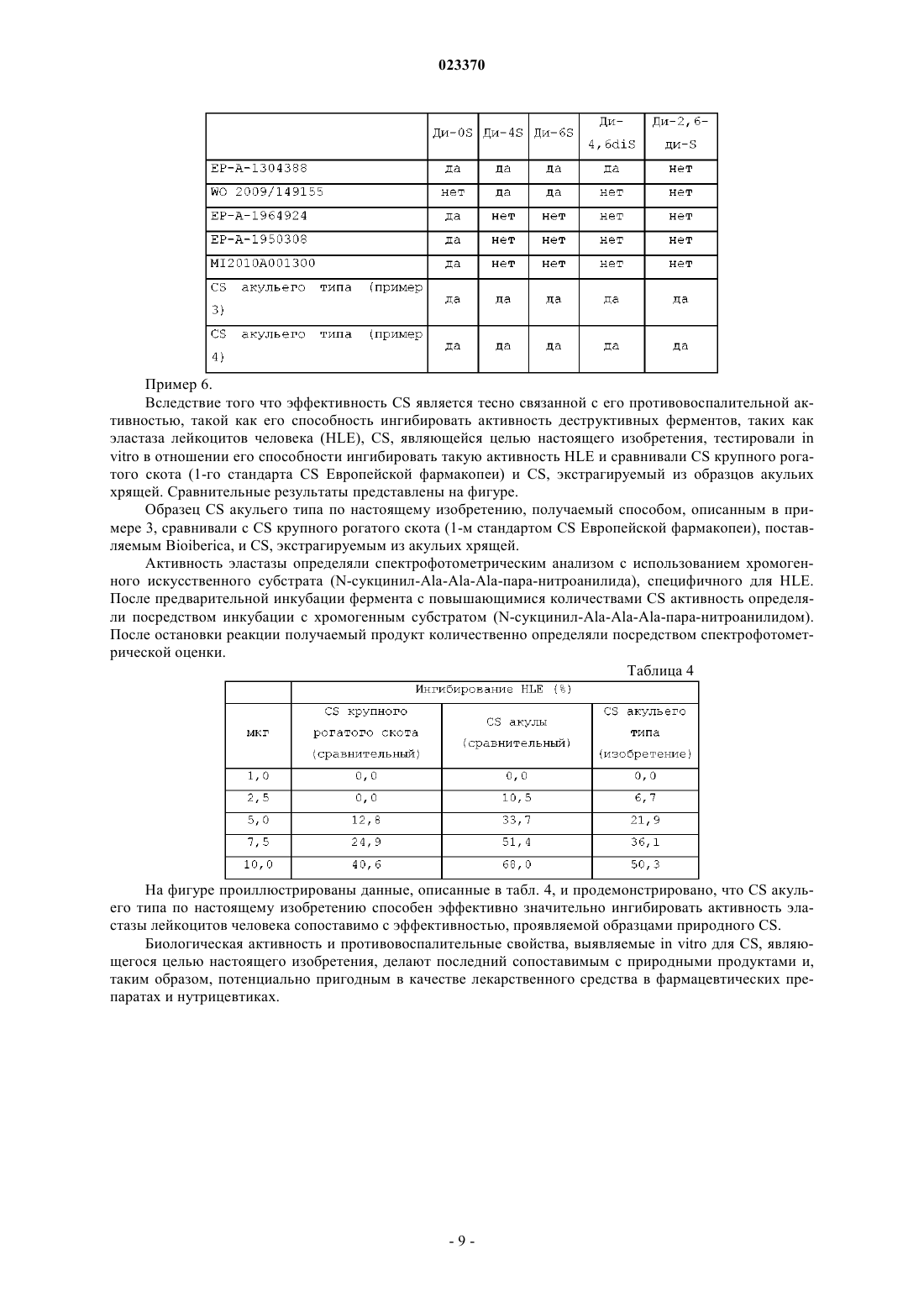
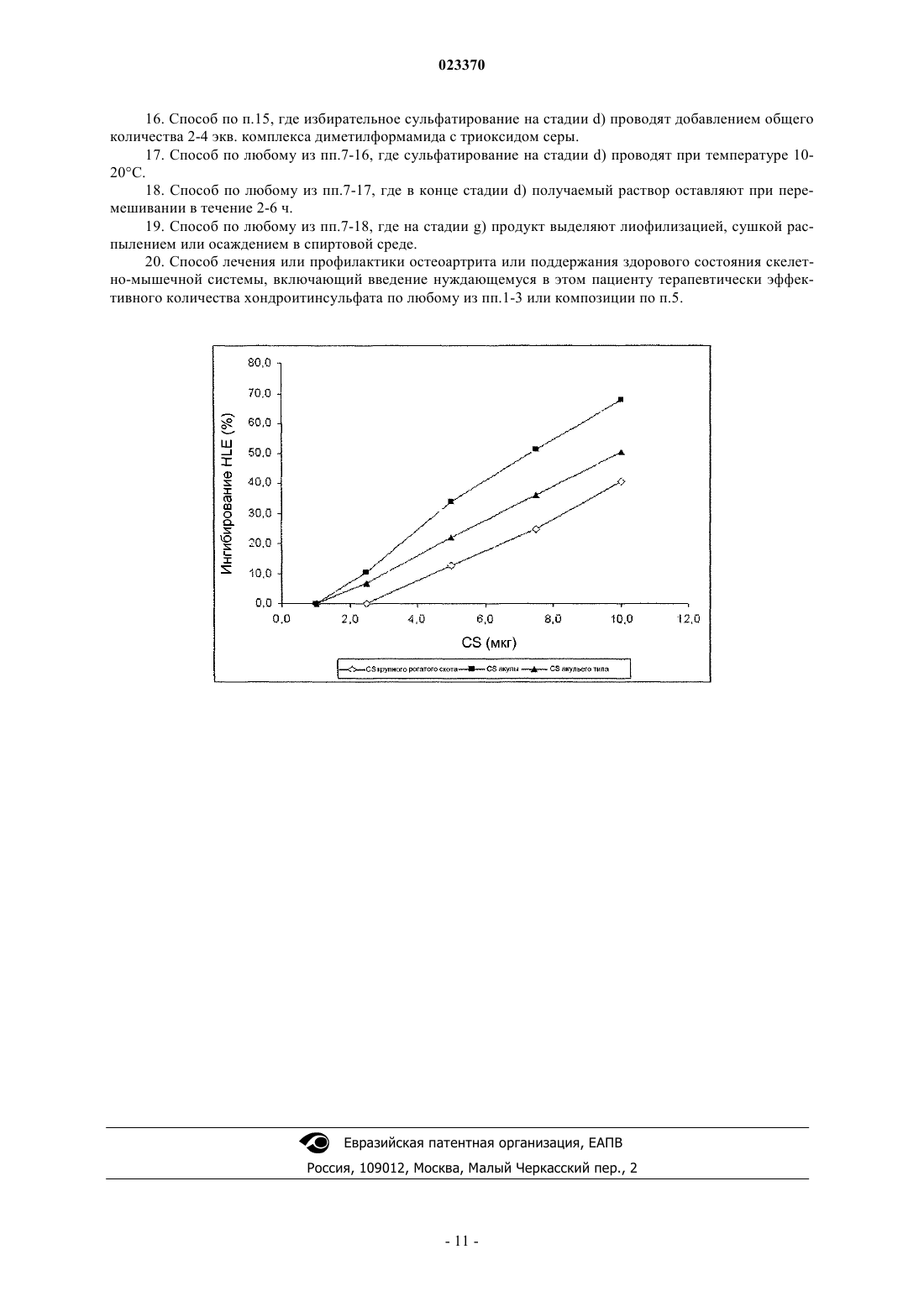
ХОНДРОИТИНСУЛЬФАТ АКУЛЬЕГО ТИПА И СПОСОБ ЕГО ПОЛУЧЕНИЯ Изобретение относится к хондроитинсульфату акульего типа и способу его получения. В частности, изобретение относится к хондроитинсульфату акульего типа, для которого демонстрируют очень низкое количество 4-сульфата, высокую плотность заряда и биологическую активность, сравнимую с природными хондроитинсульфатами; изобретение также относится к способу получения указанного хондроитинсульфата акульего типа, обеспечивающему, по существу, более высокую производительность и лучшую воспроизводимость качества продукта. Хондроитинсульфат акульего типа по изобретению обладает высокой молекулярной массой и плотностью заряда; его биологическая и противовоспалительная эффективность in vitro,сопоставимая с эффективностью природных продуктов, делает этот полисахарид потенциально пригодным в качестве лекарственного средства в фармацевтических препаратах и нутрицевтиках. Настоящее изобретение относится к хондроитинсульфату акульего типа и способу его получения. В частности, настоящее изобретение относится к хондроитинсульфату акульего типа, для которого продемонстрировано очень низкое количество 4-сульфата, высокая плотность заряда и биологическая активность, сравнимая с природными хондроитинсульфатами; изобретение также относится к способу получения указанного хондроитинсульфата акульего типа. Хондроитинсульфат (далее в настоящем описании CS), принадлежащий к классу природных сложных полисахаридов, называемых гликозаминогликанами (GAG), состоит из чередующихся дисахаридных последовательностей различным образом сульфатированных остатков D-глюкуроновой кислоты(GlcA) и N-ацетил-D-галактозамина (GalNAc), связанных бета(1-3) связями. В зависимости от природы дисахарида известны CS с различными углеводородными основными цепями. Фактически, хотя природный и синтетический известный CS состоят в основном из двух типов дисахаридных звеньев с различным процентным содержанием, т.е. сульфатированных в положениях 4 или 6 GalNAc, дисахариды с различным числом и положением сульфатных групп могут содержаться в различном процентном содержании в полисахаридных цепях. Например, несульфатированный дисахарид в основной цепи CS, как правило, содержится в небольших количествах, тогда как дисульфатированные дисахариды, содержащие две сульфатные группы О-связанные в различных положениях, таких как 2GlcA и 6 GalNAc (дисахарид D), или в положении 4 и 6 GalNAc (дисахарид Е), могут содержаться в основной цепи CS в различных процентных содержаниях в зависимости от конкретных источников животного происхождения [Volpi N., J. Pharm. Pharmacol. 61, 1271, 2009; Volpi N., J. Pharm. Sci. 96, 3168, 2007].CS содержит повторяющиеся дисахаридные звенья, содержащие следующую ниже структурную формулу: где R2, R4 и R6 независимо представляют собой Н или SO3. Значение некоторых наиболее часто встречающихся сокращений, используемых в настоящее время для сокращенного обозначения различным образом сульфатированных остатков чередующихся последовательностей дисахаридов, которые составляют CS, приведено ниже. Ди-0S (R2=H; R4=H; R6=H). Ди-6S (С) (R2=H; R4=H; R6=SO3-). Ди-4S (A) (R2=H; R4=SO3-; R6=H). Ди-4,6-ди-S (E) (R2=H; R4=SO3-; R6=SO3-). Ди-2,6-Ди-S (D) (R2=SO3-; R4=H; R6=SO3-). Ди-2,4-Ди-S (В) (R2=SO3-; R4=SO3-; R6=H). Ди-2,4,6-три-S (R2=SO3-; R4=SO3-; R6=SO3-). Природные и синтетические образцы CS можно характеризовать и различать чувствительными,специфичными, валидированными и опубликованными аналитическими подходами, с использованием которых можно получать структурную характеристику и параметры CS (например, конкретные сульфатированные группы, плотность заряда, молекулярную массу и чистоту), а также виды биологической активности. Природные экстрагируемые образцы CS можно охарактеризовать по структуре и свойствам[Volpi N., J. Pharm. Pharmacol., 61, 1271, 2009; Volpi N., J. Pharm. Sci. 96, 3168, 2007; Mucci A. et al.,Carbohydr. Polymers, 41, 37, 2000; Volpi N., Analyt. Biochem. 277, 19, 2000]. В отношении три- и тетрасульфатированных форм CS ("три-S" и "тетра-S" соответственно) можно отметить, что их обычно не детектируют в экстрагируемых образцах природного CS, тогда как они, как правило, характеризуют синтетический CS; ди-2,4,6-три-S принимают как стандарт для оценки наличия три-S CS в синтетических продуктах CS, так как другие теоретически возможные формы три-S не содержатся в продуктах, получаемых из природных источников. В табл. 1 проиллюстрированы основные дисахариды, идентифицируемые в образцах природногоCS, экстрагируемого и выделяемого из различных органов и тканей, в основном хрящей.Mw=средневзвешенная молекулярная масса; индекс полидисперсности=Mw/Mn; плотность заряда представляет собой число сульфатных групп в дисахаридных звеньях; Н/О=не обнаружено. В табл. 1 проиллюстрированы основные структурные параметры для характеристики образцов основных природных CS, выделяемых из нескольких источников. В частности, параметры молекулярной массы являются достаточно сходными для образцов CS сухопутных животных (образцов крупного рогатого скота, свиньи и курица), но достаточно отличающимися в образцах от рыб (образцы акулы, ската и кальмара), у последних значения молекулярной массы являются выше, чем указанные ранее. Кроме того, образцы CS рыб имеют характерные значения плотности заряда более приблизительно 1,0 вследствие наличия дисульфатированных дисахаридов и отличающиеся от образцов сухопутных животных, в которых значения плотности заряда составляют менее приблизительно 1,0 вследствие отсутствия дисульфатированных дисахаридов. Дополнительной характерной особенностью всех природных CS является то, что при их расщеплении хондроитиназой ABC, гидролитическим ферментом специфичным для 4S или 6S сульфатированных дисахаридов, а также для несульфатированных дисахаридов, полисахаридная цепь полностью расщепляется на дисахаридные звенья. Это можно легко наблюдать при анализе FACE (электрофорезе углеводов с использованием флуорофоров). Полное расщепление природного CS происходит вследствие отсутствия три-и тетрасульфатированных структур в полисахаридной цепи. Хондроитиназа ABC не распознает трии тетрасульфатированные дисахариды при их наличии, обеспечивая неполное расщепление полисахаридов, что приводит к образованию частично нерасщепленных олигосахаридных цепей, легко определяемых в анализе FACE. В заключение стоит отметить, что в результате пути биосинтеза для всех известных природных CS в настоящее время показано наличие дисахаридов, моносульфатированных в положении 4 и положении 6GalNAc (с содержанием 4-сульфатированного дисахарида никогда не ниже 30%), даже если их отношение изменяется в зависимости от источника. Как проиллюстрировано выше, CS представляет собой очень сложную гетерогенную макромолекулу с изменчивой структурой и свойствами в зависимости от источника выделения. Кроме того, вследст-2 023370 вие биосинтетических процессов, связанных с конкретными тканями и видами, CS с различной степенью полимеризации может синтезироваться с получением макромолекул с различными молекулярными массами и полидисперсными свойствами. Вследствие этих структурных вариаций и в дополнение к возможному наличию конкретных олигосахаридных последовательностей, и чистоты препаратов для терапевтических применений или для нутрицевтиков, CS может обладать различными свойствами и способностями. Фактически в зависимости от структуры CS описаны различные и характерные виды активности[Volpi N., Biomaterials 23, 3015, 2002; Volpi N. et al., Biochimie 81, 955, 1999; Volpi N., Biomaterials 20,1359, 1999; Suzuki S. et al., J. Biol. Chem. 243, 7, 1968]. В настоящее время на основании полученных в исследованиях доказательств и мета-анализа многих клинических исследований Европейская лига против ревматизма (EULAR) рекомендует экстрагируемый природный CS в качестве симптоматического медленнодействующего лекарственного средства для остеоартрита (SYSADOA) в Европе при лечении ОА коленного сустава [Jordan KM et al., Ann.Rheum. Dis. 62, 1145, 2003], тазобедренного сустава [Jordan K.M. et al., Ann. Rheum. Dis. 62, 1145, 2003] и кисти [Zhang W. et al., Ann. Rheum. Dis. 66, 377, 2007]. Кроме того, CS отдельно или в комбинации с другими ингредиентами широко используют в качестве нутрицевтика, главным образом в Европе и США [McAlindon Т.Е. et al., JAMA, 283, 1469, 2000;Volpi N. et al., Food Anal. Meth. 1, 195, 2008; Volpi N. et al., Separation Sc 1, 22, 2009]. Эффективность CS строго связана с его противовоспалительной активностью, такой как его способность ингибировать активность деструктивных ферментов, таких как эластаза лейкоцитов человека(HLE) [Ronca F. et al., Osteoarthritis Cartilage, 6 Suppl. A, 14, 1998; Egea J. et al., Osteoarthritis Cartilage, 18,Suppl. 1, S24, 2010]. Используемый повсеместно CS для фармацевтических или нутрицевтических применений получают экстракцией из ткани некоторых животных, таких как крупный рогатый скот и свинья [Fuentes E.P. etal., Acta Farm Bonaerense, 17, 135, 1998], птицы [Luo X.M. et al., Poult. Sci., 81, 1086-1089, 2002], хрящевые рыбы [Sugahara K. et al., Eur. J. Biochem., 239, 871, 1996; Lignot B. et al., J. Biotechnol. 103, 281, 2003] и т.д. Кроме того, животное происхождение этих продуктов несет потенциальные проблемы безопасности для потребителей, ассоциированные с возможным наличием трансмиссивных инфекционных агентов, таких как инфекционные агенты, вызывающие губчатые энцефалопатии у крупного рогатого скота,или ограничения использования, связанного с религиозными причинами. Кроме того, экстрагируемый характер этих продуктов делает их запасы потенциально ненадежными с точки зрения растущего спроса и увеличивающихся объемов рынка. Такие соображения способствовали поиску альтернативных более надежных источников CS, пример которых представляет собой биотехнологическое получение, начиная с капсулярного полисахаридаK4 Е.coli, как описано в научной и патентной литературе. В этом контексте термин "биотехнологическое получение" относится к способу получения, где существенную часть конечного продукта получают посредством микроорганизма или посредством выделенных клеток высшего организма в искусственной системе культивирования общепринято и в широком смысле, обозначаемой как ферментация. В основном в настоящее время в данной области используют три основных подхода. Первый подход можно определять как получение аналогичных CS соединений с использованием в качестве исходного вещества капсулярного полисахарида K4 Е.coli О 5:K4:Н 4, который затем подвергают химической трансформации, тогда как второй подход можно видеть в прямом биосинтезе аналогичныхCS соединений посредством микроорганизмов, и признают, что третий подход представляет собой биотехнологическое получение несульфатированного хондроитина с последующим химическим или биохимическим сульфатированием. В ЕР-А-1304338, принадлежащей к указанному выше первому подходу, описано получение CS на основании полисахарида K4, получаемого в жидких культурах, который сначала экстрагируют и очищают, а затем повторно растворяют и подвергают кислотному гидролизу, основным эффектом которого является удаление остатков фруктозы, связанных с остатками GlcA, содержащимися в линейном полимере. Вторичный эффект представляет собой частичный гидролиз полисахаридной цепи, приводящий к продуктам с меньшей молекулярной массой. Затем, полимер с удаленными остатками фруктозы, который является идентичным несульфатированному хондроитину, различным образом сульфатируют в положениях С-4 или С-6 остатков GalNAc химическими средствами с использованием соответствующих защитных групп в положениях 4 или 6. Также в этом документе описан CS, по меньшей мере 70% содержание которого составляют моно- и/или дисульфатированные в положениях 4 и 6 группы галактозамина, в положении 2 глюкуроновой группы, являющийся несульфатированным с Mw 6-25 кДа и отношением карбоксильной/сульфатной группы (т.е. плотностью заряда) 0,7-2,0. В WO 2009/149155, которая служит примером указанного выше второго подхода, описано прямое получение аналогичных CS соединений посредством нескольких микроорганизмов бактерий и грибов. Также в этом документе описано соединение, аналогичное CS сухопутных животных, где положения 4 и 6 группы галактозамина являются сульфатированными; описано, что соединение имеет молекулярную массу (Mw) приблизительно от 300 до 35 кДа и отношение сульфата 4S/6S в диапазоне от менее 1 до более 1. Третий из указанных выше подходов включает несколько различных стратегий получения несульфатированного хондроитина, главной из которых является ферментативный синтез полимера в бесклеточных системах, таких как бесклеточные системы, описанные, например, в ЕР-А-1950308 и ЕР-А-1964924, и биосинтез в получаемых рекомбинантных клетках, экспрессирующих в хозяевах, способных продуцировать на основании UDP-GlcA, продукты генов kfoA и kfoC, выделяемых из Е.coli K4,описанные, например, в WO 2008/133350. Другой пример биотехнологического получения несульфатированного хондроитина описан в патентной заявке ИталииMI2010A001300, которая, в числе прочего, относится к способу биотехнологического получения хондроитина, включающему культивирование в подходящей среде рекомбинантного микроорганизма, предпочтительно Escherichia coli DSM23644, сбор и очистку несульфатированного хондроитина, содержащегося в микробной культуре, а затем химическое сульфатирование последнего. Общим признаком описанных в настоящее время способов получения CS является существенное уменьшение молекулярной массы исходного вещества как во время катализируемого кислотой удаления остатков фруктозы, так и во время стадий химического синтеза, необходимых для сульфатирования остатков GalNAc. Например, в ЕР-А-1304338 описан CS с молекулярной массой 6-25 кДа, тогда как описано, что молекулярная масса полисахарида K4, используемого в качестве исходного вещества, составляет 150-400 кДа. Первый аспект настоящего изобретения представляет собой хондроитинсульфат акульего типа, не содержащий три-, тетра- и 2,4-дисульфатированные дисахариды, состоящий из 60-99% 6-сульфата,0,5-30% 2,6-дисульфата, 0,1-5% 4,6-дисульфата, 0,1-5% несульфатированного хондроитина и 0,1-1% 4-сульфата, где все процентные содержания выражают относительно общего содержания дисахаридов хондроитинсульфата акульего типа, где среднечисловая молекулярная масса (Mn) последнего составляет 40-85 кДа и средневзвешенная молекулярная масса (Mw) составляет 50-95 кДа. Предпочтительно хондроитинсульфат акульего типа по настоящему изобретению состоит из 7090% 6-сульфата, 8,5-20% 2,6-дисульфата, 0,1-5% 4,6-дисульфата, 0,1-5% несульфатированного хондроитина и 0,1-1% 4-сульфата, где все процентные содержания выражают относительно общего содержания дисахаридов хондроитинсульфата акульего типа, где среднечисловая молекулярная масса (Mn) последнего составляет 40-65 кДа и средневзвешенная молекулярная масса (Mw) составляет 50-70 кДа.CS, являющийся целью настоящего изобретения, характеризуется высокой молекулярной массой и характерными сульфатированными группами, в основном в положении 6, а также очень небольшим количеством 4-сульфатированного дисахарида. Анализируя характеристики CS по настоящему изобретению и сравнивая их с характеристиками,приведенными в указанной выше табл. 1 относительно природы образцов экстрагируемого CS, можно видеть, что CS по настоящему изобретению приблизительно сходен с акульим CS. Кроме того, являющийся целью настоящего изобретения CS не содержит каких-либо полисульфатированных дисахаридов, в частности он не содержит ни трисульфатированные, ни тетрасульфатированные дисахариды, как правило, характеризующие CS, получаемый синтетическими способами, описанными в известном уровне техники, и детектируемые после расщепления хондроитиназой ABC в виде нерасщепленного продукта. Кроме того, являющийся целью настоящего изобретения CS является высокоочищенным (в пересчете на количество нерасщепленного продукта после расщепления хондроитиназой ABC) и явно отличается от CS, описанного в ЕР-А-1304338, имеющего молекулярную массу 6-25 кДа и большое количество несульфатированного хондроитина (10%) и широкий диапазон плотности заряда (0,7-2), в то время как диапазоны плотности заряда CS по изобретению являются уже и предпочтительно составляют 1,051,30.Mn и Mw можно рассчитывать общепринятыми способами, известными специалисту в данной области, например высокоэффективной эксклюзионной хроматографией (HPSEC); предпочтительно Mn иMw можно определять HPSEC, оснащенной интегрированным специализированным программным обеспечением для гель-проникающей хроматографии (GPC). Предпочтительно сумма 2,6-дисульфата и 4,6 дисульфата в CS по настоящему изобретению составляет 10-25% от общего содержания дисахаридов. По другому аспекту настоящее изобретение относится к композиции, содержащей хондроитинсульфат акульего типа по настоящему изобретению и фармацевтически или нутрицевтически приемлемый носитель, такой как, например, микрокристаллическая целлюлоза, декстрин, мальтодекстрин, циклодекстрин, сульфобутилэфир-бета-циклодекстрин, соевый лецитин, пальмитолеиновая кислота, липосомы, сложные эфиры сахарозы и т.п. Как понятно специалисту в данной области на основании общих известных знаний в данной области, композицию по изобретению можно формулировать в различных формах, в твердой (например, таб-4 023370 летки, твердые капсулы, мягкие гелевые капсулы) или жидкой (например, растворы или смеси напитка в порошке), предпочтительно в форме парентерального и/или перорального фармацевтического и/или нутрицевтического препарата, и она может дополнительно содержать другие неактивные и/или активные ингредиенты. В числе таких дополнительных ингредиентов композиция по изобретению также может содержать и предпочтительно содержит по меньшей мере одно из следующих веществ: глюкозамингидрохлорид,глюкозаминсульфат, N-ацетилглюкозамин, гиалуроновую кислоту, гепарин, кератин, дерматин, метилсульфонилметан, фолаты или восстановленные фолаты, витамины группы В, S-аденозилметионин(SAMe), аскорбиновую кислоту или аскорбат марганца, и ее можно вводить в эффективном количестве нуждающемуся в этом индивидууму в зависимости от потребностей и обстоятельств в случае необходимости. Только в качестве примера CS акульего типа и/или композицию по настоящему изобретению можно вводить в количестве 100-3000 мг/сутки, предпочтительно количество 1000-2000 мг/сутки, более предпочтительно количество 1200-1800 мг/сутки, как правило, разделенной на две/три дозы в сутки. По другому аспекту настоящее изобретение относится к хондроитинсульфату акульего типа или к композиции по настоящему изобретению для применения в профилактике или лечении остеоартрита или для поддержания здорового состояния скелетно-мышечной системы, например, в качестве активного ингредиента в лекарственном средстве или пищевой добавки или питательной добавки. Только в качестве примера CS акульего типа или композицию по настоящему изобретению, как определено выше, можно использовать для получения лекарственного средства, пищевой добавки или питательной добавки для профилактики и/или лечения остеоартрита (ОА) тазобедренного сустава, кисти и коленного сустава и его основных симптомов, таких как боль, опухание сустава, воспаление, болезнь Альцгеймера, микробные инфекции, атеросклероз, остеопороз, и в качестве адъюванта в терапии злокачественной опухоли и регенерации ткани, включая регенерацию нервной ткани. По еще одному другому аспекту настоящее изобретение относится к способу получения указанного выше хондроитина акульего типа, включающему:a) высаливание несульфатированного хондроитина в виде свободной кислоты, предварительно растворенного в водной среде, солью, выбранной из группы, состоящей из тетраметил-, тетраэтил- и тетрабутиламмония или тетраметил-, тетраэтил- и тетрабутилпиридиния;b) сушку подвергаемого высаливанию несульфатированного хондроитина, получаемого на стадии а) до содержания воды 5-15%;c) сушку высаливаемого несульфатированного хондроитина, получаемого на стадии b) при температуре 100-170C до содержания воды 0,1-3%;d) избирательное сульфатирование 6 положения высаливаемого несульфатированного хондроитина,получаемого на стадии с), растворенного в N-метилпирролидоне или диметилформамиде при температуре 0C-30C, добавлением 1-2 эквивалентов комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы, с интервалами времени 1-3 ч добавляют до полных 2-15 экв. комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы; оставляя получаемый раствор при перемешивании в течение 2-24 ч;e) гашение реакции, проводимой на стадии d), водным бикарбонатом натрия или карбонатным раствором, фильтрование и выпаривание досуха получаемого раствора с получением сухого твердого вещества;f) растворение сухого твердого вещества в водном растворе хлорида натрия, ультрафильтрацию и диализ получаемого раствора;g) выделение продукта из раствора, получаемого на стадии f);h) очистку продукта, получаемого на стадии g) и получение последнего в форме кислоты или в виде его натриевой соли;i) выделение продукта, получаемого на стадии h). Высаливание несульфатированного хондроитина на стадии а) предпочтительно проводят с солью,выбранной из группы, состоящей из тетраметил-, тетраэтил- и тетрабутиламмония, наиболее предпочтительно с тетрабутиламмонием, тогда как сушку несульфатированного хондроитина на стадии b) можно проводить лиофилизацией или сушкой распылением. Сушку соли несульфатированного хондроитина на стадии с) предпочтительно проводят до 0,5-2% воды, при этом растворение соли несульфатированного хондроитина, получаемого на указанной стадии предпочтительно проводят в диметилформамиде. Избирательное сульфатирование на стадии d) предпочтительно проводят добавлением всего 6-12,более предпочтительно 6-9, эквивалентов комплекса пиридина с триоксидом серы. Альтернативно, когда проводят избирательное сульфатирование на стадии d) комплексом диметилформамида с триоксидом серы, добавляют всего 1-9, предпочтительно 2-4 экв. Кроме того, избирательное сульфатирование на стадии d) предпочтительно проводят при температуре 10-20C, при этом в конце стадии d) получаемый раствор предпочтительно оставляют при перемешивании в течение 2-6 ч. По еще одному другому предпочтительному варианту осуществления способа по изобретению продукт из раствора, получаемого на стадии f) выделяют лиофилизированием, сушкой распылением или осаждением в спиртовой среде. Способ по изобретению обеспечивает сохранение неизмененной молекулярной массы нативного полисахарида. Неожиданно способ по изобретению позволяет устранить проведение стадии, направленной на защиту любой из вторичных гидроксильных групп, вероятно, вследствие того, что реакционная способность первичной гидроксильной группы в 6 положении GalNAc обеспечивает избирательность реакции. Кроме того, способ по изобретению позволяет получать, по существу, большую производительность и лучшую воспроизводимость качества продукта по сравнению с известным уровнем техники, например, по отношению к ЕР-А-1304388, где стадии сульфатирования приводят к более широкому диапазону отношения карбоксильных/сульфатных групп, составляющему 0,7-2,0. Также способ по изобретению позволяет получать продукт, содержащий очень низкие количества 4-сульфатированного дисахарида и, по существу, не содержащий полисульфатированных дисахаридов, в частности, он позволят получать продукт, не содержащий три-S- или тетра-D-сахариды. Как правило, способ по изобретению можно проводить растворением несульфатированного хондроитина в виде свободной кислоты или натриевой соли, получаемой, например, удалением остатков фруктозы капсулярного полимера K4, получаемого ферментацией в водной среде, как описано Manzoni(Biotechnology Letters, 18, 383-6, 1996) и Rodriguez (Eur. J. of Biochem., 177, 117-24, 1988). В случае если несульфатированный хондроитин находится в форме своей натриевой соли, после его полного растворения получаемый раствор элюируют подходящим способом при температуре 0-30C на колонке, содержащей катионообменную смолу (такую как, например, Amberjet 1200H, Rohm and Haas и т.п.), собирая элюируемые части подходящим способом при pH 1,5-4,0, предпочтительно 1,5-3,0 и выделяя части водной кислоты. Альтернативно, эту стадию можно проводить в периодическом режиме: после растворения натриевой соли несульфатированного хондроитина в воде, которое предпочтительно проводят при перемешивании в течение 20-60 мин при 0-30C, к ней добавляют катионную смолу (Amberjet 1200 Н, Rohm andHaas и т.п.), получаемый pH раствора после добавления смолы составляет от 1,5 до 3,0. Затем раствор фильтруют и собирают получаемый кислый фильтрат. Затем кислый раствор несульфатированного хондроитина, получаемого непосредственным растворением несульфатированного хондроитина в виде свободной кислоты или очищением раствора его натриевой соли, как описано выше, в непрерывном или периодическом режиме добавляют к водному раствору иона, выбранного из группы, состоящей из тетраметил-, тетраэтил- и тетрабутиламмония или тетраметил-, тетраэтил- и тетрабутилпиридиния подходящим способом до pH 6,0-8,0, предпочтительно 6,07,0, раствор выпаривают досуха, например, лиофилизацией или сушкой распылением до содержания воды 5-15%, так чтобы выделять соответствующую соль хондроитина. Затем получаемую соль хондроитина подвергают стадии второй сушки при температуре 100-170C до содержания воды 0,1-3%, таким образом, чтобы в конечном итоге выделять соответствующую соль несульфатированного хондроитина. Затем соответствующую соль несульфатированного хондроитина, получаемого, как описано выше,избирательно сульфатируют в 6 положении без необходимости защиты каких-либо функциональных групп, растворяя его в растворителе, выбранном из N-метилпирролидона или диметилформамида, при температуре 0-30C, предпочтительно 10-20C, подходящим способом элюируя полностью растворенную соль несульфатированного хондроитина на колонке, содержащей катионообменную смолу (такую как, например, Amberjet 1200H, Rohm and Haas и т.п.), добавляя 1-2 экв. комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы с интервалами времени 1-3 ч до полных 2-15 экв. комплекса пиридина или диметилформамида с триоксидом серы, оставляя получающийся раствор при перемешивании в течение 2-24 ч, предпочтительно 2-6 ч. В дальнейшем получаемую реакционную массу гасят в водном растворе бикарбоната или карбоната натрия, а затем выделяют, например, обработкой бикарбонатом натрия и фильтрованием получаемых нерастворимых солей, выпаривают досуха и снова растворяют в водном растворе хлорида натрия, выделяют и в конечном итоге подвергают, например, ультрафильтрации и диализ, таким образом, чтобы удалять оставшиеся соли и низкомолекулярные примеси и в конечном итоге выделять продукт, например,лиофилизацией, сушкой распылением или осаждением в спиртовой среде. Затем получаемый хондроитин-6-сульфат, получаемый как проиллюстрировано выше, очищают,например, хроматографией на колонке с катионообменной смолой таким образом, чтобы получать его в форме его соли, а затем, возможно, в виде его натриевой соли, путем добавления, например, гидроксида натрия. Получаемый таким образом хондроитин-6-сульфат в конечном итоге выделяют, например, его сушкой в печи в вакууме при 50-70C или хроматографически очищают, получая хондроитинсульфат акульего типа не содержащий три-, тетра- и 2,4-дисульфатированных дисахаридов, с Mn 40-85 кДа,Mw 50-95 кДа. Следующие ниже примеры иллюстрируют изобретение. Пример 1. Высаливание. В деминерализованной воде (500 мл) растворяли 20 г натриевой соли хондроитина, получаемой удалением остатков фруктозы капсулярного полимера K4, получаемого ферментацией, как описаноManzoni (Biotechnology Letters, 18, 383-6, 1996) и Rodriguez (Eur. J. of Biochem., 177, 117-24, 1998). После полного растворения получаемый раствор элюировали при 5C на колонке, содержащей катионообменную смолу (160 мл Amberjet 1200 Н, Rohm and Haas), предварительно гидратированный и получаемый в форме кислоты. Элюируемые части выделяли при pH 1,9, собирая части водной кислоты и добавляя к ним 16% водный раствор тетрабутиламмония до pH 7,0; затем раствор выпаривали досуха лиофилизацией, таким образом выделяя 20,8 г хондроитина в виде тетрабутиламмониевой соли. Затем получаемую соль подвергали второй термической обработке в стационарной сушилке при 105C в течение 4 ч в вакууме до остаточной влажности менее 0,2%. Таким образом, получали 18,5 г хондроитина в виде тетрабутиламмониевой соли. Пример 2. Высаливание. В 20 мл деминерализованной воды растворяли 12 г несульфатированного хондроитина, получаемого удалением остатков фруктозы капсулярного полимера K4, получаемого ферментацией, как описаноManzoni (Biotechnology Letters, 18, 383-6, 1996) и Rodriguez (Eur. J. of Biochem, 177, 117-24, 1998), и после подкисления до pH 2,5 1 М HCl и добавления 80 мл этанола несульфатированный хондроитин осаждали в виде свободной кислоты. После фильтрования и промывания этанолом получали 10,3 г продукта в виде белого твердого вещества, который после сушки в вакууме при 50C имел титр кислоты 90% от рассчитанного для продукта в чистом виде и содержал 8% остаточной воды. Получаемое твердое вещество суспендировали в 20 мл воды и добавляли 40% мас./мас. водного раствора гидроксида тетрабутиламмония до pH 8. Затем получаемый раствор лиофилизировали до остаточной воды 2,5%, таким образом получая 15,9 г твердого хондроитина в виде тетрабутиламмониевой соли. Получаемую соль затем подвергали второй термической обработке в стационарной сушилке при 105C в течение 4 ч в вакууме до остаточной влажности менее 0,2%. Таким образом, получали 15,4 г тетрабутилхондроитина. Пример 3. Сульфатирование 1,4 г тетрабутилхондроитина, получаемого, как проиллюстрировано в примере 1,и 84 мл DMF помещали в 250 мл четырехгорлую колбу, хранящуюся в атмосфере инертного газа (N2),при механическом перемешивании и в присутствии системы охлаждения пузырьковой пленки, поглотительной трубкой с хлоридом кальция и термометром. Получаемую суспензию оставляли при перемешивании до полного растворения, затем регулируя температуру при 23C. После установления температуры к раствору порционно добавляли твердый комплекс пиридина с триоксидом серы (1,07 г, 3 экв.), поддерживая реакционную смесь при перемешивании в течение 1 ч, а затем добавляя дополнительно твердый комплекс пиридина с триоксидом серы (1,07 г, 3 экв.). После перемешивания еще в течение 1 ч при аналогичной температуре реакционную смесь переносили в 500 мл колбу, содержащую насыщенный раствор гидрокарбоната натрия, и охлаждали до 10C. После повышения температуры до 20C проводили фильтрование на воронке Бюхнера, собирая фильтрат и выпаривая его досуха в вакууме. Получаемое сухое твердое вещество (2,3 г) тонко измельчали и повторно растворяли в 0,3 М растворе NaCl (130 мл), подвергая получаемый таким образом раствор ультрафильтрации с использованием мембраны с порогом удержания 3 кДа и поддерживая pH ретентата при 7,0. Затем раствор после ультрафильтрации подвергали диализу для удаления солей, выделяя продукт посредством лиофилизации. В заключение получаемый продукт сушили при 50C и 10 мбар с получением 1 г вещества с титром(рассчитанным путем определения импульсного амперометрического детектирования глюкуроновой кислота "PAD") 95%, Mn 60 кДа и Mw 67,3 кДа, определяемыми высокоэффективной эксклюзионной хроматографией (HPSEC) с интегрированным специализированным программным обеспечением для GPC. Пример 4. Сульфатирование 1,21 г хондроитина в виде тетрабутиламмониевой соли, получаемой, как проиллюстрировано в примере 1, и 72 мл DMF помещали в 250 мл четырехгорлую колбу, хранящуюся в атмосфере инертного газа (N2), при механическом перемешивании и в присутствии системы охлаждения пузырьковой пленки, поглотительной трубкой с хлоридом кальция и термометром. Получаемую суспензию оставляли при перемешивании до полного растворения, затем регулируя температуру при 10C. После установления температуры к раствору добавляли твердый комплекс триоксидом серы с DMF(0,88 г, 3 экв.), поддерживая реакционную смесь при перемешивании в течение 1 ч. Добавляли гидрокарбонат натрия (0,97 г, 6 экв.), поддерживая аналогичную температуру, и продолжали перемешивать в течение 1 ч при повышении температуры до 20C. Получаемую суспензию фильтровали на воронке Бюхнера и выпаривали досуха в вакууме собираемый фильтрат. Получаемое сухое твердое вещество (2,05 г) тонко измельчали и повторно растворяли в 0,3 М растворе NaCl (130 мл), подвергая получаемый таким образом раствор ультрафильтрации с использованием мембраны с порогом удержания 3 кДа и поддерживая pH ретентата при 7,0. Затем раствор после ультрафильтрации подвергали диализу для удаления солей, выделяя продукт посредством лиофилизации. В заключение получаемый продукт сушили при 50C и 10 мбар с получением 0,95 г вещества с титром (рассчитанным посредством определения глюкуроновой кислоты-PAD) 94%, Mn 62 кДа и Mw 68,3 кДа, определяемыми высокоэффективной эксклюзионной хроматографией (HPSEC) с интегрированным специализированным программным обеспечением для GPC. Пример 5. Анализ хондроитин-6-сульфата. Композицию CS, получаемого в примерах 3 и 4, исследовали посредством ВЭЖХ его продуктов расщепления, обрабатывая CS, получаемого, как описано выше, хондроитиназой ABC способом, описанным Joon-Soo Sim et al. (J. Chromatography В., 2005, vol. 818, p. 133-139). Анализ проводили с использованием колонки ВЭЖХ-SAX 2504,6 мм 10 мкм, элюирования с градиентом, начиная с начальной фазы 3,5 мМ HCl (pH 3,5) (100%) до концентрации, равной 1 М NaCl, в 3,5 мМ HCl (pH 3,5) (100%). Аналогичные продукты, получаемые при расщеплении хондроитиназйо ABC, анализировали анализом FACE (электрофорез углеводов с использованием флуорофоров) для выявления наличия нерасщепленного полисахарида. Результаты демонстрируют показатель расщепления более 95%. Высокий показатель расщепления свидетельствует об отсутствии, по существу, три- и/или тетрасульфатдисахаридов в структуре получаемого CS. В следующей ниже табл. 2 представлены основные дисахариды, идентифицируемые в продуктах,получаемых в примерах 3 и 4. Таблица 2Mw=средневзвешенная молекулярная масса; индекс полидисперсности=Mw/Mn; плотность заряда представляет собой число сульфатных групп в дисахаридных звеньях; Н/О=не обнаружено. Сравнивая табл. 2 с табл. 1, можно видеть, что композиция CS, являющегося целью настоящего изобретения, является близко родственной акульему CS, так как она содержит очень небольшие количества ди-4S и в основном состоит из ди-6S, тогда как ди-OS, ди-2,6-ди-S и ди-4,6-ди-S являются приблизительно совпадающими со значениями, описанными для акульего CS; кроме того, для CS по настоящему изобретению демонстрировали плотность заряда более 1,0. Также для продуктов, получаемых при выполнении примера 3 и 4, выявили отсутствие форм три-S и тетра-S CS. Кроме того, для CS, являющегося целью настоящего изобретения, демонстрируют характерное содержание сульфатов при сравнении с некоторыми продуктами, описанными в известном уровне техники,как проиллюстрировано в табл. 3. Таблица 3 Пример 6. Вследствие того что эффективность CS является тесно связанной с его противовоспалительной активностью, такой как его способность ингибировать активность деструктивных ферментов, таких как эластаза лейкоцитов человека (HLE), CS, являющейся целью настоящего изобретения, тестировали invitro в отношении его способности ингибировать такую активность HLE и сравнивали CS крупного рогатого скота (1-го стандарта CS Европейской фармакопеи) и CS, экстрагируемый из образцов акульих хрящей. Сравнительные результаты представлены на фигуре. Образец CS акульего типа по настоящему изобретению, получаемый способом, описанным в примере 3, сравнивали с CS крупного рогатого скота (1-м стандартом CS Европейской фармакопеи), поставляемым Bioiberica, и CS, экстрагируемым из акульих хрящей. Активность эластазы определяли спектрофотометрическим анализом с использованием хромогенного искусственного субстрата (N-сукцинил-Ala-Ala-Ala-пара-нитроанилида), специфичного для HLE. После предварительной инкубации фермента с повышающимися количествами CS активность определяли посредством инкубации с хромогенным субстратом (N-сукцинил-Ala-Ala-Ala-пара-нитроанилидом). После остановки реакции получаемый продукт количественно определяли посредством спектрофотометрической оценки. Таблица 4 На фигуре проиллюстрированы данные, описанные в табл. 4, и продемонстрировано, что CS акульего типа по настоящему изобретению способен эффективно значительно ингибировать активность эластазы лейкоцитов человека сопоставимо с эффективностью, проявляемой образцами природного CS. Биологическая активность и противовоспалительные свойства, выявляемые in vitro для CS, являющегося целью настоящего изобретения, делают последний сопоставимым с природными продуктами и,таким образом, потенциально пригодным в качестве лекарственного средства в фармацевтических препаратах и нутрицевтиках. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Хондроитинсульфат акульего типа, не содержащий три-, тетра- и 2,4-дисульфатированные дисахариды, состоящий из 60-99% 6-сульфата, 0,5-30% 2,6-дисульфата, 0,1-5% 4,6-дисульфата, 0,1-5% несульфатированного хондроитина и 0,1-1% 4-сульфата, где все процентные содержания выражены относительно общего содержания дисахаридов хондроитинсульфата акульего типа, где среднечисловая молекулярная масса (Mn) последнего составляет 40-85 кДа и средневзвешенная молекулярная масса (Mw) составляет 50-95 кДа. 2. Хондроитинсульфат акульего типа по п.1, состоящий из 70-90% 6-сульфата, 8,5-20% 2,6-дисульфата, 0,1-5% 4,6-дисульфата, 0,1-5% несульфатированного хондроитина и 0,1-1% 4-сульфата,где все процентные содержания выражены относительно общего содержания дисахаридов хондроитинсульфата акульего типа, где среднечисловая молекулярная масса (Mn) последнего составляет 40-65 кДа и средневзвешенная молекулярная масса (Mw) составляет 50-70 кДа. 3. Хондроитинсульфат акульего типа по п.1 или 2, где сумма 2,6-дисульфата и 4,6-дисульфата составляет 10-25% от общего содержания дисахаридов. 4. Применение хондроитинсульфата акульего типа по любому из пп.1-3 для профилактики или лечения остеоартрита или для поддержания здорового состояния скелетно-мышечной системы. 5. Композиция для профилактики или лечения остеоартрита или для поддержания здорового состояния скелетно-мышечной системы, содержащая хондроитинсульфат акульего типа по любому из пп.1-3 и фармацевтически или нутрицевтически приемлемый носитель. 6. Применение композиции по предшествующему пункту для профилактики или лечения остеоартрита или для поддержания здорового состояния скелетно-мышечной системы. 7. Способ получения хондроитинсульфата акульего типа по любому из пп.1-3, включающий: а) высаливание несульфатированного хондроитина в виде свободной кислоты, предварительно растворенного в водной среде, солью, выбранной из группы, состоящей из солей тетраметил-, тетраэтил- и тетрабутиламмония или солей тетраметил-, тетраэтил- и тетрабутилпиридиния;b) сушку высаливаемого несульфатированного хондроитина в виде свободной кислоты и/или натриевой соли, получаемой на стадии а) до содержания воды 5-15%;c) сушку высаливаемого несульфатированного хондроитина, получаемого на стадии b), при температуре 100-170C до содержания воды 0,1-3%;d) избирательное сульфатирование 6 положения высаливаемого несульфатированного хондроитина,получаемого на стадии с), растворенного в N-метилпирролидоне или диметилформамиде при температуре 0-30C, добавлением 1-2 экв. комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы, с последующим добавлением с интервалами времени 1-3 ч комплекса пиридина с триоксидом серы или комплекса диметилформамида с триоксидом серы до полных 2-15 экв.; оставление получаемого раствора при перемешивании в течение 2-24 ч;e) гашение реакции, проводимой на стадии d), водным бикарбонатом натрия или карбонатным раствором, фильтрование и выпаривание досуха получаемого раствора с получением сухого твердого вещества;f) растворение сухого твердого вещества в водном растворе хлорида натрия, ультрафильтрацию и диализ получаемого раствора;g) выделение продукта из раствора, получаемого на стадии f);h) очистку продукта, получаемого на стадии g), и получение последнего в форме кислоты или в виде его натриевой соли;i) выделение продукта, получаемого на стадии h). 8. Способ по п.7, где высаливание несульфатированного хондроитина на стадии а) проводят солью,выбранной из группы, состоящей из солей тетраметил-, тетраэтил- и тетрабутиламмония. 9. Способ по п.7 или 8, где высаливание несульфатированного хондроитина на стадии а) проводят солью тетрабутиламмония. 10. Способ по любому из пп.7-9, где сушку несульфатированного хондроитина на стадии b) проводят лиофилизацией или сушкой распылением. 11. Способ по любому из пп.7-10, где сушку соли несульфатированного хондроитина на стадии с) проводят до содержания воды 0,5-2%. 12. Способ по любому из пп.7-11, где солюбилизацию соли несульфатированного хондроитина, получаемой на стадии с), проводят в диметилформамиде. 13. Способ по любому из пп.7-12, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 6-12 экв. комплекса пиридина с триоксидом серы. 14. Способ по любому из пп.7-13, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 6-9 экв. комплекса пиридина с триоксидом серы. 15. Способ по любому из пп.7-12, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 1-9 экв. комплекса диметилформамида с триоксидом серы. 16. Способ по п.15, где избирательное сульфатирование на стадии d) проводят добавлением общего количества 2-4 экв. комплекса диметилформамида с триоксидом серы. 17. Способ по любому из пп.7-16, где сульфатирование на стадии d) проводят при температуре 1020C. 18. Способ по любому из пп.7-17, где в конце стадии d) получаемый раствор оставляют при перемешивании в течение 2-6 ч. 19. Способ по любому из пп.7-18, где на стадии g) продукт выделяют лиофилизацией, сушкой распылением или осаждением в спиртовой среде. 20. Способ лечения или профилактики остеоартрита или поддержания здорового состояния скелетно-мышечной системы, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества хондроитинсульфата по любому из пп.1-3 или композиции по п.5.
МПК / Метки
МПК: A61K 31/737, C08B 37/00
Метки: типа, акульего, получения, способ, хондроитинсульфат
Код ссылки
<a href="https://eas.patents.su/12-23370-hondroitinsulfat-akulego-tipa-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Хондроитинсульфат акульего типа и способ его получения</a>