Стабильная частица в жидких композициях
Формула / Реферат
1. Стабильная частица в жидкой композиции, содержащая дисперсную фазу микрочастиц, суспендированных в однородной фазе, которая представляет собой неводную жидкость, в которой микрочастицы нерастворимы, где микрочастицы включают тонкоизмельченное порошкообразное сахарное "стекло", содержащее, по крайней мере, один биомолекулярный продукт, указанный биомолекулярный продукт в сахарном "стекле" либо находится в стабильном твердом растворе, либо сам по себе в суспензии в сахарном "стекле", и где однородная фаза включает липидрастворимое поверхностно-активное вещество с низким или очень низким гидрофильно-липофильным балансом.
2. Композиция по п.1, отличающаяся тем, что сахарное "стекло" формируется из одного или более cахаров, выбранных из группы, состоящей из трeгалозы, палатинита, глюкопиранозил сорбита, глюкопиранозил маннита, лактитола, и моносахаридных спиртов, таких как маннит и инозит.
3. Композиция по п.1, отличающаяся тем, что неводная однородная жидкая фаза является биосовместимой.
4. Композиция по п.1, отличающаяся тем, что неводная однородная фаза представляет собой гидрофобный растворитель.
5. Композиция по п.1, отличающаяся тем, что неводная жидкая однородная фаза является водорастворимой.
6. Композиция по любому из пп.1-5, отличающаяся тем, что микрочастицы сахарного "стекла" составляют в диаметре от приблизительно 0,1 до приблизительно 10 мкм, предпочтительно менее 10 мкм, например 1 или 2, или 5 мкм, наиболее предпочтительно меньше чем 1 мкм.
7. Композиция по п.6, отличающаяся тем, что микрочастицы не проявляют большого разброса в размере частиц.
8. Композиция по любому из пп.1-7, отличающаяся тем, что микрочастицы являются по существу сухими, имеющими очень низкое содержание воды - менее чем приблизительно 1%.
9. Композиция по любому из пп.1-8, отличающаяся тем, что биомолекулярный продукт представляет собой лекарственное средство или другой биологически активный ингредиент, такой как белок, антитело, фермент (например, рестриктаза) и подобное, включая биологические материалы, такие как пищевые продукты, красящие вещества, напитки и подобное.
10. Композиция по любому из пп.1-9, отличающаяся тем, что микрочастицы составляют монодисперсную суспензию в однородной фазе.
11. Композиция по любому из пп.1-10, отличающаяся тем, что содержит от приблизительно 1% до более чем 50%, например приблизительно 10% по весу микрочастиц в дисперсной фазе.
12. Композиция по п.1, отличающаяся тем, что количество поверхностно-активного вещества в однородной фазе составляет от приблизительно 0,01% до приблизительно 10%, например 1% по объему.
13. Композиция по п.1 или 12, отличающаяся тем, что содержит одно или более поверхностно-активных веществ, выбранных из группы, состоящей из сорбитана полуторного олеата, маннида моноолеата, сорбитана тристеарата, и моностеарат глицерина, лецитина (фосфатидилхолина), дипальмитоилфосфатидилхолина, дистеароилфосфатидилхолина, димиристоилфосфатидилхолина, и лаурата, пальмитата, стеарата и олеата сорбитана.
14. Композиция по п.1, отличающаяся тем, что однородная неводная жидкая фаза включает или состоит из одного или более гидрофобных нетоксичных растворителей, выбранных из группы, состоящей из кунжутного масла, арахисового масла, соевого масла, этилолеата и минерального масла.
15. Композиция по п.1, отличающаяся тем, что неводная однородная жидкая фаза содержит или состоит из смешивающегося с водой неводного растворителя, выбранного из группы, состоящей из полиэтиленгликоля, глицерина, этиленгликоля, пропиленгликоля, оксида пропилена, полипропиленгликоля.
16. Способ производства стабильной частицы в жидкой композиции, который включает стадии получения микрочастиц, содержащих один или более биомолекулярных продуктов, содержащихся в сахарном "стекле", и добавления микрочастиц к неводной однородной жидкой фазе, в которой частицы не растворяются, для образования суспензии, причем указанный биомолекулярный продукт в сахарном "стекле" либо находится в стабильном твердом растворе, либо сам по себе в суспензии в сахарном "стекле", и где монодисперсную с одним типом частиц суспензию микрочастиц получают в неводной однородной жидкой фазе посредством включения в однородную фазу, по меньшей мере, одного поверхностно-активного вещества, характеризующегося низким или очень низким гидрофильно-липофильным балансом.
17. Способ по п.16, отличающийся тем, что поверхностно-активное вещество добавляют к однородной неводной жидкой фазе перед добавлением частиц.
18. Композиция по п.1, отличающаяся тем, что представляет собой бинарную лекарственную композицию, где биомолекулярный продукт является предшественником лекарства и где конечный активный лекарственный компонент синтезируют или высвобождают посредством химической реакции, которая начинается только тогда, когда, после введения композиции пациенту, жидкости организма смачивают предшественник.
19. Композиция по п.1, отличающаяся тем, что содержит микрочастицы, содержащие больше чем один биомолекулярный продукт.
20. Композиция по п.1 или 19, отличающаяся тем, что содержит смеси микрочастиц, которые высвобождают более чем один тип биомолекулярного продукта, когда контактируют с водным окружением.
21. Композиция по п.19 или 20, отличающаяся тем, что два или более биомолекулярных продукта взаимодействуют при высвобождении в водном окружении.
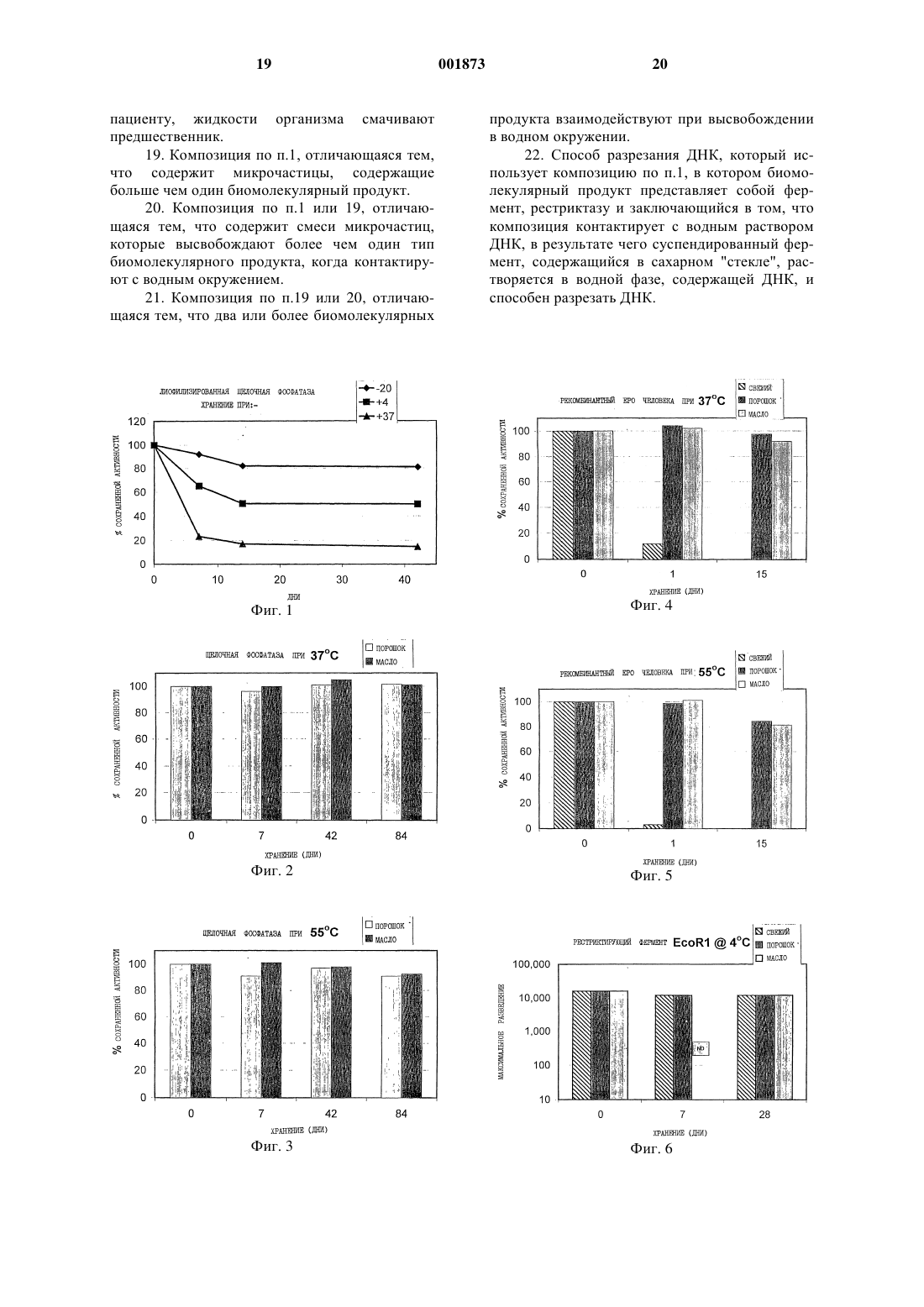
22. Способ разрезания ДНК, который использует композицию по п.1, в котором биомолекулярный продукт представляет собой фермент, рестриктазу и заключающийся в том, что композиция контактирует с водным раствором ДНК, в результате чего суспендированный фермент, содержащийся в сахарном "стекле", растворяется в водной фазе, содержащей ДНК, и способен разрезать ДНК.
Текст
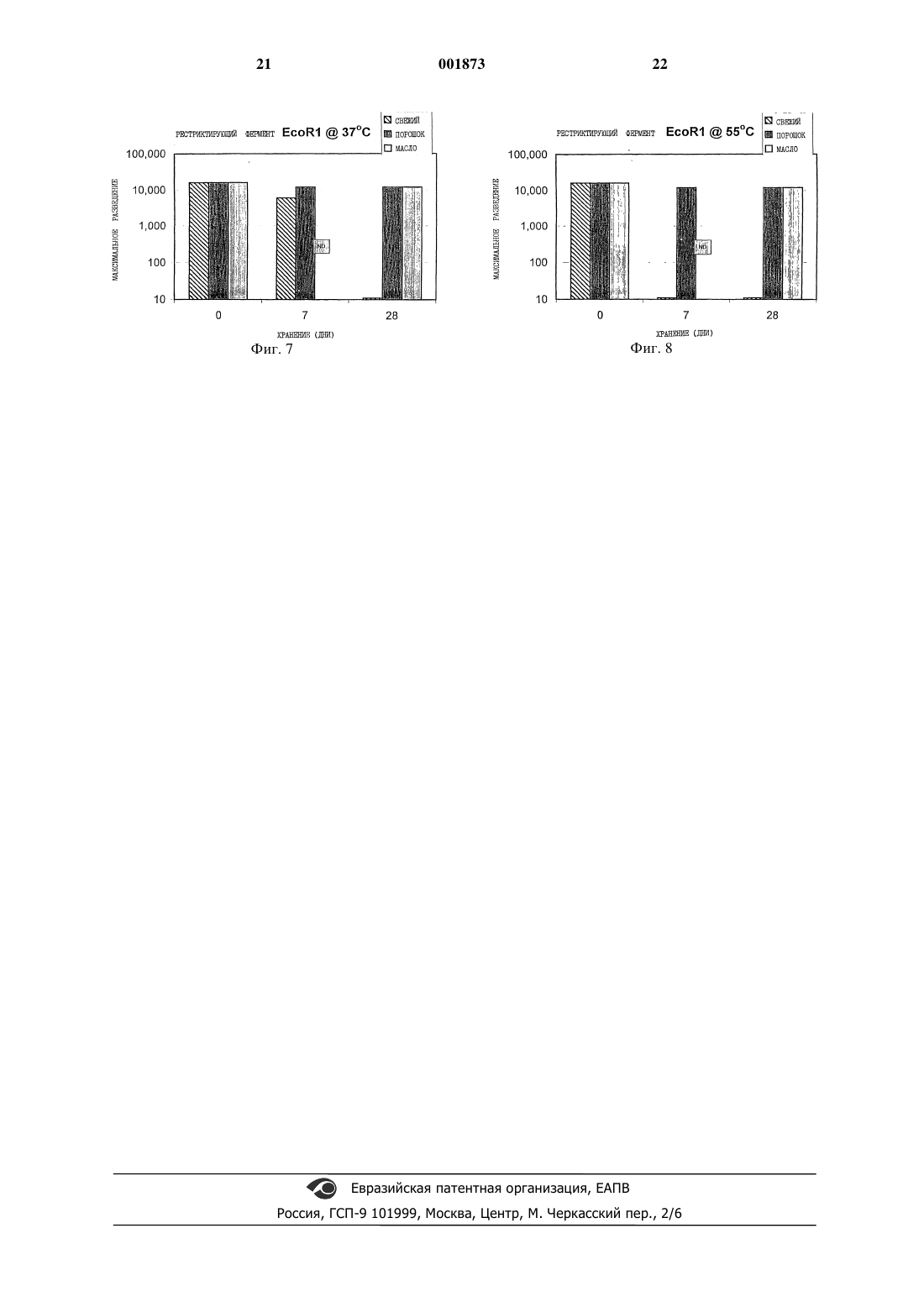
1 Все живые организмы нуждаются в воде. Действительно, в большой степени многие живые существа представляют собой воду. Одна из немногих объединяющих основ в биологии заключается в том, что вода составляет около 75% веса организма. Еще замечательно то, что существуют живые существа, которые могут выживать в высушенном состоянии после потери всей их воды. Эту способность, называемую ангидробиозом ("жизнь без воды"), обнаруживают у представителей всех биологических классов, включая бактерии, грибы, животных и растения, и она эволюционирует уже, по крайней мере, два биллиона лет. Такие ангидробиозные организмы способны высушиваться полностью и создавать видимость умирания, но они не умирают; они выживают, инертные и безжизненные в течение неопределенных периодов времени, находясь в состоянии отложенного оживления до тех пор, пока возвращаются к жизни в присутствии воды. Все эти живые существа решили для себя проблему, как сохранить биологические молекулы без охлаждения и замораживания. Четко установленная особенность, которая является общей для ангидробиозных организмов и которая, вероятно, является решающей в их толерантности к высушиванию, заключается в их способности вырабатывать большое количество простого сахара. Наиболее эффективным сахаром является трегалоза (-D-глюкопиранозил -D-глюкопиранозид), но ангидробиозное растение Craterostigma plantagineum аккумулирует, например, скорее сахарозу, чем трегалозу. Ясно, что внутриклеточные и внеклеточные сахара необходимы для жизнеспособности высушенных клеток или организмов. Факт,что одной трегалозы может быть достаточно при ангидробиозе, подтвержден в работе, в которой искусственно вводят дисахариды в живые клетки, что позволяет высушивать их и успешно повторно гидратировать. Стабилизирующая способность трегалозы проистекает из сочетания некоторых ее свойств. Подобно многим другим сахарам она может замещать структурную воду посредством связывания водорода с молекулярными поверхностями. Трегалоза инертна и не взаимодействует с другими молекулами в высушенном состоянии. Некоторые другие аналоги также стабильны и инертны, но большинство сахаров взаимодействует с аминогруппами (так называемая реакция Мейлларда (Maillard при температурах выше замерзания и разрушения продукта. Когда молекулы высушивают из раствора сахара, используя соответствующий способ, формируется "стекло" (glass), в котором молекулы оказываются закрепленными, минимизируя молекулярную диффузию и любую ассоциированную деградацию. 2 При высушивании многие растворы cахаров ведут себя в соответствии с одним из двух совершенно различных способов. Наиболее простое поведение представляет собой кристаллизацию сахара. Когда это происходит, молекулы в растворе сахара оказываются незащищенными, так как они исключены из кристаллов. При альтернативном поведении раствор прогрессивно становится более концентрированным до тех пор, пока он не станет таким вязким,что он образует твердое "стекло" при комнатной температуре. Когда это имеет место, биомолекулярный продукт претерпевает плавное изменение от существования в жидком растворе до начала нахождения в твердом растворе в "стекле" в конце. В этом состоянии молекулы продукта могут быть визуализированы как внедренные и прочно иммобилизованные в "стеклянном" матриксе. Вышеописанное является аналогом древних насекомых, которых обнаруживают заключенными в ископаемом янтаре в безупречной сохранности. Поскольку сахарное "стекло" растворимо в воде, процесс легко обратим в воде, а продукт плавно возвращается в свое нативное состояние в жидком растворе. Эти плавные превращения обеспечивают то, что во время высушивания не происходит повреждения продукта. Когда речь идет о продукте, превращение от жидкого раствора до твердого раствора оказывается незначительным. Так как "стекла" из больших сахаров инертны и имеют высокую точку плавления,когда высыхают, продукт оказывается защищенным при хранении, даже при неблагоприятных условиях. Парентерально вводимые лекарственные средства впрыскивают обычно с помощью полых металлических игл в виде раствора в воде,содержащего буферные соли. Инъекции производят внутрикожно, подкожно, внутримышечно или внутривенно. Более редко применяют другие способы, такие как внутриоболочечный или внутриглазной. Лекарственные средства вводят традиционным способом в течение более 100 лет и, несмотря на страх, боль и риск инфекций,связанных с инъекциями, в настоящее время не существует никаких существенных общепринятых усовершенствований этого способа. Жидкостный безыгольный инъектор, который выбрасывает очень тонкую струю жидкости непосредственно через кожу под очень высоким давлением, способствует достижению некоторого успеха в программах вакцинации, однако ранние модели являются ненадежными. Более современные разработки, такие как Медиджект(Mediject) и Биоджект (Bioject) устройства, находят важную нишу применения, их используют при диабете и в других случаях. Однако основные недостатки данной технологии присущи как шприцам и иглам, так и безыгольным инъекторным устройствам. Большинство лекарственных средств для парентерального введения неста 3 бильны в водном растворе и их производят и хранят в виде более стабильного лиофилизированного брикета или в виде порошка, которые требуют восстановления водой или буфером непосредственно перед инъекцией. Эта особая стадия требует обучения техническим приемам и увеличивает риск неточного распределения растворителя и поэтому дозировки, или риск проведения инъекции нестерильной техникой. Лекарственные средства, которые хранят в виде раствора или суспензии (такие как инсулин),требуют искусственного охлаждения для предупреждения деградации и имеют ограниченный срок годности. Восстановление сухого лекарственного средства следует проводить правильно и точно,чтобы обеспечить точную дозировку, а любые ошибки на этой стадии оказываются опасными и в случае сильнодействующих лекарственных средств могут быть даже смертельными. Часто необходимо назначать более одного лекарственного средства за один прием. При этом возникает необходимость многочисленных болезненных инъекций, так как определенные лекарственные средства нельзя смешивать в одном шприце из-за химической несовместимости между молекулами в растворе, что приводит к потере эффективности или даже образованию токсических продуктов реакции. В соответствии с этими проблемами, которые давно являются предметом исследований специалистов по лекарственным композициям,оптимальный раствор представляет собой стабильную жидкую композицию, которая не нуждается в реконструировании растворителем перед инъекцией. Хотя достигнуты некоторые незначительные улучшения стабильности водных растворов, они не обеспечивают все еще высоких уровней стабильности лекарственных средств, которые получают с современными сухими композициями, использующими трегалозу или подобные стабилизирующие наполнители. Однако, хотя эти последние композиции чрезвычайно стабильны даже при очень неблагоприятных окружающих условиях, они еще требуют реконструирования перед инъекцией. Они также стабильны только пока они очень сухие. Повышение влажности, даже в небольшой степени, делает эти сухие композиции нестабильными при хранении. Их обычно сохраняют в виде двухфазных систем, в которых лекарственное средство находится в дисперсной твердой фазе, а однородная жидкая фаза в сухом воздухе, часто при пониженном давлении, или в атмосфере сухого азота в закупоренной стеклянной ампуле. Из двух основных проблем с существующими вакцинами для безыгольного впрыскивания, нестабильности при хранении и необходимости реконструировать высушенные вакцины,первую в настоящее время разрешают с помощью способа высушивания, запатентованногоQuadrant Holdings Cambridge Ltd., используя простой сахар трегалозу. Высушенные с трегалозой вакцины хранят при температуре окружающей среды, по крайней мере, 45 С, без заметного разрушения. Наиболее знаменательно,что даже адъювантные гели гидроксида алюминия стабилизируют трегалозой во время высушивания и хранения и восстанавливают их полный гидратированный объем и функцию без агрегации или выпадения осадка. Хотя проблему нестабильности относят к этому способу высушивания, ранее описанные высушенные с трегалозой вакцины существовали в форме твердой стекловидной пены и требовали реконструирования (например, стерильной водой или раствором буфера) перед инъекцией по общепринятой технологии иглы и шприца. Сухие вакцины могут быть приготовлены в порошкообразной форме и могут доставляться через кожу с использованием гиперзвуковых шоковых волн газа. Из-за ограничений скорости газа и, как следствие, проникающей силы, существуют некоторые сомнения, можно ли с помощью этих средств осуществлять глубокие внутримышечные инъекции. Более пригодную композицию готовят с использованием стабильной жидкости, которая, однако, не требует транспорта определенных буферных растворов или реконструирования на месте, которая все же характеризуется чрезвычайной стабильностью высушенного с трегалозой препарата. Такую вакцину можно приготовить в контейнерах многоразовых доз и при проведении кампаний массовой иммунизации удобно доставлять посредством стандартных безыгольных инъекторов. В данном случае описывается усовершенствование, применяющее тонкоизмельченные порошки и неводные носители, в которых порошки могут быть равномерно распределены в виде стабильной монодисперсной суспензии. На основании феномена ангидробиоза удалось изобрести и утвердить условия приготовления, которые гарантируют образование стабильных "стекол", полностью имитирующих ангидробиозный феномен. Их можно использовать для стабилизации и предохранения большинства типов молекул и биологических систем, включающих многочисленные вакцины,без необходимости лиофилизации или замораживания. Предлагается способ, который может быть применен даже для приготовления большинства нестабильных лекарственных средств в виде жидкой композиции, которые оказываются такими же стабильными, как самые лучшие высушенные с трегалозой композиции, но характеризуются безопасностью и удобством готовых к применению жидких композиций. Лекарственное средство может быть высушено до состояния тонкоизмельченного порошка при условиях, которые обеспечивают его оптимальную стабилизацию в трегалозе или 5 другом стабилизирующем наполнителе в "стеклянном" состоянии. Другие сахара, которые спонтанно образуют хорошо стабилизирующие"стекла", являются палатинитами (смесь глюкопиранозил сорбита и глюкопиранозил маннита,полученных восстановлением палатинозы (изомальтулозы) водородом и с Raney-никелевым катализатором: производство Sudzucker AG в Германии). Чистые изомеры глюкопиранозил сорбита и глюкопиранозил маннита также оказываются хорошими, как и лактит (восстановленный продукт лактозы или молочного сахара).Sen S.). Также удалось обнаружить, что целый класс моносахаридных спиртов, представленных в предыдущем уровне техники как бесполезные в качестве формирующих "стекло" наполнителей, в действительности образуют прекрасные стабильные композиции, если приготовлены правильно. Они включают маннит и инозит. Образование сухих "стеклянных" порошков, содержащих стабилизированные активные агенты, может быть достигнуто применением любого приемлемого сахара или производного сахара из этой группы. Это достигается непосредственно с помощью сушки распылением или посредством некоторых других способов сушки, включающих стандартные способы, подобные сушке в вакууме или сублимационной сушке, с последующей стадией измельчения,такой как струйное измельчение, чтобы придать высушенной композиции форму тонкоизмельченного порошка. Этот тонкоизмельченный порошок сахарного "стекла" (дисперсная фаза),содержащий лекарственное средство в стабильном твердом растворе в "стекле", затем готовят как суспензию в двухфазной системе, содержащей в качестве однородной фазы, биосовместимую неводную жидкость, в которой сахар не растворяется. Исключение воды из этой системы сохраняет стабилизирующее действие трегалозы или других используемых стабилизирующих наполнителей. Ранее сообщалось, что высушенные с трегалозой активные ингредиенты 6 остаются стабильными в течение нескольких дней в неводных жидкостях, в которых сама трегалоза нерастворима. Gribbon E.M., Sen S.,Roser B.J. and Kampinga J. Stabilisation of Vaccines Using Trehalose (Q-T4) Tehnology. In F.Vaccine Potency Dev Biol Stand Kargen Basel 87 193-199 (1996). При условии, что неводные наполнители являются стабильными, и при условии, что препарат не абсорбирует значительное количество воды, оказалось возможным, что такие композиции являются неограниченно стабильными как материал, высушенный с трегалозой. В то время как эксперименты, в которых используют неводные лабораторные растворители, подобные ацетону или дихлорметану, устанавливают принцип стабильности активных молекул в суспендированных микросферах сахарного "стекла", такие препараты, конечно,оказываются непригодными для инъекций из-за токсичности наполнителя. Однако существуют различные неводные наполнители, которые одобрены действующими специалистами для парентерального введения и которые демонстрируют безопасность и пригодность. Жидкая фаза представляет собой любой приемлемый для инъекции гидрофобный растворитель, такой как инъецируемые кунжутное, арахисовое или соевое масла, этилолеат или смешивающийся с водой неводный растворитель, подобный полиэтиленгликолю. Поскольку большинство приемлемых неводных жидкостей сами по себе являются очень стабильными при комнатной или повышенной температуре и не требуют замораживания, то получающийся в результате двухфазный препарат является заведомо стабильным. Однако тонкоизмельченные частицы сахарного "стекла" характеризуются склонностью образовывать конгломераты во многих неводных жидкостях из-за разделения фаз. Поскольку сахарное "стекло" характеризуется высокой гидрофильностью, частицы проявляют устойчивую тенденцию оказываться исключенными из однородной гидрофобной фазы и объединяются вместе в конгломераты. Эти агрегаты выпадают в осадок из суспензии и при встряхивании или воздействии ультразвуком не восстанавливаются быстро до монодисперсной суспензии. Это приводит к неоднородности дозировки лекарства в суспензии и, в наихудших случаях, композиция оказывается непригодной для инъекции вследствие наличия больших конгломератов,которые закупоривают иглы. Хотя идеальная суспензия является безводной или близкой к такой, удалось обнаружить, что посредством неожиданно простых способов, почерпнутых из области стабилизации (WIO) эмульсий "вода в масле", получают однородную монодисперсную одночастичную суспензию микросфер в неводной жидкости. 7 Хотя водный компонент этих систем очень низкий (1%), поверхностно-активные вещества, которые обычно используют для стабилизации (WIO) эмульсий "вода в масле", оказывают драматическое действие при концентрации приблизительно 0,01% до 10%, предпочтительно приблизительно 1%. Они уменьшают агрегаты частиц "стекла" до однородной монодисперсной суспензии, которая по существу не проявляет тенденции к повторному объединению в конгломераты. Эти поверхностно-активные вещества, которые имеют или низкий, или очень низкий гидрофильно-липофильный баланс (HLB,ГЛБ), сами не растворяются в воде, но являются липид-растворимыми. Поверхностно-активные вещества с низким HLB, такие как сорбитан полуторный олеат (Арлацел С, HLB = 3,7), маннид моноолеат (Арлацел А, HLB = 4,3), сорбитан тристеарат (Спан 65, HLB =2,1) и моностеарат глицерина (Арлацел 129, HLB = 3,2) характеризуются очень низкой токсичностью (при пероральном введении величина LD50 для крыс 15 г/кг), и уже применяются клинически в виде(WIO) эмульсий "вода в масле", таких как адъювант Фрейнда для инъекции, и специалисты санкционируют их применение для этих целей. Предпочтительно, поверхностно-активные вещества добавляют к однородной неводной жидкой фазе перед добавлением порошкообразных частиц. Арлацел А является существенным компонентом так называемого "адъюванта Фрейнда",который широко применяют при иммунизации животных для получения максимальных титров сывороточных антител. (Ссылка: Handbook ofVol 1, p 8.10 (1996. Адъювант Фрейнда в основе представляет собой чистую водно-масляную эмульсию, в которой растворяют антиген в дисперсной водной фазе, тогда как однородная фаза жидкого вазелинового масла действует как резервуар, из которого медленно освобождается антиген. Полный адъювант Фрейнда также содержит убитые при нагревании микробактерии туберкулеза, которые вызывают сильное воспаление, увеличивающее восприимчивость иммунной системы. Это является помехой его использования для людей. Основное различие между рафинированной эмульсией "вода в масле", подобной адъюванту Фрейнда, и монодисперсным "стеклом" в масляных суспензиях, описываемых в заявке,заключается в относительно низкой энергии дисперсии, необходимой для получения последней. Тогда как рассеивание водной фазы в виде мелких капель в WIO эмульсии требует продолжительного и энергичного смешивания (высокоскоростной гомогенизатор используют для получения адъюванта Фрейнда, и он обычно вращается в течение 15 до 30 мин при высшей скорости 18000 оборотов в минуту до получе 001873 8 ния стабильной эмульсии), стабильные суспензии, описываемые в заявке, требуют только добавления тонкоизмельченного порошкообразного лекарственного средства к основе масло/поверхностно-активное вещество и энергичного встряхивания для смешивания фаз. Применяют краткую, 5 мин, экспозицию в ультразвуковой ванне для обеспечения разбивания любых небольших конгломератов, которые образуются перед или во время добавления к гидрофобной фазе. При условии, что мелкие микросферы сахарного "стекла" совершенно нерастворимы в гидрофобном растворителе, они оказываются стабильными в "стеклянной" фазе без тенденции к перекристаллизации, и стабилизированные молекулы в твердом растворе в "стеклянных" сферах также стабильны. Существенным недостатком порошков,получаемых посредством общепринятой технологии сушки распылением, является большой разброс в размере обычно получаемых частиц. Кроме того, при использовании обычной распылительной сушилки возникают большие затруднения при получении частиц со средним диаметром значительно меньшим, чем 5-10 мкм. Частицы этого размера быстро выпадают в осадок в жидкостях с низкой вязкостью. Это приводит к большим отклонениям в распределении дозировки в ампуле и требует частого и энергичного встряхивания для повторного суспендирования частиц. Частицы сахарного "стекла" диаметром приблизительно от 0,1 до 1 мкм оказываются лучше, так как они сохраняются в однородной суспензии посредством нормальных термодинамических сил, таких как Броуновское движение. В то время как стандартные фармацевтические способы производства, такие как струйное измельчение, уменьшают размер частиц порошков до среднего диаметра приблизительно от 1 до 2 мкм, обычно невозможно получить частицы меньше этих. Дополнительная стадия, такая как струйное измельчение,конечно, увеличивает стоимость производства. При использовании ультразвуковых распылителей вместо общепринятых насадок возможно видоизменение оборудования сушки распылением, чтобы получить небольшие очень одинаковые микросферы. Кажется, что нет никаких причин, почему этот способ не применяют для стерильного производства стабилизированных вакцин в больших количествах. Недостатком уменьшения размера частиц до субмикронных величин в воздухе или однородной фазе некоторого количества другого газа, является потеря материала, часто узнаваемая по опыту,из-за трудности разделения тонкоизмельченных частиц в потоке газа. Альтернативно, стандартное фармацевтическое микрогомогенизирующее под высоким давлением оборудование, такое как микрофлюиризатор (Constant Systems Inc),которое широко используют для получения сте 9 рильных, стабильных микроэмульсий, также является эффективным при производстве стабильных микросуспензий посредством уменьшения среднего размера частиц, суспендированных в однородной жидкой фазе. Этот способ фактически обеспечивает полное восстановление материала и, вероятно, является способом выбора, в частности, в отношении редких и дорогостоящих активных агентов. Единственную стадию, такую как эта, без значительных затрат включают в способ производства, когда стоимость производства составляет около 1000 за килограмм порошка. Такое производство обеспечивает около 20000 доз стандартной детской вакцины, такой как ДРТ (вакцина против дифтерии, коклюша и столбняка), добавляя по 5 центов к стоимости каждой дозы. Поскольку потери существующих нестабильных вакцин составляют от 50 до 90% в пределах уровня стоимости охлаждающей системы (замораживания) на месте, дополнительную стоимость стабильных жидких вакцин, которые могут быть уничтожены в охладительной системе, быстро компенсируют. Краткое изложение изобретения Данное изобретение обеспечивает способ производства стабильной частицы в жидких композициях вместе с продуктами производства. Частицы представляют собой тонкоизмельченную порошкообразную форму, предпочтительно микрочастицы с диаметром 10 микрон и меньше, наиболее предпочтительно 1 микрон или меньше. Предпочтительно - в размере частиц нет большого разброса. Частицы - по существу сухие, характеризующиеся очень низким содержанием воды, приблизительно менее 1%. Частицы могут содержать один или более биомолекулярных продуктов и могут включать другие добавки, наполнители и подобное. Биомолекулярный продукт, предпочтительно представляет собой лекарственное средство или другой биологически активный ингредиент, такой как белок, антитело, фермент (например, рестриктаза) и подобное, но не исключает другие биологические материалы (например, пищевые продукты, красящие вещества, напитки и подобные). Частицы суспендируют в неводную жидкость, в которой они нерастворимы. В соответствии с изобретением обеспечивают композицию тонкоизмельченных сухих порошкообразных частиц, которые содержат биомолекулярный продукт, частиц, составляющих монодисперсную суспензию в однородной фазе биосовместимой неводной жидкости, в которой частицы не растворяются, где однородная фаза включает липидрастворимое поверхностно-активное вещество с низким HLB (гидрофильным липофильным балансом). Суспензионная композиция, например,может содержать от приблизительно 1% до более чем 50%, например 10%, корпускулярного продукта, хотя содержание предпочтительно 10 больше или меньше зависит от выбора применения и выбора ингредиентов смеси. Частицы содержат или состоят из молекул продукта в сахарном "стекле". Продукт в сахарном "стекле" находится или в стабильном твердом растворе, или сам по себе в суспензии в сахарном "стекле". Предпочтительно сахарное"стекло" формируют из трегалозы. В этой заявке под термином "сахар" следует понимать включение не только дисахаридных сахаров, таких как трегалоза, но также моносахаридных сахаров и их нередуцирующих производных, таких как сахароспирты, включающие маннит, инозит, ксилит, рибит и подобные, которые составляют основной класс стабилизирующих образующих "стекло" сахаров и производных сахаров. Под термином "сахарное стекло" понимают покрытие не только "стеклами",которые быстро и легко растворяются в водном окружении, такие как трегалозное "стекло", но также сахарными "стеклами", в которых молекулу сахара модифицируют посредством присоединения одной или больше гидрофобных боковых цепей, чтобы сделать "стекло" более медленно растворимым в жидкостях организма,чем нативный сахар, для обеспечения регулируемого высвобождения биомолекулярного продукта. Когда композицию предназначают для медицинского применения, например, в качестве композиции для инъекции, неводная однородная фаза жидкости является биосовместимой. Жидкая фаза представляет собой приемлемый для инъекций гидрофобный растворитель или смешивающийся с водой неводный растворитель. Поскольку применяют стабилизацию биомолекулярного продукта сахарным "стеклом",ясно, что неводная жидкость не должна являться растворителем для сахара. Например, любое неводное нетоксичное масло, разрешенное для парентерального применения, может быть задействовано в изобретении. Масло с низкой вязкостью, такое как этилолеат, оказывается приемлемым и имеет преимущество, так как его легко вводить. Смешиваемые с водой неводные растворители включают глицерин, этиленгликоль, пропиленгликоль, оксид пропилена, полипропиленгликоль. Липидрастворимое поверхностно-активное вещество характеризуется низким или очень низким HLB. Специалисты в данной области легко поймут значение этих общих терминов, в частности, в контексте значений HLB, представленных в разделе описания, относящемся к предпочтительным примерам поверхностноактивных веществ с низким HLB. Особенно неожиданным аспектом данного изобретения является то, что любое поверхностно-активное вещество, которое, главным образом, разрабатывается коммерческим производителем для стабилизации эмульсий вода в масле, проявляет 11 любую активность и любую полезность в приготовлении особых безводных препаратов. Поверхностно-активные вещества включают сорбитан полуторный олеат, маннид моноолеат,сорбитан тристеарат и моностеарат глицерин,плюс лецитин (фосфатидилхолин), а также дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин и димиристоилфосфатидилхолин,как примеры нормальных компонентов организма с активностью поверхностно-активного вещества, которую успешно используют в этом способе. Также синтетические и уже одобренные поверхностно-активные вещества, такие как лаурат, пальмитат, стеарат и олеат сорбитана. В соответствии с изобретением возможно получение стабильной частицы в жидких композициях, в которых тонкоизмельченный сухой порошок равномерно распределяется в виде стабильной монодисперсной суспензии. Специалисты в данной области без труда поймут,что такие монодисперсные суспензии могут быть инъецированы непосредственно либо шприцем и иглой, либо жидкостным безыгольным инъектором. Композиции могут быть введены как таковые, без требующегося реконструирования растворителем перед инъекцией. Это определенно является преимуществом, когда проблематично обеспечение стерильных условий и стерильных реконструирующих растворителей и/или буферов. Частицы в жидких композициях стабильны и, следовательно, нет необходимости в замораживании. Твердые растворы безводного лекарственного средства, стабилизированного в сахарном"стекле" в форме тонкоизмельченных частиц,быстро гидратируемы. Особым еще одним преимуществом данного изобретения является то,что биосовместимые композиции могут быть введены непосредственно реципиенту с эффектом, заключающемся в том, что нормальное физиологическое водное окружение гидратирует лекарственное средство на месте. Можно легко понять, что стабильная нечувствительная к температурным изменениям непосредственно инъецируемая лекарственная композиция имеет огромный потенциал для программ вакцинации и для широко распространенного профилактического и терапевтического применения лекарственного средства. Композиции изобретения могут быть также использованы в диагностических тестах и в качестве реагентов, если неводная жидкость является водорастворимой или смешивающейся с водой. Жидкостный дозатор может в этом случае содержать нестабильные диагностические реагенты без охлаждения и распределяет их в тест-системы, которые являются водными,такие как иммуноанализ, диагностические тесты с ДНК-зондом, PCR (ПЦР, полимеразная цепная реакция) и подобные. При контакте с водой в диагностической системе тонкоизмельченный порошкообразный диагностический реагент в 12 неводном носителе немедленно растворяется, и реагент становится полностью активным. В качестве примера этот способ может быть применен для рестриктаз, используемых для расщепления ДНК в специфических участках последовательности. Отдельный препарат однородной фазы может содержать частицы более, чем одного типа, которые быстро взаимодействуют друг с другом, когда они высвобождаются в воде. В представленном примере щелочная фосфотаза находится в одном типе частиц, а п-нитропиенил фосфат (ее субстрат) - в другом. Они являются как раз теми двумя пролекарственными компонентами, которые необходимо ввести во взаимодействие, чтобы получить активное лекарственное средство из двух пролекарств. Подобный препарат может содержать несколько разных частиц, таких как индивидуальные компоненты поливалентной вакцины. Они не подвергаются деструктивному взаимодействию в масле и у них нет времени для взаимодействия,когда они повторно гидратируют в организме,так как они абсорбируются в точке инъекции и транспортируются в участок их действия. В примере с рестриктазой могут быть использованы многочисленные реагенты в отдельных частицах для сложных молекулярнобиологических методик, такие как компоненты полимеразной цепной реакции (PCR) или реакций секвенирования. В первой - одна частица содержит ДНК-полимеразу, другая содержит один праймер и третья содержит другой праймер, а четвертая содержит нуклеотиды. В реакции секвенирования ДНК-полимераза находится в одном типе частиц, а нуклеотиды и терминирующие дидезоксицепь нуклеотиды в другом. Ясно, что возможность смешивать различные реагенты в невзаимодействующих частицах в масле открывает большие возможности для создания мощных и удобных наборов. Краткое описание чертежей Фиг. 1 демонстрирует зависимость активности лиофилизированной щелочной фосфотазы от времени хранения при 37, 4 и -20 С; фиг. 2 и 3 представляют активность стабилизированной трегалозой щелочной фосфотазы в композициях в форме сухого порошка или масляной суспензии при 37 и 55 С; фиг. 4 и 5 представляют активность рекомбинантного ЕРО (эритропоэтина) в композициях в форме лиофилизированного препарата, в форме стабилизированного трегалозой сухого порошка или масляной суспензии при 37 и 55 С; и фиг. 6, 7 и 8 представляют активностьEcoR1 в композициях в форме лиофилизированного препарата и в форме стабилизированного трегалозой сухого порошка или масляной суспензии при 4, 37 и 55 С. 13 Примеры Пример 1. Щелочная фосфотаза. Фермент, щелочную фосфотазу из слизистой бычьего кишечника, КФ 3.1.3.1. (SigmaAldrich Co. Ltd p8647) обычно получают в виде лиофилизированного порошка. Фермент требует хранения обезвоженным в холодильнике при температуре 0 С для сохранения активности фермента. Даже при этой температуре лиофилизированный фермент постепенно теряет активность. Хранение при более высокой температуре приводит к более быстрой в зависимости от температуры потере активности (фиг. 1). Приготовление лекарственного средства и сушка Фермент растворяли в буфере, составленном из Ингредиент Концентрация Трегалоза 0,6 М Сульфат натрия 0,35 М Бычий сывороточный альбумин 0,75 мМ Щелочная фосфотаза 40 единиц/мл Хлорид цинка 1 мМ Хлорид магния 1 мM и высушивали в распылительной сушилке Labplant SD1. Условия сушки: температура на входе составляет 135 С, температура на выходе - 80 С при максимальном токе воздуха. В конце этого процесса остаточное содержание воды составляло 2%, измеренное посредством термогравиметрического анализа (TGA) на приборе SeicoSSC/5200 (Seico Instruments Inc). Хранение Аликивоты по 100 мг порошка отвешивали в 5 мл вакцинные ампулы и закупоривали под давлением. Другие аликвоты отвешивали в ампулы и ресуспендировали в фармацевтически чистом этилолеате (Croda Chemical CompanyLtd) при концентрации масла 200 мг/мл. Эти ампулы также закупоривали под вакуумом. Образцы как высушенного порошка, так и масляной суспензии затем хранили в течение различных периодов времени при температуре либо 37 С, либо 55 С. Анализ В конце периода хранения по 5 мл буфера следующего состава, приведенного к рН 10,0 раствором гидроокиси натрия,Концентрация Ингредиент 100 мМ Глицин 1 мМ Хлорид цинка 1 мМ Хлорид магния добавляли и ампулы центрифугировали при 3500 оборотов в минуту в течение 10 мин на центрифуге IEC Centra 413. Таким образом,обеспечивалось перемещение "стеклянных" частиц, содержащих фермент, через поверхность раздела масло-вода и затем растворение их в буфере, чтобы получить остаточный фермент. Количество полученного фермента было идентичным независимо от того, встряхивались ли энергично ампулы после добавления водного 14 буфера или нет. Активность измеряли, используя кинетический метод определения "глициновых единиц" (Sigma-Aldrich Co Ltd.), на спектрофотометре Shimadzu UV-160A при 37 С с пнитрофенил фосфатом в качестве субстрата и измеряли развитие окраски при длине волны 405 нм. Результаты При хранении при температуре 37 С не происходило потери активности фермента в течение свыше 84 дней хранения ни в сухом порошке, ни в масляной суспензии (фиг. 2). При хранении при 55 С имела место небольшая потеря активности в пределах первых 7 дней, но свыше 90% активности оставалась стабильной в течение вплоть до 84 дней (фиг. 3). В этом случае имели место различия между образцами масляной суспензии и порошка, первые были лучше, однако различия незначительны. По существу получали идентичные результаты при применении как минерального масла, так и этилолеата в качестве однородной фазы. В других экспериментах сушку распылением осуществляли, используя различные буферные композиции, содержащие молочнокислый кальций вместо сульфата натрия или маннит вместо трегалозы. Это давало по существу одинаковые результаты. Особенно неожиданными были хорошие результаты с образующими"стекло" буферами на основе маннита, так как в ранее описанной работе сообщалось, что невозможно использовать моносахаридные сахароспирты в качестве стабилизирующих агентовduring drying and subsequent storage and compositions thereof" Colaco C., Roser B.J. и Sen S.). Это определенно не так при условии, что технология приготовления и сушки лекарственного средства такова, что обеспечивает образование хорошего "стекла". Для подтверждения инертности и стабильности высушенных активных агентов в "стеклянных" порошках в суспензии, смеси порошков, содержащих щелочную фосфотазу, и порошков, содержащих п-нитрофенил фосфат,готовили в минеральном масле и хранили при 55 С в течение 7 дней. В конце этого периода они оказались неизмененными. При добавлении 1 мл воды и встряхивании, в отдельной водной фазе быстро развивался интенсивный желтый цвет, указывая, что вода реактивирует как фермент, так и субстрат. Результаты показывают,что эти композиции могут содержать в одном и том же носителе компоненты, которые взаимо 15 действуют в обычных водных смесях. Это свойство имеет большое значение, например, для поливалентных вакцин. Неизбежен вывод, что это свойство является хорошей модельной системой для разработки так называемых "бинарных" лекарственных средств, в которых конечный активный компонент синтезируют или высвобождают посредством химической реакции,которая начинается только, когда жидкость организма увлажняют предшествующие молекулы. Пример 2. Рекомбинантный эритропоэтин человека (ЕРО). ЕРО выбирают как пример современного фармацевтического препарата, который получают методом генной инженерии рекомбинантного белка в Е. coli. Лиофилизированный ЕРО повторно гидратировали и разбавляли в 100 раз буфером следующего состава: Ингредиент Концентрация Трегалоза 0,6 М Сульфат натрия 0,7 М Бычий сывороточный альбумин 0,75 мМ и высушивали в распылительной сушилке, как описано выше. Взвешивали аликвоты порошка по 125 мг и проводили повторное высушивание при температуре, изменяющейся от 40 до 80 С при скорости 15 градусов за час под вакуумом, а затем или закупоривали в сывороточных ампулах, или повторно суспендировали в 0,5 мл минерального масла ВР и закупоривали. Затем их хранили при 37 или 55 С в течение вплоть до 15 дней. В конце периода хранения остаточный ЕРО экстрагировали забуференным фосфатом физиологическим раствором,содержащим 0,01% BSA (бычий сывороточный альбумин),как описано выше, а количество, остающееся в экстракте, измеряли, применяя ЕРО-специфический иммуноанализ Quantikine IVD (RDSystems Inc). В течение одного дня при 37 С свежий ЕРО теряет 88% своей активности, тогда как высушенный материал, либо суспендированный в масле, либо нет, сохраняет всю активность (фиг. 4). Имеется небольшая потеря активности за 15 дней, но более 90% активности сохраняется. При хранении при 55 С свежий ЕРО теряет 95% активности в течение одного дня (фиг. 5). Напротив, высушенный материал не теряет никакой активности в течение первого дня, и 80% активности все еще сохраняется через 15 дней. Пример 3. EcoR1 рестриктаза (эндонуклеаза рестрикции). Рестриктазы (рестрикционные ферменты) обычно хранятся в холодильниках при -20 С в буферах, содержащих 50% глицерин для предотвращения образования льда. Даже при этих условиях некоторые из них имеют ограниченный срок хранения, и время от времени их необходимо заменять. Несколько ферментов вы 001873 16 сушивали, применяя способ данного изобретения, с получением подобных результатов. Представлены данные относительно одного фермента, EcoR1. Раствор фермента разбавляли в 100 раз в SC-буфере (Colaco C.A.L.S., Sen S., Thangavelu M., Pinder S. и Roser В. "Extraordinary(1992. Высушенный фермент получали в распылительной сушилке, как описано выше, закупоривали ампулы с маслом или без него, а его стабильность за время хранения при трех температурах 4, 37 и 55 С сравнивали со стабильностью свежего жидкого фермента, разбавленного разбавляющим буфером. Для определения остаточной активности после хранения, фермент восстанавливали в водной фазе, как описано ранее, разводили SC-буфером в 2-кратном серийном разведении и использовали для разрезания 0,5 мкг ДНК фага лямбда (Life Technologies Inc). Полноту разрезания при различных разведениях оценивали посредством разделения фрагментов ДНК при электрофорезе в агарозном геле, в котором зоны визуализировали в УФ при окрашивании этидиум бромидом. Титр фермента выражали как максимальное разведение, которое показало полное разрезание без проявления дополнительных зон. При хранении при 4 С ни один из препаратов не проявлял прогрессивной потери активности в пределах 28 дней. Даже свежий жидкий препарат был стабилен при этой температуре(фиг. 6). При 37 С свежий фермент терял по существу всю активность к 28 дню, тогда как высушенный фермент с или без добавленного масла оставался высоко активным (фиг. 7). Высушенные препараты фермента продемонстрировали одинаковую сохранность активности после хранения при 55 С, тогда как при этой температуре свежий фермент полностью инактивируется в течение 7 дней (фиг. 8). Эти композиции рестриктаз обеспечивают удобный новый способ разрезания ДНК. Масло,содержащее суспендированный порошок фермента, покрывает раствор ДНК, его перемешивают вращением и центрифугируют на центрифуге Eppendorf. Суспензию фермента растворяют в водной фазе, содержащей ДНК, и начинают разрезание при 37 С. Масляная фаза образует удобный паровой барьер, покрывающий продукт и препятствующий испарению. Этот способ уже известен молекулярным биологам, проявляющим интерес к методу полимеразной цепной реакции. Сохраняемые при комнатной температуре рестриктазы в негигроскопичном минеральном масляном носителе являются ценным и удобным новым продуктом для молекулярной биологии. 17 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стабильная частица в жидкой композиции, содержащая дисперсную фазу микрочастиц, суспендированных в однородной фазе, которая представляет собой неводную жидкость, в которой микрочастицы нерастворимы, где микрочастицы включают тонкоизмельченное порошкообразное сахарное "стекло", содержащее,по крайней мере, один биомолекулярный продукт, указанный биомолекулярный продукт в сахарном "стекле" либо находится в стабильном твердом растворе, либо сам по себе в суспензии в сахарном "стекле", и где однородная фаза включает липидрастворимое поверхностноактивное вещество с низким или очень низким гидрофильно-липофильным балансом. 2. Композиция по п.1, отличающаяся тем,что сахарное "стекло" формируется из одного или более cахаров, выбранных из группы, состоящей из трeгалозы, палатинита, глюкопиранозил сорбита, глюкопиранозил маннита, лактитола, и моносахаридных спиртов, таких как маннит и инозит. 3. Композиция по п.1, отличающаяся тем,что неводная однородная жидкая фаза является биосовместимой. 4. Композиция по п.1, отличающаяся тем,что неводная однородная фаза представляет собой гидрофобный растворитель. 5. Композиция по п.1, отличающаяся тем,что неводная жидкая однородная фаза является водорастворимой. 6. Композиция по любому из пп.1-5, отличающаяся тем, что микрочастицы сахарного"стекла" составляют в диаметре от приблизительно 0,1 до приблизительно 10 мкм, предпочтительно менее 10 мкм, например 1 или 2, или 5 мкм, наиболее предпочтительно меньше чем 1 мкм. 7. Композиция по п.6, отличающаяся тем,что микрочастицы не проявляют большого разброса в размере частиц. 8. Композиция по любому из пп.1-7, отличающаяся тем, что микрочастицы являются по существу сухими, имеющими очень низкое содержание воды - менее чем приблизительно 1%. 9. Композиция по любому из пп.1-8, отличающаяся тем, что биомолекулярный продукт представляет собой лекарственное средство или другой биологически активный ингредиент, такой как белок, антитело, фермент (например,рестриктаза) и подобное, включая биологические материалы, такие как пищевые продукты,красящие вещества, напитки и подобное. 10. Композиция по любому из пп.1-9, отличающаяся тем, что микрочастицы составляют монодисперсную суспензию в однородной фазе. 11. Композиция по любому из пп.1-10, отличающаяся тем, что содержит от приблизительно 1% до более чем 50%, например прибли 001873 18 зительно 10% по весу микрочастиц в дисперсной фазе. 12. Композиция по п.1, отличающаяся тем,что количество поверхностно-активного вещества в однородной фазе составляет от приблизительно 0,01% до приблизительно 10%, например 1% по объему. 13. Композиция по п.1 или 12, отличающаяся тем, что содержит одно или более поверхностно-активных веществ, выбранных из группы, состоящей из сорбитана полуторного олеата, маннида моноолеата, сорбитана тристеарата, и моностеарат глицерина, лецитина(фосфатидилхолина),дипальмитоилфосфатидилхолина, дистеароилфосфатидилхолина, димиристоилфосфатидилхолина, и лаурата, пальмитата, стеарата и олеата сорбитана. 14. Композиция по п.1, отличающаяся тем,что однородная неводная жидкая фаза включает или состоит из одного или более гидрофобных нетоксичных растворителей, выбранных из группы, состоящей из кунжутного масла, арахисового масла, соевого масла, этилолеата и минерального масла. 15. Композиция по п.1, отличающаяся тем,что неводная однородная жидкая фаза содержит или состоит из смешивающегося с водой неводного растворителя, выбранного из группы, состоящей из полиэтиленгликоля, глицерина, этиленгликоля, пропиленгликоля, оксида пропилена, полипропиленгликоля. 16. Способ производства стабильной частицы в жидкой композиции, который включает стадии получения микрочастиц, содержащих один или более биомолекулярных продуктов,содержащихся в сахарном "стекле", и добавления микрочастиц к неводной однородной жидкой фазе, в которой частицы не растворяются,для образования суспензии, причем указанный биомолекулярный продукт в сахарном "стекле" либо находится в стабильном твердом растворе,либо сам по себе в суспензии в сахарном "стекле", и где монодисперсную с одним типом частиц суспензию микрочастиц получают в неводной однородной жидкой фазе посредством включения в однородную фазу, по меньшей мере, одного поверхностно-активного вещества,характеризующегося низким или очень низким гидрофильно-липофильным балансом. 17. Способ по п.16, отличающийся тем, что поверхностно-активное вещество добавляют к однородной неводной жидкой фазе перед добавлением частиц. 18. Композиция по п.1, отличающаяся тем,что представляет собой бинарную лекарственную композицию, где биомолекулярный продукт является предшественником лекарства и где конечный активный лекарственный компонент синтезируют или высвобождают посредством химической реакции, которая начинается только тогда, когда, после введения композиции пациенту, жидкости организма смачивают предшественник. 19. Композиция по п.1, отличающаяся тем,что содержит микрочастицы, содержащие больше чем один биомолекулярный продукт. 20. Композиция по п.1 или 19, отличающаяся тем, что содержит смеси микрочастиц,которые высвобождают более чем один тип биомолекулярного продукта, когда контактируют с водным окружением. 21. Композиция по п.19 или 20, отличающаяся тем, что два или более биомолекулярных продукта взаимодействуют при высвобождении в водном окружении. 22. Способ разрезания ДНК, который использует композицию по п.1, в котором биомолекулярный продукт представляет собой фермент, рестриктазу и заключающийся в том, что композиция контактирует с водным раствором ДНК, в результате чего суспендированный фермент, содержащийся в сахарном "стекле", растворяется в водной фазе, содержащей ДНК, и способен разрезать ДНК.
МПК / Метки
МПК: A61P 43/00, C12N 11/04, A61K 9/10
Метки: частица, жидких, композициях, стабильная
Код ссылки
<a href="https://eas.patents.su/12-1873-stabilnaya-chastica-v-zhidkih-kompoziciyah.html" rel="bookmark" title="База патентов Евразийского Союза">Стабильная частица в жидких композициях</a>
Предыдущий патент: Система и способ для формирования спектра передаваемых сигналов данных
Следующий патент: Керамический материал, испускающий инфракрасное излучение
Случайный патент: Двойные ингибиторы pi3 киназы/mtor