Бифункциональный воздушный электрод
Формула / Реферат
1. Бифункциональный воздушный электрод для перезаряжаемого металл-воздушного аккумулятора или для перезаряжаемого металлогидрид-воздушного аккумулятора, включающий газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем, где активный слой содержит катализатор восстановления кислорода и катализатор восстановления и выделения кислорода, выбранный из La2O3, Ag2O и шпинелей и любых их сочетаний.
2. Бифункциональный воздушный электрод по п.1, в котором катализатор восстановления кислорода выбран из MnO2, KMnO4, MnSO4, SnO2, Fe2O3, CO3O4, Со, СоО, Fe, Pt и Pd и любых их сочетаний.
3. Бифункциональный воздушный электрод по п.1 или 2, в котором катализатор восстановления и выделения кислорода представляет собой La2O3.
4. Бифункциональный воздушный электрод по п.1, в котором катализатором восстановления кислорода является MnSO4, а катализатором восстановления и выделения кислорода является La2O3.
5. Бифункциональный воздушный электрод по любому из предшествующих пунктов, в котором активный слой включает гидрофобное связующее и порообразователь.
6. Бифункциональный воздушный электрод по п.5, в котором гидрофобным связующим является ПТФЭ и/или порообразователь выбран из бикарбоната аммония, углерода с высокой площадью поверхности и графита.
7. Бифункциональный воздушный электрод по любому из предшествующих пунктов, в котором кислородовыделяющий слой и активный слой представляют собой один слой, сочетающий свойства обоих слоев.
8. Перезаряжаемый аккумулятор, включающий либо металлический электрод, либо металлогидридный электрод, и воздушный электрод, где воздушный электрод является бифункциональным электродом, включающим газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем, где активный слой содержит катализатор восстановления кислорода и катализатор восстановления и выделения кислорода.
9. Перезаряжаемый аккумулятор по п.8, в котором катализатор восстановления и выделения кислорода выбран из La2O3, Ag2O, Ag, перовскитов и шпинелей и любых их сочетаний.
10. Перезаряжаемый аккумулятор по п.8 или 9, в котором катализатор восстановления кислорода выбран из MnO2, KMnO4, MnSO4, SnO2, Fe2O3, СО3О4, Co, CoO, Fe, Pt и Pd и любых их сочетаний.
11. Перезаряжаемый аккумулятор по п.8, в котором воздушный электрод включает бифункциональный воздушный электрод по любому из пп.1-7.
12. Перезаряжаемый металл-воздушный аккумулятор по любому из пп.8-11, в котором металлический электрод включает металл, выбранный из Zn, Al, Mg, Fe, Li.
13. Перезаряжаемый металлогидрид-воздушный аккумулятор по любому из пп.8-11, в котором металлогидридный электрод включает металлогидрид, выбранный из группы, состоящей из АВ5, АВ2, АВ и А2В, где А является щелочно-земельным металлом, переходным металлом, редкоземельным металлом или актинидом и В является переходным металлом группы железа.
14. Способ изготовления бифункционального воздушного электрода, включающий:
а) формирование активного слоя путем:
1) смешивания порообразующего материала, связующего материала, катализатора восстановления кислорода и катализатора восстановления и выделения кислорода с получением агломерата;
2) добавления органического растворителя к сухому агломерату, чтобы получить пасту;
3) каландрирования пасты в тонкий лист для формирования активного слоя;
б) формирование газодиффузионного слоя путем:
1) смешивания порообразующего материала и связующего материала с получением агломерата;
2) добавления органического растворителя к сухому агломерату, чтобы получить пасту;
3) каландрирования пасты в тонкий лист для формирования газодиффузионного слоя;
в) объединение указанного активного слоя и указанного газодиффузионного слоя;
г) запрессовку коллектора тока внутрь любого из слоев с образованием газодиффузионного электрода.
Текст
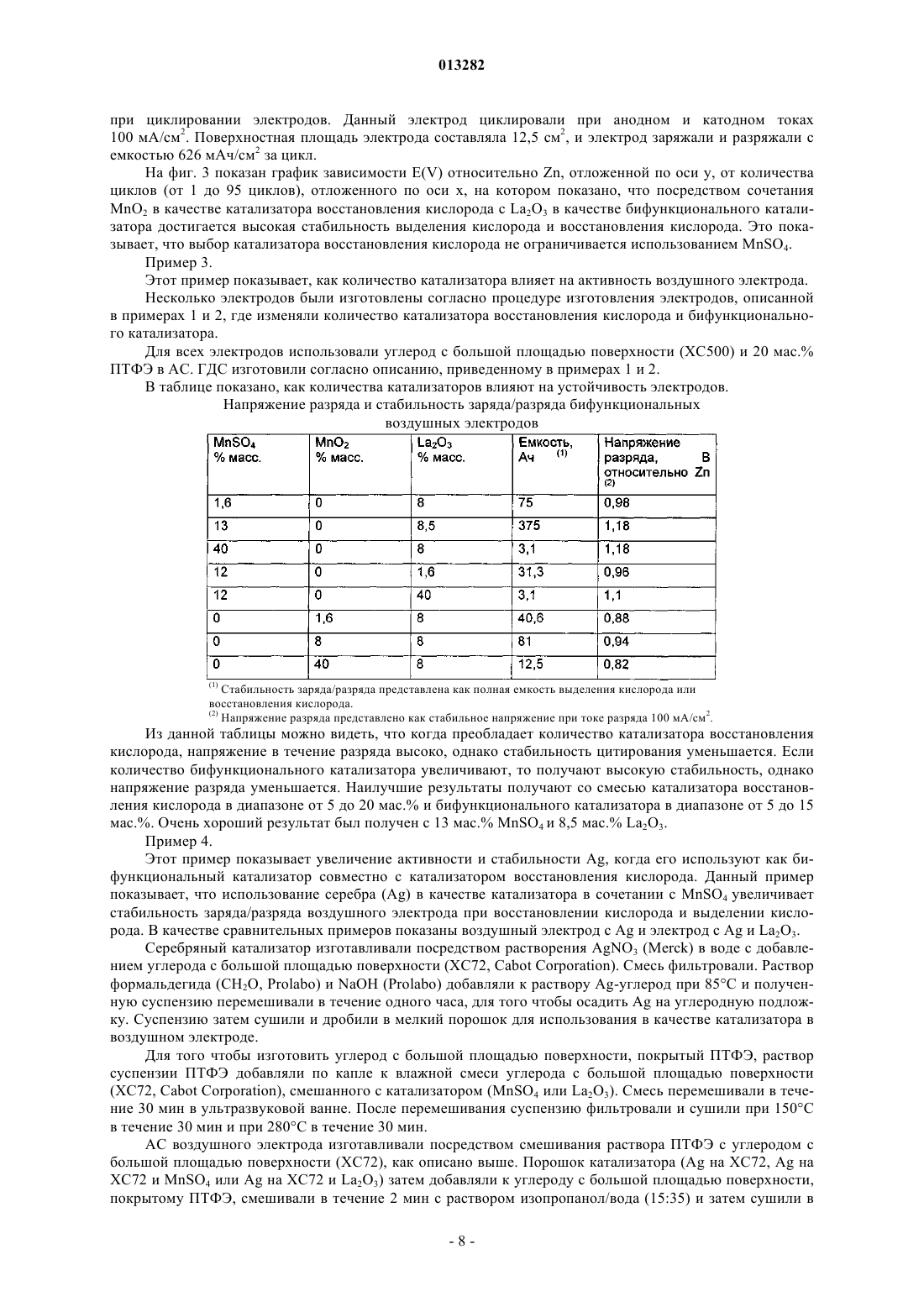
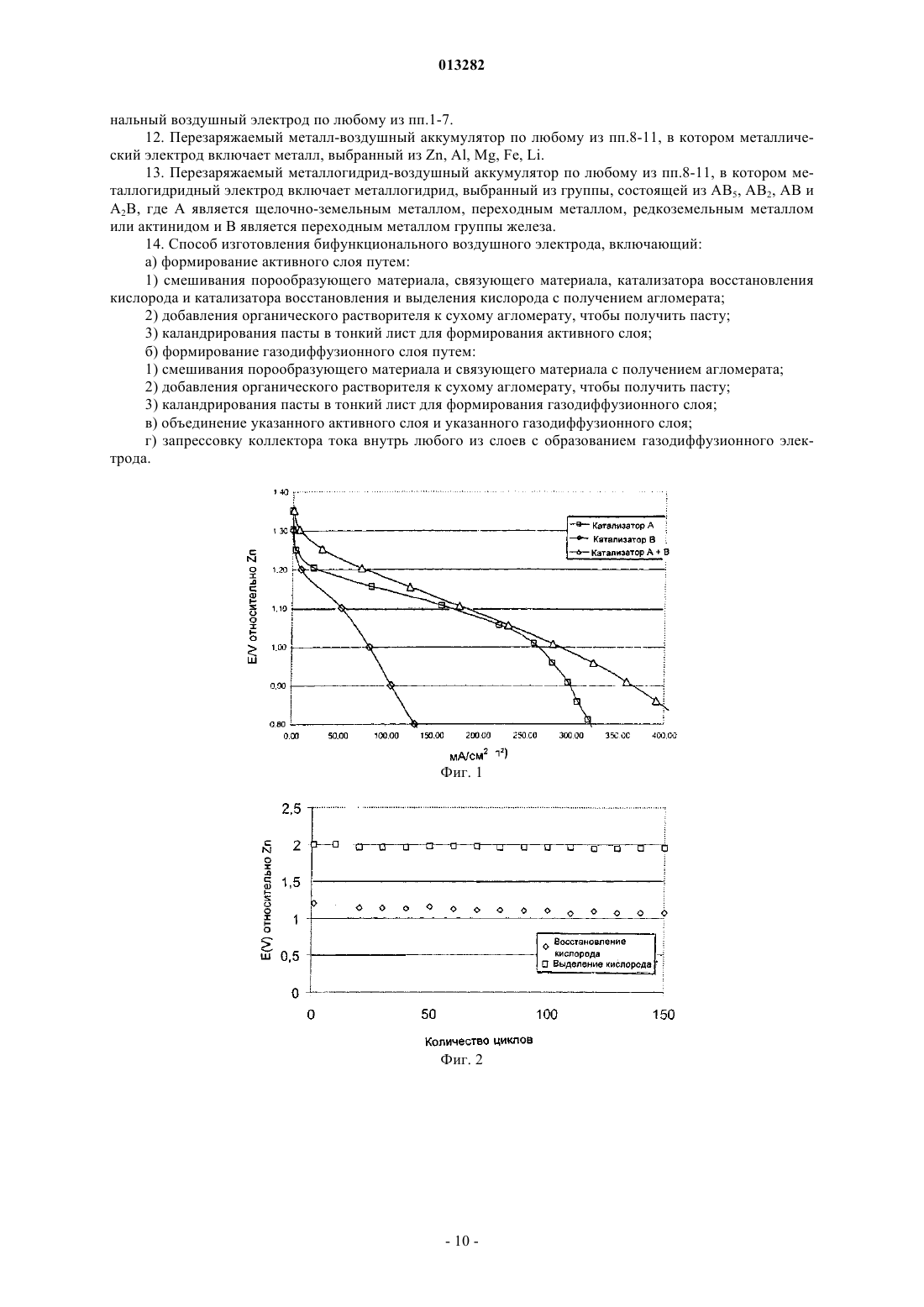
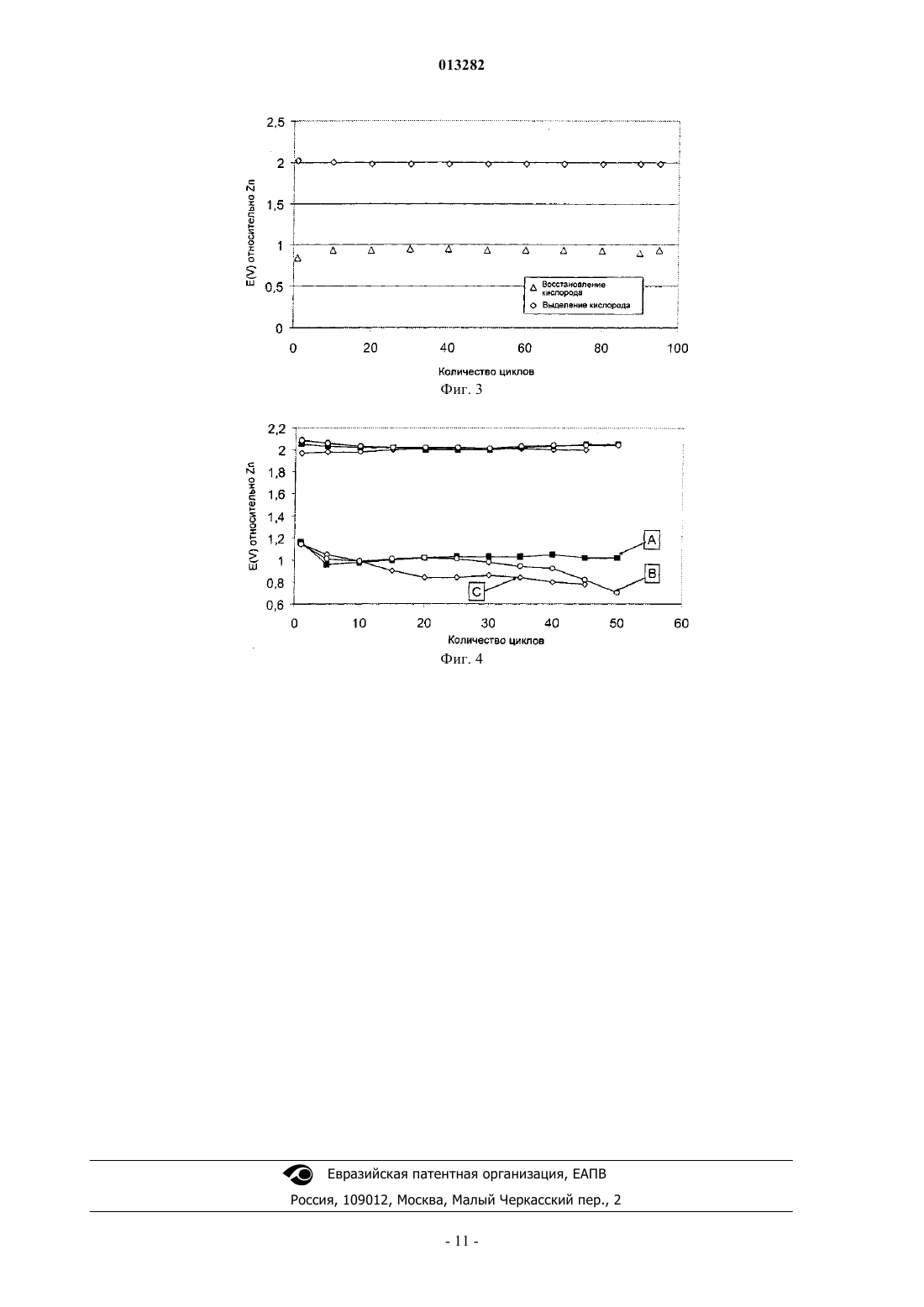
013282 Данное изобретение относится к воздушным электродам для перезаряжаемых металл-воздушных аккумуляторов или металлогидрид-воздушных аккумуляторов и, в частности, к бифункциональным воздушным электродам, которые могут подвергаться восстановлению кислорода и выделению кислорода с высокими скоростями реакций и к способу изготовления таких электродов. В большой степени разработка воздушных электродов была направлена на применение в топливных элементах. Поэтому доминирует изучение реакций восстановления кислорода. Система щелочного топливного элемента (ЩТЭ) показывает высокие скорости реакций и устойчивость к восстановлению кислорода при использовании материалов, основанных на неблагородных металлах. Данная реакция протекает на мелкодисперсных катализаторах с высокой площадью реакционной поверхности. Посредством тщательного регулирования гидрофобности и распределения пор по размерам установлена стабильная трехфазная зона внутри электрода. Обычно воздушные электроды в применениях ЩТЭ показывают стабильное поведение (менее чем 10% увеличение при перенапряжении) в течение более чем 10000 ч. Такие системы действуют при температурах 60-90 С. Основной причиной неустойчивости при применении воздушных электродов для восстановления кислорода является затопление электрода. Причиной этого является медленное проникновение электролита внутрь электрода. Диффузионный путь для кислорода внутрь структуры таким образом возрастает,что приводит к уменьшению скорости реакции восстановления кислорода. Воздушные электроды промышленно используют в первичных металл-воздушных аккумуляторах. В таких аккумуляторах используют такие металлы, как цинк (Zn), алюминий (Al), железо (Fe) и т.д. в качестве энергоносителя. Анодное растворение металла высвобождает электроны, которые перемещаются по внешней цепи к катоду, где электроны поглощаются посредством восстановления кислорода из воздуха с образованием ионов гидроксида. Ионы гидроксида растворяются в электролите и перемещаются к аноду посредством диффузии. На аноде гидроксид взаимодействует с растворенными ионами металлов с образованием оксидов металлов. Такие электроды обычно используют в системах, которые требуют срок службы менее 100 ч под нагрузкой и для которых стабильность срока службы электрода не является основным параметром. Более важным является медленное испарение электролита из-за потери водяных паров. Для увеличения стабильности и активности воздушного электрода предлагают сочетание нескольких катализаторов для реакции восстановления кислорода. Например, один катализатор может быть использован для восстановления кислорода и другой для восстановления промежуточных реагентов в механизме реакции восстановления кислорода. Такие промежуточные реагенты могут атаковать и разрушать углеродную структуру или связующие материалы, используемые для воздушного электрода. В WO 02/075827 высокую активность для реакции восстановления кислорода получали в течение длительного периода времени посредством использования двух катализаторов. Хотя это применение не дает ясного понимания механизма реакции, оно ясно показывает преимущество использования сочетания нескольких каталитических материалов для увеличения активности и стабильности.Wang et al. (Journal of Power Sources, 124 (2003), 278-284) описывают Zn-воздушный аккумулятор,изготовленный с различными катализаторами для восстановления кислорода, включая катализатор типа перовскита (La0,6 Са 0,4 СаО 3), легированный MnO2. Однако авторы указывают, что не существует удовлетворительного доступного катализатора, который действовал бы бифункциональным образом с низким перенапряжением при практических плотностях тока. В US 2004/0048125 описан двухслойный катод для металлической ячейки, в которой используютAgMnO4 в качестве предшественника катализатора, в результате получая тонко дисперсные MnO2 и Ag. Катод подвергают только восстановлению кислорода. Катализаторы для реакции восстановления кислорода включают серебро, платину, платинурутений, шпинель, перовскиты и макроциклические железо, никель или кобальт и другие катализаторы,хорошо известные специалистам в данной области техники. В патенте US 6127061 показан воздушный катод. В патенте показано, что гидроксиды металлов, такие как гидроксид никеля, гидроксид кобальта, гидроксид железа, гидроксид церия, гидроксид марганца,гидроксид лантана или гидроксид хрома действуют в качестве катализатора для реакции восстановления кислорода. В данном патенте утверждают, что это обусловлено изменением валентности гидроксида путем взаимодействия с кислородом. В патенте US 5308711 соединения марганца со степенью окисления +2 использовали в качестве катализатора для реакции восстановления кислорода. Показано, что данный катализатор образовывается между частицами углерода после того, как частицы углерода были добавлены в водный раствор перманганата калия. В патенте показано, что высокая каталитическая активность для реакции кислорода может быть получена с соединениями марганца со степенью окисления +2. Использование оксидов марганца с более высокой валентностью хорошо известно. Было приложено много усилий для разработки перезаряжаемых металл-воздушных аккумуляторов,однако до сих пор эти разработки не привели к результатам, применимым в промышленности. Металлвоздушные аккумуляторы, имеющие комбинированные характеристики высокой емкости, высокой мощности, перезаряжаемости, большое количество циклов разряда/заряда, минимальный размер и массу,-1 013282 экономичность материалов и экологическую безопасность еще должны быть разработаны. Одна из основных проблем успешной разработки перезаряжаемых металл-воздушных аккумуляторов связана с воздушным электродом. Хотя высокая устойчивость реакции восстановления кислорода была получена с воздушными электродами в применениях щелочных топливных элементов, такие электроды необходимо модифицировать перед тем, как они могут быть использованы в применениях перезаряжаемых аккумуляторов. В перезаряжаемом металл-воздушном аккумуляторе энергия, высвобождаемая в течение разряда, восстанавливается посредством увеличения напряжения ячейки, что приводит к восстановлению оксидов металлов. На воздушном электроде происходит выделение кислорода. Воздушные электроды с высокими скоростями выделения кислорода без растворения катализатора и механического разрушения электрода еще должны быть разработаны. Для перезаряжаемых металл-воздушных аккумуляторов требуется воздушный электрод, дающий стабильные скорости, как для восстановления кислорода, так и для выделения кислорода в течение нескольких сотен циклов заряда/разряда. Были разработаны некоторые бифункциональные воздушные электроды с катализаторами, работающими как для восстановления, так и для выделения кислорода. В последней разработке было показано, что использование материалов типа перовскита и шпинели является перспективным. Однако скорость выделения кислорода является низкой. Это обусловлено ограниченным диапазоном анодного потенциала, в котором могут быть использованы такие катализаторы без разрушения материалов и последующей потери активности в течение восстановления кислорода. До сих пор плотность тока 5-10 мА/см 2 представляется предельной. Другим подходом является использование нескольких катализаторов в воздушном электроде. Один катализатор выбирают для реакции выделения кислорода, а другой катализатор для восстановления кислорода. Предпочтительно используют катализатор восстановления кислорода, имеющий потенциал выделения кислорода более 2,1 В, и катализатор восстановления кислорода, имеющий потенциал восстановления кислорода менее 2 В. Таким образом, металл-воздушная ячейка, содержащая такие воздушные электроды, может быть перезаряжена при более низком потенциале так, что металл-воздушная ячейка разрушается более медленно, чем при перезарядке при более высоком напряжении. Катализаторы выделения кислорода могут быть выбраны из таких материалов, как WC или WC плавленый с кобальтом,CoWO4, FeWO4, NiS и WS2, которые, как было показано, перспективны. В патенте US 4341848 показано, что использование смеси выбранных катализаторов для выделения кислорода и реакций восстановления увеличивает стабильность. Сообщали о стабильности электрода после нескольких сотен циклов. В патенте US 5306579 показан аналогичный подход, однако в этом патенте катализатор выделения кислорода сосредоточен на воздушной стороне электрода. В данном патенте заявляют, что посредством увеличения концентрации катализатора выделения кислорода к воздушной стороне электрода уменьшается диффузионный путь для производимого кислорода и образуется небольшое количество кислородных пузырьков в электролите. Однако во всех предыдущих патентах по бифункциональным воздушным электродам были показаны только низкие скорости реакции выделения кислорода ( 50 мА/см 2). Это обусловлено выбранными материалами и скоростью диффузии кислорода из гидрофобных газовых каналов. Следствием этого является то, что требуется длительное время заряда. Для использования в силовой электронике существенна быстрая зарядка и поэтому необходима дальнейшая разработка таких электродов. К настоящему времени способ для изготовления бифункционального воздушного электрода с высокими скоростями восстановления кислорода и выделения кислорода еще требует разработки. Предметом настоящего изобретения является предоставление способа для сочетания свойств выделения кислорода и восстановления кислорода в бифункциональном электроде и предоставление электрода, который дает высокие скорости, как для выделения кислорода, так и для восстановления кислорода. В первом аспекте настоящего изобретения предложен бифункциональный воздушный электрод для перезаряжаемого металл-воздушного аккумулятора, включающий газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем; где активный слой содержит катализатор восстановления кислорода и бифункциональный катализатор, который выбран из La2O3, Ag2O и шпинелей. Во втором аспекте данного изобретения предложен перезаряжаемый металл-воздушный аккумулятор, включающий бифункциональный воздушный электрод, включающий газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем; где активный слой содержит катализатор восстановления кислорода и бифункциональный катализатор. В третьем аспекте данного изобретения предложен перезаряжаемый металлогидрид-воздушный аккумулятор, включающий бифункциональный воздушный электрод, включающий газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем; где активный слой содержит катализатор восстановления кислорода и бифункциональный катализатор. Краткое описание чертежей На фиг. 1 показана кривая поляризации для восстановления кислорода на воздушных электродах с(A) MnSO4, (В) La2O3 и (А+В) La2O3 и MnSO4, в качестве катализаторов; на фиг. 2 - стабильность воздушных электродов с La2O3 и MnSO4 в качестве катализаторов; на чертеже показано количество циклов от 1 до 150 при скорости заряда/разряда 100 мА/см 2 и с емкостью заряда и разряда 626 мАч/см 2 на цикл; на фиг. 3 - стабильность воздушных электродов с La2O3 и MnO2 в качестве катализаторов; на чертеже показано количество циклов от 1 до 95 при скорости заряда/разряда 100 мА/см 2 и с емкостью заряда и разряда 626 мАч/см 2 на цикл; на фиг. 4 - стабильность воздушных электродов с (А) Ag и MnSO4, (В) Ag и (С) Ag и La2O3 в качестве катализаторов; на чертеже показано количество циклов от 1 до 50 при скорости заряда/разряда 100 мА/см 2 и с емкостью заряда и разряда 626 мАч/см 2 на цикл. В настоящем изобретении предложен новый бифункциональный воздушный электрод. Этот электрод обеспечивает высокие скорости восстановления кислорода и выделения кислорода. Данный электрод является стабильным при нескольких сотен циклов заряда/разряда при использовании перезаряжаемого металл-воздушного аккумулятора. В данном изобретении также предложено сочетание материалов,которое предоставляет высокие скорости реакции восстановления кислорода при использовании материалов, которые предоставляют высокие скорости реакции выделения кислорода. Для того чтобы бифункциональный воздушный электрод работал, существует несколько факторов,которые необходимо рассмотреть. Во-первых, необходим активный слой с высокими скоростями реакций восстановления кислорода и высокой стабильностью. Для протекания реакции восстановления кислорода необходима трехфазная граница раздела. Газ (воздух) проникает в электрод посредством гидрофобных каналов. Электролит поступает в электрод посредством капиллярных сил, действующих в узкой гидрофильной пористой структуре. Частицы катализатора с большой площадью поверхности для восстановления кислорода присутствуют внутри электрода. Это увеличивает скорость восстановления кислорода. Скорость реакции более высока ближе к трехфазной границе раздела и уменьшается далее внутри заполненных электролитом каналов. Во-вторых, в отличие от зоны селективной реакции, требуемой для восстановления кислорода, реакция выделения кислорода происходит во всей затопленной зоне электрода. Ионы гидроксида окисляются с образованием кислорода, что приводит к локальной разности давления внутри электрода. Постепенное повышение давления внутри электрода из-за выделения кислорода может вызвать механическое разрушение электрода и поэтому важно, чтобы кислород выводили из внутренней поверхности электрода. В-третьих, важно предотвращать утечку электролита из внутренней части аккумулятора через воздушный электрод. Активный слой, в котором протекает реакция, частично заполнен электролитом. Поэтому, если воздушная сторона аккумулятора не защищена, будет происходить медленная утечка электролита. Это можно предотвратить посредством добавления отдельного слоя, обращенного к воздушной стороне электрода. Этот слой должен быть полностью гидрофобным, для того чтобы предотвратить проникновение электролита. Для того чтобы поддерживать высокую скорость реакции восстановления кислорода, этот слой должен сохранять высокую способность к диффузии кислорода. В настоящем изобретении предложено новое сочетание материалов для бифункциональных воздушных электродов. В частности, изобретение основано на использовании двух типов каталитических материалов с различными свойствами для реакций, протекающих в электроде. Использование двух типов катализаторов придает электроду уникальные свойства, что дает высокие скорости реакции и высокую стабильность. В данном изобретении используют один катализатор, который является катализатором восстановления кислорода, и другой катализатор, который действует как бифункциональный катализатор. Использование этого сочетания катализаторов увеличивает стабильность электрода при восстановлении кислорода и выделении кислорода. Используемый термин катализатор восстановления кислорода означает катализатор, который показывает высокие скорости только для реакции восстановления кислорода (то есть не показывает какого-либо существенного каталитического эффекта для реакции выделения кислорода), и высокую стабильность при длительном разряде. Термин бифункциональный катализатор означает катализатор, который показывает высокие скорости реакций и стабильность как для реакции восстановления кислорода, так и для реакции выделения кислорода. Например, бифункциональный катализатор может показывать высокую каталитическую активность выше активности углерода для выделения кислорода и устойчивость при высоких скоростях (20-2000 мА/см 2) выделения кислорода. Высокой скоростью выделения кислорода является, например, 50 мА/см 2 при 1,95-2,05 относительно Zn. Высокой скоростью восстановления кислорода является, например, 50 мА/см 2 при 1 В относительно Zn и увеличенная активность по сравнению с использованием образца, содержащего только углеродный порообразователь. Сочетание двух таких катализаторов увеличивает активность реакции восстановления кислорода. Это увеличение активности связано с взаимодействием между двумя выбранными катализаторами. Это видно из того факта, что эквивалентные количества двух катализаторов, используемых по отдельности,-3 013282 дают более низкую активность, чем когда два катализатора используют в сочетании (см. фиг. 1). Не ограничивая себя какой-либо специальной теорией, можно объяснить увеличенную активность взаимодействием между катализаторами, в котором каждый катализатор принимает участие в различных стадиях механизма реакции восстановления кислорода. Особенно для реакции восстановления кислорода является выгодным сочетание катализаторов, в котором один из катализаторов является бифункциональным катализатором, который действует как для восстановления кислорода, так и для выделения кислорода. Таким катализатором является La2O3, так как он каталитически активен как для восстановления кислорода, так и для выделения кислорода. С другой стороны, MnSO4 является катализатором, который преимущественно увеличивает активность реакции восстановления кислорода. Другие катализаторы восстановления кислорода включают MnO2, KMnO4, MnSO4, SnO2, Fe2O3,СО 3 О 4, Co, CoO, Fe, Pt и Pd. Другие бифункциональные катализаторы включают такие материалы, какLa2O3, Ag2O, Ag, шпинели и перовскиты. Шпинели являются группой оксидов общей формулы АВ 2 О 4, где А представляет собой ион двухвалентного металла, такого как магний, железо, никель, марганец и/или цинк, и В представляет собой ионы трехвалентного металла, такого как алюминий, железо, хром и/или марганец. Перовскиты являются группой оксидов общей формулы АХО 3, где А является ионом двухвалентного металла, такого как церий, кальций, натрий, стронций, свинец и/или различные редкоземельные металлы, и X является тетраэдральным ионом металла, такого как титан, ниобий и/или железо. Все члены этой группы имеют одинаковую базовую структуру с ХО 3 атомами, образующими решетку взаимосвязанных октаэдров. В одном воплощении настоящего изобретения La2O3 используют в качестве катализатора для реакции выделения кислорода. Этот катализатор может быть использован в сочетании с катализаторами восстановления кислорода, хорошо известными специалистам в данной области техники, включая такие катализаторы, как MnO2, KMnO4, MnSO4, SnO2, Fe2O3, Co3O4, Co, CoO, Fe, Pt и Pd. В другом воплощении настоящего изобретения связующее, такое как политетрафторэтилен(ПТФЭ), используют для связывания частиц катализатора внутри электрода с образованием трехмерной гидрофобной структуры для транспорта кислорода внутрь электрода. В еще одном воплощении изобретения для сохранения большой поверхности катализатора, доступной для электролита, используют порообразователь. Порообразователь может быть таким материалом,как бикарбонат аммония (NH4HCO3), который будет испаряться или растворяться, что приводит к образованию пор. Порообразователь может также быть таким материалом, как углерод с большой площадью поверхности или графит, который, смешанный с катализатором, будет образовывать гидрофильную пористую структуру, обеспечивающую доступ электролита к катализатору. В еще одном воплощении изобретения материалы, используемые в качестве катализаторов для реакций, могут быть изготовлены в виде отдельных порошков или осаждены на пористую подложку, такую как углерод или графит с большой площадью поверхности. Гидрофобное связующее используют для агломерирования отдельных порошков, например может быть использован ПТФЭ. Порообразователь может быть добавлен к смеси порошков для увеличения площади активной поверхности для трехфазной реакционной зоны внутри электрода. В другом воплощении изобретения бифункциональный воздушный электрод состоит из одного или более электродных слоев, которые вносят вклад в различные свойства электрода. Ближе к воздушной стороне электрода используют слой, который обеспечивает проникновение газа, но препятствует проникновению жидкости. Этот пористый и гидрофобный слой называют газодиффузионным слоем (ГДС). Реакции протекают в одном или более слоях, тесно связанных с этим слоем. Для реакции восстановления кислорода требуется слой, который обеспечивает проникновение кислорода и электролита в зону реакции. Этот слой с двойной пористой структурой как из гидрофобных, так и из гидрофильных пор называют активным слоем (АС). Для реакции выделения кислорода требуется слой с гидрофильной пористой структурой, чтобы обеспечивать существенное проникновение электролита внутрь зоны реакции для выделения кислорода. Этот слой с гидрофильной пористой структурой называют слоем выделения кислорода (СВК). Электрод можно собрать путем совместной прокатки слоев и последующего прессования с никелевой сеткой (например, при 6-8 МПа (60-80 бар) и 80 С). В одном воплощении настоящего изобретения как восстановление кислорода, так и выделение кислорода протекают в одном и том же слое. Этот слой обладает комбинированными свойствами АС и СВК. В другом воплощении настоящего изобретения АС и СВК представлены как два отдельных слоя. В еще одном воплощении настоящего изобретения реакции как восстановления кислорода, так и выделения кислорода протекают в одном и том же слое, однако этот слой изготовлен таким образом, что катализаторы для выделения кислорода и для восстановления кислорода имеют различное расположение внутри слоя для того, чтобы минимизировать негативное влияние, которое эти реакции производят друг на друга. Все слои, требуемые для воздушного электрода, могут быть изготовлены с использованием одних и тех же способов изготовления. Во-первых, порообразующие материалы, катализаторы, связующие и дру-4 013282 гие добавки смешивают при помощи механической, термической или механической и термической энергии. В этом способе материалы хорошо распределяются и гидрофобные связующие образуют трехмерную сеть, соединяющую порошки в агломераты. Эти агломераты затем экструдируют и/или каландрируют с образованием слоя. Во-вторых, слои с различными свойствами соединяют посредством каландрирования и/или прессования. В-третьих, коллектор тока впрессовывают или каландрируют внутрь соединенных слоев. В одном воплощении настоящего изобретения ГДС изготавливают, используя влажную смесь углерода с большой площадью поверхности и суспензии ПТФЭ. Количество смеси ПТФЭ должно составлять от 20 до 45 мас.% и предпочтительно приблизительно 35 мас.%. В другом воплощении настоящего изобретения ГДС изготавливают из сухой смеси ПТФЭ и бикарбоната аммония. Количество ПТФЭ должно составлять от 20 до 45 мас.% и предпочтительно приблизительно 35 мас.%. Размер частиц бикарбоната аммония предпочтительно должен составлять 20 мкм и наиболее предпочтительно 10 мкм. В другом воплощении настоящего изобретения АС изготавливают из сухой смеси ПТФЭ, углерода с большой площадью поверхности и катализаторов. Количество ПТФЭ должно находится в диапазоне от 5 до 40 мас.% и предпочтительно приблизительно 15 мас.%. Количество катализаторов должно составлять от 10 до 50 мас.% и предпочтительно от 10 до 35 мас.%. Количество углерода с большой площадью поверхности должно составлять от 10 до 85 мас.% и предпочтительно от 50 до 60 мас.%. В другом воплощении настоящего изобретения АС изготавливают из влажной смеси суспензии ПТФЭ, углерода с большой площадью поверхности и катализатора. Количество ПТФЭ должно составлять от 5 до 40 мас.% и предпочтительно приблизительно 15 мас.%. Количество катализаторов должно составлять от 5 до 50 мас.% и предпочтительно от 10 до 30 мас.%. Количество углерода с большой площадью поверхности должно составлять от 10 до 85 мас.% и предпочтительно от 50 до 60 мас.%. В другом воплощении настоящего изобретения СВК изготавливают из сухой смеси ПТФЭ и катализатора. Углерод с большой площадью поверхности и/или бикарбонат аммония добавляют для увеличения затопления СВК электролитом. Количество ПТФЭ в активном слое должно составлять от 3 до 15 мас.% и предпочтительно приблизительно 5 мас.%. Количество углерода с большой площадью поверхности должно составлять от 30 до 60 мас.% и предпочтительно приблизительно 50 мас.%. Количество катализатора должно составлять от 25 до 66 мас.% и предпочтительно приблизительно 45 мас.%. Если используют бикарбонат аммония в качестве порообразующего материала, его количество должно составлять от 30 до 75 мас.% и предпочтительно приблизительно 55 мас.%. В другом воплощении настоящего изобретения СВК изготавливают из влажной смеси ПТФЭ и катализатора. Углерод с большой площадью поверхности и/или бикарбонат аммония добавляют для увеличения затопления СВК электролитом. Количество ПТФЭ в активном слое должно составлять от 3 до 15 мас.% и предпочтительно приблизительно 5 мас.%. Количество углерода с большой площадью поверхности должно составлять от 30 до 60 мас.% и предпочтительно приблизительно 50 мас.%. Количество катализатора должно составлять от 25 до 66 мас.% и предпочтительно приблизительно 45 мас.%. Если используют бикарбонат аммония в качестве порообразующего материала, его количество должно составлять от 30 до 75 мас.% и предпочтительно приблизительно 55 мас.%. Количество ПТФЭ, используемое в этих образцах, должно быть настолько низким, насколько это возможно, чтобы обеспечить достаточное проникновение электролита внутрь образца. Однако если количество ПТФЭ является слишком низким (например, 3 мас.%), то механическая стабильность электрода является низкой, и электрод имеет тенденцию к разрушению, а порошковый катализатор не удерживается внутри электрода. Для дальнейшего увеличения проникновения электролита может быть использован порообразующий материал,такой как бикарбонат аммония. Альтернативно, могут быть добавлены углерод или графит. Капиллярные силы между частицами углерода приведут к затоплению электрода электролитом. Если и бифункциональный катализатор, и катализатор восстановления кислорода присутствуют в одном и том же слое электрода (то есть слое, обладающем сочетанием свойств АС и СВК), тогда количество катализаторов, упомянутое выше, относится к общему количеству обоих катализаторов. В получающемся электроде отношение бифункционального катализатора к катализатору восстановления кислорода предпочтительно составляет приблизительно 40:60. В другом воплощении настоящего изобретения сочетание катализатора выделения кислорода с бифункциональным катализатором используют в перезаряжаемом металл-воздушном аккумуляторе, топливном элементе или первичном металл-воздушном аккумуляторе. Бифункциональный электрод настоящего изобретения можно также использовать для электролиза в хлорно-щелочном элементе или в водном электролизе. Во втором аспекте настоящее изобретение предлагает перезаряжаемый металл-воздушный аккумулятор, включающий бифункциональный электрод и металлический электрод. Бифункциональный электрод включает газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока,находящийся в электрическом контакте с активным слоем, где активный слой содержит катализатор восстановления кислорода и бифункциональный катализатор. Металлический электрод предпочтительно изготовлен из Zn, Fe, Al, Mg или Li. Катализатор восстановления кислорода предпочтительно выбран изMnO2, KMnO4, MnSO4, SnO2, Fe2O3, Co3O4, Co, СоО, Fe, Pt и Pd, тогда как бифункциональный катализатор предпочтительно выбран из La2O3, Ag2O, Ag, шпинелей и перовскитов, наиболее предпочтительным является La2O3. В третьем аспекте настоящее изобретение предлагает перезаряжаемый металлогидрид-воздушный аккумулятор. Металлогидридные материалы, используемые в Ni-металлогидридных аккумуляторах, могут быть использованы в качестве материала анода в этих аккумуляторах. Металлогидридный электрод может быть предпочтительно выбран из группы, состоящей из АВ 5, АВ 2, АВ и А 2 В, где А является щелочно-земельным металлом, переходным металлом, редкоземельным металлом или актинидом, и В является переходным металлом группы железа. Катод является бифункциональным электродом, содержащим газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем, где активный слой содержит катализатор восстановления кислорода и бифункциональный катализатор. Катализатор восстановления кислорода предпочтительно выбран из MnO2, KMnO4, MnSO4, SnO2, Fe2O3, Co3O4, Co, CoO, Fe, Pt и Pd, тогда как бифункциональный катализатор предпочтительно выбран из La2O3, Ag2O, Ag, шпинелей и перовскитов, наиболее предпочтительным является La2O3. В дополнение к бифункциональному электроду по настоящему изобретению конструкция этих первичных и перезаряжаемых металл-воздушных и металлогидрид-воздушных аккумуляторов может быть выполнена любым способом, известным специалисту в данной области техники. Соответственно, перезаряжаемый металл-воздушный аккумулятор содержит бифункциональный электрод, описанный выше, в качестве воздухопроницаемого катода, металлический электрод в качестве анода, который предпочтительно изготовлен из Zn, Fe, Al, Mg или Li, и подходящий электролит. Металлический электрод может быть электродом в форме твердой пластины, спеченным пористым электродом, спеченной смесью металла и оксидов или электродом из порошка или гранул. Структура и конструкция электрода в большой степени определяется требуемыми применениями. Преимуществом является то, что электрод является слегка пористым, поскольку оксиды металлов, образованные посредством растворения металла, часто имеют более низкую плотность, чем чистые металлы. Щелочной раствор или полимер часто отделяют воздушный электрод от металлического электрода, и аккумулятор также может включать коллектор тока (например, никель). Аккумулятор функционирует посредством восстановления кислорода из окружающего воздуха на катоде, который реагирует с металлическим анодом с генерированием тока. Аккумулятор может быть повторно заряжен посредством приложения напряжения между анодом и катодом и изменения направления электрохимической реакции на обратное. В течение повторного заряда аккумулятор выделяет кислород в атмосферу через воздухопроницаемый катод. Перезаряжаемый металлогидрид-воздушный аккумулятор содержит бифункциональный электрод,описанный выше, в качестве воздухопроницаемого катода, металлогидридный электрод в качестве анода и подходящий электролит. Металлогидрид предпочтительно представляет собой АВ 5, АВ 2, АВ и А 2 В, где А является щелочно-земельным металлом, переходным металлом, редкоземельным металлом или актинидом, и В является переходным металлом группы железа. Структура и конструкция электрода в большой степени определяется требуемым применением. Аккумулятор функционирует за счет восстановления кислорода из окружающего воздуха на катоде, который реагирует с поглощенным водородом, высвобождаемым из металлогидридного материала. Аккумулятор может быть повторно заряжен посредством приложения напряжения между анодом и катодом и обращению электрохимической реакции. В течение повторного заряда аккумулятор высвобождает кислород в атмосферу через воздухопроницаемый катод. Примеры Настоящее изобретение иллюстрируется следующими примерами. Пример 1. Этот пример показывает, что использование катализатора восстановления кислорода в сочетании с бифункциональным катализатором увеличивает скорость восстановления кислорода и наработку циклов бифункционального электрода. MnSO4 был выбран в качестве катализатора восстановления кислорода иLa2O3 был выбран в качестве бифункционального катализатора. Воздушные электроды были изготовлены с использованием углерода с большой площадью поверхности, катализаторов в виде порошков и суспензии ПТФЭ. Активный слой изготавливали, используя 15 мас.% ПТФЭ в виде суспензии, содержащей 60 мас.% ПТФЭ, диспергированного в воде, (Aldrich), 63,5 мас.% углерода с большой площадью поверхности(ХС 500, Cabot Corporation) и электрокатализаторы: 13 мас.%, сульфата марганца (MnSO4, Prolabo) и 8,5 мас.% оксида лантана (La2O3, Merck). На первой стадии углерод с большой площадью поверхности смешивали с обоими катализаторами в воде. Отдельно суспензию ПТФЭ смешивали с водой. Затем раствор ПТФЭ добавляли к раствору углерода, и эти материалы смешивали и агломерировали в суспензию. Суспензию затем перемешивали в ультразвуковой ванне в течение 30 мин. Затем суспензию осушали при 300 С в течение 3 ч, чтобы удалить любые поверхностно-активные вещества. Высушенную смесь затем агломерировали и добавляли органический растворитель для образования пасты, и эту пасту затем каландрировали в тонкий слой для образования активного слоя (АС).-6 013282 Гидрофобный слой (ГДС) изготавливали подобным способом. В этом слое использовали только углерод с большой площадью поверхности (65 мас.%) и ПТФЭ (35 мас.%). Данные два слоя затем каландрировали совместно. Наконец, коллектор тока из никелевой сетки впрессовывали в электрод при 80 С и 7 МПа (70 бар). Электрод затем сушили при 70 С для удаления органического растворителя. Для сравнения были также изготовлены электроды с использованием либо 17 мас.% MnSO4, либо 17 мас.% La2O3 в качестве катализатора. Эти электроды были изготовлены при помощи способа, описанного выше, с активным слоем, содержащим 15 мас.% ПТФЭ в виде суспензии, содержащей 60 мас.% ПТФЭ в водной дисперсии и 68 мас.% углерода с большой площадью поверхности. Эти электроды испытывали в конфигурации полуэлемента в трехэлектродном устройстве, используя никелевый противоэлектрод и цинковый электрод сравнения. Воздушные электроды были помещены в держатель, который делал возможным доступ воздуха к одной стороне электрода, и противоположная сторона электрода подвергалась воздействию раствора 6,6 М КОН. Электрохимическую характеристику реакции кислорода измеряли, используя многоканальный регулятор напряжения от Arbin Instruments. На фиг. 1 показана поляризационная кривая электрода с сочетанием катализаторов, представляющем собой 13 мас.% MnSO4 и 8,5 мас.%. La2O3. В качестве сравнительных примеров показаны электроды с 17 мас.% MnSO4 и 17 мас.% La2O3. Фиг. 1 показывает график зависимости i/(мА/см 2), отложенного по оси х, от E(V) относительно Zn, отложенного по оси у. На данном чертеже показано, что при использовании сочетания MnSO4 и La2O3 в качестве катализаторов получают увеличение активности по сравнению с электродами только с MnSO4 или La2O3. На фиг. 2 показана стабильность электрода при использовании сочетания MnSO4 и La2O3 в качестве катализаторов при восстановлении кислорода и выделении кислорода при цитировании электродов. Электрод циклировался при анодном и катодном токах 100 мА/см 2. Площадь поверхности электрода составляла 12,5 см 2 и электрод заряжали и разряжали с емкостью 626 мАч/см 2 за цикл. На фиг. 2 показан график зависимости E(V) относительно Zn, отложенной по оси у, от количества циклов, отложенных по оси х, который показывает, что электрод с сочетанием бифункционального катализатора и катализатора восстановления кислорода стабилен в течение более 150 циклов. Были также испытаны сравнительные электроды, содержащие в качестве катализаторов либо только MnSO4, либо только La2O3. Эксперименты по циклированию при 100 мА/см 2 и емкости заряда/разряда 50 мАч/см 2 показали более низкую стабильность заряда/разряда. С MnSO4 в качестве катализатора наблюдалось значительное падение напряжения после 5-10 циклов. С La2O3 стабильность заряда/разряда была лучше (примерно 30-50 циклов можно было получить до падения напряжения), однако при использовании только этого материала в качестве катализатора активность реакции восстановления кислорода значительно ниже, как показано на фиг. 1. Пример 2. Этот пример показывает активность и стабильность воздушных электродов, когда MnO2 используют в качестве катализатора восстановления кислорода в сочетании с La2O3 в качестве бифункционального катализатора. Воздушные электроды изготавливали, используя углерод с высокой площадью поверхности, порошковые катализаторы и суспензию ПТФЭ. Активный слой изготавливали, используя 15 мас.% ПТФЭ в виде суспензии, содержащей 60 мас.% ПТФЭ в водной дисперсии (Aldrich), 69 мас.% углерода с большой площадью поверхности (ХС 500,Cabot Corporation) и электрокатализаторы: 8 мас.% оксида лантана (La2O3, Merck) и 8 мас.% оксида марганца (MnO2, Merck). В качестве первой стадии углерод с большой площадью поверхности смешивали с обоими катализаторами в воде. Отдельно суспензию ПТФЭ смешивали с водой. Затем раствор ПТФЭ добавляли к раствору углерода и данные материалы перемешивали и агломерировали в суспензию. Суспензию затем перемешивали в ультразвуковой ванне в течение 30 мин. Затем суспензию сушили при 300 С в течение 3 ч, для того чтобы удалить любые поверхностно-активные вещества. Осушенную смесь затем агломерировали и добавляли органический растворитель для образования пасты, и эту пасту затем каландрировали в тонкий слой для образования активного слоя (АС). Гидрофобный слой (ГДС) изготавливали таким же способом. В этом слое использовали только углерод с большой площадью поверхности (65 мас.%) и ПТФЭ (35 мас.%). Эти два слоя затем каландрировали совместно. Наконец, коллектор тока из никелевой сетки впрессовывали в электрод при 80 С и 7 МПа (70 бар). Электрод затем сушили при 70 С для удаления органического растворителя. Данный электрод испытывали в конфигурации полуэлемента в трехэлектродном устройстве, используя никелевый противоэлектрод и цинковый электрод сравнения. Воздушные электроды были помещены в держатель, который делал возможным доступ воздуха к одной стороне электрода, а противоположная сторона электрода подвергалась воздействию раствору 6,6 М КОН. Электрохимическую характеристику реакции кислорода измеряли, используя многоканальный регулятор напряжения от ArbinInstruments. На фиг. 3 показана поляризационная кривая электрода с сочетанием катализаторов: 8 мас.% MnO2 и 8 мас.% La2O3. Стабильность электрода показана при восстановлении кислорода и выделении кислорода-7 013282 при циклировании электродов. Данный электрод циклировали при анодном и катодном токах 100 мА/см 2. Поверхностная площадь электрода составляла 12,5 см 2, и электрод заряжали и разряжали с емкостью 626 мАч/см 2 за цикл. На фиг. 3 показан график зависимости E(V) относительно Zn, отложенной по оси у, от количества циклов (от 1 до 95 циклов), отложенного по оси х, на котором показано, что посредством сочетанияMnO2 в качестве катализатора восстановления кислорода с La2O3 в качестве бифункционального катализатора достигается высокая стабильность выделения кислорода и восстановления кислорода. Это показывает, что выбор катализатора восстановления кислорода не ограничивается использованием MnSO4. Пример 3. Этот пример показывает, как количество катализатора влияет на активность воздушного электрода. Несколько электродов были изготовлены согласно процедуре изготовления электродов, описанной в примерах 1 и 2, где изменяли количество катализатора восстановления кислорода и бифункционального катализатора. Для всех электродов использовали углерод с большой площадью поверхности (ХС 500) и 20 мас.% ПТФЭ в АС. ГДС изготовили согласно описанию, приведенному в примерах 1 и 2. В таблице показано, как количества катализаторов влияют на устойчивость электродов. Напряжение разряда и стабильность заряда/разряда бифункциональных воздушных электродов(1) Стабильность заряда/разряда представлена как полная емкость выделения кислорода или восстановления кислорода.(2) Напряжение разряда представлено как стабильное напряжение при токе разряда 100 мА/см 2. Из данной таблицы можно видеть, что когда преобладает количество катализатора восстановления кислорода, напряжение в течение разряда высоко, однако стабильность цитирования уменьшается. Если количество бифункционального катализатора увеличивают, то получают высокую стабильность, однако напряжение разряда уменьшается. Наилучшие результаты получают со смесью катализатора восстановления кислорода в диапазоне от 5 до 20 мас.% и бифункционального катализатора в диапазоне от 5 до 15 мас.%. Очень хороший результат был получен с 13 мас.% MnSO4 и 8,5 мас.% La2O3. Пример 4. Этот пример показывает увеличение активности и стабильности Ag, когда его используют как бифункциональный катализатор совместно с катализатором восстановления кислорода. Данный пример показывает, что использование серебра (Ag) в качестве катализатора в сочетании с MnSO4 увеличивает стабильность заряда/разряда воздушного электрода при восстановлении кислорода и выделении кислорода. В качестве сравнительных примеров показаны воздушный электрод с Ag и электрод с Ag и La2O3. Серебряный катализатор изготавливали посредством растворения AgNO3 (Merck) в воде с добавлением углерода с большой площадью поверхности (ХС 72, Cabot Corporation). Смесь фильтровали. Раствор формальдегида (СН 2 О, Prolabo) и NaOH (Prolabo) добавляли к раствору Ag-углерод при 85 С и полученную суспензию перемешивали в течение одного часа, для того чтобы осадить Ag на углеродную подложку. Суспензию затем сушили и дробили в мелкий порошок для использования в качестве катализатора в воздушном электроде. Для того чтобы изготовить углерод с большой площадью поверхности, покрытый ПТФЭ, раствор суспензии ПТФЭ добавляли по капле к влажной смеси углерода с большой площадью поверхности(ХС 72, Cabot Corporation), смешанного с катализатором (MnSO4 или La2O3). Смесь перемешивали в течение 30 мин в ультразвуковой ванне. После перемешивания суспензию фильтровали и сушили при 150 С в течение 30 мин и при 280 С в течение 30 мин. АС воздушного электрода изготавливали посредством смешивания раствора ПТФЭ с углеродом с большой площадью поверхности (ХС 72), как описано выше. Порошок катализатора (Ag на ХС 72, Ag на ХС 72 и MnSO4 или Ag на ХС 72 и La2O3) затем добавляли к углероду с большой площадью поверхности,покрытому ПТФЭ, смешивали в течение 2 мин с раствором изопропанол/вода (15:35) и затем сушили в-8 013282 духовом шкафу при 220 С в течение 2 ч. Порошок дробили и получали пасту путем добавления органического растворителя. Данную пасту затем каландрировали в тонкий слой (от 0,7 до 1 мм), для того чтобы сформировать АС электрода. ГДС воздушного электрода изготавливали посредством использования влажной смеси углерода с большой площадью поверхности ХС 72 (65 мас.%) с суспензией ПТФЭ (35 мас.%). Оба материала смешивали по отдельности с водой в течение 30 мин и затем суспензию ПТФЭ добавляли по капле к углеродному раствору. После того как суспензия была хорошо перемешана и смешана в ультразвуковой ванне в течение 30 мин, ее сушили при 300 С в течение 3 ч и затем дробили в мелкий порошок. ГДС изготавливали путем добавления органического растворителя к порошку. Пасту затем каландрировали в тонкий слой (от 0, 7 до 1 мм). АС и ГДС слои каландрировали совместно и коллектор тока из никелевой сетки впрессовывали в электрод (7 МПа (70 бар), 80 С). Электрод затем сушили при 70 С, для того чтобы удалить растворитель. Эти электроды испытывали в конфигурации полуэлемента в трехэлектродном устройстве, используя никелевый противоэлектрод и цинковый электрод сравнения. Воздушные электроды были помещены в держатель, который делал возможным доступ воздуха к одной стороне электрода, а противоположная сторона электрода подвергалась воздействию раствора 6,6 М КОН. Электрохимическую характеристику реакции кислорода измеряли, используя многоканальный регулятор напряжения от Arbin Instruments. На фиг. 4 показана поляризационная кривая электрода, изготовленного с использованием 19 мас.%AgNO3, смешанного с 8 мас.% MnSO4 в АС (показанном как А). В качестве сравнительных примеров показаны электроды с использованием только 19 мас.% AgNO3 (В) или 19 мас.% AgNO3, смешанного с 8 мас.% La2O3 (С). Электрод циклировали при анодном и катодном токах 100 мА/см 2. Поверхностная площадь электрода составляла 12,5 см 2 и электрод заряжали и разряжали с емкостью 626 мАч/см 2 за цикл. На фиг. 4 показан график зависимости E(V) относительно Zn, отложенной по оси у, от количества циклов, отложенных по оси х, из которого может быть видно, что после 50 циклов электрод с бифункциональным катализатором (Ag) и катализатором восстановления кислорода (А) показывает большую наработку циклов и высокие напряжения разряда. Для электрода только с Ag (В) наблюдалось падение напряжения разряда при циклировании. Для электрода с Ag и La2O3 (С) была получена стабильность,однако напряжение разряда составляло низкую величину после повторения циклирования. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Бифункциональный воздушный электрод для перезаряжаемого металл-воздушного аккумулятора или для перезаряжаемого металлогидрид-воздушного аккумулятора, включающий газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока, находящийся в электрическом контакте с активным слоем, где активный слой содержит катализатор восстановления кислорода и катализатор восстановления и выделения кислорода, выбранный из La2O3, Ag2O и шпинелей и любых их сочетаний. 2. Бифункциональный воздушный электрод по п.1, в котором катализатор восстановления кислорода выбран из MnO2, KMnO4, MnSO4, SnO2, Fe2O3, CO3O4, Со, СоО, Fe, Pt и Pd и любых их сочетаний. 3. Бифункциональный воздушный электрод по п.1 или 2, в котором катализатор восстановления и выделения кислорода представляет собой La2O3. 4. Бифункциональный воздушный электрод по п.1, в котором катализатором восстановления кислорода является MnSO4, а катализатором восстановления и выделения кислорода является La2O3. 5. Бифункциональный воздушный электрод по любому из предшествующих пунктов, в котором активный слой включает гидрофобное связующее и порообразователь. 6. Бифункциональный воздушный электрод по п.5, в котором гидрофобным связующим является ПТФЭ и/или порообразователь выбран из бикарбоната аммония, углерода с высокой площадью поверхности и графита. 7. Бифункциональный воздушный электрод по любому из предшествующих пунктов, в котором кислородовыделяющий слой и активный слой представляют собой один слой, сочетающий свойства обоих слоев. 8. Перезаряжаемый аккумулятор, включающий либо металлический электрод, либо металлогидридный электрод, и воздушный электрод, где воздушный электрод является бифункциональным электродом,включающим газодиффузионный слой, активный слой, кислородовыделяющий слой и коллектор тока,находящийся в электрическом контакте с активным слоем, где активный слой содержит катализатор восстановления кислорода и катализатор восстановления и выделения кислорода. 9. Перезаряжаемый аккумулятор по п.8, в котором катализатор восстановления и выделения кислорода выбран из La2O3, Ag2O, Ag, перовскитов и шпинелей и любых их сочетаний. 10. Перезаряжаемый аккумулятор по п.8 или 9, в котором катализатор восстановления кислорода выбран из MnO2, KMnO4, MnSO4, SnO2, Fe2O3, СО 3 О 4, Co, CoO, Fe, Pt и Pd и любых их сочетаний. 11. Перезаряжаемый аккумулятор по п.8, в котором воздушный электрод включает бифункцио-9 013282 нальный воздушный электрод по любому из пп.1-7. 12. Перезаряжаемый металл-воздушный аккумулятор по любому из пп.8-11, в котором металлический электрод включает металл, выбранный из Zn, Al, Mg, Fe, Li. 13. Перезаряжаемый металлогидрид-воздушный аккумулятор по любому из пп.8-11, в котором металлогидридный электрод включает металлогидрид, выбранный из группы, состоящей из АВ 5, АВ 2, АВ и А 2 В, где А является щелочно-земельным металлом, переходным металлом, редкоземельным металлом или актинидом и В является переходным металлом группы железа. 14. Способ изготовления бифункционального воздушного электрода, включающий: а) формирование активного слоя путем: 1) смешивания порообразующего материала, связующего материала, катализатора восстановления кислорода и катализатора восстановления и выделения кислорода с получением агломерата; 2) добавления органического растворителя к сухому агломерату, чтобы получить пасту; 3) каландрирования пасты в тонкий лист для формирования активного слоя; б) формирование газодиффузионного слоя путем: 1) смешивания порообразующего материала и связующего материала с получением агломерата; 2) добавления органического растворителя к сухому агломерату, чтобы получитьпасту; 3) каландрирования пасты в тонкий лист для формирования газодиффузионного слоя; в) объединение указанного активного слоя и указанного газодиффузионного слоя; г) запрессовку коллектора тока внутрь любого из слоев с образованием газодиффузионного электрода.
МПК / Метки
МПК: H01M 12/04, H01M 12/06, H01M 4/90, H01M 4/88, H01M 12/08, H01M 4/86
Метки: электрод, воздушный, бифункциональный
Код ссылки
<a href="https://eas.patents.su/12-13282-bifunkcionalnyjj-vozdushnyjj-elektrod.html" rel="bookmark" title="База патентов Евразийского Союза">Бифункциональный воздушный электрод</a>