Способ получения биологически активного покрытия
Номер патента: 19608
Опубликовано: 30.04.2014
Авторы: Шестериков Евгений Викторович, Твердохлебов Сергей Иванович, Больбасов Евгений Николаевич
Формула / Реферат
1. Способ получения биологически активного покрытия на имплантатах из металлических и керамических материалов, включающий получение раствора полимера в смесевом растворителе, обработку в шаровой мельнице порошка, используемого для получения покрытия, перемешивание в шаровой мельнице раствора полимера и обработанного порошка до состояния гомогенизации, доведение полученной смеси до вязкости, при которой данную смесь наносят, нанесение на имплантат, сушку, отличающийся тем, что в качестве полимера используют порошок поливинилиденфторида, в качестве смесевого растворителя используют смесь ацетона и бутилацетата, используют смесь порошков гидроксиапатита и трикальцийфосфата, обработанную в шаровой мельнице при добавлении бутилацетата, раствор поливинилиденфторида в смесевом растворителе и дисперсию смеси порошков гидроксиапатита и трикальцийфосфата гомогенизируют в шаровой мельнице, наносят пневматическим напылением на шероховатые и прогретые до температуры не более 90°C имплантаты, после чего покрытие формируют в камерной печи при температуре не менее 180°C и модифицируют в атмосфере аргона в течение не более 1 ч путем высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита, формируя слой фосфатов кальция.
2. Способ по п.1, отличающийся тем, что ацетон и бутилацетат берут в соотношении, мас.%:
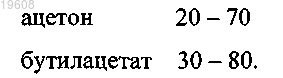
3. Способ по п.1, отличающийся тем, что порошок поливинилиденфторида и смесевой растворитель берут в соотношении, мас.%:
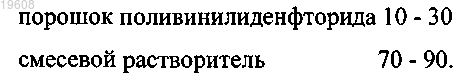
4. Способ по п.1, отличающийся тем, что порошки гидроксиапатита и трикальцийфосфата берут в соотношении, мас.%:

5. Способ по п.1, отличающийся тем, что обработку в шаровой мельнице смеси порошков гидроксиапатита и трикальцийфосфата в присутствии бутилацетата ведут при следующем соотношении компонентов, мас.%:

6. Способ по п.1, отличающийся тем, что гомогенизацию раствора поливинилиденфторида в смесевом растворителе и дисперсии гидроксиапатита трикальцийфосфата, полученной в присутствии бутилацетата, ведут в шаровой мельнице при следующем соотношении компонентов, мас.%:

Текст
СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ПОКРЫТИЯ Изобретение относится к области медицины, а именно к травматологии и ортопедии и может быть использовано для получения пористых биологически активных покрытий на металлических и керамических имплантатах. Изобретение направлено на получение биологически активного гидрофильного покрытия на металлических и керамических имплантатах. Указанный технический результат достигают тем, что в способе получения биологически активного покрытия на имплантатах из металлических и керамических материалов используют порошок поливинилиденфторида, растворенный в смеси ацетона и бутилацетата, используют смесь порошков гидроксиапатита и трикальцийфосфата, обработанных в шаровой мельнице в присутствии бутилацетата. Раствор поливинилиденфторида в смесевом растворителе и дисперсию смеси порошков гидроксиаппатита и трикальцийфосфата гомогенизируют в шаровой мельнице и наносят пневматическим напылением на шероховатые и прогретые до температуры не более 90C имплантаты. Покрытие формируют в камерной печи при температуре не менее 180C. Затем покрытие модифицируют, нанося слой фосфатов кальция в атмосфере аргона в течение не более 1 ч,путем высокочастотного магнетронного распыления мишени, изготовленной из гидроксиаппатита.(71)(73) Заявитель и патентовладелец: ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ"НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ" (ФГБОУ ВПО НИ ТПУ) (RU) Изобретение относится к области медицины, а именно к травматологии и ортопедии, и может быть использовано для получения пористых биологически активных покрытий на металлических и керамических имплантатах. Известен способ получения имплантационного материала на основе пористого политетрафторэтилена (RU 2325191 С 1, МПК A61L 27/06 (2006.01), A61L 27/14 (2006.01), A61L 27/56 (2006.01), опубл. 27.05.2008 г.), включающий подготовку поверхности основы, служащей подложкой, нанесение на подготовленную поверхность подложки поверхностного слоя покрытия, модифицированного легирующими элементами, путем магнетронного распыления одной из мишеней, выбранной из ряда металлов, включающего титан, цирконий, гафний, ниобий, тантал; карбидов указанных металлов, или композиционных керамических материалов, выбранных из группы, включающей карбид титана, содержащий 10 мас.% оксида кальция; карбид титана, содержащий 10 мас.% оксида кальция и 2 мас.% перманганата калия; карбид титана, содержащий 10 мас.% оксида циркония; карбид титана, содержащий 10 мас.% гидроксиапатита. При этом распыление одной из указанных мишеней проводят при давлении 1-210-1 Па, при температуре подложки в интервале 150-170C, в атмосфере аргона или смеси аргона с азотом, при парциальном давлении азота 14%. Полученный этим способом имплантационный материал включает основу из политетрафторэтилена пористостью 3,0-40,0% и поверхностный слой толщиной не менее 50 нм, в состав которого входят элементы упомянутых мишеней. Недостатками этого способа являются возможность формирования покрытий на имплантатах, выполненных только из пористого политетрафторэтилена, и невозможность формирования покрытия путем распыления мишеней, выполненных из гидроксиапатита с массовым содержанием более 10 мас.%. Известен способ получения биологически активного покрытия для медицинского применения [Materials Research, Vol. 10,3, 2007, p. 247-251], заключающийся в том, что получают раствор поливинилиденфторида в димитилацетамиде при температуре 100C и постоянном перемешивании, добавляют к полученному раствору порошок гидроксиапатита и перемешивают смесь до полного растворения поливинилиденфторида (без нагревания при постоянном перемешивании). Полученную дисперсию выливают в чашку Петри и высушивают в течение 4 ч при температуре 110C для удаления остатков растворителя. Таким образом, получают гибкое гомогенное покрытие, обладающее биологической активностью. Полученное покрытие обладает малым размером пор - менее 10 мкм. Его поверхностная пористость составляет менее 30%. Применяемые растворители высокотоксичны. Известен способ получения биологически активного покрытия на эндопротезах из титана и его сплавов (RU 2428207 С 1, МПК A61L 27/32 (2006.01), A61L 27/34 (2006.01), A61F 2/02 (2006.01), опубл. 10.09.2011 г.), выбранный в качестве прототипа, который заключается в том, что получают раствор полимера в органических растворителях, затем добавляют порошок гидроксиапатита, перемешивают до состоянии гомогенизации. В качестве полимера используют сополимер тетрафторэтиленом с винилиденфторидом, а качестве растворителя используют смесь ацетона с этилацетатом. Порошок гидроксиапатита предварительно обрабатывают в шаровой мельнице. Приготовленный раствор сополимера и дисперсию порошка гидроксиапатита перемешивают в шаровой мельнице, доводят полученную смесь до вязкости, при которой данную смесь наносят на металлические протезы. Покрытые смесью металлические протезы помещают в печь и формируют композитное покрытие. Полученное покрытие имеет размер пор не менее 80 мкм, поверхностную пористость до 45%. Недостатком данного способа является высокая гидрофобность поверхности покрытия. Задачей изобретения является получение биологически активного гидрофильного покрытия на металлических и керамических имплантатах. Поставленная задача решена за счет того, что способ получения биологически активного покрытия на имплантатах из металлических и керамических материалов, так же, как в прототипе, включает получение раствора полимера в смесевом растворителе, обработку в шаровой мельнице порошка, используемого для получения покрытия, перемешивание в шаровой мельнице раствора полимера и обработанного порошка до состояния гомогенизации, доведение полученной смеси до вязкости, при которой данную смесь наносят, нанесение на имплантат, сушку. Согласно изобретению в качестве полимера используют порошок поливинилиденфторида, в качестве смесевого растворителя используют смесь ацетона и бутилацетата, используют смесь порошков гидроксиапатита и трикальцийфосфата, обработанную в шаровой мельнице при добавлении бутилацетата. Раствор поливинилиденфторида в смесевом растворителе и дисперсию смеси порошков гидроксиапатита и трикальцийфосфата гомогенизируют в шаровой мельнице и наносят пневматическим напылением на шероховатые и прогретые до температуры не более 90C имплантаты, после чего покрытие формируют в камерной печи при температуре не менее 180C и модифицируют в атмосфере аргона в течение не более 1 ч путем высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита, формируя слой фосфатов кальция. Порошок поливинилиденфторида и смесевой растворитель берут в соотношении, мас.%: Обработку в шаровой мельнице смеси порошков гидроксиапатита и трикальцийфосфата в присутствии бутилацетата ведут при следующем соотношении компонентов, мас.%: Гомогенизацию раствора поливинилиденфторида в смесевом растворителе и дисперсии гидроксиапатита трикальцийфосфата, полученной в присутствии бутилацетата, ведут в шаровой мельнице при следующем соотношении компонентов, мас.%: Экспериментально установлено, что нанесение покрытия на имплантанты, прогретые до температуры более 90C, ведет к снижению эластичности покрытия и к уменьшению его прочности. Формирование покрытия при температуре более 280C вызывает термическую деструкцию поливинилиденфторида,что снижает остеоиндуктивные свойства покрытия. Модификация покрытия в атмосфере аргона путем высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита, в течение более 1 ч приводит к существенному увеличению краевого угла смачивания покрытия водой и не позволяет получить гидрофильное биологически активное покрытие. Исследования показали, что в смесевом растворителе отклонение от указанного соотношения в сторону увеличения содержания бутилацетата приводит к негативным тканевым реакциям в процессе функционирования покрытия, а увеличение содержания ацетона ведет к засорению сопла распылительной системы в процессе нанесения покрытия на имплантат. Увеличение содержания порошка поливинилиденфторида существенно увеличивает вязкость раствора полимера в смесевом растворителе, что приводит к дефектам в процессе нанесение покрытия на имплантат. Уменьшение содержания поливинилиденфторида ведет к увеличению количества наносимых слоев смеси в процессе нанесения покрытия, что увеличивает стоимость гибридного биологически активного покрытия. Отклонения в соотношении количеств порошков гидроксиапатита и трикальцийфосфата в сторону увеличения количеств гидроксиапатита приводит к снижению биологической активности гибридного покрытия, а увеличение содержания трикальцийфосфата приводит к снижению прочности фиксации имплантата с гибридным биологически активным покрытием в костной ткани. Увеличение содержания смеси порошков гидроксиапатита и трикальцийфосфата на этапе обработки порошков в шаровой мельнице в присутствии бутилацетата увеличивает время обработки порошков, а увеличение количества бутилацетата приводит к быстрому расслаиванию получаемой дисперсии смеси порошков гидроксиапатита и трикальцийфосфата. Указанное соотношение дисперсии порошков гидроксиапатита и трикальцийфосфата и раствора поливинилиденфторида в смесевом растворителе обеспечивает необходимое сочетание механических свойств биологически активного покрытия с высокими остеоиндуктивными свойствами. Большее содержание раствора поливинилиденфторида в смесевом растворителе приводит к снижению остеоиндуктивных свойств биологически активного покрытия, а увеличение содержания дисперсии порошков гидроксиапатита и трикальцийфосфата приводит к получению покрытий с низкими механическими характеристиками. Таким образом, предложенный способ позволяет получить биологически активные гидрофильные покрытия на металлических и керамических имплантантах с толщиной не менее 100 мкм, с поверхностной пористостью не менее 30%, с остеокондуктивными свойствами не менее 75%. Слой фосфатов кальция, нанесенный на покрытие в атмосфере аргона путем высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита, позволяет регулировать краевой угол смачивания покрытий водой в диапазоне от 10 до 80. На фиг. 1 представлена фотография поверхности биологически активного покрытия, сформированного на имплантанте, изготовленном из нержавеющей стали (пример 1). На фиг. 2 представлена фотография поверхности биологически активного покрытия, сформированного на имплантанте, изготовленном из циркониевой керамики (пример 2). На фиг. 3 представлена фотография поверхности биологически активного покрытия, сформированного на имплантанте, изготовленном из титана (пример 3). На фиг. 4-6 показаны фотографии препаратов, полученных в ходе эксперимента in vivo на биологически активных покрытиях, сформированных согласно примерам 1-3. На фиг. 7-9 представлены фотографии, иллюстрирующие краевой угол смачивания водой биологически активных покрытий, полученных согласно примерам 1-3, до модификации их поверхностей методом высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита. На фиг. 10-12 представлены фотографии, иллюстрирующие краевой угол смачивания водой биологически активных покрытий, полученных согласно примерам 1-3, после модификации их поверхностей методом высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита. Сущность способа демонстрируется следующими примерами. Пример 1. Имплантаты, изготовленные из нержавеющей стали перед нанесением покрытия, готовят следующим образом: подвергают пескоструйной обработке корундом с размером зерен не более 50 мкм до получения однородной матовой поверхности; обезжиривают в растворе моющего средства "Прогресс" или в растворе другого аналогичного по моющей способности средства; промывают водой с температурой 60C, затем водой с температурой 20C; протравливают в водном растворе кислот, мас.%: при температуре 40C в течение 10 мин; промывают водой с температурой 60C, затем водой с температурой 20C; нейтрализуют в водном растворе едкого натра с массовой долей 2% в течение 10 мин при комнатной температуре; промывают в воде с температурой 60C, затем в воде с температурой 20C; высушивают при температуре 80C в течение 15 мин. Качество подготовки поверхности определяют с помощью теста на смачиваемость: на изделие,предварительно подготовленное по вышеописанной методике, наливают 10-15 см 3 дистиллированной воды. Вода должна полностью смочить поверхность имплантанта. Готовят смесевой растворитель путем перемешивания ацетона и бутилацетата в стеклянной таре с притертой крышкой при следующем содержании компонентов, мас.%: Этот смесевой растворитель выдерживают при комнатной температуре не менее 2 ч. К полученному смесевому растворителю добавляют порошок поливинилиденфторида при следующем содержании компонентов, мас.%: Смесь плотно закрывают крышкой и нагревают при постоянном перемешивании при помощи магнитной мешалки до температуры 90C в течение не менее 2 ч. После этого смесь охлаждают до комнатной температуры. Получают однородную прозрачную жидкость с вязкостью по вязкозиметру Вз-3 в пределах 30-40 с. Порошок гидроксиапатита и порошок трикальцийфосфата просеивают через сито с размером ячеек 45 мкм. Смесь порошков гидроксиапатита и трикальцийфосфата готовят путем смешивания порошков при следующем содержании компонентов, мас.%: Эту смесь закладывают в шаровую мельницу, добавляют бутилацетат при следующем содержании компонентов, мас.%: и перемешивают при комнатной температуре в течение 5 ч до получения однородной белой дисперсии. Затем в шаровую мельницу закладывают полученную дисперсию и раствор поливинилиденфторида и смешивают при комнатной температуре в течение 4 ч. Нанесение полученной смеси осуществляют с помощью пневматических распылителей на прогретые до температуры 90C имплантанты. Диаметр распылительной головки составляет 1-1,5 мм, давление воздуха при распылении 1,5-2 атм. Расстояние до окрашиваемой поверхности составляет 30-50 см. Нанесение смеси производят в один слой сверху вниз с перекрытием последующих полос таким образом, чтобы обеспечить одинаковую толщину покрытия в пределах 150 мкм. На покрытом изделии не должно быть потеков, разнотолщений, просветов подложки и т.п. Изделие с нанесенной смесью загружают в камерную печь, где формируют покрытие по следующим температурным режимам. 1. Сушка при температуре 30C в течение 5 ч. 2. Подъем температуры до 100C со скоростью 1C/мин. 3. Выдержка при температуре 100C в течение 5 ч. 4. Подъем температуры до 180C со скоростью 2C/мин. 5. Выдержка при температуре 180C в течение 1 ч. Для придания покрытию гидрофильных свойств осуществляют модификацию его поверхности путем нанесения тонкого слоя фосфатов кальция на промышленной установке Катод-1 М магнетронным распылением твердотельной мишени, изготовленной из гидроксиапатита. Расстояние между мишенью и подложкодержателем составляет не менее 20 мм, что позволяет формировать однородный по толщине слой. В качестве рабочего газа при распылении мишени используют аргон. Предварительное давление газовой смеси в распылительной камере составляет 510-5 Па. Удельная высокочастотная мощность не менее 5 Вт/см 2. Время модификации покрытия составляет 1 ч. После модификации покрытия имплантанты упаковывают в полиэтиленовые пакеты и стерилизуют перед применением в автоклаве при температуре 120C в течение 30 мин. Пример 2. Имплантаты, изготовленные из циркониевой керамики, стабилизированной иттрием, перед нанесением биологически активного покрытия готовят следующим образом: подвергают пескоструйной обработке корундом с размером зерен не более 40 мкм до получения однородной матовой поверхности; обезжиривают в диэтиловом эфире; промывают водой с температурой 60C, затем водой с температурой 20C; высушивают при температуре 80C в течение 15 мин. Качество подготовленной поверхности определяют с помощью теста на смачиваемость: на изделие,предварительно подготовленное по вышеописанной методике, наливают 10-15 см 3 дистиллированной воды. Вода должна полностью смочить поверхность имплантанта. Готовят смесевой растворитель путем перемешивания ацетона и бутилацетата в стеклянной таре с притертой крышкой при следующем содержании компонентов, мас.%: Этот смесевой растворитель выдерживают при комнатной температуре не менее 2 ч. К полученному смесевому растворителю добавляют порошок поливинилиденфторида при следующем содержании компонентов, мас.%: Смесь плотно закрывают крышкой и нагревают при постоянном перемешивании до температуры 90C в течение не менее 2 ч. После этого смесь охлаждают до комнатной температуры. Получают однородную прозрачную жидкость с вязкостью по вязкозиметру Вз-3 в пределах 20-30 с. Порошок гидроксиапатита и порошок трикальцийфосфата просеивают через сито с размером ячеек 60 мкм. Смесь порошков гидроксиапатита и трикальцийфосфата готовят путем их смешивания при следующем содержании компонентов, мас.%: Эту смесь закладывают в шаровую мельницу, добавляют бутилацетат при следующем содержании компонентов, мас.%: и перемешивают при комнатной температуре в течение 5 ч до получения однородной белой дисперсии. Затем в шаровую мельницу закладывают полученную дисперсию и раствор поливинилиденфторида в смесевом растворителе в следующих пропорциях, мас.%: и смешивают при комнатной температуре в течение не менее 4 ч. Нанесение полученной смеси осуществляют с помощью пневматических распылителей на прогретые до температуры 80 С имплантанты. Диаметр распылительной головки составляет 1-1,5 мм, давление воздуха при распылении 1,5-2 атм. Расстояние до окрашиваемой поверхности составляет 30-50 см. Нанесение смеси производят в один слой сверху вниз с перекрытием последующих полос таким образом, чтобы обеспечить одинаковую толщину покрытия в пределах 150 мкм. На покрытом изделии не должно быть потеков, разнотолщений, просветов подложки и т.п. Изделие с нанесенной смесью загружают в камерную печь, где формируют покрытие по следующим температурным режимам. 1. Сушка при температуре 30C в течение 5 ч. 2. Подъем температуры до 100C со скоростью 1C/мин. 3. Выдержка при температуре 100C в течение 5 ч. 4. Подъем температуры до 210C со скоростью 2C/мин. 5. Выдержка при температуре 210C в течение 1 ч. Для придания покрытию гидрофильных свойств осуществляют модификацию его поверхности путем нанесения тонкого слоя фосфатов кальция на промышленной установке Катод-1 М магнетронным распылением твердотельной мишени, изготовленной из гидроксиапатита. Расстояние между мишенью и подложкодержателем составляет не менее 20 мм, что позволяет формировать однородный по толщине слой. В качестве рабочего газа при распылении мишени используют аргон. Предварительное давление газовой смеси в распылительной камере составляет 510-5 Па. Удельная высокочастотная мощность не менее 5 Вт/см 2. Время модификации покрытия составляет 30 мин. После модификации покрытия имплантанты упаковывают в полиэтиленовые пакеты и стерилизуют перед применением в автоклаве при температуре 120C в течение 30 мин. Пример 3. Имплантаты, изготовленные из титана и его сплавов, перед нанесением композиций готовят следующим образом: подвергают пескоструйной обработке корундом с размером зерен не более 50 мкм до получения однородной матовой поверхности; обезжиривают в растворе моющего средства "Прогресс" или в растворе другого аналогичного по моющей способности средства; промывают водой с температурой 60C, затем водой с температурой 20C; протравливают в водном растворе кислотмас.%: при температуре 40C в течение 3 мин; промывают водой с температурой 60C, затем водой с температурой 20C; нейтрализуют в водном растворе едкого натра с массовой долей 2% в течение 10 мин при комнатной температуре; промывают в воде с температурой 60C, затем водой с температурой 20C; высушивают при температуре 80C в течение 15 мин. Качество подготовленной поверхности определяют с помощью теста на смачиваемость: на изделие,предварительно подготовленное по вышеописанной методике, наливают 10-15 см 3 дистиллированной воды. Вода должна полностью смочить поверхность имплантанта. Готовят смесевой растворитель путем перемешивания ацетона и бутилацетата в стеклянной таре с притертой крышкой при следующем содержании компонентов, мас.%: Этот смесевой растворитель выдерживают при комнатной температуре не менее 2 ч. К полученному смесевому растворителю добавляют порошок поливинилиденфторида при следующем содержании компонентов, мас.%: Смесь плотно закрывают крышкой и нагревают при постоянном перемешивании до температуры 90C в течение не менее 2 ч. После этого смесь охлаждают до комнатной температуры. Получают однородную прозрачную жидкость с вязкостью по вязкозиметру Вз-3 в пределах 15-25 с. Порошок гидроксиапатита и порошок трикальцийфосфата просеивают через сито с размером ячеек 70 мкм. Смесь порошков гидроксиапатита и трикальцийфосфата готовят путем смешивания порошков при следующем содержании компонентов, мас.%: Эту смесь закладывают в шаровую мельницу, добавляют бутилацетат при следующем содержании компонентов, мас.%: и перемешивают при комнатной температуре в течение 5 ч до получения однородной белой дисперсии. Затем в шаровую мельницу закладывают полученную дисперсию и раствор поливинилиденфторида в смесевом растворителе в следующих пропорциях, мас.%: и смешивают при комнатной температуре в течение не менее 4 ч. Нанесение полученной смеси осуществляют с помощью пневматических распылителей на прогретые до температуры 85 С имплантанты. Диаметр распылительной головки составляет 1-1,5 мм, давление воздуха при распылении 1,5-2 атм. Расстояние до окрашиваемой поверхности составляет 30-50 см. Нанесение смеси производят в один слой сверху вниз с перекрытием последующих полос таким образом, чтобы обеспечить одинаковую толщину покрытия в пределах 150 мкм. На покрытом изделии не должно быть потеков, разнотолщений, просветов подложки и т.п. Изделие с нанесенной смесью загружают в камерную печь, где формируют покрытие по следующим температурным режимам. 1. Сушка при температуре 30C в течение 5 ч. 2. Подъем температуры до 100C со скоростью 1C/мин. 3. Выдержка при температуре 100C в течение 5 ч. 4. Подъем температуры до 200C со скоростью 2C/мин. 5. Выдержка при температуре 200C в течение 1 ч. Для придания покрытию гидрофильных свойств осуществляют модификацию его поверхности путем нанесения тонкого слоя фосфатов кальция на промышленной установке Катод-1 М магнетронным распылением твердотельной мишени, изготовленной из гидроксиапатита. Расстояние между мишенью и подложкодержателем составляет не менее 20 мм, что позволяет формировать однородный по толщине слой. В качестве рабочего газа при распылении мишени используют аргон. Предварительное давление газовой смеси в распылительной камере составляет 510-5 Па. Удельная высокочастотная мощность не менее 5 Вт/см 2. Время модификации покрытия составляет 20 мин. После модификации изделия с композитным покрытием упаковывают в полиэтиленовые пакеты и стерилизуют перед применением в автоклаве при температуре 120C в течение 30 мин. Исследование поверхностной пористости полученных биологически активных покрытий осуществляли методом сканирующей электронной микроскопии. Для обеспечения стекания заряда с покрытия на поверхность сформированного биологически активного покрытия наносили слой углерода. Представленные на фиг. 1-3 фотографии поверхностей биологически активных покрытий демонстрируют микроструктуру биологически активного покрытия как многоуровневую пористую систему, в которой частицы порошков гидроксиапатита и трикальцийфосфата связаны между собой поливинилиденфторидом. Размер макропор этих биологически активных покрытий составляет 80-100 мкм. В этих покрытиях присутствует значительное количество микропор и капилляров с размерами менее 20 мкм. Результаты компьютерной морфометрии изображений поверхностей биологически активных покрытий позволяют сделать вывод о том, что их поверхностная пористость составляет не менее 30%. В целом, структура биологически активных покрытий сформированных по примерам 1-3 схожа со структурой губчатой костной ткани,что является мощным фактором, способствующим прорастанию костной ткани в поры биологически активного покрытия. Исследования интеграции покрытия с костной тканью in vivo проводили на 10 мышах обоего пола линии Balb/c массой 18-21 г. Мышам подкожно имплантировали диски, диаметром 10 мм, с нанесенны-6 019608 ми покрытиями по примерам 1-3. Перед имплантацией на биологически активное покрытие предварительно наносили столбик костного мозга, извлеченный из бедренной кости подопытных животных. Через 45 суток животных выводили из эксперимента передозировкой эфирного наркоза. Диски извлекали, декальцинировали и подвергали гистологическому анализу. На гистологических срезах (фиг. 4-6) определяется костная ткань и костномозговые полости, заполненные красным костным мозгом, а также наблюдается врастание кости в поры биологически активного покрытия (ingrowth). Процесс интеграции биологически активного покрытия с костной тканью идет посредством образования структур типа "композиткостная ткань", что обеспечивает увеличение жесткости фиксации имплантатов с покрытием. Для измерения краевого угла смачивания водой поверхности образцов биологически активных покрытий, полученных согласно примерам 1-3, использовался метод "сидячей капли". Определение краевого угла смачивания проводилось с помощью системы анализа формы капли "EasyDrop". Для того чтобы установить баланс включенных сил, значения краевого угла снимались в течение 20 с после осаждения капли на поверхности образцов. Поскольку точные измерения краевого угла смачиванияповерхности могут быть проведены только на образцах имеющих однородную поверхность с низкой шероховатостью,для исследования краевого угла смачивания образцы биологически активного покрытия прессовались в виде пластин размером 2020 мм. На фиг. 7-9 приведены фотографии капли воды, помешенной на поверхность биологически активных покрытий, полученных по примерам 1-3, до модификации поверхности покрытий. Значения краевого угла смачивания поверхности биологически активных покрытий до модификации составило в среднем 95,5, что свидетельствует о высокой гидрофобности полученных покрытий. На фиг. 9, 10 представлены фотографии капли воды, помещенной на поверхность биологически активных покрытий для определения угла смачивания покрытия водой после модификации поверхности методом высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита. Средние значения краевого угла смачивания этих биологически активных покрытий после модификации поверхности методом высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита, составило менее 10, что свидетельствует об их гидрофильности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения биологически активного покрытия на имплантатах из металлических и керамических материалов, включающий получение раствора полимера в смесевом растворителе, обработку в шаровой мельнице порошка, используемого для получения покрытия, перемешивание в шаровой мельнице раствора полимера и обработанного порошка до состояния гомогенизации, доведение полученной смеси до вязкости, при которой данную смесь наносят, нанесение на имплантат, сушку, отличающийся тем, что в качестве полимера используют порошок поливинилиденфторида, в качестве смесевого растворителя используют смесь ацетона и бутилацетата, используют смесь порошков гидроксиапатита и трикальцийфосфата, обработанную в шаровой мельнице при добавлении бутилацетата, раствор поливинилиденфторида в смесевом растворителе и дисперсию смеси порошков гидроксиапатита и трикальцийфосфата гомогенизируют в шаровой мельнице, наносят пневматическим напылением на шероховатые и прогретые до температуры не более 90C имплантаты, после чего покрытие формируют в камерной печи при температуре не менее 180C и модифицируют в атмосфере аргона в течение не более 1 ч путем высокочастотного магнетронного распыления мишени, изготовленной из гидроксиапатита, формируя слой фосфатов кальция. 2. Способ по п.1, отличающийся тем, что ацетон и бутилацетат берут в соотношении, мас.%: 3. Способ по п.1, отличающийся тем, что порошок поливинилиденфторида и смесевой растворитель берут в соотношении, мас.%: 4. Способ по п.1, отличающийся тем, что порошки гидроксиапатита и трикальцийфосфата берут в соотношении, мас.%: 5. Способ по п.1, отличающийся тем, что обработку в шаровой мельнице смеси порошков гидроксиапатита и трикальцийфосфата в присутствии бутилацетата ведут при следующем соотношении компонентов, мас.%: 6. Способ по п.1, отличающийся тем, что гомогенизацию раствора поливинилиденфторида в смесе-7 019608 вом растворителе и дисперсии гидроксиапатита трикальцийфосфата, полученной в присутствии бутилацетата, ведут в шаровой мельнице при следующем соотношении компонентов, мас.%:
МПК / Метки
МПК: A61L 27/32, A61L 27/34, A61F 2/02
Метки: способ, активного, получения, биологически, покрытия
Код ссылки
<a href="https://eas.patents.su/11-19608-sposob-polucheniya-biologicheski-aktivnogo-pokrytiya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения биологически активного покрытия</a>
Предыдущий патент: Колосник для пламенной печи и способ изготовления колосника
Следующий патент: Автоинжектор с возможностью наполнения
Случайный патент: Фунгицидные смеси












