Новая кристаллическая форма 17α-ацетокси-21-метокси-11β-[4-n,n-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона и способ ее получения
Номер патента: 19114
Опубликовано: 30.01.2014
Авторы: Деметер Адам, Чёргей Янош, Балаж Аттила, Санта Чаба
Формула / Реферат
1. Кристаллическая безводная форма II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона, характеризующаяся одним или несколькими свойствами:
a) имеет типичные рефлексы в рентгеновской порошковой дифрактограмме приблизительно при 6,8, 11,0, 11,6, 14,9, 19,1±0,2° 2θ;
b) имеет типичные полосы поглощения в Фурье-рамановском адсорбционном спектре приблизительно при 3054, 2963, 2850, 1604, 1195, 1159±4 см-1;
c) имеет типичные пики в 13С ЯМР спектре в твердом состоянии при приблизительно 196,7, 172,4, 169,3, 20,7, 20,1, 17,7±0,1 м.д.
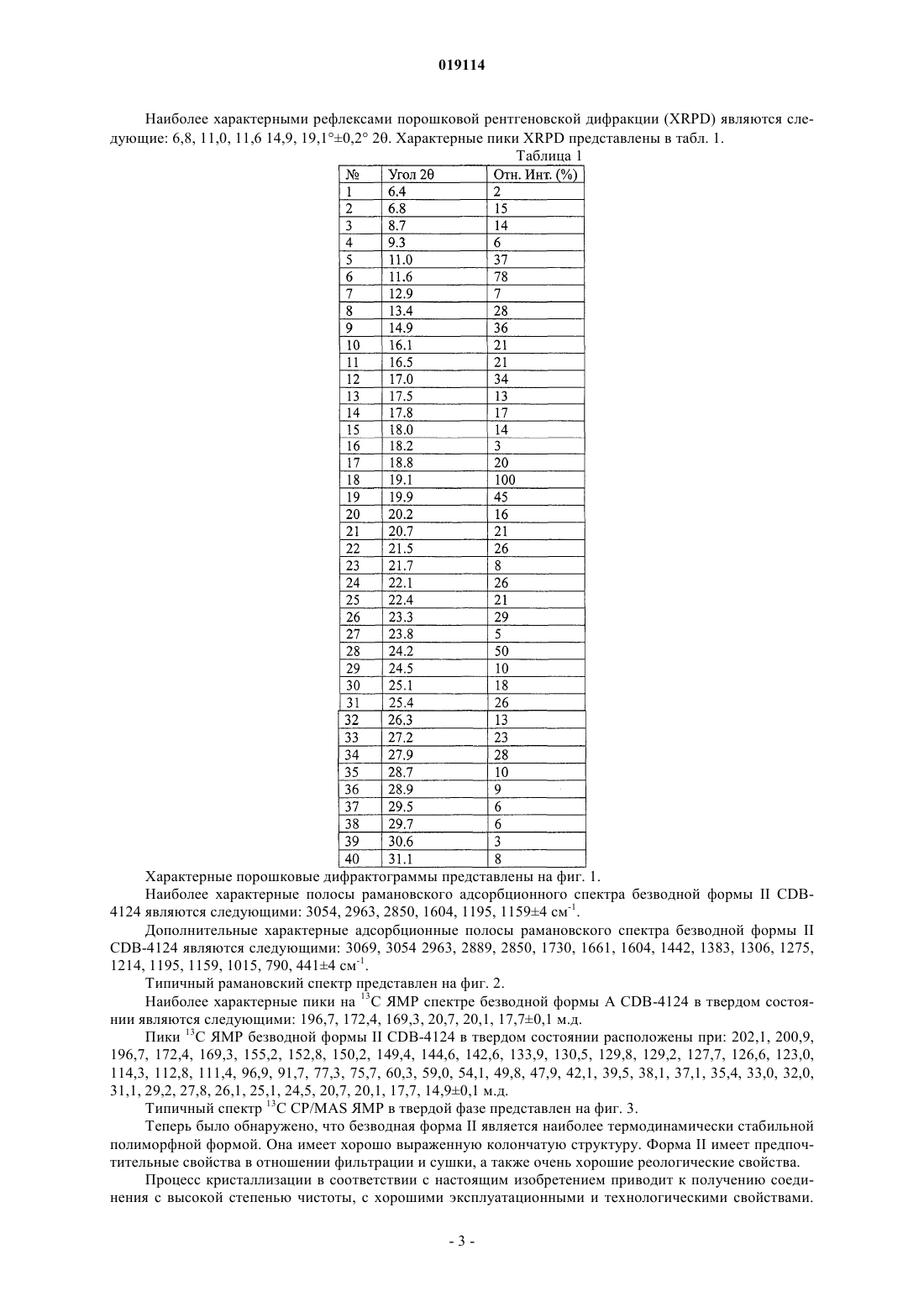
2. Кристаллическая безводная форма II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по п.1, характеризующаяся рентгеновской порошковой дифрактограммой, по существу, соответствующей дифрактограмме, представленной на фиг. 1.
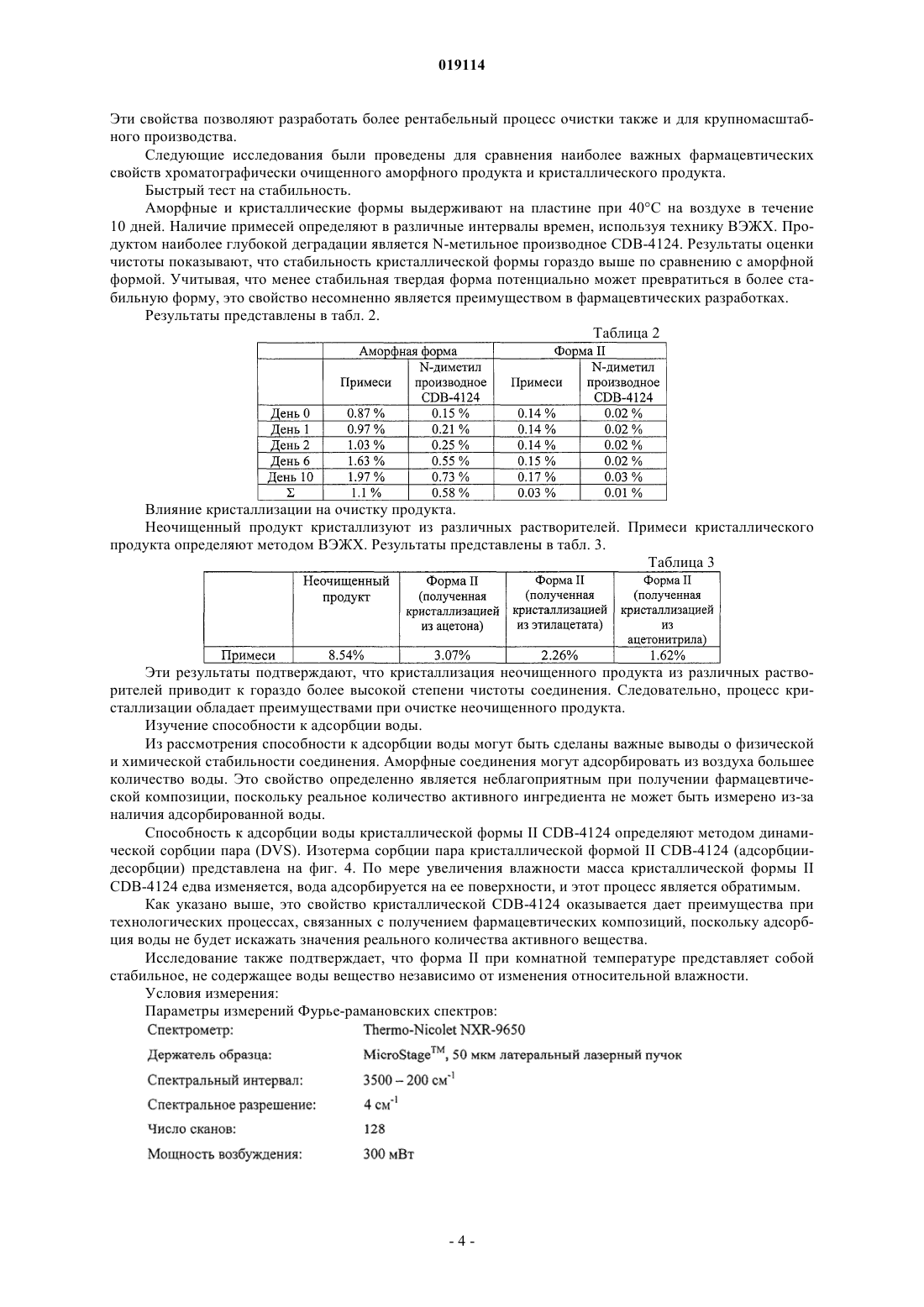
3. Кристаллическая безводная форма II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по п.1, характеризующаяся Фурье-рамановским спектром, по существу, соответствующим спектру, представленному на фиг. 2.
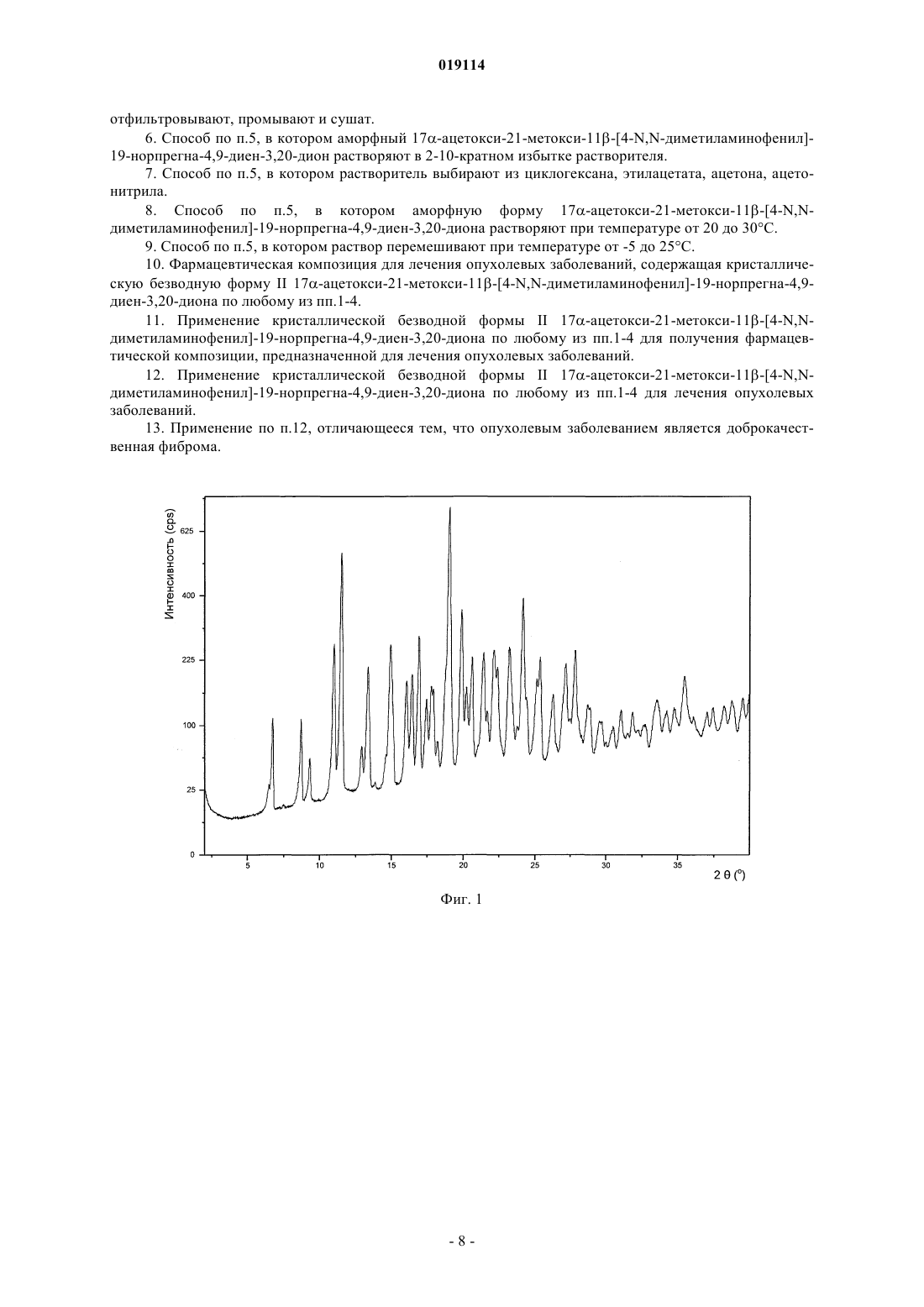
4. Кристаллическая безводная форма II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по п.1, характеризующаяся 13С ЯМР спектром в твердом состоянии, по существу, соответствующим спектру, представленному на фиг. 3.
5. Способ получения кристаллической безводной формы II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по п.1, в котором аморфный 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-дион растворяют при температуре от 0 до 40°С в 1-50-кратном избытке растворителей, выбранных из сложных эфиров С1-С4-спиртов и карбоновых кислот, кетонов, циклогексана, ацетонитрила, диметилформамида, диметилсульфоксида, воды и любых их смесей, затем раствор перемешивают при температуре от -20 до 40°С и выпавшие кристаллы отфильтровывают, промывают и сушат.
6. Способ по п.5, в котором аморфный 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-дион растворяют в 2-10-кратном избытке растворителя.
7. Способ по п.5, в котором растворитель выбирают из циклогексана, этилацетата, ацетона, ацетонитрила.
8. Способ по п.5, в котором аморфную форму 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона растворяют при температуре от 20 до 30°С.
9. Способ по п.5, в котором раствор перемешивают при температуре от -5 до 25°С.
10. Фармацевтическая композиция для лечения опухолевых заболеваний, содержащая кристаллическую безводную форму II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по любому из пп.1-4.
11. Применение кристаллической безводной формы II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по любому из пп.1-4 для получения фармацевтической композиции, предназначенной для лечения опухолевых заболеваний.
12. Применение кристаллической безводной формы II 17α-ацетокси-21-метокси-11β-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по любому из пп.1-4 для лечения опухолевых заболеваний.
13. Применение по п.12, отличающееся тем, что опухолевым заболеванием является доброкачественная фиброма.
Текст
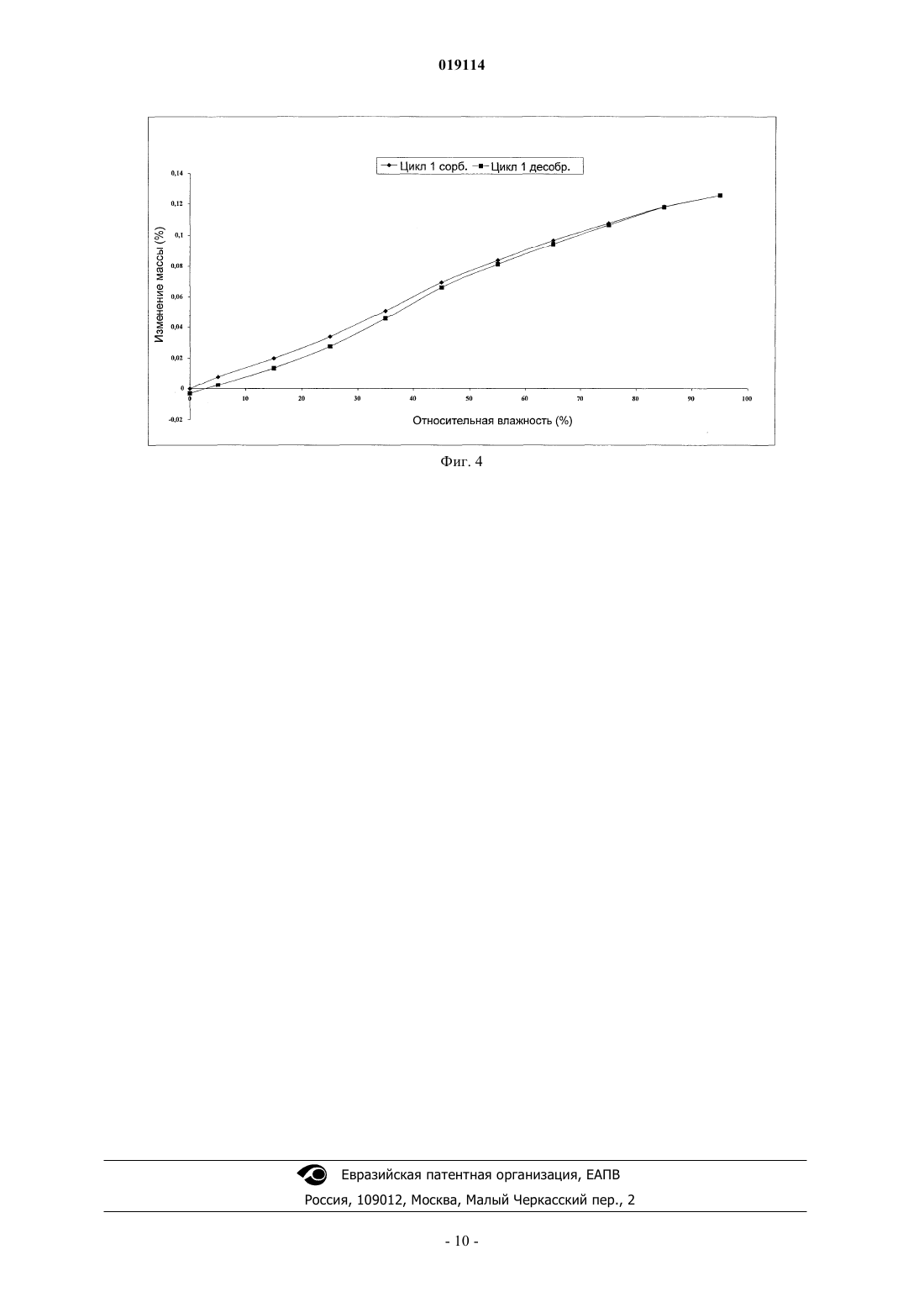
НОВАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА 17-АЦЕТОКСИ-21-МЕТОКСИ-11-[4-N,NДИМЕТИЛАМИНОФЕНИЛ]-19-НОРПРЕГНА-4,9-ДИЕН-3,20-ДИОНА И СПОСОБ Е ПОЛУЧЕНИЯ Настоящее изобретение относится к новой кристаллической форме II 17-ацетокси-21 метокси-11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона (также известного как CDB-4124), способам е получения и содержащей е фармацевтической композиции. ФормаII может быть получена кристаллизацией из различных сред, например из сложных эфиров С 1-С 4-спиртов и карбоновых кислот, кетонов, циклогексана, ацетонитрила, диметилформамида,диметилсульфоксида, воды и их смесей. Область техники, к которой относится изобретение Настоящее изобретение относится к новой кристаллической форме II 17-ацетокси-21-метокси 11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона (также известного как CDB-4124),способу ее получения и содержащей ее фармацевтической композиции. Уровень техники 17-Ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-дион является селективным модулятором рецептора прогестерона, он был протестирован для лечения прогестерончувствительной миомы. В международной заявке на патент WO 97/41145 впервые раскрыто получение 17-ацетокси-21 метокси-11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона. В примере 9 он характеризуется как светло-желтый порошок с температурой плавления, равной 116 С (чистота: 98,06%, характерные полосы поглощения в ИК-Фурье-спектроскопии: 1124, 1235, 1370, 1446, 1518, 1612, 1663, 1734, 2940 см-1). В соответствии с опубликованными международными заявками на патент WO 01/47945 иWO 01/74840 полученный 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9 диен-3,20-дион представляет собой светло-желтый порошок и также имеет температуру плавления, равную 116 С (чистота: 98,87, 98,06%, характерные полосы поглощения в ИК-Фурье-спектроскопии 1124,1235, 1370, 1446, 1518, 1612, 1662, 1734, 2940 см-1). Конечные продукты из вышеупомянутых документов получены при помощи дорогостоящих способов очистки. Сначала неочищенный продукт очищают хроматографией, а затем после упаривания полученную пену обрабатывают на ультразвуковом очистителе. В международной заявке на патент WO 2009/001148 раскрыт другой способ получения, в котором конечный продукт получают хроматографической очисткой и выпариванием (примеси: 0,5%, температура плавления: 118 С, характеристики твердой фазы определены аналитическими способами, представленными на фиг. 1-4). Используя известные в литературе способы получения, авторы настоящего изобретения показали,что продукты не способны спонтанно кристаллизоваться. Очистка технического продукта является дорогостоящей, трудоемкой и недостаточно эффективной процедурой. Поскольку продукт не может быть закристаллизован, что обеспечило бы наиболее эффективный метод очистки, должны быть использованы более трудоемкие и дорогие способы очистки (например, хроматографическая очистка). Аморфный продукт имеет малый размер зерен, благодаря чему их фильтрование является достаточно трудоемким. С одной стороны, недостаточная химическая стабильность аморфной формы затрудняет сушку и хранение продукта, а с другой стороны, размер зерен и электростатические свойства этой формы затрудняет измельчение, упаковку, отбор проб и т.д. Следует подчеркнуть, что фармацевтическая ценность соединения зависит от чистоты конечного продукта. Для разработки воспроизводимого крупномасштабного производства очень важно получать продукт, который можно легко фильтровать и сушить. С этой точки зрения важно, чтобы продукт оставался стабильным в течение долгого времени без использования каких-либо специальных условий хранения. С фармацевтической точки зрения использование аморфного продукта, полученного при помощи вышеописанных процедур, неэкономично и очень трудоемко. Таким образом, необходимо разработать способ получения чистого кристаллического продукта, поскольку, с одной стороны, это обеспечит нужные фармацевтические свойства, а с другой стороны, существенно снизит стоимость способа очистки. Венгерская заявка на патент Р 090171 раскрывает получение кристаллической формы A CDB-4124. Конечный продукт получают хроматографической очисткой аморфного CDB-4124, за которой следует кристаллизация. Температура плавления продукта равна 166-168 С. Твердофазные характеристики безводной формы А определяют ИК и рамановской спектроскопией, рентгеновской порошковой дифрактометрией и 13 С ЯМР в твердом состоянии. Кристаллическая форма однозначно является более предпочтительной в сравнении с аморфной формой благодаря ее лучшей химической и физической стабильности. В связи с фармацевтической ценностью данного соединения его получение с высокой степенью чистоты представляет первостепенный интерес. Также важно научиться синтезировать это соединение таким способом, который может быть легко перенесен на промышленные масштабы, особенно при полу-1 019114 чении соединения в форме, которая легко поддается быстрому фильтрованию и сушке. С вышеописанной технологической точки зрения и с точки зрения качества продукта некоторые полиморфы, полученные путем специальных синтетических методик, обеспечивают уникальную возможность удовлетворить этим требованиям. Следовательно, существует фармацевтическая необходимость нахождения подходящих полиморфов и способы кристаллизации, которые выгодным образом дают соединение с превосходной степенью чистоты, способное к быстрой фильтрации и сушке в промышленных масштабах. Кроме того, важным требованием является продолжительная хорошая стабильность, не требующая специальных условий хранения. Как известно, менее стабильная полиморфная форма соединения может превращаться в его более стабильную форму. Поэтому, чтобы избежать полиморфного превращения, необходимо найти наиболее стабильную полиморфную форму, поскольку трансформация активного ингредиента может изменить кривую растворения и биодоступность фармацевтической композиции. Известно несколько примеров, когда продаваемые лекарственные соединения временно изымались с рынка из-за полиморфного превращения активного ингредиента. Для того чтобы их вновь вывести на рынок, необходимо провести дополнительную работу по усовершенствованию, что требует значительных затрат. И теперь было показано, что более стабильная кристаллическая форма 17-ацетокси-21-метокси 11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона может быть получена. Сущность изобретения Настоящее изобретение относится к химически и физически стабильной кристаллической формеCDB-4124, к способам ее получения и к содержащей ее фармацевтической композиции. Перечень фигур Фиг. 1: порошковая рентгенограмма безводной кристаллической формы II CDB-4124. Фиг. 2: ФТ-рамановский спектр безводной кристаллической формы II CDB-4124. Фиг. 3: 13 С CP/MAS ЯМР в твердом состоянии безводной кристаллической формы II CDB-4124. Фиг. 4: изотерма сорбции паров воды безводной кристаллической формой II CDB-4124. Осуществление изобретения Настоящее изобретение относится к химически и физически стабильной кристаллической форме IICDB-4124 и к ее получению. Согласно уровню техники эта форма является термодинамически наиболее стабильной полиморфной формой. При кристаллизации CDB-4124 из различных сред авторы изобретения с удивлением обнаружили,что может быть получена новая кристаллическая форма. Кристаллическая форма II CDB-4124 является более стабильной, чем уже известные полиморфы CDB-4124 (аморфная форма, кристаллическая формаI), и имеет более высокую температуру плавления. Температура плавления высокоочищенной кристаллической формы II CDB-4124 равна 201-204 С, что существенно выше, чем температура плавления кристаллической формы I (166-168 С). Форма II может быть получена кристаллизацией из различных сред, например из сложных эфиров С 1-С 4-спиртов и карбоновых кислот, кетонов, циклогексана, ацетонитрила, диметилформамида, диметилсульфоксида, воды и их смесей. В соответствии с настоящим изобретением было показано, что безводная форма II CDB-4124 может быть получена следующим образом: растворяют основное вещество при температуре от 0 до 40 С (предпочтительно при комнатной температуре) в 1-50-кратном избытке растворителя (предпочтительно в 210-кратном избытке), выбранного из сложных эфиров С 1-С 4-спиртов и карбоновых кислот, кетонов, циклогексана, ацетонитрила, диметилформамида, диметилсульфоксида, воды и их смесей. Концентрацию раствора, необходимую для кристаллизации, можно контролировать путем испарения. Кристаллизацию проводят при температуре от -20 до 40 С, предпочтительно от -5 до 25 С. Для начала или ускорения кристаллизации в раствор можно добавить кристалл затравки. Кристаллическая форма II может быть также получена растворением кристаллической формы I или аморфной формы CDB-4124 в 2-10-кратном избытке любого из вышеназванных смешивающихся с водой растворителей в диапазоне температур 0-40 С и последующим осаждением продукта с 20-100-кратным избытком воды. После фильтрования выпавших кристаллов продукт сушат для удаления растворителей. Форма I является монотропной модификацией CDB-4124, также как форма II. Кристаллическая форма II является термодинамически более стабильной при любой температуре. Это подтверждается ее более высокой температурой плавления и худшей растворимостью при 25 С в различных растворителях(МеОН: 500 мг/мл форма I, 23 мг/мл форма II). Кроме того, форма I может быть трансформирована в форму II посредством кристаллизации из различных сред. Кристаллическая форма II CDB-4124 пригодна для получения различных фармацевтических лекарственных форм, предпочтительно таблеток и капсул, с фармацевтически приемлемыми ингредиентами. Характеристики безводной формы II CDB-4124 в твердой фазе, определенные соответствующими аналитическими методами, приведены ниже. Наиболее характерными рефлексами порошковой рентгеновской дифракции (XRPD) являются следующие: 6,8, 11,0, 11,6 14,9, 19,10,2 2. Характерные пики XRPD представлены в табл. 1. Таблица 1 Характерные порошковые дифрактограммы представлены на фиг. 1. Наиболее характерные полосы рамановского адсорбционного спектра безводной формы II CDB4124 являются следующими: 3054, 2963, 2850, 1604, 1195, 11594 см-1. Дополнительные характерные адсорбционные полосы рамановского спектра безводной формы IICDB-4124 являются следующими: 3069, 3054 2963, 2889, 2850, 1730, 1661, 1604, 1442, 1383, 1306, 1275,1214, 1195, 1159, 1015, 790, 4414 см-1. Типичный рамановский спектр представлен на фиг. 2. Наиболее характерные пики на 13 С ЯМР спектре безводной формы A CDB-4124 в твердом состоянии являются следующими: 196,7, 172,4, 169,3, 20,7, 20,1, 17,70,1 м.д. Пики 13 С ЯМР безводной формы II CDB-4124 в твердом состоянии расположены при: 202,1, 200,9,196,7, 172,4, 169,3, 155,2, 152,8, 150,2, 149,4, 144,6, 142,6, 133,9, 130,5, 129,8, 129,2, 127,7, 126,6, 123,0,114,3, 112,8, 111,4, 96,9, 91,7, 77,3, 75,7, 60,3, 59,0, 54,1, 49,8, 47,9, 42,1, 39,5, 38,1, 37,1, 35,4, 33,0, 32,0,31,1, 29,2, 27,8, 26,1, 25,1, 24,5, 20,7, 20,1, 17,7, 14,90,1 м.д. Типичный спектр 13 С CP/MAS ЯМР в твердой фазе представлен на фиг. 3. Теперь было обнаружено, что безводная форма II является наиболее термодинамически стабильной полиморфной формой. Она имеет хорошо выраженную колончатую структуру. Форма II имеет предпочтительные свойства в отношении фильтрации и сушки, а также очень хорошие реологические свойства. Процесс кристаллизации в соответствии с настоящим изобретением приводит к получению соединения с высокой степенью чистоты, с хорошими эксплуатационными и технологическими свойствами. Эти свойства позволяют разработать более рентабельный процесс очистки также и для крупномасштабного производства. Следующие исследования были проведены для сравнения наиболее важных фармацевтических свойств хроматографически очищенного аморфного продукта и кристаллического продукта. Быстрый тест на стабильность. Аморфные и кристаллические формы выдерживают на пластине при 40 С на воздухе в течение 10 дней. Наличие примесей определяют в различные интервалы времен, используя технику ВЭЖХ. Продуктом наиболее глубокой деградации является N-метильное производное CDB-4124. Результаты оценки чистоты показывают, что стабильность кристаллической формы гораздо выше по сравнению с аморфной формой. Учитывая, что менее стабильная твердая форма потенциально может превратиться в более стабильную форму, это свойство несомненно является преимуществом в фармацевтических разработках. Результаты представлены в табл. 2. Таблица 2 Влияние кристаллизации на очистку продукта. Неочищенный продукт кристаллизуют из различных растворителей. Примеси кристаллического продукта определяют методом ВЭЖХ. Результаты представлены в табл. 3. Таблица 3 Эти результаты подтверждают, что кристаллизация неочищенного продукта из различных растворителей приводит к гораздо более высокой степени чистоты соединения. Следовательно, процесс кристаллизации обладает преимуществами при очистке неочищенного продукта. Изучение способности к адсорбции воды. Из рассмотрения способности к адсорбции воды могут быть сделаны важные выводы о физической и химической стабильности соединения. Аморфные соединения могут адсорбировать из воздуха большее количество воды. Это свойство определенно является неблагоприятным при получении фармацевтической композиции, поскольку реальное количество активного ингредиента не может быть измерено из-за наличия адсорбированной воды. Способность к адсорбции воды кристаллической формы II CDB-4124 определяют методом динамической сорбции пара (DVS). Изотерма сорбции пара кристаллической формой II CDB-4124 (адсорбциидесорбции) представлена на фиг. 4. По мере увеличения влажности масса кристаллической формы IICDB-4124 едва изменяется, вода адсорбируется на ее поверхности, и этот процесс является обратимым. Как указано выше, это свойство кристаллической CDB-4124 оказывается дает преимущества при технологических процессах, связанных с получением фармацевтических композиций, поскольку адсорбция воды не будет искажать значения реального количества активного вещества. Исследование также подтверждает, что форма II при комнатной температуре представляет собой стабильное, не содержащее воды вещество независимо от изменения относительной влажности. Условия измерения: Параметры измерений Фурье-рамановских спектров: Параметры измерений порошковой рентгеновской дифракции: Примеры Следующие примеры только иллюстрируют настоящее изобретение, и их не следует рассматривать как ограничивающие объем притязаний изобретения любым способом, поскольку специалистам в данной области техники при чтении описания настоящего изобретения становятся очевидными множество вариантов и эквивалентов, охватываемых данным изобретением. Пример 1. 4,8 г аморфного CDB-4124 растворяют в смеси 5 мл этилацетата и 5 мл циклогексана, затем раствор перемешивают в атмосфере азота при 20-25 С. После растворения он начинает кристаллизоваться. Раствор перемешивают в течение 1 ч, затем выпавшие кристаллы отфильтровывают и сушат при 25 С для получения 3,65 г кристаллической формы II CDB-4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 2. 1,0 г кристаллической формы I (описанной в Р 090171) растворяют в 20 мл метанола, затем раствор перемешивают в атмосфере азота при 20-25 С. После растворения он начинает кристаллизоваться. Если кристаллизация не начинается в течение 1 ч, к раствору добавляют кристалл-затравку (пример 1). После начала кристаллизации смесь перемешивают в течение 25-30 мин при 20-25 С. Выпавшие кристаллы отфильтровывают и сушат при 25 С для получения 0,64 г кристаллической формы II CDB-4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 3. 3400 л хроматографически очищенного раствора CDB-4124, содержащего 20,6 кг активного ингредиента (соотношение растворителей циклогексан:этилацетат 1:1, диапазон концентраций 5-7 г/л), упаривают (пленочный испаритель) в два приема при 20-35 С для получения 400-500 л раствора. После упаривания начинается осаждение. Затем раствор дополнительно упаривают в кислотоустойчивом автоклаве до тех пор, пока объем суспензии не уменьшится до 150 л. К раствору добавляют метанол, затем раствор повторно перегоняют до тех пор, пока содержание этилацетата не уменьшится до 10%. Суспензию вновь упаривают для получения 50-70 л, затем ее охлаждают до температуры ниже -8 С и перемешивают в течение 8 ч. Выпавшие кристаллы отфильтровывают и промывают метанолом (5-10 л, -102 С), затем сушат в вакууме при 25-35 С для получения 14,7 кг кристаллической формы II CDB-4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 4. 5000 л хроматографически очищенного раствора CDB-4124, содержащего 33,9 кг активного ингредиента (соотношение растворителей циклогексан:этилацетат 1:1, диапазон концентраций 5-7 г/л), упаривают (пленочный испаритель) при 20-35 С для получения 800-900 л раствора (до начала осаждения). Затем раствор дополнительно упаривают в кислотоустойчивом автоклаве до тех пор, пока объем суспензии не уменьшится до 300 л. Упаривание проводят в вакууме при 25-35 С до тех пор, пока объем суспензии не уменьшится до 150 л, и она все еще поддается перемешиванию. Затем к суспензии добавляют 10020 кг циклогексана при 20-25 С и ее охлаждают до -102 С. Суспензию перемешивают в течение 2 ч, затем выпавшие кристаллы отфильтровывают и промывают смесью циклогексана и этилацетата (1:3,20-25 л, -102 С), затем их сушат в вакууме при 25-35 С для получения 27,1 кг кристаллической формыII CDB-4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 5. 3,0 г CDB-4124 растворяют в 20 мл ацетонитрила, раствор упаривают до половины от его исходного объема, затем перемешивают в атмосфере азота в течение 1 ч при 20-25 С. Если кристаллизация не начинается в течение 1 ч, к раствору добавляют кристалл-затравку (пример 1). Суспензию охлаждают до 0-5 С, затем ее перемешивают в течение 1 ч. Выпавшие кристаллы отфильтровывают и сушат при 25 С для получения 1,19 г кристаллической формы II CDB-4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 6. 3,0 г CDB-4124 растворяют в 13 мл этилацетата, затем его перемешивают в атмосфере азота в течение 1 ч при 20-25 С. Если кристаллизация не начинается в течение 1 ч, к раствору добавляют кристаллзатравку (пример 1). Суспензию охлаждают до 0-5 С, затем ее перемешивают в течение 1 ч. Выпавшие кристаллы отфильтровывают и сушат при 25 С для получения 1,78 г кристаллической формы II CDB4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 7. 2,0 г аморфного CDB-4124 растворяют в 20 мл ацетона в атмосфере инертного газа при 20-25 С при перемешивании раствора. Полученный раствор при перемешивании добавляют к очищенной воде, после чего его перемешивают еще в течение 30 мин при 20-25 С. Если кристаллизация не начинается в течение 1 ч, к раствору добавляют кристалл-затравку (пример 1). Выпавшие кристаллы фильтруют и сушат при 25 С для получения 0,96 г кристаллической формы II CDB-4124. Дифрактограмма продукта идентична дифрактограмме, представленной на фиг. 1. Пример 8 (1000 капсул). Вышеуказанные ингредиенты гомогенизируют, затем помещают в жесткие желатиновые капсулы. Масса наполненной капсулы равна 200 мг, и каждая капсула содержит 25 мг активного ингредиента. Вышеуказанные ингредиенты гомогенизируют, затем помещают в жесткие желатиновые капсулы. Масса наполненной капсулы равна 400 мг, и каждая капсула содержит 50 мг активного ингредиента. Пример 10 (1000 капсул). Вышеуказанные ингредиенты гомогенизируют, затем помещают в жесткие желатиновые капсулы. Масса наполненной капсулы равна 200 мг, и каждая капсула содержит 25 мг активного ингредиента. Пример 11 (1000 капсул). Вышеуказанные ингредиенты гомогенизируют, затем помещают в жесткие желатиновые капсулы. Масса наполненной капсулы равна 400 мг и каждая капсула содержит 50 мг активного ингредиента. Подписи к фигурам: Фиг. 1: ось х - 2 тета ; ось у - интенсивность (cps). Фиг. 2: ось х - см-1; ось у - Рамановская интенсивность. Фиг. 3: ось х - м.м.д. Фиг. 4: цикл 1 - сорбция, цикл 2 - десорбция; ось х - относительная влажность (%), ось у - изменение массы (%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая безводная форма II 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]19-норпрегна-4,9-диен-3,20-диона, характеризующаяся одним или несколькими свойствами:a) имеет типичные рефлексы в рентгеновской порошковой дифрактограмме приблизительно при 6,8, 11,0, 11,6, 14,9, 19,10,2 2;b) имеет типичные полосы поглощения в Фурье-рамановском адсорбционном спектре приблизительно при 3054, 2963, 2850, 1604, 1195, 11594 см-1;c) имеет типичные пики в 13 С ЯМР спектре в твердом состоянии при приблизительно 196,7, 172,4,169,3, 20,7, 20,1, 17,70,1 м.д. 2. Кристаллическая безводная форма II 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]19-норпрегна-4,9-диен-3,20-диона по п.1, характеризующаяся рентгеновской порошковой дифрактограммой, по существу, соответствующей дифрактограмме, представленной на фиг. 1. 3. Кристаллическая безводная форма II 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]19-норпрегна-4,9-диен-3,20-диона по п.1, характеризующаяся Фурье-рамановским спектром, по существу, соответствующим спектру, представленному на фиг. 2. 4. Кристаллическая безводная форма II 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]19-норпрегна-4,9-диен-3,20-диона по п.1, характеризующаяся 13 С ЯМР спектром в твердом состоянии, по существу, соответствующим спектру, представленному на фиг. 3. 5. Способ получения кристаллической безводной формы II 17-ацетокси-21-метокси-11-[4-N,Nдиметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по п.1, в котором аморфный 17-ацетокси-21 метокси-11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-дион растворяют при температуре от 0 до 40 С в 1-50-кратном избытке растворителей, выбранных из сложных эфиров С 1-С 4-спиртов и карбоновых кислот, кетонов, циклогексана, ацетонитрила, диметилформамида, диметилсульфоксида, воды и любых их смесей, затем раствор перемешивают при температуре от -20 до 40 С и выпавшие кристаллы отфильтровывают, промывают и сушат. 6. Способ по п.5, в котором аморфный 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]19-норпрегна-4,9-диен-3,20-дион растворяют в 2-10-кратном избытке растворителя. 7. Способ по п.5, в котором растворитель выбирают из циклогексана, этилацетата, ацетона, ацетонитрила. 8. Способ по п.5, в котором аморфную форму 17-ацетокси-21-метокси-11-[4-N,Nдиметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона растворяют при температуре от 20 до 30 С. 9. Способ по п.5, в котором раствор перемешивают при температуре от -5 до 25 С. 10. Фармацевтическая композиция для лечения опухолевых заболеваний, содержащая кристаллическую безводную форму II 17-ацетокси-21-метокси-11-[4-N,N-диметиламинофенил]-19-норпрегна-4,9 диен-3,20-диона по любому из пп.1-4. 11. Применение кристаллической безводной формы II 17-ацетокси-21-метокси-11-[4-N,Nдиметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по любому из пп.1-4 для получения фармацевтической композиции, предназначенной для лечения опухолевых заболеваний. 12. Применение кристаллической безводной формы II 17-ацетокси-21-метокси-11-[4-N,Nдиметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона по любому из пп.1-4 для лечения опухолевых заболеваний. 13. Применение по п.12, отличающееся тем, что опухолевым заболеванием является доброкачественная фиброма.
МПК / Метки
МПК: C07J 41/00, A61K 31/573, A61P 5/36
Метки: форма, кристаллическая, новая, 17α-ацетокси-21-метокси-11β-[4-n,n-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона, получения, способ
Код ссылки
<a href="https://eas.patents.su/11-19114-novaya-kristallicheskaya-forma-17alpha-acetoksi-21-metoksi-11beta-4-nn-dimetilaminofenil-19-norpregna-49-dien-320-diona-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новая кристаллическая форма 17α-ацетокси-21-метокси-11β-[4-n,n-диметиламинофенил]-19-норпрегна-4,9-диен-3,20-диона и способ ее получения</a>
Предыдущий патент: (1-фенил-2-пиридин-4-ил)этиловые эфиры бензойной кислоты в качестве ингибиторов фосфодиэстеразы 4 (pde4)
Следующий патент: Арил- и гетероарилзамещенные тетрагидробензазепины и их применение для блокировки обратного захвата норэпинефрина, допамина и серотонина
Случайный патент: Способ и система для обработки пласта для интенсификации притока из скважин