Средство противогистаминного антиаллергического действия и способ его получения
Номер патента: 17351
Опубликовано: 30.11.2012
Авторы: Шорр Вадим Александрович, Фоминова Ольга Самуиловна, Южаков Сергей Данилович, Сазонова Нелли Михайловна, Долгинова Елена Максовна, Глушков Роберт Георгиевич, Боровков Михаил Викторович, Аснина Валентина Васильевна
Формула / Реферат
1. Производные 1- и 7-[w-(бензгидрил-4-пиперазинил-1)алкил]-3-алкилксантинов общих формул I и II

где R=H, Me, CH2Ph;
R1=Me, н-С4Н9;
n=0-3;
X=Н, ОН, ОСОСН2СН2СООН;
Y=Y1=Н, Cl, F;
при условии, что R и R1 одновременно не означают метил,
а также их фармацевтически приемлемые соли и/или их гидраты, обладающие антигистаминной и противоаллергической активностью.
2. Соединение по п.1, а именно 7-[4-(бензгидрилпиперазинил-1)бутил]-3-метилксантина дигидрохлорид (IIж, где R=Н; R1=Me; n=2; X=Н; Y=Y1=Н), обладающее противогистаминным и антиаллергическим действием.
3. Способ получения 3-метил-7-[4-(бензгидрил-4-пиперазинил-1)бутил]ксантина и его солей с органическими или неорганическими кислотами общей формулы XI
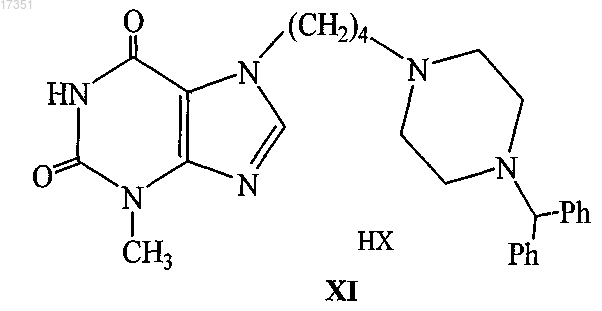
где НХ - органическая или неорганическая кислоты;
путем алкилирования 7-калиевой соли 3-метилксантина 1,4-дибромбутаном с последующим взаимодействием образующегося 7-(4-бромбутил)-3-метилксантина с 1-бензгидрилпиперазином и нейтрализацией полученного основания 7-[4-(4-бензгидрилпиперазинил-1)бутил]-3-метилксантина органической или неорганической кислотой.
4. Способ получения по п.3, отличающийся тем, что процесс алкилирования 7-калиевой соли 3-метилксантина 1,4-дибромбутаном, а также взаимодействие 7-(4-бромбутил)-3-метилксантина с 1-бензгидрилпиперазином проводят в органическом растворителе, например ацетонитриле.
5. Способ получения по пп.3, 4, отличающийся тем, что взаимодействие 7-(4-бромбутил)-3-метилксантина с 1-бензгидрилпиперазином проводят в присутствии органического основания, например триэтиламина.
Текст
СРЕДСТВО ПРОТИВОГИСТАМИННОГО АНТИАЛЛЕРГИЧЕСКОГО ДЕЙСТВИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ Предложен ряд оригинальных производных ксантина, замещенных в положениях 1 и 7-фрагментами бензгидрил-4-пиперазинил-1-алканов. Разработан способ получения 3 метил-7-[4-(бензгидрил-4-пиперазинил-1)бутил]ксантина и его солей с органическими и неорганическими кислотами путем алкилирования 7-калиевой соли 3-метилксантина 1,4-дибромбутаном с последующим взаимодействием образующегося 7-(4-бромбутил)-3 метилксантина с 1-бензгидрилпиперазином и нейтрализацией полученного основания 7-[4-(4 бензгидрилпиперазинил-1)бутил]-3-метилксантина органической или неорганической кислотой. Глушков Роберт Георгиевич, Южаков Сергей Данилович, Фоминова Ольга Самуиловна, Сазонова Нелли Михайловна, Долгинова Елена Максовна, Шорр Вадим Александрович, Боровков Михаил Викторович, Аснина Валентина Васильевна (RU) Скляр Р.В. (RU) 017351 Несмотря на довольно большую номенклатуру противогистаминных препаратов, применяющихся в медицинской практике в качестве антиаллергических средств, поиск новых блокаторов Н 1-гистаминовых рецепторов остается актуальной задачей в связи с тем, что большинство существующих препаратов этого класса не лишены недостатков, таких как кратковременность действия, наличие побочных эффектов со стороны центральной нервной системы и др. (М.Д. Машковский, Лекарственные средства, М., "Новая волна", 2005 г., 15-е изд., с. 285-297). В этой связи особый интерес представляет поиск оригинальных противогистаминных (антиаллергических) лекарственных средств с новой химической структурой и, в частности, в ряду производных ксантина, среди которых имеется ряд высокоактивных природных соединений (теофиллин, теобромин, кофеин), обладающих ценными фармакотерапевтическими свойствами. Целью изобретения является расширение номенклатуры противогистаминных (антиаллергических) лекарственных средств. Указанная цель достигается синтезом и оценкой биологической активности оригинальных химических соединений, в основе которых лежит структура ксантина, в частности производных 1- и 7-[(бензгидрил-4-пиперазинил-1)алкил]-3-алкилксантинов, включая их рацематы или оптические изомеры,а также их фармацевтически приемлемые соли/или их гидраты, общих формул I и IIY и Y1=H, Cl, F,которые обладают противогистаминной и антиаллергической активностью и могут быть использованы в медицине для изготовления на их основе новых высокоактивных и малотоксичных антиаллергических лекарственных средств. Заявляемые соединения синтезируют следующими методами. Метод А. Производные ксантина общих формул III и IVR1=Me, н-C4H9,которые получают по классическому методу Траубе (К.В. Вацуро, Г.Л. Мищенко, Именные реакции в органической химии, М.: изд-во "Химия", 1976, с. 400; П.М. Кочергин и сотр., ХГС, 1995 г.,9, с. 388),-1 017351 алкилируют в виде соли со щелочным металлом (Na, K) ,-дибромалканами общей формулы Vn=2-5,обрабатывают в присутствии иодистого калия замещенными бензгидрилпиперазинами общей формулы где Y и Y1=H, Cl, F,при этом получают заявляемые соединения I и II, где Х=Н (табл. 1). Метод Б. Согласно этому методу производные ксантина III и IV, где R=H, Me, CH2Ph; R1=Me, н-С 4 Н 9, обрабатывают эпихлоргидрином. При этом в зависимости от условий реакции (безводная или водная среда) образуются замещенные 1- или 7-(2,3-эпоксипропил)ксантины (IX и X, где хлор-2-оксипропил)ксантины (IX и X, где Z=-CH(OH)-CH2Cl)Med. Chem., 1985, 28,5, 652). При взаимодействии IX и X с бензгидрилпиперазином и его производными получают заявляемые соединения I и II, где Х=ОН; n=1 (табл. 1). Биологическая активность производных 1- и 7-[-(бензгидрил-4-пиперазинил-1)алкил]-3 алкилксантинов (I и II). Исследование антигистаминной активности заявляемых соединений проводили по известным методикам (руководство по экспериментальному изучению новых фармакологических веществ, М., 2005 г.,с. 489) на изолированной подвздошной кишке морских свинок (подавление спазмогенного эффекта гистамина) и на наркотизированных морских свинках (антагонизм в отношении бронхоконстрикторного эффекта гистамина). В опытах на целых животных вещества вводили внутривенно (за 5 мин до введения гистамина) и внутрь (за 2 ч до начала исследования). При оценке длительности противогистаминного действия соединения вводили внутрь за 24-72 ч до начала исследования. Наиболее активное соединение II ж (где R=H; R1=CH3; n=2; X=H; Y=Y1=H) изучено также на бодрствующих морских свинках с использованием модели зуда, вызываемого инстилляцией в глаз животного раствора гистамина (противогистаминное действие), а также у крыс на модели пассивной кожной анафилаксии (противоаллергический эффект) (Руководство по экспериментальному изучению новых фармако-2 017351 логических веществ, М., 2005 г., с. 511). Заявляемые соединения I и II изучали в сравнении с близкими по фармакологическому действию и широко использующимися в медицинской практике препаратами: цетиризином, лоратадином и азеластином (Машковский М.Д., Лекарственные средства, "Новая Волна", 2005 г., 15-е изд., с. 285-297) Результаты исследования противогистаминной активности и токсичности заявляемых соединений I и II представлены в табл. 2. Как следует из представленных данных, большинство заявляемых соединений в условиях in vitro иin vivo по противогистаминной активности (показатели ИК 50 и ЭД 50 соответственно) не уступают цетиризину и лоратадину, но менее активны в сравнении с азеластином. Исключением является соединениеII ж, которое на изолированной кишке морских свинок существенно превосходит по активности цетиризин и лоратадин, хотя несколько уступает азеластину. Вместе с тем, в условиях in vivo при внутривенном введении соединение II ж активнее всех указанных выше препаратов сравнения; при введении внутрь (за 2 ч до начала исследования) соединение II ж по силе действия превосходит цетиризин и лоратадин и сходно с азеластином. Следует подчеркнуть, что по длительности противогистаминного действия соединение II ж превосходит все препараты сравнения, включая азеластин. Так, на модели гистаминового бронхоспазма соединение II ж, цетиризин, лоратадин и азеластин после введения внутрь в дозе 3 мг/кг обеспечивают эффективную блокаду Н 1-гистаминовых рецепторов бронхов в течение 72, 48, 18 и 48 ч соответственно. На модели зуда, вызываемого гистамином, защитный эффект соединения II ж в дозе 3 мг/кг внутрь сохраняется на стабильном уровне в течение 2 суток и уменьшается лишь через 72 ч, тогда как аналогичный эффект цетиризина и азеластина в такой же дозе уже через 48 ч существенно уменьшается, а через 72 ч полностью исчезает. На модели пассивной кожной анафилаксии соединение II ж и цетиризин в дозах 1 и 3 мг/кг соответственно оказывают умеренное и сходное антиаллергическое действие. Весьма важным обстоятельством является тот факт, что соединение II ж менее токсично, чем азеластин и цетиризин. Соединение II ж термически устойчиво, легко растворимо в воде и в отличие от лоратадина может быть использовано для приготовления как твердых лекарственных форм, так и глазных капель. Полученные результаты позволяют заключить, что найденный и изученный авторами ряд производных 1- и 7-[-(бензгидрил-4-пиперазинил-1)алкил]-3-алкилксантинов (I и II), среди которых обнаружены вещества, обладающие высокой антигистаминной и антиаллергической активностью, открывает новые перспективы в лечении аллергических заболеваний (табл. 2). Предлагается способ получения производных ксантина, а именно 3-метил-7-[4-(бензгидрил-4 пиперазинил-1)бутил]ксантина и его солей с органическими и неорганическими кислотами общей формулы XI, обладающими противогистаминной (антиаллергической) активностью. Целевые соединения XI синтезируют из 7-калиевой соли 3-метилксантина (XII) алкилированием 1,4-дибромбутаном с последующим взаимодействием образующегося 7-(4-бромбутил)-3-метилксантина(XIII) с 1-бензгидрилпиперазином (XIV) и нейтрализацией полученного основания XI органической или неорганической кислотой согласно схеме где НХ - органическая или неорганическая кислоты. Учитывая тот факт, что XIV и основание XI могут связывать Hbr, выделяющийся в процессе реакции XIII с XIV, первоначально были предприняты попытки получить XI путем нагревания XIII с XIV в различных растворителях. Однако такой процесс протекал медленно (около 30 ч) и сопровождался образованием большого количества побочных продуктов. Не дали положительного результата и попытки катализировать реакцию XIII с XIV добавкой KJ. Существенный прогресс в улучшении этой реакции был достигнут путем взаимодействия XIII сXIV при нагревании в ацетонитриле в присутствии триэтиламина. В таких условиях процесс получения основания XI протекал гладко и заканчивался в пределах 2-3 ч. Превращение основания XI в соответствующую соль осуществлено обычными методами, используемыми в препаративной органической химии путем обработки раствора или суспензии основания XI раствором органической или неорганической кислоты. Несмотря на то что все полученные соли (XI) были равноценны по уровню фармакологической(противогистаминной) активности, наиболее удобным для практического применения и с хорошими фармакотерапевтическими свойствами (отсутствие гигроскопичности, хорошая термическая стабильность, растворимость в воде и нужный рН водного раствора) оказался XI в виде соли с янтарной кислотой (сукцинат). Говоря о полезности заявляемых соединений,в частности сукцината 7-[4-(4 бензгидрилпиперазинил-1)бутил]-3-метилксантина (XI, HX - янтарная кислота), следует подчеркнуть,что это соединение по своим фармакотерапевтическим свойствам (активности и длительности блокады Н 1-гистаминовых рецепторов, низкой токсичности, растворимости в воде) превосходит современные противогистаминные (антиаллергические) препараты: цетиризин, лоратадин и азеластин. Пример 1. Получение 1-(4-бромбутил)-3-метил-7-бензилксантина (VI к, R=CH2Ph; R1=CH3, n=4). К 60 мл абс. СН 3 ОН, содержащего 2,79 г (0,0517 моль) метилата натрия, прибавляют 10,0 г(0,039 моль) 3-метил-7-бензилксантина (III, R=CH2Ph, R1=CH3). Суспензию кипятят при перемешивании 30 мин; реакционную массу упаривают досуха; в конце процесса остатки метанола удаляют с отгонкой толуола, получают 10,86 г 1-натриевой соли 3-метил-7 бензилксантина. К раствору 42,3 г (24,4 мл; 0,196 моль) 1,4-дибромбутана в 100 мл диметилформамида (ДМФА) прибавляют 10,86 г (0,039 моль) 1-натриевой соли 3-метил-7-бензилксантина и кипятят (150C) при перемешивании 3,5 ч. Массу упаривают в вакууме, к остатку добавляют воду и бензол, перемешивают,бензольный слой отделяют, промывают водой, сушат над сульфатом натрия и фильтруют через слой окиси алюминия. Фильтрат упаривают до объема 30 мл и прибавляют равное количество гексана. Выпавший осадок отфильтровывают и сушат. Получают 12,16 г (79,6%) 1-(4-бромбутил)-3-метил-7 бензилксантина, т.пл. 90-92 С (из метанола), М+ 391. Пример 2. Получение 3-метил-7-(4-бромбутил)ксантина (VII к, R=H, R1=CH3, n=4). К раствору 42,3 г (0,196 моль; 23,4 мл) 1,4-дибромбутана в 100 мл ацетонитрила прибавляют 10,0 г(0,049 моль) 7-калиевой соли 3-метилксантина. Суспензию кипятят при перемешивании 28 ч, охлаждают,выпавший осадок отфильтровывают, промывают до нейтральной реакции водой, затем метанолом и су-4 017351 шат. Получают 9,0 (61%) технического 3-метил-7-(4-бромбутил)ксантина (VII, R=H, R1=CH3, n=4), после двукратной очистки технического образца кристаллизацией из смеси бензола и метанола, а затем диметилсульфоксида, т.пл. 218-220 С, М+ 301. Аналогично синтезируют другие VI и VII (см. табл. 3). Пример 3.R=R1=CH3). Получение 1-(2,3-эпоксипропил)-3,7-диметилксантина (IX, где Суспензию 3 г (0,148 моль) натриевой соли 3,7-диметилксантина (III, 1-Na-соль; R=R1=CH3) и 20 мл эпихлоргидрина нагревают при перемешивании при 65-70C в течение 20 ч. По охлаждении осадок отфильтровывают и промывают хлористым метиленом. Полученный раствор IX в хлористом метилене упаривают, маслообразный остаток растирают в абсолютном эфире, получают 2,7 (77%) 1-(2,3 эпоксипропил)-3,7-диметилксантина, т.пл. 115-119 С, М+ 236 (J.-C. Pascal et al., J. Med. Chem., 1985, 28,5, 647-652, т.пл. 116-117 С). Аналогично из Na-соли 3-метил-7-бензилксантина (III, 1-Na-соль, R=CH2Ph; R1=CH3) синтезируют+ т.пл. 90-95C, М 312. Пример 4. Получение 7-(4-бромбутил)-3-метилксантина (XIII). К раствору 42,2 г (0,196 моль; 23,4 мл) 1,4-дибромбутана в 100 мл ацетонитрила прибавляют 10 г(0,049 моль) 7-калиевой соли 3-метилксантина (М.В. Рубцов, А.Г. Байчиков. Синтетические химикофармацевтические препараты. М.: изд-во "Медицина", 1971 г., с. 288). Суспензию кипятят при перемешивании 28 ч, охлаждают до комнатной температуры, выпавший осадок отфильтровывают, промывают до нейтральной реакции водой, затем метанолом и сушат. Получают 9,0 г (61%) технического 7-(4-бромбутил)-3-метилксантина; после кристаллизации из смеси бензола-метанола, а затем диметилсульфоксида, т.пл. 218-220C; M+ 301. Пример 5. Получение 7-[4-(4-бензгидрилпиперазинил-1)бутил]-3-метилксантина. Суспензию 50 г 92%-ного XIII, 43,7 г 97%-ного XIV и 23,4 мл триэтиламина в 750 мл ацетонитрила кипятят при перемешивании 3 ч. Реакционную массу охлаждают до комнатной температуры, фильтруют,осадок тщательно промывают водой, ацетонитрилом и изопропанолом, сушат, получают 65,9 г основания 7-[4-(4-бензгидрилпиперазинил-1)бутил]-3-метилксантина, т.пл. 193-194C (из метанола). Вычислено, %: С 68,62; Н 6,83; N 17,78.C27H32N6O2. Найдено, %: С 68,41; Н 6,93; N 17,78. ЯМР-спектр (CDCl3, , м.д.): 1,46 (м, 2 Н, -СН 2); 1,87 (М, 2 Н, -СН 2); 2,35 (тр., 2 Н, -СН 2); 4,23 (тр.,2 Н, -СН 2); 2,15-2,60 (уш.с. 8 Н-протоны пиперазинового цикла); 3,51 (с, 3H, NCH3); 4,17 (C, 1H, CH); 7,10-7,42 (м, 10 Н, 2(С 6 Н 5; 7,53 (с, 1H, С 8 Н); 9,00 (уш.с., 1H, NH). Масс-спектр (ЭУ, 70 э), m/z: 472 [М]+. Дигидрохлорид, т.пл. 220-222 С (из 90% этанола); рН водного раствора 2,45. Вычислено, %: С 59,45; Н 6,28; N 15,40.C31H38N6O6. Найдено, %: С 62,88; Н 6,74; N 14,17. УФ-спектр (95%-ный этанол): макс 273 нм, мин 245 нм. Оксалат, т.пл. 128-130 С (из ацетона); рН водного раствора 3,44. Вычислено, %: С 61,91; Н 6,09; N 14,94.C29H34N6O6. Найдено, %: С 61,45; Н 6,83; N 14,94. Пример 6. Получение 1-[4-(бензгидрил-4-пиперазинил-1)бутил]-3-метилксантина дигидрохлорида (I, где R=H,R1=CH3, X=H, n=2, Y=Y1=H) из 7-бензил-1-(4-бромбутил)-3-метилксантина (VI, где R=бензил, R1=Me). Раствор 2,1 г (0,005 моль) 95%-ного 7-бензил-1-(4-бромбутил)-3-метилксантина в 50 мл метанола и 0,21 г 20%-ной гидроокиси палладия на угле гидрируют при 40 С до прекращения поглощения водорода(0,00022 моль) иодистого калия и 30 мл ацетонитрила кипятят при перемешивании 15 ч. Реакционную массу упаривают, остаток растворяют в 25 мл 5%-ной соляной кислоты, раствор промывают хлороформом и соляно-кислый раствор подщелачивают твердым бикарбонатом натрия до рН 8. Полученную массу экстрагируют хлороформом, экстракт промывают насыщенным водным раствором хлористого натрия и сушат сульфатом магния. Хлороформный раствор упаривают, остаток растворяют в 5 мл изопропанола,к раствору добавляют насыщенный раствор хлористого водорода в изопропаноле до рН 2. После охлаждения (5-7C, 16 ч) осадок отфильтровывают и кристаллизуют из смеси метанол-изопропанол, получают 1,38 г (50,7%) 1-[4-(бензгидрил-4-пиперазинил-1)бутил]-3-метилксантина дигидрохлорида, т.пл. 198198 С. Найдено, %: С 59,41; Н 6,54; N 15,06.Y=Y1=H), 1,38 г поташа, 0,08 г (0,00005 моль) иодистого калия и 50 мл ацетонитрила кипятят при перемешивании 20 ч. Массу упаривают, остаток растворяют в хлороформе, раствор промывают водой, сушат сульфатом магния. После отгонки хлороформа остаток кристаллизуют из этилацетата, получают 2,61 г основания II (где R=R1=CH3; n=1, Х=ОН, Y=Y1=H), которое растворяют в 70 мл изопропанола. К полученному раствору добавляют раствор хлористого водорода в изопропаноле до pH 2, выпавший осадок отфильтровывают и сушат. Получают 3,34 (66%) 1,3-диметил-7-[2-окси-3-(бензгидрил-4-пиперазинил 1)пропил]ксантина дигидрохлорида, т.пл. 224-226 С. Найдено, %: С 57,32; Н 6,10; N 14,86.C27H32N6O32HCl. Вычислено, %: С 57,75; Н 6,10; N 14,97. Пример 8. Получение 1,3-диметил-7-[2-карбоксиэтилкарбонилокси-3-(бензгидрил-4-пиперазинил 1)пропил]ксантина (II, где R=R1=CH3; n=1; Х=ОСОСН 2 СН 2 СООН; Y=Y1=H). Смесь 2,0 г (0,004 моль) 1,3-диметил-7-[2-окси-3-(бензгидрил-4-пиперазинил-1)пропил]ксантина (II,где R=R1=CH3; n=1; Х=ОН; Y=Y1=H), 0,5 г (0,005 моль) ангидрида янтарной кислоты и 20 мл дихлорэтана кипятят 4 ч и упаривают досуха. Остаток кристаллизуют из абсолютного этанола, получают 2,04 гI (где R=R1=CH3; n=1; Х=ОН; Y=Y1=H). Смесь 1 г (0,0042 моль) 1-(2,3-эпоксипропил)-3,7-диметилксантина, 1,26 г (0,0044 моль) бензгидрилпиперазина и 30 мл изопропанола кипятят при перемешивании 30 ч. По охлаждении осадок отфильтровывают, промывают эфиром и сушат. Получают 1,96 г (95%) 1-[2-окси-3-(бензгидрил-4-пиперазинил 1)пропил]-3,7-диметилксантина: основание, т.пл. 120-122 С, М+ 488; дигидрохлорид, т.пл. 196-198 С; М+ 488. Аналогично синтезируют 1-[2-окси-3-(41-хлорбензгидрил-4-пиперазинил-1)пропил]-3,7-диметилксантин (I, где R=R1=CH3;R=CH2Ph, R1=Me; n=1; X=OH; Y=Cl; Y1=H), выход 50%, т.пл. 170-172 С. Данные вещества расширяют номенклатуру противогистаминных (антиаллергических) лекарственных средств пролонгированного действия, а предлагаемый способ позволяет сократить время на проведение полного технологического цикла по сравнению с известными способами. Таблица 1 Производные 1- и 7-[-(бензгидрил-4-пиперазинил-1)алкил]-3-метилксантинов (I и II, где R1=CH3)Y=Y1=Н, Cl, F; при условии, что R и R1 одновременно не означают метил,а также их фармацевтически приемлемые соли и/или их гидраты, обладающие антигистаминной и противоаллергической активностью. 2. Соединение по п.1, а именно 7-[4-(бензгидрилпиперазинил-1)бутил]-3-метилксантина дигидрохлорид (II ж, где R=Н; R1=Me; n=2; X=Н; Y=Y1=Н), обладающее противогистаминным и антиаллергическим действием. 3. Способ получения 3-метил-7-[4-(бензгидрил-4-пиперазинил-1)бутил]ксантина и его солей с органическими или неорганическими кислотами общей формулы XI где НХ - органическая или неорганическая кислоты; путем алкилирования 7-калиевой соли 3-метилксантина 1,4-дибромбутаном с последующим взаимодействием образующегося 7-(4-бромбутил)-3-метилксантина с 1-бензгидрилпиперазином и нейтрализацией полученного основания 7-[4-(4-бензгидрилпиперазинил-1)бутил]-3-метилксантина органической или неорганической кислотой. 4. Способ получения по п.3, отличающийся тем, что процесс алкилирования 7-калиевой соли 3 метилксантина 1,4-дибромбутаном, а также взаимодействие 7-(4-бромбутил)-3-метилксантина с 1 бензгидрилпиперазином проводят в органическом растворителе, например ацетонитриле. 5. Способ получения по пп.3, 4, отличающийся тем, что взаимодействие 7-(4-бромбутил)-3 метилксантина с 1-бензгидрилпиперазином проводят в присутствии органического основания, например триэтиламина.
МПК / Метки
МПК: C07D 473/06, A61P 27/14, A61P 37/08
Метки: противогистаминного, средство, антиаллергического, действия, получения, способ
Код ссылки
<a href="https://eas.patents.su/11-17351-sredstvo-protivogistaminnogo-antiallergicheskogo-dejjstviya-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Средство противогистаминного антиаллергического действия и способ его получения</a>
Предыдущий патент: Способ и установка для изготовления слоя наночастиц или слоя нановолокон из растворов или расплавов полимеров
Следующий патент: Гербицидная композиция
Случайный патент: Окно, содержащее стеклопакет с краевым элементом












