Композиции с отсроченным высвобождением для перорального применения, содержащие аморфный бардоксолон метил (cddo-me)
Формула / Реферат
1. Твердая лекарственная форма, содержащая (А) твердую дисперсию аморфного бардоксолон метила в стеклообразной матрице, образованной сополимером метакриловой кислоты, в смеси с (В) гидроксипропилметилцеллюлозой в виде частиц, при этом указанная дисперсия (А) обеспечивает терапевтически эффективное количество бардоксолон метила.
2. Твердая лекарственная форма по п.1, отличающаяся тем, что указанная твердая дисперсия (А) представляет собой продукт, полученный по способу, включающему распылительную сушку смеси бардоксолон метила и указанного сополимера метакриловой кислоты.
3. Твердая лекарственная форма по п.2, отличающаяся тем, что указанный способ включает распылительную сушку смеси бардоксолон метила и указанного сополимера метакриловой кислоты в соотношении 4:6.
4. Твердая лекарственная форма по п.1, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 1 до 40% (мас./мас.) от общей массы состава.
5. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 2 до 20% (мас./мас.) от общей массы состава.
6. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 4 до 10% (мас./мас.) от общей массы состава.
7. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 5 до 7,5% (мас./мас.) от общей массы состава.
8. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 7 до 7,5% (мас./мас.) от общей массы состава.
9. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет 7% (мас./мас.) от общей массы состава.
Текст
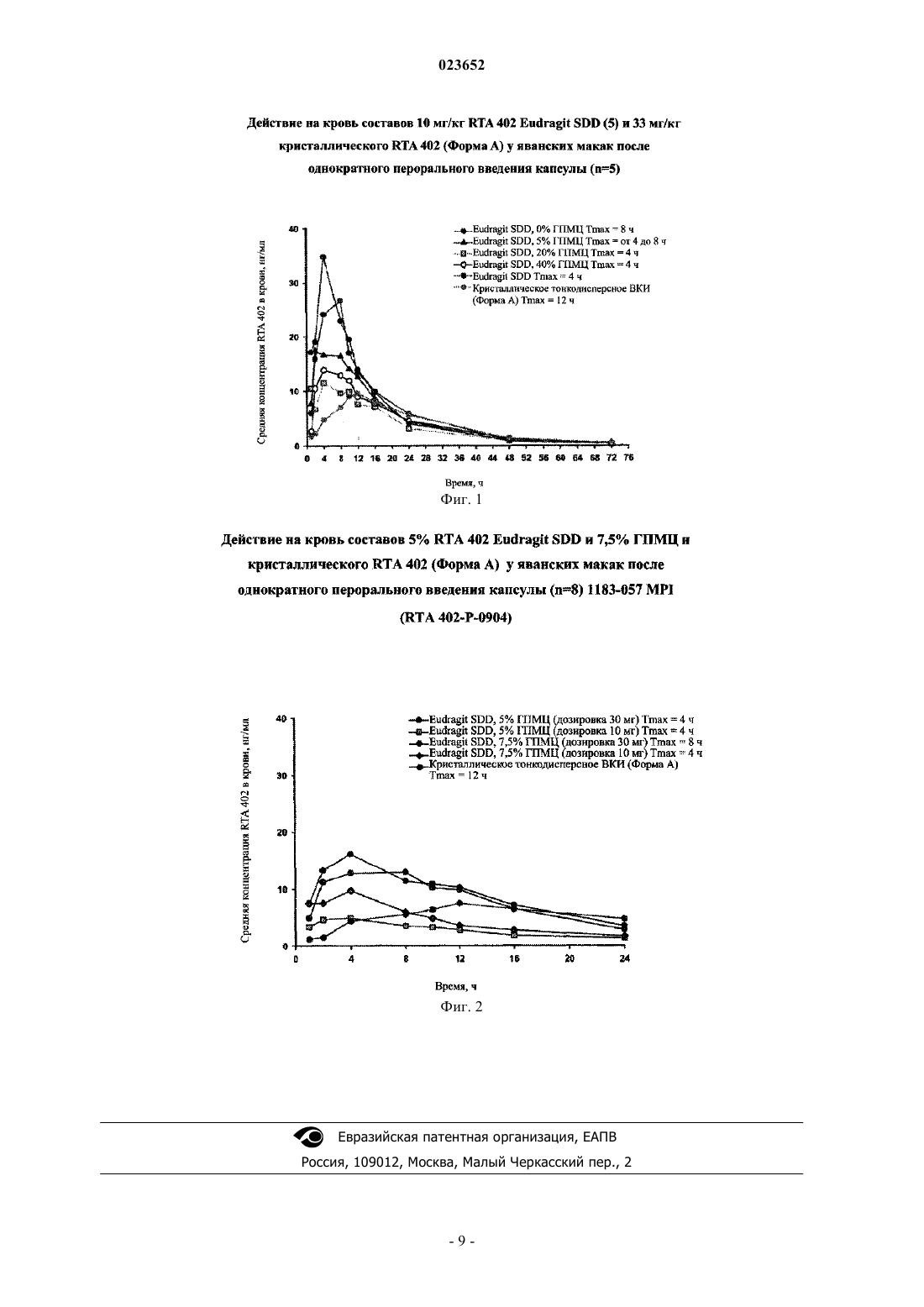
КОМПОЗИЦИИ С ОТСРОЧЕННЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ АМОРФНЫЙ БАРДОКСОЛОН МЕТИЛ (CDDO-ME) Согласно настоящему изобретению предложены фармацевтические составы, обеспечивающие необходимое низкое значение Cmax среди других свойств, при этом указанные составы содержат частицы аморфного бардоксолон метила, либо в чистой форме, либо в форме твердой дисперсии,в смеси с частицами гидрофильного связующего агента. Такие составы имеют преимущество в виде высокой пероральной биодоступности по сравнению с составами на основе кристаллической формы бардоксолон метила. Перекрестные ссылки на родственные заявки Настоящая заявка испрашивает приоритет согласно 119(е) главы 35 Свода законов США на основании предварительной заявки США 61/152,608, поданной 13 февраля 2009 г., содержание которой полностью включено в настоящее описание посредством ссылки. Уровень техники Синтетический тритерпеноид бардоксолон метил, также известный как CDDO-Me и "RTA 402," в ходе доклинических исследований и клинических испытаний на людях продемонстрировал высокую противовоспалительную и противоопухолевую активность. В частности, бардоксолон метил показал значительную противораковую активность у пациентов с раком на поздних стадиях и способность улучшать показатели функции почек, устойчивости к инсулину, гликемического контроля и системных сердечнососудистых заболеваний у пациентов, страдающих заболеваниями почек, являющимися следствием диабета 2 типа. В этих исследованиях бардоксолон метил вводили пероралыю в кристаллической форме ("форма А") один раз в сутки в различных дозах. Кроме значительной клинической эффективности, отмеченной в ходе этих исследований, для формы А бардоксолон метила был показан превосходный профиль переносимости, при этом было отмечено очень малое количество побочных эффектов лекарства. Однако фармакокинетические данные этих исследований показали, что форма А бардоксолон метила обладает сравнительно низкой пероральной биодоступностью. Однако была идентифицирована некристаллическая форма бардоксолон метила (форма В), которая обладает значительно более высокой пероральной биодоступностью по сравнению с формой А. Очевидно, что улучшенная пероральная биодоступность является необходимым свойством лекарственного состава, поскольку за счет биодоступности снижается стоимость активного вещества на дозу и обеспечивается соответствие общему медицинскому принципу введения наименьшего количества лекарства, которое производит необходимый эффект. Напротив, низкая растворимость в воде, приводящая к низкой пероральной биодоступности потенциальных лекарств, признана значительной проблемой, стоящей перед фармацевтической промышленностью. Фактически, по оценкам, 25-30% соединений на начальных стадиях разработки обладают низкой биодоступностью вследствие низкой растворимости. Управление по санитарному надзору за качеством пищевых продуктов и лекарственных средств США (FDA) приняло биофармацевтический классификатор (BCS), согласно которому лекарственные средства, предназначенные для перорального применения,классифицированы по растворимости и проницаемости через мембраны. Лекарства, являющиеся слаборастворимыми, но хорошо проникающими через мембраны, составляют существенную часть кандидатов в лекарственные средства и относятся ко 2 классу лекарственных средств по BCS. Для этого класса лекарств, предназначенных для перорального применения, улучшения эффективной биодоступности подчас могут быть направлены на изменение профиля растворимости лекарственного средства самого по себе или за счет использования функциональных вспомогательных веществ в соответствующей фармацевтической композиции. Разработано несколько методик улучшения растворимости некоторых кандидатов в лекарственные средства, потенциально являющихся безопасными и эффективными. Иследована одна из подобных методик, которая состоит в приготовлении лекарственного препарата с использованием аморфной формы лекарственного средства, взятого в отдельности или в полимерной матрице. Несмотря на то, что описана улучшенная водная растворимость аморфных форм по сравнению с соответствующими кристаллическими формами лекарственных средств, такие системы по своей природе нестабильны и могут возвращаться к термодинамически более стабильному кристаллическому состоянию. Как следствие, часто проводятся масштабные исследовательские и экспериментальные работы для определения составов систем, которые могут обеспечивать получение составов с приемлемым сроком хранения. Поскольку скорости растворения и растворимость в физиологических средах обычно выше в верхних отделах желудочно-кишечного тракта, поведение составов, содержащих аморфные лекарственные вещества, при возможности их разработки часто отличается от поведения in vivo составов, содержащих соответствующее лекарство в кристаллической форме. Сообщалось, что составы, содержащие аморфные лекарственные вещества, обладают улучшенной биодоступностью и значениями площади под фармакокинетической кривой (AUC), в несколько раз превышающими значения для составов, содержащих соответствующую кристаллическую форму лекарственного вещества в эквивалентной дозе. Несмотря на то,что сходные профили метаболизма, распределения и выведения после всасывания в общий кровоток не являются необычными для аморфных форм лекарств, время достижения максимальной концентрации в плазме (Tmax) и максимальная наблюдаемая концентрация (Cmax) часто значительно изменяются для составов, содержащих аморфные лекарства, по сравнению с их кристаллическими аналогами. Если лекарство проявляет токсичность или ассоциировано с повышенной частотой нежелательных событий выше определенной предельной концентрации в плазме, то безопасное поддержание терапевтических уровней в плазме равными ниже такого предельного уровня может иметь первостепенную важность. Таким образом, даже если лекарство обладает широким терапевтическим окном и в иных случаях безопасно и эффективно, контроль профилей Cmax или Tmax может быть важным, если лекарство пред-1 023652 назначено для постоянного применения. В более общем смысле, если определенный профиль концентрации в плазме связан с желательным профилем безопасности и эффективности, его можно использовать при создании альтернативных составов, содержащих тот же активный ингредиент, для получения сопоставимого профиля концентрации в плазме. Краткое описание изобретения С учетом вышеизложенного, в настоящем изобретении предложена, согласно одному из его аспектов, твердая лекарственная форма, содержащая (А) частицы, состоящие из аморфного бардоксолон метила, в смеси с (В) частицами, содержащими по меньшей мере один гидрофильный связующий агент, например, вспомогательное вещество на основе целлюлозы, причем частицы (А) обеспечивают терапевтически эффективное количество бардоксолон метила. Типичными представителями класса подходящих вспомогательных веществ на основе целлюлозы являются С 3-С 10 алкилгидроксиметилцеллюлоза, например метилцеллюлоза, этилцеллюлоза, пропилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и ацетат целлюлозы; арилгидроксиметилцеллюлоза и замещенная арилгидроксиметилцеллюлоза. В качестве альтернативы, гидрофильный связующий агент может представлять собой природный углеводный полимер или анионный полимер. В одном из вариантов реализации настоящего изобретения частицы (А) состоят, по существу, из аморфного бардоксолон метила. В еще одном варианте реализации частицы (А) содержат твердую дисперсию аморфного бардоксолон метила в стеклообразной матрице, которую можно получить, например,в качестве продукта согласно способу, который включает распылительную сушку смеси бардоксолон метила и сополимера метакриловой кислоты. Такая распылительная сушка может включать, например,применение смеси 4:6 бардоксолон метила и сополимера метакриловой кислоты. В соответствии с настоящим изобретением процентное содержание гидрофильного связующего агента в твердой лекарственной форме согласно описанию в настоящей заявке может быть между примерно 1 и примерно 40%(мас./мас.) от общей массы состава, например между примерно 2 и примерно 20% (мас./мас.), примерно 4 и примерно 10% (мас./мас.), примерно 5 и примерно 7,5% (мас./мас.) или примерно 7 и примерно 7,5%(мас./мас.), или составлять примерно 7% (мас./мас.) от общей массы состава. Составы в соответствии с настоящим изобретением обладают измененными профилями Cmax по сравнению с составами, в которых отсутствуют гидрофильные связующие агенты. Более конкретно, состав в соответствии с настоящим изобретением позволяет достичь значительно меньшего значенияCmax, чем состав, полученный с использованием сопоставимой композиции, содержащей аморфную дисперсию, но не содержащей указанный гидрофильный связующий агент. Состав в соответствии с настоящим изобретением имеет преимущество перед составами на основе кристаллической формы бардоксолон метила, заключающееся в более высокой биодоступности при введении пероралыю. Краткое описание чертежей На фиг. 1 графически представлены данные о биодоступности, полученные путем однократного перорального введения различных составов RTA-402 яванским макакам. На фиг. 2 графически представлены сравнительные фармакокинетические данные, полученные на яванских макаках при использовании различных составов RTA 402, содержащих 5,0 и 7,5% гидроксипропилметилцеллюлозы соответственно. Подробное описание предпочтительных вариантов реализации Доклинические исследования различных составов, содержащих аморфную дисперсию бардоксолон метила (форма В), показывают, что его улучшенная пероральная биосовместимость связана со значительно увеличенным значением Cmax по сравнению с веществом формы А, а также в связи с тем, что общая кривая концентрации в плазме существенно отличается от кривой формы А в эквивалентных дозах. Принимая во внимание высокую эффективность и превосходную переносимость, полученную для формы А в ходе клинических исследований, авторы настоящего изобретения стремились идентифицировать состав, содержащий аморфную дисперсию бардоксолон метила, который сохранял бы преимущество улучшенной пероральной биосовместимости, обладая при этом кривой концентрации в плазме, более сходной с кривой, ассоциированной с формой А. Это придало бы большую уверенность в том, что профиль эффективности и переносимости такого состава в последующих клинических исследованиях будет согласовываться с профилем, наблюдавшимся в исследованиях при использовании вещества формы А. Благодаря этому исследованию авторы настоящего изобретения установили, что модифицированный состав твердой дисперсии бардоксолон метила, содержащий в качестве дополнительного компонента один или несколько гидрофильных связующих агентов, например, связующих агентов на основе целлюлозы, таких как гидроксипропилметилцеллюлоза, демонстрировал необходимые свойства. Авторы изобретения предполагают, что эти гидрофильные связующие агенты регулируют скорость растворения,обеспечивая не только пероральную биодоступность, в несколько раз превышающую биодоступность вещества формы А, но также более низкое значение Cmax при пероральном применении, чем у ранее использованных составов формы В. Таким образом, состав в соответствии с изобретением характеризуется общей кривой концентрации в плазме (ККП), которая является более близкой к ККП, относящейся к веществу формы А. В исследованиях на животных составы на основе тонкоизмельченной твердой дисперсии В, смешанной с гидрофильным связующим агентом, демонстрировали значительно более высокие значенияCmax по сравнению с составами, содержащими эквивалентные дозы кристаллического бардоксолон метила. Таким образом, добавление гидрофильного связующего агента не ухудшало лучшую биодоступность таких аморфных форм бардоксолон метила по сравнению с кристаллическими формами. Качественно сходные результаты должны иметь отношение и к составу в соответствии с изобретением из частиц чистой формы В, смешанных с частицами гидрофильного связующего агента. В данном контексте термин "чистый" означает присутствие аморфного бардоксолон метила, не содержащего любой материал, включая вспомогательное вещество, который может воздействовать на фармацевтические свойства лекарства. Такое использование термина "чистый" не предназначено для обозначения абсолютной чистоты; скорее оно согласуется с обычным стандартом приемлемой чистоты фармацевтического агента. Синонимическое выражение в этой связи определяет частицы состава в соответствии с изобретением как"состоящие в основном из формы В". В твердой дисперсии, состоящей из формы В, стеклообразующее вспомогательное вещество составляет значительную долю от общего вещества и играет важную роль в определении общих фармакологических свойств. Каждая некристаллическая форма бардоксолон метила, как чистая форма В, так и твердая дисперсия, содержащая форму В, смешанную со стеклообразующим вспомогательным веществом, характеризуется единственной температурой стеклования (Tg), которую можно измерить путем дифференциальной сканирующей калориметрии. Каждая некристаллическая форма бардоксолон метила также имеет характерный широкий расплывчатый пик, наблюдаемый с помощью рентгеновской порошковой дифрактометрии (XRPD), который указывает на присутствие аморфной формы. Твердую дисперсию бардоксолон метила, применяемую в соответствии с одним аспектом настоящего изобретения, можно получить с помощью любого из различных стеклообразующих материалов,используемых в качестве вспомогательных веществ. Таким образом, один вариант реализации настоящего изобретения представляет собой состав, в котором частицы такой твердой дисперсии бардоксолон метила смешаны с частицами гидрофильного связующего агента, возможно, с частицами других вспомогательных веществ. Полученная смесь при введении субъекту пероральным путем или другим способом дает измененную кривую концентрации в плазме по сравнению с составами, содержащими то же количество твердой дисперсии бардоксолон метила, но не содержащими гидрофильный связующий агент. Эта измененная кривая концентрации в плазме характеризуется более низким значением Cmax по сравнению с составом, в котором отсутствует гидрофильный связующий агент. Согласно тому же принципу, смешивание частиц чистой формы В бардоксолон метила с частицами гидрофильного связующего агента в соответствии с еще одним аспектом настоящего изобретения оказывает сходное действие на кривую концентрации в плазме. Более низкое значение Cmax обнаруживают относительно эквивалентного состава, не содержащего гидрофильный связующий агент. Для получения твердых дисперсий аморфного бардоксолон метила в соответствии с настоящим изобретением можно использовать разнообразные способы получения. Подходящими для этой цели являются, например, различные традиционные термические способы (например, экструзия горячего расплава), азеотропные способы и термические/азеотропные способы (например, распылительная сушка или вихревое покрытие гранул). Также подходящими в соответствии с настоящим изобретением являются соотношения бардоксолон метила, активного ингредиента, и стеклообразующего вспомогательного вещества, отличающиеся от соотношения 4:6, упомянутого ниже. В зависимости от используемого стеклообразующего вспомогательного вещества и методологии получения подходящие значения могут значительно изменяться в диапазоне, например, между примерно 1:19 и примерно 2:1. Как указано выше, любое из разнообразных стеклообразующих вспомогательных веществ подходит для использования в соответствии с настоящим изобретением, если данное вспомогательное вещество может образовывать стекловидную твердую матрицу при температуре стеклования (Tg). Типичными представителями таких вспомогательных веществ являются производные целлюлозы (например, гидроксипропилцеллюлоза), производные акриловой кислоты и другие синтетические полимеры (например,поливинилпирролидон и коповидон), соли органических кислот и белки и пептиды (например, альбумин и полиаланин). Твердую лекарственную форму в соответствии с настоящим изобретением можно вводить иным путем, чем пероральный. Эти другие подходящие пути введения включают назальное, пульмонарное,трансмукозальное и трансдермальное введение, но не ограничиваются ими. Твердые дисперсии формы В (аморфной) бардоксолон метила проявляют повышенную пероральную биодоступность по сравнению с составами, содержащими чистую форму В бардоксолон метила(данные не показаны). Кроме того, оба типа аморфного вещества проявляют существенно улучшенную пероральную биодоступность по сравнению с кристаллическими формами бардоксолон метила. Соответственно настоящее изобретение в одном из своих аспектов включает состав, содержащий чистую форму В бардоксолон метила, смешанную с одним или несколькими гидрофильными связующими агентами,так что смесь обеспечивает общий профиль концентрации в плазме, сходный с профилем составов, при-3 023652 водимых ниже. Такое смешивание не приводит к образованию твердой дисперсии, независимо от того,может ли гидрофильный связующий агент служить стеклообразующим вспомогательным веществом при других условиях. Это вызвано тем, что способ смешивания в соответствии с изобретением не включает стадии, например, растворения обоих веществ в растворителе и последующей распылительной сушки,которые необходимы для образования твердой дисперсии. Для состава, содержащего чистую форму В бардоксолон метила в соответствии с изобретением, могут быть необходимы различные соотношения гидрофильного связующего агента и активного вещества по сравнению с составом, содержащим твердую дисперсию формы В для достижения желательного профиля концентрации в плазме. Например, меньшее количество гидрофильного связующего агента по отношению к активному ингредиенту может быть необходимо для компенсации меньшей биодоступности вещества чистой формы В по сравнению с твердой дисперсией, содержащей сопоставимое количество вещества формы В, согласно описанию выше. В общем случае, для достижения желательного результата с веществом чистой формы В могут требоваться и меньшие, и большие соотношения гидрофильного связующего агента и активного вещества, в зависимости от природы использованного гидрофильного связующего агента или агентов и действия других вспомогательных веществ, которые могут присутствовать в составе. Дозированная лекарственная форма согласно изобретению обычно содержит терапевтически эффективное количество аморфного бардоксолон метила. При этом количество, которое является "терапевтически эффективным", достаточно для активации сигнального пути Nrf2 в циркулирующих клетках крови. См. Ichikawa et al., (2009) PloS One, 4(12):e8391. В общем случае, терапевтически эффективное количество можно определить эмпирически на основе клинических параметров пациента. Для пояснения изобретения были получены композиции, содержащие аморфный бардоксолон метил, в виде дисперсии,высушенной при помощи распылительной сушки дисперсии (SDD). Твердую дисперсию формы В, каждую из SDD композиций получали путем распылительной сушки растворов, содержавших бардоксолон метил (форма В) и стеклообразующее вспомогательное вещество - сополимер метакриловой кислоты типа С, USP, в соотношении 4:6. Состав получали путем смешивания полученных частиц данной SDD с гидрофильным связующим агентом, например, гидроксиирошшметшщеллюлозой, вместе с другими вспомогательными веществами, как показано ниже в табл. 1, с последующим уплотнением смеси в валках, измельчением и капсулированием полученных таким образом гранул. В общем случае, конечный продукт, полученный согласно этому типичному способу, представлял собой смесь в гранулированном виде, причем каждая гранула содержала (i) частицы аморфной дисперсии, содержащей бардоксолон метил формы В, (ii) частицы гидрофильного(ых) связующего(их) агента(ов) и (iii) частицы других вспомогательных веществ. Можно использовать аналогичный способ для получения смеси, в гранулированном виде, изменяя природу исходного материала, т.е., чистой формы В,а не твердой дисперсии, содержащей форму В. В этом случае каждая гранула будет содержать (1) частицы чистой формы В, (2) частицы гидрофильного(ых) связующего(их) агента(ов) и (3) частицы любого другого(их) вспомогательного(ых) вещества(веществ). Как показано в табл. 1, эталонный "состав 1"(названный на фиг. 1 "Eudragit SDD") содержал коповидон, разрыхляющий агент. Были изготовлены модификации эталонного состава, причем каждая модификация не содержала коповидон и содержала от 0 до 40% гидроксипропилметилцеллюлозы (ГПМЦ) по массе, которая является типичным представителем подкласса гидрофильных связующих веществ на основе целлюллозы. Процентные соотношения вспомогательных веществ - лактозы и микрокристаллической целлюлозы - соответственно подбирали по убывающей (табл. 1). Таблица 1. Композиция контрольного состава и модификаций состава, содержащих гидроксипропилметилцеллюлозу В табл. 2 подробно представлены компоненты капсул, содержащих 50 мг активного ингредиента тонкодисперсного кристаллического (форма А) бардоксолон метила. В табл. 3 этот состав обозначен как"ВКИ". Таблица 2. Композиция капсул бардоксолон метила, содержащих тонкоизмельченную кристаллическую форму лекарственного вещества Фармакокинетические исследования проводили на голодных яванских макаках со средней массой тела 3 кг. Животным, которых лечили составами, показанными в табл. 1, вводили одну капсулу через ротовой зонд. Животным, которых лечили тонкодисперсной кристаллической формой, как показано в табл. 2, вводили две капсулы через ротовой зонд. Дозировка эталонного состава и модификаций составов, представленных в табл. 1, составляла примерно 10,0 мг/кг, в то время как дозировка композиции состава, содержавшего тонкоизмельченную кристаллическую форму лекарства, составляла 33,3 мг/кг. У каждого животного отбирали кровь в моменты времени, указанные на фиг. 1, и в каждом образце определяли количественное содержание бардоксолон метила с помощью утвержденного ЖХ/МС/МСбиоаналитического способа. Данные по фармакокинетике представлены в табл. 3. Таблица 3. Фармакокинетические параметры для крови, полученной после перорального введения капсулы с 10 мг/кг RTA 402 для каждого исследованного состава Eudragit и 33 мг/кг кристаллическогоRTA 402 (форма А) ВКИ [среднее значение (n=S); оценки фармакокинетических параметров получены с помощью анализа без компартментализации (программное обеспечение WinNonlin версии 5.2)] ВКИ: вещество для клинических испытаний,ГПМЦ: гидроксипропилметилцеллюлоза,НО: не определяли,SDD: распылительно высушенная дисперсия Определенные фармакокинетические параметры:Cmax, максимальная наблюдавшаяся концентрация; Tmax, время достижения максимальной наблюдавшейся концентрации; Cl/F, кажущееся расщепление в ротовой полости при условии 100% биодоступности лекарства; С 1, общее расщепление в организме с поправкой на долю всосавшегося лекарства; Vz/F,объем распределения лекарства при условии 100% биодоступности лекарства, рассчитанный в терминальной фазе; Vz, объем распределения лекарства с поправкой на долю всосавшегося лекарства, рассчитанный в терминальной фазе; Т 1/2, рассчитанный фармакологический период полураспада лекарства,AUC0 ч, рассчитанная для лекарства площадь иод фармакокинетической кривой с нулевого момента до 72 ч после отбора крови; % F, процентное отношение всосавшегося лекарства но сравнению с внутри-5 023652 венным введением. На фиг. 1 показано, что использование ГПМЦ в SDD, содержащей форму В бардоксолон метила(обозначена как "RTA 402") изменяло фармакокинетический профиль лекарства in vivo. Например, увеличение концентраций ГПМЦ снижало среднюю концентрацию RTA 402 в крови, достигаемую для данной дозировки. Так, концентрация ГПМЦ 20% (мас./мас.) снижала Cmax на 50% по сравнению с контролем. На основе параметров состава с 5% ГПМЦ, описанных выше, с составами формы В с 2,5, 5,0 или 7,5% ГПМЦ провели исследования растворения in vitro, как показано ниже в таблице. Результаты этих исследований показывают, что более высокие процентные соотношения ГПМЦ ассоциировались с более медленными скоростями растворения. В свете этих результатов для сравнительных фармакокинетических исследований на яванских макаках выбрали составы с 5,0 и 7,5% ГПМЦ, в качестве контроля использовали состав с кристаллической тонкоизмельченной формой А бардоксолона, описанный в табл. 2. Каждый из составов с ГПМП/формой В вводили в капсулах через ротовой зонд в дозах 30 или 10 мг. Контрольный состав с формой А вводили в дозе 100 мг. Результаты (концентрация RTA 401 в плазме крови в зависимости от времени) показаны на фиг. 2. Для клинических исследований на людях также подготовили составы с ГПМЦ, содержащие форму В бардоксолон метила. Капсулы бардоксолон метила приготовили с дозировкой 15 мг. В табл. 4 описаны использованные компоненты в единицах массы каждого вещества на капсулу. В табл. 5 представлена композиция в процентном соотношении. Согласно описанию выше SDD содержала 40% активного фармацевтического ингредиента (АФИ) бардоксолон метила. В результате этого использование 37,5 мг SDD на капсулу позволило получить содержание бардоксолон метила 15 мг на капсулу. В табл. 4 и 5 "СМКЦ" означает силицифицированную микрокристаллическую целлюлозу, совместно обрабатываемое вспомогательное вещество, состоящее из традиционных вспомогательных веществ. СМКЦ входит в список Руководства по инертным ингредиентам FDA. Таблица 4. Производственная формула для капсул, содержащих 15 мг бардоксолон метила, в единицах массы вещества на капсулу Таблица 5. Производственная формула для капсул, содержащих 15 мг бардоксолон метила, в процентном соотношении Для того, чтобы продемонстрировать, что составы с формой В в соответствии с настоящим изобретением могут поддерживать высокую биодоступность и обеспечивать желательную ККП у людей, провели клинические фармакокинетические исследования с участием здоровых добровольцев. Добровольцы получали однократную дозу 150 мг бардоксолон метила (форма А; 3 капсулы по 50 мг) или 30 мг аморфного бардоксолон метила (форма В; 2 капсулы по 15 мг). Затем производили неоднократный отбор образцов крови и анализировали концентрацию лекарства в плазме. После 10-ти дневного периода выведения каждый пациент получал лекарственную форму, которая не вводилась первый раз. После второго курса лечения повторно измеряли профиль концентрации в плазме у каждого пациента. Таблица 6. Сводные фармакокинетические параметры, полученные в ходе клинических испытаний Ниже предела определения Как показано в табл. 6, состав с формой В обладал более высокой биодоступностью, обеспечивая профиль общего воздействия, сходный с профилем кристаллического препарата, согласно измерениям значения AUC на момент 48 ч. В вышеописанных типовых композициях согласно изобретению ГПМЦ является примером под-7 023652 класса связующих агентов на основе целлюлозы, включающего другие C3-C10 алкил- и арилзамещенные производные целлюлозы, подходящие для использования в этом контексте. Представителями этого подкласса более крупной категории гидрофильных связующих агентов также являются метилцеллюлоза,этилцеллюлоза, пропилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллоза, гидроксипропилметилцеллюлоза и ацетат целлюлозы. Для целей настоящего изобретения предпочтительными связующими агентами являются алкилпроизводные целлюлозы, например, гидроксипфопилметилцеллюлоза, которая доступна для приобретения в виде препаратов с различными диапазонами молекулярных масс. Также можно использовать другие гидрофильные связующие агенгы, такие как: (а) природные углеводные полимеры, например крахмал и прежелатинизированный крахмал; (b) анионные полимеры, например, гомополимеры акриловой кислоты, поперечно-сшитые аллилсахарозой или аллилпентаэритритом; (с) полимеры молочной кислоты или сополимеры молочной и глутаминовой кислоты; (d) желатин или модифицированные желатины; и(е) аминозамещенные углеводные полимеры, например, хитозан. Не будучи связанными представлениями о конкретном механизме или теории, авторы настоящего изобретения считают, что различные гидрофильные связующие агенты, обсуждавшиеся выше, изменяют фармакокинетический профиль аморфного бардоксолон метила по меньшей мере тремя путями, каждый из которых вносит вклад в замедление растворения. Во-первых, гидрофильный(е) материал(ы), представителем которых является ГПМЦ, выполняют роль связующего агента во время процесса укатывания,согласно описанию выше, для удерживания полученных частиц вместе и более прочного связывания этих первичных частиц. Как следствие, во время растворения гранулы, образованные при укатывании,разрушаются медленнее, чем это происходило бы в ином случае. Во-вторых, во время растворения связующие агент или агенты образуют вязкий гель, который скрепляет частицы, содержащие форму В (и сами гранулы), что еще более замедляет разрушение. В-третьих, вышеупомянутый вязкий гель увеличивает локальную вязкость в присутствии растворяющей среды. Увеличение локальной вязкости замедляет диффузию лекарства и, следовательно, растворение. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Твердая лекарственная форма, содержащая (А) твердую дисперсию аморфного бардоксолон метила в стеклообразной матрице, образованной сополимером метакриловой кислоты, в смеси с (В) гидроксипропилметилцеллюлозой в виде частиц, при этом указанная дисперсия (А) обеспечивает терапевтически эффективное количество бардоксолон метила. 2. Твердая лекарственная форма по п.1, отличающаяся тем, что указанная твердая дисперсия (А) представляет собой продукт, полученный по способу, включающему распылительную сушку смеси бардоксолон метила и указанного сополимера метакриловой кислоты. 3. Твердая лекарственная форма по п.2, отличающаяся тем, что указанный способ включает распылительную сушку смеси бардоксолон метила и указанного сополимера метакриловой кислоты в соотношении 4:6. 4. Твердая лекарственная форма по п.1, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 1 до 40% (мас./мас.) от общей массы состава. 5. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 2 до 20% (мас./мас.) от общей массы состава. 6. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 4 до 10% (мас./мас.) от общей массы состава. 7. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 5 до 7,5% (мас./мас.) от общей массы состава. 8. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет от 7 до 7,5% (мас./мас.) от общей массы состава. 9. Твердая лекарственная форма по п.4, отличающаяся тем, что доля гидроксипропилметилцеллюлозы составляет 7% (мас./мас.) от общей массы состава.
МПК / Метки
МПК: A61K 9/16
Метки: бардоксолон, отсроченным, композиции, аморфный, содержащие, перорального, применения, cddo-me, метил, высвобождением
Код ссылки
<a href="https://eas.patents.su/10-23652-kompozicii-s-otsrochennym-vysvobozhdeniem-dlya-peroralnogo-primeneniya-soderzhashhie-amorfnyjj-bardoksolon-metil-cddo-me.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции с отсроченным высвобождением для перорального применения, содержащие аморфный бардоксолон метил (cddo-me)</a>
Предыдущий патент: Звукоизолирующий элемент и способ изготовления звукоизолирующего элемента
Следующий патент: Способ диагностики, страдает ли пациент от множества печеночных заболеваний, и способ определения риска пациента в отношении множества заболеваний печени
Случайный патент: Применение транс- капсаицина