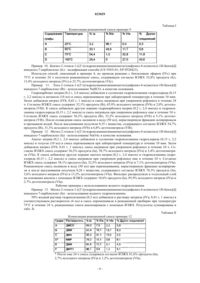
Способ получения 2-этокси-1-((2′-((гидроксиамино)иминометил)дифенил-4-ил)метил)-1h-бензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров
Формула / Реферат
1. Способ получения 2-этокси-1-((2'-((гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров формулы (I)

где R представляет собой Н, (не)разветвленный C1-C4 алкил, ArCH2, Ar2CH или Ar3C, где Ar представляет собой (не)замещенный фенил, отличающийся тем, что соответствующий нитрил формулы (IV)

где R является таким, как определено выше, подвергают взаимодействию с водным раствором, содержащим 25-50 мас.% гидроксиламина в полярном апротонном растворителе или в смеси полярных апротонных растворителей при температуре 50-90°C.
2. Способ по п.1, отличающийся тем, что R представляет собой Н, метил, этил, бензил, бензгидрил или тритил.
3. Способ по п.1, отличающийся тем, что полярный апротонный растворитель выбран из группы, состоящей из диметилсульфоксида, N,N-диметилформамида, N,N-диметилацетамида, 1-метилпирролидона, 1,1,3,3-тетраметилмочевины, 1,3-диметилимидазолидин-2-она, 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинона и гексаметилфосфорамида, а также их смесей.
4. Способ по п.3, отличающийся тем, что указанный растворитель представляет собой диметилсульфоксид (DMSO) или 1-метилпирролидон (NMP).
5. Способ по любому из пп.1-4, отличающийся тем, что реакционную смесь разбавляют водой или наливают реакционную смесь в воду, а затем нерастворимый продукт выделяют фильтрованием или центрифугированием.
6. Способ очистки соединения формулы I, полученного способом по любому из пп.1-5, отличающийся кристаллизацией из подходящих растворителей, выбранных из группы, включающей сложные эфиры алифатических кислот, выбранные из метилацетата, этилацетата, изопропилацетата, амиды, выбранные из N,N-диметилформамида, N,N-диметилацетамида, 1-метилпирролидона, простые эфиры, выбранные из тетрагидрофурана, диоксана, 1,2-диметоксиэтана, 1-метокси-2-(2-метоксиэтокси)этана, а также их смеси.
Текст
Способ получения 2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1Hбензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров формулы I, где R представляет собой либо H, либо (не)разветвленный C1-C4 алкил, ArСН 2, Ar2CH или Ar3C, где Ar представляет собой(не)замещенный фенил, являющихся ключевыми промежуточными соединениями для синтеза азилсартана; при данном способе взаимодействие соответствующего нитрила, имеющего формулуIV, проводят с водным гидроксиламином в полярном апротонном растворителе или в смеси таких растворителей. Область техники Изобретение относится к усовершенствованному способу получения 2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров (I) в которых R представляет собой либо H, либо (не)разветвленный C1-C4 алкил, ArCH2, Ar2CH илиAr3C, где Ar представляет собой (не)замещенный фенил, которые являются подходящими промежуточными соединениями для синтеза азилсартана (II), являющегося эффективным антагонистом ангиотензинаII в рецепторах АТ 1, применяемого для лечения гипертензии в форме его пролекарства азилсартана медоксомила (III). Предшествующий уровень техники Азилсартан (II) получают согласно опубликованным патентам (US 5583141 и EP 0520423) из исходного соединения метил-1-2'-цианодифенил-4-ил)метил)-2-этокси-1H-бензо[d]имидазол-7-карбоксилата (IVa). Данное соединение, являющееся хорошо известным промежуточным соединением синтеза кандесартана, сначала преобразуют путем взаимодействия с гидроксиламином, полученным in situ из гидроксиламина гидрохлорида, в метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4 ил)метил)-1H-бензо[d]имидазол-7-карбоксилат (Ia), который затем преобразуют в метил-2-этокси-1-2'(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоксилат(Va), из которого получают азилсартан (II) путем омыления. В вышеуказанных патентах преобразования нитрила (IVa) в амидоксим (Ia) достигают путем четырехчасового нагревания с гидроксиламином, полученным in situ путем взаимодействия гидроксиламина гидрохлорида с метанолятом натрия в диметилсульфоксиде (DMSO) при температуре, составляющей 90C, и сообщаемый выход соединения (Ia) составляет 90%. В более поздних публикациях те же авторы(Kohara Y., Imamiya E., Kubo K., Wada T., Inada Y., Naka Т.: Bioorg. Med. Chem. Lett. 1995, 5(7), 19031908; Kohara Y., Kubo K., Imamiya E., Wada T., Inada Y., Naka Т.: J. Med. Chem. 1996, 39(26), 5228-5235) получили гидроксиламин посредством триэтиламина и провели взаимодействие при температуре, составляющей 75C. Сообщаемое время реакции составляет 15 ч; после разбавления реакционной смеси водой сырой продукт получают путем экстракции этилацетатом в форме органического раствора, который затем промывают разбавленной соляной кислотой, и полученный в результате раствор амидоксима(Ia) гидрохлорида подщелачивают и снова экстрагируют этилацетатом с получением амидоксима (Ia) при выходе, составляющем 55%, после обработки. Описание изобретения В изобретении предложен новый эффективный способ получения 2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров (I). Эти соединения являются важными промежуточными соединениями при синтезе азилсартана. Данный способ состоит во взаимодействии соединений, имеющих формулу (IV), с водным раствором гидроксиламина. Полученные в результате соединения, имеющие формулу (I), получают при высоком выходе, и данный способ получения уменьшает образование нежелательных продуктов. Подробное описание изобретения В изобретении предложен новый эффективный способ получения 2-этокси-1-2'гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров (I), в которых R представляет собой либо H, либо (не)разветвленный C1-C4 алкил,ArCH2, Ar2CH или Ar3C, где Ar представляет собой (не)замещенный фенил. Эти соединения являются важными промежуточными соединениями при синтезе азилсартана. Данный способ состоит во взаимодействии соединений, имеющих формулу (IV) с водным раствором гидроксиламина в полярном апротонном растворителе. Полученные в результате соединения формулы (I) получают при высоком выходе, и данный способ получения подавляет образование нежелательных продуктов, в частности образование соединений, имеющих формулу (VI) в которых R является таким, как определено выше. Для данной реакции используют водный раствор гидроксиламина, имеющий концентрацию от 20 до 80 мас.%, в предпочтительном воплощении раствор, имеющий концентрацию 40-60 мас.%. Используемые полярные апротонные растворители включают диметилсульфоксид (DMSO), N,Nдиметилформамид (DMF), N,N-диметилацетамид (DMAc), 1-метилпирролидон (NMP), 1,1,3,3 тетраметилмочевину (TMU), 1,3-диметилимидазолидин-2-он (DMI), 1,3-диметил-3,4,5,6-тетрагидро 2(1H)-пиримидинон (DMPU), гексаметилфосфорамид (НМРА) или их смеси или, возможно, смеси с другими растворителями. В предпочтительном воплощении используют DMSO или NMP. Реакцию проводят при температуре, находящейся в диапазоне от 40 до 100C, предпочтительно при температуре, находящейся в диапазоне 50-90C. Реакционную смесь нагревают в течение достаточно длительного времени, находящемся в диапазоне от 12 до 48 ч; после того как реакция завершена, реакционную смесь обрабатывают путем разбавления водой или путем наливания реакционной смеси в воду. Затем отделенный продукт выделяют фильтрованием или центрифугированием. Неочищенные соединения формулы (I) получают с чистотой по меньшей мере 95%, с низким содержанием соединений формулы (VI). При необходимости неочищенные соединения формулы (I) можно очистить путем кристаллизации из подходящих растворителей, включающих сложные эфиры алифатических кислот (например, метилацетат, этилацетат, изопропилацетат), амиды (N,N-диметилформамид,N,N-диметилацетамид, 1-метилпирролидон), простые эфиры (например, тетрагидрофуран, диоксан, 1,2 диметоксиэтан, 1-метокси-2-(2-метоксиэтокси)этан или смесь этих растворителей. При повторении ранее описанных способов синтеза амидоксима (Ia) обнаружено, что в реакционной смеси помимо желаемого продукта присутствует как исходное соединение, так и значительное количество дезэтилнитрила (VIa). Побочный продукт (VIa) формально является продуктом гидролиза этоксигруппы в положении 2 бензимидазольного каркаса нитрила (IVa) где Me = CH3 В результате воспроизведения способа согласно EP 0520423 (см. примеры 1 и 5) получены сырые продукты, содержащие 17,6 и 19,7% соединения (VIa) соответственно. В результате повторения экспериментов в строго безводной среде получены сравнимые результаты. Образование соответствующих дезэтилнитрилов было также обнаружено при таких же взаимодействиях этилового эфира (IVb) и бензилового эфира (IVc) (см. примеры 6, 8 и 9). В результате модификации вышеописанных способов обнаружено, что ни изменение температуры, ни изменение основания не приводит в результате к существенному уменьшению количества данного побочного продукта (см. примеры 3, 6, 7 и 9). Хотя в оригинальных патентах или в цитируемых публикациях вовсе не упомянуто образование соединения (VIa), их авторы явным образом столкнулись с проблемами, связанными с образованием такого соединения, которые были решены авторами за счет упомянутой выше очистки неочищенного продукта,которая действительно способна удалить этот побочный продукт из неочищенного продукта (см. примеры 2 и 7). В результате повторения способа согласно патенту EP 0520423 с последующей кристаллизацией авторы изобретения обнаружили, что количество соединения (VIa) можно значительно уменьшить; например, с 18,9 до 1,3%. Тем не менее, эти процедуры приводят в результате к значительному снижению выхода. Настоящее изобретение основано на обнаружении того, что в некоторых строго определенных условиях может быть достигнуто почти полное подавление образования дезэтилнитрилов (VI). Обнаружено, что образование этих соединений в реакционной смеси в процессе образования гидроксиламина в виде основания in situ происходит как в присутствии избытка соли гидроксиламина (например, гидроксиламина гидрохлорида), так и в присутствии избытка большинства оснований, обычно используемых для высвобождения гидроксиламина основания. При подборе условий авторы изобретения обнаружили,что эта проблема может быть решена либо за счет использования слабых оснований для высвобождения гидроксиламина, либо за счет проведения последовательного добавления гидроксиламина в некоторых растворителях лишь при незначительно повышенной температуре. Характерным примером является использование NaHCO3 или NaOAc в кипящем метаноле или в смеси толуол-метанол. К сожалению, в этих условиях реакция идет очень медленно, и для достижения полного преобразования необходимо нагревание в течение нескольких суток. Что касается структуры побочных продуктов (IV), очень неожиданным является обнаружение того, что, если реакцию проводят с использованием водного раствора гидроксиламина, дезэтилнитрилы не образуются практически полностью. При всестороннем скрининге различных модификаций вышеупомянутых способов в качестве источника гидроксиламина использовали как гидроксиламина гидрохлорид и гидроксиламина сульфат, так и гидроксиламина фосфат. Для высвобождения гидроксиламина основания протестирован ряд соединений, включая амины (например, триэтиламин, диизопропилэтиламин (DIPEA), диазабициклоундецен(DBLJ), 1,8-бис-(диметиламино)нафталин), алкоголяты (например, MeONa, MeOK, EtONa, трет-BuONa,трет-BuOK, трет-AmONa, трет-AmOK), гидроксиды (NaOH, KOH, CsOH), карбонаты (Na2CO3, K2CO3,CsCO3), гидрокарбонаты (NaHCO3, KHCO3) и ацетаты (NaOAc, KOAc), в ряде растворителей и их смесей. Значительное уменьшение образования дезэтилнитрилов (VI) было достигнуто, когда реакцию проводили в метаноле или в его смеси с толуолом при использовании слабых оснований. Оказалось, что наиболее удобно использовать NaHCO3 или NaOAc в метаноле или в его смеси с толуолом при кипячении с обратным холодильником. К сожалению, в данных условиях реакция идет в значительной степени медленно, и значительная часть исходного соединения остается не прореагировавшей даже через 48 ч. Значительное усовершенствование было достигнуто в результате использования водного раствора гидроксиламина. Данный способ не требует добавления каких-либо неорганических или органических оснований, и, следовательно, отсутствует риск загрязнения продукта. Осуществление этой реакции является очень простым и состоит исключительно в нагревании исходного нитрила (IV) с водным гидроксиламином в подходящем растворителе. После достижения желаемого преобразования добавляют воду(или реакционную смесь наливают в воду), полученный в результате продукт (I) отделяется в форме хорошо фильтруемого осадка, и после промывания получают продукт высокой чистоты. Этот продукт можно дополнительно перекристаллизовать или предпочтительно использовать после высушивания непосредственно для дальнейшего взаимодействия. Для взаимодействия с нитрилами (IV) можно использовать водный гидроксиламин, содержащий 2080 мас.% гидроксиламина, предпочтительно 40-60 мас.%. Использование водного гидроксиламина, содержащего 50 мас.% гидроксиламина, наиболее удобно с точки зрения коммерческой доступности. Эта реакция идет даже при лабораторной температуре, но в отношении ее продолжительности более предпочтительно проводить ее при повышенной температуре, предпочтительно находящейся в диапазоне от 40 до 100C. Даже при более высоких температурах не наблюдали появления более значительного количества дезэтилнитрила (VI). Наиболее предпочтительно проводить реакцию при температуре,составляющей 50-90C. В связи с ограниченной растворимостью исходных нитрилов (IV) число подходящих растворителей ограничено полярными апротонными растворителями, такими как сульфоксиды (например, DMSO),амиды (например, N,N-диметилформамид (DMF), N,N-диметилацетамид (DMAc), 1-метилпирролидон(TMU),1,3 диметилимидазолидин-2-он (DMI), 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон (DMPU, гексаметилфосфорамид (НМРА) или их смеси. Эту реакцию можно также проводить в смеси вышеуказанных растворителей с другими сорастворителями, такими как сложные эфиры (например, алкилацетаты, такие как метилацетат или этилацетат) или ароматические углеводороды (например, толуол) или диглим (диметиловый эфир диэтиленгликоля). В процессе разработки синтеза алкил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4 ил)метил)-1H-бензо[d]имидазол-7-карбоксилатов мониторинг реакций проводили рутинными методами,такими как ВЭЖХ (высокоэффективная жидкостная хроматография), в устройстве HP 1050, оборудованном колонкой Phenomenex Luna 5C18(2), 2504,6 мм, а также оборудованном УФ детектором 227 нм. Фаза А: 1,2 г NaH2PO/1 л воды (pH 3,0); фаза В: метанол. Изобретение объяснено более подробно в приведенных ниже рабочих примерах. Примеры, которые иллюстрируют усовершенствование способа согласно изобретению, носят только иллюстративный характер и не ограничивают объем изобретения ни в каком отношении. Рабочие примеры Сравнительные примеры. Пример 1. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - воспроизведение способа (US 5583141; EP 0520423). 30% Раствор MeONa в МеОН (9,1 г) добавляли к перемешанной смеси тонкоизмельченного гидроксиламина гидрохлорида (3,5 г, 50 ммоль) в сухом DMSO (40 мл),и смесь перемешивали в атмосфере азота при лабораторной температуре в течение 10 мин. Затем добавляли нитрил (IVa; 4,11 г, 10 ммоль) и смесь перемешивали при температуре, составляющей 90C, в течение 4 ч. Согласно ВЭЖХ смесь содержит 32,3% продукта (Ia), 49,9% исходного нитрила (IVa) и 17,6% дезэтилнитрила (VIa). Реакционную смесь охлаждали до лабораторной температуры, затем добавляли воду (25 мл), смесь, нагретую в результате разбавления, охлаждали и перемешивали при лабораторной температуре в течение 30 мин. Нерастворимую фракцию аспирировали, промывали водой и высушивали на воздухе. Было получено 3,9 г вещества, содержащего согласно ВЭЖХ 30,7% продукта (Ia), 49,8% исходного нитрила (IVa) и 18,9% дезэтилнитрила (VIa). Пример 2. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - модификация способа (US 5583141; EP 0520423). Продукт, полученный с использованием способа, описанного в примере 1 (3,9 г), растворяли в дихлорметане (400 мл) и полученный в результате все еще мутный раствор промывали 450 мл 5% HCl. Водный раствор, полученный таким путем, подщелачивали концентрированным (20%) раствором гидроксида натрия и полученный в результате осадок аспирировали и промывали водой. После высушивания было получено 1,6 г (суммарный выход примеров 1 и 2 составляет 36,0%) вещества (Ia), содержащего согласно ВЭЖХ 96,7% продукта (Ia), необнаружимое количество исходного нитрила (IVa) и 1,3% дезэтилнитрила (VIa). Пример 3. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - модификация способа (US 5583141; EP 0520423). Используя способ, описанный в примере 1, но проводя реакцию при температуре, составляющей 90C, в течение 20 ч получили реакционную смесь, содержащую согласно ВЭЖХ 44,7% продукта (Ia),11,4% исходного нитрила (IVa) и 40,5% дезэтилнитрила (VIa). Пример 4. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - модификация способа (US 5583141; EP 0520423). Используя способ, описанный в примере 1, но проводя реакцию при температуре, составляющей 75C, в течение 24 ч получили реакционную смесь, содержащую согласно ВЭЖХ 30,7% продукта (Ia),49,8% исходного нитрила (IVa) и 18,8% дезэтилнитрила (VIa). Пример 5. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - воспроизведение способа (J. Med. Chem. 1996, 39(26), 5228-5235). Триэтиламин (1,7 мл = 1,24 г) добавляли к суспензии гидроксиламина гидрохлорида (0,85 г, 12,2 ммоль) в DMSO (4 мл) и смесь перемешивали при лабораторной температуре в течение 15 мин. Затем густую суспензию аспирировали и промывали тетрагидрофураном (10 мл). Фильтрат концентрировали в вакууме (большую часть тетрагидрофурана выпаривали). К этому раствору добавляли нитрил (IVa; 1,03 г, 2,5 ммоль) и смесь перемешивали при температуре 75C в течение 15 ч. Согласно ВЭЖХ смесь содержит 44,2% продукта (Ia), 35,2% исходного нитрила (IVa) и 19,7% дезэтилнитрила (VIa). Пример 6. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - модификация способа (US 5583141; EP 0520423). Используя способ, описанный в примере 1, но проводя реакцию с этиловым эфиром (IVb; 8,5 г, 20 ммоль) при температуре 90C в течение 14 ч, получили реакционную смесь, содержащую согласно ВЭЖХ 68,8% продукта (Ib), 5,2% исходного нитрила (IVb) и 22,9% дезэтилнитрила (VIb). После наливания реакционной смеси на воду полученный в результате осадок аспирировали, промывали водой и высушивали (9,45 г). Раствор этого вещества в дихлорметане (900 мл) встряхивали с 5% HCl (4100 мл),объединенные водные фракции подщелачивали концентрированным NaOH и полученную в результате тонкодисперсную суспензию перемешивали при лабораторной температуре в течение ночи. Затем нерастворимую фракцию аспирировали, промывали водой и высушивали. После кристаллизации из этилацетата получили 4,7 г (51,2%) кристаллов кремового цвета, содержащих согласно ВЭЖХ 96,8% продукта(Ib), 0% исходного нитрила (IVb) и 0,2% дезэтилнитрила (VIb). Пример 7. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - модификация способа (US 5583141; EP 0520423). Используя способ, описанный в примере 4, но проводя реакцию с этиловым эфиром (IVb; 1,7 г, 4 ммоль) при температуре 75C в течение 24 ч, получили реакционную смесь, содержащую согласно ВЭЖХ 58,9% продукта (Ib), 8,3% исходного нитрила (IVb) и 20,7% дезэтилнитрила (VIb). После наливания реакционной смеси на воду полученный в результате осадок аспирировали, промывали водой и высушивали (1,7 г). Раствор этого вещества в дихлорметане (300 мл) встряхивали с 5% HCl (335 мл объединенные водные фракции подщелачивали концентрированным NaOH и полученную в результате тонкодисперсную суспензию экстрагировали дихлорметаном. После промывания водой экстракт высушивали MgSO4 и после выпаривания получили 0,8 г (43,6%) продукта выпаривания (100% чистого продукта) согласно ВЭЖХ. Пример 8. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - модификация способа (J. Med. Chem. 1996, 39(26), 5228-5235). Используя способ, описанный в примере 5, но проводя реакцию с этиловым эфиром (IVb), получили реакционную смесь, содержащую согласно ВЭЖХ 42,5% продукта (Ib), 39,7% исходного нитрила(IVb) и 17,6% дезэтилнитрила (VIb). Пример 9. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - модификация способа (J. Med. Chem. 1996, 39(26), 5228-5235). Триэтиламин (3,4 мл = 2,48 г) добавляли к суспензии гидроксиламина гидрохлорида (1,7 г, 25 ммоль) в DMSO (8 мл) и смесь перемешивали при лабораторной температуре в течение 15 мин. Затем густую суспензию аспирировали и промывали тетрагидрофураном (10 мл). Фильтрат концентрировали в вакууме (большую часть тетрагидрофурана выпаривали). К этому раствору добавляли нитрил (IVa; 2,06 г, 5 ммоль) и смесь перемешивали при лабораторной температуре в течение 15 мин. Затем смесь распределяли на 4 реакционных пробирки и перемешивали их при лабораторной температуре (А), при температуре 50C (В), 75C (С) и 100C (D) в течение 48 ч. Затем реакционные смеси анализировали, используя ВЭЖХ. Результаты суммированы в табл. I. Таблица I Композиция реакционной смеси примера 9 Пример 10. Бензил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ic) - модификация способа (US 5583141; EP 0520423). Используя способ, описанный в примере 4, но проводя реакцию с бензиловым эфиром (IVc) при 75C в течение 24 ч получили реакционную смесь, содержащую согласно ВЭЖХ 52,8% продукта (Ic),13,4% исходного нитрила (IVc) и 23,7% дезэтилнитрила (VIc). Пример 11. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - использование NaHCO3 в качестве основания. Гидрокарбонат натрия (0,2 г, 2,4 ммоль) добавляли к суспензии гидроксиламина гидрохлорида (0,15 г, 2,2 ммоль) в метаноле (10 мл) и смесь перемешивали при лабораторной температуре в течение 10 мин. Затем добавляли нитрил (IVb, 0,43 г, 1 ммоль) и смесь нагревали при умеренном рефлюксе в течение 24 ч. Согласно ВЭЖХ смесь содержит 32,1% продукта (Ib), 65,9% исходного нитрила (IVb) и 2,0% дезэтилнитрила (VIb). К смеси добавляли другую порцию гидрокарбоната натрия (0,2 г, 2,4 ммоль) и гидроксиламина гидрохлорида (0,15 г, 2,2 ммоль) и смесь нагревали при умеренном рефлюксе еще в течение 24 ч. Согласно ВЭЖХ смесь содержит 56,2% продукта (Ib), 33,2% исходного нитрила (IVb) и 5,1% дезэтилнитрила (VIb). После охлаждения смесь наливали в воду (50 мл), нерастворимую фракцию аспирировали и промывали водой. После высушивания получили 0,35 г вещества, содержащего согласно ВЭЖХ 54,7% продукта (Ib), 31,3% исходного нитрила (IVb) и 6,8% дезэтилнитрила (VIb). Пример 12. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - использование NaOAc в качестве основания. Ацетат натрия (0,2 г, 2,4 ммоль) добавляли к суспензии гидроксиламина гидрохлорида (0,15 г, 2,2 ммоль) в толуоле (10 мл) и смесь перемешивали при лабораторной температуре в течение 10 мин. Затем добавляли нитрил (IVb, 0,41 г, 1 ммоль), смесь нагревали при умеренном рефлюксе в течение 24 ч. Согласно ВЭЖХ смесь содержит 36,2% продукта (Ia), 58,7% исходного нитрила (IVa) и 3,4% дезэтилнитрила (VIa). К смеси добавляли другую порцию ацетата натрия (0,2 г, 2,4 ммоль) и гидроксиламина гидрохлорида (0,15 г, 2,2 ммоль) и смесь нагревали при умеренном рефлюксе еще в течение 24 ч. Согласно ВЭЖХ смесь содержит 58,1% продукта (Ia), 32,5% исходного нитрила (IVa) и 7,1% дезэтилнитрила (VIa). Реакционную смесь наливали в воду (50 мл) при перемешивании, нерастворимую фракцию аспирировали и после высушивания получили 0,26 г вещества, содержащего согласно ВЭЖХ 78,3% продукта (Ia),3,6% исходного нитрила (IVa) и 13,2% дезэтилнитрила (VIa). Фильтрат распределяли и толуольный слой на основании анализа с помощью ВЭЖХ содержит 10,6% продукта (Ia), 85,9% исходного нитрила (IVa) и 2,7% дезэтилнитрила (VIa). Рабочие примеры с использованием водного гидроксиламина Пример 13. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - использование водного гидроксиламина. 50% водный раствор гидроксиламина (0,3 мл) добавляли к раствору нитрила (IVa; 0,41 г, 1 ммоль) в соответствующем растворителе (4 мл) и смесь перемешивали в реакционной пробирке при температуре 75C в течение 24 ч, реакционные смеси анализировали с помощью ВЭЖХ. Результаты суммированы в табл. II. Таблица II Композиция реакционной смеси примера 12 После еще 24 ч смесь содержала согласно ВЭЖХ 81,6% продукта (Ia),2,7% исходного нитрила (IVa) и 1,2% дезэтилнитрила (VIa). Пример 14. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - использование водного гидроксиламина. 50% водный раствор гидроксиламина (0,3 мл) добавляли к раствору нитрила (IVa; 0,43 г, 1 ммоль) в соответствующем растворителе (4 мл) и смесь перемешивали в реакционной пробирке при температуре 75C в течение 24 ч, реакционные смеси анализировали с помощью ВЭЖХ. Результаты суммированы в табл. III. Таблица III Композиция реакционной смеси примера 13 Пример 15. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - использование водного гидроксиламина. 25% водный раствор гидроксиламина (1,5 мл) добавляли к раствору нитрила (IVb; 0,86 г, 2 ммоль) вDMSO (8 мл) и смесь перемешивали при температуре 75C в течение 24 ч. Охлажденную реакционную смесь наливали на воду (25 мл), нерастворимую фракцию аспирировали, промывали водой и высушивали. Было получен продукт, содержащий согласно ВЭЖХ 89,6% продукта (Ib), 6,3% исходного нитрила(IVb) и 2,5% дезэтилнитрила (VIb). Пример 16. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (3 мл) добавляли к перемешанной смеси нитрила (IVb,8,6 г, 20 ммоль) и DMSO (60 мл), смесь перемешивали в атмосфере азота при температуре 75C в течение 17 ч. Затем добавляли дополнительное количество 50% водного гидроксиламина (2 мл), нагревание продолжали еще в течение 7 ч. Согласно ВЭЖХ смесь содержит 72,8% продукта (Ib), 20,2% исходного нитрила (IVb) и 2,3% дезэтилнитрила (VIb). После добавления дополнительного количества 50% водного гидроксиламина (2 мл) нагревание продолжали еще в течение 12 ч. Согласно ВЭЖХ смесь содержит 91,3% продукта (Ib), 0,5% исходного нитрила (IVb) и 2,9% дезэтилнитрила (VIb). После охлаждения по каплям добавляли воду (50 мл), смесь перемешивали в течение 30 мин, а затем нерастворимую фракцию аспирировали и промывали водой (100 мл). После высушивания получили 8,9 г продукта (97,1%), содержащего согласно ВЭЖХ 98,6% продукта (Ib), 0,3% исходного нитрила (IVb) и 0,2% дезэтилнитрила(VIb). Путем кристаллизации образца из этилацетата был получен абсолютно чистый продукт (согласно ВЭЖХ), имеющий температуру плавления 209-211C. Спектр 1H ЯМР (DMSO-d6): 1H ЯМР (500 МГц, DMSO)(млн-1): 9.19 (bs, 1H, OH), 7.69 (dd, J = 7.9,1.2 Гц, 1H, Ar), 7.46 (dd, J = 7.9, 1.2 Гц, 1H, Ar), 7.45-7.32 (гл, 3H, Ar), 7.35 (d, J = 8.4 Гц, 2H, Ar), 7.27 (dd,J = 7.6, 1.5 Гц, 1H, Ar), 7.19 (t, J = 7.9 Гц, 1H, Ar), 6.93 (d,J = 8.4 Гц, 2H, Ar), 5.55 (bs, 2H, NH2), 5.53 (s, 2H,N-CH2-Ar), 4.62 (q, J = 7.1 Гц, 2H, OCH2CH3), 4.22 (q, J = 7.1 Гц, 2H, COOCH2CH3), 1.42 (t, J= 7.1 Гц, 3H,OCH2CH3), 1.18 (t, J = 7.1 Гц, 3H, COOCH2CH3). Пример 17. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - использование водного гидроксиламина. Следуя способу, описанному в примере 16, используя нитрил (IVa), получили 96,3% продукта, содержащего согласно ВЭЖХ 96,9% продукта (Ia), 1,6% исходного нитрила (IVa) и 0,7% дезэтилнитрила(VIa). Путем кристаллизации образца из метилацетата был получен абсолютно чистый продукт (согласно ВЭЖХ), имеющий температуру плавления 208-210C. Спектр 1H ЯМР (DMSO-d6): 1H ЯМР (500 МГц, DMSO)(млн-1): 9.18 (s, 1H, OH), 7.70 (dd, J= 7.9,1.2 Гц, 1H, Ar), 7.46 (dd, J= 7.9, 1.2 Гц, 1H, Ar), 7.45-7.33 (m, 3H, Ar), 7.35 (d, J = 8.3 Гц, 2H, Ar), 7.29 (dd,J= 7.6, 1.5 Гц, 1H, Ar), 7.19 (t, J= 7.9 Гц, 1H, Ar), 6.94 (d, J = 8.3 Гц, 2H, Ar), 5.55 (bs, 2H, NH2), 5.51 (s, 2H,N-CH2-Ar), 4.62 (q, J = 7.1 Гц, 2H, OCH2CH3), 3.71 (s, 3H, ОСН 3), 1.42 (t, J = 7.1 Гц, 3H, OCH2CH3). Пример 18. Бензил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ic) - использование водного гидроксиламина. Следуя способу, описанному в примере 16, используя нитрил (IVc), получили 89,7% продукта, содержащего согласно ВЭЖХ 87,7% продукта (Ic), 2,7% исходного нитрила (IVc) и 3,5% дезэтилнитрила(VIc). Путем кристаллизации образца из изопропилацетата был получен абсолютно чистый продукт (согласно ВЭЖХ), имеющий температуру плавления 171-173C. Спектр 1H ЯМР (DMSO-d6): 9.19 (s, 1H, OH), 7.70 (dd, J = 7,9, 1.2 Гц, 1H, Ar), 7.51 (dd, J = 7.9, 1.2 Гц, 1H, Ar), 7.45-7.29 (гл, 8H, Ar), 7.31 (d, J = 8.4 Гц, 2H, Ar), 7.23 (dd, J = 7.6, 1.5 Гц, 1H, Ar), 7.19 (t, J = 7.9 Гц, 1H, Ar), 6.90 (d, J = 8.4 Гц, 2H, Ar), 5.54 (bs, 2H, NH2), 5.53 (s, 2H, N-CH2-Ar), 5.27 (s, 2H, COOCH2-7 023029Ph), 4.63 (q, J = 7.1 Гц, 2H, OCH2CH3), 1.43 (t, J = 7.1 Гц, 3H, OCH2CH3). Пример 19. Бензгидрил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1Hбензо[d]имидазол-7-карбоксилат (Id) - использование водного гидроксиламина. Следуя способу, описанному в примере 16, используя нитрил (IVd), получили 84,9% продукта, содержащего согласно ВЭЖХ 93,7% продукта (Id), 4,2% исходного нитрила (IVd) и 2,1% дезэтилнитрила(VId). Путем кристаллизации образца из изопропилацетата был получен абсолютно чистый продукт (согласно ВЭЖХ), имеющий температуру плавления, равную 234-237C. Спектр 1H ЯМР (DMSO-d6): 9.19 (s, 1H, OH), 7.76-7.70 (m, 2H, Ar), 7.53-7.44 (m, 4H, Ar), 7.42-7.28[d]имидазол-7-карбоксилат (Ie) - использование водного гидроксиламина. Следуя способу, описанному в примере 16, используя нитрил (IVe), получили 89,2% продукта, содержащего согласно ВЭЖХ 84,4% продукта (Ie), 2,1% исходного нитрила (IVe) и 5,2% дезэтилнитрила(VIe). Путем кристаллизации образца из изопропилацетата был получен продукт, имеющий температуру плавления 222-238C (разложение), содержащий 92,4% продукта (Ie) и 7,6% дезэтилнитрила (VIe) согласно ВЭЖХ. Пример 21. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (5 мл) добавляли к перемешанной смеси нитрила (IVa,4,1 г, 10 ммоль) и DMSO (30 мл) и смесь перемешивали в закрытой колбе под давлением при температуре, составляющей 75C, в течение 18 ч. Согласно ВЭЖХ смесь содержит 78,2% продукта (Ia), 0,2% исходного нитрила (IVa) и 2,2% дезэтилнитрила (VIa). После охлаждения смесь наливали в воду (50 мл), а затем нерастворимую фракцию аспирировали и промывали водой (50 мл). После высушивания получили 4,1 г продукта (92,2%), содержащего согласно ВЭЖХ 99,1% продукта (Ia), необнаружимое количество исходного нитрила (IVa) и 0,1% дезэтилнитрила (VIa). В результате кристаллизации из изопропилацетата был получен продукт, имеющий температуру плавления 206-209C, содержащий согласно ВЭЖХ 99,9% продукта (Ia). Пример 22. Этил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ib) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (5 мл) добавляли к перемешанной смеси нитрила (IVb,8,6 г, 20 ммоль) и NMP (50 мл), смесь перемешивали в атмосфере азота при температуре, составляющей 90C, в течение 10 ч. Затем добавляли дополнительное количество 50% водного гидроксиламина (3 мл) и нагревание продолжали еще в течение 5 ч. Согласно ВЭЖХ смесь содержит 83,6% продукта (Ib), не содержит обнаружимого количества исходного нитрила (IVb) и содержит 2,2% дезэтилнитрила (VIb). После охлаждения смесь наливали в воду (100 мл), а затем нерастворимую фракцию аспирировали и промывали водой (100 мл). После высушивания получили 8,9 г продукта (97%), содержащего согласно ВЭЖХ 96,6% продукта (Ib). В результате кристаллизации из этилацетата был получен продукт, имеющий температуру плавления 209-211C, содержащий согласно ВЭЖХ 99,7% продукта (Ib). Пример 23. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоксилат (Ia) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (6 мл) добавляли к перемешанной смеси нитрила (IVa,8,2 г, 20 ммоль) и DMPU (50 мл) и смесь перемешивали в закрытой колбе под давлением при температуре 75C в течение 24 ч. Согласно ВЭЖХ смесь содержит 89,8% продукта (Ia), 2,2% исходного нитрила(IVa) и 1,9% дезэтилнитрила (VIa). После охлаждения смесь наливали в воду (100 мл), а затем нерастворимую фракцию аспирировали и промывали водой (100 мл). После высушивания получили 8,35 г продукта (93,9%), содержащего согласно ВЭЖХ 99,4% продукта (Ia), 0,2% исходного нитрила (IVa) и 0,2% дезэтилнитрила (VIb). Пример 24. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (10 мл) добавляли к перемешанной смеси нитрила (IVa,8,2 г, 20 ммоль) и NMP (50 мл) и смесь перемешивали в закрытой колбе под давлением при температуре 75C в течение 48 ч. Согласно ВЭЖХ смесь содержит 74,0% продукта (Ia), не содержит обнаружимого количества исходного нитрила (IVa) и содержит 1,5% дезэтилнитрила (VIa). После охлаждения смесь наливали в воду (100 мл), а затем нерастворимую фракцию аспирировали и промывали водой (100 мл). После высушивания получили 7,1 г продукта (79,9%), содержащего согласно ВЭЖХ 89,4% продукта (Ia),не содержащего обнаружимого количества исходного нитрила (IVa) и содержащего 2,2% дезэтилнитрила(VIa). В результате кристаллизации из тетрагидрофурана получили продукт, содержащий согласно ВЭЖХ 98,3% продукта (Ia). Пример 25. Метил-2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d] имидазол-7-карбоксилат (Ia) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (5 мл) добавляли к перемешанной смеси нитрила (IVa,4,1 г, 10 ммоль), NMP (20 мл) и толуола (5 мл) и смесь перемешивали в закрытой колбе под давлением при температуре 90C в течение 18 ч. Согласно ВЭЖХ смесь содержит 76,3% продукта (Ib), не содержит обнаружимого количества исходного нитрила (IVb) и содержит 1,8% дезэтилнитрила (VIb). После охлаждения смесь наливали в воду (50 мл), а затем нерастворимую фракцию аспирировали и промывали водой (50 мл). После высушивания получили 3,7 г продукта (83,2%), содержащего согласно ВЭЖХ 88,5% продукта (Ib), не содержащего обнаружимого количества исходного нитрила (IVb) и содержащего 2,7% дезэтилнитрила (VIb). В результате кристаллизации из 1,2-диметоксиэтана получили продукт, содержащий согласно ВЭЖХ 99,3% продукта (Ia). Пример 26. 2-Этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1H-бензо[d]имидазол-7-карбоновая кислота (If) - использование водного гидроксиламина. 50 мас.% водный раствор гидроксиламина (0,3 мл) добавляли к перемешанной смеси кислоты (IVf,0,4 г, 1 ммоль) и DMSO (3 мл) и смесь перемешивали в пробирке при температуре 50C в течение 24 ч. После охлаждения смесь наливали в воду (10 мл) и после подкисления уксусной кислотой отделенную нерастворимую фракцию аспирировали и промывали водой. После высушивания получили 0,4 г продукта (91,6%), содержащего согласно ВЭЖХ 86,5% продукта (If). В результате повторной кристаллизации из этилацетата получили продукт, содержащий согласно ВЭЖХ 98,7% продукта (If), имеющего точку плавления 208-212C. Спектр 1H ЯМР (DMSO-d6): 13.19 (bs, 1H, COOH), 9.22 (bs, 1H, OH), 7.65 (dd, J = 7.9, 1.2 Гц, 1H, Ar),7.53 (dd, J = 7.9, 1.2 Гц, 1H, Ar), 7.45-7.32 (m, 3H, Ar), 7.35 (d, J = 8.4 Гц, 2H, Ar), 7.29 (dd, J = 7,6, 1.5 Гц,1H, Ar), 7.17 (t, J = 7.9 Гц, 1H, Ar), 6.99 (d, J = 8.4 Гц, 2H, Ar), 5.65 (s, 2H, N-CH2-Ar), 5.57 (bs, 2H, NH2),4.61 (q, J = 7.1 Гц, 2H, OCH2CH3), 1.42 (t, J = 7.1 Гц, 3H, OCH2CH3). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 2-этокси-1-2'-гидроксиамино)иминометил)дифенил-4-ил)метил)-1Hбензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров формулы (I) где R представляет собой Н, (не)разветвленный C1-C4 алкил, ArCH2, Ar2CH или Ar3C, где Ar представляет собой (не)замещенный фенил, отличающийся тем, что соответствующий нитрил формулы (IV) где R является таким, как определено выше, подвергают взаимодействию с водным раствором, содержащим 25-50 мас.% гидроксиламина в полярном апротонном растворителе или в смеси полярных апротонных растворителей при температуре 50-90C. 2. Способ по п.1, отличающийся тем, что R представляет собой Н, метил, этил, бензил, бензгидрил или тритил. 3. Способ по п.1, отличающийся тем, что полярный апротонный растворитель выбран из группы,состоящей из диметилсульфоксида, N,N-диметилформамида, N,N-диметилацетамида, 1-метилпирролидона, 1,1,3,3-тетраметилмочевины, 1,3-диметилимидазолидин-2-она, 1,3-диметил-3,4,5,6-тетрагидро 2(1H)-пиримидинона и гексаметилфосфорамида, а также их смесей. 4. Способ по п.3, отличающийся тем, что указанный растворитель представляет собой диметилсульфоксид (DMSO) или 1-метилпирролидон (NMP). 5. Способ по любому из пп.1-4, отличающийся тем, что реакционную смесь разбавляют водой или наливают реакционную смесь в воду, а затем нерастворимый продукт выделяют фильтрованием или центрифугированием. 6. Способ очистки соединения формулы I, полученного способом по любому из пп.1-5, отличающийся кристаллизацией из подходящих растворителей, выбранных из группы, включающей сложные эфиры алифатических кислот, выбранные из метилацетата, этилацетата, изопропилацетата, амиды, выбранные из N,N-диметилформамида, N,N-диметилацетамида, 1-метилпирролидона, простые эфиры, выбранные из тетрагидрофурана, диоксана, 1,2-диметоксиэтана, 1-метокси-2-(2-метоксиэтокси)этана, а также их смеси. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 235/26
Метки: кислоты, способ, получения, сложных, 2-этокси-1-((2'-((гидроксиамино)иминометил)дифенил-4-ил)метил)-1h-бензо[d]имидазол-7-карбоновой, эфиров
Код ссылки
<a href="https://eas.patents.su/10-23029-sposob-polucheniya-2-etoksi-1-2-gidroksiaminoiminometildifenil-4-ilmetil-1h-benzodimidazol-7-karbonovojj-kisloty-i-ee-slozhnyh-efirov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 2-этокси-1-((2′-((гидроксиамино)иминометил)дифенил-4-ил)метил)-1h-бензо[d]имидазол-7-карбоновой кислоты и ее сложных эфиров</a>
Предыдущий патент: Способ извлечения лигнина
Следующий патент: Новые соединения в качестве ингибиторов диацилглицеролацилтрансферазы
Случайный патент: Мягкая трубка для медицинских целей,система мягких трубок для медицинских целей и их применение