Феноксифенилсульфонилгалогениды и способ их получения
Формула / Реферат
1. Соединение формулы
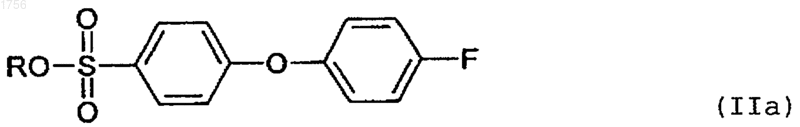
где R представляет собой Н, Li, Na, K, Мg или NH4.
2. Соединение формулы

где m является целым числом от 1 до 3;
R2 представляет собой фтор, хлор, бром, (C1-C6)алкил, (C1-C6)алкокси или перфтор (C1-С3)алкил.
3. Соединение по п.2, где R2 представляет фтор.
4. Соединение по п.3, где R2 находится в положении 4 фенильного кольца.
5. Способ получения соединение формулы
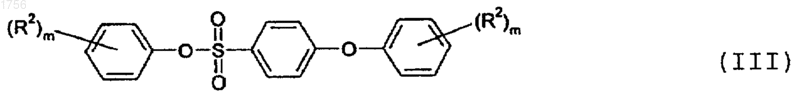
где m является целым числом от 1 до 3;
R2 представляет собой фтор, хлор, бром, (C1-C6)алкил, (C1-C6)алкокси или перфтор (C1-С3)алкил;
включающий взаимодействие соединения формулы

где R3 представляет собой фтор, хлор или бром; а
R4 представляет хлор или бром;
с соединением формулы

где m является целым числом от 1 до 3;
R2 представляет собой фтор, хлор, бром, (C1-C6)алкил, (C1-C6)алкокси или перфтор(C1-С3)алкил;
в присутствии основания и растворителя при температуре от 0 до примерно 150шС.
6. Способ по п.5, где указанное основание является трет-бутоксидом калия, а указанный растворитель является N-метилпирролидиноном.
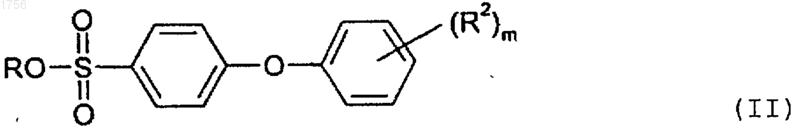
7. Способ по п.5, который дополнительно включает взаимодействие указанного соединения формулы III с основанием в растворителе при температуре от примерно 50шС до примерно 100шС с образованием соединения формулы

где m является целым числом от 1 до 3;
R представляет собой Н, Li, Na, K или NH4, и R2 представляет собой фтор, хлор, бром, (C1-C6)алкил, (C1-C6)алкокси или перфтор (C1-С3)алкил.
8. Способ по п.7, где указанное основание является гидроксидом натрия, а указанный растворитель является этанолом.
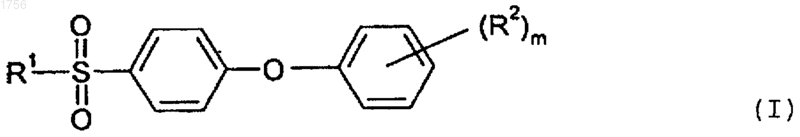
9. Способ по п.7, который дополнительно включает взаимодействие соединения формулы
где m является целым числом от 1 до 3;
R представляет собой Н, Li, Na, K или NH4, и
R2 представляет собой фтор, хлор, бром, (C1-C6)алкил, (C1-С6)алкокси или перфтор (C1-С3)алкил;
с галогенирующим агентом в растворителе при температуре от 0 до примерно 80шС с образованием соединения формулы
где R1 представляет собой галоген и m является целым числом от 1 до 3.
10. Способ по п.9, где R1 представляет собой хлор.
11. Способ по п.9, где R2 представляет собой фтор.
12. Способ по п.9, где R1 находится в положении 4 фенильного кольца.
13. Способ по п.9, где указанный галогенирующий агент является тионилхлоридом.
14. Способ по п.9, который дополнительно включает добавление катализатора и растворителя.
15. Способ по п.14, где указанный катализатор является диметилформамидом, а указанный растворитель является толуолом.
Текст
1 Предпосылки создания изобретения Данное изобретение относится к способу получения феноксифенилсульфонилгалогенидов, которые применимы в качестве промежуточных соединений для получения ингибиторов матричных металлопротеиназ и к их промежуточным соединениям. Как известно, ингибиторы матричных металлопротеиназ (ММП) применимы для лечения патологического состояния, выбираемого из группы, состоящей из артрита (включая остеоартрит и ревматоидный артрит), воспалительного заболевания кишечника, болезни Крона, эмфиземы, острого респираторного дистресссиндрома, астмы, хронического обструктивного заболевания легких, болезни Альцгеймера, токсического эффекта при пересадке органов, кахексии, аллергических реакций, аллергической контактной гиперчувствительности, рака, язв тканей, рестеноза, периодонта, иных заболеваний врожденного буллезного эпидермолиза,остеопороза, расшатывания имплантатов искусственных суставов, атеросклероза (включая отрыв атеросклеротической бляшки), аневризмы аорты (включая аневризму абдоминального отдела аорты и аневризму отдела аорты головного мозга), застойной сердечной недостаточности,инфаркта миокарда, удара (инсульта), церебральной ишемии, травмы головы, повреждения спинного мозга, нейро-дегенеративных заболеваний (острых и хронических, аутоиммунных заболеваний, болезни Хантингтона, болезни Паркинсона, мигрени, депрессии, периферической нейропатии, боли, церебральной амилоидной ангиопатии, усиления интеллектуальных или познавательных способностей, бокового амиотрофического склероза, множественного склероза, ангиогенеза глаз, повреждения роговицы, появления пятен на роговице, ненормального заживления ран, ожогов, диабета, опухолевой инвазии, роста опухоли, метастазирования опухоли, рубцов роговицы, склерита, СПИДа,сепсиса, септического шока и других заболеваний, характеризующихся ингибированием металлопротеиназы или экспрессии ADAM (включая ФНО-). Кроме того, продукты, которые могут быть получены из соединений и по способам данного изобретения, могут использоваться в комбинированной терапии со стандартными нестероидными противовоспалительными лекарственными средствами (здесь далее НПВС), ингибиторами СОХ-2 и анальгетиками для лечения артрита и в комбинации с цитотоксическими лекарственными препаратами, такими как адриамицин, дауномицин, цис-платин,этопозид, таксол, таксотер, и алкалоидами, такими как винкристин, при лечении рака. Ингибиторы матричных металлопротеиназ известны из литературы. В частности, РСТ Publication WO 96/33172, опубликованная 24 октября 1996 г.,относится к циклическим арилсульфониламиногидроксамовым кислотам, которые применимыPublication WO 98/30768, опубликованная 6 августа 1998 г, озаглавленная "Производные арилсульфониламиногидроксамовой кислоты", относится к N-незамещенным арилсульфониламиногидроксамовым кислотам. РСТ Publication WO 98/33566, опубликованная 16 июля 1998 г, озаглавленная "Циклические сульфоновые производные", относится к циклическим сульфоновым гидроксамовым кислотам в качестве ингибиторов ММП. Заявка США на предварительный патент 60/55208, поданная 8 августа 1997 г.,относится к биарилгидроксамовым кислотам в качестве ингибиторов ММП. Заявка США на предварительный патент, серийный 60/55207,поданная 8 августа 1997 г, озаглавленная "Производные арилоксисульфониламиногидроксамовой кислоты, относится к арилоксиарилсульфонилгидроксамовым кислотам в качестве ингибиторов ММП. Заявка США на предварительный патент 60/62766, поданная 24 октября 1997 г, озаглавленная "Использование селективных ингибиторов ММП-13 для лечения остеоартрита и других опосредуемых ММП расстройств", относится к использованию селективных ингибиторов ММП-13 для лечения воспаления и других заболеваний. Заявка США на предварительный патент 60/68261, поданная 19 декабря 1997 г, относится к использованию ингибиторов ММП для лечения ангиогенеза и других заболеваний. Каждая из вышеупомянутых публикаций и заявок включена сюда в виде ссылки в полном объеме. В настоящем изобретении открыт приемлемый способ получения (4-фторфеноксифенил) сульфонилхлорида в три стадии из 4-хлорсульфонилхлорида. Краткое изложение изобретения Данное изобретение относится к соединению формулыNH4, предпочтительно Na, К или Мg, наиболее предпочтительно Na. Другие предпочтительные соединения этого изобретения включают соединения формулы где m является целым числом от 1 до 3; где R2 представляет собой фтор, хлор, бром, (C1C6)алкил, (C1-C6)алкокси или перфтор(C1 С 3)алкил, предпочтительно фтор, наиболее предпочтительно, когда R2 находится в 4 положении фенильного кольца. Данное изобретение относится также к способу получения соединения формулы где m является целым числом от 1 до 3; где R2 представляет собой фтор, хлор, бром, (C1C6)алкил, (C1-C6)алкокси или перфтор(С 1 С 3)алкил,включающему взаимодействие соединения формулы где R3 представляет собой фтор, хлор или бром; а R4 представляет собой хлор или бром, с соединением формулы где m является целым числом от 1 до 3, а R2 представляет собой фтор, хлор, бром, (C1C6)алкил, (C1-C6)алкокси или перфтор(C1 С 3)алкил; в присутствии основания, предпочтительно трет-бутоксида калия, и растворителя, предпочтительно N-метилпирролидинона, при температуре от 0 до примерно 150 С. Данное изобретение относится также к способу, включающему взаимодействие указанного соединения формулы III с основанием,предпочтительно гидроксидом натрия, в растворителе, предпочтительно этаноле, при температуре от примерно 50 до примерно 100 С с образованием соединения формулыm является целым числом от 1 до 3; и 4 Данное изобретение также относится к способу, включающему взаимодействие соединения формулы где m является целым числом от 1 до 3;R2 представляет собой фтор, хлор, бром,(C1-C6)алкил, (C1-C6)алкокси или перфтор(C1 С 3)алкил; с галогенирующим агентом, предпочтительно тионилхлоридом, в растворителе при температуре от примерно 0 до примерно 80 С с образованием соединения формулы где m является целым числом от 1 до 3;R1 представляет собой галоген, предпочтительно хлор, а R2 представляет собой фтор,хлор, бром, (C1-С 6)алкил, (C1-C6)алкокси или перфтор(C1-C6)алкил, предпочтительно фтор,хлор, бром, более предпочтительно фтор, наиболее предпочтительно когда R2 находится в 4 положении фенильного кольца. Предпочтительно вышеупомянутое взаимодействие осуществляют в присутствии катализатора, предпочтительно диметилформамида, и растворителя,предпочтительно толуола. Подробное описание изобретения Следующие схемы реакций иллюстрируют получение соединений данного изобретения. Если не указано иначе, R, R1, R2, R3 и R4 на схемах реакций и в описании, которое следует далее, имеют те же определения, что и выше. Схема 1 Схема 1 относится к получению соединений формулы I, где R1 представляет собой атом галогена. Соединения формулы I применимы в качестве промежуточных соединений, которые могут быть превращены в ингибиторы матричных металлопротеиназ формулы XI по способам схемы 2. На схеме 1 соединение формулы I получают из соединения формулы II реакцией с галогенирующим агентом предпочтительно в присутствии растворителя и катализатора. Подходящие галогенирующие агенты включают оксалилхлорид, тионилхлорид, оксихлорид фосфора,пентахлорид фосфора, предпочтительно тионилхлорид. Подходящие катализаторы включают диметилформамид. Подходящие растворители включают толуол, метиленхлорид или гексан, предпочтительно толуол. Вышеуказанную реакцию проводят при температуре от примерно 0 до примерно 70 С, предпочтительно в интервале между 25 и примерно 60 С. Соединения формулы II, где R представляет собой водород, литий, натрий, калий или аммоний (т.е. Н, Li, Na, К или NH4), предпочтительно натрий, могут быть получены из соединений формулы III реакцией с основанием в 6 растворителе. Специалисту в этой области понятно, что когда R представляет собой Li, Na, К или NH4, соединение формулы II является ионным соединением, а группа R имеет положительный заряд, и соседний атом кислорода имеет отрицательный заряд. Подходящие основания включают гидроксид натрия, гидроксид калия,гидроксид аммония, предпочтительно гидроксид натрия. Подходящие растворители включают спирты, такие как метанол, этанол, изопропанол, трет-бутанол или воду, и их смеси,предпочтительно этанол. Вышеуказанную реакцию осуществляют при температуре от примерно 0 до примерно 100 С, предпочтительно в интервале между 60 и примерно 80 С. Соединение формулы III может быть получено реакцией соединения формулы IV с соединением формулы V в присутствии основания в растворителе. Подходящие основания включают связанные алкоксидные или карбонатные основания, такие как трет-бутоксид калия, третамилоксид натрия или карбонат калия, предпочтительно трет-бутоксид калия. Более предпочтительно использовать два эквивалента третбутоксида калия. Подходящие растворители включают N-метилпирролидинон, диметилформамид, диметилацетамид или диглим, предпочтительно N-метилпирролидинон. Вышеназванную реакцию осуществляют при температуре от примерно 0 до примерно 150 С, предпочтительно в интервале между 25 и примерно 130 С. Наиболее предпочтительно проводить реакцию при температуре, равной примерно 25 С в течение примерно 1 ч, и затем температура повышается до примерно 130 С в течение примерно 12 ч. Соединения формул IV и V коммерчески доступны или могут быть получены методами,хорошо известными специалисту в данной области. Схема 2 относится к получению ингибирующих матричных металлолопротеиназ соединений формулы XI, где R6 и R7 имеют значения,которые определены для соответствующих групп R2 и R3 в публикациях РСТ WO 96/27583 и WO 98/07697, опубликованных 7 марта 1996 г. и 26 февраля 1998 г., соответственно. Соединения формулы VI можно получить в соответствии с методами, описанными в публикации РСТWO 96/27583 и WO 98/07697, опубликованных 7 марта 1996 г. и 26 февраля 1998 г. Эти публикации включены сюда в качестве ссылки в полном объеме. На схеме 2 соединения указанной формулы XI получают из соединений формулы IX реакцией с хлорирующим агентом, таким как оксалилхлорид или тионилхлорид, предпочтительно с оксалилхлоридом, и каталитическим количеством, предпочтительно примерно 2%,N,N-диметилформамида в инертном растворителе, таком как метиленхлорид или толуол, с образованием in situ хлорангидрида кислоты 7 формулы X, который затем реагирует с образованным in situ силилированным гидроксиламином. Образованный in situ силилированный гидроксиламин получают реакцией гидрохлорида гидроксиламина или сульфата гидроксиламина,предпочтительно гидрохлорида гидроксиламина с триметилсилилхлоридом в присутствии основания, такого как пиридин, 2,6-лутидин или диизопропилэтиламин, предпочтительно пиридина в качестве растворителя. Подходящий образованный in situ силилированный гидроксиламин выбирают из O-триметилсилилгидроксиламина,N,О-бистриметилсилилгидроксиламина или их смесей. Реакцию осуществляют при температуре от примерно 0 до примерно 22 С (т.е. комнатной температуре) в течение от примерно 1 до примерно 12 ч, предпочтительно в течение примерно 1 ч. Соединения формулы IX могут быть получены из соединений формулы VIII восстановлением в полярном растворителе. Подходящие восстанавливающие агенты включают палладиевые катализаторы, такие как восстановление водородом над палладием на угле, или водородом над гидроксидом палладия на угле, предпочтительно восстановлением водородом над палладием на угле. Подходящие растворители включают тетрагидрофуран, метанол, этанол и изопропанол и их смеси, предпочтительно этанол. Вышеназванную реакцию осуществляют при температуре, равной примерно 22 С (т.е. комнатной температуре) в течение от 1 до 7 дней, предпочтительно в течение примерно 2 дней. Соединения формулы VIII могут быть получены из соединений формулы VII, где R5 необязательно замещен бензилом, путем реакции присоединения Михаэля к пропиолатному сложному эфиру в присутствии основания в полярном растворителе. Подходящие пропиолаты имеют формулу H-CC-CO2R8, где R8 представляет собой (С 1-С 6)алкил. Подходящие основания включают фторид тетрабутиламмония,карбонат калия, третичные амины и карбонат цезия, предпочтительно фторид тетрабутиламмония. Подходящие растворители включают тетрагидрофуран, ацетонитрил, трет-бутанол,трет-амиловые спирты, N,N-диметилформамид,предпочтительно тетрагидрофуран. Вышеназванную реакцию осуществляют при температуре от примерно -10 до примерно 60 С, предпочтительно в интервале между 0 и примерно 22 С (т.е. комнатной температуре). Соединение формулы VIII получают в виде смесей геометрических изомеров по олефиновой двойной связи; нет необходимости в разделении этих изомеров. Соединения формулы VII могут быть получены реакцией соединений формулы VI с соединениями формулы I, полученными по схеме 1, в присутствии основания в растворителе. Подходящие основания включают триэтиламин, 001756 8 диизопропилэтиламин, предпочтительно триэтиламин. Подходящие растворители включают толуол или метиленхлорид, предпочтительно толуол. Конечные продукты формулы XI могут также подвергаться омылению с получением свободной кислоты, используя основание, такое как гидроксид натрия, в протонном растворителе, таком как этанол, метанол или вода, или смеси, такой как вода и этанол, вода и толуол или вода и ТГФ. Предпочтительной системой растворителей является вода и толуол. Реакцию проводят в течение от 30 мин до 24 ч, предпочтительно в течение примерно 2 ч. Соединения формулы XI, которые являются по природе основными, способны к образованию широкого ряда разнообразных солей с разными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто в практике сначала желательно выделить соединение формулы XI из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнюю снова в соединение в виде свободного основания обработкой щелочным реагентом, а затем превратить свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений данного изобретения легко получаются обработкой основного соединения, а по существу,эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя получают желаемую соль в виде твердого вещества. Кислоты, которые используются для получения фармацевтически приемлемых кислотноаддитивных солей основных соединений данного изобретения являются такими, которые образуют нетоксичные кислотно-аддитивные соли,т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат,лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат или памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Те соединения формулы XI, которые по природе являются кислотными, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или соли щелочно-земельных металлов,и особенно натриевые и калиевые соли. Все эти соли получают обычными методами. Химические основания, которые используются в качестве реагентов для получения фармацевтически 9 приемлемых основных солей данного изобретения, представляют собой те, которые образуют нетоксичные соли оснований с описанными здесь кислотными соединениями формулы XI. Эти нетоксичные соли оснований включают те,которые являются производными таких фармакологически приемлемых катионов, как натрий,калий, кальций и магний и т.д. Эти соли могут быть легко получены обработкой соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, и затем выпариванием полученного раствора до сухости, предпочтительно при пониженном давлении. Альтернативно они могут быть также получены смешиванием растворов кислотных соединений и желаемых алкоксидов щелочных металлов в низших спиртах и затем выпариванием полученного раствора до сухости таким же образом, как указано выше. В каждом случае предпочтительно использовать стехиометрические количества реагентов, чтобы обеспечить полное прохождение реакции и максимальные выходы продукта. Способность соединений формулы XI или их фармацевтически приемлемых солей (здесь далее называемых активными соединениями) подавлять матричные металлопротеиназы или продуцированию фактора некроза опухолей(ФНО) и, следовательно, проявлять свою эффективность в отношении лечения заболеваний,характеризующихся активностью матричных металлопротеиназ или продуцирование фактора некроза опухолей, может быть определена с помощью тестов in vitro, хорошо известных специалисту. Одним из признанных тестов, демонстрирующих эффективность конечных продуктов, полученных по способам данного изобретения, является "тест на ингибирование человеческой коллагеназы". Биологический тест Ингибирование человеческой коллагеназы(ММП-1) Человеческую рекомбинантную коллагеназу активируют трипсином, используя следующее отношение: 10 мкг трипсина на 100 мкг коллагеназы. Трипсин и коллагеназу инкубируют при комнатной температуре в течение 10 мин, затем добавляют пятикратный избыток (50 мкг/10 мкг трипсина) ингибитора трипсина соевых бобов. Готовят 10 мМ стандартные растворы ингибиторов в диметилсульфоксиде и затем делают разведения, используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ Затем двадцать пять микролитров раствора каждой концентрации добавляют в трех повторениях в соответствующие ячейки 96-ячеечного микротитровального планшета для флуоресцентных исследований. Конечная концентрация ингибитора будет в разведении 1:4 после добавления фермента и субстрата. Положительные контроли (фермент, без ингибитора) помещают 10 в ячейках D1-D6, а растворы сравнения (без фермента, без ингибиторов) помещают в ячейках D7-D12. Коллагеназу разбавляют до концентрации 400 нг/мл и 25 мкл и затем добавляют в соответствующие ячейки микропланшета для флуоресцентных исследований. Конечная концентрация коллагеназы в тесте составляет 100 нг/мл. Субстрат (DNP-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) готовят в виде 5 мМ стандартного раствора в диметилсульфоксиде и затем разводят до 20 мМ буфером для исследования. Исследование начинают добавлением 50 мкл субстрата в ячейку микротитровального планшета с получением конечной концентрации, равной 10 мкМ. Регистрация флуоресценции (360 нм возбуждение, 460 нм излучение) производится в момент времени 0 и затем через 20-минутные интервалы. Это исследование проводится при комнатной температуре с обычным сроком исследования, равным 3 ч. Затем строят график изменения флуоресценции в зависимости от времени как для растворов сравнения, так и для образцов, содержащих коллагеназу (наносят средние значения по данным трех определений). Момент времени, в который получают хороший сигнал (раствор сравнения) и который приходится на линейную часть кривой (обычно около 120 мин) выбирается для определения значений IС 50. Нулевой момент времени используется в качестве сравнения для каждого соединения при каждой концентрации, и эти значения вычитаются из результатов для времени 120 мин. По данным строят зависимости изменения концентрации ингибитора oт % контроля (флуоресценция ингибитора, деленная на флуоресценцию чистой коллагеназы, умноженная на 100). IC50 определяют как концентрацию ингибитора, который дает сигнал, составляющий 50% контрольного. Если установлено, что IС 500,03 мкМ, то ингибиторы исследуют при концентрациях 0,3 мкМ, 0,03 мкМ, 0,03 мкМ и 0,003 мкМ. Следующие примеры иллюстрируют получение соединений данного изобретения. Температуры плавления не скорректированы. Данные ЯМР представлены в миллионных долях (м.д.) и сравниваются с сигналом дейтериевого захвата от образца растворителя (дейтериохлороформ,если не указано иначе). Коммерческие реагенты используются без дополнительной очистки. ТГФ - тетрагидрофуран. ДМФ - N,N-диметилформамид. Хроматография обозначает колоночную хроматографию, проводимую с использованием 32-63 мм силикагеля и под давлением азота (флэш-хроматография). Комнатная температура или температура окружающей среды соответствует температуре 20-25 С. Все реакции в неводной среде проводят в атмосфере азота для удобства и обеспечения максимального выхода. Концентрирование при пониженном 11 давлении означает, что используется роторный испаритель. Пример 1. 4-Фторфениловый эфир 4-(4 фторфенокси)бензолсульфоновой кислоты. Раствор 14,68 г (0,131 моль, 2,0 эквивалента) трет-бутоксида калия в 27 мл безводного Nметилпирролидинона обрабатывают раствором 15,39 г (0,137 моль, 2,1 экв.) 4-фторфенола в 27 мл сухого N-метилпирролидинона при температуре окружающей среды, что приводит к умеренному нагреванию до 45 С. К темной реакционной смеси медленно добавляют раствор 13,81 г (0,065 моль) 4-хлорбензолсульфонилхлорида в 27 мл сухого N-метилпирролидинона, что вызывает умеренное повышение температуры до 44 С. Полученную смесь перемешивают при комнатной температуре в течение одного часа и затем при 130 С в течение 11 ч. Охлажденную реакционную смесь обрабатывают 162 мл воды,вносят в качестве затравки небольшое количество 4-фторфенилового эфира 4-(4-фторфенокси)бензолсульфоновой кислоты и гранулируют при комнатной температуре в течение ночи. Полученное твердое вещество отфильтровывают, получая 20,24 г (85%) 4-фторфенилового эфира 4-(4-фторфенокси)бензолсульфоновой кислоты. 1H ЯМР (СDСl3) : 7,74 (дд, J=7,0, 2,0 Гц,2 Н), 7,14-6,97 (м, 10 Н). Т.пл. 78-83 С. Пример 2. Натриевая соль 4-(4-фторфенокси)бензолсульфоновой кислоты. К суспензии 47,43 г (0,131 моль) 4 фторфенилового эфира 4-(4-фторфенокси) бензолсульфоновой кислоты в 475 мл этанола добавляют 13,09 г (0,327 моль, 2,5 экв.) гранул гидроксида натрия. Эту смесь кипятят с обратным холодильником в течение трех часов и перемешивают в течение ночи при комнатной температуре. Полученное твердое вещество отфильтровывают, получая 37,16 г (98%) натриевой соли 4-(4-фторфенокси)бензолсульфоновой кислоты. 1H ЯМР (СD3 ОD) : 7,73-7,78 (м, 2 Н), 7,057,13 (м, 2 Н), 6,99-7,05 (м, 2 Н), 6,90-6,95 (м, 2 Н). Пример 3. 4-(4-Фторфенокси)бензолсульфонилхлорид. К суспензии 15,0 г (0,052 моль) натриевой соли 4-(4-фторфенокси)бензолсульфоновой кислоты в 150 мл сухого толуола добавляют 11,3 мл (0,155 моль, 3 эквивалента) тионилхлорида и 0,04 мл (0,5 ммоль, 0,01 экв.) диметилформамида. Полученную смесь перемешивают при комнатной температуре в течение 48 ч, фильтруют через диатомовую землю и концентрируют при пониженном давлении до 40 мл. Этот раствор используют без дополнительной очистки для получения бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты.H ЯМР (CDCl3) : 7,92-7,97 (м, 2 Н), 7,017,13 (м, 6 Н). Часть полученного подобным образом масла перекристаллизовывают из гексана. Т.пл. 80 С. Пример получения 1. 3-4-(4-Фторфенокси)бензолсульфонил]-(1-гидроксикарбомоилциклопентил)амино]пропионовая кислота. А) Бензиловый эфир 1-[4-4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты. К смеси 12,41 г (0,032 моль) бензилового эфира 1-аминоциклопентанкарбоновой кислоты,соли толуол-4-сульфоновой кислоты (может быть получена по методу патента США 4745124) и 10,0 г (0,035 моль, 1,1 экв.) 4-(4 фторфенокси)бензолсульфонилхлорида в 113 мл толуола добавляют 11,0 мл (0,079 моль, 2,5 экв.) триэтиламина. Полученную смесь перемешивают при температуре окружающей среды в течение ночи, промывают 2N соляной кислотой (2100 мл) и насыщенным раствором соли (100 мл),сушат над сульфатом натрия и концентрируют до 30 мл. Добавляют гексан, 149 мл, по каплям в течение трех часов, получая твердый осадок,который гранулируют при 0 С в течение одного часа и фильтруют, получая 12,59 г (85%) бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты. 1H ЯМР (CDCl3) : 7,78-7,82 (м, 2 Н), 7,307,39 (м, 5 Н), 7,06-7,12 (м, 2 Н), 6,99-7,04 (м, 2 Н),6,93-6,97 (м, 2 Н), 5,15 (с, 1 Н), 5,02 (с, 2 Н), 2,042,13 (м, 2 Н), 1,92-1,98 (м, 2 Н), 1,62-1,69 (м, 4 Н). Образец, 4,0 г, гранулируют в смеси 4 мл этилацетата и 40 мл гексанов в течение ночи,получая 3,72 г (93% выделение) бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты в виде светлого рыжевато-коричневого твердого вещества, т.пл. 97,0-97,5 С. В) Бензиловый эфир 1-(2-этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты. Раствор 25,0 г (53,2 ммоль) бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты и 10,8 мл (106 ммоль, 2 экв.) этилпропиолата в 200 мл безводного тетрагидрофурана при 1 С обрабатывают 53,2 мл (53,2 ммоль, 1 экв.) раствора фторида тетрабутиламмония (1 М) в течение 45 мин. Полученному раствору дают медленно нагреться до температуры окружающей среды и перемешивают в течение ночи. Тетрагидрофуран заменяют толуолом при пониженном давлении, и толуольный раствор промывают водой и насыщенным раствором соли, разбавляют доC) 1-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновая кислота. Раствор 2,50 г (4,4 ммоль) бензилового эфира 1-(2-этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в 25 мл этанола обрабатывают 2,5 г влажного катализатора 10% палладия на угле, содержащего 50% воды, и встряхивают при давлении 53 фунта/дюйм 2 (3,65105 н/м 2,3,61 атм) водорода в течение 21 ч. Катализатор удаляют фильтрованием и промывают этанолом(425 мл). Фильтрат и промывные жидкости объединяют и концентрируют в вакууме с получением 1,74 г (82%) неочищенного 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в виде вязкого масла. 1D) Дициклогексиламмониевая соль 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты. Раствор 3,10 г (6,5 ммоль) неочищенного 1-(2-этоксикарбонилэтил)-[4-(4-фторфенокси) бензолсульфонил]аминоциклопентанкарбоновой кислоты в 30 мл этанола обрабатывают 1,28 мл (6,5 ммоль, 1 экв.) дициклогексиламина при температуре окружающей среды с получением твердого вещества в течение пяти минут. Эту смесь перемешивают при температуре окружающей среды в течение ночи и затем при 0 С в течение пяти часов. Белое твердое вещество выделяют фильтрованием, промывают 10 мл холодного этанола и сушат на воздухе, получая 2,89 г (67%) дициклогексиламмониевой соли 1-(2-этоксикарбонилэтил)-[4-(4-фторфенок 001756H ЯМР (CDCl3) : 7,86-7,91 (м, 2 Н), 6,997,09 (м, 4 Н), 6,90-6,94 (м, 2 Н), 5,3 (шир.с., 2 Н),4,07 (кв, J=7,1 Гц, 2 Н), 3,54-3,59 (м, 2 Н), 2,882,95 (м, 4 Н), 2,31-2,38 (м, 2 Н), 1,95-2,22 (м, 6 Н),1,68-1,77 (м, 6 Н), 1,53-1,60 (м, 4 Н), 1,40-1,50 (м,4 Н), 1,21 (т, J=7,1 Гц, 3 Н), 1,14-1,22 (м, 6 Н). Т.пл. 164,5-165,9 С. Е) Дициклогексиламмониевая соль 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты из 1-(2-этоксикарбонилэтил)-[4-(4 фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты. Раствор 3,0 г (4,5 ммоль) 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты, дициклогексиламмониевой соли в 30 мл дихлорметана обрабатывают 30 мл 2N соляной кислоты при комнатной температуре, что вызывает осаждение твердого вещества. Эту смесь перемешивают при температуре окружающей среды в течение трех часов. Твердые вещества отфильтровывают, водную фазу экстрагируют дихлорметаном и объединенные органические фазы промывают водой, сушат над сульфатом натрия и концентрируют в вакууме с получением 2,2 г (100%) 1-(2-этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в виде прозрачного масла. 1F) Этиловый эфир 3-(1-хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты. Раствор 7,26 г (15,1 ммоль) 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 экв.) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 экв.) диметилформамида при температуре окружающей среды, что приводит к небольшому выделению пузырьков,и перемешивают в течение ночи. Полученный раствор этилового эфира 3-(1-хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты используют для получения этилового эфира 3-4-(4 фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты без выделения. Полученный подобным образом раствор этилового эфира 3-(1-хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил] 15 аминопропионовой кислоты концентрируют в вакууме с получением масла. 1G) Этиловый эфир 3-4-4-фторфенокси) бензолсульфонил]-1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты. Раствор 1,37 г (19,7 ммоль, 1,3 экв.) гидрохлорида гидроксиламина в 9,2 мл (114 ммоль,7,5 экв.) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 экв.) триметилсилилхлорида, что приводит к осаждению белого твердого вещества, и дают нагреться до температуры окружающей среды в течение ночи. Эту смесь охлаждают до 0 С и обрабатывают раствором 7,54 г (15,1 ммоль) этилового эфира 3(1-хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты в 73 мл дихлорметана, полученного,как описано выше, без выделения, что приводит к нагреванию до 8 С. Эту смесь перемешивают при 0 С в течение 30 мин и при температуре окружающей среды в течение одного часа перед обработкой 50 мл 2N водного раствора соляной кислоты и перемешиванием при температуре окружающей среды в течение одного часа. Водную фазу экстрагируют дихлорметаном и объединенные органические фазы промывают 2N водным раствором соляной кислоты (250 мл) и водой (50 мл). Этот раствор этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1 гидроксикарбамоилциклопентил)амино]пропионовой кислоты в дихлорметане используют для получения 3-4-(4-фторфенокси)бензолсульфонил]-1-гидроксикарбамоилциклопентил)амино] пропионовой кислоты без выделения. Аликвоту концентрируют до пены. 1(С, 1 Н), 7,74-7,79 (м, 2 Н), 7,24-7,30 (м, 2 Н), 7,147,20 (м, 2 Н), 7,01-7,05 (м, 2 Н), 3,99 (кв, J=7,1 Гц,2 Н), 3,42-3,47 (м, 2 Н), 2,62-2,67 (м, 2 Н), 2,162,23 (м, 2 Н), 1,77-1,85 (м, 2 Н), 1,43-1,52 (м, 4 Н),1,13 (т, J=7,1 Гц, 3 Н). Полученный таким образом раствор концентрируют в вакууме с получением 6,71 г(89%) этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в виде твердой сухой пены. Н) 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино] пропионовая кислота. Раствор 7,48 г (15,1 ммоль) этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1 гидроксикарбамоилциклопентил)амино]пропионовой кислоты в дихлорметане концентрируют на роторном испарителе с добавлением 75 мл толуола. Этот раствор обрабатывают 75 мл во 001756(151 ммоль, 10 экв.) гранул гидроксида натрия в течение 10 мин при энергичном перемешивании. Эту смесь перемешивают в течение 15 мин при 0 С и нагревают до температуры окружающей среды в течение одного часа. Водную фазу отделяют, разбавляют 7,5 мл тетрагидрофурана,охлаждают до 0 С и обрабатывают 33 мл 6N водного раствора соляной кислоты в течение 20 мин. Эту смесь перемешивают с 75 мл этилацетата при температуре от 0 С до температуры окружающей среды и этилацетатную фазу отделяют и промывают водой. Этилацетатный раствор медленно обрабатывают 150 мл гексанов при температуре окружающей среды, что приводит к осаждению твердого вещества, и перемешивают в течение ночи. Фильтрование дает 5,01 г 3-4-(4-фторфенокси)бензолсульфонил](1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в виде белого твердого вещества (71% выход из 1-(2-этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты). 1NH4. 2. Соединение формулы где m является целым числом от 1 до 3;R2 представляет собой фтор, хлор, бром,(C1-C6)алкил, (C1-C6)алкокси или перфтор(C1 С 3)алкил. 3. Соединение по п.2, где R2 представляет фтор. 4. Соединение по п.3, где R2 находится в положении 4 фенильного кольца. 5. Способ получения соединение формулы где m является целым числом от 1 до 3;R2 представляет собой фтор, хлор, бром,(C1-C6)алкил, (C1-C6)алкокси или перфтор(C1 С 3)алкил; включающий взаимодействие соединения формулы 18 8. Способ по п.7, где указанное основание является гидроксидом натрия, а указанный растворитель является этанолом. 9. Способ по п.7, который дополнительно включает взаимодействие соединения формулыR4 представляет хлор или бром; с соединением формулы где m является целым числом от 1 до 3;R2 представляет собой фтор, хлор, бром,(C1-C6)алкил, (C1-C6)алкокси или перфтор(C1 С 3)алкил; в присутствии основания и растворителя при температуре от 0 до примерно 150 С. 6. Способ по п.5, где указанное основание является трет-бутоксидом калия, а указанный растворитель являетсяN-метилпирролидиноном. 7. Способ по п.5, который дополнительно включает взаимодействие указанного соединения формулы III с основанием в растворителе при температуре от примерно 50 С до примерно 100 С с образованием соединения формулы где m является целым числом от 1 до 3; где m является целым числом от 1 до 3;R2 представляет собой фтор, хлор, бром,(C1-C6)алкил, (C1-С 6)алкокси или перфтор(C1 С 3)алкил; с галогенирующим агентом в растворителе при температуре от 0 до примерно 80 С с образованием соединения формулы где R1 представляет собой галоген иm является целым числом от 1 до 3. 10. Способ по п.9, где R1 представляет собой хлор. 11. Способ по п.9, где R2 представляет собой фтор. 12. Способ по п.9, где R1 находится в положении 4 фенильного кольца. 13. Способ по п.9, где указанный галогенирующий агент является тионилхлоридом. 14. Способ по п.9, который дополнительно включает добавление катализатора и растворителя. 15. Способ по п.14, где указанный катализатор является диметилформамидом, а указанный растворитель является толуолом.
МПК / Метки
МПК: C07C 309/42
Метки: способ, получения, феноксифенилсульфонилгалогениды
Код ссылки
<a href="https://eas.patents.su/10-1756-fenoksifenilsulfonilgalogenidy-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Феноксифенилсульфонилгалогениды и способ их получения</a>
Предыдущий патент: Сварная башня
Следующий патент: Документы с самопроверяющей защитой
Случайный патент: Способ получения молока или молочного продукта














