Антиидиотипические моноклональные антитела, их применение в активной иммунотерапии злокачественных опухолей и содержащие их композиции
Номер патента: 3366
Опубликовано: 24.04.2003
Авторы: Васкес Лопес Ана Мария, Перес Родригес Роландо, Перес Гонсалес Алексис, Иглесиас Сьерра Эладио, Босолей Дельгадо Ирене, Бомбино Лопес Гумерсинда
Формула / Реферат
1. Штамм гибридных клеток ECACC ь 97112901, продуцирующий антиидиотипическое моноклональное антитело 1E10, специфичное в отношении антител мыши к N-гликолилсодержащим ганглиозидным опухолевым антигенам.
2. Антиидиотипическое моноклональное антитело 1E10, специфичное в отношении антител мыши к N-гликолилсодержащим ганглиозидным опухолевым антигенам, продуцируемое штаммом гибридных клеток по п.1 и обладающее защитным действием в отношении соответствующих опухолей.
3. Фармацевтическая композиция, содержащая эффективное количество моноклонального антитела по п.2 в сочетании с растворителем, адъювантом или носителем.
4. Применение моноклонального антитела по п.2 для производства лекарственного средства для лечения опухолей.
Текст
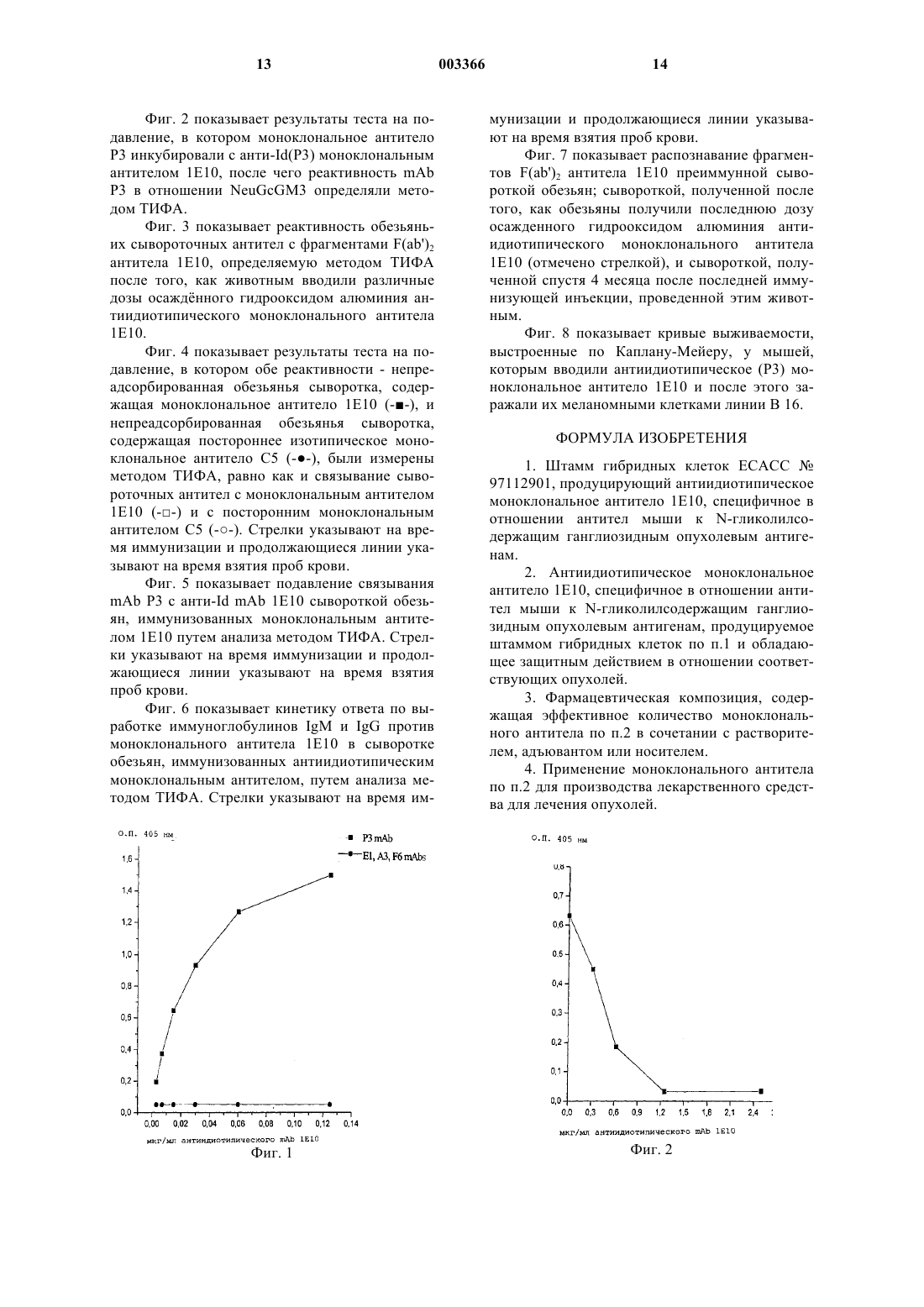
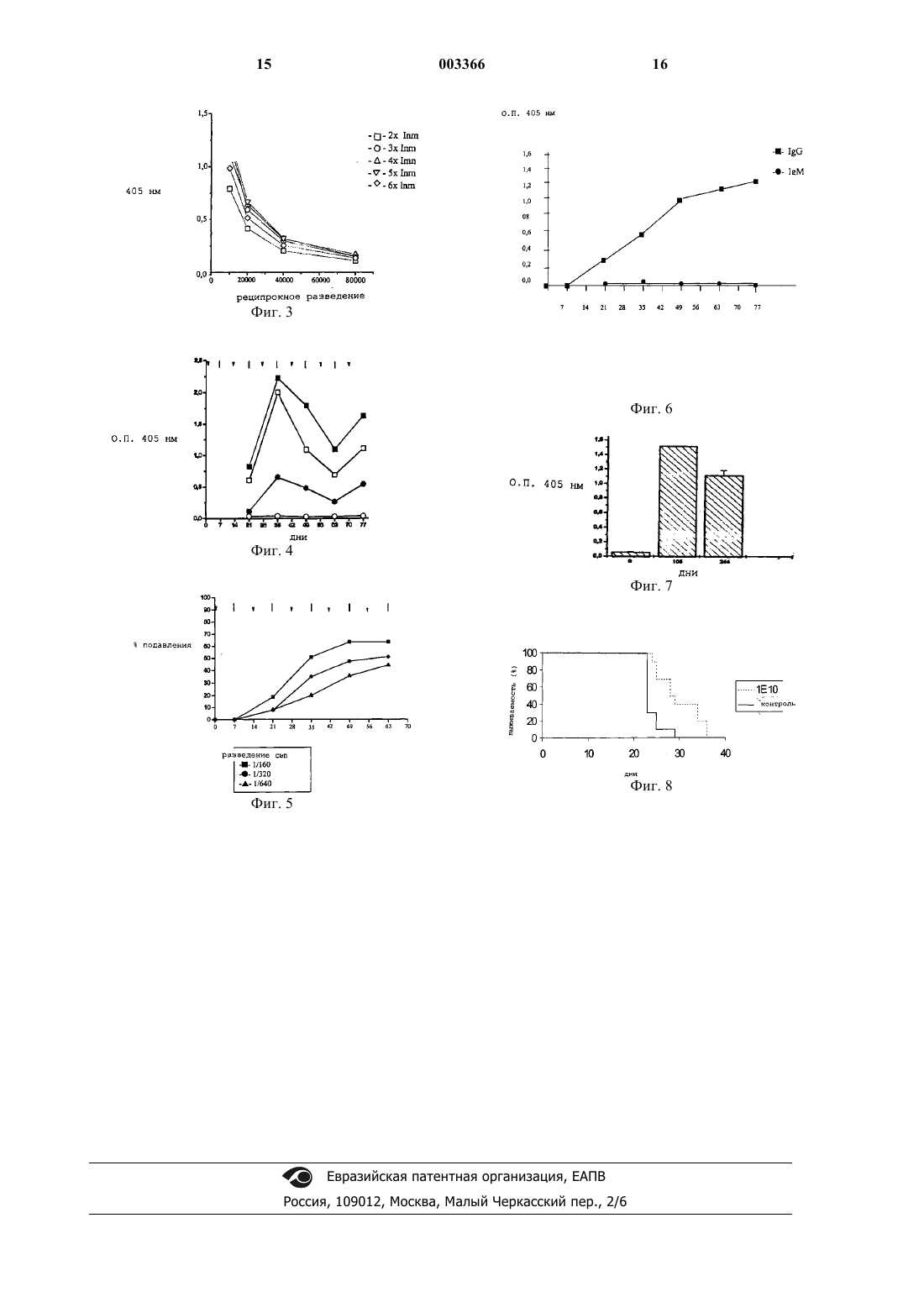
1 Область техники Настоящее изобретение в целом касается антиидиотипических моноклональных антител и их применения в качестве иммуно-модуляторов. Более конкретно, настоящее изобретение представляет мышиное моноклональное антитело,которое было сформировано в отношении мышиного моноклонального антитела к N-гликолилированным ганглиозидам и к антигенам,экспрессируемым раковыми клетками; его ингибиторное действие на рост опухоли. Предпосылки Одна из стратегий, применяемых в лечении рака, основана на применении активной иммунотерапии - способе лечения, целью которого является активация естественных возможностей иммунной системы организма-хозяина в отношении опухоли. С тех пор, как Нильс Йерн (N.K. Jerne,1974, Ann. Immunol., 125C, 373-389) предложил теорию идиопатических отношений, были открыты новые возможности в исследовании эффективной терапии против рака. Теория Йерна впервые постулировала, что иммунная система является комплексом антител, которые могут взаимодействовать друг с другом и с большим количеством естественных эпитопов с участием их вариабельных сегментов или идиотипов (Id). Этот сложный комплекс "идиотипическихантиидиотипических" взаимодействий работает как регулятор иммунных ответов на антигены. Те антитела, которые образуются в ответ на исходный антиген, обозначаемые как Аb1, сами становятся антигенами и обусловливают выработку второго "круга" антител, называемых "антиидиотипическими" (анти-Id) антителами или Аb2; они также могут регулироваться другими антителами, которые, в свою очередь, обозначаются как анти-антиидиотипические антитела(Аb1' или Аb3). Первоначальная теория Йерна пересматривалась, и было сообщено о том, что результат взаимодействия Аb2 с лимфоцитами, несущими антитела Аb1, не является необходимым для подавления иммунного ответа, но при этом может стимулировать такой ответ. Более того,Йерн ограничивал свою теорию В-лимфоцитами и антителами, однако, теперь уже понятно, что Т-лимфоциты играют важную роль в регуляции,опосредуемой идиотипами Т-клеточных рецепторов (D. Teitelbaum et al., 1984, J. Immunol, 132,1282-1285; M. Zanetti et al., 1986, J. Immunol,137, 3140-3146; J. Powell et al., 1988, 140, 32663272; J.G. Baskin et al., 1990, J. Immunol, 145,202-208; A. Furuyama et al., 1992, AnticancerRes., 54, 4837-4840). Идиотип детерминирован иммунологически по его реактивности с более чем одним анти-Id антителом, которое распознат идиоти 003366 2 пическую детерминанту или идиотоп в составе данного идиотипа. Следовательно, при том, что конкретный Аb1 экспрессирует множественные идиотопы, в случае, когда такой Аb1 вводят сингенным животным, то образуется гетерогенная популяция антиидиотипических антител. Классификация антиидиотипических антител основывается на их связывании с антигенсвязывающим сайтом или с некоторыми другими сегментами идиотипа. Если связывание Аb2 с Аb1 подавляется соответствующим антигеном и если Аb2 также способно индуцировать иммунный ответ той же специфичности, что и ответ в виде антител Аb1, то оно имитирует естественный антиген и классифицируется как Аb2: этот тип антител Аb2 определяется как внутренний вариант анти-Id и он способен проявлять активность "антигенов-суррогатов". Анти-Id антитела, которые не подавляются антигеном, обозначаются как Аb2: эти антитела Аb2 реактивны в отношении идиотопов в составе Аb1, которые не проявляют структурного сходства с антиген-связывающим сайтом. В 1984 г. Бона и Клер предположили существование третьего типа антиидиотипических антител (Аb2): они подавляются антигеном благодаря механизму стерической интерференции, и этот тип анти-Id антител реагирует с идиотопами, которые характеризуются структурным сходством с антиген-связывающим сайтом, но при этом они не способны имитировать антигенный эпитоп, распознаваемый антителом Аb1Lindstrom, A.R. Liss, NY, pp. 141-149). Основываясь на теории Йерна, было разработано два основных подхода к созданию вакцин, специфичных в отношении большого числа антигенов, включая ассоциированные с опухолью антигены. Первый из этих подходов основывается на презентировании эпитопов в различные молекулярные среды с использованием антител типа Аb2. Вакцины, содержащие этот тип антиидиотипических антител, способны индуцировать защитный ответ в отношении вирусов, бактерий и паразитов (Kennedy et al.,1986, 232, 220-223; McNamara et al., 1985, Science, 226, 1325-1326). Также антитела Ab2 были использованы для индукции иммунных ответов на ассоциированные с опухолями антигены: положительные результаты были достигнуты в животных моделях и в клинических испытанияхL.G. Durrant et al., 1994, Cancer Res., 54, 48374840; A. Mittelman et al., 1994, Cancer Res., 54,415-421; H. Schmitt et al., 1994, Hybridoma, 13,389-396; M. Chakrobarty et al., 1995, J. Immunotherapy, 18, 95-103; M. Chakrobarty et al., 1995,Cancer Res., 55, 1525-1530; К.A. Foon et al., 1995,Clin. Cancer Res., 1, 1285-1294; D. Herlyn et al.,1995, Hybridoma, 14, 159-166; H. Sclebusch et al.,1995, Hybridoma, 14, 167-174; D. Herlyn et al.,1996, Cancer Immunol. Immunotherapy, 43, 6576). Однако было показано, что -признак антител типа Аb2 недостаточен для предсказывания того биологического эффекта, который может быть обусловлен антителом Ab2 (Raychauhuri etMaruyama et al., 1996, Intern. J. Cancer, 65, 547553). Второй подход базируется на воздействии на иммунную систему через регуляторные идиотопы, общие с другими антителами или Тклетками, но которые не вовлечены в связывание антигенов. Были накоплены доказательства того, что эти антиидиотопические антитела также способны индуцировать иммунные ответы и защитные эффекты (W.E. PaulС. Воnа,1982, Immunol. Today, 3, 230-234; M.K.Kohler et al., 1992, Proc. 8th Intern. Congr. Immunol., Budapest, p. 619). Ганглиозиды являются гликосфинголипидами, которые включают сиаловую кислоту и экспрессированы в мембранах большинства клеток млекопитающих. Хотя эти антигены присутствуют в нормальных тканях, они могут быть обнаружены в больших количествах и экспрессированы в различной организации и конформации на поверхности злокачественных опухолевых клеток (S. Hakomori, 1985, CancerNuclear Med., XIX, 282-294; Hamilton et al., 1993,Intern. J. Cancer, 53, 1-81). Хотя ганглиозиды являются эффективными мишенями для иммунных ответов, их иммуногенность исключительно низка, что объясняется их углеводной природой и их "аутоантигенным" статусом (Р. Livingston et al., 1995,Seminar in Cancer Biol., 6, 357-366).N-гликолильный вариант сиаловой кислоты экспрессируется в нормальных тканях у большинства млекопитающих; однако, очень трудно бывает выявить его в нормальных тканях человека (S. Watarai et al., 1995, J. Biochem.,117, 1062-1069). С другой стороны, присутствие этих антигенов было подтверждено, помимо прочего, для рака толстой кишки, меланомы,ретинобластомы и рака молочной железы (Н.A.M. Vazquez et al., 1995, Hybridoma, 14, 551556; G. Marquina et al., 1996, Cancer Res., 56,5165-5171). Иммунизация с использованием вакцин,содержащих ганглиозиды, обусловливает в результате увеличение выживаемости тех меланомных пациентов, у которых проявлялись антиганглиозидные антитела (Р. Livingston et al.,1987, Proc. Natl. Acad. Sci. USA, 84, 2911-2915;P. Livingston et al., 1989, Cancer Res., 49, 70457050; P. Livingston, 1995, Immunol. Rev., 145,147-166). Однако проблемность данных антигенов наряду со слабой иммуногенностью делает применение антиидиотипических антител привлекательной альтернативой для активной иммунотерапии в рассматриваемой антигенной модели. Мышиное анти-Id моноклональное антитело (4 С 10) было сформировано в отношенииmAb L612 (иммуноглобулин-М) человека, распознававшего GM3 в меланоме человека. Сыворотка крови мышей, которых иммунизовали этим анти-Id моноклональным антителом вместе с гемоцианином слизня (KLH), эффективно реагировала с линией антиген-позитивных меланомных клеток и с очищенным GM3: это предполагает, что это анти-Id mAb, несущее внутренний сигнал антигена GM3 (Аb2), может быть эффективным средством для активной направленной иммунотерапии пациентов с меланомой (S. Yamamoto et al., 1990, J. Natl. CancerInst., 82, 1757-1760; R.F. Irie, патент США 5 208 146). Варибельные сегменты VL и VH из состава этого анти-Id mAb были клонированы,секвенированы и экспрессированы в составе химерного антитела IgG1 мыши/человека (A.Hastings et al., 1992, Cancer Res., 52, 1681-1686). Также в отношении mAb 1612 человека было сформировано антиидиотипическое моноклональное антитело -типа, предназначенное для применения в иммунодиагностических процедурах (R.F. Irie, патент США 5 208 146). Моноклональное антитело ВЕС-2 - мышиное анти-Id mAb, сформированное к мышиному(mAbR24), может имитировать GD3 и может индуцировать антитела, специфичные в отношении этого ганглиозида, несмотря на экспрессию GD3 в нормальной ткани кролика (Р.В.ChapmanA.N. Houghton, 1991, 88, 186-192). Результаты пилотного исследования показали,что антитело ВЕС-2 вместе с адъювантом BCG в существенной степени повышает выживаемость пациентов, у которых диагностирован мелкоклеточный рак лeгких (Scrip Mag., 1996, pp. 56 5 59; 33-d Annual Meet. Amer. Soc. Clin. Oncol.,1997). У крыс, иммунизованных мышиным моноклональным антителом, специфичным в отношении GD2 (3F8), образовывались антиидиотипические mAb, которые, при проведении их тестирования на иммуногенность у мышей, были способны стимулировать выработку антител,реактивных в отношении ганглиозида GD3. Было предположено, что такие анти-Id mAb могут быть применены при создании вакцин (N.-K.V.Cheung et al., 1993, Intern. J. Cancer, 54, 499-505). Также человеческое антиидиотипическое моноклональное антитело было получено с использованием моноядерных клеток периферической крови, взятой у пациента, для лечения которого использовалось мышиное mAb 14G2,специфичное в отношении GD2. Иммунизация кроликов этим анти-Id mAb человека индуцировало выработку антител к GD2 и формированиеDTH-ответа на антиген-позитивные опухолевые клетки. Было предположено, что это антитело может быть использовано в качестве человеческой антиидиотипической вакцины для пациентов со злокачественной меланомой (M.N. Salehet al., 1993, J. Immunol., 151, 3390-3398). В научной статье "Ganglioside vaccine: antiidiotypic monoclonal antibodies as antigen surrogates" (E. Iglesias et al., 1997, Biotecnol. Aplicada,14,1, p. 50, ХР-002091466) описано семь антиидиотипических моноклональных антител(mAb) типа иммуноглобулинa-G1 (IgG1), которые эффективно реагировали с mAb Р 3, при том, что не была выявлена реактивность в отношении других тестированных антиганглиозидных моноклональных антител типа IgM. Семь антиидиотипических mAb характеризовались способностью блокировать связывание Р 3 с NGcGM3 в концентрации в диапазоне от 1 до 10 мкг/мл. Пять из этих антиидиотипических антител были способны обусловливать гуморальный ответ на NGcGM3; их классифицировали как антиидиотипические моноклональные антитела Аb2 и Аb2. С другой стороны, Perez et al. ("What gangliosides show us about idiotypic networks", 1997,Biotecnol. Aplicada, 14,1, p. 42, ХР 002091467) также описывают, что антиганглиозидное антитело Р 3 обусловливает жсткий антиидиотипический ответ IgG-типа (Аb2: титры 10-4 и 510-4) у мышей линии BALB/c. Большинство этих полученных специфичных Аb2 клонов было способно блокировать связывание моноклонального антитела Р 3 с GM3 (NeuGc). Эти антитела, как в описанном выше случае,были способны индуцировать естественный аутоантительный ответ на ганглиозиды, которые также классифицировались как антиидиотипические антитела типа Ab22. Как явствует из описанных предпосылок настоящего изобретения, до сих пор не было 6 сформировано ни одного антиидиотипического моноклонального антитела -типа, специфичного в отношении моноклональных антител, которые распознают N-гликолилсодержащие ганглиозиды и которые в то же самое время способны были бы обусловливать противоопухолевый эффект в животной модели. Описание изобретения Настоящее изобретение касается антиидиотипических (анти-Id) моноклональных антител (mAb) и их применения в качестве иммуномодуляторов для лечения рака. Более конкретно, настоящее изобретение представляет мышиные анти-Id mAb -типа, которые формируются к мышиному моноклональному антителу, реактивному в отношении N-гликолилсодержащих ганглиозидов и антигенов, экспрессируемых в опухолевых клетках. В соответствии с настоящим изобретением целью настоящего изобретения является получение штамма гибридных клеток с номером доступа ЕСАСС 97112901, продуцирующий антиидиотипическое моноклональное антитело 1 Е 10, специфичное в отношении антител мыши к N-гликолилсодержащим ганглиозидным опухолевым антигенам. Еще одной целью настоящего изобретения является получение антиидиотипического моноклонального антитела 1 Е 10, специфичного в отношении антител мыши к N-гликолилсодержащим ганглиозидным опухолевым антигенам, продуцируемое штаммом клеток ЕСАСС 97112901 и обладающее защитным действием в отношении соответствующих опухолей. Фармацевтическая композиция, содержащая эффективное количество моноклонального антитела 1 Е 10 в сочетании с растворителем,адъювантом или носителем, а также применение указанного моноклонального антитела для производства лекарственного средства для лечения опухолей также являются целями настоящего изобретения. Подробное описание изобретения Процедура иммунизации с целью получения ответа в форме антиидиотипических антител(Аb2) на антиганглиозидные mAb Мышей и млекопитающих других видов иммунизуют дозами 25-200 мкг очищенного антиганглиозидного mAb вместе с адъювантом или без него и необязательно в сочетании с белком-переносчиком. Животным вводили 2-6 доз антиганглиозидного mAb с интервалом между введением от 14 до 30 дней. Возможными путями иммунизации являются внутрибрюшинное, подкожное или внутривенное введение или их сочетание. До иммунизации и в ходе еe берут пробы сыворотки крови иммунизуемых животных, по которым определяют уровень ответов по выработке антител Аb2, применяя для этой цели любые известные иммунологические методы. Раз 7 ведения сыворотки этих животных инкубируют с антиганглиозидными mAb, использовавшимися в качестве иммуногена, или другими антиганглиозидными mAb, которые не использовались для протокола иммунизации. Также были проведены эксперименты с целью определения способности сыворотки иммунизованных животных блокировать связывание антиганглиозидного моноклонального антитела, использовавшегося в качестве иммуногена к соответствующему антигену. Выработка антиидиотипического моноклонального антитела, специфичного в отношении антиганглиозидных mAb В отношении мышей, характеризовавшихся высокими титрами антител Аb2, проводили повторную иммунизацию моноклональным антителом, использовавшимся в качестве иммуногена, за три дня до того момента, как осуществляли получение клеток, вырабатывающих антитела. Предпочтительными для использования являются клетки селезенки; также могут быть выбраны другие клетки, вырабатывающие антитела. Эти клетки сливают с миеломными клетками с получением гибридных клеток или гибридом со способностью к размножению in vitro и in vivo. Клеточное слияние может быть осуществлено при помощи любого известного метода. Антитела, продуцируемые гибридомой,тестируют при помощи иммуноанализов, предпочтительно при помощи иммуно-ферментного анализа, при котором гибридому, находящуюся в супернатанте, инкубируют с моноклональным антителом, используемым в качестве иммуногена, и с другими антиганглиозидными моноклональными антителами, не используемыми при иммунизации. Способность гибридомы в супернатанте блокировать связывание антиганглиозидного моноклонального антитела, используемого в качестве иммуногена, с его антигеном определяется путем инкубирования супернатанта с различными разведениями антиганглиозидного моноклонального антитела с последующей инкубацией указанного антитела со своим антигеном. Полученные антиидиотипические моноклональные антитела распознают антиганглиозидные моноклональные антитела и могут проявлять способность блокировать связывание антиганглиозидного mAb с соответствующим антигеном. Процедура иммунизации, предназначенная для достижения ответа в форме анти-антиидиотипических антител (Аb3) к антителам mAb Аb2 в ксеногенных моделях Обезьян или особей других ксеногенных видов иммунизовали антиидиотипическими моноклональными антителами. Эти mAb могут быть введены вместе с адъювантом или без него 8 и необязательно могут быть соединены с белком-переносчиком перед тем, как использоваться в качестве иммуногена. Каждому животному вводят от 2 до 8 доз,равных от 250 мкг до 2 мг антиидиотипическогоmAb, при интервалах во времени от 7 до 30 дней между дозами. Пути введения могут быть внутрикожными, подкожными, внутривенными или внутрибрюшинными инъекциями, или их сочетаниями. Пробы крови животных получали до процесса иммунизации и в ходе его; по ним контролировали ответ в форме антител Аb3, используя любые известные иммунологические методы. Введение животным антиидиотипических моноклональных антител, вырабатываемых в результате иммунизации антиганглиозидными моноклональными антителами, может индуцировать преобладающий антительный ответ в отношении идиотина антиидиотипическогоmAb, использовавшегося в качестве иммуногена, без индукции ответа в форме выработки антиген-специфичных антител. Противоопухолевый эффект лечения с использованием антиидиотипических моноклональных антител Антиидиотипические моноклональные антитела вводят в эффективном количестве наряду с адъювантом или без него, необязательно, вместе с белком-переносчиком, добавляемых перед использованием. Термин эффективное количество должен пониматься как обозначение такого количества антиидиотипического моноклонального антитела, которое необходимо для достижения противоопухолевого эффекта. Введение антиидиотипических mAb осуществляется перед или после экспериментального введения клеток злокачественных опухолей животным. Животным вводят 1-5 доз по 10-200 мкг антиидиотипических mAb при промежутке времени от 7 до 30 дней между дозами. Иммунизация может быть проведена путем внутрикожных, внутрибрюшинных, подкожных или внутривенных инъекций, или путeм их сочетания. После введения антиидиотипических моноклональных антител проявленность опухоли и выживаемость подвергнутой воздействию антиидиотипических mAb животных могут сравниваться с показателями контрольных групп, на которые проводилось иное воздействие и которые содержались в аналогичных условиях. Лечение антиидиотипическими антителами в существенной степени повышает выживаемость животных, у которых имеются опухоли, и снижает легочные метастазы. Пример 1. Создание антиидиотипического антитела, специфичного в отношении моноклонального антитела Р 3 в сингенной модели. 9 Самок мышей линии ВА 1b/с в возрасте 6-8 недель иммунизовали двумя дозами по 50 мкг очищенного mAb P3 (специфично в отношенииN-гликолильных ганглиозидов: депозитарный 94113026 по ЕСАСС; европейская патентная заявкаЕР 657471-А 1; A.M. Vazquez, 1995,Hybridoma, 14, 551-556) вместе с гемоцианином слизня при 14-дневном интервале между введением доз. Через 3 дня после последней иммунизации селезeнки были взяты у мышей, которые характеризовались высокими сывороточными титрами антител Аb2, специфичных в отношенииmAb P3: из ткани селезенки готовили клеточные суспензии путeм продавливания ткани через сито из нержавеющей стали или путeм перфузии селезенки. Слияние клеток осуществляли в соответствии с методом, описанным Клером и Мильштейном (KohlerMilstein, 1975, Nature (Lond),256, 495-497), с внесением небольших модификаций. Клетки мышиной селезнки сливали с клетками мышиной несекретирующей миеломы Р 3/Х 63 Аg8 6.5.3, полученной из европейской коллекции культур (ЕСАСС), депозитарный 85011420, при соотношении клеток 10:1, в 0,5 мл среды слияния, содержащей 42% полиэтиленгликоля в культуральной среде RPMI-1640. Полученная гибридома была внесена согласно Будапештскому соглашению в Европейскую коллекцию клеточных культур (ЕСАСС) , Великобритания, 29 ноября 1997 г. под депозитарным 97112901. После слияния клеток их культивировали в селективной среде HAT (с гипоксантинаминоптерином и тимидином) при 37 С во влажной атмосфере с 5% углекислого газа. Через 10-15 дней после слияния динамику присутствия антител в гибридомной надосадочной фракции оценивали с применением метода ТИФА (твeрдофазный иммуноферментный анализ). Планшеты для ТИФА (с высоким связыванием, производство COSTAR) инкубировали в течение ночи при 4 С в присутствии 10 мкг/млmAb P3 и другого антиганглиозидного моноклонального антитела типа IgM в карбонатнобикарбонатном буфере (рН=9,8). Планшеты после их промывки фосфатносолевым буфером, содержащим 0,05% Твин-20,блокировали тем же буфером, содержащим 1% бычьего сывороточного альбумина, в течение 1 ч при 37 С. Был повторен этап промывки, после чего добавляли 50 мкл надосадочной фракции на 1 лунку. После 2-часовой инкубации планшеты промывали вновь и добавляли антисыворотку,содержащую помеченное щелочной фосфатазой козье антимышиное антитело (Fc-сегмент) IgG. После промывки добавляли по 100 мкл на 1 лунку субстратного раствора (1 мг/мл рнитрофенилфосфата, разведнного в диэтанола 003366 10 миновом буфере - рН=9,8). Величины поглощения измеряли при длине волны 405 нм на считывателе ТИФА. Кроме того, способность супернатантов блокировать связывание mAb P3 с NeuGcGM3 определяли путeм непрямого ТИФА, осуществляемого на активированных поливинилхлоридом планшетах (ICN-FLOW) с иммобилизованным NeuGcGM3 в соответствии со следующей процедурой. В каждую лунку добавляли по 50 мкл ганглиозида в метаноле (4 мкг/мл). Метанол выпаривали путeм помещения планшетов в температуру 37 С на 1 ч. Затем добавляли по 150 мкл на лунку буфера Трис-НСl (0,05 М; рН=7,8), содержащего 1% бычьего сывороточного альбумина, после чего планшеты инкубировали при 37 С в течение получаса. Гибридомные надосадочные фракции инкубировали с 4 мкг/мл моноклонального антитела P3 в течение 3 ч при 37 С, затем добавляли 50 мкл на 1 лунку смеси и планшеты инкубировали при 37 С в течение 90 мин. Лунки промывали 4 раза 200 мкл фосфатно-солевого буфера и добавляли 50 мкл соответственным образом разведeнной антисыворотки, содержащей помеченные щелочной фосфатазой антимышиные иммуноглобулины. После промывки ФСБ лунки инкубировали с субстратным раствором в соответствии с описанным выше. Было получено антиидиотипическое моноклональное антитело, обозначенное 1 Е 10, относящееся к подклассу иммуноглобулинов IgG1. Это анти-IdР 3 mAb 1E10 характеризовалось очень высоким уровнем специфичности в отношении mAb P3, использовавшегося в качестве иммуногена. Оно не проявляло реактивности в отношении с другими антиганглиозидными антителами, такими как Е 1, A3 и F6 (фиг. 1). Данное антиидиотипическое моноклональное антитело было способно подавлять связывание моноклонального антитела P3 с NeuGcGM3 (фиг. 2) и с позитивной по P3 линии клеток опухоли молочной железы. Пример 2. Создание анти-антиидиотипического (Аb3) антитела в ответ на антиидиотипическое mAb 1E10 в ксеногенной модели. Осаждeнное гидрооксидом алюминия антиидиотипическое моноклональное антитело 1E10 было использовано для иммунизации путм внутрикожной инъекции зелных мартышек при 14-дневном интервале между инъекциями дозой 2 мг mAb за одну инъекцию. Эти животные получали по несколько доз mAb. Пробы сыворотки были взяты до и после иммунизации. Присутствие антитела Аb3 в сыворотке обезьян определяли методом ТИФА. Планшеты для ТИФА (с высоким связыванием,производство Costar) инкубировали в течение ночи при 4 С с 10 мкг/мл моноклонального антитела 1E10 или его фрагментов F(ab')2 в карбонатно-бикарбонатном буфере (рН=9,8). После 11 промывки в ФСБ, содержащем 0,05% Твин-20,планшеты блокировали тем же буфером, содержащим 1% бычьего сывороточного альбумина, в течение 1 ч при 37 С. После повторения этапа промывки добавляли по 50 мкл на 1 лунку различных разведений сыворотки. После инкубации в течение 2 ч при 37 С планшеты снова промывали и добавляли антисыворотку, содержащую помеченный щелочной фосфатазой козий античеловеческий иммуноглобулин (анти-IgM или анти-IgG). После промывки добавляли описанный выше субстратный раствор. Эксперименты по индукции блокирования проводили с целью разграничения между формами иммунных ответов с образованием антиизотипических и антиидиотипических антител. Сыворотку обезьян инкубировали в течение ночи при 4 С с 500 мкг/мл mAb, характеризующегося тем же изотипом, что и антитело 1E10,но обладающим иной специфичностью. Затем оставшуюся реактивность сыворотки в отношении 1E10 измеряли с помощью ТИФА в соответствии с описанным выше. Сыворотку обезьян тестировали по еe способности подавлять связывание помеченного биотином моноклонального антитела Р 3 с фрагментами F(ab')2 моноклонального антитела 1E10, загруженными на ТИФА-планшеты в соответствии с описанным выше методом ТИФА: после инкубации загруженных планшетов с разведениями сыворотки добавляли по 50 мкл на 1 лунку биотинилированного mAb P3. После инкубации в течение 1 ч при 37 С планшеты промывали и по 50 мкл на 1 лунку авидин-биотинпероксидазного комплекса добавляли на 1 ч при 37 С. После промывки добавляли субстратный буфер (8 мг о-фенилендиамина в 12 мл фосфатно-цитратного буфера: рН=5,0). Величины поглощения при длине волны 492 нм измеряли с помощью считывателя ТИФА. Сыворотка обезьян, иммунизованных антиидиотипическим (P3) моноклональным антителом 1 Е 10, мощно реагировала с фрагментамиF(ab')2 1E10 (фиг. 3). Сыворотка иммунизованных обезьян специфическим образом связывалась с иммунизующим mAb 1E10, проявляя меньшую реактивность в отношении постороннего моноклонального антитела (С 5). Присутствие антител, специфичных в отношении идиотипа 1E10, подтверждалось после инкубирования сыворотки животного с посторонним mAb,вследствие мощной реактивности адсорбированной сыворотки с анти-Id(Р 3) mAb 1E10; оказалось, что индуцированный ответ по выработке антиидиотипического антитела был более сильным по сравнению с генерированным ответом по выработке антиизотипического антитела(фиг. 4). Аb3-содержащая сыворотка обезьян также подавляла связывание биотинилированного моноклонального антитела P3 с анти-IdmAb 1E10: это указывает на то, что Аb3 003366 12 сыворотка обезьян включает идиотопы, являющиеся общими с mAb P3 (фиг. 5). Преобладание ответа по выработке антител класса IgG было вызвано против анти-Id(Р 3) mAb 1E10 (фиг. 6). Сыворотка обезьян реагировала с фрагментамиF(ab')2 1E10 даже спустя 4 месяца после того,как животным была проведена последняя иммунизация (фиг. 7). Антитела Аb3, обладающие способностью к подавлению связывания mAbP3 с 1E10, также выявлялись в этот период времени. В то же время в сыворотке животных не выявлялись антитела, специфичные в отношении NeuGcGM3. Таким образом, показано, что антиидиотипическое моноклональное антитело 1E10 относится в -типу, поскольку антиидиотипическое моноклональное антитело 1 Е 10 характеризуется способностью подавлять связывание mAb P3 с соответствующим ему антигеном и отсутствием способности индуцировать выработку Р 3 подобных антител у животных. Пример 3. Лечение мышей с использованием анти-Id mAb 1E10. Мышей линии C57BL/6 иммунизовали пятью дозами по 50 мкг осаждeнного гидроокисью алюминия антиидиотипического моноклонального антитела 1E10 при интервале между инъекциями в 14 дней. Через 1 неделю мышам подкожно инъецировали по 5000 меланомных клеток В 16. В качестве контроля использовали животных, которых лечили аналогичным образом, но которые не получали иммунизующих инъекций. Кривые выживаемости, выстроенные по Каплану-Мейеру, показаны на фиг. 8: выживаемость была существенно выше в группе, иммунизованной анти-Id mAb 1E10, по сравнению с контрольной группой. Мышам линии C57BL/6 внутривенно вводили по 50 тысяч клеток лгочной опухоли Льюиса. Через 14 дней внутривенно вводили по 10 мкг антитела 1E10 и спустя ещe 6 дней мышей умерщвляли и подсчитывали количество лeгочных метастазов. В качестве контроля использовали животных, которых лечили посторонним моноклональным антителом класса IgG или только фосфатно-солевой буфер. У 7 животных из 10, которые получали анти-Р 3 моноклональное антитело 1E10, легочные метастазы не развивались вовсе, а у других 3 животных максимальное общее число метастазов составило 3. Напротив, у всех животных, которым вводили посторонний IgG или только ФСБ, развивались лeгочные метастазы. Эти результаты указывают на то, что введение антиидиотипического моноклонального антитела -типа обеспечивает противоопухолевый защитный эффект. Краткое описание фигур Фиг. 1 показывает реактивность антиидиотипического mAb P3 1E10 в отношении антиганглиозидных mAb Р 3, Е 1, A3 и F6. Фиг. 2 показывает результаты теста на подавление, в котором моноклональное антитело Р 3 инкубировали с анти-Id(Р 3) моноклональным антителом 1 Е 10, после чего реактивность mAbP3 в отношении NeuGcGM3 определяли методом ТИФА. Фиг. 3 показывает реактивность обезьяньих сывороточных антител с фрагментами F(ab')2 антитела 1E10, определяемую методом ТИФА после того, как животным вводили различные дозы осажднного гидрооксидом алюминия антиидиотипического моноклонального антитела 1 Е 10. Фиг. 4 показывает результаты теста на подавление, в котором обе реактивности - непреадсорбированная обезьянья сыворотка, содержащая моноклональное антитело 1 Е 10 , и непреадсорбированная обезьянья сыворотка,содержащая постороннее изотипическое моноклональное антитело С 5 , были измерены методом ТИФА, равно как и связывание сывороточных антител с моноклональным антителом 1 Е 10 и с посторонним моноклональным антителом С 5 . Стрелки указывают на время иммунизации и продолжающиеся линии указывают на время взятия проб крови. Фиг. 5 показывает подавление связыванияmAb Р 3 с анти-Id mAb 1E10 сывороткой обезьян, иммунизованных моноклональным антителом 1E10 путeм анализа методом ТИФА. Стрелки указывают на время иммунизации и продолжающиеся линии указывают на время взятия проб крови. Фиг. 6 показывает кинетику ответа по выработке иммуноглобулинов IgM и IgG против моноклонального антитела 1E10 в сыворотке обезьян, иммунизованных антиидиотипическим моноклональным антителом, путeм анализа методом ТИФА. Стрелки указывают на время им мунизации и продолжающиеся линии указывают на время взятия проб крови. Фиг. 7 показывает распознавание фрагментов F(ab')2 антитела 1E10 преиммунной сывороткой обезьян; сывороткой, полученной после того, как обезьяны получили последнюю дозу осаждeнного гидрооксидом алюминия антиидиотипического моноклонального антитела 1 Е 10 (отмечено стрелкой), и сывороткой, полученной спустя 4 месяца после последней иммунизующей инъекции, проведeнной этим животным. Фиг. 8 показывает кривые выживаемости,выстроенные по Каплану-Мейеру, у мышей,которым вводили антиидиотипическое (Р 3) моноклональное антитело 1 Е 10 и после этого заражали их меланомными клетками линии В 16. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Штамм гибридных клеток ЕСАСС 97112901, продуцирующий антиидиотипическое моноклональное антитело 1 Е 10, специфичное в отношении антител мыши к N-гликолилсодержащим ганглиозидным опухолевым антигенам. 2. Антиидиотипическое моноклональное антитело 1 Е 10, специфичное в отношении антител мыши к N-гликолилсодержащим ганглиозидным опухолевым антигенам, продуцируемое штаммом гибридных клеток по п.1 и обладающее защитным действием в отношении соответствующих опухолей. 3. Фармацевтическая композиция, содержащая эффективное количество моноклонального антитела по п.2 в сочетании с растворителем, адъювантом или носителем. 4. Применение моноклонального антитела по п.2 для производства лекарственного средства для лечения опухолей.
МПК / Метки
МПК: C07K 16/42, A61K 39/395, A61P 35/00, C12N 5/20
Метки: иммунотерапии, антитела, антиидиотипические, активной, композиции, моноклональные, злокачественных, опухолей, содержащие, применение
Код ссылки
<a href="https://eas.patents.su/9-3366-antiidiotipicheskie-monoklonalnye-antitela-ih-primenenie-v-aktivnojj-immunoterapii-zlokachestvennyh-opuholejj-i-soderzhashhie-ih-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Антиидиотипические моноклональные антитела, их применение в активной иммунотерапии злокачественных опухолей и содержащие их композиции</a>
Предыдущий патент: Производные аминоалкилхроманов, обеспечивающие релаксацию мускулатуры дна желудка
Следующий патент: Стабильные жидкие составы ботулинического токсина
Случайный патент: Устройство для пропускания газа через спекаемый материал