Стероиды, замещенные в положении 11, способ их получения, их применение в качестве лекарственного средства и содержащие их фармацевтические композиции
Номер патента: 1868
Опубликовано: 22.10.2001
Авторы: Ник Франсуа, Буали Иамина, Ван Де Вельд Патрик, Тетш Жан-Жорж
Формула / Реферат
1. Соединения общей формулы
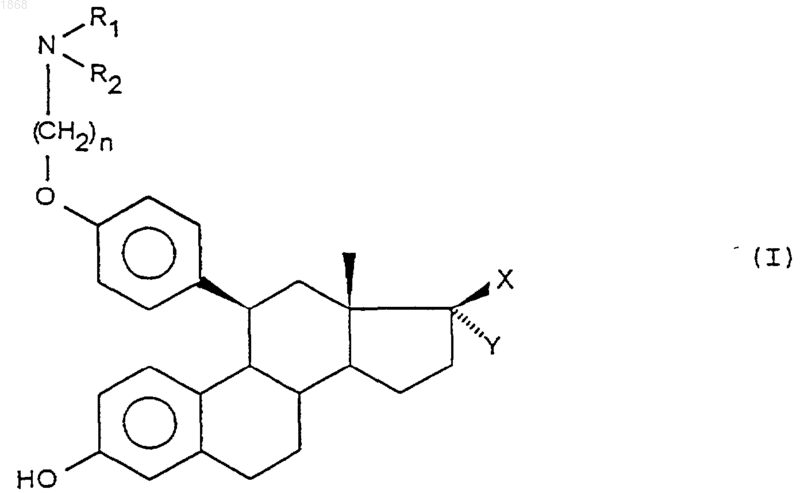
в которой n - целое число, равно 2 или 3,
либо R1 и R2, идентичные или разные, означают атом водорода или алкил, содержащий от 1 до 4 атомов углерода,
либо R1 и R2 образуют вместе с атомом азота, с которым они связаны, моно- или полициклический гетероцикл, имеющий от 5 до 15 звеньев, ароматический или не ароматический, содержащий, при необходимости, от 1 до 3 дополнительных гетероатомов, выбираемых из кислорода, серы и азота, замещенный или не замещенный,
Х означает гидроксильный радикал, при необходимости, этерифицированный, а
Y означает замещенный или не замещенный алкильный радикал, содержащий от 1 до 4 атомов углерода, а также их аддитивные соли с фармацевтически приемлемыми кислотами.
2. Соединения общей формулы (I) по п.1, в которой n равно 2, а также их аддитивные соли с фармацевтически приемлемыми кислотами.
3. Соединения общей формулы (I), определенной в п.1 или 2, в которой n равно 2, либо R1 и R2, идентичные или разные, означают радикал алкил, содержащий от 1 до 4 атомов углерода, либо R1 и R2 образуют вместе с атомом азота, с которым они связаны, группу пиперидино, пирролидино или 2-азабицикло(2.2.1)гепт-2-ил, Х означает гидроксильный радикал, a Y означает радикал метил или этил, а также их аддитивные соли с фармацевтически приемлемыми кислотами.
4. Соединения общей формулы (I) по одному из пп.1-3, а также их аддитивные соли с фармацевтически приемлемыми кислотами, имеющие следующие названия:
-11b-[4-[2-(1-пиперидинил)этокси]фенил]-19-нор-17a -прегна-1,3,5(10)-триен-3,17b-диол,
-17a-метил-11b-[4-[2-(1-пиперидинил)этокси]фенил]-эстра-1,3,5(10)-триен-3,17b-диол,
-17a-метил-11b-[4-[2-(диэтиламино)этокси]фенил]-эстра-1,3,5(10)-триен-3,17b-диол,
-17a-метил-11b-[4-[2-(1-пирролидинил)этокси]фенил]-эстра-1,3,5(10)-триен-3,17b-диол,
-17a-метил-11b-[4-[2-(2-азабицикло(2.2.1)гепт-2-ил)этокси]фенил]-эстра-1,3,5(10)-триен-3,17b-диол,
-11b-[4-[2-(2-азабицикло(2.2.1)гепт-2-ил)этокси]фенил]-19-нор-17a-прегна-1,3,5(10)-триен-3,17b-диол,
-17a-(трифторметил)-11b-[4-[2-(1-пиперидинил)этокси]фенил]-эстра-1,3,5(10)-триен-3,17b-диол.
5. Способ получения соединений общей формулы (I), определенной в п.1, отличающийся тем, что соединение общей формулы
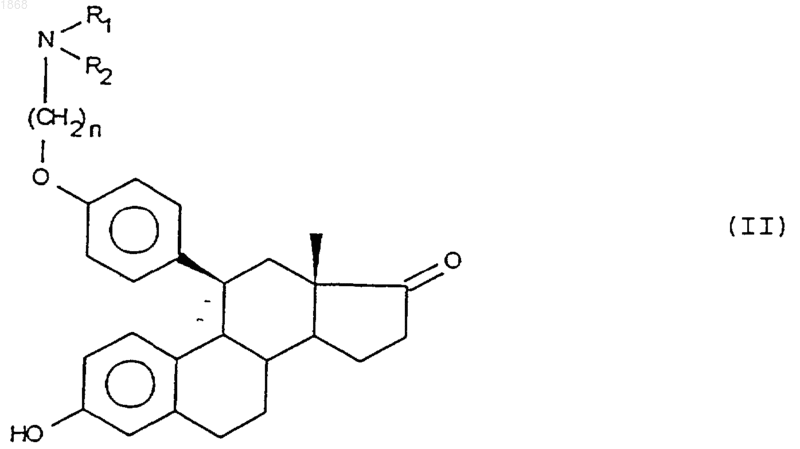
в которой n, R1 и R2 имеют значения, указанные в п.1, подвергают действию металлорганического соединения, производного радикала алкил, содержащего от 1 до 4 атомов углерода, с образованием соединения формулы (I), в которой Х - гидроксильная группа, a Y- алкильная группа, содержащая от 1 до 4 атомов углерода, полученное соединение в случае необходимости подвергают реакции этерификации 17-ОН группы или реакции солеобразования.
6. Способ получения соединений общей формулы (I), определенной в п.1, в которой Y означает радикал алкил, содержащий от 2 до 4 атомов углерода, отличающийся тем, что соединение общей формулы
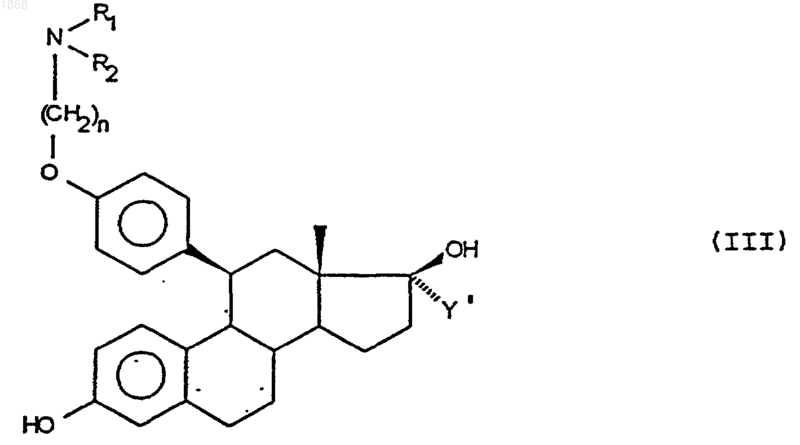
в которой n, R1 и R2 имеют вышеназванные значения и в которой Y' означает алкенильную или алкинильную группу, содержащую от 2 до 4 атомов углерода, подвергают действию агента, восстановления двойной связи или тройной связи, с получением соединения формулы (I), в которой Х - гидроксильная группа, а Y - алкильная группа, содержащая от 2 до 4 атомов углерода, соединение формулы (I), которое, в случае необходимости, подвергают реакции этерификации 17-ОН группы и/или реакции солеобразования.
7. Применение соединений общей формулы (I) по п.1 в качестве лекарственных средств.
8. Применение соединений общей формулы (I) по пп.2, 3 или 4 в качестве лекарственных средств.
9. Применение соединений формулы (I) по п.1 в качестве лекарственных средств, предназначенных для гормонального заместительного лечения менопаузы или перименопаузы, в частности, для профилактики или лечения остеопороза, и не имеющих или почти не имеющих эстрогенной активности по отношению к матке, а также для защиты сердечно-сосудистой системы.
10. Применение соединений общей формулы (I) по п.1 в качестве лекарственных средств, предназначенных для гормонального заместительного лечения менопаузы или перименопаузы, в частности, для профилактики или лечения остеопороза у женщин с риском возникновения опухоли груди.
11. Фармацевтические композиции, содержащие соединение по п.1.
Текст
1 Настоящее изобретение относится к стероидным соединениям, замещенным в положении 11, способу их получения, к их применению в качестве лекарственного средства и содержащим их фармацевтическим композициям. Остеопороз является патологией, которая характеризуется количественным и качественным ослаблением костной ткани, достаточным,чтобы повлечь за собой позвоночные или периферические переломы, которые возникают самопроизвольно или в результате незначительных травм. Хотя это заболевание имеет много факторов его возникновения, у женщин основным фактором возникновения костной недостаточности или остеопении является менопауза. Остеопения проявляется в разжижении и изменении строения спонгиозной кости, следствием чего является увеличение хрупкости скелета и риск переломов. Костная недостаточность сильно увеличивается после менопаузы в результате прекращения работы яичников и достигает 3-5% за год, затем после 65 лет скорость увеличения костной недостаточности замедляется. В терапии постменопаузный гормональный дефицит может компенсироваться заместительной гормонотерапией, где главную роль играет эстроген, сохраняющий костную ткань. Но длительная эстрогенотерапия иногда сопровождается нежелательным воздействием на половые органы (эндометриальная гиперплазия,грудная опухоль ), что является серьезным недостатком и ограничивает ее использование. Следовательно, необходимо найти другие соединения кроме эстрадиола, которые имели бы разъединенную эстрогенную активность, а именно, эстрогенную активность по отношению к кости, и совсем не имели бы или имели бы очень незначительную активность по отношению к эндометриальной гиперплазии или по отношению к разрастанию грудной опухоли. Заявка на патент FR 2640977 А (29 июня 1990) описывает стероиды, имеющие антиэстрогенную активность и/или эстрогенную активность. Эти соединения отличаются от соединений согласно изобретению тем, что они замещены группой алкинил или не замещены в положении 17 альфа. Журнал о стероидах (Lu jin et al. Vol. 608 август 1995, 512-518) описывает не замещенный в положении 17 альфа аналог (RU 39411), который обладает смешанной активностью, как эстрогенной, так и антиэстрогенной,подавляет рост опухолевых клеток груди MCF-7 и, таким образом, используется при лечении рака груди. Таким образом, объектом изобретения являются соединения общей формулы в которой n - целое число, равное 2 или 3,либо R1 и R2, идентичные или разные, означают атом водорода или радикал алкил, содержащий от 1 до 4 атомов углерода,либо R1 и R2 образуют вместе с атомом азота, с которым они соединены, гетероцикл,моно- или полициклический, насыщенный или ненасыщенный, 5-15-членный ароматический или не ароматический, содержащий, при необходимости, от 1 до 3 дополнительных гетероатомов, выбираемых из кислорода, серы и азота,замещенный или не замещенный, Х означает гидроксил, возможно этерифицированный, и Y означает алкил, замещенный или не замещенный, содержащий от 1 до 4 атомов углерода, а также их аддитивные соли с фармацевтически приемлемыми кислотами. Под алкильным радикалом, содержащим от 1 до 4 атомов углерода, понимают радикалы метил, этил, пропил, изопропил, н.бутил, изобутил, трет.-бутил. Когда Y означает алкил, речь идет, в частности, об алкиле, замещенном одним или несколькими атомами галогена. ПредпочтительноY может означать группу трифторметил. Когда R1 и R2 образуют вместе с атомом азота, с которым они соединены гетероцикл, то речь идет в частности о насыщенных моно- или бициклических гетероциклах, содержащих, при необходимости, еще один гетероатом, выбираемый из кислорода и азота, таких как гетероциклы, выбираемые из пирролила, имидазолила,индолила, пиридила, пиразинила, пиримидинила, пиридазинила, тиазолила, оксазолила, фуразонила, пиразолинила, тиазолинила, и, в частности, следующие насыщенные гетероциклы: Когда этот гетероцикл замещен, то он замещен, в частности, алкильной группой, содержащей от 1 до 4 атомов углерода на уровне атома азота. Когда Х - гидроксильный радикал, возможно этерифицированный, то речь идет о группах OCO-alc1F, в которых alc1F - алкил, содержащий от 1 до 8 атомов углерода, и предпочтительно о группах -ОСОМе или OCOEt. Под аддитивными солями с фармацевтически приемлемыми кислотами понимают аддитивные соли, образованные минеральными или 3 органическими кислотами с аминогруппами. Так, речь может идти о следующих кислотах: соляная, бромисто-водородная, азотная, серная,фосфорная, уксусная, муравьиная, пропионовая,бензойная, малеиновая, фумаровая, янтарная,винная, лимонная, щавелевая, глиоксиловая,аспарагиновая, алкинсульфоновые, такие как метансульфоновая или этансульфоновая, арилсульфоновые, такие как бензолсульфоновая или паратолуолсульфоновая и бензоларилкарбоновая или паратолуоларилкарбоновая. В частности, объектом данного изобретения являются соединения вышеназванной формулы (I), в которой n равно 2, и их аддитивные соли с фармацевтически приемлемыми кислотами. Предпочтительно объектом изобретения являются соединения вышеназванной формулы(I), в которой n равно 2,либо R1 и R2, идентичные или разные, означают радикал алкил, содержащий от 1 до 4 атомов углерода,либо R1 и R2 образуют вместе с атомом азота, с которым они связаны, группу пиперидино, пирролидино или 2-азабицикло(2.2.1)гепт 2-ил,Х означает гидроксильный радикал и Y означает радикал метил или этил. В частности объектом изобретения являются соединения формулы (I) и их аддитивные соли с фармацевтически приемлемыми кислотами, которые имеют следующие названия:-11-[4-[2[(1-пиперидинил)этокси]фенил]19-нор-17-прегна-1,3,5(10)-триен-3,17-диол,-17-метил-11-[4-[2[(1-пиперидинил) этокси]фенил]-эстра-1,3,5(10)-триен-3,17-диол,-17-метил-11-[4-[2-(диэтиламино)этокси]фенил]-эстра-1,3,5(10)-3,17-диол,-17-метил-11-[4-[2-(1-пирролидинил) этокси]фенил]-эстра-1,3,5(10)-триен-3,17-диол,-17-метил-11-[4-[2-(2-азабицикло(2,2,1) гепт-2-ил)этокси]фенил]-эстра-1,3,5(10)-триен 3,17-диол,-11-[4-[2-(2-азабицикло(2.2.1)гепт-2-ил) этокси]фенил]-19-нор-17-прегна-1,3,5(10)триен-3,17-диол,-17-(трифторметил)-11-[4-[2-(1-пиперидинил)этокси]фенил]-эстра-1,3,5(10)-триен 3,17-диол. Объектом изобретения также является способ получения соединений вышеназванной общей формулы (I), заключающийся в том, что соединение общей формулы (II) в которой n, R1 и R2 имеют вышеназванные значения, подвергают взаимодействию с металлоорганическим соединением, производным алкила, содержащего от 1 до 4 атомов углерода, и получают соединение формулы (I), в которой Х - гидроксильная группа и Y - алкильная группа, содержащая от 1 до 4 атомов углерода, которое, в случае необходимости, подвергают реакции этерификации группы 17-ОН и/или реакции солеобразования. Воздействие металлоорганического соединения на группу 17-кето позволяет получить соединения формулы (I), в которой Х - гидроксильная группа и Y - алкильная группа, содержащая от 1 до 4 атомов углерода. Металлоорганическое производное алкила,содержащего от 1 до 4 атомов углерода, выбирают из магнийорганических соединений формулы Y-MgHal и литийорганических соединений формулы Y-Li, в которых Y имеет вышеназванное значение, a Hal означает атом галогена. Предпочтительно реакцию проводят в присутствии хлорида церия. В предпочтительном варианте осуществления способа Hal означает атом хлора, брома или йода, предпочтительно брома. Чтобы получить соединения формулы (I), в которых Х - гидроксильный радикал, а Y - это группа СF3, реакцию проводят при действии СF3SiМе 3 на группу 17-кето, затем обрабатывают агентом снятия защиты, таким как фторид тетрабутиламмония. Объектом изобретения является также способ получения соединений общей формулы(I), в которой Y означает алкил, содержащий от 2 до 4 атомов углерода, заключающийся в том,что соединение общей формулы (III) в которой n, R1 и R2 имеют вышеназванные значения и в которых Y1 означает алкенильную или алкинильную группу, содержащую от 2 до 4 атомов углерода, подвергают воздействию аген 5 та восстановления двойной или тройной связи, с получением соединения формулы (I), в которой Х - гидроксильная группа и Y - алкильная группа, содержащая от 2 до 4 атомов углерода, которое, в случае необходимости, подвергают реакции этерификации с группой 17-ОН и/или реакции солеобразования. Реакцию полного восстановления можно осуществлять с помощью водорода в присутствии катализатора, такого как палладий на угле,или родиевого катализатора, такого как реактив Уилкинсона. Реакции этерификации и солеобразования осуществляют обычными способами, широко известными специалисту. Соединения общей формулы (I) и их аддитивные соли с фармацевтически приемлемыми кислотами, обладают эстрогенной активностью,а также антиэстрогенной и антипролиферативной активностью. Благодаря своей активности соединения формулы (I) могут быть использованы при лечении болезней, связанных с гипофолликулинией, например, аменорей, диспенорей, повторных выкидышей, предменструальных болей, в лечении некоторых эстрогенозависимых патологий, таких как простатические аденомы или карциномы, грудные карциномы и их метастазы или при лечении доброкачественных опухолей груди, в качестве антиустеротрофического средства, а также в заместительной терапии менопаузы или перименопаузы. Среди симптомов и последствий, связанных с менопаузой, чаще всего называют приливы крови к лицу, потение, атрофию и сухость влагалища, мочевые симптомы и продолжительное уменьшение костной массы и повышение риска переломов, а также потерю стойкости сердечно-сосудистой системы, вызываемую эстрогенами. В частности, соединения формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами могут также быть использованы в профилактике или лечении остеопороза. Соединения формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами могут также использоваться в профилактике и лечении остеопороза у мужчин. Они также могут использоваться в профилактике и лечении вторичных (побочных) остеопорозов (например, кортизоновых, связанных с неподвижностью). Соединения формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами обладают, в частности, разъединенной эстрогенной активностью. Под разъединенной эстрогенной активностью понимают эстрогенную активность по отношению к костному аппарату и минимальную активность по отношению к матке, не вызывающую эндометриальную пролиферацию (ак 001868 6 тивность гораздо ниже, чем активность эстрадиола). Соединения согласно изобретению имеют следующие преимущества.- Они обладают антиэстрогенной активностью в отношении клеток грудных желез. В противоположность эстрадиолу они не стимулируют рост опухолевых клеток грудных желез у человека и даже могут подавлять их рост. Соединения согласно изобретению, таким образом,предпочтительны при лечении менопаузы у женщин, предрасположенных к раку груди (семейный анамнез), для которых, таким образом,исключается заместительное лечение эстрадиолом. Эти соединения могут также использоваться при лечении рака груди.- Они приводят к снижению сывороточного холестерина до уровня, эквивалентного уровню при лечении эстрадиолом, усиливая тем самым стойкость сердечно-сосудистой системы.- Наконец, их не прописывают для приема вместе с прогестомиметическим соединением,потому что они не обладают эстрогенной активностью по отношению к матке. Таким образом, объектом изобретения являются соединения общей формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами, в качестве лекарственных средств. В частности, объектом изобретения являются соединения формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами, в качестве лекарственных средств,предназначенных для профилактики и лечения остеопороза. Также объектом изобретения являются соединения общей формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами в качестве лекарственного средства,предназначенного для профилактики или лечения остеопороза, которое не имеет или почти не имеет эстрогенной активности по отношению к матке. Наконец, объектом изобретения являются соединения общей формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами в качестве лекарственного средства, предназначенного для профилактики или лечения остеопороза, у женщин, расположенных к опухолям груди. Изобретение относится к фармацевтическим композициям, имеющим в качестве активного начала, по меньшей мере, одно из вышеназванных лекарственных средств. Соединения формулы (I), а также их аддитивные соли с фармацевтически приемлемыми кислотами применяют через пищеварительный тракт, парентерально или местно, например,чрескожно. Они могут назначаться в виде простых или дражированных таблеток, желатинированных капсул, гранул, свечей, вагинальных шариков, инъекций мазей, кремов, гелей, мик 7 росфер, имплантатов, внутривагинальных колец, пластырей, спреев, которые готовят согласно обычным методикам. Одно или несколько активных начал могут вводиться в фармацевтические композиции вместе с обычно используемыми в них эксципиентами, такими как тальк, гуммиарабик,лактоза, крахмал, стеарат магния, масло какао,водные и не водные связующие, жировые вещества животного или растительного происхождения, производные парафинов, гликоли, различные смачивающие вещества, диспергаторы или эмульгаторы, консерванты. Приемлемая дозировка варьируется в зависимости от заболевания и от способа введения средства, она может составлять, например, от 0,5 до 100 мг в день для взрослых при приеме внутрь. Соединения общей формулы (II) и (III) известны и описаны в следующих патентах: ЕР-В 0097572, FR-B-2640977, ЕР-В-305942. Приведенные ниже примеры иллюстрируют изобретение, но не ограничивают его. Пример 1. 17-метил-11-[4-[2-[(1-пиперидинил)этокси]фенил]-эстра-1,3,5(10)-триен 3,17-диол. После дегидратации 1,06 г СеСl3 (III), 7 Н 2O при пониженном давлении при t=140C добавляют в инертной атмосфере и при комнатной температуре 10,6 мл тетрагидрофурана(ТГФ), затем после перемешивания в течение 2 ч добавляют при температуре -70 С 1,89 мл эфирного раствора метиллития 1,6 М и перемешивают в течение 30 мин при температуре-75 С. Затем добавляют к этой суспензии 268 мг 3-гидрокси-11-[4-[2-(1-пиперидинил)этокси] фенил]-эстра-1,3,5(10)-триен-3,17-она в растворе в 3 мл тетрагидрофурана/силипорита и перемешивают при этой температуре в течение 1 ч. После добавления 15 мл насыщенного раствора хлорида аммония и 20 мл этилацетата фильтруют, промывают, сушат и выпаривают при пониженном давлении, чтобы получить 277 мг неочищенного целевого продукта. Этот продукт очищают хроматографией на диоксиде кремния, элюируя смесью метиленхлорид 90/метанол 10/гидроксид аммония 0,5. Получают 232 мг продукта,который перекристаллизовывают из смеси дихлорметан/ изопропиловый эфир, и получают 180 мг целевого продукта. Т.пл.=155 С ИК спектр (СНСl3) Пример 2. 11-[4-[2[-(1-пиперидинил) этокси]фенил]-19-нор-17-прегна-1,3,5(10)триен-3,17-диол. К раствору в инертной атмосфере из 192 мг 11-[4-[2[(1-пиперидинил)этокси]фенил]-19 нор-17-прегна-1,3,5(10)-триен-20-ин-3,17-диола в 6 мл этанола добавляют 20 мг палладия на угле (9,5%) и перемешивают под давлением водорода в 1660 мбар в течение 1 ч 45 мин. Суспензию фильтруют и выпаривают под пониженным давлением. Получают 193 мг неочищенного продукта, который очищают хроматографией на колонке из диоксида кремния (LichrosorbRP18), элюируя смесью метанола 90/вода 10. Получают 137 мг продукта, который рекристаллизуют в смеси дихлорметан/изопропиловый эфир, и получают 114 мг чистого целевого продукта. Т.пл.=231 С ИК спектр (СНСl3)H1 (цикл А) 6,96 Н'2, Н'6 фенила в положении 11 9,94 3-ОН Пример 3. 11-[4-[2-[2-азабицикло(2.2.1) гепт-2-ил]этокси]фенил]-17-метил-эстра 1,3,5(10)-триен-3,17-диол. Действуют как в примере 1, используя в качестве исходного вещества 3,70 г СеСl3, 7 H2O и 37 мл тетрагидрофурана и 6,7 мл эфирного раствора метиллития (1,6 М). К полученной суспензии, охлажденной до -78 С, добавляют медленно 966 мг 11-[4-[2-[2-азабицикло(2.2.1)гепт-2-ил]этокси]фенил]3-гидрокси-эстра 1,3,5(10)-триен-17-она в растворе 8 мл тетрагидрофурана, перемешивают в течение 45 мин и продолжают синтез, как в примере 1. Получают 874 мг неочищенного продукта. После хроматографии на диоксиде кремния (элюируя CH2Cl2 СН 3 ОН - NH4 ОH 90-10-0,7, затем AcOEt-ТЭА 88-12), получают 442 мг целевого продукта. Т. пл.=163-164 С ИК спектр (СНСl3)H1 цикла А 6,46-6,95 Н фенила в положении 11 Получение 11-[4-[2-[2-азабицикло(2.2.1) гепт-2-ил]этокси]фенил]-3-гидрокси-эстра 1,3,5(10)-триен-17-она, используемого в качестве исходного в примере 3. Смешивают 1,1 г 3-гидрокси 11-[4(иодоэтокси)фенил]-эстра-1,3,5(10)-триен-17 она, растворенного в 20 мл тетрагидрофурана, и 1,03 г 2-азабицикло[2.2.1.]гептана и перемешивают в течение 1 ч 30 мин при температуре дефлегмации в атмосфере азота. Выпаривают тетрагидрофуран, обрабатывают остаток в этилацетате, добавляют воды, экстрагируют этилацетатом, сушат, выпаривают растворитель и получают после хроматографии на диоксиде кремния (элюируя СН 2 Сl2-СН 3 ОН-NН 4OН 90-10-0,5) 0,97 г целевого продукта.Rf=0,27. Пример 4. 17-метил-11-[4-[2-(1-пирролидинил)этокси]фенил]-эстра-1,3,5(10)-триен 3,17-диол. Действуют как в примере 1, используя в качестве исходного 3,24 г СеСl3, 7 Н 2 О, 30 мл тетрагидрофурана, 5,85 мл метиллития, затем 850 мг 3-гидрокси-11-[4-[2-(1-пирролидинил) этокси]фенил]-эстра-1,3,5(10)-триен-17-она,растворенного в 8,5 мл тетрагидрофурана. После хроматографии на диоксиде кремния (элюируя CH2Cl-CH3OH-NH4OH 92-8-0,5), получают 615 мг целевого продукта. Т.пл.=155-157 С ИК спектр (СН 3 Сl3)H1 цикла А 6,49-6,95 Н фенила в положении 11 Получение 3-гидрокси-11-[4-[2-(1-пирролидинил)этокси]фенил]-эстра-1,3,5(10)-триен 17-она, используемого в качестве исходного в примере 4. Действуют, как при получении исходного продукта примера 3, используя 1,1 г стероидного иодсодержащего производного в 20 мл тетрагидрофурана и 1 мл пирролидина. Получают 864 мг целевого продукта после хроматографии на диоксиде кремния (элюируя CH2Cl2-СН 3 ОНNН 4OН 92-8-0,2).Rf=0,29. Пример 5. 11-[4-[2-(диэтиламино)этокси] фенил]17-метил-эстра-1,3,5(10)-триен-3,17 диол. Действуют, как в примере 1, используя в качестве исходного продукта 3,62 г хлорида СеСl3, 7 Н 2 О, 36 мл тетрагидрофурана и 6,5 мл метиллития в простом эфире (1,6 М), затем 898 мг 3-гидрокси 11-[4-[2-(диэтиламино)этокси] фенил]-эстра-1,3,5(10)-триен-17-она, растворенного в 9 мл тетрагидрофурана. После хроматографии на диоксиде кремния (элюируя СН 2 Сl2 СН 3 ОН-NH4 ОН 92-8-0,5), получают 686 мг целевого продукта. Т.пл.=159-160 С. ИК спектр (СНСl3)H1 (цикл А) 6,56 и 6,93 Н фенила в положении 11 Получение 3-гидрокси 11-[4-[2-(диэтиламино)этокси]фенил]-эстра-1,3,5(10)-триен-17 она. Действуют, как при получении исходного продукта примера 3, используя 1,1 г иодсодержащего стероидного производного в 20 мл тетрагидрофурана и 2 мл диэтиламина. Получают 898 мг целевого продукта после хроматографии на диоксиде кремния (элюируя CH2Cl2-СН 3 ОНNН 4 ОН 92-8-0,2).Rf = 0,24. Пример 6. 17-(трифторметил)-11-[4-[2(1-пиперидинил)этокси]фенил]-эстра-1,3,5(10)триен-3,17-диол. Нагревают в течение 2 ч при 120 С под давлением 102 мбар 83 мг фторида тетрабутиламмония (Me4NH, 4 H2O), затем доводят температуру до комнатной в инертной атмосфере. Добавляют 237 мг 3-гидрокси 11-[4-[2(пиперидинил)этокси]фенил]-эстра-1,3,5(10)триен-17-она, растворенного в 3 мл тетрагидрофурана, охлаждают до +4 С и добавляют 0,3 мл триметил (трифторметил)-силана, затем перемешивают 2 ч при этой температуре. Добавляют 4 мл фторида тетрабутиламмония в растворе в тетрагидрофуране, перемешивают 3 ч 30 мин при комнатной температуре, добавляют воды,экстрагируют метиленхлоридом, промывают водой, сушат и выпаривают растворители под пониженным давлением. Остаток хроматографируют на диоксиде кремния (элюируя СН 2 Сl2 11H1 (цикл А) Фармакологические тесты 1) Действие на пролиферацию клеток грудной железы. Пролиферативная активность молекул изучалась путем сравнения с пролиферативной активностью эстрадиола на культуре клеток грудной железы человека MCF-7. Чтобы выявить агонистическую активность эстрадиола и/или исследуемых соединений, культуральную среду, в которой поддерживают клетки (богатую факторами роста и стероидами), заменяют обедненной средой, лишенной также и стероидов (среда DEMEM, дополненная 5% сыворотки, не содержащей стероидов и без фенольного красного). Клетки помещают в обедненную среду за 2 дня до начала тестов. Через 7 дней культивирования в присутствии исследуемых соединений клеточную пролиферацию оценивают путем анализа ДНК. В каждом тесте эффект эстрадиола при концентрации 10-10 М (рост клеток в присутствии эстрадиола минус рост клеток в присутствии растворителя) принимают за 100% агонистической активности. Активность соединений определяют в сравнении с этим внутренним контролем. Соединения, которые вызывают рост клеток,идентичный росту, наблюдаемому в присутствии только одного растворителя, классифицируются как неактивные, а соединения, которые вызывают более слабый рост клеток, чем при растворителе, классифицируются как ингибиторы. Активность 2) Соединения согласно изобретению тестируют с целью определения их влияния на костную массу и на активность образования и резорбции на модели крысы с удаленным яичником в возрасте 3 месяцев. Животных обрабатывают с профилактической целью. Животные: Вид Штамм Пол- доза(ы): одна доза на тестируемое вещество (0,3 мг/кг/д)- срок между последней инъекцией и умерщвлением: 24 ч- количество введений: 20 2. Контрольное соединение: 17 эстрадиол вводили подкожно при дозе, равной 0,1 мг/кг/день в растворе со смесью масло проростков кукурузы - бензиловый спирт (99:1, об/об) в объеме 0,2 мл/кг. Протокол эксперимента: Животные. Исследование проводят на самках крыс с удаленными яичниками в возрасте 3 месяцев. Животные находятся в комнате, в которой поддерживается определенный температурный режим (202 С), их содержат в коробках группами по 4. Животные получают, ad libitum, деминерализованную воду и пищевые таблетки(пробки AО 4CR-10 UAR). Хирургия. У самок крыс в возрасте 3 месяцев весом примерно 250 г удаляют яичники под анестезией с имальгеном 100, доза которого равна 100 мг/кг и который вводят внутрибрюшинно (i.p.) и в объеме 1 мл/кг. Они получают также Нембутал (3 мг/кг внутрибрюшинно, в объеме 0,3 мл/кг). После бокового разреза кожный и мышечный слои разделяют. Удаление каждого яичника выполняют после перевязывания маточной трубы. Контрольные образцы крысы SHAM анестезируют в тех же условиях. После разреза кожного и мышечного слоев каждый яичник вынимают, затем возвращают на место. Лечение. Активность соединений определяют при профилактическом лечении. Их вводят непосредственно после удаления яичников. Животных распределяют на группы по 8. Группа 1: контрольные образцы крысыSHAM, получающие один или несколько носителей (растворителей). Группа 2: контрольные образцы крысOVX, получающие один или несколько носителей (растворителей). Группы X: крысы OVX, получающие соответственно определенные дозы одного или нескольких тестируемых соединений. 13 Взятие крови. По истечении 4 недель (продолжительность теста) животных обезглавливают с помощью гильотины. Собранную сыворотку после центрифугирования сохраняют при -20 С. Липидный баланс устанавливают, исходя из анализа сыворотки на общий холестерин,триглицериды и фосфолипиды на аликвотном объеме сыворотки 500 мкл. Понижение уровня сывороточного холестерина выражено в % по отношению к его уровню у животных с удаленными яичниками, получающими только растворитель. Изъятие органов. После умерщвления животных производят изъятие следующих органов:- генитальный тракт. Производят изъятие маток. Их взвешивают. Увеличение веса выражено в % от веса маток животных с удаленными яичниками, получающих только растворитель.- костная ткань. Костную массу (МКП или минеральная костная плотность) измеряют с помощью бифотонной абсорбциометрии рентгеновских лучей двойной энергии (DEXA). Изменения выполняют на удаленных костях, освобожденных от всех мягких тканей. BMD (костную минеральную плотность) измеряют на всей кости, а также на метафизарной части проксимального конца левой большой берцовой кости. Эта зона наиболее богата трабекулярной костью и, следовательно, наиболее чувствительна к изменениям костного объема и минеральной костной плотности. Результаты выражены в % согласно формуле: МКП тестированного продукта - МКП OVX100 Большая берцовая Матка Холестерин кость плотность % вес % Заключение Соединения согласно изобретению обеспечивают эффективную костную защиту(=75%), при этом проявляют минимальную уетеротрофическую активность по сравнению с названной активностью, вызываемой эстрадиолом. Кроме того, наблюдается значительное снижение общего уровня холестерина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы в которой n - целое число, равно 2 или 3,либо R1 и R2, идентичные или разные, означают атом водорода или алкил, содержащий от 1 до 4 атомов углерода,либо R1 и R2 образуют вместе с атомом азота, с которым они связаны, моно- или полициклический гетероцикл, имеющий от 5 до 15 звеньев, ароматический или не ароматический,содержащий, при необходимости, от 1 до 3 дополнительных гетероатомов, выбираемых из кислорода, серы и азота, замещенный или не замещенный,Х означает гидроксильный радикал, при необходимости, этерифицированный, аY означает замещенный или не замещенный алкильный радикал, содержащий от 1 до 4 атомов углерода, а также их аддитивные соли с фармацевтически приемлемыми кислотами. 2. Соединения общей формулы (I) по п.1, в которой n равно 2, а также их аддитивные соли с фармацевтически приемлемыми кислотами. 3. Соединения общей формулы (I), определенной в п.1 или 2, в которой n равно 2, либо R1 и R2, идентичные или разные, означают радикал алкил, содержащий от 1 до 4 атомов углерода,либо R1 и R2 образуют вместе с атомом азота, с которым они связаны, группу пиперидино, пирролидино или 2-азабицикло(2.2.1)гепт-2-ил, Х означает гидроксильный радикал, a Y означает радикал метил или этил, а также их аддитивные соли с фармацевтически приемлемыми кислотами. 4. Соединения общей формулы (I) по одному из пп.1-3, а также их аддитивные соли с фармацевтически приемлемыми кислотами,имеющие следующие названия:-17-(трифторметил)-11-[4-[2-(1-пиперидинил)этокси]фенил]-эстра-1,3,5(10)-триен 3,17-диол. 5. Способ получения соединений общей формулы (I), определенной в п.1, отличающийся тем, что соединение общей формулы в которой n, R1 и R2 имеют значения, указанные в п.1, подвергают действию металлорганического соединения, производного радикала алкил,содержащего от 1 до 4 атомов углерода, с образованием соединения формулы (I), в которой Х гидроксильная группа, a Y- алкильная группа,содержащая от 1 до 4 атомов углерода, полученное соединение в случае необходимости подвергают реакции этерификации 17-ОН группы или реакции солеобразования. 6. Способ получения соединений общей формулы (I), определенной в п.1, в которой Y означает радикал алкил, содержащий от 2 до 4 атомов углерода, отличающийся тем, что соединение общей формулы 16 в которой n, R1 и R2 имеют вышеназванные значения и в которой Y' означает алкенильную или алкинильную группу, содержащую от 2 до 4 атомов углерода, подвергают действию агента,восстановления двойной связи или тройной связи, с получением соединения формулы (I), в которой Х - гидроксильная группа, а Y - алкильная группа, содержащая от 2 до 4 атомов углерода, соединение формулы (I), которое, в случае необходимости, подвергают реакции этерификации 17-ОН группы и/или реакции солеобразования. 7. Применение соединений общей формулы (I) по п.1 в качестве лекарственных средств. 8. Применение соединений общей формулы (I) по пп.2, 3 или 4 в качестве лекарственных средств. 9. Применение соединений формулы (I) по п.1 в качестве лекарственных средств, предназначенных для гормонального заместительного лечения менопаузы или перименопаузы, в частности, для профилактики или лечения остеопороза, и не имеющих или почти не имеющих эстрогенной активности по отношению к матке, а также для защиты сердечно-сосудистой системы. 10. Применение соединений общей формулы (I) по п.1 в качестве лекарственных средств, предназначенных для гормонального заместительного лечения менопаузы или перименопаузы, в частности, для профилактики или лечения остеопороза у женщин с риском возникновения опухоли груди. 11. Фармацевтические композиции, содержащие соединение по п.1.
МПК / Метки
МПК: A61K 31/565, A61P 19/10, C07J 41/00
Метки: композиции, качестве, способ, средства, применение, положении, стероиды, лекарственного, содержащие, замещенные, получения, фармацевтические
Код ссылки
<a href="https://eas.patents.su/9-1868-steroidy-zameshhennye-v-polozhenii-11-sposob-ih-polucheniya-ih-primenenie-v-kachestve-lekarstvennogo-sredstva-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Стероиды, замещенные в положении 11, способ их получения, их применение в качестве лекарственного средства и содержащие их фармацевтические композиции</a>
Предыдущий патент: Способ защиты от нападения
Следующий патент: Трансформаторы с осевым воздушным охлаждением
Случайный патент: Способ передачи и приема информации













