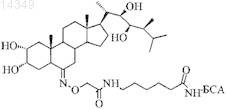
Способ количественного определения 24s-метилбрассиностероидов (брассинолида и кастастерона) и состав для его осуществления
Номер патента: 14534
Опубликовано: 30.12.2010
Авторы: Жабинский Владимир Николаевич, Прядко Андрей Георгиевич, Литвиновская Раиса Павловна, Хрипач Владимир Александрович, Новик Татьяна Валентиновна, Свиридов Олег Васильевич, Драч Светлана Васильевна
Формула / Реферат
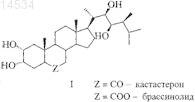
1. Способ количественного определения 24S-метилбрассиностероидов формулы I
отличающийся тем, что с целью повышения специфичности и чувствительности определение проводят с помощью иммуноферментного анализа путем смешивания анализируемых образцов 24S-метилбрассиностероидов с конъюгатом кастастерон-пероксидаза хрена в полимерных (например, полистирольных) лунках с иммобилизованными поликлональными антителами к кастастерону, инкубирования, разделения свободной и связанной антителами формы брассиностероидов, добавления к связанной форме хромоген-субстратной смеси для определения активности пероксидазы, по которой рассчитывают количество определяемого 24S-метилбрассиностероида.
2. Состав для количественного определения 24S-метилбрассиностероидов (брассинолида и кастастерона), включающий антитела к кастастерону, иммобилизованные на полимерных (в частности, полистирольных) лунках; конъюгат кастастерона с пероксидазой хрена; буферный раствор для разведения конъюгата; хромоген - субстратный буфер (раствор 3,3',5,5'-тетраметилбензидина в субстратном буфере с перекисью водорода); стоп-реагент - 4,8% раствор H2SO4.
Текст
(БРАССИНОЛИДА И КАСТАСТЕРОНА) И СОСТАВ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ Изобретение относится к области иммунохимического анализа, а именно к количественному определению фитогормонов, регуляторов роста растений, 24S-метилбрассиностероидов - кастастерона и брассинолида, и предназначено для определения указанных брассиностероидов в водных растворах, а также может быть использовано для количественной оценки в биологических объектах, определения остаточных количеств в почве, сточных водах и т.п. Задачей настоящего изобретения является способ количественного определения 24S-метилбрассиностероидов (кастастерона и брассинолида) и состав для его осуществления, которые отличаются специфичностью,высокой чувствительностью, экологической безопасностью, простотой, надежностью и технологичностью. Поставленная цель достигается, во-первых, предлагаемым способом, заключающимся в смешивании анализируемых образцов брассиностероида (или калибровочных проб) с конъюгатом кастастерон-пероксидаза хрена в полимерных (например, полистирольных) лунках с иммобилизованными на внутренней поверхности поликлональными антителами к кастастерону,последующей инкубации, разделении свободной и связанной антителами форм брассиностероидов, добавлении к связанной форме хромоген-субстратной смеси для определения активности пероксидазы, по которой рассчитывают количество определяемого 24S-метилбрассиностероида; во-вторых, составом для его осуществления, включающим антитела к кастастерону, иммобилизованные на полимерных лунках; конъюгат кастастерона с пероксидазой хрена; буферный раствор для разведения конъюгата; хромоген - субстратный буфер (раствор 3,3',5,5'тетраметилбензидина в субстратном буфере с перекисью водорода); стоп-реагент - 4,8% раствор Хрипач Владимир Александрович, Свиридов Олег Васильевич, Литвиновская Раиса Павловна, Прядко Андрей Георгиевич,Драч Светлана Васильевна, Новик Татьяна Валентиновна, Жабинский Владимир Николаевич (BY)(71)(73) Заявитель и патентовладелец: ГОСУДАРСТВЕННОЕ НАУЧНОЕ УЧРЕЖДЕНИЕ "ИНСТИТУТ БИООРГАНИЧЕСКОЙ ХИМИИ НАЦИОНАЛЬНОЙ АКАДЕМИИ НАУК БЕЛАРУСИ" (BY) 014534 Изобретение относится к области иммунохимического анализа, а именно количественному определению регуляторов роста растений, 24S-метилбрассиностероидов - кастастерона и брассинолида, и предназначено для определения указанных брассиностероидов в водных растворах, а также может быть использовано для количественной оценки их содержания в биологических объектах растительного происхождения, определения остаточных количеств в почве, сточных водах и т.п. Традиционным методом определения брассиностероидов является хроматография с массспектрометрической детекцией (ГЖХ-МС и ВЭЖХ-МС) [1-3]. Однако проведение анализа в данном случае требует сложной многоступенчатой процедуры выделения, очистки и химической модификации, что делает практически невозможным оперативный мониторинг брассиностероидов. Применение иммунохимического анализа для количественного определения брассиностероидов с использованием антител описано в ряде работ. Так, для радиоиммунного анализа были получены антитела к кастастерону, на базе которых удалось создать систему для анализа брассинолида и кастастерона [4],однако из-за сложности работы с радиоактивными изотопами и необходимости комбинирования с инструментальными методами разработка не получила развития. Кроме того, полученная система имела низкую специфичность: показатели перекрестных реакций с другими брассиностероидами составляли 2050%. Предпочтительным представляется иммуноферментный анализ, поскольку он не требует сложной измерительной аппаратуры и применения радиоактивных соединений (а поэтому безопасен), пригоден практически в любых условиях. Целью настоящего изобретения является способ количественного иммуноферментного определения кастастерона и брассинолида, повышающий специфичность и чувствительность определения и отличающийся экологической безопасностью, простотой, надежностью и технологичностью. Поставленная цель достигается предлагаемым способом, заключающимся в смешивании анализируемых образцов брассиностероида (или калибровочных проб) с конъюгатом кастастерон-пероксидаза хрена в полимерных (например, полистирольных) лунках с иммобилизованными на внутренней поверхности антителами к кастастерону, последующей инкубации, разделении свободной и связанной антителами форм брассиностероидов, добавлении к связанной форме хромоген-субстратной смеси для определения активности пероксидазы, по которой рассчитывают количество определяемого 24S-метилбрассиностероида. Заявляемый способ является экологически безопасным, простым, надежным и технологичным. Применение заявляемого способа обеспечивает быстрое и прямое (без многоступенчатых стадий выделения, подготовки образца и/или его модификации) определение кастастерона и брассинолида. Кроме того, способ отличается высокой надежностью и чувствительностью, достаточной для обнаружения кастастерона и брассинолида в концентрации 0,2-0,3 нмоль/л, которой другими методами добиться не удается. Сущность изобретения подтверждается примером конкретного выполнения. Пример 1. Проведение анализа. В полистирольные лунки планшета с иммобилизованными антителами к кастастерону вносят по 0,05 мл калибровочных проб или анализируемых образцов брассиностероидов в дубликатах. Вносят во все лунки по 0,1 мл фосфатно-буферного раствора конъюгата кастастерон-пероксидаза хрена в глицерине. Планшеты инкубируют в течение 2 ч при 37 С без встряхивания, затем удаляют жидкость из лунок и промывают их 3%-ным раствором NaCl, содержащим 0,02% Tween 20. Во все промытые лунки добавляют по 0,15 мл хромоген-субстратного буфера (раствор 3,3',5,5'-тетраметилбензидина в субстратном буфере с перекисью водорода) и инкубируют при 37 С в течение 15 мин. Останавливают реакцию добавлением во все лунки по 0,05 мл раствора стоп-реагента (4,8% раствор H2SO4). Измеряют на спектрофотометре оптическую плотность раствора во всех лунках при длине волны 450 нм. Рассчитывают величину В/В 0 100% для каждой калибровочной и исследуемой пробы, где В - среднее значение оптической плотности раствора в лунках, содержащих калибровочные и исследуемые образцы; В 0 -среднее значение оптической плотности в лунках, содержащих калибровочную пробу"0 нмоль/л". В координатах "logit-log" строят для калибровочных проб график зависимости В/В 0100% от концентрации кастастерона в калибровочных пробах (нмоль/л). По калибровочному графику определяют содержание брассиностероида в исследуемых образцах. Другой задачей изобретения является состав для осуществления заявляемого способа количественного определения 24S-метилбрассиностероидов. Известен аналог заявляемому составу - тест-система для определения 24R-метилбрассиностероидов- иммуноферментный метод определения 24-эпибрассинолида и 24-эпикастастерона [5]. Одним из наиболее примечательных свойств предложенной системы явилась ее высокая специфичность. При этом с высокой степенью чувствительности определяется 24-эпибрассинолид и его синтетический и биосинтетический предшественник - 24-эпикастастерон. Однако при концентрации брассиностероидов 10-6-10-9%(а именно в таких концентрациях эти вещества содержатся в растениях, проявляют свою активность) данная система практически не обнаруживает брассинолид и кастастерон. Только антитела, полученные-1 014534 к этим брассиностероидам, и иммуноферментная метка на их основе могут позволить получить высокоспецифическую и высокочувствительную систему для определения 24S-метилбрассиностероидов. Настоящее изобретение основано на использовании специфических антител к кастастерону и меченого антигена - кастастерона, меченного пероксидазой хрена. Заявляемая тест-система состоит из антител к кастастерону, иммобилизованных на полимерных носителях; конъюгата кастастерона с пероксидазой хрена; буферного раствора для разведения конъюгата; хромоген-субстратного буфера (раствор 3,3',5,5'-тетраметилбензидина в субстратном буфере с перекисью водорода); стоп-реагента - 4,8% раствор H2SO4. Возможность осуществления количественного определения брассинолида и кастастерона с помощью заявляемого состава по описанному выше способу подтверждается примерами конкретного исполнения. Пример 2. Получение и характеристики компонентов тест-системы. Стадия 1. Получение конъюгата кастастерон-БСА. Растворяют 8 мг (0,015 ммоль) 6-О-карбоксиметилоксима кастастерона в 1 мл безводного диоксана и добавляют 1.8 мг (0,016 ммоль) N-оксисукцинимида. Охлаждают до 5 С и при перемешивании добавляют раствор 2,63 мг (0.013 ммоль) дициклогексилкарбодиимида в 0,3 мл абсолютного диоксана. Реакционную смесь перемешивают 30 мин при 5 С и 15 ч при комнатной температуре. Выпавшую в осадок дициклогексилкарбомочевину отфильтровывают, фильтрат упаривают. Осадок растворяют в этилацетате, дополнительно образовавшийся осадок дициклогексилкарбомочевины отфильтровывают, фильтрат упаривают. Получают 9 мг (90%) N-сукцинимидного эфира. Без дополнительной очистки 9 мг (0.015 ммоль) N-сукцинимидного эфира 6-О-карбоксиметилоксима кастастерона растворяют в 1 мл безводного диоксана и добавляют 1.9 мг (0.017 ммоль)-аминокапроновой кислоты в 1 мл 0,1 М раствора гидрокарбоната натрия и перемешивают 2 ч при комнатной температуре. Затем реакционную смесь упаривают, остаток экстрагируют этилацетатом. Хроматографируют на силикагеле. Получают 7 мг (71%) гаптена (1). Т.пл. 155-158 С (метанол). ИК-спектр (вазелиновое масло), (см-1 ): 1710 (C=O), 2500-3000 (ОН), 3600 (ОН). 1 Н ЯМР (CD3OD): , м.д. 0.65 с (3H, 18-Ме), 0.88 с (3H, 19-Ме), 0,99 д (3H, 26 Me, J=6,6 Гц), 1,01 д(3H, 27-Ме, J=6,7 Гц), 1,06 д (3H, 24-Ме, J=6 Гц), 1,08 д (3H, 21-Ме, J=6,6 Гц), 2.68 дд (1H, С 5-Н,J1=2,5 Гц, J2=12,5 Гц), 3,42 м (2 Н, СН 2), 3,94 д (1H, С 22-Н, J=8,4 Гц), 4,08 м (2 Н, С 2- и С 23-Н), 4,46 м (1H,С 3-Н), 4,86 дд (2 Н, J1=3,4 Гц, J2=0,2 Гц). Растворяют 50 мг (0,08 ммоль) синтезированного гаптена и 12 мг (0,1 ммоль) N-оксисукцинимида в 5 мл безводного диоксана, охлаждают до 5 С и при перемешивании добавляют раствор 17,4 мг(0,084 ммоль) дициклогексилкарбодиимида в 3 мл безводного диоксана. Реакционную смесь перемешивают 30 мин при 5 С и 17 ч при комнатной температуре. Выпавшую в осадок дициклогексилкарбомочевину отфильтровывают, фильтрат упаривают. Остаток растворяют в этилацетате, промывают водой, сушат безводным Na2SO4, упаривают. Без дополнительной очистки растворяют 35 мг (0,055 ммоль)N-оксисукцинимидного эфира в 10 мл безводного диоксана и добавляют 52 мг (0,86 мкмоль) БСА в 10 мл смеси 9 мл дистиллированной воды и 1 мл насыщенного раствора гидрокарбоната натрия. Перемешивают реакционную смесь в течение 20 ч при комнатной температуре. Образовавшуюся массу подвергают диализу при 20 С против дистиллированной воды в течение 36 ч, затем против 1%-ной суспензии активированного угля в воде в течение 20 ч, лиофилизуют и замораживают при температуре -20 С. Содержание гаптена в конъюгате, определенное спектрофотометрически, составляет 24 моль гаптена на 1 моль белка. Стадия 2. Получение конъюгата кастастерон-пероксидаза хрена. К раствору 6 мг пероксидазы хрена в 600 мл дистиллированной воды в присутствии 2-3 капель 0,1 М раствора гидрокарбоната натрия (рН 8,35) добавляют раствор 2 мг (0,003 ммоль)N-сукцинимидного эфира 6-O-карбоксиметилоксима кастастерона, полученного, как в стадии 1,перемешивают при комнатной температуре в течение 1,5 ч. Очищают на колонке с сефадексом,элюент - дистиллированная вода. Собирают окрашенную желто-коричневую фракцию (10 мл), разбавляют глицерином (1:1) и хранят в морозильнике (при -18 С). Титр полученного конъюгата определяют как его рабочее разведение, обеспечивающее максимальную чувствительность тест-системы, которое позволяет построить калибровочный график в диапазоне 2,5-0,2 ОЕ. Типичным в проведенных экспериментах было рабочее разведение 1:150000-1:100000, т.е. специфическая активность конъюгата кастастерон-пероксидаза хрена при таком разведении (титре) позволяет проводить иммуноферментный анализ в диапазоне концентраций анализируемого вещества 0,2-100 нмоль/л.-2 014534 Стадия 3. Получение антисыворотки к кастастерону. Группу из десяти кроликов иммунизируют конъюгатом кастастерон-БСА с плотностью посадки 24 молекул стероида на 1 молекулу белка. Каждому кролику вводят подкожно в 10-15 точек спины по 1 мг конъюгата, предварительно растворенного в 0,5 мл фосфатно-буферного 0,1 М раствора поваренной соли (рН 7,4) и эмульгированного в равном объеме полного адъюванта Фрейнда. Интервалы между инъекциями составляют 3 недели. Иммунизацию продолжают в течение 6 месяцев, осуществляя периодический отбор проб крови из ушной вены животных. Полученные образцы сыворотки тестируют на наличие связывающей способности в отношении кастастерона и определяют их титры и значения констант ассоциации (Ka). Титр определяют как рабочее разведение антисыворотки, обеспечивающее максимальную чувствительность тест-системы при таком связывании конъюгата, которое позволяет построить калибровочный график в диапазоне 2,5-0,2 ОЕ. Таблица 1 Характеристики антисывороток, полученных при иммунизации животных конъюгатом кастастерона с БСА (I) Определение оптимального титра антисыворотки для применения в ИФА показало, что ее разбавление в 100 000(A1) или 10000(А 2) раз позволяет обеспечить приемлемые условия определения как кастастерона, так и брассинолида, проявивших, как и ожидалось, сравнимые параметры связывания с антителами. Специфичность. Перекрестная реакция антител к кастастерону с брассиностероидами и стероидами других классов приведена в табл. 2. Таблица 2 Кросс-реактивность антисыворотки A1 с различными стероидами,параметры связывания с антителами Из таблицы видно, что заявляемый состав позволяет определять брассинолид и кастастерон с высокой степенью специфичности.-3 014534 1. Коэффициент вариации результатов 10 определений 24S-метилбрассиностероидов в одном и том же образце с использованием заявляемого способа и состава для его осуществления не превышает 10%. 2. Тест на "линейность". Зависимость концентрации брассиностероидов в исследуемых образцах: при разведении их раствором, не содержащим кастастерона или брассинолида, имеет линейный характер. 3. Тест на "открытие". При постановке теста процент открытия составил 90-110%. 4. Чувствительность. Состав позволяет обнаружить кастастерон и брассинолид в концентрации 0,2-0,3 нмоль/л или 5-7 пг в 50 мкл образца. Важным является тот факт, что брассиностероиды широко распространены в природе, они свойственны всем или абсолютному большинству растительных видов - содержание в растении менее 10-5-10-9% [6]. Брассиностероиды регулируют рост и развитие растений. Обработка растений брассиностероидами на соответствующей стадии развития приводит к увеличению урожая и в ряде случаев - к улучшению его качества. Замечательно, что эффект достигается при обработке растений в концентрации 5-20 мг на гектар посевов, что намного меньше, чем в случае традиционно применяемых средств повышения урожайности растений. На основе одного из брассиностероидов - 24-эпибрассинолида создан препарат ЭПИН, применяемый как регулятор роста и средство повышения урожайности сельскохозяйственных культур [7]. Все это требует разработки эффективных и высокочувствительных методов определения брассиностероидов. Применение заявляемого способа и состава для его осуществления позволит проводить иммуноферментное определение одного из самых активных брассиностероидов - брассинолида и его химического и биохимического предшественника кастастерона в концентрациях 0,2-0,3 нмоль/л или 5-7 пг в 50 мкл образца. Литература 1. Takatsuto S. Brassinosteroids - distribution in plants, bioassays and microanalysis byAnalysis of Brassinosteroids.//Polish J. Chem. - 2006. - V. 80. - P. 651-654. 6. Хрипач В.А., Лахвич Ф.А., Жабинский В.Н. Брассиностероиды. - Минск: Навука i тэхнiка, 1993. 288 с. 7. Средства защиты и регуляторы роста растений./Справочник. - Минск, 1995. - С. 75. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ количественного определения 24S-метилбрассиностероидов формулы I отличающийся тем, что с целью повышения специфичности и чувствительности определение проводят с помощью иммуноферментного анализа путем смешивания анализируемых образцов 24S-метилбрассиностероидов с конъюгатом кастастерон-пероксидаза хрена в полимерных (например,полистирольных) лунках с иммобилизованными поликлональными антителами к кастастерону, инкубирования, разделения свободной и связанной антителами формы брассиностероидов, добавления к связанной форме хромоген-субстратной смеси для определения активности пероксидазы, по которой рассчитывают количество определяемого 24S-метилбрассиностероида. 2. Состав для количественного определения 24S-метилбрассиностероидов (брассинолида и кастастерона), включающий антитела к кастастерону, иммобилизованные на полимерных (в частности, полистирольных) лунках; конъюгат кастастерона с пероксидазой хрена; буферный раствор для разведения конъюгата; хромоген - субстратный буфер (раствор 3,3',5,5'-тетраметилбензидина в субстратном буфере с перекисью водорода); стоп-реагент - 4,8% раствор H2SO4. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: G01N 33/53
Метки: состав, количественного, брассинолида, кастастерона, определения, 24s-метилбрассиностероидов, способ, осуществления
Код ссылки
<a href="https://eas.patents.su/5-14534-sposob-kolichestvennogo-opredeleniya-24s-metilbrassinosteroidov-brassinolida-i-kastasterona-i-sostav-dlya-ego-osushhestvleniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ количественного определения 24s-метилбрассиностероидов (брассинолида и кастастерона) и состав для его осуществления</a>
Предыдущий патент: Способы обнаружения вирусов гриппа
Следующий патент: Способ подавления аппетита и снижения объема поглощения пищи
Случайный патент: Пресс для гидроформинга высокого давления