Способ получения эфиров 4,4-дифтор-3-оксобутановой кислоты
Номер патента: 11019
Опубликовано: 30.12.2008
Авторы: Тоблер Ханс, Вальтер Харальд, Эренфройнд Йозеф, Ламберт Клеменс, Корси Камилла
Формула / Реферат
1. Способ получения соединения формулы (I)
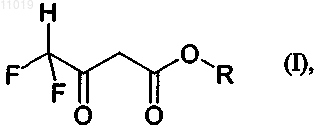
в которой R обозначает С1-С12алкил,
который включает взаимодействие соединения общей формулы (II)
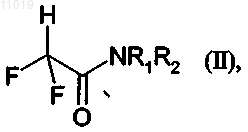
в которой R1 и R2 все независимо обозначают С1-С12алкил или R1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо,
с эфиром уксусной кислоты общей формулы (III)
![]()
в которой R является таким, как определено для формулы I,
в присутствии основания.
2. Способ по п.1, в котором R обозначает метил или этил.
3. Способ по п.1, в котором R1 и R2 оба обозначают метил или оба обозначают этил.
4. Способ по п.1, в котором R1 и R2 совместно с атомом азота, к которому они присоединены, образуют пирролидиновое или морфолиновое кольцо.
5. Способ по п.1, который осуществляют в растворителе, растворителем является избыток эфира уксусной кислоты (III) или другой растворитель или смесь обоих.
6. Способ по п.1, в котором другим растворителем является С1-С8спирт, ароматический или галогенированный ароматический растворитель или простой эфир.
7. Способ по п.1, в котором количество используемого эфира уксусной кислоты (III) составляет более 10 молярных эквивалентов соединения формулы (II).
8. Способ по п.1, в котором основанием является алкоксид щелочного металла.
9. Способ по п.1, в котором алкоксидом щелочного металла является метоксид натрия или этоксид натрия.
10. Способ по п.1, который осуществляют при температуре в диапазоне от 15 до 80шС.
Текст
011019 Настоящее изобретение относится к новому способу получения эфиров 4,4-дифторметил-3 оксобутановой кислоты. Эти эфиры применимы для получения эфиров 3-дифторметил-4 пиразолкарбоновой кислоты, которые являются важными промежуточными продуктами синтеза пиразолкарбоксанилидных фунгицидов. Различные пиразолкарбоксанилидные фунгициды и их получение описаны, например, в US 5498624 и в WO 01/42223. Для получения многих из этих фунгицидов необходимы эфиры 3-дифторметил-1 метил-4-пиразолкарбоновой кислоты. В US 5498624 этиловый эфир этой карбоновой кислоты получен по реакции метилгидразина с этил-2-(этоксиметилен)-4,4-дифторметилацетоацетатом в метаноле. Последнее соединение получают по методике, описанной в публикации JACS, 73, 3684 (1951), которая включает конденсацию этилортоформиата и уксусного ангидрида с этилдифторацетоацетатом. Синтез метил- и этилдифторацетоацетатов, также называемых метиловым и этиловым эфирами 4,4 дифтор-3-оксобутановой кислоты, по реакции соответствующих фторированных эфиров с эфирами уксусной кислоты в щелочной среде давно известен и описан, например, в публикациях JACS, 69, 1819(1947) и JACS, 75, 3152 (1953). Если использовать более слабое основание, такое как этилат натрия, то выход этой реакции неприемлем для крупномасштабного промышленного производства. Например, при использовании этилата натрия выход составляет лишь 35%, как это описано в публикации JACS, 69, 1819(1947). Из литературы известно, что выходы реакций такого типа можно увеличить путем использования более сильного основания, такого как гидрид натрия, см., например, публикацию JACS, 75, 3152 (1953), в которой сообщают, что при использовании гидрида натрия в качестве основания выход можно повысить вплоть до 75-85%. Однако в промышленном производстве применение гидрида натрия нежелательно,поскольку его крупномасштабное использование опасно и связано с образованием больших количеств взрывчатого водорода. Альтернативный путь синтеза описан в ЕР-А-694526. В этом случае метил- и этилполифторацетоацетаты получают по реакции хлорангидрида или ангидрида полифторкарбоновой кислоты с хлорангидридом карбоновой кислоты в присутствии в качестве основания третичного амина, такого как пиридин. Реакция завершается после прибавления спирта, такого как метанол или этанол. Этот путь синтеза можно с удобством использовать для получения трифторацетоацетатов со средними выходами, составляющими 52%, но он неудовлетворителен для получения дифторацетоацетатов. Хлорангидриды или ангидриды дифторуксусной кислоты при этих условиях недостаточно стабильны. Например, в ЕР-А-694526 описан синтез метил-2-дифторацетилбутаноата по реакции ангидрида дифторуксусной кислоты с бутирилхлоридом. Выход этой реакции составляет лишь 25% от теоретического. Такие низкие выходы неприменимы для промышленного получения химических соединений. Поэтому задачей настоящего изобретения является разработка нового общего способа получения эфиров 4,4-дифтор-3-оксобутановой кислоты, посредством которого можно было бы получить такие соединения с высокими выходами и при хорошем качестве по простой методике реакции и при низких затратах и который был бы лишен указанных выше недостатков, присущих известным способам. Таким образом, настоящее изобретение относится к способу получения соединения формулы (I) в которой R обозначает C1-C12 алкил,который включает взаимодействие соединения общей формулы (II) в которой R1 и R2 все независимо обозначают C1-C12 алкил или R1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо; с эфиром уксусной кислоты общей формулы (III) в которой R обладает указанным выше значением,в присутствии основания.R обозначает разветвленную или неразветвленную алкильную группу, содержащую от 1 до 12 атомов углерода, и обозначает, например, метил, этил, н-пропил, н-бутил, изопропил, втор-бутил, изобутил,трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил или н-додецил. Обычно он обозначает метил или этил.R1 и R2 обозначают разветвленные или неразветвленные алкильные группы, содержащие от 1 до 12 атомов углерода, и обозначают, например, метил, этил, н-пропил, н-бутил, изопропил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил или н-додецил. Они могут быть одинаковыми или разными. Обычно они оба обозначают метил или оба обозначают этил.-1 011019 Альтернативно, R1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо. Примерами таких алициклических кольцевых аминов являются пирролидин и пиперидин. Если R1 иR2 совместно с атомом азота, к которому они присоединены, образуют кольцо, то обычно кольцо представляет собой пирролидиновое или морфолиновое кольцо.R предпочтительно обозначает C1-C6 алкил, более предпочтительно метил или этил. В предпочтительном варианте осуществления R1 и R2 все независимо обозначают C1-C8 алкил; илиR1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо. В другом предпочтительном варианте осуществления R1 и R2 все независимо обозначают C1C8 алкил, предпочтительно оба обозначают метил или оба обозначают этил. В еще одном предпочтительном варианте осуществления R1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо. В особенно предпочтительном варианте осуществления R1 и R2 совместно с атомом азота, к которому они присоединены, образуют пирролидиновое или морфолиновое кольцо. Этот способ удобно осуществлять в растворителе, которым может являться избыток эфира уксусной кислоты (III), или другой растворитель, или смесь обоих. Если содержится смесь обоих растворителей, то эфир уксусной кислоты выступает в качестве сорастворителя. Подходящие "другие" растворители включают C1-C8 спирты, ароматические или галогенированные ароматические растворители, такие как толуол, ксилол и хлорбензол, и простые эфиры, такие как тетрагидрофуран, диоксан и третбутилметиловый эфир. Если в качестве растворителя или сорастворителя используется эфир уксусной кислоты (III), то он применяется в большом избытке, обычно в количестве, превышающем 10 молярных эквивалентов (предпочтительно 10-30 молярных эквивалентов) соединения формулы (II). В способе, предлагаемом в настоящем изобретении, можно использовать любое подходящее основание, но обычно им является алкоксид, обычно алкоксид щелочного металла, такой как С 1-С 4 алкоксид щелочного металла. Примерами являются метоксид натрия, этоксид натрия и трет-бутоксид натрия. Предпочтительно, если основанием является метоксид натрия или этоксид натрия. Для оптимизации выхода продукта (I) количество используемого основания составляет от 1 до 4 молярных эквивалентов соединения формулы (II). Способ обычно осуществляют при температуре в диапазоне от 15 до 80 С, например от 45 до 80 С и обычно от 50 до 70 С. Таким образом, если используется этанольный раствор алкоксида с этилацетатом в качестве сорастворителя, то способ можно осуществлять при любой температуре от температуры окружающей среды до температуры кипения смеси растворителей. Длительность осуществления способа, в частности, зависит от масштаба синтеза и температуры,при которой его проводят. Например, он может потребовать от получаса до 24 ч. Обычно проводимый в лабораторных условиях синтез менее моля вещества может продолжаться от 1 до 6 ч. Способ обычно осуществляют путем растворения соединение формулы (II) в эфире уксусной кислоты формулы (III), необязательно в присутствии другого растворителя. Затем при температуре окружающей среды или при повышенных температурах при перемешивании прибавляют раствор основания в спирте или другом растворителе. После этого смесь нагревают при температуре от 50 до 70 С до завершения реакции. После охлаждения смесь выливают в подкисленную смесь воды со льдом и экстрагируют подходящим растворителем, таким как диэтиловый эфир или этилацетат. Затем продукт можно извлечь из органического экстракта путем промывки рассолом, выпаривания растворителя и при необходимости очистки оставшегося продукта путем перегонки при пониженном давлении. Настоящее изобретение также включает варианты осуществления, в которых получают смеси эфиров 4,4-дифторметил-3-оксобутановой кислоты. Например, применение этилацетата в качестве эфира и метоксида натрия в качестве основания дает смесь этилового эфира 4,4-дифторметил-3-оксобутановой кислоты и метилового эфира 4,4-дифторметил-3-оксобутановой кислоты. Соединения общей формулы (II) в которой R1 и R2 все независимо обозначают C1-C12 алкил или R1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо; можно получить по методике, описанной в JP-A-06228043. Она включает фторирование амида N,N-дизамещенной дихлоруксусной кислоты, причем амид N,N-дизамещенной дихлоруксусной кислоты получают по реакции дихлорацетилхлорида со вторичным амином. Методика описана на приведенной ниже схеме. Эфиры уксусной кислоты общей формулы (III) в которой R обозначает C1-C12 алкил, известны и имеются в продаже. Приведенные ниже неограничивающие примеры более подробно иллюстрируют настоящее изобретение. Пример 1. Получение 2,2-дихлор-N,N-диметилацетамида. В колбе для сульфирования раствор, содержащий дихлорацетилхлорид (110 г; 0,75 моль) и толуол(100 мл), в течение 1 ч медленно прибавляли к раствору диметиламина (68 г; 1,5 моль) и толуола (1,2 л) сначала при 0 С, а затем температуру реакционной смеси постоянно поддерживали ниже 10 С. Реакционную смесь перемешивали в течение еще 30 мин при 0-5 С и затем ее постепенно разбавляли толуолом(1 л). Органическую фазу промывали последовательно водой (1500 мл), хлористо-водородной кислотой(5% раствор; 2500 мл), водой (1500 мл), насыщенным раствором бикарбоната натрия (2500 мл) и в заключение рассолом (1500 мл) и затем сушили над сульфатом натрия. Выпаривание давало остаток,который перегоняли в высоком вакууме и получали 2,2-дихлор-N,N-диметилацетамид в виде бесцветного масла. Выход 78,6 г (67,2%); т. кип. (температура кипения) 65-67 С при 0,3 мбар. Пример 2. Получение 2,2-дифтор-N,N-диметилацетамида. В колбе для сульфирования смесь 2,2-дихлор-N,N-диметилацетамида (23,4 г; 0,15 моль), высушенного распылением фторида калия (26,1 г; 0,45 моль) и диэтиленгликоля (150 мл), нагревали при 183 С и 160 мбар в перегонном аппарате, снабженном колонкой VIGREUX (10 см). При этих условиях искомый продукт отгонялся в виде бесцветного масла за 1 ч. Выход 12,3 г (66,7%); т. кип. 105-108 С при 160 мбар. Пример 3. Получение этилового эфира 4,4-дифтор-3-оксобутановой кислоты. В колбе для сульфирования N,N-диэтил-2,2-дифторацетамид (1,51 г; 10 ммоль) растворяли в этилацетате (20 мл), а затем по каплям прибавляли этанольный раствор этоксида натрия (15 мл 21% раствора; 40,2 ммоль). Полученную смесь перемешивали при 60 С в течение 6 ч. После охлаждения смесь выливали в лед с водой (20 мл), подкисляли хлористо-водородной кислотой (10%) и экстрагировали этилацетатом. Органическую фазу промывали рассолом, сушили над сульфатом натрия и выпаривали в вакууме,создаваемом водоструйным насосом. Остаток очищали путем перегонки при пониженном давлении и получали искомый этиловый эфир 4,4-дифтор-3-оксобутановой кислоты в виде бесцветного масла. Выход 1,09 г (66%); т. кип. 50-53 С при 18 мбар. Пример 4. Альтернативное получение этилового эфира 4,4-дифтор-3-оксобутановой кислоты. В колбе для сульфирования этанольный раствор этоксида натрия (79 мл 21% раствора; 0,243 моль) по каплям прибавляли к раствору 2,2-дифтор-N,N-диметилацетамида (27,2 г; 0,22 моль) в этилацетате(460 мл). Реакционную смесь кипятили с обратным холодильником в течение 1 ч и за расходованием исходного вещества следили с помощью ГХ (газовая хроматография). Затем реакционную смесь выливали в лед с водой (800 мл), подкисляли хлористо-водородной кислотой (10%) и затем дважды экстрагировали этилацетатом (2200 мл). После разделения органический слой промывали рассолом (200 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении (40 С при 100 мбар). Этиловый эфир 4,4-дифтор-3-оксобутановой кислоты получали в виде темного масла (34,8 г; 72%),в качестве примеси содержащего немного этанола; с помощью ГХ показано, что чистота продукта составляет примерно 75%. Пример 5. Получение смеси этилового эфира 4,4-дифтор-3-оксобутановой кислоты и метилового эфира 4,4 дифтор-3-оксобутановой кислоты. В колбе для сульфирования метанольный раствор метоксида натрия (165,7 г 30% раствора; 0,92 моль) по каплям прибавляли к раствору 2,2-дифтор-N,N-диметилацетамида (98,5 г; 0,8 моль) в этилацетате (1570 мл) при 60 С. Реакционную смесь кипятили с обратным холодильником в течение 3 ч и за расходованием исходного вещества следили с помощью ГХ. Затем реакционную смесь выливали в смесь холодной хлористо-водородной кислоты со льдом с водой (3%, 1100 мл) и после этого дважды экстрагировали этилацетатом (640 мл). Объединенные органические слои концентрировали при пониженном дав-3 011019 лении (40 С при 150 мбар). Смесь этилового эфира 4,4-дифтор-3-оксобутановой кислоты и метилового эфира 4,4-дифтор-3 оксобутановой кислоты получали в виде темного масла, содержащего 81% этилового эфира и 19% метилового эфира (121,8 г; 90% - суммарный выход обоих эфиров), в качестве примеси содержащего немного этилацетата. В контексте настоящего изобретения соединения формулы (I) можно получить с хорошими выходами и при небольшом объеме работ. Особым преимуществом способа, предлагаемого в настоящем изобретении, является то, что исходные соединения формулы (II) легко получить и их легко использовать. Еще одним особым преимуществом способа, предлагаемого в настоящем изобретении, является то,что исходные соединения формулы (III) имеются в продаже, являются недорогими и их легко использовать. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) в которой R обозначает С 1-С 12 алкил,который включает взаимодействие соединения общей формулы (II) в которой R1 и R2 все независимо обозначают С 1-С 12 алкил или R1 и R2 совместно с атомом азота, к которому они присоединены, образуют алициклический кольцевой амин, содержащий от 4 до 7 атомов углерода, или морфолиновое кольцо,с эфиром уксусной кислоты общей формулы (III) в которой R является таким, как определено для формулы I,в присутствии основания. 2. Способ по п.1, в котором R обозначает метил или этил. 3. Способ по п.1, в котором R1 и R2 оба обозначают метил или оба обозначают этил. 4. Способ по п.1, в котором R1 и R2 совместно с атомом азота, к которому они присоединены, образуют пирролидиновое или морфолиновое кольцо. 5. Способ по п.1, который осуществляют в растворителе, растворителем является избыток эфира уксусной кислоты (III) или другой растворитель или смесь обоих. 6. Способ по п.1, в котором другим растворителем является С 1-С 8 спирт, ароматический или галогенированный ароматический растворитель или простой эфир. 7. Способ по п.1, в котором количество используемого эфира уксусной кислоты (III) составляет более 10 молярных эквивалентов соединения формулы (II). 8. Способ по п.1, в котором основанием является алкоксид щелочного металла. 9. Способ по п.1, в котором алкоксидом щелочного металла является метоксид натрия или этоксид натрия. 10. Способ по п.1, который осуществляют при температуре в диапазоне от 15 до 80 С.
МПК / Метки
МПК: C07C 69/716, C07C 67/343
Метки: получения, кислоты, 4,4-дифтор-3-оксобутановой, способ, эфиров
Код ссылки
<a href="https://eas.patents.su/5-11019-sposob-polucheniya-efirov-44-diftor-3-oksobutanovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения эфиров 4,4-дифтор-3-оксобутановой кислоты</a>
Предыдущий патент: Синергическая гербицидная смесь
Следующий патент: Антисептическое лекарственное средство
Случайный патент: Способ переработки семян рапса









