Ингибиторы белка-регулятора трансмембранной проводимости при муковисцидозе и их применение
Формула / Реферат
1. Способ лечения субъекта, у которого наблюдается состояние, опосредованное белком-регулятором трансмембранной проводимости при муковисцидозе (CFTR), поддающееся лечению путем ингибирования ионного транспорта, опосредованного CFTR, при этом способ включает введение субъекту терапевтически эффективного количества соединения формулы (Ib)
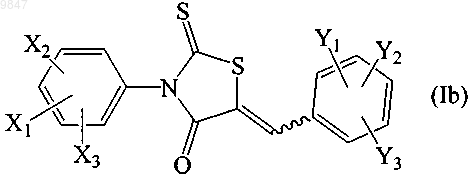
где X1 представляет собой трифторметил; Х2 и Х3 независимо выбирают из водорода и атома галогена; Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8алкильной группы, Cl-С7алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой соли в виде индивидуального стереоизомера или их смеси.
2. Способ по п.1, где состояние представляет собой увеличенную сверх нормы секрецию в кишечнике.
3. Способ по п.2, где состояние представляет собой секреторную диарею.
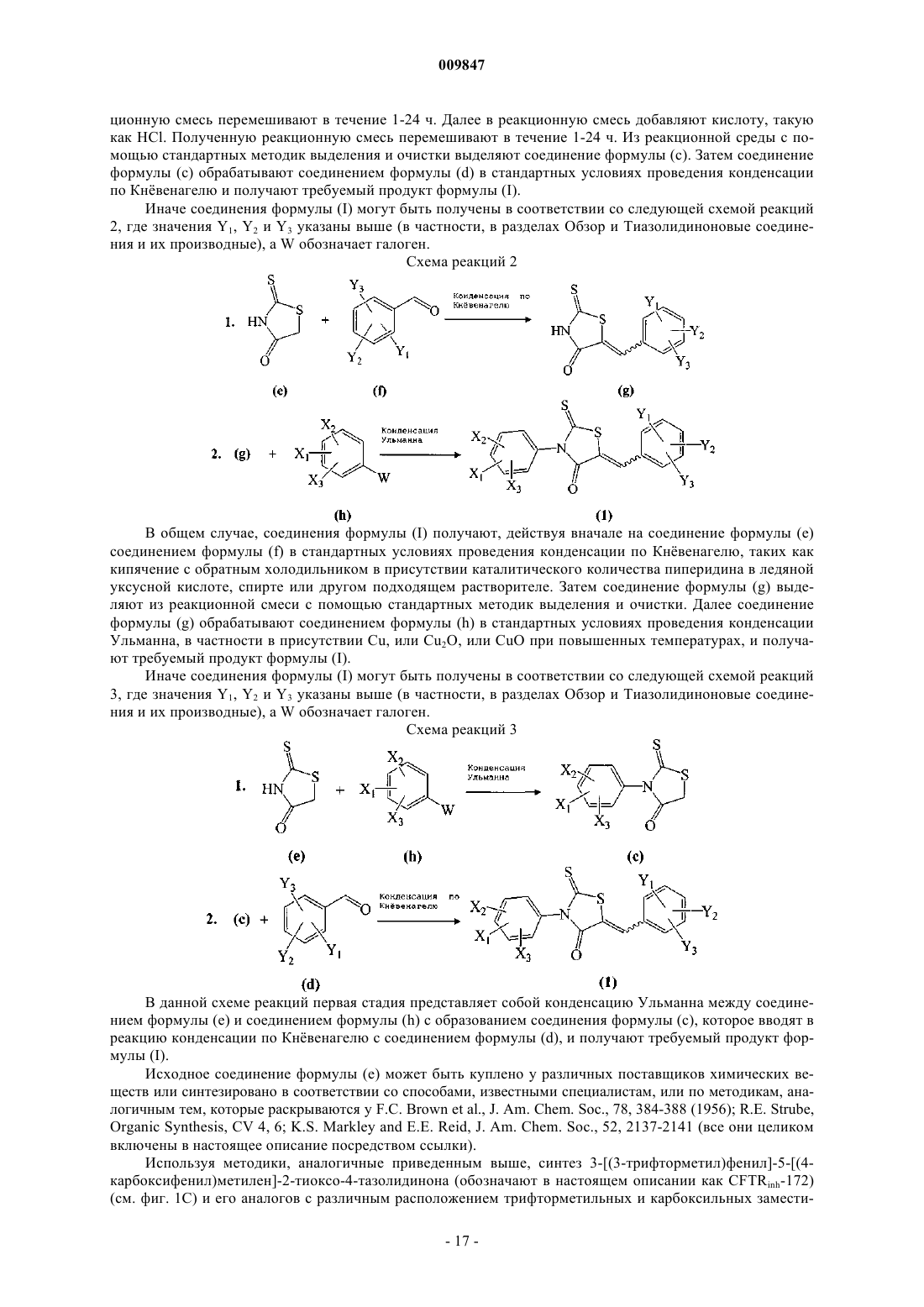
4. Способ по п.1, где соединение формулы (Ib) представляет собой 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинон.
5. Способ по п.1, где X1 расположен во 2, 3 или 4 положении фенильной группы, к которой он присоединен.
6. Способ по п.1, где Y2 выбирают из гидроксильной, карбоксильной группы, нитрогруппы, карбонатной группы и галогена.
7. Способ по п.5, где трифторметильная группа расположена в 3 положении.
8. Способ по п.1, где Y2 является гидроксильной группой.
9. Способ по п.8, где Y1 является гидроксильной группой.
10. Способ по п.8, где Y1 является атомом брома.
11. Способ по п.8, где Y3 является нитрогруппой.
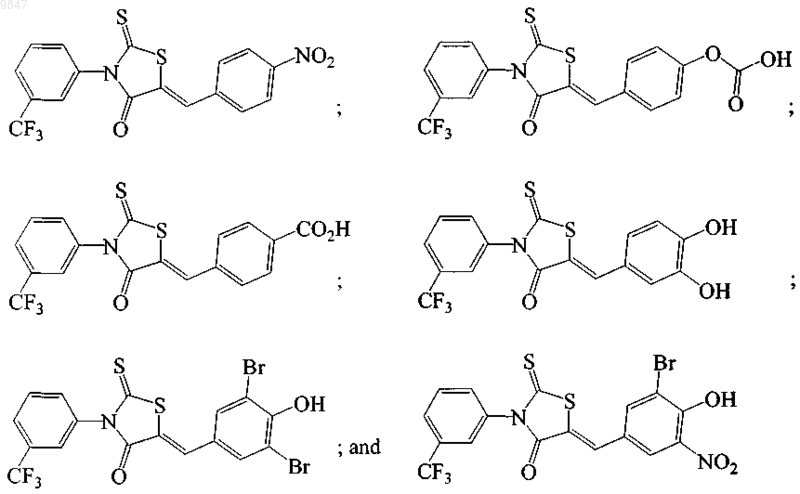
12. Способ по п.1, где соединение формулы (Ib) выбирают из

13. Способ ингибирования в клетке субъекта активности белка-регулятора трансмембранной проводимости при муковисцидозе, который включает контактирование клетки с соединением формулы (Ib)
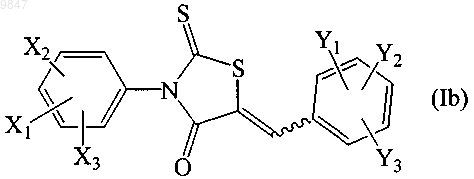
где X1 представляет собой трифторметил; Х2 и Х3 независимо выбирают из водорода и атома галогена; Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8алкильной группы, С1-С7алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой солью в виде индивидуального стереоизомера или их смеси; в количестве, достаточном для ингибирования CFTR ионного транспорта в клетке.
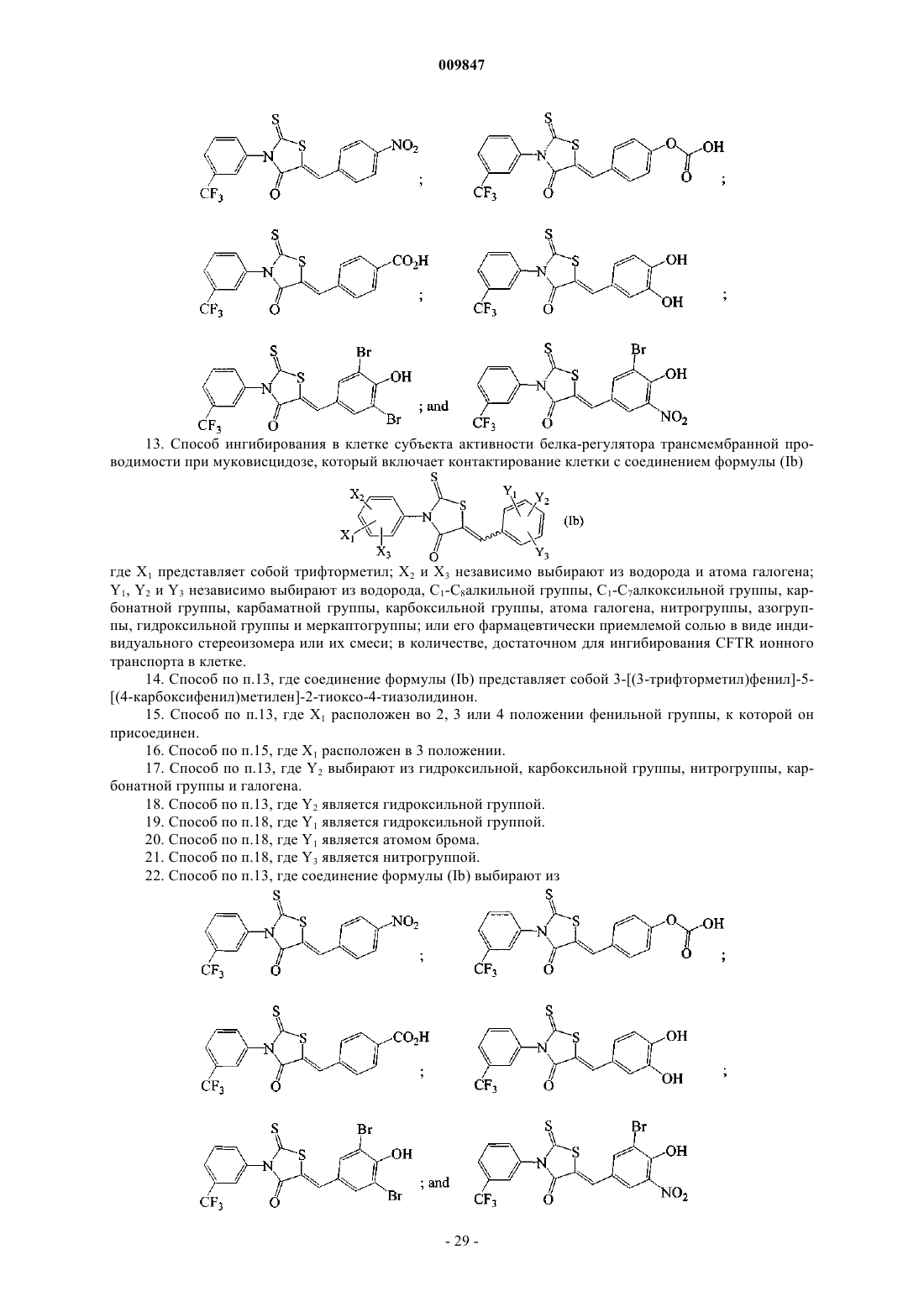
14. Способ по п.13, где соединение формулы (Ib) представляет собой 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинон.
15. Способ по п.13, где X1 расположен во 2, 3 или 4 положении фенильной группы, к которой он присоединен.
16. Способ по п.15, где X1 расположен в 3 положении.
17. Способ по п.13, где Y2 выбирают из гидроксильной, карбоксильной группы, нитрогруппы, карбонатной группы и галогена.
18. Способ по п.13, где Y2 является гидроксильной группой.
19. Способ по п.18, где Y1 является гидроксильной группой.
20. Способ по п.18, где Y1 является атомом брома.
21. Способ по п.18, где Y3 является нитрогруппой.
22. Способ по п.13, где соединение формулы (Ib) выбирают из
23. Способ по п.13, где контактирование клетки включает прием внутрь соединения формулы (Ib) субъектом.
24. Способ по п.23, где прием внутрь включает также прием внутрь фармацевтически приемлемого носителя вместе с соединением формулы (Ib).
25. Способ ингибирования в клетке субъекта активности белка-регулятора трансмембранной проводимости при муковисцидозе при проведении in vivo анализа, который включает контактирование клетки с соединением формулы (Ib)
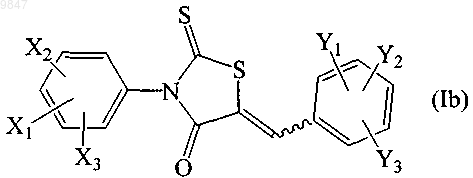
где X1 представляет собой трифторметил, Х2 и Х3 независимо выбирают из водорода и атома галогена; Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8алкильной группы, С1-С7алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой солью в виде индивидуального стереоизомера или их смеси; в количестве, достаточном для ингибирования CFTR ионного транспорта в клетке.
26. Способ индуцирования фенотипа муковисцидоза (CF) у животного, отличного от человека, при этом способ включает введение животному, отличному от человека, соединения формулы (Ib)
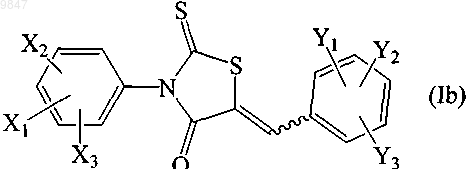
где X1 представляет собой трифторметил, Х2 и Х3 независимо выбирают из водорода и атома галогена; Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8алкильной группы, Cl-С7алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой соли в виде индивидуального стереоизомера или их смеси; в количестве, достаточном для индуцирования фенотипа муковисцидоза (CF) у животного, отличного от человека.
27. Способ лечения субъекта, у которого наблюдается состояние, характеризующееся повышенным сверх меры транспортом ионов под влиянием белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), при этом способ включает введение субъекту эффективного количества тиазолидинонового соединения 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинона; при этом CFTR ионный транспорт ингибируется, а состояние вылечивается.
28. Фармацевтическая композиция для лечения состояния, характеризующегося повышенным сверх меры транспортом ионов под влиянием белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), содержащая тиазолидиноновое соединение, независимо выбранное из
3-[(3-трифторметил)фенил]-5-[(4-нитрофенил)метилен]-2-тиоксо-4-тиазолидинона;
3-[(3-трифторметил)фенил]-5-[(4-оксикарбоксифенил)метилен]-2-тиоксо-4-тиазолидинона;
3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинона;
3-[(3-трифторметил)фенил]-5-[(3,4-дигидроксифенил)метилен]-2-тиоксо-4-тиазолидинона;
3-[(3-трифторметил)фенил]-5-[(3,5-дибром-4-гидроксифенил)метилен]-2-тиоксо-4-тиазолидинона и
3-[(3-трифторметил)фенил]-5-[(3-бром-4-гидрокси-5-нитрофенил)метилен]-2-тиоксо-4-тиазолидинона;
и по крайней мере один фармацевтически приемлемый носитель, фармацевтически приемлемый разбавитель и фармацевтически приемлемый наполнитель, где опосредованный CFTR ионный транспорт ингибируется.
29. Композиция по п.25, где композиция не содержит обнаруживаемые количества диметилсульфоксида.
30. Фармацевтическая композиция для лечения состояния, опосредованного белком-регулятором трансмембранной проводимости при муковисцидозе (CFTR), содержащая соединение формулы (Ib)
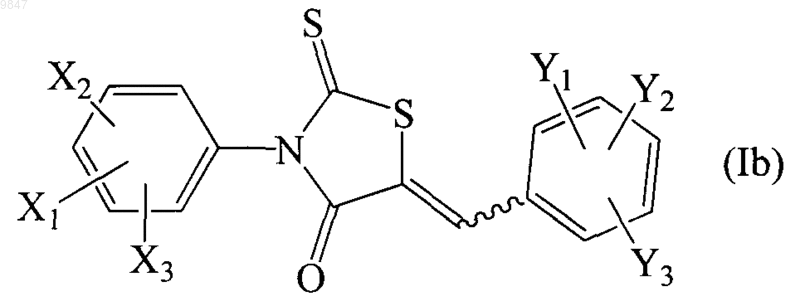
где X1 представляет собой трифторметил, Х2 и Х3 независимо выбирают из водорода и атома галогена; Y1, Y1 и Y3 независимо выбирают из водорода, C1-C8алкильной группы, С1-С7алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной групяы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемую соль в виде индивидуального стереоизомера или их смеси и по крайней мере один фармацевтически приемлемый носитель, фармацевтически приемлемый разбавитель и фармацевтически приемлемый наполнитель.
31. Композиция по п.30, где X1 расположен во 2, 3 или 4 положении фенильной группы, к которой он присоединен.
32. Композиция по п.30, где Y2 выбирают из гидроксильной, карбоксильной группы, нитрогруппы, карбонатной группы и галогена.
33. Композиция по п.30, где X1 расположен в 3 положении.
34. Композиция по п.30, где Y2 является гидроксильной группой.
35. Композиция по п.34, где Y1 является гидроксильной группой.
36. Композиция по п.34, где Y1 является атомом брома.
37. Композиция по п.36, где Y3 является нитрогруппой.
38. Композиция по п.30, где соединение является 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)
метилен]-2-тиоксо-4-тиазолидиноном.
39. Композиция по п.30, где композиция не содержит обнаруживаемые количества диметилсульфоксида.
Текст
009847 Уровень техники Белок-регулятор трансмембранной проводимости при муковисцидозе (CFTR) представляет собой активируемый циклическим аденозинмонофосфатом (сАМР, цАМФ) хлоридный (Cl-) канал, который экспрессируется в клетках эпителия воздушных путей, кишечника, поджелудочной железы и яичках млекопитающих. CFTR представляет собой хлоридный канал, который отвечает за опосредованную циклическим аденозинмонофосфатом секрецию ионов Cl-. Гормоны, такие как -адренергический агонист,или токсин, такой как холерный энтеротоксин, приводят к повышению уровня цАМФ, активации цАМФзависимой протеинкиназы и фосфорилированию Clканала CFTR, что приводит к открытию канала. Увеличение концентрации ионов Са 2+ в клетке также может активировать различные каналы апикальной мембраны. Фосфорилирование под действием протеинкиназы С также может раскрывать или закрыватьClканалы в апикальной мембране. CFTR преимущественно располагается в эпителиях, где он обеспечивает образование проводящих путей для движения ионов Cl- через апикальную мембрану, и является ключевым фактором регулирования скорости трансэпителиального транспорта соли и воды. Функционирование хлоридного канала CFTR связано с широким спектром заболеваний, включая муковисцидоз(CF), и с некоторыми формами мужского бесплодия, поликистозом почек болезни и секреторной диареи. Наследственная летальная болезнь муковисцидоз (CF) вызывается мутациями в CFTR. Изучение муковисцидоза (CF) у пациентов-мужчин и на мышиных моделях CF показывает функциональную значимость CFTR для транспорта жидкости в кишечнике и поджелудочной железе, а также для мужской плодовитости (Grubb et al., 1999, Physiol. Rev. 79: S193-S214; Wong, P.Y., 1997, Mol. Hum. Reprod. 4: 107110). Тем не менее, остается невыясненным механизм, посредством которого дефектный CFTR вызывает заболевание дыхательных путей, что является главной причиной заболеваемости и смертности при CF(Pilewski et al., 1999, Physiol. Rev. 79: S215-S255). Основные трудности в понимании причин заболеваний дыхательных путей при CF заключаются в неадекватности мышиных моделей CF, в которых болезни дыхательных путей развиваются незначительно либо совсем не возникают, в отсутствии моделей CF крупных животных и в ограниченной доступности CF дыхательных путей человека, которые не были повреждены хронической инфекцией или воспалением. Не были доступны обладающие высоким сродством CFTR-селективные ингибиторы для изучения механизмов заболеваний дыхательных путей при CF или для создания фенотипа CF в моделях крупных животных. Обладающие высоким сродством ингибиторы CFTR находят также клиническое применение в терапии секреторной диареи и поликистоза почек, а также для угнетения плодовитости у мужчин. Такие соединения, как дифениламин-2-карбоксилат (DPC) и 5-нитро-2-(3-фенилпропиламино)бензоат (NPPB),ингибируют CFTR при высоких концентрациях, однако, их ингибирующее действие не является специфичным (Cabantchik et al., 1992, Am. J. Physiol. 262: C803-C827; McDonough et al., 1994, Neuron 13: 623-634;Schultz et al., 1999, Physiol. Rev. 79: S109-S144). Глибенкламид, который является лучшим ингибиторомCFTR, доступным для проведения электрофизиологических и других исследований, основанных на изучении клетки, применяют в концентрациях 100 мкМ (Sheppard et al., 1992, J. Gen. Physiol. 100: 573-591;Hongre et al., 1994, Pflugers Arch. 426: 284-287). Однако при таких концентрациях глибенкламид ингибирует действие и других переносчиков ионов Cl-, а также K+-каналы (Edwards et al., 1993, Br. J. Pharmacol. 110: 1280-1281; Rabe et al., 1995, Pflugers Arch. 429: 659-662; Yamazaki et al., 1997, Circ. Res. 81: 101-109). Известны эффективные ингибиторы других белков ионного транспорта, которые имеют малые размеры молекул, однако, не известны молекулы с малыми размерами, которые обладают специфической ингибирующей активностью по отношению к CFTR и пригодны для терапии секреторных заболеваний. Таким образом, существует потребность в соединениях-ингибиторах CFTR и способах применения таких соединений с целью развития животных моделей, пригодных для изучения и лечения CF, а также для лечения и контролирования секреторных расстройств. Целью настоящего изобретения является удовлетворение указанных и других потребностей, а также преодоление дефицитов в данной области техники. Сущность изобретения Настоящее изобретение относится к фармацевтическим композициям и способам ингибирования белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), которые пригодны для изучения и лечения CFTR-опосредованных болезней или состояний. Фармацевтические композиции по настоящему изобретению могут содержать одно или несколько тиазолидиноновых соединений или их производных и дополнительно могут содержать один или несколько фармацевтически приемлемых носителей, наполнителей и/или вспомогательных лекарственных средств. В некоторых вариантах осуществления изобретения способы по настоящему изобретению включают введение пациенту, страдающему отCFTR-опосредованных болезней или состояний, эффективного количества тиазолидинонового соединения или его производного. Другие варианты осуществления изобретения отеносятся к способам ингибирования CFTR, которые включают контактирование клеток субъекта с эффективным количеством тиазолидинонового соединения или его производного. Кроме того, в настоящем изобретении описывается модель CFTR-опосредованного заболевания у животного, отличного от человека, при этом указанную модель получают введением тиазолидинонового соединения или его производного животному, отличному от человека, в количестве, достаточном для ингибирования CFTR.-1 009847 Эти и другие объекты и преимущества настоящего изобретения станут понятны из приведенного ниже подробного описания изобретения. Краткое описание фигур Настоящее изобретение станет более понятным после ссылки на следующие фигуры, которые приведены лишь в иллюстративных целях. На фиг. 1 А схематично представлены методики отбора, которые используют для определения ингибиторов CFTR. CFTR в максимальной степени стимулируется многими агонистами в устойчиво трансфицированных клетках эпителия, совместно экспрессирующих CFTR человека и желтый флуоресцентный белок (YFP), флуоресценция которого чувствительна к ионам Cl-/I-. После добавления тестируемого соединения приток ионов I- индуцируют добавлением Iсодержащих растворов. Фиг. 1 В является графическим представлением типичных данных флуоресценции в отдельных лунках, которые получают с помощью методики отбора, приведенной на фиг. 1 А, и он показывает данные для контролей (без активатора, без тестируемого соединения), для неактивных соединений и для активных соединений, ингибирующих CFTR. На фиг. 1C показана химическая структура ингибиторов CFTR, идентифицированных с помощью методики отбора, приведенной на фиг. 1 А. На фиг. 1D показаны химические структуры кольца 2 тиазолидинонового производного, обладающего наибольшей ингибирующей активностью по отношению к CFTR. Полная структура тиазолидинонового производного приведена на фиг. 1 С. Относительные эффективности составляют 0,2 (CFTRinh020), 0,3 (CFTRinh-029), 1,0 (CFTRinh-172), 0,2 (CFTRinh-185), 0,1 (CFTRinh-214) и 0,1 (CFTRinh-236). Фиг. 2 А является графическим представлением зависимости относительной величины флуоресценции от времени при использовании методики отбора, приведенной на фиг. 1 А, для ингибитора CFTR 3[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинонаCFTRinh-172) при нескольких концентрациях. Фиг. 2 В является графическим представлением величины ингибирования с течением времени, на котором приведены CFTR-опосредованные скорости переноса ионов I- в различные интервалы времени после добавления 2 мкМ CFTRinh-172. На вставке графически представлена обратная величина ингибирования с течением времени, которая показывает скорости переноса ионов I- в различные интервалы времени после вымывания 1 мкМ CFTRinh-172; приведенная величина представляет собой среднее значение стандартная ошибка среднего значения, полученное из серии трех экспериментов. На фиг. 2 С графически представлено ингибирование CFTR после стимулирования действием различных агонистов, включая бензофлавоновые и бензимидазолоновые UCCF соединения (UCCF-029 (бисульфат 2-(4-пиридиний)бензо[h]-4 Н-хромен-4-она) и UCCF-853 (Galietta et al. 2001, J. Biol. Chem. 276: 19723-19728, генистеин, СРТ-cAMP, 8-метоксипсорален (8-МРО), 8-циклопентил-1,3-дипропилксантин(СРХ) (все по 50 мкМ) (стандартная ошибка среднего значения, полученная из серии трех экспериментов). Закрашенные прямоугольники показывают агонист, а незакрашенные прямоугольники показывают агонист вместе с 5 мкМ CFTRinh-172. На фиг. 3 А графически представлено ингибирование тока короткого замыкания под действиемCFTRinh-172 в пермеабилизованных клетках FRT, экспрессирующих CFTR человека. CFTR стимулируют действием 100 мкМ СРТ-сАМР. На фиг. 3 В приведены суммарные графики величины ингибирования в зависимости от дозы дляCFTRinh-172 (кружки) и глибенкламида (квадраты) (SE, стандартная ошибка среднего значения получена из серии трех экспериментов). Фиг. 3 С графически иллюстрирует ингибирование тока короткого замыкания под действиемCFTRinh-172 в первичной культуре (непермеабилизованных) бронхиальных эпителиальных клеток человека. Ингибитор добавляют в апикальный промывочный раствор (левая группа данных) или сначала в базолатеральный, а затем в апикальный раствор (правая группа данных). На фиг. 3D графически представлена величина потенциала на всей клеточной мембране клетокFRT, экспрессирующих CFTR; показаны токи на мембране, полученные при +80 мВ (незакрашенные кружки) и минус 100 мВ (закрашенные кружки). CFTR стимулируют действием 5 мкМ форсколина с последующим добавлением 2 мкМ CFTRinh-172. На фиг. 3 Е графически показано, что альтернативное стимулирование прерывают (а-с), чтобы приложить градиент потенциала. На фиг. 3F графически представлены зависимости тока от напряжения в базальных условиях (контроль, незакрашенные кружки), после стимуляции форсколином (закрашенные кружки) и после добавления 0,2 мкМ CFTRinh-172, обеспечивающего 50%-ное ингибирование (незакрашенные треугольники). На фиг. 4 А графически представлена стимулированная действием UTP (100 мкМ) Са 2+-зависимая секреция ионов Cl-, которую определяют при измерении тока короткого замыкания в эпителиальных клетках дыхательных путей в отсутствие CFTFinh-172 и в присутствии 5 мкМ CFTRinh-172. На фиг. 4 В графически представлен активированный в объеме ток ионов Cl- (гипотонический 250 мОсм/кг Н 2 О), измеренный в экспериментах по определению величины потенциала на всей клеточной мембране-2 009847 клеток FRT. Токи регистрируют в отсутствие CFTRinh-172 и в присутствии 5 мкМ CFTRinh-172. На фиг. 4 С графически представлено накопление 3 Н-винкристина в клетках 9HTEo-/DX с возрастающей экспрессией MDR-1. Внутриклеточное содержание винкристина определяют в отсутствие и в присутствии верапамила (100 мкМ) или CFTRinh-172 (5 мкМ) (SE, n=3). На фиг. 4D представлен график, на котором приведен зарегистрированный типичный мембранный потенциал -клеток поджелудочной железы (INS-1), орошаемых внеклеточно растворами CFTRinh-172,диазоксида (100 мкМ) и глибенкламида (10 мкМ). На фиг. 4 Е графически представлены средние изменения в мембранном потенциале (мВ), вызванные процедурами, указанными на фиг. 4D (SE, n=4). На фиг. 5 А приведена фотография изолированных петель подвздошной кишки мыши через 6 ч после инъекции в полость кишки 1 мкг холерного энтеротоксина без внутрибрюшинной инъекции CFTRinh172 (верхний снимок) или с внутрибрюшинной инъекцией (средний снимок) CFTRinh-172 (150 мкг/кг). Для сравнения показан контрольный образец с физиологическим раствором (без холерного энтеротоксина, нижний снимок). Фиг. 5 В графически показывает вес петли подвздошной кишки через 6 ч как среднее значениестандартная ошибка среднего значения (n=6-8 мышей) для 14-16 изученных петель. Для неактивного аналога 4-карбоксифенильная группа в CFTRinh-172 замещена 3-метокси-4-метоксивинилфенильной группой (SE,6-8 мышей в одной группе, р 0,001, ANOVA). Фиг. 5 С графически поясняет полный вес тонкой кишки через 6 ч после перорального введения через зонд до удаления внутриполостной жидкости в сравнении с состоянием после удаления внутриполостной жидкости (SE, 4 мыши в одной группе, р 0,001). Фиг. 5D графически поясняет ингибирование под действием CFTRinh-172 тока короткого замыкания после добавления амилорида и стимулирования форсколином (20 мкМ) в слизистой оболочке изолированной толстой кишки. CFTRinh-172 наносят, как указано (n=4) на поверхности серозной оболочки, а затем слизистой оболочки. На фиг. 6 схематически представлен синтез 14 С-меченного CFTRinh-172. Метку 14 С вводят в ядро тиазолидинона, используя в качестве исходного соединения 14 С-меченную бромуксусную кислоту. На фиг. 7 приведены фотографии, на которых показаны результаты фармакокинетического изучения CFTRinh-172 у крыс после однократного внутривенного вливания болюса 50 мкКи 14 С-меченногоCFTRinh-172. Данные представлены в виде среднего значениястандартная ошибка среднего значения(n=3-6 крыс) для радиоактивности сыворотки. Выравнивающая кривая соответствует 2-камерной модели с периодом полураспределения 0,14 ч, периодом полуудаления 10,3 ч, максимальной концентрацией в сыворотке 3,2 мкг/мл, площадью под кривой 3,8 мкгч/мл, объемом распределения 1,2 л и коэффициентом очищения 99 мл/ч. На фиг. 8 приведена серия фотографий, на которых показано распределение 14 С-меченного CFTRinh172 после вливания болюса. Результаты в группе данных А получены для мышей, которым проводили однократное вливание болюса 2 мкКи 14 С-меченного CFTRinh-172, умерщвленных в указанные периоды времени, и для органов, выделенных для измерения 14 С-радиоактивности, при этом данные представлены как общая 14 С-радиоактивность органа в указанные периоды времени (за исключением скелетных мышц,результаты для которых приведены на 1 г ткани) после вливания (среднее значениестандартная ошибка среднего значения, 4 мыши для каждой точки). Результаты в группе данных В получены для крыс, которым проводили вливание болюса 50 мкКи 14 С-меченного CFTRinh-172, и для количества CFTRinh-172 во всем органе, измеренного через 60 мин после вливания (3 крысы). На фиг. 9 приведена серия фотографий, на которых показаны результаты изучения метаболизмаCFTRinh-172 методом тонкослойной хроматографии жидкостей и гомогената печени мышей, которым проводили вливание 14 С-меченного CFTRinh-172, как показано в группе данных А на фиг. 8. Стандартные величины 14C-CFTRinh-172 составляют 1, 3 и 6 нКи (группа данных слева) и 10, 30 и 60 нКи (группа данных справа). Пленки подвергают ауторадиографии в течение 48 ч (группа данных слева) и 12 ч (группа данных справа). На фиг. 10 приведена серия фотографий, на которых представлены результаты изучения модели закрытой кишечной петли мыши. Результаты группы данных А: в кишечные петли вводят инъекции 200 мкл буферного раствора и измеряют вес петли в указанные промежутки времени (среднее значениестандартная ошибка среднего значения, 4 мыши для каждой временной точки). Вставка (нижняя): % поглощения через 30 мин без CFTRinh-172 и вместе с CFTRinh-172 (20 мкг внутрибрюшинно, n=4). Вставка(верхняя): химическая структура CFTRinh-172. Результаты группы данных В: индуцированная холерным энтеротоксином секреция жидкости с течением времени в мышиной модели закрытой петли. Пунктирной линией показаны контрольные петли (с инъекцией физиологического раствора). Данные для петель с инъекцией (1 мкг холерного энтеротоксина на 1 петлю) представлены в виде среднего значениястандартная ошибка среднего значения (4-6 мышей). На фиг. 11 приведена серия графиков, на которых показано ингибирование под действием CFTRinh172 секреции внутрикишечной жидкости после введения мыши холерного энтеротоксина. Группа дан-3 009847 ных А: ответная реакция в зависимости от дозы для ингибирования накопления жидкости в мышиной модели петли. Мышам вводят разовую дозу CFTRinh-172 путем внутрибрюшинной инъекции и измеряют вес петли (среднее значениестандартная ошибка среднего значения, 4-6 мышей на 1 дозу) через 6 ч. Пунктирная линия показывает средний вес в контрольных петлях тех же мышей, в которые вводили инъекции физиологического раствора. Группа данных В: устойчивость ингибирования под действиемCFTRinh-172. Мышам вводят инъекции 20 мкг CFTRinh-172 (внутрибрюшинно) в указанные интервалы времени до или после введения холерного энтеротоксина (4-6 мышей на каждую временную точку). Группа данных С: величина радиоактивности 14C-CFTRinh-172 с течением времени после внутривенной инъекции (хвостовая вена, левая ордината) и перорального ведения (CFTRinh-172 в TPGS, правая ордината). Данные представлены в виде количества подсчетов в минуту на 1 мкКи в инъекции (4 мыши). Группа данных D: накопление 14C-CFTRinh-172 в желудочно-кишечных органах через 6 ч после внутривенного и перорального введения 14 С-CFTRinh-172 (4 мыши). Группа данных Е: ингибирование индуцированной холерным энтеротоксином секреции жидкости путем перорального введения CFTRinh-172 (200 мкг вTPGS) в мышиной модели открытой петли. Данные представлены в виде полного веса тонкой кишки через 6 ч после перорального введения через зонд до удаления внутриполостной жидкости по отношению к состоянию после удаления внутриполостной жидкости (среднее значениестандартная ошибка среднего значения, 4 мыши в одной группе, р 0,001). Группа данных F: проницаемость CFTRinh-172 сквозь монослои Сасо-2 (среднее значениестандартная ошибка среднего значения, 18 вставок) с Рарр=1610-6 см/с. На фиг. 12 приведена серия графиков, на которых показано ингибирование под действием CFTRinh172 индуцированной холерным энтеротоксином (группа данных А) и токсином STa (группа данных В) секреции жидкости в крысиной модели закрытой петли. Данные представлены в виде среднего значениястандартная ошибка среднего значения (4 крысы на группу), р 0,01. На фиг. 13 приведена серия графиков, на которых показано ингибирование под действием CFTRinh172 индуцированного форсколином и токсином STa тока короткого замыкания в подвздошной кишке мыши (группа данных А) и толстой кишке человека (группа данных В). Данные для токсина STa приведены на вставке. Данные представляют собой результаты исследования 5 мышей и 2 наборов тканей человека. CFTRinh-172 добавляют на обе стороны ткани. В апикальных растворах присутствует амилорид(10 мкМ). На фиг. 14 приведена серия графиков, на которых представлено исследование тока короткого замыкания при ингибировании по действием CFTRinh-172 секреции ионов Cl- в Т 84 клетках эпителия толстой кишки. Группа данных А: данные приведены в виде зарегистрированных кривых из экспериментов с 512 вставками на одно состояние. CFTRinh-172 добавляют на обе стороны клеточных слоев. Агонисты(слева) ингибирование под действием CFTRinh-172 стимулированного форсколином тока короткого замыкания после базолатеральной пермеабилизации с помощью амфотерицина В (250 мкг/мл). Типичные данные экспериментов приведены на 6 вставках. (Посредине) средняя зависимость ответной реакции от дозы для ингибирования под действием CFTRinh-172 стимулированного форсколином (кружки) и стимулированного 8-Br-cGMP (треугольники) тока короткого замыкания для пермеабилизованных клеток Т 84 в сравнении с непермеабилизованными клетками Т 84 (среднее значениестандартная ошибка среднего значения, 6-12 вставок). (Справа) ингибирование под действием CFTPinh-172 стимулированного форсколином тока короткого замыкания в присутствии высоких концентраций ионов K+ (68 мМ) в базолатеральном растворе с низким содержанием ионов Cl- в апикальном растворе. Представлены типичные данные из 4 экспериментов. Прежде, чем будет приведено описание изобретения, следует подчеркнуть, что настоящее изобретение не ограничивается представленными конкретными вариантами его осуществления, которые, конечно, могут иметь вариации. Следует также понимать, что применяемая терминология используется лишь с целью описания конкретных вариантов осуществления изобретения и ее не следует рассматривать как ограничивающую настоящее изобретение, поскольку объем притязаний по настоящему изобретению ограничивается лишь прилагаемой ниже формулой изобретения. Если не указано иное, все технические и научные термины, которые используются в настоящем описании, имеют то же значение, что и обычно понимаемое специалистами в той области техники, к которой относится настоящее изобретение. Далее описываются способы и материалы, предпочтительные для осуществления настоящего изобретения, хотя при осуществлении или проверке настоящего изобретения могут применяться любые способы и любые материалы, аналогичные или эквивалентные приведенным в настоящем описании. Все упомянутые публикации включены в настоящее описание путем ссылки с целью раскрыть или описать способы и/или материалы, в связи с которыми цитируются указанные публикации. Следует отметить, что приведенные в описании и формуле изобретения единственные формы включают множество значений, если из контекста не следует иное. Так, например, ссылка на термин"ингибитор" включает множество подобных ингибиторов, а ссылка на термин "клетка" включает ссылку-4 009847 на одну или несколько клеток и их эквивалентов, известных специалистам в данной области техники, и т.д. Обсуждаемые в настоящем описании публикации опубликованы до даты подачи настоящей заявки,и они включены в данное описание посредством ссылки. Ничто в настоящем описании не следует рассматривать как признание того, что настоящее изобретение имеет приоритет, более поздний, чем указанная публикация. Более того, приведенные даты публикаций могут отличаться от действительных дат опубликования и может потребоваться их независимое подтверждение. Используемые в настоящем описании определения приведены лишь с целью более ясного изложения, и их не следует рассматривать как ограничивающие настоящее изобретение. Все технические и научные термины, которые используются в настоящем описании, имеют то же значение, что и обычно понимаемое специалистами в той области техники, к которой относится настоящее изобретение. Подробное описание изобретения Изобретение основывается на том открытии, что тиазолидиноновые соединения или их производные представляют собой обладающие высоким сродством ингибиторы CFTR. Ниже более подробно описываются структура указанных соединений и их производных по настоящему изобретению, а также фармацевтические составы и способы их применения. Определения"Состояние или симптом, опосредованный белком-регулятором трансмембранной проводимости при муковисцидозе" или "CFTR-опосредованное состояние или симптом" означает любое состояние,нарушение или заболевание или симптом подобного состояния, нарушения или заболевания, которое является результатом активности белка-регулятора трансмембранной проводимости при муковисцидозе(CFTR), в частности активности CFTR в транспорте ионов. Указанные состояния, нарушения или заболевания или их симптомы можно лечить путем ингибирования активности CFTR, в частности путем ингибирования активности CFTR в транспорте ионов. Активность CFTR проявляется, например, при кишечной секреции в ответ на действие различных агонистов, в том числе холерного энтеротоксина (см. Snyderet al. 1982 Bull. World Health Organ. 60: 605-613; Chao et al. 1994 EMBO J. 13: 1065-1072; Kimberg et al. 1971 J. Clin. Invest. 50: 1218-1230). Термин "ингибитор CFTR" по тексту настоящего описания означает соединение, которое уменьшает эффективность транспорта ионов под действием CFTR, в частности транспорта хлоридных ионов под действием CFTR. Предпочтительными ингибиторами CFTR по настоящему изобретению являются специфические ингибиторы CFTR, т.е. соединения, которые ингибируют активность CFTR без существенного или вредного воздействия на активность других переносчиков ионов, в частности других переносчиков хлоридов, переносчиков калия и т.п. Ингибиторы CFTR предпочтительно представляют собой обладающие высоким сродством ингибиторы CFTR, в частности ингибиторы, сродство которых по отношению к CFTR составляет по крайней мере приблизительно 1 мкмоль, обычно приблизительно от 1 до 5 мкмоль. Термин "лечение" по тексту настоящего описания охватывает лечение заболевания, состояния, нарушения или его симптома у субъекта, где заболевание, состояние, нарушение или симптом опосредуются активностью CFTR, и включает: (1) профилактику заболевания, состояния или нарушения, т.е. воздействие, приводящее к тому, что у субъекта, который подвергается воздействию заболевания, состояния или нарушения или же который предрасположен к воздействию заболевания, состояния или нарушения,но еще не ощущает или не обнаруживает его симптомы, не развиваются клинические симптомы заболевания, (2) подавление заболевания, состояния или нарушения, т.е. остановку или замедление развития заболевания, состояния или нарушения или его клинических симптомов; или (3) ослабление заболевания,состояния или нарушения, т.е. воздействие, которое приводит к регрессу заболевания, состояния или нарушения или его клинических симптомов."Терапевтически эффективное количество" или "эффективное количество" означает количество соединения по настоящему изобретению, которое при введении млекопитающему или другому нуждающемуся в этом субъекту является, как указано выше, достаточным для проведения лечения заболеваний,состояний, расстройств или симптомов, опосредованных активностью CFTR. Количество соединения по настоящему изобретению, которое составляет "терапевтически эффективное количество", будет варьировать в зависимости от соединения, заболевания и его тяжести, а также от возраста, веса и т.п. субъекта,лечение которого проводят, однако, оно может быть определено обычными способами специалистом в данной области техники с учетом его знаний и сведений, приведенных в настоящем описании. Термины "субъект" и "пациент" означают представителя или представителей любого вида млекопитающих или вида, не относящегося к млекопитающим, которые могут нуждаться в фармацевтических методах, композициях и приведенных в настоящем описании способах лечения. Субъекты и пациенты,таким образом, включают, без их ограничения, представителей семейства приматов (включая человека),псовых, кошачьих, копытных (в частности, лошадей, коров, свиней (например, домашнюю свинью,птиц и другие субъекты. Особый интерес представляют люди и другие животные, отличные от человека,которые имеют коммерческое значение (в частности, домашний скот и домашние животные)."Млекопитающее" означает представителя или представителей любого вида млекопитающих и включает, например, представителей семейства псовых, кошачьих, лошадей, коров, овец, грызунов и т.д. и приматов, в частности людей. Отличные от человека животные модели, в частности модели млекопи-5 009847 тающих, например семейства приматов, мышиных, зайцеобразные и т.д., могут использоваться для проведения экспериментальных исследований. Термин "разовая дозированная форма" по тексту настоящего описания относится к физически дискретным единицам, применимым в качестве разовых дозировок для человека и животных субъектов, при этом каждая единица содержит определенное количество соединения по настоящему изобретению, которое рассчитывают таким образом, чтобы оно было достаточным для получения желаемого эффекта, в сочетании с фармацевтически приемлемым разбавителем, носителем или наполнителем. Требования к новым разовым дозированным формам по настоящему изобретению зависят от применяемого конкретного соединения и от эффекта, который должен быть достигнут, а также от фармакодинамики, связанной с поведением каждого соединения применительно к реципиенту. Следует понимать, что термин "физиологические условия" охватывает такие условия, которые совместимы с живыми клетками, в частности они преимущественно представляют собой водную среду с температурой, величиной рН, содержанием соли и т.д., которые совместимы с живыми клетками."Фармацевтически приемлемый наполнитель" означает наполнитель, пригодный для приготовления фармацевтической композиции, который в общем случае является безопасным, нетоксичным и не является ни биологически, ни каким-либо иным образом нежелательным, и включает наполнитель, который приемлем для использования в ветеринарии, а также пригодный для фармацевтического использования для человека. "Фармацевтически приемлемый наполнитель" по тексту настоящего описания и формулы изобретения включает как один, так и несколько подобных наполнителей. По тексту настоящего описания термин "фармацевтически приемлемое производное" соединения по настоящему изобретению включает их соли, сложные эфиры, простые енольные эфиры, сложные енольные эфиры, ацетали, кетали, ортоэфиры, гемиацетали, гемикетали, кислоты, основания, сольваты,гидраты или пролекарства. Указанные производные могут быть легко приготовлены специалистами в данной области техники с помощью известных методов получения указанных производных. Полученные соединения могут вводиться животным или людям, не оказывая при этом токсического воздействия, и являются либо фармацевтически активными, либо представляют собой пролекарства."Фармацевтически приемлемая соль" соединения по настоящему изобретению означает соль, которая является фармацевтически приемлемой и которая обладает требуемой фармакологической активностью исходного соединения. Подобные соли включают: (1) кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота,серная кислота, азотная кислота, фосфорная кислота и т.п.; или соли, образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2,2,2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 4,4'-метилен-бис-(3-гидрокси-2-ен-1 карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глютамовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, получаемые в том случае, когда кислый протон, имеющийся в исходном соединении, либо замещен ионом металла, в частности ионом щелочного металла, ионом щелочно-земельного металла или ионом алюминия, либо координируется с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин,N-метилглюкамин и т.п."Фармацевтически приемлемый сложный эфир" соединения по настоящему изобретению означает сложный эфир, который является фармацевтически приемлемым, обладает требуемой фармакологической активностью исходного соединения и включает, без их ограничения, алкиловые, алкениловые, алкиниловые, ариловые, гетероариловые, аралкиловые, гетероаралкиловые, циклоалкиловые и гетероциклиловые сложные эфиры с кислотными группами, в том числе, без их ограничения, кислотными группами карбоновых кислот, фосфорных кислот, фосфиновых кислот, сульфоновых кислот, сульфиновых кислот и бороновых кислот."Фармацевтически приемлемый простой енольный эфир" соединения по настоящему изобретению означает простой енольный эфир, который является фармацевтически приемлемым, обладает требуемой фармакологической активностью исходного соединения и включает, без их ограничения, производные формулы C=C(OR), где R означает водород, алкильную, алкенильную, алкинильную, арильную, гетероарильную, аралкильную, гетероаралкильную, циклоалкильную или гетероциклильную группу."Фармацевтически приемлемый сложный енольный эфир" соединения по настоящему изобретению означает сложный енольный эфир, который является фармацевтически приемлемым, обладает требуемой фармакологической активностью исходного соединения и включает, без их ограничения, производные формулы C=C(OC(O)R), где R означает водород, алкильную, алкенильную, алкинильную, арильную, ге-6 009847 тероарильную, аралкильную, гетероаралкильную, циклоалкильную или гетероциклильную группу."Фармацевтически приемлемый сольват или гидрат" соединения по настоящему изобретению означает сольватный или гидратный комплекс, который является фармацевтически приемлемым, обладает требуемой фармакологической активностью исходного соединения и включает, без их ограничения,комплексы соединения по настоящему изобретению с 1 или несколькими молекулами растворителя или молекулами воды, или от 1 до приблизительно 100, или от 1 до приблизительно 10, или от 1 до приблизительно 2, 3 или 4 молекул растворителя или молекул воды."Пролекарство" означает любое соединение, которое высвобождает in vivo активное материнское соединение формулы (I), когда указанное пролекарство вводят млекопитающему субъекту. Пролекарства соединений формулы (I) содержат функциональные группы, которые в стандартных физиологических условиях гидролизуются в соответствующие карбоксильные группы, гидроксильные группы, аминогруппы и сульфгидрильные группы. Примеры подобных функциональных групп включают, без их ограничения, сложные эфиры (в частности, ацетатные, формиатные и бензоатные производные) и карбаматы(в частности, N,N-диметиламинокарбонил), образованные гидроксильными группами в соединениях формулы (I), и т.п. Дополнительные примеры включают дипептидные или трипептидные сложные эфиры, образованные гидроксильными или карбоксильными группами в соединениях формулы (I), и т.п. Получение подобных функциональных групп хорошо известно из области техники. Например, на соединение формулы (I), которое содержит гидроксильную группу (в частности, когда X1, X2, X3, Y1, Y2 или Y3 обозначает гидроксильную группу), можно подействовать карбоновой кислотой или дипептидом, имеющим свободную концевую карбоксильную группу, в условиях проведения реакции этерификации, хорошо известных из области техники, и получить требуемую сложноэфирную функциональную группу. Аналогично на соединение формулы (I), содержащее свободную карбоксильную группу, можно подействовать спиртом или трипептидом, содержащим гидроксильную группу, таким как остаток серина (в частности, -N(Н)-С(Н)(СН 2 ОН)-С(О)-), в условиях проведения реакции этерификации, хорошо известных из области техники, и получить требуемую сложноэфирную функциональную группу. Кроме того, на соединение формулы (I), содержащее сложноэфирную группу карбоновой кислоты, можно подействовать другим эфиром карбоновой кислоты в стандартных условиях проведения реакции переэтерификации и получить соединение формулы (I), содержащее требуемую сложноэфирную функциональную группу. Все указанные функциональные группы входят в объем настоящего изобретения. Термин "органическая группа" или "органический радикал" по тексту настоящего описания обозначает любую углеродсодержащую группу, включая углеводородные группы, которые классифицируют как алифатические группы, циклические группы, ароматические группы, их функциональные производные и/или их различные комбинации. Термин "алифатическая группа" означает насыщенную или ненасыщенную линейную или разветвленную углеводородную группу и охватывает, например, алкильные,алкенильные и алкинильные группы. Термин "алкильная группа" означает замещенную или незамещенную, линейную или разветвленную углеводородную группу или цепь (в частности, от C1 до С 8) и включает, например, метильную, этильную, изопропильную, трет-бутильную, гептильную, н-октильную, додецильную, октадецильную, амильную, 2-этилгексильную группу и т.п. Подходящие заместители включают карбоксильную группу, защищенную карбоксильную группу, аминогруппу, защищенную аминогруппу, атом галогена, гидроксильную группу, защищенную гидроксильную группу, меркаптогруппу,низшую алкилтиогруппу, нитрогруппу, цианогруппу, монозамещенную аминогруппу, защищенную монозамещенную аминогруппу, дизамещенную аминогруппу, C1-C7 алкоксильную группу, C1-C7 ацильную группу, C1-C7 ацилоксигруппу и т.п. Термин "замещенный алкил" означает указанную алкильную группу,содержащую в качестве заместителей от 1 до 3 гидроксильных групп, защищенных гидроксильных групп, аминогрупп, защищенных аминогрупп, цианогрупп, атомов галогена, трифторметильных групп,монозамещенных аминогрупп, дизамещенных аминогрупп, низших алкоксильных групп, меркаптогрупп,низших алктилтиогрупп, карбоксильных групп, защищенных карбоксильных групп или же соль карбоксильной группы, аминогруппы и/или гидроксильной группы. Как и при использовании вместе с заместителями для гетероарильных колец, термины "замещенный (циклоалкил) алкил" и "замещенный циклоалкил", как указано ниже, замещены теми же самыми группами, что и группы, перечисленные для "замещенной алкильной" группы. Термин "алкенильная группа" означает ненасыщенную линейную или разветвленную углеводородную группу с одной или несколькими двойными углерод-углеродными связями,такую как винильная группа. Термин "алкинильная группа" означает ненасыщенную линейную или разветвленную углеводородную группу с одной или несколькими тройными углерод-углеродными связями. Термин "циклическая группа" означает замкнутую кольцевую углеводородную группу, которую классифицируют как алициклическую группу, ароматическую группу или гетероциклическую группу. Термин"алициклическая группа" означает циклическую углеводородную группу, свойства которой напоминают свойства алифатической группы. Термин "ароматическая группа" или "арильная группа" означает моноили полициклическую ароматическую углеводородную группу и может включать 1 или несколько гетероатомов, и он подробнее рассмотрен ниже. Термин "гетероциклическая группа" означает замкнутый циклический углеводород, в котором 1 или несколько атомов в кольце представляют собой элемент, отличный от углерода (в частности, азот, кислород, серу и т.п.), и он подробнее рассмотрен ниже."Органическая группа" может быть функционализована или же каким-либо иным образом может содержать дополнительные функциональные группы, соединенные с органической группой, такие как карбоксильная группа, аминогруппа, гидроксильная группа и т.п., которые могут быть защищены или не защищены. Например, предполагается, что словосочетание "алкильная группа" включает не только в чистом виде насыщенные углеводородные алкильные заместители с открытой цепью, такие как метил,этил, пропил, трет-бутил и т.д., но и алкильные заместители, которые содержат дополнительные заместители, известные из области техники, такие как гидроксильная группа, алкоксильная группа, меркаптогруппа, алкилтиогруппа, алкилсульфонильная группа, галоген, цианогруппа, нитрогруппа, аминогруппа,карбоксильная группа и т.д. Таким образом, "алкильная группа" включает сложные эфиры, простые эфиры, галогеналкилы, нитроалкилы, карбоксиалкилы, гидроксиалкилы, сульфоалкилы и т.п. Термины "галогеновая группа" или "галоген" используются по тексту настоящего описания как эквивалентные и относятся к фтору, хлору, брому или иоду. Предпочтительными галогенами являются хлор и фтор. Термин "галогеналкил" относится к алкильной группе, определение которой приведено выше, замещенной 1 или несколькими атомами галогена. Атомы галогена могут совпадать или же отличаться друг от друга. Термин "дигалогеналкил" относится к алкильной группе, определение которой приведено выше, замещенной 2 атомами галогена, которые могут совпадать или же отличаться друг от друга. Термин "тригалогеналкил" относится к алкильной группе, определение которой приведено выше, замещенной 3 атомами галогена, которые могут совпадать или же отличаться друг от друга. Термин "пергалогеналкил" относится к галогеналкильной группе, определение которой приведено выше, где каждый атом водорода в алкильной группе замещен атомом галогена. Термин "перфторалкил" относится к галогеналкильной группе, определение которой приведено выше, где каждый атом водорода в алкильной группе замещен атомом фтора. Термин "циклоалкил" относится к моно-, би- или трициклическому насыщенному кольцу, которое полностью насыщено или частично ненасыщено. Примеры подобных групп включают циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, цис- или транс-декалин,бицикло[2,2,1]гепт-2-ен, циклогекс-1-енил, циклопент-1-енил, 1,4-циклооктадиенил и т.п. Термин "(циклоалкил)алкил" означает алкильную группу, определение которой приведено выше,замещенную одной из указанных выше циклоалкильных групп. Примеры подобных групп включают(циклогексил)метильную, 3-(циклопропил)-н-пропильную, 5-(циклопентил)гексильную, 6-(адамантил) гексильную группу и т.п. Термин "замещенный фенил" обозначает фенильную группу, замещенную одним или несколькими фрагментами, в некоторых случаях, одним, двумя или тремя фрагментами, выбранными из групп, включающих галоген, гидроксильную группу, защищенную гидроксильную группу, цианогруппу, нитрогруппу, меркаптогруппу, алкилтиогруппу, трифторметильную группу, С 1-С 7 алкильную группу, С 1-C7 алкоксильную группу, С 1-С 7 ацильную группу, С 1-C7 ацилоксигруппу, карбоксильную, оксикарбонильную, защищенную карбоксильную, карбоксиметильную, защищенную карбоксиметильную, гидроксиметильную, защищенную гидроксиметильную группу, аминогруппу, защищенную аминогруппу, (монозамещенную)аминогруппу, защищенную (монозамещенную)аминогруппу, (дизамещенную)аминогруппу, карбоксамидную, защищенную карбоксамидную, N-(C1-С 6 алкил)карбоксамидную, защищенную N-(C1-С 6 алкил) карбоксамидную, N,N-ди(C1-С 6 алкил)карбоксамидную, трифторметильную группу, N-C1-С 6 алкил)сульфонил)аминогруппу, N-(фенилсульфонил)аминогруппу или фенильную группу, замещенную или незамещенную таким образом, чтобы, например, получить бифенильную или нафтильную группу. Примеры термина "замещенная фенильная группа" включают моно- или ди(галоген)фенильную группу, такую как 2-, 3- или 4-хлорфенильная, 2,6-дихлорфенильная, 2,5-дихлорфенильная, 3,4-дихлорфенильная, 2-, 3- или 4-бромфенильная, 3,4-дибромфенильная, 3-хлор-4-фторфенильная, 2-, 3- или 4 фторфенильная группа и т.п.; моно- или ди(гидрокси)фенильную группу, такую как 2-, 3- или 4-гидроксифенильная, 2,4-дигидроксифенильная группа, их защищенные гидроксипроизводные и т.п.; нитрофенильную группу, такую как 2-, 3- или 4-нитрофенильная группа; цианофенильную группу, например 2-,3- или 4-цианофенильная группа; моно- или ди(алкил)фенильную группу, такую как 2-, 3- или 4-метилфенильная, 2,4-диметилфенильная, 2-, 3- или 4-(изопропил)фенильная, 2-, 3- или 4-этилфенильная, 2-, 3 или 4-(н-пропил)фенильная группа и т.п.; моно- или ди(алкокси)фенильную группу, например 2,6-диметоксифенильную, 2-, 3- или 4-(изопропокси)фенильную, 2-, 3- или 4-(трет-бутокси)фенильную, 3-этокси 4-метоксифенильную группу и т.п.; 2-, 3- или 4-трифторметилфенильную группу; моно- или дикарбоксифенильную или (защищенную карбокси)фенильную группу, такую как 2-, 3- или 4-карбоксифенильная или 2,4-ди(защищенная карбокси)фенильная группа; моно- или ди(гидроксиметил)фенильную или (защищенный гидроксиметил)фенильную группу, такую как 2-, 3- или 4-(защищенный гидроксиметил)фенильная или 3,4-ди(гидроксиметил)фенильная группа; моно- или ди(аминометил)фенильную или (защищенный аминометил)фенильную группу, такую как 2-, 3- или 4-(аминометил)фенильная или 2,4-(защищенный аминометил)фенильная группа; или моно- или ди(N-(метилсульфониламинофенильную группу, такую как 2-, 3-или 4-(N-(метилсульфониламинофенильная группа. Кроме того, термин "замещенный фенил" включает дизамещенные фенильные группы, где заместители отличны друг от друга, напри-8 009847 мер 3-метил-4-гидроксифенильную, 3-хлор-4-гидроксифенильную, 2-метокси-4-бромфенильную, 4-этил 2-гидроксифенильную, 3-гидрокси-4-нитрофенильную, 2-гидрокси-4-хлорфенильную группу и т.п. Термин "(замещенный фенил)алкил" означает одну из определенных выше замещенных фенильных групп, которая присоединена к одной из определенных выше алкильных групп. Примеры включают такие группы, как 2-фенил-1-хлорэтильная, 2-(4'-метоксифенил)этильная, 4-(2',6'-дигидроксифенил)-н-гексильная, 2-(5'-циано-3'-метоксифенил)-н-пентильная, 3-(2',6'-диметилфенил)пропильная, 4-хлор-3-аминобензильная, 3-(4'-метоксифенил)-3-карбоксигексильная, 5-(4'-аминометилфенил)-3-(аминометил)пентильная, 5-фенил-3-оксопент-1-ильная, (4-гидрокси-нафт-2-ил)метильная группа и т.д. Как указано выше, термин "ароматический" или "арил" относится к 5- и 6-членным карбоциклическим кольцам. Кроме того, как указано выше, термин "гетероарил" обозначает необязательно замещенные 5- или 6-членные кольца, которые содержат от 1 до 4 гетероатомов, таких как атомы кислорода, серы и/или азота, в частности атомы азота, как самостоятельно, так и в сочетании с атомами серы и кислорода в кольце. Указанные 5- или 6-членные кольца могут быть полностью ненасыщенными. Более того, указанные выше необязательно замещенные 5- или 6-членные кольца необязательно могут быть конденсированы с ароматической 5- или 6-членной кольцевой системой. Например, кольца необязательно могут быть конденсированы с 5- или 6-членной кольцевой системой, такой как пиридиновая или триазольная система, и предпочтительно с бензольным кольцом. Следующие кольцевые системы являются примерами гетероциклических (как замещенных, так и незамещенных) радикалов, обозначенных термином "гетероарил": тиенильная, фурильная, пирролильная, пирролидинильная, имидазолильная, изоксазолильная, триазолильная, тиадиазолильная, оксадиазолильная, тетразолильная, тиатриазолильная, оксатриазолильная, пиридильная, пиримидильная, пиразинильная, пиридазинильная, оксазинильная, триазинильная, тиадиазинильная, тетразольная, 1,5-[b]пиридазинильная и пуринильная группа, а также конденсированные с бензольным кольцом производные, например бензоксазолильная, бензтиазолильная, бензимидазолильная и индолильная группа. Заместителями для указанных выше необязательно замещенных гетероарильных колец являются от 1 до 3 атомов галогена, тригалогенметильных групп, аминогрупп, защищенных аминогрупп, солей аминогрупп, монозамещенных аминогрупп, дизамещенных аминогрупп, карбоксильных групп, защищенных карбоксильных групп, карбоксилатных солей, гидроксильных групп, защищенных гидроксильных групп,солей гидроксильных групп, низших алкоксильных групп, меркаптогрупп, низших алкилтиогрупп, алкильных групп, замещенных алкильных групп, циклоалкильных групп, замещенных циклоалкильных групп, (циклоалкил)алкильных групп, замещенных (циклоалкил)алкильных групп, фенильных групп,замещенных фенильных групп, фенилалкильных групп и (замещенный фенил)алкильных групп. Заместители для гетероарильной группы определены ранее, а в случае тригалогенметильной группы могут быть трифторметильной, трихлорметильной, трибромметильной или трииодметильной группой. Применительно к использованию в сочетании с указанными выше заместителями для гетероарильных колец"низший алкил" означает C1-C4 алкоксильную группу, аналогично, "низшая алкилтиогруппа" означает C1C4 алкилтиогруппу. Термин "(монозамещенная)аминогруппа" относится к аминогруппе с одним заместителем, выбранным из группы, включающей фенильную, замещенную фенильную, алкильную, замещенную алкильную,C1-C4 ацильную, С 2-С 7 алкенильную, С 2-С 7 замещенную алкенильную, С 2-С 7 алкинильную, С 7-С 16 алкиларильную, С 7-С 16 замещенную алкиларильную и гетероарильную группу. Указанная (монозамещенная) аминогруппа может дополнительно иметь защищающую аминогруппу, которая определена термином"защищенная (монозамещенная)аминогруппа". Термин "(дизамещенная)аминогруппа" относится к аминогруппам с двумя заместителями, выбранными из группы, включающей фенильную, замещенную фенильную, алкильную, замещенную алкильную, С 1-С 7 ацильную, С 2-С 7 алкенильную, С 2-С 7 алкинильную,С 7-С 16 алкиларильную, С 7-С 16 замещенную алкиларильную и гетероарильную группу. Два заместителя могут совпадать или отличаться. Термин "гетероарил(алкил)" обозначает определенную выше алкильную группу, замещенную в любом положении гетероарильной группой, определение которой приведено выше."Необязательный" или "необязательно" означает, что описываемое далее событие, обстоятельство,особенность или элемент может, но необязательно, произойти, и это определение включает случаи, при которых событие или обстоятельство происходят, и случаи, при которых они не происходят. Например,"гетероциклическая группа, необязательно моно- или дизамещенная алкильной группой" означает, что алкильная группа может, но необязательно, присутствовать, и описание включает ситуации, когда гетероциклическая группа моно- или дизамещена алкильной группой, и ситуации, когда гетероциклическая группа не замещена указанной алкильной группой. Термин "электроноакцепторная группа" относится к способности функциональной группы в молекуле притягивать к себе электроны сильнее, чем это мог бы сделать атом водорода, если бы водород занимал то же самое положение в молекуле. Примеры электроноакцепторных групп включают, без их ограничения, атомы галогенов, группы -C(O)R (где R обозначает алкил); карбоксильные группы и сложноэфирные группы; группы -NR3+ (где R обозначает алкил или водород); азогруппы; нитрогруппы; группы и -OR и -SR (где R обозначает алкил или водород); и органические группы (определение которых дано в-9 009847 настоящем описании), содержащие подобные электроноакцепторные группы, такие как галогеналкильные группы (включая пергалогеналкильные группы) и т.п. Соединение, которое имеет ту же самую молекулярную формулу, но отличается типом или последовательностью связей их атомов или взаимным расположением их атомов в пространстве, называют"изомерами". Изомеры, которые отличаются взаимным расположением их атомов в пространстве, называют "стереоизомерами". Стереоизомеры, которые не являются зеркальными отображениями друг друга,называют "диастереомерами", а те стереоизомеры, которые представляют собой несовмещающиеся друг с другом зеркальные отображения друг друга, называют "энантиомерами". Если соединение имеет асимметрический центр, например центр, который связан с 4 разными группами, то возможна пара энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его асимметрического центра и описан с помощью правил R- и S-последовательностей Кана и Прелога или же может быть охарактеризован по типу того, как молекула вращает плоскость поляризации света, и тогда его обозначают как правовращающий или левовращающий (т.е. как (+)-изомер или (-)-изомер). Хиральное соединение может существовать либо как индивидуальный энантиомер, либо их смесь. Смесь, содержащую равные пропорции энантиомеров, называют "рацемической смесью". Соединения по настоящему изобретению может иметь один или несколько асимметрических центров; поэтому подобные соединения могут быть получены в виде индивидуальных (R)- или (S)-стереоизомеров или в виде их смеси. Если иное не указано, то подразумевается, что обозначение или название конкретного соединения в настоящем описании и формуле изобретения включает как индивидуальные энантиомеры, так и их смеси - рацемические или иные смеси. Способы установления стереохимии и способы разделения стереоизомеров хорошо известны из области техники (см., в частности, обсуждение в главе 4 монографии "Advanced Organic Chemistry", 4th edition, J. March, John Wiley and Sons, New York, 1992). Обзор Настоящее изобретение относится к композициям на основе тиазолидинонов, композиции на основе производных тиазолидинонов и их применению для обладающего высоким сродством ингибирования белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR) и при изучении или лечении CFTR-опосредованных заболеваний и состояний. Обнаружение целевых тиазолидиноновых соединений и их производных основывается на отборе многочисленных потенциальных соединений-кандидатов с помощью анализа, целью которого является идентификация ингибиторов CFTR, которые непосредственно взаимодействуют с CFTR. Не связывая себя какой-либо конкретной теорией или практическим способом, поскольку в исследования, которые привели к идентификации целевых соединений, были включены многочисленные активаторы CFTR, действующие на различных активирующих проводящих путях, авторы полагают, что соединения-ингибиторы по настоящему изобретению, вероятно, оказывают свой ингибирующий эффект за счет воздействия непосредственно на пути CFTR транспортировки ионовCl- или на прилегающие к ним области. Отбор 50000 различных соединений позволил выявить несколько 2-тиоксо-4-тиазолидиноновых соединений и их производных в качестве эффективных ингибиторовCFTR. Эти соединения и их производные не похожи химически и структурно на ранее известные активаторы CFTR или ранее известные ингибиторы CFTR, такие как DPC, NPPB или глибенкламид. Наиболее действенные ингибиторы CFTR, идентифицированные в результате отбора, имеют значение Ki, равное 300 нМ для ингибирования тока Cl- клетках дыхательных путей человека. Ингибирование является быстрым, обратимым и CFTR-специфичным. Далее более подробно описываются композиции и способы по настоящему изобретению. Тиазолидиноновые соединения и их производные Тиазолидиноновые соединения и их производные, которые используют в композициях и способах по настоящему изобретению, включают 3-арил-5-арилметилен-2-тиоксо-4-тиазолидиноны формулы (Ib) где X1 представляет собой трифторметил; Х 2 и Х 3 независимо выбирают из водорода и атома галогена;Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8 алкильной группы, С 1-С 7 алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы. В одном из вариантов осуществления изобретения X1 занимает положение, выбранное из 2, 3 или 4; Y2 занимает положение, выбранное из 2, 3 или 4; a Y1 и Y3 могут быть водородом. Более конкретно, 3-арил-5-арилметилен-2-тиоксо-4-тиазолидиноны могут иметь формулу (Ic)- 10009847 где значения Y1-Y3 приведены выше. В одном из вариантов осуществления изобретения трифторметильная группа занимает положение, выбранное из 2, 3 или 4; Y2 занимает положение, выбранное из 2, 3 или 4; a Y1 и Y3 в этом варианте осуществления изобретения могут быть водородом. В некоторых вариантах осуществления изобретения тиазолидиноновое соединение по настоящему изобретению может представлять собой т.е. 3-[(3-трифторметил)фенил]-5-[(3-бром-4-гидрокси-5-нитрофенил)метилен]-2-тиоксо-4-тиазолидинон. В качестве альтернативы трифторметильная группа в любом из приведенных выше соединений может занимать позицию 2 или позицию 4 в бензольном кольце. Фармацевтические препараты Изобретение относится также к фармацевтическим препаратам из приведенных выше тиазолидиноновых соединений по настоящему соединению. Соединения по настоящему изобретению могут быть включены в различные составы для введения различными путями с терапевтической целью. В частности,соединения по настоящему изобретению могут входить в состав фармацевтических композиций в сочетании с соответствующими фармацевтически приемлемыми носителями, разбавителями, наполнителями и/или вспомогательными лекарственными средствами и могут быть приготовлены в виде препаратов,которые имеют твердую, жидкую или газообразную форму, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, инъекции, лекарственные формы для ингаляции и аэрозоли. Составы предпочтительно не содержат обнаруживаемые количества ДМСО (диметилсульфоксида), который не является приемлемым носителем, разбавителем, наполнителем и/или вспомогательным лекарственным средством для неместного, парентерального или энтерального введения. Составы могут быть разработаны для введения нуждающимся субъектам или пациентам с помощью различных путей, включая пероральное, трансбуккальное, ректальное, парентеральное, внутрибрюшинное, внутрикожное, чрескожное,внутритрахейное и т.п. введение. Одним из вариантов осуществления настоящего изобретения является местное нанесение (в частности, чрескожное введение). Составы для местного нанесения могут быть в форме чрескожного пластыря,мази, пасты, лосьона, крема, геля и т.п. Составы для местного нанесения могут включать один или несколько смачивателей, загустителей, разбавителей, эмульгаторов, диспергирующих агентов или связую- 11009847 щих. В тех случаях, когда соединения готовят для чрескожной доставки, соединения могут быть приготовлены с использованием агентов, облегчающих проникновение лекарства. Агенты, облегчающие проникновение лекарства, которые могут представлять собой химические агенты, облегчающие проникновение лекарства, и физические агенты, облегчающие проникновение лекарства, способствуют доставке соединений через кожу, и их равнозначно можно обозначить термином "усилители проницаемости". Физические агенты, облегчающие проникновение, включают, например, электрофоретические методы, такие как ионтофорез, использование ультразвука (или "фонофорез") и т.п. Химические агенты, облегчающие проникновение, представляют собой агенты, которые вводят либо до, либо вместе, либо сразу же после введения лекарственных соединений и которые усиливают проницаемость кожи, в частности наружного слоя эпидермиса, с целью увеличения проникновения лекарства через кожу. Соединения, которые используют для увеличения проницаемости кожи, включают сульфоксиды,такие как диметилсульфоксид (ДМСО) и децилметилсульфоксид (С 10 MSO); простые эфиры, такие как моноэтиловый эфир диэтиленгликоля, декаоксиэтиленолеиловый эфир и монометиловый эфир диэтиленгликоля; поверхностно-активные вещества, такие как лаурат натрия, лаурилсульфат натрия, бромид цетилтриметиламмония, хлорид бензалкония, Poloxamer (231, 182, 184), Tween (20, 40, 60, 80) и лецитин; 1 замещенные азациклогептан-2-оны, в частности 1-н-додецилциклазациклогептан-2-он; спирты, такие как этанол, пропанол, октанол, бензиловый спирт и т.п.; вазелины, такие как вазелиновое масло (петролатум), минеральное масло (жидкий вазелин) и т.п.; жирные кислоты, такие как С 8-С 22 и другие жирные кислоты (в частности, изостеариновая кислота, октановая кислота, олеиновая кислота, лауриновая кислота, валериановая кислота); С 8-С 22 жирные спирты (в частности, олеиловый спирт, лауриловый спирт); низшие алкиловые эфиры С 8-С 22 жирных кислот и других жирных кислот (в частности, этилолеат, изопропилмиристат, бутилстеарат, метиллаурат, изопропилмиристат, изопропилпальмитат, метилпропионат,этилолеат); моноглицериды С 8-С 22 жирных кислот (в частности, глицерилмонолаурат); эфир тетрагидрофурфурилового спирта и полиэтиленгликоля; 2-(2-этоксиэтокси)этанол; монометиловый эфир диэтиленгликоля; алкилариловые эфиры полиэтиленоксида; монометиловые эфиры полиэтиленоксида; диметиловые эфиры полиэтиленоксида; динизшие алкиловые эфиры С 6-C8 дикислот (в частности, диизопропиладипат); этилацетат; ацетоуксусный эфир; полиолы и их сложные эфиры, такие как пропиленгликоль, этиленгликоль, глицерин, бутандиол, полиэтиленгликоль и монолаурат полиэтиленгликоля; амиды и другие азотсодержащие соединения, такие как мочевина, диметилацетамид (DMA), диметилформамид (ДМФА), 2 пирролидон, N-алкилпирролидон, в частности 1-метил-2-пирролидон; этаноламин, диэтаноламин и триэтаноламин; терпены; алканоны и органические кислоты, в частности, салициловую кислоту и салицилаты, лимонную кислоту и янтарную кислоту. Дополнительные химические и физические агенты, облегчающие проникновение лекарства, описаны, например, в документах A.F. Kydonieus (ED) 1987 CRLPharmacol. 2002; 54 (4): 499-508; Karande et al., Pharm. Res. 2002; 19 (5): 655-60; Vaddi et al., J. Pharm. Sci. 2002 July; 91 (7): 1639-51; Ventura et al., J. Drug Target 2001; 9 (5): 379-93; Shokri et al., Int. J. Pharm. 2001; 228 (1-2): 99-107; Suzuki et al., Biol. Pharm. Bull. 2001; 24 (6): 698-700; Alberti et al., J. Control Release 2001; 71 (3): 319-27; Goldstein et al., Urology 2001; 57 (2): 301-5; Kiijavainen et al., Eur. J. Pharm. Sci. 2000; 10 (2): 97-102; и Tenjarla et al., Int. J. Pharm. 1999; 192 (2): 147-58. Если составы готовят с использованием химического агента, облегчающего проникновение какоголибо соединения, то облегчающий проникновение агент выбирают таким образом, чтобы он был совместим с этим соединением и присутствовал в количестве, достаточном для того, чтобы облегчить проникновение указанного соединения через кожу субъекта, в частности, с целью доставки указанного соединения в систему кровообращения. В одном из вариантов осуществления настоящего изобретения из указанного соединения готовят состав с использованием облегчающего проникновение агента, отличного от ДМСО. В одном из вариантов осуществления настоящего изобретения указанное соединение доставляют в виде лечебного пластыря, в частности пластыря для доставки сквозь слизистую оболочку или через кожу, и он может включать облегчающий проникновение агент. Пластырь, как правило, содержит защитный слой, который не является проницаемым для соединения и других компонентов состава, матрицу,которая контактирует с одной из сторон защитного слоя, при этом матрица обеспечивает пролонгированное высвобождение (это высвобождение может быть контролируемым) соединения, и адгезивный слой, который располагается с той же стороны защитного слоя, что и матрица. Матрицу можно выбрать таким образом, чтобы она соответствовала пути введения, и она может быть, например, полимерной матрицей или матрицей из гидрогеля. В фармацевтических дозировочных формах целевые соединения по настоящему изобретению могут вводиться в форме их фармацевтически приемлемых производных, таких как соли, или же они могут применяться либо самостоятельно, либо в соответствующем их сочетании, а также в комбинации с другими фармацевтически активными соединениями. Указанные далее способы и наполнители приведены,скорее, в качестве примера и не ограничивают настоящее изобретение. Для приготовления пероральных препаратов соединения по настоящему изобретению могут применяться самостоятельно или в комбинации с соответствующими добавками, используемыми для изготов- 12009847 ления таблеток, порошков, гранул и капсул, например вместе с обычными добавками, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; со связующими, такими как кристаллическая целлюлоза, производные целлюлозы, камедь, кукурузный крахмал или желатины; с разрыхлителями, такими как кукурузный крахмал, картофельный крахмал и натриевое производное карбоксиметилцеллюлозы; с облегчающими таблетирование веществами, такими как тальк или стеарат магния; и, в случае необходимости, с разбавителями, буферными агентами, увлажнителями, консервантами и отдушкой. Особый интерес представляют препараты тиазолидиноновых соединений по настоящему изобретению вместе с буферным агентом, с целью защиты соединения от низких значений рН в желудке. Предпочтительно наносят энтеросолюбильную оболочку с тем, чтобы предотвратить выпадение соединения в осадок при его транзите через желудок. Из целевых соединений по настоящему изобретению могут быть приготовлены препараты для инъекций путем растворения, суспендирования или эмульгирования соединений в водных или неводных растворителях, таких как растительные или подобные им масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль; и, в случае необходимости, вместе с обычными добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгаторы, стабилизаторы и консерванты. Представляющие особый интерес солюбилизаторы включают витамин Е TPGS (сукцинат dтокоферил полиэтиленгликоля 1000), циклодекстрины и т.п. Соединения по настоящему изобретению могут применяться в виде составов аэрозолей с целью их введения с помощью ингаляции. Из соединений по настоящему изобретению могут быть приготовлены составы в смеси с находящимися под давлением приемлемыми газами-носителями, такими как дихлордифторметан, пропан, азот и т.п. Кроме того, соединения по настоящему изобретению можно приготовить в виде суппозиториев путем смешения с разнообразными основами, такими как эмульгирующиеся основы или водорастворимые основы. Соединения по настоящему изобретению могут вводиться ректально с помощью суппозитория. Суппозиторий может включать носитель, такой как масло какао, углеводородные воски и полиэтиленгликоли, которые плавятся при температуре тела, однако, затвердевают при комнатной температуре. Могут быть приготовлены разовые дозированные формы для перорального или ректального введения, такие как сиропы, эликсиры и суспензии, в которых каждая дозировочная единица, например чайная ложка, столовая ложка, таблетка или суппозиторий, содержит определенное количество композиции,включающей один или несколько ингибиторов. Аналогично, разовые дозированные формы для инъекций или внутривенного введения могут включать ингибитор(ы) в составе композиции в виде раствора в стерильной воде, обычном физиологической растворе или другом фармацевтически приемлемом носителе. В зависимости от субъекта и состояния, лечение которого проводят, а также от пути введения, соединения по настоящему изобретению могут назначаться в виде доз, составляющих, например, от 0,1 мкг до 10 мг/кг массы тела в день. Указан широкий диапазон, так как в общем случае эффективность терапевтического действия для разных млекопитающих варьирует в широких пределах, при этом типичные дозы для человека в 20, 30 и даже 40 раз меньше (на единицу массы тела), чем дозы для крысы. Кроме того, большое влияние на дозу может оказать путь введения. Авторы настоящего изобретения обнаружили, что вызываемая холерным энтеротоксином секреция жидкости в кишечнике у мышей эффективно блокируется разовой внутрибрюшинной дозой, составляющей приблизительно 10-20 мкг, а эффективная дозировка для крыс приблизительно в 10 раз больше. Так, например, пероральные дозировки могут приблизительно в 10 раз превышать дозы для инъекции. Более высокие дозы могут применяться для локализованных путей доставки. Типичная дозировка может представлять собой раствор, пригодный для внутривенного введения; таблетку, которую принимают от 2 до 6 раз ежедневно, или капсулу или таблетку, одномоментно выделяющую лекарство, которую принимают 1 раз в день и которая содержит пропорционально большее количество активного ингредиента, и т.д. Эффект пролонгированного выделения может быть достигнут с помощью материалов капсул, которые растворяются при различных величинах рН, с помощью капсул,которые медленно высвобождают лекарство под действием осмотического давления, или с использованием другого известного средства для контролируемого высвобождения лекарства. Для использования в способах по настоящему изобретению из соединений по настоящему изобретению могут быть приготовлены составы с другими фармацевтически активными агентами, в том числе другими CFTR-ингибирующими агентами. Фармацевтически приемлемые наполнители, пригодные к применению по настоящему изобретению, такие как носители, вспомогательные лекарственные средства, наполнители или разбавители, являются общедоступными. Кроме того, легко доступны вспомогательные агенты, такие как регуляторы рН и буферные агенты, агенты для регулирования тонуса, стабилизаторы, смачиватели и т.п. Для специалиста должно быть понятно, что уровни дозы могут варьировать в зависимости от конкретного соединения, тяжести симптомов и чувствительности субъекта к побочным эффектам. Предпочтительные дозировки для данного соединения могут быть легко определены специалистом с помощью различных методик.- 13009847 Предлагаются наборы с разовыми дозами соединений по настоящему изобретению, которые обычно представляют собой пероральные дозы или дозы для инъекций. Подобные наборы помимо контейнеров, содержащих разовые дозы, снабжаются вложенной информацией, которая описывает использование и соответствующие преимущества лекарств для лечения представляющего интерес патологического состояния. Предпочтительными соединениями и разовыми дозами являются те, которые приводятся в настоящем описании. Состояния, которые поддаются лечению с помощью ингибиторов CFTR по настоящему изобретению Раскрываемые в настоящем описании ингибиторы CFTR применимы при лечении CFTR-опосредованного состояния, в частности любого состояния, нарушения или заболевания или симптомов указанного состояния, нарушения или заболевания, которое является результатом активности CFTR, например активности CFTR в транспорте ионов. Указанные состояния, нарушения или заболевания или их симптомы поддаются лечению путем ингибирования активности CFTR, в частности транспорта ионов под действием CFTR. В одном из вариантов осуществления изобретения ингибиторы CFTR по настоящему изобретению применимы при лечении состояний, связанных с увеличенной сверх нормы секрецией в кишечнике, в особенности увеличенной сверх нормы секрецией в кишечнике в острой форме. CFTR принимает активное участие в секреции кишечника в качестве ответной реакции на действие различных агонистов, включая холерный энтеротоксин (см., например, Snyder et al., 1982 Bull. World Healh Organ. 60: 605-613; Chao etal., 1994 EMBO J. 13: 1065-1072; Kimberg et al., 1971 J. Clin. Invest. 50: 1218-1230). Так, ингибиторы CFTR по настоящему изобретению могут назначаться в количестве, эффективном для ингибирования транспорта ионов под действием CFTR и, следовательно, для уменьшения секреции жидкостей в кишечнике. Таким образом, ингибиторы CFTR могут применяться при лечении воспалительных заболеваний кишечника и диареи, в особенности секреторной диареи. Секреторная диарея является одной из главных причин детской смертности в развивающихся странах и уносит около 5 млн жизней ежегодно (Gabriel etCF, указывает на то, что CFTR является обычным конечным метаболическим путем секреции хлоридиона а (и, следовательно, секреции жидкости) в кишечнике в качестве ответной реакции на действие различных агонистов (Snyder et al., 1982 Bull. World Healh Organ. 60: 605-613; Chao et al., 1994 EMBO J. 13: 1065-1072; и Kimberg et al., 1971 J. Clin. Invest. 50: 1218-1230). Используемая в настоящем описании мышиная модель секреции жидкости в кишечнике показывает, что ингибирование CFTR путем системного введения нетоксичной дозы ингибитора эффективно блокирует секрецию жидкости в кишечнике, индуцируемую холерным энтеротоксином (см. примеры). Диареи, которые поддаются лечению при использовании ингибиторов CFTR по настоящему изобретению, могут быть результатом воздействия различных патогенов или агентов, включающих, без их ограничения, холерный энтеротоксин (Vidrio Cholera), E. coli (в частности, его энтеротоксигенный штамм (ЕТЕС, Shigella, Salmonella, Campylobacter, Clostridium difficile, паразиты (в частности, Giardia,Entamoeba histolytica, Cryptosporidiosis, Cyclospora), вирусы диареи (в частности, ротавирусы), пищевое отравление или действие токсина, которое приводит к повышенной секреции кишечника, опосредованной CFTR. Другие диареи включают диареи, связанные с AIDS (СПИД) (в частности, относящиеся к СПИД диареи), и воспалительные заболевания желудочно-кишечного тракта, такие как язвенный колит, воспалительное заболевание кишечника (IBD), болезнь Крона и т.п. Сообщалось, что воспаление кишечника модулирует экспрессию трех основных медиаторов транспорта соли в кишечнике и может вносить свой вклад в язвенный колит как путем усиления трансэпителиальной секреции ионов Cl- и путем ингибирования абсорбции NaCl в эпителии (см., например, Lohi et al., 2002, Am. J. Physiol. Gastrointest. LiverPhysiol. 283 (3): G567-75). Ингибиторы CFTR по настоящему изобретению могут использоваться при лечении состояний, таких как поликистоз почек, и находят дальнейшее применение в качестве лекарств против мужского бесплодия путем ингибирования активности CFTR в яичках. Ингибиторы CFTR по настоящему изобретению могут пройти дальнейший отбор в моделях крупных животных (в частности, кроличьей модели, которая описывается в Spira et al., 1981, Infect. Immun. 32: 739-747). Кроме того, для дальнейшего исследования свойств ингибиторов CFTR по настоящему изобретению может быть проведен анализ выделенного стула с использованием живого холерного эмбриона. Отличные от человека животные модели и модели тканей человека при дефиците CFTR Ингибиторы CFTR по настоящему изобретению могут также применяться для разработки отличных от человека моделей заболевания, где заболевание связано с увеличенной функцией CFTR (в частности,увеличенным транспортом ионов). Имеются веские доказательства того, что дефектная секреция жидкости и макромолекул железами, расположенными под слизистой оболочкой, приводит к ухудшению очищения реснитчатого эпителия и удаления бактерий у субъектов с дефицитом CFTR, в частности субъектов, пораженных муковисцидозом (CF, CF); тем не менее, функциональные исследования желез в дыхательных путях человека ограничиваются тяжелыми заболеваниями дыхательных путей, возникшими при трансплантации легких (Jayaraman et al., 2001, Proc. Natl. Acad. Sci. USA 98: 8119-8123). Экстренное ин- 14009847 гибирование CFTR позволяет определить роль CFTR в секреции воды, соли и макромолекул железами,расположенными под слизистой оболочкой. Обладающие высоким сродством ингибиторы CFTR позволяют фармакологически разработать отличные от человека животные модели, которые имитируют дефицит CFTR у людей, например имитируют человеческий фенотип CF. В частности, модели дефицитаCFTR у крупных животных (в частности, CF) находят особое применение для выявления патофизиологии инициирования развития болезней дыхательных путей при CF и для оценки эффективности терапииCF, в частности, при отборе кандидатов в агенты для лечения дефицита CFTR или его симптомов. Ингибирование CFTR транспорта ионов может проявляться в заболеваниях дыхательных путей и поджелудочной железы, а также в бесплодии у мужчин. Например, ингибирование каналов CFTR в легких и дыхательных путях воздействует на жидкости на поверхности дыхательных путей, что ведет к накоплению слизи, которая, в свою очередь, закупоривает дыхательные пути и в большом количестве собирается на стенках легких, тем самым создавая первичное окружение для возникновения инфекции, что,в свою очередь, может привести к развитию хронических заболеваний легких. Тот же самый феномен наблюдается в поджелудочной железе, где накопленная слизь нарушает экзокринную функцию поджелудочной железы и не дает важнейшим перерабатывающим пищу ферментам попадать в кишечник. Указанные отличные от человека животные модели могут быть созданы путем введения количества ингибитора CFTR, эффективного для снижения активности CFTR в осуществлении транспорта ионов. Особый интерес представляет использование ингибиторов CFTR по настоящему изобретению для индуцирования фенотипа муковисцидоза (CF) в отличных от человека животных моделях. Введение количества ингибитора CFTR, эффективного для ингибирования рецепторов CFTR, например, в легких эффективно имитирует недостаток CFTR, которое наблюдается при CF. Пути введения ингибитора CFTR подробно обсуждались выше. В зависимости от используемой отличной от человека животной модели, соединения по настоящему изобретению могут вводиться в дозировках, например, от 50 до 500 мкг/кг массы тела от 1 до 3 раз в день путем внутрибрюшинного, подкожного или другого пути создания отличных от человека животных моделей. Пероральные дозировки могут в 10 раз превышать внутрибрюшинную и подкожную дозу. Отличные от человека животные модели связанных с CFTR заболеваний могут применяться в качестве моделей любого подходящего состояния, связанного с пониженной активностью CFTR. Подобные состояния включают такие состояния, которые связаны с мутациями CFTR, при этом указанные мутации являются следствием аномалий в транспорте ионов и воды в эпителии. Указанные аномалии могут, в свою очередь, быть связаны с дисфункцией очистки реснитчатого эпителия в дыхательных путях, а также в эпителии других слизистых оболочек и эпителии протоков. Состояния, которые могут фармакологически моделироваться путем индуцирования в отличных от человека животных моделях фенотипа с дефицитом CFTR, включают, без их ограничения, муковисцидоз (в том числе атипичную CF), идиопатический хронический панкреатит, повреждения семявыносящих протоков, легкие формы легочных болезней, астму и т.п. Обзор расстройств, связанных с нарушением функции CFTR, см., например, в Noone etal., Respir. Res. 2: 232-332 (2001). Генерируемые ингибитором CFTR отличные от человека животные модели могут также служить в качестве моделей микробной инфекции (например, бактериальной, вирусной или грибковой инфекции, в частности респираторной инфекции) у субъекта с дефицитом CFTR. В одном представляющем особый интерес варианте осуществления изобретения ингибиторы CFTR по настоящему изобретению применяют для того, чтобы фармакологически индуцировать фенотип муковисцидоза (CF). Животные, которые подходят для использования при создании животных моделей по настоящему изобретению, включают любых животных, в частности млекопитающих, например отличных от человека приматов (например, обезьяну, шимпанзе, гориллу и т.п.), грызунов (например, крыс, мышей, песчанок,хомяков, африканских хорьков и т.п.), зайцеобразных, свиньих (например, свиней, свинок), лошадиных,псовых, кошачьих и т.п. Особый интерес представляют крупные животные. Ингибиторы CFTR могут также контактировать с изолированными тканями человека с целью создания ex vivo модели заболевания. Указанные ткани контактируют с количеством ингибитора CFTR, эффективным для снижения активности CFTR в ткани, которая может наблюдаться по меньшей мере в течение 15 мин или до 2 ч и более. Представляющие интерес ткани человека включают, без их ограничения, легкие (включая трахею и дыхательные пути), печень, поджелудочную железу, яички и т.д. Физиологические, биохимические, геномные и другие исследования могут быть проведены с обработанными ингибитором тканями с целью идентификации новых целевых терапевтических молекул, которые важны в патофизиологии заболевания. Например, ткани, взятые у людей без CF, могут быть подвергнуты воздействию ингибитора в количестве, достаточном для индуцирования фенотипа CF, и подобные исследования могут быть проведены с целью идентификации новых целевых терапевтических молекул, которые важны в патофизиологии CF. Синтез соединений по настоящему изобретению Соединения по настоящему изобретению могут быть получены в соответствии с известными специалистам способами, или по способам, аналогичным тем, которые раскрываются в патенте США 5326770 или патенте США 6380186 (все они целиком включены в настоящее описание посредством- 15009847 ссылки), или в соответствии со способами, аналогичными приведенным в настоящем описании. Следует понимать, что в приведенном далее описании комбинации заместителей и/или переменных в приведенных ниже формулах допустимы лишь в том случае, когда подобные комбинации приводят к образованию стабильных соединений. Для специалиста в данной области техники должно быть понятно, что в описываемых ниже способах может потребоваться защитить функциональные группы промежуточных соединений с помощью подходящих защитных групп. Подобные функциональные группы включают гидроксильную группу,аминогруппу, меркаптогруппу и карбоксильную группу. Подходящими защитными группами для гидроксильной группы являются триалкилсилильная или диарилалкилсилильная (например, трет-бутилдиметилсилильная, трет-бутилдифенилсилильная или триметилсилильная группа), тетрагидропиранильная,бензильная группа и т.п. Подходящие защитные группы для аминогруппы, амидиногруппы и гуанидиногруппы включают трет-бутоксикарбонильную, бензилоксикарбонильную группу и т.п. Подходящие защитные группы для меркаптогруппы включают группы -С(О)-R (где R обозначает алкильную, арильную или аралкильную группу), п-метоксибензильную, тритильную группу и т.п. Подходящими защитными группами для карбоновой кислоты являются алкиловые, ариловые и аралкиловые сложные эфиры. Защитные группы могут быть введены или удалены в соответствии со стандартными методиками,которые хорошо известны специалистам в данной области техники, а также приводятся в настоящем описании. Применение защитных групп подробно описывается в монографии Theodora W. Green, Peter G.M.Wuts, Protective Groups in Organic Synthesis (1999), 3rd Ed., Wiley-Interscience. Защитной группой может служить также полимерная смола, такая как смола Ванга или 2-хлортритилхлоридная смола. Для специалиста в данной области техники должно быть понятно, что, несмотря на возможное отсутствие фармацевтической активности как таковой у подобных защищенных производных соединений формулы (I), описание которых приведено выше (в частности, в разделах Обзор и Тиазолидиноновые соединения и их производные), указанные производные могут вводиться млекопитающему, а затем они преобразуются в ходе обмена веществ с получением соединений по настоящему изобретению, которые являются фармакологически активными. Поэтому подобные производные будут называться "пролекарствами". Все пролекарства соединений формулы (I) входят в объем настоящего изобретения. Приведенные далее схемы реакций поясняют способы получения соединений по настоящему изобретению. Следует понимать, что обычный специалист в данной области техники в состоянии получить соединения по настоящему изобретению, применяя аналогичные методы или используя способы, известные специалисту. В общем случае, исходные компоненты могут быть получены из таких источников, какAldrich, или же синтезированы в соответствии с известными из области техники литературными источниками (см., в частности, Smith and March, March's Advanced Organic Chemistry: Reactions, Mechanisms,and Structure, 5th edition (Wiley Interscience, New York. Более того, различные замещенные группы (например, X1, X2, Х 3, Y1, Y2 и Y3 и т.д.) в соединениях по настоящему изобретению могут быть присоединены к исходным компонентам, промежуточным соединениям и/или конечным пролекарствам в соответствии со способами, известными специалистам в данной области техники. В приведенных ниже схемах реакций R обозначает алкильную или аралкильную группу, a W обозначает атом галогена, такой как Cl, Br или I. Приведенная ниже схема реакций 1 посвящена получению соединений формулы (I), которые уже были рассмотрены ранее (в частности, в разделах Обзор и Тиазолидиноновые соединения и их производные), где значения X1, X2, X3, Y1, Y2 и Y3 указаны выше (в частности, в разделах Обзор и Тиазолидиноновые соединения и их производные). Схема реакций 1 В общем случае, соединения формулы (I) получают, действуя вначале на соединение формулы (а) 1 экв. основания, такого как NaOH, при комнатной температуре. Затем в реакционную смесь добавляют соединение формулы (b), растворенное в подходящем растворителе, таком как ТГФ. Полученную реак- 16009847 ционную смесь перемешивают в течение 1-24 ч. Далее в реакционную смесь добавляют кислоту, такую как HCl. Полученную реакционную смесь перемешивают в течение 1-24 ч. Из реакционной среды с помощью стандартных методик выделения и очистки выделяют соединение формулы (с). Затем соединение формулы (с) обрабатывают соединением формулы (d) в стандартных условиях проведения конденсации по Кнвенагелю и получают требуемый продукт формулы (I). Иначе соединения формулы (I) могут быть получены в соответствии со следующей схемой реакций 2, где значения Y1, Y2 и Y3 указаны выше (в частности, в разделах Обзор и Тиазолидиноновые соединения и их производные), a W обозначает галоген. Схема реакций 2 В общем случае, соединения формулы (I) получают, действуя вначале на соединение формулы (е) соединением формулы (f) в стандартных условиях проведения конденсации по Кнвенагелю, таких как кипячение с обратным холодильником в присутствии каталитического количества пиперидина в ледяной уксусной кислоте, спирте или другом подходящем растворителе. Затем соединение формулы (g) выделяют из реакционной смеси с помощью стандартных методик выделения и очистки. Далее соединение формулы (g) обрабатывают соединением формулы (h) в стандартных условиях проведения конденсации Ульманна, в частности в присутствии Cu, или Cu2O, или CuO при повышенных температурах, и получают требуемый продукт формулы (I). Иначе соединения формулы (I) могут быть получены в соответствии со следующей схемой реакций 3, где значения Y1, Y2 и Y3 указаны выше (в частности, в разделах Обзор и Тиазолидиноновые соединения и их производные), a W обозначает галоген. Схема реакций 3 В данной схеме реакций первая стадия представляет собой конденсацию Ульманна между соединением формулы (е) и соединением формулы (h) с образованием соединения формулы (с), которое вводят в реакцию конденсации по Кнвенагелю с соединением формулы (d), и получают требуемый продукт формулы (I). Исходное соединение формулы (е) может быть куплено у различных поставщиков химических веществ или синтезировано в соответствии со способами, известными специалистам, или по методикам, аналогичным тем, которые раскрываются у F.С. Brown et al., J. Am. Chem. Soc., 78, 384-388 (1956); R.E. Strube,Organic Synthesis, CV 4, 6; K.S. Markley and E.E. Reid, J. Am. Chem. Soc., 52, 2137-2141 (все они целиком включены в настоящее описание посредством ссылки). Используя методики, аналогичные приведенным выше, синтез 3-[(3-трифторметил)фенил]-5-[(4 карбоксифенил)метилен]-2-тиоксо-4-тазолидинона (обозначают в настоящем описании как CFTRinh-172)(см. фиг. 1 С) и его аналогов с различным расположением трифторметильных и карбоксильных замести- 17009847 телей (см., например, фиг. 1D) осуществляют с помощью конденсации по Кнвенагелю 2-тиоксо-3-[атрифторметил-4-фенил]-4-тиазолидинона (а=2, 3 или 4) с b-карбоксибензальдегидом (b=2, 3 или 4) в присутствии пиперидина. Образовавшийся осадок отфильтровывают, промывают этанолом, сушат и перекристаллизовывают 2-3 раза из этанола, получая кристаллы ярко-желтого цвета (выход 70-85%). Структуры подтверждают методом 1 Н-ЯМР. Чистота составляет 99% по данным тонкослойной хроматографии и ЖХВР. Примеры Следующие примеры приведены с тем, чтобы полностью раскрыть перед специалистами и описать,каким образом можно получить и использовать настоящее изобретение, и их не следует рассматривать как ограничивающие объем того, что, как считают авторы изобретения, входит в притязания по настоящему изобретению, а также не следует рассматривать их как единственные эксперименты, которые были проведены авторами настоящего изобретения. Авторы старались получить точные значения приведенных численных величин (например, количеств, значений температуры и т.п.), однако, следует учитывать некоторые ошибки эксперимента и отклонения. Если иное не указано, долевые части приведены в массовых частях, молекулярные массы представляют собой средневесовые молекулярные массы, значения температур приведены в градусах Цельсия, а давление является атмосферным или близким к атмосферному. Описание синтеза соединений по настоящему изобретению представлено в виде примеров, однако,приведенные примеры не ограничивают настоящее изобретение. Пример синтеза Синтез 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тазолидинона.A. К перемешиваемому раствору 3-трифторметиланилина (1,6 г, 10 ммоль) и триэтиламина (1 г, 10 ммоль) в этилацетате (10 мл) в течение 30 мин по каплям добавляют дисульфид углерода (0,8 г, 10 ммоль). Слабоэкзотермическую реакцию, которая начинается после того, как добавляют приблизительно половину реагента, легко контролируют, используя время от времени баню со льдом. Оставляют перемешиваться на ночь, густую суспензию желтого цвета отфильтровывают и осадок промывают 50 мл диэтилового эфира и сушат на воздухе, получая 3 г (89%) дитиокарбамата бледно-желтого цвета с т.пл. 92-95 С (с разложением).B. Дихлорацетат натрия (получают из хлоруксусной кислоты (0,064 г, 0,46 ммоль) и 0,6 мл раствораNaHCO3 с рН 8-9) перемешивают и охлаждают до 5-10 С, а затем в течение 10 мин добавляют дитиокарбамат (0,3 г, 0,9 ммоль). Перемешивание продолжают и дают колбе нагреться до комнатной температуры. После перемешивания в течение 2 ч раствор охлаждают до 10 С, подкисляют концентрированной хлористо-водородной кислотой и реакционную смесь нагревают до 90-95 С в течение 30 мин. Образовавшийся осадок отфильтровывают, промывают водой и перекристаллизовывают из этанола, получая 0,103 г 2-тиоксо-3-(3-трифторметилфенил)-4-тиазолидинона в виде блестящих кристаллов с выходом 83%, т.пл. 177-178 С, 1 Н-ЯМР (300 МГц, CDCl3):4,18 (c, 2 Н, СН 2), 7,40 (д, 1 Н, фенил, J=8,0 Гц), 7,48 (с,1 Н, фенил), 7,64 (т, 1 Н, фенил, J=8,0 Гц), 7,72 (д, 1 Н, фенил, J=7,6 Гц) м.д.C. Смесь полученного выше 2-тиоксо-3-(3-трифторметилфенил)-4-тиазолидинона (0,1 г, 0,36 ммоль) и 4-карбоксибензальдегида (0,054 г, 0,36 ммоль) в абсолютном спирте (1 мл) и пиперидине (1 капля) перемешивают при кипячении с обратным холодильником в течение 30 мин. Осадок желтого цвета отфильтровывают, промывают этанолом, сушат и перекристаллизовывают из этанола, получая 0,108 г (73%) указанного в заголовке соединения в виде твердого кристаллического вещества желтого цвета с т.пл. 180-182 С,спектр 1 Н-ЯМР (300 МГц, CDCl3):7,78 (д, 2 Н, карбоксифенил, J=8,2 Гц), 7,80-8,00 (м, 5 Н, трифторметилфенил и СН), 8,07 (д, 2 Н, карбоксифенил, J=8,31 Гц), 13,20 (с, 1 Н, СООН, D2O обменная вода) м.д.D. Аналогично тому, как описано выше, получают следующие соединения: 3-[(3-трифторметил)фенил]-5-[(3-карбокси-4-гидроксифенил)метилен]-2-тиоксо-4-тазолидинон; 3-[(3-трифторметил)фенил]-5-[(3,4,5-тригидроксифенил)метилен]-2-тиоксо-4-тазолидинон; 3-[(3-трифторметил)фенил]-5-[(2,3,4-тригидроксифенил)метилен]-2-тиоксо-4-тазолидинон; 3-[(3-трифторметил-4-фтор)фенил]-5-[(3-карбокси-4-гидроксифенил)метилен]-2-тиоксо-4-тазолидинон; 3-[(4-фтор-3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тазолидинон. В приведенных ниже примерах применяют следующие материалы и методы. Клеточные линии, мыши и соединения Клетки щитовидной железы крыс Fischer (FRT), коэкспрессирующие дикий тип CFTR человека и галогеновый индикатор YFP-H148Q, готовят, как указано ранее (Galietta et al., 2001, J. Biol. Chem. 276: 19723-19728). Клетки помещают на 96-луночные микропланшеты с черными стенками (от компанииCorning Costar) с плотностью 20000 клеток на лунку в модифицированной Куном среде F12, дополненной 5% сыворотки плода коровы, 2 мМ L-глютамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина. Анализы проводят через 48 ч после помещения на планшет, и за это время клетки только начинают сливаться (40000 клеток на лунку). Первичный отбор проводят с помощью разнообразной коллекции 50000 подобных лекарствам соединений от компании ChemBridge (Сан-Диего, Калифорния), получаемых в виде 10 мМ маточного раствора в ДМСО и разбавленных на 96-луночных планшетах до концентрации 100 мМ. Анализ структур- 18009847 ной активности проводят на аналогах, приобретенных у компаний ChemBridge и ChemDiv (Сан-Диего,Калифорния). Диких мышей и мышей с муковисцидозом (гомозиготный мутант F 508) выращивают в центре CFAnimal Core при Калифорнийском университете в Сан-Франциско (UCSF). Методики исследования животных были одобрены комитетом по изучению животных UCSF. Клетки Т 84 и Сасо-2 получают из центра клеточных культур UCSF. Клетки Т 84 выращивают в смеси 1:1 среды DMEM и среды Hams F12, дополненной 5% сыворотки плода коровы, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, помещают для роста на вставки Snapwell (от компании Corning Costar) во влажной атмосфере (5% О 2/95% СО 2) при температуре 37 С. Клетки используют через 10-14 дней после помещения на планшет. Клетки Caco-2 культивируют в среде DMEM, содержащей 10% сыворотки плода коровы, 1% неосновных аминокислот, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, и культивируют на ставках Snapwell. Клетки используют через 21-24 дня после помещения на планшет. Диких мышей с генетическим фоном CD1 выращивают, как описано ранее. Самцов крыс Wistar (200-250 г) покупают от Jackson Laboratories. Методики исследования животных были одобрены комитетом по изучению животных UCSF. Фрагменты толстой кишки человека получают непосредственно в процессе проведения операции по иссечению и транспортируют их в охлажденном льдом физиологическом растворе для использования в течение часа после проведения иссечения. Форсколин, 8-бром-cGMP, амилорид, холерный энтеротоксин и токсин STa покупают у компанииSigma Chemical Co. (Сент-Луис, Миссури). CFTRact-16 получают от компании Chem Bridge (Сан-Диего,Калифорния). Методики отбора Анализы проводят с помощью специально разработанной для заказчика системы отбора (Beckman),включающей 3-метровую руку-робот, инкубатор СО 2, установку для отмывки планшетов, неавтоматизированную установку для жидкостной обработки, ридер штрих-кодов, установку для удаления крышек и два флуоресцентных планшет-ридера FluoStar (компания BMG Labtechnologies, Оффенбург, Германия),каждый из которых снабжен двумя шприцевыми насосами и фильтром HQ500/20X (50010 нм) при возбуждении и эмиссионным фильтром (HQ535/30M (53515 нм) (от компании Chroma). Роботизированная система интегрирована с помощью программного обеспечения SAMI version 3.3 (Beckman), модифицированного для двух планшет-ридеров. Собственное программное обеспечение написано на VBA (VisualBasic for Applications) для расчета нормализованных углов наклона кривых флуоресценции (из них получают скорости притока галогенидов) после вычитания значения для базовой линии из хранящихся в базе данных протоколов. Проведение анализа начинают, помещая в инкубатор (37 С, 90% влажность, 5% СО 2) 40-60 96-луночных планшетов, содержащих клетки FRT, а на поворотный механизм помещают 96-луночные планшеты с тестируемыми соединениями и съемные пластиковые насадки для пипеток. Для инициирования анализа каждую лунку 96-луночного планшета промывают 3 раза фосфатно-солевым буферным раствором (PBS) (300 мкл на одну промывку), оставляя в лунке 50 мкл PBS. Добавляют 10 мкл активирующегоCFTR коктейля (5 мкМ форсколина, 100 мкМ IBMX, 25 мкМ апигенина в PBS), а по прошествии 5 мин в каждую лунку добавляют тестируемое соединение (0,5 мкл в 1 мМ ДМСО), получая конечную концентрацию 10 мкМ. Через 10 мин 96-луночные планшеты переносят на планшет-ридер для изучения флуоресценции. Каждую ячейку исследуют индивидуально на предмет CFTR-индуцированного переноса ионов I- путем непрерывной регистрации флуоресценции (200 мс на одну точку) в течение 2 с (базовая линия), а затем в течение 12 с после быстрого (0,5 с) добавления 160 мкл изосмолярного PBS, в котором 137 мМ Cl- заменяют на I-. Анализ внутриклеточной концентрации [цАМФ] и токсичности Анализы на [цАМФ] и фосфатазу проводят, как указано ранее (Galietta et al., 2001, J. Biol. Chem. 276: 19723-19728). Клеточную токсичность изучают с помощью дигидрородаминового метода через 24 ч после инкубации клеток вместе с 0-1000 мкМ ингибитора. Токсичность для животных исследуют путем изучения химического состава сыворотки и гематологии (клиническая лаборатория UCSF) у мышей после проведения в течение 5 дней ежедневных внутрибрюшинных инъекций ингибитора в количестве 0100 мкг/кг. Активность MDR-1 Активность MDR-1 оценивают путем измерения накопления 3 Н-винкристина в иммортализованной клеточной линии трахеи человека, 9HTEo-/Dx, в которых эндогенную экспрессию MDR-1 регулируемым образом усиливают путем селекции в возрастающих концентрациях доксорубицина (Rasola et al., 1994, J.Biol. Chem. 269: 1432-1436). Клетки высевают в 24-луночные микропланшеты (200000 клеток на лунку). Через 48 ч клетки промывают раствором, содержащим (в мМ): 130 NaCl, 2 KCl, 1 KH2PO4, 2 CaCl2, 2 MgCl2,10 Na-Hepes (pH 7,3) и 10 глюкозы, и инкубируют в течение 1 ч при 37 С вместе с 200 мкл того же раствора, содержащего 3 Н-винкристин (0,7 мкМ; 1 мкКи/мл). Затем клетки трижды промывают охлажденным льдом раствором и подвергают лизису действием 0,25 М раствора NaOH. Содержание винкристина определяют путем подсчета количества сцинтилляций.- 19009847 Изучение токов короткого замыкания с использованием клеток FRT, экпрессирующих CFTR Вставки Snapwell, содержащие клетки FRT, экспрессирующие CFTR, или клетки эпителия бронхов человека помещают в систему камер Уссинга. В случае клеток FRT в гемикамеры помещают 5 мл 75 мМ раствора NaCl и 75 мМ глюконата натрия (апикально) и 150 мМ NaCl (базолатерально) (рН 7,3) и базолатеральную мембрану пермеабилизуют с помощью 250 мкМ/мл амфотерицина В (Galietta et al., 2001, J.Biol. Chem. 276: 19723-19728). В случае клеток эпителия бронхов и клеток Т 84 обе гемикамеры содержат бикарбонатный раствор Кребса. Через гемикамеры постоянно барботируют воздух (клетки FRT) или 5% СО 2 в воздухе (бронхиальные клетки и клетки Т 84) и поддерживают температуру 37 С. Ток короткого замыкания постоянно регистрируют, используя DVC-1000-вольтный зажим (от компании World PrecisionInstruments, Сарасота, Флорида), с помощью Ag/AgCl электродов и 1 М KCl агаровых мостиков. Анализ активности Clканала по методу точечного потенциала Ток мембраны измеряют в полноклеточной конфигурации. Для регистрации Clканала внеклеточныйHepes (pH 7,3). CFTR активируют форсколином (5 мкМ) во внеклеточном растворе. Изменение проводимости мембраны с течением времени контролируют как ответную реакцию на импульсы переменного напряжения от -100 до +80 мВ. В определенное время выполнение методики прерывают для определения зависимости тока от напряжения (импульсы напряжения от -100 до +100 мВ с шагом приращения 20 мВ). Чувствительные к объему Clканалы активируют гипотоническим раствором (внеклеточный NaCl понижают до 120 NaCl; 250 мОсм/кг). Кальций-чувствительные Clканалы активируют в эпителиальных клетках бронхов человека добавлением 100 мкМ UTP во внеклеточный раствор. Анализ активности АТФ-чувствительных K+-каналов по методу точечного потенциала Мембранный потенциал регистрируют в -клетках поджелудочной железы линии INS-1, в которых внеклеточный раствор (кювета) содержит (в мМ): 130 NaCl, 2 KCl, 1 KH2PO4, 2 CaCl2, 2 MgCl2, 10 NaHepes (pH 7,3) и 10 глюкозы. Пипетка содержит (в мМ): 140 KCl, 1 CaCl2, 2 MgCl2, 10 EGTA, 0,5 MgATP,10 K-Hepes (pH 7,3). По достижении полноклеточной конфигурации усилитель переключают в режим фиксации тока. Секреция жидкости в кишечнике и ток короткого замыкания В первом из 3 анализов определяют накопление жидкости в петлях подвздошной кишки (Oi et al.,2002, Proc. Natl. Acad. Sci. USA 99: 3042-3046; Gorbach et al., 1971, J. Clin. Invest. 50: 881-889). Мышей(возраст 8-10 недель, масса тела 25-35 г) с генетическим фоном CD1 (или гомозиготных мышей F508) лишают пищи на 24 ч, а затем анестезируют внутрибрюшинным введением кетамина (40 мг/кг) и ксилазина (8 мг/кг). В процессе проведения хирургической операции температуру тела поддерживают в интервале 36-38 С с помощью подогреваемой подушки. Чтобы обнажить тонкую кишку, делают небольшой абдоминальный надрез и закрытые петли подвздошной кишки (длина 20-30 мм) отделяют проксимально к слепой кишке путем наложения шва. В петли делают инъекции 100 мкл одного лишь PBS или PBS,содержащего холерный энтеротоксин (1 мкг). В некоторых экспериментах ингибитор (150 мкг/кг) вводят внутрибрюшинной инъекцией. Абдоминальный разрез закрывают с помощью шва и дают мышам восстановиться после анестезии. Через 6 ч мышей анестезируют, петли кишок временно выводят на поверхность тела и измеряют длину и массу петель после удаления брыжеечной и соединительной тканей. В закрытой взрослой мышиной модели секреторной диареи мышам через зонд перорально вводят холерный энтеротоксин (10 мкг) в 0,1 мл 7%-ного бикарбонатного буферного раствора (или одного лишь буферного раствора), используя орогастрическую иглу для инъекционного питания (Richardson et al.,1986, Infect. Immun. 54: 522-528; Gabriel et al., 1999, Am. J. Physiol. 276: G58-G63). Формируют четыре экспериментальные группы: контрольная (один лишь буферный раствор), обработанная холерным энтеротоксином, обработанная холерным энтеротоксином+ингибитором (150 мкг/кг внутрибрюшинно за 2 мин до чреззондового введения) и с одним лишь ингибитором. Через 6 ч мышей умерщвляют и тонкую кишку (от пилоруса до слепой кишки) выводят на поверхность тела и освобождают от брыжеечных и соединительных тканей. Кишку взвешивают, затем продольно вскрывают для удаления из полости жидкости(блоттингом) и снова взвешивают. Накопление жидкости рассчитывают как отношение массы кишки до и после удаления жидкости из полости. Для измерения тока короткого замыкания выделяют полоски толстой кишки крысы, отделяют мышечные слои прямым рассечением, помещают их в камеры Уссинга(площадь 0,7 см 2) и устанавливают в кювету с насыщенным кислородом бикарбонатным раствором Рингерса, содержащим 10 мкМ индометацина. Ток короткого замыкания измеряют после подавления токаNa+ с помощью амилорида (10 мкМ), после этого проводят стимуляцию с помощью форсколина (20 мкМ),а затем добавляют ингибитор. Синтез 14 С-меченного CFTRinh-172 (фиг. 6) Промежуточный 2-тиоксо-3-(3-трифторметилфенил)-4-тиазолидинон синтезируют, добавляя по каплям дисульфид углерода (0,8 г, 10 мМ) к перемешиваемому раствору 3-трифторметиланилина (1,6 г, 10 мМ) и триэтиламина (1 г, 10 мМ) в этилацетате (10 мл) в течение 30 мин. Баню со льдом используют для того,чтобы предотвратить избыточное выделение тепла во время реакции. Оставляют перемешиваться на- 20009847 ночь, густую суспензию желтого цвета отфильтровывают и осадок промывают 50 мл эфира и сушат на воздухе, получая 3 г (89%) твердого дитиокарбамата бледно-желтого цвета (т.пл. 92-95 С). Br-14 С-ацетат натрия (получают из Br-14 С-уксусной кислоты (Amersham), 55 мКи/ммол, 64 мг, 0,46 мМ в 0,6 мл воды,рН доводят до 8-9 с помощью NaHCO3) перемешивают и охлаждают до 5-10 С, а затем в течение 10 мин добавляют дитиокарбамат (0,3 г, 0,9 мМ). Перемешивание продолжают и дают колбе нагреться до комнатной температуры. После перемешивания в течение 2 ч раствор охлаждают до 10 С, подкисляют концентрированной HCl и реакционную смесь нагревают до 90-95 С в течение 30 мин. Образовавшийся осадок отфильтровывают, промывают водой и перекристаллизовывают из этанола, получая 0,103 г требуемого продукта в виде блестящих кристаллов (выход 83%), т.пл. 177-178 С; удельная активность (14 С) 55 мКи/ммол; спектр 1H-ЯМР (300 МГц, CDCl3):4,18 (с, 2 Н, СН 2), 7,40 (д, 1 Н, фенил, J=8,0 Гц), 7,48 (с,1 Н, фенил), 7,64 (т, 1 Н, фенил, J=8,0 Гц), 7,72 (д, 1 Н, фенил, J=7,6 Гц) м.д. Для синтеза 2-тиоксо-3-(3-трифторметилфенил)-5-[4-карбоксифенилметилен]-4-тиазолидинона (14 С-5) 14( C-CFTRinh-172) смесь 2-тиоксо-3-(3-трифторметилфенил)-4-тиазолидинона (14 С-5) (100 мг, 0,36 мМ) и 4-карбоксибензальдегида (54 мг, 0,36 мМ) в абсолютном спирте (1 мл) и пиперидине (1 капля) кипятят с обратным холодильником в течение 30 мин. Осадок желтого цвета отфильтровывают, промывают этанолом, сушат и перекристаллизовывают из этанола, получая 108 мг (выход 73%) кристаллов желтого цвета,т.пл. 180-182 С, удельная активность (14 С) 54 мКи/ммол; спектр 1 Н-ЯМР (300 МГц, DMSO-d6):7,78 (д,2 Н, карбоксифенил, J=8,2 Гц), 7,80-8,00 (м, 5 Н, трифторметилфенил и СН), 8,07 (д, 2 Н, карбоксифенил,J=8,31 Гц), 13,20 (с, 1 Н, СООН, D2O обменная вода) м.д. Очистку до величины 99,9% осуществляют путем повторных перекристаллизаций. Фармакокинетические исследования Болюс 14C-CFTRinh-172 (50 мкКи) в PBS, содержащем 3% ДМСО (обрабатывают с помощью NaOH,чтобы довести рН до 7,4) вводят внутривенно крысам в течение 1 мин (самцы крыс Sprague-Dawley, 360420 г) с помощью постоянного шейного катетера. Через определенные промежутки времени отбирают образцы крови. 14 С-радиоактивность определяют в плазме (выделяют из цельной крови центрифугированием при 14000g в течение 10 мин) путем подсчет сцинтилляций (Scintiverse SE, Fischer, Калифорния) с помощью счетчика LS-6500 Multi-Purpose Scintillation Counter (Beckman). Фармакокинетический анализ проводят с помощью программного обеспечения WinNonLin (Pharsight). Крыс после отбора финальных образцов крови/тканей умерщвляют большой дозой пентабарбитала. Все методики исследования животных были одобрены комитетом по изучению животных UCSF. Изучение распределения в тканях и вымывания Болюс 14C-CFTRinh-172 (2 мкКи) вводят мышам (самцы мышей CD1, 30-35 г) внутривенно в течение 1 мин через хвостовую вену. Мышей умерщвляют через 5, 30, 120 и 240 мин. Органы извлекают, взвешивают и гомогенизуют в дистиллированной воде (10-50 об.%). Радиоактивность определяют подсчетом сцинтилляций гомогенизатов (25-50 мкл) и выражают в виде общей 14 С-радиоактивности на каждый орган (или на грамм ткани для скелетных мышц). В одно и то же время берут образцы крови, мочи и желчи(из желчного пузыря или двенадцатиперстной кишки) и 14 С-радиоактивность измеряют и пересчитывают на 1 мл жидкости. Исследование вымывания проводят, отбирая пробы мочи и стула через 24 ч после введения 14C-CFTRinh-172. Проводят также изучение распределения в тканях для крыс, подготовленных для фармакокинетических исследований. Анализ метаболизма ингибитора Аликвоты выделенных из организма жидкостей (плазма крови, моча, желчь) и гомогената печени наносят в виде пятна на пластинки с силикагелем и проявляют методом тонкослойной хроматографии,применяя систему растворителей этилацетат:гексан:метанол (1:1:0,1), которая дает величину Rf0,5 для оригинального ингибитора. Ауторадиографию проводят с помощью Hyperfilm (Amersham), используя усилительную систему Transcreen LE (Kodak). Стандарты 14C-CFTRinh-172 добавляют во все планшеты. Измерения тока короткого замыкания (пример 7) Для проведения исследований с клетками вставки Snapwell, содержащие монослои клеток Т 84, помещают в систему камер Уссинга (Navicite, Harward Apparatus, Холлистон, Миннесота). Гемокамеры заполняют карбонатным раствором Кребса, содержащим (в мМ): NaCl 120, NaHCO3 25, KH2PO4 3,3,K2HPO4 0,8, MgCl2 1,2, CaCl2 1,2, глюкоза 10 (поддерживают при температуре 37 С), и постоянно барботируют смесью 5% СО 2/95% О 2. Буферный раствор с большим содержанием ионов K+ имеет состав (в мМ): NaCl 65, KCl 67,5, KH2PO4 1,5, CaCl2 1, MgCl2 0,5, HEPES 10, глюкоза 10. Буферный раствор с небольшим содержанием ионов Cl- имеет состав (в мМ): глюконат натрия 120, KH2PO4 3,3, K2HPO4 0,8,MgCl2 1,2, CaCl2 1,2, HEPES 10, глюкоза 10 (поддерживают при температуре 37 С), и через него постоянно барботируют воздух. Для проведения измерений на толстой кишке мышей мышей анестезируют внутрибрюшинным введением кетамина (40 мг/кг) и ксилазина (8 мг/кг). Подвздошную кишку извлекают, промывают охлажденным льдом раствором Кребса, вскрывают вдоль границы брыжейки и устанавливают в микрокамеру Уссинга (площадь 0,7 см 2, World Precision Instruments, Сарасота, Флорида). Для проведения измерений на кишечнике человека фрагменты толстой кишки отделяют от мышечных слоев прямым рассечением и размещают, как описано выше. Гемикамеры наполняют насыщенным кислородом- 21009847 бикарбонатным раствором Рингерса, содержащим 10 мкМ индометацина. Токи короткого замыкания измеряют, используя DVC-1000-вольтный зажим (от компании World Precision Instruments), с помощьюIn vivo секреция жидкости в кишечнике в мышиной и крысиной моделях (примеры 5 и 7) Мышам (возраст 8-10 недель, масса тела 25-53 г) с генетическим фоном CD1 в течение 24 ч дают воду, но не кормят. Мышей анестезируют, как указано выше, и температуру при проведении хирургической операции поддерживают в интервале 36-38 С с помощью подогреваемой подушечки. Чтобы обнажить тонкую кишку, делают небольшой абдоминальный разрез и закрытые петли подвздошной кишки(длина 20-30 мм) отделяют проксимально к слепой кишке путем наложения шва. В петли делают инъекции 100 мкл одного лишь PBS или PBS, содержащего холерный энтеротоксин (1 мкг). В некоторых экспериментах CFTRinh-172 (0-200 мкг) вводят внутрибрюшинной инъекцией в определенные промежутки времени до или после инъекции холерного энтеротоксина. Абдоминальный разрез закрывают с помощью шва и дают мышам восстановиться после анестезии. Через 6 ч мышей анестезируют, петли кишок временно выводят на поверхность тела и измеряют длину и массу петель после удаления брыжеечной и соединительной тканей. Для измерения индуцируемой холерным энтеротсксином секреции жидкости в закрытой крысиной модели самцов мышей Wistar (масса тела 200-250 г) анестезируют натрий пентобарбиталом (45 мг/кг). Петли (40-60 мм) выделяют и проводят инъекции одного лишь PBS или PBS, содержащим холерный энтеротоксин (10 мкг) или токсин STa (0,1 мкг). В некоторых экспериментах CFTRinh-172 (200 мкг) вводят внутрибрюшинной инъекцией после инъекции холерного энтеротоксина или токсина STa. Длину и массу петель измеряют через 3 ч (STa) или через 6 ч (холерный энтеротоксин). При исследовании перорально введенного CFTRinh-172 используют мышиную модель с раскрытой петлей, в которой мышам через зонд перорально вводят 7%-ный бикарбонатный буферный раствор, или только холерный энтеротоксин (1 мкг в 7%-ном бикарбонатном буферном растворе), или холерный энтеротоксин вместе с CFTRinh-172 (200 мкг в витамине Е TPGS, см. ниже), используя орогастрическую иглу для инъекционного питания. Через 6 ч тонкую кишку (от пилоруса до слепой кишки) выводят на поверхность тела и освобождают от брыжеечной и соединительной тканей. Кишку взвешивают, затем продольно вскрывают для удаления из полости жидкости и снова взвешивают для количественной оценки накопления жидкости. Исследование проницаемости Сасо-2 Клетки Сасо-2 культивируют на пористых ставках и получают монослои с сопротивлением 400-600 см-1. Для исследования транспорта ионов культуральную среду заменяют равным объемом буферного солевого раствора Ханка (HBSS), содержащего 15 мМ глюкозы и 25 мМ HEPES (рН 7,3). Через 1 ч в верхнюю камеру добавляют CFTRinh-172 (25 мкМ) и планшеты осторожно встряхивают при температуре 37 С. В определенные промежутки времени берут по 50 мкл раствора из нижней (принимающей) камеры для определения концентрации CFTRinh-172 по УФ-поглощению (385 нм). Кажущуюся проницаемость(Рарр) вычисляют по уравнению Рарр=dC/dT X (Vr/ACO), где dC/dT обозначает скорость возрастания концентрации CFTRinh-172 в принимающей камере, Vr обозначает объем принимающей камеры, А обозначает площадь монослоя, а СО обозначает исходную концентрацию CFTRinh-172 в подающей камере. Фармакокинетические исследования и изучение пероральной биодоступности Мышей быстро анестезируют с помощью галотрана и через зонд перорально вводят 14 С-меченныйCFTRinh-172 (12 мкКи), солюбилизованный витамином Е TPGS (dтокоферил полиэтиленгликоль 1000 сукцинат, 0,5% мас./об., CFTRinh-172 в 10% мас./об. суспензии TPGS в воде). Для сравнения другим мышам внутривенно вводят 14C-CFTRinh-172 (2 мкКи) вливанием в хвостовую вену. Образцы крови берут из хвостовой вены в определенные промежутки времени для измерения радиоактивности 14 С в плазме. Через 6 ч мышей умерщвляют большой дозой пентобарбитала и извлекают органы для определения радиоактивности в гомогенатах. Биологический пример 1. Отбор ингибиторов CFTR. Первичная методика отбора, которую применяют для идентификации соединений по настоящему изобретению, разработана с целью идентификации ингибиторов Cl- проводимости CFTR за счет прямого взаимодействия CFTR-ингибитор. Предварительно CFTR стимулируют в клетках FRT, экспрессирующихCFTR, с помощью активирующего коктейля, содержащего форсколин, IBMX и апигенин, как схематично показано на фиг. 1 А. Активация CFTR по множественному механизму (повышение уровня цАМФ, ингибирование фосфодиэстеразы и прямое связывание CFTR) позволяет идентифицировать ингибиторы, которые активны за счет прямого блокирования пути переноса CFTR Cl-, а не за счет большего количества проксимальных шагов на пути передачи сигнала. Клетки FRT коэкспрессируют Cl-/I- сенсор на основе желтого флуоресцентного белка, который позволяет провести количественную оценку эффективности ингибирования (см., в частности, Jayaraman et al., 2000, J. Biol. Chem., 275: 6047-6050; Galietta et al., 2001,Am. J. Physiol. 281: C1734-C1742). После предварительно стимуляции CFTR и добавления соединения в клетках формируют направленный внутрь градиент ионов I- с тем, чтобы обеспечить приток ионов I- и- 22009847 получить уменьшение уровня флуоресценции. Каждый анализ состоит из регистрации в течение 2 с базового уровня флуоресценции, за которым в течение 12 с следует непрерывное регистрация флуоресценции после быстрого добавления раствора, содержащего ионы I-. Соединения тестируют отдельно с концентрацией 10 мкМ по 96-луночному формату с помощью полностью автоматизированного высокопроизводительного устройства для скрининга (см. пример 2 внизу). На фиг. 1 В приведены графики характерных кривых, на которых показаны относительные величины флуоресценции YFP от времени для первичного отбора 50000 соединений с помощью анализа, приведенного на фиг. 1 А. Как количественно оценивают по углу наклона уменьшающейся флуоресценции после добавления ионов I-, 49993 соединения не оказывают значительного влияния на кинетику притока ионов I- (10% уменьшения угла наклона). Семь соединений дают небольшое уменьшение отрицательного угла наклона (10-52%), и практически все они имеют сходное центральное ядро, включающее 2 тиоксо-4-тиазолидиноновый гетероцикл с замещенными фенилметиленовым и фенильным фрагментами(см. фиг. 1 С). Затем проводят отбор более чем 250 аналогов, имеющих тиазолидиноновую структуру центрального ядра, с целью идентифицировать наиболее действенные ингибиторы CFTR. Как показано на фиг. 1D, наиболее эффективными тиазолидиноновыми ингибиторами CFTR, идентифицированными при отборе, являются 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4 тиазолидинон (в данном описании обозначают как CFTRinh-172) вместе с пятью его аналогами, обладающими сходной действенностью при ингибировании. Таким образом, в качестве ингибиторов CFTR идентифицируют 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинон (CFTRinh-172); 3-[(3 трифторметил)фенил]-5-[(4-нитрофенил)метилен]-2-тиоксо-4-тиазолидинон (CFTRinh-020); 3-[(3-трифторметил)фенил]-5-[(4-оксикарбоксифенил)метилен]-2-тиоксо-4-тиазолидинон (CFTRinh-029); 3-[(3-трифторметил)фенил]-5-[(3,4-дигидроксифенил)метилен]-2-тиоксо-4-тиазолидинон (CFTRinh-185); 3-[(3-трифторметил)фенил]-5-[(3,5-дибром-4-гидроксифенил)метилен]-2-тиоксо-4-тиазолидинон (CFTRinh-214) и 3-[(3-трифторметил)фенил]-5-[(3-бром-4-гидрокси-5-нитрофенил)метилен]-2-тиоксо-4-тиазолидинон (CFTRinh-236). Наиболее эффективные ингибиторы CFTR содержат одну или несколько электроноакцепторных групп, таких как 3-трифторметильная группа, в кольце 1 и электроноакцепторную группу или полярные растворители в кольце 2, как указано выше. CFTRinh-172 отбирают для дальнейшего анализа. Получены следующие значения относительных величин действенности агентов при ингибировании: 0,2 (CFTRinh020), 0,3 (CFTRinh-029), 1,0 (CFTRinh-172), 0,2 (CFTRinh-185), 0,1 (CFTRinh-214) и 0,1 (CFTRinh-236). С целью изучения влияния, которое оказывает расположение трифторметильных и карбоксильных заместителей в кольце, было синтезировано 8 аналогов CFTRinh-172, в которых заместители смещались относительно уникального положения в кольцах 1 (трифторметильная группа) и 2 (карбоксильная группа). По сравнению с CFTRinh-172 (действенность 1,0) относительные величины действенности при ингибировании для аналогов 3-[(а-трифторметил)фенил]-5-[(b-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинона составляют: 0,69 (а=2, b=2), 0,70 (2, 3), 0,66 (2, 4), 0,74 (3, 2), 0,90 (3, 3), 0,67 (4, 2), 0,64 (4, 3) и 0,56 (4, 4). Биологический пример 2. Определение свойств CFTRinh-172. Уровень ингибирования CFTR для конкретных дозировок тиазолидиноновых соединений по настоящему изобретению определяют с помощью анализа флуоресцентности, приведенного на фиг. 1 А и описанного выше. На фиг. 2 А представлены данные для CFTRinh-172 в зависимости от дозы как относительные величины флуоресценции YFP в зависимости от времени. Значительное ингибирование CFTR наблюдается при концентрациях 0,3-0,6 мкМ указанного тиазолидинонового соединения. Из фиг. 2 В следует, что ингибирование под действием CFTRinh-172 (показано графически в виде относительной скорости транспорта от времени после введения или при вымывании) заканчивается в течение приблизительно 10 мин (t1/2 составляет 4 мин) и обращается после вымывания со значением t1/2, равным приблизительно 5 мин (вставка). Относительные величины скорости транспорта, приведенные на фиг. 2 С, показывают, что CFTRinh-172 эффективно ингибирует активацию CFTR под действием различных типов агонистов, которые не были включены в состав активирующего коктейля, применявшегося при исходном отборе. Указанные агонисты включают генистеин, СРТ-сАМР, СРХ, 8-МРО и такой действенный бензофлавоновый активатор CFTR, которым является UCCF-029 (бисульфат 2-(4-пиридиний)бензо[h]-4 Н-хромен-4-она), и такой бензимидазолоновый активатор CFTR, как UCCF-853 (см. Galietta et al., 2001, J. Biol.Chem., 276: 19723-19728). С целью определения действенности при ингибировании и специфичности CFTRinh-172 проводят также электрофизиологические эксперименты. Фиг. 3 А показывает быстрое, зависимое от дозы подавление тока короткого замыкания в клетках FRT, экспрессирующих CFTR, при добавлении CFTRinh-172 в раствор, омывающий апикальную поверхность клеток. Фиг. 3 В показывает средние значения зависимости ингибирования от дозы для CFTRinh-172 (Kd300 нМ, коэффициент Хилла 1) и глибенкламида(Kd200 мкМ), которые испытывают в идентичных условиях. Сходную действенность при ингибировании для указанных тиазолидинонов обнаруживают в клетках, естественно экспрессирующих дикий тип CFTR, включая клетки Т 84 и первичные культуры клеток эпителия бронхов человека, а также в трасфицированных клетках FRT, экспрессирующих G551D-CFTR иF508-CFTR (после низкотемпературной коррекции). С целью проведения исследования в клетках брон- 23009847 хов Na+-канал блокируют амилоридом таким образом, что величина тока, соответствующая базовой линии, сильно зависит от CFTR. После максимальной активации CFTR с помощью СРТ-сАМР воздействиеCFTRinh-172 с апикальной стороны сильно подавляет ток короткого замыкания (фиг. 3 С, слева). CFTRinh172 также сильно подавляет ток короткого замыкания при введении с базолатеральной стороны (фиг. 3 С,справа). Величины токов на всей мембране измеряют в клетках FRT, экспрессирующих CFTR, как показано на фиг. 3D. Стимулирование действием 5 мкМ форсколина вызывает ток в мембране, равный 38147 пА/пФ(n=4) при +100 мВ (полная емкость мембраны 213 пФ). Зависимость тока от напряжения является линейной, что можно было бы ожидать для чистого потока CFTR (фиг. 3F). Внеклеточное вливание раствора 2 мкМ CFTRinh-172 вызывает быстрое снижение величины тока на всех мембранных потенциалах, на основании чего можно сделать вывод, что ингибирование CFTR не зависит от напряжения. Отсутствие зависимости блокировки канала от напряжения подтверждают при использовании низких концентрацийCFTRinh-172 (0,2 мкМ), получая 50%-ное ингибирование (фиг. 3F). Исследуют также специфичность CFTRinh-172 при ингибировании CFTR. Изучают два не связанных с CFTR Clканала. CFTRinh-172 с концентрацией 5 мкМ не ингибирует Са 2+-активированную секрецию ионов Cl-, которую вызывают добавлением UTP (100 мкМ) в апикальный промывочный раствор в поляризованных эпителиальных клетках бронхов человека (фиг. 4 А). Максимальные величины UTP-зависимого короткого замыкания составляют 9,90,5 мкА/см 2 и 10,00,2 мкА/см 2, соответственно, в отсутствие и в присутствии CFTRinh-172 (SE, n=4). CFTRinn-172 при концентрации 5 мкМ не подавляет также активированных в объеме потоков Cl-, которые вызывают в клетках FRT путем внеклеточного смачивания гипотоническим раствором 250 мОсм/кг (фиг. 4 В). Активность гомолога CFTR, АТФ-связывающего кассетного переносчика MDR-1 (белок множественной лекарственной устойчивости-1), измеряют в 9HTEo-/Dx, где наблюдается сверхэкспрессия MDR1 (Rasola et al., 1994, J. Biol. Chem. 269: 1432-1436). Накопление винкристина, которое обратно пропорционально вытеснению активного лекарства под действием MDR-1, сильно возрастает под влиянием ингибитора верапамила (100 мкМ) (фиг. 4 С). CFTRinh-172 (5 мкМ) не оказывает воздействия на накопление винкристина и, таким образом, не ингибирует MDR-1. Другим гомологом CFTR является рецептор сульфонилмочевины (SUR), который регулирует активность АТФ-чувствительных K+-каналов (K-АТФ-каналов) (Aguilar-Bryan and Bryan 1999 Endocr. Rev. 20: 101-135). SUR1 экспрессируется -клетками поджелудочной железы, где он контролирует мембранный потенциал и высвобождением инсулина. Сульфонилмочевины, такие как глибенкламид, вызывают высвобождение инсулина (и гипогликемическую ответную реакцию) за счет блокирования K-АТФканалов и деполяризации мембраны. С целью определения, блокирует ли CFTRinh-172 также и K-АТФканалы, измеряют мембранный потенциал в клеточной линии INS-1 -клеток поджелудочной железы крысы (фиг. 4D, 4 Е). В отличие от значительной мембранной деполяризации, вызываемой глибенкламидом, CFTRinh-172 (2 и 5 мкМ) не вызывает деполимеризацию мембранного потенциала. CFTRinh-172 с концентрацией 5 мкМ вызывает небольшую гиперполимеризацию, которая значительно меньше, чем гиперполимеризация, вызываемая активатором K-АТФ-каналов диазоксидом (100 мкМ). Дополнительные исследования показывают, что CFTRinh-172 с концентрацией 5 мкМ не блокирует водный канал(AQP1), переносчик мочевины (UT-B), ионообменник Na+/H+ (NHE3) и ионообменник Cl-/НСО 3- (АЕ 1). Дальнейший анализ показывает, что 5 мкМ CFTRinh-172 не оказывает воздействия на продукцию цАМФ клетками или активность фосфатазы. В клетках FRT базальное содержание цАМФ составляет 22522 фмоль/ячейка, которое возрастает через 30 мин после стимуляции 20 мкМ форсколина до величины 1290190 фмоль/ячейка (без ингибитора) и 114050 (+CFTRinh-172) (n=3). Как можно заключить из анализа с использованием дигидрородамина, CFTRinh-172 с концентрациями вплоть до 100 мкМ не является токсичным по отношению к клеткам FRT по прошествии 24 ч. У мышей внутривенная инъекция 1000 мкг/кг CFTRinh-172 ежедневно в течение 7 дней не вызывает явной токсичности. Потребление воды не уменьшилось, а концентрация в сыворотке электролита, уровень глюкозы, индекс функционирования печени, концентрация в сыворотке креатинина, амилазы и гематокрита не изменились. Кроме того, разовая очень большая системная доза CFTRinh-172 (10 мг/кг) не вызывает явной токсичности. Биологический пример 3. Эффективность in vivo. Эффективность CFTRinn-172 испытывают in vivo с помощью двух анализов по секреции жидкости в кишечнике, индуцируемой холерным энтеротоксином, и в изолированной кишке по методу измерения тока короткого замыкания. В первом анализе in vivo формируют серию закрытых петель тонкой кишки и в полости чередующихся петель вводят инъекции небольших объемов физиологического раствора или физиологического раствора, содержащего холерный энтеротоксин. Накопление жидкости в полости определяют через 6 ч. Как видно из фиг. 5 А, заметное накопление жидкости и вздутие наблюдаются в петлях, подвергнутых воздействию холерного энтеротоксина, в то время как соседние контрольные (с физиологическим раствором) петли остаются пустыми. Однократное введение CFTRinn-172 (150 мкг/кг внутрибрюшинно) перед вливанием холерного энтеротоксина эффективно препятствует накоплению жидкости в кишечных петлях, подвергнутых воздействию холерного энтеротоксина.- 24009847 Результаты, полученные в серии указанных экспериментов, графически суммированы на фиг. 5 В.CFTRinh-172 значительно снижает секрецию жидкости до уровня в контрольных петлях с физиологическим раствором, в то время как неактивный аналог тиазолидинона не ингибирует секрецию жидкости. Как следует из ранее полученных данных (Gabriel et al., 1994, Science 266: 107-109), подвергнутые воздействию холерного энтеротоксина кишечные петли, полученные от гомозиготных мышей F508-CFTR,также остаются пустыми, указывая на то, что CFTR принимает участие в секреции жидкости в кишечнике. Во втором анализе секрецию жидкости в кишечнике индуцируют пероральным введением холерного энтеротоксина (10 мкг), a CFTRinh-172 вводят системно. Через 6 ч наблюдается явное накопление жидкости, что измеряют путем взвешивания всей тонкой кишки целиком. Ведение CFTRinh-172 заметно уменьшает накопление жидкости в кишечнике, что наблюдают визуально и количественно оценивают по отношению массы кишки до и после удаления жидкости из ее полости (фиг. 5 С). На фиг. 5D показано подавление под действием CFTRinn-172 тока короткого замыкания сквозь не подвергавшуюся воздействию слизистую оболочку толстой кишки крысы. После ингибирования потокаNa+ амилоридом форсколин приводит к заметному увеличению тока короткого замыкания. CFTRinh-172,добавленный к слизистому раствору, подавляет ток короткого замыкания с большей эффективностью,чем в том случае, когда его добавляют в серозный раствор, что может быть связано с ухудшением доступа к клеткам эпителия толстой кишки через остаточную подслизистую ткань. Добавление 5 мкМCFTRinh-172 лишь в слизистый раствор снижает ток короткого замыкания на 80%. Эти результаты дают электрофизиологические доказательства того, что CFTFinh-172 ингибирует CFTR Clканал в кишечнике. Биологический пример 4. Фармакокинетический анализ. Фармакокинетический анализ у крыс проводят в виде серии измерений 14 С-радиоактивности после однократного внутривенного вливания болюса 14 С-меченного CFTRinh-172. Общее количество веденного ингибитора (400 мкг, 1 мг/кг) эффективно в качестве средства против диареи у крыс. Фиг. 7 показывает,что кинетика 14 С-радиоактивности в сыворотке хорошо согласуется с 2-камерной моделью, при этом объем распределения составляет 1,2 л, а величина AUC (площадь под кривой) составляет 3,8 мкгч/мл. Полупериоды времени составляют 0,14 ч (перераспределение) и 10,3 ч (удаление). Никаких следов 14 Смеченного CFTRinh-172 не обнаруживается в плазме через 72 ч после введения или же в гомогенатах печени или почки через 14 дней после введения. Распределение 14 С-меченного CFTRinh-172 в тканях определяют из радиоактивности гомогенатов органов и выделенных из организма жидкостей после однократного вливания болюса. На фиг. 8 в группе данных А суммированы распределения 14 С в основных органах мышей в указанное время, прошедшее после вливания CFTRinh-172. Через 5 мин 14 С-радиоактивность обнаруживается, главным образом, в печени и почках и уменьшается с течением времени. Незначительная радиоактивность обнаруживается в мозге,сердце, скелетных мышцах и яичках. Через более длительные промежутки времени (30-240 мин) 14 С-радиоактивность аккумулируется в кишечнике. На фиг. 8 в группе данных В показано аналогичное распределение 14 С-радиоактивности у крыс, измеренное через 60 мин после внутривенного вливания болюса,при этом небольшая радиоактивность обнаруживается в мозге, сердце и скелетной мышце. В некоторых экспериментах крыс умерщвляют через 10 дней после вливания 14 С-меченного CFTRinh-172 (50 мкКи). С целью установления механизма накопления CFTRinh-172 в почке, печени и кишечнике 14 Срадиоактивность измеряют в сыворотке крови, моче и желчи. Средняя радиоактивность в моче мышей через первые 2 ч после вливания составляет 4,21,2105 отсчетов в минуту на миллилитр. Величина отношения 14 С-радиоактивности в моче к 14 С-радиоактивности в крови составляет в интервале 5-7:1 и сопоставима с отношением величины осмолярности мочи к осмолярности сыворотки, которая составляет в интервале 5:1 (1550 мОсм против 310 мОсм), и из этого можно предположить, что вымывание CFTRinh172 осуществляется почками посредством клубочковой фильтрации без абсорбции или секреции в почечных канальцах. Механизм выведения CFTRinh-172 посредством вымывания почками подтверждается приблизительно параллельным кинетическим снижением 14 С-радиоактивности в сыворотке крови, моче и ткани почки (данные не представлены). Возможность накопления CFTRinh-172 в желчи изучают на основе наблюдаемого быстрого накопления 14 С-радиоактивности в печени и позднее накопления в кишечнике. Через 60 мин после введения мышам концентрация 14 С-радиоактивности в желчи приблизительно в 9 раз превосходит концентрацию 14 С-радиоактивности в крови. Для определения того, выделяется лиCFTRinh-172 из желчи вместе со стулом или продолжает циркулировать, отбирают образцы мочи и желчи у мышей через первые 24 ч после вливания содержащего радиоактивную метку ингибитора. 933% выделенной вместе с испражнениями радиоактивности обнаруживают в моче, и это заставляет предположить, что основным механизмом выделения в почках является гепатоэнтеральная циркуляция. С целью определения того, соответствует ли 14 С-радиоактивность, измеренная в органах и жидкостях, исходному или химически модифицированному CFTRinh-172, методом тонкослойной хроматографии и ауторадиографии проводят исследования образцов мочи, сыворотки крови и желчи, а также жидкостей над осадком гомогенатов печени, выделенных центрифугированием. На фиг. 9 показано одно пятно с величиной Rf0,5 для исходного CFTRinh-172, который вводят посредством вливания болюса. Ауторадиография жидкости и гомогенатов органов показывает единственное пятно с идентичным значе- 25009847 нием Rf, и это указывает на то, что CFTRinh-172 химически не модифицируется.CFTRinh-172 является слабой кислотой с величиной pKa, равной 5,5, что определяют спектрофотометрическим рН титрованием. При значении рН 1% в физиологических условиях CFTRinh-172 присутствует в виде неионизованной кислоты, обладающей низкой полярностью и высокой способностью проникать через мембраны. Быстрое поглощение CFTRinh-172 в рассмотренных выше моделях клеток позволяет сделать вывод о возможности разработки биодоступных пероральных препаратов, но при этом необходимо учитывать, что во избежание осаждения может потребоваться защита препаратов от низкого значения рН в желудке. Результаты указанных фармокинетических исследований показывают, что CFTRinh172 медленно выводится грызунами посредством очистки почками, не претерпевая химической модификации, и что CFTRinh-172 концентрируется в желчи и накапливается в кишечнике. CFTRinh-172 не в состоянии в значительном количестве преодолевать гематоэнцефалический барьер, и небольшое количество CFTRinh-172 было обнаружено в других жизненно важных органах, включая сердце, легкое, скелетную мышцу, яички. Медленное выделение из почек, накопление в печени и низкая способность CFTRinh-172 проникать через гематоэнцефалический барьер благоприятны для применений против диареи. Биологический пример 5. Ответная реакция в зависимости от дозы и продолжительность ингибирующего воздействия CFTRinh-172. Данный пример приводится с целью дальнейшего расширения приведенных выше наблюдений, касающихся способности однократной внутрибрюшинной инъекции CFTRinh-172 ингибировать вызываемую холерным энтеротоксином секрецию в модели закрытой кишечной петли у мышей. Если более конкретно, то цель данного примера заключается в определении зависимости ответной реакции от дозы и установление кажущегося полупериода устойчивости ингибирующего эффекта CFTRinh-172. Во-первых, с целью установления свойств мышиной модели определяют кинетику абсорбции и секреции жидкости внутри кишки. Для изучения абсорбции содержание жидкости в петле измеряют в определенные промежутки времени после введения в индивидуальные петли инъекции 200 мкл PBS. На фиг. 10 группа данных А показывает быструю абсорбцию жидкости, при этом через 25 мин остается 50% жидкости. Внутрибрюшинное введение CFTRinh-172 с дозой, которая в значительной степени ингибирует индуцируемую холерным энтеротоксином секрецию жидкости (20 мкг), не изменяет скорость абсорбции жидкости (измеренную через 30 мин) по сравнению с контролями (фиг. 10, группа данных А,вставка). Для изучения секреции в петли кишки водят инъекции холерного энтеротоксина (1 мкг в 0,1 млPBS). На фиг. 10 группа данных В показывает медленное начало секреции жидкости через 6 ч, что соответствует ранее проведенным исследованиям на моделях грызунов (Gorbach et al., J. Clin. Invest. 1971, 50881-889; Oi et al., Proc. Natl. Acad. Sci. USA 2002, 99: 3042-3046). Быстрая абсорбция жидкости в кишечнике в нормальных условиях свидетельствует о том, что жидкость, накопившаяся в полости кишки после активной секреции, может быстро абсорбироваться, если секреция блокируется, и указывает на то, что ингибирование CFTR может быть эффективным для предотвращения накопления жидкости даже после введения холерного энтеротоксина. Группа данных А на фиг. 11 суммирует результаты изучения ответной реакции от дозы CFTRinh-172 у мышей, которым разовую дозу ингибитора вводят внутрибрюшинной инъекцией сразу же после вливания холерного энтеротоксина в закрытые кишечные петли. Базовое содержание жидкости (пунктирная линия), которое измеряют в петлях, не подвергавшихся воздействию холерного энтеротоксина, приблизительно равно нулю. CFTRinh-172 ингибирует накопление жидкости в петлях кишки, обработанных холерным энтеротоксином, приблизительно на 90%, при этом 50%-ное ингибирование достигается при введении 5 мкг CFTRinh-172 (150 мкг/кг). Продолжительность ингибирования измеряют в процессе исследования зависимости ответной реакции от дозы, за исключением того, что разовую дозу 20 мкгCFTRinh-172 вводят в различные периоды времени до или после введения холерного энтеротоксина. Группа данных В на фиг. 11 показывает значительное ингибирование накопления жидкости в полости в том случае, когда CFTRinh-172 вводят в течение 3 ч до или после введения холерного энтеротоксина. Однако значительно меньшее ингибирование наблюдается за 6 ч до введения холерного энтеротоксина. Принимая во внимание продолжительность действия холерного энтеротоксина, составляющее 6 ч, что устанавливают с помощью провокационной пробы, величина t1/2 устойчивости ингибирования под действием CFTRinh-172 составляет 9-10 ч. Биологический пример 6. Пероральная биодоступность CFTRinh-172. Для исследования эффективности против диареи перорально введенного CFTRinh-172 определяют фармакокинетику CFTRinh-172 у мышей и измеряют перенос CFTRinh-172 через монослои Сасо-2. Поскольку CFTRinh-172 является относительно неполярной слабой кислотой (pKa 5,5), которая, как можно ожидать, будет выпадать в осадок в желудке, то пероральное введение осуществляют с помощью двух агентов, которые обычно используют с целью солюбилизации лекарств, предназначенных для перорального введения, - витамина Е TPGS и циклодекстрина. Измерения проводят с использованием 14 Смеченного CFTRinh-172. Группа данных С на фиг. 11 показывает фармакокинетику 14C-CFTRinh-172 после перорального введения по сравнению с внутривенным введением у мышей. Внутривенное введение приводит к первоначально высоким концентрациям в сыворотке крови, которые уменьшаются в течение 30 мин (перерас- 26009847 пределение в тканях), в то время как радиоактивность в сыворотке низкая сразу же после перорального введения, достигает пикового значения через 60-90 мин, а затем снижается. Группа данных D на фиг. 11 суммирует распределение 14C-CFTRinh-172 в органах через 6 ч после перорального и внутривенного введения и показывает накопление в желудочно-кишечном тракте, а также в печени и почках. 14 С-радиоактивность концентрируется в желчи приблизительно в 10 раз больше, чем в сыворотке, при этом незначительно количество 14 С-радиоактивность выводится вместе со стулом (10% от общего количества радиоактивности, выделившейся за период 24 ч), что заставляет предположить, что накопление CFTRinh-172 в кишечнике осуществляется посредством гепатоэнтеральной циркуляции. Сравнение перорального и внутривенного введения CFTRinh-172 (содержание в тканях/сыворотке через 4-6 ч) показывает, что величина пероральной биодоступности CFTRirih-172 в препаратах TPGS составляет 15-20%. Группа данных F на фиг. 11 показывает линейное возрастание количества CFTRinh-172 по другую сторону монослоев Сасо-2 и позволяет установить, что величина коэффициента проницаемости дляCFTRinh-172 составляет 1610-6 см/с. Полученное значение укладывается в диапазон, полученный для разнообразных перорально назначаемых лекарств (в частности, 3610-6 см/с для пиндолола и 4810-6 см/с для силденафила) (Stenberg et al., J. Med. Chem., 2001, 44: 1927-1937). Биологический пример 7. Ингибирование цГМФ- и цАМФ-опосредованной секреции жидкости. Для определения эффективности CFTRinh-172 при ингибировании цГМФ- и цАМФ-опосредованной секреции жидкости, а также для исследования эффективности CFTRinh-172 в альтернативной животной модели используют in vivo крысиную модель закрытой петли. Рецептор гуанилилциклазы С экспрессируется кишечными клетками крысы и позволяет связать токсин STa и повысить уровень цГМФ (Mann etal., Biochem. Biophys. Res. Commun., 1997, 239: 463-466). Было показано, что через 3 ч токсин STa вызывает секрецию жидкости в подвздошной кишке крыс (Cohen et al., Am. J. Physiol., 1989, 257: G118-123).CFTRinh-172 предотвращает индуцируемую холерным энтеротоксином секрецию жидкости в кишечных петлях крыс (фиг. 12, группа данных А) с дозой (600 мкг/кг), которая эффективна для мышей. Чтобы вызвать индуцируемую токсином STa секрецию жидкости, в кишечные петли вводят инъекции токсина STa(0,1 мкг в 300 мкл PBS) и петли взвешивают через 3 ч. Группа данных В на фиг. 12 показывает 75%-ное ингибирование секреции жидкости в кишечнике под действием CFTRinh-172. Измерения тока короткого замыкания проводят для эпителиальных слоев мыши и человека с целью оценки ингибирования трансэпителиальной секреции ионов под действием CFTRinh-172. Группа данных А на фиг. 13 показывает ингибирование в зависимости от дозы CFTRinh-172 тока короткого замыкания в подвздошной кишке мыши после стимулирования фосколином или токсином STa (вставка). 50%-ное ингибирование обнаруживают для концентрации 5 мкМ CFTRinh-172 как для цГМФ-, так и цАМФопосредованной секреции хлорида. Группа данных В на фиг. 12 показывает действенность CFTRinh-172 при подавлении тока короткого замыкания в толстой кишке человека. Неожиданно обнаруживают, что кажущаяся действенность CFTRinh-172 при ингибировании тока короткого замыкания в кишечнике (2-5 мкМ) была значительно меньше, чем найденная при электрофизиологических исследованиях, которые проводят на нескольких клеточных линиях, включая FRT-клетки,экспрессирующие CFTR (0,2-0,5 мкМ), и клетки Calu-3 (0,5 мкМ). Приводится несколько объяснений этому различию, в том числе за счет различия в типе клеток, ограниченного доступа CFTRinh-172 к кишечным клеткам для исходного состояния кишечника, влияния мембранного потенциала (внутренний отрицательный клеточный потенциал снижает концентрацию [CFTRinh-172]) и конкурентного взаимодействия между АТФ и CFTRinh-172. С целью изучения указанного феномена проводят измерение тока короткого замыкания на эпителиальных клетках Т 84 толстой кишки. В типичных экспериментах на фиг. 14 для группы данных А показано, что, как установлено с помощью высокопроизводительного метода отбора, 3 мкМ CFTRinh-172 вызывает 50%-ное подавление тока короткого замыкания в непермеабилизованных монослоях клеток Т 84 после стимуляции с помощью форсколина, являющимся агонистом цАМФ (слева), с помощью 8-BrcGMP, являющимся проницаемым для клеточным аналогом ГМФ (посредине), или с помощью CFTRinh16, являющимся прямым активатором CFTR хлоридной проводимости. С целью определения того, необходимы ли нетронутые клетки для относительного снижения действенности CFTRinh-172 в клетках Т 84,измерение тока короткого замыкания проводят после пермеабилизации клеточной базолатеральной мембраны амфотерицином В и в присутствии градиента ионов Cl- (с целью генерирования токов, которые могут быть измерены). На фиг. 14 группа данных В (слева) показывает значительно большую действенность CFTRinh-172 при ингибировании тока короткого замыкания после пермеабилизации. Данные зависимости ответной реакции от дозы, которые суммарно представлены на фиг. 14 для группы данных В(посредине), указывают на снижение кажущегося значения KI для ингибирования под действиемCFTRinh-172 в диапазоне от 3 до 0,3 мкМ после пермеабилизации клеток. Для исследования того, является ли снижение действенности CFTRinh-172 в нетронутых клетках следствием внутреннего отрицательного мембранного потенциала (снижение концентрации [CFTRinh-172] в цитоплазме по сравнению с внешней средой), измерения тока короткого замыкания проводят на клетках Т 84 после деполяризации с помощью промывочного базолатерального раствора с большим содержанием ионов K+. На фиг. 14 груп- 27009847 па данных С показывает, что увеличенная действенность CFTRinh-172 (KI0,3 мкМ) восстанавливается в деполяризованных клетках, указывая на то, что мембранный потенциал важен для эффективностиCFTRinh-172. На основании представленных выше данных можно ожидать, что тиазолидиноновые соединения по настоящему изобретению, представленные соединением CFTRinh-172, обладают антидиарейной эффективностью в индуцируемых энтеротоксином секреторных диареях, вызываемых энтеротоксигенными организмами, такими как Е. coli и Vibrio cholerae при диареях, связанных с холерой, комплексом Трэвеллера и СПИД-связанным комплексом. Ингибирование CFTR может быть применено в качестве вспомогательной терапии диареи, вызванной энтероинвазивными бактериями, такими как виды Clostridium difficile и Salmonella; однако, повреждение слизистой оболочки, вызываемое указанными организмами, не будет уменьшаться при ингибировании CFTR. Аналогично, нельзя предполагать, что ингибирование CFTR приведет к коррекции патологии, лежащей в основе воспалительного заболевания кишечника, но оно может уменьшить объем секреции жидкости в кишечнике. Последние данные свидетельствуют о том, что секреция жидкости, вызываемая диареями под действием вирусов, таких как ротавирусы, может включать другие механизмы, такие как Са 2+-опосредованные Clканалы, хотя роль CFTR в секреции жидкостей остается неизвестной и,таким образом, может быть исследована в подходящих животных моделях с помощью соединений по настоящему изобретению. Если коротко, то соединения CFTRinh-172, представляющее собой тиазолидиноновый блокатор дляCFTR, предотвращает цАМФ- и цГМФ-индуцируемую секрецию ионов/жидкости в тканях грызунов и тканях человека, не оказывая влияния на абсорбцию жидкости в кишечнике. Его благоприятный фармакологический профиль и профиль его активности способствуют дальнейшему расширению его применения против диареи. Хотя настоящее изобретение было описано со ссылкой на конкретные варианты его осуществления,для специалистов в данной области техники должно быть понятно, что могут быть проведены различные изменения и внесены эквивалентные замены, которые не приводят к изменению сущности и объема притязаний по настоящему изобретению. Кроме того, могут быть осуществлены многие модификации с тем,чтобы адаптировать конкретную ситуацию, вещество, композицию соединений, способ, отдельную стадию или стадии способа к цели, сущности и объему притязаний по настоящему изобретению. Предполагается, что все подобные модификации входят в объем приведенной далее формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения субъекта, у которого наблюдается состояние, опосредованное белкомрегулятором трансмембранной проводимости при муковисцидозе (CFTR), поддающееся лечению путем ингибирования ионного транспорта, опосредованного CFTR, при этом способ включает введение субъекту терапевтически эффективного количества соединения формулы (Ib) где X1 представляет собой трифторметил; Х 2 и Х 3 независимо выбирают из водорода и атома галогена;Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8 алкильной группы, Cl-С 7 алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой соли в виде индивидуального стереоизомера или их смеси. 2. Способ по п.1, где состояние представляет собой увеличенную сверх нормы секрецию в кишечнике. 3. Способ по п.2, где состояние представляет собой секреторную диарею. 4. Способ по п.1, где соединение формулы (Ib) представляет собой 3-[(3-трифторметил)фенил]-5[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинон. 5. Способ по п.1, где X1 расположен во 2, 3 или 4 положении фенильной группы, к которой он присоединен. 6. Способ по п.1, где Y2 выбирают из гидроксильной, карбоксильной группы, нитрогруппы, карбонатной группы и галогена. 7. Способ по п.5, где трифторметильная группа расположена в 3 положении. 8. Способ по п.1, где Y2 является гидроксильной группой. 9. Способ по п.8, где Y1 является гидроксильной группой. 10. Способ по п.8, где Y1 является атомом брома. 11. Способ по п.8, где Y3 является нитрогруппой. 12. Способ по п.1, где соединение формулы (Ib) выбирают из 13. Способ ингибирования в клетке субъекта активности белка-регулятора трансмембранной проводимости при муковисцидозе, который включает контактирование клетки с соединением формулы (Ib) где X1 представляет собой трифторметил; Х 2 и Х 3 независимо выбирают из водорода и атома галогена;Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8 алкильной группы, С 1-С 7 алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой солью в виде индивидуального стереоизомера или их смеси; в количестве, достаточном для ингибирования CFTR ионного транспорта в клетке. 14. Способ по п.13, где соединение формулы (Ib) представляет собой 3-[(3-трифторметил)фенил]-5[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинон. 15. Способ по п.13, где X1 расположен во 2, 3 или 4 положении фенильной группы, к которой он присоединен. 16. Способ по п.15, где X1 расположен в 3 положении. 17. Способ по п.13, где Y2 выбирают из гидроксильной, карбоксильной группы, нитрогруппы, карбонатной группы и галогена. 18. Способ по п.13, где Y2 является гидроксильной группой. 19. Способ по п.18, где Y1 является гидроксильной группой. 20. Способ по п.18, где Y1 является атомом брома. 21. Способ по п.18, где Y3 является нитрогруппой. 22. Способ по п.13, где соединение формулы (Ib) выбирают из- 29009847 23. Способ по п.13, где контактирование клетки включает прием внутрь соединения формулы (Ib) субъектом. 24. Способ по п.23, где прием внутрь включает также прием внутрь фармацевтически приемлемого носителя вместе с соединением формулы (Ib). 25. Способ ингибирования в клетке субъекта активности белка-регулятора трансмембранной проводимости при муковисцидозе при проведении in vivo анализа, который включает контактирование клетки с соединением формулы (Ib) где X1 представляет собой трифторметил, Х 2 и Х 3 независимо выбирают из водорода и атома галогена;Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8 алкильной группы, С 1-С 7 алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой солью в виде индивидуального стереоизомера или их смеси; в количестве, достаточном для ингибирования CFTR ионного транспорта в клетке. 26. Способ индуцирования фенотипа муковисцидоза (CF) у животного, отличного от человека, при этом способ включает введение животному, отличному от человека, соединения формулы (Ib) где X1 представляет собой трифторметил, Х 2 и Х 3 независимо выбирают из водорода и атома галогена;Y1, Y2 и Y3 независимо выбирают из водорода, C1-C8 алкильной группы, Cl-С 7 алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемой соли в виде индивидуального стереоизомера или их смеси; в количестве, достаточном для индуцирования фенотипа муковисцидоза (CF) у животного, отличного от человека. 27. Способ лечения субъекта, у которого наблюдается состояние, характеризующееся повышенным сверх меры транспортом ионов под влиянием белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), при этом способ включает введение субъекту эффективного количества тиазолидинонового соединения 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинона; при этом CFTR ионный транспорт ингибируется, а состояние вылечивается. 28. Фармацевтическая композиция для лечения состояния, характеризующегося повышенным сверх меры транспортом ионов под влиянием белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), содержащая тиазолидиноновое соединение, независимо выбранное из 3-[(3-трифторметил)фенил]-5-[(4-нитрофенил)метилен]-2-тиоксо-4-тиазолидинона; 3-[(3-трифторметил)фенил]-5-[(4-оксикарбоксифенил)метилен]-2-тиоксо-4-тиазолидинона; 3-[(3-трифторметил)фенил]-5-[(4-карбоксифенил)метилен]-2-тиоксо-4-тиазолидинона; 3-[(3-трифторметил)фенил]-5-[(3,4-дигидроксифенил)метилен]-2-тиоксо-4-тиазолидинона; 3-[(3-трифторметил)фенил]-5-[(3,5-дибром-4-гидроксифенил)метилен]-2-тиоксо-4-тиазолидинона и 3-[(3-трифторметил)фенил]-5-[(3-бром-4-гидрокси-5-нитрофенил)метилен]-2-тиоксо-4-тиазолидинона; и по крайней мере один фармацевтически приемлемый носитель, фармацевтически приемлемый разбавитель и фармацевтически приемлемый наполнитель, где опосредованный CFTR ионный транспорт ингибируется. 29. Композиция по п.25, где композиция не содержит обнаруживаемые количества диметилсульфоксида. 30. Фармацевтическая композиция для лечения состояния, опосредованного белком-регулятором трансмембранной проводимости при муковисцидозе (CFTR), содержащая соединение формулы (Ib) где X1 представляет собой трифторметил, Х 2 и Х 3 независимо выбирают из водорода и атома галогена;Y1, Y1 и Y3 независимо выбирают из водорода, C1-C8 алкильной группы, С 1-С 7 алкоксильной группы, карбонатной группы, карбаматной группы, карбоксильной группы, атома галогена, нитрогруппы, азогруппы, гидроксильной группы и меркаптогруппы; или его фармацевтически приемлемую соль в виде инди- 30
МПК / Метки
МПК: A61P 5/00, A61K 31/549, C07D 285/01
Метки: применение, ингибиторы, белка-регулятора, трансмембранной, проводимости, муковисцидозе
Код ссылки
<a href="https://eas.patents.su/30-9847-ingibitory-belka-regulyatora-transmembrannojj-provodimosti-pri-mukoviscidoze-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы белка-регулятора трансмембранной проводимости при муковисцидозе и их применение</a>
Предыдущий патент: Способ борьбы c сорняками
Следующий патент: Тиазол-(би)циклоалкил-карбоксанилиды
Случайный патент: Устройство подачи материала для ударной дробилки с вертикальным валом и способ дробления материала