8β – винил-11β-(ω-замещённые)алкилэстра-1,3,5(10)-триены
Номер патента: 9606
Опубликовано: 28.02.2008
Авторы: Мун Ханс-Петер, Бройер Нико, Больманн Рольф, Петерс Олаф, Хиллиш Александер, Рихтер Маргит
Формула / Реферат
1. Соединения общей формулы
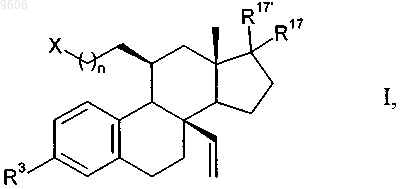
в которой R3 представляет собой водород, -ОН, -О-C1-C8алкильную группу;
n обозначает 3, 4, 5;
X представляет собой группу формулы
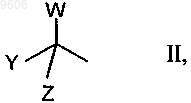
Z и W, каждый независимо друг от друга, представляет собой R19, или Z и W вместе представляют собой атом кислорода;
Y представляет собой -OR19, -CN, -SCN, атом галогена, R20, R20SO2-O- либо Y представляет собой R19 или R20, если Z и W вместе представляют собой атом кислорода;
R17 и R17' вместе представляют собой атом кислорода либо
R17 представляет собой водород, -ОН, -O-C1-C8алкильную группу;
R17' представляет собой водород, -ОН, -О-C1-C8алкильную группу;
R19 представляет собой атом водорода, остаток формулы CpFqHr, где р равно 1, 2, 3, 4, 5, 6, 7, 8, 9, q больше 1, а сумма q+r равна 2р+1, неразветвленную C1-C8алкильную группу либо разветвленную C3-C6алкильную группу, необязательно замещенную фенильным остатком C3-C6циклоалкильную группу, (C3-C6циклоалкил)-C1-C4алкиленовую группу, разветвленную или неразветвленную C2-C5алкенильную группу, C2-C5алкинильную группу или незамещенную либо замещенную арильную, гетероарильную, гетероциклильную, арил-C1-C4алкиленовую, гетероарил-C1-C4алкиленовую группу,
где арильные группы могут представлять собой фенильную, нафталин-1-ильную, нафталин-2-ильную, [1,1'-бифенил]-2-ильную, [1,1'-бифенил]-3-ильную или [1,1'-бифенил]-4-ильную группу;
гетероарильные группы могут представлять собой присоединенную через одно из замещенных положений пиридинильную, пиримидинильную, хинолинильную, изохинолинильную, бензофуранильную, бензотиенильную, 1,3-бензодиоксолильную, 2,1,3-бензотиадиазолильную, индолильную, фуранильную, тиенильную, оксазолильную, изоксазолильную, тиазолильную, пирролильную, пиразолильную, пиразинильную, пиридазинильную или имидазолильную группу и
гетероциклильные группы могут представлять собой присоединенную через одно из замещенных положений пиперидинильную, морфолинильную, тиоморфолинильную, пиперазинильную, тетрагидрофуранильную, тетрагидротиенильную, имидазолидинильную или пирролидинильную группу;
R20 представляет собой R21R22N-группу, группу -C(NOR19)H или группу общей формулы

в которой V представляет собой -СН2-, атом кислорода либо атом серы или =N-R25;
m обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8;
о обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8,
при этом их сумма m+о равна 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12;
R21 и R22, каждый независимо друг от друга, представляет собой R19;
R25 представляет собой R19, R20SO2- или ацильную группу -C(O)R21.
2. Соединения общей формулы I по п.1, отличающиеся тем, что Y обозначает -ОН, -CN, -SCN, атом галогена или R20.
3. Соединения общей формулы I по п.1, отличающиеся тем, что Y обозначает R20, если Z и W вместе представляют собой атом кислорода.
4. Соединения общей формулы I по п.1, отличающиеся тем, что Y представляет собой -ОН, -CN, -SCN, атом галогена или R20, a R17 и R17' вместе представляют собой атом кислорода либо R17 представляет собой водород, -ОН и R17' представляет собой водород, -ОН.
5. Соединения общей формулы I по п.1, отличающиеся тем, что Y представляет собой R20, если Z и W вместе представляют собой атом кислорода, a R17 и R17' вместе представляют собой атом кислорода либо R17 представляет собой водород, -ОН и R17' представляет собой водород, -ОН.
6. Соединения по п.1 из группы, включающей
11b-[(R)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[(S)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[8,8,8-трифтор-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[8,8,8-трифтор-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[6,6,6-трифтор-5-гидрокси-5-(трифторметил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7,7,7-трифтор-6-гидрокси-6-(трифторметил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[8,8,8-трифтор-7-гидрокси-7-(трифторметил)октил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7,7,7,6,6-пентафтор-5-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[7,7,7,6,6-пентафтор-5-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[8,8,8,7,7-пентафтор-6-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[8,8,8,7,7-пентафтор-6-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[9,9,9,8,8-пентафтор-7-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[9,9,9,8,8-пентафтор-7-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[8,8,8,7,7,6,6-гептафтор-5-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[8,8,8,7,7,6,6-гептафтор-5-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[9,9,9,8,8,7,7-гептафтор-6-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[9,9,9,8,8,7,7-гептафтор-6-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[10,10,10,9,9,8,8-гептафтор-7-гидроксидецил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[10,10,10,9,9,8,8-гептафтор-7-гидроксидецил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-(5-бромпентил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[5-(метиламино)пентил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[5-(диметиламино)пентил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[5-(пирролидин-1-ил)пентил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[5-(1-пиперидил)пентил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(5-морфолинопентил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{5-[метил(9,9,9,8,8-пентафторнонил)амино]пентил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{5-[(9,9,9,8,8,7,7-гептафторнонил)метиламино]пентил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{5-[метил(октаноил)амино]пентил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(6-хлоргексил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[6-(метиламино)гексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[6-(диметиламино)гексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[6-(пирролидин-1-ил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[6-(1-пиперидил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(6-морфолиногексил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{6-[метил(9,9,9,8,8-пентафторнонил)амино]гексил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{6-[(9,9,9,8,8,7,7-гептафторнонил)метиламино]гексил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{6-[метил(октаноил)амино]гексил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(7-бромгептил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7-(метиламино)гептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7-(диметиламино)гептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7-(пирролидин-1-ил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7-(1-пиперидил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(7-морфолиногептил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{7-[метил(9,9,9,8,8-пентафторнонил)амино]гептил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{7-[(9,9,9,8,8,7,7-гептафторнонил)метиламино]гептил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-{7-[метил(октаноил)амино]гептил}-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
N-н-бутил-N-метил-5-[3,17b-дигидрокси-8-винилэстра-1,3,5(10)-триен-11b-ил]валерамид,
N-н-бутил-N-метил-6-[3,17b-дигидрокси-8-винилэстра-1,3,5(10)-триен-11b-ил]капронамид,
N-н-бутил-N-метил-7-[3,17b-дигидрокси-8-винилэстра-1,3,5(10)-триен-11b-ил]энантамид,
11b-(5-тиоцианатопентил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(6-тиоцианатогексил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-(7-тиоцианатогептил)-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
6-[3,17b-дигидрокси-8-винилэстра-1,3,5(10)-триен-11b-ил]капронитрил,
7-[3,17b-дигидрокси-8-винилэстра-1,3,5(10)-триен-11b-ил]энантнитрил,
11b-[7,7,6-трифтор-5-гидроксигепт-6-енил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[7,7,6-трифтор-5-гидроксигепт-6-енил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[8,8,7-трифтор-6-гидроксиокт-7-енил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[8,8,7-трифтор-6-гидроксиокт-7-енил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[9,9,8-трифтор-7-гидроксинон-8-енил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[9,9,8-трифтор-7-гидроксинон-8-енил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
11b-[7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
11b-[5-метил-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[6-метил-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
11b-[7-метил-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол,
17a-метил-11b-[(R)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
17a-метил-11b-[(S)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
17a-метил-11b-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
17a-метил-11b-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2),
17a-метил-11b-[8,8,8-трифтор-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 1),
17a-метил-11b-[8,8,8-трифтор-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17b-диол (диастереомер 2).
7. Фармацевтические композиции, обладающие тканеселективным эстрогенным действием, содержащие по меньшей мере одно соединение по одному из предыдущих пунктов, а также фармацевтически приемлемое вспомогательное вещество и/или фармацевтически приемлемый носитель.
8. Фармацевтические композиции, обладающие тканеселективным эстрогенным действием, содержащие по меньшей мере одно соединение по одному из предыдущих пунктов и наряду по меньшей мере с одним соединением общей формулы I по п.1 содержащие также по меньшей мере одно соединение, выбранное из группы, включающей антагонисты гонадотропин-рилизинг-фактора (ЛГ/ФСГ-РФ), антагонисты прогестероновых рецепторов, мезопрогестины, гестагены и тканеселективные гестагены.
9. Применение соединений общей формулы I по одному из пп.1-6 для получения лекарственного средства, предназначенного для мужской и/или женской контрацепции, для лечения заболеваний яичника, связанных с доброкачественной и злокачественной пролиферацией.
10. Применение соединений общей формулы I по п.9 для женской контрацепции.
11. Применение соединений общей формулы I по п.9 для мужской контрацепции.
12. Применение соединений общей формулы I по п.9 для лечения заболеваний яичника, связанных с доброкачественной или злокачественной пролиферацией.
13. Применение по п.12 для лечения карциномы яичника.
14. Применение по п.12 для лечения гранулезоклеточных опухолей.
15. Применение по одному из пп.9-14, отличающееся тем, что при этом не оказывается никакого влияния на функцию других, восприимчивых к действию эстрогенов органов, таких как матка или печень.
16. Промежуточные продукты общей формулы VI для получения соединений общей формулы I
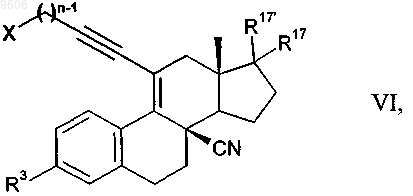
в которой остатки X, R3, R17, R17' и n имеют те же значения, что и указанные для общей формулы I.
17. Промежуточные продукты общей формулы VII для получения соединений общей формулы I
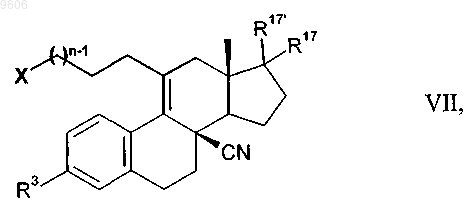
в которой остатки X, R3, R17, R17' и n имеют те же значения, что и указанные для общей формулы I.
18. Промежуточные продукты общей формулы VIII для получения соединений общей формулы I

в которой остатки X, R3, R17, R17' и n имеют те же значения, что и указанные для общей формулы I.
19. Промежуточные продукты общей формулы IX для получения соединений общей формулы I
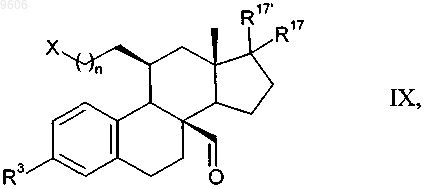
в которой остатки X, R3, R17, R17' и n имеют те же значения, что и указанные для общей формулы I.
Текст
009606 Настоящее изобретение относится к 8-винил-11-(-замещенные)алкилэстра-1,3,5(10)-триенам,обладающим антагонистической в отношении ER-рецепторов активностью, к способу их получения, к промежуточным продуктам для их получения, к фармацевтическим препаратам, содержащим такие соединения, а также к их применению для получения лекарственных средств. Предлагаемые в изобретении соединения представляют собой стероидные, обладающие избирательным действием в отношении определенных тканей (тканеселективные) эстрогены, которые in vitro обладают более высокой аффинностью к эстрогенным рецепторам в препаратах из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецепторам в препаратах из матки крыс, a in vivo из-за их направленного преимущественно на яичник действия проявляют контрацептивное действие, и которые обладают более совершенными физико-химическими свойствами. Методы контрацепции, основанные на применении химических соединений, широко распространены среди женщин, желающих предупредить беременность. В настоящее время существуют следующие химические методы женской контрацепции: 1) подавление овуляции за счет ингибирования выделения гонадотропных гормонов и тем самым предотвращения овуляции (эндокринный принцип); 2) предупреждение восхождения сперматозоидов через женский репродуктивный тракт к маточной трубе, где происходит оплодотворение; 3) предупреждение имплантации, соответственно нидации, оплодотворенных эмбрионов в матку; 4) применение спермицидов; 5) применение вызывающих аборт средств. Для предупреждения беременности женщинами наиболее часто используются пероральные контрацептивы, состоящие из различных комбинаций одного эстрогена с одним гестагеном. Действие таких контрацептивов основано на эндокринном принципе. Применение подобных противозачаточных средств,несмотря на их исключительно высокую эффективность, может сопровождаться нежелательными побочными явлениями, такими, например, как нерегулярные кровотечения, тошнота, рвота, депрессии, прибавление в весе или головные боли. Иногда наблюдаются также более сложные заболевания, такие как тромбоэмболии, апоплексический удар, аденома печени, заболевания желчного пузыря или артериальная гипертония. Наличием всех этих нежелательных побочных явлений, сопровождающих применение известных на сегодняшний день пероральных контрацептивов, обусловлена существующая в медицине потребность в новом методе контрацепции без побочных явлений. Идеальным методом контрацепции считается метод, который позволяет непосредственно воздействовать на яичниковый фолликул, не затрагивая эндокринную ось гипоталамус-гипофиз-яичник. Достичь подобного эффекта в принципе можно с помощью химического соединения, которое препятствует фолликулогенезу, например за счет нарушения паракринного взаимодействия между яйцеклеткой и гранулезными клетками, и которое таким путем: а) исключает возможность адекватного протекания "программы" формирования фолликула, приводя к созреванию некомпетентной яйцеклетки, которая хотя и выходит из фолликула яичника в брюшную полость, однако не может быть оплодотворена, или б) исключает возможность адекватного протекания "программы" формирования фолликула, приводя к созреванию некомпетентной яйцеклетки, которая хотя и выходит из фолликула яичника в брюшную полость и оплодотворяется, однако не приводит к предымплантационному развитию эмбриона, или в) допускает возможность лишь ограниченного фолликулогенеза, вследствие чего овуляция не происходит. Рост яичникового фолликула представляет собой процесс развития примордиального фолликула в крупный, антральный зрелый фолликул. К овуляции зрелой клетки потенциально способен только антральный фолликул с оптимальной структурой. У пациенток с яичниковым бесплодием, например с синдромом поликистозных яичников (СПКЯ), наблюдается нарушение фолликулогенеза, связанное с гормональными нарушениями и нарушениями овуляции, а также неполноценным созреванием яйцеклеток(Franks et al., Mol. Cell. Endocrinol. 163, 2000, p. 49-52). В последнее время появляется все больше подтверждений тому, что ранние стадии фолликулогенеза, т.е. стадии развития фолликула от примордиального до раннего антрального, не зависят от гонадотропных гормонов, однако все еще не до конца разрешенным остается вопрос о том, какие из идентифицированных факторов - аутокринные или паракринные (Elvin et al., Mol. Cell. Endocrinol. 13, 1999,p. 1035-1048; McNatty et al., J. Reprod. Fertil. Suppl. 54, 1999, p. 3-16) имеют наиболее важное значение на ранних стадиях фолликулогенеза. Гонадотропины же, такие, например, как фолликулостимулирующий гормон (ФСГ), вовлечены преимущественно в процессы, происходящие на поздних стадиях фолликулогенеза, т.е. на стадиях развития раннего антрального фолликула в крупный, способный к овуляции фолликул. Однако в настоящее время обсуждается вопрос об участии дополнительных модуляторов фолликулогенеза и на поздних его стадиях (Elvin et al., Mol. Cell. Endocrinol. 13, 1999, p. 1035-1048). Сравнительно недавно был выявлен второй подтип эстрогенных рецепторов, который обозначили как эстрогенные рецепторы- (ER) (Kuiper et al., Proc. Natl. Acad. Sci. 93, 1996, p. 5925-5930; Mosselman,-1 009606Dijkema, FEBS Letters 392, 1996, p. 49-53; Tremblay et al., Molecular Endocrinology 11, 1997, p. 353-365). Характер экспрессии рецепторов ER отличается от такового рецепторов ER (Kuiper et al.,Endocrinology, 138, 1996, p. 863-870). В отличие от рецепторов ER, экспрессия которых была выявлена практически во всех исследованных органах, наивысший уровень экспрессии рецепторов ER у самок наблюдался в яичнике, а у самцов - в предстательной железе (Couse et al., Endocrinology 138, 1997,p. 4613-4621). В яичнике значительный уровень экспрессии рецепторов ER в фолликулах наблюдается практически на всех стадиях их развития. Если в фолликулах рецептор ER экспрессируется только в наружных фолликулоцитах (тека-клетках), то рецептор ER экспрессируется в высокой степени в продуцирующих эстрадиол гранулезных клетках. Учитывая подобное распределение рецепторов ER и ER в яичниковом фолликуле по различным его клеткам, следует ожидать, что взаимодействие лиганда с рецептором ER, соответственно рецептором ER, приведет к различным клеточным ответам. Функциональные различия между рецепторами ER и ER недавно были подтверждены за счет успешного выведения нокаутных по рецептору ER и рецептору ER мышей (Couse et al., Endocrine Reviews 20, 1999, p. 358-417). В соответствии с этим рецептор ER играет главную роль в функции матки, молочной железы,управлении эндокринно-половой оси, тогда как рецептор ER преимущественно вовлечен в процессы яичниковой физиологии, прежде всего в процессы фолликулогенеза и овуляции. Другим органом с высоким уровнем экспрессии рецептора ER является яичко (Mosselmann et al.,FEBS Lett. 392, 1996, p. 49-53), включая сперматиды (Shugrue et al., Steroids 63, 1998, p. 498-504). Функциональная роль рецепторов ER в организме самца подтверждается также результатами исследований на нокаутных по рецептору ER (ERKO-нокаутных), соответственно по рецептору ER (ERKOнокаутных) мышах: у самцов ERKO-мышей (R.A. Hess et al., Nature 390, 1997, p. 509-512) имеются явные нарушения репродуктивной функции, т.е. они бесплодны. Этим подтверждается важная роль эстрогенов,которую они играют в сохранении яичком своей функции касательно репродуктивной способности. Рецепторы ER и ER имеют значительно различающиеся между собой аминокислотные последовательности в их лигандсвязывающих и трансактивирующих доменах. Отсюда можно сделать однозначный вывод о том, что:(1) различные подтипы эстрогенных рецепторов способны с различной аффинностью связывать свои лиганды и(2) лиганды рецепторов обоих подтипов могут проявлять в отношении них различный агонистический и/или антагонистический потенциал. В заявках WO 00/47603, WO 00/63228, WO 01/32680, WO 01/77138 и US 60/207370, а также в различных публикациях (Sun et al., Endocrinology 140, 1999, p. 800-804; Stauffer et al., J. Comb. Chem. 2, 2000,p. 318-329) содержится информация о стероидных и нестероидных лигандах с высокой аффинностью к рецепторам ER и ER. Некоторые из этих соединений обладали более выраженными свойствами агонистов/антагонистов рецептора ER, тогда как другие соединения обладали более выраженными свойствами агонистов/антагонистов рецептора ER. В WO 00/31112 описаны новые стероидные соединения, основу которых образует незамещенный в положении 8 эстрадиол и которые в положении 11 несут углеводородный остаток, содержащий одну единственную линейную цепь длиной от 5 до 9 атомов углерода. Такие соединения обладают ERагонистическим/ER-антагонистическим профилем действия. Эти соединения из-за наличия у них подобного смешанного профиля действия на эстрогенные рецепторы различных подтипов пригодны в качестве более эффективных эстрогенов для лечения обусловленных эстрогеном нарушений и для контрацепции совместно с гестагеном. В WO 02/068548 впервые были опубликованы результаты исследований in vivo, из которых со всей очевидностью следует, что ER-избирательные агонисты позволяют улучшить протекание фолликулогенеза, тогда как ER-избирательные антагонисты снижают репродуктивную способность, т.е. частоту овуляций. В WO 01/77138 описаны 11-н-пентил- и 11-н-гексил-8-замещенные эстра-1,3,5(10)-триены сER-антагонистическим действием. Однако замещение таких соединений н-алкилом в 11-положении влечет за собой дальнейшее уменьшение их полярности и, тем самым, ухудшение их растворимости в воде. В основу настоящего изобретения была положена задача получить соединения, которые обладали бы более совершенными физико-химическими свойствами и которые in vitro обладали бы избирательностью в отношении связывания с эстрогенными рецепторами в препаратах из предстательной железы и матки крыс, a in vivo благодаря своему направленному преимущественно на яичник действию проявляли бы контрацептивное действие, не влияя на другие чувствительные к эстрогенам органы, такие, например,как матка или печень. Помимо этого такие соединения должны быть пригодны для мужской контрацепции, а также для лечения связанных с доброкачественной или злокачественной пролиферацией заболеваний яичника.-2 009606 Указанная задача решается согласно изобретению с помощью предлагаемых в нем соединений общей формулы I. Настоящее изобретение относится к соединениям общей формулы в которой R3 представляет собой группу R19-О-, R20SO2-O-, -O-C(O)R21;X представляет собой группу формулы в которой Z и W, каждый независимо друг от друга, представляет собой R19 либо Z и W вместе представляют собой атом кислорода;R или R20, если Z и W вместе представляют собой атом кислорода,R17 и R17' вместе представляют собой атом кислорода, группу =CR23R24, где R23 и R24, каждый независимо друг от друга, представляет собой атом водорода или галоген либоR17 представляет собой водород, -OR19 или галоген,R17' представляет собой R19, -OR19, галоген, R20SO2-O-, -C(O)R21 или -O-C(O)R21,R19 представляет собой атом водорода, остаток формулы CpFqHr, где р равно 1, 2, 3, 4, 5, 6, 7, 8, 9, q больше 1, а сумма q+r равна 2 р+1, неразветвленную C1-C8 алкильную группу либо разветвленнуюC3-C6 алкильную группу, необязательно замещенную фенильным остатком C3-C6 циклоалкильную группу,(C3-C6 циклоалкил)-C1-C4 алкиленовую группу, разветвленную или неразветвленную C2-C5 алкенильную группу, C2-C5 алкинильную группу или незамещенную либо замещенную арильную, гетероарильную,гетероциклильную, арил-C1-C4 алкиленовую, гетероарил-C1-C4 алкиленовую группу,R20 представляет собой R21R22N-группу, группу -C(NOR19)H или группу общей формулы в которой V представляет собой -СН 2-, атом кислорода либо атом серы или =N-R25,m обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8,о обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8,при этом их сумма m+о равна 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12,R21 и R22, каждый независимо друг от друга, представляет собой R19,R25 представляет собой R19, R20SO2- или ацильную группу -C(O)R21. В объем настоящего изобретения включены также фармацевтически совместимые соли предлагаемых в нем соединений общей формулы I. Неразветвленные C1-C8 алкильные группы могут представлять собой, например, метильную, этильную, н-пропильную, н-бутильную, н-пентильную, н-гексильную, н-гептильную, н-октильную группу,а разветвленные C3-C8 алкильные группы могут представлять собой изопропильную, изобутильную,втор-бутильную,трет-бутильную,изопентильную,неопентильную,2-метилпентильную,2,2-диметилбутильную,2,3-диметилбутильную,2-метилгексильную,2,2-диметилпентильную,2,2,3-триметилбутильную или 2,3,3-триметилбутильную группу. Необязательно замещенные фенильным остатком C3-C6 циклоалкильные группы могут представлять собой в основном циклопропильную, циклобутильную, циклопентильную, циклогексильную, соответственно фенилциклопропильную, фенилциклобутильную, фенилциклопентильную или фенилциклогексильную группу.(C3-C6 циклоалкил)-C1-C4 алкиленовые группы могут представлять собой, например, циклопропилметильную, циклобутилметильную, циклопентилметильную, циклогексилметильную, циклопропилэтильную, циклобутилэтильную, циклопентилэтильную, циклогексилэтильную, циклопропилпропильную,циклобутилпропильную, циклопентилпропильную, циклогексилпропильную, циклопропилбутильную,циклобутилбутильную, циклопентилбутильную или циклогексилбутильную группу. Разветвленные либо неразветвленные C2-C5 алкенильные группы могут представлять собой,например, винильную, трифторвинильную, аллильную, гомоаллильную, (Е)-бут-2-енильную,(Z)-бут-2-енильную, (Е)-бут-1-енильную, (Z)-бут-1-енильную, пент-4-енильную, (Е)-пент-3-енильную,(Z)-пент-3-енильную,(Е)-пент-2-енильную,(Z)-пент-2-енильную,(Е)-пент-1-енильную,(Z)-пент-1-енильную,2-метилвинильную,3-метилбут-3-енильную,2-метилбут-3-енильную,(Е)-2-метилбут-2-енильную, (Z)-2-метилбут-2-енильную или 3-метилбут-2-енильную группу.C2-C5 алкинильные группы могут представлять собой, например, этинильную, проп-1-инильную,проп-2-инильную,бут-1-инильную,бут-2-инильную,бут-3-инильную,пент-1-инильную,пент-2-инильную, пент-3-инильную, пент-4-инильную, 1-метилпроп-2-инильную, 1-метилбут-3 инильную или 1-этилпроп-2-инильную группу. Соответственно R19O-группы могут представлять собой, например, метокси-, этокси-, н-пропокси-,изопропокси-, н-бутокси-, втор-бутокси-, изобутокси- или трет-бутоксигруппу. Арильные группы могут представлять собой, например, фенильную, нафталин-1-ильную, нафталин 2-ильную, [1,1'-бифенил]-2-ильную, [1,1'-бифенил]-3-ильную или [1,1'-бифенил]-4-ильную группу. Гетероарильные группы могут представлять собой присоединенную через одно из замещенных положений пиридинильную, пиримидинильную, хинолинильную, изохинолинильную, бензофуранильную,бензотиенильную, 1,3-бензодиоксолильную, 2,1,3-бензотиадиазолильную, индолильную, фуранильную,тиенильную, оксазолильную, изоксазолильную, тиазолильную, пирролильную, пиразолильную, пиразинильную, пиридазинильную или имидазолильную группу. Используемые в качестве остатков Z и Z' гетероциклильные группы могут представлять собой присоединенную через одно из замещенных положений пиперидинильную, морфолинильную, тиоморфолинильную, пиперазинильную, тетрагидрофуранильную, тетрагидротиенильную, имидазолидинильную или пирролидинильную группу. Заместители арильных, гетероарильных, гетероциклильных остатков могут представлять собой среди прочих неразветвленные или разветвленные C1-C4 алкильные группы (метильные, этильные, н-пропильные,изопропильные, н-бутильные, втор-бутильные, изобутильные, а также трет-бутильные группы), и/илиC3-C6 циклоалкильные группы (циклопропильные, циклобутильные, циклопентильные, циклогексильные группы), и/или галоген (фтор, хлор, бром, йод) и/или -ОН, -О-(C1-C4 алкил), формильную группу, -CO2H,-СО 2(C1-C4 алкил), -NO2, -N3, -CN, C1-C8 ацильную, C1-C8 ацилокси-, трифторметильную, пентафторэтильную, метилтио-, трифторметилтиогруппу, и/или амино-, моно(C1-C8 алкил)амино- либо ди(C1-C8 алкил)аминогруппу, при этом обе алкильные группы являются идентичными либо разными. Используемые в качестве остатков Z и Z' арил-C1-C4 алкиленовые группы могут представлять собой комбинацию указанных выше арильных и C1-C4 алкильных групп, таких, например, как фенилметильная,1-фенилэтильная, 2-фенилэтильная, 1-метил-1-фенилэтильная, 3-фенилпропильная, 4-фенилбутильная,(нафталин-1-ил)метильная, 1-(нафталин-1-ил)этильная, 2-(нафталин-1-ил)этильная, (нафталин-2 ил)метильная, 1-(нафталин-2-ил)этильная, 2-(нафталин-2-ил)этильная, ([1,1'-бифенил]-2-ил)метильная,([1,1'-бифенил]-3-ил)метильная или ([1,1'-бифенил]-4-ил)метильная группа. Используемые в качестве остатков Z и Z' гетероарил-C1-C4 алкиленовые группы могут представлять собой комбинацию указанных выше гетероарильных и C1-C4 алкиленовых групп, таких, например, как(пиридин-2-ил)метильная, (пиридин-3-ил)метильная, (пиридин-4-ил)метильная, (фуран-2-ил)метильная,(фуран-3-ил)метильная, (тиен-2-ил)метильная, (тиен-3-ил)метильная, 2-(тиен-2-ил)этильная или 2-(тиен 3-ил)этильная группа. Остаток формулы CpFqHr, где р равно 1, 2, 3, 4, 5, 6, 7, 8, 9, q больше 1, а сумма q+r равна 2 р+1,может представлять собой монофторметильную, дифторметильную, трифторметильную,пентафторэтильную,перфторпропильную,перфторбутильную,2,2,2-трифторэтильную,5,5,5,4,4-пентафторпентильную, 6,6,6,5,5,4,4,3,3-нонафторгексильную, 9,9,9,8,8-пентафторнонильную или 9,9,9,8,8,7,7-гептафторнонильную группу. Под галогеном согласно изобретению имеется в виду фтор, хлор, бром или йод. Для образования по известным специалисту методам фармацевтически приемлемых солей предлагаемых в изобретении соединений общей формулы I в качестве неорганических кислот могут использоваться среди прочих хлористо-водородная, бромисто-водородная, серная, фосфорная и азотная кислоты; в качестве карбоновых кислот - в частности, уксусная, пропионовая, гексановая, октановая, декановая, олеиновая, стеариновая, малеиновая, фумаровая, янтарная, бензойная, аскорбиновая, щавелевая, салициловая, винная, лимонная, молочная, гликолевая, яблочная, миндальная, коричная, глутаминовая,аспарагиновая кислоты;-4 009606 в качестве сульфоновых кислот - в частности, метансульфоновая, этансульфоновая, толуолсульфоновая, бензолсульфоновая, а также нафталинсульфоновая кислоты. Предпочтительными согласно настоящему изобретению являются такие соединения общей формулы I, где Y обозначает -ОН, -CN, -SCN, атом галогена, R20 или Y обозначает R20, если Z и W вместе представляют собой атом кислорода. К особенно предпочтительным согласно настоящему изобретению относятся такие соединения общей формулы I, где Y обозначает -ОН, -CN, -SCN, атом галогена, R20 или Y обозначает R20, если Z и W вместе представляют собой атом кислорода, и R17 и R17' вместе представляют собой атом кислорода либоR17 представляет собой водород, -ОН, a R17' представляет собой водород, -ОН, C1-C4 алкильную группу,C2-C5 алкенильную группу, C2-C5 алкинильную группу или трифторметильную группу. К наиболее предпочтительным предлагаемым в изобретении соединениям относятся следующие из них. В случае эпимерных спиртов оба возможных диастереомера также являются наиболее предпочтительными: 11-[(R)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[(S)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[8,8,8-трифтор-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол, (диастереомер 1),11-[8,8,8-трифтор-7-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[6,6,6-трифтор-5-гидрокси-5-(трифторметил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[7,7,7-трифтор-6-гидрокси-6-(трифторметил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[8,8,8-трифтор-7-гидрокси-7-(трифторметил)октил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[7,7,7,6,6-пентафтор-5-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[7,7,7,6,6-пентафтор-5-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[8,8,8,7,7-пентафтор-6-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[8,8,8,7,7-пентафтор-6-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[9,9,9,8,8-пентафтор-7-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[9,9,9,8,8-пентафтор-7-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[8,8,8,7,7,6,6-гептафтор-5-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[8,8,8,7,7,6,6-гептафтор-5-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[9,9,9,8,8,7,7-гептафтор-6-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[9,9,9,8,8,7,7-гептафтор-6-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2) 11-[10,10,10,9,9,8,8-гептафтор-7-гидроксидецил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[10,10,10,9,9,8,8-гептафтор-7-гидроксидецил]-8-винилэстра-1,3,5(10)-триен-3,17 диол(диастереомер 2),11-(5-бромпентил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[5-(метиламино)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[5-(диметиламино)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[5-(пирролидин-1-ил)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[5-(1-пиперидил)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(5-морфолинопентил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-5-[метил(9,9,9,8,8-пентафторнонил)амино]пентил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-5-[(9,9,9,8,8,7,7-гептафторнонил)метиламино]пентил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-5-[метил(октаноил)амино]пентил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(6-хлоргексил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[6-(метиламино)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[6-(диметиламино)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[6-(пирролидин-1-ил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[6-(1-пиперидил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(6-морфолиногексил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-6-[метил(9,9,9,8,8-пентафторнонил)амино]гексил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-6-[(9,9,9,8,8,7,7-гептафторнонил)метиламино]гексил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-6-[метил(октаноил)амино]гексил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(7-бромгептил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[7-(метиламино)гептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[7-(диметиламино)гептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[7-(пирролидин-1-ил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-[7-(1-пиперидил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(7-морфолиногептил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,-5 009606 11-7-[метил(9,9,9,8,8-пентафторнонил)амино]гептил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-7-[(9,9,9,8,8,7,7-гептафторнонил)метиламино]гептил-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-7-[метил(октаноил)амино]гептил-8-винилэстра-1,3,5(10)-триен-3,17-диол,N-н-бутил-N-метил-5-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]валерамид,N-н-бутил-N-метил-6-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]капронамид,N-н-бутил-N-метил-7-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]энантамид,11-(5-тиоцианатопентил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(6-тиоцианатогексил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,11-(7-тиоцианатогептил)-8-винилэстра-1,3,5(10)-триен-3,17-диол,6-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]капронитрил,7-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]энантнитрил,17-гидрокси-11-[(R)6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3 илсульфамат (диастереомер 1),17-гидрокси-11-[(S)6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3 илсульфамат (диастереомер 2),17-гидрокси-11-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3-илсульфамат-7 009606 Предлагаемые в изобретении соединения пригодны для подавления фолликулогенеза и овуляции,для мужской контрацепции и для лечения заболеваний яичника, связанных с доброкачественной и злокачественной пролиферацией. В отличие от этинилэстрадиола, представляющего собой обычно используемый для гормональной контрацепции эстроген, или также используемых для контрацепции соединений, описанных в заявкеWO 00/31112, предлагаемые в настоящем изобретении соединения общей формулы I могут применяться индивидуально, т.е. без дополнительного в целях контрацепции назначения гестагенов. Эфирные производные предлагаемых в изобретении эстратриенов могут обладать в качестве пролекарства рядом преимуществ по сравнению с неэтерифицированными действующими веществами касательно методики их введения, специфики их действия, эффективности и продолжительности их действия. Сульфаматные производные предлагаемых в изобретении эстратриенов также обладают фармакокинетическими и фармакодинамическими преимуществами. Достигаемые в этом отношении эффекты при использовании других сульфаматных стероидов уже описаны в литературе (Journ. Steroid Biochem.Molec. Biol. 55, 1995, p. 395-403; Exp. Opinion Invest. Drugs 7, 1998, p. 575-589). Настоящее изобретение относится,как указывалось выше,к 8-винил-11-(замещенным)алкилэстра-1,3,5(10)-триенам, которые in vitro проявляют избирательность в отношении связывания с эстрогенными рецепторами в препаратах простаты крысы и матки крысы, a in vivo предпочтительно подавляют фоликулогенез и овуляцию. Предлагаемые в изобретении соединения проявляют контрацептивное действие в широком диапазоне дозировок, не оказывая при этом никакого влияния на другие восприимчивые к действию эстрогенов органы, такие, например, как матка или печень. Кроме того, эти соединения могут применяться для мужской контрацепции и для лечения связанных с доброкачественной или злокачественной пролиферацией заболеваний яичника. В соответствии с этим настоящее изобретение относится к фармацевтическим препаратам, содержащим по меньшей мере одно соединение общей формулы I, а также его физиологически совместимые соли, к применению соединений общей формулы I для получения лекарственного средства, предназначенного для мужской и/или женской контрацепции, для лечения заболеваний яичника, связанных с доброкачественной и злокачественной пролиферацией. Предлагаемые в изобретении соединения могут при их пероральном и парентеральном введении в организм использоваться при следующих показаниях. Предлагаемые в изобретении соединения общей формулы I могут применяться в качестве отдельного компонента в фармацевтических композициях или в соответствующей комбинации, прежде всего с антагонистами гонадотропин-рилизинг-фактора (ЛГ/ФСГ-РФ), антагонистами прогестероновых рецепторов, мезопрогестинами, гестагенами либо тканеселективными гестагенами (действие через А/В-форму). Предлагаемые в изобретении соединения и содержащие их препараты особенно пригодны для овариальной контрацепции, для лечения связанных с доброкачественной или злокачественной пролиферацией заболеваний яичника, таких, например, как карцинома яичника или гранулезоклеточная опухоль. Кроме того, эти соединения могут найти применение для лечения нарушений репродуктивной функции(бесплодия) у мужчин и заболеваний простаты. Вводимое в организм количество соединения общей формулы I варьируется в широких пределах и может включать любую эффективную дозу. В зависимости от подлежащего лечению состояния и методики введения количество назначаемого соединения может составлять от 0,01 мкг до 100 мг, предпочтительно от 0,04 мкг до 1 мг/кг веса тела в сутки. Для человека это соответствует суточной дозе от 0,8 мкг до 8 г, предпочтительно от 3,2 мкг до 80 мг. Дозированная лекарственная форма содержит согласно изобретению от 1,6 мкг до 2000 мг одного или нескольких соединений общей формулы I. Предлагаемые в изобретении соединения и их кислотно-аддитивные соли могут использоваться для получения фармацевтических композиций и составов. Фармацевтические составы, соответственно лекарственные средства, содержат в качестве действующего вещества одно или несколько предлагаемых в изобретении соединений либо их кислотно-аддитивных солей, при необходимости в смеси с другими фармакологически, соответственно фармацевтически активными веществами. Лекарственные средства получают по известной технологии с использованием при этом известных и обычных фармацевтических вспомогательных веществ, а также иных обычных носителей и разбавителей. В качестве примера подобных носителей и вспомогательных веществ можно назвать таковые, которые рекомендованы, соответственно указаны в следующих публикациях как вспомогательные вещества, пригодные для применения в фармацевтике, косметической промышленности и смежных областях: Ullmann's Encyklopdie dertechnischen Chemie, том 4, 1953, p. 1-39; Journal of Pharmaceutical Sciences, том 52, 1963, p. 918 и далее,Н.V. Czetsch-Lindenwald, Hilfsstoffe fr Pharmazie und angrenzende Gebiete; Pharm. Ind.,2, 1961, p. 72 и далее: Dr. H.P. Fiedler, Lexikon der Hilfsstoffe fr Pharmazie, Kosmetik und angrenzende Gebiete, изд-во Cantor KG, Aulendorf in Wrttemberg, 1971. Предлагаемые в изобретении соединения можно вводить в организм перорально или парентерально, например интраперитонеально, внутримышечно, подкожно либо чрескожно или их можно имплантировать в ткань.-8 009606 Для перорального введения пригодны капсулы, пилюли, таблетки, драже и т.д. Дозированные лекарственные формы наряду с действующим веществом могут содержать также фармацевтически приемлемый носитель, такой, например, как крахмал, сахар, сорбит, желатин, скользящие вещества, кремниевую кислоту, тальк и др. Для парентерального введения действующие вещества можно растворять или суспендировать в соответствующем физиологически совместимом разбавителе. В качестве подобных разбавителей наиболее часто используют масла с добавлением гидротропного солюбилизатора, поверхностно-активного вещества, суспендирующего агента или эмульгатора либо без добавления этих веществ. В качестве примеров пригодных для применения в этих целях масел можно назвать оливковое, арахисовое, хлопковое, соевое,касторовое и кунжутное масло. Предлагаемые в изобретении соединения допускают также возможность их применения в виде инъекции с замедленным всасыванием действующего вещества или в виде имплантируемого препарата,т.е. в виде лекарственных форм, обеспечивающих замедленное (пролонгированное) высвобождение действующего вещества. В качестве инертных материалов имплантаты могут содержать, например, биологически разлагаемые полимеры или синтетические силиконы, такие, в частности, как силиконовый каучук. Помимо этого для чрескожного введения действующих веществ можно также использовать пластырь. Для изготовления содержащих активные соединения общей формулы I внутривагинальных (например, вагинальных колец) или внутриматочных систем (например, пессариев, спиралей, ВМС), предназначенных для местного применения, могут использоваться различные полимеры, такие, например, как силиконовые полимеры, этиленвинилацетат, полиэтилен или полипропилен. Для повышения биодоступности действующего вещества предлагаемые в изобретении соединения можно также перерабатывать в клатратные соединения циклодекстрина. С этой целью соединения подвергают взаимодействию с -, - или -циклодекстрином или его производным (РСТ/ЕР 95/02656). Согласно изобретению предлагаемые в нем соединения общей формулы I можно также заключать в липосомы. Фармакологические исследования Исследования по связыванию с эстрогенными рецепторами. Аффинность предлагаемых в изобретении соединений исследовали в опытах по конкурентному связыванию на препаратах эстрогенных рецепторов из предстательной железы и матки крыс с использованием 3 Н-эстрадиола в качестве лиганда. Для приготовления препаратов цитозоля предстательной железы и для проведения опытов по связыванию с эстрогенными рецепторами с использованием цитозоля предстательной железы использовали методику, описанную у Testas J. et al. (Endocrinology 109, 1981,p. 1287-1289). Для приготовления препаратов цитозоля матки крыс, а также для проведения опытов по связыванию с рецепторами с использованием содержащего эстрогенные рецепторы (ER) цитозоля в основном использовали методику, описанную у Stack и Gorski в Endocrinology, 117, 1985, p. 2024-2032, с некоторыми модификациями, описанными у Fuhrmann et al. в Contraception, 51, 1995, p. 45-52. Предлагаемые в изобретении соединения обладают более высокой аффинностью к эстрогенным рецепторам из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецепторам из матки крыс (табл. 1 и 2). При этом исходят из того, что в предстательной железе крыс рецепторы ER преобладают над рецепторами ER, а в матке крыс, наоборот, рецепторы ER преобладают над рецепторами ER. Приведенные в табл. 1 данные свидетельствуют о том, что соотношение между степенью связывания с рецепторами из предстательной железы и степенью связывания с рецепторами из матки(ER/ER) в качественном отношении согласуется с коэффициентом относительной аффинности (ОА) к человеческим рецепторам ER (hER) и ER (hER) крысы (согласно Kuiper et al., Endocrinology, 138,1996, p. 863-870). Опыт с трансактивацией для выявления свойств эстрогенных агонистов и антагонистов. Культивирование клеток. Клетки U-2 OS культивировали при 37 С в атмосфере с 8,5% содержанием CO2 в модифицированной по способу Дульбекко среде Игла (DMEM-среде) без фенолового красного (фирма Gibco BRL,кат.11880-028) с добавлением 5% фетальной телячьей сыворотки (ФТС) (фирма Seromed, кат.S 0115), а также смеси из пенициллина в концентрации 100 ед./мл, стрептомицина в концентрации 100 мкг/мл (фирма Seromed, кат.А 2213) и L-глутамина в концентрации 4 мМ (фирма Gibco BRL,кат.25030-024) (ПСГ-смесь). Клетки, выдержанные по меньшей мере в течение 24 ч в DMEM-среде, дополненной 5% обработанной активированным углем ФТС (ОУТС) и ПСГ-смесью, промывали забуференным фосфатом физиологическим раствором Дульбекко (фирма Gibco BRL, кат.14190-094) и обрабатывали трипсином (трипсин/ЭДТК (0,05/0,02%), фирма Seromed, кат.L 2153). Затем клетки ресуспендировали в 10 мл DMEMсреды, дополненной 5% ОУТС и ПСГ-смесью. Далее 8106 клеток для их высевания на восемь 96-луночных планшетов (фирма Packard, CulturePlate-96, кат.6005180) разводили до объема 80 млDMEM-средой, дополненной 5% ОУТС и ПСГ-смесью. После этого в каждую лунку высевали по 100 мкл суспензии клеток (1104 клеток). Через 6 ч после высевания осуществляли трансфекцию. Трансфекция реагентом FuGENE 6. Используемую экспрессирующую рецепторы ER плазмиду (HEG0) амплифицировали в штамме Е. coli DH5 (фирма Invitrogen). Используемую экспрессирующую рецепторы ER плазмиду (ER0) конструировали собственными силами и амплифицировали в штамме Е. coli DH5. При этом, как и в случаеER, использовали экспрессирующую плазмиду pSG5. Для получения несущей репортерный ген плазмиды вектор pBL-LUC+ снабжали двумя тандемными ERE-элементами (реагирующие на эстрогены эле- 10009606 менты промотора вителлогенина (от англ. "estrogen-responsive elements" и амплифицировали его в Е. coli (штамм XL1-Blue, фирма Stratagene). Плазмидную ДНК получали с помощью набора NucleoBond Plasmid Maxi Kit (фирма CLONTECH,кат.K3003-2) и реагента FuGENE 6 (фирма Boehringer Mannheim, кат.1814443). Сначала ее отдельно разводили в приемлемом количестве DMEM-среды и инкубировали, после чего растворы объединяли и вновь инкубировали. Смеси для 96-луночных планшетов. Содержащая ДНК смесь (А) (в 50-миллилитровых пробирках BlueMax (фирма Falcon, кат.2070: 2 нг/лунку(несущая репортерный ген люциферазы плазмида) Реагент для трансфекции (Б) (в 14-миллилитровых полипропиленовых пробирках (фирма Falcon,кат.2059:(непосредственно добавляется в среду) 0,3 мкл/лунку Растворы А и Б инкубировали в течение 5 мин при комнатной температуре (КТ). После этого раствор Б по каплям добавляли к раствору А и перемешивали. Затем объединенный раствор А+Б инкубировали в течение 15 мин при КТ. Смесь для трансфекции, полученную объединением растворов А и Б, разводили для 4 планшетов 22,5 мл DMEM-среды, дополненной 5% ОУТС и ПСГ-смесью. В каждую лунку к находящимся в ней клеткам добавляли по 100 мкл этого разведения и инкубировали в течение ночи (16-18 ч) при 37 С в атмосфере с 8,5% содержанием CO2. На каждом планшете трансфекции подвергали клетки только в 60 лунках, а расположенные по краю лунки содержали только среду. Обработка гормонами. Для построения кривых доза-эффект в 96-луночных планшетах (фирма Costar, кат.3595), исходя из 10-3-молярных маточных растворов в диметилсульфоксиде (ДМСО, фирма Sigma, кат.D-2650), приготавливали серийные разведения сравнительных и тестируемых веществ. 10-3-молярные растворы в ДМСО хранили при -20 С, при этом перед отбором их необходимо тщательно перемешать, чтобы раствор был гомогенным (в течение 15 мин при 37 С). Шаг разведения следует выбирать с таким расчетом, чтобы конечные концентрации на опытном планшете, используемом для исследования агонизма, лежали в интервале от 10-7 до 10-12 М (для Е 2: от 10-8 до 10-13 М). В соответствии с этим все разведения содержали 1% ДМСО. После трансфекции среду для трансфекции заменяли на DMEM-среду, дополненную 5% ОУТС и ПСГ-смесью, добавляя ее по 180 мкл в каждую лунку. Для исследования антагонизма клетки дополнительно обрабатывали эстрадиолом. После этого к ним с помощью пипетки добавляли по 20-мкл разведении сравнительных и тестируемых веществ. В качестве негативного контроля использовали DMEM-среду, дополненную 1% ДМСО, из расчета по 20 мкл на лунку. Конечные концентрации тестируемых веществ составляли 310-11 М для рецепторов ER, соответственно, 310-10 М для рецепторов ER. В качестве сравнительного вещества использовали известный антиэстроген фулвестрант (фирма AstraZeneca) в тех же концентрациях (табл. 2). Клетки инкубировали в течение ночи (16-18 ч) при 37 С в атмосфере с 8,5% содержанием СО 2. Лизис клеток и определение люциферазной активности. После отделения среды вакуум-фильтрацией к клеткам добавляли по 30 мкл реактива для лизисаLysis 1Reagent (фирма Promega, кат.Е 1531) и инкубировали в течение 0,5-1 ч при КТ и при интенсивном встряхивании (шютль-аппарат IKA-VIBRAX-VXR, 600 об/мин). После этого лизаты смешивали с 30 мкл субстрата А для люциферазы (фирма PharMingen, кат.556867) и 30 мкл субстрата Б для люциферазы (фирма PharMingen, кат.556869). Люциферазную активность определяли через 30 с после добавления субстрата Б в циклическом режиме работы люминометра (фирма DYNATECH, модель ML3000). Результаты измерений обрабатывали с помощью поставляемого изготовителем измерительного прибора в комплекте с ним программного обеспечения (BioLinx). Для графического представления результатов в виде кривых доза-эффект для агонизма и антагонизма использовали программу Sigma Plot,вычисляя средние значения (n=3) и стандартное отклонение. Для расчета значений ЕС 50, эффективности и значений EMR для агонизма, соответственно значений IC50 и эффективности для антагонизма, можно использовать программное обеспечение "MTS" (табл. 2).- 11009606 Физико-химические свойства. По сравнению с соединениями, известными из WO 01/77138, предлагаемые в изобретении соединения обладают лучшими физико-химическими свойствами касательно коэффициента распределения[logD (ЖХВР-метод, рН 7,0, 25 С)] и/или растворимости [Sw (турбидиметрия, рН 7,4, 25 С)] (табл. 2). Помимо этого неожиданно удалось также повысить активность в отношении рецепторов ER (значение EMR) и/или избирательность в пользу рецепторов ER. Таблица 2- 12009606 Примеры по исследованию контрацептивного действия Исследование на ранней стадии фолликулогенеза. В организм не достигших половой зрелости самок крыс на протяжении четырех дней (дни 1-4) вводили комбинацию из цетрореликса и ER-избирательного эстрогена, в качестве которого использовали 8-винилэстра-1,3,5(10)-триен-3,17-диол (в дозировке 25 мг/кг, подкожно). Дополнительно к этому на протяжении тех же четырех дней (дни 1-4) в организм других животных вводили наполнитель или действующее вещество в различных дозировках (1, 3, 10, 30 мг/кг, подкожно). На 5-й день животных умерщвляли и подвергали вскрытию. После извлечения яичника его исследовали макроскопически, например взвешивали, и микроскопически, например гистологически оценивали фолликул. Исследование на поздних стадиях фолликулогенеза и на стадии овуляции. Не достигших половой зрелости самок крыс подвергали гипофизэктомии. День такой операции принимали за день 0. На протяжении последующих четырех дней (дни 1-4) в организм животных подкожно и/или перорально вводили действующее вещество в сочетании с 17-эстрадиолом. На 5-й день животным путем подкожной инъекции вводили ГСЖК (гонадотропин сыворотки жеребых кобыл). На 7-й день животным для инициирования овуляции внутрибрюшинно вводили хорионический гонадотропный гормон. На 8-й день животных умерщвляли и извлекали яичник, который исследовали макроскопически (например, взвешивали) и/или микроскопически (например, гистологически оценивали фолликул). Маточные трубы продували и исследовали на наличие в них яйцеклеток. Исследование на стадии овуляции. Не достигшим половой зрелости самкам крыс возрастом 23 дня подкожно вводили ГСЖК (гонадотропин сыворотки жеребых кобыл) (день 1). В тот же день, а также через 24 и 48 ч животным подкожно или перорально вводили действующее вещество. Через 54 ч после инъекции ГСЖК животным для инициирования овуляции путем внутрибрюшинной инъекции вводили хорионический гонадотропный гормон. Через 16 ч после введения хорионического гонадотропного гормона животных умерщвляли и подвергали вскрытию. Маточные трубы продували и исследовали на наличие в них яйцеклеток. Другая возможность экспериментального подтверждения избирательного (диссоциированного) эстрогенного действия предлагаемых в изобретении соединений in vivo состоит в оценке того влияния, которое указанные соединения после их однократного введения оказывают у крыс на уровень экспрессии 5HT2a-рецепторного белка и белка-переносчика серотонина и на уровень экспрессии соответствующей мРНК в областях головного мозга с высокой концентрацией рецепторов ER. При этом влияние на экспрессию рецептора и переносчика серотонина сравнивают с влиянием на секрецию лютеинизирующего гормона (ЛГ). Соединения с более высокой степенью связывания (аффинности) с эстрогенными рецепторами из предстательной железы крыс по сравнению со степенью связывания с эстрогенными рецепторами из матки крыс обладают более высоким потенциалом касательно повышения уровня экспрессии рецептора и переносчика серотонина по сравнению с их положительным влиянием на выброс ЛГ. Концентрацию рецепторов и переносчиков серотонина определяют на срезах головного мозга с помощью радиоактивных лигандов, а наличие соответствующей мРНК определяют путем гибридизации in situ. Рассмотренная выше методика известна из литературы и описана, в частности, у G. Fink и В.Е.Н. Sumner,Nature 383, 1996, p. 306, а также у В.Е.Н. Sumner et al., Molecular Brain Research, 1999 (в печати). Способы получения предлагаемых в изобретении соединений. Настоящее изобретение относится также к промежуточным продуктам общей формулы к промежуточным продуктам общей формулы к промежуточным продуктам общей формулы- 13009606 а также к промежуточным продуктам общей формулы где остатки X, R3, R17, R17' и n имеют те же значения, что и указанные для общей формулы I. Соединения общих формул IV-Х используют в качестве промежуточных продуктов в способе получения соединений общей формулы I 1) Ангидрид трифторметансульфоновой кислоты/пиридин. 2) Соединение общей формулы X, ацетат палладия(II)/трифенилфосфин/йодид меди(I)/пиперидин/50 С. 3) Палладий/карбонат магния (10%)/давление водорода 1 бар/тетрагидрофуран/метанол. 4) Диизобутилалюмогидрид/толуол/0 С. 5) Работа с защитными группами. 6 а): Работа с защитными группами,6 б) Pd/C (10%)/давление водорода 100 бар/тетрагидрофуран/метанол. 7) Олефинирование по Виттигу действием Ph3P=CH. Соединения общей формулы IV можно получать методом, описанным в заявке WO 01/77139, а промежуточные продукты общей формулы V также известны из заявки РСТ/ЕР 02/11533. Настоящее изобретение относится далее к способам получения соединений общей формулы I, а также к соответствующим способам получения отдельных промежуточных продуктов формул VI-IX. Предлагаемые в изобретении соединения общей формулы I можно получать по методам, описанным в примерах. Аналогичным путем с использованием реагентов-гомологов таковых, описанных в примерах, можно получать другие соединения общей формулы I. Этерификацию свободных гидроксигрупп с образованием простых и/или сложных эфиров осуществляют известными методами.- 14009606 Предлагаемые в изобретении соединения могут быть представлены по 17-му атому углерода в виде,-стереоизомеров. Предлагаемые в изобретении соединения при их получении описанными ниже в примерах методами преимущественно образуются в виде смесей соответствующих ,-изомеров. Такие смеси можно разделять на индивидуальные изомеры, например, хроматографическими методами. Согласно общей формуле I возможные заместители уже могут присутствовать в окончательной форме или в форме одного из их предшественников в исходном соединении, т.е. эстроне, схема замещения которого уже соответствует таковой в требуемом конечном продукте. Заместители в 17-е положение также вводят по известным методам путем нуклеофильного присоединения требуемого заместителя или его реакционноспособного предшественника и затем при необходимости подвергают последующим структурным превращениям. Предлагаемые в изобретении карбоксилаты эстратриенов получают также известными методами из соответствующих гидроксистероидов (см., например, "Pharmazeutische Wirkstoffe, Synthesen, Patente,Anwendungen", A. Kleemann, J. Engel, изд-во Georg. Thieme Verlag. Stuttgart, 1978; "Arzneimittel,Fortschritte, 1972 bis 1985", A. Kleemann, E. Lindner, J. Engel, изд-во VCH, 1987, p. 773-814). Предлагаемые в изобретении сульфаматы эстратриенов можно получать известным методом из соответствующих гидроксистероидов путем этерификации сульфамоилхлоридами в присутствии основания (Z. Chem. 15, 1975, p. 270-272; Steroids 61, 1996, p. 710-717). В результате последующего ацилирования сульфамидной группы получают предлагаемые в изобретении (N-ацил)сульфаматы, фармакокинетические преимущества которых при отсутствии у них заместителя в положении 8 уже нашли свое подтверждение (см. WO 97/14712). Региоселективную этерификацию полигидроксилированных стероидов N-замещенными иN-незамещенными сульфамоилхлоридами проводят после частичной защиты тех гидроксильных групп,которые должны остаться неэтерифицированными. В качестве защитных групп с пригодной для этой цели избирательной реакционной способностью целесообразно использовать силиловые эфиры, поскольку в условиях образования сульфамата они остаются стабильными, а их повторное отщепление для регенерирования остальной(ых), еще сохранившейся(ихся) в молекуле гидроксильной(ых) группы(групп) не затрагивает сульфаматную группу (Steroids 61, 1996, p. 710-717). Предлагаемые в изобретении сульфаматы с одной или несколькими дополнительными гидроксильными группами в молекуле можно получать также исходя из соответствующих гидроксистероидных кетонов. Сначала в зависимости от поставленной цели одну или несколько присутствующих гидроксильных групп подвергают сульфамоилированию. После этого сульфаматные группы при необходимости можно переводить с использованием требуемого ацилхлорида в присутствии основания в соответствующие (N-ацил)сульфаматы. Получаемые в результате оксосульфаматы или оксо(N-ацил)сульфаматы восстановлением превращают в соответствующие гидроксисульфаматы,соответственно гидрокси(N-ацил)сульфаматы (Steroids 61, 1996, p. 710-717). При этом целесообразно использовать борогидрид натрия и боран-диметилсульфидный комплекс. Вместе с тем заместители, указанные в формуле I, можно вводить и в уже замещенные в положении 8 эстратриены. Сказанное может оказаться целесообразным или даже необходимым прежде всего при многократном замещении целевого конечного соединения. Ниже изобретение более подробно рассмотрено на примерах. Исходным материалом для подобного синтеза служат производные 11-кетоэстратетраенов (US 3491089, Tetrahedron Letters 37, 1967, p. 3603),замещение которых при взаимодействии с цианидом диэтилалюминия происходит стереоселективно в положении 8. Синтез соединений (1) известен из литературы (WO 01/77139). В результате перевода в-9,11-енолтрифлат и последующей реакции сочетания по Соногашира (Sonogashira) получают 8-замещенные 11-алкилэстра-1,3,5(10),9(11)-тетраены. Цианогруппу в положении 8 можно затем переводить в 8-альдегид. Функционализация (например, по реакции Виттига) после гидрирования двойной связи С(9)-С(11) позволяет получать предлагаемые в изобретении 8,11-двузамещенные стероиды(схема 1). Полученные сначала при проведении этой последовательной реакции 8-замещенные 11-алкилэстра-1,3,5(10),9(11)-тетраены, равно как и 8-замещенные 11-алкилэстра-1,3,5(10)-триены можно подвергать дальнейшим превращениям по известным методам с получением самых разнообразных схем замещения у стероида. В приведенных ниже примерах и на схемах используются следующие аббревиатуры и сокращения: ТГП тетрагидропиран-2-ил,Me метил,Bn бензил,Tf трифторметансульфонил,ТБС трет-бутилдиметилсилил,ТМС триметилсилил,экв. эквивалент.- 15009606 Синтез 5-бензилоксипент-1-ина. К суспензии 17,4 г гидрида натрия (55%) в 200 мл ДМФ по каплям добавляют при 0 С 15 мл 4-пентин-1-ола и в течение 1 ч перемешивают при 0 С. Затем при этой температуре по каплям добавляют 30 мл бензилбромида и перемешивание продолжают еще в течение 2 ч при 0 С. После этого реакцию осторожно нейтрализуют 1 н. соляной кислотой. Далее фазы разделяют, распределяя между диэтиловым эфиром и водой, и водную фазу экстрагируют несколько раз диэтиловым эфиром. Объединенные органические фазы промывают водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Остаток отгоняют в вакууме,создаваемом масляным насосом и в результате получают 22,7 г 5-бензилоксипент-1-ина в виде бесцветного масла. Синтез альдегида 9 а (схема 1). 3-Метокси-17-(тетрагидропиран-2-илокси)-11-трифторметансульфонилоксиэстра-1,3,5(10),9(11)тетраен-8-карбонитрил (2). К раствору 20 г кетона 1 в 490 мл пиридина по каплям добавляют при 0 С 16 мл ангидрида трифторметансульфоновой кислоты и перемешивают до полного завершения обменной реакции при комнатной температуре. Пиридин отгоняют с помощью толуола в качестве сорастворителя, остаток растворяют в этилацетате, промывают 1 н. соляной кислотой, водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Остаток фильтруют через силикагель (циклогексан/этилацетат) и в результате получают 18,12 г трифлата 2 в виде светло-желтого пенистого вещества, которое без дальнейшей очистки используют на следующей стадии. 11-[5-(Бензилокси)пент-1-инил]-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)тетраен-8-карбонитрил (3). К раствору 18,1 г трифлата 2 в 170 мл пиридина последовательно добавляют 0,75 г ацетата палладия(II) (47%), 1,8 г трифенилфосфина и 1,28 г йодида меди(I), после чего по каплям добавляют раствор 11,66 г 5-бензилоксипент-1-ина в 50 мл пиридина. Затем полученный раствор нагревают до 50 С и перемешивают до полного завершения обменной реакции. Для последующей переработки фазы разделяют,распределяя между диэтиловым эфиром и водой, и водную фазу несколько раз экстрагируют диэтиловым эфиром. Объединенные органические фазы нейтрализуют 1 н. соляной кислотой, промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (циклогексан/этилацетат) и в результате получают 15,26 г алкина 3 в виде светло-коричневого пенистого вещества [ЖХ-МС: m/z теор.: 565, факт.: 566 (М+Н)+]. 11-[5-(Бензилокси)пентил]-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраен 8-карбонитрил (4). Раствор 15,26 г алкина 3 в 300 мл смеси тетрагидрофурана и метанола (в соотношении 3:1) смешивают с 2,7 г палладия (10% на карбонате магния) и перемешивают в атмосфере водорода (давление 1 бар) до полного завершения обменной реакции при комнатной температуре. Для последующей переработки фильтруют через целит и концентрируют в вакууме. В результате получают 15,4 г бесцветного пенистого вещества 4, которое без дальнейшей очистки используют на следующей стадии (ГХ-МС: m/z теор.: 569,факт.: 569). 11-[5-(Бензилокси)пентил]-17-гидрокси-3-метоксиэстра-1,3,5(10), 9(11)-тетраен-8-карбальдегид (5). К раствору 15,4 г нитрила 4 в 280 мл толуола по каплям добавляют при -10 С раствор 28 мл диизобутилалюмогидрида в 83 мл толуола. Образовавшийся раствор перемешивают до полного завершения обменной реакции при 0 С, последовательно смешивают с 460 мл толуола, 92 мл насыщенного раствора гидрокарбоната натрия и 9 мл 2-пропанола и в течение нескольких часов перемешивают при комнатной температуре. Затем фильтруют через целит и фильтрат концентрируют. Полученное таким путем бесцветное пенистое вещество растворяют в 280 мл смеси этанола и воды (в соотношении 5:1), добавляют 28,75 г n-толуолсульфоновой кислоты, раствор нагревают до 60 С и перемешивают до полного завершения обменной реакции. Затем большую часть этанола удаляют с помощью роторного испарителя, остаток разбавляют этилацетатом, промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (циклогексан/этилацетат) и в результате получают 12,49 г альдегида 5 в виде вязкой массы светло-коричневого цвета (ГХ-МС: m/z теор.: 488, факт.: 488). 11-[5-(Бензилокси)пентил]-17-(трет-бутилдиметилсилилокси)-3-метоксиэстра-1,3,5(10),9(11)тетраен-8-карбальдегид (6). К раствору 12,49 г спирта 5 в 160 мл N,N-диметилформамида при 0 С последовательно добавляют 4,46 г имидазола и 9,66 г трет-бутилдиметилсилилхлорида и перемешивают до полного завершения обменной реакции при комнатной температуре. Для последующей переработки водную фазу смешивают с водой и несколько раз экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Оста- 16009606 ток очищают колоночной хроматографией (циклогексан/этилацетат) и в результате получают 14,36 г простого силилового эфира 6 в виде вязкой массы желтого цвета (ГХ-МС: m/z теор.: 602, факт.: 602). 17-(трет-Бутилдиметилсилилокси)-11-(5-гидроксипентил)-3-метоксиэстра-1,3,5(10)-триен-8 карбальдегид (7). Раствор 14,36 г тетраена 6 в 400 мл смеси тетрагидрофурана и метанола (в соотношении 3:1) смешивают с 2,8 г палладия (10% на угле) и в атмосфере водорода (давление 100 бар) перемешивают в течение 2 дней при комнатной температуре. Данную реакцию повторяют дважды. Для последующей переработки фильтруют через целит и концентрируют в вакууме. Остаток очищают колоночной хроматографией (циклогексан/этилацетат) и в результате получают 8,25 г соединения 7 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 514, факт.: 514). Общая методика олефинирования эстратриен-8-карбальдегидов по Виттигу. Суспензию гидрида натрия (80%, 15 экв.) в диметилсульфоксиде (0,5 мл/ммоль) нагревают в течение 1 ч до 70 С. Затем при комнатной температуре по каплям добавляют раствор соответствующего бромида алкилтрифенилфосфония (15 экв.) в диметилсульфоксиде (2 мл/ммоль). Реакционный раствор при этом приобретает светло-зеленую окраску и его перемешивают в течение последующего часа при комнатной температуре. Далее к раствору илида при комнатной температуре по каплям добавляют раствор соответствующего 8-карбальдегида в диметилсульфоксиде (5 мл/ммоль). Образовавшийся раствор перемешивают до полного завершения обменной реакции при 40 С, охлаждают до 0 С и смешивают с водой. Затем несколько раз экстрагируют диэтиловым эфиром, объединенные органические фазы промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают соответствующие олефины. 17-трет-Бутилдиметилсилилокси-11-(5-гидроксипентил)-3-метокси-8-винилэстра-1,3,5(10)-триен (8). Из 4 г альдегида 7 взаимодействием с бромидом метилтрифенилфосфония аналогично общей методике олефинирования получают 3,62 г олефина 8 в виде бесцветного пенистого вещества (ГХ-МС:m/z теор.: 512, факт.: 512). 5-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]валеральдегид (9 а). 1,24 г хлорхромата пиридиния предварительно помещают в 9 мл дихлорметана, после чего сначала по каплям добавляют раствор 1,5 г спирта 8 в 15 мл дихлорметана, а затем добавляют 940 мг целита. Смесь перемешивают при комнатной температуре до полного завершения обменной реакции, концентрируют с помощью роторного испарителя, затем растворяют в диэтиловом эфире и фильтруют через силикагель. В результате получают 1,41 г альдегида 9 а в виде вязкой массы светло-желтого цвета(ГХ-МС: m/z теор.: 510, факт.: 510), которую без дальнейшей очистки используют в последующей реакции. Синтез альдегида 9b (схема 2). 11-(5-Бромпентил)-17-трет-бутилдиметилсилилокси-3-метокси-8-винилэстра-1,3,5(10)-триен (10). К раствору 2,11 г спирта 8 в 41 мл дихлорметана последовательно добавляют 1,62 г трифенилфосфина и 420 мг имидазола. Затем раствор охлаждают до 0 С и добавляют 2,05 г тетрабромметана. Смесь нагревают до комнатной температуры и перемешивают до полного завершения обменной реакции. Для последующей переработки разбавляют дихлорметаном, органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 2,3 г бромида 10 в виде бесцветной вязкой массы (ГХ-МС: m/z теор.: 574, факт.: 574). 6-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]капронитрил (11 а). К раствору 2,3 г бромида 10 в 20 мл N,N-диметилформамида добавляют 295 мг цианида натрия и каталитическое количество йодида натрия. Затем смесь перемешивают до полного завершения обменной реакции при комнатной температуре. Для последующей переработки разбавляют диэтиловым эфиром,органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. В результате получают 1,97 г цианида 11a в виде бесцветного пенистого вещества, которое без дальнейшей очистки используют на следующей стадии (ГХ-МС: m/z теор.: 521, факт.: 521). 6-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]капрональдегид (9b). К раствору 1,16 г цианида 11 а в 23 мл толуола по каплям добавляют при -10 С раствор 1 мл диизобутилалюмогидрида в 1 мл толуола. Раствор перемешивают при этой температуре -10 С до полного завершения обменной реакции, затем последовательно смешивают с 17 мл толуола, 6 мл насыщенного раствора гидрокарбоната натрия и 0,7 мл 2-пропанола и перемешивание продолжают еще в течение нескольких часов при комнатной температуре. Далее фильтруют через целит и фильтрат концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 1,13 г альдегида 9b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 524, факт.: 524).- 17009606 Синтез бромида 13 (схема 2). 17-трет-Бутилдиметилсилилокси-11-(6-гидроксигексил)-3-метокси-8-винилэстра-1,3,5(10)-триен (12). К раствору 1,95 г альдегида 9b в 37 мл смеси тетрагидрофурана и метанола ( в соотношении 1:1) добавляют при 0 С 282 мг борогидрида натрия. Раствор перемешивают до полного завершения обменной реакции. Для последующей переработки разбавляют диэтиловым эфиром, органическую фазу промывают 1 н. соляной кислотой, водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 1,06 г спирта 12 в виде бесцветной вязкой массы (ГХ-МС:m/z теор.: 526, факт.: 526). 11-(6-бромгексил)-17-трет-бутилдиметилсилилокси-3-метокси-8-винилэстра-1,3,5(10)-триен (13). 930 мг спирта 12 подвергают обменной реакции по методике, аналогично указанной выше по переводу спирта 8 в бромид 10. Таким путем получают 975 мг бромида 13 в виде бесцветного вязкого масла(ГХ-МС: m/z теор.: 588, факт.: 588). Синтез альдегида 9 с (схема 3). 7-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]гептанитрил (11b). Йодид (цианометил)триметилфосфония полностью синтезируют по методике, известной из литературы (Journ. Org. Chem. 66, 2001, p. 2518-2521), с использованием триметилфосфина и йодацетонитрила. К раствору 1 г спирта 8 в 18 мл пропионитрила добавляют 2,42 г йодида (цианометил)триметилфосфония и затем по каплям добавляют 2,1 мл диизопропилэтиламина. Реакционную смесь в течение 14 ч перемешивают при 97 С. После охлаждения до комнатной температуры смесь смешивают с 10 мл воды и 1 мл концентрированной соляной кислоты. Фазы разделяют, распределяя между этилацетатом и водой. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 480 мг цианида 11b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 535, факт.: 535). 7-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]гептанал (9 с). К раствору 480 мг цианида 11b в 10 мл толуола при -10 С добавляют по каплям раствор 0,4 мл диизобутилалюмогидрида в 0,4 мл толуола. Раствор перемешивают при этой температуре -10 С до полного завершения обменной реакции, после чего последовательно смешивают с 8 мл толуола, 3 мл насыщенного раствора гидрокарбоната натрия и 0,3 мл 2-пропанола и продолжают перемешивание еще в течение нескольких часов при комнатной температуре. Затем фильтруют через целит и фильтрат концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 361 мг альдегида 9 с в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 538, факт.: 538). Пример 1. Общая методика проведения обменной реакции между альдегидами 9 а-с и(перфторалкил)триметилсиланами и последующее отщепление триметилсилилового эфира с помощью тригидрата фторида тетрабутиламмония (схемы 4 и 5). К раствору соответствующего карбонильного соединения (1 экв.) в тетрагидрофуране (2 мл/ммоль) добавляют каталитическое количество тригидрата фторида тетрабутиламмония, раствор охлаждают до-20 С и по каплям добавляют (перфторалкил)триметилсилан (15 экв.). Затем охлаждающую баню удаляют и раствор перемешивают до полного завершения обменной реакции при комнатной температуре. Для последующей переработки разбавляют диэтиловым эфиром, органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Полученный таким путем триметилсилиловый эфир после проведенной очистки колоночной хроматографией частично нестабилен и его подвергают взаимодействию в смеси с его соответствующим спиртом. С этой целью смесь растворяют в тетрагидрофуране (10 мл/ммоль), смешивают при комнатной температуре с тригидратом фторида тетрабутиламмония (1,5 экв.) и до полного завершения обменной реакции перемешивают при комнатной температуре. Для дальнейшей переработки разбавляют диэтиловым эфиром, органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают соответствующие перфторалкилзамещенные спирты в виде бесцветных пенистых веществ. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-6,6,6-трифтор-5-гидроксигексил]-8 винилэстра-1,3,5(10)-триен (14 а). Из 900 мг альдегида 9 а взаимодействием с (трифторметил)триметил-силаном по методике, аналогичной 1.1, получают 804 мг спирта 14 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 580,факт.: 580) и смесь его диастереомеров. Общая методика одновременного отщепления трет-бутилдиметилсилилового эфира и метилового эфира с помощью трихлорида бора и йодида тетрабутиламмония (схемы 2-8). К охлажденному до -78 С раствору соответствующего стероида и йодида тетрабутиламмония(1,5 экв. на каждый из отщепляемых эфиров, дополнительный 1 экв. на каждую основную группировку) в дихлорметане (5 мл/ммоль) по каплям добавляют соответствующее количество трихлорида бора(1,5 экв. на каждый из отщепляемых эфиров, дополнительный 1 экв. на каждую основную группировку).- 18009606 Затем раствор медленно нагревают до 0 С и перемешивают до полного завершения обменной реакции. Для последующей переработки смесь смешивают со смесью воды и льда и перемешивают в течение примерно 30 мин, после чего примешивают насыщенный раствор гидрокарбоната натрия и несколько раз экстрагируют дихлорметаном. Объединенные органические фазы сушат с помощью сульфата магния и концентрируют. Образовавшийся остаток очищают колоночной хроматографией и в результате получают соответствующие эстрадиолы. 11-[(R/S)-6,6,6-Трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (15 а D1/2). Из 100 мг стероида 14 а по реакции, проводимой по методике, аналогичной 1.2, получают 78 мг слегка окрашенной в желтый цвет вязкой массы, представляющей собой, как было установлено,3-метиловый эфир. Далее этот 3-метиловый эфир растворяют в 2,7 мл толуола, раствор охлаждают до 0 С и к нему по каплям добавляют 0,5 мл диизобутилалюмогидрида. Затем раствор до полного завершения обменной реакции нагревают с обратным холодильником. Для последующей переработки раствор охлаждают до 0 С и последовательно добавляют к нему по каплям этанол (1 мл), смесь этанола и воды(в соотношении 1:1,2 мл) и полуконцентрированную соляную кислоту (2 мл). Фазы разделяют, распределяя между диэтиловым эфиром и водой, и водную фазу несколько раз экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 62 мг эстратриендиола 15 а в виде бесцветной вязкой массы (ГХ-МС: m/z теор.: 452, факт.: 452) и смесь его диастереомеров D1 и D2. Эти диастереомеры разделяют препаративной ЖХВР (жидкостная хроматография высокого разрешения, колонка Chiralpak AD 25010 мм, элюент н-гептан/2-пропанол в объемном соотношении 9:1, 4,7 мл/мин) с получением соответственно 16 мг обоих диастереомеров 15 а D1 ([]D=66, хлороформ) и 15a D2 ([]D=33, хлороформ). По данным рентгеновского структурного анализа обоих диастереомеров после их разделения один из них - 15 а D1 - имеет R-, а другой - 15 а D2 -S-конфигурацию у эпимерного центра. Пример 2. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-7,7,7-трифтор-6-гидроксигептил]-8 винилэстра-1,3,5(10)-триен (14b). Из 500 мг альдегида 9b взаимодействием с (трифторметил)триметилсиланом по методике, аналогичной 1.1, получают 292 мг спирта 14b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 594,факт.: 594) и смесь его диастереомеров. 11-[(R/S)-7,7,7-Трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (15b D1/2). Из 90 мг стероида 14b по реакции, проводимой по методике, аналогичной 1.2, получают 56 мг эстратриендиола 15b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 466, факт.: 466) и смесь его диастереомеров D1/D2. Эти диастереомеры разделяют препаративной ЖХВР (колонка Chiralpak OD 25051 мм, элюент н-гексан/2-пропанол в объемном соотношении 9:1, 100 мл/мин) с получением 9 мг диастереомера 15b D1 и 7 мг диастереомера 15b D2. Пример 3. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-8,8,8-трифтор-7-гидроксиоктил]-8 винилэстра-1,3,5(10)-триен (14 с). Из 360 мг альдегида 9 с взаимодействием с (трифторметил)триметилсиланом по методике, аналогичной 1.1, получают 370 мг спирта 14 с в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 608,факт.: 608) и смесь его диастереомеров. 11-[(R/S)-8,8,8-трифтор-7-гидроксиоктил 1-8-винилэстра-1,3,5(10)-триен-3,17-диол (15 с D1/2). Из 90 мг стероида 14 с по реакции, проводимой по методике, аналогичной 1.2, получают 78 мг эстратриендиола 15 с в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 466, факт.: 466) и смесь его диастереомеров D1/2. Эти диастереомеры разделяют препаративной ЖХВР (колонка Chiralpak AD 25060 мм, элюент н-гексан/этанол в объемном соотношении 95:5, 80 мл/мин) с получением 23 мг диастереомера 15 с D1 и 17 мг диастереомера 15 с D2. Пример 4. Общая методика окисления трифторметилзамещенных спиртов (схема 4). К суспензии периодинана Десса-Мартина (6 экв.) в дихлорметане (5 мл/ммоль) по каплям добавляют при комнатной температуре раствор соответствующего спирта (1 экв.) в дихлорметане (15 мл/ммоль) и перемешивают до полного завершения обменной реакции. Затем смесь смешивают с водой и перемешивают в течение примерно 30 мин. Фазы разделяют, распределяя между диэтиловым эфиром и водой, и водную фазу несколько раз экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают насыщенным раствором тиосульфата натрия, насыщенным раствором гидрокарбоната натрия,водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают соответствующие кетоны. 6-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]-1,1,1 трифторгексан-2-он (16 а).- 19009606 Из 312 мг спирта 14 а по реакции, проводимой по методике, аналогичной 4.1, получают 252 мг кетона 16 а в виде желтой вязкой массы (ГХ-МС: m/z теор.: 578, факт.: 578). 17-трет-Бутилдиметилсилилокси-3-метокси-11-[6,6,6-трифтор-5-трифторметил-5-(триметилсилилокси)гексил]-8-винилэстра-1,3,5(10)-триен (17 а). Из 200 мг спирта 16 а его взаимодействием с (трифторметил)триметилсиланом по методике, аналогичной 1.1, после очистки колоночной хроматографией получают 200 мг стабильного триметилсилилового эфира 17 а в виде светло-желтой вязкой массы (ГХ-МС: m/z теор.: 720, факт.: 720). Этот эфир без проведения взаимодействия с тригидратом фторида тетрабутиламмония используют на следующей стадии. 11-[6,6,6-Трифтор-5-гидрокси-5-(трифторметил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (18 а). Из 200 мг стероида 17 а по реакции, проводимой по методике, аналогичной 1.2, получают 19 мг эстратриендиола 18 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 520, факт.: 520) вместе с 46 мг образующегося в качестве побочного продукта непрореагировавшего триметилсилилового эфира,который взаимодействием с тригидратом фторида тетрабутиламмония в тетрагидрофуране (ср. методику 1.1/отщепление триметилсилилового эфира) переводят в соединение 18 а (33 мг). Пример 5. 7-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]-1,1,1 трифторгептан-2-он (16b). Из 182 мг спирта 14b по реакции, проводимой по методике, аналогичной 4.1, получают 131 мг кетона 16b в виде желтой вязкой массы (ГХ-МС: m/z теор.: 592, факт.: 592). 17-трет-Бутилдиметилсилилокси-3-метокси-11-[7,7,7-трифтор-6-трифторметил-6-(триметилсилилокси)гептил]-8-винилэстра-1,3,5(10)-триен (17b). Из 131 мг спирта 16b взаимодействием с (трифторметил)триметилсиланом по методике, аналогичной 1.1, получают 162 мг триметилсилилового эфира 17b в виде желтой вязкой массы (ГХ-МС: m/z теор.: 734, факт.: 734). Этот эфир без проведения взаимодействия с тригидратом фторида тетрабутиламмония используют на следующей стадии. 11-[7,7,7-Трифтор-6-гидрокси-6-(трифторметил)гептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол(18b). Из 161 мг стероида 17b по реакции, проводимой по методике, аналогичной 1.2, получают 57 мг непрореагировавшего триметилсилилового эфира. Из 37 мг этого триметилсилилового эфира взаимодействием с тригидратом фторида тетрабутиламмония в тетрагидрофуране (ср. методику 1.1/отщепление триметилсилилового эфира) получают 20 мг эстратриендиола 18b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 534, факт.: 534). Пример 6. 8-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]-1,1,1 трифтороктан-2-он (16 с). Из 200 мг спирта 14 с по реакции, проводимой по методике, аналогичной 4.1, получают 138 мг кетона 16 с в виде желтой вязкой массы (ГХ-МС: m/z теор.: 606, факт.: 606). 17-трет-Бутилдиметилсилилокси-3-метокси-11-[8,8,8-трифтор-7-трифторметил-7-(триметилсилилокси)октил]-8-винилэстра-1,3,5(10)-триен (17 с). Из 135 мг спирта 16 с взаимодействием с (трифторметил)триметилсиланом по методике, аналогичной 1.1, получают 159 мг триметилсилилового эфира 17 с в виде желтой вязкой массы (ГХ-МС: m/z теор.: 748, факт.: 748). Этот эфир без проведения взаимодействия с тригидратом фторида тетрабутиламмония используют на следующей стадии. 11-[8,8,8-Трифтор-7-гидрокси-7-(трифторметил)октил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (18 с). Из 155 мг стероида 17 с по реакции, проводимой по методике, аналогичной 1.2, получают 57 мг непрореагировавшего триметилсилилового эфира, из которого взаимодействием с тригидратом фторида тетрабутиламмония в тетрагидрофуране (ср. методику 1.1/отщепление триметилсилилового эфира) получают 45 мг эстратриендиола 18 с в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 548, факт.: 548). Пример 7. Общая методика проведения реакции между альдегидами 9 а-b и пентафторэтиллитием (схема 5). К 1-молярному раствору пентафторэтилйодида (10 экв. в пересчете на карбонильное соединение) в тетрагидрофуране при -78 С по каплям добавляют н-бутиллитий (1-молярный в гексане, 1 экв.) и раствор перемешивают при -78 С в течение 1 ч. Затем при этой температуре по каплям добавляют раствор соответствующего карбонильного соединения в тетрагидрофуране (5 мл/ммоль). Раствор медленно нагревают и перемешивают до полного завершения обменной реакции. Для последующей переработки раствор смешивают с насыщенным раствором хлорида аммония и несколько раз экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают водой и насыщенным раствором хлорида натрия,сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают соответствующие пентафторэтилзамещенные спирты.- 20009606 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-7,7,7,6,6-пентафтор-5-гидроксигептил]-8 винилэстра-1,3,5(10)-триен (19 а). Из 55 мг альдегида 9 а по реакции, проводимой по методике, аналогичной 7.1, получают 61 мг спирта 19 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 630, факт.: 630) и смесь его диастереомеров. 11-[(R/S)-7,7,7,6,6-Пентафтор-5-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (20 а D1/2). Из 60 мг стероида 19 с по реакции, проводимой по методике, аналогичной 1.2, получают 26 мг эстратриендиола 20 а D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 502, факт.: 502) и смесь его диастереомеров. Пример 8. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-8,8,8,7,7-пентафтор-6-гидроксиоктил]-8 винилэстра-1,3,5(10)-триен (19b). Из 45 мг альдегида 9b по реакции, проводимой по методике, аналогичной 7.1, получают 47 мг спирта 19b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 644, факт.: 644) и смесь его диастереомеров. 11-[(R/S)-8,8,8,7,7-Пентафтор-6-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (20b D1/2). Из 45 мг стероида 19b по реакции, проводимой по методике, аналогичной 1.2, получают 16 мг эстратриендиола 20b D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 516, факт.: 516) и смесь его диастереомеров. Пример 9. 17-трет-Бутилдиметилсилилокси-11-[(R/S)-8,8,8,7,7,6,6-гептафтор-5-триметилсилилоксиоктил]-3 метокси-8-винилэстра-1,3,5(10)-триен (21 а). Из 60 мг альдегида 9 а взаимодействием с (гептафторпропил)триметил-силаном по методике, аналогичной 1.1, получают 81 мг стабильного триметилсилилового эфира 21 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 752, факт.: 752) и смесь его диастереомеров. Этот эфир без проведения взаимодействия с тригидратом фторида тетрабутиламмония используют на следующей стадии. 11-[(R/S)-8,8,8,7,7,6,6-Гептафтор-5-гидроксиоктил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (22 аD1/2). Из 80 мг стероида 21 а по реакции, проводимой по методике, аналогичной 1.2, получают 27 мг эстратриендиола 22 а D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 552, факт.: 552) и смесь его диастереомеров. Пример 10. 17-трет-Бутилдиметилсилилокси-11-[(R/S)-9,9,9,8,8,7,7-гептафтор-6-триметилсилилоксинонил]3-метокси-8-винилэстра-1,3,5(10)-триен (21b). Из 70 мг альдегида 9b взаимодействием с (гептафторпропил)триметил-силаном по методике, аналогичной 1.1, получают 94 мг стабильного триметилсилилового эфира 21b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 766, факт.: 766) и смесь его диастереомеров. Этот эфир без проведения взаимодействия с тригидратом фторида тетрабутиламмония используют на следующей стадии. 11-[(R/S)-9,9,9,8,8,7,7-Гептафтор-6-гидроксинонил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (22bD1/2). Из 94 мг стероида 21b по реакции, проводимой по методике, аналогичной 1.2, получают 41 мг эстратриендиола 22b D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 566, факт.: 566) и смесь его диастереомеров. Пример 11. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-7,7,6-трифтор-5-триметилсилилоксигепт-6 енил]-8-винилэстра-1,3,5(10)-триен (23 а). 1,1,2-Трифтор-2-триметилсилилэтилен полностью синтезируют по методике, известной из литературы (Journ. Fluorine Chem. 121, 2003, p. 75-77), с использованием 1-бром-1,2,2-трифторэтена, цинка и триметилсилилхлорида. Из 60 мг альдегида 9 а взаимодействием с 1,1,2-трифтор-2-триметилсилилэтиленом по методике,аналогичной 1.1, получают 77 мг триметилсилилового эфира 23 а в виде бесцветного пенистого вещества(ГХ-МС: m/z теор.: 644, факт.: 644) и смесь его диастереомеров. Этот эфир без дальнейшей очистки используют на следующей стадии. 11-[(R/S)-7,7,6-Трифтор-5-гидроксигепт-6-енил]-8-винилэстра-1,3,5(10)-триен-3,17-диолD1/2). К раствору 77 мг силилового эфира 23 а в 4 мл ацетона при комнатной температуре добавляют 0,16 мл 10% соляной кислоты. Затем раствор перемешивают до полного завершения обменной реакции при комнатной температуре и смешивают с насыщенным раствором гидрокарбоната натрия. Фазы разделяют, распределяя между этилацетатом и водой. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Полученный таким путем остаток фильтруют через силикагель (циклогексан/этилацетат) и повторно концентрируют. Полученное бесцвет- 21009606 ное пенистое вещество растворяют в 1 мл толуола, при 0 С по каплям добавляют к нему 0,15 мл диизобутилалюмогидрида и раствор до полного завершения обменной реакции нагревают с обратным холодильником. После охлаждения до 0 С смесь последовательно смешивают с 0,5 мл этанола, 0,5 мл смеси этанола и воды (в соотношении 1:1) и 0,5 мл полуконцентрированной соляной кислоты и перемешивают в течение примерно 30 мин. Фазы разделяют, распределяя между диэтиловым эфиром и водой. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают 14 мг эстратриендиола 24 а D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 464, факт.: 464) и смесь его диастереомеров. Пример 12. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[(R/S)-8,8,7-трифтор-6-триметилсилилоксиокт-7 енил]-8-винилэстра-1,3,5(10)-триен (23b). Из 80 мг альдегида 9b взаимодействием с 1,1,2-трифтор-2-триметилсилилэтиленом по методике,аналогичной 1.1, получают 95 мг триметилсилилового эфира 23b в виде бесцветного пенистого вещества(ГХ-МС: m/z теор.: 678, факт.: 678) и смесь его диастереомеров. Этот эфир без дальнейшей очистки используют на следующей стадии. 11-[(R/S)-8,8,7-Трифтор-6-гидроксиокт-7-енил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (24b D1/2). Из 95 мг альдегида 23b по реакции, проводимой по методике, аналогичной 11.2, получают 22 мг триметилсилилового эфира 24b D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 478,факт.: 478) и смесь его диастереомеров. Пример 13. Общая методика проведения реакции между альдегидом, соответственно кетоном и метиллитием. К охлажденному до -78 С раствору соответствующего карбонильного соединения (1 экв.) в тетрагидрофуране (10 мл/ммоль) по каплям добавляют с определенным избытком метиллитий (5-10 экв.,1,6-молярный в диэтиловом эфире) и раствор перемешивают при этой температуре до полного завершения обменной реакции. Для последующей переработки раствор смешивают со смесью из насыщенного раствора хлорида аммония, воды и диэтилового эфира, органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией (циклогексан/этилацетат) получают соответствующие метилзамещенные спирты в виде бесцветных пенистых веществ. 17-трет-Бутилдиметилсилилокси-11-[(R/S)-5-гидроксигексил]-3-метокси-8-винилэстра-1,3,5(10)триен (25 а). Из 200 мг альдегида 9 а по реакции, проводимой по методике, аналогичной 13.1, получают 120 мг спирта 25 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 526, факт.: 526) и смесь его диастереомеров. 11-[(R/S)-5-Гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (26 а D1/2). Из 25 мг стероида 25 а по реакции, проводимой по методике, аналогичной 1.2, получают 8 мг эстратриендиола 26 а D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 398, факт.: 398) и смесь его диастереомеров. Пример 14. 17-трет-Бутилдиметилсилилокси-11-[(R/S)-6-гидроксигептил]-3-метокси-8-винилэстра-1,3,5(10)триен (25b). Из 155 мг альдегида 9b по реакции, проводимой по методике, аналогичной 13.1, получают 100 мг спирта 25b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 540, факт.: 540) и смесь его диастереомеров. 11-[(R/S)-6-Гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (26b D1/2). Из 25 мг стероида 25b по реакции, проводимой по методике, аналогичной 1.2, получают 10 мг эстратриендиола 26b D1/D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 412, факт.: 412) и смесь его диастереомеров. Пример 15. 6-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]гексан-2-он(27a). 58 мг хлорхромата пиридиния и 58 мг целита предварительно помещают в 0,5 мл дихлорметана, затем по каплям добавляют раствор 95 мг спирта 25 а в 0,9 мл дихлорметана и смесь перемешивают при комнатной температуре до полного завершения обменной реакции. После этого смесь фильтруют через целит и силикагель и фильтрат концентрируют. В результате получают 81 мг кетона 21a в виде светложелтой вязкой массы (ГХ-МС: m/z теор.: 524, факт.: 524), который без дальнейшей очистки используют в последующей реакции. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[5-метил-5-гидроксигексил]-8-винилэстра 1,3,5(10)-триен (28 а).- 22009606 Из 75 мг кетона 27 а по реакции, проводимой по методике, аналогичной 13.1, получают 45 мг спирта 28 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 540, факт.: 540). 11-[5-Метил-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (29a). Из 40 мг стероида 28 а по реакции, проводимой по методике, аналогичной 1.2, получают 22 мг эстратриендиола 29 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 412, факт.: 412). Пример 16. 7-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]-гептан-2-он(27b). Из 70 мг спирта 25b по реакции, проводимой по методике, аналогичной 15.1, получают 56 мг кетона 27b в виде желтого пенистого вещества (ГХ-МС: m/z теор.: 538, факт.: 538), который без дальнейшей очистки используют в последующей реакции. 17-трет-Бутилдиметилсилилокси-3-метокси-11-[6-метил-6-гидроксигептил]-8-винилэстра 1,3,5(10)-триен (28b). Из 53 мг кетона 27b по реакции, проводимой по методике, аналогичной 13.1, получают 30 мг спирта 28b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 554, факт.: 554). 11-[6-Метил-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (29b). Из 26 мг стероида 28b по реакции, проводимой по методике, аналогичной 1.2, получают 9 мг эстратриендиола 29b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 426, факт.: 426). Пример 17. 11-(5-Бромпентил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (30 а). Из 1,55 г стероида 10 по реакции, проводимой по методике, аналогичной 1.2, получают 836 мг эстратриендиола 30 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 446, факт.: 446). Общая методика введения аминогруппировки (схема 7). Соответствующее количество бромида растворяют в N,N-диметилформамиде (5 мл/ммоль), смешивают с определенным избытком соответствующего амина и при комнатной температуре (в некоторых случаях при 40 С) перемешивают до полного завершения обменной реакции. Фазы разделяют, распределяя между этилацетатом и водой и водную фазу несколько раз экстрагируют этилацетатом. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат с помощью сульфата магния и концентрируют. После очистки колоночной хроматографией на силикагеле с использованием смеси этилацетата и метанола в качестве элюента получают соответствующие амины. 11-[5-(Метиламино)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (31 а). Из 258 мг бромида 30 а взаимодействием с метиламином (40%-ным в воде, 2 мл/ммоль) по методике, аналогичной 17.2, получают 161 мг амина 31 а в виде бесцветного твердого вещества (ГХ-МС: m/z теор.: 397, факт.: 397). Пример 18. 11-[5-(Диметиламино)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (32 а). Из 30 мг бромида 30 а взаимодействием с диметиламином (2-молярным в тетрагидрофуране, 10 экв.) по методике, аналогичной 17.2, получают 12 мг амина 32 а в виде бесцветного пенистого вещества(ГХ-МС: m/z теор.: 411, факт.: 411). Пример 19. 11-[5-(Пирролидин-1-ил)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (33 а). Из 30 мг бромида 30 а взаимодействием с пирролидином (10 экв.) по методике, аналогичной 17.2,получают 23 мг амина 33 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 437, факт.: 437). Пример 20. 11-[5-(1-Пиперидил)пентил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (34 а). Из 50 мг бромида 30 а взаимодействием с пиперидином (10 экв.) по методике, аналогичной 17.2, получают 41 мг амина 34 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 451, факт.: 451). Пример 21. 11-(5-Морфолинопентил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (35 а). Из 30 мг бромида 30 а взаимодействием с морфолином (10 экв.) по методике, аналогичной 17.2, получают 10 мг амина 35 а в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 453, факт.: 453). Пример 22. Общая методика введения полифторированной алкильной цепи в амины 31 а-b (схема 7). Соответствующее количество амина растворяют в N,N-диметилформамиде (5 мл/ммоль), по каплям добавляют раствор соответствующего тозилата (1,5 экв.) в N,N-диметилформамиде (5 мл/ммоль) и добавляют также 20 экв. карбоната натрия. Затем реакционную смесь в течение 8 ч перемешивают при 40 С. Для последующей переработки фазы разделяют, распределяя между этилацетатом и водой и водную фазу несколько раз экстрагируют этилацетатом. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат с помощью сульфата магния и концентрируют. После очистки колоночной хроматографией на силикагеле с использованием смеси хлороформа и метанола в качестве- 23009606 элюента наряду с непрореагировавшим исходным материалом получают соответствующие третичные амины. 11-5-[Метил(8,8,9,9,9-пентафторнонил)амино]пентил-8-винилэстра-1,3,5(10)-триен-3,17-диол(36 а). Из 32 мг амина 31 а взаимодействием с 8,8,9,9,9-пентафторнонилтозилатом по методике, аналогичной 22.1, получают 16 мг амина 36a в виде бесцветных кристаллов (ГХ-МС: m/z теор.: 613, факт.: 613). Пример 23. 11-5-[(7,7,8,8,9,9,9-гептафторнонил)метиламино]пентил-8-винилэстра-1,3,5(10)-триен-3,17 диол (37a). Из 31 мг амина 31 а взаимодействием с 7,7,8,8,9,9,9-гептафторнонилтозилатом по методике, аналогичной 22.1, получают 22 мг амина 37 а в виде бесцветных кристаллов (ГХ-МС: m/z теор.: 649, факт.: 649). Пример 24. Общая методика ацилирования аминов 31 а-b (схема 7). Соответствующее количество амина растворяют в этаноле (5 мл/ммоль), по каплям добавляют раствор N-сукцинимидоэфира соответствующей карбоновой кислоты (2 экв.) в этаноле (5 мл/ммоль) и добавляют также 4 экв. гидрокарбоната натрия. Затем смесь перемешивают при комнатной температуре до полного завершения обменной реакции. Для последующей переработки фазы разделяют, распределяя между этилацетатом и водой, и водную фазу несколько раз экстрагируют этилацетатом. Органическую фазу сушат с помощью сульфата магния и концентрируют. После очистки колоночной хроматографией на силикагеле с использованием смеси циклогексана и этилацетата в качестве элюента получают соответствующие амины. 11-5-[Метил(октаноил)амино]пентил-8-винилэстра-1,3,5(10)-триен-3,17-диол (38 а). Из 9 мг амина 31 а взаимодействием с N-сукцинимидиловым эфиром октановой кислоты по методике, аналогичной 24.1, получают 10 мг амина 38a в виде бесцветных кристаллов [ЖХ-МС: m/z теор.: 523,факт.: 524 (М+Н)+]. Пример 25. 11-(6-Хлоргексил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (30b). Из 975 мг стероида 13 по реакции, проводимой по методике, аналогичной 1.2, получают 424 мг соединения 30b в виде бесцветного пенистого вещества, которое наряду с хлористым соединением(ГХ-МС: 81%, m/z теор.: 416, факт.: 416) содержат соответствующее бромистое соединение (ГХ-МС: 17%, m/z теор.: 460, факт.: 460). 11-[6-(Метиламино)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (31b). Из 155 мг смеси продуктов 30b взаимодействием с метиламином (40% в воде, 3 мл/ммоль) при добавлении карбоната натрия по методике, аналогичной 17.2, получают 152 мг амина 31b в виде бесцветного твердого вещества (ГХ-МС: m/z теор.: 411, факт.: 411). Пример 26. 11-[6-(Диметиламино)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (32b). Из 33 мг смеси продуктов 30b взаимодействием с диметиламином (2-молярным в тетрагидрофуране, 10 экв.) при добавлении карбоната натрия по методике, аналогичной 17.2, получают 30 мг амина 32b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 425, факт.: 425). Пример 27. 11-[6-(Пирролидин-1-ил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (33b). Из 32 мг смеси продуктов 30b взаимодействием с пирролидином (10 экв.) при добавлении карбоната натрия по методике, аналогичной 17.2, получают 33 мг амина 33b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 451, факт.: 451). Пример 28. 11-[6-(1-Пиперидил)гексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (34b). Из 34 мг смеси продуктов 30b взаимодействием с пиперидином (10 экв.) при добавлении карбоната натрия по методике, аналогичной 17.2, получают 40 мг амина 34b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 465, факт.: 465). Пример 29. 11-(6-Морфолиногексил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (35b). Из 32 мг смеси продуктов 30b взаимодействием с морфолином (10 экв.) при добавлении карбоната натрия по методике, аналогичной 17.2, получают 32 мг амина 35b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 467, факт.: 467). Пример 30. 11-6-[Метил(8,8,9,9,9-пентафторнонил)амино]гексил-8-винилэстра-1,3,5(10)-триен-3,17-диол- 24009606 Из 39 мг амина 31b взаимодействием с 8,8,9,9,9-пентафторнонилтозилатом по методике, аналогичной 22.1, получают 22 мг амина 36b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 627,факт.: 627). Пример 31. 11-6-[(7,7,8,8,9,9,9-Гептафторнонил)метиламино]гексил-8-винилэстра-1,3,5(10)-триен-3,17 диол (37b). Из 39 мг амина 31b взаимодействием с 7,7,8,8,9,9,9-гептафторнонилтозилатом по методике, аналогичной 22.1, получают 21 мг амина 37b в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 663,факт.: 663). Пример 32. 11-6-[Метил(октаноил)амино]гексил-8-винилэстра-1,3,5(10)-триен-3,17-диол (38b). Из 10 мг амина 31b взаимодействием с N-сукцинимидиловым эфиром октановой кислоты по методике, аналогичной 24.1, получают 10 мг амина 38b в виде бесцветных кристаллов [ЖХ-МС: m/z теор.: 537, факт.: 538 (М+Н)+]. Пример 33. Общая методика окисления альдегидов 9 а-b (схема 8). Соответствующее количество альдегида растворяют в трет-бутаноле (5 мл/ммоль). Далее последовательно добавляют по каплям 2-метилбут-2-ен (1 мл/ммоль) и раствор хлорита натрия (1,1 экв.) и дигидрата дигидрофосфата натрия (1,1 экв.) в воде (1 мл/ммоль). Затем смесь перемешивают при комнатной температуре до полного завершения обменной реакции. Для последующей переработки фазы разделяют, распределяя между диэтиловым эфиром и водой, значение рН водной фазы с помощью 5% соляной кислоты устанавливают на 2, насыщают ее хлоридом натрия и несколько раз экстрагируют диэтиловым эфиром. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией на силикагеле с использованием смеси циклогексана и этилацетата в качестве элюента получают соответствующие карбоновые кислоты. 5-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]валериановая кислота (39 а). Из 195 мг альдегида 9 а по реакции, проводимой по методике, аналогичной 33.1, получают 136 мг карбоновой кислоты 39 а в виде бесцветных кристаллов [ЖХ-МС: m/z теор.: 526, факт.: 527 (М+Н)+]. Общая методика перевода карбоновых кислот 39 а-b в амиды 40 а-b (схема 8). Соответствующее количество карбоновой кислоты растворяют в дихлорметане (10 мл/ммоль) и охлаждают до -10 С. Далее последовательно добавляют по каплям N-метилморфолин (4 экв.), изобутилхлорформиат (4 экв.) и еще через 30 мин н-бутилметиламин (6 экв.). Затем смесь перемешивают при комнатной температуре до полного завершения обменной реакции. Для последующей переработки фазы разделяют, распределяя между дихлорметаном и насыщенным раствором гидрокарбоната натрия. Водную фазу несколько раз экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. После очистки колоночной хроматографией на силикагеле с использованием смеси циклогексана и этилацетата в качестве элюента получают соответствующие амиды.N-н-Бутил-N-метил-5-[17-(трет-бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен 11-ил]валерамид (40 а). Из 130 мг карбоновой кислоты 39 а по реакции, проводимой по методике, аналогичной 33.2, получают 81 мг амида 40 а в виде бесцветного пенистого вещества [ЖХ-МС: m/z теор.: 595, факт.: 596N-н-бутил-N-Метил-5-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]валерамид (41 а). Из 80 мг амида 40 а по реакции, проводимой по методике, аналогичной 1.2, получают 31 мг эстратриендиола 41 а в виде бесцветного пенистого вещества [ЖХ-МС: m/z теор.: 467, факт.: 468 (М+Н)+]. Пример 34. 6-[17-(трет-Бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен-11-ил]капроновая кислота (39b). Из 150 мг альдегида 9b по реакции, проводимой по методике, аналогичной 33.1, получают 108 мг карбоновой кислоты 39b в виде бесцветных кристаллов [ЖХ-МС: m/z теор.: 540, факт.: 541 (М+Н)+].N-н-Бутил-N-метил-6-[17-(трет-бутилдиметилсилилокси)-3-метокси-8-винилэстра-1,3,5(10)-триен 11-ил]капронамид (40b). Из 105 мг карбоновой кислоты 39b по реакции, проводимой по методике, аналогичной 33.2, получают 63 мг амида 40b в виде бесцветного пенистого вещества [ЖХ-МС: m/z теор.: 609, факт.: 610N-н-Бутил-N-метил-6-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]капронамид (41b). Из 60 мг амида 40b по реакции, проводимой по методике, аналогичной 1.2, получают 28 мг эстратриендиола 41b в виде бесцветного пенистого вещества [ЖХ-МС: m/z теор.: 481, факт.: 482(М+Н)+]. Пример 35. 11-(5-Тиоцианатопентил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (42) (схема 7). К раствору 13 мг бромида 30 а в 0,3 мл N,N-диметилформамида последовательно добавляют 8,4 мг роданида калия и 32 мг йодида тетрабутиламмония, после чего раствор перемешивают до полного завершения обменной реакции. Для последующей переработки фазы разделяют, распределяя между этилацетатом и водой, и водную фазу несколько раз экстрагируют этилацетатом. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (циклогексан/этилацетат) и получают в результате 9 мг роданида 42 в виде бесцветного пенистого вещества [ЖХ-МС: m/z теор.: 425, факт.: 426 (М+Н)+]. Пример 36. 6-[3,17-Дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]капронитрил (43 а) (схема 2). Из 16 мг стероида 11 а по реакции, проводимой по методике, аналогичной 1.2, получают 7 мг эстратриендиола 43 а в виде бесцветного твердого вещества (ГХ-МС: m/z теор.: 393, факт.: 393). Пример 37. 7-[3,17-дигидрокси-8-винилэстра-1,3,5(10)-триен-11-ил]гептанитрил (43b). Из 22 мг стероида 11b по реакции, проводимой по методике, аналогичной 1.2, получают 12 мг эстратриендиола 43b в виде бесцветного твердого вещества (ГХ-МС: m/z теор.: 407, факт.: 407). Пример 38. Общая методика окисления 17-гидроксигруппы по Оппенауэру. К раствору соответствующего спирта (1 экв.) в толуоле (20 мл/ммоль) последовательно добавляют циклогексанон (50 экв.) и изопропилат алюминия (10 экв.). Затем раствор до полного завершения обменной реакции нагревают с обратным холодильником. Для последующей переработки раствор при комнатной температуре подкисляют 1 н. соляной кислотой и фазы разделяют, распределяя между диэтиловым эфиром и водой. Органическую фазу промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния, диэтиловый эфир и толуол удаляют с помощью вакуумного роторного испарителя, а остаточное количество растворителей отгоняют азеотропным путем. Образовавшийся в результате остаток очищают колоночной хроматографией (циклогексан/этилацетат) с получением соответствующих 17-кетонов. 3-Гидрокси-11-[(R)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-17-он (44 а D1). Из 50 мг спирта 15 а D1 по реакции, проводимой по методике, аналогичной 38.1, получают 40 мг кетона 44 а D1 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 450, факт.: 450). 17-Метил-11-[(R)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (45 а D1). Из 39 мг кетона 44 а D1 по реакции, проводимой по методике, аналогичной 13.1, получают 30 мг спирта 45 а D1 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 466, факт.: 466). Пример 39. 3-Гидрокси-11-[(S)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-17-он (44 а D2). Из 50 мг спирта 15 а D2 по реакции, проводимой по методике, аналогичной 38.1, получают 42 мг кетона 44 а D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 450, факт.: 450). 17-Метил-11-[(S)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (45 а D2). Из 28 мг кетона 44 а D2 по реакции, проводимой по методике, аналогичной 13.1, получают 19 мг спирта 45 а D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 466, факт.: 466). Пример 40. 3-Гидрокси-11-(7,7,7-трифтор-6-гидроксигептил)-8-винилэстра-1,3,5(10)-триен-17-он (44b D1). Из 35 мг спирта 15b D1 по реакции, проводимой по методике, аналогичной 38.1, получают 27 мг кетона 44b D1 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 464, факт.: 464). 17-Метил-11-(7,7,7-трифтор-6-гидроксигептил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (45b D1). Из 25 мг кетона 44b D1 по реакции, проводимой по методике, аналогичной 13.1, получают 20 мг спирта 45b D1 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 480, факт.: 480). Пример 41. 3-Гидрокси-11-(7,7,7-трифтор-6-гидроксигептил)-8-винилэстра-1,3,5(10)-триен-17-он (44b D2). Из 35 мг спирта 15b D2 по реакции, проводимой по методике, аналогичной 38.1, получают 25 мг кетона 44b D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 464, факт.: 464). 17 а-Метил-11-(7,7,7-трифтор-6-гидроксигептил)-8-винилэстра-1,3,5(10)-триен-3,17-диол (45b D2). Из 23 мг кетона 44b D2 по реакции, проводимой по методике, аналогичной 13.1, получают 18 мг спирта 45b D2 в виде бесцветного пенистого вещества (ГХ-МС: m/z теор.: 480, факт.: 480).- 26009606 Схемы синтеза Схема 1X представляет собой группу формулыZ и W, каждый независимо друг от друга, представляет собой R19, или Z и W вместе представляют собой атом кислорода;R или R20, если Z и W вместе представляют собой атом кислорода;R17 и R17' вместе представляют собой атом кислорода либоR19 представляет собой атом водорода, остаток формулы CpFqHr, где р равно 1, 2, 3, 4, 5, 6, 7, 8, 9,q больше 1, а сумма q+r равна 2 р+1, неразветвленную C1-C8 алкильную группу либо разветвленнуюC3-C6 алкильную группу, необязательно замещенную фенильным остатком C3-C6 циклоалкильную группу,(C3-C6 циклоалкил)-C1-C4 алкиленовую группу, разветвленную или неразветвленную C2-C5 алкенильную группу, C2-C5 алкинильную группу или незамещенную либо замещенную арильную, гетероарильную,гетероциклильную, арил-C1-C4 алкиленовую, гетероарил-C1-C4 алкиленовую группу,где арильные группы могут представлять собой фенильную, нафталин-1-ильную, нафталин-2-ильную,[1,1'-бифенил]-2-ильную, [1,1'-бифенил]-3-ильную или [1,1'-бифенил]-4-ильную группу; гетероарильные группы могут представлять собой присоединенную через одно из замещенных положений пиридинильную, пиримидинильную, хинолинильную, изохинолинильную, бензофуранильную,бензотиенильную, 1,3-бензодиоксолильную, 2,1,3-бензотиадиазолильную, индолильную, фуранильную,тиенильную, оксазолильную, изоксазолильную, тиазолильную, пирролильную, пиразолильную, пиразинильную, пиридазинильную или имидазолильную группу и гетероциклильные группы могут представлять собой присоединенную через одно из замещенных положений пиперидинильную, морфолинильную, тиоморфолинильную, пиперазинильную, тетрагидрофуранильную, тетрагидротиенильную, имидазолидинильную или пирролидинильную группу;R20 представляет собой R21R22N-группу, группу -C(NOR19)H или группу общей формулы в которой V представляет собой -СН 2-, атом кислорода либо атом серы или =N-R25;m обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8; о обозначает 0, 1, 2, 3, 4, 5, 6, 7 или 8,при этом их сумма m+о равна 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12;R21 и R22, каждый независимо друг от друга, представляет собой R19;R25 представляет собой R19, R20SO2- или ацильную группу -C(O)R21. 2. Соединения общей формулы I по п.1, отличающиеся тем, что Y обозначает -ОН, -CN, -SCN, атом галогена или R20. 3. Соединения общей формулы I по п.1, отличающиеся тем, что Y обозначает R20, если Z и W вместе представляют собой атом кислорода. 4. Соединения общей формулы I по п.1, отличающиеся тем, что Y представляет собой -ОН, -CN, SCN, атом галогена или R20, a R17 и R17' вместе представляют собой атом кислорода либо R17 представляет собой водород, -ОН и R17' представляет собой водород, -ОН. 5. Соединения общей формулы I по п.1, отличающиеся тем, что Y представляет собой R20, если Z иW вместе представляют собой атом кислорода, a R17 и R17' вместе представляют собой атом кислорода либо R17 представляет собой водород, -ОН и R17' представляет собой водород, -ОН. 6. Соединения по п.1 из группы, включающей 11-[(R)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),11-[(S)-6,6,6-трифтор-5-гидроксигексил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 2),11-[7,7,7-трифтор-6-гидроксигептил]-8-винилэстра-1,3,5(10)-триен-3,17-диол (диастереомер 1),- 30
МПК / Метки
МПК: C07J 1/00
Метки: винил-11β-(ω-замещённые)алкилэстра-1,3,5(10)-триены, 8&beta
Код ссылки
<a href="https://eas.patents.su/30-9606-8beta-vinil-11beta-omega-zameshhyonnyealkilestra-13510-trieny.html" rel="bookmark" title="База патентов Евразийского Союза">8β – винил-11β-(ω-замещённые)алкилэстра-1,3,5(10)-триены</a>
Предыдущий патент: Способ характеристики полинуклеотидов
Следующий патент: Tnf-подобный секретируемый белок
Случайный патент: Устройство и способ охлаждения оборудования пищевой промышленности












