Дисульфидные, сульфидные, сульфоксидные, и сульфоновые производные циклических сахаров и их применение
Номер патента: 8942
Опубликовано: 26.10.2007
Авторы: Репольес Молинер Хосе, Пубиль Кой Франсиско, Салас Перес-Расилья Эдуардо
Формула / Реферат
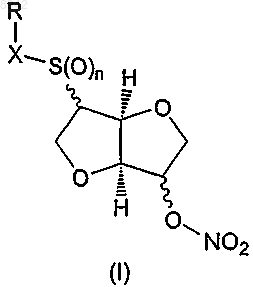
1. Соединение формулы (I) или его таутомер, фармацевтически приемлемая соль, пролекарство или сольват
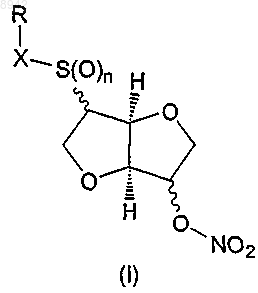
в которой
n представляет собой целое число 0, 1 или 2,
X представляет -S(O)m-, -(С=O)- или простую связь, в котором m представляет собой целое число 0, 1 или 2; с учетом того, что если X представляет -(С=О)-, то n равняется 0,
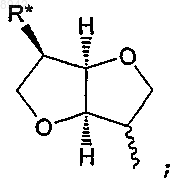
R представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из С1-6алкила; С2-6алкенила; С3-8циклоалкила; С3-8циклоалкила, в котором одна группа СН2 замещена О, S, NH или NCH3; С4-8циклоалкенила; С4-8циклоалкенила, в котором одна группа СН2 замещена О, S, NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и
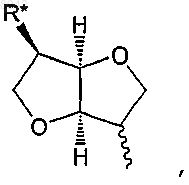
в которой R* выбирают из группы, состоящей из водорода, C1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,
в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из числа С1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,
при условии, что если RXS(O)n- и -ONO2- находятся в транс-положении по отношении друг к другу относительно плоскости кольца, как изображено в формулах (Iа) и (Ib)
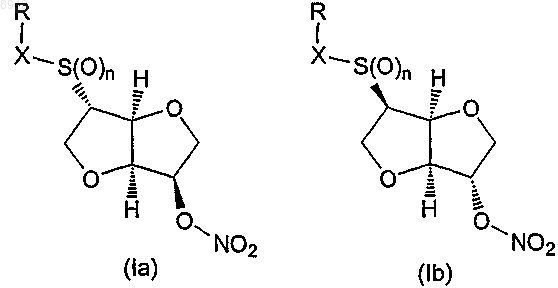
то RXS (O)n- предпочтительно не представляет
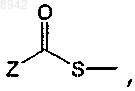
в которой Z представляет собой группу С1-С4алкил, арил или аралкил.
2. Соединение по п.1, в котором или один или оба из m и n равны 0.
3. Соединение по любому из пп.1-2, в котором X представляет простую связь или -S-.
4. Соединение по любому из пп.1-3, в котором R представляет водород, C1-6алкил, С2-6алкенил, С3-8циклоалкил, С4-8циклоалкенил, (C1-6алкил)С3-8циклоалкил, (С1-6алкил)С4-8циклоалкенил, фенил, (C1-6алкил)фенил, 5-ацетилоксиизосорбид-2-ил, 5-гидроксиизосорбид-2-ил или 5-нитратизосорбид-2-ил.
5. Соединение по любому из пп.1-4, в котором R представляет собой C1-6алкил.
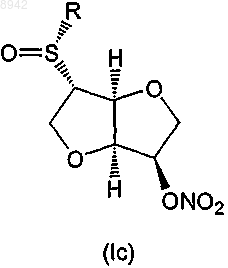
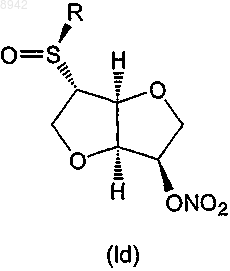
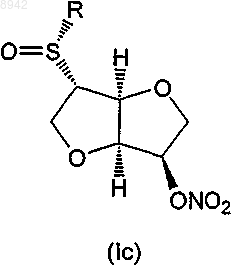
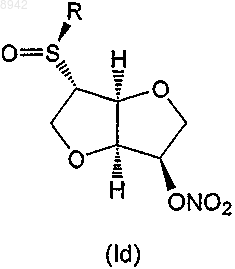
6. Соединение по любому из пп.1-5, которое представляет собой соединение формулы (Iс) или (Id)
7. Соединение по любому из пп.1-6, которое выбирают из 2-тиоизосорбид 5-мононитрата, 5,5'-динитрат-2,2'-дитиодиизосорбида, 2-метилтиоизосорбид 5-мононитрата, 2-[(R)-метилсульфинил]изосорбид 5-мононитрата, 2-[(S)-метилсульфинил]изосорбид 5-мононитрата, 2-метилсульфинил-изосорбид 5-мононитрата, 2-метилсульфонилизосорбид 5-мононитрата, S-нитрозо-2-тиоизосорбид 5-мононитрата, 2-(тетрагидропиран-2-илтио)изосорбид 5-мононитрата, 2-(изосорбидил-2'-дитио)изосорбид 5-мононитрата и 2-(5'-ацетилоксиизосорбидил-2'-дитио)изосорбид 5-мононитрата.
8. Фармацевтическая композиция, содержащая в качестве активного(ых) ингредиента(ов) по меньшей мере одно соединение по любому из пп.1-7, необязательно, в сочетании с одним или более физиологически допустимым наполнителем (наполнителями), активатором (активаторами), хелатирующим агентом (хелатирующими агентами) и/или стабилизатором (стабилизаторами).
9. Фармацевтическая композиция по п.8, которая дополнительно содержит тромболитический агент, предпочтительно активатор плазмогена, урокиназу, стрептокиназу, алтеплазу или анистреплазу.
10. Фармацевтическая композиция по п.8 или 9, которая дополнительно содержит противосвертывающий агент, предпочтительно гепарин, дикумарол, аценокумарол, эноксапарин или полисульфат пентозана.
11. Фармацевтическая композиция по любому из пп.8-10, которая дополнительно содержит антитромбический агент, предпочтительно ацетилсалициловую кислоту, дипиридамол, тиклопидин, клопидрогель, трифлусал, полисульфат пентозана или абциксимаб.
12. Фармацевтическая композиция по любому из пп.8-11, которая дополнительно содержит иммуноглобулин или его фрагмент, обладающий специфичностью к гликопротеину IIb/IIIa.
13. Фармацевтическая композиция по любому из пп.8-12, которая дополнительно содержит агент, понижающий уровень липидов в крови, предпочтительно симвастатин, ловастатин, аторвастатин, правастатин, флувастатин, эптастатин, лифиброл, ацифран, ацитемат, глуникат или росувастатин.
14. Фармацевтическая композиция по любому из пп.8-13, которая содержит агент антиоксиданта/акцепторов свободных радикалов, предпочтительно выбранный из числа никаравена, ранолазина, эмоксипина, глутатиона, эдаравона, раксофеласта, ликопена, N-ацетил-L-цистеина, N-ацетил-D-цистеина, рацемированной смеси N-ацетил-L-цистеина и N-ацетил-D-цистеина, или карведилола.
15. Фармацевтическая композиция по любому из пп.8-14 для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, дисфункции кровеносной системы, активации тромбоцита, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, патологических состояний, в патогенезе которых важную роль играет дефицит оксида азота, и/или повреждение ткани вследствие ишемии и/или вследствие реперфузии после ишемии.
16. Фармацевтическая композиция по п.15, в которой патологические состояния, в патогенезе которых важную роль играет окислительный стресс, выбирают из числа аллергий, инсульта, болезни Альцгеймера и ишемических сердечно-сосудистых заболеваний.
17. Фармацевтическая композиция по любому из пп.8-14 для лечения и/или профилактики дисфункций кровеносной системы, предпочтительно сердечно-сосудистых и/или коронарных дисфункций.
18. Применение по меньшей мере одного соединения формулы (I) или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата
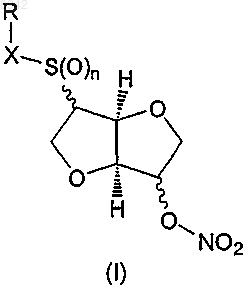
в которой n представляет собой целое число 0, 1 или 2,
X представляет -S(O)m-, -(C=O)- или простую связь, в которой m представляет собой целое число 0, 1 или 2, при условии что X представляет собой -(С=O)- и n имеет значение 0; и
R представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из С1-6алкила; С2-6алкенила; С3-8циклоалкила; С3-8циклоалкила, в котором одна группа СН2 замещена О, S, NH или NCH3; С4-8циклоалкенила; С4-8циклоалкенила, в котором одна группа СН2 замещена О, S, NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и
в которой R* выбирают из группы, состоящей из водорода, С1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ОNO2 и галогена,
в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из группы, состоящей из С1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,
в качестве активного ингредиента(ов) для получения фармацевтической композиции для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, активации тромбоцитов, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, патологичесъшх состояний, в патогенезе которых важную роль играет дефицит оксида азота, и/или повреждения ткани вследствие ишемии и/или вследствие реперфузии после ишемии.
19. Применение по меньшей мере одного соединения формулы (I)
или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата в качестве активного ингредиента (ингредиентов) для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, активации тромбоцитов, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, патологических состояний, в патогенезе которых важную роль играет дефицит оксида азота, и/или повреждения ткани вследствие ишемии и/или вследствие реперфузии после ишемии,
содержащее введение указанного соединения или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата пациенту, которому это требуется,
в которой n представляет собой целое число 0, 1 или 2,
X представляет -S(O)m-, -(C=O)- или простую связь, в котором m представляет собой целое число 0, 1 или 2; с учетом того, что если X представляет -(С=O)-, то n равняется 0,
R представляет собой водород или представляет собой остаток Ra, который выбирают из группы, состоящей из C1-6алкила; С2-6алкенила; С3-8циклоалкила; С3-8циклоалкила, в котором одна группа СН2 замещена О, S, NH или NCH3; С4-8циклоалкенила; С4-8циклоалкенила, в котором одна группа СН2 замещена О, S, NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и
в которой R* выбирают из группы, состоящей из водорода, C1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,
в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из числа C1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ОNО2 и галогена.
20. Применение по п.18 или 19, в котором или одна, или обе переменные m и n равняются 0.
21. Применение по любому из пп.18-20, в котором X представляет простую связь или -S-.
22. Применение по любому из пп.18-21, в котором R представляет водород, С1-6алкил, С2-6алкенил, С3-8циклоалкил, С4-8циклоалкенил, (С1-6алкил)С3-8циклоалкил, (C1-6алкил)С4-8циклоалкенил, фенил или (C1-6алкил)фенил.
23. Применение по любому из пп.18-22, в котором R представляет собой C1-6алкил.
24. Применение по любому из пп.18-23, в котором соединение формулы (I) представляет собой соединение формулы (Iс) или (Id)
25. Применение по любому из пп.18-24, в котором соединение формулы (I) выбирают из 2-тиоизосорбид 5-мононитрата, 5,5'-динитрат-2,2'-дитиодиизосорбида, 2-метилтиоизосорбид 5-мононитрата, 2-[(R)-метилсульфинил]изосорбид 5-мононитрата, 2-[(S)-метилсульфинил]изосорбид 5-мононитрата, 2-метилсульфинилизосорбид 5-мононитрата, 2-метилсульфонилизосорбид 5-мононитрата, S-нитрозо-2-тиоизосорбид 5-мононитрата, 2-(тетрагидропиран-2-илтио)изосорбид 5-мононитрата, 2-(изосорбидил-2'-дитио)изосорбид 5-мононитрата и 2-(5'-ацетилоксиизосорбидил-2'-дитио)изосорбид 5-мононитрата.
26. Применение по п.18 или 19, в котором соединение представляет собой 2-ацетилтиоизосорбид 5-мононитрат, представленный следующей формулой:
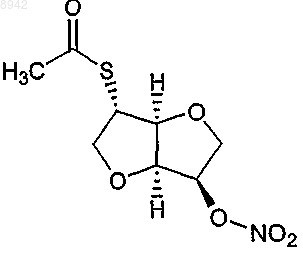
27. Применение по любому из пп.18-26, в котором фармацевтическая композиция дополнительно содержит тромболитический агент, предпочтительно активатор плазмогена, урокиназу, стрептокиназу, алтеплазу или анистреплазу.
28. Применение по любому из пп.18-27, в котором фармацевтическая композиция дополнительно содержит противосвертывающий агент, предпочтительно гепарин, дикумарол, аценокумарол, эноксапарин или полисульфат пентозана.
29. Применение по любому из пп.18-28, в котором фармацевтическая композиция дополнительно содержит антитромбический агент, предпочтительно ацетилсалициловую кислоту, дипиридамол, тиклопидин, клопидрогель, трифлусал, полисульфат пентозана или абциксимаб.
30. Применение по любому из пп.18-29, в котором фармацевтическая композиция дополнительно содержит иммуноглобулин или его фрагмент, обладающий специфичностью к гликопротеину IIb/IIIa.
31. Применение по любому из пп.18-30, в котором фармацевтическая композиция дополнительно содержит агент, понижающий уровень липидов в крови, предпочтительно симвастатин, ловастатин, аторвастатин, правастатин, флувастатин, эптастатин, лифиброл, ацифран, ацитемат, глуникат или росувастатин.
32. Применение по любому из пп.18-31, в котором фармацевтическая композиция далее содержит агент антиоксиданта/акцепторов свободных радикалов, предпочтительно выбранный из числа никаравена, ранолазина, эмоксипина, глутатиона, эдаравона, раксофеласта, ликопена, N-ацетил-L-цистеина, N-ацетил-D-цистеина, рацемированной смеси N-ацетил-L-цистеина и N-ацетил-D-цистеина или карведилола.
33. Применение по любому из пп.18-32, в котором патологические состояния, в патогенезе которых важную роль играет окислительный стресс, выбирают из числа аллергий, инсульта, болезни Альцгеймера и ишемических сердечно-сосудистых заболеваний.
34. Способ получения соединения формулы (I), его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата
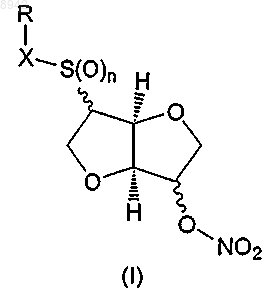
в которой n представляет собой целое число 0, 1 или 2,
X представляет -S(O)m- или простую связь, в которой m представляет собой целое число 0, 1 или 2, и
R представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из C1-6алкила; С2-6алкенила; С3-8циклоалкила; С3-8циклоалкила, в котором одна группа СН2 замещена О, S, NH или NCH3; С4-8циклоалкенила; С4-8циклоалкенила, в котором одна группа СН2 замещена О, S, NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и
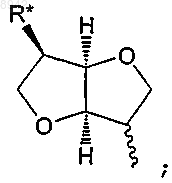
в которой R* выбирают из группы, состоящей из водорода, C1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,
в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из группы, состоящей из С1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена.
Данный способ включает следующие стадии:
а) гидролиз соединения формулы (IIа)
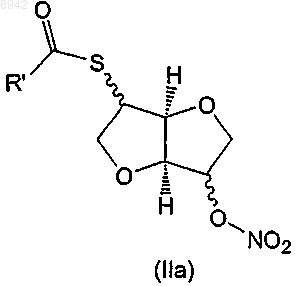
в которой R' представляет собой С1-С6алкил, предпочтительно метил, с получением следующего соединения:
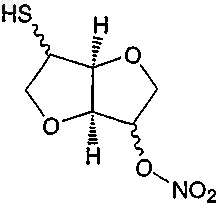
и
b) необязательно проведение с соединением, полученным на стадии (а)
I) реакции окисления с получением
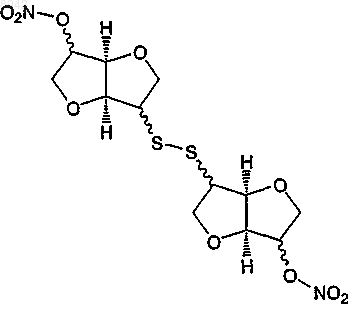
и/или
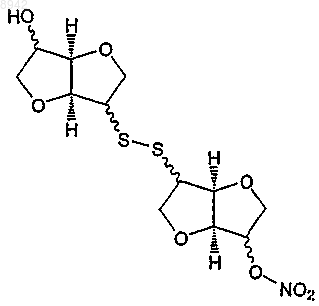
необязательно, с последующим вторым окислением, с получением следующего соединения
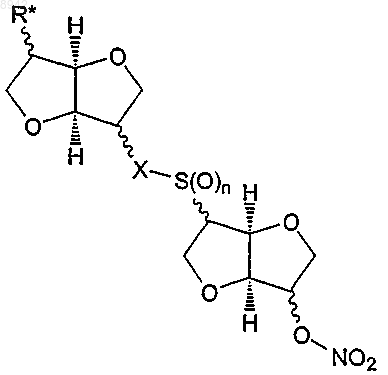
т котором n равняется 1 или 2,
X представляет собой -S(O)m-, в котором m равняется 0, 1 или 2, и
R* представляет гидроксил или ONO2;
II) реакции замещения с получением соединения формулы (I),
в котором n представляет собой целое число 0,
X представляет связь и
R не является нитрозилом,
необязательно, с последующим окислением, с получением соединения формулы (I),
в котором n представляет собой целое число 0,
X представляет -S(O)m-, в котором m представляет собой целое число 0 или 1, и
R не является нитрозилом;
III) реакции замещения с получением соединения формулы (I),
в котором n представляет собой целое число 0, и
X представляет -S-;
необязательно с последующим окислением с получением соединения формулы (I),
в котором n представляет собой целое число 1 или 2, и
X представляет -S(O)m-, в котором m представляет собой 0, 1 или 2; или
IV) реакции нитрозирования с получением
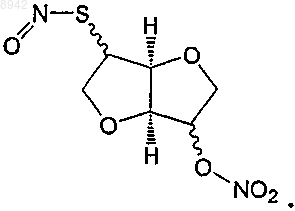
35. Способ по п.34 для получения соединения формулы (1а), его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата
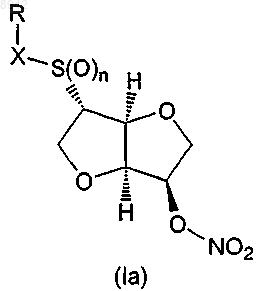
в которой n представляет собой целое число 0, 1 или 2,
X представляет -S(O)m- или простую связь, в которой m представляет собой целое число 0, 1 или 2, и
R представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из С1-6алкила; С2-6алкенила; С3-8циклоалкила; С3-8циклоалкила, в котором одна группа СН2 замещена О, S, NH или NCH3; С4-8циклоалкенила; С4-8циклоалкенила, в котором одна группа СН2 замещена О, S, NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и
в которой R* выбирают из группы, состоящей из водорода, С1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ОNО2 и галогена,
в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из группы, состоящей из С1-6алкила, С2-6алкенила, С3-8циклоалкила, С4-8циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена, и
в котором указанный способ включает следующие стадии:
а) гидролиз соединения формулы (II)
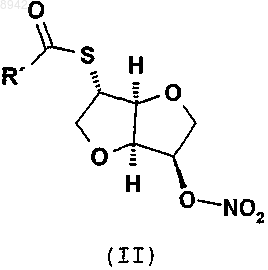
в котором R' представляет собой C1-С6алкил, предпочтительно метил, с получением 2-тиоизосорбид 5-мононитрата (1)
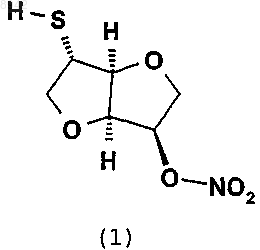
и
b) необязательно превращение с соединением (1), полученным на стадии (а)
I) реакции окисления с получением 5,5'-динитрат-2,2'-дитиодиизосорбида (2) или 2-(изосорбидил-2'-дитио)изосорбид 5-мононитрата (8), необязательно с последующим вторым окислением с получением соединения формулы (Iе)
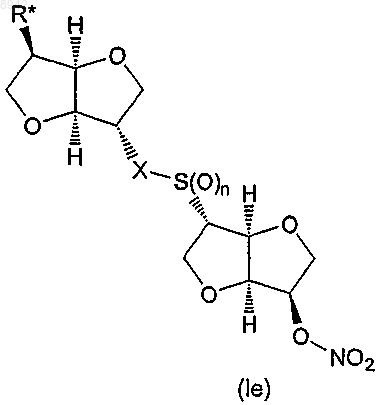
в которой n равняется 1 или 2,
X представляет собой -S(O)m-, в котором m равняется 0, 1 или 2, и
R* представляет гидроксил или ONO2;
II) реакции замещения с получением соединения формулы (Iа),
в которой n представляет собой целое число 0,
X представляет связь и
R не является нитрозилом,
необязательно, с последующим окислением с получением соединения формулы (Iа),
в которой n представляет собой целое число 0,
X представляет -S(O)m-, в котором m равняется 0 или 1, и
R не является нитрозилом;
III) реакции замещения с получением соединения формулы (Iа),
в которой n представляет собой целое число 0 и
X представляет -S-;
необязательно, с последующим окислением с получением соединения формулы (Iа),
в которой n представляет собой целое число 1 или 2 и
X представляет -S(O)m-, в котором m равняется 0, 1 или 2; или
IV) реакции нитрозирования с получением S-нитрозо-2-тиоизосорбид 5-мононитрата (6).
36. Способ по п.34 или 35, включающий стадии (а) и (b) II для получения 2-[(R)-метилсульфинил]изосорбид 5-мононитрата и/или 2-[(S)-метилсульфинил]изосорбид 5-мононитрата.
37. Способ по п.35, который включает разделение обоих диастереоизомеров.
38. Способ получения соединения формулы (11) или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата
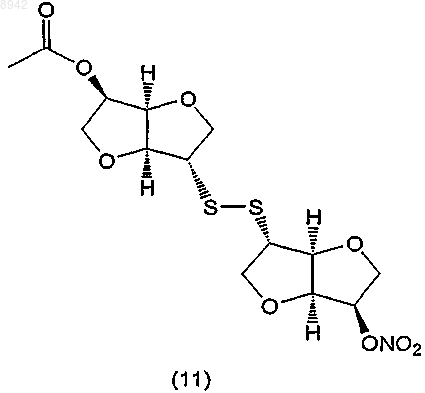
данный способ включает следующие стадии:
а) реакцию окисления соединения формулы (III)

в которой Rч представляет собой С1-С6алкил, предпочтительно метил с получением 2,2ч-дитиодиизосорбида (10)
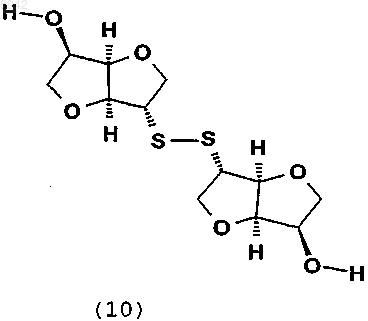
и
b) реакцию нитрования соединения, полученного на стадии (а) с нитрующим агентом в присутствии ангидрида карбоновой кислоты, предпочтительно уксусного ангидрида.
39. 2,2'-Дитиодиизосорбид.
Текст
008942 Область техники, к которой относится изобретение Настоящее изобретение относится к дисульфидным, сульфидным, сульфоксидным, и сульфоновым производным мононитрата 1,4:3,6-диангидрогексита и их применению для профилактики и/или лечения сосудистых нарушений. Уровень техники Оксид азота (NO) является одной из самых небольших и простых биологически активных молекул в природе. Кроме того, NO - одна из наиболее распространенных молекул у млекопитающих. Как одна из самых широко распространенных сигнальных молекул, NO является главным участником в контролировании практически каждой клеточной функции и функции органов в теле. NO является единственной эндогенной молекулой, способной работать в качестве нейромедиатора, физиологически активного вещества, конститутивного медиатора, индуцируемого медиатора, цитопротекторной молекулы и цитотоксической молекулы. Поскольку NO выполняет множество физиологических действий в регулировании многочисленных и разнообразных функций органов, дефекты в пути NO приводят к развитию множества различных патологических состояний. Эти нарушения включают артериальную гипертензию, атеросклероз, заболевания коронарной артерии, порок сердца, легочную гипертензию, инсульт, импотенцию, сосудистые осложнения при сахарном диабете, желудочно-кишечные язвы, астму и другие нарушения центральной и соматической нервной системы. Все доноры оксида азота (NOD) обладают общим свойством образования NO-связанной активности при применении их в биологических системах и, таким образом, имитируют эндогенные ответы на NO. Однако пути, приводящие к образованию/высвобождению NO, сильно различаются между классами соединений и их химическими активностями. В то время как некоторые соединения требуют ферментативного катализа, другие вырабатывают NO неферментативным путем. В некоторых соединениях высвобождению NO предшествуют восстановление или окисление. Процесс еще больше осложнен специфичной чувствительностью соединений к изменениям рН, содержания кислорода, света и температуры и образованием различных побочных продуктов, которое имеет место в ходе разложения или метаболизма. Кроме того, кинетика высвобождения NO из данного соединения часто является более важной, чем абсолютное количество высвобожденного NO. Кроме того, распределение NOD в тканях и место, в котором вырабатывается NO, также являются очень важными. Все эти принципы являются основополагающими, так как они объясняют сильно различающиеся фармакологические профили, полученные с помощью различных NOD, описанных в литературе, и приводят к необходимости получения полной характеристики фармакологического профиля при исследовании недавно разработанных NOD. Фармацевтически применимые NOD, содержащие изосорбид-мононитратный скелет раскрыты вWO 00/20420. Как таковые соединения, раскрытые в данной заявке, не являются частью настоящего изобретения. Данная заявка описывает нитраты органических соединений, способные к обеспечению сильного сосудорасширяющего действия, и обладающие эффектом малой или нулевой толерантности. Однако нет указания на возможное применение упомянутых соединений для лечения активации тромбоцитов; тромбоза; инсульта; повреждения ткани вследствие ишемии и/или ишемии/реперфузии; патологических состояний, в патогенезе которых важную роль играет окислительный стресс; и/или атеросклероза. Соответственно новое применение указанных соединений является частью настоящего изобретения. Одна из главных проблем описанных в литературе нитратов органических соединений и используемых клинически, заключается в том, что механизм их действия состоит в расслаблении сосудистой гладкой мышцы, без влияния на другие патологические процессы, участвующие в сердечно-сосудистых заболеваниях. Ишемия ткани приводит к истощению внутриклеточных депо-аденозин трифосфата (АТФ), которое впоследствии ставит под угрозу функцию связанных с мембраной АТФ-зависимых ионных насосов в эндотелиальных клетках. Эта мембранная дисфункция способствует проникновению кальция, натрия и воды в клетки. Накопление кальция и других ионов в клетке может привести к набуханию клеток и неадекватной активации ферментов клетки. Одним ферментом, который активируется повышением внутриклеточного кальция в ходе ишемии, является ксантин дегидрогеназа (XDH). В нормальных условиях гипоксантин (продукт расщепления метаболизма АТФ) окисляется XDH, по НАДФН-зависимому маршруту, с образованием ксантина и мочевой кислоты. Однако в условиях гипоксической ишемии уровни гипоксантина в клетке повышаются вследствие гидролиза АТФ, и имеет место кальцийзависимая активация протеаз, которые преобразуют НАДФН-восстанавливаемую XDH в реактивируемую кислородом форму фермента, а именно ксантиноксидазу (ХО). При восстановлении кровотока (реперфузии) в ткань и при повторном включении молекулярного кислорода, ХО преобразует гипоксантин в ксантин и мочевую кислоту, которая катализирует снижение содержания молекулярного кислорода, с образованием анионрадикалов супероксида (O2-) и пероксида водорода (Н 2 О 2). Этот механизм ХO-зависимой выработки радикала кислорода был приведен для объяснения участия O2- и Н 2 О 2 в реперфузионном повреждении различных органов, включая кишечник, мозг, сердце и скелетную мышцу. Выработка радикалов кислорода в постишемических тканях снижает способность эндогенных антиоксидантов, таких как супероксид дисмутаза (SOD), каталаза, глютатион, предохраняет эндотелиаль-1 008942 ные и паренхиматозные клетки. Было показано, что экзогенные антиоксиданты, такие как SOD и каталаза, смягчают инфильтрацию лейкоцитов и повреждение тканей, вызванное ишемией и реперфузией. Биодоступность оксида азота уменьшается при реперфузии, что вероятно происходит из-за снижения выработки эндотелиального NO и увеличения инактивации NO, вырабатываемым эндотелиальными клетками O2-. Ограниченная биодоступность NO вносит свой вклад в патологические межклеточные взаимодействия и сосудистую дисфункцию в процессе реперфузии. Соединения-доноры оксида азота проявляют себя как перспективные ингибиторы в экспериментальных моделях реперфузии после ишемии. Однако для рассмотрения процессов, сопровождающих повреждения при реперфузии после ишемии, большой интерес представляла бы молекула со свойствами как донора NO, так и со свойствами антиоксиданта. Атеросклероз представляет собой активный процесс, инициируемый непрерывным повреждением сосудистого эндотелия. Представление об атеросклерозе, как о реакции на повреждение эндотелия было развито в ходе изучения взаимосвязи атеросклероза с факторами риска (высокие уровни ЛПНП в плазме,низкие уровни ЛПВП в плазме, гипертензия, окислительный стресс, употребление табака, сахарный диабет, высокие уровни Lp(a) в плазме или такое изменение ЛПНП, как окисление или гликация, которые подавляют удаление ЛПНП специфичными рецепторами). ЛПНП накапливаются в стенке сосуда вследствие активного транспорта сосудистых эндотелиальных клеток. В ходе этого процесса часть молекулы ЛПНП окисляется. Наличие окисленных ЛПНП (ох-ЛПНП) играет главную роль в развитии атеросклеротического поражения. Также теория, согласно которой окисленные ЛПНП ответственны за некоторые из патологических особенностей атеросклеротических поражений, основана на открытии в системах культивируемых клеток, согласно которым окисленные ЛПНП вызывают изменения в клетках, коррелирующие с известными аспектами артериальных поражений, но не индуцируются нативными ЛПНП. Характеристиками атеросклероза являются повреждение эндотелия, задержка ЛПНП в интерстиции интимы, рекрутинг моноцитов в интиме, застой макрофагов с липидом, полученным из липопротеина, миграция и пролиферация клеток гладких мышц, накопление некротических клеточных остатков и тенденция к вазоконстрикции и прокоагулянтной активности. Васкулопатия сердечного аллотрансплантата представляет собой необычно ускоренную и рассеянную форму коронарного атеросклероза, который сокращает продолжительность успеха кардиальной трансплантации. Коронарная эндотелиальная сосудорасширяющая дисфункция является общим и ранним сигналом развития васкулопатии сердечного аллотрансплантата. Соответственно, новые нитраты органических соединений, которые в дополнение к сосудорасширяющей активности могли проявлять активности, которые позволят им изменять другие патологические процессы, вовлеченные в сердечно-сосудистые заболевания, такие как атеросклероз и повреждение ткани вследствие ишемии и/или вследствие ишемии и реперфузии, имеют важное преимущество по отношению к соединениям, используемым в настоящее время. Сущность изобретения Целью изобретения является новый тип соединений, производных диангидрогексит мононитрата,обладающих мощным сосудорасширяющим действием, и которые в то же время влияют на другие патологические процессы, вовлеченные в сердечно-сосудистые заболевания, такие как атеросклероз, васкулопатия сердечного аллотрансплантата и повреждение ткани вследствие ишемии и/или реперфузии после ишемии. Другой целью изобретения является новый тип соединений, производных диангидрогексит мононитрата, обладающих мощным антитромбическим эффектом даже при дозе, не изменяющей кровяное давление. Другой целью изобретения является новый тип соединений, производных диангидрогексит мононитрата, проявляющих синергический эффект с тромболитическими препаратами, антикоагулянтами,антитромботиками, антиоксидантами и препаратами, понижающими уровень липидов в крови. Дополнительная цель настоящего изобретения относится к новому применению производных диангидрогексит мононитрата для производства фармацевтической композиции для лечения сердечнососудистых нарушений, связанных с атеросклерозом. Подробное описание изобретения Целью настоящего изобретения является обеспечение соединения формулы (I) или его таутомера,фармацевтически приемлемой соли, пролекарства или сольвата-2 008942 в которой n представляет собой целое число 0, 1 или 2,X представляет -S(O)m-, -(C=O)- или простую связь, в котором m представляет собой целое число 0,1 или 2; с учетом того, что, если X представляет -(С=O)-, то n равняется 0,R представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из C1-6 алкила; С 2-6 алкенила; С 3-8 циклоалкила; С 3-8 циклоалкила, в котором одна группа СН 2 замещена О, S, NH или NCH3; С 4-8 циклоалкенила; С 4-8 циклоалкенила, в котором одна группа СН 2 замещена О, S,NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и в которой R выбирают из группы, состоящей из водорода, C1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила,С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из числаC1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила, С 4-8 циклоалкенила, ацетилокси, гидроксила, ОNО 2 и галогена. В соединениях формулы (I), если RXS(O)n- и -ONO2- находятся в транс-положении по отношению друг к другу относительно плоскости кольца, как изображено в формулах (Iа) и (Ib) в которой Z представляет собой С 1-С 4 алкилгруппу, арил или аралкил. Неожиданно, в дополнение к мощному сосудорасширяющему действию с малой или нулевой толерантностью, соединения формулы (I) обладают свойствами предотвращения активации тромбоцитов,антитромбическими, противоинсультными, антиоксидантными свойствами, свойствами предотвращения ранения/повреждения ткани вследствие ишемии и/или ишемии/реперфузии и антиатеросклеротическими свойствами. Другой вариант выполнения настоящего изобретения относится к фармацевтической композиции,содержащей в качестве активного ингредиента по меньшей мере одно из производных диангидрогексит мононитрата формулы (I), его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата. Дополнительный вариант выполнения настоящего изобретения относится к применению по меньшей мере одного производного диангидрогексит мононитрата формулы (I), его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата в качестве активного ингредиента для производства фармацевтической композиции для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, дисфункции кровеносной системы, активации тромбоцитов, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, без ограничений, таких как болезнь Альцгеймера, патологические состояния, в патогенезе которых важную роль играет дефицит оксида азота, и/или повреждение ткани вследствие ишемии и/или реперфузии после ишемии.-3 008942 Приведенные выше используемые выражения подробнее отмечены ниже. Выражение "его фармацевтически приемлемая соль, сольват или пролекарство" описывает любую фармацевтически приемлемую соль, сложный эфир, сольват или любое другое соединение, которое при введении пациенту (непосредственно или опосредованно) обеспечивает соединение, описанное в настоящей заявке. Однако следует полагать, что фармацевтически не приемлемые соли также включены в рамки данного изобретения, так как данные соединения могут быть полезны для получения фармацевтически приемлемых солей. Приготовление солей, пролекарств и производных можно проводить способами, известными из уровня техники. Например, фармацевтически приемлемые соли соединений, описанных в настоящей заявке, синтезируют из соответствующего соединения, которое содержит кислотную или основную группу, с помощью традиционных химических способов. По существу, данные соли, например, готовили по реакции свободных кислотных или основных форм данных соединений в стехиометрическом количестве с соответствующим основанием или кислотой в воде или органическом растворителе или их смеси. По существу, предпочтительными являются такие неводные среды, как эфир, этилацетат, изопропанол или ацетонитрил. Примеры кислых солей включают соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат и соли органических кислот, такие как ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, манделат, метилсульфонат и п-толуолсульфонат. Примеры основных солей включают неорганические соли, такие как соли натрия, калия, кальция,аммония, магния, алюминия и лития и органические соли, такие как этилендиамин, этаноламин, N,Nдиалкиленэтаноламин, триэтаноламин, глюкамин и основные соли аминокислот. Особенно предпочтительными являются производные или пролекарства, которые увеличивали биодоступность соединений настоящего изобретения, при их введении пациенту (например, позволяя введенному соединению пероральной формы быстрее всасываться в кровь) или которые увеличивали высвобождение соответствующего соединения в биологический компартмент (например, в мозг или лимфатическую систему). Любое соединение, которое является пролекарством соединения формулы (I), находится в рамках объема изобретения. Термин "пролекарство" используется в самом общем смысле и включает производные, которые метаболизируются "in vivo" в соединения в соответствии с изобретением. Такие производные включают в зависимости от присутствующих в молекуле функциональных групп и без ограничения следующие производные: сложные эфиры, сложные эфиры аминокислот, сложные эфиры фосфатов, соли металлов, сульфированные соединения, карбаминаты и сложные эфиры амидов. Соединения в соответствии с настоящим изобретением предпочтительно могут быть в кристаллической форме или в виде свободных соединений или сольватов. Пригодными для применения являются общеизвестные в уровне техники способы получения сольватов. Подходящими сольватами являются фармацевтически приемлемые сольваты. Предпочтительно сольват представляет собой гидрат. Предпочтительно соединения формулы (I) или их соли или сольваты находятся в фармацевтически приемлемой форме достаточной степени чистоты. Под фармацевтически приемлемой формой следует понимать, помимо прочего, обладающую фармацевтически приемлемой степенью очистки, не считая обычные фармацевтические добавки, такие как разбавители и носители, и включая материал, который считается нетоксичным при введении в уровнях нормальных доз. Степени очистки для лекарственного средства выше 50%, предпочтительно выше 70% и еще более предпочтительно выше 90%. В еще более предпочтительном варианте соединения формулы (I), или их соли, сольваты, или пролекарства обладают степенью очистки выше 95%. Соединения в соответствии с настоящим изобретением формулы (I) могут включать энантиомеры в зависимости от наличия хиральных или изомерных центров и/или в зависимости от наличия кратных связей (например, Z, Е). Чистые изомеры, энантиомеры или диастереоизомеры и их смеси находятся в рамках настоящего изобретения. Термин "галоген" обозначает фтор, хлор, бром или иод, предпочтительным из которых является бром. Термин "C1-6 алкил" в настоящей заявке обозначает группу алкил с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, включая, например, метил, этил, н-пропил, изопропил, нбутил, изобутил, сек-бутил, т-бутил, пентил и гексил. Термин "С 2-6 алкенил" в настоящей заявке обозначает группу алкенил с прямой или разветвленной цепью, содержащую от 2 до 6 атомов углерода и по меньшей мере одну двойную связь и со стереохимией Е или Z, где применимо. Этот термин может включать, например, винил, аллил, 1- и 2-бутенил и 2 метил-2-пропенил. Термин "С 3-8 циклоалкил" в настоящей заявке обозначает алициклическую группу, содержащую от 3 до 8 атомов углерода. Некоторые иллюстративные примеры таких групп, как циклоалкил, представляют циклопропил, циклобутил, циклопентил и циклогексил. Соответственно, термин "С 3-8 циклоалкил, в котором одна группа СН 2 замещена О, S, NH или NCH3" обозначает алициклическую группу, содержащую от 3 до 8 атомов углерода в которой одна группа СН 2 замещена О, S, NH или NCH3. Некоторые иллюстративные примеры таких групп представляют тетрагид-4 008942 ропиран, тетрагидрофуран, пирролидин, пиперидин и тетрагидротиофен. Термин "С 4-8 циклоалкенил" обозначает алициклическую группу, содержащую от 4 до 8 атомов углерода. Некоторые иллюстративные примеры таких групп, как циклоалкенил, представляют циклопентенил, циклогексенил, циклогептенил и циклооктенил. Предпочтительно R представляет водород, C1-6 алкил, С 2-6 алкенил, С 3-8 циклоалкил, С 4-8 циклоалкенил, (C1-6 алкил)С 3-8 циклоалкил, (C1-6 алкил)С 4-8 циклоалкенил, фенил или (C1-6 алкил)фенил, при этом особенно предпочтительным является C1-6 алкил. Кроме того, предпочтительно, чтобы в соединении формулы (I) или одна, или обе переменные из m и n равнялись 0. Также предпочтительно, чтобы X представляла простую связь или -S-. Особенно предпочтительно, чтобы соединения формулы (I) соответствовали соединениям, представленных формулами (Iа) и/или (Ib) Особенно предпочтительными соединениями формулы (I) являются 2-тиоизосорбид 5-мононитрат,5,5'-динитрат-2,2'-дитиодиизосорбид,2-метилтиоизосорбид 5-мононитрат,2-[(R)-метилсульфинил]изосорбид 5-мононитрат,2-[(S)-метилсульфинил]изосорбид 5-мононитрат,2-метилсульфинилизосорбид 5-мононитрат,2-метилсульфонилизосорбид 5-мононитрат,S-нитрозо-2-тиоизосорбид 5-мононитрат,2-(тетрагидропиран-2-илтио)изосорбид 5-мононитрат,-5 008942 2-(изосорбидил-2'-дитио)изосорбид 5-мононитрат и 2-(5'-ацетилоксиизосорбидил-2'-дитио)изосорбид 5-мононитрат. Кроме того, особенно предпочтительно применение 2-ацетилтиоизосорбид-5-мононитрата (соединение (12, его таутомера, фармацевтически приемлемой соли, пролекарства и/или сольвата в качестве активного ингредиента для производства фармацевтической композиции для профилактики и/или лечения тромбоза, ишемии, повреждения клетки/ткани, индуцированного ишемией и/или ишемией и реперфузией, гипертензии, сосудистого спазма, атеросклероза и/или васкулопатии сердечного трансплантата. Дополнительно, соединения формулы (I), особенно 2-ацетилтиоизосорбид 5-мононитрат (12), их таутомеры, фармацевтически приемлемые соли, пролекарства и сольваты, также можно использовать в терапии для профилактики и/или лечения атеросклероза, васкулопатии сердечного аллотрансплантата,активации тромбоцитов, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс и/или повреждения ткани вследствие ишемии и/или вследствие реперфузии после ишемии. Особенно данные соединения можно использовать в профилактике и/или лечении патологических состояний, в патогенезе которых важную роль играет окислительный стресс, таких как аллергия, инсульт, болезнь Альцгеймера и/или ишемические сердечно-сосудистые заболевания. Фармацевтические композиции можно вводить различными способами. Например, их можно вводить перорально в форме фармацевтических препаратов, таких как таблетки, капсулы, сиропы и суспензии. Парентерально в форме растворов или эмульсий и т.д. Их также можно вводить местно в форме кремов, помад, бальзамов и т.д. и трансдермально, например, с применением пластырей или бандажей. Также их можно применять непосредственно в прямой кишке в виде супозиториев. Препараты могут содержать физиологически приемлемые носители, наполнители, активаторы, хелатирующие агенты, стабилизаторы и т.д. В случае инъекций можно включать физиологически приемлемые буферы, солюбилизирующие агенты или изотонические растворы. Фармацевтические композиции в соответствии с настоящим изобретением дополнительно могут содержать тромболитический агент, предпочтительно активатор плазмогена, урокиназу, стрептокиназу,алтеплазу или анистреплазу. Они могут также содержать противосвертывающий агент, предпочтительно гепарин, дикумарол, аценокумарол, эноксапарин или полисульфат пентозана. Кроме того, они дополнительно могут содержать антитромбический агент, предпочтительно ацетилсалициловую кислоту, дипиридамол, тиклопидин, клопидрогель, трифлусал, полисульфат пентозана или абциксимаб. Они дополнительно могут содержать иммуноглобулин или его фрагмент, обладающий специфичностью к гликопротеиду IIb/IIIa. В качестве альтернативы, фармацевтические композиции в соответствии с изобретением дополнительно могут содержать агент, понижающий уровень липидов в крови, предпочтительно симвастатин,ловастатин, аторвастатин, правастатин, флувастатин, эптастатин, лифиброл, ацифран, ацитемат, глуникат или росувастатин. Они могут также содержать агент антиоксиданта/акцепторов свободных радикалов,предпочтительно выбранный из числа никаравена, ранолазина, эмоксипина, глутатиона, эдаравона, раксофеласта, ликопена, N-ацетил-L-цистеина, N-ацетил-D-цистеина, рацемированной смеси N-ацетил-Lцистеина и N-ацетил-D-цистеина или карведилола. Фармацевтические композиции в соответствии с настоящим изобретением можно использовать для лечения и/или профилактики атеросклероза, васкулопатии сердечного аллотрансплантата, активации тромбоцитов, тромбоза, инсульта, повреждения ткани вследствие ишемии и/или вследствие реперфузии после ишемии, и/или патологических состояний, в патогенезе которых важную роль играет окислительный стресс (такие как, без ограничений, аллергия, инсульт, болезнь Альцгеймера, ишемические сердечно-сосудистые заболевания); и/или патологических состояний, в патогенезе которых важную роль играет дефицит NO. Также их можно использовать для лечения и/или профилактики дисфункций кровеносной системы, предпочтительно сердечно-сосудистых и коронарных дисфункций. Суточная доза может быть различной в зависимости от особенностей симптомов, возраста, веса тела пациентов, конкретного способа введения и т.д., и ежедневная нормальная доза для взрослого человека может быть в диапазоне между 0,1-500 мг, и ее можно вводить и в виде одной дозы, можно разделить на несколько доз в течение дня. Соединения в соответствии с настоящим изобретением можно готовить способами, известными из уровня техники, путем адаптации известных процессов специалистом в данной области, используя но-6 008942 вый процесс, описанный ниже. Следовательно, другой вариант выполнения настоящего изобретения относится к процессам для получения соединений формулы (I), их таутомеров, фармацевтически приемлемых солей, пролекарств и сольватов. Согласно изобретению предпочтительно получение соединения формулы (I), его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата по способу, отмеченному ниже. в которой n представляет собой целое число 0, 1 или 2,X представляет -S(O)m- или простую связь, в которой m представляет собой целое число 0, 1 или 2,иR представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из C1-6 алкила; С 2-6 алкенила; С 3-8 циклоалкила; С 3-8 циклоалкила, в котором одна группа СН 2 замещена О, S, NH или NCH3; С 4-8 циклоалкенила; С 4-8 циклоалкенила, в котором одна группа СН 2 замещена О, S,NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и в которой R выбирают из группы, состоящей из водорода, C1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила,С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена, в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из группы, состоящей из C1-6 алкила, С 2-6 алкенила,С 3-8 циклоалкила, С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена. Данный способ включает следующие стадии: а) гидролиз соединения формулы (IIа)(b) необязательно проведение с соединением, полученным на стадии (а):R представляет гидроксил или ONO2;II) реакции замещения с получением соединения формулы (I), в которомn представляет собой целое число 0,X представляет связь, иR не является нитрозилом,необязательно, с последующим окислением, с получением соединения формулы (I), в которомn представляет собой целое число 0,X представляет -S(O)m-, в котором m представляет собой целое число 0 или 1, иIII) реакции замещения с получением соединения формулы (I), в которомn представляет собой целое число 0 иX представляет -S-; необязательно с последующим окислением, с получением соединения формулы (I), в которомn представляет собой целое число 1 или 2 и Согласно приведенному выше способу изобретения особенно предпочтительно получение соединения формулы (Iа), его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата в которой n, X, m и R имеют приведенное выше значение, и в которой указанные процессы включают проведение следующих стадий: а) гидролиз соединения формулы (II)(b) необязательно проведение с соединением (1), приготовленным на стадии (а)I) реакции окисления с получением 5,5'-динитрат-2,2'-дитиодиизосорбида (2) или 2-(изосорбидил 2'-дитио)изосорбид 5-мононитрата (8),необязательно с последующим вторым окислением с получением соединения формулы (Iе)R представляет гидроксил или ONO2;II) реакции замещения с получением соединения формулы (Iа), в которойn представляет собой целое число 0,X представляет связь, иR не является нитрозилом,необязательно, с последующим окислением с получением соединения формулы (Ia), в которойn представляет собой целое число 0,X представляет -S(O)m-, в котором m представляет собой целое число 0 или 1, иIII) реакции замещения с получением соединения формулы (Iа), в которойn представляет собой целое число 0 и-9 008942 необязательно, с последующим окислением с получением соединения формулы (Iа), в которойn представляет собой целое число 1 или 2 иIV) реакции нитрозирования с получением S-нитрозо-2-тиоизосорбид 5-мононитрата (6). Дополнительная стадия (b) данного нового процесса изобретения схематично описана на схемах 1-4 для конкретных соединений в соответствии с изобретением. Схемы 1-4 относятся к реакции окисления I,реакции замещения II, реакции замещения III и реакции нитрозирования IV соответственно. Особенно предпочтительный способ изобретения включает стадии (а) и (b) II для получения 2-[(R)алкилсульфинил]изосорбид 5-мононитрата и/или 2-[(S)-алкилсульфинил]изосорбид 5-мононитрата. Еще более предпочтительно, чтобы впоследствии два диастереоизомера были разделены, такое разделение можно осуществить с применением обычных способов, известных из уровня техники. Дополнительный предпочтительный способ получения в соответствии с изобретением относится к получению соединения формулы (II) или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата данный способ включает следующие стадии: а) реакцию окисления соединения формулы (III)(b) реакцию нитрования соединения, полученного на стадии (а) с нитрующим агентом в присутствии ангидрида карбоновой кислоты, предпочтительно уксусного ангидрида. Наконец, другой вариант выполнения настоящего изобретения относится к 2,2'-дитиодиизосорбиду,соединению (10), которое является промежуточным для получения соединения (11) в соответствии с изобретением. В рабочих примерах настоящей заявки (см. ниже) подробно описаны подходящие способы получения различных соединений общей формулы (I). В свете данных примеров, получение соединений, не явно проиллюстрированных в настоящей заявке, путем соответствующих изменений рабочих примеров в настоящей заявке, находится в рамках общих знаний специалистов в данной области. Специалисту в данной области очевидно, какие из данных примеров представлены исключительно для иллюстративных целей и не должны рассматриваться как ограничение изобретения.- 10008942 Примеры Соединения, полученные в примерах, приведенных ниже, идентифицировали с помощью данных спектроскопии ядерного магнитного резонанса протонов (1 Н-ЯМР) и углерода-13 (13 С-ЯМР). Спектры ядерного магнитного резонанса записывали с помощью спектрометров Varian Gemini-2000 или Varian Gemini-300. Рабочая частота и растворитель, используемые для записи спектра, отмечены в спектрах 1 Н-ЯМР. Положение сигналов отмечено в(ррm), с сигналом протонов растворителя, взятым в качестве стандарта. Стандартные значения которых составляли 7,24 ppm для дейтеризованного хлороформа и 2,49 ррm для дейтеризованного диметилсульфоксида. Сигнал, полученный от протонов тетраметилсилана (TMS),иногда используется в качестве внутреннего стандарта с применением стандартного значения 0 ppm. Количество протонов для каждого сигнала в соответствии с измерением электронной интеграцией и тип сигнала отмечены в круглых скобках с применением следующих сокращений: s (синглет), d (дублет), t(триплет), dd (дублет дублетов),ddd (дублет дублетов дублетов), bs (широкий сигнал), cs (сложный сигнал), s.a. D2O (упрощается при дейтерировании), d.a. D2O (исчезает при дейтерировании). Рабочая частота и растворитель, используемые в каждом спектре, отмечены в спектрах 13 С-ЯМР. Положение сигналов отмечено в(ppm) с сигналом углерода растворителя, взятого в качестве стандарта. Стандартные значения составляли 77,00 ppm для дейтеризованного хлороформа и 39,50 ppm для гексадейтеризованного диметилсульфоксида. В некоторых случаях эксперименты ядерного магнитного резонанса также выполняли с применением APT (присоединенного протонного теста) последовательностей импульсов, HETCOR (корреляции гетероядерного химического сдвига) или COSY (коррелированной спектроскопии). В экспериментальной части используются следующие сокращения:HPLC - высокоэффективная жидкостная хроматография Нх - гексанLC-(ApcI)MS - масс-спектрометрия жидкостной хроматографии-химической ионизации при атмосферном давленииs.e.m. - стандартная ошибка среднего ТНР - тетрагидропиранил. Пример 1. Способ получения 2-тиоизосорбид 5-мононитрата (1). В 50 мл колбе в 20,0 мл метилового спирта растворяли 1,00 г (4,02 ммоль) 2-ацетилтиоизосорбид 5 мононитрата (12), полученного в соответствии с WO 00/20420. Сразу добавляли 10,0 мл 10% раствора гидроксида натрия в метаноле. После быстрого распределения и перемешивания в течение 1 мин при комнатной температуре (приблизительно 25 С), сразу добавляли 2,23 мл концентрированной соляной кислоты. Смесь перемешивали и концентрировали досуха удалением растворителя при пониженном давлении при температуре ниже 30 С. Остаток суспендировали в хлороформе. Данный раствор в хлороформе фильтровали и затем сушили над безводным сульфатом магния. После фильтрации растворитель удаляли при пониженном давлении. Смесь сушили при пониженном давлении с получением 0,83 г маслянистой жидкости оранжевожелтого цвета, соответствующей интересующему продукту. Выход: 100%. 1 Н-ЯМР (200 МГц, CDCl3): 5,36-5,26 (1 Н, м, CHONO2), 4,95 (1 Н, т, J=5,0 Гц, CHCHONO2), 4,42 (1 Н,д, 4,8 Гц, CHCHS), 4,07 (1 Н, дд, J=4,6 Гц, J=4,4 Гц, H-CHCHS), 3,97 (1 Н, дд, J=5,64 Гц, J=2,5 Гц, HCHCHONO2), 3,87-3,76 (2 Н, cc, H-CHCHS, H-CHCHONO2), 3,45-3,35 (1 Н, м, CHS), 1,77 (1 Н, д, J=8,6 Гц,SH). 13 С-ЯМР (50 МГц, CDCl3): 91,21 (CHCHS), 81,22 (CHONO2), 81,07 (CHCHONO2), 76,15 (CH2CHS),69,26 (CH2CHONO2), 42,82 (CHS). Процедура 1. 0,50 г 2-ацетилтиоизосорбид 5-мононитрата (12), полученного в соответствии с WO 00/20420, растворяли в 10,0 мл метилового спирта. Данный раствор медленно добавляли по каплям в 200 мл человеческой плазмы 250 мл в колбе при сильном перемешивании на магнитной мешалке. Реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Неочищенную реакционную смесь приливали к 500,0 мл ацетонитрила при энергичном перемешивании, наблюдая мгновенное осаждение хлопьевидного вещества белого цвета, соответствующего белкам плазмы. Смесь центрифугировали при 3000 об./мин при 20 С в течение 30 мин, отделяли жидкость и твердое вещество (белковую массу) суспендировали в 250,0 мл ацетонитрила. Смесь перемешивали и центрифугировали в описанных выше условиях (3000 об./мин/20 С/30 мин). Раствор супернатанта декантировали и объединяли с предыдущим. Растворитель выпаривали при пониженном давлении при температуре ниже 30 С. Получающийся водный остаток (приблизительно 200 мл) экстрагировали 4500 мл хлороформа. Органические фазы объединяли и сушили над безводным сульфатом магния. После фильтрации растворитель концентрировали при пониженном давлении. Это дало 350 мг твердого вещества белого цвета, которое очищали с помощью хроматографии: (CHCl3/AcOEt 6:1), с выделением 250 мг твердого вещества белого цвета, соответствующего дисульфидному продукту 2-тиоизосорбид 5-мононитрата (2). Выход: 60%. Процедура 2. В 50 мл колбе в 20 мл метилового спирта растворяли 1,00 г (4,02 ммоль) 2 ацетилтиоизосорбид 5-мононитрата (12), полученного в соответствии с WO 00/20420 и растворяли в 20 мл метилового спирта добавляли 10 мл 10% раствора гидрокида калия в метаноле. Реакционную смесь накрывали и перемешивали в течение 5 ч при комнатной температуре. В ходе реакции наблюдается осаждение твердого вещества белого цвета, соответствующего дисульфиду (2). Твердое вещество отфильтровывали и несколько раз промывали метиловым спиртом. Сушка при пониженном давлении дает 0,58 г твердого вещества белого цвета, соответствующего интересующему дисульфидному продукту 2-тиоизосорбид 5-мононитрата (2). Выход: 70%. 1 Н-ЯМР (200 МГц, ДМСО-d6): 5,51-5,43 (2 Н, м, 2CHONO2), 4,96 (2 Н, т, J=5,4 Гц, 2CHCHONO2),4,51 (2 Н, д, J=4,8 Гц, 2CHCHS), 4,04-3,73 (10 Н, cc, 2CH2CHONO2, 2CH2CHS, 2CHS). 13 С-ЯМР (50 МГц, ДMCO-d6): 88,46 (2CHCHS), 83,31 (2CHONO2), 81,50 (2CHCHONO2), 73,24 В 50 мл колбе в 20,0 мл метилового спирта растворяли 1,00 г (4,02 ммоль) 2-ацетилтиоизосорбид 5 мононитрата (12), полученного в соответствии с WO 00/20420 и сразу добавляли 5,0 мл 10% раствора гидроксида натрия в метаноле. Реакционную смесь накрывали и перемешивали в течение 5 мин при комнатной температуре. Сразу добавляли 2,0 мл метилиодида (32,00 ммоль), смесь накрывали и перемешивали в течение 2 ч при комнатной температуре. Смесь концентрировали досуха, удаляя растворитель при пониженном давлении. Остаток растворяли в 250 мл хлороформа и промывали 50 мл воды. Органическую фазу отделяли и промывали 350,0 мл воды. После сушки над безводным сульфатом магния, смесь фильтровали и удаляли растворитель при пониженном давлении. Сушка при пониженном давлении, дает 0,68 г твердого вещества белого цвета, соответствующего интересующему продукту. Выход: 76%. 1 В 500 мл колбе в 75 мл диоксана растворяли 7,3 г (32,9 ммоль) 2-метилтиоизосорбид 5-мононитрата(32,9 ммоль) NaIO4 в 110 мл воды и затем перемешивали в течение 1 ч при комнатной температуре. Смесь фильтровали и затем диоксан отделяли от фильтрата при пониженном давлении. Добавляли 150 мл воды. Смесь экстрагировали 2300 мл частями хлороформа. Смесь сушили над безводным сульфатом магния, фильтровали и удаляли растворитель при пониженном давлении. Это дает 6,6 г необработанной реакционной смеси, содержащей смесь диастереоизомеров в пропорции 65% (4) и 35% (4bis). Получающуюся необработанную реакционную смесь дважды перекристаллизовывали из диоксана с получением 2,9 г интересующего продукта (4) со степенью чистоты 95% посредством HPLC. С использованием маточных растворов первой перекристаллизации, удаляли растворитель при пониженном давлении и получающийся остаток перекристаллизовывали из диоксана с получением 1 г интересующего продукта (4bis) со степенью чистоты 95% посредством HPLC. 2-[(R)-Метилсульфинил]изосорбид 5-мононитрат (4): 1H-ЯМР (200 МГц, CDCl3): 5,39-5,28 (1 Н, м, CHONO2), 5,02 (1 Н, дд, J=5,6 Гц, J=1,6 Гц, CHCHS),4,89 (1H, т, J=5,5 Гц, CHCHONO2), 4,29 (1H, дд, J=10,4 Гц, J=6,4 Гц, H-CHCHS), 4,20-3,91 (3H, cc, HCHCHS, CH2CHONO2), 3,38-3,31 (1H, м, CHSO), 2, 61 (3H, c, CH3). 13 С-ЯМР (50 МГц, CDCl3): 82,11 (CHCHONO2), 81,51 (CHCHS), 80,55 (CHONO2), 69,65 (CH2CHS),69,28 (CH2CHONO2), 66,24 (CHSO), 37,28 (CH3). Микроанализ: расчетные (%): 35,44 С; 4,67 Н; 5,90 N; 13,51 S; 40,47 О,экспериментальные (%): 35,31 С; 4,67 Н; 5,98 N; 13,5 S; 40,60 О. Масс-спектрометрия (LC-(ApcI) МС - 20V): 238 (М+1)+. Точка плавления: 153 С посредством DSC. Дифракция рентгеновских лучей монокристаллом: конфигурация диастеромера (4) установлена следующим образом: (R)-S, (S)-C2, (S)-C3, (S)-C4, (R)-C5. 2-[(S)-Метилсульфинил]изосорбид 5-мононитрат (4bis): 1(CH2CHONO2), 67,88 (CH2CHS), 66,94 (CHSO), 36,64 (CH3). Микроанализ: расчетные (%): 35,44 С; 4,67 Н; 5,90 N; 13,51 S; 40,47 O,экспериментальные (%): 35,65 С; 4,66 Н; 5,87 N; 13,56 S; 40,57 О. Масс-спектрометрия (LC-(ApcI) МС - 20V): 238 (М+Н)+. Точка плавления: 115 С посредством DSC. Дифракция рентгеновских лучей монокристаллом: конфигурация диастеромера (4bis) установлена следующим образом: (S)-S, (S)-С 2, (S)-C3, (S)-C4, (R)-C5. Пример 5. Способ получения 2-метилсульфонилизосорбид 5-мононитрата (5). В колбе растворяли в 20 мл ацетонитрила 1,0 г (4,5 ммоль) 2-метилтиоизосорбид 5-мононитрата (3),- 13008942 полученного в соответствии с примером 3. Сразу добавляли раствор 4,11 г (18,1 ммоль) йодной кислоты(Н 5IО 6) и затем перемешивали в течение 48 ч при комнатной температуре. Добавляли 50 мл насыщенного раствора Nа 2SО 3. Смесь экстрагировали 230 мл метиленхлорида. Объединяли органические фазы и промывали их 230 мл насыщенного раствора Nа 2SО 3. Смесь сушили над безводным сульфатом магния,фильтровали и удаляли растворитель при пониженном давлении. Получали 662 мг интересующего продукта (5). 640 мг необработанной смеси суспендировали в 25 мл гексана, фильтровали и промывали 7,5 мл хлороформа с получением 450 мг продукта (5) со степенью чистоты 99,7% посредством HPLC. 1 Н-ЯМР (200 МГц, ДMCO-d6): 5,53-5,47 (1 Н, м, CHONO2), 5,00-4,88 (2 Н, cc, CHCHONO2, CHCHS),4,38 (1 Н, дд, J=9,8 Гц, J=1,8 Гц, H-CHCHS), 4,12-3,86 (4 Н, cc, H-CHCHS, CH2CHONO2, CHSO2), 3,07 (3 Н,с, СН 3). 13 С-ЯМР (50 МГц, ДМСО-d6): 82,77 (CHCHS), 82,36 (CHCHONO2), 81,81 (CHONO2), 68,95 В желтой пробирке растворяли в 4,0 мл метанола 0,5 г (2,41 ммоль) 2-тиоизосорбид 5-мононитрата(1), полученного в соответствии с примером 1, закрывали и перемешивали на ледяной бане. Добавляли 320 мкл (0,249 г, 2,41 ммоль) трет-бутоксинитрита и перемешивали в закрытом состоянии при охлаждении в течение 7 ч. Твердое вещество белого цвета отфильтровывали и фильтрат концентрировали до сухого состояния при пониженном давлении, предохраняя от воздействия света, при комнатной температуре. Это дает 0,48 г (выход: 84%) твердого вещества темно-красного цвета, идентифицированного как Sнитрозо-2-тиоизосорбид 5-мононитрат (6). 1 Н-ЯМР (CDCl3, 200 МГц): 5,40-5,25 (cc, 1 Н, CHONO2), 4,84-4,64 (cc, 2 Н, CHSNO, CHCHONO2),4,40-4,30 (м, 2 Н, H-CHCHSNO, CHCHSNO), 4,12 (дд, 1 Н, J=11,4 Гц, J=2,6 Гц, H-CHCHONO2), 4,00-3,80 0,5 г (2,41 ммоль) 2-тиоизосорбид 5-мононитрата (1), полученного в соответствии с примером 1,суспендировали в 6 мл 3,4-дигидро-2 Н-пирана и охлаждали смесь на ледяной бане. Добавляли 0,10 г(0,40 ммоль) п-толуолсульфоната пиридина и перемешивали в течение ночи в атмосфере азота при комнатной температуре. Добавляли 50 мл EtOEt и промывали смесь 240 мл насыщенного раствора NaCl. Это дает 1,15 г необработанной реакционной смеси, которую очищали с помощью хроматографии(Нх:AcOEt=3:2), что дает 0,65 г интересующего продукта со степенью чистоты 83%. Перекристаллизация из гексана дала 0,45 г продукта со степенью чистоты 95%, идентифицированного с помощью данных спектроскопии как 2-(тетрагидропиран-2-ил)-2-тиоизосорбид 5-мононитрат (7). 1 Н-ЯМР (CDCl3, 200 МГц): 5,28 (ддд, 1 Н, J=11,0 Гц, 5,4 Гц, 2,8 Гц, CHONO2), 5,0-4,85 (cc, 2 Н,CHSTHP, CHCHONO2), 4,59 (дд, 1 Н, J=11,2 Гц, 4,6 Гц, CHCHSTHP), 4,20-3,80 (cc, 5 Н, CH2CHSTHP, HCHCHONO2, СН 2 ТНР), 3,60-3,40 (cc, 2 Н, H-CHCHONO2, CHTHP), 2,00-1,45 (cc, 6 Н, 3 СН 2 ТНР). 13 С-ЯМР (CDCl3, 50 МГц): 89,5 и 89,1 (CHCHS), 83,0 и 81,6 (CHCHONO2), 81,4 и 81,3 (CHSTHP,CHONO2), 74,9 и 74,1 (СН 2 ТНР), 69,0 и 68,9 (CH2CHSTHP), 64,8 и 64,7 (CH2CHONO2), 49,1 и 47,6 Раствор 0,170 г (1,72 ммоль) сукцинимида в EtOH добавляли в 0,323 г (1,56 ммоль) 2-тиоизосорбид 5-мононитрата (1). После появления осадка белого цвета добавляли 0,168 мг (2 ммоль) NaHCO3. После перемешивания при комнатной температуре в течение 3 ч и 45 мин еще добавляли 100 мг (1,19 ммоль)NаНСО 3 и 10 капель воды. После еще 1,5 ч перемешивания, смесь помещали в колбу с обратным холодильником и после 2 ч EtOH удаляли при пониженном давлении; добавляли 150 мл воды и 150 мл AcOEt. Формировали эмульсию и добавляли NaCl(s) до разделения двух фаз. Отделяли органическую фазу и промывали водную фазу 2150 мл частями AcOEt. Каждую из трех органических фаз отдельно промывали 100 мл воды, органические фазы объединяли и сушили над безводным Na2SO4. Смесь фильтровали,промывали AcOEt и растворитель удаляли из фильтрата при пониженном давлении, с получением 336 мг необработанной реакционной смеси, на которой проводят флэш-хроматографию. Применение смеси 1:1CHCl3/AcOEt в качестве растворителя для хроматографического разделения дает фракцию 98 мг интересующего продукта (8). 1 Н-ЯМР (300 МГц, CDCl3): 5,40-5,32 (1 Н, cc, CHONO2), 5,04-4,98 (1 Н, cc, CHCHONO2), 4,70-4,60 В колбе на 500 мл растворяли в 225 мл EtOH 15 г (74 ммоль) 2-ацетилтиоизосорбида (13), полученного в соответствии с WO 00/20420. Добавляли 85% раствора 11,3 г KОН в 150 мл воды. Получающуюся смесь перемешивали при комнатной температуре в течение 2 ч, нейтрализовали с помощью АсОНс) и удаляли EtOH при пониженном давлении. Получающийся раствор доводили до основного рН добавлением NaOH(s) и перемешивали при комнатной температуре с барботированием воздушного потока через раствор в течение 10 ч. Раствор подкисляли с помощью НСl(с) и доводили до рН=4. Воду удаляли при пониженном давлении и получающийся остаток повторно растворяли в СН 2 Сl2, фильтровали и сушили над безводным Nа 2SО 4. Раствор фильтровали, промывали и растворитель удаляли из фильтрата при пониженном давлении с получением 9,22 г необработанной реакционной смеси, которую очищали с помощью флэш-хроматографии с применением различных смесей циклогексана/этилацетата в качестве элюента. Элюцию начинали с 3 л смеси 1:1 и после этого процентное содержание полярного растворителя увеличивали сначала с 2 л смеси 3:5, затем с 2 л смеси 1:2 и, наконец, элюировали только AcOEt. Из элюата выделяли фракцию 2,64 г тиола (9) и еще 3,06 г дисульфида (10). 2-Тиоизосорбид (9). 1 Н-ЯМР (200 МГц, CDCl3): 4,68-4,58 (1 Н, cc, СНСНОН), 4,48-4,40 (1 Н, cc, CHCHSH), 4,34-4,18 (1H,- 15008942 шир.с, s.a. D2O, CHOH), 4,16-4,06 (1H, м H-CHCHSH), 3,96-3,78 (2H, cc, H-CHCHOH, H-CHCHSH), 3,623,50 (1H, cc, 1 H-CHCHOH), 3,48-3,36 (1H, cc, s.a. D2O, CHS), 2,80-2,60 (1H, шир.с, d.a. D2O, OH), 1,75 Смесь для нитрования готовили путем медленного и осторожного прибавления к смеси 7,5 мл уксусного ангидрида и 12,5 мл уксусной кислоты 1,8 мл 60% HNO3 при 0 С. В 100 мл колбе, снабженной обратным холодильником, термометром и магнитной мешалкой, в 17 мл уксусной кислоты растворяли 2,77 г (8,6 ммоль) 2,2'-дитиодиизосорбида (10), полученного в соответствии с примером 8 и добавляли 3,5 мл уксусного ангидрида. Смесь охлаждали при 0 С на бане со льдом и солью. 4 мл предварительно приготовленной нитрующей смеси добавляли по каплям в течение 15 мин. Смесь перемешивали при 0 С в течение 2 ч, наблюдая загустевание необработанной реакционной смеси. Затем смесь перемешивали в течение 2,5 ч при комнатной температуре. Необработанную реакционную смесь вливали в 100 мл воды,фильтровали и промывали большим количеством воды. Образующееся твердое вещество сушили при пониженном давлении в присутствии Р 2 О 5. Это дало 2,69 г необработанной реакционной смеси, которую очищали с помощью преперативной обратнофазной хроматографии. В качестве элюента для хроматографии использовали смесь 1:1 ацетонитрила:воды. Выделяли 1,01 г фракцию диацетата (14) (R=COCH3) и еще одну 0,5 г фракцию ацетат-нитрата (11) (R=NO2). 5,5'-Диацетилокси-2,2'-дитиодиизосорбид (R=COCH3) (14). 1H-ЯМР (200 МГц, CDCl3): 5,37-5,28 (1 Н, cc, CHONO2), 5,18-5,06 (1 Н, cc, СНОСО), 5,02-4,94 (1 Н,cc, СНОС), 4,87-4,78 (1 Н, cc, СНОС), 4,64-4,56 (2 Н, cc, 2 СНОС), 4,18-3,75 (8H, cc, 4 СН 2), 3,59-3,50 (2 Н,cc, 2 CHS), 2,10 (3 Н, с, СН 3). 13 С-ЯМР (50 МГц, CDCl3): 170,29 (СО), 88,25 (СН), 87,43 (СН), 81,58 (СН), 81,16 (СН), 80,79 (СН),73,80 (СН), 72,78 (СН 2), 72,66 (СН 2), 70,51 (СН 2), 69,32 (СН 2), 54,42 (CHS), 53,72 (CHS), 20,65 (СН 3). Масс-спектрометрия: Химическая ионизация (NH3): 410 (М+1)+, 427 (М+18)+. Тесты на расширение сосудов Способ, используемый в пробах, в основном представляет собой тот же способ, что и описанный в следующих ссылках:Salas E., et al., Eur. J. Pharmacol. 258 (1994); 47-55. Различные соединения протестированы при 5 различных концентрациях в диапазоне концентрации- 16008942 от 0,0001 до 10 мМ, с применением от 6 до 9 колец артерии для каждого соединения. Полученные результаты сравнивали с результатами для изосорбид 5-мононитрата, который использовали в качестве стандартного продукта. Результаты показаны в табл. 1 ниже и представлены в виде ЕС 50 (эффективной концентрации 50),которая представляет собой концентрацию каждого из протестированных соединений, приводящую к вазодилатации, равной 50% максимального тонуса, с которым кольцо артерии сокращалось за счет 1 мкМ фенилэфрина. Таблица 1 Тест расширения сосудов Как можно видеть из таблицы, все протестированные соединения как вазорелаксант являются более мощными, чем стандартный продукт.In vitro тест ингибирования скопления тромбоцитов Способ, используемый в пробах, в основном представляет собой тот же способ, что и описанный в следующей ссылке:Salas E., et al., Br. J. Pharmacol. 112 (1994); 1071-1076. Соединения тестировали при четырех различных концентрациях, с применением плазмы, богатой тромбоцитами, не менее чем от 6 различных здоровых доноров-людей. Полученные результаты сравнивали с результатами для 5-изосорбид мононитрата, который использовали в качестве стандартного продукта. Результаты показаны в табл. 2 и выражены в виде IС 50 (концентрация ингибирования 50), которая представляет собой концентрацию каждого из протестированных соединений, приводящую к ингибированию, равному 50% скопления, полученного при субмаксимальной концентрации (1-4 мкМ) АДФ (субмаксимальная концентрация АДФ представляет собой минимальное количество АДФ, приводящее к максимальному скоплению). Таблица 2 Тест ингибирования скопления тромбоцитов (плазма человека, богатая тромбоцитами) Как можно видеть из табл. 2, все протестированные соединения оказывали мощную ингибирующую активность на скопление тромбоцитов, превосходящую ингибирующую активность стандартного соединения. Ингибирование адгезии моноцитов и тромбоцитов человека с эндотелиальными клетками человека Используемые в пробах способы для определения действия соединений на адгезию тромбоцитов и моноцитов человека с эндотелиальными клетками человека в основном представляют собой те же спосо- 17008942 бы, что и описанные в следующих ссылках:Martin-Satue M. et al.; British Journal of Cancer 1999; 80; 1169-1174. Способами, используемыми для определения ингибирующего действия соединений на адгезию клеток, были адгезия клеток моноцитов U937 с конфлюэнтными эндотелиальными клетками микроциркуляторного русла человека, (НМЕС-1), активизированными посредством TNF- (50 нг/мл), и адгезия тромбоцитов с пуповинными эндотелиальными клетками человека (HUVEC). Адгезию моноцитов, предварительно меченых кальцеином-АМ (молекулярные зонды) с НМЕС-1, активизированными TNF-, оценивали путем определения флуоресценции связанных клеток. Адгезию промытых тромбоцитов человека,предварительно меченых МоАb против CD36-FITC с активизированными HUVEC (50 мкг/мл минимально модифицированных ЛПНП, ммЛПНП), определяли с помощью лазерной развертывающей цитометрии (LSC, Olympus), определяющей флуоресценцию связанных клеток. Результаты выражали как процент ингибирования по отношению к контролю (адгезия клеток в отсутствии соединений). В табл. 3 показано действие соединений на адгезию U937 с активизированными НМЕС-1. В табл. 4 показано действие соединений на адгезию тромбоцитов с активизированными HUVEC. Таблица 3 Ингибирование адгезии моноцитов U937 с активизированными эндотелиальными клетками человека НМЕС-1 Таблица 4 Ингибирование адгезии тромбоцитов с HUVEC, активизированными ммЛПНП (50 мкг/мл) Ингибирование трансцитоза ЛПНП в капиллярных эндотелиальных клетках человека Способ, используемый в пробах для определения действия соединений на трансцитоз ЛПНП в капиллярных эндотелиальных клетках человека, в основном представляет собой тот же способ, что и описанный в Colome С. et al.; Atherosclerosis 2000; 149: 295-302. Данный тест обеспечивает прогноз антиатеросклеротического потенциала соединений, поскольку накопление ЛПНП в стенке сосуда вследствие активного транспорта сосудистой эндотелиальной клетки является одним из первых стадий в развитии атеросклероза. Способ, используемый в пробах для выделения частиц ЛПНП из свежей плазмы человека и мечения с помощью Dil, в основном представляет собой тот же способ, что и описанный в Pedreno J. et al., Atherosclerosis 2001; 155: 99-112 и Stephan Z.F. и Yuracheck E.C. J. Lipid Res. 1993; 34:325-330. Активизированные (100 мкМ гистамина) и не активизированные НМЕС-1 выращивали в верхней лунке вставки совместной культуры до достижения слияния (Falcon HTS FluorBloK). Затем добавляли ЛПНП-Dil (до 200 мкг/мл) и культивировали клетки в течение 2 ч в присутствии и в отсутствии соединений. По истечении 2 ч оценивали трансцитоз частиц ЛПНП-Dil через эндотелиальные клетки, определяя наличие флуоресценции в нижней лунке вставки совместной культуры. Результаты выражали как процент ингибирования по отношению к контролю (в отсутствии соединений). В табл. 5 показано действие соединений на трансцитоз ЛПНП-Dil через НМЕС-1. Таблица 5 Ингибирование трансцитоза ЛПНП в капиллярных эндотелиальных клетках человека(% ингибирования пс отношению к контролю (среднееs.e.m. Ингибирование окисления ЛПНП Способ, используемый в пробах для определения действия соединений на окисление ЛПНП, в ос- 18008942 новном представляет собой тот же способ, что и описанный в следующих ссылках:Spranger Т., et al., Chem. Phys. Lipids 1998; 91:39-52,Lynch S.M., et al., Biochim. Biophys. Acta 2000; 1485:11-22,Pedreo J., et al., Thromb. Res. 2000; 99: 51-60. Способ, используемый в пробах для выделения частиц ЛПНП из свежей плазмы, в основном представляет собой тот же способ, что и описанный в Pedreno J., et al., Atherosclerosis 2001; 155: 99-112. Окислительное изменение липопротеинов низкой плотности (ЛПНП) в настоящее время считается центральным явлением в развитии атеросклеротического сердечно-сосудистого заболевания. Экспозиция ЛПНП гемину без глобина (комплексу, содержащему трехвалентный ион железа (Fe3+) с протопорфирином IX), полученному из гемоглобина в циркулирующих эритроцитах, служит физиологическим источником прооксидантного Fe3+, способного вызывать окисление ЛПНП. Соединения добавляли in vitro для определения ингибирующей активности по отношению к окислению ЛПНП, индуцированному гемином и Н 2 О 2. ЛПНП при конечной концентрации белка 0,2 мг/мл содержали в присутствии 2,5 мкМ гемина и 5 мкМ Н 2 О 2. Окислительное изменение частиц ЛПНП оценивали путем измерения сопряженных диенов. Экспериментальные образцы культивировали при 37 С, и каждые 5 мин по меньшей мере в течение 5 ч автоматически регистрировали увеличение поглощения света при 234 нм. Действие соединений на окисление ЛПНП, индуцированное гемином проверяли при 7 различных концентрациях с применением препаратов ЛПНП от 7 различных здоровых доноров. В табл. 6 показана ингибирующая активность соединений при 10 мкМ, выраженная как процент от увеличения индукционного периода (время, которое требуется для начала реакции формирования сопряженных диенов) по отношению к контролю. Таблица 6 Ингибирование окисления ЛПНП Ингибирование окисления плазмы Способ, используемый в пробах для определения действия соединений на способность окисления плазмы, в основном представляет собой тот же способ, что и описанный в Spranger Т. et al., Chem PhysLipids 1998; 91: 39-52. Ожидается, что окисление липопротеинов, индуцированное в плазме in vitro, представляет серьезную модель окисления липопротеинов в стенках артерии. Окисление липопротеинов плазмы оценивали,как способность к окислению гепаринизированной плазмы и измеряли посредством спектрофотометрии как увеличение поглощения света при 234 нм. Соединения добавляли in vitro для определения ингибирующй активности по отношению к способности окисления плазмы, индуцированного Cu2+ (CuSO4). Гепаринизированную плазму разбавляли фосфатно-буферным солевым раствором (PBS), содержащим 0,16M NaCl и инициировали окисление с помощью 50 мкМ CuSO4. Экспериментальные образцы культивировали при 37 С и каждые 15 мин в течение, по меньшей мере, 12 ч автоматически регистрировали увеличение поглощения света при 234 нм. Действие соединений на способность окисления плазмы,индуцированного Cu2+, тестировали при 7 различных концентрациях с применением гепаринизированной плазмы от 7 различных здоровых доноров. В табл. 7 показана ингибирующая активность соединений при 10 мкМ, выраженная как процент от увеличения индукционного периода по отношению к контролю. Таблица 7 Ингибирование окисления плазмы Профилактическое и терапевтическое действие на атерогенез у кроликов,которых кормили пищей с высоким содержанием холестерина Используемый способ в основном представляет собой тот же способ, что и описанный в Shore В.,Shore V., In: Day CE (ed) Atherosclerosis Drug Discovery, Plenum Press, New York and London, pp. 123-141,- 19008942 1976. Двадцать одного самца новозеландских белых кроликов (в возрасте 10 недель в начале протокола) содержали в стандартизированных условиях (22 С, 40-60% влажность) с регулярным дневным/ночным циклом и свободным доступом к воде. Животных случайным образом распределили в 1 из 3 групп. Группа 1 (n=5) получала рацион стандартного содержания в течение 75 дней; группа 2 (n=16) получала тот же рацион, но с добавкой 1% (вес/вес) холестерина в течение 45 дней. В конце этого периода группу 2 случайным образом распределили на две группы. Обрабатываемую группу (n=9), получающую в течение еще 30 дней 1,9 мг/кг/день соединение 12 (продолжая получать 1% холестерина в рационе), и необрабатываемую группу (n=7), получающую рацион с 1% холестерина в течение еще 30 дней. Переменными для исследования были триглицериды и полное количество холестерина. Животных умерщвляли путем внутривенного введения пентобарбитала на 75 день после начала протокола. Удаляли весь участок аорты 1 или 2 см до подвздошных артерий и фиксировали в фосфатном буфере 0,1 М (рН 7,4) с глютаральдегидом (4%). Макроскопические и микроскопические анализы образцов выполняли слепым методом. Аорты препарировали и окрашивали красителем Red Oil (красное масло). Удаляли адвентициалькый жир и вскрывали аорты в продольном направлении, погружая в раствор Red Oil на ночь,промывали в пропиленгликоле и фиксировали на плоской поверхности. Изображения аорт были получены с помощью стандартной камеры. Затем брали 3 отрезка из области дуги аорты, грудной аорты и брюшной аорты (почечные отверстия). Отрезки заливали парафином, препарировали с помощью микротома Ultracut (Испания) и окрашивали гематосилин-эозином по обычной методике. Изображения аорт,окрашенных Red Oil, и гематосилин-эозином получали с помощью стандартной камеры. Изображения импортировали в Photoshop (Adobe) с помощью слайд-сканера AGFA. Поверхность повреждения во всей аорте и толщину интимы в гистологических образцах определяли посредством процедуры, описанной ранее Lillie R.D. (Lillie R.D., 1994, Stain Technology, vol. 19, pp. 55). Поверхность или область атеросклеротического повреждения (оцененную по Red Oil-окрашенным аортам) определяли по количеству пикселей изображения, переведенному к мм 2. Толщину интимы артерии (оцененную по окрашенным гематосилин-эозином гистологическим образцам) количественно определена в мм способом, подобным способу, характеризующему поверхность или область атеросклеротического повреждения. Для этого были выбраны отрезки, которые содержали повреждения в виде жировых прожилок, и определяли толщину интимы (от медии до эндотелия артерии). Среднюю толщину области поражения оценивали в репрезентативных отрезках на квадрант аорты и рассчитывали статистическое среднее значение. Уровни полного холестерина плазмы при голодании, холестерина и триглицеридов ЛПВП показаны в табл. 8. Статистический анализ (t Стьюдента) не вскрыл существенного различия между обработанной группой и контрольной группой (необработанной группой с рационом, содержащим большое количество холестерина) в отношении липида плазмы. Таблица 8 Профиль липида плазмы [мг/дл] (среднееs.е.m.) Оценка области, покрытой атеросклеротическими поражениями показана в табл. 9. Таблица 9 Атеросклеротические поражения Толщина слоя интимы аорты показана в табл. 10.- 20008942 Таблица 10 Толщина слоя интимы аорты В табл. 8 показано, что не было различий в липидном составе плазмы между контрольной и обработанной группой, что подтверждает, что соединение (12) не повлияло на метаболизм липидов. Как видно из табл. 9 и 10, процент области атеросклеротических поражений и толщина интимы были значительно меньше в группе, обработанной соединением (12), по сравнению с контрольной группой. Профилактическое и терапевтическое действие на атерогенез у аро Е-дефицитной мыши Профилактическое и терапевтическое действие настоящих соединений на атеросклероз также проиллюстрировано с помощью следующего примера. Профилактическое и терапевтическое действие соединений на атерогенез исследуют на аро Едефицитной мыши, которую кормили в соответствии с моделью стандартного рациона. Самцы и самки аро Е-дефицитных мышей (OLA129X C57/BL6J) в возрасте трех месяцев кормили в соответствии со стандартным рационом. Контрольная группа включала 8 самцов и 7 самок мышей, при этом в обрабатываемую группу входили 8 самцов и 7 самок мышей. У всех животных в начале эксперимента был одинаковый уровень холестерина и вес тела. И контрольную и обрабатываемую группу изучали в течение 12 недель. Обрабатываемая группа получала 5 мг/кг/день соединения (12). Параметры липида плазмы (полное количество холестерина, холестерин ЛПВП и триглицериды) и окислительный стресс (измеренный, как уровни 8-изопростагландина F2) измеряли в заранее определенных интервалах. По завершении периода введения извлекали и окрашивали грудную аорту для определения области атеросклеротических повреждений, расположенных во внутренней стенке кровеносного сосуда в соответствии со способом Red Oil (Lillie R.D., 1994, Stain Technology, vol. 19, pp 55). Полные уровни холестерина в плазме, холестерина ЛПВП, триглицеридов и уровни 8 изопростагландина F2 при голодании показаны в табл. 11. Таблица 11 Параметры липидов плазмы и оксидантного стресса (среднееs.d.) Оценка области, покрытой атеросклеротическими поражениями на внутренней стенке кровеносного сосуда, и области, покрытой макрофагами, показана в табл. 12. В табл. 12 показано, что соединение (12) может понизить уровни триглицеридов в плазме, а также окислительного стресса данных животных. В табл. 12 показано, как соединение (12) уменьшает как область атеросклеротических поражений, так и область, покрытую макрофагами. Антитромбическое действие in vivo Используемый способ представлял собой в основном тот же способ, что и описанный Kurz (KurzThromb. Vase. Biol. 1999, 19: 2554-25562). Крысы получали единичную дозу 100 мг/кг соединений перорально. Через 45 мин после назначения дозы крыс подвергли анестезии с помощью пентобарбитала натрия(40 мг/кг, внутрибрюшинно), и позже их разместили дорсально на подогреваемой (37 С) хирургической доске. Извлекали левую сонную артерию и размещали под ней лист Parafilm M (720 мм, American National Can). Электромагнитное зондирование потока (Transonic Systems Inc) разместили на артерии для измерения кровотока. Через 60 мин после введения продукта для инициирования тромбоза на левой сонной артерии ниже от зондирования потока поместили отрезок бумаги, насыщенный раствором FeCl3 (70%) (и не удаляли его в течение всего эксперимента). Кровоток контролировали в течение 60 мин после наложения отрезка бумаги на артерию. Сосуд считался полностью закупоренным образованным тромбом, если кровоток не был обнаружен(0,0 мл/мин). В данной модели формирование тромба обычно происходит в течение 15-20 мин у необрабатываемых животных. Животное рассматривали как в полной мере защищенное с помощью обработки,если тромб не закупоривал сосуд в ходе периода исследования (60 мин с оставленным отрезком бумаги сFeCl3). Результаты показаны в табл. 13 и выражены как процент от животных, в полной мере защищенных с помощью обработки. Таблица 13 Антитромбическая активность in vivo Как можно видеть из табл. 13, все протестированные соединения обладают мощной антитромбической активностью in vivo. Синергичное антитромбическое действие in vivo Используемый способ представлял собой в основном тот же способ, что и описанный Kurz (KurzThromb. Vase. Biol. 1999, 19: 2554-25562). Крысы получали единичную дозу перорально одного или сочетания двух соединений как описано в табл. 14. Дозы используемых соединений не изменяли кровяное давление и частоту сердечных сокращений животных. Через 45 мин после назначения дозы крыс подвергли анестезии с помощью пентобарбитала натрия(40 мг/кг, внутрибрюшинно) и позже их разместили дорсально на подогреваемой (37 С) хирургической доске. Извлекали левую сонную артерию и размещали под ней лист Parafilm M (720 мм, American National Can). Электромагнитное зондирование потока (Transonic Systems Inc.) разместили на артерии для измерения кровотока.- 22008942 Через 60 мин после введения продукта для инициирования тромбоза на левой сонной артерии ниже от зондирования потока поместили отрезок бумаги, насыщенный раствором FeCl3 (70%) (и не удаляли его в течение всего эксперимента). Кровоток контролировали в течение 60 мин после наложения отрезка бумаги на артерию. Сосуд считался полностью закупоренным образованным тромбом, если кровоток не был обнаружен(0,0 мл/мин). В данной модели формирование закупоривающего тромба обычно происходит в течение 15-20 мин у необрабатываемых животных. Животное рассматривали как в полной мере защищенное с помощью обработки, если тромб не закупоривал сосуд в ходе периода исследования (60 мин с оставленным отрезком бумаги с FeCl3). Понятие парциального продукта использовали для идентификации синергизма при использовании соединениями. В соответствии с этим понятием, если рассматривать полную защиту животного как парциальное ингибирование,где А представляет количество животных с тромбической закупоркой в обрабатываемой группе; и В представляет количество животных с тромбической закупоркой в контрольной группе. Для двух препаратов, действующих независимым образом парциальное ингибирование =,где A1 представляет количество животных с тромбической закупоркой в группе обработки A1;A2 представляет количество животных с тромбической закупоркой в группе обработки А 2; и В представляет количество животных с тромбической закупоркой в контрольной группе. Если степень защиты, полученной с помощью сочетания препаратов, является более высокой, чем парциальное ингибирование для двух соединений, действующих независимо, тогда считается, что синергизм имеет место. Результаты показаны в табл. 14 и выражены как количество животных с тромбической закупоркой в каждой группе. Таблица 14 Поскольку процент животных, у которых защита с помощью сочетания этих двух препаратов имела место (ацетилсалициловая кислота + соединение 12) выше, чем 75% (он составляет 100%), между двумя данными продуктами имеет место синергизм. Парциальное ингибирование (клопидогрел + соединение (12 Поскольку процент животных, у которых защита с помощью сочетания этих двух препаратов имела место (клопидогрел + соединение 12) выше, чем 75% (он составляет 83%), между двумя данными продуктами имеет место синергизм.- 23008942 Защита от цитотоксичности, индуцированной радикалами кислорода с применением способа на основе ХТТ в клетках HUVEC in vitro Используемый способ представлял собой в основном тот же способ, что и описанный Caveda L., etal. (J. Clin. Invest. 1996; 98: 886-893). Для определения способности к ингибированию цитотоксичности, индуцированной радикалами кислорода использовали эндотелиальные клетки пупочной вены человека (HUVEC). HUVEC выделяли и культивировали в М 199 и 20% FCS (телячья эмбриональная сыворотка). Тестовая проба ХТТ основана на гидролизе метаболически активными клетками соли теразоло ХТТ с образованием продукта оранжевого цвета, образующийся краситель формазан растворим и пригоден для количественного анализа непосредственно с применением спектрофотометра. Клетки HUVEC выращивали до начала состояния слияния в 96-луночных плашках для культуры тканей и предварительно обрабатывали 50 мкМ соединения в течение одного часа. После этого клетки обрабатывали 800 мкМ пероксинитрита в течение ночи. После ночной культивации клетки культивировали с раствором желтого ХТТ (конечная концентрация 0,3 мг/мл) в течение 4 ч. По истечении данного периода культивации образовывался оранжевый раствор формазана, который спектрофотометрически подвергли количественному анализу с применением спектрофотометра для анализа плашек ELISA при 450 нм. Результаты показаны в табл. 15 и выражены как процент умерших клеток. Таблица 15 Цитопротекторная активность in vitro Как можно видеть в табл. 15, все протестированные соединения обладают цитопротекторной активностью (Р 0,05) по отношению к повреждениям клеток, индуцированным радикалами кислорода. Защита от повреждения сердца вследствие реперфузии после ишемии in vivo Эксперименты проводили в соответствии с моделью, описанной ранее Hirata Y. et al. (Journal of Cardiovascular Pharmacology. 1998, 31: 322-326). После голодания в течение 6 ч, животных разделили на группы, включающие по меньшей мере 8 животных каждая. Дозы продуктов назначали путем орального зондирования за 1 ч до индукции ишемии. Животных подвергали анестезии с помощью пентобарбитала (40 мг/кг, внутрибрюшинно) и регистрировали стандартную электрокардиограмму конечности lead III для обнаружения ослабления волны S. для индукции вазоконстрикцию малых коронарных артерий и увеличения коронарной резистентности в сонную артерию вводили 0,3 ед/кг аргинин-вазопрессина (AVP) (Sigma Chemicals, St Louis, Mo, USA). Во всех группах получили AVP через 60 мин после тестируемого препарата. Во всех группах через 10 мин после инъекции AVP проводили регистрацию ЭКГ. Результаты показаны в табл. 16 и выражены в виде спада волны S (мкВ). Таблица 16 Как можно видеть из табл. 16, все протестированные соединения защищают от повреждения сердца вследствие реперфузии после ишемии.n представляет собой целое число 0, 1 или 2,X представляет -S(O)m-, -(С=O)- или простую связь, в котором m представляет собой целое число 0,1 или 2; с учетом того, что если X представляет -(С=О)-, то n равняется 0,R представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из С 1-6 алкила; С 2-6 алкенила; С 3-8 циклоалкила; С 3-8 циклоалкила, в котором одна группа СН 2 замещена О, S, NH или NCH3; С 4-8 циклоалкенила; С 4-8 циклоалкенила, в котором одна группа СН 2 замещена О, S,NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и в которой R выбирают из группы, состоящей из водорода, C1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила,С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из числа С 1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила, С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,при условии, что если RXS(O)n- и -ONO2- находятся в транс-положении по отношении друг к другу относительно плоскости кольца, как изображено в формулах (Iа) и (Ib) в которой Z представляет собой группу С 1-С 4 алкил, арил или аралкил. 2. Соединение по п.1, в котором или один или оба из m и n равны 0. 3. Соединение по любому из пп.1-2, в котором X представляет простую связь или -S-. 4. Соединение по любому из пп.1-3, в котором R представляет водород, C1-6 алкил, С 2-6 алкенил,С 3-8 циклоалкил, С 4-8 циклоалкенил, (C1-6 алкил)С 3-8 циклоалкил, (С 1-6 алкил)С 4-8 циклоалкенил, фенил,(C1-6 алкил)фенил, 5-ацетилоксиизосорбид-2-ил, 5-гидроксиизосорбид-2-ил или 5-нитратизосорбид-2-ил. 5. Соединение по любому из пп.1-4, в котором R представляет собой C1-6 алкил. 6. Соединение по любому из пп.1-5, которое представляет собой соединение формулы (Iс) или (Id) 7. Соединение по любому из пп.1-6, которое выбирают из 2-тиоизосорбид 5-мононитрата, 5,5'динитрат-2,2'-дитиодиизосорбида, 2-метилтиоизосорбид 5-мононитрата, 2-[(R)-метилсульфинил] изосорбид 5-мононитрата, 2-[(S)-метилсульфинил]изосорбид 5-мононитрата, 2-метилсульфинилизосорбид 5-мононитрата, 2-метилсульфонилизосорбид 5-мононитрата, S-нитрозо-2-тиоизосорбид 5 мононитрата, 2-(тетрагидропиран-2-илтио)изосорбид 5-мононитрата, 2-(изосорбидил-2'-дитио)изосорбид 5-мононитрата и 2-(5'-ацетилоксиизосорбидил-2'-дитио)изосорбид 5-мононитрата. 8. Фармацевтическая композиция, содержащая в качестве активного(ых) ингредиента(ов) по меньшей мере одно соединение по любому из пп.1-7, необязательно, в сочетании с одним или более физиологически допустимым наполнителем (наполнителями), активатором (активаторами), хелатирующим агентом (хелатирующими агентами) и/или стабилизатором (стабилизаторами). 9. Фармацевтическая композиция по п.8, которая дополнительно содержит тромболитический агент, предпочтительно активатор плазмогена, урокиназу, стрептокиназу, алтеплазу или анистреплазу. 10. Фармацевтическая композиция по п.8 или 9, которая дополнительно содержит противосвертывающий агент, предпочтительно гепарин, дикумарол, аценокумарол, эноксапарин или полисульфат пентозана. 11. Фармацевтическая композиция по любому из пп.8-10, которая дополнительно содержит антитромбический агент, предпочтительно ацетилсалициловую кислоту, дипиридамол, тиклопидин, клопидрогель, трифлусал, полисульфат пентозана или абциксимаб. 12. Фармацевтическая композиция по любому из пп.8-11, которая дополнительно содержит иммуноглобулин или его фрагмент, обладающий специфичностью к гликопротеину IIb/IIIa. 13. Фармацевтическая композиция по любому из пп.8-12, которая дополнительно содержит агент,понижающий уровень липидов в крови, предпочтительно симвастатин, ловастатин, аторвастатин, правастатин, флувастатин, эптастатин, лифиброл, ацифран, ацитемат, глуникат или росувастатин. 14. Фармацевтическая композиция по любому из пп.8-13, которая содержит агент антиоксиданта/акцепторов свободных радикалов, предпочтительно выбранный из числа никаравена, ранолазина,эмоксипина, глутатиона, эдаравона, раксофеласта, ликопена, N-ацетил-L-цистеина, N-ацетил-Dцистеина, рацемированной смеси N-ацетил-L-цистеина и N-ацетил-D-цистеина, или карведилола. 15. Фармацевтическая композиция по любому из пп.8-14 для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, дисфункции кровеносной системы, активации тромбоцита, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, патологических состояний, в патогенезе которых важную роль играет дефицит оксида азота, и/или повреждение ткани вследствие ишемии и/или вследствие реперфузии после ишемии. 16. Фармацевтическая композиция по п.15, в которой патологические состояния, в патогенезе которых важную роль играет окислительный стресс, выбирают из числа аллергий, инсульта, болезни Альцгеймера и ишемических сердечно-сосудистых заболеваний. 17. Фармацевтическая композиция по любому из пп.8-14 для лечения и/или профилактики дисфункций кровеносной системы, предпочтительно сердечно-сосудистых и/или коронарных дисфункций. 18. Применение по меньшей мере одного соединения формулы (I) или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата в которой n представляет собой целое число 0, 1 или 2,X представляет -S(O)m-, -(C=O)- или простую связь, в которой m представляет собой целое число 0,1 или 2, при условии что X представляет собой -(С=O)- и n имеет значение 0; иR представляет водород или представляет собой остаток Ra, который выбирают из группы, состоящей из С 1-6 алкила; С 2-6 алкенила; С 3-8 циклоалкила; С 3-8 циклоалкила, в котором одна группа СН 2 замещена О, S, NH или NCH3; С 4-8 циклоалкенила; С 4-8 циклоалкенила, в котором одна группа СН 2 замещена О, S,NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и в которой R выбирают из группы, состоящей из водорода, С 1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила,С 4-8 циклоалкенила, ацетилокси, гидроксила, ОNO2 и галогена,в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из группы, состоящей из С 1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила, С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,в качестве активного ингредиента(ов) для получения фармацевтической композиции для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, активации тромбоцитов, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, патологических состояний, в патогенезе которых важную роль играет дефицит оксида азота, и/или повреждения ткани вследствие ишемии и/или вследствие реперфузии после ишемии. 19. Применение по меньшей мере одного соединения формулы (I) или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата в качестве активного ингредиента (ингредиентов) для профилактики и/или лечения атеросклероза, эндотелиальных дисфункций, сосудистого спазма, васкулопатии сердечного аллотрансплантата, активации тромбоцитов, тромбоза, инсульта, патологических состояний, в патогенезе которых важную роль играет окислительный стресс, патологических состояний, в патогенезе которых важную роль играет дефицит оксида азота,и/или повреждения ткани вследствие ишемии и/или вследствие реперфузии после ишемии,содержащее введение указанного соединения или его таутомера, фармацевтически приемлемой соли, пролекарства или сольвата пациенту, которому это требуется,в которой n представляет собой целое число 0, 1 или 2,X представляет -S(O)m-, -(C=O)- или простую связь, в котором m представляет собой целое число 0,1 или 2; с учетом того, что если X представляет -(С=O)-, то n равняется 0,R представляет собой водород или представляет собой остаток Ra, который выбирают из группы,состоящей из C1-6 алкила; С 2-6 алкенила; С 3-8 циклоалкила; С 3-8 циклоалкила, в котором одна группа СН 2 замещена О, S, NH или NCH3; С 4-8 циклоалкенила; С 4-8 циклоалкенила, в котором одна группа СН 2 замещена О, S, NH или NCH3; фенила; пиридила; тиофенила; нитрозила; S-цистеинила; S-глютатионила и в которой R выбирают из группы, состоящей из водорода, C1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила,С 4-8 циклоалкенила, ацетилокси, гидроксила, ONO2 и галогена,в которой Ra необязательно замещен одной-тремя группами, независимо выбранными из числаC1-6 алкила, С 2-6 алкенила, С 3-8 циклоалкила, С 4-8 циклоалкенила, ацетилокси, гидроксила, ОNО 2 и галогена. 20. Применение по п.18 или 19, в котором или одна, или обе переменные m и n равняются 0. 21. Применение по любому из пп.18-20, в котором X представляет простую связь или -S-. 22. Применение по любому из пп.18-21, в котором R представляет водород, С 1-6 алкил, С 2-6 алкенил,С 3-8 циклоалкил, С 4-8 циклоалкенил, (С 1-6 алкил)С 3-8 циклоалкил, (C1-6 алкил)С 4-8 циклоалкенил, фенил или(C1-6 алкил)фенил. 23. Применение по любому из пп.18-22, в котором R представляет собой C1-6 алкил.
МПК / Метки
МПК: C07D 493/04, A61K 31/34
Метки: сахаров, циклических, сульфоновые, дисульфидные, сульфидные, производные, сульфоксидные, применение
Код ссылки
<a href="https://eas.patents.su/30-8942-disulfidnye-sulfidnye-sulfoksidnye-i-sulfonovye-proizvodnye-ciklicheskih-saharov-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Дисульфидные, сульфидные, сульфоксидные, и сульфоновые производные циклических сахаров и их применение</a>
Предыдущий патент: Способ получения тиоуксусной кислоты и её солей
Следующий патент: Фунгицидные смеси для борьбы с фитопатогенными грибами, в частности с патогенами риса
Случайный патент: Гликозидирование индолкарбазола с применением межфазного катализа












