Антитело или антигенсвязывающий домен, специфически связывающиеся с полипептидом потенциалзависимого воротного ионного канала
Номер патента: 8252
Опубликовано: 27.04.2007
Авторы: Чумаков Илья, Коэн Даниель, Симон Анн-Мари, Абдеррахим Хади
Формула / Реферат
1. Антитело или антигенсвязывающий домен, специфически связывающийся с полипептидом с последовательностью SEQ ID NO: 5.
2. Антитело или антигенсвязывающий домен по п.1, который является химерным, гуманизированным антителом, или антигенсвязывающим доменом, или моноклональным или поликлональным антителом, или антигенсвязывающим доменом человека.
3. Антитело или антигенсвязывающий домен по п.1 или 2, которое является антителом или антигенсвязывающим доменом с одной цепью.
4. Антитело или антигенсвязывающий домен по любому из пп.1-3, который является моноспецифичным, биспецифичным, триспецифичным или мультиспецифичным антителом или антигенсвязывающим доменом.
5. Применение антитела или антигенсвязывающего домена по любому из пп.1-3 для диагностики шизофрении или биполярного расстройства.
6. Набор антисмысловых последовательностей, ингибирующих экспрессию полипептида ионного канала, кодируемого полинуклеотидом, показанным в виде SEQ ID NO: 1, 2, 3 или 4, содержащий фрагмент полинуклеотида с последовательностью SEQ ID NO: 1, 2, 3 или 4, для получения лекарственного средства для лечения шизофрении или биполярного расстройства.
7. Набор антисмысловых последовательностей по п.6, которые являются рибозимами.
8. Применение антитела или антигенсвязывающего фрагмента по пп.1-4 для получения лекарственного средства для лечения шизофрении или биполярного расстройства.
9. Применение набора антисмысловых последовательностей по п.6 или 7 для получения лекарственного средства для лечения шизофрении или биполярного расстройства.
10. Фармацевтическая композиция, содержащая антитело или антигенсвязывающий фрагмент по пп.1-4.
11. Фармацевтическая композиция, содержащая набор антисмысловых последовательностей по п.6 или 7.
12. Применение по крайней мере одного двухаллельного маркера (ДМ), связанного с ионным каналом, выбранного из группы двуаллельных маркеров, показанных ниже, для определения подвержен ли индивидуум риску или страдает ли больной шизофренией или биполярным расстройством.
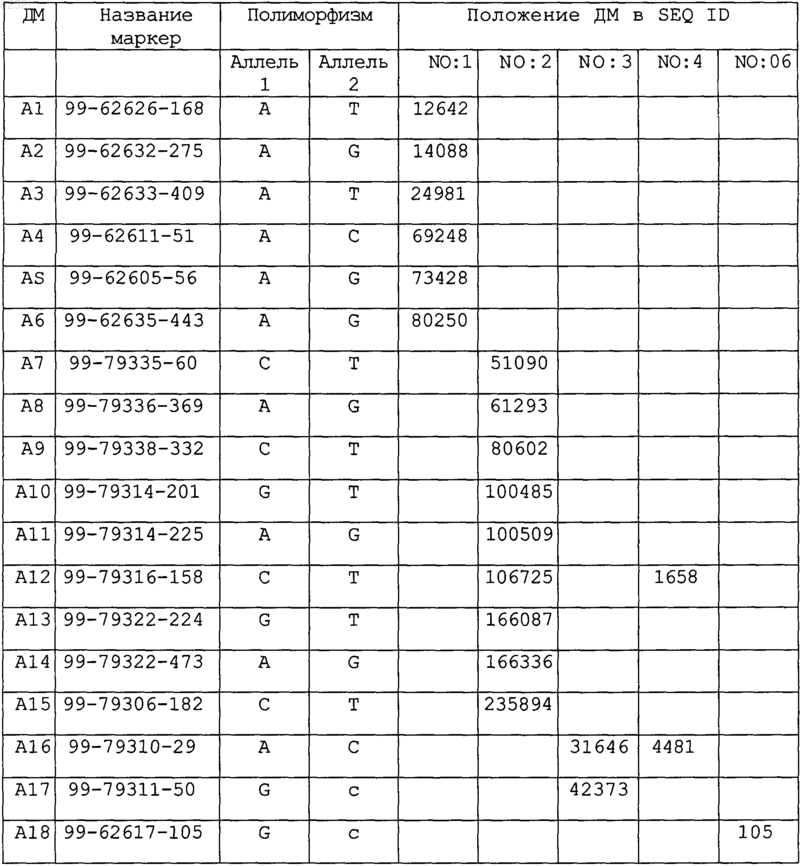
13. Способ генотипирования, включающий стадии:
a) выделения нуклеиновой кислоты из биологического образца;
b) обнаружения наличия нуклеотида в одном или нескольких зависимых двухаллельных маркерах, связанных с ионным каналом, А1-А18, перечисленных в п.12.
14. Способ по п.13, где способ осуществляют с использованием анализа микросеквенирования.
15. Диагностический набор для диагностики шизофрении или биполярного расстройства, содержащий полинуклеотид, который является фрагментом полинуклеотида с последовательностью SEQ ID NO: 1, 2, 3 или 4, содержащего один или несколько биаллельных маркеров А1-А18, как описано в п.12.
16. Диагностический набор для диагностики шизофрении или биполярного расстройства, содержащий:
a) поликлональное или моноклональное антитело, которое специфически связывается с полипептидом ионного канала, содержащим аминокислотную последовательность SEQ ID No 5, или с фрагментом пептида или его вариантом, необязательно меченным;
b) реагент, с помощью которого осуществляется определение образовавшегося комплекса антиген-антитела, указанный реагент либо необязательно содержит метку, либо который может быть распознан меченным реагентом.
Текст
008252 Область техники, к которой относится изобретение Настоящее изобретение относится к антителу или антигенсвязывающему домену, специфически связывающимся с полипептидом потенциалзависимого воротного ионного канала, к их применению для диагностики шизофрении или биполярного расстройства, к набору антисмысловых последовательностей,ингибирующих экспрессию ионного канала, к соединению, которое активирует или ингибирует экспрессию или активность ионного канала указанного полипептида, к фармацевтической композиции, содержащей антитело или антигенсвязывающий фрагмент, набор антисмысловых последовательностей или такое соединение и к диагностическому набору для диагностики шизофрении или биполярного расстройства. Уровень техники Достижения в техническом оснащении лабораторий, занятых фундаментальными и клиническими исследованиями, в огромной мере способствовали более глубокому изучению влияния головного мозга и нервной системы на здоровье и болезни. Выдвинут ряд нейробиологических и фармакологических гипотез в отношении нейрохимических и генетических механизмов, имеющих место при нарушениях центральной нервной системы (ЦНС), включающих психические нарушения и нейродегенеративные заболевания. Однако нарушения ЦНС характеризуются сложным и недостаточным пониманием этиологии, а также симптомы,которые перекрываются, плохо описаны, и трудны для измерения. В итоге, будущие схемы лечения и усилия по созданию лекарств нуждаются в усовершенствовании и сосредоточении внимания на мультигенных причинах, а это требует проведения новых демографических исследований заболеваний и получения более точной диагностической и прогностической информации о пациентах, страдающих нарушениями ЦНС. Нарушения ЦНС охватывают широкий ряд расстройств и соответствующую широкую группу генетических факторов. Примеры расстройств ЦНС включают нейродегенеративные нарушения, психотические расстройства, расстройства в эмоциональном состоянии, аутизм, зависимость от химических веществ и алкоголизм, нарушения болевых ощущений, эпилепсию, задержку психического развития и другие психические заболевания, включая когнитивную функцию, страх, нарушение функции приема пищи,нарушение функции мотивации и аномалии характера. Нарушения можно определить, используя классификацию Diagnosis and Statistical Manual of Mental Disorders fourth edition (Диагностический и Статистический Справочник Психических Нарушений) (DSM-IV). Даже при рассмотрении всего лишь небольшой подгруппы нарушений ЦНС очевидно, что из-за недостатка адекватного лечения и для понимания молекулярной основы нарушений при шизофрении и биполярном расстройстве, нужны новые цели для создания лекарств и усовершенствования способов лечения. Что касается шизофрении и биполярного расстройства, все ныне известные молекулы, используемые для их лечения, обладают побочными эффектами и действуют только против симптомов данного заболевания. Существует, таким образом, очень большая потребность в новых молекулах, не вызывающих побочных эффектов и направленных против мишеней, которые вовлечены в причинные механизмы шизофрении и биполярного расстройства. Поэтому, инструментальные средства, облегчающие открытие и характеристику данных целей, необходимы и полезны. Потенциалзависимые воротные ионные каналы Потенциалзависимые воротные ионные каналы являются частью большого семейства макромолекул, функции которых включают контроль и поддержание электрического потенциала клеточных мембран, выделение и трансдукцию сигнала. Эти белки-каналы участвуют в контроле высвобождения нейромедиаторов из нейронов и играют существенную роль в регуляции разнообразных клеточных функций, включая мембранную возбудимость, мышечное сокращение и синаптическую передачу. Основные альфа-субъединицы Nа+-каналов и альфа-1-субъединицы Са+-каналов состоят, приблизительно, из 2000 аминокислот и составляют путь протекания ионов. Биохимический анализ показал, что физиологически активный ионный канал составлен из нескольких разных субъединиц. Существует две вспомогательные субъединицы, бета-1- и бета-2-субъединица, которые очищаются совместно с альфа-субъединицей Nа+каналов. Что касается Са+-каналов, для них идентифицированы дополнительные субъединицы (альфа-2,бета, гамма и сигма) с модуляторным действием. Субъединицы альфа-2 и бета, похоже, усиливают функциональную активность альфа-1-субъединицы Са+-каналов. Альфа-субъединицы К+-каналов ассоциируются с бета-субъединицами в соотношении 1:1, что приводит к усложнению К+-каналов, проявляющих (альфа)4(бета)4 стехиометрию (Terlau и соавт., Naturwissenschaften 85:437-444 (1998. Базовая структура и примеры кальциевых и натриевых ионных каналов рассматриваются, кроме того, например,у Williams, и соавт., Science 257:389-395 (1992); Mori, и соавт., Nature 350:398-402 (1991); и Koch, и соавт., J. Biol. Chem. 265 (29):17786-17791 (1990). Нуклеотидная последовательность Са+- и Nа+-ионного канала крысы обладает высоким уровнем гомологии с последовательностью CanIon-канала, впоследствии описанного у Lee и соавт., FEBS Lett. 445:231-236 (1999) . Альфа-субъединица обладает последовательностью, характерной для всех потенциалзависимых катионных каналов, и использует один и тот же структурный мотив, включающий пучок из 6 спиралей в доменах, предположительно пронизывающих мембрану. И в натриевых, и в кальциевых каналах данный мотив повторяется в указанной последовательности 4 раза, образуя пучок из 24 спиралей. Данные аминокислотные последовательности высококонсервативны у видов (например, человека и Drosophila), a также у разных ионных каналов.-1 008252 Существует несколько тканеспецифичных фармакологически и электрофизиологически различимых изоформ кальциевых каналов, кодируемых отдельными генами мультигенного семейства. В скелетной мышце каждая группа из плотно связанных альфа-, бета- и гамма-субъединиц ассоциирована с 4 другими с образованием пятичленной макромолекулы. Например, альфа-1-субъединицы кальциевого канала нейрона являются продуктом, по меньшей мере, семи разных генов, именуемых от А до Н. В иммуноцитохимических исследованиях показано разное распределение альфа-1-субъединиц кальциевого канала. Альфа-1 А и альфа-1B экспрессируются главным образом в дендритах и пресинаптических окончаниях, и альфа-1 А обычно концентрируется в большем числе нервных окончаний, в альфа-1B. В нервномышечном соединении крысы и человека альфа-1 А локализуется пресинаптически, тогда как альфа-1B,так и альфа-1 А представлены в ассоциированных с аксоном швановских клетках. Альфа-1E локализуется главным образом в клеточных телах, в некоторых случаях - в проксимальных дендритах, а также в дистальных ответвлениях клеток Пуркинье. Альфа-1 С и альфа-1D локализуются в клеточных телах и в проксимальных дендритах центральных нейронов. Нативные кальциевые каналы классифицируются на основе их фармакологических и/или электрофизиологических свойств. Классификация потенциалзависимых кальциевых каналов разделяет их на каналы, активируемые высоким потенциалом (HVA), включающие типы L, N, Р и О; промежуточным (IVA,R-тип); и активируемые низким потенциалом (LVA, Т-тип). (Моrеnа и соавт., Annals NY Acad. Sci. 102-117 (1999. Основные субъединицы (альфа-1) относятся к генному семейству, члены которого могут сами образовывать функциональные каналы при экспрессии в гетерологичных экспрессионных системах. (Zhang и соавт., Neuropharmacology 32 (11):1075-1088 (1993), включенный в данное описание путем ссылки). В нативных клетках альфа-1-субъединицы экспрессируются в виде мультисубъединичных комплексов вместе с вспомогательными субъединицами, которые модифицируют функциональные характеристики альфа-1-субъединицы. Во многих случаях коэкспрессия вспомогательных субъединиц влияет на биофизические свойства данных каналов. Бета-субъединицы, в частности, имеют тенденцию к существенному влиянию на альфа-1-субъединицы; было показано, что бета-субъединицы изменяют активационные свойства, стационарную инактивацию, кинетику инактивации и максимальное протекание тока. Большое молекулярное разнообразие каналов получают благодаря существованию множественных форм альфа-1-субъединиц. Например, было показано, что по-разному сплайсированные формы кальциевых каналов и экспрессируются по-разному и обладают разной чувствительностью к фосфорилированию серин-треониновыми киназами. (Hell и соавт., Annals NY Acad. Sci. 747:282-293 (1994. Установлено,что мутации генов ионных каналов вовлечены в целый ряд заболеваний, включая некоторые заболевания центральной нервной системы. Примеры мутаций ионных каналов, вызывающих ряд эпизодических нарушений, включая периодический паралич, эпизодическую атаксию, гемикранию, синдром удлинения от интервала QT, пароксизмальную дискинезию, рассматриваются в обзоре Bulman и соавт., Hum. Mol. Gen. 6(10):1679-1685 (1997). Некоторые нарушения, связанные с мутацией Са+-канала, представлены, например, в табл. А (из Moreno, выше). Таблица А Модуляторы кальциевых и натриевых каналов обычно используются для лечения различных заболеваний и состояний. Например, было показано, что блокаторы кальциевого и/или натриевого канала могут использоваться для лечения или профилактики одного или нескольких симптомов, связанных с различными заболеваниями или состояниями, такими как различные заболевания и состояния сердца(например, стенокардия, аритмия), гипертензия, мигрени, неврологические эффекты нарушений мозгово-2 008252 го кровообращения, мания, нейролептически индуцированная поздняя дискинезия стенок миокарда, биполярное расстройство, боль, эпилепсия и другие. Было показано, что между разными ионными каналами нервной системы имеются существенные функциональные различия. Кроме того, существенные различия имеются между разными мутациями в одном и том же гене ионного канала, а также между вариантами сплайсинга одного и того же ионного канала. Таким образом, несмотря на причастность ионных каналов к заболеваниям ЦНС, то, что касается конкретного заболевания, трудно определить какой ионный канал может представлять собой эффективную мишень для терапевтического вмешательства. Первоочередная задача состоит в том, чтобы предоставить ген ионного канала, причастный к шизофрении, биполярному расстройству или заболеваниям, связанными с ними. Настоящее изобретение направлено на решение этих и других задач. Краткое изложение существа изобретения Настоящее изобретение относится к антителу или антигенсвязывающему домену, специфически связывающемуся с полипептидом с последовательностью SEQ ID No 5. Антитело или антигенсвязывающий домен может быть химерным, гуманизированным антителом или антигенсвязывающим доменом,или моноклональным или поликлональным антителом или антигенсвязывающим доменом человека. В одном из вариантов осуществления антитело или антигенсвязывающий домен имеет одну цепь. В другом варианте осущетвления антитело или антигенсвязывающий домен является моноспецифичным, биспецифичным, триспецифичным или мультиспецифичным антителом или антигенсвязывающим доменом. Настоящее изобретение также относится к применению антитела или антигенсвязывающего домена для диагностики шизофрении или биполярного расстройства. Настоящее изобретение, кроме того, относится к набору антисмысловых последовательностей, ингибирующих экспрессию ионного канала, кодируемого полинуклеотидом с SEQ ID No 1, 2, 3 или 4, содержащим фрагмент поликулеотида с последовательностью SEQ ID No 1, 2, 3 или 4, для получения лекарственного средства для лечения шизофрении или биполярного расстройства. В одном из вариантов осуществления такой набор антисмысловых последовательностей представляет собой набор рибозимов. Настоящее изобретение относится к применению соединения, которое активирует или ингибирует экспрессию или активность ионного канала полипептида, содержащего полипептид с последовательностьюSEQ ID No 5 для получения лекарственного средства для лечения шизофрении или биполярного расстройства. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей вышеуказанное антитело или антигенсвязывающий фрагмент, вышеуказанный набор антисмысловых последовательностей или вышеупомянутое соединение, которое активирует или ингибирует экспрессию или активность ионного канала полипептида, содержащего полипептид с последовательностью SEQ IDNo 5, и подходящий носитель или эксципиент. Настоящее изобретение также относится к применению по крайней мере одного двуаллельного маркера (ДМ), связанного с ионным каналом, выбранного из группы двуаллельных маркеров, показанных в табл. 1' ниже, для определения подвержен ли индивидуум риску или страдает ли больной шизофренией или биполярным расстройством. Таблица 1'-3 008252 Настоящее изобретение относится к способу генотипирования, включающему стадии:a) выделения нуклеиновой кислоты из биологического образца;b) обнаружения наличия нуклеотида в одном или нескольких зависимых двуаллельных маркерах,связанных с ионным каналом, А 1-А 18, перечисленных в п.13. В одном из вариантов осуществления такой способ генотипирования осуществляют с использованием анализа микросеквенирования. Настоящее изобретение относится к диагностическому набору для диагностики шизофрении или биполярного расстройства, содержащему полинуклеотид, который является фрагментом полинуклеотида с последовательностью SEQ ID NO: 1, 2, 3 или 4, содержащего один или несколько биаллельных маркеров А 1-А 18. В одном из конкретных вариантов осуществления настоящего изобретения диагностический набор для диагностики шизофрении или биполярного расстройства, содержитa) поликлональное или моноклональное антитело, которое специфически связывается с полипептидом ионного канала, содержащим аминокислотную последовательность SEQ ID No 5, или с фрагментом пептида или его вариантом, необязательно меченным;b) реагент, с помощью которого осуществляется определение образовавшегося комплекса антигенантитела, указанный реагент либо необязательно содержит метку, либо который может быть распознан меченным реагентом. Краткое описание чертежей На фиг. 1 изображена диаграмма, представляющая ВАС-карту области хромосомы 13q, содержащейCanIon-ген. На фиг. 2 изображен блок диаграмм типовой компьютерной системы. На фиг. 3 изображена структурная схема, иллюстрирующая один из вариантов осуществления процесса 200 по сравнению новой нуклеотидной или белковой последовательности с базой данных последовательностей с целью установления уровней гомологии между новой последовательностью и соответствующей последовательностью базы данных. На фиг. 4 изображена схема последовательности операций, иллюстрирующая один из вариантов осуществления процесса 250 в компьютере, чтобы определить действительно ли две последовательности гомологичны. На фиг. 5 изображена схема последовательности операций, иллюстрирующая один из вариантов процесса-идентификатора 300 для выявления в последовательности наличия характерной особенности. Краткое описание последовательностей, представленных в списке последовательностейSEQ ID No 1 содержит геномную последовательность CanIon, включающую 5'-регуляторную область ("левая" нетранскрибируемая область) и экзоны 1-7.SEQ ID No 2 содержит геномную последовательность CanIon, включающую экзоны 8-27.SEQ ID No 3 содержит геномную последовательность CanIon, включающую экзоны 28-44, а также 3'-регуляторную область ("правая" нетранскрибируемая область).SEQ ID No 6 содержит нуклеотидную последовательность ампликона, который включает двуаллельный маркер А 18.SEQ ID No 8 содержит праймер, содержащий дополнительную 5'-последовательность RP, ниже описанную в примере 2. В соответствии с правилами, относящимися к Спискам Последовательностей, в данном Списке Последовательностей используются коды, которые указывают расположение двуаллельных маркеров в данных последовательностях и которые идентифицируют каждый из аллелей, представленный по полиморфному основанию. Код "r" для данной последовательности свидетельствует о том, что один аллель по данному полиморфному основанию представляет собой гуанин, а другой аллель представляет собой аденин. Код "у" для данных последовательностей свидетельствует о том, что один аллель по данному полиморфному основанию представляет собой тимин, тогда как другой аллель представляет собой цитозин. Код "m" для данных последовательностей свидетельствует о том, что один аллель по данному полиморфному основанию представляет собой аденин, а другой аллель представляет собой цитозин. Код "k" для данных последовательностей свидетельствует о том, что один аллель по данному полиморфному основанию представляет собой гуанин, а другой аллель представляет собой тимин. Код "s" для данных последовательностей свидетельствует о том, что один аллель по данному полиморфному основанию представляет собой гуанин, а другой аллель представляет собой цитозин. Код "w" для данных последовательностей свидетельствует о том, что один аллель по данному полиморфному основанию представляет собой аденин, а другой аллель представляет собой тимин. Нуклеотидный код исходного аллеля для каждого двуаллельного маркера следующий: Двуаллельный маркер Исходный аллель 5-124-273 А (например)-4 008252 В некоторых случаях полиморфные основания двуаллельных маркеров изменяют идентичность аминокислот в кодируемом полипептиде. Это указано в прилагаемом Списке Последовательностей с использованием элемента VARIANT, размещения Хаа в положении данной полиморфной аминокислоты и определения Хаа в виде двух альтернативных аминокислот. Например, если один аллель двуаллельного маркера представляет собой кодон САС, который кодирует гистидин, а другой аллель двуаллельного маркера представляет собой САА, который кодирует глутамин, то Список Последовательностей для кодируемого полипептида будет содержать Хаа в положении полиморфной аминокислоты. В данном случае Хаа должен определяться в виде гистидина или глутамина. В других случаях Хаа может обозначать аминокислоту, идентичность которой неизвестна, вследствие неопределенности нуклеотидной последовательности. В данном случае использование элемента UNSURE размещает Хаа в положение неизвестной аминокислоты и значение Хаа считается любым из 20 аминокислот или ограниченным числом аминокислот, подсказанных генетическим кодом. Подробное описание изобретения Ассоциация шизофрении и биполярного расстройства в семьях, доказанная при изучении близнецов и усыновления, хотя изменчивость по всему миру отсутствует, свидетельствует о том, что шизофрения и биполярное расстройство в первую очередь представляют собой генетические состояния, хотя факторы риска окружающей среды также до некоторой степени рассматриваются в качестве необходимых, достаточных или воздействующих друг на друга причин. Например, шизофрения встречается у 1% от общей численности населения. Но при наличии шизофрении у одного из дедушек или бабушек риск возникновения данной болезни возрастает до примерно 3%; если же шизофренией страдает один из родителей,этот риск возрастает до примерно 10%. Если оба родителя больны шизофренией, тогда риск возрастает приблизительно до 40%. Идентификация генов, связанных с характерным признаком, таким как специфическое нарушение центральной нервной системы, подобное шизофрении, может быть осуществлена с помощью двух основных подходов, используемых в настоящее время для генетического картирования: анализа сцепления и ассоциативные исследования (исследование сообществ). Анализ сцепления требует изучения семей, в которых заболеванием поражены многие их члены, и в настоящее время пригоден для выявления моно- и олигогенных наследственных признаков. И наоборот, в ассоциативных исследованиях анализируют частоту маркерных аллелей признака (Т+) у несвязанных родством индивидов, сравниваемых с негативным по данному признаку контролем (Т-) и обычно используемых для выявления полигенного наследования. Генетическая связь или сцепление базируется на анализе, в котором две соседствующие последовательности на хромосоме содержат, по меньшей мере, рекомбинации в результате кроссинговера во время мейоза. Чтобы осуществить это хромосомные маркеры, подобные микросателлитным маркерам, тщательно локализуют в данном геноме. В анализе генетического сцепления рассчитывают вероятность рекомбинаций в данном гене-мишени с использованием хромосомных маркеров, в соответствии с генеалогическим древом, передачей данного заболевания и передачей данных маркеров. Таким образом, если отдельный аллель данного маркера передается вместе с заболеванием более часто, а не случайно (уровень рекомбинации находится между 0 и 0,5), то можно сделать вывод о том, что ген-мишень, о котором идет речь, обнаруживается поблизости от данного маркера. При использовании этого метода можно локализовать несколько генов, демонстрирующих генетическую предрасположенность семейных злокачественных опухолей. Для того чтобы иметь возможность включиться в изучение генетического сцепления, семьи, пораженные наследственной формой данного заболевания, должны удовлетворять критерию"информативности": несколько человек (конституциональная ДНК которых доступна) на поколение,должны быть поражены данным заболеванием, и в лучшем случае, обладать большим числом сибсов. Результаты исследований по сцеплению подтверждают гипотезу о том, что хромосома 13, повидимому, содержит локус предрасположенности к шизофрении на 13q32 (Blouin J.L. и соавт., 1998, Nature Genetics, 20:70-73; Lin M.W. и соавт., Hum. Genet., 99(3) (1997):417-420; Brzustowicz и соавт., Am. J.Hum. Genet. 65:1096-1103 (1999. Однако, несмотря на то, что анализ сцепления представляет собой мощный метод выявления генов и связанного с ними признака, решение часто невозможно без уровня данной мегабазы данных, а соответствующие исследования часто нуждаются в уточнении анализа участков, первоначально идентифицированных с помощью данного способа. ВАС-контиг, покрывающий предполагаемую геномную область локуса хромосомы 13q-31-q33,конструированы с использованием общедоступных STS, расположенных в данной области хромосомного локуса 13q31-q33, для скринирования запатентованной отдельной ВАС-библиотеки, эквивалентной 7 геномам. По данным материалам получали новые STS, позволяющие конструировать компактную физическую карту данной области. Определяли размер всех ВАС и картировали с помощью хромосомной гибридизации in situ для верификации. Идентифицировали минимальную группу ВАС и полностью секвенировали по нескольким контигам, что приводило к получению конечного контига, превышающего 4 млн.п.н. Создание данной карты позволяет идентифицировать CanIon-ген, который локализуется в геномной области, демонстрирующей существенное сцепление с шизофренией. Аминокислотная последовательность CanIon характерна для CACHANNEL, 7-элементного фингерпринта, который характеризует альфа-1-субъединицы кальциевых каналов (Ref. PR00167, BLOCK+база-5 008252 данных). Данный фингерпринт получали, исходя из первичного выравнивания 6 последовательностей: мотивы извлекали из консервативных областей петли, поддающихся различению между этими и другими катионными каналами; мотивы 1 и 2 кодируют последовательности между трансмембранными сегментами 4 и 5, а также 5 и 6 (первый внутренний повтор); мотив 3 соответствует последовательности между сегментом 6 повтора 1 и сегментом 1 повтора 2; мотив 4 кодирует последовательность между сегментами 5 и 6 повтора 2; мотив 5 соответствует последовательности между сегментом 6 повтора 3 и сегментом 1 повтора 4; а мотивы 6 и 7 кодируют последовательности между сегментами 4 и 5, а также между сегментами 5 и 6 повтора 4. На фиг. 1 представлены ВАС-контиги, покрывающие представляющую интерес область хромосомы 13, которая включает CanIon-ген, и показано геномное расположение CanIon-гена относительно генетических маркеров, демонстрирующих наивысшую значимость в исследованиях по сцеплению. В частности, Blouin и соавт. (1998) осуществили широкое исследование генома на предмет выявления локусов предрасположенности к шизофрении, в 54 комплексных родословных, с использованием 452 микросателлитных маркеров. Наиболее значимое сцепление между шизофренией в семьях обнаруживалось на хромосоме 13q32 вблизи маркера D13S174. Brzustowicz и соавт. (1999) дали оценку микросателлитным маркерам, охватывающим хромосомы 8 и 13 в 21 обширных Канадских семьях. Маркеры для хромосомной области 13q дают позитивные оценки LOD в каждой используемой аналитической модели: аутосомно-доминантной и аутосомно-рецессивной, с узким или широким определением шизофрении. Максимальные трехточечные LOD-оценки были получены с маркером D13S793 в рецессивно-широкой модели: 3,92 в рекомбинантной фракции 0,1 при гомогенности и 4,42 с =0,65 и = при гетерогенности. На указанной фиг. 1 CanIon-ген локализован частично в контиге, помеченном 'Region E' и частично в контиге, помеченном С 0001 А 10. Данный CanIon-ген фланкирован двумя маркерами, демонстрирующими наивысшую значимость в исследованиях по сцеплению. Маркер D13S174 также находится в контиге С 0001 А 10, а маркер D13S793 локализован, приблизительно 3,5 млн.п.н. центромернее к CanIon-гену. Существует очень большая потребность в идентификации генов, связанных с шизофренией, биполярным расстройством и другими ЦНС, а также сердечно-сосудистыми заболеваниями и состояниями. Существует также необходимость в идентификации новых ионных каналов, связанных с заболеваниями. Такие гены и белки могут открыть новые перспективы в лечении шизофрении, биполярного расстройства или иных ЦНС-состояний, а также иных состояний, таких как, например, состояния сердца и гипертензия, и позволяют, кроме того, изучать и характеризовать CanIon-ген и связанные с ним биологические пути. Познание таких генов и связанных с ними биологических путей, вовлеченных в данные заболевания и состояния, позволит исследователям понять этиологию, например, шизофрении и биполярного расстройства, и приведет к разработке лекарственных средств и лекарственных препаратов, нацеленных против причины данных заболеваний. Например, соединения, которые блокируют CanIon-каналы, могут использоваться для лечения любых заболеваний и состояний, предпочтительно шизофрении или биполярного расстройства, и включающих также болевые нарушения, эпилепсию и различные сердечнососудистые нарушения, такие как сердечная аритмия, стенокардия и гипертензия. Существует также большая необходимость в новых способах выявления предрасположенности к шизофрении, биполярному расстройству и иным состояниям, а также для предотвращения или для наблюдения за развитием любого из этих заболеваний. Диагностические средства могли бы также оказаться в высшей степени полезными. В самом деле, в качестве примера, ранняя идентификация у людей с риском развития шизофрении сделает возможным раннее и/или профилактическое осуществление лечения. Кроме того, точные оценки эффективности лекарственного средства, а также толерантности пациента, даст возможность врачуклиницисту улучшить соотношение между выгодой и риском, что касается схем лечения шизофрении и биполярного расстройства. Определения Перед более подробным описанием настоящего изобретения формулируются следующие ниже определения, которые иллюстрируют и задают значение и рамки терминов, используемых для описания представленного в данном описании изобретения. Используемый в данном описании термин "CanIon-ген" включает в себя геномные, мРНК и кДНК последовательности, кодирующие CanIon-белок, в том числе и нетранслируемые регуляторные области геномной ДНК. Используемый в данном описании термин "гетерологичный белок" предназначен для обозначения любого белка или полипептида, отличающегося от CanIon-белка. Например, гетерологичный белок может представлять собой соединение, которое можно использовать в качестве маркера в дополнительных экспериментах с регуляторной областью CanIon. Термин "выделенный" требует, чтобы материал был удален из своей первоначальной окружающей среды (например, природной окружающей среды, если он является встречаемым в природе). Например,встречаемый в природе полинуклеотид или полипептид, представленный в живом организме животного,не является выделенным, но тот же полинуклеотид или ДНК, или полипептид, отделенный от некоторых или от всех сосуществующих веществ в данной природной системе, является выделенным. Такой полинуклеотид может являться частью вектора и/или такой полинуклеотид или полипептид может являться-6 008252 частью композиции, и все же являться выделенным, вектор или композиция не являются частью его природного окружения. Например, встречаемый в природе полинуклеотид, представленный в живом организме животного,не является выделенным, но тот же полинуклеотид, отделенный от некоторых или из всех сопутствующих веществ в природной системе, является выделенным. В частности, исключенными из определения"выделенный" являются: встречаемые в природе хромосомы (такие как хромосомные распределения),библиотеки искусственных хромосом, геномные библиотеки и кДНК-библиотеки, которые существуют либо в виде in vitro препарата нуклеиновой кислоты, либо в виде препарата трансфицированной/трансформированной клетки-хозяина, где данные клетки-хозяева представляют собой либо гетерогенный in vitro препарат, либо посеянные в виде гетерогенной популяции из единичных колоний. Исключаются также, в частности, и указанные выше библиотеки, в которых конкретный полинуклеотид составляет менее 5% от числа вставок нуклеиновых кислот в векторные молекулы. Кроме того, исключаются, в частности, препараты геномной ДНК целых клеток или РНК целых клеток (включая указанные выше препараты целых клеток, которые механически нарезаются или энзиматически расщепляются). Кроме того, исключаются, в частности, препараты указанных выше целых клеток в виде либо in vitro препарата, либо в виде гетерогенной смеси, разделенной с помощью электрофореза (включая блотинг),где полинуклеотид настоящего изобретения не был дополнительно отделен от гетерологичных полинуклеотидов в электрофоретической среде (например, дополнительное отделение путем вырезания одиночной полосы из гетерогенной популяции полос в агарозном геле или в найлоновом блоте). Термин "выделенный очисткой" не требует абсолютной степени очистки; скорее он предназначается в качестве относительного определения. Очистка исходного вещества или природного вещества до по меньшей мере одного порядка величины, предпочтительно двух или трех порядков, и более предпочтительно четырех или пяти порядков, определенно предполагается. В качестве примера, очистка с 0,1% концентрации до 10% концентрации является очисткой на два порядка. В качестве примера, индивидуальные кДНК-клоны, выделенные из кДНК-библиотеки, были традиционно очищены до электрофоретической гомогенности. Последовательности, полученные из данных клонов, невозможно было бы получить непосредственно из данной библиотеки или из тотальной ДНК человека. Данные кДНК-клоны не являются встречаемыми в природе как таковые, но скорее их получают с помощью операции частично выделяемого очисткой встречаемого в природе вещества (информационная РНК). Преобразование мРНК в кДНК-библиотеку включает в себя создание синтетического вещества (кДНК), а очищенные индивидуальные кДНК-клоны могут быть выделены из данной синтетической библиотеки с помощью клональной селекции. Таким образом, создание кДНК-библиотеки из информационной РНК и последовательное выделение индивидуальных клонов из данной библиотеки приводит, приблизительно, к 104-106-кратной очистке нативной РНК. Кроме того, термин "выделенный очисткой" используют в данном описании для описания полипептида или полинуклеотида настоящего изобретения, который был отделен от других соединений, включая, но, не ограничиваясь ими, полипептиды или полинуклеотиды, углеводы, липиды и т.п. Термин "выделенный очисткой" можно использовать для конкретного отделения мономерных полипептидов настоящего изобретения от олигомерных форм, таких как гомо- или гетеродимеры, димеры, тримеры и т.п. Термин "выделенный очисткой" можно также использовать в отношении специфического отделения ковалентнозамкнутых полинуклеотидов от линейных полинуклеотидов. Любой полинуклеотид является в значительной степени чистым, если, по меньшей мере, около 50%, предпочтительно 60-75% образца обнаруживает единственную полинуклеотидную последовательность и конформацию (например, линейную в сравнении с ковалентнозамкнутой). В значительной степени чистый полипептид или полинуклеотид обычно включает около 50%, предпочтительно 60-90% масса/масса полипептидного или полинуклеотидного образца, соответственно, предпочтительно около 95% и более предпочтительно около 99% чистого продукта. Беспримесность полипептида или полинуклеотида или гомогенность показывают с помощью ряда способов, хорошо известных в данной области техники, таких, например, как электрофорез образца в геле агарозы или в геле полиакриламида, с последующей визуализацией единственной полосы после окрашивания геля. Для некоторых целей наибольшее разрешение можно получить с использованием ВЭЖХ или иных способов, хорошо известных в данной области техники. В качестве альтернативного варианта осуществления настоящего изобретения, очистка полипептидов и полинуклеотидов настоящего изобретения может быть выражена, по меньшей мере, в виде процентов чистого вещества по отношению к гетерологичным полипептидам и полинуклеотидам (ДНК, РНК или обоим). В качестве предпочтительного варианта осуществления настоящего изобретения, полипептиды и полинуклеотиды настоящего изобретения обладают, по меньшей мере, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 98, 99 или 100% чистоты (беспримесности) относительно, соответственно, гетерологичных полипептидов и полинуклеотидов. В качестве еще более предпочтительного варианта осуществления настоящего изобретения данные полипептиды и полинуклеотиды обладают степенью очистки, колеблющейся от любого числа до тысячной доли, между 90 и 100% (например, полипептид или полинуклеотид, по меньшей мере, 99,995% чистоты) по отношению, соответственно, к их гетерологичным полипептидам и полинуклеотидам, или в виде соотношения масса/масса по отношению ко всем соединениям и молекулам, отличным от сущест-7 008252 вующих в данном носителе. Каждое число, представляющее процент чистоты, до тысячной доли, можно заявлять в качестве индивидуального вида чистоты. Термин "полипептид" относится к полимеру аминокислот, не принимая во внимание длину данного полимера; поэтому пептиды, олигопептиды и белки включены без определения полипептида. Данный термин также не определяет или исключает постэкспрессионные модификации полипептидов, например,полипептидов, которые имеют в своем составе ковалентно присоединенные гликозильные группы, ацетильные группы, фосфатные группы, липидные группы и им подобные, четко подпадаемых под термин полипептид. В данное определение включены также полипептиды, которые содержат один или несколько аналогов аминокислот (включая, например, не встречаемые в природе аминокислоты, аминокислоты,которые встречаются в природе только в неродственной биологической системе, модифицированные аминокислоты из систем млекопитающих и т.п.), полипептиды с замещенными связями, а также иные модификации, известные в данной области техники, как встречаемые в природе, так и не встречаемые в природе. Используемый в данном описании термин "рекомбинантный полипептид" относится к полипептиду,который искусственно создают и который включает, по меньшей мере, две полипептидные последовательности, которые не обнаруживаются в виде смежных полипептидных последовательностей в их природной среде, или относится к полипептидам, которые экспрессируются из рекомбинантного полинуклеотида. Используемый в данном описании термин "животное, не принадлежащее человеческому роду", относится к любому позвоночному, не принадлежащему человеческому роду, птицам и, более предпочтительно, млекопитающим, предпочтительно приматам, сельскохозяйственным животным, таким как свинья, козы, овцы, ослы и лошади, кролики или грызуны, более предпочтительно крысы или мыши. Используемый в данном описании термин "животное" относится к любому позвоночному, предпочтительно млекопитающему. Оба термина "животное" и "млекопитающее" определенно включают человеческие существа, если не предшествует термин "не принадлежащий человеческому роду". Используемый в данном описании термин "антитело" относится к полипептиду или к группе полипептидов, которые включают, по меньшей мере, один связывающий домен, отличающийся тем, что антителосвязывающий домен образуется из упакованных вариабельных доменов молекулы антитела с образованием трехмерного связывающего пространства с формой внутренней поверхности и распределением заряда, комплементарного особенностям антигенной детерминанты антигена, что позволяет иммунологически реагировать с данным антигеном. Антитела имеют в своем составе рекомбинантные белки, включающие связывающие домены, а также фрагменты, включающие Fab, Fab', F(ab)2 и F(ab')2-фрагменты. Используемая в данном описании "антигенная детерминанта" представляет собой часть молекулы антигена, в данном случае CanIon-полипептида, которая определяет специфичность взаимодействия антиген-антитело. "Эпитоп" относится к антигенной детерминанте полипептида. Эпитоп может включать не менее 3 аминокислот для пространственной конформации, которая уникальна для данного эпитопа. Как правило, эпитоп включает по меньшей мере 6 таких аминокислот, но более обычно, по меньшей мере, 8-10 таких аминокислот. Способы определения аминокислот, которые составляют эпитоп, включают рентгеновскую кристаллографию, 2-мерный ядерный магнитный резонанс и эпитопное картирование,например, способом Pepscan, описанном Geysen и соавт., 1984; публикация РСТ No WO84/03564; и публикация РСТ No WO84/03506. На всем протяжении настоящего описания экспрессия "нуклеотидной последовательности" может употребляться для обозначения полинуклеотида или нуклеиновой кислоты. Более точно, экспрессия"нуклеотидной последовательности" охватывает собственно материал нуклеиновой кислоты и, следовательно, не ограничивается информацией о последовательности (т.е., последовательности букв, выбранной из четырех букв основания), которая биохимически характеризует специфичность молекулы ДНК или РНК. Используемые в данном описании попеременно термины "нуклеиновые кислоты", "олигонуклеотиды" и "полинуклеотиды" включают РНК, ДНК или гибридные последовательности РНК/ДНК с более чем одной последовательностью в одноцепочечной или дуплексной форме. Термин "нуклеотид" используют в данном описании в качестве прилагательного к описанию молекул, включающих РНК, ДНК, или гибридных последовательностей РНК/ДНК любой длины в одноцепочечной или дуплексной форме. Термин"нуклеотид", также используемый в данном описании в качестве существительного, относится к индивидуальным нуклеотидам или к множеству нуклеотидов, подразумевая молекулу или индивидуальный элемент в большей молекуле нуклеиновой кислоты, включающей пурин или пиримидин, сахарную составляющую рибозы или дезоксирибозы и фосфатную группу, или фосфодиэфирную связь в случае нуклеотидов в олигонуклеотиде или полинуклеотиде. Хотя используемый в данном описании термин "нуклеотид" охватывает также "модифицированные нуклеотиды", которые включают, по меньшей мере, одну из модификаций (а) альтернативную связывающую группу, (b) аналоговую форму пурина, (с) аналоговую форму пиримидина или (d) аналоговый сахар, примеры аналоговых связывающих групп, пурина,пиримидинов и cахаров см., например, в публикации РСТ No WO95/04064. Полинуклеотидные последовательности настоящего изобретения могут быть получены любым известным способом, включая синтетический, рекомбинантный, ex vivo преобразование или их сочетанием, а также используя любые способы очистки, известные в данной области техники. Последовательность, которую "функционально присоединяют" к регуляторной последовательности,-8 008252 такой как промотор, означает, что указанный регуляторный элемент находится в правильном положении и ориентации по отношению к нуклеиновой кислоте, для контролирования РНК-полимеразной инициации и экспрессии представляющей интерес нуклеиновой кислоты. Используемый в данном описании термин "функционально присоединенный" относится к связыванию полинуклеотидных элементов в функциональной взаимосвязи. Например, промотор или энхансер функционально связывают с кодирующей последовательностью, если он влияет на транскрипцию данной кодирующей последовательности. Термины "признак" и "фенотип" используются в данном описании взаимозаменяемо и относятся к любому видимому, обнаруживаемому или иначе измеряемому свойству организма, такому, например, как симптомы или предрасположенность к заболеванию. Обычно термины "признак" или "фенотип", используемые в данном описании, относят к симптомам или к предрасположенности к заболеванию, к положительному ответу или к побочным эффектам, связанным с лечением. Предпочтительно, указанный признак может представлять собой, без ограничения, психические расстройства, такие как шизофрения или биполярное расстройство, другие ЦНС или нейрональные расстройства, такие как эпилепсия или нарушения болевых ощущений, а также сердечно-сосудистые состояния, такие как стенокардия, гипертензия и аритмия, а также любой аспект, особенность или характеристику любого из данных заболеваний или состояний. Термин "аллель", используемый в данном описании, относят к вариантам нуклеотидной последовательности. Двуаллельный полиморфизм имеет две формы. Диплоидные организмы могут быть гомозиготой или гетерозиготой по аллельной форме. Термин "уровень гетерозиготности", используемый в данном описании, относят к доле индивидуумов в популяции, которые являются гетерозиготами по отдельному аллелю. В двуаллельной системе уровень гетерозиготности равен, в среднем, 2 Ра(1-Ра), где Ра соответствует частоте наименее распространенного аллеля. Для использования в генетических исследованиях генный маркер должен обладать адекватным уровнем гетерозиготности, допускающим приемлемую вероятность того, что случайно выбранный субъект будет гетерозиготой. Термин "генотип", используемый в данном описании, относят к тождественности аллелей, представленных у индивидуума или в образце. В контексте настоящего изобретения генотип предпочтительно относят к описанию двуаллельных маркерных аллелей, представленных у индивида или в образце,например, аллели двуаллельных маркеров в CanIon-гене или в геномной области. Термин "генотипирование" образца или индивида по двуаллельному маркеру включает в себя определение конкретного аллеля или конкретного нуклеотида, осуществляемое по индивидуальному двуаллельному маркеру. Термин "мутация", используемый в данном описании, относят к различию в ДНК-последовательности между или среди разных геномов или индивидов, которые обладают частотой ниже 1%. Термин "гаплотип" относят к сочетанию аллелей, представленных у индивида или в образце. В контексте настоящего изобретения гаплотип предпочтительно относят к сочетанию двуаллельных маркерных аллелей, обнаруживаемых у данного индивида, и которые могут быть ассоциированы с фенотипом. Термин "полиморфизм", используемый в данном описании, относят к встречаемости одной или нескольких альтернативных геномных последовательностей или аллелей среди или у разных геномов или индивидов. "Полиморфный" относится к состоянию, в котором два или более вариантов конкретной геномной последовательности могут быть обнаружены в популяции. "Полиморфный сайт" представляет собой локус, по которому наблюдается изменчивость. Полиморфизм единственного нуклеотида представляет собой замещение одного нуклеотида другим нуклеотидом в данном полиморфном сайте. Делеция единичного нуклеотида или вставка единичного нуклеотида также приводит к возрастанию полиморфизма единственного нуклеотида. В контексте настоящего изобретения "полиморфизм единственного нуклеотида" предпочтительно относится к единичной нуклеотидной замене. Обычно у разных индивидов данный полиморфный сайт может быть занят двумя разными нуклеотидами. Термины "двуаллельный полиморфизм" и "двуаллельный маркер" используются в данном описании взаимозаменямо и относятся к полиморфизму единственного нуклеотида, обладающего двумя аллелями с достаточно высокой частотой в популяции. "Двуаллельный маркерный аллель" относится к нуклеотидным вариантам, представленным по сайту двуаллельного маркера. Обычно частота малораспространенного аллеля двуаллельных маркеров настоящего изобретения, как оценка, составляет более чем 1%,предпочтительно его частота превышает 10%, более предпочтительно его частота составляет по меньшей мере 20% (т.е., уровень гетерозиготности составляет по меньшей мере 0,32), еще более предпочтительно его частота равна по меньшей мере 30% (т.е., уровень гетерозиготности достигает по меньшей мере 0,42). Двуаллельный маркер, в котором частота малораспространенного аллеля равна 30% или больше,называют "высококачественным двуаллельным маркером". Положение нуклеотидов в полинуклеотиде относительно центра полинуклеотида описывается в данном описании следующим образом. Если полинуклеотид обладает нечетным числом нуклеотидов, то считают, что нуклеотид, равноотстоящий от 3' и 5' концов в данном полинуклеотиде, находится "в центре" данного полинуклеотида, и любой нуклеотид, непосредственно примыкающий к нуклеотиду в центре, или же сам нуклеотид в центре, считают находящимся "в 1 нуклеотиде от центра". При нечетном числе нуклеотидов в полинуклеотиде любую из пяти нуклеотидных позиций в средине полинуклеотида следует считать находящейся в 2 нуклеотидах от центра, и так далее. Если полинуклеотид обладает чет-9 008252 ным числом нуклеотидов, то в центре данного полинуклеотида будет находиться связь, а не нуклеотид. Таким образом, любой из двух центральных нуклеотидов следует считать находящимися "в 1 нуклеотиде от центра", а любой из четырех нуклеотидов в средине данного полинуклеотида следует считать находящимся "в 2 нуклеотидах от центра", и так далее. Что касается полиморфизма, который связан с заменой,вставкой или делецией 1 или более нуклеотидов, то данный полиморфизм, аллель или двуаллельный маркер находится "в центре" полинуклеотида, если разница между расстоянием от замещенных, вставленных или делетированных полинуклеотидов данного полиморфизма до 3'-конца данного полинуклеотида, расстоянием от замещенных, вставленных или делетированных полинуклеотидов данного полиморфизма до 5'-конца данного полинуклеотида, равна нулю или одному нуклеотиду. Если данная разница равна 0-3, тогда данный полиморфизм считают находящимся "в 1 нуклеотиде от центра". Если эта разница составляет 0-5, данный полиморфизм считают находящимся "в 2 нуклеотидах от центра". Если же эта разница составляет 0-7, то данный полиморфизм считают находящимся "в 3 нуклеотидах от центра", и т.д. Термин "левее", используемый в данном описании, относится к месту, которое находится около 5'конца данного полинуклеотида от определенной точки отсчета, или, в случае гена, в направлении от кодирующей последовательности к промотору. Термины "спаренные основания" и "спаренные основания Уотсона и Крика", используемые в данном описании взаимозаменяемо, относятся к нуклеотидам, которые могут быть связаны друг с другом водородной связью, благодаря идентичности их последовательностей, способом, подобным тому, который обнаруживает двухспиральная ДНК для остатков тимина или урацила, связанных с остатками аденина с помощью двух водородных связей, и остатков цитозина и гуанина, связанных с помощью трех водородных связей (См. Stryer, L., Biochemistry, 4th edition, 1995). Термины "комплементарный" или "его комплемент", используемые в данном описании, относятся к последовательностям полинуклеотидов, которые способны образовывать пары оснований Уотсона и Крика с другим конкретным полинуклеотидом по всей полностью комплементарной области. Для данной цели настоящего изобретения первый полинуклеотид признают комплементарным второму полинуклеотиду, если каждое основание первого полинуклеотида спаривается со своим комплементарным основанием. Комплементарными основаниями являются, как правило, А и Т (или А и U), или С и G. "Комплемент" используется в данном описании в качестве синонима "комплементарного полинуклеотида", "комплементарной нуклеиновой кислоты" и "комплементарной нуклеотидной последовательности". Данные термины, применяемые к парам полинуклеотидов, базируются исключительно на их последовательностях, а не на какой-либо конкретной совокупности условий, при которых данные два полинуклеотида были бы фактически связаны. Варианты и фрагменты 1. Полинуклеотиды. Варианты полинуклеотидов, в виде используемого в данном описании термина, представляют собой полинуклеотиды, которые отличаются от исходного полинуклеотида. Вариант полинуклеотида может быть встречаемым в природе вариантом, таким, например, как встречаемый в природе аллельный вариант, или он может быть вариантом, который не известен в качестве встречаемого в природе. Такие не встречаемые в природе варианты данного полинуклеотида можно создать методами мутагенеза, в том числе и теми, которые применимы к полинуклеотидам, клеткам или организмам. Обычно, различия столь невелики, что нуклеотидные последовательности исходного и вариантного полинуклеотидов почти полностью совпадают, а по многим участкам идентичны. Варианты полинуклеотидов, в соответствии с настоящим изобретением, включают, без существенного ограничения, нуклеотидные последовательности, которые по меньшей мере на 95% идентичны полинуклеотиду, выбранному из группы, состоящей из нуклеотидных последовательностей SEQ ID Nos 14, или полинуклеотидному фрагменту по меньшей мере из 12 последовательных нуклеотидов полинуклеотида, выбранного из группы, состоящей из нуклеотидных последовательностей SEQ ID Nos 1-4, и предпочтительно, по меньшей мере, идентичны на 99%, более предпочтительно, по меньшей мере, идентичны на 99,5%, и наиболее предпочтительны, по меньшей мере, идентичны на 99,8% полинуклеотиду,выбранному из группы, состоящей из нуклеотидных последовательностей SEQ ID Nos 1-4, или любому полинуклеотидному фрагменту, по меньшей мере, из 12 последовательных нуклеотидов полинуклеотида,выбранного из группы, состоящей из нуклеотидных последовательностей SEQ ID No 1-4. Нуклеотидные изменения, присутствующие в вариантном полинуклеотиде, могут быть молчащими,что означает, что они не изменяют аминокислоты, кодируемые данным полинуклеотидом. Однако нуклеотидные изменения могут также приводить и к аминокислотным заменам, добавлениям делециям, слияниям и укорочениям в данном полипептиде, кодируемом начальной последовательностью. В этих заменах, делециях или добавках могут участвовать один или более нуклеотидов. Данные варианты могут являться результатом изменений в кодирующей или некодирующей областях или в обоих. Изменения в кодирующих областях могут создавать консервативные или неконсервативные замены, делеции или добавки. В контексте настоящего изобретения особенно предпочтительными вариантами осуществления настоящего изобретения являются те, в которых данные полинуклеотиды кодируют полипептиды, которые фактически сохраняют ту же биологическую функцию или активность, что и зрелый CanIon-белок, или те,- 10008252 в которых данные полинуклеотиды кодируют полипептиды, которые сохраняют или повышают основную биологическую активность, снижая в то же время вспомогательную (вторичную) биологическую активность. Полинуклеотидный фрагмент представляет собой полинуклеотид, обладающий последовательностью, которая совершенно такая же, что и часть, но не вся данная нуклеотидная последовательность,предпочтительно нуклеотидная последовательность CanIon-гена, и его варианты. Данный фрагмент может представлять собой участок интрона или экзона CanIon-гена. Он может также представлять собой какую-нибудь часть из регуляторных областей CanIon. Предпочтительно, такие фрагменты включают, по меньшей мере, один из двуаллельных маркеров А 1-А 17 или его комплементов или двуаллельный маркер,сцепленный при нарушении равновесия с одним или несколькими двуаллельными маркерами А 1-А 17. Такие фрагменты могут быть "автономными", т.е., не являться частью или слившимися с другими полинуклеотидами, или они могут быть включены в отдельный большой полинуклеотид, в котором они образуют сегмент или участок. Действительно, несколько таких фрагментов могут быть представлены в отдельном большом полинуклеотиде. Факультативно, такие фрагменты могут состоять или состоять в основном из непрерывного участка последовательности, по меньшей мере, из 8, 10, 12, 15, 18, 20, 25, 35, 40, 50, 70, 80, 100, 250, 500 или 1000 нуклеотидов в длину. Совокупность предпочтительных фрагментов содержит, по меньшей мере, один из двуаллельных маркеров А 1-А 17 CanIon-гена, который описан в данном описании, или его комплементы. 2. Полипептиды. Данный вариант может представлять собой 1) вариант, в котором один или несколько аминокислотных остатков заменены консервативным или неконсервативным аминокислотным остатком, и такой замещенный аминокислотный остаток может или может не кодироваться с помощью генетического кода,или 2) вариант, в котором один или несколько аминокислотных остатков включают замещенную группу,или 3) вариант, в котором мутантный CanIon сливается с другим соединением, таким, например, как соединение, которое увеличивает время полужизни данного полипептида (например, полиэтиленгликоль),или 4) вариант, в котором дополнительные аминокислоты сливаются с мутантным CanIon, такой, например, как лидерная или секреторная последовательность или последовательность, которую употребляют для выделения очисткой мутантного CanIon, или препротеиновая последовательность. Такие варианты считаются находящимися в компетенции специалистов в данной области техники. Полипептидный фрагмент представляет собой полипептид, обладающий последовательностью, которая идентична части, но не всей данной полипептидной последовательности, предпочтительно полипептид, кодируемый CanIon-геном и его вариантами. Что касается аминокислотной замены в аминокислотной последовательности полипептида, в соответствии с настоящим изобретением, одну или несколько аминокислот можно заменить "эквивалентными" аминокислотами. Выражение "эквивалентная" аминокислота используют в данном описании для обозначения любой аминокислоты, которая может быть заменена одной или несколькими аминокислотами, обладающими аналогичными свойствами, при условии, что специалисты в области химии пептидов могут предполагать вторичную структуру и гидропатичную природу данного полипептида, которые будут оставаться практически неизмененными. Большей частью следующие группы аминокислот соответствуют эквивалентным изменениям: (1) Ala, Pro, Gly, Glu, Asp, Gln, Asn, Ser, Thr; (2) Cys, Ser, Tyr,Thr; (3) Val, Ile, Leu, Met, Ala, Phe; (4) Lys, Arg, His; (5) Phe, Tyr, Trp, His. Специфичный вариант осуществления представляющей интерес модифицированной пептиднойCanIon-молекулы, в соответствии с настоящим изобретением, включает, но не ограничивается указанным, пептидную молекулу, которая устойчива к протеолизу, в которой пептидная связь -CONH- модифицирована и заменена восстановленной связью (CH2NH), связью retro inverso (NHCO), метиленоксисвязью (СН 2-O), тиометиленовой связью (CH2-S), карбосвязью (СН 2 СН 2), ацетометиленовой связью (СОСН 2), гидроксиэтиленовой связью (СНOН-СН 2), N-N-связью, Е-аlсеn-связью или -СН=СН-связью. В настоящее изобретение включен CanIon-полипептид человека или его фрагмент, или его вариант, в котором по меньшей мере одна пептидная связь была модифицирована, как описано выше. Такие фрагменты могут быть "автономными", т.е., не являться частью или слившимися с другими полипептидами, или они могут быть включены в отдельный большой полипептид, в котором они образуют сегмент или участок. Вместе с тем, несколько фрагментов можно включить в один большой полипептид. В качестве репрезентативных примеров полипептидных фрагментов настоящего изобретения в данном описании можно указать на фрагменты, которые обладают длиной от примерно 5, 6, 7, 8, 9 или 1015, 10-20, 15-40 или 30-55 аминокислот. Предпочтительными являются фрагменты, содержащие, по крайней мере, мутацию одной аминокислоты в белок CanIon. Идентичность нуклеиновых кислот или полипептидов Термины "процент идентичности последовательностей" и "процент гомологии", используемые в данном описании взаимозаменяемо, применяют для сравнения полинуклеотидов или полипептидов, и определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может включать добавки или делеции (т.е. пробелы) при сравнении с исходной последовательностью (которая не включает добавки или делеции) для оптимального выравнивания двух данных последовательностей. Указанный- 11008252 процент вычисляют путем определения числа позиций, по которым у обеих последовательностей наблюдаются идентичные основания нуклеиновых кислот или аминокислотные остатки, с получением соответствующих позиций, делением числа соответствующих позиций на общее число позиций в данном окне сравнения и умножением полученного результата на 100 с получением процента идентичности последовательностей. Гомологию оценивают с использованием любого из множества разнообразных алгоритмов сравнения последовательностей и программ, известных в данной области техники. Такие алгоритмы и программы включают, но никоим образом не ограничиваются, TBLASTN, BLASTP, FASTA, TFASTA иCLUSTALW (Pearson and Lipman, 1988; Altschul и соавт., 1990; Thompson и соавт., 1994; Higgins и соавт.,1996; Altschul и соавт., 1990; Altschul и соавт., 1993). В особенно предпочтительном варианте осуществления настоящего изобретения гомологии последовательностей белков и нуклеиновых кислот оценивают с использованием Basic Local Alignment Search Tool ("BLAST"), который хорошо известен в данной области техники (см., например, Karlin and Altschul, 1990; Altschul и соавт., 1990, 1993, 1997). В частности,пять специфичных BLAST-программ используются для выполнения следующей задачи:(1) BLASTP и BLAST3 сравнивают запрашиваемую аминокислотную последовательность с последовательностью белка базы данных;(2) BLASTN сравнивает запрашиваемую нуклеотидную последовательность с нуклеотидной последовательностью базы данных;(3) BLASTX сравнивает воображаемые продукты трансляции шести рамок запрашиваемой нуклеотидной последовательности (обе цепи) с последовательностью белка базы данных;(4) TBLASTN сравнивает запрашиваемую последовательность белка с нуклеотидной последовательностью базы данных, транслированную со всех шести открытых рамках считывания (обе цепи); и(5) TBLASTX сравнивает трансляцию шести рамок запрашиваемой нуклеотидной последовательности с трансляцией шести рамок нуклеотидной последовательности базы данных.BLAST-программы идентифицируют гомологичные последовательности путем идентификации сходных сегментов, которые именуются в данном описании как "высокооцениваемые пары сегментов",между представляющей интерес аминокислотной или нуклеотидной последовательностью и тестпоследовательностью, которую предпочтительно получают из последовательности белка или нуклеотидной последовательности базы данных. Высокооцениваемые пары сегментов предпочтительно идентифицируют (т.е. выстраивают) с помощью способов оценки матрицы, многие из которых хорошо известны в данной области техники. Предпочтительно используемая матрица оценок представляет собой ВLOSUM62-матрицу (Connet и соавт., 1992; Henikoff and Henikoff, 1993). С меньшей предпочтительностью можно также использовать матрицы РАМ или РАМ 250 (см., например, Schwartz and Dayhoff, eds., 1978). BLAST-программы оценивают статистическую значимость идентифицируемых высокооцениваемых пар сегментов и предпочтительно отбирают те сегменты, которые удовлетворяют порогу значимости, устанавливаемому пользователем, такому как устанавливаемый пользователем процент гомологии. Предпочтительно статистическая значимость высокооцененной пары сегментов оценивается с использованием формулы статистической значимости Карлина (см., например, Karlin and Altschul, 1990).BLAST-программы могут использоваться со значениями параметров по умолчанию или с модифицированными параметрами, созданными пользователем. Жесткие условия гибридизации С целью охарактеризовать такую гибридизующуюся нуклеиновую кислоту, в соответствии с настоящим изобретением, жесткие условия гибридизации являются следующими: стадию гибридизации осуществляют при 65 С в присутствии 6 х SSC-буфера, 5 х раствора Денхардта, 0,5% SDS и 100 мкг/мл ДНК спермы лосося. Стадию гибридизации осуществляют с последующими четырьмя стадиями отмывки: две отмывки по 5 мин, предпочтительно при 65 С в 2 х SSC и 0,1% SDS-буфере; одна отмывка 30 мин, предпочтительно при 65 С в 2 х SSC и 0,1% SDS-буфере,одна отмывка 10 мин, предпочтительно при 65 С в 0,1 х SSC и 0,1% SDS-буфере,данные условия гибридизации пригодны для молекулы нуклеиновой кислоты длиной около 20 нуклеотидов. Нет необходимости говорить о том, что описанные выше условия гибридизации адаптируют в соответствии с длиной требуемой нуклеиновой кислоты, следуя методам, хорошо известным специалистам в данной области техники. Подходящие условия гибридизации можно, например, адаптировать в соответствии с указаниями, изложенными в книге Hames и Higgins (1985). Геномные последовательности CanIon-гена Настоящее изобретение включает в себя CanIon-ген или геномные CanIon-последовательности, состоящие, или в основном состоящие из, или включающие последовательность SEQ ID Nos 1-3, комплементарную ей последовательность, а также ее фрагменты и варианты. Данные полинуклеотиды могут представлять собой полинуклеотиды, выделенные очисткой, выделенные или рекомбинантные. Настоящее изобретение включает в себя также выделенный очисткой, выделенный или рекомбинантный полинуклеотид, включающий нуклеотидную последовательность, обладающую по меньшей мере 70, 75, 80, 85, 90 или 95% нуклеотидной идентичностью с нуклеотидной последовательностью SEQID Nos 1-3 или с ее комплементарной последовательностью, или с ее фрагментом. Нуклеотидные различия, что касается нуклеотидной последовательности SEQ ID Nos 1-3, могут быть, как правило, распределены случайно по всей длине нуклеиновой кислоты. Тем не менее, предпочтительными нуклеиновыми кислотами являются те из них, в которых нуклеотидные различия, что касается нуклеотидной последовательности SEQ ID Nos 1-3, преимущественно локализованы за пределами данных кодирующих последовательностей, содержащихся в экзонах. Данные нуклеиновые кислоты, а также их фрагменты и варианты, могут использоваться в качестве олигонуклеотидных праймеров или зондов с целью обнаружения наличия копии CanIon-гена в тест-выборке или, альтернативно, с целью амплифицировать нуклеотидную последовательность-мишень в CanIon-последовательностях. Другой объект настоящего изобретения состоит из выделенной очисткой, выделенной или рекомбинантной нуклеиновой кислоты, которая гибридизуется с нуклеотидной последовательностью SEQ IDNos 1-3 или с комплементарной ей последовательностью, или с ее вариантом, в жестких гибридизационных условиях, как указано выше. В предпочтительных вариантах осуществления настоящего изобретения указанная выделенная очисткой, выделенная или рекомбинантная нуклеиновая кислота специфически гибридизуется с полинуклеотидами CanIon-гена человека, более предпочтительно, если указанная нуклеиновая кислота способна гибридизоваться с нуклеотидами из CanIon-гена человека, но практически неспособна гибридизоваться с нуклеотидной последовательностью CanIon-гена крысы. Особенно предпочтительная нуклеиновая кислота настоящего изобретения включает выделенные,выделенные очисткой или рекомбинантные полинуклеотиды, включающие непрерывный участок последовательности, по меньшей мере, из 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500,1000, 2000, 3000, 4000, 5000 или 10000 нуклеотидов из SEQ ID Nos 1-3 или из ее комплементов. Следует отметить, что нуклеотидные фрагменты любого размера и последовательности могут также включаться в полинуклеотиды, описанные в данном разделе. Геномная нуклеиновая кислота CanIon включает 44 экзона. Расположение экзонов в SEQ ID Nos 1-3 подробно представлено ниже в табл. В. Таблица В Таким образом, настоящее изобретение содержит выделенные очисткой, выделенные или рекобинантные полинуклеотиды, включающие нуклеотидную последовательность, выбранную из группы, состоящей, каждая, из 44 экзонов CanIon-гена и, каждая, - из комплементарной ей последовательности. В настоящем изобретении обеспечиваются также выделенные очисткой, выделенные или рекомбинантные нуклеиновые кислоты, включающие сочетание, по меньшей мере, из двух экзонов CanIon-гена, в котором данные полинуклеотиды размещены в нуклеиновой кислоте, от 5'-конца до 3'-конца указанной нуклеиновой кислоты, в том же порядке, что и в SEQ ID No 1-3. Интрон 1 относится к нуклеотидной последовательности, локализованной между Экзоном 1 и Экзоном 2, и так далее. Положение интронов детально представлено в табл. А. Таким образом, настоящее изобретение содержит выделенные очисткой, выделенные или рекобинантные полинуклеотиды, включающие нуклеотидную последовательность, выбранную из группы, состоящей из 43 интронов CanIonгена, или комплементарную ей последовательность. Хотя данный раздел называется "Геномные Последовательности CanIon", следует иметь ввиду, что нуклеотидные фрагменты любого размера и последовательности могут также включаться в полинуклеотиды, описанные в данном разделе, фланкируя данные геномные последовательности CanIon на любой стороне или между двумя или более такими геномными последовательностями. кДНК-последовательности CanIon Показано, что экспрессия CanIon-гена приводит к продуцированию по меньшей мере одного из видов мРНК, последовательности нуклеиновой кислоты, которая приведена в SEQ ID No 4. Другой объект настоящего изобретения представляет собой выделенную очисткой, выделенную или рекомбинантную нуклеиновую кислоту, включающую нуклеотидную последовательность SEQ IDNo 4, комплементарные ей последовательности, а также аллельные варианты, и ее фрагменты. Кроме того, предпочтительные полинуклеотиды настоящего изобретения включают выделенные очисткой, выделенные или рекомбинантные кДНК CanIon, состоящие, в основном состоящие из или включающие последовательность SEQ ID No 4. Особенно предпочтительные нуклеиновые кислоты настоящего изобретения включают выделенные, выделенные очисткой или рекомбинантные полинуклеотиды, включающие непрерывный участок последовательности, по меньшей мере, из 12, 15, 18, 20, 25, 30, 35, 40, 50,60, 70, 80, 90, 100, 150, 200, 500, 1000, 2000, 3000, 4000, 5000 или 6000 нуклеотидов из SEQ ID No 4 или из ее комплементов. В предпочтительных вариантах осуществления настоящего изобретения указанный непрерывный участок последовательности включает связанный с CanIon двуаллельный маркер; предпочтительно избранный из группы, состоящей из А 12 или А 16. К настоящему изобретению относится также выделенная очисткой или выделенная нуклеиновая кислота, включающая полинуклеотид, обладающий по меньшей мере 95% нуклеотидной идентичностью с полинуклеотидом SEQ ID No 4, преимущественно 99% нуклеотидной идентичностью, предпочтительно 99,5% нуклеотидной идентичностью и наиболее предпочтительно 99,8% нуклеотидной идентичностью с полинуклеотидом SEQ ID No 4, или комплементарная ей последовательность или ее биологически активный фрагмент. Другая цель настоящего изобретения имеет отношение к выделенным очисткой, выделенным или рекомбинантным нуклеиновым кислотам, включающим полинуклеотид, который гибридизуется в сформулированных в данном описании жестких условиях гибридизации с полинуклеотидом SEQ ID No 4, или с комплементарной ему последовательностью или с его вариантом, или с его биологически активным- 14008252 фрагментом. Дополнительная цель настоящего изобретения имеет отношение к выделенному, выделенному очисткой или рекомбинантному полинуклеотиду, который кодирует CanIon-полипептид, включающий непрерывный участок последовательности по меньшей мере из 6 аминокислот SEQ ID No 5, в котором указанный непрерывный участок последовательности включает, по меньшей мере, 1, 2, 3, 5 или 10 аминокислотных позиций 277, 338, 574, 678, 680, 683, 691, 692, 695, 696, 697, 894, 1480, 1481, 1483, 1484, 1485,1630, 1631, 1632, 1636, 1660, 1667, 1707, 1709 SEQ ID No 5. Включен также выделенный, выделенный очисткой или рекомбинантный полинуклеотид, который кодирует CanIon-полипептид, включающий аминокислотную последовательность SEQ ID No 5, или производные или ее биологически активные фрагменты, а также выделенный, выделенный очисткой или рекомбинантный полинуклеотид, который кодирует CanIon-полипептид, идентичный по меньшей мере на 80, 85, 90, 95, 98, 99, 99,5 или 99% аминокислотной последовательности SEQ ID No 5. кДНК SEQ ID No 4 включает 5'-UTR-область, начинающуюся от нуклеотида в положении 1 и заканчивающуюся нуклеотидом в положении 65 SEQ ID No 4. кДНК из SEQ ID No кДНК включает 3'UTR-область, начинающуюся от нуклеотида в положении 5283 и заканчивающуюся нуклеотидом в положении 6799 SEQ ID No 4. Следовательно, в настоящем изобретении рассматривается выделенная очисткой, выделенная или рекомбинантная нуклеиновая кислота, включающая нуклеотидную последовательность 5'UTR из кДНКCanIon, комплементарную ей последовательность, или ее аллельный вариант. В настоящем изобретении рассматривается также выделенная очисткой, выделенная или рекомбинантная нуклеиновая кислота,включающая нуклеотидную последовательность 3'UTR из кДНК CanIon, комплементарную ей последовательность, или ее аллельный вариант. Хотя данный раздел называется "кДНК-последовательности CanIon", следует иметь ввиду, что нуклеотидные фрагменты любого размера и последовательность могут быть также включены в полинуклеотиды, описанные в данном разделе, фланкируя геномные последовательности CanIon на любой стороне или между двумя или несколькими такими геномными последовательностями. Кодирующие области Открытая рамка считывания CanIon содержится в соответствующей мРНК из SEQ ID No кДНК. Точнее, эффективная CanIon-кодирующая последовательность (CDS) включает область между нуклеотидной позицией 66 (первый нуклеотид ATG-кодона) и нуклеотидной позицией 5282 (концевой нуклеотид TGA-кодона) из SEQ ID No 4. Настоящее изобретение включает также выделенные, выделенные очисткой и рекомбинантные полинуклеотиды, которые кодируют полипептиды, включающие непрерывный участок последовательности по меньшей мере из 6 аминокислот, предпочтительно по меньшей мере 8 или 10 аминокислот, более предпочтительно по меньшей мере 12, 15, 20, 25, 30, 40, 50, 100, 200, 300,400, 500, 700 или 1000 аминокислот SEQ ID No 5. Раскрытый выше полинуклеотид, который содержит кодирующую последовательность CanIon-гена,может экспрессироваться в требуемой клетке-хозяине или в требуемом организме-хозяине, если данный полинуклеотид поместить под контроль соответствующих экспрессионных сигналов. Экспрессионные сигналы могут представлять собой или экспрессионные сигналы, содержащиеся в регуляторных районахCanIon-гена настоящего изобретения, или в противоположность сигналы могут представлять собой экзогенные регуляторные последовательности нуклеиновых кислот. Такой полинуклеотид, помещенный под соответствующие экспрессионные сигналы, можно также встроить в вектор для его экспрессии и/или амплификации. Регуляторные CanIon-последовательности Как отмечено, геномная последовательность CanIon-гена содержит регуляторные последовательности как в некодирующей 5'-фланкирующей области, так и в некодирующей 3'-фланкирующей области,которые ограничивают CanIon-кодирующую область, содержащую 44 экзона данного гена. Полинуклеотиды, полученные из 5'- и 3'-регуляторных областей, пригодны для того, чтобы выявить наличие, по меньшей мере, копии нуклеотидной последовательности CanIon или ее фрагмента в тестируемом образце. Промоторную активность 5'-регуляторных областей, содержащихся в CanIon, можно оценить, как описано ниже. Для того чтобы идентифицировать релевантные биологически активные полинуклеотидные фрагменты или варианты SEQ ID No 1, специалистов в данной области техники можно отослать кSambrook и соавт., 1989, которые описывают использование рекомбинантного вектора, несущего маркерный ген (т.е. бета-галактозидазу, хлорамфениколацетилтрансферазу и т.п.), экспрессию которого можно обнаружить при помещении его под контроль биологически активных полинуклеотидных фрагментов или вариантов SEQ ID No 1. Геномные последовательности, локализованные "левее" первого экзона CanIon-гена, клонируют в соответствующий промоторный репортерный вектор, такие как доступные от Clontech Промоторные репортерные векторы pSEAP-Basic, pSEAP-Enhancer, pgal-Basic, pgalEnhancer или pEGFP1, или беспромоторный репортерный вектор гена люциферазы от Promega pGL2basic или pGL3-basic. Вкратце, каждый из этих промоторных репортерных векторов включает множество сайтов клонирования, позиционированных "левее" репортерного гена, кодирующего легко поддающийся- 15008252 анализу белок, такой как секретируемая щелочная фосфатаза, люцифераза, -галактозидаза или зеленый флуоресцентный белок. Последовательности, расположенные "левее" от кодирующей CanIon-области, встраивают в сайты клонирования "левее" данного репортерного гена в обоих ориентациях и вводят в соответствующую клетку-хозяина. Анализируют уровень репортерного белка и сравнивают с уровнем, полученным для вектора, у которого отсутствует вставка в сайт клонирования. Наличие повышенного уровня экспрессии в векторе, содержащем вставку, по сравнению с уровнем для контрольного вектора, свидетельствует о наличии промотора в данной вставке. При необходимости расположенные слева последовательности могут быть клонированы в векторы, которые содержат энхансер для увеличения уровней транскрипции под слабыми промоторными последовательностями. Существенный уровень повышенной экспрессии,которая наблюдается для вектора, не имеющего вставки, свидетельствует о том, что промоторная последовательность присутствует во встроенной слева последовательности. Промоторную последовательность, расположенную "левее" геномной ДНК, можно также определить путем создания сгруппированных 5' и/или 3' делеций в расположенной слева ДНК с использованием традиционных методик, таких как обработка экзонуклеазой III или обработка соответствующей эндонуклеазой рестрикции. Полученные делеционные фрагменты можно встроить в данный промоторный репортерный вектор, чтобы определить, действительно ли данная делеция снижает или уничтожает промоторную активность, как это описано, например, у Coles и соавт. (1998), раскрытие которой включено в данное описание путем ссылки во всей ее полноте. Таким способом можно определить границы промоторов. При желании можно идентифицировать потенциальные индивидуальные регуляторные сайты внутри промотора с использованием сайт-направленного мутагенеза или линкерного сканирования, которые аннулируют сайты связывания потенциальных транскрипционных факторов внутри промотора,индивидуально или в сочетании. Влияние таких мутаций на уровень транскрипции можно определить путем встраивания мутаций в сайты клонирования промоторных репортерных векторов. Данный вид анализа хорошо известен специалистам в данной области техники и описан в WO 97/17359, патенте США 5374544; ЕР 582796; патенте США 5698389; патенте США 5643746; патенте США 5502176; и патенте США 5266488; раскрытие которых включено в данное описание путем ссылки во всей их полноте. Силу и специфичность промотора CanIon-гена можно оценить через уровни экспрессии детектируемого полинуклеотида, функционально присоединенного к данному CanIon-промотору, в разных типах клеток и тканях. Данный детектируемый полинуклеотид может представлять собой полинуклеотид,который специфически гибридизуется с заранее определенным олигонуклеотидным зондом, или полинуклеотид, кодирующий детектируемый белок, в том числе CanIon-полипептид или фрагмент или его вариант. Данный вид анализа хорошо известен специалистам в данной области техники и описан в патенте США 5502176; и патенте США 5266488; раскрытие которых включено путем ссылки во всей их полноте. Некоторые способы обсуждаются более подробно ниже. Полинуклеотиды, несущие регуляторные элементы, локализованные на 5' или на 3'-конце CanIonкодирующей области, можно преимущественно использовать для контроля транскрипционной и трансляционной активности представляющего интерес гетерологичного полинуклеотида. Таким образом, в настоящем изобретении рассматривается также выделенная очисткой или выделенная нуклеиновая кислота, включающая полинуклеотид, который выбран из группы, состоящей из 5'и 3'-регуляторных областей, или комплементарную ему последовательность, или ее биологически активный фрагмент или вариант. В предпочтительных вариантах осуществления настоящего изобретения "5'регуляторная область" локализована в нуклеотидной последовательности, расположенной между позициями 1 и 2000 SEQ ID No 1. "3'- регуляторная область" локализована в нуклеотидной последовательности, расположенной между позициями 45842 и 47841 SEQ ID No 3. Настоящее изобретение относится также к выделенной очисткой или выделенной нуклеиновой кислоте, включающей полинуклеотид, обладающий, по меньшей мере, 95% нуклеотидной идентичности с полинуклеотидом, выбранным из группы, состоящей из 5' и 3' регуляторных областей, преимущественно 99% нуклеотидной идентичности, предпочтительно 99,5% нуклеотидной идентичности и наиболее предпочтительно 99,8% нуклеотидной идентичности с полинуклеотидом, выбранным из группы, состоящей из 5' и 3' регуляторных областей, или комплементарной ему последовательностью или его вариантом,или его биологически активным фрагментом. Другой объект настоящего изобретения включает выделенные очисткой, выделенные или рекомбинантные нуклеиновые кислоты, включающие полинуклеотид, который гибридизуется в установленных в данном описании жестких условиях гибридизации с полинуклеотидом, выбранным из группы, состоящей из нуклеотидных последовательностей 5' и 3' регуляторных областей, или с комплементарной ему последовательностью или с его вариантом, или с его биологически активным фрагментом. Предпочтительные фрагменты 5'-регуляторной области обладают длиной около 1500 или 1000 нуклеотидов, предпочтительно около 500 нуклеотидов, более предпочтительно около 400 нуклеотидов, еще более предпочтительно около 300 нуклеотидов и наиболее предпочтительно около 200 нуклеотидов. Предпочтительные фрагменты 3'-регуляторной области обладают, по меньшей мере, 50, 100, 150,- 16008252 200, 300 или 400 п.н. в длину."Биологически активные" полинуклеотидные производные SEQ ID Nos 1-3 представляют собой полинуклеотиды, включающие или же состоящие из фрагмента указанного полинуклеотида, который является функционирующим в качестве регуляторной области для экспрессирования рекомбинантного полипептида или рекомбинантного полинуклеотида в рекомбинантной клетке-хозяине. Он должен действовать либо в качестве энхансера, либо как репрессор. Для цели настоящего изобретения нуклеиновая кислота или полинуклеотид являются "функциональными" в качестве регуляторной области для экспрессии рекомбинантного полипептида или рекомбинантного полинуклеотида, если указанный регуляторный полинуклеотид содержит нуклеотидные последовательности, которые содержат информацию о регуляции транскрипции и трансляции, и такие последовательности "функционально связаны" с нуклеотидными последовательностями, которые кодируют требуемый полипептид или требуемый полинуклеотид. Регуляторные полинуклеотиды настоящего изобретения можно получить из нуклеотидной последовательности SEQ ID Nos 1 и 3 путем расщепления с использованием соответствующих ферментов рестрикции, что описано, например, в книге Sambrook и соавт. (1989). Регуляторные полинуклеотиды можно также получить путем обработки SEQ ID Nos 1 и 3 ферментом экзонуклеазой, такой как Ва 131 (Wabiko и соавт., 1986). Такие регуляторные полинуклеотиды можно также получить с помощью химического синтеза нуклеиновых кислот, как описано в другом месте в данном описании. Регуляторные полинуклеотиды, в соответствии с настоящим изобретением, могут представлять собой часть рекомбинантного экспрессионного вектора, который можно использовать для экспрессии кодирующей последовательности в требуемой клетке-хозяине или организме-хозяине. Рекомбинантные экспрессионные векторы, в соответствии с настоящим изобретением, описаны в другом месте настоящего описания. Предпочтительный 5'-регуляторный полинуклеотид настоящего изобретения включает 5'-нетранслируемую область (5'-UTR) кДНК CanIon, или ее биологически активный фрагмент или ее вариант. Предпочтительный 3'-регуляторный полинуклеотид настоящего изобретения включает 3'-нетранслируемую область (3'-UTR) кДНК CanIon, или ее биологически активный фрагмент или ее вариант. Дополнительная цель настоящего изобретения включает выделенную очисткой или выделенную нуклеиновую кислоту, включающую: а) нуклеиновую кислоту, включающую регуляторную нуклеотидную последовательность, выбранную из группы, состоящей из:(i) нуклеотидной последовательности, включающей полинуклеотид из 5'-регуляторной области или комплементарную ей последовательность;(ii) нуклеотидной последовательности, включающей полинуклеотид, обладающий по меньшей мере 95% нуклеотидной идентичности с нуклеотидной последовательностью из 5'-регуляторной области или с комплементарной ей последовательностью;(iii) нуклеотидной последовательности, включающей полинуклеотид, который гибридизуется в жестких гибридизационных условиях с нуклеотидной последовательностью из 5'-регуляторной области или с комплементарной ей последовательностью; и(iv) биологически активного фрагмента или варианта полинуклеотидов в (i), (ii) и (iii);b) полинуклеотид, кодирующий требуемый полипептид или представляющую интерес нуклеиновую кислоту, функционально присоединенную к нуклеиновой кислоте, указанной выше в (а);c) факультативно, нуклеиновую кислоту, включающую 3'-регуляторный полинуклеотид, предпочтительно 3'-регуляторный полинуклеотид CanIon-гена. В конкретном варианте осуществления настоящего изобретения указанная выше нуклеиновая кислота отличается тем, что указанная нуклеиновая кислота включает 5'-нетранслируемую область (5'UTR) кДНК CanIon, или ее биологически активный фрагмент или ее вариант. В другом конкретном варианте осуществления настоящего изобретения указанная выше нуклеиновая кислота отличается тем, что указанная нуклеиновая кислота включат 3'-нетранслируемую область (3'UTR) кДНК CanIon, или ее биологически активный фрагмент или ее вариант. Регуляторный полинуклеотид 5'-регуляторной области или его биологически активные фрагменты или варианты, функционально присоединяют по 5'-концу полинуклеотида, кодирующего требуемый полипептид или полинуклеотид. Регуляторный полинуклеотид 3'-регуляторной области, или его биологически активные фрагменты или варианты, преимущественно функционально присоединяют по 3'-концу полинуклеотида, кодирующего требуемый полипептид или полинуклеотид. Требуемый полипептид, кодируемый указанной выше нуклеиновой кислотой, может иметь разную природу или происхождение, включая белки прокариотического или эукариотического происхождения. Полипептиды, экспрессируемые под контролем CanIon-регуляторной области, включают антигены бактерий, грибов или вирусов. Включены также эукариотические белки, такие как внутриклеточные белки,подобные белки "домашнего хозяйства", связанные с мембраной белки, подобные рецепторам, и секретируемые белки, подобные эндогенным медиаторам, таким как цитокины. Требуемый белок может бытьCanIon-белком, в частности, белком с аминокислотной последовательностью SEQ ID No 5, или фрагментом или его вариантом. Требуемые нуклеиновые кислоты, кодируемые указанным выше полинуклеотидом, обычно РНКмолекулой, могут быть комплементарны требуемому кодирующему полинуклеотиду, например, CanIonкодирующей последовательности, и таким образом использоваться в качестве антисмыслового полинуклеотида. Такой полинуклеотид может включаться в рекомбинантный экспрессионный вектор, чтобы экспрессировать требуемый полипептид или требуемую нуклеиновую кислоту в клетке-хозяине или в организме-хозяине. Соответствующие рекомбинантные векторы, которые содержит полинуклеотид, такой как описано в данном описании, рассматриваются в другом месте настоящего описания. Полинуклеотидные конструкции Термины "полинуклеотидная конструкция" и "рекомбинантный полинуклеотид", используемые в данном описании взаимозаменяемо, относятся к линейным или кольцевым, выделенным очисткой или выделенным полинуклеотидам, которые были искусственно созданы и которые включают, по меньшей мере, две нуклеотидные последовательности, которые не обнаруживаются в виде непрерывных нуклеотидных последовательностей в их исходном природном окружении. ДНК-конструкция, которая обеспечивает прямую временную и пространственную экспрессиюCanIon-гена в рекомбинантных клетках-хозяевах и в трансгенных животных Для того чтобы исследовать физиологические и фенотипические последствия отсутствия синтезаCanIon-белка, как на клеточном уровне, так и на уровне мультиклеточного организма, в настоящее изобретение включены также ДНК-конструкции и рекомбинантные векторы, обеспечивающие обусловленную экспрессию конкретного аллеля CanIon-геномной последовательности или кДНК, а также копии данной геномной последовательности или кДНК, содержащие замены, делеции или добавки из одного или более оснований, что касается CanIon-нуклеотидной последовательности SEQ ID Nos 1-4, или ее фрагмента, причем данные замены, делеции или добавки оснований локализованы в экзоне, интроне или регуляторной последовательности, но предпочтительно в 5'-регуляторной последовательности или в экзоне CanIon-геномной последовательности, или в CanIon-кДНК SEQ ID No 4. В предпочтительном варианте осуществления CanIon-последовательность включает двуаллельный маркер настоящего изобретения. В предпочтительном варианте осуществления настоящего изобретения CanIon-последовательность включает двуаллельный маркер настоящего изобретения, предпочтительно один из двуаллельных маркеров А 1-А 17. Настоящее изобретение содержит рекомбинантные векторы, включающие любой один из полинуклеотидов, описанных в настоящем изобретении. В частности, полинуклеотидные конструкции, в соответствии с настоящим изобретением, могут включать любой из полинуклеотидов, описанных в разделе"Кодирующие Области" и в разделе "Олигонуклеотидные Зонды и Праймеры". Первую предпочтительную ДНК-конструкцию создают на основе оперона устойчивости к тетрациклину tet из транспозона Tn10 E. coli для контроля экспрессии CanIon-гена так, как описано у Gossen и соавт. (1992, 1995) и у Furth и соавт. (1994). Такая ДНК-конструкция содержит семь tet-операторных последовательностей из Tn10 (tetop), которые сливаются с минимальным промотором или с 5'регуляторной последовательностью CanIon-гена, причем указанный минимальный промотор или указанную CanIon-регуляторную последовательность функционально присоединяют к представляющему интерес полинуклеотиду, который кодирует смысловой или антисмысловой олигонуклеотид или полипептид,включая CanIon-полипептид или его пептидный фрагмент. Данная ДНК-конструкция является функциональной в качестве условной экспрессионной системы представляющей интерес нуклеотидной последовательности, где одна и та же клетка включает нуклеотидную последовательность, кодирующую репрессор дикого типа (tTA) или мутантный (rТА) репрессор, слитый с активирующим доменом вирусного белка VP16 из вируса простого герпеса, помещенного под контроль промотора, такого как HCMVIE1 энхансер/промотор или MMTV-LTR. Фактически предпочтительная ДНК-конструкция настоящего изобретения включает как полинуклеотид, содержащий tet-операторную последовательность, так и полинуклеотид, содержащий последовательность, кодирующую репрессор tTA или rТА. В конкретном варианте осуществлении настоящего изобретения условная экспрессионная ДНКконструкция содержит последовательность, кодирующую мутантный тетрациклиновый репрессор rТА,причем экспрессия представляющего интерес полинуклеотида является молчащей в отсутствие тетрациклина и индуцируется в его присутствии. ДНК-конструкции, обеспечивающие гомологичную рекомбинацию: замещающие векторы Вторая предпочтительная ДНК-конструкция включает, от 5'-конца до 3'-конца: (а) первую нуклеотидную последовательность, которая включена в CanIon-геномную последовательность; (b) нуклеотидную последовательность, включающую позитивный селективный маркер, такой как маркер устойчивости к неомицину (nео); и (с) вторую нуклеотидную последовательность, которая включена в CanIonгеномную последовательность и локализована в геноме справа от первой CanIon-нуклеотидной последовательности (а).- 18008252 В предпочтительном варианте осуществления настоящего изобретения данная ДНК-конструкция включает также негативный селективный маркер, расположенный слева от нуклеотидной последовательности (а) или справа от нуклеотидной последовательности (с). Предпочтительно, если негативный селективный маркер включает ген тимидинкиназы (tk) (Thomas и соавт., 1986), ген бета-гигромицина (ТеRicle и соавт., 1990), hprt-ген (Van der Lught и соавт., 1991; Reid и соавт., 1990) или фрагмент гена дифтерийного токсина A (Dt-A) (Nada и соавт., 1993; Yagi и соавт., 1990). Предпочтительно, если позитивный селективный маркер локализован в экзоне CanIon-последовательности так, что разрывает данную последовательность, кодирующую CanIon-белок. Данные замещающие векторы описаны, например, у Thomas и соавт. (1986; 1987), Mansour и соавт. (1988) и у Koller и соавт. (1992). Безразлично где расположить первую и вторую нуклеотидные последовательности (а) и (с) - в CanIonрегуляторной последовательности, в интронной последовательности, в экзонной последовательности или в последовательности, содержащей и регуляторную и/или интронную и/или экзонную последовательности. Размер нуклеотидных последовательностей (а) и (с) колеблется от 1 до 50 т.п.н., предпочтительно от 1 до 10 т.п.н., более предпочтительно от 2 до 6 т.п.н. и наиболее предпочтительно от 2 до 4 т.п.н. ДНК-конструкции, обеспечивающие гомологичную рекомбинацию: Cre-LoxP-система Такие новые ДНК-конструкции используют в сайт-специфичной рекомбинационной системе фага Р 1. Фаг Р 1 обладает рекомбиназой, именуемой Сrе, которая специфически взаимодействует с 34 парами нуклеотидов loxP-байта. Данный loxP-сайт составлен из двух палиндромных последовательностей из 13 п.н., разделенных 8 п.н. консервативной последовательности (Hoess и соавт., 1986). Рекомбинация между двумя loxP-сайтами, обладающими идентичной ориентацией, с помощью Cre-фермента приводила к удалению ДНК-фрагмента.Cre-loxP-система, используемая в сочетании с методом гомологичной рекомбинации, впервые была описана Gu и соавт. (1993, 1994). Вкратце, представляющую интерес нуклеотидную последовательность встраивают в намеченное место генома, содержащего по меньшей мере два loxP-сайта в одной и той же ориентации и расположенных на соответствующих концах нуклеотидной последовательности, которую вырезают из данного рекомбинантного генома. Данное экцизионное событие требует присутствия в ядре рекомбинантной клетки-хозяина фермента рекомбиназы (Сrе). Фермент рекомбиназу можно внести в нужное время либо с помощью (а) инкубации данных рекомбинантных клеток-хозяев в культуральный среде, содержащей данный фермент, с помощью инъекции Cre-фермента прямо в нужную клетку так, как описано у Araki и соавт. (1995), или путем введения данного фермента в клетки-хозяева с помощью липосом так, как описано у Baubonies и соавт. (1993); (b) трансфекции клетки-хозяина с помощью вектора,включающего Сrе-кодирующую последовательность, функционально присоединенную к функциональному в данной рекобинантной клетке-хозяине промотору, который необязательно является индуцируемым, причем указанный вектор внедряют в данную рекомбинантную клетку-хозяина так, как описано уGu и соавт. (1993) и у Sauer и соавт. (1988); (с) введения в геном клетки-хозяина полинуклеотида, включающего Сrе-кодирующую последовательность, функционально присоединенную к функциональному в данной рекомбинантной клетке-хозяине промотору, который необязательно является индуцируемым, а указанный полинуклеотид встраивается в геном клетки-хозяина либо в результате случайного встраивания, либо в результате гомологичной рекомбинации так, как описано у Gu и соавт. (1994). В конкретном варианте осуществления настоящего изобретения векторную последовательность,содержащую последовательность, которую встраивают в CanIon-ген с помощью гомологичной рекомбинации, конструируют таким образом, чтобы селективные маркеры фланкировались бы loxP-сайтами в одной и той же ориентации в результате обработки Cre-ферментом возможно было осуществить удаление селективных маркеров, оставляя представляющие интерес CanIon-последовательности, которые были встроены с помощью гомологичной рекомбинации. Снова необходимы два селективных маркера: позитивный селективный маркер - для отбора по рекомбинационному событию, и негативный селективный маркер - для отбора по событию гомологичной рекомбинации. Векторы и способы с использованием CreloxP-системы описываются у Zou и соавт. (1994). В соответствии с этим третья предпочтительная ДНК-конструкция настоящего изобретения включает,от 5'-конца до 3'-конца: (а) первую нуклеотидную последовательность, которая включается в CanIonгеномную последовательность; (b) нуклеотидную последовательность, включающую полинуклеотид,кодирующий позитивный селективный маркер, причем указанная нуклеотидная последовательность дополнительно включает две последовательности, определяющие сайт, узнаваемый рекомбиназой, такой как loxP-сайт, и данные два сайта размещаются в той же самой ориентации; и (с) вторую нуклеотидную последовательность, которая включается в CanIon-геномную последовательность и локализуется в данном геноме справа от первой CanIon-нуклеотидной последовательности (а). Последовательности, определяющие сайт, узнаваемый рекомбиназой, такой как loxP-сайт, предпочтительно расположены в нуклеотидной последовательности (b) в соответствующих местах, граничащих с нуклеотидной последовательностью, которую необходимо вырезать. В одном из конкретных вариантов осуществления настоящего изобретения два loxP-сайта расположены с каждой стороны последовательности позитивного селективного маркера для того, чтобы обеспечить ее вырезание в нужное время после проявления события гомологичной рекомбинации.- 19008252 В предпочтительном варианте осуществления способа с использованием описанной выше третьей ДНК-конструкции, вырезание полинуклеотидного фрагмента, ограниченного двумя сайтами, узнаваемыми рекомбиназой, предпочтительно двумя lохР-сайтами, осуществляют в нужный момент, обусловленный наличием в геноме рекомбинантной клетки-хозяина последовательности, кодирующей Creфермент, функционально присоединенный к промоторной последовательности, предпочтительно индуцируемому промотору, более предпочтительно к тканеспецифичной промоторной последовательности и наиболее предпочтительно к промоторной последовательности, которая одновременно является и индуцируемой, и тканеспецифичной, как это описано у Gu и соавт. (1994). Наличие Cre-фермента в геноме рекомбинантной клетки-хозяина может явиться следствием скрещивания двух трансгенных животных, где первое трансгенное животное несет представляющую интерес созданную CanIon-последовательность, содержащую описанные выше loxP-сайты, а второе трансгенное животное несет Сrе-кодирующую последовательность, функционально присоединенную к соответствующей промоторной последовательности, так как это описано у Gu и соавт. (1994). Пространственно-временной контроль экспрессии Сrе-фермента можно также осуществить на основе аденовирусного вектора, который содержит Cre-ген, обеспечивая тем самым заражение клеток илиin vivo заражение органов, для доставки Cre-фермента, так как это описано у Anton and Graham (1995) и уKanegae и соавт. (1995). Описанные выше ДНК-конструкции можно использовать для введения требуемой нуклеотидной последовательности настоящего изобретения, предпочтительно CanIon-геномной последовательности или кДНК-последовательности CanIon, но более предпочтительно - для введения измененной копии геномной или кДНК-последовательности CanIon, в заранее определенное местоположение целевого генома, приводящее либо к образованию измененной копии целевого гена (нокаутная гомологичная рекомбинация), либо к замене копии целевого гена другой копией, достаточно гомологичной, чтобы обеспечить прохождение гомологичной рекомбинации (гомологичная рекомбинация с вбиванием). В конкретном варианте осуществления настоящего изобретения описанные выше ДНК-конструкции могут использоваться для встраивания CanIon-геномной последовательности или кДНК-последовательности CanIon,включающей по меньшей мере один двуаллельный маркер настоящего изобретения, предпочтительно по меньшей мере один двуаллельный маркер, выбранный из группы, состоящей из А 1-А 17. Ядерные антисмысловые ДНК-конструкции Другие композиции содержат вектор настоящего изобретения, включающий олигонуклеотидный фрагмент нуклеотидной последовательности SEQ ID No 4, предпочтительно фрагмент, включающий старт-кодон CanIon-гена, в качестве антисмыслового средства, которое подавляет экспрессию соответствующего CanIon-гена. Предпочтительные способы с использованием антисмыслового полинуклеотида, в соответствии с настоящим изобретением, представлены методиками, описанными у Sczakiel и соавт. (1995) или методиками, описанными в РСТ-заявкеWO 95/24223, раскрытие которых включено в данное описание путем ссылки во всей их полноте. Предпочтительно, антисмысловые средства выбраны среди полинуклеотидов (длиной 15-200 п.н.),которые комплементарны 5'-концу мРНК CanIon. В одном из вариантов осуществления настоящего изобретения используется сочетание различных антисмысловых полинуклеотидов, комплементарных разным частям требуемого целевого гена. Предпочтительные антисмысловые полинуклеотиды, в соответствии с настоящим изобретением,комплементарны последовательности многих мРНК CanIon, которые содержат либо кодон инициации трансляции ATG, либо сайт сплайсинга. Кроме того, предпочтительные антисмысловые полинуклеотиды, в соответствии с настоящим изобретением, комплементарны сайта сплайсинга мРНК CanIon. Предпочтительно, если антисмысловые полинуклеотиды настоящего изобретения обладают 3'-сигналом полиаденилирования, который заменен саморасщепляющейся рибозимной последовательностью так, чтобы транскрипты РНК-полимеразы II получались без поли(А) на их 3'-концах, причем эти антисмысловые полинуклеотиды оказываются неспособными выйти из ядра, что описано у Liu и соавт.(1994). В предпочтительном варианте осуществления настоящего изобретения эти CanIon-антисмысловые полинуклеотиды включают также, в рибозимной кассете, гистоновую шпилечную структуру, которая стабилизирует расщепляемые транскрипты от 3'-5'-экзонуклеолитической деградации, такая структура описана у Eckner и соавт. (1991). Олигонуклеотидные зонды и праймеры Полинуклеотиды, полученные из CanIon-гена, пригодны для выявления присутствия в тестируемом образце, по меньшей мере, копии нуклеотидной последовательности SEQ ID Nos 1-4 и 6, или ее фрагмента, комплемента, или варианта. Особенно предпочтительные зонды и праймеры настоящего изобретения включают выделенные,выделенные очисткой или рекомбинантные полинуклеотиды, включающие непрерывный участок последовательности по меньшей мере из 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500, 1000,2000, 5000, 10000 или 20000 нуклеотидов SEQ ID Nos 1-3 или их комплементов. Кроме того, предпочтительные зонды и праймеры настоящего изобретения включают выделенные, выделенные очисткой или- 20008252 рекомбинантные полинуклеотиды, в которых указанный непрерывный участок последовательности включает двуаллельный маркер, выбранный из группы, состоящей из А 1-А 17. Другая цель настоящего изобретения заключается в получении выделенной очисткой, выделенной или рекомбинантной нуклеиновой кислоты, включающей нуклеотидную последовательность SEQ ID No 4, комплементарные ей последовательности, а также аллельные варианты и их фрагменты. Кроме того,предпочтительные зонды и праймеры настоящего изобретения включают выделенную очисткой, выделенную или рекомбинантную CanIon-кДНК, состоящую из, фактически состоящую из или включающую последовательность SEQ ID No 4. Особенно предпочтительные зонды и праймеры настоящего изобретения включают выделенные, выделенные очисткой или рекомбинантные полинуклеотиды, включающие непрерывный участок последовательности по меньшей мере из 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80,90, 100, 150, 200, 500, 1000, 2000, 3000, 4000, 5000 или 6000 нуклеотидов SEQ ID No 4 или их комплементов. Кроме того, предпочтительные зонды и праймеры настоящего изобретения включают выделенные, выделенные очисткой или рекомбинантные полинуклеотиды, включающие непрерывный участок последовательности по меньшей мере из 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500,1000, 2000, 3000, 4000, 5000 или 6000 нуклеотидов SEQ ID No 4 или их комплементов, где указанный непрерывный участок последовательности включает двуаллельный маркер, выбранный из группы, состоящей из А 12 и А 16. В дополнительных вариантах осуществления настоящего изобретения зонды и праймеры настоящего изобретения включают выделенные, выделенные очисткой или рекомбинантные полинуклеотиды,включающие непрерывный участок последовательности по меньшей мере из 12, 15, 18, 20, 25, 30, 35, 40,50, 60, 70, 80, 90, 100, 150, 200, 300 или 400 нуклеотидов SEQ ID No 6 или их комплементов. В предпочтительных вариантах осуществления настоящего изобретения указанный непрерывный участок последовательности SEQ ID No 6 включает двуаллельный маркер А 18. Таким образом, настоящее изобретение относится также к зондам нуклеиновых кислот, отличающимся тем, что они специфически гибридизуются в описанных выше жестких условиях с нуклеиновой кислотой, выбранной из группы, состоящей из CanIon-нуклеотидных последовательностей SEQ ID No 13 человека, ее вариантов или последовательности, комплементарной ей. В одном из вариантов осуществления настоящего изобретения включены выделенные, выделенные очисткой и рекомбинантные полинуклеотиды, состоящие или в основном состоящие из непрерывного участка последовательности из 8-50 нуклеотидов какой-либо одной SEQ ID Nos 1-4 или 6, или его комплементов, где указанный участок включает связанный с CanIon двуаллельный маркер в указанной последовательности; где необязательно указанный связанный с CanIon двуаллельный маркер выбран из группы, состоящей из А 1-А 18, и ее комплементов, или, необязательно, данные двуаллельные маркеры сцеплены при нарушении равновесия. Где, необязательно, указанный участок составляет в длину 18-35 нуклеотидов, а указанный двуаллельный маркер находится в пределах 4 нуклеотидов от центра указанного полинуклеотида; где необязательно указанный полинуклеотид состоит из указанного непрерывного участка последовательности и указанный непрерывный участок последовательности составляет 25 нуклеотидов в длину, а указанный двуаллельный маркер находится в центре указанного полинуклеотида; где необязательно 3'-конец указанного участка непрерывной последовательности представлен на 3'-конце указанного полинуклеотида; и где необязательно 3'-конец указанного непрерывного участка последовательности расположен на 3'-конце указанного полинуклеотида, а указанный двуаллельный маркер представлен на 3'-конце указанного полинуклеотида. В предпочтительном варианте осуществления настоящего изобретения указанные зонды включают, состоят или в основном состоят из последовательности,выбранной из следующих последовательностей: Р 1-Р 18 и комплементарных им последовательностей. В другом варианте осуществления настоящее изобретение включает в себя выделенные, выделенные очисткой и рекомбинантные полинуклеотиды, включающие, состоящие, в основном состоящие из непрерывного участка последовательности 8-50 нуклеотидов SEQ ID Nos 1-4, или их комплементов, где 3'-конец указанного непрерывного участка последовательности расположен на 3'-конце указанного полинуклеотида, и где 3'-конец указанного полинуклеотида расположен в пределах 20 нуклеотидов слева от связанного с CanIon двуаллельного маркера в указанной последовательности; где, необязательно, указанный двуаллельный маркер, связанный с CanIon, выбран из группы, состоящей из А 1-А 18, и их комплементов, или необязательно двуаллельные маркеры, к тому же, сцеплены при нарушении равновесия; где необязательно 3'-конец указанного полинуклеотида расположен в указанной последовательности 1 нуклеотидом "левее" от указанного двуаллельного маркера, связанного с CanIon; и где, необязательно,указанный полинуклеотид состоит, в основном, из последовательности, выбранной из следующих последовательностей: D1-D18 и Е 1-Е 18. Еще в одном варианте осуществления настоящее изобретение включает в себя выделенные, выделенные очисткой или рекомбинантные полинуклеотиды, включающие, состоящие, в основном состоящие, из последовательности, выбранной из следующих последовательностей: В 1-В 17 и С 1-С 17. В дополнительном варианте осуществления настоящее изобретение включает в себя полинуклеотиды, используемые в гибридизационном анализе, секвенирующем анализе и в анализе ферментного выявления дефекта комплементарного спаривания для определения нуклеотидной идентичности двуаллель- 21008252 ного маркера, связанного с CanIon, в SEQ ID Nos 1-4 и 6 или в их комплементах, а также полинуклеотиды, используемые для амплификации нуклеотидных сегментов, включающих двуаллельный маркер, связанный с CanIon, в SEQ ID Nos 1-4 и 6 или в их комплементах; где, необязательно, указанный двуаллельный маркер, связанный с CanIon, выбран из группы, состоящей из А 1-А 18 и их комплементов, или необязательно двуаллельные маркеры сцеплены к тому же при нарушении равновесия. В настоящем изобретении рассматривается использование полинуклеотидов, в соответствии с настоящим изобретением, для определения нуклеотидной идентичности двуаллельного маркера, связанного с CanIon, предпочтительно в гибридизационном анализе, секвенирующем анализе, микросеквенирующем анализе или методом ферментного выявления дефекта комплементарного спаривания и амплификацией нуклеотидных сегментов, включающих двуаллельный маркер, связанный с CanIon. Зонд или праймер, в соответствии с настоящим изобретением, обладает около 8-1000 нуклеотидов в длину или задан по крайней мере 12, 15, 18, 20, 25, 35, 40, 50, 60, 70, 80, 100, 250, 500 или 1000 нуклеотидами в длину. Более предпочтительно, длина таких зондов и праймеров может колебаться от 8, 10, 15, 20 или 30-100 нуклеотидов, предпочтительно от 10 до 50, более предпочтительно от 15 до 30 нуклеотидов. У коротких зондов и праймеров обычно недостаточно специфичности для целевой последовательности нуклеиновой кислоты и, как правило, нужны пониженные температуры для образования достаточно стабильных гибридных комплексов с матрицей. Более длинные зонды и праймеры являются дорогостоящими в изготовлении и могут иногда самогибридизоваться с образованием шпилечных структур. Надлежащую длину для праймеров и зондов под конкретный комплекс аналитических условий может эмпирически определить специалист в данной области техники. Предпочтительный зонд или праймер состоит из нуклеиновой кислоты, включающей полинуклеотид, выбранный из группы нуклеотидных последовательностей Р 1-Р 18 и их комплементарных последовательностей, В 1-В 17, С 1-С 17, D1-D18, Е 1 Е 18, для которых соответственные местоположения в списке последовательностей представлены в табл. 1, 2 и 3. Образование стабильных гибридов зависит от температуры плавления (Тm) ДНК. Тm зависит от длины праймера или зонда, ионной силы данного раствора и содержания G+C. Чем выше содержаниеG+C праймера или зонда, тем выше температура плавления, потому что G:C пары удерживаются тремя Н-связями, тогда как А:Т пары удерживаются только двумя такими связями. GC-содержание в зондах настоящего изобретения, как правило, колеблется между 10 и 75%, предпочтительно между 35 и 60%, и наиболее предпочтительно между 40 и 55%. Праймеры и зонды можно изготовить любым подходящим способом, включая, например, клонирование и рестрикцию соответствующих последовательностей, а также способом прямого химического синтеза, например, таким как фосфодиэфирный способ Narang и соавт. (1979), фосфодиэфирный способBrown и соавт. (1979), диэтилфосфоамидитный способ Beaucage и соавт. (1981) и твердофазный способ,описанный в ЕР 0707592. Зонды для детекции представляют собой, как правило, последовательности нуклеиновых кислот или незаряженные аналоги нуклеиновых кислот, такие, например, как пептидонуклеиновые кислоты,которые раскрыты в международной патентной заявке WO 92/20702, морфолиновые аналоги, которые описаны в патентах США 5185444; 5034506 и 5142047. Зонд может оказаться "не удлиняемым", поскольку дополнительные dNTP невозможно добавить к данному зонду. Внутри себя аналоги, как правило, не удлиняемы, и зонды нуклеиновых кислот могут оказываться неудлиняемыми из-за модификации 3'-конца данного зонда, так что гидроксильная группа уже не способна участвовать в элонгации. Например, 3'-конец данного зонда может быть функционализирован захватом или детекцией метки, чтобы таким образом истратить или иначе блокировать данную гидроксильную группу. С другой стороны, 3'гидроксильная группа может попросту отщепиться, заместиться или модифицироваться, патентная заявка США, порядковый 07/049061, поданная 19 апреля 1993 г., описывает модификации, которые могут использоваться для придания зонду неудлиняемости. Любой полинуклеотид настоящего изобретения можно пометить при желании путем включения любой метки, известной в данной области техники, которая обнаруживается спектроскопическим, фотохимическим, биохимическим, иммунохимическим или химическим способом. Например, используемые метки включают радиоактивные вещества (в том числе, Р 32, S35, Н 3, I125), флуоресцентные красители (в том числе, 5-бромдезоксиуридин, флуоресцеин, ацетиламинофтор, дигоксигенин) или биотин. Предпочтительно, полинуклеотиды метят по их 3'- и 5'-концам. Примеры нерадиоактивного мечения фрагментов нуклеиновых кислот описаны во французском патентеFR-7810975 или у Urdea и соавт. (1988), или уSanchez-Pescador и соавт. (1988). Кроме того, зонды, в соответствии с настоящим изобретением, могут иметь структурные характеристики, которые делают возможным усиление сигнала, причем такими структурными характеристиками являются, например, разветвленные ДНК-зонды, как те, что описаны уUrdea и соавт. (1991) или в европейском патентеЕР 0225807 (Chiron). Метку можно также использовать для захвата данного праймера, с тем, чтобы обеспечить иммобилизацию на твердом носителе либо данного праймера, либо удлиненного продукта, такого как амплифицированная ДНК. Введенная метка присоединяется к праймерам или к зондам и может представлять собой связывающий член, который образует связывающую пару вместе со специфичным связывающим- 22008252 членом твердофазного реагента (например, биотин и стрептавидин). Поэтому, в зависимости от типа метки, переносимой полинуклеотидом или зондом, ее можно использовать для улавливания или для обнаружения ДНК-мишени. Кроме того, следует иметь в виду, что созданные в данном описании полинуклеотиды, праймеры или зонды могут, сами по себе, служить в качестве захватной метки. Например, в том случае, когда связывающий член твердофазного реагента представляет собой последовательность нуклеиновой кислоты, его можно выбрать так, чтобы он связывал комплементарную часть праймера или зонда с тем, чтобы иммобилизовать данный праймер или зонд на данную твердую фазу. В случае если полинуклеотидный зонд сам служит в качестве связывающего члена, специалисты должны знать, что данный зонд будет содержать последовательность или "хвост", который не комплементарен данной мишени. В том случае, если полинуклеотидный праймер сам служит в качестве захватной метки, по меньшей мере, часть данного праймера будет свободна для гибридизации с нуклеиновой кислотой на твердой фазе. Методы меченья ДНК хорошо известны квалифицированным специалистам. Зонды настоящего изобретения пригодны для многих целей. Они могут, в частности, использоваться в Саузерн-гибридизации с геномной ДНК. Зонды могут также использоваться для обнаружения продуктов ПЦР-амплификации. При использовании других методик они могут также использоваться для обнаружения несоответствий в CanIon-гене или мРНК. Они могут также использоваться для обнаружения экспрессии CanIon-гена, например, в Нозерн-блоте. Любой полинуклеотид, праймер или зонд настоящего изобретения можно удобно иммобилизовать на твердый носитель. Твердые носители хорошо известны специалистам в данной области техники и включают стенки лунок реакционной кюветы, пробирки, шарики из полистирола, магнитные шарики,полоски нитроцеллюлозы, мембраны, микрочастицы, такие как латексные частицы, эритроциты барана(или другого животного), duracytes и другие. Твердый носитель не является ключевым и его может выбрать специалист в данной области техники. Таким образом, латексные частицы, микрочастицы, намагниченные и ненамагниченные шарики, мембраны, пластмассовые пробирки, стенки лунок для микротитрования, стеклянное или силиконовое крошево, эритроциты барана (или иных подходящих животных) иduracytes (мозговые оболочки), все, представляют собой подходящие модели. Соответствующие способы иммобилизации нуклеиновых кислот на твердых фазах включают ионное, гидрофобное, ковалентное взаимодействие и т.п. Используемый в данном описании твердый носитель относится к любому нерастворимому материалу, или его можно сделать нерастворимым в последующей реакции. Твердый носитель можно выбрать в соответствии с его способностью притягивать и иммобилизовать захватный реагент. Или же, данная твердая фаза может удерживать дополнительный рецептор, который обладает способностью притягивать и иммобилизовать захватный реагент. Дополнительный рецептор может включать заряженное вещество, которое противоположно заряжено по отношению к собственно захватному реагенту или к заряженному веществу, конъюгированному с данным захватным реагентом. Согласно еще одной альтернативе, рецепторная молекула может представлять собой любой специфический связывающий член, который иммобилизуется на (присоединяется к) твердом носителе, и который обладает способностью иммобилизовать захватный реагент посредством специфичной реакции связывания. Рецепторная молекула делает возможным непрямое связывание захватного реагента с материалом твердого носителя перед осуществлением анализа или в течение осуществления данного анализа. Твердая фаза,таким образом, может быть представлена пластмассой, производными пластмассы, намагниченным или ненамагниченным металлом, стеклянной или силиконовой поверхностью пробирки, лункой для микротитрования, полоской, шариком, микрочастицей, крошкой, эритроцитами барана (или иных подходящих животных), duracytes и другими формами, хорошо известными среднему специалисту в данной области техники. Полинуклеотиды настоящего изобретения можно присоединять или иммобилизовать на твердом носителе индивидуально или группами по меньшей мере из 2, 5, 8, 10, 12, 15, 20 или 25 разных полинуклеотидов настоящего изобретения с единственным твердым носителем. Кроме того, полинуклеотиды, отличающиеся от полинуклеотидов настоящего изобретения, можно присоединять к тому же твердому носителю, к которому присоединены один или несколько полинуклеотидов настоящего изобретения. Следовательно, настоящее изобретение включает также способ для обнаружения присутствующей нуклеиновой кислоты, включающей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID Nos 1-4 и 6, ее фрагмента или варианта, и комплементарную ей последовательность, в образце, причем указанный способ включает следующие стадии:a) приведение в контакт зонда нуклеиновой кислоты или совокупности зондов нуклеиновой кислоты, которые могут гибридизоваться с нуклеотидной последовательностью, включенной в нуклеиновую кислоту, выбранную из группы, состоящей из нуклеотидных последовательностей SEQ ID Nos 1-4 и 6, их фрагмента или варианта, и комплементарную ей последовательность, и анализируемого образца; иb) выявление гибридного комплекса, образованного между зондом и нуклеиновой кислотой данного образца. Кроме того, в настоящем изобретении рассматривается набор для детектирования присутствующей нуклеиновой кислоты, включающий нуклеотидную последовательность, выбранную из группы, состоящей SEQ ID Nos 1-4 и 6, ее фрагмента или варианта, и комплементарную ей последовательность, в образце, причем указанный набор включает:a) зонд нуклеиновой кислоты или множество данных зондов нуклеиновой кислоты, которые могут гибридизоваться с нуклеотидной последовательностью, включенной в нуклеиновую кислоту, выбранную из группы, состоящей из нуклеотидных последовательностей SEQ ID Nos 1-4 и 6, ее фрагмента или варианта, и комплементарной ей последовательности; иb) необязательно, реагенты, необходимые для осуществления реакции гибридизации. В первом предпочтительном варианте осуществления настоящего изобретения данный способ детекции и набор отличаются тем, что указанный зонд нуклеиновой кислоты или множество данных зондов нуклеиновой кислоты метят с помощью детектируемой молекулы. В другом предпочтительном варианте осуществления настоящего изобретения указанный способ и набор отличаются тем, что указанный зонд нуклеиновой кислоты или множество данных зондов нуклеиновой кислоты были иммобилизованы на субстрате. В третьем предпочтительном варианте осуществления настоящего изобретения данный зонд нуклеиновой кислоты или множество данных зондов нуклеиновой кислоты включают либо последовательность, которая выбрана из группы, состоящей из нуклеотидных последовательностей Р 1-Р 18 и комплементарной им последовательности, В 1-В 17, С 1-С 17, D1-D18, Е 1-Е 18, либо двуаллельный маркер,выбранный из группы, состоящей из А 1-А 18 и их комплементов. Олигонуклеотидные наборы Любой субстрат, включающий множество олигонуклеотидных праймеров или зондов настоящего изобретения, может использоваться либо для детекции или амплификации последовательностеймишеней CanIon-гена, либо может также использоваться для детекции мутаций в кодирующих и некодирующих последовательностях CanIon-гена. Любой созданный в данном описании полинуклеотид можно присоединить в области перекрывания или в случайные места данного твердого носителя. Альтернативно, полинуклеотиды настоящего изобретения можно присоединить в виде упорядоченного набора, где каждый полинуклеотид присоединяется к определенной области твердого носителя, которая не перекрывается с участком присоединения любого другого полинуклеотида. Предпочтительно, такой упорядоченный набор полинуклеотидов создают "адресным", где отдельные участки регистрируются и могут быть доступны как часть аналитического метода. Адресные полинуклеотидные наборы обычно включают множество различных олигонуклеотидных зондов, которые связаны с поверхностью субстрата в разных известных местах. Знание точного расположения каждого полинуклеотида делает эти "адресные" наборы особенно пригодными для методов гибридизации. Любая технология адресного набора, известная в данной области техники, может использоваться для полинуклеотидов настоящего изобретения. Один из конкретных вариантов осуществления данных полинуклеотидных наборов известен в качестве Genechips, и в основном описан в патенте США 5143854; публикациях РСТ WO 90/15070 и 92/10092. Данные наборы обычно можно получить с использованием методов автоматизированного синтеза или методов светонаправленного синтеза, которые включают сочетание фотолитографических способов и твердофазного олигонуклеотидного синтеза(Fodor и соавт., 1991). Иммобилизация наборов олигонуклеотидов на твердых носителях представляется возможной благодаря развитию технологии, обычно идентифицируемой как "Very Large Scale Immobilized Polymer Synthesis" (Крупномасштабный синтез иммобилизованного полимера) (VLSIPS), в которой, как правило, зонды иммобилизуются в виде набора с высокой плотностью на твердой поверхности чипа. Примеры технологий VLSIPS представлены в патентах США 5143854; и 5412087, а также в публикациях РСТ WO 90/15070, WO 92/10092 и WO 95/11995, в которых описываются способы создания олигонуклеотидных наборов с помощью таких методов, как методы по светонаправленному синтезу. В разработанных методиках, предназначенных для создания наборов нуклеотидов, иммобилизованных на твердых носителях, дополнительно были разработаны методики представления для приведения в порядок и представления олигонуклеотидных наборов на чипах в попытке извлечь максимальную пользу из паттернов гибридизации и информации о последовательности. Примеры таких методик представления раскрыты в публикациях РСТ WO 94/12305, WO 94/11530, WO 97/29212 и WO 97/31256, раскрытие которых включено путем ссылки во всей их полноте. В другом варианте осуществления олигонуклеотидных наборов настоящего изобретения матрица олигонуклеотидного зонда может преимущественно использоваться для обнаружения мутаций, встречаемых в CanIon-гене и предпочтительно в его регуляторной области. Для этой конкретной цели специально создают зонды, которые обладают нуклеотидной последовательностью, обеспечивающей их гибридизацию с генами, которые несут известные мутации (в результате делеции, вставки или замены одного или нескольких нуклеотидов). Для известных мутаций это означает, что мутации в CanIon-гене были идентифицированы в соответствии, например, с методом, используемым Huang и соавт. (1996) и Samson и соавт. (1996). В другом методе, который используется для обнаружения мутаций в CanIon-гене, используют набор ДНК высокой плотности. Каждый олигонуклеотидный зонд, составляющий единичный элемент набора ДНК высокой плотности, создается для сопоставления специфичной субпоследовательности геномной ДНК или кДНК CanIon. Таким образом, набор, состоящий из олигонуклеотидов, комплементарных субпоследовательностям из последовательности гена-мишени, используют для определения идентичности целевой последовательности с последовательностью природного гена, измерения его количества, обна- 24008252 ружения различий между целевой последовательностью и стандартной последовательностью природного гена из CanIon-гена. Одна такая конструкция, названная 4L-"плиточный" набор (4L tiled array), представляет собой группу из четырех зондов (А, С, G, Т), предпочтительно 15-нуклеотидных олигомеров. В каждой группе из четырех зондов полный комплемент будет гибридизоваться более интенсивно, чем комплементарно несогласованные зонды. Следовательно, целевая нуклеиновая кислота длиной L сканируется по мутациям с помощью "плиточного" набора, содержащего 4L-зонды, причем весь набор зондов содержит все возможные мутации в известной стандартной природной последовательности. Гибридизационные сигналы группы 15-мерного зонда "плиточного" набора нарушаются из-за единственной замены основания в целевой последовательности. Вследствие этого происходит характерная утрата сигнала или"футпринта" для зондов, фланкирующих положение мутации. Данный метод описан Chee и соавт. (1996). Следовательно, в настоящем изобретении рассматривается набор молекул нуклеиновых кислот,включающих, по меньшей мере, один полинуклеотид, описанный выше в качестве зондов и праймеров. Предпочтительно, в настоящем изобретении рассматривается набор нуклеиновой кислоты, включающей,по меньшей мере, два полинуклеотида, описанных выше в качестве зондов и праймеров. Дополнительная цель настоящего изобретения заключается в создании набора последовательностей нуклеиновых кислот, включающих, по меньшей мере, одну из последовательностей, выбранную из группы, состоящей из Р 1-Р 18, В 1-В 17, С 1-С 17, D1-D18, Е 1-Е 18, комплементарных ей последовательностей,ее фрагментов по меньшей мере из 8, 10, 12, 15, 18, 20, 25, 30 или 40 последовательных нуклеотидов либо, по меньшей мере, одну последовательность, включающую двуаллельный маркер, выбранный из группы, состоящей из А 1-А 18, и его комплементов. Настоящее изобретение относится также к набору последовательностей нуклеиновых кислот, включающих либо, по меньшей мере, две последовательности, выбранные из группы, состоящей из Р 1-Р 18,В 1-В 17, С 1-С 17, D1-D18, Е 1-Е 18, комплементарных ей последовательностей, ее фрагмента, по меньшей мере, из 8 последовательных нуклеотидов, либо по меньшей мере две последовательности, включающие двуаллельный маркер, выбранный из группы, состоящей из А 1-А 18, и его комплементов.CanIon-белки и полипептидные фрагменты Термин "CanIon-полипептиды" используется в данном описании для охвата всех белков и полипептидов настоящего изобретения. Кроме того, образующей частью настоящего изобретения являются полипептиды, кодируемые полинуклеотидами настоящего изобретения, а также слитые полипептиды,включающие такие полипептиды. В настоящем изобретении содержатся CanIon-белки людей, включая выделенные или выделенные очисткой CanIon-белки, состоящие, состоящие в основном или включающие последовательность SEQ ID No 5. В настоящем изобретении рассматривается полипептид, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID No 1-4 и 6, комплементарной ей последовательностью или ее фрагментом. В настоящем изобретении содержатся выделенные, выделенные очисткой и рекомбинантные полипептиды, включающие непрерывный участок последовательности по меньшей мере из 6 аминокислот,предпочтительно по меньшей мере 8-10 аминокислот, более предпочтительно по меньшей мере 12, 15,20, 25, 30, 40, 50, 100, 150, 200, 300, 400, 500, 700, 1000, 1200, 1400, 1600 или 1700 аминокислот SEQ IDNo 5. В других предпочтительных вариантах осуществления настоящего изобретения непрерывный участок из аминокислот включает участок с мутацией или функциональной мутацией, включающий делецию, добавку, перестановку, укороченные аминокислоты в белковой последовательности CanIon. В предпочтительных вариантах осуществления настоящего изобретения, настоящее изобретение содержит выделенные, выделенные очисткой и рекомбинантные полипептиды, включающие непрерывный участок последовательности по меньшей мере из 6 аминокислот, предпочтительно, по меньшей мере, 8-10 аминокислот, более предпочтительно по меньшей мере 12, 15, 20, 25, 30, 40, 50, 100, 150, 200,300, 400, 500, 700, 1000, 1200, 1400, 1600 или 1700 аминокислот SEQ ID No 5, где непрерывный участок включает по меньшей мере 1, 2, 3, 5 или 10 аминокислотных позиций 277, 338, 574, 678, 680, 683, 691,692, 695, 696, 697, 894, 1480, 1481, 1483, 1484, 1485, 1630, 1631, 1632, 1636, 1660, 1667, 1707, 1709 из SEQID No 5. Предпочтительно, указанный непрерывный участок SEQ ID No 5 включает остаток Аланина в положении 277; Серин в положении 338; Валин в положении 574; Лейцин в положении 678; Серин в положении 680; Треонин в положении 683; Гистидин в положении 691; Серин в положении 692; Серин в положении 695; Аланин в положении 696; Изолейцин в положении 697; Изолейцин в положении 894; Лизин в положении 1480; Аргинин в положении 1481; Глицин в положении 1483; Валин в положении 14 84; Изолейцин в положении 1485; Аспарагин в положении 1630; Серин в положении 1631; Метионин в положении 1632; Треонин в положении 1636; Аланин в положении 1660; Фенилаланин в положении 1667; Треонин в положении 1707; и/или Аланин в положении 1709. Обеспечены также полинуклеотиды,кодирующие любой из этих полипептидов. Настоящее изобретение включает также в себя выделенные очисткой, выделенные или рекомбинантные полипептиды, включающие аминокислотную последовательность, обладающую, по меньшей мере, 70, 75, 80, 85, 90, 95, 98 или 99% аминокислотной идентичностью с аминокислотной последовательностью SEQ ID No 5 или с ее фрагментом.CanIon-белки предпочтительно выделяют из тканевых образцов человека или млекопитающих или экспрессируют из генов человека или млекопитающих. CanIon-полипептиды настоящего изобретения могут быть получены с использованием стандартных способов экспрессии, известных в данной области техники. Полинуклеотид, кодирующий требуемый полипептид, лигируют в экспрессионный вектор, приемлемый для любого удобного хозяина. Эукариотическая и прокариотическая хозяйская система, та и другая, используются для создания рекомбинантных полипептидов, при этом кратко излагаются некоторые наиболее распространенные системы. Затем полипептид выделяют из лизированных клеток или из культуральной среды и выделяют очисткой до степени, необходимой для его предполагаемого использования. Очистку осуществляют с помощью любого метода, известного в данной области техники, например, дифференциальным экстрагированием, солевым фракционированием, хроматографией, центрифугированием и т.п. См., например, Methods in Enzymology для разнообразных способов по выделению очисткой белков. Кроме того, короткие белковые фрагменты получают химическим синтезом. Альтернативно, белки настоящего изобретения экстрагируют из клеток или тканей людей или животных, не принадлежащих человеческому роду. Способы выделения очисткой белков известны в данной области техники и включают использование детергентов или хаотропных агентов, которые дезинтегрируют (разобщают) частицы, за которым следует дифференциальное экстрагирование и разделение полипептидов с помощью ионообменной хроматографии, хроматографии по сродству, осаждения в соответствии с плотностью и гель-электрофореза. Любая кДНК CanIon, включая SEQ ID No 4, может использоваться для экспрессии CanIon-белков и полипептидов. Нуклеиновую кислоту, кодирующую экспрессируемый CanIon-белок или полипептид,функционально присоединяют к промотору в экспрессионном векторе с использованием традиционной техники клонирования. CanIon-вставка в данный экспрессионный вектор может включать полную кодирующую последовательность для CanIon-белка или его части. Экспрессионный вектор представляет собой любую экспрессионную систему млекопитающего,дрожжей, насекомого или бактерии, известную в данной области техники. Коммерчески доступные векторы и экспрессионные системы можно получить от разных поставщиков, включая Genetics Institute(Cambridge, MA), Stratagene (La Jolla, California), Promega (Madison, Wisconsin) и Invitrogen (San Diego,California). При желании, для усиления экспрессии и обеспечения надлежащей упаковки белка, для конкретного экспрессионного организма, в который интродуцирован экспрессионный вектор, оптимизируют кодоновый фон и спаривание кодонов данной последовательности, в соответствии с разъяснениями Hatfield и соавт., патент США 5082767, раскрытие которого включено в данное описание путем ссылки во всей его полноте. В одном из вариантов осуществления настоящего изобретения полную кодирующую последовательность кДНК CanIon, включая полиА-сигнал кДНК, функционально присоединяют к промотору данного экспрессионного вектора. Альтернативно, если нуклеиновая кислота кодирует часть CanIon-белка, в котором отсутствует метионин, служащий в качестве сайта инициации, инициирующий метионин можно встроить рядом с первым кодоном данной нуклеиновой кислоты с использованием традиционных методов. Также, если в данной вставке из кДНК CanIon отсутствует полиА-сигнал, данную последовательность можно добавить в конструкцию, например, путем вырезания полиА-сигнала из pSG5 (Stratagene) с использованием эндонуклеаз рестрикции BglI и SalI и встраивания в экспрессионный вектор pXT1(Stratagene) млекопитающего. pXT1 содержит LTR и часть gag-гена вируса лейкоза мышей Молони. Положение LTR в данной конструкции делает возможной эффективную стабильную трансфекцию. Данный вектор включает тимидинкиназный промотор вируса простого герпеса и селективный ген неомицина. Нуклеиновую кислоту, кодирующую CanIon-белок или его часть, получают с помощью ПЦР из бактериального вектора, содержащего CanIon-кДНК SEQ ID No 5 с использованием олигонуклеотидных праймеров, комплементарных CanIon-кДНК или ее части и содержащих последовательность для рестрицированной эндонуклеазы PstI, встраиваемую в 5'-праймер, и BglII-последовательность, встраиваемую в 5'конец соответствующего 3'-праймера кДНК, обеспечивая данной последовательности, кодирующей CanIon-белок или его часть, надлежащее расположение относительно полиА-сигнала. Выделенный очисткой фрагмент, полученный в окончательной ПЦР-реакции, расщепляют с помощью PstI, затупляют по концам нуклеазой, расщепляют с помощью BglII, выделяют очисткой и лигируют с ХТ 1, содержащем полиА-сигнал и расщепляют с помощью BglII. Данный лигированный продукт можно трансфицировать в мышиные NIH3 Т 3-клетки с использованием Lipofectin (Life Technologies, Inc., Grand Island, New York) в условиях, вкратце изложенных в описании к данному продукту. Позитивные трансфектанты отбирают после выращивания трансфицированных клеток в 600 ug/мл G418 (Sigma, St. Louis, Missouri). Приведенные выше протоколы можно также использовать для экспрессии мутантного CanIonбелка, ответственного за обнаруживаемый фенотип, или его части. Экспрессированный белок можно выделить очисткой с использованием традиционных методов очистки, таких как осаждение сульфатом аммония или хроматографическим разделением по размеру или заряду. Белок, кодируемый встроенной нуклеиновой кислотой, можно также выделить очисткой с ис- 26008252 пользованием стандартных иммунохроматографических методов. В таких протоколах раствор, такой как клеточный экстракт, содержащий экспрессированный CanIon-белок или его часть, наносят на колонку,содержащую антитела к CanIon-белку или его части, которые присоединяют к хроматографическому матриксу. Экспрессированному белку дают возможность связаться иммунохроматографической колонкой. Затем колонку промывают для удаления неспецифически связавшихся белков. После чего специфически связавшийся экспрессированный белок высвобождают из колонки и извлекают с использованием стандартных методов. Для подтверждения экспрессии CaIon-белка или его части, белки, экспрессированные из клетокхозяев, содержащих экспрессионный вектор, содержащий вставку, кодирующую CanIon-белок или его часть, можно сравнить с белками, экспрессированными из клеток-хозяев, содержащих экспрессионный вектор без вставки. Наличие полосы в образцах клеток, содержащих экспрессионный вектор со вставкой,которая отсутствует в образцах из клеток, содержащих экспрессионный вектор без вставки, свидетельствует о том, что CanIon-белок или его часть экспрессируются. Как правило, данная полоса будет обладать подвижностью, ожидаемой для CanIon-белка или его части. Однако данная полоса может обладать подвижностью, отличающейся от ожидаемой из-за модификаций, таких как гликозилирование, убихитинизиция или ферментативное расщепление. Антитела, способные специфически распознавать экспрессированный CanIon-белок или его часть,описаны ниже. Когда образование антител невозможно, нуклеиновые кислоты, кодирующие CanIon-белок или его часть, встраиваются в экспрессионный вектор, созданный для использования в схемах очистки, использующих химерные полипептиды. В таких методиках нуклеиновая кислота, кодирующая CanIon-белок или его часть, встраивается в открытую рамку считывания вместе с геном, кодирующим другую половину данной химеры. Другая половина химеры представляет собой последовательность -глобина или последовательность, кодирующую полипептид, связывающий никель. Хроматографический матрикс, содержащий антитело к -глобину или присоединенный к нему никель, используется для выделения очисткой химерного белка. Сайты протеазного расщепления создают генно-инженерным способом между геном -глобина или никельсвязывающим полипептидом и CanIon-белком или его частью. Таким образом,два полипептида химеры отделяются друг от друга с помощью протеазного расщепления. Пригодным экспрессионным вектором для образования -глобиновых химерных белков являетсяpSG5 (Stratagene), который кодирует -глобин кролика. Интрон II кроличьего гена -глобин обеспечивает сплайсинг экспрессируемого транскрипта, а сигнал полиаденилирования, встраиваемый в данную конструкцию, повышает уровень экспрессии. Эти методы хорошо известны в данной области молекулярной биологии. Стандартные способы опубликованы в руководствах, как например, Davies и соавт.(1986), но многие способы доступны от Stratagene, Life Technologies, Inc., или Promega. Полипептид можно дополнительно получить из конструкции с использованием in vivo трансляционных систем, таких как In vitro Express Translation Kit (Stratagene). Антитела, которые связывают CanIon-полипептиды настоящего изобретения Любой CanIon-полипептид или целый белок можно использовать для получения антител, способных специфически связываться с экспрессируемым CanIon-белком или его фрагментами, которые описаны. Антительная композиция настоящего изобретения способна специфически или селективно связываться с вариантом CanIon-белка SEQ ID No 5. Для антительной композиции, которая специфически связывается с первым вариантом CanIon, необходимо продемонстрировать в ELISA, RIA или ином анализе по связыванию антител, по меньшей мере, на 5, 10, 15, 20, 25, 50 или 100% более высокое связывание по сродству для полноразмерного первого варианта CanIon-белка, чем для полноразмерного второго варианта CanIon-белка. В предпочтительном варианте осуществления настоящего изобретения антительная композиция способна специфически связывать CanIon-белок человека. В предпочтительном варианте осуществления настоящего изобретения рассматриваются антительные композиции, поликлональные или моноклональные, способные селективно связывать или селективно связываться с эпитопсодержащим полипептидом, включающим непрерывный участок последовательности, по меньшей мере, из 6 аминокислот, предпочтительно по меньшей мере 8-10 аминокислот, более предпочтительно, по меньшей мере, 12, 15, 20, 25, 30, 40, 50, 100, 200, 300, 400, 500, 700 или 1000 аминокислот SEQ ID No 5. В предпочтительных вариантах осуществления настоящего изобретения указанный непрерывный участок последовательности включает, по меньшей мере, 1, 2, 3, 5 или 10 аминокислотных позиций 277, 338, 574, 678, 680, 683, 691, 692, 695, 696, 697, 894, 1480, 1481, 1483, 1484, 1485, 1630, 1631,1632, 1636, 1660, 1667, 1707, 1709 SEQ ID No 5. Любой CanIon-полипептид или целый белок можно использовать для получения антител, способных, как описано, специфически связываться с экспрессируемым CanIon-белком или его фрагментами. Эпитоп может включать не менее 3 аминокислот для пространственной конформации, которая является уникальной для данного эпитопа. Как правило, эпитоп состоит, по меньшей мере, из 6 таких аминокислот, но чаще, по меньшей мере, из 8-10 таких аминокислот. В предпочтительном варианте осуществления настоящего изобретения антигенные эпитопы включают ряд аминокислот, которые составляют- 27008252 любое целое число между 3 и 50. Фрагменты, которые функционируют в качестве эпитопов, можно получить с помощью любого традиционного способа. Эпитопы можно определить в антигеном анализеJameson-Wolf, например, применяя компьютерную программу PROTEAN с использованием значений параметров по умолчанию (Version 4.0 Windows, DNASTAR, Inc., 1228 South Park Street Madison, WI). В настоящем изобретении рассматривается также выделенное очисткой или выделенное антитело,способное специфически связаться с мутантным CanIon-белком, его фрагментом или вариантом, включающим эпитоп мутантного CanIon-белка. В другом предпочтительном варианте осуществления настоящего изобретения рассматривается антитело, способное связаться с полипептидом, включающим, по меньшей мере, 10 последовательных аминокислот CanIon-белка и включающего, по меньшей мере, одну из аминокислот, которая может кодироваться мутациями, определяющими данный признак. Животные или млекопитающие, не принадлежащие человеческому роду, природные или трансгенные, которые экспрессируют разные виды CanIon, отличные от CanIon, к которому требуется связывание антитела, а также животные, которые не экспрессируют CanIon (т.е. CanIon-нокаутное животное, которое описано в данном описании), особенно пригодны для получения антител. CanIon-нокаутные животные будут распознавать все или большинство находящихся на поверхности участков CanIon-белка в качестве чужеродных антигенов и, вследствие этого, производить антитела с более широким набором CanIonэпитопов. Кроме того, меньшие полипептиды, всего лишь с 10-30 аминокислотами, могут быть пригодны для получения специфичного связывания с одним из CanIon-белков. К тому же, гуморальная иммунная система животных, которая продуцируют виды CanIon, имеющие сходство с антигенной последовательностью, будет предпочтительно распознавать различия между нативными CanIon-видами животного и данной антигенной последовательностью, и продуцировать антитела к этим уникальным сайтам в последовательности данного антигена. Такой метод особенно пригоден для получения антител, которые специфически связываются с любым отдельным CanIon-белком. Препараты антител, полученные в соответствии с любым протоколом, пригодны для количественного иммуноанализа, в котором определяют концентрации несущих антиген веществ в биологических образцах; их также используют, полуколичественно или количественно, для идентификации антигена,присутствующего в биологическом образце. Антитела можно также использовать в терапевтических композициях для уничтожения клеток, экспрессирующих данный белок или для снижения уровня данного белка в данном организме. Антитела настоящего изобретения можно метить радиоактивной, флуоресцентной или ферментной меткой, известной в данной области техники. Поэтому, настоящее изобретение относится также к способу детектирования специфически присутствующего в биологическом образце CanIon-полипептида в соответствии с настоящим изобретением,причем указанный способ включает следующие стадии:a) приведения в контакт данного биологического образца с поликлональным или моноклональным антителом, которое специфически связывает CanIon-полипептид, включающий аминокислотную последовательность SEQ ID No 5, или его пептидный фрагмент или вариант; иb) детектирования образованного комплекса антиген-антитело. В настоящем изобретении рассматривается также диагностический набор для детектирования в биологическом образце, в соответствии с настоящим изобретением, наличия in vitro CanIon-полипептида,где указанный набор включает:a) поликлональное или моноклональное антитело, которое специфически связывает CanIonполипептид, включающий аминокислотную последовательность SEQ ID No 5, или его пептидный фрагмент или вариант, необязательно меченый;b) реагент, обеспечивающий детекцию образованных комплексов антиген-антитело, причем указанный реагент необязательно несет метку или способен распознавать самого себя с помощью меченного реагента, в частности, в случае, если указанное выше моноклональное или поликлональное антитело само не является меченым. Настоящее изобретение относится, таким образом, к антителам и Т-клеточным антигенным рецепторам (TCR), которые специфически связывают полипептиды и, в частности, эпитопы полипептидов настоящего изобретения, включая, но, не ограничиваясь ими, IgG (в том числе IgG1, IgG2, IgG3 и IgG4),IgA (в том числе IgA1 и IgA2), IgD, IgE или IgM и IgY. В предпочтительном варианте осуществления настоящего изобретения данные антитела, представляющие собой антительные фрагменты настоящего изобретения, связывающие антиген человека, включают, но не ограничиваются ими, Fab, Fab', F(ab)2 иF(ab')2, Fd, одноцепочечные Fvs (scFv), одноцепочечные антитела, связанные дисульфидной связью Fvs(sdFv) и фрагменты, включающие домен VL или VH. Антитела можно получить у любого животного, в том числе у птиц и млекопитающих. Предпочтительны антитела человека, мыши, кролика, козы, морской свинки, верблюда, лошади или обезьяны. Антигенсвязывающие антительные фрагменты, включая одноцепочечные антитела, могут включать вариабельную область(и), отдельно или в сочетании с полной или частичной: шарнирной областью, доменами CH1, CH2 и СН 3. В настоящее изобретение включены также любые сочетания вариабельной области(ей) и шарнирной области, доменов CH1, CH2 и СН 3. Кроме того, настоящее изобретение включает- 28008252 химерные, гуманизированные, а также моноклональные и поликлональные антитела человека, которые специфически связывают полипептиды настоящего изобретения. Настоящее изобретение к тому же включает антитела, которые являются антиидиотипическими к антителам настоящего изобретения. Антитела настоящего изобретения могут быть моноспецифичными, биспецифичными, триспецифичными или обладать более высокой мультиспецифичностью. Мультиспецифичные антитела могут быть специфичны для разных эпитопов полипептида настоящего изобретения или могут быть специфичны для полипептида настоящего изобретения, а также для гетерологичных композиций, таких как гетерологичный полипептид или вещество твердого носителя. См., например, WO 93/17715; WO 92/08802;WO 91/00360; WO 92/05793; Tutt и соавт. (1991) J. Immunol. 147:60-69; патенты 5573920, 4474893,5601819, 4714681, 4925648; Kostelny и соавт. (1992) J. Imminol. 148:1547-1553. Антитела настоящего изобретения могут быть описаны или охарактеризованы в пределах эпитопа(ов) или эпитоп-несущей части(ей) полипептида настоящего изобретения, которые распознаются или специфически связываются с данным антителом. В случае белков настоящего изобретения, секретируемых белков, антитела могут специфически связывать полноразмерный белок, кодируемый нуклеиновой кислотой настоящего изобретения, зрелый белок (т.е., белок, образованный в результате отщепления сигнального пептида), кодируемый нуклеиновой кислотой настоящего изобретения, сигнальный пептид,кодируемый нуклеиновой кислотой настоящего изобретения, или любой другой полипептид настоящего изобретения. Поэтому, эпитоп(ы) или эпитоп, несущий часть(и) полипептида, можно точно определить,как описано в данном описании, например, по N-концевому и С-концевому положению, по размеру в контиге аминокислотных остатков или описать иначе (включая список последовательностей). Антитела,которые специфически связывают любой эпитоп или полипептид настоящего изобретения, можно также исключить в качестве индивидуальных видов. Таким образом, настоящее изобретение включает антитела, которые специфически связывают определенные (заданные) полипептиды настоящего изобретения, и позволяют исключить одинаковые. Антитела настоящего изобретения можно также описать или точно определить в пределах их перекрестной реактивности. В настоящее изобретение включены антитела, которые специфически не связывают любой другой аналог, ортолог или гомолог полипептидов настоящего изобретения. В настоящее изобретение включены также антитела, которые не связывают полипептиды менее чем с 95%, менее чем с 90%, менее чем с 85%, менее чем с 80%, менее чем с 75%, менее чем с 70%, менее чем с 65%, менее чем с 60%, менее чем с 55%, менее чем с 50% идентичностью (что рассчитано с использованием способов, известных в данной области техники и описанных в данном описании) с полипептидом настоящего изобретения. Кроме того, в настоящее изобретение включены антитела, которые связывают лишь полипептиды, кодируемые полинуклеотидами, которые гибридизуются с полинуклеотидом настоящего изобретения в жестких гибридизационных условиях (как описано в данном описании). Антитела настоящего изобретения могут быть также описаны или точно определены в терминах их связывания по сродству. Предпочтительное связывание по сродству проявляют антитела с константой диссоциации или Kd меньше 5X10-6 М, 10-6 М, 5 Х 10-7 М, 10-7 М, 5 Х 10-8 М, 10-8 М, 5 Х 10-9 М, 10-9 М, 5 Х 10-10 М, 10-10 М, 5 Х 10-11 М, 10-11 М,5 Х 10-12 М, 10-12 М, 5 Х 10-13 М, 10-13 М, 5 Х 10-14 М, 10-14 М, 5 Х 10-15 М и 10-15 М. Используемые антитела настоящего изобретения включаются, но не ограничиваются ими, в известные в данной области техники способы по выделению очисткой, обнаружения и мишенирования полипептидов настоящего изобретения, в том числе in vitro и in vivo диагностические и терапевтические способы. Например, в иммуноанализе антитела используют для качественного и количественного измерения уровня полипептидов настоящего изобретения в биологических образцах. См., например, Harlow и соавт., ANTIBODIES: A LABORATORY MANUAL, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988)(включенный в данное описание путем ссылки во всей его полноте). Антитела настоящего изобретения могут использоваться отдельно или в сочетании с другими композициями. Данные антитела можно, кроме того, рекомбинантно сливать с гетерологичным полипептидом по N- или С-концу или химически конъюгировать (включая ковалентную и нековалентную конъюгацию) с полипептидами или с другими композициями. Например, антитела настоящего изобретения можно рекомбинантно слить или конъюгировать с молекулами, пригодными в качестве метки для детекционных анализов, и с эффекторными молекулами, такими как гетерологичные полипептиды, лекарственные средства или токсины. См., например, WO 92/08495; WO 91/14438; WO 89/12624; патент США 5314995; и ЕР О 396387. Антитела настоящего изобретения можно получить любым подходящим способом, известным в данной области техники. Например, полипептид настоящего изобретения или его антигенный фрагмент можно вводить животному для того, чтобы индуцировать образование сыворотки, содержащей поликлональные антитела. Термин "моноклональное антитело" не ограничен антителами, получаемыми с помощью гибридомной техники. Термин "антитело" относится к полипептиду или к группе полипептидов,которые включают, по меньшей мере, один связывающий домен, где связывающий домен образуется из упакованных вариабельных доменов антительной молекулы с образованием трехмерного связывающего пространства, причем форма и заряд внутренней поверхности являются комплементарными элементам антигенной детерминанты антигена, что обеспечивает иммунологическое взаимодействие с антигеном.- 29008252 Термин "моноклональное антитело" относится к антителу, которое получают из одиночного клона, в том числе эукариотического, прокариотического или фагового клона, но не к способу, с помощью которого его получают. Моноклональные антитела можно получить с использованием весьма разнообразных методов, известных в данной области техники, в том числе с использованием гибридомной, рекомбинантной и фаговой дисплейной технологии. Гибридомные методы включают методы, известные в данной области техники (см., например, Harlow и соавт. (1998; Hammerling и соавт. (1981) (указанные ссылки включены путем ссылки во всей их полноте). Фрагменты Fab и F(ab')2 можно получить, например, из гибридомно-полученных антител в результате протеолитического расщепления, с использованием ферментов, таких как папаин (для полученияFab-фрагментов) или пепсин (для образования F(ab')2-фрагментов). Альтернативно, антитела настоящего изобретения можно получить путем применения техники рекомбинантных ДНК или с помощью химического синтеза с использованием способов, известных в данной области техники. Например, антитела настоящего изобретения можно получить с использованием разнообразных способов фагового дисплея, известных в данной области техники. В способах фагового дисплея функциональные антительные домены представлены на поверхности фаговой частицы, которая несет кодирующие их полинуклеотидные последовательности. Фаг с требуемой связывающей способностью выбирают из набора или из комбинаторной библиотеки антител (например, человека или мыши) путем прямого отбора по антигену, как правило, антигену, связанному или захваченному твердой поверхностью или шариком. Используемый в этих способах фаг обычно представляет собой нитчатый фаг,включающий fd и М 13 с Fab, Fv или стабилизированные дисульфидной связью Fv-домены антитела, рекомбинантно слитые с фаговым геном III фага или с белком гена VIII. Примеры способов фагового дисплея, которые можно использовать для создания антител настоящего изобретения, включают способы,которые описаны у Brinkman и соавт. (1995); Ames и соавт. (1995); Kettleborough и соавт. (1994); Persic и соавт. (1997); Burton и соавт. (1994); PCT/GB91/01134; WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; W095/15982; WO 95/20401; и патенты США 5698426, 5223409, 5403484,5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727 и 5733743 (указанные ссылки включены путем ссылки во всей их полноте). Как описано в указанных выше ссылках, после фаговой селекции кодирующие антитело области можно выделить из данного фага и использовать для образования целых антител, в том числе и антител человека, или любого другого требуемого антигенсвязывающего фрагмента и экспрессировать в любом желаемом хозяине, включая клетки млекопитающих, клетки насекомых, растительные клетки, дрожжевые и бактериальные. Например, методы для рекомбинантного производства фрагментов Fab, Fab', F(ab)2 и F(ab')2, можно также употребить, используя способы, известные в данной области техники, способы,раскрытые в WO 92/22324; Mullinax и соавт. (1992); а также Sawai и соавт. (1995); а также Better и соавт.(1998) (указанные ссылки включены путем ссылки во всей их полноте). Примеры методик, которые можно использовать для получения одноцепочечных Fvs и антител,включают методики, описанные в патентах США 4946778 и 5258498; Huston и соавт. (1991); Shu и соавт. (1993); и Skerra и соавт. (1988). Для определенного использования, включая in vivo использование антител у людей и in vitro детекционные анализы, предпочтительным может оказаться использование химерных, гуманизированных или антител человека. Способы получения химерных антител хорошо известны в данной области техники. См. например, Morrison (1985); Oi и соавт. (1986); Gillies, S.D. и соавт.(1989); и патент США 5807715. Антитела можно гуманизировать с использованием разнообразных методов, включая CDR-трансплантацию (ЕР 0239400; WO 91/09967; патент США 5530101; и 5585089), облицовку или перекладку (ЕР 0592106; ЕР 0519596; Padlan E.A. (1991); Studnicka G.M. и соавт. (1994); Roguska M.A. и соавт. (1994 и перестановку цепи (патент США 5565332). Антитела человека можно создать разнообразными способами, известными в данной области техники, включая описанные выше способы фагового дисплея. См. также патенты США 4444887, 4716111, 5545806, и 5814318; WO 98/46645; WO 98/50433; WO 98/24893; WO 96/34096; WO 96/33735 и WO 91/10741 (указанные ссылки включены путем ссылки во всей их полноте). В настоящее изобретение дополнительно включены рекомбинантно слитые антитела или химически конъюгированные (включая ковалентную и нековалентную конъюгацию) с полипептидом настоящего изобретения. Данные антитела могут оказаться специфичными для антигенов, отличных от полипептидов настоящего изобретения. Например, антитела можно использовать для мишенирования полипептидов настоящего изобретения в отдельных типах клеток либо in vitro, либо in vivo, путем слияния или конъюгации полипептидов настоящего изобретения с антителами, специфичными к отдельным рецепторам клеточной поверхности. Антитела, слитые или конъюгированные с полипептидами настоящего изобретения, можно также использовать в иммуноанализе in vitro и в способах очистки с использованием способов, известных в данной области техники. См., например, Harbor и соавт. выше и WO 93/21232; ЕР 0439095; Naramura, H. и соавт. (1994); патент США 5474981; Gillies S.O. и соавт. (1992); Fell H.P. и соавт. (1991) (указанные ссылки включены путем ссылки во всей их полноте). Настоящее изобретение содержит также композиции, включающие полипептиды настоящего изобретения, слитые или конъюгированные с доменами антитела, отличными от вариабельных областей.
МПК / Метки
МПК: G01N 33/577, C12N 15/09, C07K 16/18, A61K 39/395, G01N 33/53, A61P 25/28
Метки: домен, канала, потенциалзависимого, полипептидом, связывающиеся, антигенсвязывающий, ионного, воротного, антитело, специфически
Код ссылки
<a href="https://eas.patents.su/30-8252-antitelo-ili-antigensvyazyvayushhijj-domen-specificheski-svyazyvayushhiesya-s-polipeptidom-potencialzavisimogo-vorotnogo-ionnogo-kanala.html" rel="bookmark" title="База патентов Евразийского Союза">Антитело или антигенсвязывающий домен, специфически связывающиеся с полипептидом потенциалзависимого воротного ионного канала</a>
Предыдущий патент: Производные имидазола, обладающие аффиностью по отношению к альфа2 рецепторам
Следующий патент: Антагонисты nogo – рецептора
Случайный патент: Резервуар для хранения веществ и/или приборов при низких температурах












