Способы обнаружения амниотической жидкости во влагалищном секрете и устройства для реализации указанных способов
Номер патента: 8194
Опубликовано: 27.04.2007
Авторы: Маршицкая Маргарита Игоревна, Старосветская Нелли Андрониковна, Назимова Светлана Владимировна, Константинов Александр, Зарайский Евгений Ильич, Петрунин Дмитрий Дмитриевич, Болтовская Марина Николаевна, Фукс Борис
Формула / Реферат
1. Способ минимизации вероятности получения ложноположительных и ложноотрицательных результатов при обнаружении присутствия малых количеств амниотической жидкости во влагалищном секрете беременных женщин, при этом указанный способ включает:
(i) выбор высокоспецифичной пары моноклональных антител для определения минимальной фоновой концентрации плацентарного альфа-1-микроглобулина (PAMG-1) во влагалищном секрете; и
(ii) выбор дополнительных моноклональных антител против PAMG-1 для использования в сочетании с указанной парой высокоспецифичных моноклональных антител в устройстве для проведения стрип-тестов с целью точной установки предварительно заданного порога чувствительности устройства для проведения стрип-тестов.
2. Способ по п.1, отличающийся тем, что одна пара высокоспецифичных моноклональных антител (i) локализована в зоне прокладки стрип-устройства.
3. Способ по п.1, отличающийся тем, что одна пара высокоспецифичных моноклональных антител связана с маркером.
4. Способ по п.3, отличающийся тем, что маркер представляет собой окрашенную частицу.
5. Способ по п.1, отличающийся тем, что одна пара высокоспецифичных моноклональных антител (i) локализована в зоне анализа стрип-устройства.
6. Способ по п.1, отличающийся тем, что одно или несколько дополнительных моноклональных антител против PAMG-1 (ii) локализуют в зоне анализа указанного стрип-устройства в предварительно заданной пропорции по отношению к одному антителу (i) из высокоспецифичной пары моноклональных антител, локализованных в указанной зоне анализа стрип-устройства.
7. Способ по п.6, отличающийся тем, что указанные дополнительные антитела (ii) используют в сочетании с указанной парой высокоспецифичных моноклональных антител для установки предварительно заданного порога чувствительности указанного стрип-устройства.
8. Способ по пп.1, 6 и 7, отличающийся тем, что указанные моноклональные антитела против PAMG-1 (i) и (ii) используют в сочетании в заданной пропорции по отношению друг к другу для установки оптимального интервала между фоновым уровнем содержания указанного PAMG-1 во влагалищном секрете, составляющим около 0,05-0,2 нг/мл, и пороговой чувствительностью указанного стрип-устройства, при этом указанное пороговое значение устанавливают в пределах от 5 до 10 нг/мл, чтобы минимизировать вероятность получения ложноотрицательных и ложноположительных результатов при определении малых концентраций амниотической жидкости во влагалищном секрете беременных женщин.
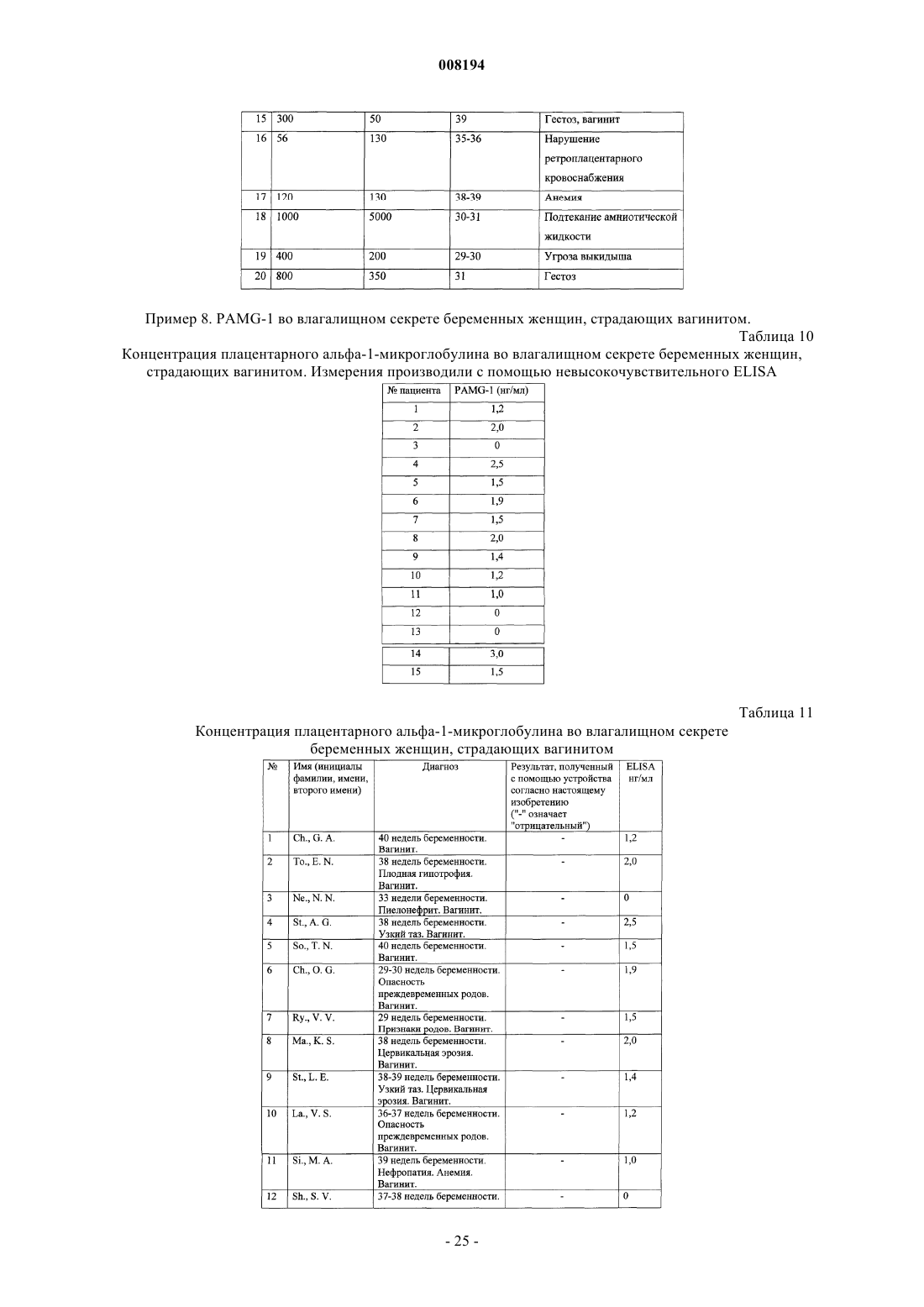
9. Способ определения попадания амниотической жидкости в вагинальный секрет, включающий обнаружение связывания пары антител, специфичных для PAMG-1 во влагалищном секрете.
10. Способ по п.9, отличающийся тем, что пара антител является чувствительной к уровню PAMG-1, превышающему фоновое значение.
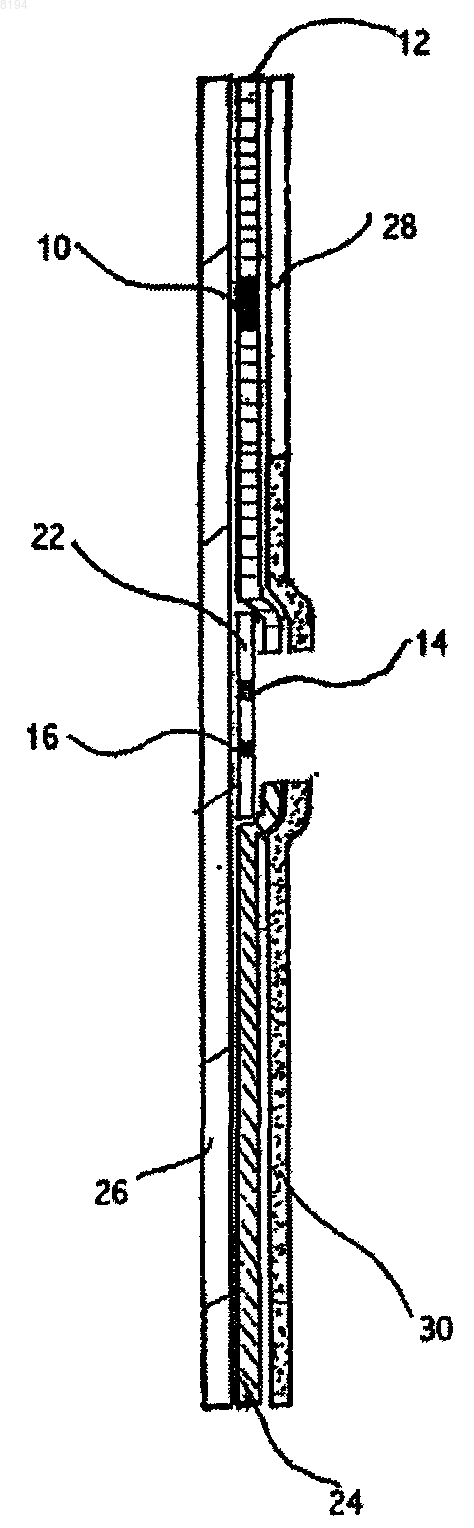
11. Способ по п.9, отличающийся тем, что одно из пары антител иммобилизуют на твердотельной подложке.
12. Способ по п.11, отличающийся тем, что твердотельная подложка представляет собой мембрану, через которую жидкость может перемещаться под действием капиллярных сил.
13. Способ по п.11, отличающийся тем, что указанные антитела являются моноклональными антителами.
14. Способ по п.11, отличающийся тем, что он дополнительно включает использование третьего антитела, специфичного для PAMG-1 и иммобилизованного на твердой подложке.
15. Способ по п.14, отличающийся тем, что содержание антител, иммобилизованных на твердотельной подложке, обеспечивает пороговый уровень обнаружения PAMG-1 примерно 5 нг/мл.
16. Способ по п.13, отличающийся тем, что моноклональное антитело выбирают из группы, включающей М271, образованное гибридомой N271, которая хранится в депозитарии Всероссийской коллекции промышленных микроорганизмов (ВКПМ) с инвентарным номером ВКПМ-93, М52, образованное гибридомой N52, которая хранится в ВКПМ с инвентарным номером ВКПМ-92, и М42, образованное гибридомой N42, которая хранится в ВКПМ с инвентарным номером ВКПМ-94.
17. Устройство, содержащее иммобилизованное антитело, специфичное для PAMG-1, и мобилизуемое антитело, специфичное для PAMG-1, при этом мобилизация мобилизуемого антитела жидким образцом обеспечивает связывание мобилизуемого антитела с каким-либо PAMG-1 в образце и связывание образующегося комплекса мобилизуемое антитело-PAMG-l с иммобилизованным антителом, при этом мобилизуемое антитело содержит маркер.
18. Устройство по п.17, отличающееся тем, что указанные антитела являются моноклональными антителами.
19. Устройство по п.17, отличающееся тем, что иммобилизованное антитело иммобилизуют на мембранной подложке.
20. Устройство по п.17, отличающееся тем, что маркер представляет собой коллоидное золото.
21. Устройство по п.17, отличающееся тем, что оно дополнительно содержит третье антитело, специфичное для PAMG-1 и иммобилизованное на твердой подложке.
22. Устройство по п.17, отличающееся тем, что отношение антител, иммобилизованных на твердотельной подложке, обеспечивает пороговый уровень обнаружения PAMG-1 примерно 5 нг/мл.
23. Устройство по п.17, отличающееся тем, что моноклональное антитело выбирают из группы, включающей М271, образованное гибридомой N271, которая хранится в депозитарии Всероссийской коллекции промышленных микроорганизмов (ВКПМ) с инвентарным номером ВКПМ-93, М52, образованное гибридомой N52, которая хранится в ВКПМ с инвентарным номером ВКПМ-92, и М42, образованное гибридомой N42, которая хранится в ВКПМ с инвентарным номером ВКПМ-94.
Текст
008194 Настоящая заявка испрашивает приоритет согласно предварительной заявке США 60/403407, зарегистрированной 13 августа 2002 г., описание которой полностью входит в описание настоящей заявки по ссылке. Данное изобретение относится к способу диагностики для точного обнаружения малых количеств амниотической жидкости во влагалище. В частности, изобретение относится к применению особым образом выбранных моноклональных антител, которые специфичным образом связывают плацентарный 1-микроглобулин (PAMG-1). Более конкретно, настоящее изобретение относится к выбору пары антител против PAMG-1 ("базовой пары"), обеспечивающей чувствительность, достаточную для обнаружения минимальной фоновой концентрации PAMG-1 во влагалищном секрете беременных женщин. Кроме того, настоящее изобретение относится к системе твердофазного иммунологического анализа, содержащей антитела против PAMG-1, в которой комбинацию двух или нескольких антител против PAMG-1 иммобилизуют на твердотельной подложке устройства с целью точной настройки требуемого порогового уровня чувствительности. Преждевременный разрыв плодной оболочки (амниотического мешка) происходит примерно у 10% беременных женщин, и при отсутствии незамедлительного лечения он вызывает примерно 10% всех перинатальных смертей. Термин PROM (premature rupture of the fetal membranes, преждевременный разрыв плодных оболочек) относится к спонтанному разрыву оболочек за 24 и более часов до начала своевременных или преждевременных родов. Термин PPROM (preterm premature rupture of membranes) относится к преждевременному раннему разрыву оболочек. Около 30-50% таких преждевременных разрывов происходят до 37 недели беременности. В этих случаях определенный диагноз разрыва является чрезвычайно важным, поскольку PROM связан с существенным повышением опасности внутриматочной инфекции и нарушения развития легочной системы плода. Внутриматочное проникновение таких инфекций примерно на 10% увеличивает как материнскую, так и перинатальную заболеваемость и смертность. Незамедлительный диагноз разрыва на 38-40 неделе беременности является критичным, поскольку в случае определения наличия PROM необходимо как можно скорее стимулировать роды. Диагностика разрыва также является важной до 37 недель беременности, поскольку она способствует предотвращению возникновения внутриамниотической инфекции и стимуляции развития легких плода."Золотого стандарта" для диагностики разрыва оболочки не существует. PROM имеет динамическую природу, поэтому интервал между разрывом оболочки и реализацией диагностической модальности, наличие интенсивной потери амниотической жидкости, периодические просачивания, различия в возникновении PROM у различных групп пациенток и учет факторов, которые способны оказывать влияние на результаты анализов, являются параметрами, отсутствие учета которых ведет к неточному диагнозу. Эти неточности могут приводить к ошибкам интерпретации исследований, задачей которых является определение оптимальных средств для идентификации PROM. Диагностика PROM традиционно основывается на жалобах пациенток о выделении жидкости из влагалища. Физический осмотр позволяет однозначно ставить диагноз, однако, бывают случаи, когда результаты осмотра являются внутренне противоречивыми или сомнительными. Такая ситуация требует проведения подтверждающих диагностических тестов (Lockwood С.J. et al., Am. J. Obstet. Gynecol., 1994,v. 171, No 1, pp. 146-150). Некоторые методы, являющиеся, впрочем, недостаточно эффективными, используют в настоящее время для обнаружении амниотической жидкости во влагалище. К таким методам относится, в частности, папортниковый тест (М.L. Friedman and T.W. McElin, "Diagnosis of Ruptured FetalMembranes", American Journal of Obstetrics and Gynecology 1969, Vol. 100, pp. 544-550). Данный метод основан на обнаружении присутствия амниотической жидкости путем наблюдения так называемой листовидной структуры, которая появляется при высыхании амниотической жидкости на предметном стекле. Однако этот метод является недостаточно точным, поскольку он основан на чрезвычайно изменчивых свойствах амниотической жидкости во влагалище. В 30% случаев он может давать ложные результаты. Предлагалось также определять разрыв плодной оболочки с помощью нескольких красителей: нильский голубой, акридиновый оранжевый, бромтимоловый синий, нитразин и т.д. (М.L. Friedman and Т.W. McElin, см. выше). Этот подход является неудобным и обладает недостатками, связанными с изменчивостью химических свойств амниотической жидкости во влагалище и некоторых возможных примесей, содержащихся в ней. Так, например, влагалищная инфекция может оказывать влияние на результаты вышеуказанных анализов. Проведенное ранее исследование наиболее распространенных в настоящее время нитразинового и папортникового тестов показало, что эти тесты имеют высокую погрешность,которая прогрессивно возрастает, если с момента разрыва оболочки прошло более 1 ч, а через 24 ч результаты становятся совершенно неинтерпретируемыми. Исследование показало, что в случаях затяжного PROM эти тесты дают не лучшую диагностическую информацию, чем простое клиническое исследование (Gorodeski I.G., Haimovitz L., Bahari С.М., Journal Perinat. Med, 1982, v. 10, No 6, pp. 286-292). Более поздние данные (Trovo S. et al., Minerva Ginecol. 1998, v. 50, No 12, pp. 519-512) по этим тестам показывают нитразиновый тест - чувствительность 70%, специфичность 97%, точность 90%; папортниковый тест - чувствительность 70%, точность 93%.-1 008194 Недавно было предложено определять разрыв плодных оболочек на основании иммунохимического анализа белков амниотической жидкости. Стыковочный (контактный) иммунохимический анализ использует следующие белки амниотической жидкости для определения разрыва оболочки: альфафетопротеин, пролактин, фибронектин и протеин 1, связывающий инсулиноподобный фактор роста, см. В.L. Rochelson et al., "Rapid Assay - Possible Application in the Diagnosis of Premature Rupture of the Membranes", in Obstetrics and Gynecology, 1983, v. 62, pp. 414-418; P.R. Konickx et al., "Prolactin ConcentrationEarly Detection of Rupture of the Amniotic Membranes", Eur. J. Obstet. Gynecol. Reprod. Biol., 1992, v. 43(3),pp. 173-179; Rutanen, E.M. et al., "Measurement of Insulin-like Growth-Factor binding Protein-1 in Cervical/Vaginal Secretions: Comparison with the ROM Check Membrane Immunoassay in the Diagnosis of Ruptured Fetal Membranes", Clin. Chim. Acta., 1993, v. 214, pp. 73-81. Rutanen E.М. и др. позднее разработали хроматографический тест, используя хроматографическую мембрану в инверсной позиции (FI-84863; патент США 5554504). Способы, основанные на определении альфа-фетопротеина (AFP) и пролактина (PRL), являются ненадежными, поскольку отношение содержания AFP и PRL в крови/амниотической жидкости подвержено существенным колебаниям. AFP и PRL имеют высокую концентрацию в амниотической жидкости только во время второго трехмесячного периода беременности. К моменту родов отношение концентрации амниотического/сывороточного белка для обоих белков составляет всего лишь около 3-4. Другой способ, основанный на определении фетального фибронектина в влагалищном секрете,также найден неудовлетворительным. Например, наличие фетального фибронектина может иметь место даже при отсутствии разрыва плодной оболочки (Р. Hellemans et al., "Preliminary Results with the Use ofVaginal Secretions as a Predictor of Preterm Delivery", New England Journal of Medicine, 1991, v. 325, pp. 669-674), что приводит к ложноположительным результатам. Все эти способы определения разрыва плодной оболочки, основанные на определении альфафетопротеина, пролактина и фибронектина, являются неточными из-за переменных факторов, регулирующих концентрацию этих белков в амниотической жидкости и относительную концентрацию этих белков в амниотической жидкости и в сыворотке крови. Что касается усовершенствованного теста на IGFBP-1 (протеин 1, связывающий инсулиноподобный фактор роста), то имеются противоречивые данные относительно его специфичности и точности. Экспресс-тест по индикаторной полосе (PROM тест, OY Medix Biochemica, Финляндия, известный также под маркой Amni-check, MAST Diagnostica, Германия) разработан для определения присутствия IGFBP-1 во влагалищном секрете (Rutanen ЕМ, Karkkainen TH, Lehtovirta J., Uotila JT, Hinkula MK, Hartikainen AL,"Evaluation of a rapid strip test for insuline-like growth factor binding protein-1 in the diagnosis of ruptured fetalmembranes", Clin Chim Acta 1996 Sep 30; v. 253 (1-2), pp. 91-101). E. Rutanen сообщил, что порог чувствительности в тесте был установлен таким образом, чтобы концентрации IGFBP-1 ниже 400 нг/мл в цервикальном секрете (ниже 95-го процентиля содержания IGFBP-1 в сыворотке беременных женщин) давали отрицательный результат. Однако в случаях кровотечения результат теста следует интерпретировать с осторожностью, поскольку кровь, полученная непосредственно из плацентарной площадки, может иметь более высокое содержание IGFBP-1, чем кровь из цервикальных кровеносных сосудов. Все пробы (n=55), взятые у пациенток с клинически подтвержденным PROM, показали положительный результат, а 71 из 75 проб, взятых у бессимптомных пациенток, были отрицательными согласно тесту. В данном наборе проб тест имел чувствительность 100% и специфичность 94,7%. Этот факт можно пояснить недостаточной чувствительностью (перекрестной реактивностью) моноклонального антитела, используемого на первом этапе тестирования. У 181 пациентки с подозрением на PROM, не получившим однозначного подтверждения после первичного обследования, результаты теста были положительными в 64 случаях и отрицательными в 117 случаях. Пятьдесят из 64 пациенток (78,1%) с положительным результатом теста имели роды ранее 37 недель беременности, а 42 (65,6%) - в течение 2 недель после отбора пробы. Пять из 117 пациенток с отрицательным результатом теста перенесли избирательное кесарево сечение по причинам, не связанным с(6,3%) - в течение двух недель после отбора пробы (Е. Rutanen et al., 1996). К сожалению, данные, касающиеся чувствительности и специфичности теста на PROM у женщин с однозначным диагнозомPROM, отсутствуют. В исследовании W. Woltmann использовали тест Amni-check для определения IGFBP-1 в 150 пробах амниотической жидкости и 50 пробах влагалищного секрета, взятых у женщин с клинически неподтвержденным PROM. Тест имел чувствительность 97% и специфичность 100% (Woltmann W. et al., Z. Gebursh. Neonatal, 1995, v. 199, pp. 243-244).V. Ragosh оценил диагностическую точность теста Amni-check в 75 пробах влагалищного секрета. Тест показал чувствительность 100% и специфичность 83%. Исследователи сообщают, что доля ложно-2 008194 положительных результатов в сильной степени зависит от родовой активности. У женщин с маточными сокращениями (схватками) тест имел специфичность 59% (Ragosh V. et al., Geburtsh. U. Frauenheililk.,1996, Vol. 56, pp. 291-296). В исследовании Е. Darj и S. Lyrenas (Acta Obstet. Gynecol. Scand., 1998, v. 77, pp. 295-297) PROMтест имел чувствительность 95,7% и специфичность 93,1% у пациенток с клинически подтвержденным диагнозом (женщины с очевидным разрывом оболочек или женщины с неповрежденными оболочками). Однако у пациенток с подозрением на PROM чувствительность и специфичность PROM-теста составляли только 70,8 и 88,2% соответственно. Это расхождение можно объяснить тем, что пороговая чувствительность теста (400 нг/мл) делает невозможным определение низких концентраций амниотической жидкости во влагалищном секрете пациенток с сомнительным диагнозом (например, в случае небольшого разрыва). Таким образом, значительный фоновый уровень содержания вагинального IGFBP-1 у женщин с неповрежденными оболочками и высокий пороговый уровень определения могут ухудшать чувствительность и специфичность способа и тем самым оказывать сильное влияние на точность теста для пациенток с сомнительным диагнозом. Примеси сыворотки крови и/или воспалительного экссудата также могут оказывать влияние на точность теста (см. выше данные Е. Darj и S. Lyrenas). Автор данного теста не исследовал этот его аспект. С целью исключения некоторых из вышеуказанных недостатков использовали два моноклональных антитела для двух центров связывания инсулиноподобных факторов роста с целью обнаружения несвязанной фракции плацентарного 1-микроглобулина (патенты США 5968758; 5597700; 5891722; 5877029). В этих патентах необоснованно допускается идентичность двух белков - несвязанных PAMG-1 иIGFBP-1. Фактически, такое допущение могло бы быть основано только на сравнении первичной структуры и генов этих белков. В вышеуказанных патентах оказалось невозможным установить порог чувствительности такого теста, обеспечивающий максимально возможную степень точности (99% или более). Общей проблемой указанных тестов является фоновый уровень и непостоянство фоновой концентрации определяемого вещества. Так, например, фоновый уровень белка IGFBP-1 во влагалищном секрете беременных женщин изменяется в широких пределах от 0,5 до 90 нг/мл (см. исследования Rutanen). Вторым важным фактором является возможность присутствия примесей воспалительных экссудатов или сыворотки крови, содержащих определяемое вещество во влагалищном секрете. Это может приводить к получению ложноположительных результатов. Белок PAMG-1 был впервые описан Д. Петруниным (Petrunin D. et al., Akusherstvo i Ginekologia,1977, No. 1, p. 64, на русском языке; см. также PMID:65924 (PubMed-indexed for MEDLINE: "Immunochemical identification of organ specific human placental alpha-globulin and its concentration in amniotic fluid",Akusherstvo i Ginekologia, (Moscow) 1977 Jan, vol. 1, p. 64. Авторы получили антитела для очищенного и выделенного белка и с помощью иммунохимических методов определили содержание белка в амниотической жидкости (включая амниотическую жидкость, взятую из влагалища) на различных стадиях беременности. Определили также концентрацию белка в крови и различных органах плода и матери. Указанная группа исследователей продолжала публиковать новые результаты изучения этого белка в последующие годы вплоть до 1990 г. (Petrunin D. et al., "Comparative Study of Four Placental Protein During Gestation", Akusherstvo i Ginekologia, 1988, No. 1, pp. 50-52; Zaraisky, E. et al., Voprosy Med. Khemii,1989, No. 5, pp. 131-132; Tatarinov, Y. et al., Uspekhi Sovr. Biologii and Medicine, 1993 Sep; vol. 116, No. 9,pp. 302-304 (все указанные работы опубликованы на русском языке с рефератами на английском языке). Д. Петрунин получил авторское свидетельство на способ выделения PAMG-1 (SU-1614184 A1, приоритет 1988 г.). В 1988-89 гг. было опубликовано несколько работ, описывающих частичную и полную последовательность сходных белков, связывающих инсулиноподобный фактор роста (IGFBP) и полученных из амниотической жидкости, плаценты и гепатомы женщин (Bell S. et al., 1988; Luthman H. et al., 1989;Julkunen et al., 1988; Lee, Y. et al., 1988). Ген локализовали на участке 7 р 14-7 р 12 7-ой хромосомы человека. До 1991 г. исследователи использовали различные наименования для этого белка: 1-PEG, РР-12,IGFBP, BP-25 и т.п. В 1980-82 гг. Bohn выделил белок из плаценты и назвал его РР-12. В своей работе он сравнил РР-12 с открытым ранее белком PAMG-1 и обсудил сходства и различия между ними. Отличной от других исследований была работа авторов Bell et al. (1988 г.), которые обнаружили полиморфизм в N-концевом пептиде белка 1-PEG, а именно, в 11 и 12 позициях, и пришли к заключению о фактическом существовании не одного, а двух различных белков. Позднее, S. Bell снова сослался на свою работу, касающуюся двух различных белков 1-PEG в амниотической жидкости. Эта работа признает решение Номенклатурного комитета от 1990 г. (Report onthe Nomenclature of the IGF Binding Proteins, Journ. Clin. Endocr. And Metabol. 1990, 70, 3, р. 817), который постановил, что белки AFBP, PP-12, 1-PEG, GH-белок, cвязывающиеся белки 28, 26, 25, JB-1 являются идентичными, и дал им всем общее наименование hIGFBP-1.-3 008194 Так называемый свободный PAMG-1 использовали для определения разрыва плодной оболочки. Однако, как указано выше, тест с высокой точностью ( 99%) не был разработан. Эта задача была решена позднее с помощью нашего нового способа и устройства, описанного в данной патентной заявке. Настоящее изобретение использует способ выбора пары моноклональных антител с целью обеспечения чувствительности, достаточной для определения очень низкой концентрации PAMG-1 во влагалищном секрете, а также использует выбор некоторых других анти-PAMG-l-антител, которые в сочетании с двумя вышеуказанными антителами позволяют точно установить предварительно заданный порог чувствительности для стрип-устройства. Это в свою очередь позволяет минимизировать частоту ложноположительных результатов теста. Началом настоящего изобретения послужило новаторское исследование Д. Петрунина, который отделил и описал плацентарный альфа-микроглобулин и провел тщательное измерение его концентрации в амниотической жидкости, крови и некоторых тканях с помощью иммунохимических методов. Эта публикация является общественной собственностью, что следует принимать во внимание всем исследователям. Способ отделения PAMG-1 защищен официальным авторским свидетельством (SU-1614184 A1,приоритет 1988 г.), которое являлось эквивалентом патента в бывшем СССР. Краткое описание изобретения Настоящее изобретение относится к способу обнаружения малых количеств амниотической жидкости во влагалищном секрете в период беременности. Настоящее изобретение относится также к способу определения содержания PAMG-1, превышающего минимальную фоновую концентрацию амниотического белка PAMG-1 во влагалищном секрете беременных женщин и указывающего на присутствие амниотической жидкости. В специфическом варианте реализации способа обнаружения белка PAMG-1 используют пару моноклональных антител, специально выбранных для определения минимальной фоновой концентрации белка PAMG-1 во влагалищном секрете. Эту пару антител используют в сочетании по меньшей мере с одним дополнительным моноклональным антителом против PAMG-1, чтобы точно устанавливать требуемую пороговую чувствительность теста. Настоящее изобретение использует также сочетание антител, связывающих PAMG-1, в общем стрип-устройстве, чтобы обеспечить более точную установку порога чувствительности для способа обнаружения амниотического белка PAMG-1 во влагалищном секрете. Такой подход обеспечивает большую степень регулирования чувствительности и более широкий динамический диапазон, чем простое применение выбранной пары антител. Наиболее подходящий порог чувствительности способа является близким к 5 нг/мл, поскольку верхний уровень PAMG-1 во влагалищном секрете, который может быть вызван воспалением, не превышает 3 нг/мл. С другой стороны, регулярный фоновый уровень PAMG-1 во влагалищном секрете здоровых беременных женщин составляет около 0,2 нг/мл. Существенный интервал между фоновым уровнем и пороговой концентрацией определяемого вещества минимизирует вероятность получения ложноотрицательных и ложноположительных результатов. В одном из вариантов реализации первый этап распознавания амниотического PAMG-1 происходит в зоне прокладки стрип-устройства, куда помещают специально выбранное и меченое антитело. Второй этап реакции происходит в зоне анализа устройства в виде измерительного стержня, где иммобилизуют второе антитело из выбранной пары и предпочтительно по меньшей мере одно дополнительное антитело против PAMG-1. В итоге, мы описываем способ и устройство для обнаружения малых концентраций амниотической жидкости во влагалище беременной женщины. Способ предпочтительно основан на выборе пары моноклональных антител антиплацентарного 1-микроглобулина (PAMG-1). Первая задача выбора заключалась в том, чтобы обеспечить измерение минимальной фоновой концентрации PAMG-1 во влагалищном секрете. Имея эту информацию, можно использовать любой аналитический способ, способный определять содержание PAMG-1, превышающее пороговый уровень, чтобы детектировать амниотическую жидкость во влагалищном секрете. Пользуясь этой информацией, можно создать устройство, основанное на применении той же самой пары и дополнительных антител с целью снижения и точного установления пороговой чувствительности устройства и, соответственно, минимизации вероятности получения ложноотрицательных и ложноположительных результатов. Возможно применение различных комбинаций захватывающих (связывающих антиген) антител и их фрагментов или сочетаний других молекул, обладающих такими же свойствами, как указано в данном описании. В одном из вариантов реализации способ согласно настоящему изобретению включает контактирование образца, содержащего белок PAMG-1, и моноклонального антитела, первого из выбранной пары,которое селективно связывает PAMG-1. Способ использует также антитело, которое образует комплекс антитело-PAMG-l, и включает стадию связывания комплекса антитело-PAMG-l другим меченым моноклональным антителом из указанной пары. Кроме того, способ включает количественное измерение минимально низкой фоновой концентрации PAMG-1 во влагалищном секрете беременных женщин, не имеющих разрыва плодных оболочек. Этот способ часто используют в категории тестов ELISA (enzymelinked immunosorbent assay - иммуносорбентный анализ с применением фиксированных ферментов).-4 008194 В другом варианте реализации настоящего изобретения в устройстве используют контакт образца,содержащего белок PAMG-1 и меченое моноклональное антитело, первое из выбранной пары, которое селективно связывает PAMG-1. Кроме того, используют антитело, которое образует комплекс антителоPAMG-l, создают растекание капли этого комплекса в радиальном направлении и выявляют комплекс антитело-PAMG-l с помощью другого моноклонального антитела, распознающего PAMG-1, при этом порог чувствительности устройства устанавливают в диапазоне примерно 5-7 нг/мл с помощью дополнительных антител, что обеспечивает более высокую точность, чем использование только пары моноклональных антител, распознающих PAMG-1. На прилагаемых чертежах представлены на фиг. 1 - схематический вид в продольном разрезе устройства согласно изобретению, которое можно использовать для обнаружения PAMG-1 с целью диагностики разрыва плодной оболочки; на фиг. 2 - двумерное изображение устройства с фиг. 1. Подробное описание изобретения Настоящее изобретение решает вышеуказанные задачи точного обнаружения присутствия амниотической жидкости во влагалищном секрете путем определения во влагалищном секрете очень низких концентраций плацентарного 1-микроглобулина. Достоинство данного подхода связано с низкой фоновой концентрацией PAMG-1 (около 0,2 нг/мл во влагалищном секрете беременных женщин). Важным фактором данного изобретения является выбор моноклонального антитела для обнаружения низкой концентрации белка, которое обеспечивает количественное определение этого параметра и, в свою очередь,позволяет применять любые аналитические методы для определения содержания PAMG-1. Во влагалищном секрете можно ожидать присутствия низкой концентрации PAMG-1, поскольку проницаемость капиллярной стенки для белков крови зависит от посттрансляционных модификаций белков и их взаимодействия с другими молекулами (Marinaro J.A. et al.: O-glycosilation delays the clearance of human IGFbinding protein-6 from the circulation; Eur J Endocrinol 2000, May; 142(5):512; Schneeberger E.E.: ProteinsMed 2001; 19(1):97-101). Среди молекул PAMG-1, которые подвергаются посттрансляционным модификациям или устанавливают нековалентную связь с другими молекулами, имеются такие, проникновение которых во влагалищный секрет является минимальным. Концентрация таких молекул во влагалищном секрете должна быть низкой, если отсутствует разрыв амниотического мешка. Гетерогенность молекулPAMG-1 также может быть результатом альтернативного сплайсинга. Bell et al. представили данные,касающиеся двух близких, но различных белков 1-PEG в амниотической жидкости. 1-PEG близок кPAMG-1. Низкое или высокое проникновение различных молекул в вагинальный секрет происходит вследствие селективной проницаемости капиллярных стенок и селективных секреторных процессов. Успешный иммунологический анализ требует обнаружения низкой фоновой концентрации молекул PAMG1 во влагалищном секрете. Успешно выбрали пару моноклональных антител, пригодных для такого определения. Точные характеристики выявляемых молекул PAMG-1 оказались несущественными для целей настоящего изобретения за одним исключением: низкая концентрация этого белка во влагалищном секрете должна быть определена. Этот параметр является достаточным для установления порога чувствительности на низком уровне при поддержании значительного интервала между порогом чувствительности теста и фоновой концентрацией PAMG-1 во влагалищном секрете. Такой выбор оптимального порога чувствительности позволяет отфильтровывать потенциальные ложноотрицательные и ложноположительные результаты теста. Моноклональные антитела (monoclonal antibodies, MAb) по отношению к плацентарному 1 микроглобулину исследовали на основании их реакции в системе MAb-PAMG-1-конъюгат другого MAb согласно настоящему изобретению (пример 4, табл. 6). Максимальный титр получили, используя пару М 271-М 52. Однако, используя пару Mab271-МАb52 и стандартную методику ELISA (enzyme-linked immunosorbent assay - иммуносорбентный анализ с применением фиксированных ферментов), заявители не смогли обнаружить какую-либо концентрацию PAMG-1 во влагалищном секрете. Поэтому разработали специальную высокочувствительную методику ELISA для пары MAb271-МАb52 (пример 5, табл. 7) и использовали ее для измерения низких (в диапазоне пикограммов) концентраций PAMG-1 во влагалищных пробах (пример 6, табл. 8), а затем - в цервикальном и вагинальном секрете беременных женщин(пример 7, табл. 9). При анализе ELISA первый слой образовывался из высокоспецифичного MAb M271. Конъюгат пероксидазы хрена, содержащий MAb-М 52, разбавили буфером, в котором отсутствовали ингибирующие агенты.-5 008194 Из примера 7, табл. 9 можно видеть, что концентрация PAMG-1 в цервикальном и вагинальном секрете беременных женщин, не имеющих осложнений беременности, составляла от 0,05 до 0,22 нг/мл. Из этих данных следует, что нормальная концентрация PAMG-1 (8 случаев) локализуется около некоторого постоянного уровня. Относительная стабильность содержания PAMG-1 как во влагалище, так и в шейке может служить показателем стабильности параметров метода и стандартизации способа отбора проб; средний уровень нормальной концентрации PAMG-1 в цервикальном секрете составляет около 151 пг/мл, во влагалищном секрете - около 110 пг/мл; в случае гестационной патологии, не связанной с нарушениями кровеносных сосудов (анемия, задержка развития плода), наблюдается уровень PAMG-1, также близкий к нормальному; примесь крови сопровождается увеличением концентрации PAMG-1 в шейке, где наблюдался уровень 290 пг/мл в отличие от нормальной концентрации 151 пг/мл; уровень PAMG-1 возрастает при наличии симптомов преждевременных родов и гистоза, что можно объяснить увеличением проницаемости плодных оболочек для белков; при наличии подтекания амниотической жидкости уровень PAMG-1 резко возрастает (в 10-50 раз). Как показано в приведенных ниже примерах, для дальнейшей разработки способа, устройства и аналитического набора выбрали пару моноклональных антител М 271 и М 52. Таким образом, настоящее изобретение относится, в частности, к выбранной паре моноклональных антител, имеющих сродство к PAMG-1, биологическим составам, включающим антитела, имеющие сродство к PAMG-1, наборам для выявления PAMG-1 с помощью антител согласно настоящему изобретению и линиям клеток для получения антител согласно настоящему изобретению. Настоящее изобретение относится также к устройствам и способам определения содержания PAMG-1 и разрыва плодной оболочки на основании присутствия амниотической жидкости во влагалище, что показывает наличиеPAMG-1 во влагалищном секрете. В соответствии с приведенным далее более подробным описанием настоящее изобретение является,в частности, результатом исследования пары моноклональных антител, которые позволяют определять минимальную фоновую концентрацию PAMG-1 во влагалищном секрете беременных женщин. Минимальная фоновая концентрация PAMG-1 во влагалищном секрете и его высокая концентрация в амниотической жидкости позволяют, во-первых, установить порог чувствительности устройства на низком уровне и тем самым выявлять очень малые количества амниотической жидкости во влагалищном секрете, и, во-вторых, позиционировать порог чувствительности устройства оптимальным образом, в частности, между типичным низким уровнем минимальной фоновой концентрации PAMG-1 во влагалищном секрете беременных женщин, у которых отсутствует разрыв плодной оболочки, и высоким типичным уровнем PAMG-1 в амниотической жидкости. Дополнительные одно или несколько моноклональных антител против PAMG-1 позволяют более точно устанавливать порог чувствительности устройства на предварительно заданном уровне, например, для полуколичественного анализа. Кроме того, поскольку присутствие амниотической жидкости во влагалищном секрете является показателем разрыва плодной оболочки, определение обнаружение PAMG-1 во влагалищном секрете также можно использовать для определения разрыва плодной оболочки. Все это в сочетании позволяет минимизировать вероятность получения ложных результатов теста на определение PROM и PPROM. Согласно настоящему изобретению антитела, специфичные для PAMG-1, можно использовать в составах материалов, наборах, устройствах и способах, применяемых для обнаружения PAMG-1, и, соответственно, определять разрыв плодной оболочки на основании присутствия PAMG-1 во влагалищном секрете. Белок PAMG-1.PAMG-1 представляет собой белок, присутствующий в сыворотке крови, амниотической жидкости и вагинальном секрете беременных женщин, а также в сыворотке крови всех людей. PAMG-1 присутствует в сыворотке крови небеременных (0-60 нг/мл) и беременных (5-120 нг/мл) женщин, при этом определяемая концентрация зависит от пары моноклональных антител, которые используют для его определения (пример 1, табл. 1, 2). Известно, что применение различных пар антител к одному и тому же белку может приводить к различным результатам измерения концентрации этого белка. Так, например, в аналогичном исследовании Diamandi A. et al. (см. Diamandi A. et al. "Immunoassay of the Insulin-Like GrowthFactor-Binding Protein-3", Journal of Clinical Endocrinology and Metabolism, 2000, June, Vol. 85, No. 6, pp. 2327-2333) три варианта ELISA показали три различных концентрации IGFBP-3, что Diamandi A. et al. объяснили способностью каждой пары антител выбирать специфическую посттрансляционную модификацию молекул белка. PAMG-1 имеет гораздо более высокую концентрацию в амниотической жидкости,чем в сыворотке (2000-75000 нг/мл).PAMG-1 был выделен Д. Петруниным в 1977 г. из амниотической жидкости и вначале был определен как специфический альфа-1-глобулин плаценты (D. Petrunin, et al., "Immunological Identification of-6 008194 Аналогичный, но не идентичный белок, определенный как РР 12 (плацентарный протеин 12), позднее выделили из плацентарной и плодной оболочек Bohn, et al. ("Isolierung und Charakterisierung einesNeuen Placentaspezifischen Proteins (PP12)" in Arch. Gynecol., 980, Vol. 229, pp. 279-291). S. Bell, et al. сообщили о выделении эндометриального белка PEG-1, отличного от PP12, в двух заместителях аминокислот (аминокислоты N 11, 12) в N-концевых пептидах 15 аминокислот (S. Bell, et al., American Journal ofReproductive Immunology, 1989, Vol. 20, pp. 87-96). Для дальнейшей характеризации белков, выделенных из амниотической жидкости, провели ряд измерений с целью определения молекулярной массы PAMG-1. Для определения молекулярной массыPAMG-1 использовали метод иммуноблоттинга и получили результат, равный 32 кД (килодальтон, кД единица измерения атомной массы) (Boltovskaya, M. N. et al., "Histochemical and Clinico-Diagnostic StudyPAMG-1 может присутствовать в различных изоформах, т.е. может подвергаться различным посттрансляционным модификациям. Антитела могут иметь различную специфичность по отношению к разным изоформам, и этот факт может быть использован в качестве достоинства в анализах согласно настоящему изобретению. Антитела для PAMG-1. Первоначально использовали антитела, моноспецифические для PAMG-1 (см., например, Tatarinov,Y. et al. in Uspekhi Sovr. Biologii, 1990, Vol. 109, pp. 369-373). Позднее получили антитела, способные распознавать только те молекулы PAMG-1, которые не содержали IGF-1 и IGF-2 (патент США 5891722). Термин "антитело", используемый в данном описании, относится к любому белку, который обладает сродством к связыванию, как указанно в настоящей заявке, независимо от способа получения этого белка. Так, например, белок может представлять собой моноклональное антитело, его фрагмент или любую молекулу, обладающую специфичностью к связыванию, как указано в данной заявке. Согласно изобретению полипептид PAMG-1, выделенный из жидкостей организма, полученный в результате рекомбинации или химического синтеза, и его фрагменты, другие производные или аналоги,включая белки слияния, можно использовать в качестве иммуногена для получения антител, которые распознают полипептид PAMG-1. Такие антитела включают поликлональные, моноспецифические, моноклональные, химерные, одноцепочечные, фрагменты Fab и библиотеку экспрессии Fab, но не ограничиваются ими. Антитела против PAMG-1 согласно изобретению могут обладать перекрестной реактивностью, например, они могут распознавать PAMG-1 у различных биологических видов. Поликлональные антитела имеют более высокую вероятность перекрестной реактивности. В альтернативном варианте антитело согласно изобретению может быть специфичным к какой-либо одной форме PAMG-1. Предпочтительно такое антитело является специфичным по PAMG-1 человека. Различные способы, известные специалистам, можно использовать для получения поликлональных антител для полипептида PAMG-1, а также их производных или аналогов. Для получения антитела можно произвести иммунизацию различных животных-хозяев путем инъекции полипептида PAMG-1 или его производного (например, фрагмента или белка слияния). Такими животными могут быть, в частности, но без ограничения, кролики, мыши, крысы, овцы, козы и т.п. В одном из вариантов реализации полипептидPAMG-1 или его фрагмент может быть конъюгирован с иммуногенетическим носителем, например, с альбумином бычьей сыворотки (bovine serum albumin, BSA) или с гемоцианином лимфы улитки (keyholelimpet hemocyanin, KLH). Для повышения иммунологической реакции можно использовать различные адъюванты в зависимости от биологического вида хозяина, включая, в частности, но без ограничения адъювант Фрейнда (полный и неполный), минеральные гели, в частности, гидроксид алюминия, поверхностно-активные вещества, в частности, лизолецитин, плюрониловые многоатомные спирты, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки, динитрофенол и потенциально полезные адъюванты человека, в частности, бациллы Кальметта-Герена (bacille Calmette-Guerin, BCG) и Corynebacterium parvum. Для получения моноклональных антител к полипептиду PAMG-1 или их фрагментов, аналогов или производных можно использовать любые способы, которые обеспечивают продуцирование молекул антител непрерывными клеточными линиями в культуре. Эти способы включают, в частности, но без ограничения, способ гибридомы, первоначально разработанный Kohler и Milstein (Nature 1975, 265:495-497),а также способ триомы, способ гибридомы В-клеток человека (Kozbor et al., Immunology Today 1983,4:72; Cote et al., Proc. Natl. Acad. Sci. USA 1983, 80:2026-2030) и способ гибридомы EBV (Epstein-Barrvirus, вирус Эпштейна-Барра) для получения моноклональных антител человека (Cole et al., in Monoclonal Antibodies and Cancer therapy, Alan R. Liss, Inc., pp. 77-96, 1985). В другом варианте реализации изобретения моноклональные антитела можно получить у стерильных животных (International PublicationNo. WO 89/12690, опубликована 28 декабря 1989 г.). Согласно изобретению можно использовать способы, разработанные для получения "химерных антител" (Morrison et al., J. Bacteriol. 1984, 159:870; Neuberger et al., Nature 1984, 312:604-608; Takeda et al., 1985, Nature 314:452-454) путем соединения генов молекулы антитела мыши, специфичного к полипептиду PAMG-1, вместе с генами молекулы антитела чело-7 008194 века с соответствующей биологической активностью; такие антитела включены в область распространения настоящего изобретения. Указанные человеческие или гуманизированные химерные антитела являются предпочтительными для применения в терапии заболеваний и нарушений организма человека (описанных ниже), поскольку сами человеческие или гуманизированные антитела с гораздо меньшей вероятностью, чем ксеногенные антитела, индуцируют иммунную реакцию, в частности, аллергическую реакцию. Согласно изобретению способы, описанные для получения одноцепочечных антител (патенты США 5476786 и 5132405, Houston; патент США 4946778), можно адаптировать для получения одноцепочечных антител, специфических для полипептида PAMG-1. Эти гены действительно могут быть доставлены для экспрессии in vivo. Другой вариант реализации изобретения использует способы, описанные для построения библиотек экспрессии Fab (Huse et al., Science 1989, 246:1275-1281), чтобы обеспечить быструю и простую идентификацию моноклональных фрагментов Fab с желательной специфичностью для полипептида PAMG-1, или его производных, или аналогов. Фрагменты антитела, которые содержат идиотип молекулы антитела, можно получить известными способами. Так, например, указанные фрагменты включают, в частности, но без ограничения, фрагментF(ab)2, который можно получить путем расщепления пепсином молекулы антитела; фрагменты Fab, которые можно получить путем восстановления дисульфидных мостиков фрагмента F(ab)2, и фрагментыFab, которые можно получить путем обработки молекулы антитела папаином и восстанавливающим агентом. При получении антител скрининг желаемого антитела можно выполнить способами, известными специалистам, например, с помощью радиоиммунологического анализа, ELISA (иммуносорбентного анализа с применением фиксированных ферментов), послойного иммунологического анализа, иммунорадиометрического анализа, реакций преципитации с диффузией геля, иммунодиффузионного анализа,иммунологического анализа in situ (например, с помощью коллоидного золота, ферментов или радиоизотопных меток), вестерн-блоттинга, реакций преципитации, реакций агглютинации, (например, реакций агглютинации геля, реакций гемагглютинации), реакций связывания комплемента, иммунофлуоресцентных реакций, реакций протеина А, иммуноэлектрофорезных реакций и т.д. В одном из вариантов реализации связывание антитела определяют по выявлению метки первичного антитела. В другом варианте реализации первичное антитело выявляют путем связывания вторичного антитела или реагента с первичным антителом. В следующем варианте реализации метят вторичное антитело. Множество известных специалистам средств определения связывания в иммунологическом анализе включается в область распространения настоящего изобретения. Так, например, для выбора антител, которые распознают специфический эпитоп полипептида PAMG-1, можно проанализировать образующиеся гибридомы для продукта, связывающего фрагмент полипептида РАМG-1, содержащего указанный эпитоп. Для выбора антитела, специфического для полипептида PAMG-1 у конкретного вида животного, можно исходить из положительного связывания с полипептидом PAMG-1, экспрессированным или выделенным из клеток указанного вида животного. Специфичные антитела согласно настоящему изобретению. Линии клеток гибридомы согласно настоящему изобретению получают следующим способом. Вначале мышей, имеющих В-клетки селезенки и лимфатических узлов, подвергают иммунизации PAMG-1. Затем получают гибридомы для иммортализации В-клеток. В-клетки могут представлять собой В-клетки селезенки и/или лимфатических узлов. Эти гибридомы, вырабатывающие моноклональное антитело, которое обладает сродством к связыванию с PAMG-1, затем идентифицируют с помощью ELISA: первый слой - PAMG-1; второй слой - гибридомная надосадочная жидкость, и третий слой - конъюгат кроличьих антимышиных антител, меченых пероксидазой хрена. После этого указанные идентифицированные гибридомы культивируют в искусственных условиях или в асците и выделяют моноклональные антитела,которые они вырабатывают. В специфическом варианте реализации антитела получают из гибридомN52, N271 и N42, хранящихся в Российской национальной коллекции Банка производственных микроорганизмов с инвентарными номерами ВКПМ Н-92, ВКПМ Н-93 и ВКПМ Н-94 соответственно. Составы согласно настоящему изобретению. Настоящее изобретение относится также к серии составов, которые содержат два или несколько антител согласно настоящему изобретению. В одном из вариантов реализации состав содержит пару антител и детектируемый (выявляемый) маркер, присоединенный к одному из антител указанной пары. При этом можно использовать множество детектируемых маркеров, включая, но без ограничения, окрашенные частицы, ферменты, флуоресцентные красители и радиоактивные изотопы. Одним из примеров детектируемого маркера являются окрашенные частицы золота, имеющие средний размер в пределах от 20 до 30 нм. Другим примером детектируемого маркера является перокисдаза хрена. Способы присоединения детектируемого маркера к антителу описаны, например, в Methods In Enzymology, 1981, vol. 73, pp. 3-46, Harlow, E., and Lane, D.; "Anibodies a Laboratory Manual", Cold Spring Harbor Laboratory, 1988, pp. 322, 323, 343; Pierce Catalog, pp. T9-T17 (1996). Пригодные ферменты включают, в частности, но без ограничения, щелочную фосфатазу и перокисдазу хрена. Другие маркеры или метки для применения согласно изобретению включают коллоидное золото, окрашенные латексные гранулы, магнитные гранулы,-8 008194 флуоресцентные метки (например, флуоресцеин изотиоцианат, FITC), фикоэритрин (РЕ), техасовый красный (TR), родамин, свободные или хелатные соли лантаноидов, в особенности Еu3+, некоторые флуорофоры, хемилюминисцентные молекулы, радиоизотопы (125I, 32 Р, 35S, хелатный Тc и т.д.) или метки для магнитно-резонансной визуализации. Другие маркеры включают гашение флуоресценции (qeunching) и флуоресцентные трансфертные маркеры (fluorescence transfer), используемые, например, в гомогенных и твердофазных анализах. Кроме того, в соответствии с изобретением маркер может представлять собой эпитоп, партнер связывания, или обеспечивать взаимодействие с другой молекулой, в частности, с биотинстрептавидином, глутатионом-GST, гексагистидином никеля и т.п. Изобретение включает также применение вторичных антител, которые сами являются детектиуемыми метками и служат в качестве маркеров (например, в тех случаях, когда в паре анти-PMAG-l антител используют антитела, содержащие части Fc от двух различных видов животных). В другом варианте реализации настоящего изобретения состав может включать два или несколько моноклональных антител, локализованных в зоне анализа стрип-устройства согласно изобретению. Аналитические наборы согласно настоящему изобретению. Настоящее изобретение относится также к аналитическим наборам для обнаружения PAMG-1. В одном из вариантов реализации аналитический набор включает пару антител согласно изобретению, одно из которых является высокоспецифичным по отношению к PAMG-1. В одном варианте набора одно из двух антител содержит детектируемый маркер, присоединенный к антителу. В другом варианте набора одно из двух антител выбранной пары присоединяют к твердой подложке. В этом варианте мобилизуемое антитело из выбранной пары содержит детектируемый маркер. В следующем варианте реализации состав содержит три или более моноклональных антител, одно из которых является мобилизуемым и детектируемым. Такая комбинация позволяет регулировать порог чувствительности иммунохроматографического анализа. В одном из вариантов реализации изобретения анти-PAMG-l антитело с максимальным сродством к связыванию является мобилизуемым и помещается в зону прокладки устройства с целью обеспечения начального контакта с образцом. Другое антитело помещают в зону анализа устройства. В альтернативном исполнении другие моноклональные антитела с высоким сродством к связыванию PAMG-1, хотя и меньшим, чем максимальное сродство к связыванию, можно получить в приготовить различных комбинациях для иммобилизации в зоне анализа устройства, чтобы установить или настроить предварительно определенный порог чувствительности устройства согласно изобретению. Это можно выполнить с помощью стандартных экспериментов, как показано в примере 11. Различные сочетания антител обеспечивают различные уровни порогового обнаружения сигнала в устройстве согласно настоящему изобретению согласно имеющимся требованиям. Способы и устройства для определения PAMG-1. Настоящее изобретение устанавливает, что PAMG-1, в частности, PAMG-1, присутствующий в амниотической жидкости в гораздо большем количестве, чем в нормальной влагалищной жидкости, является полезным аналитом для определения разрыва плодной оболочки, который приводит к проникновению амниотической жидкости во влагалище. Иными словами, он позволяет диагностировать преждевременный разрыв оболочек, т.е. амниотического мешка. Изобретение устанавливает также пороговые значения для обнаружения PAMG-1 при нормальных условиях, различных симптомах вагинита и истинном разрыве оболочки. Идентифицировав аналит и относительные уровни содержания, указывающие на разрыв оболочки, специалист в данной области может успешно использовать любой известный аналитический способ для определения содержания белков, чтобы установить, имеет ли место преждевременный разрыв плодной оболочки у пациентки. Иммунологический анализ, в частности иммунохроматографический анализ, является предпочтительным способом согласно изобретению. Методика иммунологического анализа подробно описана далее. Достоинствами этого анализа являются специфичность, точность, быстрота выполнения и экономичность. Изобретение может использовать также другие способы обнаружения и количественного определения PAMG-1, хотя указанные способы могут потребовать применения дорогостоящего оборудования и ограничить параметры анализа имеющимися лабораторными настройками оборудования. Одним из таких способов является масс-спектрометрия, например, применение времяпролетной (ТОF) массспектрометрии (MS) с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI) с задержанной экстракцией и рефлектроном во времяпролетной камере. Анализ MALDI предпочтительно проводят на кремниевых матрицах. Примером матрицы для MALDI являются круглые гелевые прокладки размером 200 мкм, располагаемые на центрированных подложках из окисленного кремния размером 350 мкм. Гидрофобная (водоотталкивающая) поверхность между гелевыми прокладками обеспечивает получение более фокусированной матрицы/белковой точки для MALDI, что повышает сигнал для количественного определения. Так, например, точки, образующиеся с помощью системы Packard Bioscience, могут иметь диаметр менее 200 мкм. Система Piezo позволяет доставлять матрицу MALDI величиной около 300 пл(например, DHB, синапиновая кислота) в точную позицию местоположения агента, имеющего сродство к связыванию, и пептида, чтобы создать однородный пептидно-матричный кристалл. Десорб-9 008194 ция/ионизация (Karas et al., Ion Processes, 1987, v. 78, pp. 5-68 or Zenobi et al. Mass Spectrom. Rev. 1998, v. 17, pp. 337-366) из этого кристалла в MALDI-MS (например, Perseptive Voyager) образует масс-спектр, в котором высота пептидного пика связана с количеством белка, содержащего указанный пептид. Альтернативным способом применения настоящего изобретения является капиллярная электрофоретическая хроматография, которая позволяет количественно определять аналит, присутствующий в образце в малых концентрациях. Кроме того, можно использовать количественные биохимические методы анализа, в частности,электрофорез на полиакриламидном геле, жидкостную хроматографию высокого разрешения и т.п., отдельно или в сочетании, чтобы выявить и количественно определить содержание PAMG-1 в образце. Иммунологические методы и устройства обнаружения PAMG-1. Различные средства обнаружения иммуноспецифического связывания антитела с антигеном, известные специалистам, могут быть использованы для обнаружения связывания согласно настоящему изобретению. Давно применяемый способ обнаружения взаимодействия между антигеном и антителом с помощью анализа комплекса заключается в осаждении на гелях. Другой способ определения связывания пары аналит-идентифицирующее антитело включает применение меченных радиоактивным йодом идентифицирующих антител или меченного радиоактивным йодом белка, реагирующего с IgG, в частности,протеина А. Эти традиционные способы хорошо известны специалистам и описаны, в частности, в работе Methods in Enzymology, 1980, v. 70, pp. 166-198. Выбрав антитело и условия получения положительного результата над пороговыми значениями для PROM, указанные в настоящем описании, можно использовать эти способы при реализации данного изобретения. Разработанные позднее способы определения аналита с помощью только одного антитела включают анализ конкурентного связывания. При этом на антитело, которое обычно иммобилизуют на твердой подложке, взаимодействует с образцом, в котором предполагается присутствие аналита, вместе с известным количеством меченого аналита. Два аналита, а именно, меченый аналит и аналит, присутствующий в образце, конкурируют за центр связывания антитела. Определение свободного меченого аналита или связанного меченого аналита позволяет установить содержание конкурирующего аналита в образце. Более подробное описание этого способа приведено в "Basic Principles of Antigen-Antibody Reaction", ElvinA. Labat, (Methods in Enzymology, 70, 3-70, 1980). В этом примере меченый аналит может быть помечен радиоактивным изотопом или ферментной меткой. Более современные методы иммунологического анализа используют способ двойного антитела для определения присутствия аналита. Эти способы также описаны в вышеуказанной работе Methods in Enzymology. Согласно одному из вариантов реализации настоящего изобретения присутствие отдельных маркеров определяют с помощью пары антител, специфических для каждого определяемого маркера. Одно из антител указанной пары называют идентифицирующим антителом, а другое иммобилизованным антителом. Один из вариантов реализации настоящего изобретения использует послойный метод с двумя антителами для определения PAMG-1 в образце вагинальной жидкости. В этом методе аналит помещают между идентифицирующим антителом и иммобилизованным антителом, при этом иммобилизованное антитело необратимо иммобилизуют на твердой подложке. Идентифицирующее антитело содержит детектируемую метку, которая позволяет определять присутствие слоистой структуры антитело-аналит и тем самым - присутствие аналита. Традиционно применяемые формы твердых подложек включают пластины, трубки или гранулы,все из которых хорошо известны специалистам в области радиоиммунологического анализа и ферментного иммунологического анализа. Позднее в качестве твердых подложек стали применять ряд пористых материалов, в частности нейлон, нитроцеллюлозу, ацетат целлюлозы, стекловолокно и другие пористые полимеры. В одном специфическом варианте реализации устройство согласно изобретению содержит средство для проведения иммунохроматографического анализа ("устройство для иммунохроматографического анализа"). Такое устройство содержит твердофазное средство для пропускания жидкости. Термин "твердофазное средство для пропускания жидкости", используемый в данном описании, относится к твердотельной подложке, через которую может мигрировать жидкость, например, за счет капиллярного механизма. Типичным продуктом такой природы является нитроцеллюлозная мембрана, которую можно получить способами, известными специалистам. Многие средства и способы иммунохроматографического анализа известны специалистам и могут быть использованы при реализации настоящего изобретения. Средства для иммунографического анализа,использующие мембрану в качестве твердой подложки в устройстве в виде измерительного стержня, или в проточном устройстве, хорошо приспособлены для применения в клинической лаборатории и в альтернативных, т.е. в нелабораторных условиях эксплуатации. Устройство для иммунохроматографического анализа обычно представляет собой мембрану (целлюлозную или нецеллюлозную), установленную в пластмассовом держателе. Пластмассовый держатель фиксирует мембрану соответствующей конфигурации, чтобы обеспечить правильное функционирование всего устройства. Существует множество видоизменений базовой конструкции аналитических устройств. Так, например, Litman et al. (патенты США 5156952 и 5030558) описывают способ анализа и устройство для определения присутствия мини- 10008194 мальных количеств аналита в образце. Ullman et al. (патенты США 5137808 и 4857453) описывают устройство, содержащее аналитическую мембрану с замкнутой системой жидких реагентов, которая обеспечивает протекание образца. Dafforn et al. (патент США 4981768) описывают устройство с каналами для подачи образца и дополнительной жидкости. Corti et al. (европейская патентная заявка 89118378.2) Greenquist et al. (патент США 4806312) и Berger et al. (патент США 5114673) также описывают аналитические устройства. Устройство для иммунохроматографического анализа предпочтительно включает контрольное средство, указывающее на правильность проведения анализа. Контрольное средство может представлять собой специфичный связывающий реагент, который нанесен в точке, более удаленной от точки нанесения образца на твердотельную подложку, чем зона анализа, и который связывается с меченым реагентом в присутствии или при отсутствии аналита, указывая при этом, что мобилизуемый рецептор вместе с жидким образцом мигрировал на достаточное расстояние, чтобы дать значимый результат. Метки, пригодные для применения в иммунохроматографическом анализе, включают ферменты,флуорофоры, хромофоры, радиоизотопы, красители, коллоидное золото, коллоидный уголь, латексные частицы и хемилюминисцентные агенты. При использовании контрольного маркера можно применять одни и те же или различные метки для рецептора и контрольного маркера. В одном из вариантов реализации настоящего изобретения для проведения иммунологического анализа используют устройство проточного типа.Valkirs et al. (патент США 4632901) описывают устройство, содержащее антитело, специфичное для антигенного аналита и связанное с пористой мембраной или фильтром, на которые наносят жидкий образец. При протекании жидкости через мембрану определяемый аналит связывается с антителом. Введение образца производят после введения меченого антитела. Визуальное определение меченого антитела указывает на присутствие в образце определяемого аналита. Другой пример проточного устройства предложили Kromer et al. (EP-F 0229359), которые описывают систему доставки реагента, содержащую матрицу, насыщенную реагентом или его компонентами,диспергированными в водорастворимом полимере, для регулирования скорости растворения реагента и его доставки в реакционную матрицу, расположенную под насыщенной матрицей. В анализах миграционного типа твердотельную подложку, например, мембрану, пропитывают реагентами, необходимыми для проведения анализа. Создают тестовую зону выявления аналита, в которой связывается меченый аналит, и производят считывание результатов анализа. В частности, см. Тоm et al.(патент США 4366241) и Zuk (EP-A 0143574). Устройства для проведения миграционного анализа обычно содержат реагенты, присоединенные к окрашенным меткам, в частности к коллоидному золоту или углероду, что позволяет визуально получать результаты анализа без добавления дополнительных веществ. См., например, Bernstein (патент США 4770853), May et al. (WO 88/08534) и Ching et al. (EPA 0299428). Все эти известные типы проточных устройств могут быть использованы согласно настоящему изобретению. Одним из примеров меток, которые могут быть использованы в иммунохроматографических анализах согласно настоящему изобретению, являются прямые метки. Прямая метка определяется как компонент, который легко виден в естественном состоянии невооруженным глазом или с помощью оптического фильтра и/или применения стимуляции, например, ультрафиолетовым излучением, для создания флуоресценции. Примеры окрашенных меток, которые можно использовать согласно настоящему изобретению, включают металлические зольные частицы, например зольные частицы золота, описанные, в частности, Leuvering (патент США 4313734), зольные частицы красителей, описанные, в частности,Gribnau et al. (патент США 4373932) и May et al. (WO 88/08534), окрашенный латекс, описанный, в частности, May, см. выше, Snyder (ЕР-А 0280559 и 0281327) или красители, инкапсулированные в липосомы, описанные Campbell et al. (патент США 4703017). Другие прямые метки включают радионуклиды, флуоресцентные соединения или люминесцентные соединения. Кроме указанных прямых меток согласно настоящему изобретению могут быть использованы также косвенные метки, содержащие ферменты. Различные типы иммунологических анализов со связанными ферментами хорошо известны специалистам, например, щелочная фосфатаза и пероксидаза хрена, лизоцим, глюкоза-6 фосфатдегидрогеназа, лактатдегидрогеназа, уреаза и другие соединения подробно рассмотрены Eva Engvall в работе Enzyme Immunoassay ELISA and EMIT in Methods in Enzymology, 70,419-439,1980 и патенте США 4857453. В специфическом варианте реализации диагностическое устройство согласно настоящему изобретению содержит мембранный блок, в котором зона идентификации расположена вблизи точки введения образца, а зона захвата удалена вниз по течению потока от этой позиции. Зона идентификации содержит антитела (идентифицирующие антитела), которые реагируют с аналитами согласно настоящему изобретению, присутствующими в образце. Идентифицирующие антитела обратимо иммобилизованы на мембране и мигрируют с образцом в процессе применения. Предпочтительно, хотя и не обязательно, чтобы идентифицирующие антитела были мечеными, например, радионуклидами, ферментами, флуоресцентными соединениями, люминесцентным соединением или окрашенными метками, описанными, в частно- 11008194 сти, в прототипах и рассмотренными выше. Например, можно использовать реактивную метку, с которой антитело имеет золотистый цвет до захвата антигена и меняет его на фиолетовый цвет после захвата. Зона захвата, которая, как указано выше, расположена ниже по течению потока от зоны идентификации, содержит захватывающие антитела, необратимо иммобилизованные на твердой подложке, при этом все антитела иммобилизованы в различных позициях зоны захвата. Антитела и необходимые реагенты иммобилизованы на твердой подложке известными стандартными способами, рассмотренными выше при описании устройств проточного типа для проведения иммунологического анализа. В общем случае антитела абсорбируются на твердотельных подложках в результате гидрофобного взаимодействия между неполярными белковыми субструктурами и неполярным материалом матрицы подложки. Особым достоинством способов иммунохроматографического анализа согласно настоящему изобретению является возможность получения количественных результатов. Зона захвата может содержать,соответственно, смесь иммобилизованных антител, специфических для PAMG-1, при этом сигнал вырабатывается только в том случае, если содержание PAMG-1 в образце превышает желаемый порог обнаружения. Кроме того, настоящее изобретение предполагает использование однородных способов иммунологического анализа. Один из примеров такого конкурентного однородного способа приведен в патенте США 3817837, Rubenstein и Ullman, где описан способ, в котором лиганд и ферментсвязанный лиганд конкурируют в занятии центров связывания антитела. Поскольку связывание антитела с ферментсвязанным лигандом изменяет активность фермента, концентрацию присутствующего лиганда можно определять, измеряя скорость, с которой смесь превращает субстрат в продукт. Таким образом, в однородном методе способность детекции метки существенно отличается в зависимости от связанного или несвязанного состояния метки. В связанном состоянии метка дает большую или меньшую интенсивность сигнала. Обычно связывание антитела с меченым лигандом вызывает уменьшение интенсивности сигнала, например, в том случае, если метка является ферментом. Типичные продукты данной категории включают линейку наборов EMIT для иммуноферментных анализов производства Syva Company и линейку TDX для флуоресцентных поляризационных иммунологических анализов производства Abbot Diagnostics. Особенно однородный анализ можно провести при нанесении всех аналитов на гранулы. В этом случае при введении образца гранулы перемешивают, осаждают и анализируют. Другие примеры устройств для биологической диагностики, которые можно использовать согласно настоящему изобретению, включают устройства, описанные G. Grenner, P.В. Diagnostics Systems, Inc., в патентах США 4906439 и 4918025. Устройство, описанное в патенте Grenner '439, содержит диагностический тестовый элемент и блок ввода образца, включающий элемент подачи жидкости, который имеет слой со множеством канавок для подачи образца в тестовый элемент. Патент Grenner '025 относится к устройству, содержащему средство для ввода образца, в частности, мембрану, рядом с которой расположен капилляр со связанным реактивом и резервуар для жидких отходов. Выделение связанного реагента из капилляра завершает реакцию после осаждения образца, а избыточная жидкость сохраняется в резервуаре для отходов, таким образом, устройство является автономным. Измерение с применением мембраны является предпочтительным, однако, следует понимать, что другие способы и соответствующие сенсорные устройства могут быть также использованы аналогично описанным выше. В настоящее время существуют автоматические анализаторы, которые могут производить анализ нескольких образцов одновременно. Такие автоматические анализаторы включают приборы непрерывного действия/приборы с произвольной выборкой. Примеры указанных систем включаютNorth Chicago, I11., 1988 г. В общем случае образец анализируемой жидкости вводят в приемную емкость, после чего все операции процесса, включая закапывание образца из пипетки в тестовый элемент,инкубацию и считывание полученного сигнала, выполняются автоматически. Системы автоматического анализа обычно включают ряд рабочих позиций, каждая из которых выполняет одну из операций процедуры анализа. Тестовый элемент может перемещаться с одной рабочей позиции на другую различными средствами, например, с помощью барабана или передвижного штатива, чтобы обеспечить последовательное выполнение операций анализа. Тестовые элементы могут включать также резервуары для хранения реагентов, смешивания жидкостей, разбавления образцов и т.п. Кроме того, тестовые элементы могут содержать отверстие для нанесения на пористое тело предварительно определенного количества жидкого образца и в случае необходимости - другого требуемого реагента. Тестовый элемент может также содержать окно для считывания сигнала, получаемого в результате аналитической операции и обычно представляющего собой флуоресцентное или калориметрическое изменение реагентов, присутствующих на пористом теле, например, с помощью спектроскопа или флуориметра, включенных в аналитическую систему. Приборы для автоматического анализа производства РВ Diagnostic System, Inc. описаны в патентах США 5051237; 5141871 и 5147609. Следующим классом систем для иммунохимического анализа, которые можно использовать для реализации настоящего изобретения, являются биосенсорные или иммуносенсорные оптические системы. В общем случае оптический биосенсор представляет собой устройство, которое использует оптические принципы для количественного анализа определяемого компонента с помощью преобразования его- 12008194 химической или биохимической концентрации или активности в электрические сигналы. Такие системы можно разделить на четыре основные категории: устройства, измеряющие отражение, устройства поверхностного плазменного резонанса, оптоволоконные устройства и устройства интегральной оптики. Устройства, измеряющие отражение, включают эллипсометрию, спектроскопию отражения с многократным интегрированием, флуоресцентные капилляродиффузионные системы. Оптоволоконные устройства включают флуоресценцию рассеянных полей, оптоволоконные капиллярные трубки и оптоволоконные флуоресцентные сенсоры. Устройства интегральной оптики включают флуоресценцию планарных рассеянных полей, иммуносенсоры с входным дифференцирующим устройством связи, интерферометр МахаЦендера, интерферометр Хартмана и дифференциальные интерферометрические сенсоры. Голографическое определение реакций связывания осуществляют по присутствию голографического изображения,которое формируется с предварительно заданной ориентацией, когда один реагент из связывающей пары связывается с иммобилизованным вторым реагентом этой пары (см. патент США 5352582, выданный 4 октября 1994 г. Lictenwalter et al.). Общее описание примеров оптических иммуносенсоров приведено в обзорной статье G.A. Robins (Advances in Biosensors), vol. 1, pp. 229-256, 1991. Более подробное описание этих устройств можно найти, например, в патентах США 4810658; 4978503 и 5186897; R.A. Brady etal. (Phil. Trans. R. Soc. Land. В 316, 143-160, 1987) и G.A. Robinson et al. (in Sensors and Actuators, Elsevier,1992). Способы и соответствующие аналитические наборы согласно настоящему изобретению можно использовать в различных оптических измерительных системах. В частности, в то время как аналитические наборы и материалы согласно настоящему изобретению можно применять в способе иммунологического анализа, такой способ можно реализовать в различных оптоэлектронных аналитических системах. При этом известно множество оптических иммуносенсорных систем, которые могут быть использованы для практической реализации настоящего изобретения. Так, например, устройства и способы, в частности,отражательные способы, поверхностный плазменный резонанс, оптоволоконные волноводные способы устройства интегральной оптики могут быть адоптированы и специально конфигурированы для определения и отображения результатов анализа биологических проб пациенток в соответствии со способом согласно настоящему изобретению. Особые способы отражения, в частности, измерение коэффициента отражения и эллипсометрия, а также специфическое применение оптических волокон, оптических волноводов, флуоресцентных капилляродиффузионных систем и интегральных оптических биосенсоров,представляют собой некоторые варианты способов и оборудования, которые также могут быть использованы. Общий обзор этих устройств можно найти в работе Robinson, G.A., Optical Immunosensors: AnOverview, Advances in Biosensors, vol. 1, pp. 229-256 (1991). Более конкретно, эллипсометрия основана на направлении луча поляризованного света вначале к базовой поверхности (стандарту), а затем - к поверхности образца с последующим сравнением природы и величины полученных отражений. В частности, связывание аналита с молекулами рецептора измеряется как изменение толщины поверхности относительно базовой поверхности. В случае спектроскопии внутреннего отражения лиганд и его рецептор могут быть, например, ковалентно иммобилизованы на оптической поверхности планарного волновода из плавленого кварца, после чего луч света может быть внутренне отражен в волноводе и направлен в раствор, расположенный рядом с волноводом. При этом можно измерять разность хода преломленных лучей от стандарта и образца. В этом особом способе можно использовать флуоресцентную метку и произвести измерения флуоресценции, чтобы определить имеющуюся степень связывания. В другом способе используют устройства, известные как флуоресцентные капилляродиффузионные системы. В этой системе две стеклянные пластины устанавливают на расстоянии, равном размеру капилляра. Рецепторные молекулы могут быть иммобилизованы на базовой пластине, которая служит также в качестве оптического волновода. Можно произвести конкурентный или послойный анализ, использующий мечение FITS (fluorescein isothiocyanate, флуоресцинизотиоционат), а индуцированную флуоресценцию соединить в волноводе с сигналом от связанного источника, противоположным сигналу от несвязанных источников. Такой сигнал выделяется по его угловой расходимости после выхода из волновода. Разработаны также устройства поверхностного плазменного резонанса (Surface Plasmon Resonance, SPR),которые действуют, реагируя на связывание света, падающего на тонкую металлическую пленку, в поверхностных модах, связанных с коллективными электронными осцилляциями в металлической пленке. Условие резонанса зависит от оптических характеристик металлической пленки, ее толщины, коэффициентов преломления диэлектрика, расположенного по обеим сторонам пленки и угла падения света. Молекулы рецепторов связываются с верхней стороной металлической пленки, а свет направляют к нижней стороне пленки, в частности, через призматическую подложку. Определяемый аналит, связываясь с этими рецепторами, вызывает изменение локального коэффициента преломления и вследствие этого изменяет условия резонанса. Резонанс наблюдают, контролируя интенсивность отраженного света, поскольку угол падения светового луча на поверхность металлической пленки изменяется. Изменение величины угла, при котором возникает резонанс, непосредственно коррелирует с количеством связанного аналита. Способ, использующий оптоволоконные системы, включает флуоресценцию рассеянных полей. В этом способе конец оптического волокна освобождают от плакирующей оболочки, получая сенсорный- 13008194 элемент, который взаимодействует с окружающей средой в кратковременном режиме. Молекулы рецептора связываются с открытой поверхностью волокна, при этом можно провести прямой анализ, используя естественную флуоресценцию рецептора и конъюгатных белков. Для повышения чувствительности можно использовать конкурентный или послойный анализ с мечением FITC. При проведении анализа световую волну пропускают по волокну, и часть кратковременно образующегося флуоресцентного излучения входит обратно в волокно и возвращается к чувствительному элементу. Другой оптоволоконный способ использует капиллярную трубку оптического волокна, при этом оптическое волокно без плакирующей оболочки помещают в цилиндрическую заполняемую камеру, получая сенсорный элемент, который кратковременно взаимодействует с частью заполняемого объема, непосредственно окружающего волокно. Молекулы рецептора могут связываться с открытой поверхностью волокна, при этом можно произвести послойный анализ или анализ конкурентного вытеснения. Световая волна перемещается по волокну, и часть кратковременно индуцированного флуоресцентного излучения входит обратно в волокно и возвращается к чувствительному элементу. Сигнал от определяемого аналита выделяют из сигналов фоновых источников по его угловой расходимости после выхода из волокна. Другие оптоволоконные способы, в частности, оптоволоконная флуоресценция, могут быть адаптированы для реализации настоящего изобретения с помощью таких же принципов, как описаны выше. Другие фотонные способы, в частности, интерферометрия, включают установку тонкопленочного волновода, содержащего, например, две дорожки, на первой из которых могут быть иммобилизованы молекулы рецептора, а вторая - экранирована для создания опорного канала. Лазерное излучение можно ввести, например, в волновод и разделить между двумя дорожками таким образом, чтобы по сдвигу фаз луча определять изменения коэффициента преломления и толщину защитного слоя, которые в свою очередь коррелируют с количеством связанного аналита. Видоизменение такого способа используют в интерферометре Хартмана, где имеется мультимодальный тонкопленочный планарный волновод с одной дорожкой. Молекулы рецептора могут быть иммобилизованы на этой дорожке, а лазерное излучение может быть введено в волновод таким образом, чтобы по указанной дорожке распространялись две моды. Оптические свойства мультимодальной геометрии таковы, что мода высшего порядка имеет большее поле рассеяния, обеспечивая сигнальный механизм, а мода низшего порядка практически не имеет поля рассеяния и создает опорный механизм. Связывание с определяемым аналитом вызывает относительные изменения коэффициента преломления и толщины защитного слоя на дорожке, которые определяются полем рассеяния моды высшего порядка и приводят к сдвигу фазы в этой моде. Поскольку мода низшего порядка или опорная мода не реагирует на такие изменения и в этой моде не происходит сдвига фазы,измерение разности хода сигнального и опорного лучей позволяет получить корреляцию для определения количества связанного аналита. Приведенное выше описание, как общих условий, так и некоторых деталей, показывает возможность адаптации различных способов применения оптических сенсоров для практической реализации настоящего изобретения. Следует понимать, что вышеприведенное описание не является ни исчерпывающим, ни ограничительным, поскольку существует возможность применения множества современных способов, позволяющих успешно измерять разность связывания и, соответственно, определять присутствие и количество соответствующих маркеров или аналитов, представляющих интерес. Как подчеркивалось выше, независимо от применяемого способа реализация настоящего изобретения включает одновременное определение и измерение содержания по меньшей мере трех аналитов. Иммунохроматографические способы обнаружения PAMG-1. Ниже описаны способы обнаружения PAMG-1 согласно настоящему изобретению. В одном из вариантов реализации способа PAMG-1 выявляют в образце посредством контакта образца, содержащего PAMG-1, с иммунологической аналитической системой согласно настоящему изобретению, чтобы получить комплекс антитело-PAMG-l. Затем производят выявление присутствия комплекса антитело-PAMG-1. В одном из вариантов реализации этого способа антитело содержит детектируемый маркер, при этом определяют содержание комплекса антитело-PAMG-l, содержащего детектируемый маркер. В другом варианте реализации способа PAMG-1 выявляют в образце, контактирующем с антителом, которое имеет высокое сродство к связыванию с PAMG-1 (как М 271, описанное ниже), получая при этом комплекс антитело М 271-PAMG-1. Затем полученный комплекс вступает в контакт с иммобилизованным вторым антителом (например, типа М 52). Второе антитело иммунологически отличается от первого антитела, и они не являются перекрестно реактивными, поэтому такие антитела могут одновременно связываться с молекулой PAMG-1. Иммобилизованное антитело связывается с комплексом (подвижное антитело)-РАМС-1, образуя комплекс иммобилизованное антитело-PAMG-l антитело. PAMG-1 выявляют по присутствию этого гетеротримерного комплекса. Как указано выше, для начального распознавания PAMG-1 предпочтительно используют антитело с высокой специфичностью к PAMG-1. В то время как вышеописанный способ включает применение одного антитела из выбранной пары,меченого детектируемым маркером, видоизмененный вариант этого способа включает контактирование образца с первым меченым антителом, а затем - контакт образца со вторым, иммобилизованным антителом. В этом варианте меченое антитело служит для связывания PAMG-1 в образце. В другом варианте- 14008194 реализации способ включает следующие операции: введение жидкого образца, содержащего PAMG-1, в зону пористого материала с мобилизуемым меченым антителом, при этом антитела и белки могут мигрировать сквозь указанный материал, а зона антител содержит мобилизуемое антитело, обладающее высокой специфичностью к PAMG-1, которая приводит к присоединению антитела к PAMG-1 и образованию комплекса антитело-PAMG-l; миграцию комплекса в зону анализа, содержащую второе антитело,иммобилизованное в ней, при этом указанное второе антитело обладает сродством к связыванию сPAMG-1, что приводит к связыванию второго антитела с меченым комплексом антитело-PAMG-l и образованию иммобилизованного комплекса, и выявление иммобилизованного комплекса в зоне анализа. Другой вариант реализации способа представляет собой стандартный послойный анализ, в котором немеченое антитело иммобилизуют на какой-либо поверхности. Добавление жидкого образца приводит к образованию иммобилизованного комплекса, состоящего из иммобилизованного антитела и PAMG-1. Добавление меченого антитела приводит к образованию иммобилизованного комплекса, состоящего из иммобилизованного антитела, PAMG-1 и меченого антитела, и с последующим выявлением этого комплекса. Согласно вышеописанным способам антитела могут включать детектируемый маркер или метку, а операция выявления комплекса антитело-PAMG-l или PAMG-1-антитело включает обнаружение детектируемого маркера или метки. Примеры детектируемых маркеров, которые могут быть использованы,включают окрашенные частицы, ферменты, красители и радиоактивные изотопы. В специфическом варианте реализации детектируемый маркер представляет собой окрашенные частицы золота, имеющие средний размер, например, около 20-30 нм. В другом варианте реализации детектируемый маркер представляет собой пероксидазу хрена. Примеры устройств для обнаружения PAMG-1. Существует множество устройств для обнаружения белка PAMG-1 в образце. Отдельный вариант реализации устройства согласно настоящему изобретению для обнаружения PAMG-1 показан на фиг. 12. Предпочтительно, чтобы устройства согласно настоящему изобретению могли выявлять наличиеPAMG-1 в образце, если концентрация PAMG-1 составляет от 5 до 50 нг/мл. Предпочтительно также,чтобы указанные устройства имели порог чувствительности около 5-7 нг/мл. Чем шире интервал между фоновой концентрацией PAMG-1 и порогом чувствительности устройства, тем ниже вероятность получения ложноположительных результатов. В данном разделе рассматриваются различные возможные варианты реализации устройств согласно настоящему изобретению на примере устройства, показанного на фиг. 1, 2. Следует отметить, что это устройство может служить для простого обнаружения присутствияPAMG-1 в образце влагалищного секрета. Термин "примерно", используемый в данном описании, означает "в пределах допустимой погрешности" для конкретной величины, которая определяется специалистом в данной области и которая частично зависит от способа измерения или определения, т.е. от ограничений измерительной системы. Так,например, термин "примерно" может означать "в пределах 1 или более чем 1 стандартного отклонения" согласно принятой практике в данной области. Альтернативно термин "примерно" может означать диапазон до 20%, предпочтительно до 10%, более предпочтительно до 5% и еще более предпочтительно до 1% данной величины. Альтернативно, в особенности для биологических систем или процессов, этот термин может означать "в пределах порядка величины", предпочтительно в пределах 5 крат и более предпочтительно в пределах 2 крат указанной величины. При описании в данной заявке и формуле изобретения конкретных величин термин "примерно", если не указано иного, следует понимать как "в пределах допустимой погрешности для соответствующей величины". Описание устройства согласно настоящему изобретению В качестве примера в настоящем описании использованы моноклональные антитела, рассмотренные ниже. Однако использование именно этих специфичных моноклональных антител не является обязательным. Как показано на фиг. 1 и 2, устройство имеет стрип-структуру, состоящую из нескольких взаимосвязанных элементов. Более конкретно, деталь 12 устройства содержит прокладку с зоной 10, в которой находятся антитела М 271, меченые, например, окрашенными частицами SP (не показаны на чертежах). Прокладка 12 может быть выполнена из стекловолокнистой ткани или иного пористого материала,который не препятствует миграции различных веществ и субстанций образца. Окрашенные частицы могут представлять собой частицы золота, имеющие размер в пределах от 20 до 30 нм. Зона антител М 271 содержит также мышиный иммуноглобулин IgG, меченый таким же окрашенными частицами. Меченые антитела М 271 и мышиный иммуноглобулин IgG вводят в стрип-часть 10 прокладки 12 путем пропитывания прокладки 12 раствором меченых антител М 271 и меченого мышиного иммуноглобулина IgG. Раствор антител М 271 и мышиного иммуноглобулина IgG можно вводить в нитроцеллюлозную мембрану 22 с помощью чертежного пера или микрокапельницы. Нитроцеллюлозная мембрана 22, соединенная с одним концом прокладки 12 в продольном направлении, содержит зону 14 анализа и зону 16 контроля. Зона 14 анализа и зона 16 контроля расположены в поперечном направлении по всей ширине устройства. Зона 14 анализа представляет собой часть полосы нитроцеллюлозной мембраны 22. Зона 14 анализа содержит антитела М 52, присоединенные к нитроцеллюлозной мембране 22. Зона 16 контроля содержит антитела против иммуноглобулинов мыши, присоединенные к нитроцеллюлозной мембране 22. Зона- 15008194 контроля 16 проходит по всей ширине полосы 22. Мембрану 24 из фильтровальной бумаги соединяют с концом нитроцеллюлозной мембраны 22, противоположным концу нитроцеллюлозной мембраны 22,который соединяется с прокладкой 12. Мембрану 24 из фильтровальной бумаги соединяют с концом нитроцеллюлозной полосы 22 в ее продольном направлении. Поверхность устройства покрывают специальными защитными пленками 28 и 30, например, тонкими клейкими лентами, специально предназначенными для стрип-устройств. Стрелками 18 на поверхности пленки 28 показан конец зоны нанесения образца прокладки 12. Прокладку 12, нитроцеллюлозную мембрану 22 и полосу 24 из фильтровальной бумаги присоединяют к клейкому жесткому пластмассовому основанию 26. Обозначения на фиг. 1, 2. 10 - зона антител М 271 12-прокладка 14 - зона анализа 16 - зона контроля 18 - стрелки 22 - нитроцеллюлозная мембрана 24 - мембрана из фильтровальной бумаги 26 - клейкое жесткое пластмассовое основание 28 - частично прозрачная защитная пленка со стрелками 30 - непрозрачная защитная пленка. Предпочтительный вариант реализации устройства согласно настоящему изобретению В варианте реализации, описанном в данном разделе, устройство содержит зону 10 прокладки с антителами М 271, выполненной из пористой матрицы для нанесения образца, которая не препятствует миграции антител и белков. Зона 10 антител М 271 содержит антитела М 271, обладающие чрезвычайно специфическим сродством к связыванию с PAMG-1. Введение жидкого образца, содержащего PAMG-1, в зону антител М 271 приводит к соединению антитела М 271 с PAMG-1 и образованию комплекса антитело М 271-PAMG-1. Устройство содержит также зону 14 анализа, которая соединяется посредством жидкой среды с зоной 10 антител М 271 и выполнена из пористого материала, не препятствующего миграции антител и белков. Зона 14 анализа содержит антитело М 52, иммобилизованное в этой зоне и также способное связываться с PAMG-1. Антитело М 52 иммунологически отличается от антитела М 271, поэтому антитела М 271 и М 52 могут одновременно связываться с PAMG-1. Введение жидкого образца в зону 10 антитела М 271 приводит к миграции комплекса антитело М 271-PAMG-1 в зону 14 анализа, где комплекс антитело М 271-PAMG-1 связывается с антителом М 52 и иммобилизуется в зоне анализа антителом М 52. Устройство выявляет присутствие PAMG-1 в образце на основании присутствия антитела М 52, иммобилизованного в зоне 14 анализа. В соответствии с этим вариантом реализации оба антитела представляют собой антитела согласно настоящему изобретению. Процедура выбора пары антител, описанная выше,может быть воспроизведена специалистом в данной области. В результате только PAMG-1 образует комплекс антитело М 271-PAMG-1-антитело М 52, который иммобилизуется в зоне 14 анализа. Таким образом, наличие антитела М 52, иммобилизованного в зоне 14 анализа, является показателем присутствияPAMG-1 в образце. В этом варианте реализации устройства антитело М 271 присоединяется к детектируемому маркеру,который используют для определения присутствия PAMG-1, иммобилизованного в зоне 14 анализа. Примеры детектируемых маркеров, которые могут быть использованы, включают, в частности, но без ограничения, окрашенные частицы, ферменты, красители, флуоресцентные красители и радиоактивные изотопы. В одном варианте реализации детектируемый маркер представляет собой частицы золота,имеющие средний размер, примерно 20-30 нм. В другом варианте реализации антитело М 271 представляет собой меченое антитело в сублимированном состоянии. В варианте реализации, в котором антитело М 271 метят детектируемым маркером в зоне прокладки, содержащей антитела М 271, устройство включает также зону анализа, в которой находится антитело М 52. Зона прокладки и зона анализа соединяются посредством жидкой среды. В другом варианте реализации устройства, также соответствующего фиг. 1, 2, устройство имеет стрип-структуру с ближним и дальним концом. Зона 10 антител М 271 стрип-структуры выполнена из материала, который не препятствует миграции антител и белков. Зона 10 антитела М 271 стрипструктуры содержит антитело М 271, обладающее чрезвычайно специфическим сродством к связыванию с PAMG-1. Введение жидкого образца, содержащего PAMG-1, в зону прокладки с антителами М 271 приводит к соединению антитела М 271 с PAMG-1 и образованию комплекса антитело М 271-PAMG-1. Стрип-структура содержит также зону 14 анализа, близко расположенную к зоне 10 антитела М 271 и соединяющуюся посредством жидкой среды с зоной 10 антитела М 271. Зона 14 анализа выполнена из материала, который не препятствует миграции антител и белков. Зона 14 анализа содержит антитело М 52, иммобилизованное в этой зоне и имеющее сродство к связыванию с PAMG-1. Введение жидкого образца в зону 10 антитела М 271 приводит к миграции комплекса антитело М 271-PAMG-1 в зону 14 анализа, где комплекс антитело М 271-PAMG-1 связывается с антителом М 52 и иммобилизуется в зоне анализа антителом М 52. Зона анализа содержит также антитело М 42 и антитело М 52, иммобилизованные- 16008194 в зоне 14 анализа. Комбинация немеченых антител М 52 и М 42 позволяет производить точную настройку порога чувствительности стрип-устройства согласно настоящему изобретению (пример 11). Устройство выявляет присутствие PAMG-1 в образце на основании иммобилизации комплекса меченое антитело М 271-PAMG-1 в зоне 14 анализа. Зона контроля. Устройство согласно изобретению включает одну стандартную зону 16 контроля(фиг. 1, 2). Эта зона контроля служит для подтверждения правильности функционирования устройства. При этом следует отметить, что в устройстве согласно настоящему изобретению можно использовать также любые альтернативные варианты реализации зоны контроля. Устройство с одной зоной контроля включает зону 10 антитела М 271, выполненную из материала,который не препятствует миграции антител и белков. Зона 10 антитела М 271 содержит меченое антитело М 271, которое не иммобилизовано в этой зоне и которое имеет высокую специфичность по отношению кPAMG-1. Введение жидкого образца, содержащего PAMG-1, в зону 10 прокладки с антителом ММ 271 приводит к связыванию антитела М 271 с PAMG-1 и к образованию комплекса антитело М 271-PAMG-1. Устройство содержит также зону 14 анализа, которая связана жидкой средой с зоной 10 антитела М 271 и выполнена из материала, не препятствующего миграции антител и белков. Зона 14 анализа содержит также антитело М 52, иммобилизованное в этой зоне и имеющее сродство к связыванию с PAMG-1. Антитело М 52 иммунологически отличается от антитела М 271, поэтому антитела М 271 и М 52 могут одновременно связываться с PAMG-1. Введение жидкого образца в зону 10 антитела М 271 приводит к миграции комплекса антитело М 271-PAMG-1 в зону 14 анализа, где комплекс антитело М 271-PAMG-1 связывается с антителом М 52 и иммобилизуется в зоне 14 анализа антителом М 52. Устройство выявляет присутствие PAMG-1 в образце на основании иммобилизации меченого антитела М 271 в зоне 14 анализа. Если в образце присутствует низкая концентрация PAMG-1, по меньшей мере часть меченых антител М 271 мигрирует из зоны 10 антител М 271 через зону 14 анализа в зону 16 контроля. Антитела против иммуноглобулинов мыши иммобилизуются в зоне 16 контроля. Антитела против иммуноглобулинов связывают меченые антитела М 272, которые окрашивают зону контроля. Если в образце присутствует высокая концентрация PAMG-1, то лишь небольшое количество антител М 271 может приблизиться к зоне 16 контроля, при этом окрашивание зоны контроля может оказаться слишком слабым для распознавания невооруженным глазом человека. Чтобы предотвратить такую возможность, в зону 10 антитела М 271 добавляют меченый мышиный иммуноглобулин IgG. Этот иммуноглобулин не связывает PAMG-1 и свободно мигрирует сквозь зону 14 анализа, содержащую антитела М 52, в зону 16 контроля, где он связывается антителами антимышиного антиглобулина и окрашивает зону 16 контроля. Зона контроля подтверждает правильность функционирования устройства независимо от концентрации PAMG-1 в образце. Другим компонентом устройства согласно настоящему изобретению является пористый материал,который находится в плотном пористом соединении с материалом зоны анализа. Эта часть устройства работает как насос, который помогает перемещать жидкости, белки и антитела. Примеры детектируемых маркеров, которые могут быть использованы для мечения мышиных антител и иммуноглобулина IgG,включают, в частности, но без ограничения, окрашенные частицы, ферменты, красители и радиоактивные изотопы. В одном из вариантов реализации детектируемый маркер представляет собой флуоресцентный краситель. В другом варианте реализации детектируемые маркеры являются окрашенными частицами. В одном из вариантов реализации антитело М 271, которое является меченым антителом, и меченый мышиный иммуноглобулин IgG находятся в сублимированном состоянии. Материалы, используемые в различных зонах вышеописанного устройства, могут представлять собой любую комбинацию материалов, которые не препятствуют миграции антител и белков. Примеры пригодных материалов включают, в частности, но без ограничения, стекловолокно, пористую пластмассу, нитроцеллюлозу и фильтровальную бумагу. Детали устройства можно располагать в любых функциональных комбинациях при условии, что в любом варианте реализации настоящего изобретения имеется выбранная пара антител, которая детектирует минимальную фоновую концентрацию PAMG-1 во влагалищном секрете беременных женщин. Устройство согласно настоящему изобретению может содержать защитную пленку, покрывающую по меньшей мере часть устройства. Она может быть прозрачной или непрозрачной и может иметь на поверхности необходимый товарный знак, информационные метки/символы или стрелки. Определение разрывов плодной оболочки.PAMG-1 содержится в амниотической жидкости с концентрацией, по меньшей мере примерно в 100 раз большей, чем в сыворотке крови беременных женщин, и по меньшей мере в 3000 раз большей, чем во влагалищном секрете беременных женщин при отсутствии разрыва плодной оболочки. Поэтому в случае растворения в образце вагинального секрета даже небольшого количества амниотической жидкости(примерно 1/100 капли на 1 мл вагинального секрета) в этом образце будет присутствовать достаточное содержание PAMG-1, указывающее на разрыв плодной оболочки. При этом несущественная примесь сыворотки крови в образце (10-15%) не оказывает влияния на результаты, получаемые с помощью устройств и способов согласно настоящему изобретению вследствие низкой концентрации PAMG-1 в сыворотке крови.- 17008194 Поскольку наличие амниотической жидкости во влагалищном секрете является показателем разрыва плодной оболочки, выявление PAMG-1 во влагалищном секрете также можно использовать для определения разрыва плодной оболочки. Способ обнаружения PAMG-1 в амниотической жидкости согласно настоящему изобретению является чрезвычайно чувствительным. Так, например, можно обнаружить PAMG-1 в концентрации, равной 0,05 нг/мл (примеры 6, 7). Поскольку максимальная концентрация PAMG-1 в сыворотке составляет примерно 25 нг/мл по сравнению с минимальной концентрацией примерно 1680 нг/мл в амниотической жидкости и поскольку фоновая концентрация PAMG-1 во влагалищном секрете является очень низкой и составляет примерно 0,2 нг/мл, в способе согласно изобретению можно использовать более низкий пороговый уровень для PAMG-1, чтобы выявлять присутствие амниотической жидкости во влагалище. Использование более низкого порогового уровня согласно настоящему изобретению исключает большинство ложных результатов. Устройства и способы согласно настоящему изобретению позволяют исключить появление ложных результатов за счет использования пары антител, которые являются высокочувствительными и специфичными для PAMG-1. Кроме того, порог чувствительности устройства согласно настоящему изобретению может быть точно установлен на предварительно определенном уровне, близком к 5-7 нг/мл. В результате на устройства и способы согласно настоящему изобретению не влияет наличие вагинита и других переменных факторов, которые оказывают негативное воздействие на точность известных способов детекции разрывов плодной оболочки. Максимальная концентрация PAMG-1 в воспалительном экссудате составляет 3 нг/мл (примеры 8, табл. 10, 11). Такая же концентрация PAMG-1 может возникнуть, если примесь сыворотки крови во влагалищном секрете не превышает 10-15%. Кроме того, большая величина отношения концентрации сыворотки к концентрации амниотического PAMG-1 при применении устройств и способов согласно настоящему изобретению существенно уменьшает вероятность получения ложноположительных результатов вследствие присутствия сыворотки крови во влагалищном секрете даже при низком пороге детекции PAMG-1. Как указано далее, эти устройства и способы можно просто и быстро адаптировать для применения во внебольничных условиях. Так, например, способ согласно настоящему изобретению можно использовать с простым устройством, которое сможет эксплуатировать пациентка, не имеющая опыта или имеющая небольшой опыт работы с таким устройством. Для пользования устройством не требуется специального отсчета времени, разбавления или корректировки концентрации образца перед проведением измерения. Это обеспечивает высокую надежность устройства и способа и снижает зависимость от ошибки оператора. Способ можно также реализовать для простого обнаружения "да/нет" присутствия PAMG-1 в образце и выявления присутствия амниотической жидкости во влагалище. Настоящее изобретение обеспечивает способы и устройства для определения разрыва плодной оболочки на основании присутствия PAMG-1 во влагалищном секрете беременной женщины. Вследствие этого способ определения разрыва плодной оболочки согласно изобретению просто включает операцию выявления присутствия PAMG-1 во влагалищном секрете, при этом наличие PAMG-1 во влагалищном секрете указывает на появление разрыва плодной оболочки. Ключевым моментом настоящего изобретения является последовательный выбор пары антител, которые позволяют выявлять очень низкую фоновую концентрацию белка PAMG-1 во влагалищном секрете беременных женщин. Во влагалищном секрете можно ожидать наличия низкой концентрации PAMG-1, поскольку проницаемость стенки капилляра для белков крови зависит от посттрансляционных модификаций белков и их взаимодействия с другими молекулами (Marinaro J.A., et al., "O-glycosylation delays the clearance of human IFG-binding protein-6hormone across the endhotelial barrier in target organs", in Semin. Reproduct. Med., 2001, vol. 19(1), pp. 97101). Часть молекул PAMG-1, подвергаемых посттрансляционным модификациям или устанавливающих нековалентную связь с другими молекулами, имеет минимальное проникновение в вагинальный секрет. Концентрация таких молекул во влагалищном секрете должна быть низкой. Низкая или высокая степень проникновения различных молекул связана с селективной проницаемостью капиллярных стенок и селективными секреторными процессами. Поскольку известно, что присутствие амниотической жидкости во влагалищном секрете беременных женщин является показателем разрыва плодной оболочки, выявление присутствия PAMG-1 во влагалищном секрете также можно использовать для определения наличия разрыва плодной оболочки. Примеры способов и устройств для обнаружения PAMG-1 во влагалищном секрете включают способы и устройства, более подробное описание которых приведено ниже. Способы,включающие операцию определения разрыва плодной оболочки на основании выявления PAMG-1 в образце вагинального секрета, также описаны далее более подробно.- 18008194 Как указано выше, способы и устройства для определения разрыва плодной оболочки являются высоко специфичными, чувствительными и точными. Чувствительность и точность обеспечиваются за счет широкого интервала между низкой фоновой концентрацией PAMG-1 во влагалищном секрете беременных женщин и гораздо более высоким, заранее установленным порогом чувствительности устройства согласно настоящему изобретению. Указанное пороговое значение в свою очередь является более низким, чем типичная концентрация PAMG-1 во влагалищном секрете во время разрыва плодной оболочки,который приводит к проникновению амниотической жидкости во влагалище. Точную настройку порогового значения обеспечивают с помощью по меньшей мере одного или нескольких антител противPAMG-1, вводимых в зону 14 анализа, чтобы с высокой точностью задать требуемый порог чувствительности устройства согласно настоящему изобретению (пример 9). Вследствие этого способы и устройства согласно настоящему изобретению помогают избежать получения ложноотрицательных и ложноположительных результатов за счет применения пары высоко специфичных моноклональных антител М 271 и М 52 и по меньшей мере одного дополнительного антитела М 42. В результате этого на точность указанных способов и устройств не оказывает отрицательного влияния присутствие вагинальных инфекций или других определенных переменных факторов, которые снижают точность известных способов определения разрыва плодной оболочки. Предпочтительные устройства и способы обнаружения PAMG-1 во влагалищном секрете беременных женщин согласно настоящему изобретению обеспечивают простоту,удобство и быстрое применение, что дает возможность использовать устройство согласно настоящему изобретению во внебольничных условиях. Так, например, указанные способы можно применять с простым устройством, которое сможет эксплуатировать пациент, не имеющий опыта или имеющий небольшой опыт работы с таким устройством. Для пользования устройством не требуется специального, отсчета времени, разбавления или корректировки концентрации образца перед проведением измерения. Это обеспечивает высокую надежность устройств и способов определения разрывов плодной оболочки согласно настоящему изобретению и уменьшает чувствительность к ошибкам оператора. Результаты клинических испытаний устройства согласно изобретению представлены в примере 10. Измерение концентрации PAMG-1 во влагалищном секрете при наличии вагинита представлено в примере 8. Из примера 8 можно видеть, что максимальная наблюдаемая концентрация PAMG-1 в воспалительном экссудате близка к 3 нг/мл. Примеры Приведенные ниже примеры более подробно описывают выделение PAMG-1 из амниотической жидкости, выбор пары анти-PAMG-l-антител, исследование специфичности таких антител и концентрации PAMG-1 в воспалительном экссудате при вагините. Эти примеры предназначены для иллюстрации определенных задач настоящего изобретения и не ограничивают области его распространения. Пример 1. Концентрация PAMG-1 в крови и амниотической жидкости. Концентрацию PAMG-1 измерили в сыворотке крови небеременных женщин, беременных женщин(37-40 недель беременности) и в амниотической жидкости (39-40 недель беременности) способом ELISA с применением пар моноклональных антител, полученных, как описано в примере 3. Антитела M1, M271, M152 и М 392 абсорбировали на полистироле в 0,05 М карбонатбикарбонатном буфере при рН 9,5 в течение 18 ч при 6 С (100 мкл раствора антитела в каждой лунке). Неспецифичную сорбцию к полистиролу удалили 1% раствором бычьего сывороточного альбумина(BSA) в фосфатном солевом буфере (PBS) с рН 7,0, 200 мкл в каждой лунке, инкубировали в течение одного часа при 37 С. В каждую лунку добавили 100 мкл антигена PAMG-1 с концентрацией 50, 25, 12, 6, 3, 1,5 и 0,7 нг/мл. Образцы сыворотки крови или амниотической жидкости разбавили в буфере 0,01% BSA и 0,05%Twin 20 в PBS. Разбавленные образцы добавили в лунки и инкубировали в течение одного часа при 37 С. Вызвали реакцию с помощью раствора ортофенилендиамина в 0,05 М цитратфосфатном буфере (рН 4,7),инкубировали в течение 20 мин при 37 С. Определили оптическую плотность при длине волны 492 нм. Определили концентрацию антител в первом слое и концентрацию конъюгата, получив в результате стандартную кривую оптической плотности для PAMG-1 с максимальным наклоном примерно 45(увеличение на одну оптическую единицу соответствует увеличению концентрации PAMG-1 в образце на 1 нг/мл), с верхним пределом (для концентрации PAMG-1 50 нг/мл) в 1,5 оптических единицы и с точкой нулевой концентрации, не превышающей 0,1 оптических единицы. Образцы для исследования (сыворотки, амниотическую жидкость, вагинальный и цервикальный секреты) заморозили при -40 С. Каждый образец анализировали три раза. Сыворотку разбавили до 1/5 исходной концентрации. Образцы амниотической жидкости разбавили до 1/2000 исходной концентрации. Если оптическая плотность образца превышала 1,5 единицы, то такой образец дополнительно разбавляли и повторно анализировали. Полученные данные обобщены ниже в табл. 1-3.- 19008194 Таблица 1 Концентрация PAMG-1 (нг/мл) в сыворотке крови небеременных женщин Таблица 2 Концентрация PAMG-1 (нг/мл) в сыворотке крови беременных женщин (37-40 недель беременности) Пример 2. Выделение PAMG-1. В 1980 г. Д. Петрунин предложил модифицированный способ выделения PAMG-1 (Петрунин Д.Д.,Козляева Г.А., Татаринов Ю.С., Шевченко О.П. Бюллетень экспериментальной биологии и медицины,5, стр. 558, 1980 (на русском языке. Схема операций выделения показана ниже в табл. 4.PAMG-1 выделили из амниотической жидкости при сроках беременности от 16 до 25 недель. Пробы жидкости получили у женщин, беременность которых была прервана по медицинским показаниям. К амниотической жидкости добавили 10% раствор хлорида лантана при объемном отношении 20:1 (таким образом, его конечная концентрация составила 0,5%) и инкубировали при 4 С в течение 18 ч. Образовался осадок, который отделили центрифугированием со скоростью 8000 об./мин в течение 30 мин. Осадок растворили в насыщенном растворе Na2HPO4 и отделили нерастворимый осадок солей лантана, образовавшийся в процессе центрифугированием при 8000 об./мин в течение 30 мин. Полученный раствор фракционировали 50% насыщенным раствором с инкубацией при 4 С в течение 18 ч и растворили образовавшийся осадок в дистиллированной воде таким образом, чтобы в обоих случаях довести объем фракций растворенного осадка до начального объема амниотической жидкости. Затем осадили раствор 60%-ным насыщенным сульфатом лития и растворили осадок в небольшом количестве дистиллированной воды. После диализа адсорбировали примеси пирофосфатом кальция, добавив к раствору белка равный объем поглотителя влаги, перемешали и инкубировали в течение 10-15 мин, а затем отделили абсорбент с помощью центрифугирования. Пример 3. Получение стабильных гибридных линий согласно настоящему изобретению. Гибридомный эксперимент 1. Использовали лимфоциты из подколенных лимфатических узлов мышей BALB/c (инбредных мышей экспериментальной линии Багга-Альбино). Мышей иммунизировали пятью инъекциями PAMG-1 в стопу. Каждая инъекция содержала 100 мкг PAMG-1 и полного адъюванта Фрейнда в отношении 1:1. После слияния клеток их посеяли в 1152 лунки. Протестировали 363 первичных гибридомы, 38 из них оказались PAMG-1-положительными. Затем проверили специфичность моноклональных антител путем исследования их перекрестного реактивного связывания белков - фертильного альфа-2-микроглобулина, хорионического гонадотропина человека, трофобластического бета-1 гликопротеина, плацентарного лактогена человека, альфа-фетопротеина и сывороточного альбумина человека. Выбрали четырнадцать первичных гибридом, моноклональные антитела которых не обладали перекрестной реактивностью по отношению к другим белкам. Затем применили способ серийных разведений, чтобы дважды клонировать первичные PAMG-1-специфические гибридомы. И, наконец, выбрали пять клонов, которые, очевидно, были наиболее стабильными и продуктивными производителями моноклональных антител M1, М 38, М 42, М 52 и М 91. Гибридомный эксперимент 2. Использовали лимфоциты из селезенки 5 мышей. Мышей иммунизировали пятью внутрибрюшинными инъекциями PAMG-1 по 100 мкг. Каждая инъекция состояла изPAMG-1 и полного адъюванта Фрейнда в отношении 1:1. Использовали 1344 лунки и протестировали 562 гибридом. 45 из них оказалось PAMG-1-специфическими, а 19 не обладали перекрестной реактивностью по отношению к другим белкам, т.е. были специфичными к PAMG-1. Гибридомы, не обладающие перекрестной реактивностью, дважды клонировали и выбрали для дальнейшего применения 6 клонов,которые были наиболее стойкими и продуктивными производителями моноклональных антител M122,M152, М 211, М 271, М 371 и М 392. Таким образом, получили 11 вариантов моноклональных антител для PAMG-1, из которых затем выбрали пару, способную выявлять минимальную фоновую концентрацию PAMG-1 во влагалищном секрете беременных женщин, как описано в примере 4. Специфические клеточные линии согласно настоящему изобретению. Антитела М 271 и М 52 получили с помощью гибридомных клеточных линий М 271 и М 52 соответственно. Клеточные линии, образующие моноклональные антитела и обозначенные в данном описании как М 271 и М 52, а также М 42, вырабатывают моноклональные антитела, которые использовали для установки и настройки пороговой чувствительности устройства, как описано ниже. В табл. 5 приведены результаты получения гибридом в двух опытах. Пример 4. Выбор пары моноклональных антител, выявляющих минимальную концентрациюPAMG-1 во влагалищном секрете беременных женщин.PAMG-1 с концентрацией 1 мкг/мл в 0,05 М карбонатно-бикарбонатном буфере с рН 9,5 сорбировали на полистирольных планшетах путем выдержки в течение 18 ч при 4 С. Антитела, указанные ниже в табл. 6, добавили в лунки с использованием серийных разведении, начиная с концентрации 3 мг/мл. Затем планшеты инкубировали в течение одного часа при 37 С. В лунки добавили конъюгат из кроличьих антимышиных-анти-IgG антител, меченых пероксидазой хрена. Инициировали реакцию раствором ортофенилендиамина в 0,05 М цитратно-фосфатном буфере (рН 4,7) и инкубировали в течение 20 мин при 37 С. Определили титр моноклональных антител. Таблица 6 Сродство к связыванию PAMG-1 при концентрации 1 мкг/мл моноклональными телами согласно настоящему изобретению Концентрации моноклональных антител, указанные в табл. 6, представляют собой минимальные концентрации, при которых антитела связывают PAMG-1, при условии, что концентрация PAMG-1 в растворе составляет 1 мкг/мл. Чем меньше концентрация, тем выше способность антитела выявлять минимальные концентрации PAMG-1. Моноклональные антитела М 271 и М 52 выбрали для того, чтобы обеспечить высокую чувствительность ELISA к PAMG-1. При проведении ELISA моноклональное антитело М 271 не проявляло перекрестной реактивности к следующим отдельным белкам амниотической жидкости: фертильному альфа-2-микроглобулину, хорионическому гонадотропину человека, трофобластическому бета-1-гликопротеину, плацентарному лактогену человека, альфа-фетопротеину и сывороточному альбумину человека.- 22008194 Кроме того, в опытах с колонками антитела М 271 иммобилизовали на сефарозе и пропускали через колонку неразбавленную амниотическую жидкость. Элюат, полученный из колонки после электрофореза, показал полосу, соответствующую молекулярной массе PAMG-1 (28-30 кДа). Высокоспецифическое моноклональное антитело М 271 поместили на прокладку бокового потока стрип-устройства согласно изобретению. В противоположность антителу М 271 антитело М 52 при проведении ELISA проявляло перекрестную реактивность по отношению к белку IGFBP-3 (протеин 3, связывающий инсулиноподобный фактор роста), который имеет высокое содержание в сыворотке и амниотической жидкости. Концентрация негликозилированного IGFBP-3, измеренная во влагалищном секрете, составляла примерно 600 нг/мл(пример 9). В экспериментах со стрип-устройством согласно настоящему изобретению такая концентрация IGFBP-3 не препятствовала распознаванию PAMG-1, взятому с концентрацией 5 нг/мл. Пример 5. Высокочувствительный анализ ELISA для плацентарного 1-микроглобулина. Обнаружение PAMG-1 во влагалищном секрете с помощью стандартного анлиза ELISA и пары антител М 271-М 52 оказалась невозможным. Чтобы обеспечить его, чувствительность ELISA повысили,уменьшив необходимую для выявления концентрации PAMG-1, до 0,05 нг/мл. Получили слоистую систему иммунологического анализа с антителами М 271-М 52, которые проявляли чувствительность 50 пикограмм на миллилитр (0,05 нг/мл). 1 слой: моноклональные антитела М 271, концентрация 6 мкг/мл, в карбонатно-бикарбонатном буфере, рН 9,5. 2 слой: PAMG-1, концентрации 4300, 1600, 800, 300, 200, 100, 50 пг/мл, а также цервикальный и вагинальный секреты, разбавленные до 1/2 концентрации, на буфере с рН 7,0. 3 слой: конъюгат М 52 на буфере при разбавлении 1/1000. Повышение чувствительности получили, варьируя первым и третьим слоем. В отличие от высокочувствительной системы в регулярной системе с чувствительностью 1 нг/мл первый слой имел концентрацию М 271 от 10 до 20 нг/мл, а разбавление конъюгата (М 52, меченый пероксидазой хрена) составляло 1/40000. Получили стандартную калибровочную кривую. Она представлена в табл. 7, где концентрацияPAMG-1 указана в пикограммах на миллилитр (пг/мл), а оптическая плотность наблюдаемого окрашивания Е при длине волны 450 нм - в стандартных безразмерных единицах. Таблица 7 Калибровочная кривая для высокочувствительного способа ELISA Пример 6. PAMG-1 во влагалищном секрете беременных женщин. Таблица 8 Концентрация PAMG-1 (нг/мл) во влагалищном секрете беременных женщин. Измерения произведены с помощью различных пар моноклональных антител к PAMG-1 (29-41 неделя беременности) После измерения минимальных концентраций все антитела пометили перкосидазой хрена. При проведении анализа ELISA немеченые антитела с концентрацией 10 мкг/мл ввели в лунки планшета. Затем в качестве второго слоя в планшет ввели PAMG-1 с концентрацией 50, 100, 200, 400, 800, 1600 и 3200 пг/мл. И, наконец, во все лунки планшета ввели конъюгат одного из остальных антител. Выбрали следующие антитела, работающие в парах (показаны как антитело-конъюгат): М 1-М 91; М 271-М 52; М 152-М 91; М 392-М 371. Эти пары антител использовали для измерения концентрации PAMG-1 во влагалищном секрете беременных женщин. Окончательно выбрали пару антител М 271-М 52, с которыми измеренная концентрация PAMG-1 во влагалищном секрете была минимальной. Концентрацию PAMG-1 для пары М 271-М 52 измерили с помощью высокочувствительного способа ELISA. Выбранную пару М 271-М 52 и несколько других пар использовали для измерения концентрации PAMG-1 в амниотической жидкости и в сыворотке крови небеременных и беременных женщин (пример 1, см. выше). Пример 7. PAMG-1 во влагалищном и цервикальном секретах беременных женщин. Таблица 9 Концентрация PAMG-1, пикограммы на миллилитр (пг/мл) в цервикальном и вагинальном секретах беременных женщин. Нормальная беременность в таблице означает отсутствие диагностированных отклонений от нормального протекания беременности. Концентрацию измеряли способом высокочувствительного анализа ELISA с помощью пары антител М 271-М 52. Пример 8. PAMG-1 во влагалищном секрете беременных женщин, страдающих вагинитом. Таблица 10 Концентрация плацентарного альфа-1-микроглобулина во влагалищном секрете беременных женщин,страдающих вагинитом. Измерения производили с помощью невысокочувствительного ELISA Таблица 11 Концентрация плацентарного альфа-1-микроглобулина во влагалищном секрете беременных женщин, страдающих вагинитом Пример 9. Модификации характеристик стрип-устройства. В первом эксперименте приготовили растворы М 52 МАb с концентрациями 1, 1/2, 1/4, 1/8, 1/16 и 1/32 мг/мл. Каждый раствор поместили в стрип-устройство. Смесь трех МАb (М 52, М 271, М 42) также разбавили до концентраций 1, 1/2, 1/4, 1/8, 1/16 и 1/32 от исходной концентрации и каждый разбавленный раствор ввели в отдельное стрип-устройство. Затем в каждое из 12 стрип-устройств добавили раствор, содержащий PAMG-1 с концентрацией 50 нг/мл. Раствор чистого антитела создал в зоне анализа окрашенную полосу, видимую при концентрации 1/8, а окрашенная полоса смеси МАb стала видимой при концентрации 1/2. Таким образом, смесь МАb препятствует присоединению молекул PAMG-1, регулируя тем самым видимость полосы. Моноклональные антитела с концентрациями М 52: 0,8 мг/мл и М 42: 0,1 мг/мл поместили в зону анализа нескольких стрип-устройств. Затем в зону анализа каждого стрип-устройства согласно настоящему изобретению добавили PAMG-1 с широким диапазоном концентраций от 12800 до 7 нг/мл и с концентрацией 1 нг/мл. Индикаторную полосу можно было видеть невооруженным глазом в диапазоне концентраций PAMG-1 от 12800 до 7 нг/мл, при этом она была невидима при концентрации 1 нг/мл. В то же время, в случае применения раствора чистого М 52 с такими же концентрациями индикаторную полосу можно было видеть во всем диапазоне концентраций PAMG-1, включая 1 нг/мл, хотя ее интенсивность при 1 нг/мл была низкой. Это существенно увеличивает вероятность получения ложноположительных результатов у пациенток с определенными медицинскими состояниями, в частности с воспалением. 1. Настройка чувствительности стрип-устройства согласно изобретению с помощью комбинации двух антител в зоне анализа. В первом эксперименте в зону анализа вводили только антитела М 52 (с концентрацией 0,4 мг/мл). Во втором эксперименте в зону анализа вводили антитела М 52 (с концентрацией 0,4 мг/мл) и антитела М 271 (с концентрацией 0,4 мг/мл). Антитела М 271, конъюгированные с частицами золота, вводили в зону прокладки с концентрацией, выбранной таким образом, чтобы оптическая плотность была равна десяти при длине волны 510 нм. Этот конъюгат вводили в прокладку в растворе, содержащем 10% сахарозы и 2% казеина. PAMG-1 титровали до концентраций 20, 10, 5 и 1 нг/мл.- 26008194 В приведенных ниже таблицах представлены результаты измерения относительной оптической плотности, полученные сканером с помощью программы Sigma Scan. Антитела М 271 находятся на прокладке, а комбинация М 271+М 52 - в зоне анализа. Знак "+" указывает видимость индикаторной полосы(достаточно окрашена для наблюдения невооруженным глазом), а знак "-" - невозможность наблюдения индикаторной полосы невооруженным глазом. Чувствительность анализа изменилась с 5 нг/мл в первом эксперименте до 20 нг/мл во втором эксперименте. Можно сделать вывод, что добавление MAb M271 в зону анализа приводит к подавлению чувствительности в четыре раза. 2. Настройка интенсивности индикаторной полосы в стрип-устройстве с помощью комбинации из двух антител. В первом эксперименте в зону анализа вводили только антитела М 52 (с концентрацией 0,8 мг/мл). Во втором эксперименте в зону анализа вводили антитела М 52 (с концентрацией 0,8 мг/мл), антителаM271 (с концентрацией 0,7 мг/мл) и антитела М 42 (с концентрацией 0,8 мг/мл). Смесь антител для ввода в зону анализа получили следующим образом: 14 мкл (микролитров) раствора антитела М 52 с концентрацией 8,6 мг/мл смешали с 7 мкл раствора М 42 с концентрацией 13,9 мг/мкл и с 3 мкл раствора M271 с концентрацией 10,9 мг/мл. Затем добавили буфер до суммарного объема 150 мкл и ввели раствор в стрип-устройство. В приведенной ниже таблице представлены значения относительной оптической плотности. Наклон (градиент) кривой оптической плотности отличался в первом и втором эксперименте. При концентрации PAMG-1 12 нг/мл цветная линия на стрипе во втором эксперименте была ярче, чем в первом эксперименте. При концентрации PAMG-1 6 нг/мл цветная линия в стрипе была видна в первом эксперименте, но не видна во втором эксперименте. В случае комбинации антител визуально наблюдали более яркие полосы. Таким образом, независимо от почти одинаковой чувствительности интенсивность окрашивания, наблюдаемая невооруженным глазом, различается. 3. Настройка чувствительности и наклона кривой интенсивности окрашивания устройства согласно настоящему изобретению с помощью комбинации из четырех антител. В приведенной ниже таблице +" указывает видимость индикаторной полосы, а "-" - невозможность наблюдения индикаторной полосы невооруженным глазом. Таким образом, комбинируя антитела, можно настраивать чувствительность анализа. Пример 10: Результаты клинических испытаний. Протокол исследования Состояние пациенток оценивали по результатам клинического обследования и с помощью устройства согласно настоящему изобретению. Критерии включения: 1). Срок беременности 20-41 неделя. 2). Пациентка сообщает о признаках или симптомах, предполагающих PROM или PPROM. 3). Количественные анализы вагинального секрета отсутствовали до получения проб с целью выявления у пациентки PROM или PPROM.- 27008194 4). Пациентка согласна на проведение стерильного исследования с помощью зеркала с целью сбора стандарных клинических данных (депонирование, гидразин, феномен папортника) и стерильный смыв для анализа PAMG-1. Критерии исключения: 1). Активное вагинальное кровотечение, имеющее любой источник. 2). Предлежание плаценты. Статистический анализ 192 пациенток от 15.12.2000, проведенный в больницах Sharp MemorialMary Birch Hospital for Women (Сан Диего) и Summit Medical Center (Окленд). У двух пациенток из 192 устройство согласно настоящему изобретению дало положительный результат, в то время как стандартное клиническое обследование не показало наличия PROM. Поэтому указанные два случая первоначально отнесли к ложноположительному результату устройства согласно настоящему изобретению (см. ниже "Некорректированные данные"). Однако у обеих пациенток в течение нескольких часов после обследования появились симптомы PROM. При втором клиническом обследовании диагноз PROM подтвердился, и оба результата, полученные с помощью устройства согласно настоящему изобретению, отнесли к истинно положительным (окончательные результаты испытаний представлены ниже в столбце "Откорректированные"). Истинная положительная величина представляет собой количество положительных результатов,полученных с помощью устройства согласно настоящему изобретению, PROM подтвержден последующим клиническим обследованием,истинная отрицательная величина представляет собой количество отрицательных результатов, подтвержденных последующим клиническим обследованием,ложная положительная величина представляет собой количество положительных результатов, для которых PROM не подтвержден последующим клиническим обследованием,ложная отрицательная величина представляет собой количество отрицательных результатов, для которых PROM подтвержден последующим клиническим обследованием.- 28008194 Таблица 12 Результаты испытания устройства согласно настоящему изобретению (лот С 98-0007) в третьем родильном доме Москвы, Российская Федерация, отделение акушерства и гинекологии 2
МПК / Метки
МПК: G01N 33/53
Метки: способы, влагалищном, способов, указанных, секрете, реализации, обнаружения, жидкости, устройства, амниотической
Код ссылки
<a href="https://eas.patents.su/30-8194-sposoby-obnaruzheniya-amnioticheskojj-zhidkosti-vo-vlagalishhnom-sekrete-i-ustrojjstva-dlya-realizacii-ukazannyh-sposobov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы обнаружения амниотической жидкости во влагалищном секрете и устройства для реализации указанных способов</a>
Предыдущий патент: Способ получения глимепирида и соответствующего промежуточного соединения
Следующий патент: Применение тория- 227 в лучевой терапии заболеваний мягких тканей
Случайный патент: Производные бензолсульфонамидов, способ их получения и их применение для лечения боли