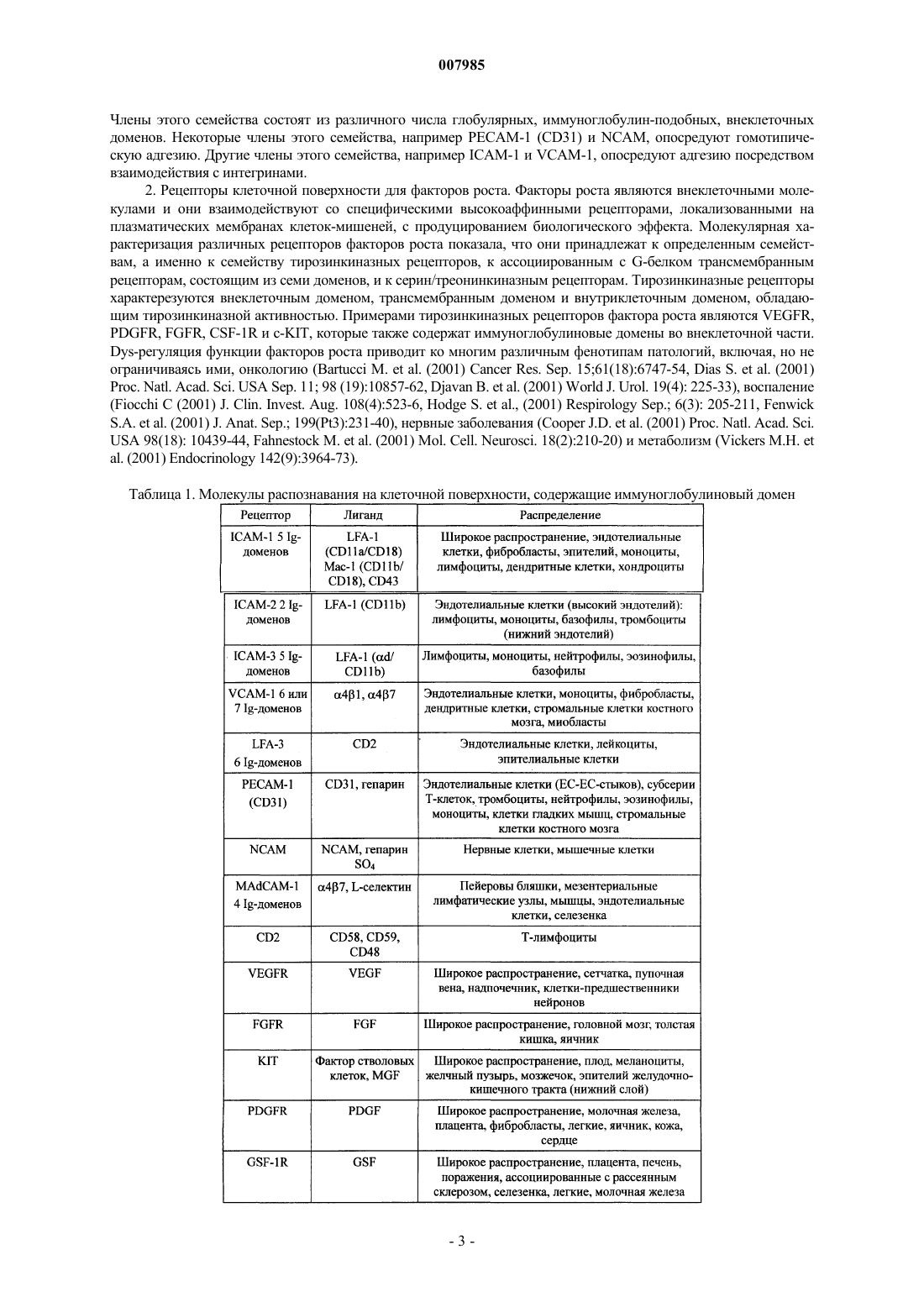
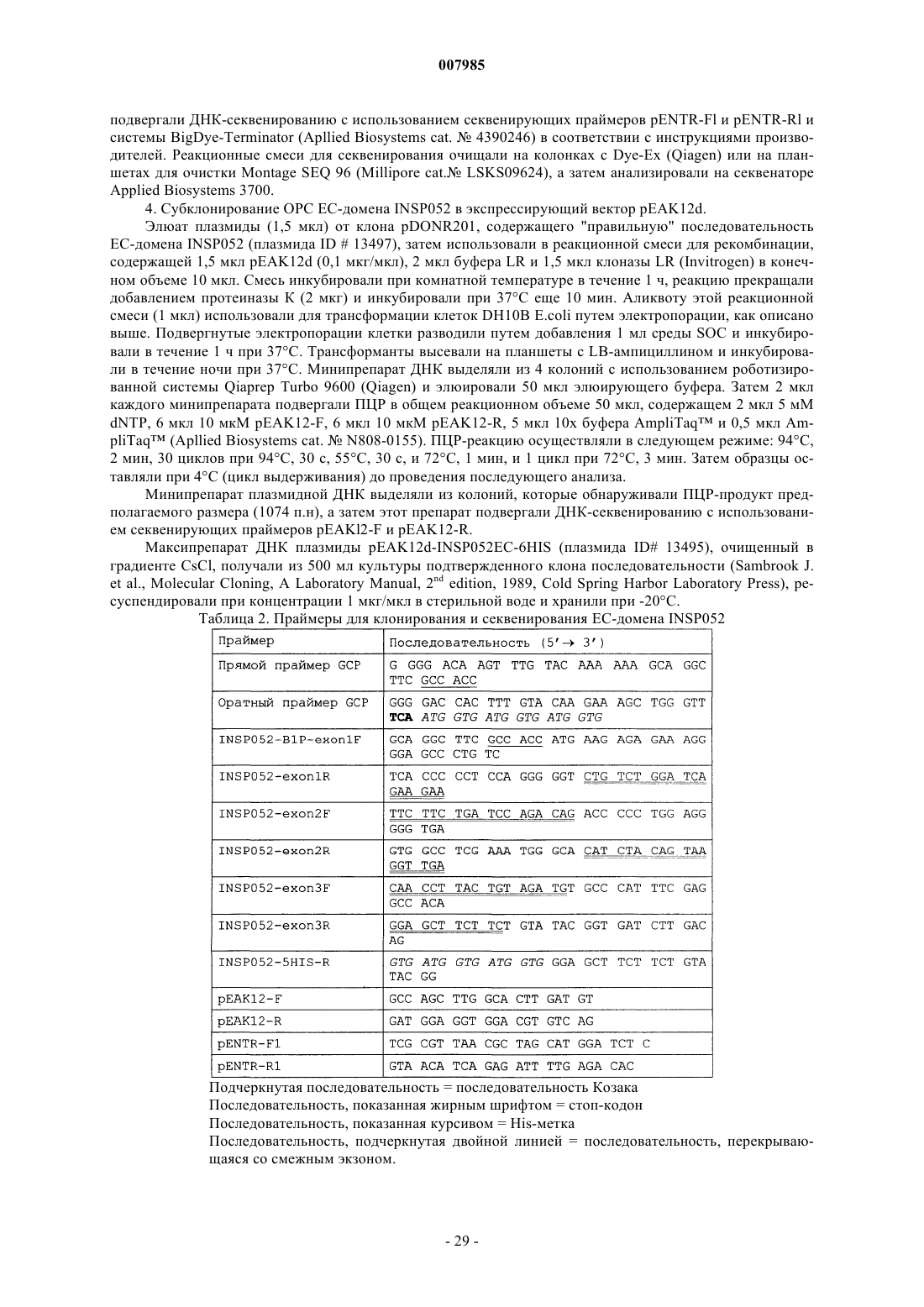
Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен
Номер патента: 7985
Опубликовано: 27.02.2007
Авторы: Фэйган Ричард Джозеф, Фелпс Кристофер Бенджамин, Пауэр Кристин, Дэвидс Эндрю Роберт
Формула / Реферат
1. Полипептид, который:
(i) содержит аминокислотную последовательность, представленную в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, или внеклеточный домен INSP052, представленный на фиг. 7, либо состоит из указанных аминокислотных последовательностей или указанного внеклеточного домена;
(ii) представляет собой фрагмент, обладающий активностью полипептида (i) или имеющий общую антигенную детерминанту с полипептидом (i), или
(iii) представляет собой функциональный эквивалент (i) или (ii).
2. Полипептид по п.1, который содержит аминокислотную последовательность, представленную в SEQ ID NO:16, или состоит из нее.
3. Полипептид по п.2, который состоит из аминокислотной последовательности, представленной в SEQ ID NO:16.
4. Полипептид, который представляет собой функциональный эквивалент по п.1 (iii), отличающийся тем, что он гомологичен аминокислотной последовательности, представленной в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 или SEQ ID NO:16, и обладает активностью молекулы распознавания, расположенной на клеточной поверхности и содержащей иммуноглобулиновый домен.
5. Полипептид, который представляет собой фрагмент или функциональный эквивалент по любому из предыдущих пунктов и который идентичен аминокислотной последовательности, представленной в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 или SEQ ID NO:16, или ее активному фрагменту более чем на 84%, а предпочтительно более чем на 85, 90, 95, 98 или 99%.
6. Полипептид, который представляет собой функциональный эквивалент по любому из предыдущих пунктов, и который обладает значительной структурной гомологией с полипептидом, имеющим аминокислотную последовательность, представленную в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 или SEQ ID NO:16.
7. Полипептид, который представляет собой фрагмент по любому из предыдущих пунктов, имеющий антигенную детерминанту, общую с полипептидом по п.1 (i), и состоящую из 7 или более (например, 8, 10, 12, 14, 16, 18, 20 или более) аминокислотных остатков аминокислотной последовательности, представленной в SEQ ID NO:16.
8. Полипептид по п.7, где полипептид содержит аминокислотную последовательность зрелого экстрацеллюлярного домена INSP052 или состоит из указанной аминокислотной последовательности.
9. Полипептид по п.7, где полипептид содержит сочетание аминокислотных последовательностей, представленных в SEQ ID NO:4 и SEQ ID NO:6, или состоит из него.
10. Слитый белок, содержащий полипептид по любому из предыдущих пунктов.
11. Очищенная молекула нуклеиновой кислоты, кодирующая полипептид по любому из предыдущих пунктов.
12. Очищенная молекула нуклеиновой кислоты по п.11, которая содержит последовательность нуклеиновой кислоты, представленную в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 или SEQ ID NO:15, или представляет собой ее избыточный эквивалент или фрагмент.
13. Очищенная молекула нуклеиновой кислоты по п.12, которая состоит из последовательности нуклеиновой кислоты, представленной в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 или SEQ ID NO:15, или представляет собой ее избыточный эквивалент или фрагмент.
14. Очищенная молекула нуклеиновой кислоты, которая гибридизуется с молекулой нуклеиновой кислоты по любому из пп.8-10 в условиях высокой жесткости.
15. Вектор, содержащий молекулу нуклеиновой кислоты по любому из пп.11-14.
16. Клетка-хозяин, трансформированная вектором по п.15.
17. Лиганд, который специфически связывается с полипептидом по любому из пп.1-10 и предпочтительно ингибирует активность указанного полипептида.
18. Лиганд по п.17, который представляет собой антитело.
19. Полипептид по любому из пп.1-10, молекула нуклеиновой кислоты по любому из пп.11-14, вектор по п.15, клетка-хозяин по п.16, или лиганд по п.17 или 18 для применения при лечении или диагностики заболевания.
20. Способ диагностики заболевания у пациента, предусматривающий оценку уровня экспрессии природного гена, кодирующего полипептид по любому из пп.1-10, или оценку активности полипептида по любому из пп.1-10 в ткани указанного пациента, и сравнение указанного уровня экспрессии или активности с контрольным уровнем, где уровень, отличающийся от указанного контрольного уровня, является признаком наличия заболевания.
21. Способ по п.20, осуществляемый in vitro.
22. Способ по п.20 или 21, который включает стадии (а) контактирования лиганда по п.17 или 18 с биологическим образцом в условиях, подходящих для образования комплекса лиганд-полипептид; и (b) детекции указанного комплекса.
23. Способ по п.20 или 21, включающий стадии:
a) контактирования образца ткани, взятой у пациента, с нуклеотидным зондом в жестких условиях, способствующих образованию гибридного комплекса между молекулой нуклеиновой кислоты по любому из пп.11-14 и указанным зондом;
b) контактирования контрольного образца с указанным зондом в условиях, идентичных условиям стадии (а); и
c) детекции присутствия гибридных комплексов в указанных образцах, где детекция уровней указанного гибридного комплекса в образце данного пациента, которые отличаются от уровней гибридного комплекса в контрольном образце, указывает на наличие заболевания.
24. Способ по п.21 или 22, предусматривающий:
а) контактирование образца нуклеиновой кислоты ткани, взятой у пациента, с нуклеотидным праймером в жестких условиях, способствующих образованию гибридного комплекса между молекулой нуклеиновой кислоты по любому из пп.11-14 и указанным праймером;
b) контактирование контрольного образца с указанным праймером в условиях, идентичных условиям стадии (а);
c) амплификацию указанного образца нуклеиновой кислоты; и
d) детекцию уровня амплифицированной нуклеиновой кислоты в образцах, взятых у пациента, и в контрольных образцах, где детекция уровней амплифицированной нуклеиновой кислоты во взятом у пациента образце, которые значительно отличаются от уровней амплифицированной нуклеиновой кислоты в контрольном образце, указывает на наличие заболевания.
25. Способ по п.21 или 22, предусматривающий:
a) получение образца тканей от пациента, исследуемого на наличие заболевания;
b) выделение молекулы нуклеиновой кислоты по любому из пп.11-14 из указанного образца ткани; и
c) установление диагноза заболевания данному пациенту путем детекции присутствия мутации в молекуле нуклеиновой кислоты, где указанная мутация ассоциируется с данным заболеванием, и где присутствие такой мутации указывает на наличие заболевания.
26. Способ по п.25, который, кроме того, предусматривает амплификацию указанной молекулы нуклеиновой кислоты с образованием амплифицированного продукта и детекцию присутствия или отсутствия мутации в указанном амплифицированном продукте.
27. Способ по п.25 или 26, где присутствие или отсутствие мутации у пациента определяют путем осуществления контакта указанной молекулы нуклеиновой кислоты с нуклеотидным зондом, который гибридизуется с указанной молекулой нуклеиновой кислоты в жестких условиях с образованием гибридной двухцепочечной молекулы, где указанная гибридная двухцепочечная молекула имеет негибридизованную часть цепи нуклеиновокислотного зонда в любой области, соответствующей мутации, ассоциированной с заболеванием; и детекции присутствия или отсутствия негибридизованной части цепи указанного зонда как показателя присутствия или отсутствия ассоциированной с заболеванием мутации.
28. Способ по любому из пп.20-27, где указанное заболевание выбрано из клеточно-пролиферативного расстройства, аутоиммунного/воспалительного заболевания, сердечно-сосудистого заболевания, неврологического расстройства, психического расстройства, нарушения развития, генетического нарушения, метаболического расстройства, инфекции, заболевания печени или другого патологическюую состояния.
29. Применение полипептида по любому из пп.1-10 в качестве молекулы распознавания, расположенной на клеточной поверхности и содержащей иммуноглобулиновый домен.
30. Фармацевтическая композиция, содержащая полипептид по любому из пп.1-10.
31. Фармацевтическая композиция, содержащая молекулу нуклеиновой кислоты по любому из пп.11-14.
32. Фармацевтическая композиция, содержащая лиганд по п.17 или 18.
33. Композиция вакцины, содержащая полипептид по любому из пп.1-10 или молекулу нуклеиновой кислоты по любому из пп.11-14.
34. Применение полипептида по любому из пп.1-10, молекулы нуклеиновой кислоты по любому из пп.11-14, вектора по п.15, клетки-хозяина по п.16, лиганда по п.17 или 18 для производства лекарственного средства для лечения заболевания, выбранного из группы, состоящей из клеточно-пролиферативных расстройств, аутоиммунных/воспалительных заболеваний, сердечно-сосудистых заболеваний, неврологических и психических расстройств, нарушений развития, генетических нарушений, метаболических расстройств, инфекций, заболевания печени и других патологических состояний.
35. Способ лечения заболевания у пациента, предусматривающий введение указанному пациенту полипептида по любому из пп.1-10, молекулы нуклеиновой кислоты по любому из пп.11-14, вектора по п.15, клетки-хозяина по п.16, лиганда по п.17 или 18, или фармацевтической композиции по любому из пп.30-32.
36. Способ по п.35, где для лечения заболеваний, при которых уровень экспрессии природного гена или активности указанного полипептида у пациента с заболеванием ниже, чем уровень экспрессии или активности у здорового пациента, данному пациенту вводят полипептид, молекулу нуклеиновой кислоты, вектор, лиганд, соединение или композицию, которые являются агонистами.
37. Способ по п.35, где для лечения заболеваний, при которых уровень экспрессии природного гена или активности указанного полипептида у пациента с заболеванием выше, чем уровень экспрессии или активности у здорового пациента, данному пациенту вводят полипептид, молекулу нуклеиновой кислоты, вектор, лиганд, соединение или композицию, которые являются антагонистами.
38. Способ мониторинга терапевтического лечения заболевания у пациента, предусматривающий мониторинг уровня экспрессии или активности полипептида по любому из пп.1-10, или уровня экспрессии молекулы нуклеиновой кислоты по любому из пп.11-14 в ткани указанного пациента в течение определенного периода времени, где изменение указанного уровня экспрессии или активности за определенный промежуток времени по сравнению с контрольным уровнем является показателем регрессирования указанного заболевания.
39. Способ идентификации соединения, которое является эффективным для лечения и/или диагностики заболевания, предусматривающий контактирование полипептида по любому из пп.1-10 или молекулы нуклеиновой кислоты по любому из пп.11-14 с одним или несколькими соединениями, предположительно обладающими аффинностью связывания с указанным полипептидом или молекулой нуклеиновой кислоты, и отбор соединения, которое специфически связывается с указанной молекулой нуклеиновой кислоты или полипептидом.
40. Набор, используемый для диагностики заболевания и включающий первый контейнер, содержащий нуклеотидный зонд, который гибридизуется в жестких условиях с молекулой нуклеиновой кислоты по любому из пп.11-14; второй контейнер, содержащий праймеры, подходящие для амплификации указанной молекулы нуклеиновой кислоты; и инструкции по использованию зонда и праймеров для облегчения диагностики заболевания.
41. Набор по п.40, который, кроме того, включает третий контейнер, содержащий агент для гидролиза негибридизованной РНК.
42. Набор, содержащий массив молекул нуклеиновой кислоты, по крайней мере одной из которых является молекула нуклеиновой кислоты по любому из пп.11-14.
43. Набор, содержащий одно или несколько антител, связывающихся с полипептидом по любому из пп.1-10, и реагент, используемый для детекции реакции связывания между указанным антителом и указанным полипептидом.
44. Трансгенное или дефицитное по ниже указанному полипептиду животное, не являющееся человеком, которое было трансформировано так, что оно экспрессирует более высокие или более низкие уровни полипептида по любому из пп.1-10 или вообще не экспрессирует указанный полипептид.
45. Способ скрининга на соединение, эффективное для лечения заболевания, предусматривающий контактирование трансгенного животного, не являющегося человеком, по п.44, с соединением-кандидатом и оценку эффективности указанного соединения для лечения такого заболевания у указанного животного.
Текст
007985 Настоящее изобретение относится к новым белкам (обозначенным INSP052 и INSP055), идентифицированным в настоящей заявке как молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен, и к использованию этих белков и последовательностей нуклеиновых кислот генов, кодирующих эти белки, для диагностики, профилактики и лечения заболеваний. Все процитированные здесь публикации, патенты и патентные заявки во всей своей полноте вводятся в настоящее описание посредством ссылки. Предшествующий уровень техники В настоящее время в области разработки лекарственных средств произошел крутой перелом, который положил начало новой эре функциональной геномики, пришедшей на смену старым методам. Термин"функциональная геномика" применяется к способам использования средств биоинформатики для приписывания функций последовательностям белков, представляющих интерес для специалистов. Такие средства становятся все более необходимыми, и это связано с тем, что оснащение научно-исследовательских лабораторий, занимающихся определением функций последовательностей этих белков, пока не дает возможности быстро обрабатывать все нарастающий поток данных для этих последовательностей. Поскольку эффективность и точность методов биоинформатики возрастает, то эти методы быстро вытесняют стандартные методы биохимической характеризации. Действительно, современные средства биоинформатики, используемые для идентификации белков настоящего изобретения, позволяют получать окончательные результаты с достаточной высокой степенью достоверности. Различные институты и коммерческие организации занимаются обработкой непрерывно поступающих данных о последовательностях, и на основе полученных результатов они приходят к важным открытиям. Однако необходимость в идентификации и характеризации других генов и полипептидов, кодируемых этими генами, в целях их дальнейшего исследования и поиска новых лекарственных средств, все еще остается актуальной. Недавно, заявителем настоящего изобретения был разработан превосходный способ оценки последовательностей с неизвестной функцией. Этот способ представляет собой систему генерирования базы данных, называемую поисковой базой данных Biopendium, которая рассматривается в WO 01/69507. Эта система базы данных состоит из общего источника данных, созданного с использованием запатентованной технологии и содержащего информацию, полученную в результате всестороннего сравнения всех имеющихся последовательностей белков или нуклеиновых кислот. Помимо объединения данных об этих последовательностях, взятых из отдельных источников, необходимо также объединить как можно больше данных, относящихся как к самим последовательностям,так и к соответствующей информации для каждой последовательности, в один общий источник. Для этого, все имеющиеся данные, относящиеся к каждой последовательности, включая данные о трехмерной структуре кодируемого белка, если они имеются, суммируют в одно целое, что позволяет наилучшим образом использовать данные, имеющиеся для каждой последовательности, и таким образом, дает возможность сделать в высокой степени обоснованный прогноз исходя из сравнения этих последовательностей. Комментарии, которые имеются в указанной базе данных и приводятся для каждой последовательности, позволяют рассматривать информацию о последовательностях в нужном биологическом аспекте. Такой источник данных дает возможность точно предсказать функцию белка исходя из отдельно взятой последовательности. С использованием стандартной технологии можно проводить оценку лишь тех белков, последовательности которых в высокой степени идентичны (примерно выше 20-30%) последовательностям других белков одного и того же функционального семейства. При этом невозможно точно предсказать функции белков, которые имеют очень низкую степень гомологии последовательностей по отношению к другим родственным белкам с известной функцией. Белки, содержащие сигнальный пептид Способность клеток продуцировать и секретировать внеклеточные белки является главным фактором во многих биологических процессах. Ферменты, факторы роста, белки внеклеточного матрикса и молекулы, передающие сигналы, секретируются клетками. Это происходит в результате слияния секреторной везикулы с плазматической мембраной. В большинстве случаев, но не всегда, белки транспортируются в эндоплазматический ретикулум и в секреторные везикулы посредством сигнального пептида. Сигнальные пептиды представляют собой цис-активные последовательности, которые влияют на транспорт полипептидных цепей из цитоплазмы в мембрано-ассоциированный компартмент, такой как секреторная везикула. Полипептиды, которые доставляются в секреторные везикулы, либо секретируются во внеклеточный матрикс, либо удерживаются в плазматической мембране. Полипептиды, которые удерживаются в плазматической мембране, имеют один или несколько трансмембранных доменов. Примерами белков, содержащих сигнальный пептид, которые играют главную роль в функционировании клеток,являются цитокины, гормоны, белки внеклеточного матрикса, адгезивные молекулы, рецепторы, протеазы и факторы роста и дифференцировки. Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен Было показано, что молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен, играют определенную роль в различных физиологических функциях, и многие из них могут играть определенную роль в паралогических процессах. Изменение их активности влечет за собой-1 007985 изменение фенотипа заболевания, а поэтому такая идентификация новых молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, является крайне необходимой, поскольку указанные молекулы могут играть определенную роль во многих заболеваниях, а в частности, в воспалительных, онкологических и в сердечно-сосудистых заболеваниях. Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен, участвуют в различных биологических процессах, включая эмбриогенез(Martin-Bermudo, M.D. et al., Development 2000 127 (12):2607-15; Chen, L.M., et al., J. Neurosci. 2000 20 (10):377684; Zweegman, S., et al., Exp. Hemalol. 2000 28(4):401-10; Darribere, Т., et al., Biol. Cell. 2000 92(l):5-25), сохранение целостности тканей (Eckes, В., et al., J. Cell Sci. 2000 113(Pt 13): 2455-2462; Buckwalter, J.A., et al., Instr. Course(Lond). 2000 526(Pt 1):57-68; Matsuno, H., et al., Nippon Yakurigaku Zasshi. 2000 115 (3):143-50; Eliceiri, B.P., et al.,Cancer J. Sci. Am. 2000 6 (Suppl. 3):S245-9; von Beckerath, N., et al., Blood. 2000 95(11):3297-301; Topol, E.J., et al.,Am. Heart J. 2000 139 (6):927-33; Kroll, H., et al., Thromb Haemost. 2000 83(3):392-6), и инвазия бактериальных патогенов в клетку-хозяина/адгезия бактериальных патогенов к клетке-хозяину (Dersch P., et al. EMBO J. 1999 18(5): 1199-1213). Детальная характеризация структуры и функции нескольких семейств молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, послужила стимулом для создания различными фармацевтическими компаниями программ по разработке модуляторов, которые могут быть использованы в целях лечения заболеваний, включая воспалительные, онкологические, нервные, иммунные и сердечнососудистые заболевания. Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен, участвуют фактически в каждой биологической функции, начиная с эмбриогенеза и кончая апоптозом. Они играют важную роль в обеспечении структурной целостности и гомеостаза большинства тканей. Поэтому не удивительно, что дефекты в молекулах распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, приводят к развитию заболевания, и что при многих заболеваниях наблюдается модуляция функции молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен. Члены этого семейства описаны ниже в табл. 1. Действительно, семейство молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, включает несколько отдельных семейств. Некоторые из этих семейств представляют особый фармацевтический интерес, который обусловлен тем, что малые молекулы легко поддаются модуляции. Эти семейства включают 1. Адгезивные молекулы иммуноглобулина, представляющие собой контррецепторы для интегринов, например внеклеточные адгезивные молекулы (ICAM) и васкулярные клеточно-адгезивные молекулы (VCAM).-2 007985 Члены этого семейства состоят из различного числа глобулярных, иммуноглобулин-подобных, внеклеточных доменов. Некоторые члены этого семейства, например РЕСАМ-1 (CD31) и NCAM, опосредуют гомотипическую адгезию. Другие члены этого семейства, например ICAM-1 и VCAM-1, опосредуют адгезию посредством взаимодействия с интегринами. 2. Рецепторы клеточной поверхности для факторов роста. Факторы роста являются внеклеточными молекулами и они взаимодействуют со специфическими высокоаффинными рецепторами, локализованными на плазматических мембранах клеток-мишеней, с продуцированием биологического эффекта. Молекулярная характеризация различных рецепторов факторов роста показала, что они принадлежат к определенным семействам, а именно к семейству тирозинкиназных рецепторов, к ассоциированным с G-белком трансмембранным рецепторам, состоящим из семи доменов, и к серин/треонинкиназным рецепторам. Тирозинкиназные рецепторы характерезуются внеклеточным доменом, трансмембранным доменом и внутриклеточным доменом, обладающим тирозинкиназной активностью. Примерами тирозинкиназных рецепторов фактора роста являются VEGFR,PDGFR, FGFR, CSF-1R и c-KIT, которые также содержат иммуноглобулиновые домены во внеклеточной части.Dys-регуляция функции факторов роста приводит ко многим различным фенотипам патологий, включая, но не ограничиваясь ими, онкологию (Bartucci M. et al. (2001) Cancer Res. Sep. 15;61(18):6747-54, Dias S. et al. (2001)al. (2001) Endocrinology 142(9):3964-73). Таблица 1. Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен-3 007985 Таким образом, было показано, что молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен, играют определенную роль в различных физиологических функциях,многие из которых могут играть определенную роль в различных патологических процессах. Изменение их активности влечет за собой изменение патологического фенотипа, а поэтому идентификация новых молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, является в высокой степени необходимой, поскольку эти молекулы могут играть определенную роль в развитии многих заболеваний, а особенно, иммунных заболеваний, воспалительных заболеваний, онкологических заболеваний, сердечно-сосудистых заболеваний, расстройств центральной нервной системы и инфекций. Описание изобретения Настоящее изобретение основано на обнаружении того факта, что белки INSP052 и INSP055 функционируют как молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен. Примеры молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, приводятся в табл. 1. В одном из вариантов своего первого аспекта настоящее изобретение относится к полипептиду, который(i) содержит аминокислотную последовательность, представленную в SEQ ID NO:2; SEQ ID NO:4,SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16 или внеклеточный домен INSP052, либо состоит из указанных аминокислотных последовательностей или указанного внеклеточного домена;(ii) представляет собой фрагмент указанной последовательности, который обладает активностью полипептида (i), или имеет общую антигенную детерминанту с полипептидом (i), или(iii) представляет собой функциональный эквивалент (i) или (ii). Используемый авторами термин "активность полипептида по п.(i)" означает активность молекулы распознавания, расположенной на клеточной поверхности и содержащей иммуноглобулиновый домен. Используемый авторами термин "активность молекулы распознавания, расположенной на клеточной поверхности и содержащей иммуноглобулиновый домен," относится к полипептидам, содержащим аминокислотную последовательность или структурные особенности, которые могут быть идентифицированы как консервативные признаки, присущие семейству молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен. Полипептид, имеющий последовательность, указанную в SEQ ID NО:2, будет далее называться "полипептидом экзона 1 INSP052". Полипептид, имеющий последовательность, представленную SEQ IDNО:4, будет далее называться "полипептид экзона 2 INSP052". Полипептид, имеющий последовательность, представленную SEQ ID NO:6, будет далее называться "полипептидом экзона 3 INSP052". Полипептид, имеющий последовательность, представленную SEQ ID NO:8, будет далее называться "полипептидом экзона 4 INSP052". Полипептид, имеющий последовательность, представленную SEQ ID NO:10,будет далее называться "полипептидом экзона 5 INSP052". Полипептид, имеющий последовательность,представленную SEQ ID NO:12, будет далее называться "полипептидом экзона 6 INSP052". Полипептид,имеющий последовательность, представленную SEQ ID NO:14, будет далее называться "полипептидом экзона 7 INSP052". В результате объединения последовательностей SEQ ID NO:2, SEQ ID NO:4, SEQ IDNO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14 получают последовательность, обозначенную SEQ ID NO:16. Полипептид, имеющий последовательность, представленную SEQ ID NO:16,будет далее называться "полипептидом INSP052". Используемый здесь термин "полипептиды экзонов INSP052" означает полипептиды, содержащие,или состоящие из них, полипептид экзона 1 INSP052, полипептид экзона 2 INSP052, полипептид экзона 3INSP052, полипептид экзона 4 INSP052, полипептид экзона 5 INSP052, полипептид экзона 6 INSP052,полипептид экзона 7 INSP052, полипептид INSP052 и внеклеточный домен INSP052. В одном из вариантов осуществления изобретения полипептид этого варианта состоит из аминокислотной последовательности, представленной в SEQ ID NO:16, либо он представляет собой его фрагмент или функциональный эквивалент. В другом варианте полипептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ IDNO:10, SEQ ID NO:12 или SEQ ID NO:14, или ее варианта. В одном из вариантов своего первого аспекта настоящее изобретение относится к полипептиду, который(i) содержит аминокислотную последовательность или состоит из аминокислотной последовательности внеклеточного домена INSP052;(ii) представляет собой ее фрагмент, обладающий активностью полипептида (i), или содержащий общую антигенную детерминанту с полипептидом (i); или(iii) представляет собой функциональный эквивалент (i) или (ii). Внеклеточный домен INSP052 соответствует аминокислотам 1-240 (см. раздел "Примеры"). См. также фиг. 7, относящуюся к внеклеточному домену INSP052. Во втором варианте своего первого аспекта настоящее изобретение относится к полипептиду, который(i) содержит аминокислотную последовательность или состоит из аминокислотной последователь-4 007985 ности, представленной в SEQ ID NO:18;(ii) представляет собой ее фрагмент, обладающий активностью полипептида по п. (i), или содержащий общую антигенную детерминанту с полипептидом по п.(i); или(iii) представляет собой функциональный эквивалент (i) или (ii). Используемый авторами термин "активность полипептида (i)" означает активность молекулы распознавания, расположенной на клеточной поверхности и содержащей иммуноглобулиновый домен. В соответствии с этим вариантом указанный полипептид, предпочтительно, состоит из аминокислотной последовательности, представленной в SEQ ID NO:18, или ее фрагмента или ее функционального эквивалента. Полипептид, имеющий последовательность, представленную в SEQ ID NO:18, будет далее называться "полипептидом INSP055". Во втором своем аспекте настоящее изобретение относится к очищенной молекуле нуклеиновой кислоты, кодирующей полипептид первого аспекта настоящего изобретения. Указанная очищенная молекула нуклеиновой кислоты предпочтительно содержит, или состоит из них, последовательность нуклеиновой кислоты, представленную в SEQ ID NO:1 (кодирующую полипептид экзона 1 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:3 (кодирующую полипептид экзона 2 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:5 (кодирующую полипептид экзона 3 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:7 (кодирующую полипептид экзона 4 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:9 (кодирующую полипептид экзона 5 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:11 (кодирующую полипептид экзона 6 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:13 (кодирующую полипептид экзона 7 INSP052); последовательность нуклеиновой кислоты, представленную в SEQ ID NO:15 (кодирующую полипептид INSP052); или последовательность нуклеиновой кислоты, представленную в SEQ ID NO:17 (кодирующую полипептид INSP055), либо она представляет собой избыточный эквивалент или фрагмент любой из этих последовательностей. При объединении последовательностей, представленных в SEQ ID NO:1, SEQ ID NO:3, SEQ IDNO:5, SEQ ID NO:7, SEQ ID NO:9, SEQ ID NO:11 и SEQ ID NO:13, продуцируется последовательность,представленная в SEQ ID NO:15. В одном из вариантов своего второго аспекта настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей полипептид, который включает внеклеточный домен INSP052 или состоит из этого домена. Указанная молекула нуклеиновой кислоты предпочтительно содержит, или состоит из нее, последовательность нуклеиновой кислоты, представленную на фиг. 7, или кодирующую часть последовательности нуклеиновой кислоты, представленную на фиг. 7. В своем третьем аспекте настоящее изобретение относится к очищенной молекуле нуклеиновой кислоты, которая гибридизуется в условиях высокой жесткости с молекулой нуклеиновой кислоты второго аспекта настоящего изобретения. В своем четвертом аспекте настоящее изобретение относится к вектору, такому как экспрессирующий вектор, который содержит молекулу нуклеиновой кислоты второго или третьего аспекта настоящего изобретения. В своем пятом аспекте настоящее изобретение относится к клетке-хозяину, трансформированному вектором четвертого аспекта настоящего изобретения. В своем шестом аспекте настоящее изобретение относится к лиганду, который специфически связывается с полипептидом первого аспекта настоящего изобретения, и который предпочтительно ингибирует активность указанного полипептида. Используемый авторами термин "активность полипептида настоящего изобретения" и аналогичные понятия означают активность, присущую молекулам распознавания на клеточной поверхности, содержащим иммуноглобулиновый домен. В своем седьмом аспекте настоящее изобретение относится к соединению, которое является эффективным в отношении изменения экспрессии природного гена, кодирующего полипептид первого аспекта настоящего изобретения, или в отношении регуляции активности полипептида первого аспекта настоящего изобретения. Соединение седьмого аспекта настоящего изобретения может либо повышать (служить агонистом),либо снижать (служить антагонистом) уровень экспрессии гена или активности полипептида. Важно отметить, что идентификация функции полипептидов INSP052 и INSP055 дает возможность-5 007985 разработать способы скрининга, позволяющие идентифицировать соединения, эффективные для лечения и/или диагностики заболеваний. Лиганды и соединения шестого и седьмого аспектов настоящего изобретения могут быть идентифицированы с использованием таких способов. Эти способы также являются аспектами настоящего изобретения. В своем восьмом аспекте настоящее изобретение относится к полипептиду первого аспекта настоящего изобретения, или к молекуле нуклеиновой кислоты второго или третьего аспекта настоящего изобретения, или к вектору четвертого аспекта настоящего изобретения, или к клетке-хозяину пятого аспекта настоящего изобретения, или к лиганду шестого аспекта настоящего изобретения, или к соединению седьмого аспекта настоящего изобретения, которые могут быть использованы для лечения или диагностики. Эти молекулы могут быть также использованы в целях получения лекарственного средства, предназначенного для лечения заболеваний, включая, но не ограничиваясь ими, клеточно-пролиферативные расстройства, аутоиммунные/воспалительные заболевания, сердечно-сосудистые заболевания, неврологические и психические расстройства, нарушения развития, генетические нарушения, метаболические расстройства, инфекции и другие патологические состояния. Такими заболеваниями предпочтительно являются неоплазма, рак, опухоль головного мозга, глиома, опухоль кости, опухоль легких, опухоль молочной железы, опухоль предстательной железы, опухоль толстой кишки, гемангиома, миелопролиферативное расстройство, лейкоз, гематологическое заболевание, нейтропения, тромбоцитопения, нарушения ангиогенеза, кожное заболевание, старение, раны, ожоги, фиброз, сердечно-сосудистые заболевания, рестеноз, болезнь сердца, заболевание периферических сосудов, коронарная болезнь сердца, отеки, тромбоэмболия, дисменорея, эндометриоз, преэклампсия, болезнь легких, ХОЗЛ (хроническое обструктивное заболевание легких), астма, заболевание костей, почечное заболевание, гломерулонефрит, болезнь печени, болезнь Крона, гастрит, язвенный колит, язва, иммунное расстройство, аутоиммунное заболевание,артрит, ревматоидный артрит, псориаз, буллезный эпидермолиз, системная красная волчанка, анкилозирующий спондилит, болезнь Лайма, рассеянный склероз, нейродегенеративное расстройство, инсульт,повреждение головного мозга/спинного мозга, болезнь Альцгеймера, болезнь Паркинсона, "болезни мотонейрона" (общее название группы заболеваний, характеризующихся поражением периферических мотонейронов), нервномышечное заболевание, ВИЧ-инфекции, СПИД, цитомегаловирусные инфекции,грибковые инфекции, глазные болезни, дегенерация желтого пятна, глаукома, диабетическая ретинопатия, повышенное глазное давление и другие состояния, в которых участвуют молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен. Указанные молекулы первого, второго, третьего, четвертого, шестого или седьмого аспектов настоящего изобретения могут быть также использованы в целях изготовления лекарственного средства для лечения указанных заболеваний. В своем девятом аспекте настоящее изобретение относится к способу диагностики заболеваний у пациента, предусматривающему оценку уровня экспрессии природного гена, кодирующего полипептид первого аспекта настоящего изобретения, или оценку уровня активности полипептида первого аспекта настоящего изобретения в ткани указанного пациента и сравнение указанного уровня экспрессии или активности с контрольным уровнем, где уровень, который отличается от указанного контрольного уровня, является показателем заболевания. Такой способ предпочтительно осуществляют in vitro. Аналогичные способы могут быть использованы для мониторинга терапевтического лечения заболевания у пациента, где изменение уровня экспрессии или активности полипептида или молекулы нуклеиновой кислоты в течение определенного периода времени по сравнению с контрольным уровнем служит показателем регрессирования заболевания. Предпочтительный способ детекции полипептидов первого аспекта настоящего изобретения включает стадии: (а) контактирования лиганда шестого аспекта настоящего изобретения, такого как антитело,с биологическим образцом в условиях, подходящих для образования комплекса лиганд-полипептид; и (b) детекции указанного комплекса. Что касается девятого аспекта настоящего изобретения, то каждому читателю известно, что для детекции аномальных уровней белка существуют различные методы, такие как методыгибридизации нуклеиновой кислоты с короткими зондами, методы анализа на точковую мутацию, метод амплификации с помощью полимеразной цепной реакции (ПЦР) и методы, в которых используются антитела. Аналогичные методы могут быть использованы в течение коротких или продолжительных промежутков времени,что позволяет наблюдать за терапевтическим лечением заболевания у пациента. Настоящее изобретение также относится к набору, который может быть использован в указанных методах диагностики заболевания. Заболеванием, диагностируемым способом в соответствии с девятым аспектом настоящего изобретения, предпочтительно, является заболевание, которое ассоциировано с описанными выше молекулами распознавания на клеточной поверхности, содержащими иммуноглобулиновый домен. В своем десятом аспекте настоящее изобретение относится к использованию полипептидов первого аспекта настоящего изобретения в качестве молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен. Важная роль Ig-доменов в рецепторах клеточной поверхности описанаJ.Biol.Chem. 1997 Dec.26;272(52):33037-44. Настоящее изобретение также относится к использованию молекулы нуклеиновой кислоты второго или третьего аспектов настоящего изобретения для экспрессии белка, обладающего активностью молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен. Настоящее изобретение также относится к способу воздействия на активность молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен, где указанный способ предусматривает использование полипептида первого аспекта настоящего изобретения. В своем одиннадцатом аспекте настоящее изобретение относится к фармацевтической композиции,содержащей полипептид первого аспекта настоящего изобретения или молекулу нуклеиновой кислоты второго или третьего аспекта настоящего изобретения, или вектор четвертого аспекта настоящего изобретения, или клетку-хозяина пятого аспекта настоящего изобретения, или лиганд шестого аспекта настоящего изобретения, или соединение седьмого аспекта настоящего изобретения в сочетании с фармацевтически приемлемым носителем. В своем двенадцатом аспекте настоящее изобретение относится к полипептиду первого аспекта настоящего изобретения, или к молекуле нуклеиновой кислоты второго или третьего аспекта настоящего изобретения, или к вектору четвертого аспекта настоящего изобретения, или к клетке-хозяину пятого аспекта настоящего изобретения, или к лиганду шестого аспекта настоящего изобретения, или к соединению седьмого аспекта настоящего изобретения, которые могут быть использованы для диагностики или лечения заболеваний. Эти молекулы могут быть также использованы в целях изготовления лекарственного средства, предназначенного для лечения заболеваний, включая, но не ограничиваясь ими, клеточно-пролиферативные расстройства, аутоиммунные/воспалительные заболевания, сердечнососудистые заболевания, неврологические и психические расстройства, нарушения развития, генетические нарушения, метаболические расстройства, инфекции и другие патологические состояния. Такими заболеваниями, предпочтительно, являются неоплазма, рак, опухоль головного мозга, глиома, опухоль кости, опухоль легких, опухоль молочной железы, опухоль предстательной железы, опухоль толстой кишки, гемангиома, миелопролиферативное расстройство, лейкоз, гематологическое заболевание, нейтропения, тромбоцитопения, нарушения ангиогенеза, кожное заболевание, старение, раны, ожоги, фиброз, сердечно-сосудистые заболевания, рестеноз, болезнь сердца, заболевание периферических сосудов,коронарная болезнь сердца, отеки, тромбоэмболия, дисменорея, эндометриоз, преэклампсия, болезнь легких, ХОЗЛ, астма, заболевание костей, почечное заболевание, гломерулонефрит, болезнь печени, болезнь Крона, гастрит, язвенный колит, язва, иммунное расстройство, аутоиммунное заболевание, артрит,ревматоидный артрит, псориаз, буллезный эпидермолиз, системная красная волчанка, анкилозирующий спондилит, болезнь Лайма, рассеянный склероз, нейродегенеративное расстройство, инсульт, повреждение головного мозга/спинного мозга, болезнь Альцгеймера, болезнь Паркинсона, "болезни мотонейрона", нервномышечное заболевание, ВИЧ-инфекции, СПИД, цитомегаловирусные инфекции, грибковые инфекции, глазные болезни, дегенерация желтого пятна, глаукома, диабетическая ретинопатия, повышенное глазное давление и другие состояния, в которых участвуют молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен. В своем тринадцатом аспекте настоящее изобретение относится к способу лечения заболевания у пациента, предусматривающему введение указанному пациенту полипептида первого аспекта настоящего изобретения, или молекулы нуклеиновой кислоты второго или третьего аспекта настоящего изобретения, или вектора четвертого аспекта настоящего изобретения, или клетки-хозяина пятого аспекта настоящего изобретения, или лиганда шестого аспекта настоящего изобретения или соединения седьмого аспекта настоящего изобретения. В случае заболеваний, при которых у данного пациента уровень экспрессии природного гена, кодирующего полипептид первого аспекта настоящего изобретения, или активность полипептида первого аспекта настоящего изобретения ниже, чем уровень экспрессии или активность у здорового пациента,полипептид, молекула нуклеиновой кислоты, лиганд или соединение, вводимые указанному пациенту,должны обладать агонистическими свойствами. И наоборот, в случае заболеваний, при которых у данного пациента уровень экспрессии природного гена, кодирующего полипептид первого аспекта настоящего изобретения, или активность полипептида первого аспекта настоящего изобретения выше, чем уровень экспрессии или активность у здорового пациента, полипептид, молекула нуклеиновой кислоты, лиганд или соединения, вводимые указанному пациенту, должны обладать антагонистическими свойствами. Примерами таких антагонистов являются молекулы антисмысловой нуклеиновой кислоты, рибозимы и лиганды, такие как антитела. В своем четырнадцатом аспекте настоящее изобретение относится к трансгенным животным или к животным, дефицитным по полипептиду первого аспекта настоящего изобретения, которые не являются человеком и которые были трансформированы так, что они экспрессируют более высокие или более низкие уровни такого полипептида или вообще не экспрессируют указанный полипептид. Такие трансгенные животные являются наиболее подходящими моделями для исследования заболеваний и могут быть также использованы в способах скрининга в целях идентификации соединений, которые являются эффективными для лечения или диагностики такого заболевания.-7 007985 Таким заболеванием, предпочтительно, является заболевание, которое ассоциировано с описанными выше молекулами распознавания на клеточной поверхности, содержащими иммуноглобулиновый домен. При этом следует отметить, что объем охраны для рассматриваемых полипептидов и нуклеиновых кислот настоящего изобретения не распространяется на нуклеиновые кислоты или полипептиды, присутствующие в их природных источниках. Точнее говоря, полипептиды и нуклеиновые кислоты, заявленные в настоящем изобретении, могут рассматриваться как "выделенные" или "очищенные". Используемые здесь термины "выделенный" и "очищенный" относятся к нуклеиновой кислоте или полипептиду, отделенным по крайней мере от одного другого компонента (например, нуклеиновой кислоты или полипептида), присутствующего вместе с нуклеиновой кислотой или с полипептидом в их природном источнике. Так, например, "выделенным" или "очищенным" полипептидом может быть полипептид, содержащийся в экстракте ткани, а также синтетически или рекомбинантно продуцированный полипептид. В одном из вариантов нуклеиновая кислота или полипептид присутствуют (если вообще присутствуют) только в растворителе, буфере, вместе с ионами или с другим соединением, обычно присутствующем в растворе указанных соединений. При этом следует отметить, что термины "выделенный" и "очищенный" не означают метод, с помощью которого были получены указанный полипептид или нуклеиновая кислота, или уровень чистоты этого препарата. Так, например, такие выделенные или очищенные молекулы могут быть продуцированы рекомбинантным способом, могут быть выделены непосредственно из нужной клетки или ткани, либо они могут быть продуцированы путем синтеза на основе определенных последовательностей. Краткое описание стандартных способов и процедур, которые могут быть использованы для осуществления настоящего изобретения, приводится ниже. Следует отметить, что настоящее изобретение не ограничивается конкретно описанными способами, протоколами, клеточными линиями, векторами и реагентами. Следует также отметить, что используемая здесь терминология приводится лишь в целях описания конкретных вариантов осуществления настоящего изобретения и не должна рассматриваться как ограничение объема настоящего изобретения. Объем настоящего изобретения ограничивается лишь прилагаемой формулой изобретения. В этом описании используются стандартные сокращения, принятые для обозначения нуклеотидов и аминокислот. Если это не оговорено особо, то для осуществления настоящего изобретения могут быть использованы стандартные методы молекулярной биологии и микробиологии, методы рекомбинантных ДНК и методы иммунологии, которые хорошо известны специалистам в этой области. Более полное описание таких методов можно найти в литературе. Так, например, наиболее подходящее описание, которое может быть использовано в качестве консультации, приводится в следующих работах: Sambrook Molecular Cloning; А Laboratory Manual, Second Edition (1989); DNA Cloning, VolumesBlackwell eds. 1986). Используемый здесь термин "полипептид" включает любой пептид или белок, содержащий две или более аминокислот, связанных друг с другом пептидными связями или модифицированными пептидными связями, то есть пептидными изостерами. Этот термин относится как к коротким цепям (пептидам и полипептидам), так и к более длинным цепям (белкам). Полипептид настоящего изобретения может присутствовать в форме зрелого белка, либо он может присутствовать в виде пре-, про- или препробелка, который может быть активирован путем отщепления пре-, про- или препрочасти этого белка с продуцированием активного зрелого полипептида. В таких полипептидах, пре-, про- или препропоследовательность может представлять собой лидерную или секреторную последовательность, либо она может представлять собой последовательность, используемую для очистки зрелой полипептидной последовательности. Полипептид первого аспекта настоящего изобретения может образовывать часть гибридного белка. Так, например, часто оказывается предпочтительным, чтобы данный полипептид включал одну или несколько дополнительных аминокислотных последовательностей, которые могут содержать секреторную или лидерную последовательности, пропоследовательности, последовательности, облегчающие очистку,или последовательности, сообщающие белку более высокую стабильность, например, во время рекомбинантного продуцирования. Альтернативно или дополнительно, зрелый полипептид может быть присоединен к другому соединению, например к соединению, увеличивающему время полужизни указанного полипептида (например, к полиэтиленгликолю).-8 007985 Полипептиды могут содержать аминокислоты, которые отличаются от 20 аминокислот, кодируемых генами, и которые являются модифицированными либо в результате природных процессов, таких как посттрансляционный процессинг, либо в результате применения химических методов модификации,хорошо известных специалистам. Примерами известных модификаций, которые могут быть осуществлены в полипептидах настоящего изобретения, являются гликозилирование, присоединение липида, сульфирование, гамма-карбоксилирование, например, остатков глутаминовой кислоты, гидроксилирование иADP-рибозилирование. Другими возможными модификациями являются ацетилирование, ацилирование,амидирование, ковалентное присоединение флавина, ковалентное присоединение молекулы гема, ковалентное присоединение нуклеотида или нуклеотидного производного, ковалентное присоединение липидного производного, ковалентное присоединение фосфатидилинозита, перекрестное сшивание, циклизация, образование дисульфидной связи, деметилирование, образование ковалентных поперечных связей,образование цистеина, образование пироглутамата, формилирование, образование GPI-якоря, иодирование, метилирование, миристоилирование, окисление, протеолитический процессинг, фосфорилирование,пренилирование, рацемизация, селеноилирование, присоединение аминокислот к белкам, опосредуемое т-РНК, такое как аргинилирование; и убихитинизация. Модификации могут присутствовать в любом участке полипептида, включая пептидный остов,аминокислотные боковые цепи и амино- или карбоксиконцы. Действительно, блокирование амино- или карбоксиконца в полипептиде, либо того и другого, посредством ковалентной модификации является обычным процессом, происходящим в природных и синтетических полипептидах, и такие модификации могут присутствовать в полипептидах настоящего изобретения. Модификации, которые присутствуют в полипептиде, в большинстве случаев, будут зависеть от способа получения данного полипептида. Для полипептидов, полученных рекомбинантным методом,природа и степень модификации, по большей части, будет определяться способностью к посттрансляционной модификации конкретной клетки-хозяина и присутствием сигналов модификации в аминокислотной последовательности рассматриваемого полипептида. Так, например, характер гликозилирования может варьироваться у клеток-хозяев различного типа. Полипептиды настоящего изобретения могут быть получены любым подходящим способом. Такими полипептидами являются выделенные природные полипептиды (например, выделенные из клеточной культуры), полипептиды, продуцированные рекомбинантным методом (включая гибридные белки), синтетические полипептиды или полипептиды, продуцированные с использованием комбинации этих методов. Функционально эквивалентные полипептиды первого аспекта настоящего изобретения могут представлять собой полипептиды, гомологичные полипептидам INSP052 и INSP055. Два полипептида могут быть определены используемым здесь термином "гомологичные", если последовательность одного из этих полипептидов имеет достаточно высокую степень идентичности или сходства с последовательностью другого полипептида. Термин "идентичность" означает, что в любом конкретном положении сопоставляемых последовательностей, эти две последовательности имеют идентичные аминокислотные остатки. Термин "сходство" означает, что в любом конкретном положении сопоставляемых последовательностей, эти две последовательности имеют аминокислотные остатки аналогичного типа. Степень идентичности и сходства может быть легко определена (Computational Molecular Biology, Lesk, A.M., ed., OxfordPress, 1987; and Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York,1991). Поэтому гомологичными полипептидами являются природные биологические варианты (например,аллельные варианты или варианты полипептидов, образовавшиеся в результате географических изменений видов, от которых они происходят), и мутанты (такие как мутанты, содержащие аминокислотные замены, инсерции или делеции) полипептидов INSP052 и INSP055. Такими мутантами могут быть полипептиды, в которых один или несколько аминокислотных остатков заменены консервативным или неконсервативным аминокислотным остатком (предпочтительно, консервативным аминокислотным остатком), и такой замененный аминокислотный остаток может быть, а может и не быть, остатком, кодируемым генетическим кодом. Обычно такие замены происходят между Ala, Val, Leu и Ilе; между Ser и Thr; между кислотными остатками Asp и Glu; между Asn и Gln; между основными остатками Lys и Arg; или между ароматическими остатками Phe и Туr. Особенно предпочтительными являются варианты, в которых несколько, то есть от 5 до 10, от 1 до 5, от 1 до 3, от 1 до 2 аминокислот или только одна аминокислота являются замененными, делетированными или добавленными в любой комбинации. Особенно предпочтительными являются "молчащие" замены, добавления и делеции, которые не влияют на свойства и активность указанного белка. Также предпочтительными являются консервативные замены. Такими мутантами также являются полипептиды, в которых один или несколько аминокислотных остатков включают группу-заместитель. Обычно считается, что два полипептида, имеющие более чем 30% идентичность, являются функционально эквивалентными. Предпочтительно, чтобы последовательности функционально эквивалент-9 007985 ных полипептидов первого аспекта настоящего изобретения были более, чем на 80% идентичны последовательностям полипептидов INSP052 и INSP055 или их активных фрагментов. Более предпочтительными являются полипептиды, имеющие степень идентичности более чем 85, 90, 95, 98, 99% или более,соответственно. Функционально эквивалентными полипептидами первого аспекта настоящего изобретения могут быть также полипептиды, которые были идентифицированы с применением одного или нескольких методов сопоставления первичных последовательностей путем их выравнивания. Так, например, технология информационной обработки потока данных для генома (Inpharmatica. Genome Threader), которая составляет один из аспектов способа поиска, используемых для генерирования базы данных поиска Biopendium, может быть применена (см. Международную патентную заявкуPCT/GB01/01105, опубликованную как WO 01/69507) для идентификации полипептидов с неизвестными функциями, в отношении которых, несмотря на их низкую степень идентичности по сравнению с полипептидами INSP052 иINSP055, высказывается предположение, что они представляют собой молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен, где указанный способ предусматривает использование полипептида первого аспекта настоящего изобретения, и где указанное предположение основано на их значительной структурной гомологии с последовательностями полипептидов INSP052 иThreader позволяет предсказать, с достоверностью по крайней мере 10%, а более предпочтительно по крайней мере 20, 30, 40, 50, 60, 70, 80, 90% и выше. Полипептиды первого аспекта настоящего изобретения также включают фрагменты полипептидовINSP052 и INSP055, и фрагменты функциональных эквивалентов полипептидов INSP052 и INSP055, при условии, что эти фрагменты сохраняют активность молекул распознавания на клеточной поверхности,содержащих иммуноглобулиновый домен, или имеют общую антигенную детерминанту с полипептидами INSP052 и INSP055. Используемый здесь термин "фрагмент" означает полипептид, имеющий аминокислотную последовательность, которая является идентичной части, но не всей, аминокислотной последовательности полипептидов INSP052 и INSP055, либо одному из их функциональных эквивалентов. Эти фрагменты должны содержать, по крайней мере, n смежных аминокислот данной последовательности, и в зависимости от конкретной последовательности, n, предпочтительно равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20 или более). Небольшие фрагменты могут образовывать антигенную детерминанту. Указанные фрагменты могут присутствовать в "свободной форме" то есть не являться частью другого полипептида или не быть присоединенными к другим аминокислотам или полипептидам, либо они могут входить в состав более крупного полипептида, часть или область которого они образуют. Если фрагмент настоящего изобретения входит в состав более крупного полипептида, то наиболее предпочтительно, чтобы такой фрагмент образовывал одну непрерывную область. Так, например, некоторые предпочтительные варианты настоящего изобретения относятся к фрагменту, имеющему пре- и/или прополипептидную область, присоединенную к аминоконцу указанного фрагмента, и/или дополнительную область, присоединенную к карбоксильному концу этого фрагмента. Однако несколько фрагментов могут входить в состав одного более крупного полипептида. Полипептиды настоящего изобретения или их иммуногенные фрагменты (содержащие, по крайней мере, одну антигенную детерминанту) могут быть использованы для генерирования лигандов, таких как поликлональные или моноклональные антитела, которые обладают иммуноспецифичностью к таким полипептидам. Указанные антитела могут быть использованы для выделения или для идентификации клонов, экспрессирующих полипептиды настоящего изобретения, или для очистки данных полипептидов аффинной хроматографией. Как совершенно очевидно для любого читателя, такие антитела, помимо других применений, могут быть также использованы в качестве диагностических или терапевтических средств. Термин "иммуноспецифический" означает, что данные антитела имеют значительно более высокую аффинность к полипептидам настоящего изобретения, чем к другим родственным полипептидам, описанным ранее. Используемый здесь термин "антитело" означает интактные молекулы, а также их фрагменты, такие как Fab, F(ab')2 и Fv, которые способны связываться с рассматриваемой антигенной детерминантой. Таким образом, такие антитела связываются с полипептидами первого аспекта настоящего изобретения. Под понятием "значительно более высокая аффинность" авторы подразумевают заметно повышенную аффинность к полипептиду настоящего изобретения по сравнению с аффиностью известных молекул распознавания на клеточной поверхности, содержащих иммуноглобулиновый домен. При этом предпочтительно, чтобы аффинность по отношению к полипептиду настоящего изобретения,по крайней мере, в 1,5, 2, 5, 10, 100, 103, 104, 105 или 106 раз превышала аффинность по отношению к известным молекулам распознавания на клеточной поверхности, содержащим иммуноглобулиновый домен. Если желательно использовать поликлональные антитела, то выбранное млекопитающее, такое как мышь, кролик, коза или лошадь, может быть иммунизовано полипептидом первого аспекта настоящего изобретения. Полипептид, используемый для иммунизации животного, может быть получен методами- 10007985 рекомбинантных ДНК, либо он может быть синтезирован методом химического синтеза. Если необходимо, то данный полипептид может быть конъюгирован с белком-носителем. Обычно используемыми носителями, к которым могут быть химически присоединены данные полипептиды, являются альбумин бычьей сыворотки, тироглобулин и гемоцианин лимфы улитки. Затем связанный полипептид может быть использован для иммунизации животного. Сыворотку, взятую у иммунизованного животного, собирают и обрабатывают известными методами, например, иммуноаффинной хроматографией. Моноклональные антитела против полипептидов первого аспекта настоящего изобретения могут быть легко продуцированы любым специалистом. Общая методика получения моноклональных антител с использованием гибридомной техники хорошо известна специалистам (см., например, Kohler G.Milstein, С.Nature 256:495-497 (1975); Kozbor et al., Immunology Today 4:72(1983); Cole et al., 77-96, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. (1985. Панели моноклональных антител, продуцированных против полипептидов первого аспекта настоящего изобретения, могут быть скринированы на различные свойства, то есть на изотип, эпитоп, аффинность и т.п. Моноклональные антитела являются особенно подходящими для очистки отдельных полипептидов, против которых они направлены. Альтернативно, гены, кодирующие нужные моноклональные антитела, могут быть выделены из гибридом, например, методами ПЦР, известными специалистам, а также они могут быть клонированы и экспрессированы в соответствующих векторах. Могут быть также использованы химерные антитела, в которых нечеловеческие вариабельные области соединены или лигированы с человеческими константными областями (см. например, Liu et al.,Proc. Natl. Acad. Sci. USA, 84, 3439 (1987. Эти антитела могут быть модифицированы так, чтобы они были менее иммуногенными для индивидуума, например, путем их "гуманизации" (см., Jones et al., Nature, 321, 522 (1986); Verhoeyen et al.,Science, 239, 1534 (1988); Kabat et al., J. Immunol., 147, 1709 (1991); Queen et al., Proc. Natl. Acad. Sci.,USA, 86, 10029 (1989); Gorman et al., Proc. Natl. Acad. Sci., USA, 88, 34181 (1991) and Hodgson et al.,Bio/Technology, 9, 421 (1991. Используемый здесь термин "гуманизированное антитело" означает молекулы антитела, в которых аминокислоты CDR и другие выбранные аминокислоты в вариабельных доменах тяжелой и/или легкой цепей нечеловеческого донорного антитела были заменены эквивалентными аминокислотами человеческого антитела. Таким образом, гуманизированное антитело имеет близкое сходство с человеческим антителом, но при этом оно обладает способностью к связыванию донорного антитела. В другом альтернативном варианте изобретения, таким антителом может быть "биспецифическое" антитело, то есть антитело, имеющее два различных антигенсвязывающих домена, каждый из которых обладает специфичностью к различным эпитопам. Для отбора генов, кодирующих антитела, обладающие способностью связываться с полипептидами настоящего изобретения, либо из набора ПЦР-амплифицированных V-генов лимфоцитов людей, скринированных на способность вырабатывать соответствующие антитела, либо из библиотеки "необученных" лимфоцитов, может быть использована техника фагового представления (McCafferty J. et al. (1990), Nature 348, 552-554; Marks J. et al., (1992) Biotechnology 10, 779-783). Аффинность этих антител может быть также увеличена путем перестановки цепей (Clackson Т. et al. (1991) Nature 352, 624-628). Антитела, генерированные вышеописанными методами, независимо от того, являются ли они поликлональными или моноклональными, обладают и другими ценными свойствами, то есть они могут быть использованы в качестве реагентов в иммуноанализах, радиоиммуноанализах (РИА) или твердофазных иммуноферментных анализах (ELISA). Для использования в этих целях антитела могут быть помечены аналитически детектируемым реагентом, таким как радиоизотоп, флуоресцентная молекула или фермент. Предпочтительными молекулами нуклеиновой кислоты второго и третьего аспектов настоящего изобретения являются молекулы, которые кодируют полипептидные последовательности, представленные в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ IDNO:14 и/или SEQ ID NO:16 или SEQ ID NO:18, и функционально эквивалентные полипептиды. Эти молекулы нуклеиновой кислоты могут быть использованы в способах и в целях, описанных в настоящей заявке. Молекулы нуклеиновой кислоты настоящего изобретения предпочтительно содержат, по крайней мере, n смежных нуклеотидов из описанных здесь последовательностей, где n, в зависимости от конкретной последовательности предпочтительно равно 10 или более (например, 12, 14, 15, 18, 20, 25, 30, 35,40 или более). Молекулами нуклеиновой кислоты настоящего изобретения также являются последовательности,комплементарные последовательностям молекул нуклеиновой кислоты, описанных выше (например, для использования в качестве антисмысловых последовательностей или в качестве зондов). Молекулы нуклеиновой кислоты настоящего изобретения могут присутствовать в форме РНК, такой как мРНК, или в форме ДНК, включая, например, кДНК, синтетическую ДНК или геномную ДНК. Такие молекулы нуклеиновой кислоты могут быть получены методами клонирования, химического синтеза или их комбинацией. Молекулы нуклеиновой кислоты могут быть получены, например, методом химического синтеза, таким как твердофазный фосфорамидитный химический синтез, выделением из геномных или кДНК-библиотек или выделением из микроорганизма. РНК-молекулы могут быть, в ос- 11007985 новном, генерированы путем in vitro- или in vivo-транскрипции ДНК-последовательностей. Молекулы нуклеиновой кислоты могут быть двухцепочечными или одноцепочечными. Одноцепочечной ДНК может быть кодирующая цепь, также известная как смысловая цепь, либо некодирующая цепь, также называемая антисмысловой цепью. Термин "молекула нуклеиновой кислоты" также охватывает аналоги ДНК и РНК, такие как аналоги,содержащие модифицированные остовы и связанные с пептидом нуклеиновые кислоты (PNA). Используемый здесь термин "PNA" означает антисмысловую молекулу или антиген, который содержит олигонуклеотид, состоящий, по крайней мере, из пяти нуклеотидов, и присоединенный к пептидному остову из аминокислотных остатков, которые, предпочтительно, заканчиваются лизином. Этот концевой лизин сообщает данной композиции растворимость. PNA могут быть ПЭГилированы для продления их времени жизни в клетке, где они предпочтительно, связываются с комплементарной одноцепочечной ДНК и РНК и приостанавливают элонгацию транскрипта (Nielsen P.E. et al. (1993) Anticancer Drug Des. 8:53-63). Эти молекулы могут также иметь различные последовательности, которые, вследствие вырожденности генетического кода, кодируют полипептид SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ IDNO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 и/или SEQ ID NO:16 или SEQ ID NO:18. Такими молекулами могут быть, но не ограничиваются ими, кодирующая последовательность для отдельного зрелого полипептида; кодирующая последовательность для зрелого полипептида и дополнительные кодирующие последовательности, такие как последовательности, кодирующие лидерную или секреторную последовательность, такую как про-, пре- или препрополипептидную последовательность; кодирующая последовательность зрелого полипептида с вышеупомянутыми дополнительными кодирующими последовательностями, или без них, вместе с дополнительными некодирующими последовательностями,включая некодирующие 5'- и 3'-последовательности, такие как транскрибируемые нетранслируемые последовательности, которые играют определенную роль в транскрипции (включая сигналы терминации), в связывании с рибосомой и в обеспечении стабильности мРНК. Молекулами нуклеиновой кислоты могут быть также вспомогательные последовательности, кодирующие дополнительные аминокислоты, такие как аминокислоты, обладающие дополнительными функциональными свойствами. Молекулы нуклеиновой кислоты второго и третьего аспектов настоящего изобретения могут также кодировать фрагменты или функциональные эквиваленты полипептидов и фрагментов первого аспекта настоящего изобретения. Такая молекула нуклеиновой кислоты может представлять собой природный вариант, такой как природный аллельный вариант, либо указанной молекулой может быть вариант, не встречающийся в природе. Указанные неприродные варианты молекулы нуклеиновой кислоты могут быть получены методами мутагенеза, включая методы, применяемые к молекулам нуклеиновой кислоты,к клеткам или к целым организмам. Среди рассматриваемых вариантов имеются варианты, которые отличаются от вышеупомянутых молекул нуклеиновой кислоты тем, что они имеют нуклеотидные замены, делеции или инсерции. Такие замены, делеции или инсерции могут быть сделаны в одном или нескольких нуклеотидах. Указанные варианты могут быть модифицированы в кодирующей или в некодирующей области или в той и другой области. Альтерации в кодирующих областях могут приводить к консервативным или неконсервативным аминокислотным заменам, делециям или инсерциям. Молекулы нуклеиновой кислоты настоящего изобретения могут быть также сконструированы методами, в основном, известными специалистам, включая, в зависимости от различных целей, модификацию клонирования, процессинга и/или экспрессии генного продукта (полипептида). Перестановка ДНК путем рандомизированной фрагментации и повторной сборки генных фрагментов и синтетических олигонуклеотидов с помощью ПЦР представляет собой технологию, которая может быть использована для конструирования нуклеотидных последовательностей. Сайт-направленный мутагенез может быть использован для введения новых рестрикционных сайтов, изменения характера гликозилирования, изменения предпочтительности кодонов, продуцирования вариантов сплайсинга, введения мутаций и т.п. Молекулы нуклеиновой кислоты, которые кодируют полипептид первого аспекта настоящего изобретения, могут быть лигированы с гетерологичной последовательностью так, чтобы полученная комбинированная молекула нуклеиновой кислоты кодировала гибридный белок. Такие комбинированные молекулы нуклеиновой кислоты входят во второй или третий аспект настоящего изобретения. Так, например, для скрининга пептидных библиотек на ингибиторы активности указанного полипептида с использованием такой комбинированной молекулы нуклеиновой кислоты может оказаться полезным экспрессировать гибридный белок, который будет распознаваться коммерчески доступным антителом. Гибридный белок может быть также сконструирован так, чтобы он содержал сайт расщепления, расположенный между последовательностью полипептида настоящего изобретения и последовательностью гетерологичного белка, и чтобы такой полипептид мог быть отщеплен и выделен из указанного гетерологичного белка. Молекулами нуклеиновой кислоты настоящего изобретения могут быть также антисмысловые молекулы, которые являются частично комплементарными молекулам нуклеиновой кислоты, кодирующим полипептиды настоящего изобретения, а поэтому они гибридизуются с кодирующими молекулами нуклеиновой кислоты (гибридизация). В соответствии с методами, хорошо известными специалистам, указанные антисмысловые молекулы, такие как олигонуклеотиды, могут быть сконструированы так, чтобы- 12007985 они распознавали нужную нуклеиновую кислоту, кодирующую полипептид настоящего изобретения,специфически связывались с этой нуклеиновой кислотой и предупреждали ее транскрипцию (см., например, Cohen J.S., Trends in Pharm. Sci., 10, 435 (1989), Okano, J. Neurochem. 56, 560 (1991); O'Connor, J.(1988); Dervan et al., Science 251, 1360 (1991. Используемый здесь термин "гибридизация" означает присоединение двух молекул нуклеиновой кислоты друг к другу посредством водородных связей. Обычно одна молекула может быть фиксирована на твердом носителе, а другая молекула может находиться в растворе в свободном состоянии. Затем эти две молекулы могут быть подвергнуты контакту друг с другом в условиях, благоприятствующих образованию водородной связи. Факторами, влияющими на образование таких связей, являются: тип и объем растворителя; температура реакции; время гибридизации; перемешивание; присутствие агентов, блокирующих неспецифическое связывание молекулы в жидкой фазе с твердым носителем (реагент Денхардта или BLOTTO); концентрация молекул; использование соединений, повышающих скорость ассоциации молекул (сульфата декстрана или полиэтиленгликоля); и жесткость условий промывки после гибридизации (Sambrook et al., [см. выше]). Ингибирование гибридизации полностью комплементарной молекулы с молекулой-мишенью может быть оценено с использованием гибридизационного анализа, известного специалистам (Sambrook etal. [см.выше]). По существу гомологичная молекула будет затем конкурировать с полностью гомологичной молекулой за связывание с молекулой-мишенью и ингибировать это связывание в различных условиях жесткости, как описано у Wahl G.M. и S.L. Berger (1987; Methods Enzymol. 152:399-407) и KimmelA.R. (1987; Methods Enzymol. 152:507-511). Термин "жесткость" означает условия реакции гибридизации, которые способствуют ассоциации молекул с большим сходством, но не ассоциации отличающихся молекул. Условия гибридизации высокой жесткости определяют как условия инкубирования в течение ночи при 42 С в растворе, содержащем 50% формамид, 5XSSC (150 мМ NaCl, 15 мМ тринатрийцитрат), 50 мМ фосфат натрия (рН 7,6), 5 х раствор Денхардта, 10% сульфат декстрана и 20 мкг/мл денатурированной фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 0,1X SSC приблизительно при 65 С. Условия низкой жесткости предусматривают реакцию гибридизации, осуществляемую при 35 С (Sambrook et al. [см.выше]). Предпочтительными условиями гибридизации являются условия гибридизации высокой жесткости. В предпочтительных вариантах этого аспекта настоящее изобретение относится к молекулам нуклеиновой кислоты, которые по всей своей длине по крайней мере на 70% идентичны молекуле нуклеиновой кислоты, кодирующей полипептиды INSP052 или INSP055 (SEQ ID NO:1, SEQ ID NO:3, SEQ IDNO:17), и к молекулам нуклеиновой кислоты, которые, по существ, комплементарны указанным молекулам нуклеиновой кислоты. В соответствии с этим аспектом настоящего изобретения предпочтительно,чтобы молекула нуклеиновой кислоты содержала область, которая по всей своей длине по крайней мере на 80% идентична кодирующей SEQ ID NO:2 последовательности, представленной в SEQ ID NO:1; кодирующей SEQ ID NO:4 последовательности, представленной в SEQ ID NO:3; кодирующей SEQ ID NO:6 последовательности, представленной в SEQ ID NO:5; кодирующей SEQ ID NO:8 последовательности,представленной в SEQ ID NO:7; кодирующей SEQ ID NO:10 последовательности, представленной в SEQID NO:9; кодирующей SEQ ID NO:12 последовательности, представленной в SEQ ID NO:11; кодирующей SEQ ID NO:14 последовательности, представленной в SEQ ID NO:13; кодирующей SEQ ID NO:16 последовательности, представленной в SEQ ID NO:15; кодирующей SEQ ID NO:18 последовательности,представленной в SEQ ID NO:17; либо, чтобы эта молекула представляла собой комплементарную им молекулу нуклеиновой кислоты. При этом особенно предпочтительно, чтобы молекулы нуклеиновой кислоты по всей своей длине были по крайней мере на 90%, более предпочтительно по крайней мере на 95%, а особенно предпочтительно по крайней мере на 98 или 99% были идентичны указанным последовательностям. Предпочтительными вариантами этого аспекта являются молекулы нуклеиновой кислоты,кодирующие полипептиды, которые обладают по существу такой же биологической функцией или активностью, как и полипептиды INSP052 и INSP055. Настоящее изобретение также относится к способу детекции молекулы нуклеиновой кислоты настоящего изобретения, включающему стадии: (а) контактирования нуклеотидного зонда настоящего изобретения с биологическим образцом в условиях гибридизации, способствующих образованию дуплексов; и (b) детекции любого из таких образованных дуплексов. Как будет дополнительно обсуждаться ниже в связи с анализами, которые могут быть использованы в соответствии с настоящим изобретением, молекула нуклеиновой кислоты, описанная выше, может быть использована в качестве гибридизационного зонда для РНК, кДНК или геномной ДНК в целях выделения полноразмерных кДНК и геномных клонов, кодирующих полипептиды INSP052 и INSP055, и в целях выделения кДНК и геномных клонов гомологичных и ортологичных генов, имеющих высокую степень сходства с генами, кодирующими этот полипептид. В этой связи, наряду с другими известными методами, могут быть использованы описанные и обсуждаемые методы, которые приводятся ниже в качестве иллюстрации. Методы секвенирования и анали- 13007985 за ДНК хорошо известны и, в основном, доступны специалистам, и могут быть реально использованы для осуществления многих вариантов настоящего изобретения, обсуждаемых в настоящей заявке. В указанных методах могут использоваться ферменты, такие как фрагмент Кленова ДНК-полимеразы I, секвеназа (US Biochemical Corp., Cleveland, ОН), полимераза Taq (Perkin Elmer), термостабильная полимераза Т 7 (Amersham, Chicago, IL), или комбинация полимераз и корректирующих экзонуклеаз, таких как экзонуклеазы, присутствующие в ELONGASE Amplification System, и поставляемые Gibco/BRL (Gaithersburg,MD). Способ секвенирования может быть, предпочтительно, автоматизирован с использованием устройств, таких как аппарат Hamilton Micro Lab 2200 (Hamilton, Reno, NV), термоячейка Peltier ThermalCycler (PTC200; MJ Research, Watertown, MA), катализатор ABI и ДНК-секвенаторы 373 и 377 DNA Sequencers (Perkin Elmer). Одним из методов выделения молекулы нуклеиновой кислоты, кодирующей полипептид с функцией, эквивалентной функции полипептидов INSP052 и INSP055, является зондирование библиотеки геномных ДНК или кДНК природным или искусственно сконструированным зондом с использованием стандартных процедур, известных специалистам (см., например, "Current Protocols in Molecular Biology",Ausubel et al. (eds). Greene Publisching Associates and John Wiley Interscience, New York, 1989, 1992). Особенно подходящими являются зонды, содержащие 15, предпочтительно по крайней мере 30, а более предпочтительно по крайней мере 50 непрерывно следующих друг за другом оснований, которые соответствуют или комплементарны последовательностям нуклеиновой кислоты, происходящей от соответствующего кодирующего гена (SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9,SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:15 или SEQ ID NO:17). Для облегчения идентификации такие зонды могут быть помечены аналитически детектируемым реагентом. Подходящими реагентами являются, но не ограничиваются ими, радиоизотопы, флуоресцентные красители и ферменты, способные катализировать образование детектируемого продукта. С использованием этих зондов каждый специалист может самостоятельно выделить комплементарные копии полинуклеотидов геномной ДНК, кДНК или РНК, кодирующих представляющие интерес белки, происходящие от различных источников, например человека, млекопитающего или других животных, и скринировать эти источники на присутствие родственных последовательностей, например, дополнительных членов семейства, типа и/или подтипа. Во многих случаях, выделенные кДНК-последовательности будут неполными, то есть в этих последовательностях область, кодирующая полипептид, будет сильно обрезана, обычно у 5'-конца. Для получения полноразмерных кДНК или для удлинения коротких кДНК существует несколько методов. Такие последовательности можно удлинить с использованием неполной нуклеотидной последовательности и с применением различных известных методов детекции расположенных выше последовательностей, таких как промоторы и регуляторные элементы. Так, например, одним из методов, который может быть использован в данном случае, является метод быстрой амплификации кДНК-концов (RACE; см., например,Frohman et al., PNAS USA 85, 8998-9002, 1998). Недавно разработанные модификации этой технологии,например, проиллюстрированные Marathon T.M. (Clontech Laboratories Inc.), значительно упростили поиск более длинных кДНК. Для поиска неизвестной последовательности нуклеиновой кислоты, которая является смежной с известным локусом, может быть использован слегка модифицированный метод, который называется "сайт-рестрикционной" ПЦР и предусматривает использование универсальных праймеров (Sarkar G. (1993) PCR Methods Applic. 2:318-322). Для амплификации или для удлинения последовательностей с использованием различных праймеров, полученных на основе известной области, может быть также использована обратная ПЦР (Triglia Т. et al. (1988) Nucleic Acids Res. 16:8186). Другим методом, который может быть использован в данном случае, является ПЦР "с захватом", которая представляет собой ПЦР-амплификацию ДНК-фрагментов, смежных с известной последовательностью в искусственной хромосомной ДНК человека и дрожжей (Lagerstrom M. et al., (1991) PCR Methods Applic. 1, 111119). Другим методом, который может быть использован для поиска неизвестных последовательностей,является метод Parker J.D. et al. (1991) Nucleic Acids Res. 19:3055-3060). Кроме того, можно использовать ПЦР, "гнездовые" праймеры и библиотеки PromoterFinderTM для "прогулки" по геномной ДНК(Clontech, Palo Alto, CA). Этот способ позволяет избежать необходимости скрининга библиотек и может быть использован для обнаружения участков стыка интрон/экзон. При скрининге на полноразмерные кДНК предпочтительно использовать библиотеки, которые были отобраны по размерам и содержат более крупные кДНК. Предпочтительными также являются библиотеки рандомизированных праймеров, которые могут включать дополнительные последовательности,содержащие 5'-области генов. Использование библиотеки рандомизированных праймеров может оказаться особенно предпочтительным в том случае, если библиотека oligo-d(T) не дает полноразмерной кДНК. Геномные библиотеки могут быть использованы для удлинения последовательности с получением 5'-нетранскрибируемых регуляторных областей. В одном из вариантов осуществления изобретения молекулы нуклеиновой кислоты настоящего изобретения могут быть использованы для определения локализации в хромосоме. В этом методе молекула нуклеиновой кислоты может быть нацелена на конкретный участок, либо она может быть гибридизована с конкретным участком на отдельной хромосоме человека. В соответствии с настоящим изобретением картирование релевантных последовательностей в хромосомах является важным звеном в подтвер- 14007985 ждении корреляции этих последовательностей с геноассоциированным заболеванием. После картирования последовательности с определением ее точной локализации, физическое положение последовательности на хромосоме может быть сопоставлено с данными генетической карты. Эти данные можно найти,например, в работе V. McKusick, Mendelian Inheritance in Man (имеющейся в настоящее время в библиотеке Уэлльского медицинского университета Джона Хопкинса) (John Hopkins University Welch MedicalLibrary). Взаимосвязь между генами, которые могут быть картированы на одной и той же области хромосомы, и заболеваниями, ассоциированными с ними, затем идентифицируют с помощью анализа на сцепление генов (совместное наследование физически смежных генов). Это позволяет исследователям получить ценную информацию, которая может быть использована для поиска генов, ассоциированных с данным заболеванием, с применением метода позиционного клонирования или других методов обнаружения генов. После предварительного определения локализации генов, ассоциированных с данным заболеванием или синдромом, путем анализа на сцепление генов с конкретной областью генома, любое картирование последовательностей на данном участке может дать информацию об ассоциированных или регуляторных генах, которая может быть использована для последующих исследований. Молекула нуклеиновой кислоты может быть также использована для детекции различий в хромосомной локализации, обусловленных транслокацией, инверсией и т.п., у нормальных индивидуумов, индивидуумов-носителей и у индивидуумов с заболеванием. Молекулы нуклеиновой кислоты настоящего изобретения также являются ценным материалом для определения локализации в тканях. Такие методы позволяют определять характер экспрессии полипептида в тканях путем детекции мРНК, которая их кодирует. Такими методами являются методы гибридизации in situ и методы амплификации нуклеотидов, такие как ПЦР. Результаты этих исследований позволили получить определенные сведения относительно нормальных функций данного полипептида в организме. Кроме того, в этих исследованиях сравнение нормального характера экспрессии мРНК с экспрессией мРНК, кодируемой мутантным геном, позволяет получить важную информацию о роли мутантных полипептидов в данном заболевании. Такая аномальная экспрессия может иметь кратковременную, пространственную или количественную природу. Для ингибирования эндогенной экспрессии гена, кодирующего полипептид настоящего изобретения, могут быть также использованы методы "отключения" гена. Одним из методов, который может быть использован для последовательность-специфического посттрансляционного "отключения" гена, является интерференция РНК (RNAi) (Elbashir S.M. et al., Nature 2001, 411, 494-498). Короткие дцРНКолигонуклеотиды синтезируют in vitro и вводят в клетку. Последовательность-специфическое связывание этих дцРНК-олигонуклеотидов запускает процесс деградации мРНК-мишени, что приводит к снижению уровня или к отмене экспрессии целевого белка. Эффективность методов "отключения" гена, описанных выше, может быть оценена путем определения уровня экспрессии полипептидов (например, с помощью Вестерн-блоттинга), а на РНК-уровне она может быть оценена с помощью методики, основанной на TaqMan. Векторы настоящего изобретения содержат молекулы нуклеиновой кислоты настоящего изобретения и могут представлять собой клонирующие или экспрессирующие векторы. Клетки-хозяева настоящего изобретения, которые могут быть трансформированы, трансфицированы или трансдуцированы векторами настоящего изобретения, могут представлять собой прокариотические или эукариотические клетки-хозяева. Полипептиды настоящего изобретения могут быть получены в рекомбинантной форме посредством экспрессии кодирующих эти полипептиды молекул нуклеиновой кислоты в векторах, содержащихся в клетке-хозяине. Такие методы экспрессии хорошо известны специалистам, и многие из них подробно описаны у Sambrook et al. (см. выше) и FernandezHoeffler (1998, eds. "Gene expression systems. Usingnature for the art of expression". Academic Press, San Diego, London, Boston, New York, Sydney, Tokyo, Toronto). Для продуцирования полипептида в нужном хозяине могут быть использованы, в основном, любые системы или любые векторы, подходящие для поддержания, амплификации или экспрессии молекул нуклеиновой кислоты. Подходящая нуклеотидная последовательность может быть встроена в экспрессионную систему любым из хорошо известных и рутинных методов, таких как методы, описанные у Sambrook et al. (см.выше). В общих чертах, кодирующий ген может быть помещен под контроль регуляторного элемента, такого как промотор, сайт связывания рибосомы (для экспрессии в бактериях), и необязательно, оператор, так, чтобы ДНК-последовательность, кодирующая нужный полипептид, транскрибировалась в РНК в трансформированной клетке-хозяине. Примерами подходящих систем экспрессии являются, например, хромосомная, эписомная и вирусная системы, включая, например, векторы, происходящие от бактериальных плазмид, бактериофага,транспозонов, дрожжевых эписом, инсерционных элементов, дрожжевых хромосомных элементов, вирусов, таких как бакуловирус, паповавирусы, такие как SV40, вирусы коровьей оспы, аденовирусы, вирусы оспы домашней птицы, псевдорабивирусы и ретровирусы, или их комбинации, а также векторы, происходящие от плазмидных и бактериофаговых генетических элементов, включая космиды и фагмиды. Для доставки более крупных фрагментов ДНК, чем те, которые могут содержаться и экспрессироваться в плазмиде, могут быть также использованы искусственные человеческие хромосомы (НАС).- 15007985 Особенно подходящими экспрессионными системами являются микроорганизмы, такие как бактерии, трансформированные рекомбинантным бактериофагом, плазмидными или космидными ДНКэкспрессирующими векторами; дрожжи, трансформированные векторами для экспрессии в дрожжах; клеточные системы насекомых, инфицированные вирусными экспрессирующими векторами (например,бакуловирусом); клеточные системы растений, трансформированные вирусными экспрессирующими векторами (например, вирусом мозаики цветной капусты, CaMV; вирусом мозаики табака, TMV) или векторами для экспрессии в бактериях (например, плазмидами Ti или pBR322); или клеточные системы животных. Для продуцирования полипептидов настоящего изобретения могут быть также использованы бесклеточные системы трансляции. Введение молекул нуклеиновой кислоты, кодирующих полипептид настоящего изобретения, в клетки-хозяева может быть осуществлено методами, описанными во многих известных лабораторных руководствах, таких как руководство Davis et al., Basic Methods in Molecular Biology (1986) и Sambrook etal. [см. выше]. Особенно подходящими методами являются трансфекция с использованием фосфата кальция; трансфекция, опосредованная DEAE-декстраном; трасвекция; микроинъекция; трансфекция,опосредованная катионным липидом; электропорация; трансдукция; загрузка путем соскоба; введение методом биобаллистики или инфицирование (см., Sambrook et al., 1989, [см. выше], Ausubel et al., 1991[см. выше], Spector, GoldmanLeinwald, 1998). В эукариотических клетках экспрессионные системы, в зависимости от целей их использования, могут быть либо временными (например, эписомными), либо перманентными (хромосомная интергация). Кодирующая молекула нуклеиновой кислоты может включать, а может и не включать последовательность, кодирующую регуляторную последовательность, такую как сигнальный пептид или лидерная последовательность, если это необходимо, например, для секреции транслируемого полипептида в просвет эндоплазматического ретикулума, в периплазматическое пространство или во внеклеточное пространство. Эти сигналы могут быть эндогенными по отношению к полипептиду, либо они могут быть гетерологичными. Лидерные последовательности могут быть удалены бактериальным хозяином при посттрансляционном процессинге. Помимо регуляторных последовательностей может оказаться желательным введение регуляторных последовательностей, которые обеспечивают регуляцию экспрессии полипептида в зависимости от роста клетки-хозяина. Примерами регуляторных последовательностей являются последовательности, которые обеспечивают увеличение или снижение уровня экспрессии гена в ответ на химическую или физическую стимуляцию, включая присутствие регуляторного соединения, или в ответ на различные температурные или метаболические условия. Регуляторными последовательностями являются нетранслируемые области вектора, такие как энхансеры, промоторы и 5'- и 3'-нетранслируемые области. Эти последовательности взаимодействуют с клеточными белками хозяина, в результате чего осуществляется транскрипция и трансляция. Такие регуляторные последовательности могут варьироваться по своей длине и специфичности. В зависимости от выбранной векторной системы и выбранного хозяина могут быть использованы любые подходящие транскрипционные и трансляционные элементы, включая конститутивные и индуцибельные промоторы. Так, например, для клонирования в бактериальных системах могут быть использованы индуцибельные промоторы, такие как гибридный промотор lacZ фагмиды BlueScript (Stratagene,LaJolla, CA) или плазмиды pSportlTM (Gibco BRL) и т.п. В клетках насекомых может использоваться бакуловирусный промотор полиэдрина. Промоторы или энхансеры, происходящие от геномов растительных клеток (например, гена белка теплового шока, RUBISCO и гена запасных белков) или от вирусов растений (например, вирусных промоторов или лидерных последовательностей), могут быть клонированы в указанный вектор. В клеточных системах млекопитающих предпочтительными являются промоторы, происходящие от генов млекопитающих или от вирусов млекопитающих. Если необходимо генерировать клеточную линию, содержащую множество копий данной последовательности, то могут быть использованы векторы на основе SV40 или EBV с соответствующим селективным маркером. Экспрессирующий вектор конструируют так, чтобы конкретная кодирующая последовательность нуклеиновой кислоты присутствовала в векторе вместе с соответствующими регуляторными последовательностями, и чтобы положение и ориентация кодирующей последовательности по отношению к регуляторным последовательностям позволяли такой кодирующей последовательности транскрибироваться под "контролем" регуляторных последовательностей, то есть так, чтобы РНК-полимераза, которая связывается с ДНК-молекулой в положении регуляторных последовательностей, осуществляла транскрипцию кодирующей последовательности. В некоторых случаях может оказаться необходимым модифицировать указанную последовательность так, чтобы она могла присоединяться к регуляторным последовательностям в соответствующей ориентации, то есть с сохранением рамки считывания. Указанные регуляторные последовательности и другие регуляторные последовательности могут быть лигированы с кодирующей последовательностью нуклеиновой кислоты перед встраиванием в вектор. Альтернативно, такая кодирующая последовательность может быть клонирована непосредственно в экспрессирующий вектор, который уже содержит регуляторные последовательности и соответствующий рестрикционный сайт. Для длительного высокоэффективного продуцирования рекомбинантного полипептида, предпочти- 16007985 тельной является стабильная экспрессия. Так, например, клеточные линии, которые стабильно экспрессируют нужный полипептид, могут быть трансформированы с использованием экспрессирующих векторов, которые могут содержать вирусные сайты инициации репликации и/или эндогенные экспрессионные элементы и выбранный маркерный ген, присутствующий на том же самом или на отдельном векторе. После введения этого вектора, клетки можно оставить на 1-2 дня для роста в обогащенной среде, которую затем заменяют селективной средой. Селективный маркер необходим для сообщения резистентности, используемой в целях отбора, и его присутствие позволяет культивировать и выделять клетки,успешно экспрессирующие введенные последовательности. Резистентные клоны стабильно трансформированных клеток могут быть подвергнуты пролиферации методами культивирования ткани, подходящими для клеток такого типа. Клеточные линии млекопитающих, подходящие в качестве хозяев для экспрессии, хорошо известны специалистам, и такими клеточными линиями являются многие иммортализованные клеточные линии,имеющиеся в Американской коллекции типовых культур (АТСС), включая, но не ограничиваясь ими,клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почек детенышей хомячка (ВНК), клетки почек обезьяны (COS), клетки С 127, клетки 3 Т 3, клетки ВНК, клетки НЕК 293, клетки меланомы Боуэса, клетки гепатоцеллюлярной карциномы человека (например, Hep G2) и ряд других клеточных линий. В бакуловирусной системе, материалы для получения экспрессионных систем бакуловирус/клетка насекомого являются коммерчески доступными и поставляются в наборах, inter alia, от Invitrogen, SanDiego CA (набор "МахВас"). В общих чертах, эти методы известны специалистам и подробно описаны уSummersSmith, Texas Agricultural Experiment Station Bulletin1555 (1987). Клетками-хозяевами, особенно подходящими для использования в данной системе, являются клетки насекомых, такие как клеткиDrosophila S2 и клетки Spodoptera Sf9. Специалистам известно множество систем экспрессии генов в клеточных культурах растений и в целых растениях. Примерами подходящих систем экспрессии генов в клетках растений являются системы, описанные в патентах США 5693506, 5659122 и 5608143. Другие примеры экспрессии генов в клеточных культурах растений описаны Zenk, Phytochemistry 30, 3861-3863 (1991). В частности, можно использовать любые растения, из которых могут быть выделены и культивированы протопласты с последующим генерированием из них целых регенерированных растений, которые содержат перенесенный ген. В частности, из культивируемых клеток или тканей могут быть регенерированы все растения, включая, но не ограничиваясь ими, все основные виды сахарного тростника, сахарной свеклы, хлопчатника, плодовых и других деревьев, бобовых, а также овощных растений. Примерами особенно предпочтительных бактериальных клеток-хозяев являются клетки стрептококков, стафилококков, E.coli, Streptomyces и Bacillus subtilis. Примерами особенно подходящих клеток-хозяев для экспрессии в грибах являются дрожжевые клетки (например, S. cerevisiae) и клетки Aspergillus. Любые системы отбора, которые могут быть использованы для выделения трансформированных клеточных линий, известны специалистам. Примерами являются гены тимидинкиназы (Wigler M. et al.(1977) Cell 11:223-32) и аденин-фосфорибозилтрансферазы вируса простого герпеса (Lowy I. et al. (1980)Cell 22:817-23), которые могут быть использованы в tk- или aprt-клетках, соответственно. Кроме того, в качестве основы для отбора могут быть использованы гены резистентности к антиметаболиту, антибиотику или к гербициду, например, ген дигидрофолат-редуктазы (DHFR), который сообщает резистентность к метотрексату (Wigler M. et al. (1980) Proc. Natl. Acad. Sci. 77:3567-70); ген npt, который сообщает резистентность к аминогликозидам, неомицину и к G-418 (Colbere-Garapin F. et al.(1981) J. Mol. Biol. 150:1-14), и гены als или pat, которые сообщают резистентность к хлорсульфурон- и фосфинотрицинацетилтрансферазе, соответственно. Были описаны и другие селективные гены, примеры которых хорошо известны специалистам. Хотя присутствие или отсутствие экспрессии маркерного гена позволяет предположить, что присутствует также и нужный ген, однако его присутствие и экспрессия еще нуждаются в подтверждении. Так, например, если соответствующая последовательность была встроена в последовательность маркерного гена, то трансформированные клетки, содержащие соответствующие последовательности, могут быть идентифицированы по отсутствию функции маркерного гена. Альтернативно, маркерный ген может находиться в тандеме с последовательностью, кодирующей полипептид настоящего изобретения,под контролем одного промотора. Экспрессия маркерного гена в ответ на индуцирование или отбор обычно указывает также на экспрессию тандемного гена. Альтернативно, клетки-хозяева, которые содержат последовательность нуклеиновой кислоты, кодирующую полипептид настоящего изобретения, и которые экспрессируют указанный полипептид, могут быть идентифицированы различными методами, известными специалистам. Такими методами являются, но не ограничиваются ими, ДНК-ДНК или ДНК-РНК-гибридизация и биоанализы на присутствие белка, например, сортировка клеток по интенсивности флуоресценции (FACS) или иммуноанализы (такие как твердофазный иммуноферментный анализ [ELISA] и радиоиммуноанализ [РИА]), которые предусматривают использование мембран, растворов или чипов для детекции и/или количественной оценки нуклеиновой кислоты или белка (см. Hampton R. et al. (1990) Serological Methods, a Laboratory Manual,- 17007985APS Press, St. Paul, MN и Maddox D.E. et al., (1983) J. Exp. Med. 158, 1211-1216). Существует широкий ряд методов мечения и конъюгирования, известных специалистам, и эти методы могут быть использованы в различных анализах на присутствие нуклеиновых кислот и аминокислот. Методами, используемыми в целях продуцирования меченных зондов для гибридизации или ПЦРзондов для детекции последовательностей, родственных молекулам нуклеиновой кислоты, кодирующим полипептиды настоящего изобретения, являются мечение олигонуклеотидами, ник-трансляция, мечение по концам или ПЦР-амплификация с использованием меченного полинуклеотида. Альтернативно, последовательности, кодирующие полипептид настоящего изобретения, могут быть клонированы в вектор для продуцирования мРНК-зонда. Такие векторы известны специалистам, являются коммерчески доступными и могут быть использованы для синтеза РНК-зондов in vitro путем добавления соответствующей РНК-полимеразы, такой как Т 7, Т 3 или SP6, и меченных нуклеотидов. Эти процедуры могут быть проведены с использованием различных коммерчески доступных наборов (PharmaciaUpjoin (Kalamazoo, MI); Promega (Madison WI) и U.S. Biochemical Corp., Cleveland, OH). Подходящими репортерными молекулами или метками, которые могут быть использованы для облегчения детекции, являются радионуклиды, ферменты и флуоресцентные, хемилюминисцентные или хромогенные агенты, а также субстраты, кофакторы, ингибиторы, магнитные частицы и т.п. Молекулы нуклеиновой кислоты настоящего изобретения могут быть также использованы для генерирования трансгенных животных, а в частности, грызунов. Такие трансгенные животные входят в дополнительный аспект настоящего изобретения. Это генерирование может быть осуществлено путем локальной модификации соматических клеток или манипуляций с зародышевыми линиями для введения наследуемых модификаций. Такие трансгенные животные могут быть, в частности, использованы для генерирования животных-моделей в целях поиска молекул лекарственных средств, которые являются эффективными в качестве модуляторов полипептидов настоящего изобретения. Полипептид может быть выделен и очищен из рекомбинантных клеточных культур хорошо известными методами, включая преципитацию сульфатом аммония или этанолом, экстракцию кислотой, анионообменную или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, гидрофобную хроматографию, аффинную хроматографию, хроматографию на гидроксиаппатитах и хроматографию на лектине. Для очистки, наиболее подходящей является высокоэффективная жидкостная хроматография. В случае, если данный полипептид был денатурирован в процессе выделения и/или очистки, то для восстановления активной конформации может быть использована хорошо известная техника рефолдинга белков. Если необходимо, то для облегчения очистки белков могут быть также использованы специальные векторные конструкции, полученные путем присоединения последовательностей, кодирующих полипептиды настоящего изобретения, к нуклеотидной последовательности, кодирующей полипептидный домен,который облегчает очистку растворимых белков. Примерами таких доменов, облегчающих очистку белков, являются пептиды, образующие хелатные комплексы с металлами, такие как гистидинтриптофановые модули, которые позволяют проводить очистку на иммобилизованных металлах; домены белка А, которые позволяют проводить очистку на иммобилизованном иммуноглобулине; и домен, используемый в системе FLAGS удлинения/аффинной очистки (Immunex Corp., Seattle, WA) . Для облегчения очистки, между доменом для очистки и полипептидом настоящего изобретения могут быть включены расщепляемые линкерные последовательности, такие как последовательности, специфичные к фактору ХА или энтерокиназе (Invitrogen, San Diego, CA). Один из таких экспрессирующих векторов обеспечивает экспрессию гибридного белка, содержащего полипептид настоящего изобретения, присоединенный к нескольким гистидиновым остаткам, за которыми следуют тиоредоксин или рестрикционный сайт энтерокиназы. Гистидиновые остатки облегчают проведение очистки с помощью IMAC (аффинной хроматографии на иммобилизованном ионе металла, описанной Porath J. et al. (1992), Prot. Exp. Purif. 3:263281), тогда как тиоредоксин или рестрикционный сайт энтерокиназы позволяют выделять полипептид из гибридного белка. Обсуждение векторов, содержащих гибридные белки, можно найти у Kroll D.J. et al.(1993; DNA Cell Biol. 12:441-453). Если экспрессируемый полипептид используется в аналитическом скрининге, то обычно предпочтительно, чтобы он был продуцирован на поверхности клетки-хозяина, в которой он экспрессируется. В этом случае клетки-хозяева могут быть собраны до их использования в скрининг-анализе, например, таким методом, как сортировка клеток с возбуждением флуоресценции (FACS) или иммуноаффинным методом. Если полипептид секретируется в среду, то такая среда может быть восстановлена для выделения и очистки экспрессированного полипептида. Если полипептид продуцируется внутри клетки, то перед выделением полипептида эти клетки должны быть сначала подвергнуты лизису. Полипептид настоящего изобретения может быть использован для скрининга библиотек соединений в любом из известных методов, применяемых для поиска лекарственных средств. Такие соединения могут стимулировать (служить агонистами) или ингибировать (служить антагонистами) экспрессию гена или активность полипептида настоящего изобретения, а поэтому они составляют дополнительный аспект настоящего изобретения. Предпочтительными соединениями являются соединения, способные влиять на экспрессию природного гена, кодирующего полипептид первого аспекта настоящего изобретения, или регулировать активность полипептида первого аспекта настоящего изобретения.- 18007985 Соединения-агонисты или соединения-антагонисты могут быть выделены, например, из клеток,бесклеточных препаратов, химических библиотек или смесей природных продуктов. Такими агонистами или антагонистами могут быть природные или модифицированные субстраты, лиганды, ферменты, рецепторы, либо структурные или функциональные миметики. Подходящее описание таких методов скрининга можно найти в работе Coligan et al., Current Protocols in Immunology 1(2):Chapter 5 (1991). Соединения, которые могут рассматриваться как наиболее вероятные кандидаты на хорошие антагонисты, представляют собой молекулы, которые связываются с полипептидом настоящего изобретения,но не индуцируют каких-либо биологических эффектов полипептида после связывания с ним. Потенциальными антагонистами являются небольшие органические молекулы, пептиды, полипептиды и антитела, которые связываются с полипептидом настоящего изобретения и, тем самым, ингибируют или подавляют его активность. Таким образом, связывание полипептида с нормальными связывающимися клеточными молекулами может ингибироваться, так, чтобы подавлялась нормальная биологическая активность такого полипептида. Полипептид настоящего изобретения, который используется в таком методе скрининга, может находиться в растворе в свободном состоянии, может быть иммобилизован на твердом носителе, может присутствовать на клеточной поверхности, либо он может быть локализован внутри клетки. В основном,такие процедуры скрининга предусматривают использование соответствующих клеток или клеточных мембран, экспрессирующих полипептид, который контактирует с тестируемым соединением, что приводит к связыванию и к стимуляции или ингибированию функционального ответа. Функциональный ответ клеток, контактируемых с тестируемым соединением, сравнивают с контрольными клетками, которые не контактировали с тестируемым соединением. С помощью подходящей системы детекции, такой анализ позволяет определить, может ли тестируемое соединение давать сигнал, генерируемый активацией указанного полипептида. Ингибиторы активации обычно анализируют в присутствии известного агониста, и оценивают влияние этого агониста на активацию в присутствии тестируемого соединения. Предпочтительный способ идентификации соединения-агониста или соединения-антагониста по отношению к полипептиду настоящего изобретения предусматривает:(a) контактирование клетки, экспрессирующей на своей поверхности полипептид первого аспекта настоящего изобретения, где указанный полипептид ассоциирован со вторым компонентом, способным давать детектируемый сигнал в ответ на связывание соединения с указанным полипептидом, и где указанное соединение скринируют в условиях, благоприятствующих связыванию с указанным полипептидом; и(b) определение события связывания указанного соединения с указанным полипептидом и активации или ингибирования полипептида путем измерения уровня сигнала, генерируемого в результате взаимодействия указанного соединения с указанным полипептидом. Еще более предпочтительный способ идентификации агониста или антагониста по отношению к полипептиду настоящего изобретения предусматривает:(а) контактирование клетки, экспрессирующей на своей поверхности полипептид, где указанный полипептид ассоциирован со вторым компонентом, способным давать детектируемый сигнал в ответ на связывание соединения с указанным полипептидом, и где указанное соединение скринируют в условиях,благоприятствующих связыванию с указанным полипептидом; и(b) определение события связывания указанного соединения с указанным полипептидом и активации или ингибирования полипептида путем сравнения уровня сигнала, генерируемого в результате взаимодействия указанного соединения с указанным полипептидом, с уровнем сигнала, полученного в отсутствии указанного соединения. В других предпочтительных вариантах изобретения общие методы, описанные выше, могут, кроме того, предусматривать осуществление идентификации агониста или антагониста в присутствии меченного или немеченного лиганда для полипептида. В другом варианте изобретения способ идентификации агониста или антагониста полипептида настоящего изобретения предусматривает определение факта ингибирования связывания лиганда с клетками, которые содержат полипептид настоящего изобретения на своей поверхности, или с клеточными мембранами, содержащими такой полипептид, в присутствии соединения-кандидата в условиях, благоприятствующих связыванию с указанным полипептидом, и определение количества лиганда, связанного с указанным полипептидом. Считается, что соединение, способное приводить к снижению уровня связывания с лигандом, является агонистом или антагонистом. При этом предпочтительно, чтобы указанный лиганд был меченным. Более конкретно, способ скрининга на соединение, являющееся агонистом или антагонистом к полипептиду, включает стадии:(a) инкубирования меченного лиганда с целой клеткой, экспрессирующей полипептид настоящего изобретения на своей поверхности, или с клеточной мембраной, содержащей полипептид настоящего изобретения;(b) измерения количества меченного лиганда, связанного с целой клеткой или с клеточной мембраной;(c) добавления соединения-кандидата к смеси меченного лиганда и целой клетки или клеточной- 19007985 мембраны стадии (а) и доведение этой смеси до состояния равновесия;(d) измерения количества меченного лиганда, связанного с целой клеткой или с клеточной мембраной, после проведения стадии (с); и(e) сравнения различия в количествах связанного меченного лиганда стадий (b) и (d), где соединение, вызывающее снижение уровня связывания в стадии (d), считается агонистом или антагонистом. В некоторых описанных выше вариантах настоящего изобретения могут быть использованы простые анализы на связывание, в которых адгезию тестируемого соединения к поверхности, несущей данный полипептид, детектируют с помощью метки, непосредственно или опосредованно ассоциированной с тестируемым соединением, или с помощью анализа на конкуренцию с меченным соединениемконкурентом. В другом варианте осуществления изобретения могут быть использованы конкурентные анализы на скрининг лекарственных средств, в которых нейтрализующие антитела, способные связываться с данным полипептидом, специфически конкурируют за связывание с тестируемым соединением. Таким образом, указанные антитела могут быть использованы для детекции на присутствие любого тестируемого соединения, обладающего специфической аффинностью связывания с указанным полипептидом. Каждый специалист может самостоятельно разработать анализы для идентификации модуляторов полипептида настоящего изобретения. В этой связи, особый интерес представляет работа Lokker N.A. etal., J. Biol. Chem. 1997 Dec.26; 272 (52):33037-44, в которой описан пример анализа для идентификации антагонистов (в данном случае нейтрализующих антител). Могут быть также разработаны анализы для детекции влияния добавленных тестируемых соединений на продуцирование мРНК, кодирующей указанный полипептид, в клетках. Так, например, анализELISA может быть разработан так, чтобы можно было измерить секретированные или клеточноассоциированные уровни полипептида с использованием моноклональных или поликлональных антител стандартными методами, известными специалистам, и этот анализ может быть использован для поиска соединений, которые могут ингибировать или усиливать продуцирование полипептида из соответствующим образом модифицированных клеток или тканей. Затем может быть определен уровень образования связывающих комплексов между полипептидом и тестируемым соединением. Аналитическими способами, которые также входят в объем настоящего изобретения, являются способы, предусматривающие использование генов и полипептидов настоящего изобретения в анализах на сверхэкспрессию или в анализах на исключение. Такие анализы предусматривают манипуляцию с уровнями указанных генов/полипептидов в клетках и оценку влияния этой манипуляции на физиологию модифицированных клеток. Так, например, такие эксперименты позволяют точно выявить пути передачи сигнала и метаболические пути, в которых участвуют конкретные гены/полипептиды, а также получить информацию относительно идентичности полипептидов, с которыми взаимодействуют исследуемые полипептиды, и найти ключ к разгадке механизмов, с помощью которых регулируются родственные гены и белки. Другой метод, который может быть использован для скрининга на лекарственные средства, дает возможность осуществлять высокоэффективный скрининг соединений, обладающих подходящей аффинностью связывания с нужным полипептидом (см. Международную патентную заявку WO 84/03564). В этом методе, большое число различных небольших тестируемых соединений синтезируют на твердом субстрате, который затем может быть подвергнут реакции с полипептидом настоящего изобретения и промывке. Одним из способов иммобилизации полипептида является использование ненейтрализующих антител. Связанный полипептид может быть затем детектирован методами, хорошо известными специалистам. Очищенный полипептид также может быть непосредственно нанесен на планшеты для последующего использования в вышеупомянутых способах скрининга на лекарственные средства. Полипептид настоящего изобретения может быть использован для идентификации мембраноассоциированных или растворимых рецепторов с помощью стандартной техники связывания с рецептором, известной специалистам, такой как анализы на связывание и перекрестное сшивание с лигандом, в которых данный полипептид метят радиоактивным изотопом, химически модифицируют или присоединяют к пептидной последовательности, которая облегчает его детекцию или очистку, и инкубируют с источником предполагаемого рецептора (например, с композицией клеток, клеточными мембранами,клеточными супернатантами, тканевыми экстрактами или с физиологическими жидкостями). Эффективность связывания может быть определена биофизическими методами, такими как поверхностный плазмонный резонанс и спектроскопия. Анализы на связывание могут быть использованы для очистки и клонирования рецептора, но они могут быть также использованы для идентификации агонистов и антагонистов указанного полипептида, которые конкурируют с указанным полипептидом за связывание с рецептором. Стандартные методы проведения скрининг-анализов хорошо известны специалистам. Настоящее изобретение также относится к набору для скрининга, используемому в методах идентификации агонистов, антагонистов, лигандов, рецепторов, субстратов и ферментов, описанных выше. Настоящее изобретение также относится к агонистам, антагонистам, лигандам, рецепторам, субстратам, ферментам и к другим соединениям, модулирующим активность или антигенность полипептида настоящего изобретения, обнаруженным с помощью описанных выше методов.- 20007985 Настоящее изобретение также относится к фармацевтическим композициям, содержащим полипептид, нуклеиновую кислоту, лиганд или соединение настоящего изобретения в комбинации с подходящим фармацевтическим носителем. Эти композиции могут быть использованы в качестве терапевтических или диагностических реагентов, в качестве вакцин или в качестве других иммуногенных композиций,подробно описанных ниже. В соответствии с используемой здесь терминологией композиция, содержащая полипептид, нуклеиновую кислоту, лиганд или соединение [X], считается "по существу не содержащей" примесей [здесь,Y], если по крайней мере 85 мас.% от всего количества X+Y в данной композиции составляет X. Предпочтительно X составляет по крайней мере примерно 90% по общей массе X+Y в данной композиции, а более предпочтительно по крайней мере примерно 95, 98 или даже 99 мас.%. Фармацевтические композиции, предпочтительно, должны содержать терапевтически эффективное количество полипептида, молекулы нуклеиновой кислоты, лиганда или соединения настоящего изобретения. Используемый здесь термин "терапевтически эффективное количество" означает количество терапевтического агента, необходимое для лечения, ослабления или профилактики рассматриваемого заболевания или состояния, или для достижения детектируемого терапевтического или профилактического эффекта. Для каждого соединения, терапевтически эффективная доза может быть сначала оценена либо в анализе клеточной культуры, например, опухолевых клеток, либо на животных-моделях, обычно на мышах, кроликах, собаках или свиньях. Животное-модель может быть также использовано для определения соответствующего интервала концентраций и способа введения. Такая информация может быть затем использована для определения подходящих доз и способов их введения человеку. Точное эффективное количество соединения для введения индивидууму будет зависеть от тяжести патологического состояния, общего состояния здоровья индивидуума, его возраста, веса, пола и режима питания, от времени и частоты введения лекарственного средства, а также от комбинации(й) лекарственных средств, чувствительности данного индивидуума к реакции и его переносимости/восприимчивости к данной терапии. Такое количество может быть определено путем рутинного экспериментирования и может быть установлено врачом-клиницистом. В общих чертах, эффективная доза может составлять от 0,01 до 50 мг/кг, а предпочтительно от 0,05 до 10 мг/кг. Композиции могут быть введены пациенту либо отдельно, либо в комбинации с другими агентами, лекарственными средствами или гормонами. Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель,подходящий для введения терапевтического агента. Такими носителями являются антитела и другие полипептиды, гены и другие терапевтические агенты, такие как липосомы, при условии, что этот носитель сам по себе не индуцирует вырабатывание антител, оказывающих негативное воздействие на индивидуума, которому вводят указанную композицию, и что данный вводимый носитель не является чрезмерно токсичным. Подходящими носителями могут быть крупные макромолекулы с замедленным метаболизмом, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Используемыми здесь фармацевтически приемлемыми солями могут быть, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п., и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и т.п. Подробное обсуждение фармацевтически приемлемых носителей можно найти в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). Фармацевтически приемлемые носители в терапевтических композициях могут, кроме того, содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Кроме того, в указанных композициях могут присутствовать и вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, рН-забуферивающие вещества и т.п. С помощью таких носителей могут быть получены фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п., для перорального введения пациенту. Композиции настоящего изобретения, после их приготовления, могут быть непосредственно введены индивидууму. Индивидуумами, подвергаемыми лечению, могут быть животные, а в частности человек. Фармацевтические композиции, используемые в настоящем изобретении, могут быть введены различными способами, включая, но не ограничиваясь ими, пероральное, внутривенное, внутримышечное,внутриартериальное, интрамедулярное, интратекальное, интравентрикулярное, трансдермальное или чрезкожное введение (см., например, WO 98/20734), а также подкожное, внутрибрюшинное, интраназальное, кишечное, местное, подъязычное, интравагинальное или ректальное введение. Для введения фармацевтических композиций настоящего изобретения могут быть также использованы аппараты для"выстреливания" генов или безыгольные шприцы. В основном, терапевтические композиции могут быть приготовлены в виде растворов для инъекций, либо в виде жидких растворов или суспензий, либо они могут быть получены в виде твердых форм, подходящих для получения растворов или суспензий в жидких носителях перед их введением путем инъекции. Указанные композиции могут быть непосредственно доставлены, в основном, путем подкожной,внутрибрюшинной, внутривенной или внутримышечной инъекции, либо они могут быть доставлены в интерстициальное пространство ткани. Эти композиции могут быть также введены в пораженный участок. При этом, лечение может быть проведено по схеме введения разовой дозы или дробных доз.- 21007985 При повышенной активности полипептида настоящего изобретения при конкретном патологическом состоянии может быть рассмотрено несколько подходов. Один из таких подходов предусматривает введение индивидууму вышеописанного соединения-ингибитора (антагониста) вместе с фармацевтически приемлемым носителем, где указанный ингибитор вводят в количестве, эффективном для ингибирования функции полипептида, например, блокирования связывания с лигандами, субстратами, ферментами или рецепторами, либо ингибирования вторичного сигнала, и, тем самым, эффективном для ослабления симптомов аномального состояния. Такими антагонистами, предпочтительно, являются антитела. Для минимизации иммуногенности антител, описанных выше, наиболее предпочтительно, чтобы такие антитела были химерными и/или гуманизированными. В соответствии с другим подходом могут быть введены растворимые формы полипептидов, которые сохраняют аффинность связывания с рассматриваемым лигандом, субстратом, ферментом или рецептором. В основном, такой полипептид может быть введен в виде фрагментов, в которых сохраняются соответствующие части. В альтернативном подходе, экспрессия гена, кодирующего данный полипептид, может быть ингибирована методами блокирования экспрессии, такими как использование молекул антисмысловой нуклеиновой кислоты (описанных выше), которые могут быть либо эндогенно генерированы, либо введены отдельно. Модификации экспрессии генов могут быть получены путем конструирования комплементарных последовательностей или антисмысловых молекул (ДНК, РНК или PNA) для контролирующих элементов, 5'-последовательностей или регуляторных последовательностей (сигнальной последовательности, промоторов, энхансеров и интронов) гена, кодирующего данный полипептид. Аналогичным образом, такое ингибирование может быть осуществлено с использованием методики спаривания оснований с образованием "тройной спирали". Спаривание с образованием тройной спирали используется потому,что оно приводит к нарушению способности двойной спирали раскрываться так, чтобы это оказалось достаточным для связывания с полимеразами, факторами транскрипции или регуляторными молекулами. Успехи в клинической терапии, достигнутые за последнее время благодаря использованию ДНКтриплекса, были описаны в литературе (Gee J.E. et al. (1994): Huber B.E.B.I. Carr, Molecular and Immunologic Approaches, Futura Publishing Co., Mt. Kisco, NY). Комплементарная последовательность или антисмысловая молекула могут быть также сконструированы в целях блокирования трансляции мРНК посредством предотвращения связывания транскрипта с рибосомами. Такие олигонуклеотиды могут быть введены или генерированы in situ в результате экспрессии in vivo. Кроме того, экспрессия полипептида настоящего изобретения может быть предотвращена с использованием рибозимов, специфичных к мРНК-последовательности, кодирующей этот полипептид. Рибозимы представляют собой каталитически активные РНК, которые могут быть природными или синтетическими (см. например, Usman N. et al., Curr. Opin. Struct. Biol. (1996) 6(4), 527-33). Синтетические рибозимы могут быть сконструированы так, чтобы они специфически расщепляли мРНК в выбранных положениях и, тем самым, предотвращали трансляцию мРНК в функциональный полипептид. Рибозимы могут быть синтезированы с использованием природного рибозофосфатного остова и природных оснований,обычно присутствующих в РНК-молекулах. Альтернативно, рибозимы могут быть синтезированы с использованием неприродных остовов, например, 2'-О-метил-РНК, в целях защиты от расщепления рибонуклеазой, и эти рибозимы могут содержать модифицированные основания. РНК-молекулы могут быть модифицированы в целях увеличения внутриклеточной стабильности и времени полужизни. Возможными модификациями являются, но не ограничиваются ими, присоединение фланкирующих последовательностей у 5'- и/или у 3'-концов данной молекулы или использование в указанном остове молекулы фосфортиоата или 2'-O-метила вместо фосфодиэстеразных связей. Эта концепция может рассматриваться и при продуцировании PNA и может быть применена ко всем указанным молекулам посредством включения нетрадиционных оснований, таких как инозин, квеозин и бутозин, а также ацетил-, метил-, тио- и аналогичные модифицированные формы аденина, цитидина, гуанина, тимина и уридина, которые не могут легко распознаваться эндогенными эндонуклеазами. Для лечения аномальных состояний, ассоциированных с недостаточной экспрессией полипептида настоящего изобретения и его активностью, имеется несколько способов. Один из таких способов предусматривает введение индивидууму терапевтически эффективного количества соединения, которое активирует указанный полипептид, то есть соединение-агонист, описанный выше, в целях ослабления симптомов патологического состояния. Альтернативно, терапевтическое количество указанного полипептида в комбинации с подходящим фармацевтическим носителем может быть введено в целях сохранения соответствующего физиологического равновесия данного полипептида. Для осуществления эндогенного продуцирования данного полипептида соответствующими клетками у индивидуума может быть применена генотерапия. Генотерапию используют для перманентного лечения заболеваний, связанных с аномальным продуцированием данного полипептида, путем замены дефектного гена "правильным" терапевтическим геном. Генотерапия настоящего изобретения может быть осуществлена in vivo или ex vivo. Для генотерапии ex vivo требуется выделение и очистка клеток, взятых у пациента, введение терапевтического гена и введение генетически модифицированных клеток обратно пациенту. В противоположность этому, гено- 22007985 терапия in vivo не требует выделения и очистки клеток пациентов. Для введения пациенту обычно используют "упакованный" терапевтический ген. Носители для доставки генов могут быть невирусными, такие как липосомы, либо они могут представлять собой дефектные по репликации вирусы, такие как аденовирус, описанный Berkner K.L., Curr. Top. Microbiol. Immunol.,158, 39-66 (1992) или векторы на основе адено-ассоциированного вируса (AAV), описанные Muzyczka N.Curr. Top. Microbiol. Immunol., 158, 97-129 (1992) и в патенте США 5252479. Так, например, молекула нуклеиновой кислоты, кодирующая полипептид настоящего изобретения, может быть сконструирована для экспрессии в дефектном по репликации ретровирусном векторе. Затем эта экспрессионная конструкция может быть выделена и введена в упаковывающую клетку, трансдуцированную ретровирусным плазмидным вектором, содержащим РНК, кодирующую указанный полипептид, так, чтобы указанная упаковывающая клетка продуцировала инфекционные вирусные частицы, содержащие нужный ген. Эти клетки-продуценты могут быть введены индивидууму для конструирования клеток in vivo и экспрессии полипептида in vivo (см. Chapter 20 Gene Therapy and other Molecular Genetic-based Therapeutic Approaches (и цитируемые там ссылки), Human Molecular Genetics (1996), Т. StrachanA.P.Read, BIOS Scientific Publishers Ltd). Другим способом является введение "оголенной ДНК", где терапевтический ген непосредственно инъецируют в кровоток или в мышечную ткань. В случае, когда полипептидами или молекулами нуклеиновой кислоты настоящего изобретения являются агенты, вызывающие заболевание, настоящее изобретение относится к их использованию в целях получения вакцин для вырабатывания антител против указанного агента, вызывающего заболевания. Вакцины настоящего изобретения могут быть либо профилактическими (то есть предназначенными для предупреждения инфекции), либо терапевтическими (то есть предназначенными для лечения заболеваний после инфицирования). Такие вакцины содержат иммунизирующий(е) антиген(ы), иммуноген(ы),полипептид(ы), белок(ки) или нуклеиновую кислоту, обычно в комбинации с описанными выше фармацевтически приемлемыми носителями, где указанным носителем может быть любой носитель, который сам по себе не индуцирует вырабатывание антител, оказывающих негативное воздействие на индивидуума, которому вводят указанную композицию. Кроме того, эти носители могут действовать как иммуностимуляторы ("адъюванты"). Кроме того, антиген или иммуноген может быть конъюгирован с бактериальным токсоидом, таким как токсоид дифтерии, столбняка, холеры, H. pylori и другие патогены. Поскольку полипептиды могут разрушаться в желудке, то вакцины, содержащие полипептиды,предпочтительно вводят парентерально (например, путем подкожной, внутримышечной, внутривенной или чрезкожной инъекции). Композициями, подходящими для парентерального введения, являются водные и безводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы,бактериостаты и растворенные вещества, сообщающие данной композиции изотоничность с кровью реципиента, а также водные и безводные стерильные суспензии, которые могут содержать суспендирующие агенты или загустители. Вакцинные композиции настоящего изобретения могут быть помещены в упаковки для разовых лекарственных форм или для дробных лекарственных форм. Так, например, эти лекарственные формы могут быть помещены в запаянные ампулы и сосуды и могут храниться в замороженном виде, в которые непосредственно перед их использованием необходимо лишь добавить стерильный жидкий носитель. Конкретная доза будет зависеть от удельной активности данной вакцины и может быть легко определена путем рутинного экспериментирования. Генетическая доставка антител, связывающихся с полипептидами настоящего изобретения, может быть осуществлена, например, как описано в Международной патентной заявке WO 98/55607. Для получения вакцинных композиций может быть также использована технология безыгольного впрыскивания (см., например, www.powderject.com). Ряд подходящих методов вакцинации и систем для доставки вакцин описаны в международной патентной заявке WO 00/29428. Настоящее изобретение также относится к использованию молекул нуклеиновой кислоты настоящего изобретения в качестве диагностических реагентов. Детекция мутированной формы гена, характерирующейся существованием молекул нуклеиновой кислоты настоящего изобретения, которые ассоциируются с дисфункцией, используется в качестве диагностического средства, которое может облегчать установление диагноза заболевания или установление восприимчивости к заболеванию, возникающему в результате пониженной экспрессии, сверхэкспресии или измененной пространственной или временной экспрессии данного гена. Индивидуумы, несущие мутации в данном гене, могут быть идентифицированы на уровне ДНК различными методами. Молекулы нуклеиновой кислоты, используемые для диагностики, могут быть получены из клеток данного индивидуума, таких как клетки крови, мочи, слюны, биоптата ткани или материала, полученного после аутопсии. Геномные ДНК могут быть использованы непосредственно для детекции, либо, перед проведением анализа, они могут быть амплифицированы ферментативным способом с использованием ПЦР, лигазной цепной реакции (ЛЦР), амплификации с замещением цепи (SDA) или другими методами амплификации (см. Saiki et al., Nature, 324, 163-166 (1986); Bej et al., Crit. Rev. Biochem. Molec. Biol., 26,- 23007985 301-334 (1991); Birkenmeyer et al., J. Virol. Meth., 35, 117-126 (1991), Van Brunt, J. Bio/Technology, 8, 291294 (1990. В одном из своих аспектов настоящее изобретение относится к способу диагностики заболевания у пациента, предусматривающему оценку уровня экспрессии природного гена, кодирующего полипептид настоящего изобретения, и сравнение полученного уровня экспрессии с контрольным уровнем, где уровень, отличающийся от указанного контрольного уровня, является признаком наличия данного заболевания. Этот способ включает следующие стадии:a) контактирование образца ткани, взятой у пациента, с нуклеиновокислотным зондом в жестких условиях, в результате чего образуется гибридный комплекс между молекулой нуклеиновой кислоты настоящего изобретения и указанным зондом;b) контактирование контрольного образца с указанным зондом в условиях, аналогичных условиям стадии (а); иc) детекцию присутствия гибридных комплексов в указанных образцах,где детекция уровней гибридного комплекса в образце данного пациента, которые отличаются от уровней гибридного комплекса в контрольном образце, является признаком наличия данного заболевания. В другом своем аспекте настоящее изобретение относится к способу диагностики, включающему следующие стадии:a) получение образцов тканей от пациента, исследуемого на наличие заболевания;b) выделение молекулы нуклеиновой кислоты настоящего изобретения из указанного образца ткани; иc) установление диагноза заболевания у данного пациента путем обнаружения присутствия мутации в молекуле нуклеиновой кислоты, которая ассоциируется с данным заболеванием. Для облегчения детекции молекулы нуклеиновой кислоты в описанных выше способах может быть проведена стадия амплификации, например, с помощью ПЦР. Делеции и инсерции могут быть детектированы по изменению размера амплифицированного продукта по сравнению с нормальным генотипом. Точковые мутации могут быть идентифицированы путем гибридизации амплифицированной ДНК с меченной РНК настоящего изобретения, или альтернативно, с меченными антисмысловыми ДНК-последовательностями настоящего изобретения. Полностью соответствующие последовательности могут быть дифференцированы от дуплексов с ошибочным спариванием путем ращепления РНКазой или путем оценки различий в температурах плавления. Присутствие или отсутствие мутации у пациента может быть определено посредством контактирования ДНК с нуклеиновокислотным зондом, который гибридизуется с ДНК в жестких условиях, в результате чего образуется гибридная двухцепочечная молекула, где указанная гибридная двухцепочечная молекула имеет негибридизованную часть цепи нуклеиновокислотного зонда в любой области, соответствующей мутации, ассоциированной с заболеванием; и установления присутствия или отсутствия негибридизованной части цепи нуклеиновокислотного зонда как показателя наличия или отсутствия ассоциированной с заболеванием мутации в соответствующей области ДНК-цепи. Такие способы диагностики являются особенно ценными для проведения пренатальных и даже неонатальных тестов. Точковые мутации и другие отличия между последовательностями эталонного гена и "мутантных" генов могут быть идентифицированы другими хорошо известными методами, такими как прямое секвенирование ДНК или определение конформационного полиформизма одноцепочечных последовательностей (см. Orita et al., Genomics, 5, 874-879 (1989. Так, например, секвенирующий праймер может быть использован вместе с двухцепочечным ПЦР-продуктом или с одноцепочечной матричной молекулой,генерированной с помощью модифицированной ПЦР. Определение последовательности осуществляют в соответствии со стандартными процедурами с использованием радиоактивно меченных нуклеотидов или в соответствии с процедурами автоматического секвенирования с использованием флуоресцентных меток. Клонированные ДНК-сегменты могут быть также использованы в качестве зондов для детекции специфических ДНК-сегментов. Чувствительность этого метода значительно повышается при комбинировании с ПЦР. Кроме того, точковые мутации и другие модификации последовательностей, такие как полиморфизм, могут быть детектированы как описано выше, например, с использованием аллельспецифических олигонуклеотидов для ПЦР-амплификации последовательностей, отличающихся одним нуклеотидом. Различия в ДНК-последовательностях могут быть также детектированы по изменениям электрофоретической подвижности ДНК-фрагментов в гелях, в присутствии или в отсутствии денатурирующих агентов, либо путем прямого секвенирования ДНК (например, Myers et al., Science (1985) 230:1242). Изменения в конкретных положениях данных последовательностей могут быть также выявлены либо путем проведения анализов на защиту от нуклеазы, таких как анализ на защиту от РНКазы или S1, либо путем химического расщепления (см. Cotton et al., Proc. Natl. Acad. Sci. USA (1985) 85:4397-4401). Помимо стандартного гель-электрофореза и секвенирования ДНК, мутации, такие как микроделеции, анеуплоидии, транслокации и инверсии, могут быть также детектированы путем проведения анализа in situ (см. например, Keller et al., DNA Probes, 2nd Ed., Stockton Press, New York, N.Y., USA (1993, то- 24007985 есть ДНК или РНК-последовательности в клетках могут быть проанализированы на мутации, не прибегая к их выделению и/или иммобилизации на мембране. Гибридизация in situ с флуоресценцией (FISH) является в настоящее время наиболее широко используемым методом, и множество его описаний уже появилось в литературе (см. например, Trachuck et al., Science 250, 559-562 (1990) и Trask et al., Trends,Genet., 7, 149-154 (1991. В другом варианте осуществления изобретения для проведения эффективного скрининга генетических вариантов, мутаций и полиморфизма может быть создан массив олигонуклеотидных зондов, содержащий молекулу нуклеиновой кислоты настоящего изобретения. Технология создания массивов хорошо известна специалистам, находит широкое применение и может быть использована для решения ряда проблем молекулярной генетики, касающихся экспрессии генов, сцепления генов и генетической изменчивости (см. например, М. Chee et al., Science (1996) Vol. 274, pp.610-613). В одном из вариантов осуществления изобретения такой массив может быть получен и использован в соответствии с методами, описанными в заявке РСТ WO 95/11995 (Chee et al.; Lockhart D.J. et al., (1996)Nat. Biotech. 14:1675-1680); и Schena M. et al. (1996) Proc. Natl. Acad. Sci. 93:10614-10619). Олигонуклеотидные пары могут быть использованы в количестве от двух пар до одного миллиона пар. Эти олигомеры синтезируют в соответствующих участках на субстрате с использованием оптически направленного химического синтеза. Таким субстратом может быть бумага, найлон или мембрана другого типа, фильтр,чип, покровное стекло или любой другой твердый носитель. В другом аспекте настоящего изобретения олигонуклеотид может быть синтезирован на поверхности субстрата с использованием процедуры химического связывания и струйного аппарата для нанесения путем разбрызгивания, как описано в заявке РСТ WO 95/251116 (Baldeschweiler et al.). В другом своем аспекте для определения порядка расположения кДНК-фрагментов или олигонуклеотидов на поверхности субстрата и связывания этих фрагментов или олигонуклеотидов с поверхностью субстрата могут быть использованы "сетчатые" массивы, аналогичные массивам для дот (или слот)-блотов, с использованием вакуумной системы и процедур термического, УФ-, механического или химического связывания. Массив, такой как массивы, описанные выше,может быть создан вручную или с использованием подходящих устройств (слот-блот или дот-блотаппарата), материалов (любого твердого носителя) и оборудования (включая роботизированную аппаратуру), и этот массив может содержать 8, 24, 96, 384, 1536 или 6144 олигонуклеотидов, или любое другое число от двух и выше одного миллиона, которое является подходящим для эффективного использования коммерчески доступного оборудования. Помимо методов, описанных выше, заболевания могут быть диагностированы методами, предусматривающими определение в образце, взятом у индивидуума, аномально низкого или аномально высокого уровня полипептида или мРНК. Для количественной оценки полипептидов пониженный или повышенный уровень экспрессии может быть измерен на РНК-уровне любыми методами, хорошо известными специалистам, например путем амплификации нуклеиновых кислот, а именно, с помощью ПЦР или ОТПЦР, путем проведения анализов на защиту от РНКазы, с помощью Нозерн-блот-анализов и другими методами гибридизации. Аналитические методы, которые могут быть использованы для определения уровней полипептида настоящего изобретения в образце, взятом у хозяина, хорошо известны специалистам, и подробно обсуждаются выше (включая радиоиммуноанализы, анализы на конкурентное связывание, Вестерн-блотанализ и ELISA-анализы). В этом аспекте настоящее изобретение относится к способу диагностики, который включает стадии: (а) контактирования лиганда, описанного выше, с биологическим образцом в условиях, подходящих для образования комплекса лиганд-полипептид; и (b) детекции указанного комплекса. Протоколы, такие как ELISA, РИА и FACS, разработанные для измерения уровней полипептидов,могут быть, кроме того, взяты за основу при определении измененных или аномальных уровней экспрессии полипептида. Нормальные или стандартные значения для экспрессии полипептида получают путем объединения физиологических жидкостей или клеточных экстрактов, взятых у нормальных млекопитающих, предпочтительно у человека, с антителом против полипептида в условиях, подходящих для образования комплекса. Количество образованного стандартного комплекса может быть оценено различными методами, такими как фотометрические методы. Антитела, которые специфически связываются с полипептидом настоящего изобретения, могут быть использованы для диагностики состояний или заболеваний, характеризующихся экспрессией полипептида, или в анализах для наблюдения за пациентами, которым было проведено лечение полипептидами, молекулами нуклеиновой кислоты, лигандами и другими соединениями настоящего изобретения. Антитела, подходящие для использования в диагностических целях, могут быть получены способом,аналогичным способу, описанному выше для терапии. Диагностические анализы на присутствие полипептида осуществляют методами, в которых используют антитело и метку для детекции полипептида в физиологических жидкостях или экстрактах клеток или тканей человека. При этом, могут быть использованы модифицированные или немодифицированные антитела, и эти антитела могут быть помечены путем их ковалентного или нековалентного связывания с репортерной молекулой. При этом, могут быть использованы репортерные молекулы широкого ряда,- 25007985 известные специалистам, и некоторые из них описаны выше. Количества полипептида, экспрессируемого у индивидуума, в контрольном образце и образце ткани, взятой при биопсии, сравнивают со стандартными величинами. Отклонение величин, полученных для данного индивидуума, от стандартных величин позволяет определить параметры для диагностики заболевания. Диагностический анализ может быть использован для выявления отсутствия, присутствия и избыточной экспрессии полипептида и для мониторинга регуляции уровней полипептида во время терапевтического лечения. Такие анализы могут быть также использованы для оценки эффективности конкретного курса терапевтического лечения при исследовании животных в клинических испытаниях или для наблюдения за лечением отдельного пациента. Диагностический набор настоящего изобретения может содержать:(a) молекулу нуклеиновой кислоты настоящего изобретения;(b) полипептид настоящего изобретения или(c) лиганд настоящего изобретения. В одном из аспектов настоящего изобретения диагностический набор может включать первый контейнер, содержащий нуклеиновокислотный зонд, который гибридизуется в жестких условиях с молекулой нуклеиновой кислоты настоящего изобретения; второй контейнер, содержащий праймеры, подходящие для амплификации молекулы нуклеиновой кислоты; и инструкции по использованию зонда и праймеров для облегчения диагностики заболевания. Этот набор может, кроме того, включать третий контейнер, содержащий агент для гидролиза негибридизованной РНК. В альтернативном аспекте настоящего изобретения диагностический набор может содержать массив молекул нуклеиновой кислоты, по крайней мере одной из которых является молекула нуклеиновой кислоты настоящего изобретения. Для детекции полипептида настоящего изобретения диагностический набор может содержать одно или несколько антител, связывающихся с полипептидом настоящего изобретения, и реагент, используемый для детекции реакции связывания между антителом и полипептидом. Такие наборы могут быть использованы для диагностики заболевания или восприимчивости к заболеванию, включая, но не ограничиваясь ими, клеточно-пролиферативные расстройства, аутоиммунные/воспалительные заболевания, сердечно-сосудистые заболевания, неврологические и психические расстройства, нарушения развития, генетические нарушения, метаболические расстройства, инфекции и другие патологические состояния. Такими заболеваниями предпочтительно являются неоплазма, рак,опухоль головного мозга, глиома, опухоль кости, опухоль легких, опухоль молочной железы, опухоль предстательной железы, опухоль толстой кишки, гемангиома, миелопролиферативное расстройство, лейкоз, гематологическое заболевание, нейтропения, тромбоцитопения, нарушения ангиогенеза, кожное заболевание, старение, раны, ожоги, фиброз, сердечно-сосудистые заболевания, рестеноз, болезнь сердца,заболевание периферических сосудов, коронарная болезнь сердца, отеки, тромбоэмболия, дисменорея,эндометриоз, преэклампсия, болезнь легких, ХОЗЛ (хроническое обструктивное заболевание легких),астма, заболевание костей, почечное заболевание, гломерулонефрит, болезнь печени, болезнь Крона, гастрит, язвенный колит, язва, иммунное расстройство, аутоиммунное заболевание, артрит, ревматоидный артрит, псориаз, буллезный эпидермолиз, системная красная волчанка, анкилозирующий спондилит, болезнь Лайма, рассеянный склероз, нейродегенеративное расстройство, инсульт, повреждение головного мозга/спинного мозга, болезнь Альцгеймера, болезнь Паркинсона, "болезни мотонейрона" (общее название группы заболеваний, характеризующихся поражением периферических мотонейронов), нервномышечное заболевание, ВИЧ-инфекции, СПИД, цитомегаловирусные инфекции, грибковые инфекции,глазные болезни, дегенерация желтого пятна, глаукома, диабетическая ретинопатия, повышенное глазное давление и другие состояния, в которых участвуют молекулы распознавания на клеточной поверхности,содержащие иммуноглобулиновый домен. Различные аспекты и варианты настоящего изобретения будут более подробно проиллюстрированы на примерах, а в частности, для полипептидов INSP052 и INSP055. При этом следует отметить, что в настоящее изобретение могут быть внесены конкретные модификации, не выходящие за рамки объема изобретения. Краткое описание графического материала Фиг. 1 - результаты, полученные с помощью программы BLAST в неизбыточной базе данных NCBI с использованием полноразмерной полипептидой последовательности INSP052. Фиг. 2. Сопоставление, осуществляемое путем выравнивания полноразмерной полипептидой последовательности INSP052 с наиболее близкородственной последовательностью билиарного гликопротеина Н (мыши) с помощью программы BLAST. Фиг. 3. Результаты, полученные с помощью BLAST в неизбыточной базе данных NCBI с использованием полноразмерной полипептидой последовательности INSP055. Фиг. 4. Сопоставление, осуществляемое путем выравнивания полноразмерной полипептидой последовательности INSP055 с наиболее близкородственной последовательностью билиарного гликопротеина Н (мыши) с помощью программы BLAST. Фиг. 5. Предсказанная нуклеотидная последовательность INSP052 с трансляцией. Подчеркнутая по- 26007985 следовательность означает предсказанный сигнальный пептид. Последовательность в рамке означает предсказанный трансмембранный домен. Фиг. 6. Организация INSР 052-кодирующего экзона в геномной ДНК. Внизу = INSP052.кДHK, 1251 п.н. Вверху = chr11.genomicDNA. Последовательность, кодирующая предполагаемый внеклеточный домен, подчеркнута. Старт- и стоп-кодоны обозначены жирным шрифтом. Фиг. 7. Нуклеотидная последовательность и трансляция клонированного внеклеточного доменаINSP052. Фиг. 8. Карта pENTR-INSP052-EC-6HIS. Фиг. 9. Карта pEAK12d-INSP052-EC-6HIS. Примеры Пример 1. INSP052 и INSP055. Полипептидная последовательность, происходящая от объединенных последовательностей SEQ IDNO:16, которая представляет собой транслированную последовательность следующих друг за другом экзонов INSP052, была выведена из человеческой геномной последовательности. Полинуклеотидные и полипептидные последовательности SEQ ID NO:17 и SEQ ID NO:18, обозначенные INSP055, представляют собой полинуклеотидную и полипептидную последовательности мышиного ортолога INSP052, соответственно. Существование мышиного ортолога подтверждает генную модель для человеческой последовательности INSP052. Было предсказано, что последовательности полипептидов INSP052 и INSP055, представленные SEQID NO:16 и SEQ ID NO:18, соответственно, содержат сигнальные пептидные последовательности и трансмембранный домен. Полипептидная последовательность, происходящая от объединенных последовательностей SEQ IDNO:16, которая представляет собой транслированную последовательность следующих друг за другом экзонов INSP052, была использована в качестве запрашиваемой последовательности в программе BLAST для поиска в базе данных неизбыточных последовательностей NCBI. Наилучшие десять соответствий показаны на фиг. 1, каждая из которых представляет собой белок, содержащий иммуноглобулиновый домен. На фиг. 2 показано сопоставление запрашиваемой последовательности INSP052 с последовательностью известного белка, имеющего наивысшую степень соответствия, а именно, билиарного гликопротеина Н (мыши). Полипептидная последовательность INSP055 была использована в качестве запрашиваемой последовательности в программе BLAST для поиска в базе данных неизбыточных последовательностей NCBI. Наилучшие десять соответствий показаны на фиг. 3. На фиг. 4 показано сопоставление запрашиваемой последовательности INSP055 с последовательностью известного белка, имеющего наивысшую степень соответствия, а именно, билиарного гликопротеина Н (мыши). Экспрессируемые метки-последовательности (EST), представляющие собой транскрипты INSP052 и INSP055 у человека и мышей, происходят из следующих кДНК-библиотек: головного мозга, включая мозжечок, кору головного мозга, гиппокамп, гипоталамус, продолговатый мозг; внутреннего уха и молочной железы. Транскрипты, представленные EST, могут также происходить от пораженной ткани олигодендроглиомы, глиобластомы и рассеянного склероза. Это дает основание предполагать, что INSP052 может быть клонирован из вышеуказанных тканей и может быть ассоциирован с поражением вышеуказанных тканей. В соответствии с этим, описанные здесь полипептиды, антитела и другие молекулы могут быть использованы для лечения заболевания, ассоциированного с поражением одной из вышеуказанных тканей. Пример 2. Клонирование внеклеточного домена INSP052 путем сборки экзонов. Было предсказано, что полноразмерная нуклеотидная последовательность INSP052 кодирует мембранный белок типа I из 416 аминокислот, родственный рецепторам VEGF/PDGF, принадлежащим к суперсемейству иммуноглобулинов. Предсказанная нуклеотидная последовательность, начинающаяся с инициирующего кодона ATG и заканчивающаяся poly А-хвостом, имеет длину в 2025 нуклеотидов (фиг. 5). Кодирующая последовательность (кдп) охватывает 7 экзонов (фиг. 6). Предполагаемая сигнальная последовательность (кодирующая аминокислоты 1-33) расположена в экзоне 1. Последовательность, кодирующая предсказанный трансмембранный домен (ТМ) (аминокислоты 241-263), расположена на границе экзонов 3-4. Внеклеточный домен (ЕС), кодирующий аминокислоты 1-240, клонировали путем сборки экзонов из геномной ДНК. Общий метод сборки экзонов кратко описан ниже: Отдельные экзоны 1, 2 и 3 амплифицировали из геномной ДНК с помощью ПЦР. Обратный праймер для экзона 3 также содержал 11 нуклеотидов, перекрывающихся с 5'-последовательностью экзона 4. Экзоны, очищенные гель-фильтрацией, смешивали и проводили вторую ПЦР-реакцию для амплификации уже собранной ДНК.- 27007985 Полноразмерный ПЦР-продукт, соответствующий ЕС-домену INSP052, подвергали гель-очистке и последовательно субклонировали в pDONR 201 (встраивающий вектор Gateway) и pEAK12d (экспрессирующий вектор) с использованием технологии Invitrogen Gateway. 1. ПЦР-амплификация экзонов, кодирующих внеклеточный домен INSP052, из геномной ДНК. ПЦР-праймеры конструировали для амплификации отдельных экзонов 1, 2 и 3 (табл. 1). Прямой праймер для экзона 1 (INSP052-B1P-exon1F) также содержал неполную последовательность attBl-сайтаGateway (5'GCAGGCTTC) и последовательность Козака (5'GCCACC). Обратный праймер для экзона 1(INSP052-exon1R) имел 18 нуклеотидов, перекрывающихся с экзоном 2 у 5'-конца. Прямой праймер для экзона 2 (INSP052-exon2F) имел 18 нуклеотидов, перекрывающихся с экзоном 1 у 5'-конца. Обратный праймер для экзона 2 (INSP052-exon2R) имел 18 нуклеотидов, перекрывающихся с экзоном 3 у 5'-конца. Прямой праймер для экзона 3 (INSP052-exon3F) имел 17 пар нуклеотидов, перекрывающихся с экзоном 2 у 5'-конца. Обратный праймер для экзона 3 (INSP052-exon3R) имел 11 нуклеотидов, перекрывающихся с экзоном 4 у 5'-конца. Для амплификации экзона 1 INSP052 проводили ПЦР-реакцию в конечном объеме 50 мкл, и эта реакционная смесь содержала 1,5 мкл человеческой геномной ДНК (0,1 мкг/мкл, Novagen cat69237), 2 мкл 5 мМ dNTP (Amersham Pharmacia Biotech), 6 мкл INSP052-B1P-exon1F (10 мкМ), 6 мкл INSP052exon1R, 5 мкл 10 х буфера Pwo и 0,5 мкл полимеразы Pwo (5 ед/мкл) (Roche, cat1644955). ПЦРреакцию осуществляли в следующем режиме: 94 С, 2 мин, 35 циклов при 94 С, 30 с, 60 С, 30 с, и 72 С, 1 мин; и дополнительный цикл удлинения при 72 С, 5 мин, а затем 1 цикл выдерживания при 4 С. Продукты реакции загружали на 1,5% агарозный гель (1 х ТАЕ) и ПЦР-продукты, имеющие "правильный" размер (118 п.н.), очищали гель-фильтрацией с использованием набора для гель-экстракции Qiaquick GelExtraction Kit (Qiagen cat28704) и элюировали в 50 мкл элюирующего буфера (Qiagen). Экзон 2 амплифицировали с использованием тех же самых реакционных условий и с использованием праймеров INSP052-exon2F и INSP052-exon2R. ПЦР-продукты, состоящие из 378 п.н., подвергали гель-очистке, как описано выше. Экзон 3 амплифицировали с использованием тех же самых реакционных условий и с использованием праймеров INSP052-exon3F и INSP052-exon3R. ПЦР-продукты, состоящие из 321 п.н., подвергали гель-очистке, как описано выше. 2. Сборка экзонов, кодирующих внеклеточные домены INSP052. Экзоны 1, 2 и 3-4 вновь собирали с помощью ПЦР, где реакционная смесь содержала 5 мкл каждого из очищенных гель-фильтрацией экзонов, 2 мкл 5 мМ dNTP, 6 мкл INSP052-BlP-exon1F (10 мкМ), 6 мклPromega catМ 774 В). Реакцию осуществляли в следующем режиме: 94 С, 4 мин, 10 циклов при 94 С,30 с, 48 С, 30 с, и 70 С, 2 мин; 25 циклов при 94 С, 30 с, 52 С, 30 с, и 72 С, 2 мин; и дополнительный цикл удлинения при 70 С, 10 мин; а затем 1 цикл выдерживания при 4 С. Продукты реакции анализировали на 1,5% агарозном геле (1 х ТАЕ). ПЦР-продукты, имеющие "правильный" размер (750 п.н.), очищали гель-фильтрацией с использованием набора для гель-экстракции Qiaquick Gel Extraction Kit (Qiagencat28704) и элюировали в 50 мкл элюирующего буфера (Qiagen). Полученный продукт (ОРС ЕСINSP052) содержал открытую рамку считывания (ОРС) внеклеточного домена INSP052, которая у своего 5'-конца была фланкирована attB1-сайтом и последовательностью Козака, а у своего 3'-конца - последовательностью, кодирующей 5HIS-метку. 3. Субклонирование ОРС ЕС-домена INSP052 в pDONR201. Сайты рекомбинации attB1 и attB2 добавляли в 5'- и 3'-концы полноразмерной последовательности ЕС-домена INSP052 в реакционной смеси для ПЦР, содержащей 2 мкл очищенной гель-фильтрацией ОРС ЕС-домена INSP052, 2 мкл 5 мМ dNTP (Amersham Pharmacia Biotech), 6 мкл прямого праймера GCP(10 мкМ), 6 мкл обратного праймера GCP (10 мкМ), 5 мкл 10 х буфера Vent и 0,5 мкл ДНК-полимеразыVent (2 ед/мкл) (New England Biolabs, catM0254S) в конечном объеме 50 мкл. ПЦР-реакцию осуществляли в следующем режиме: 94 С, 2 мин, 30 циклов при 94 С, 30 с, 55 С, 30 с, и 72 С, 1 мин; и дополнительный цикл удлинения при 72 С, 3 мин, а затем 1 цикл выдерживания при 4 С. Продукты реакции анализировали на 1,5% агарозном геле (1 х ТАЕ) и ПЦР-продукты, имеющие "правильный" размер (808 п.н.),очищали гель-фильтрацией с использованием набора для гель-экстракции Qiaquick Gel Extraction Kit(Qiagen cat28704) и элюировали в 50 мкл элюирующего буфера (Qiagen). Затем очищенный ПЦРпродукт (Gateway-модифицированный ЕС-домен INSP052) переносили в pDONR201 с использованием клоназы ВР следующим образом: 5 мкл Gateway-модифицированного ЕС-домена INSP052 инкубировали с 1,5 мкл pDONR201 (0,1 мкг/мкл), 2 мкл буфера ВР и 1,5 мкл смеси клоназных ферментов ВР(Invitrogen) при комнатной температуре в течение 1 ч. Реакцию прекращали добавлением протеиназы К(2 мкг) и инкубировали при 37 С еще 10 мин. Аликвоту этой реакционной смеси (1 мкл) трансформировали в 20 мкл клеток DH10B E.coli (разведенных 1/5 в Н 2 О) путем электропорации с использованием генератора импульсов BioRad Gene Pulser. Подвергнутые электропорации клетки разводили путем добавления 1 мл среды SOC и инкубировали в течение 1 ч при 37 С. Трансформанты высевали на планшеты сLB-канамицином и инкубировали в течение ночи при 37 С. Минипрепарат плазмидной ДНК выделяли из 1-10 полученных колоний с использованием роботизированной системы Qiaprep Turbo 9600 (Qiagen) и- 28007985 подвергали ДНК-секвенированию с использованием секвенирующих праймеров pENTR-Fl и pENTR-Rl и системы BigDye-Terminator (Apllied Biosystems cat.4390246) в соответствии с инструкциями производителей. Реакционные смеси для секвенирования очищали на колонках с Dye-Ex (Qiagen) или на планшетах для очистки Montage SEQ 96 (Millipore cat. LSKS09624), а затем анализировали на секвенатореApplied Biosystems 3700. 4. Субклонирование ОРС ЕС-домена INSP052 в экспрессирующий вектор pEAK12d. Элюат плазмиды (1,5 мкл) от клона pDONR201, содержащего "правильную" последовательность ЕС-домена INSP052 (плазмида ID13497), затем использовали в реакционной смеси для рекомбинации,содержащей 1,5 мкл pEAK12d (0,1 мкг/мкл), 2 мкл буфера LR и 1,5 мкл клоназы LR (Invitrogen) в конечном объеме 10 мкл. Смесь инкубировали при комнатной температуре в течение 1 ч, реакцию прекращали добавлением протеиназы К (2 мкг) и инкубировали при 37 С еще 10 мин. Аликвоту этой реакционной смеси (1 мкл) использовали для трансформации клеток DH10B E.coli путем электропорации, как описано выше. Подвергнутые электропорации клетки разводили путем добавления 1 мл среды SOC и инкубировали в течение 1 ч при 37 С. Трансформанты высевали на планшеты с LB-ампициллином и инкубировали в течение ночи при 37 С. Минипрепарат ДНК выделяли из 4 колоний с использованием роботизированной системы Qiaprep Turbo 9600 (Qiagen) и элюировали 50 мкл элюирующего буфера. Затем 2 мкл каждого минипрепарата подвергали ПЦР в общем реакционном объеме 50 мкл, содержащем 2 мкл 5 мМdNTP, 6 мкл 10 мкМ pEAK12-F, 6 мкл 10 мкМ pEAK12-R, 5 мкл 10 х буфера AmpliTaq и 0,5 мкл AmpliTaq (Apllied Biosystems cat.N808-0155). ПЦР-реакцию осуществляли в следующем режиме: 94 С,2 мин, 30 циклов при 94 С, 30 с, 55 С, 30 с, и 72 С, 1 мин, и 1 цикл при 72 С, 3 мин. Затем образцы оставляли при 4 С (цикл выдерживания) до проведения последующего анализа. Минипрепарат плазмидной ДНК выделяли из колоний, которые обнаруживали ПЦР-продукт предполагаемого размера (1074 п.н), а затем этот препарат подвергали ДНК-секвенированию с использованием секвенирующих праймеров pEAKl2-F и pEAK12-R. Максипрепарат ДНК плазмиды pEAK12d-INSP052EC-6HIS (плазмида ID 13495), очищенный в градиенте CsCl, получали из 500 мл культуры подтвержденного клона последовательности (Sambrook J.et al., Molecular Cloning, A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press), ресуспендировали при концентрации 1 мкг/мкл в стерильной воде и хранили при -20 С. Таблица 2. Праймеры для клонирования и секвенирования ЕС-домена INSP052 Подчеркнутая последовательность = последовательность Козака Последовательность, показанная жирным шрифтом = стоп-кодон Последовательность, показанная курсивом = His-метка Последовательность, подчеркнутая двойной линией = последовательность, перекрывающаяся со смежным экзоном.(плазмида 13495). Клетки почек человеческого эмбриона 293, экспрессирующие ядерный антиген вируса ЭпштейнаБарра (HEK293-EBNA, Invitrogen), поддерживали в суспензии бессывороточной среды Ех-клеток VPRO(посевной материал, поддерживающая среда, JRH). За 16-20 ч до трансфицирования (день 1) клетки высевали во флаконы с 2 х Т 225 (50 мл на флакон в среде DMEM/F12 (1:1), содержащие посевную среду с 2% FBS (JRH), при плотности 2 х 105 клеток/мл). На следующий день (день трансфекции 0) осуществляли трансфекцию с использованием реагента JetPEI (2 мкл/мкг плазмидной ДНК, PolyPlus-трансфекция). Для каждого флакона, 113 мкг кДНК (плазмида 13495) котрансфицировали 2,3 мкг GFP (флуоресцентного репортерного гена). Затем смесь для трансфекции добавляли во флаконы с 2 х Т 225 и инкубировали при 37 С (5% СО 2) в течение 6 дней. Для повышения шансов получить большее количество материала авторы повторяли эту процедуру еще в двух колбах, в результате чего получали всего 200 мл продукта. Подтверждение позитивной трансфекции проводили путем качественной оценки флуоресценции на день 1 и на день 6 (Axiovert 10 Zeiss). На 6-й день (день сбора), супернатанты (200 мл) из четырех флаконов объединяли и центрифугировали (4 С, 400 г), а затем помещали в сосуд, содержащий уникальный идентификатор. Одну аликвоту (500 мкл) оставляли для проведения количественной оценки (QC) 6 хНis-меченного белка (QC внутреннего биопроцессинга). Способ очистки 200 мл образца культуральной среды, содержащего рекомбинантный белок с С-концевой меткой 6His, разводили холодным буфером А (50 мМ NaH2PO4; 600 мМ NaCl; 8,7 % (мас./об.) глицерина, рН 7,5) до конечного объема 200 мл. Образец фильтровали через стерильный фильтр 0,22 мкм (Millipore, 500-мл фильтровальное устройство) и выдерживали при 4 С в стерильном квадратном 500-мл сосуде со средой(Nalgene). Очистку осуществляли при 4 С на рабочей станции VISION (Applied Biosystems), подсоединенной к автоматическому устройству для загрузки образцов (Labomatic). Процедура очистки состояла из двух последовательных стадий, то есть сначала проводили металлоаффинную хроматографию на колонке сPoros 20 МС (Applied Biosystems), загруженной ионами Ni (4,6 х 50 мм, 0,83 мл), а затем проводили гельфильтрацию на колонке (1,0 х 10 см) со средой, содержащей сефадекс G-25 (Amersham Pharmacia). Для проведения первой стадии хроматографии, металлоаффинную колонку регенерировали 30 колоночными объемами раствора EDTA (100 мМ EDTA; 1M NaCl; pH 8,0), снова загружали ионы металла путем промывки 15 колоночными объемами 100 мМ раствора NiSO4, после чего промывали 10 колоночными объемами буфера А, а затем промывали 7 колоночными объемами буфера В (50 мМ NaH2PO4; 600 мМ NaCl; 8,7% (мас./об.) глицерин, 400 мМ имидазол; рН 7,5), и наконец уравновешивали 15 колоночными объемами буфера А, содержащего 15 мМ имидазола. Образец переносили с помощью устройства для загрузки образцов Labomatic в 200 мл-петлю для образца, а затем загружали на аффинную колонку с металлическим Ni при скорости потока 10 мл/мин. После этого колонку промывали 12 колоночными объемами буфера А, а затем 28 колоночными объемами буфера А, содержащего 20 мМ имидазола. Во время промывки 20 мМ имидазолом, не тесно связанные примесные белки элюировались с колонки. И наконец, рекомбинантный His-меченный белок элюировали 10 колоночными объемами буфера В при скорости потока 2 мл/мин, и элюированный белок собирали в 1,6 мл-фракции. Для проведения второй стадии хроматографии, гель-фильтрационную колонку с сефадексом G-25 регенерировали 2 мл буфера D (1,137 М NaCl; 2,7 мМ КСl; 1,5 мМ КН 2 РO4; 8 мМ Na2HPO4; рН 7,2), а затем уравновешивали 4 колонками буфера С (137 мМ NaCl, 2,7 мМ КСl; 1,5 мМ КН 2 РO4; 8 мМNa2HPO4; 20% (мас./об.) глицерина; рН 7,4). Фракции пиков, элюированные с Ni-колонки, автоматически пропускали через многофункциональное устройство для загрузки образцов, подсоединенное к рабочей станции VISION с колонки, и загружали в колонку с сефадексом G-25, а затем белок элюировали буфером С при скорости потока 2 мл/мин. Обессоленный образец собирали в 2,2 мл-фракцию. Эту фракцию фильтровали через стерильный центрифужный фильтр 0,22 мкм (Millipore), замораживали и хранили при-80 С. Аликвоту данного образца анализировали с помощью электрофореза в ДСН-ПААГ (в 4-12% гелеNuPAGE; Novex) посредством окрашивания Кумасси и путем проведения Вестерн-блоттинга с использованием анти-His антител. Окрашивание Кумасси Гель NuPAGE окрашивали в растворе для окрашивания, содержащем 0,1% Кумасси синего R250(30% метанол, 10% уксусная кислота), при комнатной температуре в течение 1 ч, а затем обесцвечивали в 20% метаноле, 7,5% уксусной кислоте до тех пор, пока фон не становился прозрачным, а полосы белка не становились видимыми. Вестерн-блоттинг После электрофореза белки подвергали электрофоретическому переносу из геля на нитрицеллюлозную мембрану при 290 мА в течение 1 ч при 4 С. Мембрану блокировали 5% сухим молоком в буфере Е (137 мМ NaCl; 2,7 мМ КСl; 1,5 мМ КН 2 РO4; 8 мМ Na2HPO4; 0,1% твина 20, рН 7,4) в течение 1 ч при комнатной температуре, а затем инкубировали со смесью 2 кроличьих поликлональных анти-His антител
МПК / Метки
МПК: C12N 5/10, C12N 15/63, C07K 14/705, C12N 15/12, A01K 67/027
Метки: распознавания, иммуноглобулиновый, содержащие, клеточной, молекулы, домен, поверхности
Код ссылки
<a href="https://eas.patents.su/30-7985-molekuly-raspoznavaniya-na-kletochnojj-poverhnosti-soderzhashhie-immunoglobulinovyjj-domen.html" rel="bookmark" title="База патентов Евразийского Союза">Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен</a>
Предыдущий патент: Полипептиды tacis и br3 и их применение
Следующий патент: Применение липосом определенных размеров для лечения или предотвращения заболевания
Случайный патент: Способ получения гибридного покрытия на металлических имплантатах