Способы модулирования киназных белков множественных линий и скрининга соединений, которые модулируют киназные белки множественных линий
Номер патента: 6648
Опубликовано: 24.02.2006
Авторы: Найт Эрнест Мл., Гликсман Марси А., Нефф Никола, Уолтон Кевин М., Дайонн Крэйг А., Мэрони Анна
Формула / Реферат
1. Способ идентификации соединения, которое модулирует активность киназного белка множественных линий и повышает выживаемость клеток, включающий в себя следующие этапы:
(a) контактирование указанной клетки, содержащей указанный киназный белок множественных линий, с указанным соединением;
(b) определение того, снижает ли указанное соединение активность указанного киназного белка множественных линий; и
(c) определение того, повышает ли указанное соединение выживаемость клеток.
2. Способ идентификации соединения, которое модулирует активность киназного белка множественных линий и повышает гибель клеток, включающий в себя следующие этапы:
(a) контактирование указанной клетки, содержащей указанный киназный белок множественных линий, с указанным соединением;
(b) определение того, повышает ли указанное соединение активность указанного киназного белка множественных линий; и
(c) определение того, повышает ли указанное соединение гибель клеток.
3. Способ идентификации соединения, которое может быть пригодно для лечения нейродегенеративного состояния, включающий в себя осуществление контакта клетки или клеточного экстракта, содержащего киназный белок множественных линий, с соединением, и определение того, снижает ли указанное соединение активность указанного киназного белка множественных линий.
4. Способ идентификации соединения, которое может быть пригодно для лечения воспаления, включающий в себя осуществление контакта клетки или клеточного экстракта, содержащего киназный белок множественных линий, с соединением и определение того, снижает ли указанное соединение активность указанного киназного белка множественных линий.
5. Способ по п.1, при котором указанный белок выбран из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6.
6. Способ по п.2, при котором указанный белок выбран из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6.
7. Способ по п.3, при котором указанный белок выбран из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6.
8. Способ по п.4, при котором указанный белок выбран из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6.
9. Способ по любому из пп.5-8, при котором указанную клетку подвергают контакту in vitro.
10. Способ по любому из пп.5-8, при котором указанную клетку подвергают контакту in vivo.
11. Способ по любому из пп.5-8, при котором указанная активность белка определяется с помощью анализа киназ in vitro или анализа связывания.
12. Способ по любому из пп.5-8, при котором указанной клеткой является нервная клетка.
13. Способ по любому из пп.5, 7 или 8, при котором указанную активность белка определяют путем измерения активности или уровня фосфорилирования субстрата указанного белка.
14. Способ по п.6, при котором указанную активность белка определяют путем измерения активности субстрата указанного белка.
15. Способ по п.13 или 14, при котором указанный субстрат выбран из группы, состоящей из JNK1, JNK2, JNK3, ERK1, ERK2, p38a, p38b, p38g, p38d, MEK1, MEK2, MKK3, MKK4 (SEK1), MEK5, MKK6, MKK7, jun, ATF2, ELK1 и гомолога AEX-3 млекопитающих.
16. Способ по любому из пп.5, 7 или 8, при котором указанная активность белка определяется путем измерения активности субстрата указанного белка, количества субстрата указанного белка или мРНК, кодирующей указанный субстрат указанного белка.
17. Способ по п.6, при котором указанная активность белка определяется путем измерения активности субстрата указанного белка, количества указанного белка или мРНК, кодирующей указанный белок.
18. Способ по п.5 или 6, где указанное повышение выживаемости или гибели клеток определяется путем использования клеток с повышенным риском гибели и сравнения количества живых клеток, которые подвергались контакту с указанным соединением, с количеством живых клеток, которые не контактировали с указанным соединением.
19. Способ по любому из пп.7, 8 или 18, при котором указанными клетками являются первичные эмбриональные клетки мотонейронов.
20. Способ по любому из пп.7, 8 или 18, при котором указанные клетки сверхэкспрессируют указанный киназный белок множественных линий.
21. Способ по п.5, при котором указанное повышение выживаемости клеток определяется путем наблюдения за уменьшением апоптоза.
22. Способ по п.6, где указанное повышение гибели клеток определяется путем наблюдения за увеличением апоптоза.
23. Способ по любому из пп.5, 6 или 7, при котором указанная клетка вовлечена в нейродегенеративное заболевание.
24. Способ по п.8, при котором указанная клетка вовлечена в воспаление.
25. Способ модуляции активности киназного белка множественных линий, включающий контактирование указанного белка или клетки, содержащей указанный белок, с соединением, имеющим формулу
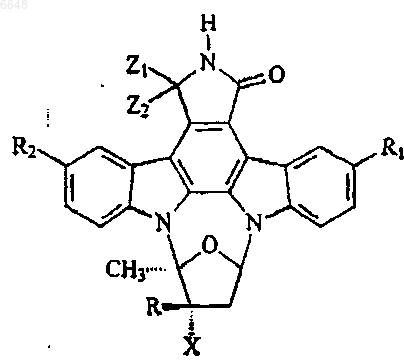
где Z1 и Z2 представляют собой H или Z1 и Z2, взятые вместе, представляют собой =O;
R представляет собой OH или OCH3;
X представляет собой CO2CH3 или CO2(CH2)4CH3;
R1 выбран из H, CH2SCH2CH3, NHCONHC2H5, CH2OCH2OCH2CH3, Br и CH2CH2SCH3;
R2 выбран из H, CH2SCH2CH3, NHCONHC2H5, CH2CH2(2-пиридил), CH2OCH2OCH2CH3, CH2OH, Br, I и CH2CH2SCH3.
26. Способ модуляции активности киназного белка множественных линий, включающий контактирование указанного белка или клетки, содержащей указанный белок, с соединением, имеющим формулу

где кольцо B и кольцо F, независимо и каждое вместе с атомами углерода, к которым они присоединены, выбраны из группы, включающей:
a) ненасыщенное 6-членное карбоциклическое ароматическое кольцо, в котором от 1 до 3 атомов углерода могут быть заменены атомами азота;
A1, A2, R1, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2OAc;
R4 представляет собой CH2CH2 (2-пиридил) и
X представляет собой CH2, или
A1, A2, R1, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой H;
R4 представляет собой CH2CH2 (2-пиримидинил) и
X означает CH2, или
A1, A2, R1, R3 и R4 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2OH;
R5 и R6 представляют собой OCH3 и
X означает CH2, или
A1, A2, R1, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2OAc;
R4 представляет собой Br и
X означает CH2; или
A1, A2, R1, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2OAc;
R4 представляет собой CH2CH2 (2-пиридил);
X означает CH2, или
A1, A2, R1, R3, R4, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2OH и
X означает CH2, или
A1, A2, R1, R3, R4, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2CH2OH и
X означает CH2, или
A1, A2, R1, R2, R3, R4, R5 и R6 являются H;
B1 и B2 вместе представляют собой O и
X означает S, или
A1, A2, R1, R3, R4, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой CH2CH2CH2NHCO(4-(OH)Ph) и
X означает CH2, или
A1, A2, R1, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой H;
R4 представляет собой CH2CH2(2-пиримидинил) и
X означает CH2, или
A1, A2, R1, R2, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R4 представляет собой CH2CH2(2-пиридазинил) и
X означает CH2, или
A1, A2, R1, R3, R5 и R6 являются H;
B1 и B2 вместе представляютсобой O;
R2 представляет собой H;
R4 представляет собой CH2CH2(2-пиридил) и
X означает CH2, или
A1, A2, R1, R3, R4, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой (CH2)3NH-C(=O)-3,5-дигидроксифенил и
X означает CH2, или
A1, A2, R1, R3, R4, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R2 представляет собой бензоил и
X означает CH2, или
A1, A2, R1, R2, R3, R5 и R6 являются H;
B1 и B2 вместе представляют собой O;
R4 представляет собой CH=CH-C=N и
X означает CH2.
Текст
006648 Направлением данного изобретения отчасти являются способы модулирования представителей семейства киназ множественных линий (MLK), способы идентификации соединений, которые модулируют киназный белок множественных линий, и либо повышают выживаемость клеток, либо стимулируют гибель клеток, способы идентификации соединений, которые могут быть пригодны для лечения нейродегенеративных заболеваний и/или воспаления, и способы лечения нейродегенеративных заболеваний соединениями, которые ингибируют киназный белок множественных линий. Семейство MLK включает в себя группу белков, в которых белковые последовательности киназных доменов представителей семейства имеют близкое сходство с МАРKKK, но обладают большим сходством друг с другом, чем с другими МАРKKK. Представители семейства MLK охватывают часть очень сложных киназных каскадов, таких, например, как каскад передачи сигнала при стрессе, в который вовлечено модулирование в числе других N-концевой киназы c-Jun (JNK), которая в свою очередь модулирует в числе других белков факторы транскрипции, включая c-Jun, ATF2 и ELK-1. Киназа JNK описана в патентах США 5534426, 5593884, 5605808 и заявке WO 95/03324, каждый из этих документов включен здесь в виде ссылки в полном объеме. Семейство MLK включает в себя, в частности, следующие группы: 1) киназу множественных линий 1 (MLK1); 2) киназу множественных линий 2 (MLK2); 3) киназу множественных линий 3 (MLK3); 4) киназу, несущую лейциновую молнию (LZK); 5) киназу, несущую двойную лейциновую молнию (DLK); и 6) киназу множественных линий 6 (MLK6). MLK1 имеет каталитический домен, сходный как с киназами,специфичными для Туr, так и с киназами, специфичными для Ser/Thr. Dorow, et al., Eur. J. Biochem., 1993,213, 701-710. MLK2 также имеет каталитический домен, сходный с обеими киназами, специфичными для Туr или Ser/Thr. Dorow, et al., Eur. J. Biochem., 1993, 213, 701-710. MLK2 известна также как MST. Katoh,et al., Oncogene, 1995, 10, 1447-1451. MLK3 включает в себя белок, который кроме киназного домена содержит две лейциновые молнии с примыкающим основным районом на карбоксильном конце и район,богатый пролином. Ing, et al., Oncogene, 1994, 9, 1745-1750. MLK3 также известна как SPRK (Gallo, et al.,J. Biol. Chem., 1994, 269, 15092-15100) и РТK1 (Ezoe, et al., Oncogene, 1994, 9, 935-938). LZK является киназой, несущей лейциновую молнию. Sakuma, et al., J. Biol. Chem., 1997, 272, 28622-28629. DLK имеет киназный домен и два предполагаемых мотива лейциновой молнии. Holzman, et al., J. Biol. Chem., 1994,269, 30808-30817. DLK также известна как ZPK (Reddy, et al., Biochem. Biophys. Res. Comm., 1994, 202,613-620) и MUK (Hirai, et al., Oncogene, 1996, 12, 641-650). Представители семейства MLK также описаны, например, в патентах США 5676945, 5554523, WO 93/15201, патенте Канады 2148898, Diener, et al.,Proc. Natl. Acad. Sci. USA, 1997, 94, 9687-9692, DeAizpurua, et al., J. Biol. Chem., 1997, 272, 16364-16373,Tung, et al., Oncogene, 1997, 14, 653-659, Sells, et al., Trends in Cell Biol., 1997, 7, 161-167, Mata, et. al., J.Chem., 1996, 271, 24788-24793, Blouin, et al., DNA and Cell Biol., 1996, 15, 631-642, Pombo, et al., Nature,1995, 377, 750-754, Kiefer, et al., EMBO J., 1996, 15, 7013-7025, Hu, et al., GenesDev., 1996, 10, 22512264, Su, et al., EMBO J., 1997, 16, 1279-1290, и Dorow, et al., Eur. J. Biochem., 1995, 234, 492-500. Недавно в базе данных EST была идентифицирована другая киназа, родственная MLK. Последовательность ДНК этого клона, MLK6, описывается семью перекрывающимися элементами. Идентификационные номера их клонов: 1007489, 1460085, 510915, 666323, F5555, 482188 и 178522, последовательности каждого из которых включены здесь в виде ссылки в полном объеме. Каждая из ссылок, цитированных в данном параграфе, включена здесь в виде ссылки в полном объеме. Недавно было показано, что стабильная экспрессия ZPK снижает пролиферативную способность фибробластов NIH 3 Т 3, что было измерено с помощью анализа образования колоний. Bergeron, et al.,Biochem. Biophys. Res. Comm., 1997, 231, 153-155. Однако Bergeron с соавторами не удалось представить каких-либо данных, указывающих на то, что ZPK модулировал активность субстрата ZPK или что ZPK стимулировал гибель клеток. Было показано, что экспрессия конструкции, кодирующей Myc-MLK2, в клетках Swiss 3 Т 3 приводит к апоптозу примерно через 20 ч после инъекции. Nagata, et al., EMBO J., 1998, 17, 149-158. Заявители разработали многочисленные индоло- и инденосоединения, которые наряду с другими действиями ингибируют рост клеток, ассоциированный с состоянием гиперпролиферации, и ингибируют гибель в различных эмбриональных культурах, таких как культуры ганглия дорсального корешка, полосатого тела, верхних шейных ганглиев и мотонейронов. Патенты США 5475110, 5591855, 5594009,5461146, 5621100, 5621101, 5705511 и 5756494, каждый из которых уступает место правопреемника данной заявке, включены здесь в виде ссылки в полном объеме. Соединения, перечисленные в патенте США 5705511, имеющие формулу G, указаны в данной заявке как соединения, имеющие формулу I. Заявители также показали, что апоптоз мотонейронов ингибируется производным K-252 а, индолокарбазолом, который также модулирует каскад передачи сигнала при стрессе. Работа Maroney et al., J. Neurosci., 1998, 18,104-111 включена здесь в виде ссылки в полном объеме. Вследствие неадекватности отбираемых соединений, которые модулируют представителей каскада передачи сигнала при стрессе и либо стимулируют гибель клеток, либо повышают выживаемость клеток,остается необходимость в новых избирательных способах скрининга соединений. Кроме того, остается необходимость в скрининговых исследованиях терапевтических средств, которые могут быть пригодны-1 006648 при лечении воспаления и нейродегенеративных заболеваний. Данное изобретение направлено на достижение этих, а также других важных целей. Сущность изобретения Данное изобретение предоставляет способы идентификации соединений, которые модулируют активность киназного белка множественных линий и повышают выживаемость клеток, включающие в себя этапы контактирования клетки, содержащей киназный белок множественных линий, с соединением, определения того, снижает ли соединение активность киназного белка множественных линий, и определения того, повышает ли соединение выживаемость клеток. Данное изобретение также предоставляет способы идентификации соединений, которые модулируют активность киназного белка множественных линий и стимулируют гибель клеток, включающие в себя этапы контактирования клетки, содержащей киназный белок множественных линий, с соединением,определения того, увеличивает ли соединение активность киназного белка множественных линий, и определения того, стимулирует ли соединение гибель клеток. Данное изобретение также предоставляет способы идентификации соединений, которые могут быть пригодны для лечения нейродегенеративных заболеваний, включающие в себя контактирование клетки или клеточного экстракта, содержащего киназный белок множественных линий, с соединением и определение того, снижает ли соединение активность киназного белка множественных линий. Данное изобретение также предоставляет способы идентификации соединений, которые могут быть пригодны для лечения воспаления, включающие в себя контактирование клетки или клеточного экстракта, содержащего киназный белок множественных линий, с соединением и определение того, снижает ли соединение активность киназного белка множественных линий. Предпочтительно, если указанный белок выбран из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6. При этом указанная клетка может представлять собой нервную клетку, которую подвергают контакту in vitro илиin vivo, а указанная активность белка определяется с помощью анализа киназ in vitro или анализа связывания. Предпочтительно указанную активность белка определяют путем измерения активности или уровня фосфорилирования субстрата указанного белка, а данный субстрат выбран из группы, состоящей изJNK1, JNK2, JNK3, ERK1, ERK2, р 38, р 38, р 38, р 38, МЕK1, МЕK2, МKK3, МKK4 (SEK1), МЕK5,МKK6, МKK7, jun, ATF2, ELK1 и гомолога АЕХ-3 млекопитающих. Активность белка определяется путем измерения активности субстрата указанного белка, количества субстрата указанного белка или мРНК, кодирующей указанный субстрат указанного белка, или мРНК, кодирующей указанный белок. В одном из вариантов осуществления изобретения повышение выживаемости или гибели клеток определяется путем использования клеток с повышенным риском гибели и сравнения количества живых клеток, которые подвергались контакту с указанным соединением, с количеством живых клеток, которые не контактировали с указанным соединением, а указанными клетками являются первичные эмбриональные клетки мотонейронов, которые сверхэкспрессируют указанный киназный белок множественных линий. В одном из вариантов осуществления изобретения указанная клетка вовлечена в нейродегенеративное заболевание или в воспаление, а повышение выживаемости клеток определяется путем наблюдения за уменьшением или за увеличением апоптоза. Данное изобретение также включает способы модуляции активности киназного белка множественных линий, включающий контактирование указанного белка или клетки, содержащей указанный белок, с соединением, имеющим формулуR представляет собой ОН или ОСН 3;X представляет собой СО 2 СН 3 или СО 2(CH2)4CH3;-2 006648 Кроме того, данное изобретение относится к способам модуляции активности киназного белка множественных линий, включающий контактирование указанного белка или клетки, содержащей указанный белок, с соединением, имеющим формулу где кольцо В и кольцо F независимо и каждое вместе с атомами углерода, к которым они присоединены,выбраны из группы, включающей: а) ненасыщенное 6-членное карбоциклическое ароматическое кольцо, в котором от 1 до 3 атомов углерода могут быть заменены атомами азота;B1 и В 2 вместе представляют собой О;R2 представляет собой СН 2 СН 2 ОАс;R4 представляет собой СН 2 СН 2(2-пиридил) иX представляет собой СН 2; илиB1 и В 2 вместе представляют собой О;R4 представляет собой СН 2 СН 2(2-пиримидинил) иB1 и В 2 вместе представляют собой О;R2 представляет собой СН 2 СН 2 ОН;R5 и R6 представляют собой ОСН 3 иB1 и В 2 вместе представляют собой О;R2 представляет собой СН 2 СН 2 ОАс;B1 и В 2 вместе представляют собой О;R2 представляет собой СН 2 СН 2 ОАс;R4 представляет собой СН 2 СН 2(2-пиридил);B1 и В 2 вместе представляют собой О;R2 представляет собой СН 2 СН 2 ОН иB1 и В 2 вместе представляют собой О;R2 представляет собой СН 2 СН 2 СН 2 ОН иB1 и В 2 вместе представляют собой О иB1 и В 2 вместе представляют собой О;B1 и В 2 вместе представляют собой О;R4 представляет собой СН 2 СН 2(2-пиримидинил) иB1 и В 2 вместе представляют собой О;R4 представляет собой СН 2 СН 2(2-пиридазинил) иB1 и В 2 вместе представляют собой О;R4 представляет собой СН 2 СН 2(2-пиридил) иB1 и В 2 вместе представляют собой О;B1 и В 2 вместе представляют собой О;R2 представляет собой бензоил иB1 и В 2 вместе представляют собой О;X означает СН 2. Краткое описание чертежей В целях иллюстрации вариантов данного изобретения некоторые детали показаны на чертежах. Однако следует понимать, что это изобретение не ограничено показанными определенными вариантами. Фиг. 1 представляет собой схематичный чертеж, на котором показано общее получение инденопирролокарбазолов с мостиковой связью; фиг. 2 - схематичный чертеж, на котором показано общее получение инденопирролокарбазолов с мостиковой связью; фиг. 3 - схематичный чертеж, на котором показано получение связанных со смолой инденопирролокарбазолов; фиг. 4 - схематичный чертеж, на котором показано получение защищенных, растворимых инденопирролокарбазолов; фиг. 5 - схематичный чертеж, на котором показано получение промежуточного соединения V; фиг. 6 - схематичный чертеж, на котором показано получение инденопирролокарбазолов с мостиковой связью с помощью метода А; фиг. 7 - схематичный чертеж, на котором показано получение инденопирролокарбазолов с мостиковой связью с помощью метода В; фиг. 8 - схематичный чертеж, на котором показано получение инденопирролокарбазолов с мостиковой связью, замещенных в В кольце; фиг. 9 - схематичный чертеж, на котором показана дериватизация Е кольца инденопирролокарбазолов с мостиковой связью; на фиг. 10 показана диаграмма двух отдельных экспериментов, представляющая количество жизнеспособных дифференцированных по нейронному пути клеток РС-12, которые остаются после 5 дней культивирования в отсутствие NGF. Результаты выражены в виде процента от контроля в присутствииNGF в каждой группе (векторный контроль в отсутствие NGF, n=12; все другие группы, n=3). Различие между векторным контролем и стабильными пулами клеток, экспрессирующими доминантный негативный мутант MLK-3, в отсутствие NGF статистически значимо, что было определено по двухстороннему Т-критерию (р 0,05); на фиг. 11 А - фосфорилирование неработающей киназы (мертвой киназы) GST-SEK-1, экспрессируемой бакуловирусами FLAG-MLK-3 (смесь полноразмерного белка и киназного домена) с использованием анализа, основанного на определении радиоактивности в геле; на фиг. 11 В - 32 Р-меченный продукт фосфорилирования основного белка миелина, образованный в результате киназной реакции, катализируемой экспрессированной бакуловирусами FLAG-MLK-3 (смесь полноразмерного белка и киназного домена) или киназным доменом GST-MLK-3; фиг. 12 представляет собой анализ иммуноблоттов, на котором показано фосфорилирование мертвой киназы GST-SEK-1, экспрессируемой бакуловирусами FLAG-MLK-3 (смесь полноразмерного белка и киназного домена), как было определено с помощью антител, специфичных для фосфорилированнойSEK; на фиг. 13 показано фосфорилирование основного белка миелина киназным доменом экспрессируемой бакуловирусами GST-MLK-3 с использованием (о) множественного скринингового анализа при осаждении трихлоруксусной кислотой, илиметода исследования на фосфоцеллюлозных мембранах; на фиг. 14 показана кривая насыщения связывания [3 Н]K252 а, инкубированного с лизатом клеток насекомых, инфицированных MLK-3 бакуловирусами;-4 006648 на фиг. 15 А показано количество 32 Р-меченного с-jun при иммунопреципитации/реакции с киназой,полученной из клеток, сверхэкспрессирующих MLK-3, MLK-2 или DLK и обработанных либо 0,025% ДМСО (контроль), либо 500 нМ K-252 а; на фиг. 15 В показана диаграмма количественного определения процента активности, остающейся при иммунопреципитации/реакции с киназой в образцах, приведенных в описании к фиг. 15 А. Колонки представляют среднее для двух образцов, где величина ошибки показывает пределы средней; на фиг. 15 С показано количество 32 Р-меченного с-jun при иммунопреципитации/реакции с киназой,полученной из клеток, сверхэкспрессирующих одну только HA-JNK1 или в сочетании с МЕKK1 при разных количествах кДНК, как показано, и обработанных либо 0,025% ДМСО (контроль), либо 500 нМ соединения III-3 (см. табл. 3). Колонки представляют среднее для двух образцов, где величина ошибки показывает пределы средней; на фиг. 16 показано, что соединение III-3 повышает выживаемость нейронов зависимым от концентрации образом. Диссоциированные нейроны из симпатического ганглия (SG) (А), ганглия дорсального корешка (DRG) (В), цилиарного ганглия (CG) (С) и мотонейроны (MN) (D) культивировали в присутствии или в отсутствие указанных трофических факторов. Через 48 ч после посева подсчитывали клетки,как описано в материалах и методах. Данные представлены в виде средней + стандартное отклонение из определений в трех или четырех повторах. Показан один из трех экспериментов; на фиг. 17 показаны фазово-контрастные микроснимки культур Э 12 DRG (А, Е), симпатических Э 9(В, F), цилиарных Э 8 (С, G) и мотонейронов Э 5,5 (D, Н) после культивирования в течение 48 ч (24 ч для цилиарных нейронов) в присутствии соответствующего нейротрофического фактора (20 нг/мл NGF для симпатических и чувствительных нейронов, 10 нг/мл CNTF для цилиарных нейронов, 30 мкг/мл мышечного экстракта (МЕХ) для мотонейронов (A-D) или в присутствии 1 мкМ соединения III-3 (Е-Н). Полоска=200 мкм; на фиг. 18 показан микрофотоснимок эксплантатов ганглиев дорсальных корешков in vitro. Эксплантаты DRG цыплят (Е 9) высевали в 96-луночные планшеты в среду, содержащую 0,05% БСА. После 2 ч периода прикрепления делали добавки: (А) контроль ДМСО; (В) 20 нг/мл NGF; (С) 250 нМ соединения III-3. Спустя 48 ч среду удаляли и эксплантаты фиксировали 4% параформальдегидом в фосфатносолевом буфере; на фиг. 19 показано количество люмбальных мотонейронов цыпленка, выживающих на Э 10 после ежедневной обработки (Э 5-9) определенными дозами соединения III-3. Представленные данные являются среднимистандартное отклонение для 5-6 животных/группу обработки. Изложенный эксперимент повторяли два раза. Данные являются данными одного типичного эксперимента и представляют одну сторону поясничного столба. р 0,01, р 0,001, по t-критерию Стьюдента с поправкой Бонферрони между группой, которой вводили соединение III-3 и контрольной группой; на фиг. 20 показано количество мотонейронов в спинномозговом ядре bulbocavernosus самок крыс(SNB), выживающих на ПН 10 или ПН 60 после ежедневной обработки (ПН 1-5) соединением III-3 или контрольным наполнителем (5% Solutol). На ПН 10 (А, В) или ПН 60 (В) крыс забивали и делали срезы района спинного мозга, содержащего SNB и обрабатывали их для гистологии; затем подсчитывали мотонейроны, окрашенные крезиловым фиолетовым (Cresylecht violet), в серийных срезах поясничного 5 крестцового 1 района спинного мозга, как описано ранее (Wingfield, et al., Steroids, 1975, 26, 311-327). Экспериментальные данные представляют собой средниестандартное отклонение для 4-8 животных/группу обработки; на фиг. 21 показана потеря ХАТ-иммунореактивности после подъязычной аксотомии у взрослых крыс после обработки соединением III-3. Микрофотографии подъязычного ядра после рассечения подъязычного нерва и обработки (А) раствором одного наполнителя (5% Solutol) и (В) 200 мкг соединенияIII-3, нанесенными в место рассечения. (С) количество ХАТ-иммунореактивных подъязычных мотонейронов после обработок, описанных выше в пунктах (А) и (В). Результаты выражены в виде процентного содержания ХАТ-иммунореактивных мотонейронов при этом за 100% принимали количество ХАТиммунореактивных мотонейронов в расположенном на противоположной стороне неповрежденном подъязычном ядре; на фиг. 22 показано ингибирование пути MLK-3, которое происходит эффективно in vivo и блокирует следующие далее этапы фосфорилирования. На фиг. 22 А показано увеличение иммунореактивных при анализе на тирозингидроксилазу нейронов черной субстанции после повреждения МРТР при систематическом введении соединения III-3. Фиг. 22 В представляет собой типичный иммуноблот, показывающий индуцированное МРТР увеличение уровней фосфорилированной МKK4. На фиг. 22 С изображен типичный иммуноблот и результаты ELISA, демонстрирующие ослабление индуцированного МРТР увеличения уровня фосфорилированного МKK4 в присутствии соединения III-3; на фиг. 23 показана индукция IL-2 в клетках Jurkat. На фиг. 23 А показана временная кривая индукции IL-2. На фиг. 23 В показано ингибирование индукции IL-2 соединением III-3. На фиг. 23 С показано ингибирование индукции IL-2 соединением III-3 и соединением 1-4. Следующие термины, которые использованы выше и на протяжении всей заявки, если не оговорено-5 006648 особо, следует понимать как термины, имеющие следующие значения. Термин апоптоз относится к особой морфологической форме гибели клеток, характеризующейся фрагментацией клеток и их ядер на мембрано-связанные частицы. Апоптоз может быть запущен, например, обработкой соединениями, индуцирующими апоптоз, такими как этопозид, стауроспорин, фактор некроза опухоли , церамид и им подобными, или в таких условиях, как х-облучение. Термин гибель клеток относится к гибели клеток путем апоптоза, некротическим или другим способом, широко известным специалистам в данной области. Гибель клеток может быть охарактеризована, например, в виде снижения общего количества клеток или снижения выживаемости клеток по сравнению с необработанными контрольными популяциями клеток. Соединения, которые стимулируют гибель клеток, приводят в результате к снижению количества клеток или снижению выживаемости клеток по сравнению с контрольными популяциями. Напротив, соединения, которые повышают выживаемость клеток, приводят в результате к увеличению количества клеток или выживаемости клеток, или эти соединения замедляют или снижают скорость гибели клеток. Термин избирательно реагирует или избирательно связывает описывает соединения, которые непосредственно физически или химически взаимодействуют с белком MLK. Напротив, соединения, которые не избирательно реагируют или не избирательно связывают могут влиять на белки ниже по течению или выше по течению белка MLK, и таким образом могут влиять на активность белков MLK, но не взаимодействовать непосредственно физически или химически с белком MLK. Термин модулирует относится к повышению или снижению активности конкретного белка или его субстрата. Частичным направлением данного изобретения являются способы идентификации соединений, которые модулируют активность белка MLK и либо повышают выживаемость клеток, либо стимулируют гибель клеток. Соединения, которые в результате приводят к увеличению активности белка MLK, могут стимулировать гибель клеток, тогда как соединения, которые в результате приводят к снижению активности белка MLK, могут повышать выживаемость клеток.MLK белком может быть любой белок, отнесенный при идентификации к MLK классу белков. Предпочтительно MLK белок выбирается из группы, состоящей из MLK1, MLK2, MLK3 (SPRK, РТK1),LZK, DLK (ZPK, MUK) и MLK6, которые описаны выше. В предпочтительных вариантах изобретения эти способы идентифицируют соединения, которые непосредственно взаимодействуют или связываются с MLK-белком, что определяется с помощью исследований связывания, исследований киназ или другими равноценными анализами. Чтобы идентифицировать соединения, которые модулируют активность MLK-белка и стимулируют либо выживаемость клеток, либо гибель клеток, клетку или клетки, содержащие MLK белок, подвергают контакту с тестируемым соединением. Контактирование может происходить в буферах или средах, хорошо известных специалистам в данной области. В альтернативном случае контактирование может происходить in vivo, при этом животное, такое, например, как мышь или другое подходящее животное, известное специалистам в данной области, подвергают контакту путем введения фармацевтической композиции, содержащей тестируемое соединение и фармацевтически приемлемую соль, носитель или разбавитель. Дополнительно могут быть использованы варьирующие количества клеток и концентрации тестируемых соединений. Определяют, увеличивает ли тестируемое соединение или уменьшает активность белка MLK. Кроме того, также определяют, стимулирует ли тестируемое соединение выживаемость клеток или гибель клеток. Клетками, которые подвергают контакту с тестируемыми соединениями, могут быть любые клетки млекопитающих. Предпочтительно клеткой является нервная клетка. Предпочтительно клетка вовлечена в нейродегенеративное заболевание. В целях данного изобретения термины нейродегенеративное заболевание, нейродегенеративное нарушение и нейродегенеративное состояние взаимозаменяемы и используются, чтобы описать любое заболевание или состояние, в которое вовлекаются нервные клетки или клетки, связанные с нервной системой, включая, но не ограничиваясь этим, болезнь Альцгеймера,заболевание мотонейронов, боковой амиотрофический склероз, болезнь Паркинсона, цереброваскулярное заболевание, ишемические состояния, деменцию при СПИДе, эпилепсию, болезнь Гентингтона и повреждение при сотрясении или проникающее ранение головного или спинного мозга. Активность MLK белка может быть определена многими способами. Например, активность MLK может быть определена путем измерения активности субстрата MLK белка. Такие субстраты хорошо известны и без труда отличимы специалистами в данной области. Предпочтительно субстрат является представителем семейства киназ активируемых митогеном протеинкиназ или семейства активируемых митогеном протеинкиназ, или субстратов, продолжающих путь ниже, которые включают в себя, но не ограничены этим, белок, выбранный из группы, состоящей из JNK1, JNK2, JNK3, ERK1, ERK2, р 38,р 38, р 38, р 38, МЕK1, МЕK2, МKK3, МKK4 (SEK1), МЕK5, МKK6, МKK7, jun, ATF2, ELK1 и гомолог АЕХ-3 млекопитающих, а также общие субстраты Ser/Thr протеинкиназ, такие как основной белок миелина (МBР). Реактивы и способы измерения активности субстратов также хорошо известны специалистам в данной области. Присутствие MLK также может быть определено путем измерения количестваMLK белка или мРНК, кодирующей MLK белок. Реактивы, включая антитела и олигонуклеотидные зонды, а также способы измерения количества ДНК или белка, включая нозерн- и вестерн-блотты, хорошо известны специалистам в данной области. Активность MLK белка также может быть определена путем анализа киназы in vitro. Анализы киназ in vitro хорошо известны специалистам в данной области. Другие способы измерения активности белка известны специалистам в данной области, и имеется в виду, что они включены в данное изобретение. Таким образом, специалист в данной области может определить,модулирует ли тестируемое соединение (т.е. увеличивает или снижает) активность MLK-белка. Стимулирует ли или не стимулирует тестируемое соединение выживание клеток или гибель клеток,может быть определено многими путями. Предпочтительно повышение выживаемости клеток или стимуляция гибели клеток определяется с использованием клеток, для которых существует риск гибели, и при сравнении количества клеток, которые подвергались контакту с тестируемым соединением и остались живыми, с количеством клеток, которые не подвергались контакту с тестируемым соединением и остались живы. Предпочтительно клетками являются первичные эмбриональные клетки мотонейронов,которые заранее запрограммированы на смерть. Первичные эмбриональные клетки мотонейронов описаны в работе Maroney, et al., J. Neurosci., 1998, 18, 104-111, которая включена здесь в виде ссылки в полном объеме. Первичные эмбриональные клетки мотонейронов погибнут, если не будут спасены с помощью тестируемого соединения. Таким образом, большее количество живых клеток мотонейронов в популяции клеток мотонейронов, обработанных тестируемым соединением, по сравнению с количеством клеток мотонейронов в популяции мотонейронных клеток, которые не были обработаны тестируемым соединением, является показателем тестируемого соединения, которое повышает выживаемость клеток. Напротив, меньшее количество живых клеток мотонейронов в популяции мотонейронных клеток, обработанных тестируемым соединением, по сравнению с количеством живых клеток мотонейронов в популяции мотонейронных клеток, которые не были обработаны тестируемым соединением, является показателем тестируемого соединения, которое стимулирует гибель клеток. В другом варианте изобретения нормальные клетки, или клетки дикого типа, превращают в клетки,для которых существует риск гибели, путем сверхэкспрессии белка MLK, как описано ниже в примерах,и затем подвергают контакту с тестируемым соединением. Клетки, сверхэкспрессирующие белки MLK,могут погибнуть, если не будут спасены с помощью тестируемого соединения. Сверхэкспрессия белковMLK может быть достигнута с помощью векторов, способных к экспрессии конкретного белка внутри клетки. Экспрессирующие векторы хорошо известны специалистам в данной области. Кроме того, способы подготовки экспрессирующих векторов также хорошо известны специалистам в данной области. Экспрессирующие векторы, которые экспрессируют какие-либо белки MLK, могут быть получены способом, подобным тем, которые описаны в примерах. Большее количество живых клеток в популяции сверхэкспрессирующих клеток, обработанных тестируемым соединением, по сравнению с количеством живых клеток в популяции сверхэкспрессирующих клеток, которые не были обработаны тестируемым соединением, является показателем тестируемого соединения, которое повышает выживаемость клеток. Напротив, меньшее количество живых клеток в популяции сверхэкспрессирующих клеток, обработанных тестируемым соединением, по сравнению с количеством живых клеток в популяции сверхэкспрессирующих клеток, которые не были обработаны тестируемым соединением, является показателем тестируемого соединения, которое стимулирует гибель клеток. В другом варианте изобретения повышение выживаемости клеток определяется путем наблюдения или измерения уменьшения апоптозов. С апоптозом ассоциировано сжатие цитоплазмы и конденсация ядер. Таким образом, специалист в данной области может измерить уменьшение апоптоза путем измерения или наблюдения за уменьшением сокращения цитоплазмы и/или конденсации ядер. Кроме того, специалист в данной области может измерить апоптоз с применением традиционных способов окрашивания. В другом варианте изобретения для идентификации соединений, которые стимулируют гибель клеток, могут быть использованы нормальные нервные клетки дикого типа. Нормальные нервные клетки будут выживать, если они не будут индуцированы к смерти тестируемым соединением. Меньшее количество живых клеток в популяции нормальных клеток, обработанных тестируемым соединением, по сравнению с количеством живых клеток в популяции нормальных клеток, которые не были обработаны тестируемым соединением, является показателем тестируемого соединения, которое стимулирует гибель клеток. Напротив, большее или равное количество живых клеток в популяции нормальных клеток, обработанных тестируемым соединением, по сравнению с количеством живых клеток в популяции нормальных клеток, которые не были обработаны тестируемым соединением, не является показателем тестируемого соединения, которое стимулирует гибель клеток. Частично данное изобретение направлено также на способы модулирования активности белкаMLK, которые включают в себя контактирование белка или клетки, содержащей белок, с соединением,имеющим формулу G (обозначена здесь как формула I), заявленную в патенте США 5705511, правопреемником которого является данное изобретение и который включен здесь в виде ссылки в полном объеме. Частично данное изобретение направлено также на способы модулирования активности белкаMLK, включающие в себя контактирование белка или клетки, содержащей белок, с соединением, имеющим формулу III, приведенную нижеX выбирается из группы, состоящей из Н, СН 2 ОН, СН 2NН-серина, СО 2 СН 3, CONHC6H5,CH2NHCO2C6H5, CH2NHCO2CH3, CH2N3, CONHC2H5, СН 2NH-глицина, CON(CH3)2, -CH2NHCO2-,CONH2, CONHC3H7, CH2NH-cepинa, CH2SOCH3, CH=NOH, СН 2NH-пролина, CH2CH2(2-пиридила),CH=NNHC(=NH)NH2, CONH(CH2)2OH, CH=NNHCONH2, CH2OCOCH3, -CH2OC(CH3)2O-, CH2SC6H5,CH2SOC6H5, СО 2 Н-гексила, CONHCH3 и CO2(CH2)4CH3; или одной из следующих формул: и R выбирается из группы, состоящей из ОН и ОСН 3. В предпочтительных вариантах изобретения Z1 и Z2 являются Н, X представляет собой СО 2 СН 3, R1 означает NHCONHC2H5, R2 означает СН 2 СН 2(2-пиридил) и R означает ОН. В других предпочтительных вариантах изобретения Z1 и Z2 являются Н, X представляет собой СО 2 СН 3, R1 и R2 представляют собой СН 2 ОСН 2 ОСН 2 СН 3 и R означает ОН; или Z1 и Z2 являются Н, X представляет собой СО 2 СН 3, R1 и R2 представляют собой CH2SCH2CH3, и R означает ОН; или Z1, Z2, R1 и R2 являются Н, X означает СО 2 СН 3,и R означает ОН; или Z1, Z2, R1 и R2 являются Н, X означает СO2(СН 2)4 СН 3, и R означает ОН; или Z1, Z2 иR1 являются Н, R2 представляет собой СН 2 ОН, X означает СО 2 СН 3, и R означает ОН; или Z1 и Z2 являются Н, R1 и R2. представляют собой H2S[3-(1,2,4-триазин)], X означает СО 2 СН 3, и R означает ОН; или Z1 иZ2 являются Н, R1 является Br, R2 является I, X означает СО 2 СН 3, и R означает ОН; или Z1 и Z2 являются Н, R1 и R2 представляют собой CH2CH2SCH3, X означает СО 2 СН 3, и R означает ОН; или Z1, Z2, R1 и R2 являются Н, X означает СО 2 СН 3, и R означает ОСН 3; или Z1 и Z2 вместе образуют =O, R1 и R2 являются Вr, X означает СО 2 СН 3, и R означает ОН. Направлением части данного изобретения также являются способы модулирования активности белка MLK, включающие в себя контактирование белка, или клетки, содержащей белок, с соединением,имеющим формулу II, приведенную ниже где кольцо В и кольцо F независимо и каждое вместе с атомами углерода, с которыми они связаны, выбираются из группы, состоящей из: а) ненасыщенного 6-членного карбоциклического ароматического кольца, в котором от 1 до 3 атомов углерода могут быть замещены атомами азота;b) ненасыщенного 5-членного карбоциклического ароматического кольца иc) ненасыщенного 5-членного карбоциклического ароматического кольца, в котором либо 1) один атом углерода замещен атомом кислорода, азота или серы; 2) два атома углерода замещены атомами серы и азота, атомами кислорода и азота или двумя атомами азота; либо 3) три атома углерода замещены тремя атомами азота;a) Н, замещенного или незамещенного алкила, имеющего от 1 до 4 углеродов, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероарила или замещенного или незамещенного гетероарилалкила;d) -C(=O)NH2, -NR11R12, -(CH2)рNR11R12, -(CH2)рOR10, -(CH2)рOR10 и -O(CH)рNR11R12, где р равно от 1 до 4; и где либо 1) каждый из радикалов R11 и R12 независимо выбирается из группы, состоящей из Н и алкила,имеющего от 1 до 4 углеродов; либо 2) R11 и R12 вместе образуют связанную группу формулы -(СН 2)2-Х 1-(СН 2)2-, где X1 выбирается из группы, состоящей из -O-, -S- и -СН 2-;R2 выбирается из группы, состоящей из Н, алкила, имеющего от 1 до 4 углеродов, -ОН, алкоксигруппы, имеющей от 1 до 4 углеродов, -OC(=O)R9, -ОС(=O)NR11R12, -О(СН 2)pNR11R12, -О(СН 2)pOR10, замещенного или незамещенного арилалкила, имеющего от 6 до 10 углеродов, и замещенного или незамещенного гетероарилалкила; каждый из радикалов R3, R4, R5 и R6 независимо выбирается из группы, состоящей из:b) -CH2OR14, где R14 является остатком аминокислоты после удаления гидроксила карбоксильной группы;e) алкила, имеющего от 1 до 8 углеродов, алкенила, имеющего от 2 до 8 углеродов, и алкинила,имеющего от 2 до 8 углеродов, где 1) каждая из алкильной, алкенильной или алкинильной группы незамещена; или 2) каждая из алкильной, алкенильной или алкинильной группы замещена группами в количестве от 1 до 3, выбранными из группы, состоящей из арила, имеющего от 6 до 10 углеродов, гетероарила, арилалкоксигруппы, гетероциклоалкоксигруппы, гидроксиалкоксигруппы, алкилоксиалкоксигруппы, гидроксиалкилтиогруппы, алкоксиалкилтиогруппы, F, Cl, Br, I, -CN, -NO2, -ОН, -OR9, -X2(CH2)pNR11R12,-X2(СН 2)pС(=O)NR11R12,-X2(CH2)pOC(=O)NR11R12,-X2(CH2)pCO2R9,-X2(СН 2)pS(О)yR9,2 10 11 12 9 2 11 12X (СН 2)pNR C(=O)NR R , -ОС(=O)R , -OCONHR , -O-тетрагидропиранила, -NR R , -NR10C(=O)R9,-NR10CO2R9, -NR10C(=O)NR11R12, -NHC(=NH)NH2, NR10S(O)2R9, -S(O)yR9, -CO2R2, C(=O)NR11R12,-C(=O)R2, -CH2OR10, -CH=NNR2R2A, -CH=NOR2, -CH=NR9, -CH=NNHCH(N=NH)NH2, -S(=O)2NR2R2A,-P(=O)(OR10)2, -OR14 и моносахарида, имеющего от 5 до 7 углеродов, где каждая гидроксильная группа моносахарида независимо либо незамещена, либо замещена Н, алкилом, имеющим от 1 до 4 углеродов,алкилкарбонилоксигруппой, имеющей от 2 до 5 углеродов, или алкоксигруппой, имеющей от 1 до 4 уг-9 006648 леродов;X2 означает O, S или NR10 ; каждый из радикалов R7 и R8 независимо выбирается из группы, состоящей из Н, алкила, имеющего от 1 до 4 углеродов, алкоксигруппы, имеющей от 1 до 4 углеродов, замещенного или незамещенного арилалкила, имеющего от 6 до 10 углеродов, замещенного или незамещенного гетероарилалкила,-(CH2)pOR10, -(CH2)pOC(=O)NR11R12 и -(CH2)pNR11R12; или R7 и R8 вместе образуют связанную группу формулы -СН 2-Х 3-СН 2-, где X3 представляет собой X2 или связь; каждый из индексов m и n независимо равны 0, 1 или 2;Z выбирается из группы, состоящей из связи, -О-, -СН=СН-, -S-, -С(=О)-, -CH(OR10)-, -N(R10)-,-N(OR10)-, CH(NR11R12)-, -C(=O)N(R17)-, -N(R17)С(=O)-, -N(S(O)yR9)-, -N(S(O)yNR11R12)-, -N(C(=O)R17)-,-C(R15R16)-, -N+(O-)(R10)-, -CH(OH)-CH(OH)- и -CH(O(C=O)R9)CH(OC(=O)R9A)-, где R9A представляет собой то же, что и R9;R15 и R16 независимо выбираются из группы, состоящей из Н, -ОН, -C(=O)R10, -O(C=O)R9, гидроксиалкила и -CO2R10;R17 выбирается из группы, состоящей из Н, алкила, арила и гетероарила; А 1 и А 2 выбираются из группы, состоящей из Н,Н; H,OR2; H,-SR2; H,-N(R2)2; и группы, в которой А 1 2 и А вместе образуют фрагмент, выбранный из группы, состоящей из =O, =S и =NR2; В 1 и В 2 выбираются из группы, состоящей из Н,Н; Н,-OR2; H,-SR2; H,-N(R2)2; и группы, в которой 1 В и В 2 вместе образуют фрагмент, выбранный из группы, состоящей из =O, =S и =NR2; при условии, что по меньшей мере одна из пар А 1 и А 2 или В 1 и В 2 образует =O. Частично данное изоберетение направлено также на способы модулирования активности белкаMLK, включающие в себя контактирование белка или клетки, содержащей белок, с соединением, имеющим формулу IV, приведенную нижеR4 означает Н, СН 2 СН=СН 2 или СН 2 СН 2 СН 2 ОН. В предпочтительных вариантах изобретения R1, R2, R4, Z1 и Z2 являются H, и R3 означает СН 2 СН=СН 2. В других предпочтительных вариантах изобретения R1 является Вr и R2, R3, R4, Z1 и Z2 являются Н; или R1, R2, Z1 и Z2 являются Н и R3 и R4 означают СН 2 СН=СН 2; или R1, R2, R3, Z1 и Z2 являются Н и R4 означает СН 2 СН=СН 2; или R1, R2, Z1 и Z2 являются Н, и R3 и R4 означают СН 2 СН 2 СН 2 ОН; или Данное изобретение также предоставляет способы идентификации соединений, которые могут быть пригодны при лечении нейродегенеративных заболеваний, включающие в себя контактирование клетки или клеточного экстракта, содержащего киназный белок множественных линий, с соединением, и определении того, снижает ли соединение активность киназного белка множественных линий. Клетки и их экстракты включают в себя такие, которые описаны выше. Соединения, которые выявляются данными способами (т.е. те соединения, которые ингибируют или снижают активность киназного белка множественных линий) могут быть пригодны для лечения нейродегенеративных заболеваний. Белок предпочтительно выбирается из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6. Клетку подвергают контакту in vitro или invivo. Предпочтительно активность белка определяют путем измерения активности или уровня фосфорилирования субстрата указанного белка. Предпочтительно субстрат выбирается из группы, состоящей изJNK1, JNK2, JNK3, ERK1, ERK2, р 38, р 38, р 38, р 38, MEKl, MEK2, МKK3, МKK4 (SEK1), МЕK5,- 10006648 МKK6, МKK7, jun, ATF2, ELK1 и гомолога АЕХ-3 млекопитающих, а также общих Ser/Thr субстратов,таких, например, как основной белок миелина (МBР). Активность белка также может быть определена путем измерения активности субстрата белка, количества субстрата белка, или мРНК, кодирующей субстрат белка. Активность белка также может быть определена путем анализа киназы in vitro или анализа связывания. Клетками предпочтительно являются первичные эмбриональные клетки мотонейронов,клетки, которые сверхэкспрессируют киназный белок множественных линий, или нервная клетка, но может быть любая клетка или клеточный экстракт. Предпочтительно идентифицируются соединения,которые непосредственно связывают киназный белок множественных линий, как описано выше. Данное изобретение также предоставляет способы идентификации соединений, которые могут быть пригодны при лечении воспаления, включающие в себя контактирование клетки или клеточного экстракта, содержащего киназный белок множественных линий, с соединением, и определении того, снижает ли соединение активность киназного белка множественных линий. Клетки и их экстракты включают в себя такие, которые описаны выше. Соединения, которые обнаруживаются данными способами (т.е. те соединения, которые ингибируют или снижают активность киназного белка множественных линий) могут быть пригодны для лечения воспаления. Белок предпочтительно выбирается из группы, состоящей из киназы множественных линий 1, киназы множественных линий 2, киназы множественных линий 3, киназы, несущей лейциновую молнию, киназы, несущей двойную лейциновую молнию, и киназы множественных линий 6. Клетку подвергают контакту in vitro или in vivo. Предпочтительно активность белка определяют путем измерения активности или уровня фосфорилирования субстрата указанного белка. Предпочтительно субстрат выбирается из группы, состоящей из JNK1, JNK2, JNK3, ERK1, ERK2, р 38,р 38, р 38, р 38, МЕK1, МЕK2, МKK3, МKK4 (SEK1), МЕK5, МKK6, МKK7, jun, ATF2, ELK1 и гомолога АЕХ-3 млекопитающих, а также общих Ser/Thr субстратов, таких, например, как основной белок миелина (МBР). Активность белка также может быть определена путем измерения активности субстрата белка, количества субстрата белка или мРНК, кодирующей субстрат белка. Активность белка также может быть определена путем анализа киназы in vitro или анализа связывания. Клетками предпочтительно являются первичные эмбриональные клетки мотонейронов, клетки, которые сверхэкспрессируют киназный белок множественных линий, или нервная клетка, но может быть любая клетка или клеточный экстракт. Клетки также включают в себя, не ограничиваясь этим, клетки,участвующие в воспалении, такие, например, как лимфоциты, макрофаги и другие лейкоциты, хорошо известные специалистам в данной области. Предпочтительно идентифицируются соединения, которые непосредственно связывают киназный белок множественных линий. Данное изобретение также предоставляет способы лечения млекопитающего, болеющего или предположительно болеющего нейродегенеративным заболеванием, включающие в себя введение млекопитающему соединения, которое ингибирует или снижает активность киназного белка множественных линий. Соединения, которые ингибируют или снижают активность киназного белка множественных линий,включают в себя, не ограничиваясь этим, соединения, имеющие формулы I, II, III и IV. Предпочтительные соединения включают в себя соединения, приведенные выше в описании, которые касаются способа скрининга соединений, которые модулируют активность киназного белка множественных линий, и либо повышают выживаемость клеток, либо стимулируют гибель клеток. Предпочтительным млекопитающим является человек. Можно предполагать, что у человека имеется нейродегенеративное заболевание, если у человека есть симптомы конкретного нейродегенеративного заболевания, он относится к группе повышенного риска, или имеется нейродегенеративное заболевание в истории семьи. Данное изобретение также предоставляет способы лечения млекопитающего при воспалении,включающие в себя введение указанному млекопитающему соединения, которое ингибирует или снижает активность киназного белка множественных линий. Соединение, которое ингибирует или снижает активность киназного белка множественных линий, включает в себя, не ограничиваясь этим, соединения,имеющие формулы I, II, III и IV. Предпочтительные соединения включают в себя соединения, приведенные выше в описании, в связи со способом скрининга соединений, которые модулируют активность киназного белка множественных линий и либо повышают выживаемость клеток, либо стимулируют гибель клеток. Предпочтительным млекопитающим является человек. Контактирование с соединениями, имеющими формулы I-IV, может происходить в буферах или средах, которые хорошо известны специалистам в данной области. В альтернативном случае контактирование может осуществляться путем введения фармакологической композиции, содержащей тестируемое соединение и фармацевтически приемлемую соль, носитель или разбавитель, подходящему животному или млекопитающему, такому, например, как мышь или другое пригодное животное, известное специалистам в данной области. Кроме того, могут быть использованы варьирующие количества клеток и концентраций соединений. Клетками, которые подвергаются контакту с тестируемыми соединениями,могут быть любые клетки млекопитающих. Предпочтительно клеткой является нервная клетка. Предпочтительно клетка вовлечена в такое нейродегенеративное заболевание, как, например, болезнь Альцгеймера, заболевание мотонейронов, боковой амиотрофический склероз, болезнь Паркинсона, цереброваскулярное заболевание, ишемические состояния, деменцию при СПИДе, эпилепсию, болезнь Гентингто- 11006648 на и повреждение при сотрясении или проникающее ранение головного или спинного мозга. Соединения, имеющие формулу I, и способы их получения описаны в патенте США 5705511, который включен здесь в виде ссылки в полном объеме. Соединения, имеющие формулу III, и способы их получения описаны в патентах США 57418098, 5621100, 5621101, 5461146 и 5756494 и WO 97/46567, каждый из которых включен здесь в виде ссылки в полном объеме. Соединения, имеющие формулу IV, и способы их получения описаны в патентах США 57418098, 5621100, 5 621101, 5461146 и 5756494 и WO 97/46567,каждый из которых включен здесь в виде ссылки в полном объеме. Соединения, имеющие формулу II, включают в себя диастереомеры и энантиомеры у атомов углерода, с которыми связаны заместители R2, R7 и R8. Предпочтительными инденопирролокарбазолами с мостиковой связью являются соединения, представленные формулой II В некоторых предпочтительных вариантах соединений формулы II R1 является Н. В дополнительных предпочтительных вариантах R2 является Н, гидроксилом или замещенным или незамещенным алкилом. В других предпочтительных вариантах R3, R4, R5 и R6 независимо представляют собой Н, замещенный или незамещенный алкил, галоген, замещенную или незамещенную алкоксигруппу, замещенную или незамещенную аминогруппу или замещенный или незамещенный арил. В следующих предпочтительных вариантах R7 и R8 независимо являются Н или замещенным или незамещенным алкилом. В некоторых предпочтительных вариантах Y означает О. В дополнительных предпочтительных вариантах Z означает связь, О, S или замещенный или незамещенный N. В других дополнительных предпочтительных вариантах m и n независимо равны 1 или 2. В некоторых особо предпочтительных вариантах Y означает О, Z означает связь или О и m и n независимо равны 1 или 2. В следующих предпочтительных вариантах А 1 А 2 и В 1 В 2 являются =O или Н,Н. В некоторых особо предпочтительных вариантах каждый из R1, R4, R6 и R7 является Н, Y означает=O, n равно 1, А 1 А 2 и В 1 В 2 являются =O или Н,Н, R2 является Н, ОН или низшим алкилом, R3 является Н или замещенным алкилом, каждый из R5 и R8 является Н или алкоксигруппой, причем метоксигруппа является предпочтительной, Z означает связь или O, и m равно 1 или 2. Некоторыми особенно предпочтительными вариантами соединений формулы II являются соединения II-1, II-2, II-3, II-4 а, II-4b, II-5, II-6, II-7a, II-7b, II-8, II-9, II-10, II-11 и II-12, представленные ниже в табл. 1. Соединения, представленные формулой II в дальнейшем называются соединениями (II). В используемом здесь смысле термин карбоциклическая относится к циклическим группам, в которых циклическая часть состоит только из атомов углерода. Термины гетероцикло и гетероциклическая относятся к циклическим группам, в которых циклическая часть включает в себя по меньшей мере один гетероатом, такой как O, N или S. В используемом здесь смысле термин алкил означает алкильную группу с неразветвленной цепью, циклическую алкильную группу или алкильную группу с разветвленной цепью, имеющую от 1 до 8 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил,пентил, изоамил, неопентил, 1-этилпропил, гексил, октил, циклопропил и циклопентил. Алкильный фрагмент алкилсодержащих групп, таких как алкоксигруппы, алкоксикарбонильные группы и алкиламинокарбонильные группы, имеет такое же значение, как и алкил, определенный выше. Низшими алькильными группами, которые предпочтительны, являются алкильные группы, которым дано определение выше и которые содержат от 1 до 4 углеродов. Термин алкенил означает группы, включающие в себя неразветвленные или разветвленные углеводородные цепи, имеющие по меньшей мере одну двойную связь углерод-углерод. Примеры алкенильных групп включают в себя этенильную и пропенильную группы. В используемом здесь смысле термин алкинил означает группы, включающие в себя неразветвленные или разветвленные углеводородные цепи, имеющие по меньшей мере одну тройную связь углерод-углерод. Примеры алкинильных групп включают в себя этинильную и пропинильную группы.- 12006648 Ацильный фрагмент ацилсодержащих групп, таких как ацилоксигруппы означает группы, включающие в себя неразветвленную или разветвленную алканоильную группу, имеющую от 1 до 6 атомов углерода, такие как формил, ацетил, пропаноил, бутирил, валерил, пивалоил или гексаноил. В используемом здесь смысле термин арил означает группу, имеющую от 6 до 12 атомов углерода, такую как фенил, бифенил и нафтил. Предпочтительные арильные группы включают в себя незамещенные или замещенные фенильные и нафтильные группы. В используемом смысле термин гетероарил означает арильную группу, в которой один или большее количество атомов углерода кольца замещены гетероатомом (т.е. не углеродным атомом), таким как О, N или S. Предпочтительные гетероарильные группы включают в себя группы пиридила, пиримидила, пирролила, фурила, тиенила, имидазолила,триазолила, тетразолила, хинолила, изохинолила, бензоимидазолила, тиазолила, пиразолила и бензотиазолила. Термин аралкил (или арилалкил) предназначен для обозначения группы, имеющей от 7 до 15 углеродов, состоящей из алкильной группы, которая несет арильную группу. Примеры аралкильных групп включают в себя бензильную, фенетильную, бензгидрильную и нафтилметильную группы. Алкильные группы и алкильные фрагменты, находящиеся в замещающих группах, таких как аралкил, алкоксигруппа, арилалкоксигруппа, гидроксиалкоксигруппа, алкоксиалкоксигруппа, гидроксиалкилтиогруппа, алкоксиалкилтиогруппа, алкилкарбонилоксигруппа, гидроксиалкил и ацилоксигруппа могут быть замещенными или незамещенными. Замещенная алкильная группа имеет от 1 до 3 независимо выбранных заместителей, предпочтительно гидроксигруппу, низшую алкоксигруппу, низшую алкоксиалкоксигруппу, замещенную или незамещенную арилалкокси-низшую алкоксигруппу, замещенную или незамещенную гетероарилалкокси-низшую алкоксигруппу, замешенную или незамещенную арилалкоксигруппу, замещенную или незамещенную гетероциклоалкоксигруппу, галоген, карбоксил, низший алкоксикарбонил, нитрогруппу, аминогруппу, моно- или динизшую алкиламиногруппу, диоксолан, диоксан, дитиолан, дитион, фуран, лактон или лактам. Каждая из замещенных арильных, замещенных гетероарильных и замещенных аралкильных групп имеет от 1 до 3 независимо выбранных заместителей, которыми предпочтительно являются низший алкил, гидроксигруппа, низшая алкоксигруппа, карбоксигруппа, низший алкоксикарбонил, нитрогруппа,аминогруппа, моно- или динизшая алкиламиногруппа и галоген. Гетероциклические группы, образованные с участием атома азота, включают в себя пирролидинил,пиперидинил, пиперидиногруппу, морфолинил, морфолиногруппу, тиоморфолиногруппу, Nметилпиперазинил, индолил, изоиндолил, имидазол, имидазолин, оксазолин, оксазол, триазол, тиазолин,тиазол, пиразол, пиразолон и триазол. Гетероциклические группы, образованные с участием атома кислорода, включают в себя фурановую, тетрагидрофурановую, пирановую и тетрагидропирановую группы. Гидроксиалкильными группами являются алкильные группы, которые имеют дополнительно присоединенную гидроксильную группу. Галогены включают в себя фтор, хлор, бром и иод. В используемом здесь смысле гетероарилалкил означает арилалкильную группу, которая содержит гетероатом. Термин окси означает наличие атома кислорода. Таким образом, алкокси группами являются алкильные группы, которые присоединяются посредством атома кислорода, и карбонилокси группами являются карбонильные группы, которые присоединяются посредством атома кислорода. Термин гетероциклоалкокси означает алкоксигруппу, которая имеет гетероциклическую группу,присоединенную к ее алкильному фрагменту, и термин арилалкокси означает алкоксигруппу, которая имеет арильную группу, присоединенную к ее алкильному фрагменту. Термин алкилкарбонилокси означает группу формулы -O-С(=O)-алкил. В использованном здесь смысле термин алкилоксиалкокси означает алкоксигруппу, которая содержит алкилоксизаместитель, присоединенный к ее алкильному фрагменту. Термин алкоксиалкилтио означает алкилтиогруппу (т.е. группу формулы -S-алкил), которая содержит алкоксизаместитель, присоединенный к ее алкильному фрагменту. Термин гидроксиалкилтио означает алкилтиогруппу (т.е. группу формулы -S-алкил), которая содержит гидроксильный заместитель, присоединенный к ее алкильному фрагменту. В используемом здесь смысле термин моносахарид имеет свое обычное значение, как простой сахар. В используемом здесь смысле термин аминокислота означает молекулу, содержащую как аминогруппу, так и карбоксильную группу. Варианты аминокислот включают в себя -аминокислоты, т.е. карбоновые кислоты общей формулы НООС-СН(NH2) - (боковая цепь). Боковые цепи аминокислот включают в себя фрагменты природного происхождения и неприродного происхождения. Боковые аминокислотные цепи неприродного происхождения (т.е. несвойственные) являются фрагментами, которые используются вместо боковых цепей аминокислот природного происхождения, например, в аналогах аминокислот. См., например, публикацию Lehninger, Biochemistry, Second Edition, Worth Publishers, Inc, 1975, pages 73-75, включенную здесь в виде ссылки. Предпочтительные -аминоксилоты включают в себя глицин, аланин, пролин, глутаминовую ки- 13006648 слоту и лизин, имеющие D конфигурацию, L-конфигурацию или представленные в виде рацемата. Боковые цепи следующих типичных -аминоксилот показаны ниже в табл. 1. Таблица 1 В некоторых предпочтительных вариантах замещающие группы для соединений формулы II включают в себя остаток аминокислоты после удаления из нее гидроксильного фрагмента карбоксильной группы, т.е. группы формулы -С(=O)-СН(NH2) - (боковая цепь). Функциональные группы, присутствующие в соединениях формулы II, могут содержать защитные группы. Например, боковые цепи аминокислотных заместителей соединений формулы II могут быть замещены такими защитными группами, как бензилоксикарбонильная или трет-бутоксикарбонильная группы. Защитные группы по сути известны как функциональные химические группы, которые можно избирательно присоединять и отсоединять от функциональных групп, таких как гидроксильные группы и карбоксильные группы. Эти группы вводятся в химическое соединение, чтобы сделать такие функциональные группы инертными к условиям химических реакций, которым подвергается соединение. Одной из таких защитных групп является бензилоксикарбонильная (Cbz; Z) группа. Другие предпочтительные защитные группы согласно изобретению могут быть найдены в Greene, T.W. and Wuts, P.G.M., "ProtectiveGroups in Organic Synthesis" 2d. Ed., WileySons, 1991. Соединения инденопирролокарбазолов с мостиковой связью обладают очевидными важными функциональными фармакологическими активностями, которые находят применение в различных сферах, включая как исследовательскую, так и терапевтическую область. Эти производные пригодны в качестве терапевтических средств. Активности соединений проявляют положительные воздействия на функционирование и/или выживаемость клеток, отвечающих на трофические факторы. Влияние на функционирование и/или выживаемость клеток, отвечающих на трофические факторы, например, клеток нейронной линии, показано с помощью каждого из следующих исследований: (1) анализа холинацетилтрансферазы (ХАТ) в культивируемых нейронах спинного мозга; или (2) анализа ХАТ активности культивируемых базальных нейронов переднего мозга. В используемом здесь смысле термин влияние, применяемый для случая модификации процессов, обозначаемых терминами функционирование и выживаемость, означает позитивное или негативное изменение или перемену. Влияние, которое является позитивным, может называться повышением или усилением, и влияние, которое является негативным, может называться ингибированием или подавлением. В используемом здесь смысле термины повышать или повышение, применяемые для случая модификации процессов, обозначаемых терминами функционирование и выживаемость, означают,- 14006648 что присутствие соединения инденопирролокарбазола с мостиковой связью оказывает позитивное воздействие на функционирование и/или выживаемость клетки, отвечающей на трофические факторы, по сравнению с клеткой в отсутствие соединения. Например, но не с целью ограничения, что касается выживаемости, например, холинэргического нейрона, то соединение будет способствовать повышению выживаемости популяции холинэргических нейронов при риске гибели (вследствие, например, травмы,болезненного состояния, дегенеративного состояния или естественного прогрессирования) по сравнению с популяцией холинэргических нейронов, не экспонированных с таким соединением, если обработанная популяция будет иметь сравнительно больший период функциональной активности, чем необработанная популяция. В используемом здесь смысле ингибировать и ингибирование означает, что конкретный ответ намеченного для исследования материала (например, энзиматическая активность) сравнительно снижен в присутствии инденопирролокарбазолового соединения с мостиковой связью. В используемом здесь смысле термин "trk" относится к семейству нейротрофических рецепторов с высоким сродством, в настоящее время включающему в себя trkA, trkB и trkC и другие ассоциированные с мембраной белки, с которыми может связываться нейротрофин. В используемом здесь смысле ингибирование VEGFR предполагает применение, например, при заболеваниях, в которых важную роль играет ангиогенез, таких как твердые раковые опухоли, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, а также другие глазные болезни и раковые заболевания. Ингибирование trk предполагает, например, применение при заболеваниях простаты, таких как рак простаты и доброкачественная гиперплазия простаты, и для лечения боли при воспалении. Ингибирование рецептора фактора роста, полученного из тромбоцитов (PDGFR), предполагает применение, например, при различных формах неоплазии, ревматоидном артрите, фиброзе легких, миелофиброзе, аномальном заживлении ран, заболеваний, заканчивающихся сердечно-сосудистыми явлениями, таких как атеросклероз, рестеноз, рестеноз после пластической операции на сосудах и т.д. В используемом здесь смысле термины рак и канцерогенный относится к любой злокачественной пролиферации клеток млекопитающих. Примеры включают в себя рак простаты, доброкачественную гиперплазию простаты, рак яичника, молочной железы, мозга, легкого, поджелудочной железы, толстой и прямой кишки, желудка, брюшной полости, твердые опухоли, рак головы и шеи, нейробластому, почечно-клеточный рак, лимфому, лейкоз, другие распознаваемые злокачественные процессы в гематопоэтических системах и другие распознаваемые раковые заболевания. В используемом здесь смысле термины нейрон, клетка нейронной линии и нейронная клетка включают в себя, не ограничиваясь этим, гетерогенную популяцию типов нейронов, имеющую единственный или множество медиаторов и/или единственную или множество функций; предпочтительно это холинэргические и чувствительные нейроны. В используемом здесь смысле фраза холинэргический нейрон означает нейроны центральной нервной системы (ЦНС) и периферической нервной системы(ПНС), нейромедиатором которых является ацетилхолин; типичными являются базальные нейроны переднего мозга, нейроны полосатого тела и спинного мозга. В используемом здесь смысле фраза чувствительный нейрон включает в себя нейроны, реагирующие на сигналы окружающей среды (например,температуру, движение), поступающие, например, от кожи, мышцы и суставов; типичным является нейрон ганглия дорсального корешка. Клетка, отвечающая на трофические факторы, определяется здесь как клетка, которая содержит рецептор, с которым может специфично связываться трофический фактор; примеры включают в себя нейроны (например, холинэргические и чувствительные нейроны) и не нейронные клетки (например,моноциты и неопластические клетки). Описанные здесь соединения инденопирролокарбазолов с мостиковой связью находят применение как в исследовательской области, так и в области терапии, например, для ингибирования активности ферментов. Например, в области научных исследований соединения могут применяться для разработки методов анализа и моделей для дальнейшего углубления представления о тех ролях, которые играет ингибирование серин/треониновой или тирозиновой протеинкиназы (например, РKС, trk тирозинкиназы) в механистических аспектах ассоциированных расстройств и заболеваний. В области терапии соединения,которые ингибируют эти энзиматические активности, могут применяться для того, чтобы ингибировать опасные последствия действия этих ферментов, касающиеся таких заболеваний как рак. В качестве примеров ниже показано, что ингибирование энзиматической активности с использованием соединений инденопирролокарбазолов с мостиковой связью можно определять, например, с помощью следующих анализов: 1. Анализ ингибирования активности тирозинкиназы trkA; 2. Ингибирование NGF-стимулированного фосфорилирования trk в препарате целых клеток; 3. Анализ ингибирования киназы рецептора фактора эндотелиального роста сосудов (VEGFR); 4. Анализ ингибирования активности РKС; 5. Анализ ингибирования PDGFR. Заявленные соединения инденопирролокарбазолов с мостиковой связью могут быть использованы- 15006648 для усиления функционирования и/или выживаемости клеток нейронной линии млекопитающих, например, человека. В этом контексте соединения могут быть использованы отдельно или с другими конденсированными пирролокарбазолами и/или индолокарбазолами или в комбинации с другими молекулами целебного действия, которые также проявляют способность влиять на функционирование и/или выживаемость указанной клетки. Многие неврологические расстройства характеризуются наличием нейронных клеток, которые представляют собой умирающие, поврежденные клетки, клетки с функциональными нарушениями, претерпевающие дегенерацию аксонов, с риском гибели и т.д. Эти расстройства включают в себя, не ограничиваясь этим болезнь Альцгеймера; нарушения мотонейронов (например, боковой амиотрофический склероз); болезнь Паркинсона, цереброваскулярные нарушения (например, инсульт, ишемия); болезнь Гентингтона; деменцию при СПИДе; эпилепсию; множественный склероз; периферические невропатии(например, затрагивающие DRG нейроны при периферической невропатии, ассоциированной с химиотерапией), включая диабетическую невропатию; расстройства, индуцированные стимулирующими аминокислотами; и расстройства, ассоциированные с повреждениями при сотрясении или проникающими ранениями головного или спинного мозга. ХАТ катализирует синтез нейромедиатора ацетилхолина, и он считается энзиматическим маркером функционального холинэргического нейрона. Функциональный нейрон также способен к выживанию. Выживание нейронов анализируется путем количественной оценки специфичного поглощения и ферментативного превращения красителя (например, кальцеина AM) живыми нейронами. Описанные здесь соединения, включая соединения, идентифицированные описанными здесь способами, благодаря своим разнообразным применениям находят использование в различных сферах. Соединения могут быть использованы для разработки in vitro моделей выживаемости, функционирования,идентификации нейронных клеток или для скрининга других синтетических соединений, которые обладают активностями, сходными с активностями описанных здесь соединений, или соединений, идентифицируемых описанными здесь способами. Описанные здесь соединения, а также соединения, идентифицированные с помощью описанных здесь способов, могут быть использованы в области научных исследований, чтобы изучить, охарактеризовать и определить молекулярные мишени, связанные с функциональными ответами. Например, путем радиоактивного мечения соединения инденопирролокарбазола с мостиковой связью или соединения, идентифицированного описанными здесь способами, связанного со специфичной клеточной функцией (например, митогенезом), может быть идентифицирована, выделена и очищена для характеристики мишень организма, с которой связывается производное. Соединения, которые здесь описаны, а также соединения, идентифицированные с применением описанных здесь способов, между прочим, пригодны не только для усиления индуцированных трофическими факторами активностей клеток, отвечающих на трофические факторы, например, холинэргических нейронов, но также могут функционировать в качестве средств, повышающих выживаемость нейронных клеток других типов, например, допаминэргических или глутаматэргических. Фактор роста может регулировать выживаемость нейронов посредством каскадов передачи сигнала вниз по течению от малых ГТФ-связывающих белков, которые включают в себя, не ограничиваясь этим, ras, rас и cdc42(Denhardt, Biochem. J., 1996, 318, 729). В частности, активация ras приводит к фосфорилированию и активации активируемой внеклеточным рецептором киназы (ERK), которая связана с процессами биологического роста и дифференцировки. Стимулирование rac/cdc42 приводит к увеличению активности JNK и р 38, ответы которых связаны со стрессом, апоптозом и воспалением. Хотя ответы на фактор роста в основном осуществляются посредством ERK пути, воздействие на эти последние процессы может приводить к альтернативным механизмам выживаемости нейронов, которые могут имитировать свойства фактора роста в повышении выживаемости (Xia et al., Science, 1995, 270, 1326). Соединения также могут функционировать как средства, повышающие выживаемость нейронных и не нейронных клеток посредством механизмов близких, но в то же время отличных от опосредованной фактором роста выживаемости, например, путем ингибирования путей JNK и р 38, которое может приводить к выживаемости за счет ингибирования процессов апоптотической гибели клеток. Данные соединения пригодны для лечения расстройств, связанных с пониженной активностью ХАТ или гибелью, повреждением мотонейронов спинного мозга, а также применимы, например, при заболеваниях, связанных с апоптотической гибелью клеток центральной и периферической нервной системы,иммунной системы и при воспалительных заболеваниях. Описанные здесь соединения также могут находить применение при лечении патологических состояний, в которые вовлечена злокачественная пролиферация клеток, таких как многие виды рака. Фармацевтически приемлемые соли описанных здесь соединений, а также соединений, идентифицированных представленными способами, включают в себя фармацевтически приемлемые соли присоединения кислот, соли металлов, соли аммония, соли присоединения органических аминов и соли присоединения аминокислот. Примерами солей присоединения кислот являются соли присоединения неорганических кислот, такие как гидрохлорид, сульфат и фосфат, и соли присоединения органических кислот,такие как ацетат, малеат, фумарат, тартрат, цитрат и лактат; примерами солей металлов являются соли щелочных металлов, такие как литиевая соль, натриевая соль и калиевая соль, соли щелочно-земельных- 16006648 металлов, такие как соль магния и соль кальция, соль алюминия и соль цинка; примерами солей аммония являются соль аммония и соль тетраметиламмония; примерами солей присоединения органических аминов являются соли с морфолином и пиперидином; и примерами солей присоединения аминокислот являются соли с глицином, фенилаланином, глутаминовой кислотой и лизином. Предоставленные здесь соединения, включая соединения, идентифицируемые данными способами,могут быть включены в состав фармацевтических композиций путем смешивания с фармацевтически приемлемыми нетоксичными наполнителями и носителями. Такие композиции могут быть приготовлены для применения при парентеральном введении, в частности в виде жидких растворов или суспензий; или для перорального введения, в частности в форме таблеток или капсул; или интраназально, в частности в виде порошков, носовых капель или аэрозолей; или дермально, например, посредством трансдермальных пластырей. Композицию можно удобно вводить в форме стандартных доз и можно приготовить любыми способами, хорошо известными в области фармации, например, как описано в Remington's PharmaceuticalSciences (Mack Pub. Co., Easton, PA, 1980). Композиции для парентерального введения могут содержать в качестве обычных наполнителей стерильную воду или раствор соли, полиалкиленгликоли, такие как полиэтиленгликоль, масла и имеющие растительное происхождение гидрогенизированные нафталины и им подобные. В частности, биосовместимый, биодеградируемый полимер лактида, сополимер лактида/гликолида или сополимеры полиоксиэтилена-полиоксипропилена могут быть пригодными наполнителями для того, чтобы контролировать высвобождение активных соединений. Другие потенциально пригодные системы парентеральной доставки этих активных соединений включают в себя частицы сополимера этилена-винилацетата, осмотические насосы, имплантируемые инфузионные системы и липосомы. Композиции для введения путем ингаляции в качестве наполнителей содержат, например, лактозу или могут представлять собой водные растворы, содержащие, например, эфир полиоксиэтилен-9 лаурила, гликохолат и дезоксихолат или масляные растворы для введения в виде носовых капель, или в виде геля, применяемого интраназально. Композиции для парентерального введения также могут включать в себя гликохолат для буккального введения, салицилат для ректального введения или лимонную кислоту для вагинального введения. Композиции для трансдермальных пластырей предпочтительно представляют собой липофильные эмульсии. Соединения данного изобретения могут применяться как единственное активное средство в фармацевтической композиции. В альтернативном случае они могут использоваться в комбинации с другими активными ингредиентами, например, другими факторами роста, которые способствуют выживаемости нейронов или регенерации аксонов при заболеваниях или расстройствах. Соединения данного изобретения или фармацевтически приемлемые соли этих соединений могут вводиться перорально или не перорально, например, в виде мази или инъекции. Концентрации соединений данного изобретения в терапевтической композиции могут варьировать. Концентрация будет зависеть от таких факторов как суммарная доза вводимого лекарственного средства, химические характеристики (например, гидрофобность) применяемых соединений, путь введения, возраст, вес тела и симптомы у пациента и т.д. Обычно соединения данного изобретения предоставляются в виде водного раствора в физиологическом буфере, содержащего примерно от 0,1 до 10% соединения, вес/объем, для парентерального введения. Обычными являются пределы доз примерно от 1 мкг/кг до 1 г/кг веса тела в сутки; предпочтителен предел доз примерно от 0,01 до 100 мг/кг веса тела в сутки и предпочтительно примерно от 0,1 до 20 мг/кг от одного до четырех раз в сутки. Предпочтительная доза вводимого лекарственного средства, вероятно, зависит от различных факторов, таких как тип и степень прогрессии болезни или расстройства, общий статус здоровья конкретного пациента, относительная биологическая эффективность выбранного соединения и введение в композицию наполнителя соединения, и путь его введения. Соединения согласно изобретению, включая тестируемое соединение и соединения, идентифицируемые способами данного изобретения, и фармацевтически приемлемые соли этих соединений могут вводиться отдельно или в виде различных фармацевтических композиций, в соответствии с фармакологической активностью и целями введения. Согласно данному изобретению фармацевтические композиции могут быть получены путем смешивания до однородности эффективного количества соединения или фармацевтически приемлемой соли этого соединения в качестве активного ингредиента с фармацевтически приемлемым носителем. Носитель может иметь широкий диапазон форм в соответствии с формами композиции, пригодной для введения. Желательно, чтобы такая фармацевтическая композиция готовилась в виде стандартных лекарственных доз, пригодных для перорального и не перорального введения. Формы для не перорального введения включают в себя мазь и инъекционный препарат. Таблетки могут быть приготовлены обычным способом с использованием таких наполнителей как лактоза, глюкоза, сахароза, маннит и метилцеллюлоза, дезинтегрирующих средств, таких как крахмал,альгинат натрия, кальций-карбоксиметилцеллюлоза и кристаллическая целлюлоза, смазывающих средств, таких как стеарат магния и тальк, связывающих веществ, таких как желатин, поливиниловый спирт, поливинилпирролидон, гидроксипропилцеллюлоза и метилцеллюлоза, поверхностно-активных веществ, таких как сложный эфир жирной кислоты и сахарозы и сложныйэфир жирной кислоты и сорбита и подобных веществ. Предпочтительно, чтобы каждая таблетка содержала 15-300 мг активного ин- 17006648 гредиента. Гранулы можно приготовить традиционным способом, используя наполнители, такие как лактоза и сахароза, дезинтегрирующие средства, такие как крахмал, связывающие вещества, такие как желатин и им подобные. Порошки можно приготовить традиционным способом, используя наполнители, такие как лактоза и маннит и им подобные. Капсулы можно приготовить традиционным способом, используя желатин, воду, сахарозу, аравийскую камедь, сорбит, глицерин, кристаллическую целлюлозу, стеарат магния, тальк и им подобные. Предпочтительно, чтобы каждая капсула содержала 15-300 мг активного ингредиента. Препараты в виде сиропов можно приготовить обычным способом, используя сахара, такие как сахароза, воду, этанол и им подобные. Мазь можно приготовить обычным способом, используя мазевую основу, такую как вазелин, жидкий парафин, ланолин и макроголь, эмульгаторы, такие как лауриллактат натрия, хлорид бензалкония,сложный моноэфир сорбитана и жирной кислоты, натриевая соль карбоксиметилцеллюлозы и аравийская камедь, и им подобные. Инъекционные препараты можно приготовить традиционным способом, используя растворители,такие как вода, физиологический раствор соли, растительные масла (например, оливковое масло и арахисовое масло), этилолеат и пропиленгликоль, солюбилизирующие средства, такие как бензоат натрия, салицилат натрия и уретан, средства, обеспечивающие изотоничность, такие как хлорид натрия и глюкоза,консерванты, такие как фенол, крезол, сложный эфир парагидроксибензойной кислоты и хлоробутанол,антиоксиданты, такие как аскорбиновая кислота и пиросульфат натрия, и им подобные. Далее изобретение иллюстрируется путем следующих примеров, которые предназначены для разъяснения изобретения. Эти примеры не предназначены и не рассматриваются как примеры, лимитирующие рамки заявки. Примеры Пример 1. Общее описание процессов синтеза и примеры. Общий путь синтеза, применяемый для получения инденопирролокарбазолов с мостиковой связью данного изобретения, имеющих формулу II, показан на фиг. 1 и 2. Общие процедуры синтеза инденопирролокарбазолов (III)/(VIII) могут быть выполнены, как описано в патенте США 5705511, публикация которого включена таким образом в виде ссылки в полном объеме. В том случае, когда R1 является Н,азот лактама инденопирролокарбазолов (III)/(VIII) защищают подходящей защитной группой, что приводит к (IV)/(IX). Защищенные соединения обрабатывают соответствующим основанием в безводном органическом растворителе(лях), в результате чего образуется темно-красный раствор, который, повидимому, является карбанионом. Результатом реакции карбаниона с бифункциональным реагентом (V) является электрофильное присоединение к C=Y связи соединения (V), приводящее к первичному промежуточному соединению (VI)/(X). Обработка промежуточного соединения(ий) (VI)(X) и/или (VII)/(XI) либо сульфокислотой, либо кислотой Льюиса, например, эфиратом трехфтористого бора, дает инденопирролокарбазолы с мостиковой связью (I)/(II). Стратегия защиты азота лактама (показанная на фиг. 3 и 4) может быть осуществлена с помощью процесса, катализируемого либо кислотой, либо основанием. Реакцию, катализируемую кислотой, можно проводить с реагентом, связанным со смолой, позволяющим иммобилизовать инденопирролокарбазол(III)/(VIII) на полимерном носителе, таком как основанная на полистироле кислая смола Ринка (XII) (фиг. 3), получая при этом (XIII). В альтернативном случае катализируемая кислотой реакция может быть проведена с растворимым реагентом, чтобы получить соединение (XIV) (фиг. 4). В условиях основного катализа получают защищенное силилом соединение (XV) (фиг. 4). На фиг. 5 описано несколько способов получения промежуточного соединения (V). Процедура (а) описывает превращения различных ацеталей (XVI) в (XVII, Z = связь). Например, сложный эфирацеталь/кеталь (XVI, D=COOR) полностью восстанавливают до соответствующего спирта и затем окисляют (например, окисление по Сверну или Десс-Мартину) до альдегидацеталя/кеталя (XVII, R8=H). В альтернативном случае сложный эфир-ацеталь/кеталь (XVI, D=COOR) частично восстанавливают с помощью DIBAL , чтобы непосредственно получить альдегид (XVII, R8=H). Сходным образом восстановление нитрилацеталя (XVI, D=CN) с помощью DIBAL дает альдегид (XVII, R8=H). Кетоацетали/кеталь получают добавлением реактивов Гриньяра к амиду Вейнреба-ацеталю/кеталю (XVI, D=CON(OMe)Me). Промежуточное соединение (XVII, Z=связь) также может быть получено с помощью двухстадийной процедуры, краткое содержание которой дано в описании процедуры (b). Добавление металлоорганического реагента (XIX) к ацеталю/кеталю (XVIII) дает алкен (XX), который при озонолизе с последующей восстанавливающей обработкой дает кетоацеталь/кеталь (XVII). Получение промежуточного соединения (XVII, Z = гетероатом) с помощью двухстадийной обработки кратко описано в процедуре (с). Сочетание ацеталя (XXII) с алкеном (XXI) с последующим озонолизом (с восстанавливающей обработкой) полученного в результате алкена дает кетоацеталь/кеталь (XVII). В альтернативном случае промежуточное соединение (XVII, Z=гетероатом) получают с помощью двухстадийной процедуры, кратко описанной в процедуре (d). Реакция соединения (XXIV) с ацеталем/кеталем (XVIII) дает (XXV), который превращают в кетоацеталь/кеталь (XVII) с помощью методов, описанных в процедуре (а). Конденсация- 18006648 кетоацетала/кеталя (XVII) с гидроксиламинами, гидразинами, N-алкил-N-алкоксиаминами и аминами дает промежуточное соединение (XXVI), обладающее электрофильной C=N функциональностью. Связанный со смолой инденопирролокарбазол (XIII) (фиг. 6, способ А) обрабатывают избытком реактива Гриньяра в качестве основания, результатом чего является образование темно-красного раствора карбаниона. Последующая реакция с (V) приводит к продуктам, полученным благодаря электрофильному присоединению к C=Y группе.Обработка водой и отщепление продукта(тов) от смолы разбавленной кислотой (1% ТФУ в метиленхлориде) в результате приводит к выделению соединения(ий) (XXVII) и/или (XXVIII). Обработка промежуточного соединения(ий) (XXVII) и/или (XXVIII) либо сульфокислотой, либо кислотой Льюиса, например, эфиратом трехфтористого бора, дает инденопирролокарбазолы с мостиковой связью (II). Сходная стратегия применяется для реакции растворимого промежуточного соединения с защищенным лактамом, например, (XV) (фиг. 7, способ В). Однако в этом случае промежуточное соединение(XV) обрабатывают тритоном В в пиридине в качестве основания, вместо реактива Гриньяра. Промежуточное соединение(ия) (XXIX) и/или (XXX) может быть выделено интактным с защитной группой лактама, которая поддается хроматографической очистке. Так же, как в способе А (фиг. 6), обработка кислотой Льюиса (такой как эфират трехфтористого бора) дает инденопирролокарбазолы с мостиковой связью(II), где R1 = Н. Введение групп R3, R4, R5 и R6 может быть выполнено, как описано в патентах США 5705511 и 4923986, публикации которых включены в виде ссылки в полном объеме. Заместитель R3 иначе может быть введен после конструирования инденопирролокарбазолов с мостиковой связью, как показано на фиг. 8. Положение 3 В кольца бромируют NBS, получая соединение (XXXI). Затем вводят углеродный фрагмент, используя катализируемые палладием реакции Стилла, Сузуки, Хека, Кумады или КастроСтефенса, чтобы получить соединения типа (XXXII), (XXXIII) и т.д. Кроме того, соединение (XXXI) может предоставить доступ к соединениям, в которых группа брома замещена гетероатомом, например,основанной на амине группой с применением химии катализируемого палладием аминирования Бухвальда. С помощью окислительного процесса связанная с кислородом группа может быть введена при углероде индена в Е кольце, как показано на фиг. 9, в соединении (XXXIV). Этот химический процесс также приводит в результате к окислению метиленовой группы лактама (А кольцо) давая, как показано,имидное производное. Пример 2. Получение промежуточных соединений, связанных со смолой Ринка (XIII-A), (XIII-B) и(XIII-C), (фиг. 3). Пример 2-А. В три узкогорлых круглодонных сосуда, оснащенных верхней механической мешалкой и ловушкой Дина Старка последовательно загружали кислую смолу Ринка XII (10,00 г, 0,64 ммоль/г), 1-метил-2 пирролидинон (80 мл), бензол (350 мл), VIII-A (A1, A2 = Н 2, В 1, В 2 = O, R3 = R4 = R5 = R6 = Н (3,00 г) и паратолуолсульфокислоту (1,00 г). Реакционную смесь нагревали с обратным холодильником в течение 20 ч и затем фильтровали. Полимер промывали ТГФ (5175 мл) и фильтрат отставляли. Затем полимер последовательно промывали ДМСО (4100 мл), 2% водным NaHCO3 (4100 мл), водой (4100 мл),ДМСО (2200 мл), ТГФ (4100 мл) и этилацетатом (4100 мл). Смолу сушили в вакууме (24 ч), получая 11,70 (0,47 ммоль/г) связанного со смолой VIII-A (XIII-A). Первичные ТГФ промывки выпаривали, остаток разбавляли водой (750 мл) и полученный в результате осадок отфильтровывали и последовательно промывали водой, 2% водным NаНСО 3 (4100 мл) и водой (4100 мл). После сушки в вакууме получали VIII-A (1,28 г). Пример 2-В. Сходным образом VIII-B (А 1, А 2 = О, В 1, В 2 = Н 2, R3 = R4 = R5 = R6 = Н) (0,5 г) связывали с кислой смолой Ринка XII (1,52 г), получая 1,58 г связанного со смолой VIII-B (XIII-B). Пример 2-С. Сходным образом VIII-C (А 1, А 2 = Н 2, В 1, В 2 = O, R3 = R4 = R5 = Н, R6 = 10-ОМе) (1,02 г) связывали с кислой смолой Ринка XII (3,12 г), получая 3,70 (0,46 ммоль/г) связанного со смолой соединения VIII-C(XIII-C), вместе с исходным соединением VIII-C (0,44 г). Пример 3. Получение соединения (II-1), соединения (II-2), соединения (II-3), соединения (II-4 а), соединения (II-4b), соединения (II-6) и соединения (II-8) (способ А, фиг. 6). Пример 3-А. К суспензии (XIII-A) (1,25 г) в ТГФ (24 мл) добавляли 1,0 М раствор EtMgBr (6,25 мл в ТГФ) и реакционную смесь перемешивали в течение 1 ч перед добавлением НМРА (5,0 мл). После 10-минутного перемешивания добавляли диэтоксибутиральдегид (3,0 г) (который был получен в соответствии с описанной в литературе процедурой - Paquette, et al., J. Am. Chem. Soc, 1997, 119, 9662-71) и реакционную смесь перемешивали в течение 20 ч. Реакцию гасили 10% водным NH4Cl (5 мл) и фильтровали. Смолу последовательно промывали 10% водным NH4Cl (310 мл), водой (310 мл), ТГФ (310 мл), ДМФ (310 мл), водой (310 мл) , ТГФ (310 мл) и эфиром (310 мл). Смолу сушили в вакууме, переносили в- 19006648 хлористый метилен (15 мл) и обрабатывали трифторуксусной кислотой (0,15 мл). После перемешивания в течение 1 ч реакционную смесь фильтровали и фильтрат выпаривали. Полученный в результате остаток переносили в хлористый метилен (20 мл) и обрабатывали тозилатом пиридиния (50 мг) и полученный в результате раствор перемешивали в течение 4 ч. В это время реакцию промывали насыщенным воднымNаНСО 3 и раствором соли и сушили над MgSO4. После фильтрования и выпаривания растворителя остаток очищали с помощью препаративной ВЭЖХ (Zorbax RX-8, 425 см, элюировали 60% MeCN/водой w/0,1% трифторуксусной кислотой). Соответствующие фракции нейтрализовали NаНСО 3 и экстрагировали хлористым метиленом (350 мл) и сушили над MgSO4. После фильтрования и выпаривания растворителя было получено 70,2 мг соединения II-1 в виде белого порошка, которое имело следующие характеристики: 13 С ЯМР (ДMCO-d6)171,8; 143,3; 142,4; 141,4; 140,1; 140,0; 136,6, 129,2; 127,9; 127,4; 127,1; 126,8; 124,1 (2 С), 122,7; 121,6; 121,5; 118,3; 112,1; 88,1; 79,2; 56,6; 45,6; 33,4; 24,8; 1 Н ЯМР (ДМСО-d6)9,21 (д, J=7,5, 1H), 8,62 (с, 1 Н), 7,98 (д, J=7,7, 1H), 7,86 (д, J=8,3, 1H), 7,71 (д,J=7,3, 1 Н), 7,49 (дд, J=7,9, 7,4, 1 Н), 7,41 (дд, J=7,5, 7,4, 1 Н), 7,36-7,27 (м, 2H), 6,86 (д, J=6,0, 1 Н), 5,63-5,58(м, 1 Н), 4,91 (с, 2 Н), 4,53 (д, J=3,3, 1 Н), 2,23-2,14 (м, 1 Н), 1,96-1,92 (м, 1 Н), 0,96-0,88 (м, 1 Н), 0,60-0,57 (м,1 Н); Масс-спектр m/z (М+Н) вычислено 379, измерено 379. С помощью препаративной ВЭЖХ этой смеси продуктов реакции также было выделено соединениеII-2 (0,5 мг), которое имело следующие характеристики: 1 Н ЯМР (ДМСО-d6)9,17 (д, J=8,1, 1 Н), 8,62 (с, 1 Н), 7,98 (д, J=7,0, 1H), 7,85 (д, J=6,8, 1 Н), 7,57 (д,J=6,8, 1 Н), 7,49 (дд, J=7,9, 7,4, 1 Н), 7,44-7,26 (м, 3 Н), 6,81 (д, J=6,0, 1 Н), 5,43-5,33 (м, 1 Н), 4,43 (с, 2 Н),2,23-2,14 (м, 1 Н), 1,96-1,92 (м, 1 Н), 1,45-1,55 (м, 2 Н), 0,96-0,88 (м, 1 Н), 0,60-0,57 (м, 1 Н), 0,29 (т, J=7,0,3 Н); Масс-спектр m/z (М+Н) вычислено 407, измерено 407. Пример 3-В. Подобным образом, как описано выше для соединения II-1, смолу (XIII-A) (70,3 мг) обрабатывали 1,1-диэтокси-2-пентаноном (0,75 мл) (который готовили в соответствии с описанной в литературе процедурой Sworin, et al., J. Org. Chem., 1988, 53, 4894-6), чтобы получить соединение II-3 (3,5 мг), которое было выделено с помощью препаративной ТСХ (силикагель, элюировали 50% EtOAc/ толуолом) и имело следующие свойства: 1 Н ЯМР (ДMCO-d6)9,42 (д, J=8,2, 1 Н), 8,58 (с, 1 Н), 7,95 (д, J=7,4, 1 Н), 7,79 (д, J=8,3, 1 Н), 7,71 (д,J=7,1), 7,50-7,20 (м, 4 Н), 6,81 (д, J=5,9, 1 Н), 4,90 (с, 2 Н), 4,46 (с, 1 Н), 2,35-2,20 (м, 1 Н), 1,98 (с, 3 Н), 1,751,60 (м, 1 Н), 1,25-1,00 (м, 1 Н), 0,35-0,15 (м, 1 Н); Масс-спектр m/z (М+Н) вычислено 393, измерено 393. Пример 3-С. Подобным образом, (XIII-A) (74,3 мг) обрабатывали 1,1-диэтокси-2-гексаноном (который готовили в соответствии с описанной в литературе процедурой Brenner, J. Org. Chem., 1961, 26, 22-7) (0,75 мл),чтобы получить соединение II-4 а (2,10 мг) и соединение II-4b (1,06 мг), которые были выделено отдельно с помощью препаративной ВЭЖХ (Zorbax RX-8, 425 см, элюировали 65% MeCN/водой w/0,1% трифторуксусной кислотой). Соединение II-4 а имело следующие свойства: 1 Н ЯМР (ДМСО-d6)9,30 (д, J=8,3, 1 Н), 8,55 (с, 1 Н), 7,97 (д, J=7,2, 1H), 7,65 (д, J=8,5, 1H), 7,59 (д,J=7,5), 7,48 (дд, J=7,8, 7,2, 1 Н), 7,39-7,15 (м, 3 Н), 6,31 (дд, J=5,9, 5,5, 1 Н), 5,02 (с, 2 Н), 4,88 (с, 2 Н), 0,88 (с,3 Н), другие алифатические сигналы терялись под пиками растворителя; Масс-спектр m/z (M+H) вычислено 407, измерено 407. Соединение II-4b имело следующие свойства: 1 Н ЯМР (ДMCO-d6)9,43 (д, J=8,1, 1 Н), 8,59 (с, 1 Н), 7,99 (д, J=7,3, 1 Н), 7,75-7,65 (м, 2H), 7,49 (дд,J=7,0, 6,4, 1 Н), 7,43 (дд, J=8,2, 8,1, 1 Н), 7,36-7,25 (м, 2H), 6,75 (с, 1 Н), 4,91 (с, 2 Н), 4,50 (с, 1 Н), 1,95 (с,3 Н), другие алифатические сигналы терялись под пиками растворителя; Масс-спектр m/z (M+H) вычислено 407, измерено 407. Пример 3-D. Подобным образом (XIII-С) (1,00 г) обрабатывали диэтоксибутиральдегидом (3,65 г), чтобы получить соединение II-6 (87,8 мг), которое было выделено с помощью препаративной ВЭЖХ (Zorbax RX-8,2,525 см, 65% MeCN/вода w/0,1% трифторуксусная кислота) и имело следующие свойства: 1 Н ЯМР (ДМСО-d6)9,09 (д, J=8,6, 1 Н), 8,60 (с, 1 Н), 7,95 (д, J=7,4, 1H), 7,84 (д, J=8,3, 1 Н), 7,47 (дд,J=7,2, 7,0, 1 Н), 7,35 (с, 1 Н), 7,29 (дд, J=7,0, 7,0, 1 Н), 6,98 (дд, J=8,6, 1,9, 1 Н), 6,83 (д, J=6,0, 1H), 5,65-5,55(м, 1 Н), 4,88 (с, 2 Н), 4,48 (д, J=3,9, 1H), 3,82 (с, 3 Н), 2,25-2,10 (м, 1 Н), 2,08-1,85 (м, 1 Н), 0,96-0,75 (м, 1 Н),0,65-0,50 (м, 1 Н); Масс-спектр m/z (M+Na) вычислено 431, измерено 431. Пример 3-Е. Подобным образом полимер (XIII-B) (153,2 мг) обрабатывали диэтоксибутиральдегидом (1,5 мл),чтобы получить соединение II-8 (3,6 мг), которое было выделено с помощью препаративной ВЭЖХ (Zor- 20006648al., J. Org. Chem., 1961, 26, 395-407) (9,00 г) в ТГФ (20 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 ч перед добавлением хлористого метилаллила (8,0 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи, охлаждали и фильтровали через прослойку целита. Растворитель удаляли выпариванием в роторном испарителе, и остаток очищали с помощью хроматографии на колонке (силикагель, 20% эфир/гексан), чтобы получить 1,1-диэтоксиэтилметилаллиловый эфир (11,5 г, 90%). Озонолиз охлажденного (-30 С) раствора этого эфира (6,00 г) вEtOAc (80 мл) проводили до тех пор, пока исходный материал уже не регистрировался с помощью ТСХ(1 ч). В это время реакционную смесь продували кислородом, обрабатывали Pd(OH)2 (150 мг) и перемешивали в атмосфере водорода в течение ночи. Катализатор отфильтровывали, и фильтрат концентрировали с помощью выпаривания в роторном испарителе. Полученный в результате остаток очищали хроматографией на колонке (силикагель, 20% EtOAc/гексан), получая указанное в заголовке соединение (4,53 г, 82%). Пример 4-В. Согласно способу А (фиг. 6) смолу (XIII-A) (230,2 мг) обрабатывали EtMgBr (1,25 мл), после чего(1,1-диэтоксиэтокси)ацетоном (пример 3-А) (1,2 мл). После обработки и отщепления от смолы часть грубой смеси реакционных продуктов (10,5 мг) переносили в хлористый метилен (20 мл) и обрабатывали эфиратом BF3 (20 мкл). После перемешивания в течение 2,5 ч раствор промывали насыщенным воднымNаНСО 3 и раствором соли, затем сушили над MgSO4. После фильтрования и удаления растворителя полученный в результате остаток очищали с помощью препаративной ВЭЖХ (Zorbax RX-8, 425 см, 65%MeCN/вода w/0,1% трифторуксусная кислота), чтобы получить соединение II-7 а (2,34 мг) и соединение(д, J=13,1, 1 Н), 3,82 (д, J=13,2, 1 Н), 1,13 (с, 3 Н); Масс-спектр m/z (M+H) вычислено 409, измерено 409. Пример 5: Получение соединения II-5 (фиг. 8) К раствору соединения II-1 (8,1 мг) в ТГФ (2 мл) добавляли NBS (4,6 мг) и реакционную смесь перемешивали в течение ночи. Добавляли дополнительное количество NBS (4,5 мг) и реакцию перемешивали в течение 2,5 ч. Нерастворимый материал отфильтровывали и фильтрат концентрировали в роторном испарителе. Полученный в результате остаток очищали хроматографией на колонке (С-18, 65%MeCN/вода w/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализовали NаНСО 3 и экстрагировали хлористым метиленом (320 мл), и сушили над MgSO4. После фильтрования и выпаривания растворителя было получено соединение II-5 (5,1 мг) в виде белого порошка, которое имело следующие характеристики: 1 Н ЯМР (ДМСО-d6)9,22 (д, J=7,4, 1 Н), 8,67 (с, 1 Н), 8,14 (с, 1 Н), 7,86 (д, J=8,7, 1H), 7,72 (д, J=7,0,1 Н), 7,63 (д, J=7,8, 1 Н), 7,42 (дд, J=7,5, 7,3, 1 Н), 7,35 (дд, J=1,3, 7,2, 1 Н), 6,86 (д, J=6,0, 1H), 5,63-5,58 (м,1 Н), 4,94 (с, 2 Н), 4,54 (д, J=3,1, 1 Н), 2,30-2,14 (м, 1 Н), 2,00-1,82 (м, 1 Н), 0,96-0,88 (м, 1 Н), 0,62-0,50 (м,1 Н); Масс-спектр m/z (M+H) вычислено 457/9 (1:1), измерено 457/9 (1:1). Пример 6. Получение промежуточного соединения XV (фиг. 4). К раствору (XIII-A) [А 1, А 2 = Н 2, В 1, В 2 = O, R3 = R4 = R5 = R6 = Н)] (1,05 г) в ДМФ (25 мл) добавляли триэтиламин (0,75 мл) и трет-бутилдиметилсилилхлорид (TBS-Cl) (0,65 г). После перемешивания в течение 3 ч реакцию гасили насыщенным водным NаНСО 3 и экстрагировали EtOAc. Органический слой промывали водой и раствором соли и сушили над MgSO4. После фильтрования и выпаривания растворителя полученный в результате остаток растирали в эфире, получая соединение XV (84 8 мг). Промывки выпаривали, чтобы выделить остаток, который очищали хроматографией на колонке (кремнезем, 1%EtOAc/CH2Cl2) и получали дополнительное количество продукта (502 мг, суммарный выход 94%), кото- 21006648 рый имел следующие спектральные свойства: 1 Н ЯМР (ДМСО-d6)11,94 (с, 1 Н), 9,32 (д, J=7,6, 1H), 8,03 (д, J=7,7, 1H), 7,64 (д, J=7,2, 1 Н), 7,58 (д,J=8,l, 1 Н), 7,44 (дд, J=1,1, 7,6, 1 Н), 7,39 (дд, J=1,1, 7,6, 1 Н), 7,32 (д, J=1,3, 1 Н), 7,25 (дд, J=1,6, 7,3, 1 Н),5,00 (с, 2 Н), 4,14 (с, 2 Н), 0,99 (с, 9 Н), 0,46 (с, 6 Н); Масс-спектр m/z (M+H) вычислено 425, измерено 425. Пример 7. Получение соединения II-1 с помощью способа В (фиг. 7). Раствор тритона В в пиридине (0,45 М) готовили путем растворения 40% раствора тритона В в метаноле (10 мл) в пиридине (10 мл). Растворитель удаляли при пониженном давлении (20 мм Нg) до конечного объема 8 мл. Остаток разводили пиридином до 50 мл, фильтровали и хранили в азоте. РастворXV (20,3 мг) в пиридине (2,0 мл) вносили в струю аргона и обрабатывали 300 мкл тритона В (0,45 М в пиридине) и диэтоксибутиральдегидом (50 мкл). После 2-часового перемешивания реакционную смесь экстрагировали EtOAc, промывали 1N водным НСl, раствором соли и сушили над MgSO4. После фильтрования и выпаривания растворителя аддукт переносили в СН 2 С 12 (10 мл) и обрабатывали эфиратом BF3(10 мкл). После 2,0-часового перемешивания раствор промывали насыщенным водным NаНСО 3 и раствором соли, затем сушили над MgSO4. Удаление растворителя при выпаривании в роторе давало остаток, который очищали препаративной ВЭЖХ (Zorbax RX-8, 2,525 см, 65% MeCN/вода w/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализовали NаНСО 3 и экстрагировали хлористым метиленом (320 мл) и сушили над MgSO4. После фильтрования и выпаривания растворителя получалиII-1 (11,8 мг, выход 65%), спектр 1 Н ЯМР и масс-спектр которого и время удержания которого при ВЭЖХ были идентичными материалу, полученному и выделенному способом А, описанным в примере 3-А. Пример 8. Получение соединения II-9 (фиг. 8). К суспензии бромосоединения II-5 (6,2 мг) в 1-пропаноле (4,0 мл) добавляли 3-аминофенилборную кислоту (3,8 мг). После перемешивания в течение 0,25 ч последовательно добавляли Pd(OAc)2 (2,0 мг),Ph3P (4,8 мг), Na2CO3 (2,8 мг) и воду (2,0 мл). Смесь кипятили с обратным холодильником в течение 0,75 ч, охлаждали, экстрагировали СН 2 Сl2 и промывали водой и раствором соли. Органический слой сушили над MgSO4 и растворитель удаляли выпариванием в роторном испарителе, получая остаток, который очищали препаративной ВЭЖХ (Zorbax RX-8, 2,525 см, 50% MeCN/вода w/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализовали NaHCO3 и экстрагировали хлористым метиленом (320 мл) и сушили над MgSO4. После фильтрования и выпаривания растворителя получали соединение II-9(3,1 мг, выход 49%), которое обладало следующими спектральными свойствами: 1 Н ЯМР (ДМСО-d6)9,22 (д, J=7,5, 1H), 8,66 (с, 1 Н), 8,00-7,25 (м, 8 Н), 7,12 (дд, J=7,1, 7,0, 1 Н), 6,956,80 (м, 3 Н), 6,53 (д, J=6,0, 1 Н), 5,63-5,58 (м, 1 Н), 4,99 (с, 2 Н), 4,55 (с, 1 Н), 2,25-2,10 (м, 1 Н), 1,95-1,90 (м,1 Н), 0,98-0,88 (м, 1 Н), 0,65-0,57 (м, 1 Н); Масс-спектр m/z (M+H) вычислено 470, измерено 470. Пример 9. Получение соединения II-10 (фиг. 9). К раствору соединения II-1 (5,0 мг) в ДМСО (1 мл) добавляли NaCN (4,3 мг) и смесь нагревали до 145 С в течение 1 ч. Смесь охлаждали, экстрагировали EtOAc и промывали водой (320 мл) и раствором соли. Органический слой сушили над MgSO4, фильтровали и выпаривали, получая остаток, который очищали препаративной ВЭЖХ (Zorbax RX-8, 2,525 см, 55% MeCN/вода w/0,1% трифторуксусная кислота). Соответствующие фракции нейтрализовали NаНСО 3 и экстрагировали хлористым метиленом (320 мл) и сушили над MgSO4. После фильтрования и выпаривания растворителя получали соединение II10 (2,7 мг, выход 50%), которое обладало следующими спектральными свойствами: 1 Н ЯМР (ДМСО-d6)11,4 (с, 1 Н), 8,86 (д, J=7,9, 1H), 8,79 (д, J=7,6, 1 Н), 7,90 (д, J=8,3, 1 Н), 7,62-7,55(с, 1 Н), 5,40-5,30 (м, 1 Н), 2,25-2,14 (м, 1 Н), 2,03-1,90 (м, 1 Н), 1,10-0,98 (м, 1 Н), 0,82-0,77 (м, 1 Н). Пример 10. Получение соединения II-11 (способ А, фиг. 6). Согласно способу А смолу (ХIIIа) (150,2 мг) подвергали реакции с EtMgBr (1,00 мл), после чего - с этил 2,5-диоксопентаноатом (Schmidt, et al., Synthesis, 1993, 809) (1,5 мл). После обработки и отщепления от смолы грубую смесь реакционных продуктов переносили в хлористый метилен (20 мл) и обрабатывали эфиратом BF3 (20 мкл). После перемешивания в течение 2,5 ч раствор промывали насыщенным водным NаНСО 3 и раствором соли, затем сушили над MgSO4. После фильтрования и удаления растворителя полученный в результате остаток очищали с помощью препаративной ВЭЖХ (Zorbax RX-8, 425 см,55-75% градиент MeCN/вода w/0,1% трифторуксусная кислота), чтобы получить соединение II-11 (6,4 мг), которое обладало следующими свойствами: 1 Н ЯМР (ДМСО-d6)9,36 (д, J=7,7, 1 Н), 8,68 (с, 1 Н), 8,00 (д, J=7,7, 1 Н), 7,83 (д, J=8,3, 1H), 7,53-7,15(м, 5 Н), 6,97 (д, J=5,9, 1 Н), 4,93 (с, 2H), 4,82 (с, 1 Н), 4,48 (д, J=7,l, 2 Н), 2,42-1,91 (м, 2 Н), 1,37 (т, 3 Н, J=7,l),1,25-0,63 (м, 2 Н). Пример 11. Получение соединения II-12. Раствор соединения II-11 (3,4 мг) в ТГФ (2 мл) обрабатывали 2 М раствором LiBH4 (1,0 мл в ТГФ) и реакцию перемешивали в течение 1,5 ч. Реакцию гасили добавлением 1N водного НСl (4 мл). После пе- 22006648 ремешивания в течение 20 мин добавляли 10% водный NaOH (15 мл) и смесь экстрагировали хлористым метиленом (310 мл). После высушивания над MgSO4, смесь фильтровали и растворитель выпаривали,чтобы получить соединение II-12 (0,32 мг), которое обладало следующими свойствами: 1 Н ЯМР (ДМСО-d6)9,35 (д, J=7,7, 1 Н), 8,62 (с, 1 Н), 7,98 (д, J=7,7, 1H), 7,83 (д, J=8,2, 1H), 7,75 (д,J=8,2, 1H), 7,50-7,25 (м, 4 Н), 6,84 (д, J= 7,7, 1 Н), 6,11 (с, 1 Н), 4,91 (с, 2 Н), 4,71 (с, 1 Н), 4,50-4,40 (м, 1 Н),4,30-4,20 (м, 1 Н), 2,42-1,91 (м, 2 Н), 1,25-0,63 (м, 2 Н); Масс-спектр m/z (M+H) вычислено 409, измерено 409. Пример 12. Повышение ХАТ-активности спинного мозга. ХАТ является специфичным биохимическим маркером функциональных холинэргических нейронов. Холинэргические нейроны представляют собой основной холинэргический вход в формацию гиппокампа, обонятельное ядро, ядро, расположенное между ножками мозга, кору головного мозга, миндалевидное тело и части таламуса. Мотонейроны в спинном мозге являются холинэргическими нейронами,которые содержат ХАТ (Phelps, et al., J. Соmр. Neurol., 1988, 273, 459-472). ХАТ активность была использована для изучения воздействий нейротрофинов (например, NGF или NT-3) на выживаемость и/или функционирование холинэргических нейронов. Анализ ХАТ также служит для индикации регуляции уровней ХАТ в холинэргических нейронах. Способы. Клетки спинного мозга зародышей крыс диссоциировали и эксперименты выполняли, как описано(Smith, et al., J. Cell Biology, 1985, 101, 1608-1621; Glicksman, et al., J. Neurochem., 1993, 61, 210-221). Диссоциированные клетки получали из спинного мозга вскрытых крыс (на 14-15 эмбриональный день) с помощью стандартной технологии диссоциации трипсином (Smith, et al., выше). Клетки высевали при плотности 6105 клеток/см 2 в покрытые поли-L-орнитином лунки планшетов для культивирования тканей в бессывороточную среду N2 с добавлением 0,05% бычьего сывороточного альбумина (БСА) (Bottenstein, et al., Proc. Natl. Acad. Sci. USA, 1979, 76, 514-517). Культуры инкубировали при 37 С во влажной атмосфере, состоящей из 5% СО 2/95% воздуха, в течение 48 ч. ХАТ активность измеряли через 2 дняin vitro, используя модификацию процедуры Fonnum (Fonnum, Neurochem., 1975, 24, 407-409) в соответствии с McManaman et al. и Glicksman, et al. (McManaman, et al., Develop. Biol., 1988, 125, 311-320;MLK3 клонировали, как описано Lee, et al. (Oncogene, 1993, 8, 3403-3410; Ezoe, et al., Oncogene,1994, 9, 935-938). кДНК получали из 200 нг полиаденилированной мРНК меланоцитов и 5% реакционной смеси использовали в качестве матрицы, чтобы амплифицировать набор кДНК РТК, используя смеси либо двух, либо четырех высоковырожденных олигонуклеотидных праймеров, полученных из консенсусных последовательностей консервативных субдоменов VIb и IX известных РТK: РТK1, 5'CGGATCCACMGIGAYYT-3' (SEQ ID NO: 1); РТK2, 5'-GGAATTCCAWAGGACCASACRTC-3' (SEQ IDNO: 2); PTK3, 5'-CGGATCCRTICAYMGIGAYYTIGCIGCIMGIAA-3' (SEQ ID NO: 3); PTK4, 5'GGAATTIAYIGGAWAIGWCCAIACRTCISW-3' (SEQ ID NO: 4). Было выполнено сорок циклов ПЦР с использованием ДНК полимеразы Taq (Ampli-Taq; Perkin-Elmer/Cetus) и автоматизированного термоциклера ДНК; каждый цикл состоял из 40 с при 94 С, 2 мин при 37 С и 3 мин при 63 С. Объединяли продукты восьми ПЦР, обрабатывали ДНК-полимеразой (Кленова), расщепляли BamH1 плюс EcoR1 и подвергали электрофорезу в 5% полиакриламидном геле. При окрашивании бромидом этидия идентифицировали преобладающую полосу, соответствующую 200-230 п.н., которую вырезали, элюировали и клонировали в М 13mр 18. В одном эксперименте часть кДНК, амплифицированной с помощью ПЦР, не расщепляли, а вместо этого клонировали тупыми концами в М 13mр 18, расщепленный Sma1. Нуклеотидные последовательности определяли с помощью метода секвенирования с терминацией цепи. Одна кДНК, идентифицированная как РТK1, была использована в качестве пробы для скрининга библиотек кДНК меланомы и меланоцитов человека. Клон, обозначенный РТK1-3.2, включал в себя полную открытую рамку считывания длиной 2541 н., кодирующую белок из 847 аминокислот. Эту кДНК разрезали Nco1, затупляли концы ДНК-полимеразой (Кленова), снова разрезали EcoR1 и лигировали в вектор pCDNA3-EE, который был разрезан BamH1, концы которого были затуплены и который затем был разрезан EcoR1. Вектор pCDNA3-EE был сконструирован путем встраивания в HindIII/BamH1-сайт олигонуклеотида, который кодирует стартовый кодон, после которого следует эпитоп ЕЕ, MEEEEYMPME (SEQ ID NO: 5) (Grussenmeyer, et al., Proc. Natl. Acad. Sci. USA, 1985, 82, 7952-7954). Неактивная в качестве киназы версия (мертвая киназа) MLK3 была получена путем создания мутации K144R с помощью ПЦР, с применением технологии, опубликованной ранее (Chen, et al., Biotechniques, 1994, 17,657-659). Первым мутагенным олигонуклеотидом был 5'-GTGGCTGTGCGGGCAGCTCGCCAG-3' (SEQID NO: 6) и вторым олигонуклеотидом был 5'-GAGACCCTGGATCTCGCGCTT-3' (SEQ ID NO: 7). Эти олигонуклеотиды были использованы в ПЦР, где в качестве матрицы использовали MLK3, чтобы образовать фрагмент длиной 806 п.н., и применяли во второй ПЦР-реакции, используя праймер Т 7 в качестве другого амплимера и MLK3 в качестве матрицы, чтобы образовать фрагмент длиной 1285 п.н. Фрагмент отделяли путем электрофореза в агарозном геле, выделяли, клонировали в pGEM-5 (Promega) и секвенировали. Фрагмент разрезали HindIII и HpaI, и встраивали в pCDNA3-EE-MLK3, разрезанную HindIII иHpaI. Была выявлена дополнительная точечная мутация в нуклеотиде 1342. Чтобы ее исправить, изMLK3 дикого типа вырезали Pf1M1 фрагмент (н. 1093-1418) и использовали, чтобы заменить идентичный фрагмент в MLK3, имеющей мутацию K144R. Пример 14. pFB-FLAG-MLK3. Чтобы получить белок MLK3, кДНК была клонирована в бакуловирусный экспрессирующий векторpFB-FLAG. MLK3 была вырезана из РТK1-3.2 путем переваривания Nco1, затуплена ДНК полимеразой(Кленова), снова разрезана Not1 и лигирована в pFB-FLAG, переваренный Stu1 и Not1. pFB-FLAG получен из pFB (Life Technologies) и имеет последовательность, кодирующую эпитоп FLAG (Hopp, et al.,Biotechnology, 1988, 6, 1205-1210) со стартовым кодом, MDYKDDDDK (SEQ ID NO: 8), добавленным к полилинкеру в BamH1 сайте. Пример 15. pFB-GST-MLK3(KD). Бакуловирусная экспрессия киназного домена MLK3 была достигнута путем вырезания фрагментаMLK3 из pGEXKG-MLK3(KD) с использованием EcoR1 и Xho1 и его лигирования в вектор pFB, разрезанный EcoR1 и Xho1, в котором выше по течению была клонирована кодирующая последовательность глутатион-S-трансферазы (GST). Это было достигнуто благодаря получению последовательности, кодирующей GST, и полилинкера из вектора pGEXKG с помощью ПЦР с использованием вектора в качестве матрицы (Guan, et al., Anal. Bioch., 1991, 192, 262-267). 5'-олигонуклеотид для ПЦР создавал сайт рестрикции Вg12 на 5'-конце фрагмента. Этот выделенный фрагмент затем переваривали Вg12 и HinD3 и лигировали в pFB, переваренный BamH1 и HinD3. Пример 16. pGEXKG-MLK3(KD). Фрагмент ДНК, который включал в себя как киназный домен MLK3, так и часть лейциновой молнии (н. 736-1791), был получен ПЦР с использованием РТK1 кДНК. Выделенный фрагмент переваривали ферментами рестрикции EcoR1 и Xho1, сайты для которых были включены в олигонуклеотиды для ПЦР,и клонировали в pGEX-KG, переваренном EcoR1 и Xho1. Затем этот фрагмент в pGEX-KG был укорочен с помощью ПЦР, чтобы он включал только киназный домен (н. 736-1638). Пример 17. pKH3-MLK2, pKH3-MLK2(KA).MLK2 клонировали с использованием вырожденной ПЦР (Dorow, et al., Eur. J. Biochem., 1993, 213,701-710; Dorow, et al., Eur. J. Biochem., 1995, 234, 492-500). Сегменты кДНК, кодирующие каталитиче- 24006648 ские субдомены протеинкиназ в линии эпителиальных опухолевых клеток Colo 16, амплифицировали на РНК с помощью ПЦР с обратной транскриптазой. Вырожденные праймеры ПЦР были созданы на основании последовательностей, кодирующих консервативные мотивы в субдоменах VIb и VIII каталитических киназных доменов семейства рецепторов эпидермального фактора роста. Праймеры имели следующие последовательности: прямой праймер, 5'-CGGATCCGTG(A)CACC(A)GT(CG)G(A)ACC(T)T-3' (SEQID NO: 9), обратный праймер, 5'-GGAATTCACCA(G)TAA(G)CTCCAG(С)АСАТС-3' (SEQ ID NO: 10). Несколько продуктов ПЦР было клонировано в М 13 и секвенировано с помощью набора для секвенирования Т 7 Super-Base (Bresatec). Один продукт ПЦР длиной 216 п.н. был использован в качестве пробы для скрининга gt11 библиотеки кДНК толстого кишечника человека (Clontech, номер по каталогуHL10346). Фрагмент метили со случайным праймером, гибридизацию проводили при 65 С и фильтры промывали в условиях жесткости 0,2 X NaCl/цитрат (150 мМ хлорид натрия, 15 мМ цитрат натрия, рН 7,0) и 0,5% SDS при 65 С. Авторадиографию фильтров проводили в течение 16 ч при -70 С на пленкеKodak XAR-5. Были выделены четыре клона, и самый длинный из них, длиной 1,2 т. п.н., был использован в качестве повторного зонда для той же библиотеки при тех же самых условиях. Были отобраны еще четыре клона, и один из этих клонов представлял собой фрагмент MLK2 длиной 1034 п.н. Этот клон был использован в качестве пробы для gt10-библиотеки мозга человека. Проверено примерно 500000 клонов, и выделен один клон длиной 3454 п.н., представляющий собой полный кодирующий район MLK2.MLK2 была клонирована от ATG до полиА-хвоста в вектор рKН 3 между сайтами BamH1 и EcoR1 в два этапа, так как в середине последовательности MLK2 имеется BamH1 сайт. Вектор рКН 3 был сконструирован путем встраивания трех копий НА эпитопа tag и следующим далее BamH1 сайтом между сайтами Xba1 и EcoR1 полилинкера pRK7. Чтобы получить мутантную версию, К 125 А, 5' BamH1 фрагментMLK2 был клонирован в векторе Promega pAlter и подвергнут мутации, как рекомендовано изготовителем. Затем фрагмент был клонирован назад в вектор MLK2 рKН 3. Пример 18. pcDNA3-HA-JNK1.JNK1 кДНК была получена как описано Coso, et al. (Cell, 1995, 81, 1137-1146). кДНК была получена ПЦР с использованием в качестве матрицы кДНК скелетной мышцы человека (Invitrogen) и была клонирована в Bgl2/Sal1 сайты pcDNA3-HA, модифицированной pcDNA3 экспрессирующей плазмиды, кодирующей эпитоп HA (Wilson et al., Cell, 1984, 37, 767-778). Затем она была вырезана из pcDNA3, включая эпитоп НА, и лигирована в pGEX-4T3 (Pharmacia). JNK1 кДНК была вырезана из конструкции pGEX-4T3 в виде Bg12/Sal1 фрагмента и лигирована в pcDNA3-HA, вектор с эпитопом НА, добавленным вDLK была клонирована в экспрессирующий вектор pcDNA3 с эпитопом FLAG, присоединенным как описано Holzman, et al. (J. Biol. Chem., 1994, 269, 30808-30817). Фрагмент кДНК для DLK был выделен с помощью ПЦР клонирования, основанного на использовании вырожденных олигонуклеотидов. Суммарную РНК экстрагировали из почек (32 органа) на 13,5 эмбриональный день и из почек (16 органов) на 17,5 эмбриональный день, используя способ на основе серийно производимого фенол/гуанидинизотиоционатного реагента, в соответствии с инструкциями изготовителя (TRIzol Reagent, Life Technologies, Inc.). После переваривания свободной от РНКазы ДНКазой I РНК подвергали обратной транскрипции РНКазой Н - обратной транскриптазой (Superscript, Life Technologies, Inc.) с синтетического олиго(dТ) олигонуклеотидного праймера до однонитевой кДНК. Вырожденные олигонуклеотидные праймеры, соответствующие каталитическим субдоменам Vib и IX тирозиновой протеинкиназы, исходно разработанные Wilks (Wilks, Proc. Natl. Acad. Sci. USA., 1989, 86, 1603-1607), были модифицированы для 5'EcoRI и HindIII-сайтов, соответственно (5'-ATAATTC(GT)GC(TAGC)GCCA(GA)GTC(TAGC)CGGTG-3'NO: 12) . Проводили сорок циклов ПЦР в течение 1,5 мин при 94 С, 2 мин при 37 С и 3 мин при 63 С. Добавляли свежие реактивы и выполняли еще 40 циклов перед последней 10-минутной элонгацией при 72 С. Полученный в результате продукт амплификации ДНК длиной 200-210 п.н. выделяли в геле, субклонировали в готовую плазмиду pGEM7zf(+) (Promega) и трансформировали в Escherichia coli. Плазмидная ДНК была получена из трансформированных бактерий с использованием набора Miniprep, и часть была переварена эндонуклеазами рестрикции EcoRI и HindIII; клоны, содержащие вставки, были секвенированы. Фрагмент кДНК DLK длиной 195 п.н., полученный с помощью вырожденной ПЦР, радиоактивно метили и использовали для скрининга примерно 1106 рекомбинантов Uni-ZAP II (Stratagene, La Jolla,CA), библиотеки кДНК мозга взрослой мыши, полученной с помощью олиго(dT)-праймеров (Holzman, etal., Mol. Cell Biol., 1990, 10, 5830-5838). Фильтры гибридизовали в буфере, состоящем из 50% формамида, 5 х SSC, 3 х раствора Денхардта, 0,25% SDS, 1 мг/мл полиадениловой кислоты, и 200 мг/мл ДНК спермы лосося, при 42 С. Фильтры промывали один раз при комнатной температуре в 2 х SSC, 0,2% SDS и дважды - при 65 С в течение 30 мин. Было идентифицировано двадцать пять уникальных клонов; 10 клонов были очищены до гомогенности, проведена эксцизия in vivo в соответствии с протоколом изготовителя, и проведено рестрикционное картирование. Два самых длинных клона (3401 и 3397 п.н., соответ- 25006648 ственно, отличающиеся только своими 5' концами) были секвенированы вдоль обеих нитей по всей длине. Фрагмент полноразмерной NotI-XhoI DLK кДНК (3401 п.н.) субклонировали в эукариотический экспрессирующий вектор pcDNA3 с промотором цитомегаловируса (Invitrogen, San Diego, СА) (конструкция названа pcDNA3-DLK). Затем была создана меченая NH4-Met FLAG эпитопом (DYKDDDDK)(SEQ ID NO: 13) конструкция (pFLAG-DLK). Чтобы амплифицировать фрагменты кДНК, которые кодируют 5' HindIII сайт, консенсусную последовательность Козака в DLK, включающую кодон инициацииATG, эпитоп FLAG, и последовательность открытой рамки считывания кДНК DLK, простирающуюся от нуклеотида 88 до внутреннего EcoRI сайта у нуклеотида 758, использовали ПЦР. (Очищенные с помощью ВЭЖХ синтетические олигонуклеотиды использовали в эквимолярных количествах: 5'ATAAAGCTTCCAGAGGCCATGGACTACAAGGACGACGATGACAAGGCCTGCCTCCATGAAACCCGAACA-3' (SEQ ID NO: 14) для смыслового праймера конструкции FLAG и 5'GACAGGGCGGCCGGCTCT-3' (SEQ ID NO: 15) для антисмыслового праймера). Очищенные в геле, переваренные HindIII и EcoRI амплифицированные фрагменты были субклонированы в HindIII-EcoR1,чтобы получить плазмиду pcDNA3-DLK. Конструкции секвенировали вдоль обеих нитей, чтобы убедиться в точности Taq полимеразы и сохранении рамки считывания. Пример 20. pcDNA3-MLK1. 5' часть MLK1 была получена из баз данных EST (инвентарный номер АА 160611). Этот клон представлял собой слияние между MLK1 и другой кДНК неизвестной природы. Он содержал ранее не опубликованную 5' последовательность MLK1 вместе с частью ранее опубликованного киназного доменаMLK1 (Dorow, et al., Eur. J. Bichem., 1993, 213, 701-710). Последовательность кДНК MLK1 клона EST представляет собой следующую последовательность: 3' часть MLK1 в начале была клонирована с помощью вырожденной ПЦР, как опубликовано ранее(Dorow, et al., Eur. J. Bichem., 1993, 213, 701-710). Протокол клонирования 3' части MLK1 был таким, как описано выше для MLK2, со следующими исключениями. Из четырех клонов, полученных при повторном скрининге библиотеки с помощью клона длиной 1,2 т.п.н., три клона представляли собой MLK1. Ни один из клонов не содержал полного киназного домена, который был получен с помощью ПЦР. Фаг из аликвотных проб амплифицированных библиотек (кДНК нормального эпителия толстой кишки человека и кДНК линии клеток карциномы толстой кишки человека Т 84 в 1 Uni-ZAPXR (Stratagene, номер по каталогу 937204) объемом 1 мл лизировали путем суспендирования в 20 мл воды и мгновенно замораживали. Образец объемом 5 мл лизированного фага использовали в качестве ПЦР матрицы в двух реакциях для каждой библиотеки. Праймеры, представляющие векторы, были взяты из нуклеотидных последовательностей, фланкирующих сайты клонирования. В случае библиотеки линии клеток толстого кишечника Т 84 были использованы праймеры для секвенирования Т 3 и Т 7 (Promega). В каждой реакции один праймер был из 3' - 5' нити гена MLK1, примерно 100 п.н. 5' конца известной последовательности. Вторым праймером был один из двух векторных праймеров. Реакционная смесь ПЦР содержала 1X буфер для ПЦР, 2,5 мМ хлорид магния, 1 ед. полимеразы Taq (все реактивы из Bresatec) , 0,2 мМ дНТФ и 0,4 мМ каждого праймера в общем объеме 50 мл. Условия реакций были следующими: 60 с при- 26006648 95 С, 90 с при 52 С, 90 с при 72 С в ходе 30 циклов, с 15-минутным временем элонгации в последнем цикле. Продукты ПЦР были клонированы и секвенированы как описано выше. Самый длинный клон из отобранных в библиотеке и фрагмент ПЦР, который включал в себя дополнительную последовательность MLK1, были лигированы друг с другом, чтобы получить кДНК MLK1 длиной 1,08 т.п.н. в pUC18. Клон MLK1 из базы данных EST был представлен в векторе pBluescript (Stratagene). кДНК MLK1 из библиотеки толстого кишечника была лигирована в клон EST с помощью переваривания вышеупомянутой кДНК EcoRI, затупления концов фрагментом Кленова, затем разрезанием AflII. Этот выделенный фрагмент был клонирован в кДНК MLK1 из базы данных EST, которую разрезали XhoI, концы которой затупляли фрагментом Кленова и разрезали AflII. Затем эта новая конструкция была вырезана изApa1. Последовательности всех соединений при клонировании проверялись. Пример 21. Экспрессия GST-MLK3KD в Е. coli. Е. coli линии BL21 трансформировали pGEXKG-MLK3(KD) путем электропорации. Бактерии, содержащие плазмиду, инокулировали в 15-литровый ферментер Applikon в 10 л следующей богатой среды: 1,95 г/л K2 НРО 4, 0,9 г/л KН 2 РО 4, 0,1 г/л ампициллина, 0,3 г/л (NH4)2SO4, 0,92 г/л MgSO47H2O, 42,7 мг/л цитрата Na, 21,8 мг/л FeSO47H2O, 0,5 мл микроэлементов металлов Pichia (Higgins, et al., MethodsMolecular Biology, 1998, 103, 149-177), 20 г/л казаминовых кислот, 40 г/л глицерина, 25,5 мг/л СаСl2. Бактерии выращивали в течение ночи при 800 об./мин/68% растворенного кислорода/30 С до тех пор, пока культура не достигнет OD600 = 4,4. Продукцию рекомбинантного белка индуцировали добавлением 1 мМ изопропилD-тиогалактозида, при непрерывной ферментации при 25 С продолжительностью до 6 ч. Затем бактерии извлекали центрифугированием, и клеточную пасту хранили в замороженном виде при-20 С до очистки. Пример 22. Очистка бактериальной GST-MLK3KD. Частично очищенную GST-MLK3KD получали путем озвучивания 100 г пасты бактериальных клеток в 100 мМ трис-НСl, 150 мМ NaCl, 1 мМ ЭДТА, 5 мМ дитиотреитола (DTT), рН 7,5 (буфер А). В раствор добавляли тритон Х-100 до 1%, затем раствор перемешивали на льду в течение 1 ч. Надосадочный раствор после центрифугирования в течение 45 мин при 20 000 х g перемешивали в течение 1 ч на льду с 10 мл смолы глутатионсефарозы 4 В (Pharmacia), уравновешенной буфером А. Осевшую смолу дважды промывали 12,5 х объемом буфера А, затем элюировали 20 мл 100 мМ трис-НСl, 150 мМ NaCl, 5 мМ ДТТ(буфер В), содержащим 20 мМ глутатиона, рН 7,5. Белок диализовали в течение ночи против буфера В и хранили в аликвотных пробах при -80 С. Пример 23. Бакуловирусная экспрессия FLAG-MLK3 и GST-MLK3KD. Рекомбинантные бакуловирусы, экспрессирующие FLAG-MLK3 и GST-MLK3KD были получены из соответствующих векторов переноса, pFB-FLAG-MLK3 и pFB-GST-MLK3KD, используя систему ВАСТО-ВАС (Life Technologies), в соответствии с инструкцией изготовителя. Суспензионные культуры клеток Sf21 (Vaughn, et al., In Vitro, 1977, 13, 213-217) выращивали при 27 С/120 об./мин в дополненной среде Грейса (Hink, Nature, 1970, 226, 466-467) с 10% инактивированной нагреванием фетальной сыворотки теленка (FBC). Для получения рекомбинантной FLAG-MLK3 клетки Sf21 при плотности 1,5106 клеток/мл дополненной среды Грейса, содержащей 5% FBS, инфицировали многократными заражениями(MOI) 3,1 и собирали через 39 ч после заражения. Для получения рекомбинантной GST-MLK3KD клеткиMOI 2 и собирали через 41 ч после заражения. В обоих случаях осадок клеток ресуспендировали в буфере, содержащем 10 мМ HEPES, 50 мМ NaCl, 0,5 мМ Pefabloc SC, 5 мкМ пепстатина, 10 мкг/мл апротинина, 10 мкг/мл лейпептина, рН 7,4. Надосадочный раствор, полученный после центрифугирования в течение 1 ч при 147000 х g, повторно доводили до рН 7,4 с помощью 3 М основного триса и затем перед очисткой хранили при -70 С. Пример 24. Очистка бакуловирусной GST-MLK3KD. Частично очищенную бакуловирусную GST-MLK3KD получали с помощью глутатион-специфичной аффинной хроматографии. К 10 мл экстракта клеток (26,6 мг суммарного белка) добавляли 1 мл смолы глутатионсефарозы 4 В (Pharmacia), уравновешенной в 10 мМ HEPES, 150 мМ NaCl, рН 7,4 (буфер С), и белку давали возможность связаться в течение 45 мин при 4 С. Затем смолу промывали в колонке буфером С объемом, равным 30 объемам колонки, затем элюировали буфером С, содержащим 20 мМ глутатиона, объемом, равным 5 объемам колонки. Объединенный конечный продукт диализовали в течение ночи против буфера С и хранили в аликвотных пробах при -70 С. Пример 25. Очистка бакуловирусной FLAG-MLK3. Частично очищенную бакуловирусную FLAG-MLK3 получали с помощью антитело-специфичной аффинной хроматографии. Белок из 15 мл экстракта (19,5 мг суммарного белка) с добавлением 0,1 МNaCl связывали на 0,25 мл колонке с моноклональным антителом М 2 против пептида FLAG, связанным с агарозной смолой (Sigma), в результате многократных загрузок (всего три раза). Перед хроматографией смолу предварительно уравновешивали промывкой 5 колоночными объемами 50 мМ трис-НСl, 150 мМNaCl, pH 7,4 (TBS), промывкой 3 колоночными объемами 0,1 М глицина, рН 3,5, после чего еще одной- 27006648 промывкой 5 колоночными объемами TBS. Рекомбинантный белок сначала элюировали 5 колоночными объемами 0,2 мМ FLAG пептида (N-Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys-C) (SEQ ID NO: 18) в TBS. Белок хранили в аликвотных пробах при -80 С до анализа. Пример 26. Доминантный негативный мутант: доминантный негативный мутант семейства MLK блокирует гибель дифференцированных клеток РС 12, вызванную удалением фактора роста нервов. Линию клеток РС-12, полученную из опухоли феохромоцитомы крыс, широко использовали в качестве модели нервных клеток для изучения молекулярных событий, приводящих к гибели нейронов (для обзора, см. Troy, et al., Adv. Neurology, 1937, 103-111). Фактор роста нервов (NGF) индуцирует клетки РС-12 к дифференцировке в клетки с фенотипом симпатических нейронов (Greene, Cell Biol., 1978, 78,747-755). Выживаемость дифференцированных под действием NGF клеток РС-12 зависит от NGF, и они подвергаются морфологически описанной апоптозной гибели при удалении NGF из культуральной среды. Была разработана клеточная система для определения влияния представителей семейства киназ смешанных линий на гибель клеток РС-12 вследствие удаления NGF. Клетки РС-12 трансфецировали кДНК,кодирующей доминантный негативный (DN) мутант MLK-3, используя систему переноса на основе липидов Pfx, как рекомендовано изготовителем (Invitrogen, Carlsbad, CA). Стабильный пул трансфектантов,экспрессирующих DN-MLK-3 отбирали, используя сульфат G418 (Mediatech Inc., Herndon, VA). Примерно 30% клеток в этих пулах экспрессируют DN-MLK3, как было определено с помощью иммуногистохимии. Пулы клеток, стабильно экспрессирующих мутантную киназу, высевали на покрытые полиорнитином/ламинином (10 мкг/мл каждого в фосфатно-солевом буфере) планшеты 96-луночной формы для культур тканей при плотности 2104 клеток/лунку и обрабатывали 100 нг/мл NGF в течение 7 дней. Среду, содержащую NGF, удаляли, монослой клеток промывали фосфатно-солевым буфером и на 1-5 дней вносили среду, содержащую антитела, нейтрализующие NGF (номер по каталогу 6655; Sigma, St.Louis, МО) в конечном разведении 1:1000. Выживаемость клеток определяли количественно с помощью анализа выживаемости клеток на основе превращения соли тетразолия, MTS, в окрашенный формазан,который регистрировали по поглощению при 570 нм на CytoFluor 2350 (Millipore, Bedford, MA) как рекомендовано изготовителем (Promega, Madison, WI). Пулы стабильно экспрессирующие DN-MLK-3 частично были спасены от гибели клеток, вызванной удалением NGF (фиг. 10). Пример 27. Анализ энзиматической активности рекомбинантного MLK белка. Чтобы показать, что MLK белок, экспрессированный либо в бакуловирусной, либо в бактериальной системе экспрессии, является энзиматически активным белком, может быть использовано несколько видов анализа. MLK белок может быть полноразмерной конструкцией или киназным доменом, экспрессированными либо в бакуловирусной, либо в бактериальной системе экспрессии. Анализ может быть основан на антителах, например твердофазный иммуно-ферментный анализ (ELISA), флюоресценция с временным разрешением (TRF), или поляризация флюоресценции (FP). Антителом может быть моноклональное или поликлональное антитело, реактивное против фосфосерина, фосфотреонина или фосфорилированного специфичного субстрата. В альтернативном случае может быть использован метод, не основанный на антителах, такой как анализ радиоактивности в геле (см. фиг. 11), множественный скрининговый анализ на основе преципитации трихлоруксусной кислотой (ТХУ) (фиг. 13), выявление сходства при сцинтилляционном анализе (SPA), способ скрининга с использованием flashplate, или разновидность анализа на нитроцеллюлозных фильтрах (фиг. 13). Целью анализа может быть контроль непосредственного фосфорилирования субстрата или связанной анализируемой системы, использующей киназы сигнального пути ниже по течению. Субстратом может быть специфичный субстрат, такой как SEK-1, или относительно неспецифичный субстрат, такой как основной белок миелина (МBР). Пример 28. Анализ киназ.(1) Анализ киназ на основе измерения радиоактивности в геле. Киназную активность MLK-3 исследовали, контролируя включение 32 Р из [-32 Р]-АТФ в субстратMLK (например, мертвую киназу SEK-1; основной белок миелина). 50 мкл смеси для анализа содержали буфер А (20 мМ MOPS, pH 7,2, 25 мМ -глицеринфосфата, 5 мМ ЭГТА, 1 мМ ортованадата натрия,1 мМ дитиотреитола), 15 мМ МgСl2, 100 мкМ АТФ, 10 мккюри [-32 Р]-АТФ, и 0,1 мкг субстрата - мертвой киназы SEK-1 (Stressgen, Inc; связанную с глутатион-S-трансферазой SEK-1 (GST-SEK-1) высвобождали из глутатионагарозных шариков с помощью 10 мМ глутатиона, рН 8,0) или 25 мкг МBР (SigmaChemical Co.). Реакцию инициировали добавлением MLK белка (киназный домен или препарат, содержащий как полноразмерный белок, так и киназный домен) или контрольного белка. Смесь инкубировали в течение 30 мин при 30 С. В конце реакции добавляли 2 х восстанавливающего буфера для образца. Смесь кипятили в течение 5 мин, наносили либо на 12% SDS-ПААГ гель (при использовании в качестве субстрата МBР) или на 8% гель (при использовании в качестве субстрата SEK-1). После электрофореза гель сушили. Количественное определение включения фосфата в субстрат, SEK-1, выполняли на приборе для регистрации динамики молекулярного фосфорилирования (Molecular Dynamics Phosporimager,Sunnyvale, CA). Результаты экспериментов, предназначенных для того, чтобы показать энзиматические активности экспрессируемой бакуловирусами MLK-3 (меченная FLAG полноразмерная или меченныйGST киназный домен) с использованием в качестве субстрата мертвой киназы GST-SEK-1 или МБР,показаны на фиг. НА и 11 В.(2) Вестерн-блот анализ. Киназную активность экспрессируемой бакуловирусами MLK-3 оценивали с помощью иммуноблот анализа. Смесь для анализа объемом 20 мкл содержала буфер А, 15 мМ МgСl2, 100 мкМ АТФ, и 0,1 мкг субстрата - мертвой киназы SEK-1. Реакции позволяли продолжаться в течение 30 мин при 30 С, затем гасили 10 мкл 4 х восстанавливающего буфера для образцов. Белки разделяли в 8% трис-глициновом геле, и с помощью электрофореза переносили на мембрану Immobilon PVDF. Мембрану инкубировали с антителом, специфичным для фосфорилированного SEK-1 (Thr223) (New England Biolabs, Inc.), после чего с меченым пероксидазой хрена антикроличьим IgG козы (Bio-Rad). Регистрацию иммунореактивных полос выполняли посредством усиленной хемилюминисценции (Amersham). Фосфорилирование мертвой киназы GST-SEK-1 белком FLAG-MLK-3 (бакуловирусный препарат, содержащий как полноразмерный белок, так и киназный домен) показано на фиг. 12.(3) Множественный скрининговый анализ на основе преципитации трихлоруксусной кислотой(ТХУ). Киназную активность киназного домена GST-MLK-3, экспрессируемого бактериями, оценивали с использованием множественного скринингового анализа в планшетах Millipore с трихлоруксусной кислотой (ТХУ), который описан Pitt, et al., J. Biomol. Screening, 1996, 1, 47-51). Анализы выполняли в 96-луночных планшетах Durapore для множественного скрининга (Millipore). Каждая смесь для анализа,объемом 50 мкл, содержала 20 мМ Hepes, рН 7,4, 20 мМ МgСl2, 20 мМ МnСl2, 2 мМ ДТТ, 0,1 мМNa3VO4, 1 мккюри [-Р 32] АТФ и 30 мкг МBР субстрата. Реакцию инициировали добавлением MLK белка и позволяли продолжаться в течение 15 мин при 37 С. Реакцию останавливали 25 мкл 50% ТХУ. Планшеты оставляли для установления равновесия на 30 мин при 4 С, затем промывали ледяной 25% ТХУ. В планшеты добавляли сцинтилляционную смесь и радиоактивность определяли, используя сцинтилляционный счетчик Wallac MicroBeta 1450 PLUS. Зависимость образования 32 Р-меченного МBР от дозы белка показана на фиг. 13.(4) Анализ на фосфоцеллюлозных фильтрах. Анализ киназы выполняли в 50 мкл реакционной смеси, содержащей 20 мМ Hepes, pH 7,4, 20 мМ МgСl2, 20 мМ МnСl2, 2 мМ ДТТ, 0,1 мМ Na3VO4, 1 мккюри [-р 32] АТФ и 30 мкг МВР. Реакцию инициировали добавлением MLK белка и позволяли продолжаться в течение 15 мин при 37 С. Реакцию останавливали 75 мкл 75 мМ фосфорной кислоты. Аликвоты погашенного раствора наносили непосредственно на фосфоцеллюлозную мембрану (Pierce). В альтернативном случае могут быть использованы 96 луночные фосфоцеллюлозные планшеты для множественного скрининга (Millipore). Мембраны промывали 75 мМ Н 3 РО 4. Связанный 32 Р-меченный фосфорилированный МВР элюировали в пробирки для сбора добавлением 1 М гидроокиси натрия. Радиоактивность определяли методом счета Черенкова в сцинтилляционном счетчике Beckman (Somerset, NJ). Образование фосфорилированного МВР с увеличением концентрации экспрессируемого бактериями киназного домена GST-MLK-3 показано на фиг. 13. Пример 29. Анализ с целью определения связывания соединений с рекомбинантными белками семейства MLK.K-252 а (соединение III-3; см. табл. 4), метаболит индолокарбазола видов Nocardia, связывается с различными серин/треониновыми и тирозиновыми киназами (Angeles, et al., Anal. Biochem., 1996, 236,49-55; Knight, et al., Anal. Biochem., 1997, 247, 376-381). Меченый тритием K-252 а лиганд был использован для оценки связывания с полноразмерной рекомбинантной MLK-3 человека из неочищенного препарата инфицированных бакуловирусами клеток. [3 Н]K-252 а специфично метили тритием в 3 и 9 положениях, благодаря контракту с NEN Research products (Billerica, MA), и он имел удельную активность 40 кюри/ммоль. Реакцию связывания проводили в 1 мл в 96-луночном планшете. Реакционная смесь содержала 50 мМ буфер MOPS, pH 7, 150 мМ NaCl, 5 мМ МnСl2, 1 мг/мл БСА, 1% ДМСО и 0,25 нМ [3 Н]К 252 а. Образцы готовили в трех повторах при концентрации 5 мкг/мл неочищенной полученной на основе бакуловирусов MLK-3. Неспецифическое связывание определяли по связыванию в присутствии не меченного 1,2 мкМ K-252 а, и вычитали из суммарного связывания, чтобы получить специфичное связывание. При таком разведении 12-15% общего количества импульсов было неспецифично связано с белком,и 75-85% этих импульсов были специфично связаны с MLK-3 (фиг. 14). Все эксперименты выполняли в течение 2 ч при 4 С. Комплексы [3 Н]K-252a/MLK-3 собирали на фильтры Whatman GF/C, используя сборщик Brandel, промывали холодным MOPS/NaCl буфером и считали в бета-счетчике Wallac Micro. Проводили эксперимент по насыщению связывания, чтобы получить Kd для K-252 а. Показан примерный результат одного из таких экспериментов (фиг. 14). Было получено значение Kd равное 0,89 нМ (границы доверительного интервала: от 0,2 до 1,5 нМ). Пример 30. Анализ интактных клеток.K-252 а и производные этого соединения были предоставлены Kyowa-Hakko Kogyo Co. Ltd. (Tokyo,- 29006648Japan) (Kaneko et al., 1997). Соединения растворяли в диметилсульфоксиде (ДМСО) по уровню качества,предназначенного для культур клеток, и хранили в темноте при 4 С. Все разведения соединений делали в среде Игла модификации Дульбекко (DMEM), содержащей 1% бычьего сывороточного альбумина. Гемагглютининовые (НА) антитела были приобретены в BabCO (Richmond, СА). АР-1 (c-jun) субстрат был приобретен в Promega (Madison, WI). [-32 Р]АТФ (6000 кюри/ммоль) приобретали в Amersham (ArlingtonHeights, IL). Культура клеток COs7. Клетки почки зеленой мартышки Cos7 получали из АТСС, Rockville, Maryland (CRL 1651) и поддерживали в DMEM, содержащей 10% бычьей сыворотки, 2 мМ глутамина, 1 мМ пирувата, 50 ед/мл пенициллина/стрептомицина при 37 С в атмосфере из 10% СО 2, 90% воздуха. Клетки Cos7 отделяли для пересева добавлением 0,25% трипсина.(1) Сверхэкспрессия представителей MLK семейства и JNK1 в клетках Cos7. Клетки Cos7 пассировали при 80% конфлюентности, и трансфецировали 2 мкг каждой из конструкций кДНК, используя липофектамин, как рекомендовано поставщиком (Gibco BRL, Gaithersburg, MD). Полноразмерная кДНК MLK-3, MLK-2 человека или DLK мыши, или неполная кДНК MLK-1 человека,которые описаны выше, и полноразмерная кДНК меченной гемагглютинином A JNK1 человека, любезно предоставленная J. Silvio Gutkind (NIH, Bethesda, MD), были субклонированы в векторе pcDNA3 (Invitrogene, San Diego, CA). Через 48 ч после трансфекции клетки обрабатывали 0,025% ДМСО или 500 нМ указанных соединений в течение 2 ч, после чего лизировали в 0,4 мл буфера с тритоном (1% тритон Х 100, 50 мМ хлорид натрия, 10 мМ трис (рН 7,6), 0,1% бычий сывороточный альбумин, 30 мкМ пирофосфат натрия, 50 мМ фторид натрия, 20 мкг/мл апротинина, 1 мМ фенилметилсульфонилфторид, 1 мМ ванадат натрия). Активность JNK лизата анализировали с помощью иммунопреципитации/киназного анализа, как описано ниже.(2) Иммунопреципитация и киназный анализ на целых клетках. В лизате клеток Cos7 измеряли концентрацию белка, используя набор Micro BCA Pierce (Rockford,IL), и равные количества белка подвергали иммунопреципитации с НА антителами в течение 1 ч при 4 С. Иммунопреципитаты осаждали путем центрифугирования в микроцентрифуге в течение 20 с, ресуспендировали в тритоновом буфере, промывали центрифугированием еще 2 раза, после чего делали последнюю промывку в киназном буфере (20 мМ Hepes, рН 7,4, 20 мМ МgСl2, 2 мМ дитиотреитол, 0,1 мМ ванадат натрия). Иммунопреципитат ресуспендировали в киназном буфере, содержащем 1 мкМ АТФ и 5 мккюри [-32 Р]АТФ и субстрат (1 мкг/образец АР-1) и инкубировали в течение 15 мин при 30 С. Киназную реакцию останавливали добавлением восстанавливающего буфера для образца (Laemmli, Nature 1970: 227; 680-685). Образцы нагревали до 80 С в течение 5 мин и наносили на 10% SDSполиакриламидные гели. Белки разделяли с помощью электрофореза. Гель сушили, и количественное определение радиоактивности в АР-1 субстрате проводили на приборе для регистрации динамики молекулярного фосфорилирования (Sunnyvale, CA). Результаты экспериментов, в которых MLK-3, MLK-2 иDLK экспрессировались совместно с HA-JNK1 и были инкубированы в отсутствии или в присутствии соединения K-252 а показаны на фиг. 15 А и 15 В. Напротив, производное исходного соединения K-252 а,названное соединением III-3 (см. табл. 4), которое является более избирательным ингибитором киназы,не влияло на JNK путь, активируемый другой МАРKKK выше по течению, чем JNK, MEKK1 (фиг. 15 С).(В) Анализ JNK, активированной MLK, в целых клетках с использованием репортера. Попытки получения клонов, конститутивно экспрессирующих семейство MLK, оказались неудачными, что свидетельствует о том, что сверхэкспрессия MLK может влиять на выживаемость клеток (Bergeron et al., Biochem. Biophis. Res. Commun., 1997, 231, 153-155; Nagata, et al., EMBO J., 1998, 17, 149158). Поэтому при разработке анализа на целых клетках для слежения за биохимическими событиями,индуцируемыми MLK, может быть необходима линия клеток, содержащая полученную генноинженерным путем индуцируемую систему экспрессии интересуемой киназы. Например, линия клеток РС-12, трансфицированная регулируемым тетрациклином трансактиватором. В том случае, когда в дальнейшем клетки трансфецируют интересующим геном, управляемым индуцируемым промотором tetO,экспрессия этого гена непосредственно контролируется тетрациклином в среде (Shockett, et al., Proc. Natl.Acad. Sci. USA, 1995, 92, 6522). Чтобы количественно оценить активацию MLK, можно измерить фосфорилирование расположенных ниже по течению субстратов, таких как МЕK4, JNK или c-jun с помощью многих видов анализа, которые описаны выше. Другим подходом к количественной оценке активации MLK в целых клетках является использование активности репортерного фермента, такого как c-jun - люциферазная репортерная система, доступная для приобретения благодаря Path-Detect системе (Stratagene, LaJolla, CA). В этой системе индуцируемая тетрациклином линия клеток трансфецируется двумя плазмидами. Одна плазмида конститутивно экспрессирует NH2-концевой трансактивирующий домен cJun, слитый с ДНКсвязывающим доменом GAL4 дрожжей (cJun-DBD гибридный белок). Другая плазмида несет кодирующие последовательности люциферазы светляка, управляемые пятью тандемными повторами сайта связывания GAL4. При активации MLK расположенный ниже по течению субстрат JNK, cJun-DBD гибрид- 30
МПК / Метки
МПК: G01N 33/68, C12Q 1/68, A61K 31/40, A61K 31/535, G01N 33/50, A61K 31/55
Метки: киназные, модулируют, модулирования, множественных, белки, белков, способы, линий, киназных, скрининга, которые, соединений
Код ссылки
<a href="https://eas.patents.su/30-6648-sposoby-modulirovaniya-kinaznyh-belkov-mnozhestvennyh-linijj-i-skrininga-soedinenijj-kotorye-moduliruyut-kinaznye-belki-mnozhestvennyh-linijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы модулирования киназных белков множественных линий и скрининга соединений, которые модулируют киназные белки множественных линий</a>












