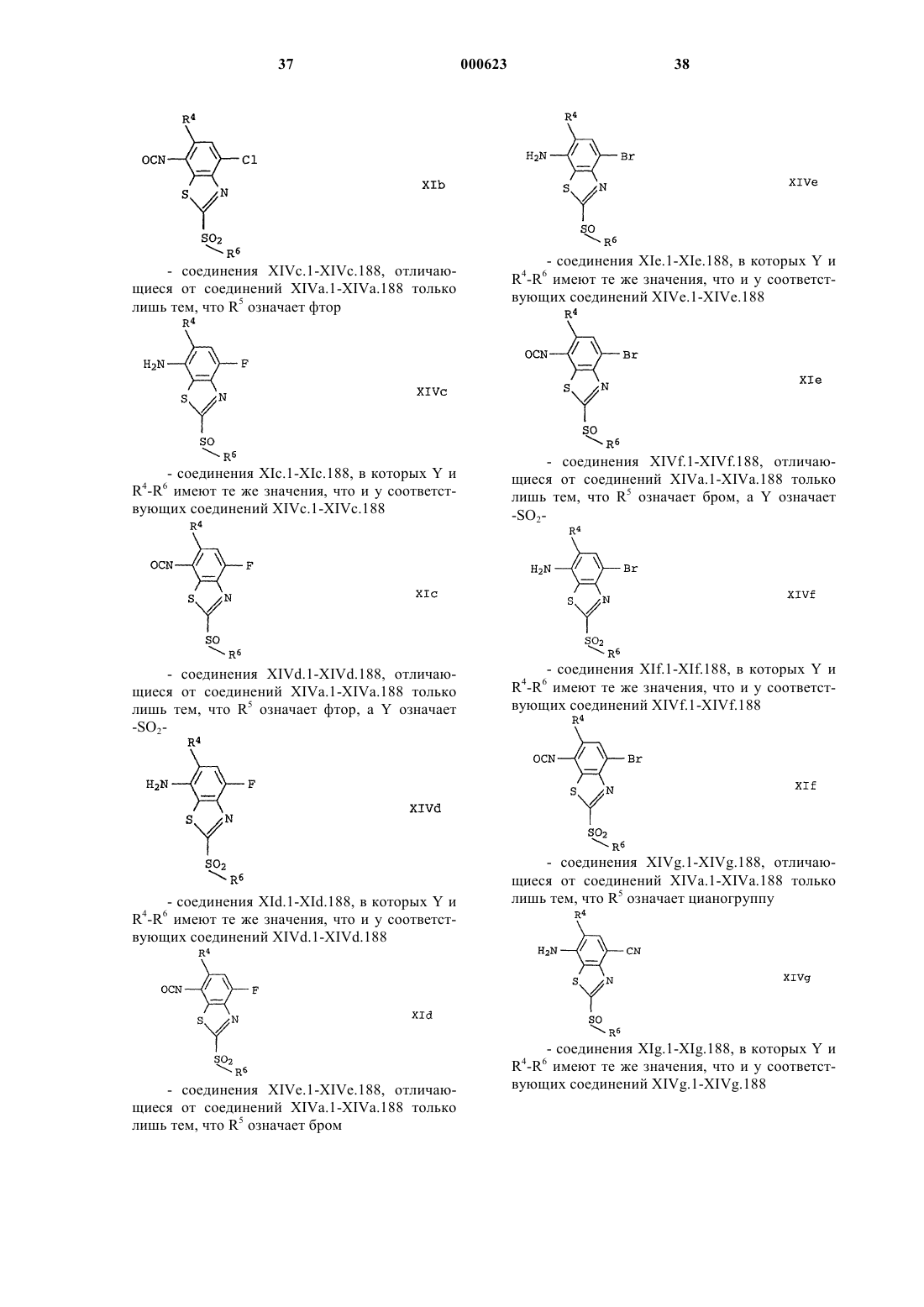
Замещенные бензотиазолы в качестве средств защиты растений.
Номер патента: 623
Опубликовано: 29.12.1999
Авторы: Мисслитц Ульф, Вестфален Карл-Отто, Менке Олаф, Хайштрахер Элизабет, Хампрехт Герхард, Шэфер Петер, Вальтер Хельмут, Цагар Кирилл
Формула / Реферат
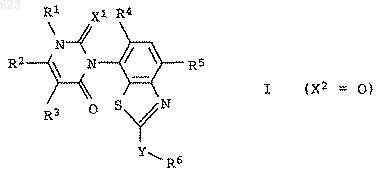
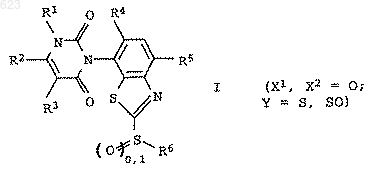
1. Замещенные бензтиазолы общей формулы I
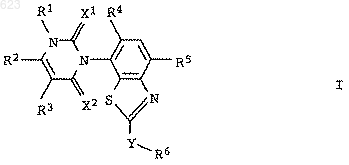
в которой переменные имеют следующее значение:
Х1 и Х2 независимо друг от друга означают кислород или серу;
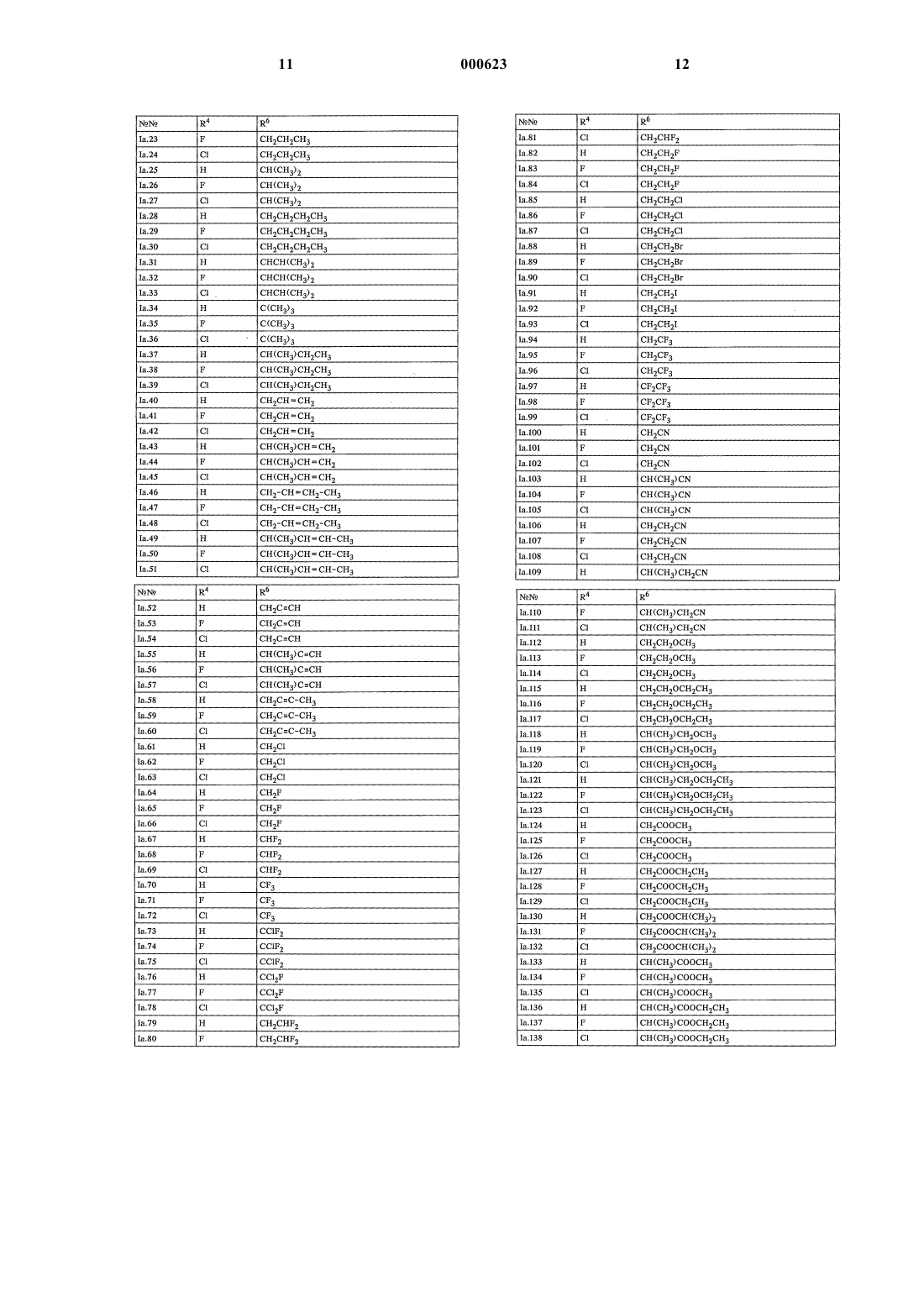
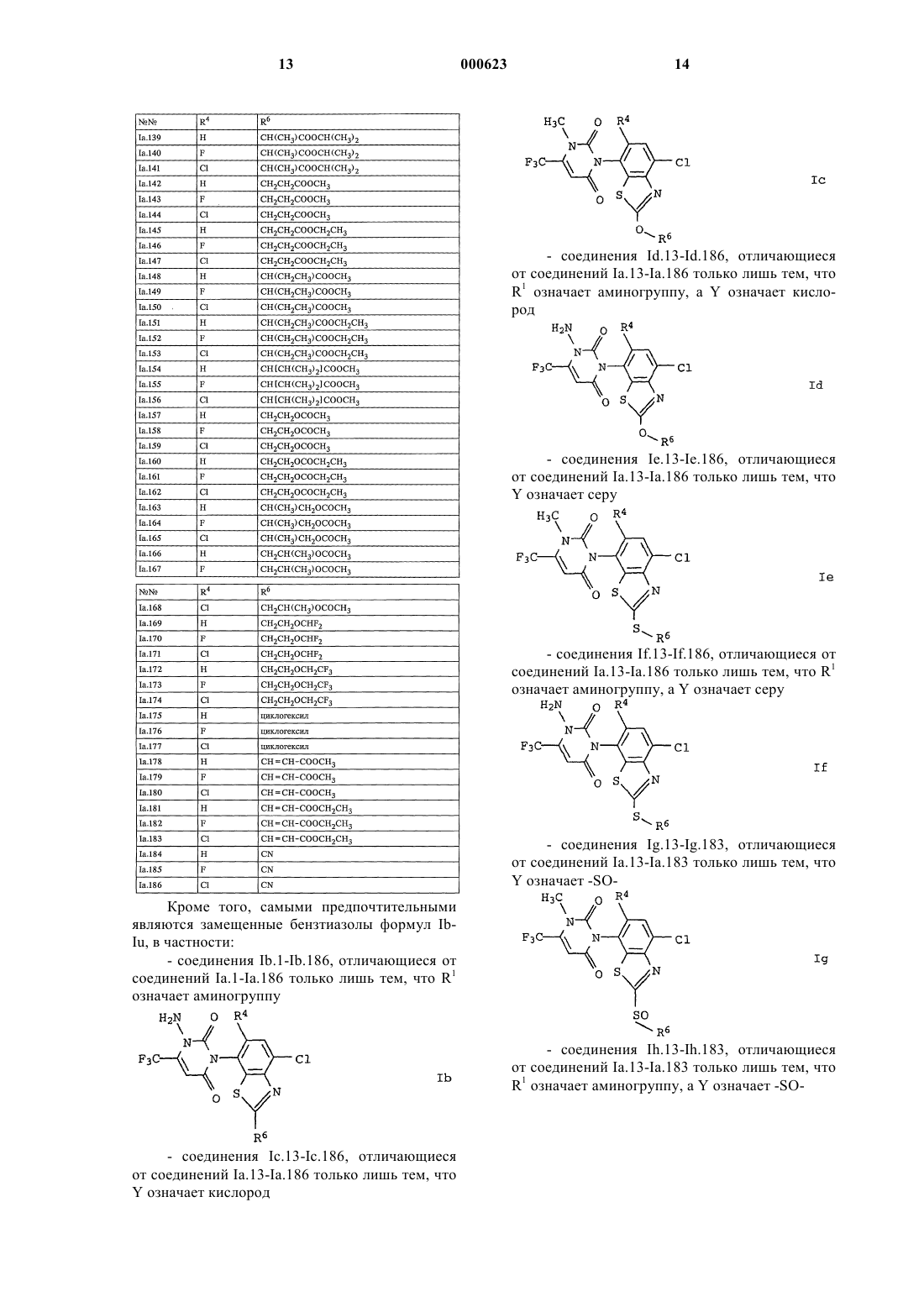
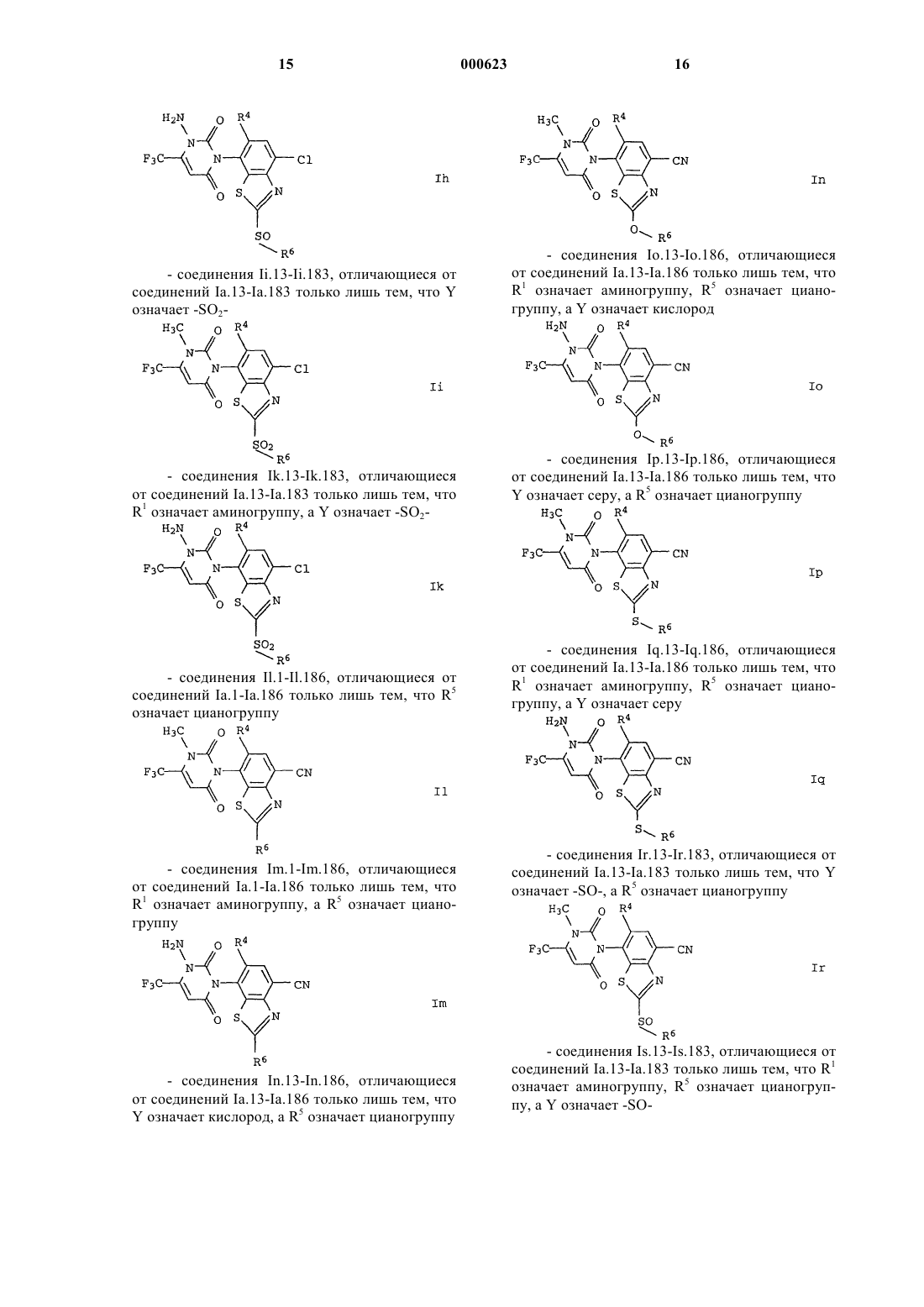
R1 означает водород, амино, С1-С6алкил или С1-C6гaлoгeнaлкил;
R2 означает водород, галоген, С1-С6алкил, С1-С6галогеналкил, С1-
С6алкилтио, С1-С6алкилсульфинил или С1-С6алкилсульфонил;
R3 означает водород, галоген или С1-С6алкил;
R4 означает водород или галоген;
R5 означает циано, галоген, С1-С6алкил, С1-С6галогеналкил, C1-С6алкокси или С1-С6галогеналкокси;
Y представляет собой химическую связь, кислород, серу, -SO- или -SO2-;
R6 означает водород, циано, галоген, С3-С6циклоалкил, С1-С6галогеналкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил или C1-С6алкил, причем названные циклоалкильные, алкильные, алкенильные и алкинильные остатки могут быть замещены цианогруппой, C1-С6алкоксигруппой, С1-С6алкилтиогруппой, (С1-С6алкокси)карбонилом, С1-С6алкиламинокарбонилом, ди(С1-С6алкил)аминокар-бонилом, (С1-С6алкил)карбанилоксигруппой, С1-С6галогеналкоксигруппой, С1-С6галогеналкилтиогруппой или С3-С6циклоалкилом, при условии, что R6 может означать циано только в тех случаях, когда Y представляет собой химическую связь, кислород или серу, и R6 может означать галоген только в тех случаях, когда Y представляет собой химическую связь,
а также пригодные для применения в сельском хозяйстве соли соединений I.
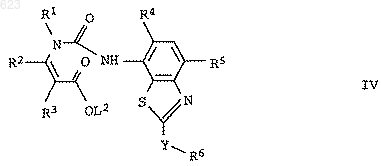
2. Енаминовые эфиры формулы IV
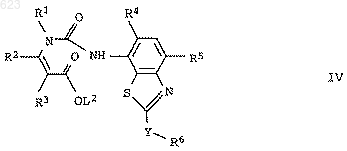
где L2 означает C1-С6алкил или фенил, а переменные R1-R6 и Y имеют значения, указанные в п.1.
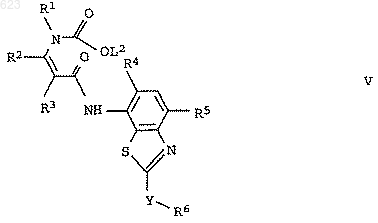
3. Енаминкарбоксилаты формулы V
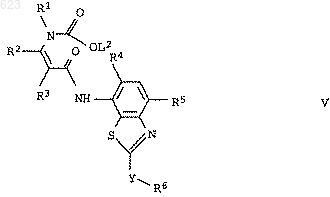
где L2 означает С1-С6алкил или фенил, а переменные R1-R6 и Y имеют значения, указанные в п.1.
4. Изоцианаты формулы XI
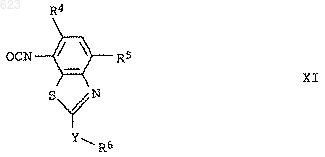
где Y представляет собой -SO- или -SO2-, а переменные R4-R6 имеют значения, указанные в п.1.
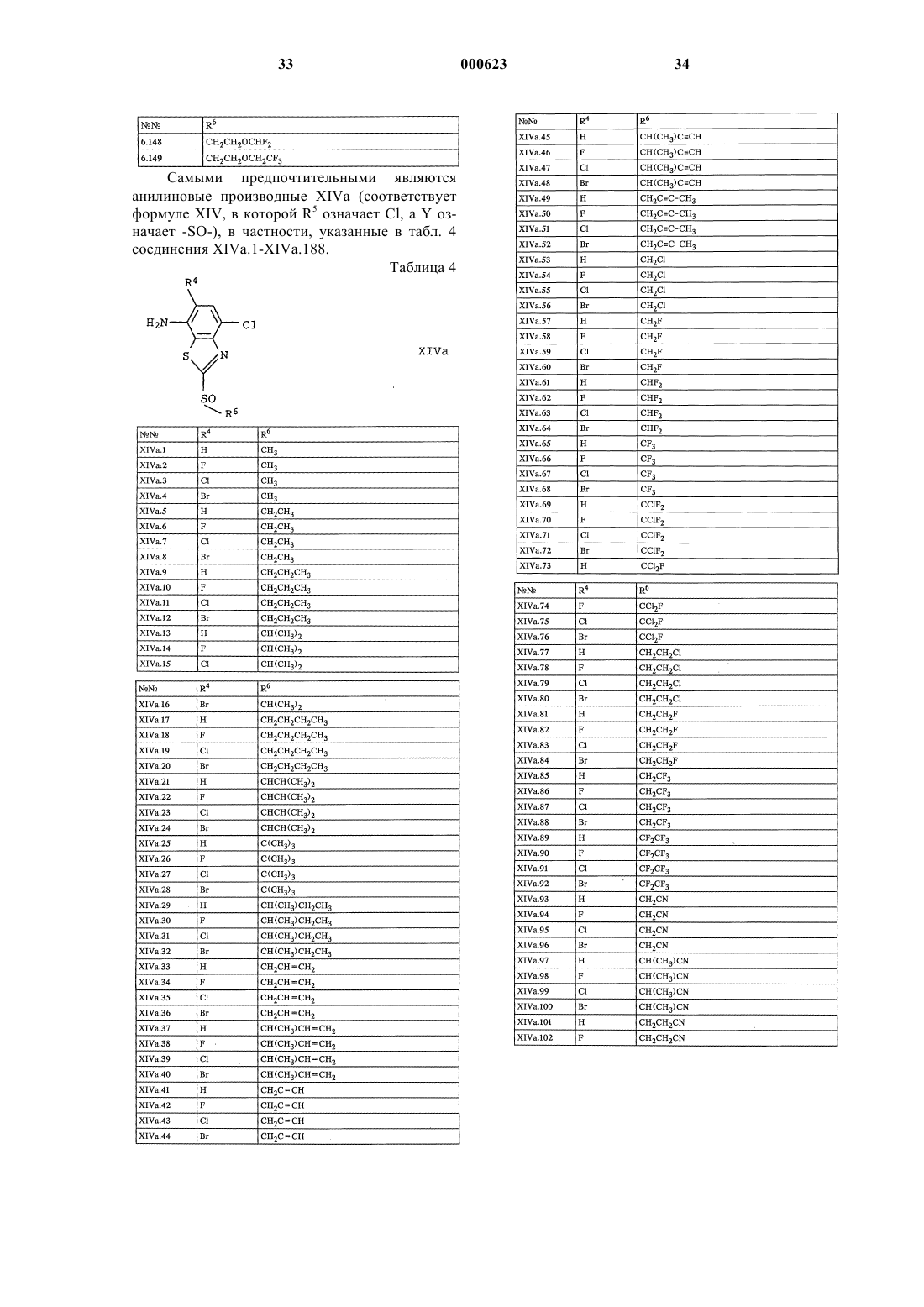
5. Производные анилина формулы XIV
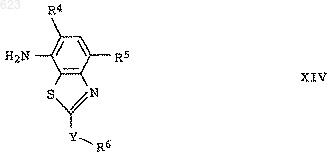
где Y представляет собой -SO- или -SO2-, а переменные R4-R6 имеют значения, указанные в п.1.
6. Гербицидные препараты, содержащие гербицидно эффективное количество, по крайней мере, одного замещенного бензтиазола формулы I или одной из пригодных для применения в сельском хозяйстве солей соединения I по п.1 и, по крайней мере, один инертный жидкий и/или твердый наполнитель, а также при необходимости, по крайней мере, одно поверхностно-активное вещество.
7. Средства десикации и/или дефолиации растений, содержащие обладающее десикантным и/или дефолиантным действием количество, по крайней мере, одного замещенного бензтиазола формулы I или одной из пригодных для применения в сельском хозяйстве солей соединения I по п.1, и, по крайней мере, один инертный жидкий и/или твердый наполнитель, а также при необходимости, по крайней мере, одно поверхностно-активное вещество.
8. Способ борьбы с нежелательной растительностью, отличающийся тем, что гербицидно эффективным количеством, по крайней мере, одного замещенного бензтиазола формулы I или одной из пригодных для применения в сельском хозяйстве солей соединения I по п.1 воздействуют на растения, среду их произрастания или на посевной материал.
9. Способ десикации и/или дефолиации растений, отличающийся тем, что обладающим десикантным и/или дефолиантным действием количеством, по крайней мере, одного замещенного бензтиазола формулы I или одной из пригодных для применения в сельском хозяйстве солей соединения I по п.1 воздействуют на растения.
10. Способ получения замещенных бензтиазолов формулы I по п.1, отличающийся тем, что либо
а) замещенный бензтиазол формулы I, где R1 означает водород, а Х1 означает кислород

алкилируют или аминируют, либо
б) замещенный бензтиазол формулы I, где Х2 означает кислород,
обрабатывают сульфирующим реагентом, либо
в) замещенный бензтиазол формулы I, где группировка YR6 представляет собой хлор, бром, -SO2-алкил или -SO2-галогеналкил, подвергают взаимодействию со спиртом HOR6 или меркаптаном HSR6, либо
г) замещенный бензтиазол формулы I, где Х1 и Х2 означают кислород, a Y означает серу или -SO-,
окисляют, либо
д) енаминовый эфир формулы IV
или енаминкарбоксилат формулы V
циклизуют, либо
е) 2-аминобензтиазол формулы VI
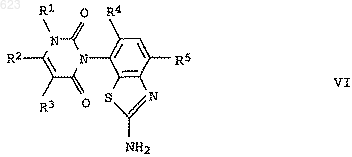
диазотируют и продукт подвергают реакции Зандмейера или одному из ее вариантов.
Текст
1 Настоящее изобретение относится к новым замещенным бензтиазолам общей формулы I в которой переменные имеют следующее значение:X1 и X2 независимо друг от друга означают кислород или серу;R4 означает водород или галоген;Y представляет собой химическую связь,кислород, серу, -SO- или -SО 2-;R6 означает водород, циано, галоген, С 3 С 6 циклоалкил,С 1-С 6 галогеналкил,С 3 С 6 алкенил, С 3-С 6 галогеналкенил, С 3-С 6 алкинил или С 1-С 6 алкил, причем названные циклоалкильные, алкильные, алкенильные и алкинильные остатки могут быть замещены цианогруппой,С 1-С 6 алкоксигруппой,С 1 С 6 алкилтиогруппой,(С 1-С 6 алкокси)карбонилом,С 1-С 6 алкиламинокарбонилом,ди(С 1 С 6 алкил)аминокарбонилом, (С 1-С 6 алкил)карбонилоксигруппой, С 1-С 6 галогеналкоксигруппой,С 1-С 6 галогеналкилтиогруппой или С 3 С 6 циклоалкилом, при условии, что R6 может означать циано только в тех случаях, когда Y представляет собой химическую связь, кислород или серу, и R6 может означать галоген только в тех случаях, когда Y представляет собой химическую связь,а также к пригодным для применения в сельском хозяйстве солям соединений I. Кроме того, изобретение относится- к гербицидным препаратам и средствам десикации/дефолиации растений, содержащим соединения I в качестве действующих субстанций,- к способу получения соединений I,- к способам борьбы с нежелательной растительностью и десикации и/или дефолиации растений с помощью соединений I, а также к новым промежуточным продуктам формул IV,V, XI и XIV, из которых получают соединения I. Обладающие гербицидной эффективностью бензтиазолы с определенными гетероциклами в положении 7 уже известны из международной заявки WO 92/20675 и из заявки Герма 000623 2 нии DE-A 4241658. В WO 92/20675 указывается также на возможное десикантное/дефолиантное действие описанных в этой заявке соединений. Однако гербицидная эффективность известных соединений по отношению к вредоносным грибам далеко не полностью удовлетворяет необходимым требованиям. Исходя из этого, в основу настоящего изобретения была положена задача получить новые бензтиазолы с более совершенными гербицидными свойствами. Целью изобретения является также получение новых соединений,обладающих десикантным/дефолиантным действием. В соответствии с указанной задачей были получены замещенные бензтиазолы формулы I,определение которых представлено выше. Далее были получены гербицидные препараты, содержащие в своем составе соединения I и обладающие очень хорошим гербицидным действием. Кроме того, были разработаны способ получения этих препаратов и способ борьбы с нежелательной растительностью с помощью соединений I. Далее было установлено, что соединения I пригодны также для десикации и дефолиации частей растений, в частности таких культур, как хлопчатник, картофель, рапс, подсолнечник, соя или бобовые, прежде всего хлопчатник. В соответствии с этим были получены средства десикации и/или дефолиации растений, созданы способ получения этих средств и способ десикации и/или дефолиации растений с помощью соединений I. Соединения формулы I в зависимости от типа замещения могут содержать один либо несколько центров хиральности и в этих случаях могут быть представлены в виде смесей энантиомеров или диастереомеров. Предметом изобретения в соответствии с этим являются также как чистые энантиомеры или диастереомеры, так и их смеси. Замещенные бензтиазолы формулы I могут быть представлены в виде их пригодных для применения в сельском хозяйстве солей, причем тип соли, как правило, существенной роли не играет. В принципе могут применяться соли таких оснований и также кислотно-аддитивные соли, гербицидное действие которых не уступает таковому свободных соединений I. В качестве основных солей пригодны, в первую очередь, соли щелочных металлов,предпочтительно соли натрия и калия, соли щелочно-земельных металлов, предпочтительно соли кальция и магния, соли переходных металлов, предпочтительно соли цинка и железа, а также аммониевые соли, в которых ион аммония при необходимости может нести от одного до четырех С 1-С 4 алкильных, гидрокси-С 1 С 4 алкильных заместителей и/или один фенильный либо бензильный заместитель, предпочтительно соли диизопропиламмония, тетраметиламмония, тетрабутиламмония, триметилбензи 3 ламмония и триметил-(2-гидроксиэтил)аммония, далее, фосфониевые соли, сульфониевые соли, такие предпочтительно, как соли три-(С 1-C4 алкил)сульфония, и сульфоксониевые соли, предпочтительно такие, как соли три(С 1-С 4 алкил)сульфоксония. Из числа кислотно-аддитивных солей следует назвать, в первую очередь, гидрохлориды и гидробромиды, сульфаты, нитраты, фосфаты,оксалаты или додецилбензолсульфонаты. Органические фрагменты молекул, указанные выше при расшифровке значений заместителей R1-R6, представляют собой как, в частности, обозначение галогенобобщающие понятия,включающие индивидуальные обозначения отдельных членов групп. Все углеродные цепи,т.е. все алкильные, галогеналкильные, алкоксильные, алкилтио-, алкилсульфинильные, алкилсульфонильные, галогеналкоксильные, галогеналкилтио-, алкоксикарбонильные, алкиламинокарбонильные, диалкиламинокарбонильные,алкилкарбонилокси-, алкенильные, галогеналкенильные и алкинильные фрагменты могут быть прямоцепочечными либо разветвленными. Многократно галогенированные галогеналкильные, галогеналкоксильные, галогеналкилтио- и галогеналкенильные остатки могут нести идентичные или различные атомы галогена. Конкретно приняты, в частности, следующие обозначения:- С 1-С 6 галогеналкил: С 1-С 6 алкильный остаток, как указано выше, замещенный частично либо полностью фтором, хлором, бромом и/или йодом, т.е., например, хлорметил, дихлорметил,трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил,хлордифторметил, 2-фторэтил, 2-хлорэтил, 2 бромэтил, 2-йодэтил, 2,2-дифторэтил, 2,2,2 трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2 дифторэтил,2,2-дихлор-2-фторэтил,2,2,2 трихлорэтил, пентафторэтил, 2-фторпропил, 3 фторпропил,2,2-дифторпропил,2,3 дифторпропил, 2-хлорпропил, 3-хлорпропил,2,3-дихлорпропил,2-бромпропил,3 бромпропил,3,3,3-трифторпропил,3,3,3 трихлорпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1(хлорметил)-2-хлорэтил,1-(бромметил)-2 бромэтил,4-фторбутил,4-хлорбутил,4 бромбутил и нонафторбутил, 5-фторпентил, 5 хлорпентил, 5-бромпентил, 5-йодпентил, ундекафторпентил, 6-фторгексил, 6-хлоргексил, 6 бромгексил, 6-йодгексил и додекафторгексил;- С 1-С 6 алкокси, а также алкоксильные фрагменты С 1-С 6 алкокси-С 1-С 6 алкила,С 1 С 6 алкокси-С 3-С 6 алкенила,С 1-С 6 алкокси-С 3 С 6 алкинила,С 1-С 6 алкокси-С 3-С 6 циклоалкила,(С 1-С 6 алкокси)карбонила, (С 1-С 6 алкокси)карбонил-С 1-С 6 алкила,(C1-С 6 алкокси)карбонил-С 3 С 6 алкенила,(С 1-С 6 алкокси)карбонил-С 3 С 6 алкинила и- С 1-С 6 галогеналкокси, а также галогеналкоксильные фрагменты C1-С 6 галогеналкокси-С 1 С 6 алкила, С 1-С 6 галогеналкокси-С 3-С 6 алкенила,С 1-С 6 галогеналкокси-С 3-С 6 алкинила и С 1 С 1 С 6 галогеналкокси-С 3-С 6 циклоалкила: С 6 алкоксильный остаток, как указано выше,замещенный частично либо полностью фтором,хлором, бромом, и/или йодом, т.е., например,хлорметокси, дихлорметокси, трихлорметилокси, фторметокси, дифторметокси, трифторметокси, хлорфторметокси, дихлорфторметокси,хлордифторметокси,2-фторэтокси,2 хлорэтокси, 2-бромэтокси, 2-йодэтокси, 2,2 5 дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2 фторэтокси,2-хлор-2,2-дифторэтокси,2,2 дихлор-2-фторэтокси, 2,2,2-трихлорэтокси, пентафторэтокси,2-фторпропокси,3-фторпропокси, 2,2-дифторпропокси, 2,3-дифторпропокси, 2-хлорпропокси, 3-хлорпропокси, 2,3 дихлорпропокси,2-бромпропокси,3 бромпропокси, 3,3,3-трифторпропокси, 3,3,3 трихлорпропокси, 2,2,3,3,3-пентафторпропокси,гептафторпропокси,1-(фторметил)-2 фторэтокси, 1-(хлорметил)-2-хлорэтокси, 1(бромэтил)-2-бромэтокси, 4-фторбутокси, 4 хлорбутокси, 4-бромбутокси и нонафторбутокси,5-фторпентокси,5-хлорпентокси,5 бромпентокси, 5-йодпентокси, ундекафторпентокси, 6-фторгексокси, 6-хлоргексокси, 6 бромгексокси, 6-йодгексокси и додекафторгексокси;- С 1-С 6 галогеналкилтио, а также галогеналкилтиофрагменты С 1-С 6 галогеналкилтио-С 1 С 6 алкила, С 1-С 6 галогеналкилтио-C3-С 6 алкенила,С 1-С 6 галогеналкилтио-С 3-С 6 алкинила и С 1 С 6 галогеналкилтио-С 3-С 6 циклоалкила: С 1-С 6 алкилтио, как указано выше, замещенный частично либо полностью фтором, хлором и/или бромом, т.е. например, дифторметилтио, трифторметилтио, хлордифторметилтио, бромдифторметилтио, 2-фторэтилтио, 2-хлорэтилтио, 2 бромэтилтио, 2-йодэтилтио, 2,2-дифторэтилтио,2,2,2-трифторэтилтио, 2,2,2-трихлорэтилтио, 2 хлор-2-фторэтилтио, 2-хлор-2,2-дифторэтилтио,2,2-дихлор-2-фторэтилтио, пентафторэтилтио,2-фторпропилтио, 3-фторпропилтио, 2-хлорпропилтио, 3-хлорпропилтио, 2-бромпропилтио,3-бромпропилтио, 2,2-дифторпропилтио, 2,3 дифторпропилтио, 2,3-дихлорпропилтио, 3,3,3 трифторпропилтио,2,2,3,3,3-пентафторпропилтио, гептафторпропилтио, 1-(фторметил)-2 фторэтилтио, 1-(хлорметил)-2-хлорэтилтио, 1(бромметил)-2-бромэтилтио, 4-фторбутилтио, 4 хлорбутилтио,4-бромбутилтио,5 фторпентилтио,5-хлорпентилтио,5 000623- С 3-С 6 алкенил, а также алкенильные фрагменты С 1-С 6 алкокси-С 3-С 6 алкенила, С 1 С 6 алкилтио-С 3-С 6 алкенила, (С 1-С 6 алкокси)карбонил-С 3-С 6 алкенила, С 1-С 6 алкиламинокарбонил-С 3-С 6 алкенила, ди(С 1-С 6 алкил)аминокарбонил-С 3-С 6 алкенила, (С 1-С 6 алкил)карбанилоксиС 3-С 6 алкенила, С 1-С 6 галогеналкокси-С 3-С 6 алкенила, С 1-С 6 галогеналкилтио-С 3-С 6 алкенила и С 3 С 6 циклоалкил-С 3-С 6 алкенила: проп-1-ен-1-ил,проп-2-ен-1-ил, 1-метилэтенил, н-бутен-1-ил, нбутен-2-ил, н-бутен-3-ил, 1-метилпроп-1-ен-1 ил, 2-метилпроп-1-ен-1-ил, 1-метилпроп-2-ен-1 ил, 2-метилпроп-2-ен-1-ил, н-пентен-1-ил, нпентен-2-ил, н-пентен-3-ил, н-пентен-4-ил, 1 метилбут-1-ен-1-ил, 2-метилбут-1-ен-1-ил, 3 метилбут-1-ен-1-ил, 1-метилбут-2-ен-1-ил, 2 метилбут-2-ен-1-ил, 3-метилбут-2-ен-1-ил, 1 метилбут-3-ен-1-ил, 2-метилбут-3-ен-1-ил, 3 метилбут-3-ен-1-ил, 1,1-диметилпроп-2-ен-1-ил,1,2-диметилпроп-1-ен-1-ил, 1,2-диметилпроп-2 ен-1-ил, 1-этилпроп-1-ен-2-ил, 1-этилпроп-2-ен 1-ил, н-гекс-1-ен-1-ил, н-гекс-2-ен-1-ил, н-гекс 3-ен-1-ил, н-гекс-4-ен-1-ил, н-гекс-5-ен-1-ил, 1 метилпент-1-ен-1-ил, 2-метилпент-1-ен-1-ил, 3 метилпент-1-ен-1-ил, 4-метилпент-1-ен-1-ил, 1 метилпент-2-ен-1-ил, 2-метилпент-2-ен-1-ил, 3 метилпент-2-ен-1-ил, 4-метилпент-2-ен-1-ил, 1 метилпент-3-ен-1-ил, 2-метилпент-3-ен-1-ил, 3 метилпент-3-ен-1-ил, 4-метилпент-3-ен-1-ил, 1 метилпент-4-ен-1-ил, 2-метилпент-4-ен-1-ил, 3 метилпент-4-ен-1-ил,4-метилпент-4-ен-1-ил,1,1-диметилбут-2-ен-1-ил, 1,1-диметилбут-3-ен 1-ил, 1,2-диметилбут-1-ен-1-ил, 1,2-диметилбут 2-ен-1-ил,1,2-диметилбут-3-ен-1-ил,1,3 диметилбут-1-ен-1-ил, 1,3-диметилбут-2-ен-1 ил, 1,3-диметилбут-3-ен-1-ил, 2,2-диметилбут-3 ен-1-ил,2,3-диметилбут-1-ен-1-ил,2,3 диметилбут-2-ен-1-ил, 2,3-диметилбут-3-ен-1 ил, 3,3-диметилбут-1-ен-1-ил, 3,3-диметилбут-2 ен-1-ил, 1-этилбут-1-ен-1-ил, 1-этилбут-2-ен-1 ил, 1-этилбут-3-ен-1-ил, 2-этилбут-1-ен-1-ил, 2 этилбут-2-ен-1-ил, 2-этилбут-3-ен-1-ил, 1,1,2 триметилпроп-2-ен-1-ил, 1-этил-1-метилпроп-2 ен-1-ил, 1-этил-2-метилпроп-1-ен-1-ил и 1-этил 2-метилпроп-2-ен-1-ил;- С 3-С 6 галогеналкенил: С 3-С 6 алкенил, как указано выше, замещенный частично либо полностью фтором, хлором, бромом и/или йодом,т.е., например, 2-хлораллил, 3-хлораллил, 2,3 дихлораллил,3,3-дихлораллил,2,3,3 трихлораллил,2,3-дихлорбут-2-енил,2 бромаллил, 3-бромаллил, 2,3-дибромаллил, 3,3 дибромаллил, 2,3,3-трибромаллил и 2,3 дибромбут-2-енил;- С 3-С 6 алкинил, а также алкинильные фрагменты С 1-С 6 алкокси-С 3-С 6 алкинила, С 1 С 6 алкилтио-С 3-С 6 алкинила, (С 1-С 6 алкокси)карбонил-С 3-С 6 алкинила, С 1-С 6 алкиламинокарбонил-С 3-С 6 алкинила,ди(С 1-С 6 алкил)аминокар 000623- циано-С 3-С 6 алкинил: например, 3 цианопропаргил,4-цианобут-2-ин-1-ил,5 цианопент-3-ин-1-ил и 6-цианогекс-4-ин-1-ил. С учетом применения предлагаемых соединений формулы I в качестве гербицидов или в качестве соединений, обладающих десикантным/дефолиантным действием, переменные имеют предпочтительно следующие значения, а именно, индивидуально либо в соответствующем сочетании: Х 1 означает кислород; Х 2 означает кислород или серу, прежде всего кислород;R1 означает С 1-С 6 алкил или С 1 С 6 галогеналкил, прежде всего амино или С 1 С 6 алкил, особенно предпочтителен метил;R3 означает водород или галоген, прежде всего водород;R5 означает циано или галоген, прежде всего циано, хлор или бром, особенно предпочтителен хлор;Y представляет собой химическую связь,серу, -SO- или -SO2-, прежде всего химическую связь или серу;R6 означает водород, галоген, С 3 С 6 циклоалкил, С 1-С 6 галогеналкил, С 3-С 6 алкенил или С 1-С 6 алкил, причем названные циклоалкильные, алкильные и алкенильные остатки могут быть замещены цианогруппой, C1 С 6 алкоксильной группой, (С 1-С 6 алкокси)карбонилом,(С 1-С 6 алкил)карбонилоксигруппой или С 1-С 6 галогеналкоксильной группой, при условии, что R6 может означать галоген только в тех случаях, когда Y представляет собой химическую связь. Особенно предпочтительны те соединения формулы I, в которых R6 означает один из остатков 6.5-6.63 или, если Y представляет собой химическую связь, означает также один из остатков 6.1-6.4 (табл. 1). Таблица 1 С учетом применения замещенных бензтиазолов формулы I в качестве гербицидов самыми предпочтительными являются бензтиазолы формулы Iа (соответствует формуле I, в которой R1 означает СН 3, R2 означает CF3, R3 означает Н, R5 означает Сl, X1 и X2 означают О, Y представляет собой химическую связь), прежде всего соединения Ia.1-Ia.186 из табл. 2. Таблица 2- соединения Id.13-Id.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения Ie.13-Ie.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения If.13-If.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что R1 означает аминогруппу, a Y означает серу- соединения Ig.13-Ig.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, чтоY означает -SOКроме того, самыми предпочтительными являются замещенные бензтиазолы формул IbIu, в частности:- соединения Ib.1-Ib.186, отличающиеся от соединений Ia.1-Ia.186 только лишь тем, что R1 означает аминогруппу- соединения Ih.13-Ih.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, что- соединения Ic.13-Ic.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения Ii.13-Ii.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, что Y означает -SO2- соединения Ik.13-Ik.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, что- соединения Il.1-Il.186, отличающиеся от соединений Ia.1-Ia.186 только лишь тем, что R5 означает цианогруппу- соединения Im.1-Im.186, отличающиеся от соединений Ia.1-Ia.186 только лишь тем, что- соединения In.13-In.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения Io.13-Io.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения Ip.13-Ip.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения Iq.13-Iq.186, отличающиеся от соединений Ia.13-Ia.186 только лишь тем, что- соединения Ir.13-Ir.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, что Y означает -SO-, a R5 означает цианогруппу- соединения Is.13-Is.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, что R1 означает аминогруппу, R5 означает цианогруппу, a Y означает -SO 17- соединения It.13-It.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, что R5 означает цианогруппу, а Y означает -SO2- соединения Iu.13-Iu.183, отличающиеся от соединений Ia.13-Ia.183 только лишь тем, чтоR1 означает аминогруппу, R5 означает цианогруппу, а Y означает -SO2 Замещенные бензтиазолы формулы I могут быть получены различным путем, например, с помощью одного из следующих способов: Способ А. Взаимодействие замещенного бензтиазола формулы I, где R1 означает водород, с соединением формулы II, осуществляемое по известной технологииL1 представляет собой обычную уходящую группу, такую как галоген, предпочтительно хлор,бром или йод,(галоген)алкилсульфонилокси, предпочтительно метилсульфонилокси или трифторметилсульфонилокси, арилсульфонилокси, предпочтительно толуолсульфонилокси, и алкоксисульфонилокси, предпочтительно метоксисульфонилокси или этоксисульфонилокси. Обычно работают в инертном органическом растворителе, например, в протонном растворителе, таком как низшие спирты, предпочтительно в метаноле или этаноле, при необходимости в смеси с водой, или в апротонном растворителе, например, в простом алифатическом либо циклическом эфире, таком как метил-трет 000623 18 бутиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран и диоксан, в алифатическом кетоне,таком как ацетон, диэтилкетон и этилметилкетон, в амиде, таком как диметилформамид и N-метилпирролидон, в сульфоксиде, таком как диметилсульфоксид, в мочевине, такой как тетраметилмочевина и 1,3-диметилтетрагидро 2(1 Н)-пиримидинон, в эфире карбоновой кислоты, таком как этиловый эфир уксусной кислоты,или в галогенированном алифатическом либо ароматическом углеводороде, таком как дихлорметан, дихлорэтан, хлорбензол и дихлорбензолы. При необходимости можно работать в присутствии основания, причем приемлемы как неорганические основания, например, карбонаты, такие как карбонат натрия и карбонат калия,гидрокарбонаты, такие как гидрокарбонат натрия и гидрокарбонат калия, или гидриды щелочных металлов, такие как гидрид натрия и гидрид калия, так и органические основания,например, амины, такие как триэтиламин, пиридин и N,N-диэтиланилин, или алкоголяты щелочных металлов, такие как метанолят натрия,этанолят натрия и трет-бутанолят калия. Количество основания и алкилирующего агента II составляет предпочтительно соответственно от 0,5- до 2-кратного молярного количества в пересчете на количество исходного соединения I (где R1 является водородом). Температура реакции находится, как правило, в интервале от 0 С до температуры кипения реакционной смеси, прежде всего в интервале от 0 до 60 С. Один из предпочтительных вариантов способа состоит в том, что соль соединения I, полученную циклизацией соединения IV, где R1 является Н, или соединения V, где R1 является Н,согласно способу Ж, алкилируют без выделения из реакционной смеси, которая может еще содержать избыточное основание, например, гидрид натрия, алкоголят натрия или карбонат натрия. При невозможности получения непосредственно путем циклизации в основных условиях, описанной в способе Ж соли тех соединенийI, в которых R1 означает водород, можно получить также по известной технологии из продуктов способов Г-И. С этой целью смешивают,например, водный раствор неорганического либо органического основания с замещенным бензтиазолом I, где R1 представляет собой водород. Солеобразование в этом случае происходит обычно уже при 20-25 С с достаточной скоростью. Особенно целесообразно получать натриевую соль за счет растворения замещенного бензтиазола I, где R1 является водородом, в водном растворе гидроксида натрия при 20-25 С, применяя при этом бензтиазол I (где R1 означает Н) и гидроксид натрия в примерно эквимолярных количествах. Соответствующую соль бензтиа 19 зола I в таких случаях можно выделять затем,например, путем осаждения с помощью соответствующего инертного растворителя либо путем выпаривания растворителя. Соли замещенных бензтиазолов I, ион металла которых не является ионом щелочного металла, могут быть получены обычно "пересаливанием" соответствующей соли щелочного металла (т.е. за счет замены указанных ионов один на другой) в водном растворе, равно как и соли аммония, фосфония, сульфония и сульфоксония - с помощью гидроксидов аммиака, фосфония, сульфония или сульфоксония. Таким путем можно получить, например, металлические соли бензтиазолов, нерастворимые в воде. Способ Б. Взаимодействие замещенного бензтиазола формулы I, где R1 означает водород, с электрофильным аминирующим реагентом в присутствии основания В качестве аминирующего реагента до настоящего времени особенно хорошо зарекомендовал себя 2,4-динитрофеноксиамин, однако возможно также применение, например, гидроксиламин-O-сульфоновой кислоты (HOSA), уже известной из литературы как аминирующий реагент (ср., например, Е. Hofer и др., Synthesis 1983, 466; W. Friedrichsen и др., Heterocycles 20Perkin Trans. 1987, 2787). Аминирование может осуществляться по известной методике (см., например, Т. Sheradsky, Tetrahedron Lett. 1968, 1909; M.P. Wentland и др., Journ. Med. Chem. 27 (1984) 1103 и прежде всего европейские заявки ЕР-А 240194, ЕР-А 476697 и ЕР-А 517181, где описывается аминирование урацилов). Обычно реакцию проводят в полярном растворителе, например, в диметилформамиде,N-метилпирролидоне, диметилсульфоксиде или этилацетате, зарекомендовавшем себя до настоящего времени как особенно пригодный для указанной цели. В качестве основания приемлемы среди прочих карбонаты щелочных металлов, такие как карбонат калия, алкоголяты щелочных металлов, такие как метилат натрия и третбутанолят калия, или гидриды щелочных металлов, такие как гидрид натрия. Количество основания и аминирующего реагента составляет предпочтительно соответственно от 0,5- до 2-кратного молярного коли 000623 20 чества в пересчете на количество исходного соединения. Способ В. Сульфирование замещенного бензтиазола формулы I, где Х 2 означает кислород Сульфирование осуществляют, как правило, в инертном растворителе либо разбавителе,например, в ароматическом углеводороде, таком как толуол и ксилолы, в простом эфире, таком как диэтиловый эфир, 1,2-диметоксиэтан и тетрагидрофуран, или в органическом амине, таком как пиридин. В качестве сульфирующего реагента наиболее пригодны сульфид фосфора (V) и 2,4 бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан 2,4-дитион ("реагент Лауссона"). Для практически полного завершения реакции достаточным является обычно 1-5-кратное молярное количество в пересчете на сульфируемое исходное соединение. Температура реакции находится обычно в интервале от 20 до 200 С, предпочтительно в интервале от 40 С до температуры кипения реакционной смеси. Способ Г. Взаимодействие замещенного бензтиазола формулы I, где группировка -YR6 представляет собой хлор, бром, алкилсульфонил или галогеналкилсульфонил, осуществляемое по известной технологии со спиртом либо меркаптаном формулы III в присутствии основания Реакцию целесообразно проводить в инертном растворителе, например, в простом эфире, таком как диэтиловый эфир, метил-третбутиловый эфир, диметоксиэтан, диэтиленгликольдиметиловый эфир, тетрагидрофуран и диоксан, в кетоне, таком как ацетон, диэтилкетон,этилметилкетон и циклогексанон, в диполярном апротонном растворителе, таком как ацетонитрил, диметилформамид, N-метилпирролидон и диметилсульфоксид, в протонном растворителе,таком как метанол и этанол, в ароматическом,при необходимости галоидированном углеводороде, таком как бензол, хлорбензол и 1,2 дихлорбензол, в гетероароматическом растворителе, таком как пиридин и хинолин, либо в смеси таких растворителей. Предпочтительны из указанных тетрагидрофуран, ацетон, диэтилкетон и диметилформамид. 21 В качестве оснований при этом могут служить, например, гидроксиды, гидриды, алкоксиды, карбонаты или гидрокарбонаты щелочных и щелочно-земельных металлов, третичные алифатические амины, такие как триэтиламин,N-метилморфолин и N-этил-N,N-диизопропиламин, би- и трициклические амины, такие как диазабициклоундекан (ДБУ) и диазабициклооктан (ДАБЦО), или ароматические азотистые основания, такие как пиридин, 4-диметиламинопиридин и хинолин. Возможны также сочетания различных оснований. Предпочтительными основаниями являются гидрид, гидроксид и карбонат натрия, карбонат калия, метилат и этилат натрия и трет-бутилат калия. Обычно исходные вещества применяют приблизительно в стехиометрических количествах, однако с учетом условий проведения способа или для обеспечения максимальной полноты превращения исходного соединения I (X1, Х 2 означают О; -YR6 представляет собой Сl, Вr,-SО 2-алкил, -SО 2-галогеналкил) может быть также предпочтителен избыток того или иного компонента. Молярное соотношение между спиртом либо меркаптаном III и основанием составляет,как правило, от 1:1 до 1:3. Концентрация исходных веществ в растворителе обычно составляет от 0,1 до 5,0 моль/л. Реакцию можно осуществлять при температурах в интервале от 0 С до температуры дефлегмации используемого растворителя, соответственно смеси растворителей. Способ Д. Окисление замещенного бензтиазола формулы I, где Y представляет собой серу, с получением соединения I, где Y представляет собой-SO-, осуществляемое по известной технологии Пригодными для указанной реакции окислителями являются, например, пероксид водорода, органические пероксиды, такие как пероксид уксусной кислоты, пероксид трифторуксусной кислоты, м-хлорпербензойная кислота,трет-бутилгидропероксид и третбутилгипохлорит, а также неорганические соединения, такие как метаиодат натрия, хромовая кислота и азотная кислота. Обычно работают, в зависимости от окислителя, в органической кислоте, такой как уксусная кислота и трихлоруксусная кислота, в хлорированном углеводороде, таком как метиленхлорид, хлороформ и 1,2-дихлорэтан, в аро 000623 22 матическом углеводороде, таком как бензол,хлорбензол и толуол, либо в протонном растворителе, таком как метанол и этанол. Приемлемы также смеси названных растворителей. Температура реакции находится, как правило, в интервале от 30 С до температуры кипения соответствующей реакционной смеси,причем предпочтителен нижний диапазон температур. Целесообразно исходное соединение и окислитель применять в приблизительно стехиометрическом соотношении, однако возможно также использование того или другого компонента в избытке. Способ Е. Окисление замещенного бензтиазола формулы I, где Y представляет собой серу или -SO-,с получением соединения I, где Y представляет собой -SO2-, осуществляемое по известной технологии (ср., например, Houben-Weyl, Methoden В качестве окислителей для указанной реакции пригодны среди прочих пероксид водорода, органические пероксиды, такие как пероксид уксусной кислоты, пероксид трифторуксусной кислоты и м-хлорпербензойная кислота,далее, неорганические окислители, такие как перманганат калия. Присутствие катализатора,например вольфрамата, может оказать положительное воздействие на ход реакции. Как правило, реакцию проводят в инертном растворителе, причем в зависимости от окислителя могут применяться, например, органические кислоты, такие как уксусная кислота и пропионовая кислота, хлорированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан, ароматические углеводороды либо галогеноуглеводороды, такие как бензол,хлорбензол и толуол, или вода. Возможно также применение смесей названных растворителей. Обычно работают при температурах в интервале от 30 С до температуры кипения соответствующей реакционной смеси, предпочтительно в интервале от 10 С до температуры кипения. Целесообразно применять исходное соединение I, где Х означает S или SO, и окислитель в приблизительно стехиометрических количествах. Однако для оптимизации превращения исходного соединения в требуемый продукт 23 может оказаться целесообразным использовать окислитель в избытке. Способ Ж. Циклизация енаминового эфира формулыIV или енаминкарбоксилата формулы V в присутствии основанияL2 означает низкомолекулярный алкил,предпочтительно С 1-С 4 алкил, или фенил. Как правило, циклизацию осуществляют в инертном органическом растворителе либо разбавителе, являющимся апротонным, например, в простом алифатическом или циклическом эфире, таком как 1,2-диметоксиэтан, тетрагидрофуран и диоксан, в ароматическом углеводороде, таком как бензол и толуол, или в полярном растворителе, таком как диметилформамид и диметилсульфоксид. Пригодны для этих целей также смеси из полярного растворителя и углеводорода, такого как н-гексан. В зависимости от исходного соединения в качестве разбавителя можно использовать также воду. В качестве оснований могут рассматриваться предпочтительно алкоголяты щелочных металлов, прежде всего алкоголяты натрия, гидроксиды щелочных металлов, прежде всего гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, прежде всего карбонат натрия и карбонат калия, и гидриды металлов,прежде всего гидрид натрия. При использовании в качестве основания гидрида натрия оказалось целесообразным работать в простом алифатическом или циклическом эфире, в частности в диметилформамиде либо в диметилсульфоксиде. Для успешного проведения реакции достаточным является обычно 0,5-2-кратное молярное количество основания в пересчете на количество соединения IV, соответственно соединения V. Температура реакции находится, как правило, в интервале от 78 С до температуры кипения соответствующей реакционной смеси,прежде всего в интервале от 60 до +60 С. Если R1 в формуле IV или V представляет собой водород, то продукт способа получают в виде соли металла, причем металл соответствует катиону применяемого основания. Соль можно выделять и очищать по известной технологии, а при необходимости ее с помощью кисло 000623 24 ты можно переводить в свободное соединение I,где R1 означает водород. Способ З. Перевод 2-аминобензтиазола формулы VI в соединения формулы I, где YR6 представляет собой галоген, циано, родано или цианато, по методу Зандмейера либо по одному из его вариантов При осуществлении реакции такого типа 2 аминобензтиазол VI сначала переводят в диазониевую соль, а именно, предпочтительно по известной технологии взаимодействием 2 аминобензтиазола VI в водном растворе кислоты, например, в водном растворе соляной кислоты, бромисто-водородной кислоты или серной кислоты, с нитритом, таким как нитрит натрия и нитрит калия. Затем полученную таким путем диазониевую соль без последующей очистки можно подвергать в присутствии катализатора на основе переходного металла, прежде всего соли меди (I), такой как хлорид меди (I),бромид меди (I), цианид меди (I), роданид меди(I) и цианат меди (I), взаимодействию с соответствующей кислотой HYR6, такой как соляная кислота и бромисто-водородная кислота, либо с соответствующей металлической солью кислоты HYR6, такой как хлорид лития, натрия и калия, бромид лития, натрия и калия, цианид лития, натрия и калия и роданид лития, натрия и калия. Другая возможность получения диазониевой соли бензтиазола VI состоит в том, что соединение VI подвергают в безводной системе,например, в ледяном уксусе, содержащем хлористый водород, в диоксане, в абсолютном этаноле, в тетрагидрофуране, в ацетонитриле либо в ацетоне, взаимодействию с эфиром азотистой кислоты, таким как трет-бутилнитрит и изопропилнитрит. В этом случае диазотирование можно проводить в присутствии катализатора на основе переходного металла и соответствующей металлической соли группировки -YR6, как указано выше. Температура реакции находится обычно в интервале от 30 до +80 С. Компоненты реакции диазотирования применяют обычно в приблизительно стехиометрических количествах, однако может оказаться целесообразным один из компонентов использовать в избытке, например, для обеспечения максимально полного превращения одного из других компонентов. Катализатор на основе переходного металла может применяться в меньшем количестве, в приблизительно эквимолярном количестве либо в избытке, а кислоты и соли металлов - либо в приблизительно эквимолярных количествах,либо предпочтительно в значительном избытке. Способ И. Перевод 2-аминобензтиазола формулы VI в соединения формулы I, где Y представляет собой серу, "меркаптодедиазотированием" Для осуществления указанной реакции 2 аминобензтиазол VI в безводной системе, например, в простом эфире, таком как диоксан и тетрагидрофуран, в нитриле, таком как ацетонитрил, либо в галогеноуглеводороде, таком как метиленхлорид и 1,2-дихлорэтан, взаимодействием с эфиром азотистой кислоты, таким как трет-бутилнитрит и изопропилнитрит, переводят в соответствующую диазониевую соль бензтиазола. Затем эту соль подвергают взаимодействию с соответствующим дисульфидом R6-SSR6. Однако само диазотирование может также осуществляться уже в присутствии дисульфида. Реакцию проводят обычно в диапазоне температур от 30 до +80 С. Компоненты реакции применяют предпочтительно в приблизительно стехиометрических количествах при условии, что избыток одного или нескольких компонентов целесообразен,например, лишь для обеспечения максимально полного превращения соединения VI. Замещенные бензтиазолы формулы I с одним или несколькими центрами хиральности получают обычно в виде смесей энантиомеров либо диастереомеров, разделение которых на практически чистые изомеры при необходимости осуществляют по обычным для таких случаев методам, например, путем кристаллизации или хроматографии на оптически активном адсорбате. Чистые, оптически активные изомеры можно получить, например, также из соответствующих оптически активных исходных материалов. Те замещенные бензтиазолы формулы I, в которых R1 означает водород, могут быть переведены по известной методике в их соли (см. соответствующие пояснения в способе А). Енаминовые эфиры формулы IV являются новыми. Их получение можно осуществлять по известным методам, в частности с помощью одного из следующих способов. Способ К. Взаимодействие эфира -кетокарбоновой кислоты формулы VII с мочевиной формулыL2 представляет собой низкомолекулярный алкил, предпочтительно C1-С 4 алкил, или фенил. Предпочтительно работают в основном в безводной среде в инертном растворителе либо разбавителе, особенно предпочтительно в присутствии кислотного или основного катализатора. В качестве растворителя, соответственно разбавителя, приемлемы, в первую очередь,азеотропно смешиваемые с водой органические растворители, например, ароматические углеводороды, такие как бензол, толуол и о-, м-, пксилол, галоидированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорметан и хлорбензол, простые алифатические и циклические эфиры, такие как 1,2-диметоксиэтан,тетрагидрофуран и диоксан, или циклогексан, а также спирты, такие как метанол и этанол. В качестве кислотных катализаторов пригодны предпочтительно сильные минеральные кислоты, такие как серная кислота и соляная кислота, фосфорсодержащие кислоты, такие как ортофосфорная кислота и полифосфорная кислота, органические кислоты, такие как птолуолсульфоновая кислота, а также кислотные катиониты, как, например, "Amberlyst 15" (фирма Fluka). В качестве основных катализаторов пригодны среди прочих гидриды щелочных металлов, такие как гидрид натрия, равно как и относящиеся к особенно предпочтительным алкоголяты щелочных металлов, такие как метанолят и этанолят натрия. Мочевину VIII и эфир -кетокарбоновой кислоты VII применяют преимущественно в приблизительно стехиометрических количествах или же работают с небольшим избытком того или другого компонента до порядка 10 мол.%. Достаточным для проведения реакции является обычно количество катализатора от 0,5 до 2 мол.% по отношению к количеству исходных соединений. Как правило, реакцию проводят при температурах в интервале от 60 до 120 С, для быстрого же удаления образующейся воды работают 27 предпочтительно при температуре кипения реакционной смеси. Способ Л. Взаимодействие енольного эфира формулыL2 и L3 представляют собой соответственно низкомолекулярный алкил, предпочтительно С 1-С 4 алкил, или фенил. Реакцию проводят предпочтительно в инертном, смешиваемом с водой, органическом растворителе, например, в простом алифатическом или циклическом эфире, таком как 1,2 диметоксиэтан, тетрагидрофуран и диоксан,либо в низшем спирте, прежде всего в этаноле,причем температура реакций находится обычно в интервале от 50 до 100 С, предпочтительно при температуре кипения реакционной смеси. Однако реакцию можно осуществлять также в ароматическом разбавителе, таком как бензол,толуол, и о-, м-, п-ксилол, причем в этом случае рекомендуется добавлять либо кислотный катализатор, такой как соляная кислота и птолуолсульфоновая кислота, либо основание,например, алкоголят щелочного металла, такой как метанолят натрия или этанолят натрия. В этом варианте способа температура реакции обычно находится также в интервале от 50 до 100 С, предпочтительно, однако, от 60 до 80 С. Касательно соотношений компонентов по массе следует соблюдать таковые, указанные для способа К. Способ М. Взаимодействие енаминового эфира формулы Х с изоцианатом формулы XIL2 представляет собой низкомолекулярный алкил, предпочтительно C1-С 4 алкил, или фенил. Реакцию целесообразно осуществлять в присутствии в основном безводного апротонного органического растворителя либо разбавителя, например, простого алифатического или циклического эфира, такого как диэтиловый 28 эфир, 1,2-диметоксиэтан, тетрагидрофуран и диоксан, алифатического или ароматического углеводорода, такого как н-гексан, бензол, толуол и о-, м-, п-ксилол, галоидированного, алифатического углеводорода, такого как метиленхлорид, хлороформ, тетрахлорметан, 1,2 дихлорэтан и хлорбензол, апротонного, полярного растворителя, такого как диметилформамид, триамид гексаметилфосфорной кислоты и диметилсульфоксид, или же в присутствии смеси названных растворителей. При необходимости можно работать также в присутствии основания типа гидрида металла,такого, например, как гидрид натрия и калия,либо органического третичного основания, такого как триэтиламин и пиридин, причем органическое основание может служить одновременно растворителем. Эдукты применяют преимущественно в стехиометрических количествах или работают с небольшим избытком одного или другого компонента до порядка 10 мол.%. При работе без растворителя в присутствии органического основания последнее применяют в большем избытке. Температура реакции находится предпочтительно в интервале от 80 до +50 С, прежде всего от 60 до +30 С. В особенно предпочтительном варианте осуществления способа полученный енаминовый эфир IV взаимодействием с избыточным основанием непосредственно (т.е. "in situ") согласно способу Ж переводят в целевой продукт формулы I. Способ Н. Взаимодействие енаминового эфира формулы Х с уретаном формулы XIIL2 и L4 независимо друг от друга представляют собой низкомолекулярный алкил, предпочтительно C1-С 4 алкил, или фенил. Эту реакцию целесообразно осуществлять в апротонном, полярном растворителе либо разбавителе, таком как диметилформамид, 2 бутанон, диметилсульфоксид и ацетонитрил, а именно, предпочтительно в присутствии основания, например, алкоголята щелочного или щелочно-земельного металла, прежде всего алкоголята натрия, такого как метанолят натрия,карбоната щелочного или щелочно-земельного металла, прежде всего карбоната натрия, или же гидрида щелочного металла, такого как гидрид лития и гидрид натрия. Достаточным является обычно 1-2-кратное молярное количество основания в пересчете на количество исходных соединений Х или XII. 29 Температура реакции находится в основном в диапазоне от 80 до 180 С, предпочтительна температура кипения реакционной смеси. Касательно соотношения исходных соединений по массе следует соблюдать таковые, указанные для способа К. В особенно предпочтительном варианте осуществления способа в качестве основания применяют алкоголят натрия, а образующийся в ходе реакции спирт непрерывно отгоняют. Полученные таким путем енаминовые эфиры IV без выделения из реакционной смеси могут подвергаться согласно способу Ж циклизации с получением в результате соли замещенного бензтиазола формулы I (где R1 является Н). Способ О. Взаимодействие изоцианата формулы XIII с производным анилина формулы XIVL2 представляет собой низкомолекулярный алкил, предпочтительно С 1-С 4 алкил, или фенил. Эту реакцию целесообразно осуществлять в основном в безводном, апротонном, органическом растворителе либо разбавителе, например,в присутствии простого алифатического или циклического эфира, такого как диэтиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран и диоксан, алифатического либо ароматического углеводорода, такого как н-гексан, бензол, толуол и о-, м, п-ксилол, галоидированного, алифатического углеводорода, такого как метиленхлорид, хлороформ, тетрахлорметан, 1,2 дихлорэтан и хлорбензол, апротонного, полярного растворителя, такого как диметилформамид, триамид гексаметилфосфорной кислоты и диметилсульфоксид, или же в присутствии смеси названных растворителей. При необходимости можно работать в присутствии основания типа гидрида металла,такого как гидрид натрия и калия, алкоголята щелочного или щелочно-земельного металла,такого как метанолят натрия, этанолят натрия и трет-бутанолят калия, или органического азотистого основания, такого как триэтиламин и пиридин, причем органическое основание может служить одновременно растворителем. Эдукты применяют преимущественно в приблизительно стехиометрических количествах или один из компонентов используют в избытке до порядка 20 мол.%. При работе без растворителя в присутствии органического основания последнее применяют в еще большем избытке. Температура реакции находится, как правило, в интервале от 80 до +150 С, предпочтительно от 30 С до температуры кипения соответствующей реакционной смеси. 30 Енаминкарбоксилаты формулы V также являются новыми; их также можно получать по известной методике, например, взаимодействием амида формулы XV с уретаном формулыL2 представляет собой низкомолекулярный алкил, предпочтительно С 1-С 4 алкил, или фенил. Эту реакцию осуществляют предпочтительно в практически безводном растворителе либо разбавителе при нормальном давлении,особенно предпочтительно в присутствии кислотного катализатора. Для получения енаминкарбоксилатов V,где R1 представляет собой амино, рекомендуется применять соединения формулы XVI с защищенной аминогруппой (например, в качестве гидразона). В качестве растворителей, соответственно разбавителей, могут рассматриваться в первую очередь азеотропно смешиваемые с водой органические жидкости, например, ароматические углеводороды, такие как бензол, толуол и о-,м-, п-ксилол, либо галоидированные углеводороды, такие как тетрахлорметан и хлорбензол. Приемлемыми катализаторами являются прежде всего сильные минеральные кислоты,такие как серная кислота, органические кислоты, такие как п-толуолсульфоновая кислота,фосфорсодержащие кислоты, такие как ортофосфорная кислота и полифосфорная кислота,или же катиониты, такие как "Amberlyst 15"(фирма Fluka). Достаточные для реакции температуры находятся в основном в интервале от приблизительно 70 до 150 С; однако, для быстрого удаления образующейся в ходе реакции воды целесообразно работать при температуре кипения соответствующей реакционной смеси. Соединения XV и XVI применяют обычно в примерно стехиометрических количествах; предпочтительно, однако, соединение XVI использовать с небольшим избытком порядка 20 мол.%. Амид формулы XV может быть получен следующим путем: Р. Реакцию осуществляют предпочтительно в безводном инертном апротонном растворителе, 31 например, в галоидированном углеводороде,таком как метиленхлорид, хлороформ, тетрахлорметан и хлорбензол, в ароматическом углеводороде, таком как бензол, толуол и о-, м-, пксилол, либо в простом алифатическом или циклическом эфире, таком как диэтиловый эфир, дибутиловый эфир, 1,2-диметоксиэтан,тетрагидрофуран и диоксан. Температура реакции находится, как правило, в интервале от приблизительно 70 до 140 С, прежде всего от 100 до 120 С. Соединения XVII и XIV применяют обычно в примерно стехиометрических количествах или же один из компонентов используют в избытке порядка 10 мол.%."Аминолиз" соединений формулы VII,осуществляемый взаимодействием с соединениями формулы XIV, может проводиться без растворителя (ср., например, J. Chem. Soc. DyesSynth. Coll. том IV, 80 (1963), J. Am. Chem. Soc. 70, 2402, (1948 либо в инертном безводном растворителе, соответственно разбавителе, прежде всего в апротонном растворителе, например, в ароматическом углеводороде, таком как толуол и ксилолы, или в галоидированном ароматическом углеводороде, таком как хлорбензол. При этом рекомендуется работать в присутствии основного катализатора, например, высоко кипящего амина (см., например, Helv. Chim.Acta 11, 779 (1928) и патент США 2416738) или пиридина. Предпочтительно температура реакции находится в интервале от приблизительно 130 до 160 С. Исходные соединения применяют преимущественно в примерно стехиометрических количествах либо работают с небольшим избытком того или другого компонента до порядка 10 мол.%. При работе в присутствии основного катализатора достаточным является количество последнего от 0,5 до 2 мол.% в пересчете на количество одного из эдуктов. Исходные соединения, указанные для отдельных способов, либо известны, либо могут быть получены по известной технологии или аналогично одному из вышеописанных способов. Изоцианаты формулы XI и производные анилина формулы XIV являются новыми, еслиY представляет собой -SO- или -SO2-. Предпочтительны из них такие соединения XI и XIV, в которых R4, R5 и/или R6 имеют следующее значение:R5 означает циано или галоген, прежде всего циано, фтор, хлор или бром;R6 означает С 1-С 6 галогеналкил, С 3 С 6 алкенил, С 3-С 6 алкинил или С 1-С 6 алкил, который может быть незамещенным либо может быть замещен цианогруппой, С 1-С 6 алкоксильной группой, (С 1-С 6 алкокси)карбонилом,(С 1-С 6 алкил)карбонилоксигруппой или С 1 С 6 галогеналкоксильной группой. Особенно предпочтительны те соединения формул XI иXIV, в которых R6 означает один из остатков из группы 6.101-6.149 (табл. 3). Таблица 3 Самыми предпочтительными являются анилиновые производные XIVa (соответствует формуле XIV, в которой R5 означает Cl, a Y означает -SO-), в частности, указанные в табл. 4 соединения XIVa.1-XIVa.188. Таблица 4 Кроме того, самыми предпочтительными являются изоцианаты XIa-XIh и анилиновые производные XIVb-XIVh, в частности:R4-R6 имеют те же значения, что и у соответствующих соединений XIVa.1-XIVa.188- соединения XIVb.1-XIVb.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что Y означает -SO2R4R6 имеют те же значения, что и у соответствующих соединений XIVb.l-XIVb.188- соединения XIVc.1-XIVc.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что R5 означает фторR -R имеют те же значения, что и у соответствующих соединений XIVc.1-XIVc.188 4- соединения XIVd.1-XIVd.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что R5 означает фтор, а Y означаетR4-R6 имеют те же значения, что и у соответствующих соединений XIVd.1-XIVd.188- соединения XIVe.1-XIVe.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что R5 означает бромR4-R6 имеют те же значения, что и у соответствующих соединений XIVe.1-XIVe.188- соединения XIVf.1-XIVf.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что R5 означает бром, а Y означаетR4-R6 имеют те же значения, что и у соответствующих соединений XIVf.1-XIVf.188- соединения XIVg.1-XIVg.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что R5 означает цианогруппуR4-R6 имеют те же значения, что и у соответствующих соединений XIVg.1-XIVg.188- соединения XIVh.1-XIVh.188, отличающиеся от соединений XIVa.1-XIVa.188 только лишь тем, что R5 означает цианогруппу, a Y означает -SO2R4-R6 имеют те же значения, что и у соответствующих соединений XIVh.1-XIVh.188 Изоцианаты формулы XI могут быть получены, например, из производных анилина формулы XIV согласно способу Т Этот способ можно осуществлять в инертном, в основном безводном растворителе или разбавителе либо вообще без растворителя,причем амины XIV предпочтительно подвергают взаимодействию с фосгеном, "фосгенным эквивалентом", таким как дифосген, трифосген и карбонилдиимидазол, или же с трихлорметиловым эфиром хлормуравьиной кислоты. В качестве растворителя или разбавителя могут рассматриваться прежде всего апротонные, органические растворители, например,ароматические углеводороды, такие как толуол и о-, м-, п-ксилол, галоидированные углеводороды, такие как метиленхлорид, хлороформ, 1,2 дихлорэтан и хлорбензол, простые алифатические или циклические эфиры, такие как 1,2 диметоксиэтан, тетрагидрофуран и диоксан, или сложные эфиры, такие как этиловый эфир ук 000623 40 сусной кислоты, а также смеси этих растворителей. Эдукты применяют предпочтительно в приблизительно стехиометрических количествах или один из компонентов используют в избытке порядка 200 мол.%. В зависимости от применяемого производного анилина XIV может оказаться целесообразным добавлять основание, такое как триэтиламин, например, в 0,5-2-кратном молярном количестве в пересчете на количество соединения XIV. Температура реакции находится, как правило, в интервале от 20 С до температуры дефлегмации растворителя или реакционной смеси. Производные анилина формулы XIV могут быть получены, в свою очередь, по известной методике (ср., например, Houben-Weyl, Methoden der Organischen Chemie, изд-во GeorgThieme Verlag, том XI/1, 4-е издание 1957, стр. 431 и далее) восстановлением соответствующих нитропроизводных формулы XVIII В качестве восстановителей могут рассматриваться, в первую очередь,- элементарные металлы, такие как железо,олово и цинк,- водород в присутствии соответствующих катализаторов, таких как палладий или платина на угле или никель Ренея, или- комплексные гидриды, такие как LiAlH4 и NaBH4, необязательно в присутствии катализаторов. В качестве растворителей, в зависимости от восстановителя, пригодны обычно карбоновые кислоты, такие как уксусная кислота и пропионовая кислота, спирты, такие как метанол и этанол, простые эфиры, такие как диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран и диоксан, ароматические углеводороды,такие как бензол и толуол, а также смеси растворителей такого типа. Реакции могут проводиться при температурах в интервале от 100 С до температуры кипения соответствующей реакционной смеси. Исходные соединения применяют обычно в приблизительно стехиометрических количествах; однако, в отдельных случаях может оказаться целесообразным избыток того или другого компонента до порядка 10 мол.%. Соединения формул XI и XIV также могут содержать один или несколько цетров хиральности и в этом случае их получают обычно в виде смесей энантиомеров либо диастереоме 41 ров. Эти смеси при необходимости могут разделяться с помощью обычных для этих целей методов, например, путем кристаллизации или посредством хроматографии на оптически активном адсорбате, на практически чистые изомеры. Чистые, оптически активные изомеры можно получить, например, также из соответствующих оптически активных исходных материалов. Если не указано иное, все вышеописанные способы целесообразно осуществлять при атмосферном давлении либо при собственном давлении соответствующей реакционной смеси. Обработку реакционных смесей осуществляют, как правило, по известным методам, например, разбавлением реакционной смеси водой и последующим выделением требуемого продукта путем фильтрации, кристаллизации или экстракции растворителя, либо удалением растворителя, распределением остатка в смеси воды и соответствующего органического растворителя и последующей обработкой органической фазы с получением требуемого продукта. В основном получение замещенных бензтиазолов формулы I возможно с помощью одного из описанных выше способов синтеза. Однако по соображениям экономичности и технологичности может оказаться целесообразным некоторые соединения I получать из аналогичных замещенных бензтиазолов I, отличающихся, однако, прежде всего значением радикала R6. Соединения формулы I и их пригодные для использования в сельском хозяйстве соли - как в виде смесей изомеров, так и в виде чистых изомеров - могут применяться в качестве гербицидов. Гербицидные препараты, содержащие соединения формулы I, дают очень хороший эффект при борьбе с растительностью на площадях, на которых не возделываются культурные растения, прежде всего при высоких нормах расхода. В посевах таких культур, как пшеница,рис, кукуруза, соя и хлопчатник, эти препараты эффективны против сорняков и вредоносных растений, практически не нанося вреда культурным растениям. Этот эффект достигают прежде всего при низких нормах расхода. В зависимости от соответствующего метода обработки соединения формулы I, соответственно содержащие эти соединения гербицидные препараты могут применяться для уничтожения нежелательной растительности также в целом ряде других культурных растений. Среди таковых можно назвать, например, следующие культуры: Allium сера, Ananas comosus, Arachis hypogaea, Asparagus officinalis. Beta vulgaris spp.durum, Vicia faba, Vitis vinifera и Zea mays. Кроме того, соединения формулы I могут применяться также в культурах, которые благодаря методам селекции и/или генной инженерии приобрели значительную устойчивость к действию гербицидов. Замещенные бензтиазолы формулы I могут применяться также для десикации и/или дефолиации растений. В качестве десикантов они пригодны, прежде всего, для предуборочного подсушивания надземных частей таких культурных растений, как картофель, рапс, подсолнечник и соя. Тем самым обеспечивается возможность полностью механизированной уборки урожая этих важных культур. Интерес с экономической точки зрения представляет далее возможность облегчить сбор урожая цитрусовых, маслин или других видов и сортов семечковых и косточковых плодов и орехов за счет сконцентрированного в определенный промежуток времени значительного снижения или уменьшения прочности сцепления указанных плодов с деревом. Тот же самый механизм, т.е. создание благоприятных условий для образования разделительной ткани между плодами, соответственно листьями и побегами растений, играет важную роль также для хорошо регулируемой дефолиации культурных растений, прежде всего хлопчатника. Кроме того, сокращение времени созревания отдельных растений хлопчатника обеспечивает повышение качества волокон после уборки. Соединения формулы I, соответственно содержащие их гербицидные препараты могут применяться, например, в виде предназначенных для непосредственного опрыскивания водных растворов, порошков, суспензий, в том числе высококонцентрированных водных, масляных или каких-либо других суспензий, или дисперсий, эмульсий, масляных дисперсий, паст,препаратов для опыливания, препаратов для опудривания или гранулятов, которые используют для обработки самыми разными методами,такими как опрыскивание, обработка в виде туманов, опыливание, опудривание или полив. Методика обработки и используемые формы зависят от целей применения, но во всех случа 43 ях должно быть обеспечено максимально тонкое и равномерное распределение действующих веществ по изобретению. В качестве инертных вспомогательных веществ для приготовления предназначенных для непосредственного опрыскивания растворов, эмульсий, паст или масляных дисперсий могут рассматриваться в основном следующие: фракции нефтяного топлива с температурой кипения от средней до высокой, такие как керосин и дизельное топливо, далее каменноугольные масла, а также масла растительного или животного происхождения, алифатические,циклические и ароматические углеводороды,например, парафины, тетрагидронафталин, алкилированные нафталины и их производные,алкилированные бензолы и их производные,спирты, такие как метанол, этанол, пропанол,бутанол и циклогексанол, кетоны, такие как циклогексанон, сильно полярные растворители,например,амины,такие какNметилпирролидон, и вода. Водные формы применения могут приготавливаться из эмульсионных концентратов,суспензий, паст, смачивающихся порошков или диспергируемых в воде гранулятов добавлением воды. Для приготовления эмульсий, паст или масляных дисперсий субстраты как таковые либо после их растворения в масле или растворителе можно с помощью смачивателей, адгезивов, диспергаторов или эмульгаторов гомогенизировать в воде. Возможно также из действующего вещества, смачивателей, адгезивов, диспергаторов или эмульгаторов и необязательно растворителей или масла получать концентраты,пригодные для разбавления водой. В качестве поверхностно-активных веществ (адъювантов) могут использоваться соли щелочных и щелочно-земельных металлов и аммониевые соли ароматических сульфокислот,например, лигнин-, фенол-, нафталин- и дибутилнафталинсульфокислоты, а также соли жирных кислот, алкил- и алкиларилсульфонаты,алкилсульфаты, сульфаты лаурилового эфира и жирных спиртов и соли сульфатированных гекса-, гепта- и октадеканолов, а также гликолевых эфиров жирных спиртов, продукты конденсации сульфированного нафталина и его производных с формальдегидом, продукты конденсации нафталина, соответственно нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфеноловый эфир, этоксилированный изооктил-, октил- или нонилфенол, полигликолевые эфиры алкилфенила и трибутилфенила, алкилариловые полиэфиры спиртов, изотридециловый спирт, конденсаты этиленоксида и жирных спиртов, этоксилированное касторовое масло, полиоксиэтилен- или полиоксипропиленалкиловые эфиры, ацетат эфира лаурилового спирта и полигликоля, сложные эфиры сорбита,отработанный лигнинсульфитный щелок или метилцеллюлоза. 44 Порошковые препараты, препараты для опыливания и опудривания могут приготавливаться путем смешения или совместного измельчения действующих веществ с каким-либо твердым наполнителем. Грануляты, например, грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты могут быть получены за счет связывания действующих веществ с твердыми наполнителями. В качестве таких твердых наполнителей могут служить минеральные земли,в частности кремниевые кислоты, силикагели,силикаты, тальк, каолин, известняк, известь,мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, оксид магния,измельченные синтетические материалы, удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и растительные продукты, такие как мука зерновых, мука из коры деревьев, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или какие-либо другие твердые наполнители. Концентрация действующих веществ I в готовых для применения композициях может варьироваться в широких пределах. Как правило, композиции содержат, по крайней мере, одно действующее вещество в количестве от 0,001 до 98 мас.%, предпочтительно от 0,01 до 95 мас.%. Действующие вещества применяют при этом со степенью чистоты от 90 до 100%, предпочтительно от 95 до 100% (согласно ЯМРспектру). Ниже представлены примеры, поясняющие методику приготовления таких композиций и их состав.Nмоноэтаноламида олеиновой кислоты, 5 мас.ч. кальциевой соли додецилбензолсульфокислоты и 5 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.ч. воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества.II. 20 мас.ч. соединенияI.3 растворяют в смеси, состоящей из 40 мас.ч. циклогексанона,30 мас.ч. изобутанола, 20 мас.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.ч. воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества.III. 20 мас.ч. действующего веществаI.5 растворяют в смеси, состоящей из 25 мас.ч. циклогексанона, 65 мас.ч. получаемой при перегонке нефти фракции нефтяного топлива с температурой кипения 210-280 С и 10 мас.ч. про 45 дукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.ч. воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества.IV. 20 мас.ч. действующего веществаI.7 тщательно перемешивают с 3 мас.ч. натриевой соли диизобутилнафталинсульфо-кислоты,17 мас.ч. натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 60 мас.ч. порошкообразного геля кремниевой кислоты, после чего тщательно измельчают в молотковой мельнице. После тонкого и равномерного распределения смеси в 20000 маc.ч. воды получают раствор для опрыскивания, содержащий 0,1 мас.% действующего вещества.V. 3 мас.ч. действующего веществаI.33 смешивают с 97 мас.ч. тонкодисперсного каолина. Таким путем получают препарат для опыливания, содержащий 3 маc.% действующего вещества.I.11 тщательно смешивают с 2 мас.ч. кальциевой соли додецилбензолсульфокислоты, 8 мас.ч. полигликолевого эфира жирного спирта, 2 мас.ч. натриевой соли конденсата фенолмочевины и формальдегида и 68 мас.ч. парафинового минерального масла. Таким путем получают стабильную масляную дисперсию.VII. 1 маc. ч соединенияI.9 растворяют в смеси, состоящей из 70 мас.ч. циклогексанона,20 мас.ч. этоксилированного изооктилфенола и 10 мас.ч. этоксилированного касторового масла. Таким путем получают стабильный эмульсионный концентрат.VIII. 1 маc. ч. соединенияI.14 растворяют в смеси, состоящей из 80 мас.ч. циклогексанона и 20 мас.ч. Wettol ЕМ 31 (неионный эмульгатор на основе этоксилированного касторового масла; фирма BASF AG). Такие путем получают стабильный эмульсионный концентрат. Действующие вещества формулы I, соответственно гербицидные препараты могут применяться в методах как предвсходовой, так и послевсходовой обработки. Если действующие вещества обладают недостаточной совместимостью с некоторыми культурными растениями,то рекомендуется применять такую технологию обработки, при которой гербицидные препараты следует распылять с помощью соответствующих опрыскивателей так, чтобы они по возможности не попадали на листья чувствительных культур, а были направлены на листья растущих среди них нежелательных растений или на открытые участки почвы (способ направленного опрыскивания, способ ленточного опрыскивания). Нормы расхода действующих веществ формулы I в зависимости от цели обработки,времени года, обрабатываемых растений и ста 000623 46 дии роста составляют от 0,001 до 3,0, предпочтительно от 0,01 до 1,0 кг/га активной субстанции (а.с.). Для расширения спектра действия и достижения синергетического эффекта замещенные бензтиазолы формулы I можно смешивать с многочисленными представителями других групп действующих веществ, обладающих гербицидными или регулирующими рост свойствами, и использовать их таким образом для совместной обработки. В качестве таких сокомпонентов для совместной обработки могут служить, например, 1,2,4-тиадиазолы, 1,3,4 тиадиазолы, амиды, аминофосфорная кислота и ее производные, аминотриазолы, анилиды, арилокси- и гетероарилоксиалкановые кислоты и их производные, бензойная кислота и ее производные, бензотиадиазиноны, 2-(гетароил/ароил)1,3-циклогександионы, гетероарил-арилкетоны,бензилизоксазолидиноны,мета-СFзфенилпроизводные, карбаматы, хинолинкарбоновая кислота и ее производные, хлорацетанилиды, производные циклогексан-1,3-диона, диазины, дихлорпропионовая кислота и ее производные, дигидробензофураны, дигидрофуран-3 оны, динитроанилины, динитрофенолы, дифениловые эфиры, дипиридилы, галогенкарбоновые кислоты и их производные, мочевины, 3 фенилурацилы, имидазолы, имидазолиноны, Nфeнил-3,4,5,6-тeтpaгидpoфтaлимиды, оксадиазолы, оксираны, фенолы, эфиры арилокси- и гетероарилоксифеноксипропионовой кислоты,фенилуксусная кислота и ее производные, 2 фенилпропионовая кислота и ее производные,пиразолы, фенилпиразолы, пиридазины, пиридинкарбоновая кислота и ее производные, пиримидиловые эфиры, сульфонамиды, сульфонилмочевины, триазины, триазиноны, триазолиноны, триазолкарбоксамиды и урацилы. Кроме того, может оказаться полезным и целесообразным соединения формулы I индивидуально либо в сочетании с другими гербицидами применять также в смесях с целым рядом других средств защиты растений для совместной обработки, например, со средствами борьбы против вредителей или фитопатогенных грибов,соответственно бактерий. Интерес представляет далее возможность смешения с растворами минеральных солей, предназначенных для компенсации недостатка питательных веществ и микроэлементов. Можно также вводить добавки нефитотоксичных масел и масляных концентратов. Примеры по получению Пример 1. 3-[2,4-дихлор-6-фторбензтиазол-7-ил]-6 трифторметил-2,4(1 Н,3 Н)-пиримидиндион (соединение I.4). 1,6 г гидрида натрия (97%-ного) помещали в 200 мл абсолютного диметилформамида, после чего при 0-5 С добавляли по каплям 11,0 г этилового эфира 3-амино-4,4,4-трифторбут-2 47 енкарбоновой кислоты. По истечении одного часа перемешивания при этой температуре охлаждали до 30 С и затем по каплям добавляли 16,2 г 2,4-дихлор-6-фтор-7-изоцианатобензтиазола в 50 мл абсолютного тетрагидрофурана. По истечении одного часа перемешивания при этой температуре медленно нагревали до комнатной температуры. Затем смешивали с ледяной водой и устанавливали разбавленной соляной кислотой значение рН 3-4, после чего продукт экстрагировали этиловым эфиром уксусной кислоты. Эфирный раствор сушили и затем концентрировали. 1 Н-ЯМР (250 МГц; в d6-диметилсульфоксиде):[част./млн] = 6,43 (s,1H), 8,06(соединение I.8). К 1,1 г гидрида натрия (97%-ного) в 40 мл абсолютного тетрагидрофурана по каплям добавляли при комнатной температуре 108 мл абсолютного н-пропанола. По истечении 30 мин перемешивания медленно добавляли 7,0 г 3[2,4-дихлор-6-фторбензтиазол-7-ил]-6-трифторметил-2,4(1 Н,3 Н)-пиримидиндиона (соединениеI.4). По истечении 12 ч перемешивания растворитель отгоняли при пониженном давлении,после чего остаток растворяли в воде. Водную фазу смешивали с 10%-ной соляной кислотой до значения рН 3-4. Образовавшийся осадок отфильтровывали, промывали водой и затем сушили. Выход: 5,2 г. 1(sex,2H), 4,53 (t,2H), 6,46 (s,1H), 7,82 (d,1H). Пример 3. 3-[4-хлор-6-фтор-2-пропоксибензтиазол-7 ил]-1-метил-6-трифторметил-2,4(1 Н,3 Н)пиримидиндион (соединение I.9). К смеси из 200 мл абсолютного этилметилкетона, 1,7 г карбоната калия и 5,0 г 3-[4 хлор-6-фтор-2-пропоксибензтиазол-7-ил]-6 трифторметил-2,4(1 Н,3 Н)-пиримидиндиона (соединение I.8) при температуре приблизительно 20 С добавляли по каплям 1,7 г метилиодида. По истечении 12 ч перемешивания при комнатной температуре нерастворимые компоненты отгоняли. Полученный прозрачный раствор концентрировали. Затем остаток растворяли в воде, после чего нейтрализовали разбавленной соляной кислотой. Затем продукт экстрагировали этиловым эфиром уксусной кислоты. В завершение эфирную фазу сушили над сульфатом натрия и концентрировали. Очистку полученного таким путем сырого продукта осуществляли посредством хроматографии на силикагеле(соединение I.15). 0,5 г (20 ммолей) гидрида натрия суспендировали в 50 мл диметилформамида и при охлаждении льдом смешивали с 2,7 г (15 ммолей) метилового эфира 3-амино-4,4,4-трифторбут-2 еновой кислоты. По истечении 1 ч охлаждали до 30 С и к реакционной смеси добавляли изоцианат из предварительной стадии 4.4, растворенный в 20 мл тетрагидрофурана. Далее перемешивали в течение 16 ч при температуре приблизительно 20 С. Затем реакционную смесь смешивали с ледяной водой, после чего подкисляли разбавленной соляной кислотой. Требуемый продукт экстрагировали этилацетатом, после чего органическую фазу сушили над сульфатом магния и в завершение концентрировали. Очистку сырого продукта осуществляли посредством колоночной хроматографии на силикагеле=2,85 (s,3H), 6,26 (s,lH), 7,45 (d,lH). Предварительная стадия 4.1. 4-хлор-6-фтор-2-метилбензтиазол. К раствору из 22 г (0,1 моля) 2,4-дихлор-6 фторбензтиазола и 3,3 г (5 ммолей) дихлорбис(трифенилфосфин)никеля в 100 мл диэтилового эфира добавляли по каплям 67 мл раствора метилхлорида магния в тетрагидрофуране (3 М; 0,2 моля). По истечении 2 ч перемешивания смесь сливали на насыщенный водный раствор хлорида аммония. Требуемый продукт экстрагировали диэтиловым эфиром, после чего объединенные органические фазы промывали водой,сушили над сульфатом магния и в завершение концентрировали. После кристаллизации из петролейного эфира получили 10 г требуемого продукта. 1= 2,85 (s,3H), 7,24 (dd,1H), 7,41 (dd,1H). Предварительная стадия 4.2. 4-хлор-6-фтор-2-метил-7-нитробензтиазол. К раствору из 10 г (50 ммолей) 4-хлор-6 фтор-2-метилбензтиазола в 35 мл концентрированной серной кислоты добавляли раствор из 7 мл концентрированной азотной кислоты в 6 мл концентрированной серной кислоты. По истечении 10 мин смесь сливали при перемешивании в ледяную воду. Затем суспендированный требуемый продукт отделяли и для очистки растворяли в 100 мл смеси циклогексан/этилацетат(3:1). После фильтрации через слой силикагеля из оставшегося раствора получили 8 г требуемого продукта; tпл: 130-132 С. 49 Предварительная стадия 4.3. 7-амино-4-хлор-6-фтор-2-метилбензтиазол. К нагретой до 80 С суспензии из 8 г (32 ммоля) 4-хлор-6-фтор-2-метил-7-нитробензтиазола в 100 мл воды и 9 мл концентрированной соляной кислоты добавляли 6 г железного порошка, после чего в течение 3 ч нагревали до температуры дефлегмации. Затем реакционную смесь смешивали с 200 мл этилацетата. Твердую часть смеси отфильтровывали, а оставшуюся органическую фазу промывали водой, сушили над сульфатом магния и в завершение концентрировали. Выход: 4,5 г. 1= 2,85 (s,3H), 3,93 (s,2H), 7,22 (d,lH). Предварительная стадия 4.4. 4-хлор-6-фтор-7-изоцианато-2-метилбензтиазол. Раствор из 3,2 г (15 ммолей) 7-амино-4 хлор-6-фтор-2-метилбензтиазола и 15 г (76 ммолей) дифосгена в 150 мл толуола нагревали в течение 6 ч до температуры дефлегмации. Полученный после концентрирования сырой продукт непосредственно превращали в действующее вещество I.15. Пример 5. 3-(4-хлор-6-фтор-2-(метилтио)бензтиазол 7-ил)-6-трифторметил-2,4(1 Н,3 Н)-пиримидиндион (соединение I.10). Сначала следующим путем получали 4 хлор-6-фтор-7-изоцианато-2-(метилтио)бензтиазол: раствор из 7 г (28 ммолей) 7-амино-4-хлор 6-фтор-2-(метилтио)бензтиазола и 55 г (0,28 моля) дифосгена в 200 мл толуола нагревали в течение 7 ч до температуры дефлегмации, затем смешивали с 20 г дифосгена (0,1 моля), продолжали нагрев до температуры дефлегмации еще в течение 8 ч и в завершение концентрировали. Затем суспензию из 0,7 г (30 ммолей) гидрида натрия в 50 мл диметилформамида смешивали при охлаждении льдом с 2,7 г (15 ммолей) этилового эфира 3-амино-4,4,4-трифторбут-2 еновой кислоты. По истечении одного часа перемешивания смесь охлаждали до 30 С, после чего ее смешивали с полученным сначала изоцианатом в 50 мл тетрагидрофурана. Далее продолжали перемешивание еще в течение 16 ч при температуре приблизительно 20 С. После добавления ледяной воды смесь подкисляли разбавленной соляной кислотой. Продукт экстрагировали этилацетатом. Отделенную органическую фазу в завершение сушили над сульфатом магния и концентрировали. Выход: 4 г. 1= 2,78 (s,3H), 6,22 (s,lH), 7,35 (d,lH). Предварительная стадия 5.1. 2-амино-4-хлор-6-фторбензтиазол. 30 г 2-хлор-4-фторанилина (0,2 моля) подвергали реакции аналогично предварительной стадии 9.1. Выход: 19,4 г.(d,1H), 7,90 (s,2H). Предварительная стадия 5.2. 4-хлор-6-фтор-2-(метилтио)бензтиазол. 27 г (0,13 моля) 2-амино-4-хлор-6 фторбензтиазола подвергали реакции аналогично предварительной стадии 6.1. Выход: 20 г. 1= 2,80 (s,3H), 7,21 (dd,1H), 7,36 (dd,1H). Предварительная стадия 5.3. 4-хлор-6-фтор-2-метилсульфинил-7 нитробензтиазол. 21,8 г (93 ммоля) 4-хлор-6-фтор-2(метилтио)бензтиазола подвергали реакции аналогично предварительной стадии 4.2. Выход: 21,2 г. 1= 3,16 (s,3H), 7,66 (d,lH). Предварительная стадия 5.4. 7-амино-4-хлор-6-фтор-2-(метилтио)бензтиазол. 19,1 г 4-хлор-6-фтор-2-метилсульфинил-7 нитробензтиазола подвергали реакции аналогично предварительной стадии 4.3 с тем, однако, отличием, что с целью восстановить как нитрогруппу, так и сульфинильную группу проводили нагрев в течение 24 ч до температуры дефлегмации. Выход: 12 г. 1(соединение I.20). 4,0 г (15 ммолей) 7-амино-4,6-дихлор-2(метилтио)бензтиазола подвергали реакции аналогично примеру 5. Выход: 4,4 г. 1= 2,82 (s,3H), 6,27 (s,lH), 7,66 (s,lH). Предварительная стадия 6.1. 4,6-дихлор-2-(метилтио)бензтиазол. К раствору из 34 г (0,16 моля) 2-амино-4,6 дихлорбензтиазола в 1 л 1,2-дихлорэтана добавляли 43,7 г (0,47 моля) диметилсульфида и 154,5 г (1,5 моля) трет-бутилнитрита. По истечении 16 ч перемешивания промывали водой и 10%-ным едким натром, сушили над сульфатом магния и концентрировали. Выход: 34 г; tпл: 108-110 С. Предварительная стадия 6.2. 4,6-дихлор-2-метилтио-7-нитробензтиазол. 23 г(92 ммоля) 4,6-дихлор-2(метилтио)бензтиазола подвергали реакции аналогично предварительной стадии 4.2. Отличие заключалось в том, что очистку сырого продукта осуществляли посредством хроматографии на силикагеле (элюенты: циклогексан/этилацетат = 4:1). Выход: 23 г; tпл: 130-132 С. Предварительная стадия 6.3. 7-амино-4,6-дихлор-2-(метилтио)бензтиазол. 51 5,5 г (19 ммолей) 4,6-дихлор-2-метилтио-7 нитробензтиазола подвергали реакции аналогично предварительной стадии 4.3. Выход: 5,0 г. 1= 2,84 (s,3H), 4,15 (s,2H), 7,39 (s,1H). Пример 7. 3-(4-хлор-6-фтор-2-(метилсульфинил)бензтиазол-7-ил)-1-метил-6-трифторметил 2,4(1 Н,3 Н)-пиримидиндион (соединение I.22) и 3-(4-хлор-6-фтор-2-(метилсульфонил)бензтиазол-7-ил)-1-метил-6-трифторметил 2,4(1 Н,3 Н)-пиримидиндион (соединение 1.23). К раствору из 0,7 г (1,6 ммоля) 3-(4-хлор-6 фтор-2-(метилтио)бензтиазол-7-ил)-1-метил-6 трифторметил-2,4(1 Н,3 Н)-пиримидиндиона в 50 мл дихлорметана добавляли при 0 С 0,6 г (1,7 ммоля) 50%-ной м-хлорпербензойной кислоты. По истечении 16 ч перемешивания промывали последовательно водой, насыщенным водным раствором тиосульфата натрия, водой, 10%-ным едким натром и водой, после чего сушили над сульфатом магния и в завершение концентрировали. Разделение обоих продуктов осуществляли посредством хроматографии на силикагелеI.23, а затем 0,12 г соединения I.22. Пример 8. 3-(4,6-дихлор-2-метилбензтиазол-7-ил)-6 трифторметил-2,4(1 Н,3 Н)-пиримидиндион (соединение I.24). 3,5 г (15 ммолей) 7-амино-4,6-дихлор-2 метилбензтиазола подвергали реакции аналогично примеру 5. Выход: 3 г. 1H-ЯМР (270 МГц; в d6-диметилсульфоксиде):[част./млн] = 2,86 (s,3H), 6,58 (s,1H),8,04 (s,1H). Предварительная стадия 8.1. 4,6-дихлор-2-метил-7-нитробензтиазол. 6,9 г (32 ммоля) 4,6-дихлор-2-метилбензтиазола подвергали реакции аналогично предварительной стадии 4.2. Выход: 8,3 г. 1= 2,91 (s,3H), 7,73 (s,lH). Предварительная стадия 8.2. 7-амино-4,6-дихлор-2-метилбензтиазол. 8,3 г (32 ммоля) 4,6-дихлор-2-метил-7 нитробензтиазола подвергали реакции аналогично предварительной стадии 4.3. Выход: 3,5 г. 1I.26). Из 3,0 г (14 ммолей) 7-амино-4,6 дихлорбензтиазола по описанной в примере 5 технологии получили 3 г целевого продукта.H-ЯMP (270 МГц; в d6-диметилсульфоксиде):[част./млн] = 6,56 (s,1H), 8,12 (s,1H),9,57 (s,1H). Предварительная стадия 9.1. 2-амино-4,6-дихлорбензтиазол. К раствору из 200 г (1,23 моля) 2,4 дихлоранилина и 200 г (2,46 моля) тиоцианата натрия в 1,5 л ледяной уксусной кислоты медленно добавляли по каплям при охлаждении льдом 197 г (1,23 моля) брома. По истечении 16 ч перемешивания при температуре приблизительно 20 С твердую часть смеси отделяли и промывали 10%-ным едким натром и водой. Выход: 205 г. 1(1,23 моля) бромида натрия, после чего по каплям добавляли 16,5 г (0,16 моля) третбутилнитрита. По истечении 16 ч перемешивания реакционную смесь подкисляли 10%-ной соляной кислотой. Затем продукт экстрагировали метил-трет-бутиловым эфиром. Органическую фазу промывали водой, сушили над сульфатом магния и в завершение концентрировали. Очистку сырого продукта осуществляли посредством колоночной хроматографии на силикагеле (элюенты: циклогексан/уксусный эфир = 1:1). Выход: 9,1 г. 1(49 ммолей) 2-бром-4,6-дихлорбензтиазола в 200 мл тетрагидрофурана добавляли по каплям раствор из 98 ммолей метилхлорида магния в тетрагидрофуране. По истечении 2 ч подкисляли 10%-ной соляной кислотой и затем продукт экстрагировали диэтиловым эфиром. Органическую фазу промывали последовательно водой,насыщенным водным раствором гидрокарбоната натрия и повторно водой, сушили над сульфатом натрия и в завершение концентрировали. Очистку сырого продукта осуществляли посредством хроматографии на силикагеле (элюенты: петролейный эфир/метил-трет-бутиловый эфир = 5:1). Выход: 5,2 г. 1 53 5,2 г (26 молей) 4,6-дихлорбензтиазола подвергали реакции аналогично предварительной стадии 4.2. Выход: 5,8 г. 1H-ЯМР (270 МГц; в d6-диметилсульфоксиде):[част./млн] = 8,17 (s,1H), 9,65 (s,1H). Предварительная стадия 9.5. 7-амино-4,6-дихлорбензтиазол. 5,8 г 4,6-дихлор-7-нитробензтиазола подвергали реакции аналогично предварительной стадии 4.3. Выход: 3,0 г. 1H-ЯМР (250 МГц; в d6-диметилсульфоксиде):[част./млн] = 6,11 (s,2H), 7,52 (d,1H),9,38 (d,1H). Пример 10. Этиловый эфир 3-[4-хлор-6-фтор-7-(6 трифторметил-2,4(1 Н,3 Н)-пиримидиндион-3 ил)бензтиазол-2-ил]акриловой кислоты (соединение I.28). 4,0 г (13 ммолей) этилового эфира 3-(7 амино-4-хлор-6-фторбензтиазол-2-ил)акриловой кислоты подвергали реакции аналогично примеру 5. Выход: 0,8 г. 1= 1,34 (t,3H), 4,30 (q,2H), 6,31 (s,1H), 6,75 (d,1H),7,52 (d,1H), 7,88 (d,1H), 9,30 (s,1H). Предварительная стадия 10.1. Этиловый эфир 3-(4-хлор-6-фторбензтиазол-2-ил)акриловой кислоты. К раствору из 12 г (59 ммолей) 2-амино-4 хлор-6-фторбензтиазола в 0,4 л ацетонитрила добавляли 150 г (1,48 моля) этилового эфира акриловой кислоты, 11,4 г (85 ммолей) хлорида меди (II) и 11,4 г (0,11 моля) трет-бутилнитрита. По истечении 3 дней перемешивания смесь подкисляли разбавленной соляной кислотой. Продукт экстрагировали метил-трет-бутиловым эфиром, после чего экстракты сушили над сульфатом магния и в завершение концентрировали. Очистку сырого продукта осуществляли посредством колоночной хроматографии на силикагеле (элюенты: циклогексан/метил-третбутиловый эфир = 19:1). Выход: 9,0 г. 1(dd,1H), 7,48 (dd,1H), 7,90 (d,1H). Предварительная стадия 10.2. Этиловый эфир 3-(4-хлор-6-фтор-7 нитробензтиазол-2-ил)акриловой кислоты. 8,0 г (28 ммолей) этилового эфира 3-(4 хлор-6-фторбензтиазол-2-ил)акриловой кислоты подвергали реакции аналогично предварительной стадии 4.2. Выход: 9,2 г. 1 54 кислоты подвергали реакции аналогично предварительной стадии 4.3. Выход: 7,8 г. 1(соединение I.18). 5,4 г 7-амино-4-хлор-2-этил-6-фторбензтиазола подвергали реакции аналогично примеру 5. Выход: 5,7 г; tпл: 178-180 С. Предварительная стадия 11.1. 4-хлор-2-этил-6-фторбензтиазол. К раствору из 22,0 г (0,1 моля) 2,4-дихлор 6-фторбензтиазола и 3,3 г (5 ммолей) дихлоробис(трифенилфосфин)никеля в 0,5 л диэтилового эфира добавляли раствор из 0,2 моля этилбромида магния в диэтиловом эфире. По истечении 2 ч перемешивания сливали на насыщенный водный раствор хлорида аммония. Продукт экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали водой,сушили над сульфатом магния и в завершение концентрировали. Очистку сырого продукта осуществляли посредством хроматографии на силикагеле (элюенты: циклогексан/метил-третбутиловый эфир = 8:2). Выход: 10,3 г. 1(42 ммоля) 4-хлор-2-этил-6 фторбензтиазола подвергали реакции аналогично предварительно стадии 4.2. Выход: 8,4 г; tпл: 70-73 С. Предварительная стадия 11.3. 7-амино-4-хлор-2-этил-6-фторбензтиазол. 8,5 г (33 ммоля) 4-хлор-2-этил-6-фтор-7 нитробензтиазола подвергали реакции аналогично предварительной стадии 4.3. Выход: 6,4 г. 1= 1,44 (t,3H), 3,16 (q,2H), 7,21 (d,lH), 8,00 (s,2H). В нижеследующей табл. 5 наряду с указанными выше действующими веществами представлены также другие замещенные бензтиазолы формулы I, которые были получены по той же технологии либо могут быть получены аналогичным путем. Таблица 5 Пример 12. 7-амино-4-хлор-6-фтор-2-(метилсульфинил)бензтиазол (соединение XIV.1; = XIVa.2). К смеси из 455 мл воды, 32,6 мл концентрированной соляной кислоты и 37,2 г железного порошка при температуре дефлегмации небольшими порциями добавляли 23,0 г 4-хлор-6 фтор-2-метилсульфинил-7-нитробензтиазола. По завершении добавления смесь продолжали нагревать еще в течение 2 ч до температуры дефлегмации. После охлаждения добавляли 200 мл этилового эфира уксусной кислоты, после чего неорганические соли отфильтровывали. Органическую фазу промывали водой, сушили над сульфатом натрия и в завершение концентрировали. Полученный сырой продукт без последующей очистки использовали для дальнейшей переработки. 1 Н-ЯМР (250 МГц; в d6-димeтилcyльфoкcидe): см. табл. 6. В табл. 6 наряду с указанными выше представлены также другие производные анилина формулы XIV, которые были получены по той же технологии либо могут быть получены аналогичным путем Пример 13. 4,6-дихлор-7-изоцианато-2-(метилсульфонил)бензтиазол (соединение ХI.1; = ХIb.3). 5 г (17 ммолей) 7-амино-4,6-дихлор-2(метилсульфонил)бензтиазола и 17 г (85 ммолей) дифосгена нагревали в 200 мл толуола в течение 8 ч до температуры дефлегмации, после чего реакционную смесь концентрировали. Полученный сырой продукт без последующей очи 57 стки использовали в дальнейшем реакционном процессе. ИК (пленка):= 2272 см-1. Пример 14. Аналогично примеру 7 получили 4-хлор-2 этилсульфинил-6-фтор-7-изоцианатобензтиазол(гербицидное действие) Гербицидное действие замещенных бензтиазолов формулы I было подтверждено в ходе проведения следующих опытов в теплице. В качестве вегетационных сосудов служили пластиковые цветочные горшки с супесью с содержанием приблизительно 3% гумуса в качестве субстрата. Семена опытных растений высевали раздельно по видам. Предвсходовую обработку суспендированными или эмульгированными в воде действующими веществами проводили непосредственно после высевания с помощью соответствующих сопел, обеспечивающих мелкокапельное опрыскивание. Сосуды подвергали легкому дождеванию с тем, чтобы способствовать прорастанию и росту, после чего сосуды накрывали прозрачными пластиковыми крышками, пока растения не пошли в рост. Такие крышки обеспечивают равномерную всхожесть опытных растений, пока еще не испытывающих воздействия активных субстанций. Нормы расхода при предвсходовой обработке составляли 0,0156 или 0,0078 кг/га активной субстанции (а.с.). Для послевсходовой обработки опытные растения в зависимости от экстерьера выращивали сначала до достижения ими высоты от 3 до 15 см и лишь после этого обрабатывали суспендированными или эмульгированными в воде действующими веществами. С этой целью опытные растения либо непосредственно высевали и выращивали в тех же самых сосудах, либо их выращивали сначала отдельно как зародышевые растения, а за несколько дней до обработки пересаживали в сосуды для экспериментов. Нормы расхода для послевсходовой обработки составляли 0,0156, 0,0078 или 0,0039 кг/га активной субстанции. Растения по видам выдерживали при температурах в интервале 10-25 С, соответственно 20-35 С. Опыты проводились в течение 2-4 недель. В течение этого периода времени за растениями вели тщательный уход, определяя при этом их реакцию на каждую из проводимых обработок. Оценку производили по шкале с градацией от 0 до 100. При этом показатель 100 означал,что растения не взошли, соответственно, что имеет место полная гибель, по крайней мере, их надземных частей, а показатель 0 означал, что растения не повреждены или наблюдается их нормальный рост. 58 Опыты в теплице проводили на растениях следующих видов: Латинское название Русское название щирица запрокинутая цепкий подмаренник подвиды ипомеи щетинник горчица белая паслен черный кукуруза обыкновенная При нормах расхода 0,0156 или 0,0078 кг/га а.с. соединение 1.7 при предвсходовой обработке проявило очень высокую гербицидную эффективность действия против Setaria faberii в посевах кукурузы. В отличие от этого сравнительное соединение А, известное из заявки Германии DE-A 4241658 ( 1.01) никакого эффекта по отношению к Setaria faberii не показало. СоединениеI.7 проявило, кроме того,при послевсходовой обработке при нормах расхода 0,0156 или 0,0078 кг/га а.с. очень высокую эффективность действия против AmaranthusSolanum nigrum. СоединениеI.5 при нормах расхода 0,0078 или 0,0039 кг/га а.с. проявило при послевсходовой обработке более высокую эффективность действия против Amaranthus retroflexus, Galium aparine, Ipomoea subspecies и Sinapis alba no сравнению с контрольным соединением В, известным из международной заявки Примеры по применению (десикантное/дефолиантное действие) В качестве опытных растений служили молодые, 4-листные (без семядолей) растения хлопчатника, которые выращивали в условиях теплицы (относительная влажность воздуха 5070%; дневная/ночная температура 27/22 С). Листья молодых растений хлопчатника интенсивно, до появления капель, опрыскивали водной композицией действующих веществ (с добавками 0,15 мас.% алкоксилата жирного спирта Plurafac LF 700 (малопенное, неионное поверхностно-активное вещество фирмы BASFAG) в пересчете на раствор для опрыскивания). Норма расхода воды составляла в соответствующем пересчете 1000 л/га. По истечении 13 дней определяли число опавших листьев и степень дефолиации в %. На необработанных контрольных растениях опадания листьев не происходило. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенные бензтиазолы общей формулы I в которой переменные имеют следующее значение: Х 1 и Х 2 независимо друг от друга означают кислород или серу;R4 означает водород или галоген;Y представляет собой химическую связь,кислород, серу, -SO- или -SO2-;R6 означает водород, циано, галоген, С 3 С 6 циклоалкил,С 1-С 6 галогеналкил,С 3 С 6 алкенил, С 3-С 6 галогеналкенил, С 3-С 6 алкинил или C1-С 6 алкил, причем названные циклоалкильные, алкильные, алкенильные и алкинильные остатки могут быть замещены цианогруппой,C1-С 6 алкоксигруппой,С 1-С 6 алкилтиогруппой,(С 1-С 6 алкокси)карбонилом,С 1 С 6 алкиламинокарбонилом, ди(С 1-С 6 алкил)аминокарбонилом,(С 1-С 6 алкил)карбанилоксигруппой,С 1-С 6 галогеналкоксигруппой,С 1 С 6 галогеналкилтиогруппой или С 3-С 6 циклоалкилом, при условии, что R6 может означать циано только в тех случаях, когда Y представляет собой химическую связь, кислород или серу,и R6 может означать галоген только в тех случаях, когда Y представляет собой химическую связь,а также пригодные для применения в сельском хозяйстве соли соединений I. 2. Енаминовые эфиры формулы IV где Y представляет собой -SO- или -SO2-, а переменные R4-R6 имеют значения, указанные в п.1. 5. Производные анилина формулы XIV где Y представляет собой -SO- или -SO2-, а переменные R4-R6 имеют значения, указанные в п.1. 6. Гербицидные препараты, содержащие гербицидно эффективное количество, по крайней мере, одного замещенного бензтиазола формулы I или одной из пригодных для применения в сельском хозяйстве солей соединения I по п.1 и, по крайней мере, один инертный жидкий и/или твердый наполнитель, а также при необходимости, по крайней мере, одно поверхностно-активное вещество. 7. Средства десикации и/или дефолиации растений, содержащие обладающее десикантным и/или дефолиантным действием количество, по крайней мере, одного замещенного бензтиазола формулы I или одной из пригодных для применения в сельском хозяйстве солей соединения I по п.1, и, по крайней мере, один инертный жидкий и/или твердый наполнитель, а
МПК / Метки
МПК: A01N 43/78, C07D 417/04
Метки: растений, качестве, средств, защиты, замещенные, бензотиазолы
Код ссылки
<a href="https://eas.patents.su/30-623-zameshhennye-benzotiazoly-v-kachestve-sredstv-zashhity-rastenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные бензотиазолы в качестве средств защиты растений.</a>
Предыдущий патент: Способ получения производных дифенила
Следующий патент: 1,1-дифтор-1,4-дихлорбутан и способ его получения.