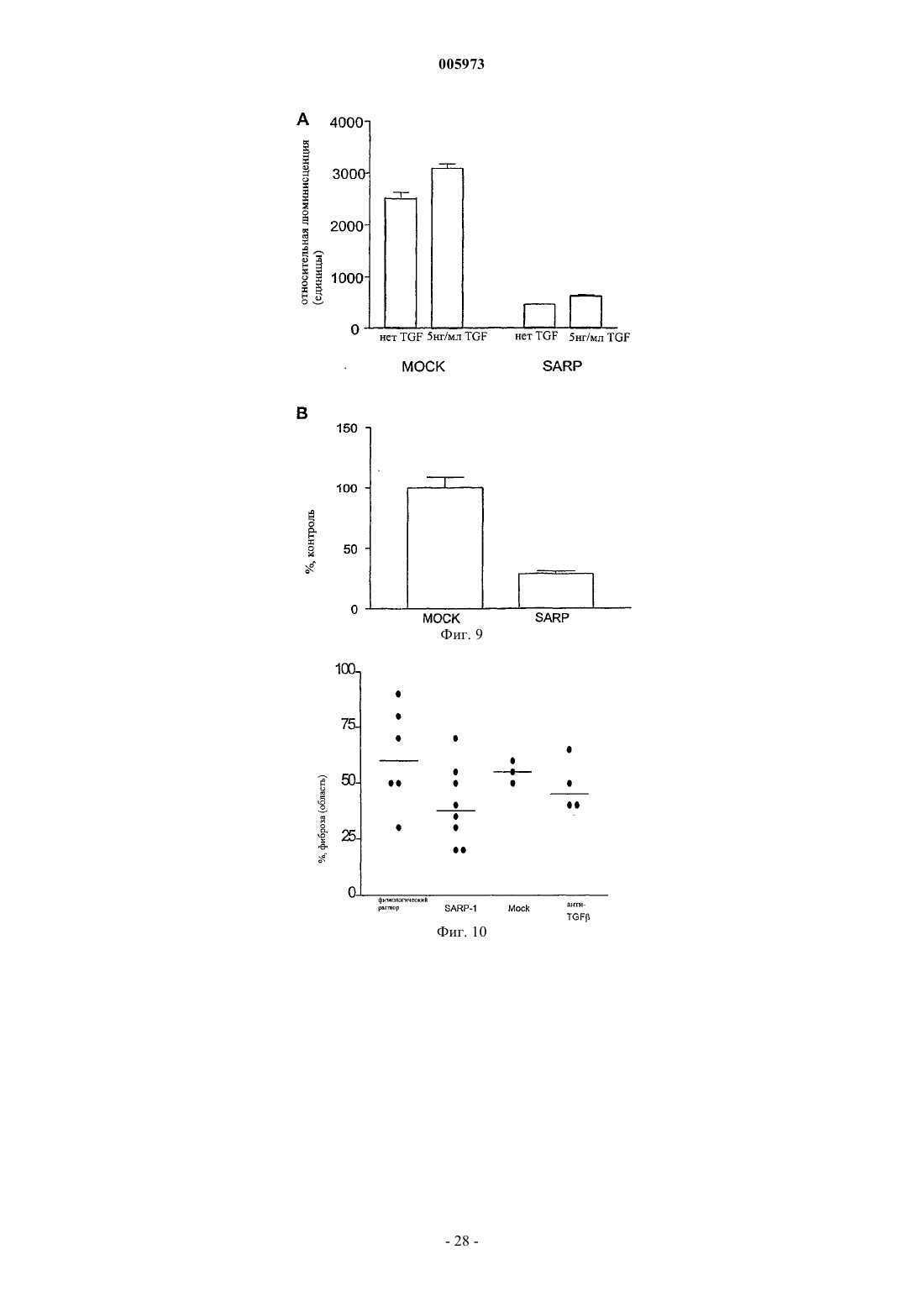
Применение sarp-1 для лечения и/или предупреждения склеродермии
Номер патента: 5973
Опубликовано: 25.08.2005
Авторы: Пауэр Кристин, Колинж Жак, Платер-Зиберк Кристин
Формула / Реферат
1. Применение вещества, выбранного из группы, состоящей из
(a) зрелого секретируемого, связанного с апоптозом белка-1 SARP-1 (секретируемый связанный с апоптозом белок);
(b) фрагмента SARP-1, который связывается с рецептором SARP-1 и инициирует передачу сигнала через рецептор SARP-1;
(c) полипептида, содержащего SEQ ID NO: 2;
(d) полипептида, содержащего аминокислоты с 21 по 295 SEQ ID NO: 2;
(e) полипептида, содержащего аминокислоты с 24 по 295 SEQ ID NO: 2;
(f) полипептида, содержащего аминокислоты с 25 по 295 SEQ ID NO: 2;
(g) полипептида, содержащего аминокислоты с 26 по 295 SEQ ID NO: 2;
(h) полипептида, содержащего аминокислоты с 27 по 295 SEQ ID NO: 2;
(i) полипептида, содержащего аминокислоты с 28 по 295 SEQ ID NO: 2;
(j) полипептида, содержащего аминокислоты с 37 по 295 SEQ ID NO: 2;
(k) мутеина любого из (a)-(j), в котором аминокислотная последовательность имеет по крайней мере 40, или 50, или 60, или 70, или 80, или 90% идентичности по крайней мере с одной из последовательностей в (a)-(j);
(l) мутеина любого из (a)-(j), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей любой из (a)-(j), при умеренно жестких условиях или при чрезвычайно жестких условиях;
(m) мутеина любого из от (a) до (j), в котором любые изменения в аминокислотной последовательности являются консервативными аминокислотными замещениями в аминокислотных последовательностях в (a)-(j);
(n) агонистического антитела против рецептора SARP-1;
(o) соли или изоформы, слитого белка, функционального производного или активной фракции любого из (a)-(n), для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний.
2. Применение по п.1, при котором вещество является гликозилированным по одному или более участков.
3. Применение по п.1 или 2, при котором слитый белок включает соединение с иммуноглобулином (Ig).
4. Применение по любому из пп.1-3, при котором функциональное производное содержит по крайней мере одну составляющую, присоединенную к одной или более функциональных групп, которые встречаются в виде одной или более боковых цепей на аминокислотных остатках.
5. Применение по п.4, при котором составляющая представляет собой полиэтиленовую составляющую.
6. Применение молекулы нуклеиновой кислоты для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний, причем молекула нуклеиновой кислоты включает последовательность нуклеиновой кислоты, кодирующую полипептид, включающий аминокислотную последовательность, выбранную из группы, состоящей из
(a) зрелого SARP-1;
(b) фрагмента SARP-1, который связывается с рецептором SARP-1 и инициирует передачу сигнала через рецептор SARP-1;
(c) полипептида, содержащего SEQ ID NO: 2;
(d) полипептида, содержащего аминокислоты с 21 по 295 SEQ ID NO: 2;
(e) полипептида, содержащего аминокислоты с 24 по 295 SEQ ID NO: 2;
(f) полипептида, содержащего аминокислоты с 25 по 295 SEQ ID NO: 2;
(g) полипептида, содержащего аминокислоты с 26 по 295 SEQ ID NO: 2;
(h) полипептида, содержащего аминокислоты с 27 по 295 SEQ ID NO: 2;
(i) полипептида, содержащего аминокислоты с 28 по 295 SEQ ID NO: 2;
(j) полипептида, содержащего аминокислоты с 37 по 295 SEQ ID NO: 2;
(k) мутеина любого из (a)-(j), в котором аминокислотная последовательность имеет по крайней мере 40, или 50, или 60, или 70, или 80, или 90% идентичности по крайней мере с одной из последовательностей в (a)-(j);
(l) мутеина любого из (a)-(j), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей любой из (a)-(i), при умеренно жестких условиях или при чрезвычайно жестких условиях;
(m) мутеина любого из от (a) до (j), в котором любые изменения в аминокислотной последовательности являются консервативными аминокислотными замещениями в аминокислотных последовательностях в (a)-(j);
(n) изоформы, слитого белка или активной фракции любого из (a)-(m).
7. Применение вектора, содержащего молекулу нуклеиновой кислоты, охарактеризованную в п.6, для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний.
8. Применение по п.7, при котором вектор является экспрессирующим вектором.
9. Применение по п.7 или 8, при котором вектор представляет собой вектор генной терапии.
10. Применение вектора для индукции и/или увеличения эндогенной продукции полипептида, охарактеризованного в любом из пп.1 или 2, в клетке для получения лекарственного средства для лечения и/или предупреждения фиброзных заболеваний.
11. Применение клетки, экспрессирующей вещество, охарактеризованное в любом из пп.1-3, для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний.
12. Применение по п.11, при котором клетка генетически модифицирована, чтобы продуцировать полипептид, охарактеризованный в любом из пп.1-3.
13. Применение по п.11 или 12, при котором клетка включает вектор, охарактеризованный в любом из пп.7-10.
14. Применение по любому из предшествующих пунктов, при котором фиброзным заболеванием является цирроз печени.
15. Применение по любому из предшествующих пунктов, при котором фиброзным заболеванием является склеродермия.
16. Применение по п.15, при котором лекарственное средство, кроме того, содержит интерферон для одновременного, последовательного или раздельного применения.
17. Применение по п.16, при котором интерферон является интерфероном-b .
18. Применение по п.15, при котором лекарственное средство, кроме того, содержит антагонист фактора некроза опухоли (TNF) для одновременного, последовательного или раздельного применения.
19. Применение по п.18, при котором антагонист TNF представляет собой TBPI и/или TBPII.
20. Применение по любому из пп.15-19, при котором лекарственное средство, кроме того, содержит антисклеродермический агент для одновременного, последовательного или раздельного применения.
21. Применение по п.20, при котором антисклеродермический агент выбран из группы, состоящей из ингибиторов ACE (АПФ), блокаторов кальциевых каналов, ингибиторов протонного насоса, NSAID, COX-ингибиторов, кортикостероидов, тетрациклина, пентоксифиллина, буцилламина, ингибиторов геранилгеранилтрансферазы, роттерлина, ингибиторов пролил-4-гидроксилазы, ингибиторов с-протеиназы, ингибиторов лизилоксидазы, релаксина, галогенфугинона, простагландинов, простациклинов, эндотелина-1, окиси азота, ингибиторов ангиотензина II и антиоксидантов.
22. Фармацевтическая композиция, содержащая вещество, охарактеризованное в любом из пп.1-5, в комбинации с антисклеродермическим агентом, выбранным из группы, состоящей из ингибиторов ACE, блокаторов кальциевых каналов, ингибиторов протонного насоса, NSAID, COX-ингибиторов, кортикостероидов, тетрациклина, пентоксифиллина, буцилламина, ингибиторов геранилгеранилтрансферазы, роттерлина, ингибиторов пролил-4-гидроксилазы, ингибиторов с-протеиназы, ингибиторов лизилоксидазы, релаксина, галогенфугинона, простагландинов, простациклинов, эндотелина-1, окиси азота, ингибиторов ангиотензина II и антиоксидантов.
23. Способ лечения и/или предупреждения фиброзных заболеваний, в частности цирроза печени и склеродермии, предусматривающий введение пациенту эффективного количества вещества, охарактеризованного в любом из пп.1-9, необязательно вместе с фармацевтически приемлемым носителем, в случае необходимости такого лечения.
24. Способ лечения и/или предупреждения фиброзных заболеваний, в частности цирроза печени и склеродермии, предусматривающий введение пациенту фармацевтической композиции по п.22 в случае необходимости такого лечения.
25. Способ по п.23 или 24, при котором вещество или фармацевтическую композицию вводят системно.
26. Способ по любому из пп.23 или 24, при котором вещество или фармацевтическую композицию ввофят посредством внутримышечной инъекции.
27. Способ по любому из пп.23 или 24, при котором вещество или фармацевтическую композицию вводят посредством ингаляции.
Текст
005973 Область техники изобретения Данное изобретение имеет отношение к склеродермии. Точнее изобретение касается примененияSARP-1 для лечения и/или предупреждения склеродермии, в особенности прогрессирующего системного склероза. Предпосылки к созданию изобретения Склеродермия является заболеванием соединительной ткани, характеризующимся фиброзом кожи и внутренних органов, приводящим к поражению органов и смерти (Black et al., 1998; Clements and Furst,1996). Склеродермия характеризуется спектром симптомов и целым рядом терапевтических аспектов. Она включает в себя очаговую склеродермию, прогрессирующий системный склероз, склеродермияподобные нарушения и бессимптомную склеродермию (Smith, 2000). В то время как очаговая склеродермия является редким кожным заболеванием, связанным с фиброзом и проявлениями, ограниченными кожей, прогрессирующий системный склероз представляет собой мультисистемное заболевание с изменчивой степенью риска в отношении поражения внутренних органов и колебаниями тяжести заболевания кожи. Системный склероз может быть диффузным или ограниченным. Ограниченный прогрессирующий системный склероз также называют CREST (кальциноз, эзофагальная дисфункция Рейно, склеродактилия, телеангиэктазии). Полагают, что склеродермияподобные нарушения связаны с воздействием факторов окружающей промышленной среды. В случае бессимптомного заболевания, имеет место поражение внутренних органов без кожных изменений. Основными проявлениями склеродермии и, в частности прогрессирующего системного склероза являются несоответствующие, избыточные синтез и отложение коллагена, эндотелиальная дисфункция,спазмы, коллапс и облитерация в результате фиброза. Склеродермия является редким заболеванием со стабильной частотой заболеваемости приблизительно 19 случаев на 1 миллион человек. Причины склеродермии неизвестны. Однако генетическая предрасположенность является важной. Расстройства включают в себя аутоиммунную реакцию и изменение функции эндотелиальных клеток и фибробластов. Действительно, прогрессирующий системный склероз вероятно является наиболее тяжелым аутоиммунным заболеванием с 50% смертностью в течение 5 лет после диагностики (Silman, 1991). С точки зрения диагностики важным клиническим показателем является кожное уплотнение проксимально к пястно-фаланговым суставам. Феномен Рейно является частым, почти универсальным компонентом склеродермии. Феномен распознается по изменению цвета кожи при воздействии холода. Ишемия и кожное уплотнение являются симптомами болезни Рейно. Несколько лежащих в основе биологических процессов вовлечены в инициацию, тяжесть и прогрессирование заболевания и включают в себя сосудистую дисфункцию, активацию и повреждение эндотелиальных клеток, аккумуляцию лейкоцитов, продукцию ауто-антител и решающий неконтролируемый фиброзный ответ, которые могут привести к смерти (Clement and Furst, 1996). Фибробласты играют центральную роль в патогенезе заболевания. Первичные фибробласты, полученные от больных склеродермией, проявляют множество характерных особенностей заболевания, наблюдаемых in vivo, значительно повышенные синтез и отложение внеклеточного матрикса, особенно коллагена и фибронектина, и измененную продукцию фактора роста и цитокинов, таких как TGF и CTGF (Strehlow and Korn, 1998 иLeRoy, 1974). Не существует эффективной терапии склеродермии. В новейшей, но высокого риска терапии предложена трансплантация аутогенных стволовых клеток (Martini et al., 1999). В частности, в настоящее время нет никакого лечения склеродермии, направленного на фиброзный процесс (Wigley and Boling,2000). Идентификация генов, ассоциированных с риском заболевания и прогрессией склеродермии, может привести к разработке эффективной стратегии для вмешательства на разных стадиях заболевания.SARP-1 (секретируемый, связанный с апоптозом белок 1) является представителем семейства секретируемых белков, известных как секретируемые родственные "завитые" белки, на основании их гомологии с богатым цистеином доменом (CRD-домен), обнаруженным у "завитого" семейства из 7 трансмембранных рецепторов (Rattner et al., 1997). "Завитые" гены первоначально были идентифицированы у плодовой мушки и в контрольной тканевой полярности (Adler et al., 1987). "Завитые" белки являются рецепторами для высококонсервативного Wnt-семейства по крайней мере из 16 секретируемых сигнальных молекул, которые регулируют взаимодействия клетка-клетка во время эмбриогенеза (Smalley andDale, 1999). Понимание механизмов действия Wnt составлялось по данным нескольких систем: генетикиDrosophila и С.elegant, биохимических исследований клеточной культуры, и экспрессии эктопического гена у Xenopus embryos. Осуществлены мутации многих генов Wnt у мыши, приведшие к различным специфическим дефектам развития. Wnt-путь передачи сигнала, который запускается взаимодействиемWnt с "завитыми" белками, опосредован несколькими цитоплазматическими компонентами переключения и функционирует, чтобы подавить активность мультибелкового комплекса обмена -катенина, таким образом способствуя созданию цитозольного -катенина, который затем проникает в ядро и образует-1 005973 комплекс с TCF, чтобы активировать транскрипцию генов-мишеней Wnt (Miller et al., 1999; Kuhl et al.,2000). Взаимодействия Wnt -"завитые" белки можно модулировать посредством ограниченной экспрессии отдельных Wnt-связывающих белков, секретируемых родственных "завитых" белков (sFRP). SFRPs способны связывать Wnt по N-концевому CRD-домену. Поэтому они могут изолировать Wnt от его рецепторов и, таким образом, противодействовать его эффектам (Bafico et al., 1999).SARP-1 известен под несколькими альтернативными названиями, такими как SDF-5, PR0697, ATG1622, HLHDY31, SFRP-2. Частичные или полномерные белковые последовательности и/или последовательности нуклеиновых кислот SARP-1 мыши или человека описаны в нескольких патентных заявках,например WO 98/35043, WO 98/13493, ЕР 0879887, WO 99/46281. С точки зрения функции, секретируемые родственные "завитые" белки (SFRPs), по-видимому, действуют как растворимые модуляторы передачи сигнала Wnt посредством конкурирования с мембраносвязанными "завитыми" рецепторами за связывание секретируемых Wnt-лигандов. Помимо SARP-1, известные в настоящее время человеческие белки упомянутого семейства включают в себя SARP-2 (SFRP1) и SARP-3 (SFRP-5). Описано, что мышиный SARP-1 и SARP-2 и -3 человека обладают способностью или повышать чувствительность клеток к апоптозу, или ингибировать апоптозный ответ (Melkonyan etal., 1997). Когда SARP-1 мыши и SARP-2 человека экспрессировали в клеточной линии аденокарциномы молочной железы, они оказывали противоположные эффекты на клеточную чувствительность к проапоптозному стимулу. Тогда как клетки с SARP-1 проявляли более высокую резистентность, клетки,экспрессирующие SARP-2, оказались чувствительными к апоптозу, индуцированному фактором некроза опухоли и церамидом. Экспрессия SARP-1 или SARP-2 изменяла внутриклеточные уровни -катенина,индикатора опосредованной Wnt трансдукции сигнала, позволяя предположить, что SARP являются препятствием для Wnt-"завитые" белки путей передачи сигнала (Melkonyan et al., 1997). Анализ методом Нозерн-блоттинга показал, что гены SARP характеризуются индивидуальными особенностями экспрессии (Leimeister et al., 1998). SARP-1 существует в виде транскриптов размером 2,2- и 1,3-т.п.н. в некоторых тканях человека с наиболее высокими уровнями в прямой кишке и тонком кишечнике. Chang et al., 1999, сообщили, что SARP-1 или SFRP-2 высоко и предпочтительно экспрессируются в сетчатке быка по всему внутреннему нуклеарному слою. В сетчатой оболочке SARP-3 илиSFRP-5 экспрессируются, в основном, в сетчаточном пигментированном эпителии. С помощью анализа соматических клеточных гибридов, Melkonyan et al., (1997) картировали генSARP-1 в хромосоме 4 человека. Chang et al., (1999) уточнили положение места до 4q31.3, используя радиационный анализ гибридов. Также появляются данные, касающиеся того, что измененная экспрессия SARP-1 связана с раком(WO 98/13493). Краткое изложение изобретения Изобретение базируется на данных благоприятного действия SARP-1 на разработанной животной модели склеродермии. Поэтому первым аспектом изобретения является применение SARP-1 для приготовления лекарственного средства для лечения и/или предупреждения склеродермии и, в частности, прогрессирующего системного склероза. Второй аспект изобретения заключается в применении клетки, экспрессирующейSARP-1, или экспрессирующего вектора, содержащего кодирующую последовательность SARP-1, для получения лекарственного средства для лечения и/или предупреждения склеродермии, в особенности,прогрессирующего системного склероза. Также в рамках интересов данного изобретения рассматриваются фармацевтические композиции, содержащие SARP-1, и способы лечения, включающие в себя введение SARP-1 в организм человека. Краткое описание чертежей На фиг. 1 представлена экспрессия мРНК SARP-1 в нормальных и патологических фибробластах от 7 больных склеродермией по данным анализа фильтров с иммобилизованными генами. Средний уровень экспрессии для каждого класса образцов (нормальных или патологических) представлен в (А) и медиана представлена в (В); на фиг. 2 показано соотношение экспрессии мРНК SARP-1 в патологических/нормальных фибробластах (низкое количество пассажей, 5 пассажей) от 8 больных склеродермией, установленное посредством PCR (ПЦР) в реальном времени; на фиг. 3 представлены результаты анализа посредством PCR в реальном времени экспрессии мРНКSARP-1 в нормальных фибробластах кожи человека (NHDF) относительно экспрессии мРНК GAPDH; на фиг. 4 представлены данные анализа посредством PCR в реальном времени экспрессии мРНКSARP-1 в биопсиях клинически нормальной кожи человека (n=6), сравниваемой с биопсиями аномальных участков кожи от больных склеродермией (n=2), относительно GAPDH; фиг. 5 А и В являются следующими друг за другом и представляют нуклеотидную последовательность и выведенную аминокислотную последовательность кДНК SARP-1. Предсказанные участки расщепления для сигнального пептида указаны стрелками;-2 005973 на фиг. 6 представлены данные сравнительного анализа аминокислотных последовательностейSARP-1 человека и мыши. Неидентичные остатки между двумя последовательностями выделены(серым); на фиг. 7 показан уровень апоптоза в SARP-1- и псевдотрансфицированных клетках по сравнению с контролями. означает статистически значимое снижение; на фиг. 8 показано влияние обработки SARP-1 на общую активность мМР-1 в кондиционированной среде, собранной из культур фибробластов кожи человека. Фибробласты были получены из патологических тканей (A, D, F), или от здоровых индивидуумов (В, С), или из непораженных областей больного склеродермией (Е); на фиг. 9 показан эффект котрансфекции SARP-1 на активность промотора коллагена в нестимулированных и стимулированных TGF-клетках NIH3T3. На фиг. (А) указаны единицы люминисценции,измеренные в репортерном исследовании, на фиг. (В) представлен процент люминисценции относительно контроля; на фиг. 10 представлена величина фиброза на легкое на модели фиброза легкого, индуцированного блеомицином. Зоны оценивали у мышей, которым вводили обычный наполнитель, трансформированныеSARP-1 клетки, псевдотрансформированные клетки или анти-ТGF-терапию.указывает на статистически значимое снижение. Описание изобретения Согласно данному изобретению обнаружено, что экспрессия секретируемого белка SARP-1 значительно ниже в патологических фибробластах, полученных от больных склеродермией по сравнению с контрольными клетками. Использовали ДНК-технологию на микропланшетных фильтрах с иммобилизованными генами, чтобы идентифицировать дифференциально экспрессированные гены в кожных фибробластах, изолированных из участков фиброзного поражения, полученных от больных склеродермией,сравниваемых с фибробластами, изолированными из клинически непораженных областей кожи от тех же самых больных. Экспрессия SARP-1 подавлялась в патологических фибробластах у 5 из 7 исследованных больных. Кроме того, анализ с помощью RT-PCR в реальном времени тотальной РНК, изолированной из всех биопсийных образцов патологической кожи от больных склеродермией, выявил более низкие уровни мРНК SARP-1 по сравнению с подобранными контрольными биопсиями из клинически нормальных анатомических участков от пациентов соответствующего возраста и пола. В подтверждение выше приведенных результатов, с помощью статистического метода сравнения уровней экспрессии всех генов, содержащихся на микропланшетных фильтрах с иммобилизованными генами, показали, что имеется 95% вероятности, что снижение уровня регуляции SARP-1 ассоциировано с фиброзными поражениями у больных, позволяя предположить связь с клинической прогрессией заболевания. Лечебное действие SARP-1 при склеродермии подтверждено на общепринятой мышиной модели склеродермии, модели фиброза легкого, индуцированного блеомицином. В упомянутой модели введение клеток, экспрессирующих SARP-1, значительно уменьшало распространенность фиброза легкого. Поэтому изобретение направлено на применение вещества, которое связывается с рецепторомSARP-1 человека и стимулирует передачу сигнала через рецептор SARP-1, или вещества, которое стимулирует высвобождение или потенциирует активность эндогенного SARP-1, для производства лекарственного средства для лечения и/или предупреждения склеродермии. Названное вещество может быть самим зрелым SARP-1 или любым фрагментом SARP-1, связывающимся с рецептором SARP-1 или стимулирующим передачу сигнала через рецептор SARP-1, а также любым другим агонистом рецептораSARP-1, таким как агонистические антитела, направленные на рецептор SARP-1, или химические агонисты, специфичные к рецептору. Рецептор, который был предложен для SARP-1, является Wnt-белком, предположительно связывающимся с богатым цистеином "завитым" (frz) доменом SARP-1 (Lin et al., 1997). Поэтому вещество согласно изобретению также может быть фрагментом SARP-1, содержащим его богатый цистеином "завитой" домен. Предпочтительно вещество, используемое для лечения и/или предупреждения склеродермии, выбирают из группы, состоящей из(j) мутеина любого из (а) до (i), в котором аминокислотная последовательность имеет по крайней мере 40, или 50, или 60, или 70, или 80, или 90% идентичности по крайней мере с одним из веществ (a)(i);(k) мутеина любого из (а) до (i), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности нативной ДНК, кодирующей любой из (a)-(i), при умеренно жестких условиях или чрезвычайно жестких условиях;(l) мутеина любого из (а) до (i), в котором любые изменения в аминокислотной последовательности являются консервативными аминокислотными замещениями в аминокислотных последовательностях в(m) соли или изоформы, слитого белка, функционального производного, активной фракции или циркулярно пермутированного производного любого из (а)-(l). Полномерную кДНК SARP-1 человека клонировали и изобразили на фиг. 5, а также SEQ ID NO: 1 из прилагаемого списка последовательностей. Соответствующая аминокислотная последовательность представлена на фиг. 5 и SEQ ID NO: 2 прилагаемого списка последовательностей. Как видно из примеров, приведенных ниже, было обнаружено, что N-конец SARP-1 является высокогетерологичным. Предсказан сигнальный пептид SARP-1, который охватывает или аминокислоты от 25 до 295 SEQ ID NO: 2 или аминокислоты от 21 до 295. N-концевые последовательности очищенного рекомбинантного SARP-1 человека, экспрессированного в клетках НЕК 293, выявили другие N-концевые последовательности зрелого SARP-1, начиная с аминокислот 24, 25, 26, 27, 28 или 37 SEQ ID NO: 2. Используемый в описании термин "SARP-1" относится к любому или всем веществам, рассмотренным выше в (а)-(m). Используемый термин лечение и/или предупреждение заключает в себе любое ослабление,уменьшение или частичное, существенное или полное предупреждение или блокаду возникновения, развития, прогрессирования заболевания или возникновения, проявления или прогрессирования любого одного или нескольких или всех симптомов заболевания. Используемый здесь термин склеродермия включает в себя склеродермию по любой классификации и определению, а также один или более симптомов склеродермии, которые описаны подробно во введении. Кроме того, термин склеродермия относится к заболеваниям, которые, как известно, связаны со склеродермией, такими как заболевания, описанные Смитом (Smith) (2000), которые, например,включены в описание с помощью ссылки в полном объеме. Кроме того, термин склеродермия включает в себя фиброзные заболевания, такие как цирроз печени, интерстициальный фиброз легких, контрактура Дюпюитрена, келоидные и другие рубцевания/нарушения заживления ран, послеоперационные спайки и реактивный фиброз, а также хроническую сердечную недостаточность, в особенности после инфаркта миокарда. Изобретение относится к применению SARP-1 для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний, таких как перечисленные выше заболевания. Другие заболевания и нарушения, которые лечатся SARP-1, включают в себя расстройства раневого заживления, в частности раневого заживления в легком, включая хроническое воспаление легких и, в конечном счете, фиброз или рубцевание поверхностей легких. Нарушения, вовлекающие в процесс воспаление легкого, включают в себя, например, идиопатический фиброз легких, саркоидоз, бронхопульмональную диплазию, фибропролиферативный ARDS (ПДСВ), а также легочные проявления или системные заболевания, такие как ревматоидный артрит (Krein et al., 2001). Предпочтительно термин склеродермия относится к очаговой, системной, ограниченной и диффузной склеродермии, а также к частично совпадающим синдромам. Очаговая склеродермия первоначально поражает кожу, но также может поражать расположенные под ней мышцы и кости. Однако она не поражает внутренние органы. Очаговая склеродермия является относительно легкой, но может быть отнесена к системной склеродермии в зависимости от похожих поверхностных симптомов, таких как вид кожной биопсии под микроскопом. Системная склеродермия охватывает несколько типов симптомов или групп симптомов, таких какCREST, ограниченный или диффузный. Системная склеродерсия также известна как системный склероз. Ее также упоминают как прогрессирующий системный склероз, или семейный прогрессирующий склероз. Системная склеродермия может поражать, например, кожу, кровеносные сосуды и/или внутренние органы. Когда системная склеродермия поражает кожу, она может вызывать уплотнение кожи, обычно на руках и/или лице. Когда системная склеродермия поражает кровеносные сосуды, она может быть причиной болезни Рейно. Наиболее серьезные формы системной склеродермии поражают внутренние органы и могут вызывать потерю трудоспособности или даже смерть. Из числа других системный склероз включает в себя склеродермическое заболевание легких, склеродермический почечный криз, кардиальные симптомы, мышечную слабость, включая утомление или ограниченный CREST, нарушение моторики желудочно-кишечного тракта и спазм, и нарушения центральной, периферической и вегетативной нервной системы. Относительно нарушений нервной системы, наиболее общим является запястный синдром с последующей невралгией тройничного нерва.-4 005973 Ограниченная склеродермия может быть ограничена руками, хотя лицо и шея также могут быть вовлечены в процесс. Диффузная склеродермия включает уплотнение кожи и также обнаруживается выше запястий (или локтей). Выделяют несколько подкатегорий диффузного системного склероза, такие как склеродермия без склеродермии, где имеется фиброз внутренних органов, но нет никакого кожного уплотнения; и семейный прогрессирующий системный склероз, редкая форма, которая встречается в семьях. Перекрывающимися синдромами называют случаи, если у больного склеродермией также имеется другое аутоиммунное заболевание (такое как волчанка, ревматоидный артрит и так далее), например диффузная склеродермия совпадает с волчанкой. Симптомы склеродермии также могут быть частью смешанного заболевания соединительной ткани (MCTD) или недифференцированного заболевания соединительной ткани (UCTD). Используемый термин SARP-1 относится к белку, содержащему всю или часть последовательности SEQ ID NO: 2 (человеческая) или SEQ ID NO: 5 (мышиная) из прилагаемого списка последовательностей, независимо от обозначения такого белка, включая, без ограничения, другие известные обозначения SDF-5, PR0697, ATG-1622, HLHDY31, SFRP-2 или FRP-2, а также к солям, изоформам, мутеинам,активным фракциям, функциональным производным и их циркулярно пермутированным производным. Предпочтительно термин SARP-1 относится к зрелому белку, не имеющему сигнального пептида. Предсказано, что сигнальный пептид содержит первые 20 или первые 23, 24, 25, 26, 27 или 36 аминокислот SARP-1, которые определены в SEQ ID NO: 2, подразумевая, что зрелый белок будет содержать или аминокислоты 21 - 295 или 24, 25, 26, 27, 28 или 37 - 295 SEQ ID NO: 2. Как видно на фиг.6 ниже, человеческая аминокислотная последовательность SARP-1 высоко гомологична мышиной последовательности (SEQ ID NO: 5). Поэтому мышиный SARP-1 также можно использовать согласно изобретению, а также белки, полученные из других видов, до тех пор пока существует достаточно высокая идентичность между белками, что позволяет белку проявлять его биологическую активность, не вызывая значительного иммунного ответа у человека, которого лечат. Кроме того, термин "SARP-1" относится к любому фрагменту, части, домену или субдомену SEQID NO: 2 или 5, проявляющему желаемую активность при склеродермии. Белковые фрагменты или один или более доменов белка можно использовать согласно изобретению, до тех пор пока они оказывают какое-либо благоприятное действие на склеродермию, предпочтительным является то действие, которое,по крайней мере, сопоставимо с действием полномерного белка. Лечебный эффект может быть определен в одном из тестов in vitro или in vivo, описанных в примерах ниже, или в любом другом исследовании подходящем, чтобы продемонстрировать влияние на склеродермию. Например, SARP-1 содержит богатый цистеином "завитой" домен и нетринподобный домен, также называемый модуль NTR, который гомологичен тканевым ингибиторам металлопротеиназ (TIMPs) (Banyai and Patthy, 1999). Поэтому фрагмент, содержащий "завитой" домен SARP-1, или фрагмент, содержащий модуль NTR, являются предпочтительными фрагментами согласно изобретению. В соответствии с данным изобретением, SARP-1 может быть природного происхождения, то есть нативным белком или рекомбинантным белком. Рекомбинантная продукция может быть проведена в эукариотических клетках, таких как дрожжевые клетки или клетки СНО, в клетках или в клеточных линиях фибробластов человека. Кроме того, рекомбинантный белок может продуцироваться в прокариотических клетках, таких как Е. coli. Предпочтительно SARP-1 гликозилирован по одному или более участкам. Он также может быть негликозилированным в зависимости от данных потребностей и источника продукции или выделения белка. Используемый в описании термин соли относится как к солям карбоксильных групп, так и к кислотно-аддитивным солям аминогрупп молекулы SARP-1 или его аналога. Соли карбоксильной группы могут быть образованы по способам, известным в данной области, и включать в себя неорганические соли, например соли натрия, кальция, аммония, железа или цинка и тому подобного, и соли с органическими основаниями, как соли, образованные, например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и тому подобное. Аддитивные соли кислот включают в себя, например,соли минеральных кислот, таких как, например, хлористо-водородная кислота или серная кислота, и соли органических кислот, таких как, например, уксусная кислота или щавелевая кислота. Конечно, любые такие соли должны сохранять биологическую активность SARP-1, относящуюся к данному изобретению,т.е. оказывать лечебное действие при склеродермии. Согласно данному изобретению также можно использовать изоформы или варианты сплайсингаSARP-1, поскольку они способны ингибировать прогрессию склеродермического заболевания и/или сиптомы такого заболевания. Обнаружено, что два транскрипта размером 1,3 т.п.н. и 2,2 т.п.н., которые дифференциально экспрессируются в тканях человека, могут, например, представлять различные изоформы SARP-1, которые можно использовать согласно изобретению. Используемый в описании термин мутеины относится к аналогам SARP-1, в которых один или более аминокислотных остатков природного SARP-1 замещены различными аминокислотными остатками, или удалены, или один или более аминокислотных остатков добавлены к естественной последова-5 005973 тельности SARP-1, имеющие предпочтительно, по крайней мере, такую же активность, как дикий типSARP-1, или имеющие даже значительно более мощную активность. Названные мутеины получают посредством известного синтеза и/или методом сайт-направленного мутагенеза, или любым другим известным способом, подходящим для этого. Предпочтительно любой такой мутеин имеет последовательность аминокислот, достаточно дублирующую последовательность SARP-1, представленную в SEQ ID NO: 2, так, чтобы иметь, по крайней мере, активность, по существу подобную SARP-1. Активность мутанта SARP-1 можно тестировать посредством способов, известных в данной области, и, в частности, используя исследования, описанные в примерах ниже. Например, оценка уровня синтеза коллагена (пример 7) в фибробластах является подходящим тестом для определения активности мутеинов SARP-1. Согласно данному изобретению мутеины включают в себя белки, кодированные нуклеиновой кислотой, такой как ДНК или РНК, которые гибридизуют с ДНК или РНК, которые кодируют SARP-1, в соответствии с данным изобретением, при жестких условиях. Термин "жесткие условия" относится к условиям гибридизации и последующей отмывки, которые специалисты в данной области обычно называют "жесткими". Смотри Ausubel et al., Current Protocols in Molecular Biology, supra, Interscience, N.Y.,6,3 и 6,4 (1987, 1992) и Sambrook, J.C., Fritsch, E.F. and Maniatis, T. (1989) Molecular Cloning: A LaboratoryManual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). Без ограничения примеры жестких условий включают условия отмывки на 12-20 С ниже рассчитанной Тm гибрида при исследовании, например, в 2 х SSC и 0,5% SDS в течение 5 мин, 2 х SSC и 0,1%SDS в течение 15 мин; 0,1 х SSC и 0,5% SDS при 37 С в течение 30-60 мин, а затем 0,1 х SSC и 0,5% SDS при 68 С в течение 30-60 мин. Специалистам в данной области понятно, что жесткость условий также зависит от длины последовательности ДНК, олигонуклеотидных зондов (таких как 10-40 оснований) или смешанных олигонуклеотидных зондов. Если применяют смешанные зонды, оказывается предпочтительным использовать хлорид тетраметиламмония (ТМАС) вместо SSC. См. Ausubel, supra. Предпочтительно любой такой мутеин имеет последовательность аминокислот, достаточно дублирующую последовательность SARP-1, такую которая имеет по существу подобную биологическую активность, как SARP-1, или даже лучше. Одной легко определяемой активностью SARP-1 является его способность снижать синтез коллагена. Способ определения названной активности подробно описан в примере 6 ниже. До тех пор пока мутеин характеризуется значительной активностью, снижающей коллаген, можно считать, что он, по существу, обладает активностью подобной активности SARP-1. Таким образом, можно определять, имеет ли какой-либо данный мутеин, по крайней мере, по существу такую же активность как SARP-1, посредством обычного исследования, например, подвергая такой мутеин простому анализу, который описан в примере 7. В предпочтительном аспекте любой такой мутеин имеет по крайней мере 40% идентичности или гомологии с последовательностью SEQ ID NO: 2 из прилагаемого списка последовательностей. Более предпочтительно мутеин имеет по крайней мере 50, 60, 70, 80% или наиболее предпочтительно по крайней мере 90% идентичности или гомологии. Установленная при сравнении последовательностей идентичность отражает родство между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями. Вообще, идентичность отражает точное соответствие нуклеотид к нуклеотиду или аминокислота к аминокислоте двух полинуклеотидов или двух полипептидных последовательностей соответственно по длине сравниваемых последовательностей. Для последовательностей, где не имеется точного соответствия, можно определять "% идентичности". Вообще, две сравниваемые последовательности выравнивают, чтобы получить максимальную корреляцию между последовательностями. Это может включать в себя вставку "брешей" или в одну, или в обе последовательности, чтобы увеличить степень выравнивания. % Идентичности может быть определен по всей длине каждой из сравниваемых последовательностей (так называемый всеобщий сравнительный анализ первичной структуры), что особенно подходит для последовательностей одинаковой или очень похожей длины или с относительно более короткими определенными протяженностями (так называемый локальный сравнительный анализ первичной структуры), что больше подходит для последовательностей неравной длины. Способы сравнения идентичности и гомологии двух или более последовательностей хорошо известны в данной области. Так, например, программы, имеющиеся в Висконсинском пакете программ для анализа последовательностей, версия 9.1 (Devereux J et al., 1984), например программы BESTFIT и GAP могут быть использованы для определения % идентичности между двумя полинуклеотидами и % идентичности и % гомологии между двумя полипептидными последовательностями. В BESTFIT используют алгоритм "локальной гомологии" Смита и Ватермана (Smith и Waterman) (1981) и обнаруживают лучшую единственную область сходства между двумя последовательностями. Другие программы для определения идентичности и/или сходства между последовательностями также известны в данной области, например, семейство программ BLAST (Altschul S.F. et al., 1990, Altschul S.F. et al., 1997, доступные через домашнюю страницу NCBI в www.ncbi.nim.nih.gov) и FASTA (Pearson W.R., 1990; Pearson 1988).-6 005973 Мутеины SARP-1, которые можно использовать согласно данному изобретению, или нуклеиновые кислоты, кодирующие их, включают в себя ограниченный набор в основном соответствующих последовательностей в виде пептидов замещения или полинуклеотидов, которые шаблонно может получить любой из специалистов в данной области без чрезмерного экспериментирования, основываясь на рекомендациях и руководстве, представленных в настоящем описании. Предпочтительными изменениями для мутеинов в соответствии с данным изобретением являются изменения, которые известны как консервативные замещения. Консервативные аминокислотные замещения полипептидов или белков SARP-1 могут включать синонимические аминокислоты в пределах группы, которая характеризуется достаточно похожими физико-химическими свойствами, так что замещение между представителями группы сохраняют биологическую функцию молекулы (Grantham, 1974). Ясно, что вставки и делеции аминокислот также можно производить в определенных выше последовательностях без изменения их функции, особенно, если вставки и делеции вовлекают только несколько аминокислот, например меньше тридцати, и более предпочтительно менее десяти, и не удалять или замещать аминокислоты, которые являются существенными для функциональной конформации, например цистеиновые остатки. Белки и мутеины, полученные с помощью таких делеций и/или вставок, находятся в рамках данного изобретения. Предпочтительно группами синонимических аминокислот являются группы, представленные в табл. I. Более предпочтительно группами синонимических аминокислот являются группы, представленные в табл. II, и наиболее предпочтительно группами синонимических аминокислот являются группы,представленные в табл. III. Таблица I Предпочтительные группы синонимических аминокислот-7 005973 Таблица II Более предпочтительные группы синонимических аминокислот Таблица III Наиболее предпочтительные группы синонимических аминокислот-8 005973 Примеры осуществления аминокислотных замещений в белках, которые можно использовать для получения мутеинов полипептидов или белков SARP-1, для применения в данном изобретении включают в себя любые стадии известных способов, такие как представленные в патентах США 4959314,4588585 и 4737462 Mark et al., 5116943 Koths et al., 4965195 Namen et al., 4879111 Chong et al. и 5017691Lee et al. и замещенные лизином белки, описаны в патенте США 4904584 (Shaw et al.). Термин слитые белки относится к полипептиду, содержащему SARP-1, или его мутеину, слитому с другим белком, который, например, характеризуется продолжительным временем пребывания в жидкостях организма. Согласно изобретению предпочтительными являются слитые белки, содержащие весь или функциональную часть SARP-1, слитого с целым белком или его функциональной частью, способными улучшить биологические активности молекулы, например, подобные периоду полураспада в организме человека. В предпочтительном аспекте слитый белок включает соединение с иммуноглобулином(Ig). Белки слияния, содержащие весь или часть SARP-1, слитого с целым иммуноглобулином или его частью, являются наиболее предпочтительными. Они могут быть мономерными или мультимерными,гетеро- или гомомультимерными. Целесообразно, если слитый белок содержит константную область иммуноглобулина, в частности Fc-часть иммуноглобулина. Кроме того, согласно изобретению предпочтительными являются аспекты, в которых иммуноглобулин представляет собой изотип IgG1 или IgG2. Таким образом, SARP-1 может быть слит с другим белком, полипептидом или тому подобным, например с иммуноглобулином или его фрагментом. Соединение может быть прямым или через короткий линкерный пептид, который может быть настолько коротким, как 1-3 аминокислотных остатка по длине,или длиннее, например 13 аминокислотных остатков по длине. Названный линкер может быть, например, трипептидом последовательности E-F-M (Glu-Phe-Met), или 13-аминокислотной линкерной последовательностью, содержащей Glu-Phe-Gly-Ala-Gly-Leu-Val-Leu-Gly-Gly-Gln-Phe-Met, введенной между последовательностью SARP-1 и последовательностью иммуноглобулина. Используемый в описании термин "функциональные производные" охватывает производные SARP1 и их мутеинов и слитых белков, которые могут быть получены из функциональных групп, которые существуют в виде боковых цепей на остатках или N- или С-концевых групп, способами, известными в данной области, и включены в изобретение до тех пор, пока они остаются фармацевтически приемлемыми, т.е. они не уничтожают активность белка, которая оказывается, по крайней мере, по существу, подобной активности SARP-1, и не придают токсические свойства композиции, содержащей их. Поэтому в предпочтительном аспекте функциональное производное содержит по крайней мере одну составляющую, присоединенную к одной или более функциональным группам, которые существуют в виде одной или более боковых цепей на аминокислотных остатках. В соответствии с данным изобретением боковые цепи полиэтиленгликоля (PEG) являются чрезвычайно предпочтительными составляющими. Боковые цепи PEG могут скрывать антигенные участки и увеличивать длительность пребывания вещества, к которому они присоединены, в жидкостях организма. Другие производные включают в себя сложные алифатические эфиры карбоксильных групп, амиды карбоксильных групп в результате реакции с аммиаком или с первичными или вторичными аминами, Nацилпроизводными свободных аминогрупп аминокислотных остатков, образованных с ацил-радикалами(например, группы алканоила или карбоциклического ароила) или O-ацилпроизводными свободных гидроксильных групп (например, групп остатков серила или треонила), образованных с ацил-радикалами. Термин активные фракции SARP-1 или его мутеинов и слитых белков охватывает любой фрагмент или предшественников полипептидной цепи белковой молекулы, одной или вместе с ассоциированными молекулами или остатками, которые присоединенны к ней, например остатки сахара или фосфата, или агрегаты белковой молекулы или остатки сахаров сами по себе, при условии, что названная активная фракция имеет, по крайней мере, активность, по существу, подобную активности SARP-1. Кроме того, изобретение имеет отношение к применению молекулы нуклеиновой кислоты для производства лекарственного средства для лечения и/или предупреждения склеродермии, причем молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую полипептид,включающий аминокислотную последовательность, выбранную из группы, состоящей из(j) мутеина любого из от (а) до (i), в котором аминокислотная последовательность имеет по крайней мере 40, или 50, или 60, или 70, или 80, или 90% идентичности по крайней мере с одной из последовательностей в (a)-(i);(k) мутеина любого из (a)-(i), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей любой из (a)-(i), при умеренно жестких условиях или при чрезвычайно жестких условиях;(l) мутеина любого из (a)-(i), в котором любые изменения в аминокислотной последовательности являются консервативными аминокислотными замещениями в аминокислотных последовательностях в(m) соли или изоформы, слитого белока, функционального производного, активной фракции или циркулярно пермутированного производного любого из (а)-(l). Изобретение в равной степени имеет отношение к применению названных молекул нуклеиновых кислот для лечения и/или предупреждения склеродермии. В соответствии с данным изобретением, SARP-1 также может быть введен в организм человека в виде вектора, содержащего названную молекулу нуклеиновой кислоты. Поэтому изобретение, кроме того, касается применения вектора, содержащего названную молекулу нуклеиновых кислот, для производства лекарственного средства для лечения и/или предупреждения склеродермии. Предпочтительно вектор является экспрессирующим вектором, содержащим промотор, функционально связанный со всей и частью кодирующей последовательности SARP-1. В другом предпочтительном аспекте вектор является вектором генной терапии. Векторы генной терапии известны в данной области, большинство из них представляют собой векторы вирусного происхождения, такие как аденовирусный и лентивирусные векторы. Согласно изобретению SARP-1 также может быть введен в организм человека в виде клетки, продуцирующей и/или секретирующей SARP-1. Поэтому изобретение, кроме того, имеет отношение к применению клетки, экспрессирующей SARP-1, для производства лекарственного средства для лечения и/или предупреждения склеродермии, т.е. к клеточной терапии для лечения и/или предупреждения склеродермии. Клетка может быть естественно продуцирующей SARP-1 и/или трансфицированной клеткой,которая продуцирует рекомбинантный SARP-1. Предпочтительными являются клетки, экспрессирующие и секретирующие высокие количества белка, такие как сверхпродуцирующие клетки, несущие большое число копий экспрессирующего вектора, содержащего молекулу нуклеиновой кислоты, кодирующуюSARP-1. Так как фибробласты олицетворяют механизм фиброза, они являются наиболее подходящими клетками для антифиброзной и антисклеродермической терапии. Поэтому предпочтительно используют фибробласты, экспрессирующие SARP-1, в соответствии с данным изобретением. Кроме того, изобретение касается клетки, включающий вектор, содержащий молекулу нуклеиновой кислоты, кодирующей весь или часть SARP-1, для получения лекарственного средства для лечения и/или предупреждения склеродермии. Клетка, которую генетически модифицировали, чтобы она продуцировала полипептид согласно изобретению, также находится в рамках данного изобретения. Применение экспрессирующего вектора для индукции и/или увеличения эндогенной продукцииSARP-1 в клетке, обычно безмолвной или экспрессирующей количество ингибитора, которое недостаточно, также рассматривают согласно изобретению. Таким образом, изобретение использует технологию, известную как эндогенная генная активация (EGA), для продукции требуемого белка. Прогрессирующий системный склероз представляет собой одно из наиболее тяжелых заболеваний среди склеродермий, часто приводящих к потери трудоспособности и смерти. Поэтому следующий предпочтительный аспект изобретения имеет отношение к прогрессирующему системному склерозу,который входит в группу заболеваний склеродермией, который характеризуется, главным образом, вовлечением внутренних органов, подробно описанным выше. В соответствии с данным изобретением предпочтительными являются некоторые комбинированные терапии. Поэтому предпочтительно лекарственное средство изобретения включает в себя еще интерферон, в частности интерферон-, антагонист фактора некроза опухоли (TNF), в частности TBPI и/илиTBPII, другое антисклеродермическое вещество, антисклеродермическое вещество, выбранное из группы, состоящей из ингибиторов АСЕ (АПФ), блокаторов кальциевых каналов, ингибиторов протонного насоса, NSAID, СОХ-ингибиторов, кортикостероидов, тетрациклина, пентоксифиллина, буцилламина,ингибиторов геранилгеранилтрансферазы, роттерлина, ингибиторов пролил-4-гидроксилазы, ингибиторов с-протеиназы, ингибиторов лизилоксидазы, релаксина, галогенфугинона, простагландинов, простациклинов, эндотелина-1, окиси азота, ингибиторов ангиотензина II и антиоксидантов. Все терапии предназначены для одновременного, последовательного или отдельного применения. Хотя в настоящее время нет метода лечения склеродермии, некоторые вещества или терапии применяются сейчас для лечения симптомов склеродермии. Такие антисклеродермические вещества, которые могут быть использованы в комбинированной терапии согласно изобретению, суммированы, например, Leighton (2001) или Wigley and Sule (2001), которые введены в описание с помощью ссылки в полном объеме. Интерфероны известны преимущественно как ингибиторы вирусной репликации и клеточной пролиферации. Интерферон-, например, играет важную роль в стимулировании иммунного и воспалитель- 10005973 ного ответов. Интерферон- (IFN-, интерферон I типа), как описано, играет противовоспалительную роль. Кроме того, в другом аспекте изобретения, SARP-1 используют в комбинации с антагонистом TNF. Антагонисты TNF проявляют свою активность несколькими способами. Прежде всего, антагонисты могут связываться с самой молекулой TNF с достаточным сродством и специфичностью или изолировать ее, чтобы частично или значительно нейтрализовать эпитоп TNF или эпитопы, ответственные за связывание рецептора TNF (в дальнейшем называемый "секвестрирующий антагонист"). Секвестрирующий антагонист, например, может быть антителом, направленным против TNF. Альтернативно, антагонисты TNF могут ингибировать путь передачи сигнала TNF, активированный рецептором клеточной поверхности после связывания TNF (в дальнейшем называемые "антагонисты передачи сигнала"). Антагонисты TNF легко идентифицируют и оценивают посредством обычного скрининга кандидатов по их действию на активность нативного TNF на чувствительных клеточных линиях invitro, например клетках В человека, в которых TNF вызывает пролиферацию и секрецию иммуноглобулина. Для анализа используется TNF препарат при различных разведениях антагониста-кандидата, например от 0,1 до 100 раз молярного количества TNF, используемого в анализе, и контроли без TNF или только с антагонистом (Tucci et al., 1992). Секвестрирующие антагонисты являются предпочтительными антагонистами TNF, которые следует использовать согласно данному изобретению. Из числа секвестрирующих антагонистов предпочтительными являются те полипептиды, которые связывают TNF с высоким сродством и обладают низкой иммуногенностью. Особенно предпочтительными являются растворимые молекулы рецептора TNF и нейтрализующие антитела к TNF. Например, растворимые формы TNF-RI (р 55) и TNF-RII (р 75) используются в данном изобретении. Усеченные формы упомянутых рецепторов, содержащие внеклеточные домены рецепторов или их функциональные участки, являются особенно предпочтительными антагонистами согласно данному изобретению. Например, усеченные растворимые рецепторы TNF типа I и типаII описаны в ЕР 914431. Усеченные формы рецепторов TNF являются растворимыми и были определены в моче и сыворотке как TNF-связывающие ингибиторные белки с М.м. 30 кДа или 40 кДа, которые называют TBPI иTBPII соответственно (Engelmann et al., 1990). Согласно изобретению предпочтительным является одновременное, последовательное или отдельное применение SARP-1 с антагонистом TNF и/или интерфероном. Согласно изобретению TBPI и TBPII являются предпочтительными антагонистами TNF, которые следует использовать в комбинации с SARP-1. Также в данном изобретении можно использовать производные, фрагменты, области и биологически активные участки рецепторных молекул, имеющие функциональное сходство с молекулами рецептора. Такой биологически активный эквивалент или производное молекулы рецептора имеет отношение к части полипептида или последовательности, кодирующей молекулу рецептора, которая имеет достаточный размер и способна связывать TNF с таким сродством,что взаимодействие с мембраносвязанным рецептором TNF ингибируется или блокируется. В другом предпочтительном аспекте человеческий растворимый TNF-RI (TBPI) является антагонистом TNF, который используют согласно изобретению. Природные и рекомбинантные растворимые молекулы рецептора TNF и способы их продукции описаны в Европейских патентах ЕР 308378, ЕР 398327 и ЕР 433900. В то время как блокирование TNF- может быть полезным на ранних стадиях заболевания, полагают, что на поздних стадиях сам TNF может оказывать лечебное действие при склеродермии (Abraham etal., 2000). Поэтому изобретение, кроме того, имеет отношение к комбинации SARP-1 и TNF- для лечения или предупреждения склеродермии, в особенности на стадиях прогрессирования заболевания. Ингибиторы СОХ известны в данной области. Например, специфические ингибиторы СОХ-2 рассмотрены в WO 01/00229. Изобретение еще имеет отношение к фармацевтической композиции, содержащей SARP-1, возможно вместе с одним или более фармацевтически приемлемым носителем, разбавителем или наполнителем, для лечения и/или предупреждения склеродермии, в особенности прогрессирующего системного склероза. Еще фармацевтическая композиция может содержать любой из идентифицированных выше компонентов, в частности интерферон, ТВР или ингибитор СОХ. В соответствии с изобретением фармацевтическая композиция также может содержать вектор,включающий молекулу нуклеиновой кислоты согласно изобретению, или клетку, экспрессирующуюSARP-1. Активные ингредиенты фармацевтического препарата, т.е. полипептиды, нуклеиновые кислоты или клетки согласно изобретению или их комбинации, а также комбинации упомянутых выше веществ можно вводить индивидууму различными способами. Способы введения включают в себя внутрикожный,чрезкожый (например, композиции с пролонгированным высвобождением), внутримышечный, внутрибрюшинный, внутривенный, подкожный, пероральный, эпидуральный, местный и интраназальный способы. Можно использовать любой другой терапевтически эффективный способ введения, например вса- 11005973 сывание через эпителиальные или эндотелиальные ткани или посредством генной терапии, при которой молекулу ДНК, кодирующую активное вещество, вводят пациенту (например, посредством вектора), что заставляет активное вещество экспрессироваться и секретироваться in vivo. Кроме того, белок(и) согласно изобретению может быть введен вместе с другими компонентами биологически активных веществ,таких как фармацевтически приемлемые поверхностно-активные вещества, наполнители, носители, разбавители и растворители. Определение "фармацевтически приемлемый" означает включение любого носителя, который не препятствует эффективности биологической активности активного ингредиента и который нетоксичен для хозяина, которому его вводят. Например, для парентерального введения активный белок(и) может быть приготовлен в дозированной стандартной форме для инъекции в носителе, таком как физиологический раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Для парентерального (например, внутривенного, подкожного, внутримышечного) введения, активный белок(и) можно приготовить в виде раствора, суспензии, эмульсии или лиофилизированного порошка в соединении с фармацевтически приемлемым парентеральным растворителем (например, водой, физиологическим раствором, раствором декстрозы) и добавками, которые поддерживают изотоничность(например, маннит) или химическую стабильность (например, консерванты и буферы). Композицию стерилизуют посредством обычно используемых способов. Биодоступность активного белка(ов) согласно изобретению также может быть улучшена в результате использования способов конъюгации, что увеличивает период полураспада молекулы в организме человека, например связыванием молекулы с полиэтиленгликолем, как описано в патентной заявке РСТWO 92/13095. Терапевтически эффективное количество активного белка(ов) будет функцией многих переменных величин, включая тип рецептора, сродство вещества согласно изобретению к его рецептору, любую остаточную цитотоксическую активность, проявляемую в связи с этим, способ введения, клиническое состояние пациента. Терапевтически эффективное количество является таким, что введение вещества согласно изобретению приводит к активации рецептора SARP-1 или инактивации лиганда, стимулирующего рецепторin vivo. Дозировки, вводимые в виде однократных или многократных доз индивидууму, будут изменяться в зависимости от целого ряда факторов, включая фармакокинетические свойства SARP-1, способ введения, состояния и особенности (пол, возраст, вес тела, здоровье и размер) пациента, выраженность симптомов, сопутствующее лечение, частоту повторения лечения и желаемый эффект. Регулирование и установление диапазонов разработанных дозировок находится в компетенции специалистов в данной области. Требуемая доза полипептида согласно изобретению будет колебаться приблизительно от 0,0001 до 100 мг/кг, или от 0,01 до 10 мг/кг, или от 0,1 до 5 мг/кг, или приблизительно от 1 до 3 мг/кг, хотя, как отмечено выше, доза подвергается дроблению в терапевтических целях. Суточную дозу обычно назначают в раздельных дозах или в форме с пролонгированным высвобождением, эффективной для достижения требуемых результатов. Второе или последующие введения можно проводить в дозировках, которые являются такими же, меньше или больше, чем первоначальная или предшествующая доза, введенная индивидууму. Второе или последующее введение можно осуществлять во время или до начала заболевания. Кроме того, изобретение имеет отношение к способу лечения и/или предупреждения склеродермии,в особенности прогрессирующего системного склероза, включающего в себя введение пациенту эффективного количества полипептида согласно изобретению, необязательно вместе с фармацевтически приемлемым носителем, в случае необходимости такого лечения. Альтернативно или дополнительно, согласно изобретению можно вводить клетку, продуцирующую SARP-1, или молекулу нуклеиновой кислоты изобретения, необязательно содержащуюся в экспрессирующем векторе. Экспрессирующий вектор можно вводить системно. Предпочтительно экспрессирующий вектор вводят посредством внутримышечной инъекции. Другим предпочтительным способом введения является ингаляция, в частности, если фиброз легкого вовлечен в заболевание. Кроме того, изобретение имеет отношение к способу получения фармацевтической композиции,содержащей смесь эффективного количества SARP-1 с фармацевтически приемлемым носителем, и к способу лечения и/или предупреждения артрита, включающего в себя введение хозяину эффективно ингибирующего количества SARP-1 в случае необходимости этого. Все ссылки, приведенные в описании, включая журнальные статьи или резюме, опубликованные и неопубликованные патентные заявки США и других стран, выданные патенты США или других стран или любые другие ссылки, введены в описание с помощью ссылок в полном объеме, включая все данные, таблицы, фигуры и текст, представленные в приведенных ссылках. Кроме того, полное содержание ссылок, упоминаемых в ссылках, приведенных здесь в описании, также включены цитированием в полном объеме.- 12005973 Ссылка на стадии известных способов, стадии общепринятых способов, известные способы или обычные способы не являются никаким образом допущением, что любой аспект, описание или воплощение данного изобретения раскрыты, изложены или предложены в соответствующей области. Предшествующее описание специальных аспектов настолько полно раскрывает основную сущность изобретения, что другие исследователи, применяя знания специалистов в данной области (включая содержание ссылок, приведенных в описании), легко смогут модифицировать и/или приспособить описанные специальные аспекты для другого применения без чрезмерного экспериментирования, не отступая от основной концепции данного изобретения. Поэтому такие адаптации и модификации предназначены находиться в сфере эквивалентов специальных аспектов, основанных на пояснениях и рекомендациях,представленных в описании. Понятно, что фразеология или терминология данного описания соответствует целям описания, а не ограничения его, так что терминология и фразеология данного описания должны быть интерпретированы квалифицированным специалистом в свете пояснений и рекомендаций,представленных в описании, в сочетании со знаниями специалиста в данной области. Описанное изобретение значительно легче понять посредством рассмотрения следующих примеров, которые являются способом иллюстрации данного изобретения и не предназначаются для его ограничения. Примеры Пример 1. SARP-1 дифференциально экспрессируется в фибробластах кожи больных склеродермией. Способы. Образцы от больных. Две биопсии по 3 мМ взяты дерматом из пораженного и непораженного участка кожи (обычно из кожи предплечья) у девяти больных с диффузным кожным системным склерозом (SSc), подобранных по возрасту и полу. Все пациенты соответствовали критериям Американского колледжа ревматологии относительно диагноза системного склероза. Культуры фибробластов. Фибробласты получали из биопсий культивированием in vitro, как было описано ранее (Abraham etal., 1991). Вкратце, биопсии разрезали на кусочки и помещали в стерильные пластиковые чашки или флаконы. После 15 мин высушивания при комнатной температуре, кусочки биопсии оказывались прикрепленными к пластику для тканевой культуры, а затем их культивировали в фибробластной ростовой среде (FGM), состоящей из модифицированной по способу Дульбекко среды Игла (DMEM), содержащей 10% фетальной телячьей сыворотки (FCS), 2 мМ L-глутамина, 1 мМ пирувата натрия, 100 единиц на мл пенициллина, 100 мкг на мл стрептомицина, 50 мкг на мл гентамицина и 2,5 мкг на мл амфотерицина В. После 2-3 недель инкубации в увлажненной атмосфере 5% СO2 в воздухе, фибробластное потомство отделяли краткой обработкой трипсином и повторно культивировали в FGM без гентамицина и амфотерицина В. В экспериментах использовали фибробласты между 2 и 5 пассажами. Фибробластный фенотип подтверждали по их типичной морфологии в монослое и трехмерных коллагеновых гелевых культурах. Выделение РНК. Тотальную РНК выделяли из конфлюентных склеродермических фибробластов на ранних пассажах или из первичных культур (пассажи 1-3) нормальных фибробластов кожи (крайней плоти) человека(приобретенной у Promocell), используя тризол (Life Technologies) в соответствии с протоколом производителя. Конечный осадок РНК повторно суспендировали в стерильной воде, обработанной DEPC, при концентрации 1 мкг/мкл и хранили при -80 С. Синтез зонда кДНК. 2 мкг тотальной РНК смешивали с 1,3 мкл цитокинспецифических праймеров (RD systems, каталожныйGAC11) и инкубировали при 70 С в течение 2 мин в 0,5 мл пробирке Eppendorf. Затем пробирки охлаждали до 50 С в течение 2 мин, время после которого добавляли реакционную смесь, содержащую 2 мкл 5 х реакционного буфера (250 мМ Трис-НСl рН 8,3, 375 мМ КСl и 15 мМ MgCl2), 1 мкл 10 х смеси dNTP (5 мМ dGTP, 5 мМ dCTP и 5 мМ dTTP), 3,5 мкл 32P-dATP (3000 Ки/ммоль, Amersham каталожныйPB10204), 0,5 мкл DTT (100 мМ) и 1 мкл Superscript II (Life Technologies). Реакционную смесь быстро перемешивали пипетированием и инкубировали при 50 С в течение 25 мин. Реакцию останавливали добавлением 1 мкл 0,1 М EDTA рН 8,0, содержащей 1 мг/мл гликогена. Затем меченую кДНК очищали от невключенных дезоксинуклеотидов, используя колонку Chromaspin-200 DEPC-H20 (Clontech) в соответствии с инструкциями производителя. Фракции, содержащие кДНК, идентифицировали сустом излучения по Черенкову. Фракцию пика (обычно фракция 2 из всех собранных 6 фракций) обрабатывали 0,1 объемом 1 М NaOH, содержащей 1 мМ EDTA, в течение 20 мин при 70 С, чтобы гидролизовать РНК, а затем нейтрализовали равным объемом 1 М NaH2PO4, содержащим 2,5 мкг ДНК Cot-1 человека (Life Technologies) в течение 20 мин при 70 С. Затем термообработанный нейтрализованный зонд ДНК добавляли непосредственно в смесь для гибридизации. Гибридизация к микропланшетным фильтрам с иммобилизованными генами. Микропланшетные фильтры с иммобилизованными генами (экспрессия цитокинов человека, RDsystems каталожный по. GA001) предгибридизовали при 68 С в течение 2 ч в 5 мл раствора экспресс- 13005973 гибридизации (Clontech), содержащем 0,5 мкг/мл ДНК спермы лосося (Life Technologies) в цилиндрических флаконах в гибридизационной печи Хайбайда (Hybaid) (MWG Biotech). Затем предгибридизационный раствор заменяли свежим гибридизационным раствором, содержащим препарат зонда кДНК с удельной активностью между 0,25-1 х 106 (импульсов в минуту)/мл. Гибридизацию проводили в течение 16-20 ч при 68 С. После гибридизации фильтры промывали 4 раза 2 Х SSC/1% SDS при 68 С в течение 20 мин на отмывку и дважды 0,1 Х SSC/0,5% SDS в течение 15 мин на отмывку. Потом фильтры запечатывали в Saran wrapTM и экспонировали экран для регистрации и сохранения изображения фосфора Ктипа (Biorad) в течение различных периодов времени (от 4 ч до 4 дней) при комнатной температуре. Анализ изображения. Экраны изображения сканировали при разрешении 50 мкм, используя фосфоимиджер Biorad Personal FX. Полученный 16-битный файл превращали в формат TIF и анализировали изображение, используя программное обеспечение Arrayvision (Imaging Research Inc.). Для каждого образца определяли интенсивность элементов изображения 384 генов, нанесенных на фильтр в двух экземплярах. Вычитали фоновый сигнал и устанавливали среднюю интенсивность элементов изображения для каждой пары пятен на микропланшетном фильтре (= уровень экспрессии). Подтверждение полученных результатов на микропланшетных фильтрах, на выбранных генах с помощью RT-PCR. 1 мкг тотальной РНК для каждого образца больного обратно транскрибировали, используя олигоdТ-праймер (Promega) в 20 мкл-объеме реакционной смеси, содержащей 5 мМ MgCl2, 10 мМ Трис-HCl,50 мМ КСl, 0,1% Тритон Х-100, 1 мМ каждого из dATP, dGTP, dCTP, dTTP, 0,5 единиц рекомбинантного РНКазина, ингибитора рибонуклеазы (Promega) и 15 единиц обратной AMV-транскриптазы (Promega). Реакционную смесь инкуировали при 42 С в течение 60 мин, нагревали при 95 С в течение 5 мин, затем разбавляли до 200 мкл стерильной водой. Разведения реакционной смеси обратной транскриптазы потом подвергали анализу посредством PCR в реальном времени на Taqman (РЕ Applied Biosystems 7700), используя специфические пары праймеров, составленные для каждого гена, используя программное обеспечение Primer Express (PE Applied Biosystems), на основании номера поступления в базу данных, данного изготовителем фильтров с иммобилизованными генами. Результаты стандартизировали к экспрессии контрольного гена (гена "домашнего хозяйства") глицеральдегид-3-фосфатдегидрогеназы (GAPDH) в каждом образце и выражали как кратные изменения, определенные разделением величины экспрессии патологического образца больного на величину соответствующего образца здорового пациента. Статистический способ предсказания генов, ассоциированных со склеродермией. Статистический способ для предсказания генов, ассоциированных со склеродермией, был осуществлен с помощью метода "соседей" и "предсказателя класса", как подробно описано Golub et al., 1999, который в полном объеме включен здесь в описание с помощью ссылки. Результаты. Анализ микропланшетных фильтров с иммобилизованными генами проводили на образцах нормальных и патологических фибробластов от 7 больных склеродермией. Средний уровень экспрессии кДНК SARP-1 для образца каждого пациента представлен на фиг. 1 А, медиана экспрессии представлена на фиг. 1 В. Средние значения и величины медианы значительно отличались между нормальными и патологическими клетками, уровень нормальной экспрессии SARP-1 оказался выше, чем уровень патологической экспрессии. Медианы обычно использовали, если имели дело с образцами больных, так как они минимизировали эффект в большой степени отличающегося индивидуума в группе. В данном случае,патологические фибробласты экспрессировали значительно более низкие уровни мРНК SARP-1 по сравнению с нормальными фибробластами у 5 из 7 исследованных больных. Результаты, полученные на микропланшетных фильтрах, далее подтверждали анализом образцов пациентов посредством PCR в реальном времени, используя SARP-1-специфические прамеры PCR. Результаты представлены на фиг. 2 и выражены как кратное изменение в уровне экспрессии (патологический разделен на нормальный). У 6 из 8 тестированных больных, SARP-1 подавлялся по крайней мере в 2 раза в патологических фибробластах по сравнению с нормальными фибробластами, полученными от тех же самых больных. У 2 оставшихся пациентов уровень экспрессии оказался сопоставимым в нормальных и патологических фибробластых. Наблюдаемые различия в экспрессии между нормальными и патологическими фибробластами от того же самого пациента не обусловлены различиями в культуральных условиях между двумя популяциями, так как экспрессия мРНК SARP-1 в первичных культурах нормальных фибробластов кожи человека значительно не изменялась при пассировании клеток (фиг. 3). К тому же анализ методом RT-PCR в реальном времени тотальной РНК, выделенной из всех биопсийных образцов патологической кожи от больных склеродермией, показал более низкие уровни мРНК SARP-1 по сравнению с подобранными контрольными биопсиями клинически нормальных анатомических участков от пациентов соответствующего возраста и пола (фиг. 4). Кроме того, используя статистические способы было показано, что имеется 95% вероятности, что снижение регуляции SARP-1 ассоциировано с прогрессированием склеродермии.- 14005973 Заключение. Описанные выше результаты демонстрируют, что имеется недостаток SARP-1 в патологической ткани, полученной от больных склеродермией по сравнению со здоровой тканью, указывая, что восстановление нормального уровня SARP-1 может способствовать лечению заболевания. Таким образом,SARP-1 может представлять собой новое лекарственное средство для достижения частичного или полного ингибирования заболевания, или по крайней мере одного или более симптомов склеродермии, или для ингибирования прогрессирования заболевания. Пример 2. Клонирование полной кодирующей последовательности кДНК SARP-1 человека. Материалы и способы. Последовательные BLAST-поиски проводили на dbEST человека (открытая база данных EST), начиная с частичной кодирующей последовательности SARP-1 (EMBL номер поступления AF017986) и соответствующие EST находили, используя ENTREZ http://www.ncbi.nlm.gov/Web/Search/index.html. Затем следующие EST собирали с последовательностью AF017986, чтобы образовать согласованную полную кодирующую последовательность SARP-1 AW580647, AW608301, АА 976403 и W92531. Затем клонировали полномерную кодирующую последовательность кДНК SARP-1 посредствомPCR с обратной транскриптазой, используя следующие праймеры, основанные на согласованной последовательности, полученной выше, SARP-1F 5'GCC AAG CTT CCC ACG ATG CTG CAG GGC CCT (SEQID NO: 3) и SARP-1R 5'GCG CTC GAG СТА GCA CTG CAG CTT GCG GAT (SEQ ID NO: 4) при 50 пмоль каждого в 50 мкл реакционной смеси, содержащей 0,3 мМ dNTP, 1 мМ MgSO4, 5 мкл матрицы кДНК нормальных фибробластов кожи (крайняя плоть) человека (полученной, как описано выше), 5 мкл 10 х амплификационного буфера, высокой степени чистоты (Life Technologies) и 1 мкл ДНК-полимеразы,высокой степени чистоты, (Life Technologies). Реакционную смесь нагревали при 94 С в течение 2 мин,затем подвергали 35 циклам PCR следующим образом: 94 С - 15 с, 55 С в течение 30 с и 68 С в течение 1 мин. Продукты амплификации анализировали на 1% агарозных гелях в 1 х ТАЕ-буфере (Life Technologies) и продукты PCR, мигрирующие с предсказанной молекулярной массой (906 пар оснований), очищали из геля, используя набор для очистки PCR Wizard (Promega). 100 нг гель-очищенной ДНК расщепляли рестрикционными ферментами HindIII и XhoI (Pharmacia) в соответствии с условиями производителя, повторно очищали, как описано выше, и лигировали сEngland Biolabs), по стандартным методам молекулярной биологии. Продукты лигирования трансформировали в штамм ТОР 10F' E.coli (Invitrogen) электропорацией, используя генный импульсный генераторBiorad Gene Pulser. Плазмидную ДНК изолировали из 5 мл культур, выращенных из полученных колоний, и подвергали автоматическому анализу последовательности на секвенаторе Applied Biosystems 3700,используя праймеры Т 7 и pcDNA3.1AS (Invitrogen), чтобы подтвердить последовательность SARP-1. Результаты. Для того чтобы охарактеризовать активность SARP-1 in vitro и in vivo, клонировали полную кодирующую последовательность кДНК человека. Частичную последовательность кДНК SARP-1 человека(EMBL номер поступления AF017986) использовали, чтобы идентифицировать перекрывающиеся EST в открытой базе данных dbEST, используя программу BLAST. Полную кодирующую последовательность кДНК собирали из последовательностей со следующими номерами поступлений: AF017986, AW580647,AW608301, АА 976403 и W92531. Полномерная последовательность ДНК и выведенная аминокислотная последовательность SARP-1 представлены на фиг. 5 А и В (А и В следует читать непрерывно). Кодирующую последовательность кДНК SARP-1 клонировали посредством PCR с обратной транскриптазой,используя праймеры, которые фланкировали предсказанные инициирующий и терминирующий кодоны. Анализ последовательностей полученных клонов кДНК SARP-1 выявил 93% идентичности на нуклеотидном уровне с опубликованной последовательностью SARP-1 мыши (Melkonyan et al., 1997) и 95% идентичности с последовательностью мыши на аминокислотном уровне. Выстроенные аминокислотные последовательности SARP-1 человека и мыши изображены на фиг. 6. Предсказанная белковая последовательность составлена из 295 аминокислот с предсказанным сигнальным пептидом из 20 или 24 аминокислот, используя программы SIGNALASE (Von Heijne, 1986) или SIGNALP соответственно, см. стрелки на фиг. 5 А. Аминокислотные различия между последовательностями человека и мыши выделены на фиг. 6 и находятся в N-концевом сигнальном пептиде (4 аминокислоты) и в последовательности зрелого белкаSEQ ID NO: 1 из прилагаемого списка последовательностей содержит кодирующую цепь кДНКSARP-1 человека, a SEQ ID NO: 2 содержит аминокислотную последовательность SARP-1 человека. Мышиная аминокислотная последовательность проиллюстрирована в SEQ ID NO: 5 из прилагаемого списка последовательностей. Пример 3. N-концевая последовательность SARP-1 человека. Предсказанный сигнальный пептид SARP-1 имеет длину 20 или 24 аминокислоты (см. фиг. 5 А). Для того чтобы проверить соответствующий N-конец зрелого SARP-1, рекомбинантный SARP-1, содержащий метку из шести остатков гистидина, экспрессировали в клетках НЕК-293 и очищали на никель- 15005973 хелатной колонке. Очищенный белок мигрировал в виде зоны 32 кДа при SDS-PAGE, соответствуя массе, определенной посредством MS (MC), которая оказалась 34313 Да.N-концевые последовательности очищенного рекомбинантного белка получали, используя импульсный жидкофазный белковый секвенатор модели 494 Applied Biosystems с аминокислотным анализатором модели 148 С с оперативным фенилтиогидантоином согласно Maundrell et al., (1997). Вкратце,очищенный SARP-1 переваривали посредством инкубации в течение ночи при 37 С в 90 мкл 100 мМ Трис-НСl рН 8,5, содержащем 1 М мочевины, 20 мМ метиламина, 1 мМ дитиотрейтола и 5 мкг трипсина(Boehringer Mannheim, чистый для секвенирования). Пептиды разделяли с помощью ВЭЖХ с обращенной фазой (Hewlett Packard HP1090) на колонке С 18 Brownlee (2202,1 мм). Пептиды элюировали градиентом ацетонитрила (в 0,1% трифторуксусной кислоте) от 0 до 55% в течение 60 мин с последующим градиентом 55-70% в течение 5 мин. Элюционные фракции собирали и радиоактивные 33 Р-меченые фосфопептиды, идентифицированные сцинтилляционной спектрометрией, секвенировали деградацией по Эдману, используя импульсный жидкофазный белковый секвенатор модели 494 Applied Biosystems с аминокислотным анализатором модели 148 С с оперативным фенилтиогидантоином. Последовательность GLFLFGQPDFSYK получали посредством тандемной масс-спектрометрии на трипсиновом гидролизате восстановленного и алкилированного белка. Анализ проводили на массспектрометре Q-TOF (Micromass UK Limited, Manchester, UK), оснащенном ионным источником NanoSpray, по существу как описано Cavalli et al., 2001. Кратко, один микрограмм очищенного белка разделяли посредством 10% SDS-PAGE. Белковые зоны вырезали из окрашенного серебром геля и гидролизовали в геле трипсином (Shevchenko et al., 1996). Смесь экстрагированных пептидов анализировали посредством тандемного масс-спектрометрического секвенирования (Wilm et al., 1996), используя массспектрометр Q-TOF (Micromass, Manchester, UK), оснащенный нано-электроспрейным источником ионов. Результаты. Теоретическая N-концевая последовательность незрелого SARP-1 представляет собой следующее: Место 2-го предсказанного сигнального участка расщепления находится между остатками 24 и 25(G и L). В проведенных экспериментах по секвенированию обнаружена значительная гетерогенность Nконца SARP-1. В одном эксперименте обнаружены две главные последовательности, одна, начинающаяся сFGQPD, т.е. начинающаяся с аминокислоты 28 SEQ ID NO: 2, другая последовательность, начинающаяся с LFGQPD, т.е. начинающаяся с 27 аминокислоты SEQ ID NO: 2. Однако, кроме того, в 4 последовательностях другой очищенной партии обнаруженоLFLFGQPDFS (начинается по 25 аминокислоте),FLFGQPDFS (начинается по 26 аминокислоте),LFGQPD (начинается по 27 аминокислоте),FGQPD (начинается по 28 аминокислоты). Также имеется еще одна последовательность, начинающаяся с 37 аминокислоты: RSNCKPIPAN. Эта последовательность является следствием расщепления после остатка лизина (расщепление, подобное трипсиновому). Кроме того, в другом эксперименте обнаружена последовательность, начинающаяся с положения 24 GLFLFGQPDFSYK Таким образом, оказалось, что N-конец является очень гетерогенным, что также обусловлено активностью эндопептидазы или протеазы, присущей SARP-1. Зрелый SARP-1 может встречаться в нескольких различных вариантах с разными N-концами. Пример 4. Трансфекция SARP-1 индуцирует апоптоз in vitro. Способы. Клеточные линии фибробластов (клетки NIH3T3 мыши и клетки AG1518 человека) и культуры первичных фибробластов (нормальные фибробласты кожи человека, пассаж 1-5) трансфицировали плазмидой pcDNA3.1, содержащей кодирующую последовательность кДНК SARP-1, или одной pcDNA3.1(пустой вектор - псевдотрансфицированный, в качестве отрицательного контроля), используя реагенты для трансфекции или Genepoter 2 (Gene Therapy Systems, San Diego) или Fugene 6 (Life Technologies) в соответствии с рекомендациями изготовителя. Апоптоз определяли через 24 ч после трансфекции, используя набор для исследования апоптоза с 96 лунками TiterTacs от фирмы RD systems, и считали клетки, используя краски CyQuant (Molecular Probes) в соответствии с инструкциями изготовителя. Результаты. Для оценки влияния SARP-1 на фибробласты, клеточную линию фибробластов трансфицировали кДНК SARP-1 и определяли степень апоптоза. Результаты представлены на фиг. 7. Апоптоз в трансфицированных SARP-1 клетках значительно снижался (Р=0,0009) по сравнению с псевдо- 16005973 трансфицированными (pcDNA3.1) клетками, свидетельствуя о том, что SARP-1 человека проявляет активность, подобную активности, описанной для его мышиного гомолога. Базовый уровень апоптоза определяли в нетрансфицированных клетках. Обработанные нуклеазой клетки NIH 3T3 служили в качестве позитивного контроля. Немеченая колонка показывает фоновый уровень окрашивания, а обработка нуклеазой (обработанные нуклеазой) служила в качестве позитивного контроля. Пример 5. Влияние SARP-1 на продукцию TGF1.TGF1 является профиброзным цитокином, который активируется при склеродермии и, как предварительно было показано, ассоциирован с патогенезом склеродермии (Kawakami et al., 1998). Для того чтобы определить, снижает ли SARP-1 регуляцию или ингибирует ли продукцию TGF1 или секрецию фибробластами, SARP-1 можно добавлять в культуры фибробластов в виде очищенного белка. Альтернативно, экспрессирующий вектор, содержащий кДНК SARP-1, можно трансфицировать в клетки, чтобы получить достаточное количество SARP-1 в клеточной культуре. Другая возможность заключается в добавлении среды от экспрессирующих SARP-1 клеток, которая может быть концентрированной, чтобы получить достаточное количество SARP-1, в культуры фибробластов. Для упомянутого эксперимента можно использовать клеточные линии фибробластов или первичные фибробласты, полученные от здоровых или пораженных индивидуумов или из нормальных или патологических участков кожи больного склеродермией. Количество TGF1 может быть измерено с помощью ELISA (твердофазного иммуноферментного анализа) в кондиционированной среде культивированных клеток, с использованием системы ELISAQuantikine для TGF1 от RD systems (каталожный no. DB100). Пример 6. Влияние введения SARP-1 на активность ММР-1 в фибробластах человека in vitro. Способы. кДНК для SARP-1 человека, содержащую кодирующую последовательность для метки 6XHis на 3' конце, субклонировали в вектор pDEST Fastbac переноса бакуловируса. 6 Хhis-меченый на С-концеSARP-1 продуцировали в клетках Sf5 насекомых, инфицированных рекомбинантньм бакуловирусом, и очищали методом аффинной хроматографии на Ni-NTA. Фибробласты человека с низким количеством пассажей (2-5), полученные из пораженных или непораженных участков кожи больных склеродермией или от здоровых субъектов, обрабатывали рекомбинантным SARP-1 0, 100 или 1000 нг/мл в течение 24 ч. Собирали кондиционированную среду, а клеточные остатки удаляли центрифугированием при 1200 об./мин в течение 10 мин при 4 С. Активность ММР-1 определяли в неразведенной культуральной среде, используя флуорокинный набор ММР-1 (приобретенный у RD systems) в соответствии с протоколом изготовителей. В тех же образцах также определяли активность ММР-9. Результаты. ММР-1 ответственна за деградацию коллагена I типа, означая, что снижение активности мМР-1 является фактором, содействующим одному из основных нарушений при склеродермии, которое вызывает избыточное отложение коллагена. Кожные фибробласты от больных склеродермией снижали экспрессию ММР-1 как на уровне мРНК,так и на уровне белка по сравнению с нормальными и непораженными фибробластами кожи, полученными от тех же самых больных. Хотя определяемая общая активность ММР-1 значительно отличалась от пациента к пациенту, обработанные SARP-1 фибробласты проявляли более высокую активность ММР-1,чем необработанные фибробласты, как в патологических фибробластах от больных склеродермией (фиг. 8 А, D, F), так и в фибробластах, полученных из непораженных, здоровых участков кожи от больного склеродермией (фиг. 8 Е) и в фибробластах от клинически здоровых контрольных индивидуумов (фиг. 8 В и С). Представленные результаты являются средними значениями из определений в трех повторах. В отличие от ММР-1 не наблюдали никакого влияния SARP-1 на активность ММР-9 (данные не представлены). Пример 7. Трансфекция кДНК SARP-1 снижает активность промотора коллагена типа 12 в фибробластах NIH3T3. Материалы и методы. Клетки NIH3T3, поддерживаемые в DMEM, содержащей 2 мМ глутамина, 100 единиц/мл пенициллин/стрептомицина и 10% FCS, помещали при 50% конфлюентности в 96-луночный планшет для тканевой культуры с белыми стенками и прозрачным дном (Wallac). На следующий день клетки котрансфицировали pcDNA3.1 SARP-1 и вектором pGL3 (Promega), содержащим промотор коллагена 3,5(т.п.н.) и люциферазный ген-репортер (любезно предоставлены Dr. David Abraham, Royal Free Hospital),используя реагент для трансфекции Geneporter в соответствии с инструкциями производителя. Через 30 ч после трансфекции добавляли TGF (RD systemsm 5 нг/мл). Через 24-36 ч определяли активность люциферазы непосредственно в каждой лунке, используя систему для исследования Bright-Glo, приобретенную от Promega.- 17005973 Результаты. Для того чтобы определить, существует ли какая-либо зависимость между высокой экспрессиейSARP-1 и синтезом коллагена, исследовали влияние трансфекции кДНК SARP-1 на активность промотора коллагена в фибробластах NIH3T3, котрансфицированных промотором Со 112-люциферазной репортерной кострукцией. Котрансфекция кДНК SARP-1 промотором коллагена-люциферазной репортерной плазмидой показала, что SARP-1 способен подавлять не только базальную активность промотора коллагена, но также индуцированное TGFp увеличение активности промотора коллагена (фиг. 9). Приведенные результаты позволяют предположить, что продукт гена SARP-1 может быть вовлечен в регуляцию активности промотора коллагена in vitro или непосредственно или не непосредственно через опосредованные SARP-1 события передачи сигнала. Другой способ тестирования влияния SARP-1 на отложения коллагена и/или синтез, и/или секрецию в фибробластах заключается в добавлении очищенного SARP-1 в культуры фибробластов. Альтернативно, экспрессирующий вектор, содержащий кДНК SARP-1, может быть трансфицирован в фибробласты для достижения достаточной концентрации SARP-1 в клеточной культуре. Другая возможность заключается в добавлении среды от экспрессирующих SARP-1 клеток, которая может быть концентрированной для достижения соответствующей концентрации SARP-1, в культуры фибробластов. Для этого эксперимента можно использовать клеточные линии фибробластов или первичные фибробласты, полученные от здоровых и заболевших индивидуумов, или из нормальных или патологических участков кожи больного склеродермией. Синтез коллагена можно определять in vitro в культивированных фибробластах человека, используя систему захвата ELISA (антитела получены от Southern Biotechnology Associates Inc), как описано Shiwen et al., 1997. Пример 8. Фибробласты кожи человека, сверхэкспрессирующие SARP-1 или обработанные рекомбинантным SARP-1 человека, изменяют экспрессию мРНК генов, ассоциированных с патологическим процессом склеродермии. Материалы и способы. Нормальные фибробласты кожи (крайней плоти) человека поддерживали в фибробластной культуральной среде (Promocell). Фибробласты обрабатывали рекомбинантным SARP-1 человека (100 нг/мл) в течение 4 или 24 ч в присутствии и в отсутствие TGF1 человека. Клетки собирали после периода обработки и выделяли тотальную РНК, используя реагент тризолТМ (Life Technologies) в соответствии с инструкциями изготовителя. 32 Р-dАТР-меченный зонд кДНК получали из РНК, как описано выше, и гибридизовали на фильтрах с иммобилизованными генами цитокинов человека от RD systems и обрабатывали, как описано выше. Результаты. Хотя SARP-1 первоначально был описан как белок, связанный с апоптозом, его точная функция неизвестна. Для того чтобы понять роль SARP-1 в склеродермии, определяли влияние обработки посредством SARP-1 фибробластов кожи человека, предварительно обработанных TGF, которые имитируют склеродермический фенотип, на экспрессию гена фибробластов. В табл. IV приведены мРНК, затронутые обработкой фибробластов рекомбинантньм SARP-1 после предварительной стимуляции в течение 4 ч TGF, который использовали, чтобы имитировать склеродермический фенотип. Клетки обрабатывали SARP-1 в течение 24 ч. При приведенных условиях TGF иFGF5 были ингибированы. Наблюдали сниженную экспрессию эндоглина, TGF1-связывающего белка,и увеличенную экспрессию фурина, протеазы, ассоциированной с активацией матриксных металлопротеиназ. Другой мРНК, которая подавлялась, оказалась TARC. Названный хемокин связан с рекрутментом Т клеток кожного хоминга в участках воспаления. Поэтому возможно, что введение SARP-1 может оказывать противовоспалительные эффекты. Также наблюдали увеличение регуляции мРНК субъединицTNFR1. Значение этого наблюдения не ясно, так как оказалось, что имеются значительные противоречия в научной литературе относительно того, играет ли TNF патогенную или защитную роль в склеродермии. В отдельном эксперименте (не показано), анализировали регуляцию генов в фибробластах от больных склеродермии в сравнении со здоровыми контрольными фибробластами. Интересно, обнаружено,что регулируемые гены, представленные в табл. IV, регулируются в склеродермических образцах. Те гены, которые обнаружены как активированные в склеродермических фибробластах, ингибировались после экспрессии SARP-1 в вышеприведенной модели, и те гены, которые были ингибированными, активировались после экспрессии SARP-1 в выше описанной модели, указывая, кроме того, что SARP-1 может оказывать благоприятное действие при лечении склеродермии. Представленные результаты являются результатами двух независимых экспериментов. Пример 9. Оценка влияния SARP-1 in vivo на мышиной модели заболевания. Индуцированное блеомицином поражение легких является признанной моделью склеродермии. Заболевание вызывается внутритрахеальным введением блеомицина (Hattori et al., 2000). У обработанной мыши развивается воспалительный ответ в легких (максимально около 7 дня) с последующим фиброзом,пики которого имеют место около 14 дня после индукции. Упомянутую модель использовали, чтобы оценить влияние введения SARP-1 на развитие фиброза легкого in vivo. Использовали систему клеткадоставка (клетки NIH3T3, трансфицированные полномерной кДНК SARP-1), чтобы генерировать SARP1 in vivo. Способы. Обработки животных. Фиброз легкого индуцировали у мышей (20-25 г) внутритрахеальным введением блеомицина (0,075ME) в физиологическом растворе в течение 1 дня. Мышей разделяли на 4 отдельные группы из 10 животных. Одна группа получала внутрибрюшинную инъекцию 106 клеток NIH3T3, трансфицированныхSARP-1/pcDNA3.1. Второй группе вводили 106 псевдотрансфицированных (вектор pcDNA3.1) клетокNIH3T3. Третья группа получала 250 мкг антител против TGF (Anti Pan TGF: Sigma каталожныйT9429), и мышам последней группы вводили физиологический раствор. Всех мышей умерщвляли на 14 день и легкие фиксировали формалином и пропитывали парафином для гистологии. Срезы легкого окрашивали трихромом или пикросириусом красным на коллаген (Bancroft J.D. and Stevens A. Theory andPractice of Histological Techniques) и отмечали соотношение фиброз/легкое. Трансфекция клеток NIH3T3. Клетки NIH3T3 трансфицировали SARP-1/pcDNA3.1 или pcDNA3.1, используя реагент Geneporter 2, как описано ранее. Через 24 ч после трансфекции культуральную среду удаляли, а клетки обрабатывали забуференным фосфатом физиологическим раствором (PBS), содержащим 1 мМ EDTA, в течение 5 мин при 37 С. Клетки мягко отделяли клеточным скребком (Costar), центрифугировали в течение 5 мин при 4 С для осаждения клеток и повторно суспендировали в физиологическом растворе, со степенью чистоты для инъекций, при концентрации 107 клеток/мл. Результаты.SARP-1 защищает против индуцированного блеомицином фиброза легкого. У животных, обработанных одним блеомицином или псевдотрансфицированными клеткамиNIH3T3, развивался значительный фиброз легких (данные не представлены). Полагают, что TGF1 является одним из ключевых агентов, ответственных за патологические изменения, ведущие к фиброзу. Предварительно было показано, что поликлональные антитела против TGF1 защищают против развития фиброза легкого, когда их вводили профилактически (Yamamoto et al., 1999), а также снижают фиброз кожи на GvHD-модели склеродермии (McCormick et al., 1999). Поэтому эти антитела использовали как позитивный контроль в этих экспериментах. У анти-ТGF-обработанных мышей не развивался обширный фиброз легких. Однако у мышей, обработанных трансфицированными SARP-1 клетками, отмечали значительно сниженное количество фиброзных поражений в легком, когда сравнивали с мышами, обработанными одним блеомицином или псевдотрансфицированными клетками. Действие оказалось сравнимым или даже лучше, чем эффект, наблюдаемый при анти-ТGF-обработке (не представлено). Гистологический анализ легких показал, что обработанные SARP-1 животные имели близкую к нормальной морфологию легких с небольшой воспалительной инфильтрацией и по большей части нормальной альвеолярной архитектурой. Такая морфология напоминает морфологию анти-ТGFобработанных животных и резко отличается от аномальной морфологии, наблюдаемой в легких от псевдообработанных и необработанных животных. В последних 2 группах альвеолярные пространства оказались заполненными клеточными инфильтратами и отложением коллагена (не представлено).- 19005973 Количества фиброзных поражений в легких различных экспериментальных групп изображено на фиг. 10. У обработанных SARP-1 мышей отмечали значительно меньше фиброзных поражений по сравнению с мышами, обработанными физиологическим раствором или анти-TGF. Введение блеомицина может приводить к повышенной смертности. Кроме защитного действия введения SARP-1 против фиброза также было отмечено, что большее число мышей выживало (8/10) по сравнению с мышами, обработанными физиологическим раствором (6/10), мышами, обработанными анти-TGF (4/10), и псевдообработанными мышами (3/10). Поэтому обработка SARP-1 даже предотвращала смерть на модели фиброза легкого, указывая, что лечение SARP-1 является несомненно лучше лечения анти-TGFp в описанной экспериментальной серии. Резюме, на описанной общепринятой модели склеродермии in vivo продемонстрировано лечебное действие SARP-1. Другие модели in vivo можно использовать для тестирования влияния введения SARP-1, такие как мышиное склеродерматозное заболевание трансплантат-против-хозяина (Scl GVHD) модель склеродермии. Названная модель воспроизводит важные особенности склеродермии, включающие уплотнение кожи, фиброз легких и увеличение регуляции мРНК кожного коллагена, которым предшествуют моноцитарная инфильтрация и увеличенная регуляция мРНК кожного TGF-бета 1. Модель подробно описана(McCormick LL et al., 1999). Пример 10. Системная доставка SARP-1 внутримышечной инъекцией экспрессирующей плазмидной ДНК. Для демонстрации роли SARP-1 как защитного фактора при склеродермии, мышей трансфицировали in vivo плазмидой, кодирующей кДНК SARP-1, и сравнивали с мышами, трансфицированными пустой плазмидой, как контрольными. Плазмиды вводили в обе передние большеберцовые мышцы анестезированной мыши, как описано ранее (Dimmeler et al., 1997; Mir et al., 1999). Кратко, чрезкожные электрические импульсы (8 прямоугольных электрических импульсов 200 Вт/см, продолжительность 20 мс при 2 Гц) доставляли с помощью электропульсатора PS-15, используя два электрода-пластины из нержавеющей стали, помещенные на 4,2-5,3 мМ отдельно на каждой стороне ноги. Индуцированный блеомицином фиброз легких являлся моделью склеродермии, как описано в предшествующих примерах, а за развитием заболевания следили как у трансфицированных SARP-1, так и псевдотрансфицированных животных. Список литературы 1. Abraham D., Lupoli S., McWhirter A., Plater-Zyberk C., Piela T.H., Korn J.H., Olsen I. and Black C.(b) фрагмента SARP-1, который связывается с рецептором SARP-1 и инициирует передачу сигнала через рецептор SARP-1;(k) мутеина любого из (а)-(j), в котором аминокислотная последовательность имеет по крайней мере 40, или 50, или 60, или 70, или 80, или 90% идентичности по крайней мере с одной из последовательностей в (а)-(j);(l) мутеина любого из (а)-(j), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей любой из (а)-(j), при умеренно жестких условиях или при чрезвычайно жестких условиях;(m) мутеина любого из от (а) до (j), в котором любые изменения в аминокислотной последовательности являются консервативными аминокислотными замещениями в аминокислотных последовательностях в (а)-(j);(n) агонистического антитела против рецептора SARP-1;(о) соли или изоформы, слитого белка, функционального производного или активной фракции любого из (а)-(n), для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний. 2. Применение по п.1, при котором вещество является гликозилированным по одному или более участков. 3. Применение по п.1 или 2, при котором слитый белок включает соединение с иммуноглобулином(Ig). 4. Применение по любому из пп.1-3, при котором функциональное производное содержит по крайней мере одну составляющую, присоединенную к одной или более функциональных групп, которые встречаются в виде одной или более боковых цепей на аминокислотных остатках. 5. Применение по п.4, при котором составляющая представляет собой полиэтиленовую составляющую. 6. Применение молекулы нуклеиновой кислоты для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний, причем молекула нуклеиновой кислоты включает последовательность нуклеиновой кислоты, кодирующую полипептид, включающий аминокислотную последовательность, выбранную из группы, состоящей из(b) фрагмента SARP-1, который связывается с рецептором SARP-1 и инициирует передачу сигнала через рецептор SARP-1;(k) мутеина любого из (а)-(j), в котором аминокислотная последовательность имеет по крайней мере 40, или 50, или 60, или 70, или 80, или 90% идентичности по крайней мере с одной из последовательностей в (а)-(j);(l) мутеина любого из (а)-(j), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей любой из (а)-(i), при умеренно жестких условиях или при чрезвычайно жестких условиях;(m) мутеина любого из от (а) до (j), в котором любые изменения в аминокислотной последовательности являются консервативными аминокислотными замещениями в аминокислотных последовательностях в (а)-(j);(n) изоформы, слитого белка или активной фракции любого из (а)-(m). 7. Применение вектора, содержащего молекулу нуклеиновой кислоты, охарактеризованную в п.6,для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний. 8. Применение по п.7, при котором вектор является экспрессирующим вектором.- 22005973 9. Применение по п.7 или 8, при котором вектор представляет собой вектор генной терапии. 10. Применение вектора для индукции и/или увеличения эндогенной продукции полипептида, охарактеризованного в любом из пп.1 или 2, в клетке для получения лекарственного средства для лечения и/или предупреждения фиброзных заболеваний. 11. Применение клетки, экспрессирующей вещество, охарактеризованное в любом из пп.1-3, для производства лекарственного средства для лечения и/или предупреждения фиброзных заболеваний. 12. Применение по п.11, при котором клетка генетически модифицирована, чтобы продуцировать полипептид, охарактеризованный в любом из пп.1-3. 13. Применение по п.11 или 12, при котором клетка включает вектор, охарактеризованный в любом из пп.7-10. 14. Применение по любому из предшествующих пунктов, при котором фиброзным заболеванием является цирроз печени. 15. Применение по любому из предшествующих пунктов, при котором фиброзным заболеванием является склеродермия. 16. Применение по п.15, при котором лекарственное средство, кроме того, содержит интерферон для одновременного, последовательного или раздельного применения. 17. Применение по п.16, при котором интерферон является интерфероном-. 18. Применение по п.15, при котором лекарственное средство, кроме того, содержит антагонист фактора некроза опухоли (TNF) для одновременного, последовательного или раздельного применения. 19. Применение по п.18, при котором антагонист TNF представляет собой TBPI и/или TBPII. 20. Применение по любому из пп.15-19, при котором лекарственное средство, кроме того, содержит антисклеродермический агент для одновременного, последовательного или раздельного применения. 21. Применение по п.20, при котором антисклеродермический агент выбран из группы, состоящей из ингибиторов АСЕ (АПФ), блокаторов кальциевых каналов, ингибиторов протонного насоса, NSAID,СОХ-ингибиторов, кортикостероидов, тетрациклина, пентоксифиллина, буцилламина, ингибиторов геранилгеранилтрансферазы, роттерлина, ингибиторов пролил-4-гидроксилазы, ингибиторов с-протеиназы,ингибиторов лизилоксидазы, релаксина, галогенфугинона, простагландинов, простациклинов, эндотелина-1, окиси азота, ингибиторов ангиотензина II и антиоксидантов. 22. Фармацевтическая композиция, содержащая вещество, охарактеризованное в любом из пп.1-5, в комбинации с антисклеродермическим агентом, выбранным из группы, состоящей из ингибиторов АСЕ,блокаторов кальциевых каналов, ингибиторов протонного насоса, NSAID, СОХ-ингибиторов, кортикостероидов, тетрациклина, пентоксифиллина, буцилламина, ингибиторов геранилгеранилтрансферазы,роттерлина, ингибиторов пролил-4-гидроксилазы, ингибиторов с-протеиназы, ингибиторов лизилоксидазы, релаксина, галогенфугинона, простагландинов, простациклинов, эндотелина-1, окиси азота, ингибиторов ангиотензина II и антиоксидантов. 23. Способ лечения и/или предупреждения фиброзных заболеваний, в частности цирроза печени и склеродермии, предусматривающий введение пациенту эффективного количества вещества, охарактеризованного в любом из пп.1-9, необязательно вместе с фармацевтически приемлемым носителем, в случае необходимости такого лечения. 24. Способ лечения и/или предупреждения фиброзных заболеваний, в частности цирроза печени и склеродермии, предусматривающий введение пациенту фармацевтической композиции по п.22 в случае необходимости такого лечения. 25. Способ по п.23 или 24, при котором вещество или фармацевтическую композицию вводят системно. 26. Способ по любому из пп.23 или 24, при котором вещество или фармацевтическую композицию вводят посредством внутримышечной инъекции. 27. Способ по любому из пп.23 или 24, при котором вещество или фармацевтическую композицию вводят посредством ингаляции.
МПК / Метки
МПК: C07K 14/52, A61P 1/16
Метки: склеродермии, применение, sarp-1, лечения, предупреждения
Код ссылки
<a href="https://eas.patents.su/30-5973-primenenie-sarp-1-dlya-lecheniya-i-ili-preduprezhdeniya-sklerodermii.html" rel="bookmark" title="База патентов Евразийского Союза">Применение sarp-1 для лечения и/или предупреждения склеродермии</a>
Предыдущий патент: Способ получения коллоидной силикатной дисперсии
Следующий патент: N-замещенные неарильные гетероциклические антагонисты nmda/nr2b
Случайный патент: Поглощающий аппарат