Производные витамина d с циклическими субструктурами в боковых цепях, способ и промежуточные продукты для их получения и их применение для получения лекарственных средств
Номер патента: 4703
Опубликовано: 24.06.2004
Авторы: Гизен Клаудиа, Шварц Катика, Штайнмейер Андреас, Хаберей Мартин, Фэнрих Марианне
Формула / Реферат
1. Производные витамина D общей формулы I
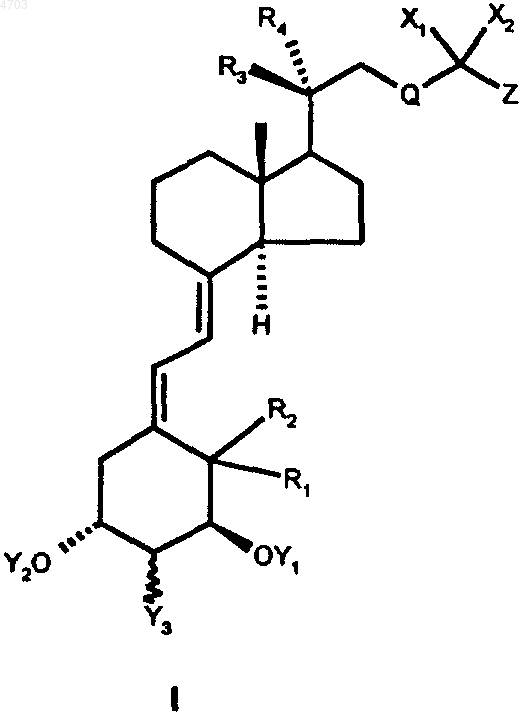
в которой Y1 и Y2, каждый независимо один от другого, обозначает атом водорода или группу -C(O)R5, а
Y3 обозначает атом водорода или гидроксигруппу, атом галогена, группу -OC(O)R5 либо группу -OR5,
где R5 представляет собой насыщенный C1-C12алкильный радикал и
группа Y3 может быть представлена как в 2a-, так и в эпимерной 2b-конфигурации,
R1 и R2 каждый обозначает атом водорода или оба вместе представляют собой экзоциклическую метиленовую группу,
R3 и R4, каждый независимо один от другого, обозначает атом водорода или алкильную группу с 1-4 атомами углерода,
Q обозначает прямоцепочечную алкиленовую группу с 1-5 атомами углерода,
X1 и X2 вместе обозначают кетокислородный атом с двойной связью или независимо один от другого обозначают атом водорода, гидроксигруппу, -OC(O)R5-группу, атом фтора, хлора либо брома, при этом X1 и X2 не должны каждый одновременно обозначать гидроксигруппу или -OC(O)R5-группу,
Z обозначает карбоциклическое либо гетероциклическое, необязательно ароматическое либо гетероароматическое кольцо с 5 или 6 членами либо конденсированную циклическую систему, состоящую из 5- и 6-членного кольца или же двух 6-членных колец, которые могут быть замещены одним или несколькими атомами фтора, хлора, брома либо иода, одной или несколькими гидроксигруппами, одной или несколькими COOR6-группами, одной или несколькими C1-C5алкильными группами, которые в свою очередь могут быть замещены одним или несколькими атомами фтора, хлора, брома либо иода, C1-C6алкоксигруппами и/или COOR6-группами, при этом
R6 представляет собой C1-C6алкильную группу, бензильную группу или фенильную группу,
а также все возможные эпимеры или диастереомеры и их смеси.
2. Соединения общей формулы I по п.1,
в которой
R3 или R4 обозначает водород,
X1 и X2 оба вместе обозначают карбонильную группу или X1 обозначает гидроксильную группу либо атом фтора, а X2 обозначает атом водорода, или X1 обозначает атом водорода, а X2 обозначает гидроксильную группу либо атом фтора, или X1 обозначает -OC(O)R5-группу, а X2 обозначает атом водорода, или X1 обозначает атом водорода, а X2 обозначает -OC(O)R5-группу и
Z представляет собой ароматическую циклическую систему.
3. Соединения общей формулы I по п.1,
в которой
R3 или R4 обозначает водород,
X1 и X2 оба вместе обозначают карбонильную группу или X1 обозначает гидроксильную группу либо атом фтора, а X2 обозначает атом водорода, или X1 обозначает атом водорода, а X2 обозначает гидроксильную группу либо атом фтора, или X1 обозначает -OC(O)R5-группу, а X2 обозначает атом водорода, или X1 обозначает атом водорода, а X2 обозначает -OC(O)R5-группу и
Z представляет собой гетероароматическую циклическую систему.
4. Соединения по п.1, где стереохимия в положении 20 представлена в не природной 20-эпиконфигурации.
5. Производные витамина D общей формулы I по п.1
(7E)-(1R,3R,24aR)-24a-(оксазол-4-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(оксазол-4-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24aR)-24a-(оксазол-4-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24aS)-24a-(оксазол-4-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(7E)-(1R,3R,24aR)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,24aR)-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24aS)-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(7E)-(1R,3R,24aR)-24a-(4-метилтиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(4-метилтиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(4-метилтиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,24aR)-24a-(4-метилтиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24aS)-24a-(4-метилтиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24a-(4-метилтиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(7E)-(1R,3R,24aR)-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,24aR)-24a-(тиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24aS)-24a-(тиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(7E)-(1R,2S,3R,24aR)-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24-тетрол,
(7E)-(1R,2S,3R,24aS)-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24-тетрол,
(7E)-(1R,2S,3R)-24a-(тиен-2-ил)-1,2,3-тригидрокси-24a-гомо-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,24aR)-24a-(4-метилтиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24aS)-24a-(4-метилтиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24a-(4-метилтиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(7E)-(1R,2S,3R,24aR)-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24-тетрол,
(7E)-(1R,2S,3R,24aS)-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24-тетрол,
(7E)-(1R,2S,3R)-24a-(4-метилтиен-2-ил)-1,2,3-тригидрокси-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(5-этилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(5-этилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aR)-24a-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(бензотиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(бензотиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-24a-(бензотиазол-2-ил)-1,3-дигидрокси-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(бензофуран-2-ил)-24a-гомо-19-нор-9,10-секохолр-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(бензофуран-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-24a-(бензофуран-2-ил)-1,3-дигидрокси-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(бензотиофен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(бензотиофен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-24a-(бензотиофен-2-ил)-1,3-дигидрокси-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(1-метилбензимидазол-2-ил)-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(1-метилбензимидазол-2-ил)-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(1-метилбензимидазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
этиловый эфир (7E)-(1R,3R)-1-(1,3-дигидрокси-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-ил)-3-[(4-метоксифенил)метокси]-1H-пиразол-4-карбоновой кислоты,
этиловый эфир (7E)-(1R,3R)-1-(1,3-дигидрокси-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-ил)-3-гидрокси-1H-пиразол-4-карбоновой кислоты,
(7E)-(1R,3R,24aR)-24a-(4-метилфенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(4-метилфенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(4-метилфенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,2R,3R,24aR)-24a-(4-метилфенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24a-тетрол,
(7E)-(1R,RS,3R,24aS)-24a-(4-метилфенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24a-тетрол,
(7E)-(1R,3R,24aR)-24a-(4-трифторметилфенил)-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(4-трифторметилфенил)-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(4-трифторметилфенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,24aR)-24a-(4-метоксифенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(4-метоксифенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-1,3-дигидрокси-24a-(4-метоксифенил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(7E)-(1R,3R,20S,24aR)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S,24aS)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S)-1,3-дигидрокси-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S,24aS)-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S)-1,3-дигидрокси-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(5Z,7E)-(1S,3R,24S)-24-(тиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R,24R)-24-(тиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(тиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(7E)-(1R,3R,20S,24aR)-24a-(оксазол-4-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S,24aS)-24a-(оксазол-4-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S)-1,3-дигидрокси-24a-(оксазол-4-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(оксазол-4-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S,24aS)-24a-(оксазол-4-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S)-1,3-дигидрокси-24a-(оксазол-4-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(5Z,7E)-(1S,3R,24R)-24-(оксазол-4-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24S)-24-(оксазол-4-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(оксазол-4-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(7E)-(1R,3R,20S,24aR)-24a-(4-метилтиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S,24aS)-24a-(4-метилтиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S)-1,3-дигидрокси-24a-(4-метилтиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(4-метилтиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S,24aS)-24a-(4-метилтиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S)-1,3-дигидрокси-24a-(4-метилтиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(5Z,7E)-(1S,3R,24R)-24-(4-метилтиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(4-метилтиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(7E)-(1R,3R,20S,24aR)-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S,24aS)-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S)-1,3-дигидрокси-24a-(4-метилтиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(4-метилтиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S,24aS)-24a-(4-метилтиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S)-1,3 -дигидрокси-24a-(4-метилтиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(5Z,7E)-(1S,3R,24R)-24-(4-метилтиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(4-метилтиен-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(7E)-(1R,3R,20S,24aR)-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S,24aS)-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,20S)-1,3-дигидрокси-24a-(тиен-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-24a-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(тиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S,24aS)-24a-(тиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,20S)-1,3-дигидрокси-24a-(тиен-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-24a-он,
(5Z,7E)-(1S,3R,24R)-24-(тиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R,24S)-24-(тиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24a-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(тиен-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R,24R)-24-(4-метилтиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(4-метилтиазол-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(5Z,7E)-(1S,3R,24S)-24-(тиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R,24R)-24-(тиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(тиен-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R,24R)-24-(4-метилтиен-2-ил)-9,10-секохола-5,7,10(19)-триен-1,3,24-триол,
(5Z,7E)-(1S,3R)-1,3-дигидрокси-24-(4-метилтиен-2-ил)-9,10-секохола-5,7,10(19)-триен-24-он,
(7E)-(1R,3R,24aR)-24a-фтор-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3-диол,
(7E)-(1R,3R,24aS)-24a-фтор-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3-диол,
(5Z,7E)-(1S,3R,24aR)-24a-фтор-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3-диол,
(5Z,7E)-(1S,3R,24aS)-24a-фтор-24a-(тиазол-2-ил)-24a-гомо-9,10-секохола-5,7,10(19)-триен-1,3-диол,
(7E)-(1R,3R,24aR)-24a-(ацетилокси)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(ацетилокси)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aR)-24a-(2,2-диметилпропаноилокси)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R,24aS)-24a-(2,2-диметилпропаноилокси)-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол,
(7E)-(1R,3R)-2-бром-24a-(тиазол-2-ил)-24a-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24a-триол.
6. Способ получения соединений общей формулы I по п.1, где Q обозначает C2-C5алкил, отличающийся тем, что соединение формулы III
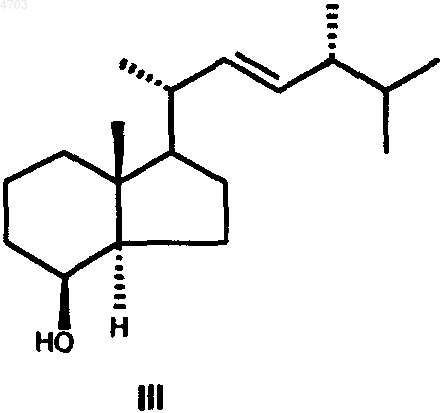
введением защитной группы Y4 превращают в соединение формулы IV
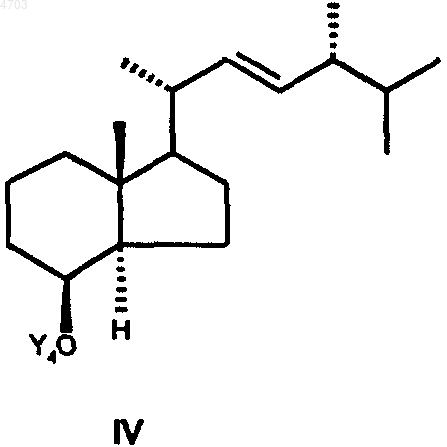
в которой Y4 обозначает триалкилсилильную защитную группу, силильную защитную группу со смешанным арилалкильным замещением, тетрагидропиранильную или тетрагидрофуранильную защитную группу,
затем путем оксидативного расщепления двойной связи соединение IV переводят в соединение общей формулы V
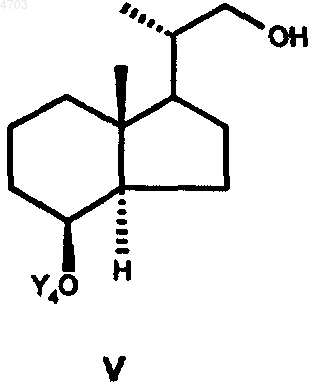
которое за счет введения любой уходящей группы L переводят в соединение общей формулы VI
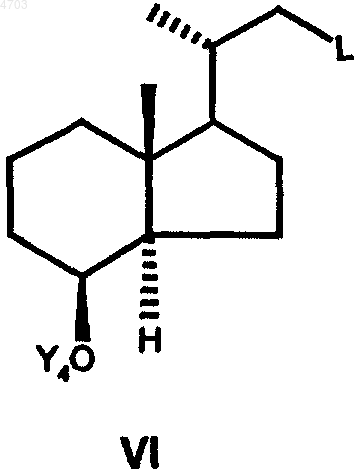
которое подвергают взаимодействию с алкинолом формулы
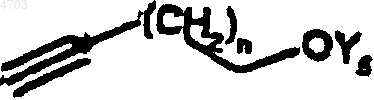
где Y5 представляет собой тетрагидропиранильную группу или бензильную группу, а n обозначает 0, 1, 2, 3, депротонированным с помощью соответствующего основания, такого как гидрид натрия, гидрид калия, бутиллитий или амид натрия, с получением соединения общей формулы VIIb
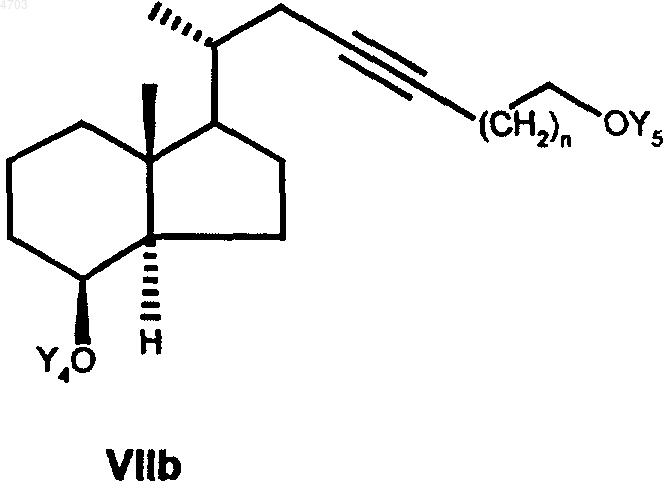
в которой Y5 имеет указанные выше значения, далее в любой последовательности гидрируют тройную связь и необязательно имеющуюся еще защитную группу Y5 обычным путем отщепляют с целью получить соединение общей формулы VIIIb
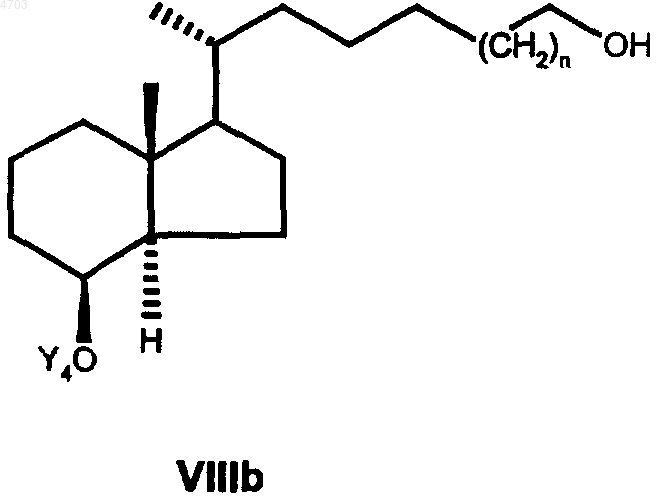
свободную гидроксигруппу которого с помощью соответствующих окислителей, таких как хлорхромат пиридиния, дихромат пиридиния, окислением согласно Сверну или окислением согласно Коллинзу переводят затем в альдегид общей формулы IXb
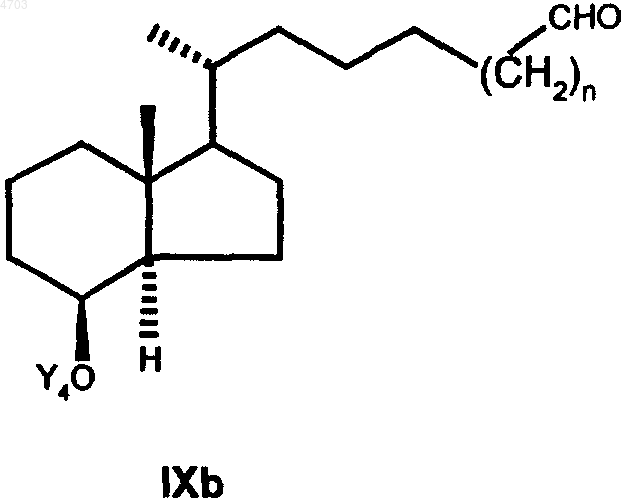
который взаимодействием с нуклеофилом Z', представляющим собой любую нуклеофильную форму радикалов из числа указанных для Z, переводом свободной гидроксигруппы в группу OCOR', где R' обозначает C1-C5алкил, отщеплением защитной группы Y4 и окислением свободной гидроксигруппы переводят в кетон общей формулы XIIIb
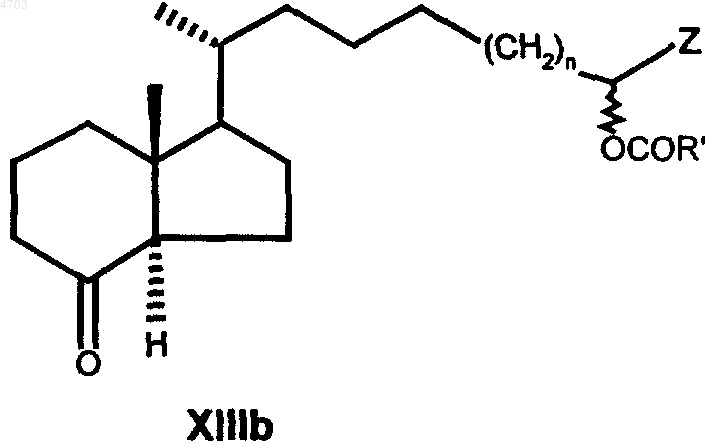
который затем обычным путем по реакции Виттига с использованием одного из известных фосфонатов формул XIV, XV или XVI
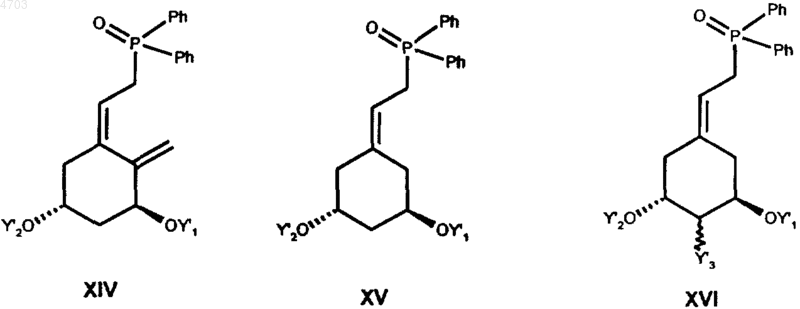
после отщепления защитных групп переводят в соединение общей формулы I.
7. Промежуточные продукты общей формулы VIIb
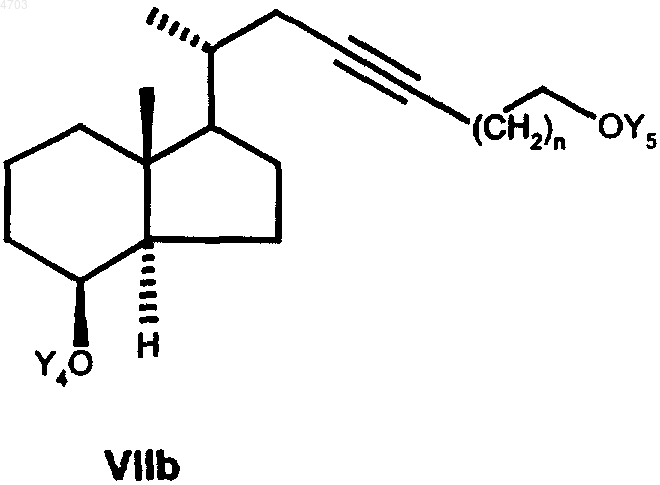
согласно способу по п.6, при этом Y4, Y5 и n имеют значения, указанные в п.6.
8. Промежуточные продукты общей формулы VIIIb
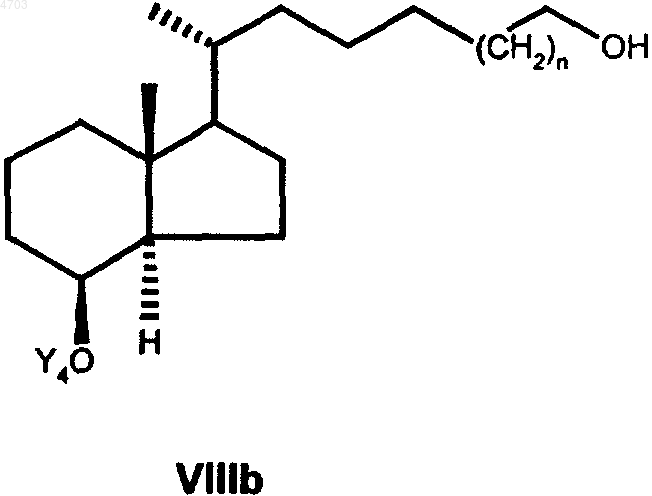
согласно способу по п.6, при этом Y4 и n имеют значения, указанные в п.6.
9. Промежуточные продукты общей формулы IXb
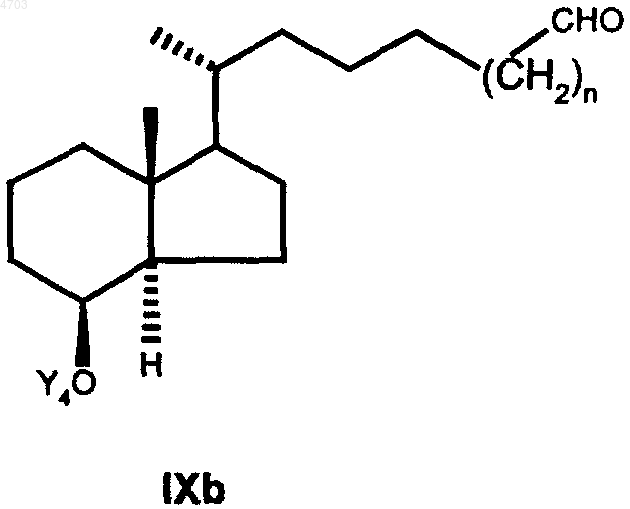
согласно способу по п.6, при этом Y4 и n имеют значения, указанные в п.6.
10. Фармацевтические препараты, содержащие в своем составе по меньшей мере одно соединение по п.1 вместе с фармацевтически приемлемыми вспомогательными веществами и носителями.
11. Применение производных витамина D общей формулы I по п.1 для получения соответствующих лекарственных средств.
12. Применение по п.11 для лечения заболеваний, характеризующихся гиперпролиферацией и отсутствием дифференцировки клеток (например, гиперпролиферативных заболеваний кожи: псориаза, лишая Pityriasis subia pilasis, угрей и ихтиоза; кожного зуда; опухолевых заболеваний и предрака: опухолей желудочно-кишечного тракта, рака молочной железы, опухолей легких, рака предстательной железы, лейкозов, лимфомы Т-клеток, меланомы, бета-клеточного рака, чешуйчатого рака, актинического кератоза, шейной дисплазии, метастазирующих опухолей любого типа).
13. Применение по п.11 для лечения и профилактики заболеваний, характеризующихся нарушением равновесия иммунной системы (например, экземы, атопических заболеваний и воспалительных заболеваний: ревматоидного артрита, заболеваний дыхательных путей, таких как астма, аутоиммунных заболеваний, таких как множественный склероз, сахарного диабета типа I, тяжелой миастении, красной волчанки, склеродермии, буллезных заболеваний кожи, таких как пемфигус, пемфигоид, при реакциях отторжения аутологичных, аллогенных или гетерологичных трансплантатов, а также СПИДа).
14. Применение по п.12 в сочетании с другими обладающими иммуносупрессорным действием средствами, такими как циклоспорин A, FK 506, рапамицин и антитела к CD4.
15. Применение по п.11 для терапии вторичного гиперпаратиреоза и почечной остеодистрофии, а также сахарного диабета типа II.
16. Применение по п.11 при местном введении для ускоренного заживления ран, а также для лечения старения кожи или индуцированной медикаментами атрофии кожи.
17. Применение по п.11 для лечения заболеваний, сопровождающихся нарушением роста волос, с целью способствовать физиологическому процессу роста волос.
18. Применение по п.11 для терапии и профилактики старческого остеопороза, климактерического остеопороза, индуцированного стероидами остеопороза и для ускоренного заживления артропластики.
19. Применение по п.11 для лечения дегенеративных заболеваний периферической и центральной нервной системы.
20. Применение по п.11 соединений общей формулы I, обладающих антагонистическим действием по отношению к кальцитриолу, для терапии и профилактики артериосклероза, для терапии гиперкальциемии, для контроля фертильности, при СПИДе, в качестве иммуностимуляторов, при гирсутизме и гранулематозных заболеваниях.
21. Способ получения соединений общей формулы I по п.1, отличающийся тем, что кетон общей формулы XIIIc

в которой E представляет собой боковую цепь в положении 17 соединения формулы I по п.1, а необязательно имеющиеся кетогруппы и/или гидроксигруппы представлены в защищенной форме, взаимодействием с эфиром триметилсилилуксусной кислоты в присутствии соответствующего основания, например н-бутиллития или алюмогидрида лития, либо с соответствующим реагентом Виттига в апротонном растворителе, таком как толуол, тетрагидрофуран, диэтиловый эфир или диоксан, переводят в соединение общей формулы XXXIVc
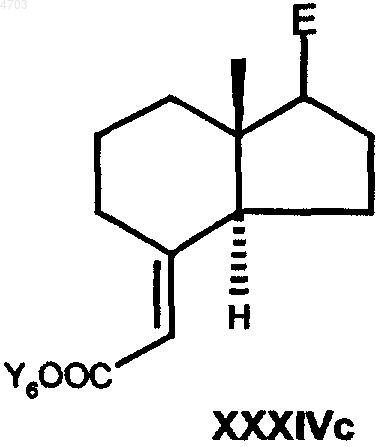
в которой E имеет вышеуказанные значения, Y6 обозначает C1-C6алкильную группу, бензильную группу или фенильную группу, затем сложноэфирную группу по реакции с восстановителем, таким как диизобутилалюмогидрид, алюмогидрид лития, диборан или красный алюминий (RedAl), в гексане, толуоле, тетрагидрофуране, диэтиловом эфире или диоксане, переводят в аллиловый спирт общей формулы XXXVc
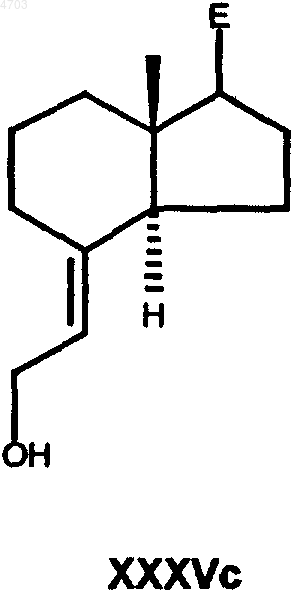
где E имеет вышеуказанные значения,
после чего этот аллиловый спирт известэыь образом переводят в соединение общей формулы XXXVd
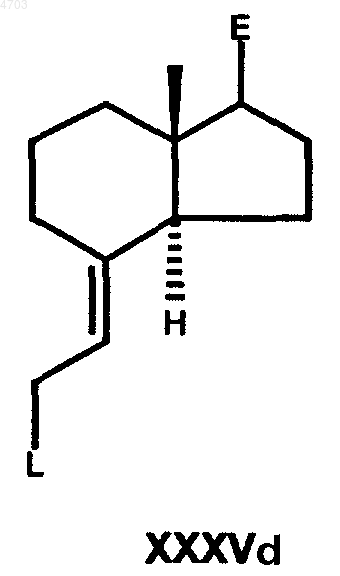
в которой E имеет вышеуказанные значения, а L обозначает любую уходящую группу (галоген, мезилат, тозилат, трифлат, нонафлат), указанное соединение выделяют или при необходимости образуют in situ и далее сразу же превращают в реагент Виттига общей формулы XXXVIc
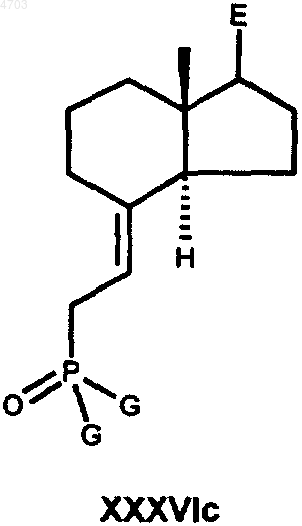
в которой E имеет вышеуказанные значения, а G обозначает C1-C10алкильную группу, C1-C10алкоксигруппу, фенильную группу или феноксигруппу, затем указанный реагент Виттига при соблюдении известных условий подвергают взаимодействию с кетоном общей формулы XXXIIIc
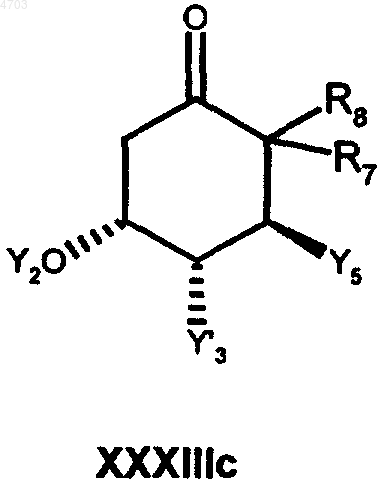
в которой Y'3 обозначает атом водорода, атом галогена или защищенную гидроксигруппу, группу -O(CO)R5 либо OR5-группу, а Y5, R7 и R8 имеют значения, указанные в п.1 для Y1, R1 и R2 соответственно, с получением целевого продукта в котором при необходимости удаляют защитные группы.
22. Промежуточные продукты способа по п.21 общей формулы XXXIVc
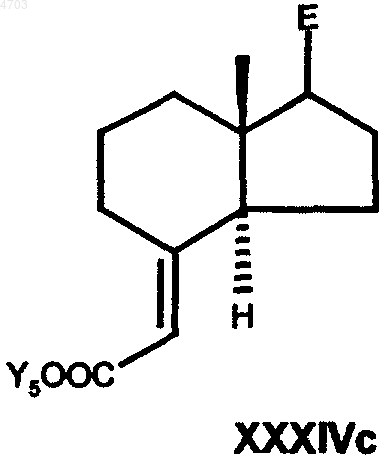
в которых E и Y6 имеют указанные в п.21 значения.
23. Промежуточные продукты способа по п.21 общей формулы XXXVc
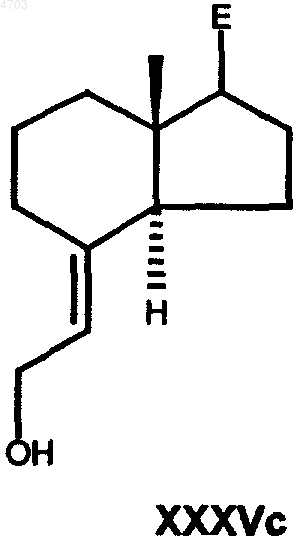
в которых E имеет указанные в п.21 значения.
24. Промежуточные продукты способа по п.21 общей формулы XXXVIc
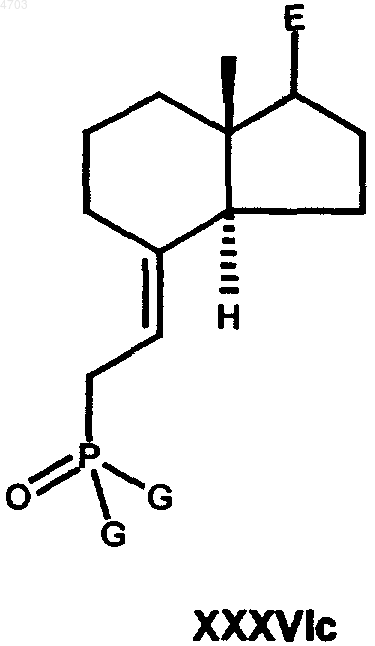
в которых E и G имеют указанные в п.21 значения.
Текст
1 Настоящее изобретение относится к новым производным витамина D общей формулы I в которой Y1 и Y2 каждый независимо один от другого обозначает атом водорода или группуY3 обозначает атом водорода или гидроксигруппу, атом галогена, группу -OC(O)R5 либо группу -ОR5,где R5 представляет собой насыщенный С 1-С 12 алкильный радикал, и группа Y3 может быть представлена как в 2-, так и в эпимерной 2-конфигурации,R1 и R2 каждый обозначает атом водорода или оба вместе представляют собой экзоциклическую метиленовую группу,R3 и R4 каждый независимо один от другого обозначает атом водорода или алкильную группу с 1-4 атомами углерода,Q обозначает прямоцепочечную алкиленовую группу с 1-5 атомами углерода,X1 и Х 2 вместе обозначают кетокислородный атом с двойной связью или независимо один от другого обозначают атом водорода,гидроксигруппу, -OC(O)R5-группy, атом фтора,хлора либо брома, при этом X1 и Х 2 не должны каждый одновременно обозначать гидроксигруппу или -OC(O)R5-гpyппy,Z обозначает карбоциклическое либо гетероциклическое, необязательно ароматическое либо гетероароматическое кольцо с 5 или 6 членами либо конденсированную циклическую систему, состоящую из 5- и 6-членного кольца или же двух 6-членных колец, которые могут быть замещены одним или несколькими атомами фтора, хлора, брома либо иода, одной или несколькими гидроксигруппами, одной или несколькими СООR6-группами, одной или несколькими С 1-С 5 алкильными группами, которые в свою очередь могут быть замещены одним или несколькими атомами фтора, хлора, брома либо иода, C1-С 6 алкоксигруппами и/или СООR6-группами, при этомR6 представляет собой C1-С 6 алкильную группу, бензильную группу или фенильную группу,а также ко всем возможным эпимерам или диастереомерам и их смесям, к способу их получения, промежуточным продуктам способа, а также к их применению для получения соответствующих лекарственных средств. 2 Уровень техники Природные витамины D2 и D3 как таковые не являются биологически активными веществами и лишь после гидроксилирования у Сатома 25 в печени и у С-атома 1 в почках превращаются в биологически активные метаболиты [1,25-дигидроксивитамин D3 (кальцитриол),соответственно - D2]. Действие активных метаболитов заключается в том, что они регулируют концентрацию кальция и фосфатов в сыворотке; они противодействуют снижению концентрации кальция в сыворотке благодаря тому, что повышают абсорбцию кальция в кишечнике и при определенных условиях способствуют выведению кальция из костной ткани. На фиг. 1 представлена структура некоторых известных производных витамина D: Фиг. 1 Наряду с их выраженной эффективностью в отношении обмена веществ с участием кальция и фосфатов активные метаболита витаминаD2 и витамина D3, равно как и их синтетические производные обладают действием, ингибирующим пролиферацию и стимулирующим дифференцировку опухолевых клеток и нормальных клеток, например клеток кожи. Наряду с этим было обнаружено выраженное действие на клетки иммунной системы (ингибирование пролиферации и синтеза интерлейкина-2 лимфоцитов, повышение цитотоксичности и фагоцитозаin vitro моноцитов), которое проявляется в иммуномодуляторной эффективности. Кроме того,как было установлено на нормальных и остеопорозных крысах, благодаря своему положительному действию на образующие костную ткань клетки они способствуют усиленному образованию последней [R. Bouillon и др.,"Short term course of 1,25-(OH)2D3 stimulates osteoblasts but not osteoclasts", Calc. Tissue Int. 49,168 (1991)]. Все эти действия опосредуются связыванием витамина D с рецептором. Благодаря этому связыванию регулируется активность специфичных генов. При применении биологически активных метаболитов витамина D2 и D3 наблюдается токсичное действие на обмен веществ с участием кальция (гиперкальциемия). За счет соответствующих структурных модификаций боковой цепи терапевтически положительные эффекты удается отделить от нежелательной гиперкальциемической активности. Одним из таких структурных вариантов является введение 24-гидроксигруппы. Гидроксилированные в положении 24 1-холекальциферолы 3 описаны, в частности, в заявке DE 2526981. По сравнению с соответствующим негидроксилированным 1-холекальциферолом они обладают меньшей токсичностью. 24-гидроксипроизводные описаны, кроме того, в следующих заявках: DE 3933034, DE 4003854, DE 4034730, ЕР 0421561, ЕР 0441467, WO 87/00834, WO 91/12238. Следует сослаться и на заявку WO 94/07853, где описываются гидроксилированные у С-24 25-карбонокислотные производные кальцитриола, обладающие более положительным спектром действия по сравнению с кальцитриолом. Сказанное справедливо также и в отношении новых производных витамина D с другими заместителями у С-25 (заявка WO 97/00242). Хотя способность провоцировать гиперкальциемию в этих случаях заметно снижается, ингибирующие пролиферацию и стимулирующие дифференцировку эффекты сохраняются. Как правило, однако, введение 24 гидроксильной группы приводит к метаболической дестабилизации производных. По этой причине указанные соединения пригодны для системного применения лишь в ограниченной степени. Таким образом, существует настоятельная потребность в новых производных витамина D,которые при сохранении примерно такого же положительного или более совершенного механизма действия, что и у соединений из уровня техники (описанных прежде всего в заявках WO 94/07853 и WO 97/00242), благодаря более высокой метаболической стабильности могли бы эффективнее применяться для системного введения. С учетом вышеизложенного в основу настоящего изобретения была положена задача получить производные витамина D указанного типа. Эта задача решается с помощью соединений, представленных в приведенной выше формуле изобретения. Кроме того, были изучены и другие производные витамина D общей формулы I в которой R5 представляет собой ароматический радикал с 5-12 С-атомами либо алифатический,прямоцепочечный или разветвленный, насыщенный или ненасыщенный С 1-С 12 алкильный радикал, необязательно прерванный 1-2 атомами кислорода, 1-2 атомами серы и/или 1-2 NHгруппами и/или необязательно замещенный 1-2 4 гидроксигруппами, 1-2 аминогруппами, 1-2 SHгруппами, 1-2 СООН-группами и/или 1-2 фенильными группами,R3 и R4 каждый независимо один от другого обозначает атом водорода, атом фтора, хлора либо брома, алкильную группу с 1-4 атомами углерода, оба вместе представляют собой метиленовую группу или вместе с четвертичным атомом углерода 20 образуют 3-7-членное, насыщенное или ненасыщенное карбоциклическое кольцо,а остальные заместители имеют указанные выше значения,а также все возможные эпимеры или диастереомеры этих соединений и их смеси. Особенно предпочтительные варианты осуществления изобретения являются объектом зависимых пунктов формулы изобретения. Группа -C(O)R5, указанная в качестве значения радикалов Y1 и Y2, может нести от 1 до 13 атомов углерода и представляет собой производное прежде всего насыщенных карбоновых кислот. Радикалы при этом могут быть циклическими, ациклическими, прямоцепочечными или разветвленными, насыщенными или ненасыщенными, карбоциклическими или гетероциклическими. Предпочтительно дериватизировать радикалы из С 1-С 9 карбоновых кислот. В качестве примеров можно назвать муравьиную кислоту, уксусную кислоту, пропионовую кислоту, бутановую кислоту, пентановую кислоту и пивалиновую кислоту. Особенно предпочтительными значениями Y1 и Y2 каждого независимо один от другого являются соответственно атом водорода или ацетильная, пропионильная либо пивалоильная группа. Приведенное пояснение справедливо также в отношении группы -OC(O)R5, указанной в качестве значения радикалов Y3, X1 и Х 2.Y3 может представлять собой атом водорода, атом фтора, хлора либо брома или гидроксигруппу, OR5-гpyппy либо -OC(O)R5-гpyппy. Указанная для Y3 алкоксигруппа может быть прямоцепочечной или разветвленной,предпочтительно незамещенной и не прерванной гетероатомами, и может представлять собой, например, метокси-, этокси-, пропокси-,изопропокси-, бутокси-, изобутокси- или тpeтбутоксигруппу с предпочтительной длиной цепи C1-C9.R3 и R4 независимо один от другого могут обозначать соответственно атом фтора, хлора либо брома, алкильную группу с 1-4 атомами углерода (метильную, этильную, н-пропильную,изопропильную, н-бутильную, изобутильную или трет-бутильную группу), а оба вместе могут представлять собой метиленовую группу либо вместе с четвертичным атомом углерода 20 могут образовывать 3-7-членное, насыщенное или ненасыщенное карбоциклическое кольцо. Для R3 и R4 рекомендуются следующие предпочтительные комбинации:R4=метил или R3=метил, R4=Н; R3=R4=метил; R3 и R4 вместе образуют метиленовую группу или вместе с третичным атомом углерода 20 образуют циклопропильное кольцо. Возможный радикал R5 в указанной дляY3, X1 и Х 2 группе -OC(O)R5 представляет собой органический радикал с 1-12 С-атомами, дериватизированный из карбоновых кислот соответственно с удлиненной на один углеродный атом цепью. Такие радикалы могут быть насыщенными или ненасыщенными, разветвленными или неразветвленными, насыщенными или ненасыщенными, ациклическими, карбоциклическими или гетероциклическими. В качестве примеров радикала R5 можно назвать метил,этил, пропил, изопропил, бутил и фенил. Вместе с тем возможны также радикалы встречающихся в природе аминокислот. Предпочтительный радикал R5 представляет собой производное С 1-С 9-, прежде всего С 2 С 5 алканкарбоновых кислот, таких, например,как уксусная кислота, пропионовая кислота,масляная кислота или пивалоиновая кислота. Из ароматических групп предпочтительными являются фенильная группа и замещенные фенильные группы. Указанная в качестве значения для R6 алкильная группа может быть прямоцепочечной или разветвленной, насыщенной или ненасыщенной и может представлять собой метил,этил, пропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил или гексил. Указанные в качестве значений для R6 бензильная группа и фенильная группа могут быть незамещенными или же могут быть замещены одним либо несколькими атомами галогена,одной или несколькими гидроксигруппами, С 1 С 4 алкоксигруппами, СF3-группами или аминогруппами. Предпочтительны незамещенные бензильная и фенильная группы.Q обозначает предпочтительно метиленовую, этиленовую или пропиленовую группу.X1 и Х 2 оба вместе предпочтительно образуют карбонильную группу, или X1 обозначает гидроксильную группу либо атом фтора, а Х 2 обозначает атом водорода, или X1 обозначает атом водорода, а Х 2 обозначает гидроксильную группу либо атом фтора, или X1 обозначает-ОС(O)R6-группу, а Х 2 обозначает атом водорода, или X1 обозначает атом водорода, а Х 2 обозначает -ОС(O)R6-группу. Оба варианта, в которых X1 и Х 2 означают ОН или X1 и Х 2 означают OC(O)R6, являются исключением, поскольку нецелесообразны с химической точки зрения.Z обозначает предпочтительно фенильное кольцо, замещенное в орто-, мета- или параположении одной или несколькими метокси-,этокси-, пропокси-, гидроксигруппами, фтором,хлором, бромом, метильными, этильными, пропильными либо трифторметильными группами,или Z представляет собой предпочтительно ге 004703 6 тероциклическую систему, такую, например,как фурановое, тиофеновое, пиразольное, пиррольное, оксазольное, тиазольное либо имидазольное кольцо, которое в одном или нескольких любых положениях может нести метильные, этильные либо пропильные группы, которые в свою очередь могут быть замещены галогеном гидроксигрупп, и каковое кольцо может быть связано через любой С-атом с основной системой, или Z представляет собой предпочтительно гетероциклическую конденсированную систему, такую, например, как бензофурановую,бензотиофеновую, бензимидазольную, бензоксазольную, бензотиазольную или индольную систему, которая в любом положении может нести метильные, этильные либо пропильные группы, которые в свою очередь могут быть замещены галогеном гидроксигрупп, и каковая система может быть связана через любой Сатом с основной системой. При использовании понятия "галоген" касательно образца замещения радикалов имеется в виду фтор, хлор, бром или иод, а в качестве уходящей группы в способе - предпочтительно бром или иод. К наиболее предпочтительным соединениям общей формулы I согласно изобретению относятся следующие соединения:(7 Е)-(1R,3R,24 аS)-24 а-фтор-24 а-(тиазол-2 ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен-1,3 диол,(5Z,7 Е)-(1S,3R,24 аR)-24 а-фтор-24 а-(тиазол-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)триен-1,3-диол,(5Z,7 Е)-(1S,3R,24 аS)-24 а-фтор-24 а-(тиазол-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)триен-1,3-диол,(7 Е)-(1R,3R,24 аR)-24 а-(ацетилокси)-24 а(тиазол-2-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-1,3,24 а-триол,(7 Е)-(1R,3R,24 аS)-24 а-(ацетилокси)-24 а(тиазол-2-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-1,3,24 а-триол,(7 Е)-(1R,3R,24 аR)-24 а-(2,2-диметилпропаноилокси)-24 а-(тиазол-2-ил)-24 а-гомо-19-нор 9,10-секохола-5,7-диен-1,3,24 а-триол,(7 Е)-(1R,3R,24 аS)-24 а-(2,2-диметилпропаноилокси)-24 а-(тиазол-2-ил)-24 а-гомо-19-нор 9,10-секохола-5,7-диен-1,3,24 а-триол,(7 Е)-(1R,3R)-2-бром-24 а-(тиазол-2-ил)-24 агомо-19-нор-9,10-секохола-5,7-диен-1,3,24 атриол. Предлагаемые в изобретении субстанции обладают заметно более высокой метаболической стабильностью по сравнению с родственными им по своей структуре соединениями из уровня техники, что позволяет применять их для системного введения. В отличие от структурно родственных соединений из уровня техники некоторые из субстанций по изобретению отличаются, кроме того, и тем, что оказывают существенное воздействие на дифференциацию клеток, не влияя при этом на баланс кальция в сторону его увеличения. Ряд других субстанций согласно изобретению обладают антагонистическим или частично антагонистическим механизмом действия, что открывает новые возможности для их применения. Исследование биологической активности Активность предлагаемых субстанций в качестве производных витамина D определяют в тесте на связывание кальцитриола с рецептором. С этой целью используют экстракт протеина, взятого из кишечника молодой свиньи. Содержащий рецептор экстракт протеина инкубируют в специальной трубке с 3 Н-кальцитриолом(5 х 10-10 моль/л) в реакционном объеме 0,27 мл при отсутствии и в присутствии исследуемых субстанций в течение 2 ч при 4 С. Для разделения свободного и связанного с рецептором кальцитриола используют метод абсорбции с древесным углем и декстраном в качестве абсорбентов. С этой целью в каждую трубку вводят по 250 мкл суспензии из древесного угля и декстрана и при 4 С инкубируют в течение 20 мин. Затем образцы в течение 5 мин при 4 С центрифугируют при 10000 g. Супернатант декантируют и после одночасового уравновеши 13 вания в Picofluor 15 проводят измерения с помощью бета-счетчика. Кривые конкурентного связывания, полученные для различных концентраций исследуемой субстанции, а также сравнительной субстанции (немеченый кальцитриол) при постоянной концентрации стандартной субстанции (3 Нкальцитриол), соотносят друг с другом и определяют коэффициент конкурентного связывания(ККС). Этот коэффициент представляет собой частное от деления концентраций соответствующей исследуемой и сравнительной субстанций, необходимых для 50%-ного конкурентного связывания: Для выявления быстроты и эффективности действия различных производных кальцитриола в отношении гиперкальциемии проводят описанное ниже исследование. В этих целях используют контроль (основу раствора), сравнительную субстанцию (1,25-дигидроксивитаминD=кальцитриол) и исследуемую субстанцию,определяя их действие соответственно после однократного подкожного введения здоровым самцам крыс весом 140-170 г, объединенных в группы по десять особей в каждой. Во время опытов животных содержат в специальных клетках для определения экскреции воды и минеральных веществ. Мочу собирают двумя фракциями (0-16 ч и 16-22 ч). Недостаток поступления в организм кальция к моменту истечения 16 ч, обусловленный отсутствием корма,компенсируют оральным введением кальция(0,1 мМ раствор кальция в 6,5%-ной гидроксипропилцеллюлозе, 5 мл/животное). В конце опытов животных умерщвляют путем декапитации и обескровливают с целью определить уровень кальция в сыворотке. Для первичного скрининга in vivo используют однуединственную стандартную дозу (200 мкг/кг). Для выбранных субстанций на основании полученных результатов строят кривую зависимости доза-действие. Гиперкальциемическое действие проявляется в повышенном по сравнению с контролем уровне кальция в сыворотке. Значимость выявленных различий между группами, обработанными исследуемой и сравнительной субстанциями, и контрольными группами, а также различия между группами,обработанными исследуемой субстанцией и обработанными сравнительной субстанцией,определяют методами статистического анализа. Полученный результат выражают в виде соотношения доз СД (СД представляет собой коэффициент, рассчитываемый делением дозы исследуемой субстанции на дозу сравнительной субстанции для сравнимых эффектов). Стимулирующее дифференцировку действие аналогов кальцитриола определяют также в количественном отношении. 14 Из литературы [D.J. Mangelsdorf и др.,Journ. Cell. Biol. 98, стр.391 (1984)] известно,что обработка лейкозных клеток человека (промиелоцитные клетки линии HL 60) in vitro кальцитриолом индуцирует дифференцировку клеток до макрофагов. Клетки HL 60 культивируют в тканевой культуральной среде (RPMI+10% фетальной телячьей сыворотки) при 37 С на воздухе в атмосфере с 5%-ным содержанием СО 2. Для исследования субстанций клетки отделяют центрифугированием и в количестве 2,0 х 105 клеток/мл помещают в не содержащую фенолового красного тканевую культуральную среду. Затем исследуемые субстанции растворяют в этаноле и с помощью тканевой культуральной среды без фенолового красного разводят до требуемой концентрации. Полученные разведения смешивают с клеточной суспензией в соотношении 1:10 и по 100 мкл этой смешанной с субстанцией клеточной суспензии с помощью пипетки вносят в лунки 96-луночного планшета. В целях контроля клеточную суспензию аналогичным образом смешивают с растворителем. После инкубации в течение 96 ч при 37 С на воздухе в атмосфере с 5%-ным содержанием СО 2 в каждую лунку 96-луночного планшета к клеточной суспензии с помощью пипетки добавляют 100 мкл раствора ТНГ/ТФА(ТНГ=тетразолиевый нитроголубой, конечная концентрация в смеси 1 мг/мл; ТФА= тетрадеканоилфорболмиристат-13-ацетат,конечная концентрация в смеси 2 х 10-7 молей/л). В результате 2-часовой инкубации при 37 С на воздухе в атмосфере с 5%-ным содержанием СО 2 благодаря внутриклеточному высвобождению кислородных радикалов, стимулированному ТФА, в дифференцированных до макрофагов клетках ТНГ восстанавливается до нерастворимого формазана. Для завершения реакции находящуюся в лунках 96-луночного планшета клеточную суспензию отфильтровывают с помощью вакуум-фильтра и клетки за счет добавления метанола фиксируют на дне планшета, после чего проводят сушку. С целью растворить образовавшиеся внутриклеточные кристаллы формазана в каждую лунку планшета добавляют с помощью пипетки 100 мкл гидроксида калия(2 моля) и 100 мкл диметилсульфоксида и в течение 1 мин обрабатывают ультразвуком. Концентрацию формазана определяют методом спектрофотометрии при длине волны 650 нм. Мерой индукции дифференцировки клеток HL 60 до макрофагов служит концентрация образовавшегося формазана. Полученный результат выражают в виде соотношения доз СД (СД представляет собой коэффициент, рассчитываемый делением дозы исследуемой субстанции на дозу сравнительной субстанции для сравнимых 50%-ных максимальных эффектов). Результаты исследования по связыванию кальцитриола с рецептором, а также определе 15 ние соотношения доз, обусловливающего соответствующую индукцию дифференцировки клеток HL 60, и соотношения доз, влияющего в той или иной степени на гиперкальциемию, представлены ниже в обобщенном виде. Примеры используемых в исследовании субстанций:(217 а). ККС СД (HL 60) СД (Са) 16 а 5 5 30 20 а 3 2 50 55b 5 8 100 57 12 2 350 217 а 7 100 300 Кальцитриол 1 1 1 Указанные соединения наряду с выраженным сродством к рецептору витамина D проявляют заметную активность касательно дифференцировки клеток. Индукция же гиперкальциемии наблюдается лишь при значительно более высоких дозах по сравнению с кальцитриолом. Благодаря сниженной способности вызывать гиперкальциемию, а также высокой метаболической стабильности субстанции по изобретению могут особенно успешно применяться для получения лекарственных средств, предназначенных для лечения заболеваний, характеризующихся гиперпролиферацией и отсутствием дифференцировки клеток. К таким заболеваниям относятся среди прочих гиперпролиферативные заболевания кожи (псориаз, лишай (Pityriasis subia pilasis), угри, ихтиоз) и кожный зуд, а также опухолевые заболевания и предрак (например, опухоли желудочно-кишечного тракта,рак молочной железы, опухоли легких, рак предстательной железы, лейкозы, Т-клеточная лимфома, меланома, бета-клеточный рак, чешуйчатый рак, актинический кератоз, шейная дисплазия, метастазирующие опухоли любого типа). В равной мере предлагаемые в изобретении субстанции пригодны для лечения и профилактики заболеваний, характеризующихся нарушением равновесия иммунной системы. К ним относятся экземы, атонические заболевания и воспалительные заболевания (ревматоидный 16 артрит, заболевания дыхательных путей, например астма), а также аутоиммунные заболевания, такие, например, как множественный склероз, сахарный диабет типа I, тяжелая миастения, красная волчанка, склеродермия, буллезные заболевания кожи (пемфигус, пемфигоид), кроме того, реакции отторжения аутологичных, аллогенных или гетерологичных трансплантатов, а также СПИД. При всех перечисленных заболеваниях новые соединения общей формулы I могут с успехом применяться также в сочетании с другими обладающими иммуносупрессорной активностью средствами, такими как циклоспорин A, FK 506, рапамицин и антитела к CD4. Субстанции по изобретению пригодны также для терапии вторичного гиперпаратиреоза и почечной остеодистрофии, обусловленных свойством кальцитриолов снижать синтез паратгормонов. Присутствие рецептора витамина D в продуцирующих инсулин клетках поджелудочной железы позволяет применять субстанции по изобретению благодаря повышению секреции инсулина для терапии сахарного диабета типаII. Далее неожиданным образом было установлено, что в результате местного применения предлагаемых соединений на коже мышей, крыс и морских свинок удается индуцировать усиленное покраснение кожи и увеличение толщины эпидермиса. Усиленное покраснение кожи определяют по повышению количественного показателя красноты, выявляемому с помощью соответствующего колориметра. Этот показатель красноты после трехкратного введения субстанций (доза 0,003%) в интервалы времени по 24 ч обычно возрастает в 1,5 раза. Увеличение толщины эпидермиса определяют на гистологическом препарате. Этот показатель возрастает обычно в 2,5 раза. Число пролиферирующих клеток эпидермиса (клетки в S-фазе клеточного цикла) выявляют методом проточной цитометрии, и это число увеличивается обычно в 6 раз. Указанные свойства предлагаемых производных из группы витамина D позволяют с определенной долей уверенности предположить возможность их терапевтического применения при атрофической коже, которая наблюдается при естественном старении кожи вследствие длительного светового воздействия или индуцированной медикаментами атрофии кожи, в частности при лечении глюкокортикоидами. Еще одно преимущество новых соединений заключается в возможности их местного применения с целью ускорить заживление ран. В клеточных популяциях волосяного фолликула, которые играют решающую роль для роста волос, соответственно для регуляции цикла жизни волос, удалось обнаружить протеины рецептора витамина D3 [W.E. Stumpf и др. CellTissue Res. 238, стр.489 (1984); P. Milde и др.,Journ. Invest. Dermatol. 97, стр.230 (1991)]. Кроме того, данные исследований in vitro выделенных кератиноцитов волосяного фолликула подтверждают, что 1,25-(ОН)2-D3 оказывает ингибирующее пролиферацию и стимулирующее дифференцировку влияние. Клинические наблюдения, как известно,показали, что устойчивый к витамину D3 рахит часто сопровождается алопецией, которая проявляется в раннем детском возрасте. Экспериментальные данные подтверждают тот факт, что место связывания витамина D3 с ВДР при таких заболеваниях претерпевает изменения, т.е. является дефектным. [К. Kristjansson и др., Journ.Clin. Invest. 92, стр.12 (1993)]. Кератиноциты,выделенные из волосяных фолликул пациентов,не реагируют in vitro на добавление 1,25(ОН)2D3 [S. Arase и др., Journ. Dermatol. Science 2, стр.353 (1991)]. Таким образом, имеющиеся на сегодняшний день данные позволяют сделать вывод о решающей роли 1,25-(ОН)2-D3 при регуляции роста волос. В соответствии с этим указанные аналоги особенно пригодны для получения лекарственных средств, предназначенных для лечения заболеваний, сопровождающихся нарушением роста волос (андрогенетическая алопеция, круговидное облысение/общее выпадение волос, алопеция, обусловленная химиотерапией), или способных дополнительно стимулировать физиологический процесс роста волос, не вызывая при этом побочных эффектов кальцитриола (прежде всего гиперкальциемию). Старческий и климактерический остеопороз характеризуется, как известно, повышенным изменением костной ткани, приводящем в итоге к негативным последствиям. Атрофия костной ткани, прежде всего трабекулярных костей, является частой причиной переломов. Благодаря стимулирующему действию кальцитриола как на количество, так и на эффективность синтеза образующих новую костную ткань клеток (остеобластов), предлагаемые в изобретении субстанции могут применяться для терапии и профилактики старческого и климактерического остеопороза (ЕР 0634173 А 1), индуцированного стероидами остеопороза, а также для ускоренного заживления артропластики, не вызывая при этом побочных эффектов кальцитриола(прежде всего гиперкальциемию). При терапии различных форм остеопороза их можно успешно применять в сочетании с эстрадиолом или иными модификациями эстрогенов. Далее было установлено, что кальцитриол усиливает синтез "ростового вещества" нервных клеток (фактор роста нервов) [M.S. Saporito и др., Brain Res. 633, стр.189 (1994)]. Поэтому соединения по изобретению пригодны также для лечения дегенеративных заболеваний периферической и центральной нервной системы, та 004703 18 ких как болезнь Альцгеймера и боковой амиотрофический склероз. Кроме того, было установлено, что некоторые соединения общей формулы I неожиданным образом действуют в клетках HL 60 как антагонисты кальцитриола. Такие соединения могут применяться при терапии гиперкальциемии, например при гипервитаминозе D или интоксикации, вызванной кальцитриолом либо субстанциями, обладающими действием подобно кальцитриолу, или же при повышенном экстраренальном синтезе кальцитриола при гранулематозных заболеваниях (саркоидозе, туберкулезе). Сюда же относятся случаи паранеопластической гиперкальциемии (например, при остеолитических метастазах и опухолях с повышенным синтезом белка, родственного паратгормону), а также при паращитовидной гиперкальциемии. Еще одна возможность применения антагонистов кальцитриола состоит в контроле репродуктивной способности (фертильности). В репродуктивном тракте самок и самцов животных рецептор витамина D экспрессируется. Известно, что у самок и самцов животных, испытывающих недостаток витамина D, репродуктивная способность снижена. За счет кратковременной замены кальцитриола эту способность можно повысить, поэтому антагонисты кальцитриола способны воздействовать на женскую и мужскую фертильность. Поскольку кальцитриол при определенных условиях проявляет иммуносупрессорную эффективность, антагонисты рецептора кальцитриола могут применяться также в качестве иммуностимуляторов, например, при ослабленной сопротивляемости инфекции и при СПИДе. О кальцитриоле известно, что он может модулировать рост волос, поэтому антагонисты кальцитриола могут найти терапевтическое применение при нежелательном росте волос,например при гирсутизме. С давнего времени известна стимулирующая роль витамина D, которую он играет при образовании артериосклеротических бляшек. В таких пораженных сосудах обнаруживается повышенное содержание регулируемого кальцитриолом протеина остеопонтина, которому приписывают определенную роль при обыизвествлении сосудов [R. Eisenstein и др., Arch. Path. 77,стр.27 (1964); L.A. Fitzpatrick и др., Journ. Clin.Invest. 94, стр.1597 (1994)]. В соответствии с этим антагонисты кальцитриола пригодны для применения при терапии и профилактике всех форм проявления артериосклероза. В заключение следует назвать еще одну возможность применения антагонистов кальцитриола, обусловленную свойством последнего усиливать неспецифичные иммунореакции моноцитарных клеток, а именно, для терапии воспалительных заболеваний, прежде всего хронического характера, таких как ревматоид 19 ный артрит, болезнь Крона, язвенный колит, и гранулематозных заболеваний, таких как саркоидоз, а также других реакций организма на чужеродные тела. Для всех указанных случаев терапевтического применения соединений по изобретению справедливо то, что при всех названных картинах болезней они способны обеспечить требуемый терапевтический эффект, не вызывая при этом побочных действий кальцитриола (прежде всего гиперкальциемию). С учетом вышеизложенного настоящее изобретение относится также к фармацевтическим препаратам, содержащим в своем составе по меньшей мере одно соединение общей формулы I вместе с фармакологически приемлемыми носителями. Из предлагаемых соединений могут приготавливаться растворы в фармацевтически приемлемых растворителях или эмульсии, суспензии либо дисперсии в соответствующих фармацевтических растворителях либо носителях или же из них можно изготавливать пилюли, таблетки и капсулы, в которых содержатся известные твердые носители. Для местного применения из соединений предпочтительно приготавливать кремы или мази либо иные аналогичные лекарственные формы, пригодные для местного применения. Любая композиция такого типа может содержать в своем составе и другие фармацевтически приемлемые и нетоксичные вспомогательные вещества, например стабилизаторы, антиоксиданты, связующие, красители, эмульгаторы или вкусовые добавки. Соединения предпочтительно применять для инъекции, внутривенной инфузии в соответствующих стерильных растворах, вводить в виде аэрозолей через бронхи и легкие или пероральным путем в соответствующей дозировке через пищеварительный тракт или же в виде кремов, мазей, лосьонов либо соответствующих трансдермальных пластырей, предназначенных для местного применения, как это описано в заявке ЕР-А 0387077. Суточная доза составляет от 0,1 до 1000 мкг/пациент/день, предпочтительно от 1,0 до 500 мкг/пациент/день. Способ получения соединений по изобретению Производные витамина D общей формулыI получают согласно изобретению из соединения общей формулы II в которой Y'1 и Y'2 обозначают гидроксизащитные группы, а Y'3 представляет собой атом водорода, атом галогена или защищенную гидроксигруппу.X'1, Х'2 и Z' отличаются от X1, Х 2 и Z тем,что необязательно имеющиеся гидрокси- или кетогруппы могут быть представлены в защищенной форме. Под защитными группами подразумеваются предпочтительно алкильные, арильные, силильные группы или таковые со смешанным алкиларильным замещением, например триметилсилил (ТМС), триэтилсилил (ТЭС), трет-бутилдиметилсилил (ТБДМС), трет-бутилдифенилсилил (ТБДФС) либо триизопропилсилил(ТИПС), или иные обычно используемые в этих целях гидроксизащитные группы (триметилсилилэтоксиметил, метоксиметил, метоксиэтоксиметил, этоксиэтил, тетрагидрофуранил, тетрагидропиранил), а также ацетил, пропионил или пивалоил, в случае кетогрупп подразумеваются кетали (1,3-диоксоланы, 1,3-диоксаны, диалкоксикетали) (см. T.W. Greene, P.G.M. Wuts "Protective Groups in Organic Synthesis", 2-е издание,изд-во John WileySons, 1991). За счет одновременного либо последовательного отщепления гидрокси- и кетозащитных групп и необязательно за счет частичной,последовательной либо полной этерификации свободных гидроксильных групп с образованием сложного эфира соединение общей формулыII переводят в соединение общей формулы I. В случае силильных защитных групп или триметилсилилэтоксиметильной группы для их отщепления используют фторид тетрабутиламмония, фтористо-водородную кислоту или фтористо-водородную кислоту/пиридин либо кислые ионообменники. В случае групп простых эфиров (метоксиметиловый, метоксиэтоксиметиловый, этоксиэтиловый, тетрагидропираниловый эфир) и кеталей указанные группы отщепляют под каталитическим действием соответствующей кислоты, такой, например, как птолуолсульфокислота, п-толуолсульфонат пиридиния, уксусная кислота, соляная кислота,фосфорная кислота, или кислого ионообменника. В отличие от этого, сложноэфирные группы гидролизуют в основной среде, используют карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия в воде, этаноле, метаноле либо смесях этих растворителей. Этерификацию свободных гидроксигрупп при необходимости осуществляют по обычным методам с помощью хлорангидридов, бромангидридов или ангидридов карбоновой кислоты. Исходные соединения для общей формулыII, в которых Q обозначает по меньшей мере этиленовую группу, в зависимости в конечном счете от требуемого образца замещения в положении 20 получают исходя из различных начальных соединений. Для соединений с природной конфигурацией у С-20 в качестве исходного материала используют известный CD-фрагмент формулы III [H.H. Inhoffen, G. Quinkert, S. Соединение формулы VI через стадии описанного ниже пропаргилового спирта формулы VII и его перевода в спирт формулы VIII и окисления последнего до альдегида формулы IX открывает не известную до настоящего времени возможность получения описанного ниже кетона формулы ХIII, который является важным исходным материалом для синтеза производных витамина D согласно ДеЛюку [H.F. DeLuca и др., Tetrahedron Lett. 32, стр.7663 (1991); H.F.(1994)]. В соответствии с этим настоящее изобретение относится к способу получения соединений общей формулы I по п.1, где Q обозначает С 2-С 5 алкил. Согласно предложенному способу соединение формулы III Введением защитной группы получают соединение общей формулы IV введением защитной группы Y4 в соединение формулы IV где Y4 может обозначать, в частности, триалкилзамещенную силильную группу либо таковую со смешанным арилалкильным замещением или тетрапиранильную либо тетрафуранильную группу. В результате озонолитического расщепления двойной связи в боковой цепи и последующей восстановительной переработкой (например борогидридом натрия) получают соединение общей формулы V в которой Y4 обозначает триалкилсилильную защитную труппу, силильную защитную группу со смешанным арилалкильным замещением,тетрагидропиранильную или тетрагидрофуранильную защитную группу,путем оксидативного расщепления двойной связи переводят в соединение общей формулы V Свободную гидроксигруппу можно затем переводить в уходящую группу с образованием при этом соединения общей формулы VI в которой L может представлять собой любую уходящую группу, прежде всего атом галогена спирт за счет введения любой уходящей группыL переводят в соединение общей формулы VI в которой L обозначает любую уходящую группу, а Y4 обозначает триалкилсилильную защитную группу, силильную защитную группу со смешанным арилалкильным замещением, тетрагидропиранильную или тетрагидрофуранильную защитную группу, подвергают взаимодействию с алкинолом формулы в которой Y5 представляет собой тетрагидропиранильную группу или бензильную группу, а n обозначает 0, 1, 2, 3, депротонированным с помощью соответствующего основания, такого как гидрид натрия, гидрид калия, бутиллитий или амид натрия, с получением соединения общей формулы VIIb в которой Y5 имеет указанные выше значения,далее в любой последовательности гидрируют тройную связь и необязательно имеющуюся еще защитную группу Y5 обычным путем отщепляют с целью получить соединение общей формулы VIIIb свободную гидроксигруппу которого с помощью соответствующих окислителей, таких как хлорхромат пиридиния, дихромат пиридиния,окислением согласно Сверну или окислением согласно Коллинзу переводят затем в альдегид общей формулы IXb который взаимодействием с нуклеофилом Z',представляющим собой любую нуклеофильную форму радикалов из числа указанных для Z,переводом свободной гидроксигруппы в группуOCOR', где R' обозначает С 1-С 5 алкил, отщеплением защитной группы Y4 и окислением свободной гидроксигруппы переводят в кетон общей формулы XIIIb который затем обычным путем по реакции Виттига с использованием одного из известных фосфонатов формул XIV, XV или XVI после отщепления защитных групп переводят в соединение общей формулы I. Описан также способ получения кетона формулы XIII, осуществляемому через стадии промежуточных продуктов формул VII, VIII иIX. Этот путь синтеза можно реализовать по выбору для любой другой длины цепи за счет использования соответствующего защищенного алкинола. В качестве примера ниже описывается синтез соединения, в котором Q представляет собой этиленовую группу. Взаимодействием соединения общей формулы VI с защищенным пропаргиловым спиртом, предварительно депротонированным с помощью соответствующего основания (например гидрида натрия, гидрида калия, бутиллития или амида натрия), получают соединение общей формулы VII в которой Y5 должен представлять собой тетрагидропиранильную, бензильную либо иную аналогичную защитную группу. Путем гидрирования тройной связи и бензилового эфира или при необходимости последующим расщеплением тетрагидропиранилового эфира под действием кислоты (п-толуолсульфокислоты, п-толуолсульфоната пиридиния, уксусной кислоты,хлорида диметилалюминия, дихлорида метилалюминия и т.п.) получают соединение общей формулы VIII, свободную гидроксигруппу которого с помощью соответствующего окислителя (хлорхромата пиридиния, дихромата пиридиния, в условиях согласно Сверну, в условиях согласно Коллинзу) переводят в альдегид общей формулы IX Взаимодействием с произвольно подобранным нуклеофилом Nu, который можно вводить в реакцию с альдегидом, например, с использованием анионов необязательно содержащих атомы кислорода или серы органических радикалов, при определенных условиях замещенных, необязательно защищенных у восприимчивых функциональных групп, реактивов 25 Гриньяра или литиевых соединений, которые могут быть получены по известным из литературы методам, получают соединение общей формулы Ха в виде диастереомерных спиртов: При синтезе соединений по изобретению взаимодействием с нуклеофильной формой радикала Z, обозначаемого как Z', предпочтительно с металлированным ароматическим либо гетероароматическим соединением получают соединение общей формулы ХZ' может представлять собой любой из указанных для Z радикалов, предпочтительно фуран, тиофен, оксазол, тиазол, имидазол, пиразол, пиррол, бензофуран, бензотиофен, бензоксазол, бензотиазол, бензимидазол, индол или фенил, при этом кольца могут нести один или несколько заместителей в любых положениях. В качестве заместителей могут рассматриваться атомы фтора, хлора, брома либо иода, одна или несколько гидроксигрупп, одна или несколькоCOOR6-гpyпп, одна или несколько С 1 С 5 алкильных групп, которые в свою очередь могут быть замещены одним или несколькими атомами фтора, хлора, брома либо иода, C1 С 6 алкоксигруппами и/или СООR6-группами (R6 обозначает C1-С 6 алкильную группу, бензильную группу или фенильную группу). Ароматические соединения за счет обмена водород-литий, ортометаллирования, обмена галоген-литий (с использованием н-бутиллития, втор-бутиллития,трет-бутиллития, метиллития) или взаимодействием галогеносоединений с магнием либо цинком переводят в металлированные производные. Присоединение к CD-фрагменту осуществляют во всех случаях у положения металлирования,за исключением оксазольных колец, которые в результате перегруппировки и рециклирования проявляют активность по отношению к положению 4 [G. Boche и др., Chem. Веr./Receuil 130,стр.1213 (1997)]. Перевод свободной гидроксигруппы в ацетатные (R'=Me), пропионатные (R' означает Et) или пивалоатные (R' означает трет-Вu) группировки позволяет получать соединения общей формулы XI, которые за счет отщепления циклогексанольных защитных групп Y4 переводят в соединения общей формулы XII. Если Y4 обозначает силильную группу, то отщеплять эту группу можно, например, с использованием 26 фторида тетрабутиламмония, фтористого водорода, комплекса фтористый водород/пиридин,если же Y4 обозначает тетрагидропиранильную или тетрагидрофуранильную группу, то такую группу можно отщеплять в кислых условиях. Путем последующего окисления свободной гидроксигруппы окислителем (хлорхроматом пиридиния, дихроматом пиридиния, в условиях согласно Сверну или в условиях согласно Коллинзу) получают соединение общей формулы Взаимодействием кетона общей формулыXIII с одним из известных фосфиноксидов формул XIV, XV или XVI [XIV: M.R. Uskokovic и др., Tetrahedron Lett. 33, стр.7701 (1991), A. где Y'1 и Y'2 представляют собой алкильные синильные группы или таковые со смешанным арилалкильным замещением (предпочтительно трет-бутилдиметилсилильные, трет-бутилдифенилсилильные, триметилсилильные, триэтилсилильные или триизопропилсилильные группы),а Y'3 обозначает соответствующую силилоксигруппировку, получают витамин D-системы общих формул XVII, XVIII и XIX Соединения общих формул XVII, XVIII иXIX представляют собой особые случаи соединений общей формулы II, и их переводят описанным выше путем в соединения общей формулы I. Прежде всего гидроксигруппу можно высвобождать в положении С-24 и с помощью окислителя (например хлорхромата пиридиния,дихромата пиридиния, реагента Коллинза, в условиях согласно Сверну или диоксида марганца) переводить в соответствующий кетон,представляющий собой также особый случай соединения общей формулы II. С-24-спирты,соответственно С-24-кетон при соблюдении известных условий можно переводить в галоге 27 ниды либо дигалогениды. Кроме того, существует возможность удалять гидрокси-, кето- или галофрагменты путем восстановления. Все операции с функциональными группами в боковой цепи могут проводиться и на более ранних стадиях. Для получения соединений общей формулы II с измененным образцом замещения у С-20 спирт общей формулы V соответствующим окислителем (например хлорхроматом пиридиния, дихроматом пиридиния, реагентом Коллинза, в условиях согласно Сверну, в условиях согласно Дессу-Мартину) окисляют до альдегида общей формулы XX. Этот альдегид по описанной в DE 4220757, 20-эпи: M.J. Calverley,Bioorg. Med. Chem. Lett. 3, стр.1845 (1993) технологии можно переводить в соединение общей формулы XXI, в которой R3 и R4 имеют указанные выше значения. Затем это соединение с помощью восстановителя (например борогидрида натрия, алюмогидрида лития или диизобутилалюмогидрида) восстанавливают до спирта общей формулы XXII, который далее подвергают описанной выше обменной реакции. При получении соединений общей формулы II, где Q представляет собой метиленовую группу, исходят из известного альдегида витамина D формулы XXIII, который, как описано выше (DE 19619036), может быть модифицирован в положении 20. В качестве примера рассматривается последующее превращение альдегида с природной конфигурацией у С-20. С помощью восстановителя (например борогидрида натрия, алюмогидрида лития или диизобутилалюмогидрида) получают спирт общей формулы XXIV, который описанным выше образом переводят в уходящую группу, получая в результате соединение общей формулы XXV Реакцией этого соединения общей формулы XXV с депротонированным с помощью соответствующего основания (например, диизопропиламида лития, гексаметилдисилазида натрия, гексаметилдисилазида лития или гексаметилдисилазида калия) ацетонитрилом получают соединение общей формулы XXVI, которое путем восстановления с использованием соответствующего восстановителя (например диизобутилалюмогидрида) переводят в соединение общей формулы XXVII Взаимодействием этого соединения с нуклеофилом карбоциклического, гетероциклического, предпочтительно металлированного ароматического либо гетероароматического соединения указанным выше образом получают соединения общей формулы XXVIII которые следует рассматривать как особый случай соединений общей формулы II и которые описанным выше путем переводят в соединения общей формулы I. Прежде всего гидроксигруппу в положении С-24 можно переводить с помощью окислителя (например хлорхромата пиридиния, дихромата пиридиния, реагента Коллинза, в условиях согласно Сверну или диоксида марганца) в соответствующий кетон, представляющий собой особый случай соединения общей формулы II. С-24-спирты, соответственно С-24-кетон при соблюдении известных условий можно переводить в галогениды либо дигалогениды. Кроме того, существует возможность 29 удалять гидрокси-, кето- или галофрагменты путем востановления. Если предусматривается генерирование соединений общей формулы I, в которой Y3 представляет собой атом галогена (например,фтора, хлора либо брома), то А-звено общей формулы XXX, где Y3 имеет вышеуказанное значение, необходимо синтезировать из известного из литературы производного циклогексана формулы XXIX [J.-L. Montchamp, J.W. Frost,Journ. Am. Chem. Soc. 113, стр.6296 (1991)] по реакции Ханессиана (Hanessian). Благодаря введению защитной группы для свободной гидроксигруппы получают соединение общей формулы XXXI, которое переводят сначала в кислой среде обычным образом в диол формулыXXXII, а последующим расщеплением диола (с использованием периодата натрия или периодной кислоты) - в кетон формулы XXXIII (значения Y'1 и Y3 уже указывались выше). Для синтеза системы витамина D при Y3,обозначающем галоген, предлагается новый путь его осуществления, который вместе с тем приемлем и при всех возможных заместителяхY3 (в том числе и при Y3=атом водорода), равно как и в случае иных образцов замещения у Акольца (например, вместо OY1 в положении 1 галоген, (СН 2)n-ОН или (CH2)n-O(CO)R5, где R5 обозначает алифатический С 1-С 12 алкильный радикал, необязательно прерванный 1-2 атомами кислорода, 1-2 атомами серы и/или 1-2 NHгруппами и/или необязательно замещенный 1-2 гидроксигруппами, 1-2 аминогруппами, 1-2 SHгруппами, 1-2 СООН-группами и/или 1-2 фенильными группами, где n=0-4, или обозначает ароматический радикал с 5-12 С-атомами), а также при любых боковых цепях в положении 17 с необязательно представленными в защищенной форме гидроксигруппами и/или кетогруппами. Такие реакции описываются ниже на примере кетона общей формулы XIII, вместе с тем они применимы и для других вариантов боковых цепей. Олефинированием по Петерсону (взаимодействие с эфиром триметилсилилуксусной кислоты в присутствии соответствующего основа 004703XIII получают соединение общей формулыXXXIV, сложноэфирную группу которой восстановлением с помощью соответствующего восстановителя (например диизобутилалюмогидрида или алюмогидрида лития) переводят в спирт общей формулы XXXV. Трансформацию гидроксигруппы в производное дифенилфосфиноксида общей формулы XXXVI осуществляют в стандартных условиях через аллилгалогенид(хлорид, бромид) либо через промежуточный тозилат или мезилат. В результате связывания с кетоном общей формулы XXXIII получают систему витамина D общей формулы II с указанными выше значениями Y3. Перевод в соединение общей формулы I осуществляют описанным ранее путем за счет отщепления защитных групп. В соответствии с этим еще одним объектом настоящего изобретения является также способ получения новых производных витаминаD общей формулы I, согласно которому кетон общей формулы XIIIc в которой Е представляет собой боковую цепь в положении 17 соединения формулы I по п.1, а необязательно имеющиеся кетогруппы и/или гидроксигруппы представлены в защищенной форме, взаимодействием с эфиром триметилсилилуксусной кислоты в присутствии соответствующего основания, например нбутиллития или алюмогидрида лития, либо с соответствующим реагентом Виттига в апротонном растворителе, таком как толуол, тетрагидрофуран, диэтиловый эфир или диоксан, переводят в соединение общей формулы XXXIVc в которой Е имеет вышеуказанные значения, Y6 обозначает C1-С 6 алкильную группу, бензильную группу или фенильную группу, сложноэфирную группу по реакции с восстановителем, таким как диизобутилалюмогидрид, алюмогидрид лития, диборан или красный алюминий (RedAl), в гексане, толуоле, тетрагидрофуране, диэтило 31 вом эфире или диоксане, переводят в аллиловый спирт общей формулы XXXVc где Е имеет вышеуказанные значения,этот аллиловый спирт известным образом переводят в соединение общей формулы в которой Е имеет вышеуказанные значения, a L обозначает любую уходящую группу (галоген,мезилат, тозилат, трифлат, нонафлат), указанное соединение выделяют или при необходимости образуют in situ и далее сразу же превращают в реагент Виттига общей формулы XXXVIc в которой Е имеет вышеуказанные значения, a G обозначает C1-С 10 алкильную группу, C1 С 10 алкоксигруппу, фенильную группу или феноксигруппу, затем указанный реагент Виттига при соблюдении известных условий подвергают взаимодействию с кетоном общей формулы ХХХIIIс в которой Y'3 обозначает атом водорода, атом галогена или защищенную гидроксигруппу,группу -O(CO)R5 либо OR5-гpyппy, а Y5, R7 и R8 имеют значения, указанные в п.1 для Y1, R1 и R2 соответственно, с получением целевого продукта в котором при необходимости удаляют защитные группы. Кроме того, описан способ получения производных витамина D общей формулы IIа в которой Е обозначает любую боковую цепь,R7 и R8 каждый независимо один от другого обозначает атом водорода, метильную группу или оба вместе образуют экзоциклическую метиленовую группу либо циклопропильное кольцо,Y2 обозначает атом водорода или группуR5 представляет собой алифатический C1 С 12 алкильный радикал, необязательно прерванный 1-2 атомами кислорода, 1-2 атомами серы и/или 1-2 NH-группами и/или необязательно замещенный 1-2 гидроксигруппами, 1-2 аминогруппами, 1-2 SH-группами, 1-2 СООНгруппами и/или 1-2 фенильными группами, или представляет собой ароматический радикал с 512 С-атомами,Y5 обозначает атом фтора, (СН 2)n-ОНгруппу или (СН 2)n-O(СО)R5-группу, где n обозначает 0-4,и необязательно имеющиеся гидроксигруппы представлены при необходимости в защищенной форме. Указанный способ отличается тем, что кетон общей формулы ХIIIс в которой Е обозначает любую боковую цепь, а необязательно имеющиеся кетогруппы и/или гидроксигруппы представлены в защищенной форме, взаимодействием с эфиром триметилсилилуксусной кислоты в присутствии соответствующего основания, например н-бутиллития или алюмогидрида лития, либо с соответствующим реагентом Виттига в апротонном растворителе, таком как толуол, тетрагидрофуран,диэтиловый эфир или диоксан, переводят в соединение общей формулы XXXIVc в которой Y6 обозначает C1-С 6 алкильную группу, бензильную группу или фенильную группу,сложноэфирную группу по реакции с восстановителем, таким как диизобутилалюмогидрид,алюмогидрид лития, диборан или красный алюминий (RedAl), в гексане, толуоле, тетрагидрофуране, диэтиловом эфире или диоксане, переводят в аллиловый спирт общей формулы этот аллиловый спирт известным образом переводят в соединение общей формулы XXXVd в которой L обозначает любую уходящую группу (галоген, мезилат, тозилат, трифлат, нонафлат), указанное соединение выделяют или при необходимости образуют in situ и далее сразу же превращают в реагент Виттига общей формулы XXXVIc в которой G обозначает C1-С 10 алкильную группу, C1-С 10 алкоксигруппу, фенильную группу или феноксигруппу, затем указанный реагент Виттига при соблюдении известных условий подвергают взаимодействию с кетоном общей формулы XXXIIIc в которой Y'3 обозначает атом водорода, атом галогена или защищенную гидроксигруппу,группу -O(CO)R5 либо OR5-гpyппy, а Y5, R7 и R8 имеют указанные выше значения, и при необходимости защитные группы отщепляют. Соединения общей формулы IIа можно переводить, как описано выше, за счет отщепления защитных групп в требуемые производные витамина D. Предлагаемый в изобретении способ особенно пригоден для получения производных витамина D, в которых Y3 обозначает атом галогена, однако, способ не ограничен только этой возможностью применения. Индекс "а", используемый в формулах (например XXXIVa), служит для пояснения того,что радикалы в принципе имеют те же значения,что и в формулах без индекса "а", с тем, однако,отличием, что восприимчивые к реакции группы представлены в защищенной форме. В другом, альтернативном, варианте синтеза соединений общей формулы II, где X'1 и Х'2 обозначают атомы водорода, a Q представляет собой этиленовую группу, исходят из спирта общей формулы VIII, гидроксигруппу которого переводят в соответствующую уходящую группу (например в хлорид, бромид, иодид, тозилат или мезилат) и подвергают взаимодействию с металлированными ароматическими либо гетероароматическими соединениями, получая в результате соединения общей формулы XXXVII последующее превращение которых может осуществляться аналогично описанным выше соединениям. Ниже изобретение более подробно поясняется на примерах. Примеры Синтез исходных соединений (СD-альдегид) 1. [1R-[1[1R,4S-(Е)],3,4,7 а-Oктагидро-7 а-метил-4-[(триэтилсилил)окси]-1-(1,4,5 триметил-2-гексенил)-1 Н-инден 2. 12,95 г [1R-[1[1R,4S-(Е)],3,4,7 аоктагидро-7 а-метил-1-(1,4,5-триметил-2-гексенил)-1 Н-инден-4-ола 1 помещают в 220 мл диметилформамида [Н.Н. Inhoffen и др., Chem. 35 перемешивают при комнатной температуре. Затем прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, органическую фазу промывают раствором хлорида натрия и сушат над сульфатом натрия. После удаления растворителя остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 14,6 г указанного в заголовке соединения 2 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,58 част./млн (q, 6H); 0,82 (d, 3 Н); 0,84 (d, 3H); 0,93 (t, 9H); 0,96 (d,3 Н); 0,97 (s, 3 Н); 0,98 (d, 3 Н); 4,05 (m, 1H); 5,19(m, 2H). 2. [1R-[1(S),3,4,7 а-2-[Oктагидро 7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1 ил]-1-пропанол 3. 14,6 г силилового эфира растворяют в 300 мл дихлорметана и 150 мл метанола, добавляют 14,8 мл пиридина и охлаждают до -78 С. При этой температуре пропускают озон, генерируемый озонатором, до тех пор, пока цвет раствора не станет голубым. Избыточное количество озона удаляют с помощью потока кислорода, а затем добавляют 1,61 г боронитрида натрия. После этого реакционную смесь нагревают до комнатной температуры и затем сливают в дихлорметан. Органическую фазу промывают раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают путем хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 10,1 г указанного в заголовке соединения 3 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,57 част./млн (q, 6H); 0,92 (s, 3 Н); 0,96 (t, 9H); 1,02 (d, 3 Н); 3,38 (dd,1H); 3,63 (d, 1H); 4,05 (m, 1H). 3. [1R-[1(S),3,4,7 а-2-[октагидро 7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1 ил]пропил-(4-метилбензенсульфонат) 4. 9,1 г спирта 3 растворяют в 135 мл пиридина, охлаждают до 0 С, а затем добавляют 7,8 г толуолсульфонилхлорида. Реакционную смесь перемешивают в течение ночи при 0 С, после чего осторожно прерывают реакцию с помощью раствора гидрокарбоната натрия. Далее экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель под вакуумом. Остаток очищают посредством хроматографии на силикагеле с использoванием смеси уксусный эфир/гексан, получая при этом 13,3 г указанного в заголовке соединения 4 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,56 част./млн (q, 6H); 0,87 (s, 3 Н); 0,96 (t, 9H); 0,97 (d, 3 Н); 2,47 (s,3 Н); 3,80 (dd, 1H); 3,97 (d, 1H); 4,01 (m, 1H); 7,35 36 метил-3-пентинил-4-[(триэтилсилил)окси]-1 Нинден 5. 15,4 г пропаргил-ТГП-эфира помещают в 350 мл диоксана и при 10-15 С осторожно по каплям добавляют 43,8 мл н-бутиллития (2,5 М в гексане). Через 1 ч по каплям добавляют 13,3 г тозилата 4 в 100 мл диоксана и в течение 48 ч нагревают до кипения. Затем прекращают реакцию с помощью раствора хлорида натрия и сушат над сульфатом натрия. После удаления растворителя остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 12,1 г указанного в заголовке соединения 5 в виде бесцветного масла. 1 Н-ЯМР (CDCI3): =0,57 част./млн (q, 6H); 0,92 (s, 3 Н); 0,96 (t, 9H); 1,06 (d, 3 Н); 3,56 (m,1H); 3,88 (m, 1H); 4,04 (m, 1H); 4,29 (d, 2H); 4,83(m, 1H). 5. [1R-[1(R),3,4,7 а-Октагидро-7 аметил-1-5-[(тетрагидро-2 Н-пиран-2-ил)окси]-1 метилпентил-4-[(триэтилсилил)окси]-1 Н-инден 6. 12,6 г алкина 5 растворяют в 250 мл уксусного эфира, добавляют 2,2 г палладия на активированном угле (10%) и 5,06 г гидрокарбоната натрия и подвергают гидрированию в гидраторе при нормальном давлении. Реакцию проводят до тех пор, пока не прекратится поглощение водорода, после чего смесь фильтруют через броунмиллерит и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 9,9 г указанного в заголовке соединения 6 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,56 част./млн (q, 6H); 0,91 (s, 3 Н); 0,95 (t, 9H); 0,97 (d, 3 Н); 3,38 (m,1H); 3,51 (m, 1H); 3,70 (m, 1H); 3,88 (m, 1H); 4,02 (d, 2H); 4,59 (m, 1H). 6. [1R-[1(R),3,4,7 а-5-[октагидро 7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1 ил]-1-гексанол 7. 11,4 г ТГП-эфира 6 помещают в 500 мл дихлорметана и по каплям добавляют 50 мл раствора диметилалюмохлорида. Через 2 ч при комнатной температуре прекращают реакцию с помощью смеси изопропанол/вода (15:85), по каплям добавляют толуол и перемешивают в течение ночи. Затем фильтруют через броунмиллерит с помощью вакуум-фильтра и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 6,2 г указанного в заголовке соединения 7 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,56 част./млн (q, 6H); 0,90 (s, 3 Н); 0,95 (t, 9H); 0,96 (d, 3 Н); 3,64 (m,2H); 4,02 (m, 2H). 37 7. [1R-[1(R),3,4,7 а-5-[октагидро 7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1 ил]гексанaль 8. 8,0 г спирта 7 растворяют в 300 мл дихлорметана, после чего добавляют 6,5 г пиридинийхлорхромата. Далее смесь перемешивают в течение 2 ч при комнатной температуре. Затем добавляют диэтиловый эфир, фильтруют через броунмиллерит и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 6,2 г указанного в заголовке соединения 8 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,57 част./млн (q, 6H); 0,91 (s, 3 Н); 0,95 (t, 9H); 0,96 (d, 3 Н); 4,02 (m,1H); 9,75 (t, 1H). Пример 1. (7 Е)-(1R,3R,24 аR)-24 а-(оксазол 4-ил)-24-гомо-19-нор-9,10-секохола-5,7-диен 1,3,24 а-триол 16 а и (7 Е)-(1R,3R,24 аS)-24 а(оксазол-4-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-1,3,24 а-триол 16b. 8. 939 мг оксазола помещают в 20 мг тетрагидрофурана и охлаждают до -78 С. После этого по каплям добавляют 5,44 мл нбутиллития (2,5 М в гексане), перемешивают в течение 20 мин, а затем добавляют 500 мг альдегида 8 в 5 мл тетрагидрофурана. Реакционную смесь далее перемешивают в течение ночи, при этом смесь нагревается до комнатной температуры, затем прекращают реакцию с помощью раствора хлорида натрия. После этого экстрагируют уксусным эфиром, органическую фазу промывают раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 234 мг [1R[1(R),3,4,7 а[4-[октагидро-7 а-метил 4-[(триэтилсилил)окси]-1 Н-инден-1 ил]пентил]оксазол-4-метанола 9 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,57 част./млн (q, 6H); 0,86 (d, 3H); 0,92 (s, 3H); 0,99 (t, 9H); 4,02 (m,1H); 4,70 (m, 1H); 7,60 (s, 1H); 7,90 (s, 1H). 9. 361 мг спирта 9 помещают в 8 мл дихлорметана, добавляют 0,17 мл триэтиламина,0,12 мл ангидрида уксусной кислоты и диметиламинопиридин на кончике шпателя и в течение ночи перемешивают при комнатной температуре. Затем добавляют раствор хлорида натрия,экстрагируют уксусным эфиром, органическую фазу промывают раствором гидрокарбоната натрия, а также раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 296 г [1R[1(R),3,4,7 а-5-[октагидро-7 а-метил-4[(триэтилсилил)окси]-1 Н-инден-1-ил]-1 004703(s, 1H). 10. 281 мг ацетата 10 помещают в 10 мл тетрагидрофурана, добавляют 1 мл комплекса фтороводород-пиридин и в течение ночи перемешивают при комнатной температуре. Затем прекращают реакцию с помощью раствора гидрокарбоната натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан,получая при этом 193 мг [1R-[1(R),3,4,7a-1-[5-(ацетилокси)-1-метил-5-(оксазол 4-ил)пентил]октагидро-7 а-метил-1 Н-инден-4 ола 11 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,88/0,89 част./млн (d,3 Н); 0,91 (s, 3 Н); 2,09 (s, 3H); 4,07 (m, 1H); 5,80(t, 1H); 7,61 (s, 1H); 7,85 (s, 1H). 11. 193 мг спирта 11 помещают в 8 мл дихлорметана, добавляют 160 мг пиридинийхлорхромата и перемешивают в течение 1 ч при комнатной температуре. Затем смесь разбавляют простым диэтиловым эфиром, фильтруют через броунмиллерит и удаляют растворитель. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 160 мг [1R[1(R),3,4,7 а-1-[5-(ацетилокси)-1-метил-5-(оксазол-4-ил)пентил]октагидро-7 а-метил-4 Н-инден-4-она 12 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,61 част./млн (s, 3 Н); 0,91/0,92 (d, 3 Н); 2,10 (s, 3 Н); 4,07 (m, 1H); 5,80-78 С . Далее при этой температуре добавляют 0,39 мл раствора н-бутиллития (2,5 М в гексане) и в течение 10 мин перемешивают при -30 С. После этого по каплям добавляют 146 мг кетона 12 в 4 мл тетрагидрофурана и перемешивают в течение 1 ч. Затем прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 180 мг (7 Е)(1R,3R)-24 а-(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(оксазол-4-ил) 39 24 а-гомо-19-нор-9,10-секохола-5,7-диена 14 в виде бесцветного пенного вещества. 1 Н-ЯМР (CDCl3): =0,06 част./млн (s, 12H); 0,52 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 2,09 (s,3 Н); 4,08 (m, 2H); 5,80 (t, 1H); 5,81 (d, 1H); 6,18(d, 1H); 7,61 (s, 1H); 7,87 (s, 1H). 13. 180 мг ацетата 14 помещают в 8 мл метанола, добавляют 140 мг карбоната калия и в течение 1 ч перемешивают при комнатной температуре. После этого смешивают с раствором хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 144 мг (7 Е)-(1R,3R)-1,3 бис(1,1-диметилэтил)диметилсилил]окси]-24 а(оксазол-4-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-24 а-ола 15 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,06 част./млн (s,12H); 0,52 (s, 3H); 0,84 (s, 18H); 0,91/0,92 (d,3H); 4,07 (m, 2 Н); 4,62 (m, 1H); 5,80 (d, 1H); 6,14(d, 1H); 7,55 (s, 1H); 7,82 (s, 1H). 14. 144 мг спирта 15 помещают в 10 мл тетрагидрофурана, добавляют 467 мг фторида тетрабутиламмония ( гидрат) и в течение 2 ч перемешивают при комнатной температуре. Затем добавляют раствор гидрокарбоната натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусная кислота/гексан, а затем разделяют диастереомеры посредством ЖХВР (относительно С-24 а), получая при этом 25 мг указанного в заголовке соединения 16 а и 34 мг указанного в заголовке соединения 16b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 16 а: = 0,52 част./млн (s, 3H); 0,89 (d, 3H); 3,98 (m, 1H); 4,03 (m, 1H); 4,62 (m, 1H); 5,82 (d,1H); 6,28 (d, 1H); 7,57 (s, 1H); 7,84 (s, 1H). 16b: =0,52 част./млн (s, 3H); 0,90 (d, 3H); 3,98 (m, 1H); 4,03 (m, 1H); 4,62 (m, 1H); 5,82 (d,1H); 6,28 (d, 1H); 7,57 (s, 1H); 7,83 (s, 1H). Пример 2. (5Z,7 Е)-(1S,3R,24 аR)-24 а-(оксазол-4-ил)-24 а-гомо-9,10-секохола-5,7,10(19)триен-1,3,24 а-триол 20 а и (5Z,7 Е)-(1S,3R,24 аS)24 а-(оксазол-4-ил)-24 а-гомо-9,10-секохола 5,7,10(19)-триен-1,3,24 а-триол 20b. 15. 257 мг 2-3S-(1Z,3,5)]-3,5-бис(1,1 диметилэтил)диметилсилил]окси]-2-метиленциклогексилиден]дифенилфосфиноксида 17(1992)] помещают в 6 мл тетрагидрофурана и охлаждают до -78 С. При этой температуре добавляют 0,21 мл раствора н-бутиллития (2,5 М в гексане) и при -30 С перемешивают в течение 40 10 мин. После этого по каплям добавляют 80 мг кетона 12 в 4 мл тетрагидрофурана и перемешивают в течение 2 ч. Затем прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 140 мг (5Z,7 Е)(1S,3R)-24 а-(ацетилокси)-1,3-бис(1,1-диметилтил)диметилсилил]окси]-24 а-(оксазол-4-ил)-24 агомо-9,10-секохола-5,7,10(19)триена 18 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,06 част./млн (s, 12H); 0,52 (s, 3 Н); 0,90 (s, 18H); 0,90 (d, 3 Н); 2,09 (s,3 Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88 (s, 1H); 5,19(s, 1H); 5,81 (t, 1H); 6,02 (d, 1H); 6,23 (d, 1H); 7,62 (s, 1H); 7,87 (s, 1H). 16. 140 мг ацетата 18 подвергают переработке аналогично 13 и получают 120 мг (5Z,7 Е)(1S,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(оксазол-4-ил)-24 а-гомо-9,10 секохола-5,7,10(19)-триен-24 а-ола 19 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,52 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 4,19 (m,1H); 4,38 (m, 1H); 4,87 (s, 1H); 5,20 (s, 1H); 5,81(t, 1H); 6,02 (d, 1H); 6,25 (d, 1H); 7,60 (s, 1H); 7,88 (s, 1H). 17. 120 мг спирта 19 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24) посредством ЖХВР получают 14 мг указанного в заголовке соединения 20 а и 18 мг указанного в заголовке соединения 20b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 20 а: =0,53 част./млн (s, 3 Н); 0,91 (d, 3 Н); 4,15 (m, 1H); 4,36 (m, 1H); 4,63 (m, 1H); 4,94 (s,1H); 5,26 (s, 1H); 6,01 (d, 1H); 6,35 (d, 1H); 7,56(s, 1H); 7,85 (s, 1H). Пример 3. (7 Е)-(1R,3R,24 аR)-24 а-(тиазол 2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен 1,3,24 а-триол 27 а и (7 Е)-(1R,3R,24 аS)-24 а(тиазол-2-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-1,3,24 а-триол 27b. 18. 3,1 мл 2-бромтиазола помещают в 40 мл тетрагидрофурана и при -78 С добавляют 13,8 мл раствора н-бутиллития (2,5 М в гексане). Через 30 мин при этой температуре по каплям добавляют 2,52 г альдегида 8 в 10 мл тетрагидрофурана и перемешивают в течение 1 ч. Затем прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, органическую фазу промывают раствором хлорида натрия и сушат над сульфатом на 41 трия. Растворитель удаляют, а остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан,получая при этом 2,6 г [1R-[1(1R),3,4,7a[4-[октагидро-7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1-ил]пентил]тиазол 2-метанола 21 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,57 част./млн (q, 6H); 0,88 (d, 3 Н); 0,91 (s, 3H); 0,97 (t, 9 Н); 4,02 (m,1H); 5,01 (m, 1H); 7,30 (d, 1H); 7,71 (d, 1H). 19. 948 мг спирта 21 подвергают переработке аналогично 9 и получают при этом 824 мг(s, 3 Н); 4,02 (m, 1H); 6,10 (t, 1H); 7,31 (d, 1H); 7,78 (d, 1H). 20. 824 мг ацетата 22 подвергают переработке аналогично 10 и получают при этом 583 мг(t, 1H); 7,31 (d, 1H); 7,78 (d, 1H). 21. 583 мг спирта 23 подвергают переработке аналогично 11 и получают при этом 514 мг(2,5 М в гексане), подвергают взаимодействию с 460 мг кетона 24 аналогично 12 и получают при этом 672 мг (7 Е)-(1R,3R)-24 а-(ацетилокси)-1,3 бис(1,1-диметилэтил)диметилсилил]окси]-24 а(тиазол-2-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диена 25 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,89 (s, 18H); 0,93 (d, 3 Н); 2,18 (s,3 Н); 4,09 (m, 2H); 5,82 (d, 1H); 6,10 (t, 1H); 6,18(d, 1H); 7,31 (d, 1H); 7,78 (d, 1H). 23. 672 мг ацетата 25 подвергают взаимодействию аналогично 13 и получают при этом 526 мг (7 Е)-(1R,3R)-1,3-бис(1,1-диметилэтил) диметилсилил]окси]-24 а-(тиазол-2-ил)-24 агомо-19-нор-9,10-секохола-5,7-диен-24 а-ола 26 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,04 част./млн (s,12H); 0,51 (s, 3 Н); 0,87 (s, 18H); 0,92 (d, 3 Н); 4,07 42 24. 426 мг спирта 26 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 134 мг указанного в заголовке соединения 27 а и 149 мг указанного в заголовке соединения 27b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 27 а: =0,50 част./млн (s, 3 Н); 0,88 (d, 3 Н); 3,93 (m, 1H); 4,01 (m, 1H); 4,90 (t, 1H); 5,83 (d,1H); 6,23 (d, 1H); 7,29 (d, 1H); 7,67 (d, 1H). 27b: =0,50 част./млн (s, 3 Н); 0,90 (d, 3 Н); 3,93 (m, 1H); 4,01 (m, 1H); 4,90 (t, 1H); 5,83 (d,1H); 6,23 (d, 1H); 7,29 (d, 1H); 7,67 (d, 1H). Пример 4. (7E)-(1R,3R)-1,3-дигидрокси 24 а-(тиазол-2-ил)-24-а-гомо-19-нор-9,10 секохола-5,7-диен-24 а-он 29. 25. 100 мг спирта 26 помещают в 6 мл дихлорметана и добавляют 378 мг диоксида марганца. Реакционную смесь перемешивают при комнатной температуре, затем фильтруют через броунмиллерит, удаляют растворитель и остаток очищают посредством хроматографии на силикагеле, получая при этом 78 мг (7E)(1R,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(тиазол-2-ил)-24 а-гомо-19-нор 9,10-секохола-5,7-диен-24 а-она 28 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,04 част./млн (s,12H); 0,51 (s, 3 Н); 0,84 (s, 18H); 0,93 (d, 3 Н); 4,05(m, 2 Н); 5,80 (d, 1H); 6,15 (d, 1H); 7,66 (d, 1H); 7,97 (d, 1H). 26. 78 мг кетона 28 помещают в 7 мл смеси метанол/дихлорметан (9:1), добавляют 780 мг активированного ионита Dowex и перемешивают в течение 1 ч при комнатной температуре. Затем фильтруют через броунмиллерит, тщательно промывают дихлометаном, удаляют растворитель и очищают остаток посредством хроматографии на силикагеле, получая при этом 43 мг указанного в заголовке соединения 29 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СD2 Сl2): =0,51 част./млн (s, 3 Н); 0,97 (d, 3 Н); 3,97 (m, 1H); 4,06 (m, 1H); 5,81 (d,1H); 6,27 (d, 1H); 7,68 (d, 1H); 7,97 (d, 1H). Пример 5.(19)-триен-1,3,24 а-триол 32b. 27. 309 мг фосфиноксида 17, депротонированного с помощью 0,25 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию со 100 мг кетона 24 аналогично 15 и получают при этом 170 мг (5Z,7 Е)-(1S,3R)24 а-(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(тиазол-2-ил)-24 а-гомо 9,10-секохола-5,7,10(19)-триена 30 в виде бесцветного пенистого вещества.(s, 1H); 6,01 (d, 1H); 6,10 (t, 1H); 6,23 (d, 1H); 7,31 (d, 1H); 7,83 (d, 1H). 28. 170 мг ацетата 30 подвергают взаимодействию аналогично 13 и получают при этом 149 мг (5Z,7 Е)-(1S,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-гомо-9,10-секохола-5,7,10(19)-триен-24 а-ола 31 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,51 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 2,18 (s,3 Н); 4,18 (m, 1H); 4,38 (m, 1H); 4,87 (s, 1H); 5,02(s, 1H); 5,19 (s, 1H); 6,01 (d, 1H); 6,23 (d, 1H); 7,31 (d, 1H); 7,74 (d, 1H). 29. 101 мг спирта 31 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24) посредством ЖХВР получают 24 мг указанного в заголовке соединения 32 а и 29 мг указанного в заголовке соединения 32b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 32 а: =0,50 част./млн (s, 3 Н); 0,90 (d, 3 Н); 4,11 (m, 1H); 4,33 (m, 1H); 4,90 (t, 1H); 4,92 (s,1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,32 (d, 1H); 7,29(19)-триен-24 а-он 34. 30. 149 мг спирта 31 подвергают переработке аналогично 25 и получают при этом 127 мг (5Z,7 Е)-(1S,3R)-1,3-бис(1,1-диметилэтил) диметилсилил]окси]-24 а-(тиазол-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)-триен-24 а-она 33 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,90 (s, 18H); 0,97 (d, 3 Н); 4,19 (m,1H); 4,38 (m, 1H); 4,88 (s, 1H); 5,19 (s, 1H); 6,02(d, 1H); 6,24 (d, 1H); 7,68 (d, 1H); 8,00 (d, 1H). 31. 21 мг кетона 33 подвергают переработке аналогично 8 и получают при этом 8 мг указанного в заголовке соединения 34 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,51 част./млн (s, 3 Н); 0,94 (d, 3 Н); 4,17 (m, 1H); 4,34 (m, 1H); 4,90 (s,1H); 5,26 (s, 1H); 6,00 (d, 1H); 6,33 (d, 1H); 7,66 44 не). Через 30 мин при этой температуре по каплям добавляют 1,06 г альдегида 8 в 5 мл тетрагидрофурана и перемешивают в течение 1 ч. Затем прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия и сушат над сульфатом натрия. После этого удаляют растворитель, а остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан, получая при этом 601 мг [1R[1(R),3,4,7 а[4-[октагидро-7 а-метил 4-[(триэтилсилил)окси]-1 Н-инден-1-ил]пентил]4-метилтиазол-2-метанола 35 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,56 част./млн (q, 6H); 0,88 (d, 3 Н); 0,90 (s, 3H); 0,97 (t, 9H); 2,41 (s,3 Н); 4,02 (m, 1H); 4,94 (m, 1H); 6,82 (s, 1H). 33. 601 мг спирта 35 подвергают переработке аналогично 9 и получают при этом 589 мг(s, 3 Н); 2,45 (s, 3 Н); 4,02 (m, 1H); 6,02 (t, 1H); 6,81 (s, 1H). 34. 589 мг ацетата 36 подвергают переработке аналогично 10 и получают при этом 366 мг(m, 1H); 6,03 (t, 1H); 6,81 (s, 1H). 35. 360 мг спирта 37 подвергают переработке аналогично 11 и получают при этом 340 мг [1R-[1(1R),3,7 а-1-[5-(ацетилокси)-1 метил-5-(2-метилтиазол-2-ил)пентил]октагидро 7 а-метил-4 Н-инден-4-она 38 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,61 част./млн (s, 3 Н); 0,92/0,93 (d, 3 Н); 2,13 (s, 3 Н); 2,45 (s, 3 Н); 6,05(t, 1H); 6,82 (s, 1H). 36. 329 мг фосфиноксида 13, депротонированного с помощью 0,28 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 113 мг кетона 38 аналогично 12 и получают при этом 98 мг (7 Е)-(1R,3R)-24 а(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиазол-2-ил)-24 аго-мо-19-нор-9,10-секохола-5,7-диена 39 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 2,15 (s,3 Н); 2,46 (s, 3 Н); 4,09 (m, 2H); 5,81 (d, 1H); 6,04(t, 1H); 6,18 (d, 1H); 6,83 (s, 1H). 37. 93 мг ацетата 39 подвергают превращению аналогично 13 и получают при этом 72 45 мг (7 Е)-(1R,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиазол-2-ил)24 а-гомо-19-нор-9,10-секохола-5,7-диен-24 а-ола 40 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 3 Н); 0,53 (s, 3 Н); 0,89 (s, 18H); 0,93 (d, 3 Н); 2,45 (s,3 Н); 4,08 (m, 2 Н); 4,95 (m, 1H); 5,82 (d, 1H); 6,18(d, 1H); 6,82 (s, 1H). 38. 72 мг спирта 40 подвергают переработке аналогично 14 и после разделения диастереоизомеров (относительно 24 а) посредством ЖХВР получают 15 мг указанного в заголовке соединения 41 а и 21 мг указанного в заголовке соединения 41b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 41 а: =0,51 част./млн (s, 3 Н); 0,90 (d, 3 Н); 2,36 (s, 3 Н); 3,94 (m, 1H); 4,02 (m, 1H); 4,88 (m,1H); 5,83 (d, 1H); 6,24 (d, 1H); 6,82 (s, 1H). 41b: =0,51 част./млн (s, 3 Н); 0,90 (d, 3 Н); 2,36 (s, 3 Н); 3,94 (m, 1H); 4,02 (m, 1H); 4,86 (m,1H); 5,83 (d, 1H); 6,24 (d, 1H); 6,83 (s, 1H). Пример 8. (7 Е)-(1R,3R)-1,3-дигидрокси 24 а-(4-метилтиазол-2-ил)-24 а-гомо-19-нор-9,10 секохола-5,7-диен-24 а-он 43. 39. 53 мг спирта 40 подвергают переработке аналогично 25 и получают при этом 42 мг(7 Е)-(1R,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиазол-2-ил)-24 агомо-19-нор-9,10-секохола-5,7-диен-24 а-она 42 в виде бесцветного пенистого вещества. 1(s, 1H). 40. 42 мг кетона 42 подвергают переработке аналогично 26 и получают при этом 13 мг указанного в заголовке соединения 43 в виде бесцветного пенистого вещества. 1(5Z,7 Е)(1S,3R,24 аS)-24 а-(4-метилтиазол-2-ил)-24 агомо-9,10-секохола-5,7,10(19)-триен-1,3,24 атриол 46b. 41. 337 мг фосфиноксида 17, депротонированного с помощью 0,28 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 113 мг кетона 38 аналогично 15 и получают при этом 170 мг (5Z,7 Е)-(1S,3R)-24 а(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиазол-2-ил)-24 агомо-9,10-секохола-5,7,10(19)-триена 44 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,52 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 2,14 (s,3 Н); 2,45 (s, 3 Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88(s, 1H); 5,19 (s, 1H); 6,02 (d, 1H); 6,03 (m, 1H); 6,23 (d, 1H); 6,83 (s, 1H). 42. 170 мг ацетата 44 подвергают превращению аналогично 13 и получают при этом 109 мг (5Z,7 Е)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиазол-2-ил)-24 а-гомо 9,10-секохола-5,7,10(19)-триен-24 а-ола 45 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,52 (s, 3 Н); 0,90 (s, 18H); 0,93 (d, 3 Н); 2,45 (s,3 Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88 (s, 1H); 4,95(m, 1H); 5,19 (s, 1H); 6,02 (d, 1H); 6,23 (d, 1H); 6,83 (s, 1H). 43. 105 мг спирта 45 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 30 мг указанного в заголовке соединения 46 а и 29 мг указанного в заголовке соединения 46b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 46 а: =0,50 част./млн (s, 3 Н); 0,90 (d, 3 Н); 2,38 (s, 3 Н); 4,17 (m, 1H); 4,36 (m, 1H); 4,88 (dd,1H); 4,94 (s, 1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,36(d, 1H); 6,81 (s, 1H). Пример 10. (5Z,7 Е)-(1S,3R)-1,3-дигидрокси-24 а-(4-метилтиазол-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)-триен-24 а-он 48. 44. 48 мг спирта 45 подвергают переработке аналогично 25 и получают при этом 40 мг(5Z,7 Е)-(1S,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиазол-2-ил)-24 агомо-9,10-секохола-5,7,10(19)-триен-24 а-она 47 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,52 (s, 3 Н); 0,88 (s, 18H); 0,95 (d, 3 Н); 2,52 (s,3 Н); 4,19 (m, 1H); 4,37 (m, 1H); 4,84 (s, 1H); 5,18(s, 1H); 6,00 (d, 1H); 6,23 (d, 1H); 7,21 (s, 1H). 45. 39 мг кетона 47 подвергают переработке аналогично 26 и получают при этом 11 мг указанного в заголовке соединения 48 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,53 част./млн (s, 3 Н); 0,95 (d, 3H); 2,45 (s, 3H); 4,15 (m, 1H); 4,36 (m,1H); 4,95 (s, 1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,35(d, 1H); 7,24 (s, 1H). Пример 11. (7 Е)-(1R,3R,24 аR)-24 а-(тиен-2 ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен 1,3,24 а-триол 55 а и (7 Е)-(1R,3R,24 аS)-24 а-(тиен 2-ил)-24 а-гомо-19-нор-9,10-секохоло-5,7-диен 1,3,24 а-триол 55b. 46. 0,65 мг тиофена помещают в 20 мл тетрагидрофурана и при -78 С добавляют 3,27 мл раствора н-бутиллития (2,5 М в гексане). Через 30 мин при этой температуре по каплям добавляют 600 мг альдегида 8 в 3 мл тетрагидрофурана и перемешивают в течение 1 ч. После этого 47 прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром,промывают органическую фазу раствором хлорида натрия и сушат над сульфатом натрия. Затем отгоняют растворитель и остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан,получая при этом 673 мг [1R-[1(1R),3,4,7 а[4-[октагидро-7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1-ил]пентил]тиофен 2-метанол 49 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,56 част./млн (q, 6H); 0,89 (d, 3H); 0,91 (s, 3 Н); 0,97 (t, 9H); 4,03 (m,1H); 4,93 (m, 1H); 6,98 (m, 2H); 7,27 (m, 1H). 47. 673 мг спирта 49 подвергают переработке аналогично 9 и получают при этом 712 мг(s, 3 Н); 4,02 (m, 1H); 6,05 (t, 1H); 6,98 (m, 1H); 7,05 (m, 1H); 7,27 (m, 1H). 48. 704 мг ацетата 50 подвергают переработке аналогично 10 и получают при этом 412 мг(t, 1H); 6,97 (m, 1H); 7,07 (m, 1H); 7,28 (m, 1H). 49. 407 мг спирта 51 подвергают переработке аналогично 11 и получают при этом 373 мг(m, 1H); 7,05 (m, 1H); 7,28 (m, 1H). 50. 329 мг фосфиноксида 13, депротонированного с помощью 0,28 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 109 мг кетона 52 аналогично 12 и получают при этом 183 мг (7 Е)-(1R,3R)-24 а(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(тиен-2-ил)-24 а-гомо-19 нор-9,10-секохола-5,7-диена 53 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,53 (s, 3H); 0,90 (s, 18H); 0,90 (d, 3H); 2,07 (s,3H); 4,08 (m, 2H); 5,81 (d, 1H); 6,04 (t, 1H); 6,18(d, 1H); 6,98 (m, 1H); 7,05 (m, 1H); 7,29 (m, 1H). 51. 178 мг ацетата 53 подвергают превращению аналогично 13 и получают при этом 138 мг (7 Е)-(1R,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(тиен-2-ил)-24 а-гомо-19 нор-9,10-секохола-5,7-диен-24 а-ола 54 в виде бесцветного пенистого вещества.(m, 2H); 7,28 (m, 1H). 52. 97 мг спирта 54 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 19 мг указанного в заголовке соединения 55 а и 24 мг указанного в заголовке соединения 55b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 55 а: =0,52 част./млн (s, 3 Н); 0,90 (d, 3 Н); 3,95 (m, 1H); 4,02 (m, 1H); 4,87 (dd, 1H); 5,84 (d,1H); 6,25 (d, 1H); 6,98 (m, 2H); 7,23 (m, 1H). 55b: =0,52 част./млн (s, 3 Н); 0,89 (d, 3 Н); 3,95 (m, 1H); 4,02 (m, 1H); 4,86 (t, 1H); 5,84 (d,1H); 6,25 (d, 1H); 6,97 (m, 2H); 7,22 (m, 1H). Пример 12. (7 Е)-(1R,3R)-1,3-дигидрокси 24 а-(тиен-2-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-24 а-он 57. 53. 40 мг спирта 54 подвергают переработке аналогично 25 и получают при этом 28 мг(7 Е)-(1R,3R)-1,3-бис(1,1 диметилэтил)диметилсилил]окси]-24 а-(тиен-2 ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен 24 а-она 56 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,88 (s, 18H); 0,98 (d, 3 Н); 4,09 (m,2H); 5,81 (d, 1H); 6,18 (d, 1H); 7,14 (dd, 1H); 7,62(d, 1H); 7,72 (d, 1H). 54. 27 мг кетона 42 подвергают переработке аналогично 26 и получают при этом 13 мг указанного в заголовке соединения 57 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,52 част./млн (s, 3 Н); 0,92 (d, 3 Н); 3,93 (m, 1H); 4,03 (m, 1H); 5,82 (d,1H); 6,23 (d, 1H); 7,12 (dd, 1H); 7,60 (d, 1H); 7,67(d, 1H). Пример 13. (5Z,7 Е)-(1S,3R,24 аR)-24 а-(тиен-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)-триен-1,3,24 а-триол 60 а и (5Z,7 Е)-(1S,3R,24 аS)-24 а(тиен-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)триен-1,3,24 а-триол 60b. 55. 350 мг фосфиноксида, депротонированного с помощью 0,29 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 113 мг кетона 52 аналогично 15 и получают при этом 93 мг (5Z,7 Е)-(1S,3R)-24 а(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(тиен-2-ил)-24 а-гомо-9,10 секохола-5,7,10(19)-триена 58 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,90 (s, 18H); 0,90 (d, 3 Н); 2,07 (s,3 Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88 (s, 1H); 5,20(s, 1H); 6,01 (d, 1H); 6,02 (t, 1H); 6,24 (d, 1H); 6,98 (m, 1H); 7,06 (m, 1H); 7,28 (m, 1H). 56. 92 мг ацетата 58 подвергают превращению аналогично 13 и получают при этом 79 49 мг (5Z,7 Е)-(1S,3R)-1,3-бисдиметил(1,1-диметилэтил)диметилсилил]окси]-24 а-(тиен-2-ил)24 а-гомо-9,10-секохола-5,7,10(19)-триен-24 аола 59 в виде бесцветного пенистого соединения. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,52 (s, 3 Н); 0,88 (s, 18H); 0,90 (d, 3 Н); 4,18 (m,1H); 4,38 (m, 1H); 4,88 (s, 1H); 4,93 (m, 1H); 5,18(s, 1H); 6,00 (d, 1H); 6,22 (d, 1H); 6,98 (m, 1H); 7,28 (m, 1H). 57. 78 мг спирта 59 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 21 мг указанного в заголовке соединения 60 а и 24 мг указанного в заголовке соединения 60b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 60 а: =0,50 част./млн (s, 3 Н); 0,88 (d, 3 Н); 4,10 (m, 1H); 4,32 (m, 1H); 4,86 (dd, 1H); 4,94 (s,1H); 5,26 (s, 1H); 6,00 (d, 1H); 6,27 (d, 1H); 6,92(1994)] помещают в 6 мл тетрагидрофурана и по каплям при -78 С добавляют 0,28 мл раствора нбутиллития (2,5 М в гексане). Через 10 мин при-30 С добавляют 109 мг кетона 52 и перемешивают в течение часа при этой температуре. После этого прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 206 мг (7E)-(1R,2S,3R)-24a(ацетилокси)-24 а-(тиен-2-ил)-1,2,3-трис(1,1 диметилэтил)диметилсилил]окси]-24 а-гомо-19 нор-9,10-секохола-5,7-диена 62 в виде бесцветного пенистого соединения. 1 Н-ЯМР (СDСl3): =0,02-0,07 част./млн(m, 1H); 3,85 (m, 1H); 5,84 (d, 1H); 6,03 (t, 1H); 6,04 (d, 1H); 6,97 (m, 2H); 7,05 (m, 1H). 59. 205 мг ацетата 62 подвергают превращению аналогично 13 и получают при этом 180 мг (7 Е)-(1R,2S,3R)-(тиен-2-ил)-1,2,3-трис(1,1 диметилэтил)диметилсилил]окси]-24 а-гомо-19 004703 50 нор-9,10-секохола-5,7-диен-24 а-ола 63 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,02-0,07 част./млн(4 хs, 18H); 0,53 (s, 3 Н); 0,83 (s, 9H); 0,89 (s,18H); 0,90 (d, 3 Н); 3,63 (m, 1H); 3,79 (m, 1H); 3,83 (m, 1H); 4,93 (m, 1H); 5,83 (d, 1H); 6,04 (d,1H); 6,99 (m, 2H); 7,28 (m, 1H). 60. 134 мг спирта 63 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 18 мг указанного в заголовке соединения 64 а и 25 мг указанного в заголовке соединения 64b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 64 а: =0,52 част./млн (s, 3 Н); 0,89 (d, 3 Н); 3,44 (dd, 1H); 3,72 (m, 1H); 4,00 (m, 1H); 4,87(m, 1H). Пример 15. (7 Е)-(1R,2S,3R)-24 а-тиен-2-ил 1,2,3-тригидрокси-24 а-гомо-9,10-секохола-5,7 диен-24 а-он 66. 61. 45 мг спирта 63 подвергают переработке аналогично 25 и получают при этом 38 мг(7 Е)-(1R,2S,3R)-24 а-(тиен-2-ил)-1,2,3-трис(1,1 диметилэтил)диметилсилил]окси]-24 а-гомо-19 нор-9,10-секохола-5,7-диен-24 а-она 65 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,02-0,07 част./млн(4 хs, 18H); 0,53 (s, 3 Н); 0,83 (s, 9H); 0,90 (s,18H); 0,97 (d, 3 Н); 3,62 (m, 1H); 3,80 (m, 1H); 3,85 (m, 1H); 5,85 (d, 1H); 6,06 (d, 1H); 7,12 (dd,1H); 7,61 (d, 2H); 7,70 (d, 1H). 62. 38 мг кетона 65 подвергают переработке аналогично 26 и получают при этом 13 мг указанного в заголовке соединения 66 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,53 част./млн (s, 3 Н); 0,95 (d, 3 Н); 3,48 (m, 1H); 3,74 (m, 1H); 4,03 (m,1H); 5,85 (d, 1H); 6,30 (d, 1H); 7,13 (dd, 1H); 7,61(d, 1H); 7,69 (d, 1H). Пример 16. (7 Е)-(1R,3R,24 аR)-24 а-(4-метилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7 диен-1,3,24 а-триол 73 а и (7 Е)-(1R,3R,24 аS)-24 а(4-метилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24 а-триол 73b. 63. 0,79 мг 3-метилтиофена помещают в 20 мл тетрагидрофурана и при -78 С добавляют 3,27 мл раствора н-бутиллития (2,5 М в гексане). Через 30 мин при этой температуре по каплям добавляют 600 мг альдегида 8 в 3 мл тетрагидрофуране и перемешивают в течение часа. После этого прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют, а остаток 51 очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 681 мг [1R[1(1R),3,4,7 а 4-[октагидро-7 а-метил-4-[(триэтилсилил)окси-1 Н-инден-1-ил]пентил]-4-метилтиофен-2-метанола 67 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,55 част./млн (q, 6H); 0,88 (d, 3 Н); 0,90 (s, 3H); 0,96 (t, 9H); 2,23 (s,3 Н); 4,03 (m, 1H); 4,83 (m, 1H); 6,80 (s, 1H); 6,82(s, 1H). 64. 671 мг спирта 67 подвергают переработке аналогично 9 и получают при этом 692 мг(s, 3 Н); 2,25 (s, 3 Н); 4,03 (m, 1H); 5,98 (t, 1H); 6,83 (s, 1H); 6,85 (s, 1H). 65. 682 мг ацетата 68 подвергают переработке аналогично 10 и получают при этом 425 мг(m, 1H); 5,98 (t, 1H); 6,82 (s, 1H); 6,85 (s, 1H). 66. 415 мг спирта 69 подвергают переработке аналогично 11 и получают при этом 352 мг(t, 1H); 6,83 (s, 1H); 6,84 (s, 1H). 67. 306 мг фосфиноксида 13, депротонированного с помощью 0,26 мл раствора нбутиллития, подвергают взаимодействию с 105 мг кетона (7E)-(1R,3R)-24a-(ацетилокси)-1,3 бис(1,1-диметилэтил)диметилсилил]окси]-24 а(4-метилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диена 70 аналогично 12 и получают при этом 166 мг 71 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,90 (s, 18H); 0,91 (d, 3 Н); 2,07 (s,3 Н); 2,23 (s, 3 Н); 4,09 (m, 2H); 5,81 (d, 1H); 5,97(t, 1H); 6,18 (d, 1H); 6,82 (s, 1H); 6,84 (s, 1H). 68. 165 мг ацетата 71 подвергают превращению аналогично 13 и получают при этом 128 мг (7 Е)-(1R,3R)-1,3-бисдиметил(1,1-диметилэтил)силил]окси]-24 а-(4-метилтиен-2-ил)-24 агомо-19-нор-9,10-секохола-5,7-диен-24 а-ола 72 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,54 (s, 3 Н); 0,89 (s, 18H); 0,91 (d, 3 Н); 2,25 (s, 004703(d, 1H); 6,80 (s, 1H); 6,82 (s, 1H). 69. 91 мг спирта 72 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 16 мг указанного в заголовке соединения 73 а и 19 мг указанного в заголовке соединения 73b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 73 а: =0,51 част./млн (s, 3 Н); 0,91 (d, 3 Н); 2,18 (s, 3 Н); 3,94 (m, 1H); 4,02 (m, 1H); 4,76 (t,1H); 5,84 (d, 1H); 6,25 (d, 1H); 6,75 (s, 1H); 6,77(s, 2H). Пример 17. (7 Е)-(1R,3R)-1,3-дигидрокси 24 а-(4-метилтиен-2-ил)-24 а-гомо-19-нор-9,10 секохола-5,7-диен-24 а-он 75. 70. 36 мг спирта 72 подвергают переработке аналогично 25 и получают при этом 30 мг(7 Е)-(1R,3R)-1,3-бисдиметил(1,1-диметилэтил) силил]окси]-24 а-(4-метилтиен-2-ил)-24 а-гомо 19-нор-9,10-секохола-5,7-диен-24 а-она 74 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,54 (s, 3 Н); 0,88 (s, 18H); 0,98 (d, 3 Н); 2,30 (s,3 Н); 4,09 (m, 2H); 5,82 (d, 1H); 6,18 (d, 1H); 7,22(s, 1H); 7,52 (s, 1H). 71. 29 мг кетона 74 подвергают переработке аналогично 26 и получают при этом 13 мг указанного в заголовке соединения 75 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,52 част./млн (s, 3 Н); 0,94 (d, 3 Н); 2,27 (s, 3 Н); 3,95 (m, 1H); 4,04 (m,1H); 5,82 (d, 1H); 6,24 (d, 1H); 7,19 (s, 1H); 7,48(s, 1H). Пример 18. (5Z,7E)-(1S,3R,24 аR)-24 а-(4 метилтиен-2-ил)-24 а-гомо-9,10-секохола 5,7,10(19)-триен-1,3,24 а-триол 78 а и (5Z,7 Е)(1S,3R,24 аS)-24 а-(4-метилтиен-2-ил)-24 а-гомо 9,10-секохола-5,7,10(19)-триен-1,3,24 а-триол 78b. 72. 316 мг фосфиноксида 17, депротонированного с помощью 0,26 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 106 мг кетона 70 аналогично 15 и получают при этом 177 мг (5Z,7 Е)-(1S,3R)-24 а(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиен-2-ил)-24 агомо-9,10-секохола-5,7,10(19)-триена 76 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 2,08 (s,3 Н); 2,23 (s, 3 Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88(s, 1H); 5,20 (s, 1H); 5,98 (t, 1H); 6,01 (d, 1H); 6,23 (d, 1H); 6,83 (s, 1H); 6,85 (s, 1H). 73. 176 мг ацетата 76 подвергают превращению аналогично 13 и получают при этом 149 53 мг (5Z,7 Е)-(1S,3R)-1,3-бис(1,1-диметилэтил) диметилсилил]окси]-24 а-(4-метилтиен-2-ил)24 а-гомо-9,10-секохола-5,7,10(19)-триен-24 аола 77 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,89 (s, 18H); 0,90 (d, 3 Н); 2,23 (s,3 Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88 (s, 1H); 4,95(m, 1H); 5,19 (s, 1H); 6,02 (d, 1H); 6,25 (d, 1H); 6,80 (s, 1H); 6,82 (s, 1H). 74. 103 мг спирта 77 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 26 мг указанного в заголовке соединения 78 а и 27 мг указанного в заголовке соединения 78b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 78 а: =0,50 част./млн (s, 3 Н); 0,88 (d, 3 Н); 2,17 (s, 3 Н); 4,09 (m, 1H); 4,30 (m, 1H); 4,76 (t,1H); 4,92 (s, 1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,28(d, 1H); 6,82 (s, 1H); 6,84 (s, 1H). Пример 19. (5Z,7E)-(1S,3R)-1,3-дигидрокси-24 а-(4-метилтиен-2-ил)-24 а-гомо-9,10-секохола-5,7,10(19)-триен-24 а-он 80. 75. 45 мг спирта 77 подвергают переработке аналогично 25 и получают при этом 20 мг(5Z,7 Е)-(1S,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(4-метилтиен-2-ил)-24 агомо-9,10-секохола-5,7,10(19)-триен-24 а-она 79 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,06 част./млн (s, 12H); 0,53 (s, 3H); 0,88 (s, 18H); 0,97 (d, 3H); 2,29 (s,3H); 4,18 (m, 1H); 4,38 (m, 1H); 4,96 (s, 1H); 5,18(s, 1H); 6,00 (d, 1H); 6,23 (d, 1H); 7,22 (s, 1H); 7,52 (s, 1H). 76. 19 мг кетона 79 подвергают переработке аналогично 26 и получают при этом 9 мг указанного в заголовке соединения 80 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,52 част./млн (s, 3H); 0,94 (d, 3H); 2,27 (s, 3H); 4,16 (m, 1H); 4,36 (m,1H); 4,94 (s, 1H); 5,28 (s, 1H); 5,98 (d, 1H); 6,36(d, 1H); 7,20 (s, 1H); 7,48 (s, 1H). Пример 20. (7 Е)-(1R,2S,3R,24 аR)-24 а-(4 метилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен-1,2,3,24-тетрол 83 а и (7 Е)-(1R,2S,3R,24 аS)-24 а-(4-метилтиен-2-ил)-24 а-гомо-19 нор-9,10-секохола-5,7-диен-1,2,3,24-тетрол 83b. 77. 377 мг фосфиноксида 61 а помещают в 6 мл тетрагидрофурана и при -78 С по каплям добавляют 0,26 мл раствора н-бутиллития (2,5 М в гексане). Через 10 мин при -30 С добавляют 105 мг кетона 70 и перемешивают в течение часа при этой температуре. После этого прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида 54 натрия, сушат над сульфатом натрия и удаляют растворитель. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 174 мг (7 Е)-(1R,2S,3R)-24 а-(ацетилокси)24 а-(4-метилтиен-2-ил)-1,2,3-трис(1,1-диметилэтил)диметилсилил]окси]-24 а-гомо-19-нор-9,10 секохола-5,7-диена 81 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,02-0,07 част./млн(m, 1H); 3,80 (m, 1H); 3,85 (m, 1H); 5,85 (d, 1H); 5,97 (t, 1H); 6,05 (d, 1H); 6,82 (s, 2H); 6,84 (s,1H). 78. 173 мг ацетата 81 подвергают превращению аналогично 13 и получают при этом 146 мг (7 Е)-(1R,2S,3R)-24 а-(4-метилтиен-2-ил)-1,2,3-трис(1,1-диметилэтил)диметилсилил]окси]24 а-гомо-19-нор-9,10-секохола-5,7-диен-24 а-ола 82 в виде бесцветного пенистого соединения. 1 Н-ЯМР (СDСl3): =0,02-0,07 част./млн(m, 1H); 3,84 (m, 1H); 4,93 (m, 1H); 5,83 (d, 1H); 6,04 (d, 1H); 6,78 (s, 1H); 6,80 (s, 1H). 79. 99 мг спирта 82 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 19 мг указанного в заголовке соединения 83 а и 23 мг указанного в заголовке соединения 83b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2): 83 а: =0,52 част./млн (s, 3 Н); 0,88 (d, 3 Н); 2,18 (s, 3 Н); 3,45 (m, 1H); 3,70 (m, 1H); 4,00 (m,1H); 4,78 (t, 1H); 5,77 (d, 1H); 6,28 (d, 1H); 6,86(s, 1H); 6,89 (s, 1H). Пример 21. (7 Е)-(1R,2S,3R)-24 а-(4-метилтиен-2-ил)-1,2,3-тригидрокси-24 а-гомо-19-нор 9,10-секохола-5,7-диен-24 а-он 85. 80. 46 мг спирта 82 подвергают переработке аналогично 25 и получают при этом 41 мг(7 Е)-(1R,2S,3R)-24 а-(4-метилтиен-2-ил)-1,2,3 трис(1,1-диметилэтил)диметилсилил]окси]24 а-гомо-19-нор-9,10-секохола-5,7-диен-24 а-она 84 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,02-0,07 част./млн(m, 1H); 3,84 (m, 1H); 5,83 (d, 1H); 6,05 (d, 1H); 7,21 (s, 1H); 7,51 (s, 1H). 81. 40 мг кетона 84 подвергают переработке аналогично 26 и получают при этом 18 мг указанного в заголовке соединения 85 в виде бесцветного пенистого вещества.(7 Е)-(1R,3R,24 аR)-24 а-(5 этилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола 5,7-диен-1,3,24 а-триол 92 а и (7 Е)-(1R,3R,24 аS)24 а-(5-этилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7-диен-1,3,24 а-триол 92b. 82. 1,19 мл 2-этилтиофена помещают в 20 мл тетрагидрофурана и при -78 С добавляют 4,2 мл раствора н-бутиллития (2,5 М в гексане). Через 30 мин при этой температуре по каплям добавляют 770 мг альдегида 8 в 5 мл тетрагидрофурана и перемешивают в течение часа. После этого прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют, а остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 773 мг [1R-[1(1R),3,4,7 а-5-этил[4-[октагидро-7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1-ил]пентил]тиофен-2 метанола 86 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,56 част./млн (q, 6H); 0,89 (d, 3 Н); 0,90 (s, 3H); 0,97 (t, 9 Н); 1,31 (t, 3 Н); 2,82 (q, 2 Н); 4,03 (m, 1H); 4,81 (m, 1H); 6,62 (d,1H); 6,80 (d, 1H). 83. 763 мг спирта 86 подвергают переработке аналогично 9 и получают при этом 745 мг(t, 1H); 6,62 (d, 1H); 6,87 (d, 1H). 84. 682 мг ацетата 87 подвергают переработке аналогично 10 и получают при этом 287 мг(q, 2H); 4,07 (m, 1H); 5,97 (t, 1H); 6,63 (d, 1H); 6,85 (d, 1H). 85. 142 мг спирта 88 подвергают переработке аналогично 11 и получают при этом 123 мг [1R-[1(1R),3,7 а-1-[5-(ацетилокси)-5(5-этилтиен-2-ил)-1-метилпентил]октагидро-7 аметил-4 Н-инден-1-она 89 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =0,62 част./млн (s, 3 Н); 0,92/0,93 (d, 3 Н); 1,30 (t, 3 Н); 2,07 (s, 3 Н); 2,82 56 бутиллития (2,5 М в гексане), подвергают взаимодействию с 123 мг кетона 89 аналогично 12 и получают при этом 129 мг (7 Е)-(1R,3R)-24 а(ацетилокси)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-(5-этилтиен-2-ил)-24 а-гомо 19-нор-9,10-секохола-5,7-диена 90 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,90 (s, 18H); 0,91 (d, 3 Н); 1,30 (t,3 Н); 2,07 (s, 3 Н); 2,82 (q, 2 Н); 4,09 (m, 2H); 5,82(d, 1H); 5,96 (t, 1H); 6,18 (d, 1H); 6,62 (d, 1H); 6,86 (d, 1H). 87. 129 мг ацетата 90 подвергают превращению аналогично 13 и получают при этом 98 мг (7 Е)-(1R,3R)-24 а-(ацетилокси)-1,3-бис(1,1 диметилэтил)диметилсилил]окси]-24 а-(5-этилтиен-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7 диен-24 а-ола 91 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,54 (s, 3 Н); 0,89 (s, 18H); 0,91 (d, 3 Н); 1,30 (t,3 Н); 2,82 (q, 2H); 4,10 (m, 2H); 4,84 (m, 1H); 5,82(d, 1H); 6,18 (d, 1H); 6,63 (d, 1H); 6,80 (d, 1H). 88. 98 мг спирта 91 подвергают переработке аналогично 14 и после разделения диастереоизомеров (относительно С-24 а) посредством ЖХВР получают 18 мг указанного в заголовке соединения 92 а и 19 мг 92b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 92 а: =0,51 част./млн (s, 3 Н); 0,89 (d, 3 Н); 1,27 (t, 3 Н); 2,78 (q, 2H); 3,94 (m, 1H); 4,02 (m,1H); 4,75 (t, 1H); 5,84 (d, 1H); 6,25 (d, 1H); 6,59(d, 1H); 6,71 (d, 1H) Пример 23. (7 Е)-(1R,3R,24 аR)-24 а-[5-(2 гидроксиэтил)-4-метилтиазол-2-ил]-24 а-гомо 19-нор-9,10-секохола-5,7-диен-1,3,24 а-триол 102 а и (7E)-(1R,3R,24aS)-24a-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]-24 а-гомо-19-нор 9,10-секохола-5,7-диен-1,3,24 а-триол 102b. 89. 2,09 мл 5-(2-гидроксиэтил)-4-метилтиазола 93 помещают в 150 мл дихлорметана, добавляют 7,8 мл дигидропирана и 400 мг птолуолсульфоната пиридиния и перемешивают в течение 5 ч при комнатной температуре. После этого добавляют раствор хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором гидрокарбоната натрия и раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 3,8 г 5-[2-[(тетрагидро-2 Н-пиран-2-ил) окси]этил]-4-метилтиазола 94 в виде бесцветного масла. 1 Н-ЯМР (СDСl3): =1,48-1,90 част./млн (m,6H); 2,41 (s, 3 Н); 3,05 (t, 2H); 3,48 (m, 1 Н); 3,56(dt, 1H); 3,75 (m, 1 Н); 3,93 (dt, 1H); 4,61 (m, 1 Н); 8,54 (s, 1H). 90. 2,78 г тиазола 94 помещают в 25 мл тетрагидрофурана и при -78 С добавляют 4,9 мл раствора н-бутиллития (2,5 М в гексане). Через 30 мин при этой температуре по каплям добавляют 900 мг альдегида 8 в 5 мл тетрагидрофурана и перемешивают в течение 1 ч. После этого прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром,промывают органическую фазу раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют, а остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 1,12 г [1R-[1(1R),3,4,7 а[4[октагидро-7 а-метил-4-[(триэтилсилил)окси]1 Н-инден-1-ил]пентил]-5-[2-[(тетрагидро-2 Нпиран-2-ил)окси]этил]-4-метилтиазол-2-метанола 95 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,56 част./млн (q, 6H); 0,89 (d, 3 Н); 0,90 (s, 3 Н); 0,96 (t, 9 Н); 2,32 (s,3 Н); 3,00 (t, 2H); 3,48 (m, 1H); 3,58 (dt, 1H); 3,75(m, 1H); 3,90 (dt, 1H); 4,03 (m, 1H); 4,61 (m, 1H); 4,87 (m, 1H); 6,62 (d, 1H); 6,80 (d, 1H). 91. 1,12 г спирта 95 подвергают переработке аналогично 9 и получают при этом 104 мг(s, 3 Н); 2,35 (s, 3 Н); 3,00 (t, 2H); 3,50 (m, 1H); 3,53 (dt, 1H); 3,74 (m, 1H); 3,90 (dt, 1H); 4,02 (m,1H); 4,61 (m, 1H); 5,97 (t, 1H). 92. 1,04 мг ацетата 96 подвергают переработке аналогично 10 и получают при этом 540 мг[1R-[1(1R),3,4,7 а-1-[5-(ацетилокси)-5-[5-[2-[(тетрагидро-2 Н-пиран-2-ил)окси] этил]-4-метилтиазол-2-ил]-1-метилпентил]октагидро-7 а-метил-1 Н-инден-4-ола 97 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,88/0,89 част./млн (d,3 Н); 0,91 (s, 3H); 2,11 (s, 3H); 2,35 (s, 3 Н); 3,00 (t,2 Н); 3,50 (m, 1H); 3,55 (dt, 1H); 3,74 (m, 1H); 3,90 (dt, 1H); 4,07 (m, 1H);4,61 (m, 1H); 5,97 (t,1H). 93. 540 мг спирта 97 подвергают переработке аналогично 11 и получают при этом 498 мг [1R-[1(1R),3,7 а-1-[5-(ацетилокси)-5[5-[2-[(тетрагидро-2 Н-пиран-2-ил)окси]этил]-4 метилтиазол-2-ил]-1-метилпентил]октагидро-7 аметил-4 Н-инден-4-она 98 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,62 част./млн (s, 3 Н); 0,92/0,93 (d, 3 Н); 2,13 (s, 3H); 2,37 (s, 3 Н); 3,00 58 94. 656 мг фосфиноксида 13, депротонированного с помощью 0,55 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 300 мг кетона 98 аналогично 12 и получают при этом 310 мг (7 Е)-(1R,3R)-1,3 бис(1,1-диметилэтил)диметилсилил]окси]-24 а[5-[2-[(тетрагидро-2 Н-пиран-2-ил)окси]этил]-4 метилтиазол-2-ил]-24 а-гомо-19-нор-9,10 секохола-5,7-диен-24 а-илацетата 99 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СDСl3): =0,07 част./млн (s, 12H); 0,53 (s, 3 Н); 0,90 (s, 18H); 0,91 (d, 3 Н); 2,12 (s,3 Н); 2,38 (s, 3 Н); 3,01 (t, 2H); 3,50 (m, 1H); 3,56(dt, 1H); 3,75 (m, 1H); 3,90 (dt, 1H); 4,09 (m, 2H); 4,61(m, 1H); 5,82 (d, 1H); 5,97 (t, 1H); 6,18 (d,1H). 95. 151 мг ацетата 99 подвергают превращению аналогично 13 и получают при этом 104 мг (7 Е)-(1R,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-[5-[2-[(тетрагидро-2 Н-пиран-2-ил)окси]этил]-4-метилтиазол-2-ил]-24 агомо-19-нор-9,10-секохола-5,7-диен-24 а-ола 100 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,04 част./млн (s,12H); 0,51 (s, 3 Н); 0,85 (s, 18H); 0,90 (d, 3 Н); 2,28(s, 3 Н); 2,95 (t, 2H); 3,40 (m, 1H); 3,50 (dt, 1H); 3,70 (m, 1H); 3,82 (dt, 1H); 4,07 (m, 2H); 4,80 (m,1H); 5,80 (d, 1H); 6,17 (d, 1H). 96. 170 мг ТГП-эфира 100 помещают в 20 мл дихлорметана, добавляют при -25 С 0,41 мл раствора хлорида диметилалюминия и перемешивают в течение 1 ч, при этом смесь нагревается до 0 С. После этого прекращают реакцию с помощью раствора гидрокарбоната натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель под вакуумом. Остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 153 мг (7E)-(1R,3R)-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]-24 а-гомо-19-нор 9,10-секохола-5,7-диен-24 а-ола 101 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,04 част./млн (s,12H); 0,51 (s, 3 Н); 0,85 (s, 18H); 0,90 (d, 3 Н); 2,28(s, 3 Н); 2,92 (t, 2H); 3,26 (t, 2 Н); 4,08 (m, 2H); 4,80 (m, 1H); 5,80 (d, 1H); 6,17 (d, 1H). 97. 113 мг спирта 101 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно С-24 а) посредством ЖХВР получают 21 мг указанного в заголовке соединения 102 а и 24 мг указанного в заголовке соединения 102b в виде бесцветных пенистых веществ. 1 Н-ЯМР (CD2Cl2/CD3OD): 102 а: =0,50 част./млн (s, 3 Н); 0,88 (d, 3 Н); 2,27 (s, 3 Н); 2,88 (t, 2H); 3,68 (d, 2H); 3,92 (m,1H); 4,00 (m, 1H); 4,74 (m, 1H); 5,82 (d, 1H); 6,24(d, 1H). Пример 24. (7 Е)-(1R,3R)-1,3-дигидрокси 24 а-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]24 а-гомо-19-нор-9,10-секохола-5,7-диен-24 а-он 104. 98. 70 мг спирта 100 подвергают переработке аналогично 25 и получают при этом 40 мг(7 Е)-(1R,3R)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 а-[5-(2-гидроксиэтил)-4-метилтиазол-2-ил]-24 а-гомо-19-нор-9,10-секохола-5,7 диен-24 а-она 103 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,04 част./млн (s,12H); 0,51 (s, 3 Н); 0,84 (s, 18H); 0,93 (d, 3 Н); 2,37(s, 3 Н); 3,01 (t, 2H); 3,40 (m, 1H); 3,53 (dt, 1H); 3,68 (m, 1H); 3,89 (dt, 1H); 4,08 (m, 2H); 4,54 (m,1H); 5,80 (d, 1H); 6,15 (d, 1H). 99. 40 мг кетона 103 подвергают переработке аналогично 26 и получают при этом 12 мг указанного в заголовке соединения 104 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CD2Cl2): =0,52 част./млн (s, 3 Н); 0,95 (d, 3 Н); 2,41 (s, 3 Н); 3,01 (t, 2H); 3,80 (t, 2H); 3,95 (m, 1H); 4,05 (m, 1H); 5,82 (d, 1H); 6,25 (d,1H). Пример 25. (7 Е)-(1R,3R,24 аR)-24 а-(бензотиазол-2-ил)-24 а-гомо-19-нор-9,10-секохола-5,7 диен-1,3,24 а-триол 111a и (7 Е)-(1R,3R,24 аS)24 а-(бензотиазол-2-ил)-24 а-гомо-19-нор-9,10 секохола-5,7-диен-1,3,24 а-триол 111b. 100. 0,85 мг бензотиазола помещают в 20 мл тетрагидрофурана и при -78 С добавляют 3,1 мл раствора н-бутиллития (2,5 М в гексане). Через 30 мин при этой температуре по каплям добавляют 574 мг альдегида 8 в 3 мл тетрагидрофурана и перемешивают в течение 1 ч. После этого прекращают реакцию с помощью раствора хлорида натрия, экстрагируют уксусным эфиром, промывают органическую фазу раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют, а остаток очищают посредством хроматографии на силикагеле с использованием смеси уксусный эфир/гексан и получают при этом 751 мг [1R-[1(1R),3,4,7 а[4-[октагидро-7 а-метил-4-[(триэтилсилил)окси]-1 Н-инден-1-ил]пентил]бензотиазол-2-метанола 105 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,55 част./млн (q, 6H); 0,89 (d, 3 Н); 0,91 (s, 3H); 0,95 (t, 9 Н); 4,02 (m,1H); 5,10 (m, 1H); 7,40 (t, 1H); 7,48 (t, 1H); 7,90(d, 1H); 8,00 (d, 1H). 101. 751 мг спирта 105 подвергают переработке аналогично 9 и получают при этом 764 мг(s, 3 Н); 4,02 (m, 1H); 6,15 (t, 1H); 7,40 (t, 1H); 7,49 (t, 1H); 7,90 (d, 1H); 8,03 (d, 1H). 102. 764 мг ацетата 106 подвергают переработке аналогично 10 и получают при этом 310 мг(d, 1H). 103. 310 мг спирта 107 подвергают переработке аналогично 11 и получают при этом 277 мг[1R-[1(1R),3,4,7 а-1-[5-(ацетилокси)-5-(5-бензотиазол-2-ил)-1-метилпентил]октагидро-7 а-метил-4 Н-инден-4-она 108 в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,62 част./млн (s, 3 Н); 0,92/0,93 (d, 3H); 2,19 (s, 3H); 6,17 (t, 1H); 7,40 (t,1H); 7,49 (t, 1H); 7,89 (d, 1H); 8,02 (d, 1H). 104. 756 мг фосфиноксида 13, депротонированного с помощью 0,62 мл раствора нбутиллития (2,5 М в гексане), подвергают взаимодействию с 277 мг кетона 108 аналогично 12 и получают при этом 193 мг (7 Е)-(1R,3R)-24 а(ацетилокси)-24 а-(2-бензотиазол-2-ил)-1,3-бис(1,1-диметилэтил)диметилсилил]окси]-24 агомо-19-нор-9,10-секохола-5,7-диена 109 в виде бесцветного пенистого вещества. 1 Н-ЯМР (CDCl3): =0,07 част./млн (s, 12H); 0,53 (s, 3H); 0,90 (s, 18H); 0,91 (d, 3H); 2,19 (s,3H); 4,08 (m, 2H); 5,82 (d, 1H); 6,18 (d, 1H); 6,18(m, 1H); 7,38 (t, 1H); 7,49 (t, 1H); 7,88 (d, 1H); 8,02 (d, 1H). 105. 193 мг ацетата 109 подвергают переработке аналогично 13 и получают при этом 177 мг(7 Е)-(1R,3R)-24 а-(2-бензотиазол-2-ил)-1,3 бис(1,1-диметилэтил)диметилсилил]окси]-24 агомо-19-нор-9,10-секохола-5,7-диен-24 а-ола 110 в виде бесцветного пенистого вещества. 1 Н-ЯМР (СD2 Сl2): =0,04 част./млн (s,12H); 0,51 (s, 3H); 0,86 (s, 18H); 0,92 (d, 3H); 4,06(m, 2H); 5,04 (m, 1H); 5,80 (d, 1H); 6,16 (d, 1H); 7,33 (t, 1H); 7,43 (t, 1H); 7,87 (d, 1H); 7,92 (d,1H). 106. 124 мг спирта 110 подвергают переработке аналогично 14 и после разделения диастереомеров (относительно 24 а) посредством ЖХВР получают 23 мг указанного в заголовке соединения 111a и 22 мг указанного в заголовке соединения 111b в виде бесцветных пенистых веществ. 1 Н-ЯМР (СD2 Сl2): 111a: =0,50 част./млн (s, 3H); 0,90 (d, 3H); 3,95 (m, 1H); 4,02 (m, 1H); 5,07 (m, 1H); 5,82 (d,1H); 6,24 (d, 1H); 7,36 (t, 1H); 7,46 (t, 1H); 7,90
МПК / Метки
МПК: C07C 401/00
Метки: субструктурами, получения, способ, продукты, цепях, витамина, применение, промежуточные, лекарственных, циклическими, производные, боковых, средств
Код ссылки
<a href="https://eas.patents.su/30-4703-proizvodnye-vitamina-d-s-ciklicheskimi-substrukturami-v-bokovyh-cepyah-sposob-i-promezhutochnye-produkty-dlya-ih-polucheniya-i-ih-primenenie-dlya-polucheniya-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные витамина d с циклическими субструктурами в боковых цепях, способ и промежуточные продукты для их получения и их применение для получения лекарственных средств</a>
Предыдущий патент: Сульфированные сахариды
Следующий патент: Производные феноксипропиламина
Случайный патент: Стабильная композиция фенофибрата для перорального введения и ее применение


































