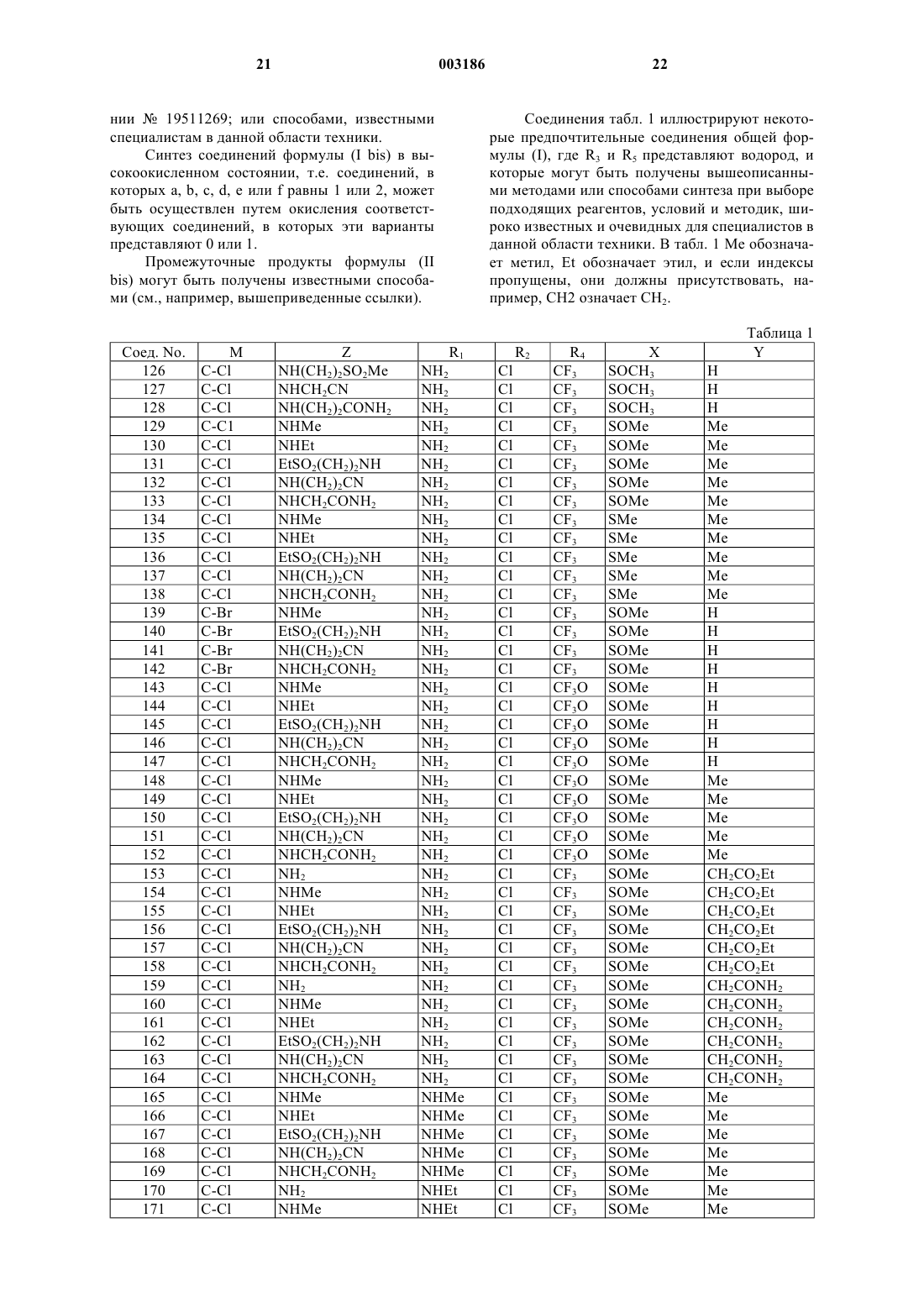
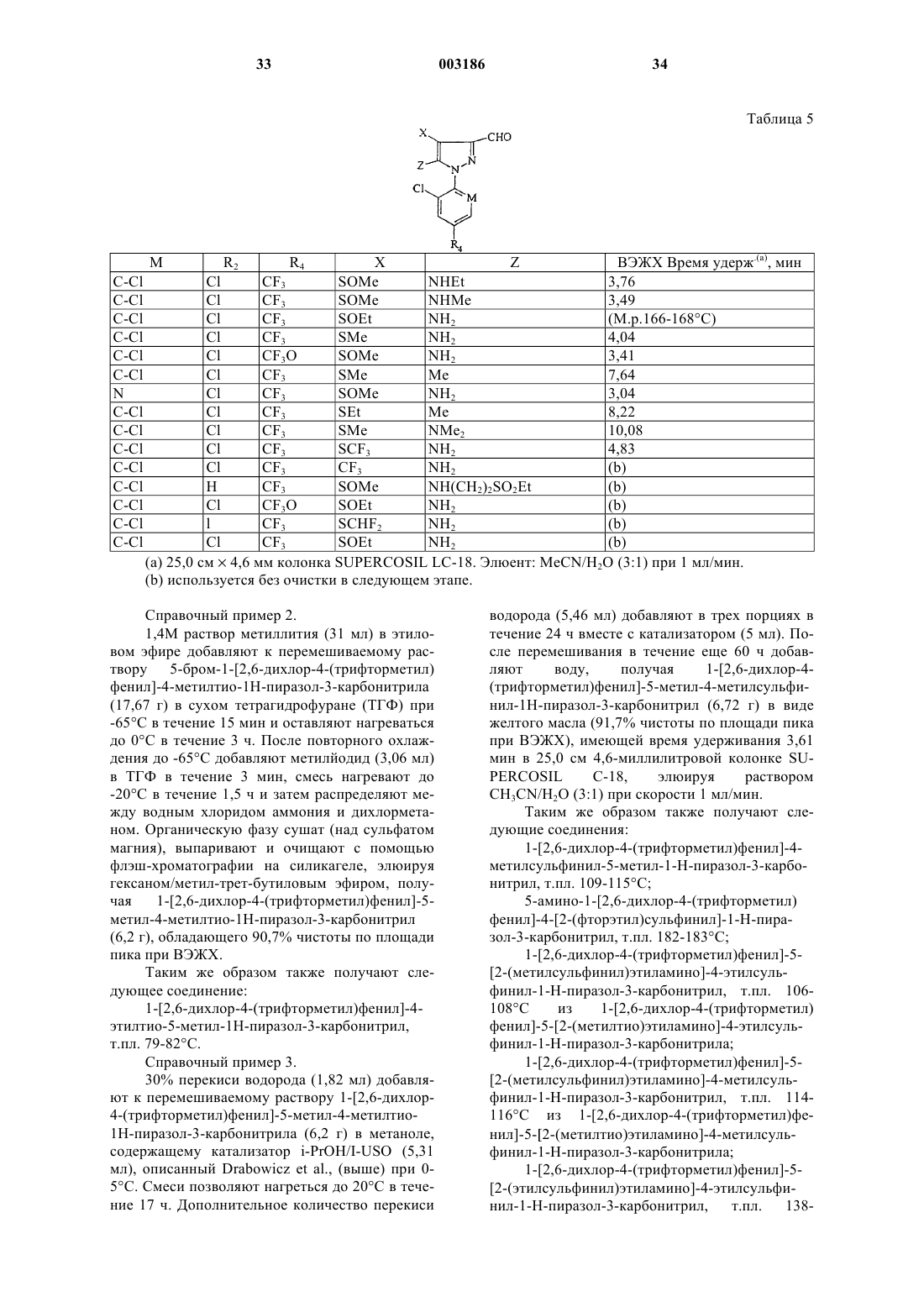
Пестицидные 1-арилпиразолы
Номер патента: 3186
Опубликовано: 27.02.2003
Авторы: Филлипс Дженнивер Ленц, Шен Алан, Лоудер Патрик Дойл, Ву Тай-Тех, Меннинг Девид Тридвей, Рей Николас Чарльз, Ньюсам Питер Вайэтт
Формула / Реферат
1. Соединение формулы
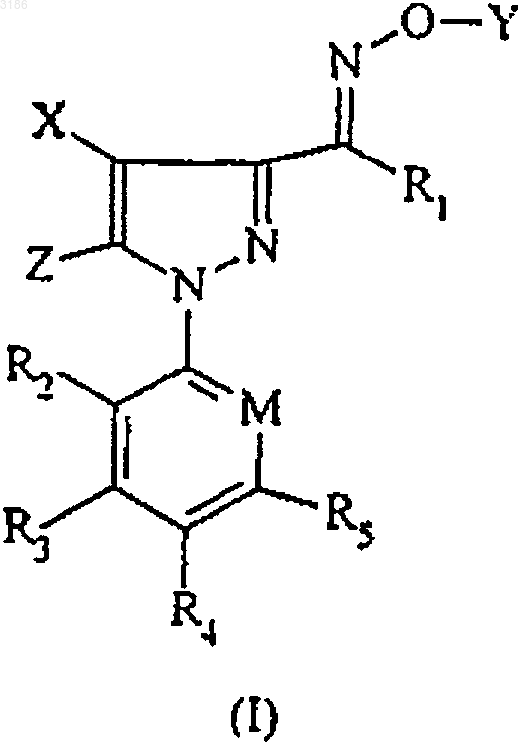
где X представляет -S(O)mR6 или R7,
Y представляет водород; C1-C4алкил или циклоалкил, содержащий до 4 атомов углерода, каждый из которых возможно замещен аминокарбонилом, C1-C6алкилсульфонилом, C1-C6алкокси, C1-C6алкоксикарбонилом, C1-C6алкилкарбонилом, циано или нитро; C3-C4алкенил; C3-C5алкинил; C1-C6алкилкарбонил; замещенный или незамещенный C4-C8ароил; C4-C8арилC1-C6алкилкарбонил; C1-C6алкилсульфонил; C1-C6алкоксикарбонилC1-C6алкилкарбонил; галогенC1-C6алкилкарбонил; N-C1-C6алкилкарбамоил; C1-C6алкоксикарбонил; C4-C8арилоксикарбонил; C1-C6алкоксиC1-C6 алкилкарбонил; альфагидроксиС4-C8арилC1-C6алкилкарбонил; гидроксиC1-C6алкилкарбонил; аминоC1-C6алкилкарбонил; C(=O)S-C1-C6алкил и триC1-C6алкилсилил;
Z представляет C1-C6алкил, галоген, амино, R12NH- или R13R14N-;
R1 представляет водород, C1-C6алкил или -NR15R16;
R2 представляет водород или галоген;
R3 и R5 представляют водород;
R4 представляет галоген, галогенC1-C6алкил, галогенC1-C6алкокси;
R6 представляет C1-C6алкил или галогенC1-C6алкил,
R7 представляет C1-C6алкил или галогенC1-C6алкил;
R12, R13 и R14 одинаковые или различные и представляют R7S(O)r, C3-C6алкинил или C1-C6алкоксикарбонил; или C1-C6алкил, C3-C6алкенил или -C(O)C1-C6алкил, где алкильные или алкенильные части необязательно замещены одним или более R18;
R15 и R16 независимо представляют водород или C1-C6алкил;
R18 представляет циано, нитро, C1-C6алкокси, галоген C1-C6алкокси, -C(O)R7, R8S(O)s-, -C(O)OR9, аминокарбонил, C1-C6алкиламинокарбонил, диC1-C6алкиламинокарбонил, галоген, гидрокси, аминосульфонил, C1-C6алкиламиносульфонил или диC1-C6алкиламиносульфонил;
m, r и s равны нулю, одному или двум;
M представляет C-галоген или N;
их геометрические изомеры, таутомерные формы и пестицидно-активные соли.
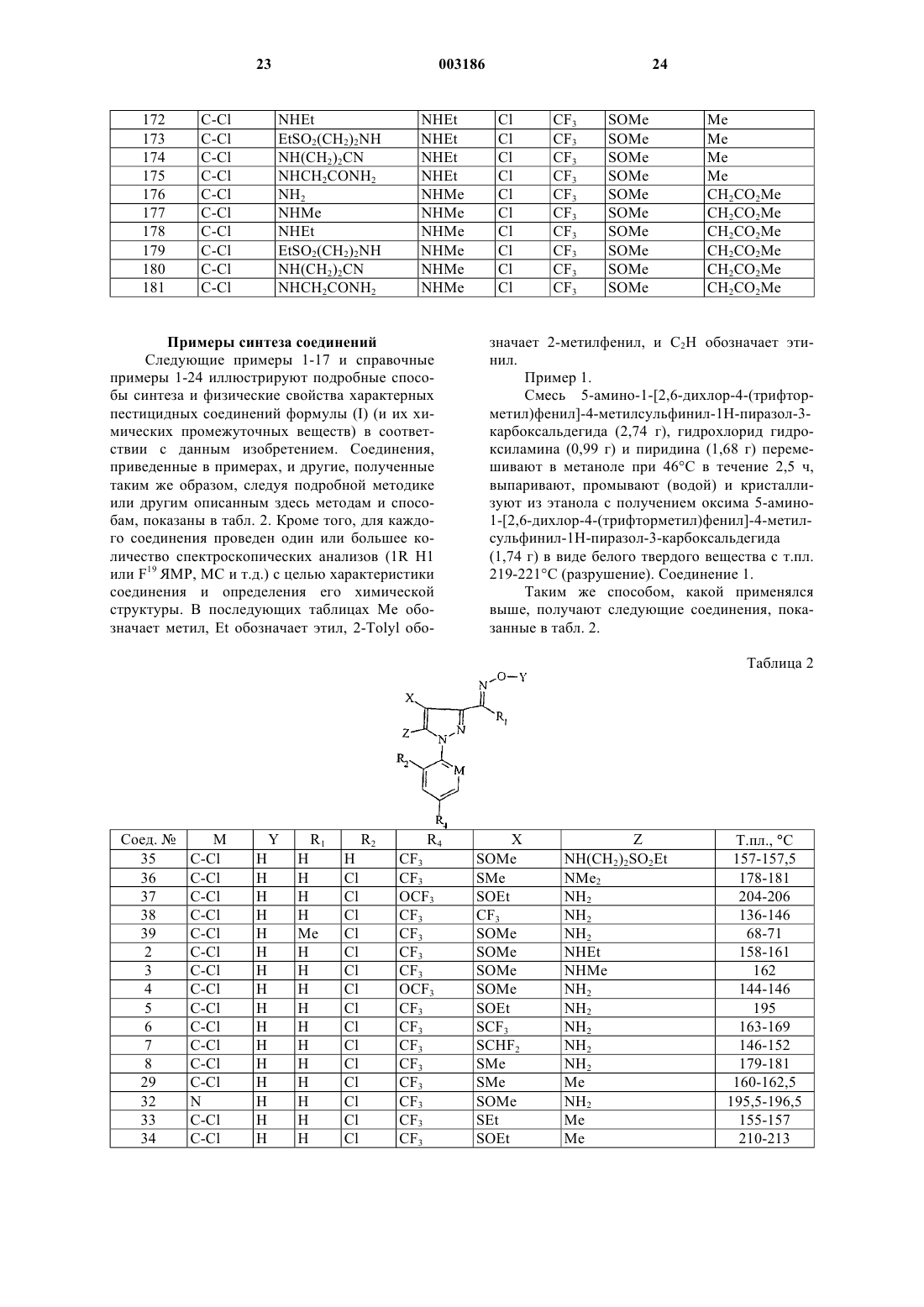
2. Соединение формулы (I) по п.1, которое представляет
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5-этиламино-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5-метиламино-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилтио-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-дифторметилтио-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилтио-1H-пиразол-3-карбоксальдегида;
O-(метил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилтио-1H-пиразол-3-карбоксальдегида;
O-(ацетил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-(2-метилбензоил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-(2-метоксикарбонил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-[(2-этоксикарбонил)пропионил]оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-(ацетил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилтио-1H-пиразол-3-карбоксальдегида;
O-(метоксикарбонил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилтио-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфонил-1H-пиразол-3-карбоксальдегида;
O-(метил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-металсульфинил-1H-пиразол-3-карбоксальдегида;
O-(N-метилкарбамоил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-(карбоксиметил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфиннл-1H-пиразол-3-карбоксальдегида;
O-(трет-бутилметилсилил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
1-[2,6-дихлор-4-(трифторметил)фенил]-5-формил-N-гидрокси-4-трифторметилтио-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-5-гидроксииминометил-4-трифторметилтио-1H-пиразол-3-карбоксимидамид;
O-(изопропил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-(этоксикарбонилметил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-(аминокарбонилметил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
O-[(2-(этилсульфонил)этил)]оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
О-(2-цианоэтил)оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5-метил-4-метилтио-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5-метил-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5-метил-4-метилсульфонил-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[3-хлор-5-(трифторметил)-2-пиридинил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилтио-5-метил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-5-метил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2-хлор-4-(трифторметил)фенил]-5-[2-(этилсульфонил)этиламино]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5-диметиламино-4-метилтио-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-этилсульфинил-1H-пиразол-3-карбоксальдегида;
оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметил-1H-пиразол-3-карбоксальдегида;
оксим 3-ацетил-5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразола;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-трифторметилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-метокси-4-трифторметилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-этилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-этилтио-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-N-гидрокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-метилсульфонил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-метилтио-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-этилсульфонил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-метокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-метокси-N-метил-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-[2-(фторэтил)сульфинил]-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-[2-(фторэтил)сульфонил]-1H-пиразол-3-карбоксимидамид;
5-амино-1-[3-хлор-5-(трифторметил)-2-пиридинил]-4-этилсульфинил-N-гидрокси-1H-пиразол-3-карбоксимидамид;
5-амино-1-[3-хлор-5-(трифторметил)-2-пиридинил]-4-метилсульфинил-N-гидрокси-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-5-метиламино-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-5-этиламино-N-гидрокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-5-[2-(этилсульфонил)этиламино]-N-гидрокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
5-[2-(циано)этиламино]-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
5-(аминокарбонилметиламино)-1-[2,6-дихлор-4-(трифторметил)фенил]-N-гидрокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[2-(фенилсульфонил)этиламино]-N-гидрокси-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дибром-4-(трифторметил)фенил]-4-метилсульфинил-N-гидрокси-1H-пиразол-3-карбоксимидамид;
1-[2-бром-6-хлор-4-(трифторметил)фенил]-5-этиламино-4-метилсульфинил-N-гидрокси-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2-бром-6-хлор-4-(трифтормет)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-5-[2-(метилсульфинил)этиламино]-N-гидрокси-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[2-(метилсульфинил)этиламино]-N-гидрокси-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-5-[2-(этилсульфинил)этиламино]-N-гидрокси-1H-пиразол-3-карбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[(проп-2-инил)амино]-N-гидрокси-1H-пиразол-3-карбоксимидамид и
5-амино-1-[2-хлор-4-(трифторметил)фенил]-4-метилсульфинил-N-гидрокси-1H-пиразол-3-карбоксимидамид.
3. Пестицидная композиция, включающая соединение формулы (I), как определено в п.1, или его геометрические изомеры, таутомерные формы или пестицидно-активные соли и приемлемый в сельском хозяйстве инертный носитель.
4. Способ подавления вредителей в очаге, включающий применение к названному очагу пестицидно эффективного количества соединения формулы (I), определенного в п.1, или его геометрических изомеров, таутомерных форм или пестицидно-активных солей.
5. Способ получения соединения формулы (I) по п.1, где R1 представляет амино, включающий взаимодействие соединения формулы (II)
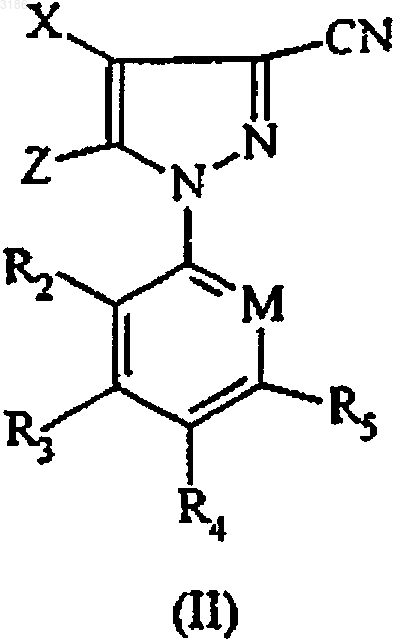
где X, Z, M, R2-R5 определены в п.1, с соединением формулы (III)

в которой Y определен в п.1.
6. Способ получения соединения формулы (I), по п.1, где R1 представляет амино, включающий взаимодействие соединения формулы (IV)
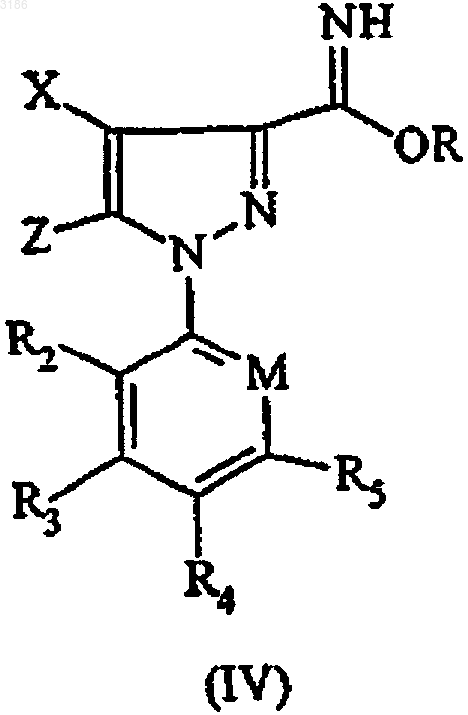
где X, Z, M, R2-R5 определены в п.1, a R представляет алкил, с соединением формулы (III)
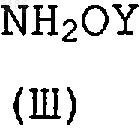
где Y такой, как определено в п.1.
7. Способ получения соединения формулы (I) по п.1, где R1 представляет алкиламино или диалкиламино, X, Z, M, R2-R5 определены в п.1, включающий взаимодействие соединения формулы I, где R1 представляет амино, с алкилирующим агентом, таким как R-Hal, где R представляет алкил и Hal является Cl, Br или I.
8. Способ получения соединения формулы (I) по п.1, где R1 представляет водород или алкил, X, Z, M, R2-R5 определены в п.1, включающий взаимодействие соединения формулы (V)

в которой R1 представляет водород или алкил, с соединением формулы (III)
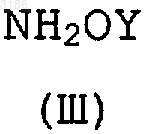
в которой Y такой, как определено в п.1.
9. Способ получения соединения формулы (I) по п.1, где R1 представляет водород или алкил, X, Z, M, R2-R5 определены в п.1, и Y такой, как определено в п.1, за исключением водорода, включающий взаимодействие соединения формулы (I), где Y представляет водород, с соответствующим алкилирующим или ацилирующим агентом или акцептором Михаэля.
10. Способ получения соединения формулы (I) по п.1, где Z представляет R12NH- или R13R14N-, в котором R12, R13 и R14 представляют алкил или C3-C6алкенил, необязательно замещенный R18, включая циклические аминосоединения формулы (I), включающий алкилирование соединения формулы (I), в котором Z представляет аминогруппу; или образование иминоэфира, с последующим его восстановлением; или путем присоединения по Михаэлю.
11. Способ получения соединения формулы (I) по п.1, в котором m равно 1 или 2, включающий окисление соответствующего соединения формулы (I), в котором m представляет 0 или 1.
12. Соединение формулы (I bis)
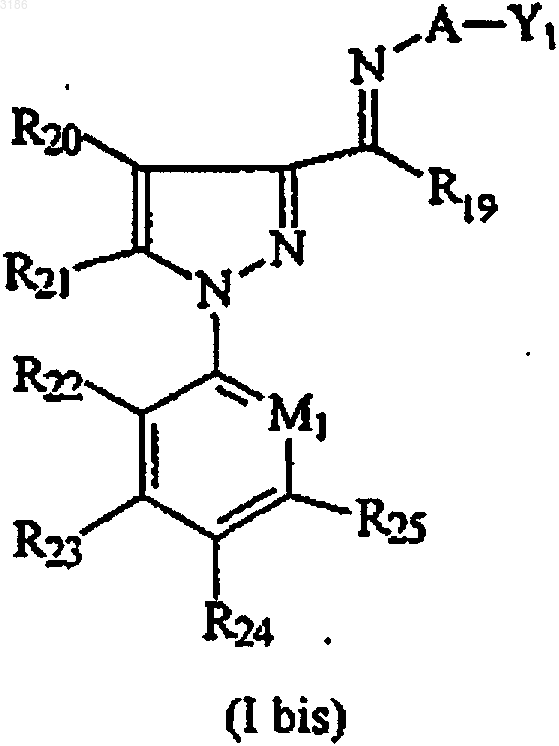
где A представляет NR26-;
Y1 представляет водород, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил,
-S(O)aR28, -P(O)R29R30, -P(S)R29R30, -Si(R31)(R32)(R33), C(O)R27, -C(S)R27, циано или нитро;
R19 представляет водород, алкил, галогеналкил или NR34R35;
R20 представляет -S(O)bR36 или R37;
R21 представляет водород, галоген, -C(O)R38, -S(O)cR39, алкил, галогеналкил, -OR40, -N=C(R41)(R42), алкенил, -NR43R44, 1H-пиррол-1-ил, 1H-пиразол-1-ил или -CH=NH;
R22, R23 и R25 независимо друг от друга выбраны из водорода, галогена или алкила;
R24 представляет галоген, галогеналкил, галогеналкокси, -S(O)dR45 или SF5;
R26 представляет водород или необязательно замещенный алкил;
R27 представляет водород, необязательно замещенный алкил C1-C20, необязательно замещенный арил, -OR46, -NR47R48 или -SR49;
R28 представляет необязательно замещенный алкил или необязательно замещенный арил;
R29 и R30 независимо друг от друга выбраны из алкокси и тиоалкокси;
R31, R32 и R33 независимо друг от друга выбраны из алкила, галогеналкила и арила;
R34 и R35 независимо друг от друга выбраны из водорюфр или необязательно замещенного алкила;
R36 представляет алкил, алкенил, алкинил или C3-C6циклоалкил, каждый из которых необязательно замещен одним или более галогенами;
R37 представляет алкил или галогеналкил;
R38 представляет водород, алкил; галогеналкил, алкокси или тиоалкокси;
R39 представляет алкил, галогеналкил или арил;
R40 и R41 независимо друг от друга выбраны из водорода, алкила или галогеналкила;
R42 представляет алкил, галогеналкил, алкокси или фенил, каждый из которых необязательно замещен одной или более группами, выбранными из гидрокси, галогена, алкокси, CN, алкила, -S(O)eалкила;
R43 и R44 независимо друг от друга выбраны из водорода, NH2, -S(O)fR50, -C(O)R51, необязательно замещенного алкенила или алкинила; или R43 и R44 могут вместе образовывать двухвалентный алкиленовый радикал, который может прерываться одним или более гетероатомами, предпочтительно выбранными из кислорода, азота или серы;
R45 представляет галогеналкил;
R46 и R49 независимо друг от друга выбраны из необязательно замещенного алкила и необязательно замещенного арила;
R47 и R48 независимо друг от друга выбраны из водорода, необязательно замещенного алкила и необязательно замещенного арила; или R47 и R48 могут вместе образовывать двухвалентный алкиленовый радикал, который может прерываться одним или более гетероатомами;
R50 представляет необязательно замещенный алкил;
R51 представляет водород, алкил, галогеналкил, арил, алкенил, -OR52, -SR53 или -NR54R55;
R52 и R53 независимо друг от друга выбраны из алкила и галогеналкила;
R54 и R55 независимо друг от друга выбраны из водорода, алкила, галогеналкила и арила;
a, b, c, d, e и f независимо друг об друга равны нулю, одному или двум;
M1 представляет C-галоген, C-CH3, C-CH2F, C-CH2Cl, C-NO2 или N; причем если не оговорено иначе, все указанные выше группы алкила включают 1-6 атомов углерода, алкенила 3-4 атомов углерода, алкинила 3-5 атомов углерода, циклоалкила 3-8 атомов углерода, арила 4-8 атомов углерода или их пестицидно-приемлемые соли.
13. Соединение по п.12, где соединения формулы (I bis) обладают одним или большим количеством следующих признаков, когда
А представляет -NR26-;
Y1 представляет водород, алкил или -C(O)R27;
R19 представляет NH2;
R20 представляет -S(O)bR36;
R21 представляет -NR43R44;
R22 представляет галоген;
R23 и R25 представляют водород;
R24 представляет галогеналкил;
R27 представляет алкил или O-алкил;
или M представляет C-галоген.
14. Соединение по пп.1-2, где соединение формулы (I) представляет
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(этилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(пропилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(2-метилэтенилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(бензоилокси)-1H-пиразолкарбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-5-метиламино-4-метилсульфинил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфонил-N-(2-ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(гептилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфонил-N-(гептилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфенил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфенил-N-(гептилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилсульфинил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-5-формиламино-4-этилсульфенил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(гексилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(пентилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(бутилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфенил-N-(циклопентилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(циклопентилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(трет-бутилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(изопропилкарбонилокси)-1H-пиразолкарбоксимидамид;
1-[2,6-дихлор-4-(трифторметил)фенил]-5-формиламино-4-этилсульфинил-N-(ацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(хлорацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(бромацетилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(1-этилпропилкарбонилокси)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-[(3-ацетилокси)фенилкарбонилокси]-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-гидрокси-4-трифторметилсульфонил-1H-пиразол-3-карбоксимидамид или
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-гидрокси-4-трифторметилсульфенил-1H-пиразол-3-карбоксимидамид.
15. Соединение по пп.12-13 или 8, где соединение формулы (I bis) представляет
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-амино-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(изопропилкарбонил)амино-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(н-гептакарбонил)амино-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(этоксикарбонил)амино-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилсульфинил-N-амино-1H-пиразол-3-карбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-N-амино-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилсульфинил-N-ацетиламино-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(1-метилэтенилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(трет-бутилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(2-метилэтенилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(этилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(пропилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(1-этилпропилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(бутилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(пентилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(гексилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-N-ацетиламино-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-хлорацетиламино-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(тридецилкарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(н-пропоксикарбониламино)-1H-пиразолкарбоксимидамид;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(1,1-диметилпропилоксикарбониламино)-1H-пиразолкарбоксимидамид или
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(трет-бутилоксикарбониламино)-1H-пиразолкарбоксимидамид.
16. Пестицидная композиция, включающая соединение формулы (I bis), как определено выше в п.12, или его пестицидно приемлемые соли.
17. Способ подавления вредных насекомых в очаге, включающий нанесение на указанный очаг пестицидно эффективного количества соединения формулы (I bis), как определено выше в п.12, или его пестицидно приемлемых солей.
Текст
1 Настоящее изобретение относится к новым оксимам 1-арилпиразолкарбоксальдегида, их композициям и производным. Оно относится к их неожиданной и полезной системной инсектицидной активности. В особенности изобретение относится к композициям названных соединений и к способам, в которых используются названные композиции для подавления артроподов (клещей), нематодов (круглых червей),гельминтов или протозойных вредителей, в частности, для применения названных соединений или композиций в сельскохозяйственных работах, в особенности в качестве пестицидов, для подавления артроподов, главным образом насекомых, путем системной обработки. Контроль за насекомыми, нематодами или гельминтами с помощью активного вещества,имеющего 1-арилпиразольную группу, описан во многих патентах или патентных заявках, таких как публикация патентной заявкиWO 93/06089 (и аналогичный патент США 5451598), WO 94/2106 и WO 87/03781, а также европейские патентные публикации 0295117, 659745, 679650, 201852 и 412849, патент ГерманииDE 19511269 и патент США 5232940. Другие соединения раскрыты в WO 92/13451, 20 августа 1992 г., принадлежащиеSobering Agrochemicals Ltd., которая описывает 5-хлор-1-[2,6-дихлор-4-(трифторметил)фенил]4-(4,5-дициано-1 Н-имидазол-2-ил)-3-гидроксииминометил-1 Н-пиразол как промежуточное вещество, также обладающее активностью против единичных видов Lucilla sercata, муха Цеце. Данная ссылка на патент, принадлежащийSobering Agrochemicals Ltd., оказалась единственной ссылкой, описывающей соединения 1 арилпиразолоксима, как инсектицидные. Целью настоящего изобретения является предложение новых пестицидных соединений группы 1-арилпиразола одновременно со способом их получения. Второй целью настоящего изобретения является предложение пестицидных композиций и пестицидных способов применения пестицидных соединений пиразола против артороподов,в особенности насекомых, нематод растений,гельминтов или протозойных паразитов, в особенности на сельскохозяйственных или садовых культурах, в лесоводстве, ветеринарии или животноводстве, или в сфере общественного здоровья. Третьей целью настоящего изобретения является предложение очень активных соединений с широким спектром пестицидной активности, а также соединений с выбранной специфической активностью, например, афицидные,митицидные, лиственные инсектицидные, почвенные инсектицидные и нематодоцидные, системные, препятствующие поеданию или проявляющие пестицидную активность через обработку семян. 2 Четвертой целью настоящего изобретения является предложение соединений со значительно повышенной и более быстрой активностью, направленной главным образом против насекомых, и более конкретно против насекомых в их личиночных стадиях развития. Пятой целью настоящего изобретения является предложение соединений со значительно улучшенным (более сильным и быстрым) проникновением в различные виды вредителей (паразитов) при их местном применении, что обеспечивает усиление продвижения соединения в область(и) пестицидной активности внутри вредителя. Еще одной целью настоящего изобретения является предложение соединений с высокой активностью и улучшенной безопасностью как для пользователя, так и для окружающей среды. Эти и другие цели данного изобретения будут очевидны из подробного описания настоящего изобретения. Данные аспекты изобретения будут встречаться полностью или частично по ходу текущего изобретения. Данное изобретение описывает новые химические композиции для системного применения и способы обработки растений данными композициями, обладающими инсектицидной или нематодоцидной системной активностью,следующей формулы (I): где Х представляет -S(O)mR6 или R7,Y представляет водород; С 1-C4 алкил или циклоалкил, содержащий до 4 атомов углерода,каждый из которых возможно замещен аминокарбонилом, C1-С 6 алкилсульфонилом, С 1-С 6 алкокси, C1-C6 алкоксикарбонилом, C1-С 6 алкилкарбонилом, циано или нитро; С 3-С 4 алкенил; С 3 С 5 алкинил; C1-С 6 алкилкарбонил; замещенный или незамещенный С 4-С 8 ароил; С 4-С 8 арилС 1 С 6 алкилкарбонил; C1-C6 алкилсульфонил; С 1 С 6 алкоксикарбонилС 1-С 6 алкилкарбонил; галогенС 1-С 6 алкилкарбонил; N-C1-С 6 алкилкарбамоил; C1-C6 алкоксикарбонил; С 4-С 8 арилоксикарбонил; С 1-С 6 алкоксиС 1-С 6 алкилкарбонил; альфагидроксиС 4-С 8 арилС 1-С 6 алкилкарбонил; гидроксиС 1-С 6 алкилкарбонил; аминоС 1-С 6 алкилкарбонил; С(=O)S-C1-С 6 алкил и триС 1-С 6 алкилсилил;R2 представляет водород или галоген;R6 представляет C1-С 6 алкил или галогенС 1 С 6 алкил,R7 представляет С 1-С 6 алкил или галогенС 1 С 6 алкил;R12, R13 и R14 одинаковые или различные и представляют R7S(O)r, С 3-С 6 алкинил или C1 С 6 алкоксикарбонил; или С 1-С 6 алкил, С 3 С 6 алкенил или -С(O)С 1-С 6 алкил, где алкильные или алкенильные части необязательно замещены одним или более R18;R15 и R16 независимо представляют водород или C1-С 6 алкил;m, r и s равны нулю, одному или двум; М представляет С-галоген или N; их геометрические изомеры, таутомерные формы и пестицидно-активные соли. Под термином пестицидно-активные соли понимают соли, анионы и катионы которых известны и применяются в настоящем уровне техники для образования пестицидноприемлемых солей. Подходящие соли присоединения кислот, образованные из соединений формулы (I), содержащих аминогруппу, включают соли с неорганическими кислотами, например гидрохлориды, фосфаты, сульфаты и нитраты, и соли с органическими кислотами,например ацетаты. Подходящие соли присоединения оснований, образованные из соединений формулы (I), содержащих группу карбоновой кислоты, включают соли щелочных металлов(например, натрия или калия), аммониевые соли и соли с органическими аминами (например,диэтаноламином или морфолином). Соединения формулы (I), где R1 представляет -NR15R16, в которых R16 представляет водород и R15 представляет водород или алкил, могут существовать в таутомерных формах, как показано в формуле (Iа) и (Ib). Подобная таутомерия хорошо известна, поскольку описана вAmides and Imidates, Vol 2, 1991, pages 276-277). Понятно, что все подобные таутомерные формы охватываются настоящим изобретением. Если не определено другое, алкильные, алкокси и алкилтиогруппы содержат от одного до шести (предпочтительно от одного до четырех) атомов углерода, алкенильные группы содержат от двух до шести (предпочтительно от двух до четырех) атомов углерода, и алкинильные группы содержат от трех до шести (предпочтительно три или четыре) атомов углерода. Циклоалкильные группы содержат от 3 до 8 атомов углерода,предпочтительно от 5 до 7 атомов углерода. Под термином арил понимают моно- или полициклические ароматические остатки, предпочтительно включающие фенильную, пиридильную, пиримидинильную, фурильную и нафтильную группы. Понятно, что кольца, образованные двухвалентными алкиленовыми радикалами, включающими атом азота, с помощью которого они соединяются, представляют собой 5-, 6- и 7-членные кольца. В данном изобретении некоторые слова используются в особом смысле. Термин аминокарбонил означает карбамоильный радикал, который является радикалом формулы -C(O)NH2. Точно так же, термин алкиламинокарбонил означает алкилкарбамоильный радикал, который представляет радикал-С(О)-NН-алкил; и термин диалкиламинокарбонил означает диалкилкарбамоильный радикал формулы -С(O)-N(алкил)2, в котором алкильные остатки могут быть одинаковыми или различными. Термин аминосульфонил означает сульфамоильный радикал, представляющий -SO2NH2. Подобным же образом термин алкиламиносульфонил означает алкилсульфамоильный радикал, формулы -SO2NН-алкил; в то время как термин диалкиламиносульфонил означает диалкилсульфамоильный радикал, имеющий формулу -SO2N(алкил)2, где алкильные остатки могут быть одинаковыми или различными. Термин галоген перед названием радикала означает, что данный радикал частично или полностью галогенирован, т.е. замещен F, Cl, Вr или I в любом сочетании, предпочтительно F или Cl. Термин галоген означает F, Cl, Вr илиI. Когда название любого заместителя повторяется, оно сохраняет то же значение, пока не определено что-то другое. Термин ароил обозначает карбонильный ароматический радикал,который представляет арил-С(О)-, который предпочтительно представляет собой бензоил, 5 необязательно замещенный одной или более алкильными, алкокси или галогеновыми группами. Соединения, в которых Z представляет амино, R12NH- или R13R14N, наиболее предпочтительны. Соединения, в которых Х представляетR1 предпочтительно представляет амино или водород;R6 предпочтительно представляет алкил; особенно предпочтительно метил или этил;R4 предпочтительно представляет галогеналкил, галогеналкокси или SF5; особенно предпочтительным является трифторметил; М предпочтительно представляет Сгалоген или N;Y предпочтительно представляет водород или алкоксикарбонил; Предпочтительные фенильные группы или пиридильные группы, включающие радикалыR2-R5 и М в формуле (I), представляют собой 2,6-дихлор-4-трифторметилфенил; 2,6-дихлор-4-трифтормеоксифенил; 2-бром-6-хлор-4-трифторметилфенил; 2-бром-6-хлор-4-трифторметоксифенил; 2,6-дифтор-4-трифторметилфенил; 2-хлор-4-трифторметилфенил; 3-хлор-5-трифторметил-2-пиридинил; 3-хлор-5-трифторметокси-2-пиридинил; 2-бром-6-фтор-4-дифторметилфенил; 2-хлор-6-фтор-4-трифторметилфенил; 2,6-дибром-4-трифторметилфенил; 2,6-дибром-4-трифторметоксифенил и 2,6-дихлор-4-пентафтортиофенил. Предпочтительный класс соединений формулы (I) представляет такие соединения, где Х представляет -S(O)mR6;R6 представляет метил или этил, необязательно замещенный F, Cl или Вr; М представляет ССl, CF, СВr или N;R12, R13 и R14 представляют СF3S(O)r-, алкинил или алкоксикарбонил; или алкил, алкенилС 3-С 6 или -С(О)алкил,где алкильные и алкенильные части необязательно замещены одним или более R18;R18 представляет циано, нитро, алкокси,галогеналкокси, -С(O)R7, R8S(O)s-, -C(O)OR9,аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, галоген, гидрокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил. Еще одним предпочтительным классом соединений формулы (I) являются соединения, гдеR6 представляет необязательно галогенированный метил или этил;R8 представляет алкил или фенил; и М представляет С-Сl, С-Вr или N. В соответствии с другим аспектом изобретения Y может представлять остаток сахара; предпочтительно Y представляет кольцо, содержащее 4, 5 или 6 атомов углерода, которые прерываются атомом кислорода, замещенными одной или более гидроксильными группами,одной или более группами СН 2 ОН или одной или более ОС(О)алкильными группами. Настоящее изобретение также предлагает арилпиразолы следующей формулы (I bis)R22, R23 и R25 независимо друг от друга выбраны из водорода, галогена или алкила;R26 представляет водород или необязательно замещенный алкил;R28 представляет необязательно замещенный алкил или необязательно замещенный арил;R29 и R30 независимо друг от друга выбраны из алкокси и тиоалкокси;R31, R32 и R33 независимо друг от друга выбраны из алкила, галогеналкила и арила;R34 и R35 независимо друг от друга выбраны из водорода или необязательно замещенного алкила;R36 представляет алкил, алкенил, алкинил или С 3-С 6 циклоалкил, каждый из которых необязательно замещен одним или более галогенами;R37 представляет алкил или галогеналкил;R40 и R41 независимо друг от друга выбраны из водорода, алкила или галогеналкила;R42 представляет алкил, галогеналкил, алкокси или фенил, каждый из которых необязательно замещен одной или более группами, выбранными из гидрокси, галогена, алкокси, CN,алкила, -S(О)eалкила;R43 и R44 независимо друг от друга выбраны из водорода, NH2, -S(O)fR50, -C(O)R51, необязательно замещенного алкенила или алкинила; или R43 и R44 могут вместе образовывать двухвалентный алкиленовый радикал, который может прерываться одним или более гетероатомами, предпочтительно выбранными из кислорода,азота или серы;R46 и R49 независимо друг от друга выбраны из необязательно замещенного алкила и необязательно замещенного арила;R47 и R48 независимо друг от друга выбраны из водорода, необязательно замещенногоR47 и R48 могут вместе образовывать двухвалентный алкиленовый радикал, который может прерываться одним или более гетероатомами;R50 представляет необязательно замещенный алкил;R52 и R53 независимо друг от друга выбраны из алкила и галогеналкила;R54 и R55 независимо друг от друга выбраны из водорода, алкила, галогеналкила и арила; а, b, с, d, e и f независимо друг от друга равны нулю, одному или двум;M1 представляет С-галоген, С-СН 3, CCH2F, C-CH2Cl, C-NO2 или N; причем если не оговорено иначе, все указанные выше группы алкила включают 1-6 атомов углерода, алкенила 3-4 атомов углерода, алкинила 3-5 атомов углерода, циклоалкила 3-8 атомов углерода, арила 48 атомов углерода или их пестицидно-приемлемые соли. Предпочтительной группой соединений формулы (I bis) являются соединения с одним или большим количеством следующих признаков, когда А представляет -NR26-;R19 представляет водород или NH2;R27 представляет алкил или O-алкил; или М представляет С-галоген; Другой предпочтительной группой соединений формулы (I bis) являются такие соединения, где А представляет собой -NR26-;R19 представляет водород или NH2;R27 представляет алкил или О-алкил; и М представляет из себя С-галоген. В соединениях формулы (I bis) предпочтительно под термином замещенный понимают замещение одним или более заместителями,включающих галоген, гидрокси, алкилтио, циано,карбокси,-C(O)алкил,-С(О)Оалкил,-С(O)NН 2, -С(О)NНалкил, -С(О)N(алкил)2, арил,нитро, азидо, амино, алкиламино, диалкиламино, алкилсульфенил, алкилсульфинил, алкилсульфонил, арилокси, арилтио, алкилкарбони 9 ламино, алкилкарбонилокси или арилоксикарбонил. Среди соединений общей формулы (I) или(I bis) присутствуют следующие конкретные предпочтительные соединения, которые обеспечивают практически применимый контроль за различными видами насекомых при их системном применении. Нумерация соединений дана только для удобства ссылок. 1) оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида; 2) оксим 1-[2,6-дихлор-4-(трифторметил) фенил]-5-этиламино-4-метилсульфинил-1 Нпиразол-3-карбоксальдегида; 3) оксим 1-[2,6-дихлор-4-(трифторметил) фенил]-5-метиламино-4-метилсульфинил-1Hпиразол-3-карбоксальдегида; 4) оксим 5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксальдегида; 5) оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-1Hпиразол-3-карбоксальдегида; 6) оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилтио-1Hпиразол-3-карбоксальдегида; 7) оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-дифторметилтио-1Hпиразол-3-карбоксальдегида; 8) оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилтио-1 Н-пиразол-3 карбоксальдегида; 9) О-(метил)оксим 5-амино-1-[2,6-дихлор 4-(трифторметил)фенил]-4-трифторметилтио 1 Н-пиразол-3-карбоксальдегида; 10) 12 56) 1-[2,6-дихлор-4-(трифторметил)фенил]-5-этиламино-N-гидрокси-4-метилсульфинил-1 Н-пиразол-3-карбоксимидамид; 57) 1-[2,6-дихлор-4-(трифторметил)фенил]-5-[2-(этилсульфонил)этиламино]-N-гидрокси-4-метилсульфинил-1 Н-пиразол-3-карбоксимидамид; 58) 5-[2-(циано)этиламино]-1-[2,6-дихлор 4-(трифторметил)фенил]-N-гидрокси-4-метилсульфинил-1 Н-пиразол-3-карбоксимидамид; 59) 5-(аминокарбонилметиламино)-1-[2,6 дихлор-4-(трифторметил)фенил]-N-гидрокси-4 метилсульфинил-1 Н-пиразол-3-карбоксимидамид; 60) 1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[2-(фенилсульфонил) этиламино]-N-гидрокси-1 Н-пиразол-3-карбоксимидамид; 61) 5-амино-1-[2,6-дибром-4-(трифторметил)фенил]-4-метилсульфинил-N-гидрокси-1 Нпиразол-3-карбоксимидамид; 62) 1-[2-бром-6-хлор-4-(трифторметил) фенил]-5-этиламино-4-метилсульфинил-Nгидрокси-1 Н-пиразол-3-карбоксимидамид; 63) 5-амино-1-[2-бром-6-хлор-4-(трифтормет)фенил]-4-метилсульфинил-1 Н-пиразол-3 карбоксимидамид; 64) 1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-5-[2-(метилсульфинил) этиламино]-N-гидрокси-1 Н-пиразол-3-карбоксимидамид; 65) 1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[2-(метилсульфинил) этиламино]-N-гидрокси-1H-пиразол-3-карбоксимидамид; 66) 1-[2,6-дихлор-4-(трифторметил)фенил]-4-этилсульфинил-5-[2-(этилсульфинил) этиламино]-N-гидрокси-1 Н-пиразол-3-карбоксимидамид; 67) 1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[(проп-2-инил)амино]-N-гидрокси-1 Н-пиразол-3-карбоксимидамид; 68) 5-амино-1-[2-хлор-4-(трифторметил) фенил]-4-метилсульфинил-N-гидрокси-1 Нпиразол-3-карбоксимидамид. Другие соединения формулы (I bis), которые предлагает настоящее изобретение, включают 69) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-амино-1 Нпиразол-3-карбоксимидамид; 70) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(изопропилкарбонил)амино-1 Н-пиразол-3-карбоксимидамид; 71) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(н-гептакарбонил)амино-1 Н-пиразол-3-карбоксимидамид; 72) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(этоксикарбонил)амино-1 Н-пиразол-3-карбоксимидамид; 15 112) 1-[2,6-дихлор-4-(трифторметил)фенил]-5-формиламино-4-этилсульфинил-N(ацетилокси)-1H-пиразолкарбоксимидамид; 113) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(хлорацетилокси)-1H-пиразолкарбоксимидамид; 114) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(бромацетилокси)-1H-пиразолкарбоксимидамид; 115) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-(1-этилпропилкарбонилокси)-1H-пиразолкарбоксимидамид; 116) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-N-[(3-ацетилокси)фенилкарбонилокси]-1H-пиразолкарбоксимидамид; 117) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-гидрокси-4-трифторметилсульфонил-1H-пиразол-3-карбоксимидамид или 118) 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-гидрокси-4-трифторметилсульфенил-1 Н-пиразол-3-карбоксимидамид. Соединения формулы I могут быть получены в соответствии со способом промышленного получения, описанного в публикации международного патентаWO 94/21606 и WO 93/06089 или WO 97/03781, также в публикации европейского патента 0295117 и Hatton et al. патента США 5232940. Квалифицированные специалисты смогут выбрать из известных способов подходящий исходный реагент и использовать для получения соответствующего желательного продукта. Понятно, что в описании следующего способа последовательность введения различных групп в пиразольное кольцо может быть различной, и могут требоваться подходящие защитные группы, что очевидно для специалистов в данной области. В последующем описании способа, когда символы, представленные в формуле, специально не определены, понятно, что указанные символы такие, "как определено выше" в соответствии с первым определением каждого символа в детальном описании изобретения. В соответствии с еще одной формой осуществления настоящего изобретения соединения общей формулы (I), где R2, R3, R4, R5, М, X,Y и Z такие, как определено выше, и R1 представляет амино (а именно соединения формулы(Iа) или (Ib), в которых R1 представляет водород), могут быть получены путем взаимодействия соединения формулы (II) где Y такой, как определено выше. Реакция в общем проводится с использованием соли кислоты соединения (III), например хлористоводородной соли, в присутствии основания, например пиридина или карбоната щелочного металла (такого как карбонат натрия), или ацетата щелочного металла (такого как ацетат натрия),или ацетата аммония в растворителе, таком как метанол и/или вода при температуре от 0 до 100 С. В соответствии со следующей формой осуществления настоящего изобретения соединения общей формулы (I), где R2, R3, R4, R5, М,X, Y и Z такие, как определено выше, и R1 представляет амино, могут быть получены путем реакции соединения формулы (IV) где R представляет алкил, с соединением формулы (III), в котором R представляет алкил, и Y такой, как определено выше. Реакцию обычно проводят с использованием соли кислоты соединения (III), например хлористо-водородной соли, и необязательно в присутствии основания,например пиридина или карбоната щелочного металла (такого как карбонат натрия), или ацетата щелочного металла (такого как ацетат натрия), или ацетата аммония в растворителе, таком как метанол и/или вода, при температуре от 0 до 100 С. В соответствии с еще одной формой осуществления настоящего изобретения соединения общей формулы (I), где R2, R3, R4, R5, М, X,Y и Z такие, как определено выше, и R1 представляет алкиламино или диалкиламино, могут быть получены путем взаимодействия соединения формулы (I), где R1 представляет амино, с алкилирующим агентом предпочтительно формулы R-галоген, где R представляет алкил, и галоген является хлором, бромом или йодом. Реакция обычно проводится в присутствии сильного основания, такого как т-бутоксид калия или гидрид натрия, в растворителе, таком как тетрагидрофуран, при температуре от 0 до 100 С. В соответствии со следующей формой осуществления настоящего изобретения соединения общей формулы (I), где R2, R3, R4, R5, M,X, Y и Z такие, как определено выше, и R1 представляет водород или алкил, могут быть получены путем взаимодействия соединения формулы (V) в которой R1 представляет водород или алкил, с соединением формулы (III), в которой Y такой,как определено выше, и с проведением реакции в тех же условиях, какие использовались выше в реакции соединения формулы (II) с соединением формулы (III). В соответствии со следующей формой осуществления настоящего изобретения соединения общей формулы (I), где R2, R3, R4, R5, М,X, Y и Z такие, как определено выше, и R1 представляет водород или алкил, и Y такой, как определено выше, за исключением водорода (это исключение делается только по химическим причинам), могут быть получены путем взаимодействия соответствующего соединения формулы (I), где Y представляет водород, с соответствующим алкилирующим или ацилирующим агентом или акцептором Михаэля, обычно в присутствии основания, например, триэтиламина, в инертном растворителе, таком как дихлорэтан, при температуре от 0 до 100 С. В соответствии с еще одной стороной настоящего изобретения соединения общей формулы (I), где Z представляет R12NH- илиR13R14N-, в которых R12, R13 и/или R14 представляют -С(O)алкил, необязательно замещенный одним или более R18, могут быть получены путем ацилирования соответствующего соединения, где Z представляет амино, в соответствии со способами, описанными в одной или более международных публикацийWO 94/21606,WO 93/06089 и WO 87/03781, в публикации европейского патента 0295117 и в патенте США 5232940 Hatton et al. Для синтеза 5-алкиламино и диалкиламино соединений, где Z представляет R12NH- илиR13R14N-, в которых R12, R13 и R14 представляют алкил или алкенил С 3-C6, необязательно замещенный R18, включая циклическое аминосоединение (т.е. соединение, в котором R13 и R14 соединены вместе) формулы (I), подходят три основных способа. Первый способ включает непосредственное алкилирование соединенийпредшественников формулы (I), где Z представляет амино, с помощью алкилирующих агентов. Второй способ включает двухэтапный последовательный процесс с образованием иминоэфира и последующим восстановлением. Третий способ получения производится через присоединение конъюгата, например, типа Михаэля. Соединения формулы (I), где Z представляет R12NH- или R13R14N- в которых R12, R13 и/или R14 представляют R7S(O)r, формил, алки 003186 18 нил, алкоксикарбонил, алкилтиокарбонил или ароил, и R7 и r такие, как определено выше,можно получить способами, описанными в одной или большем количестве международных публикацийWO 94/21606, WO 93/06089, WO 87/03781, в публикации европейского патента 0295177 и в патенте США 5232940 Hatton etal. Соединения формулы (I), в которой Z представляет водород, галоген, амино, R12NHили R13R14N-, могут быть получены способами,описанными в одной или большем количестве международных публикацийWO 94/21606,WO 93/06089 и WO 87/03781, в публикациях европейских патентовЕР 0295117, ЕР 511845, ЕР 403309 и ЕР 403300 и патенте США 5232940 Hatton еt al. и в публикации патента ГерманииDE 19511269. Синтез соединений формулы (I) с более высокой степенью окисления, т.е. соединений, в которых m равно 1 или 2, может быть осуществлен путем окисления соответствующих соединений, в которых m равно 0 или 1. Промежуточные соединения формулы (II) могут быть получены известными способами(см., например, вышеперечисленные ссылки). Несколько соединений формулы (II) являются новыми и, являясь таковыми, составляют еще одну особенность настоящего изобретения. Промежуточные вещества формулы (IV),где R представляет алкил, могут быть получены путем реакции соединения формулы (II) со спиртом формулы ROH, где R представляет алкил. Спирт обычно применяется в избытке, как растворитель, но может присутствовать и сорастворитель, такой как тетрагидрофуран. Реакцию обычно проводят в присутствии основания,такого как алкоксид натрия, при температуре от 0 до 100 С. Промежуточные вещества формулы (V),где R1 представляет водород или алкил, могут быть получены известными способами, например, как описано в WO 8703781 и ЕР 295117. Например, где R1 представляет водород, их получают взаимодействием соответствующего соединения формулы (II) с гидридом диизобутилалюминия, и где R1 представляет алкил, путем взаимодействия соответствующего соединения формулы (II) с органометаллическим реагентом формулы R1Q, в котором Q представляет, например, Мg-Сl или литий, в инертном растворителе, таком как тетрагидрофуран. Соединения формулы (IV) и некоторые соединения формулы (V) являются новыми соединениями, и являясь таковыми составляют еще один аспект настоящего изобретения. Промежуточные вещества формулы (III) известны и могут быть получены известными способами. В соответствии с еще одной стороной настоящего изобретения соединения общей формулы (I bis), в которых R19 представляет амино, 19 могут быть получены путем взаимодействия соединения формулы (II bis) 20 творителе, как тетрагидрофуран при температуре от 0 до 10 С. В соответствии с еще одной стороной настоящего изобретения соединения общей формулы (I bis) с вышеприведенными определениями, где R19 представляет водород или алкил,могут быть получены путем реакции соединения формулы (V bis) с соединением формулы (III bis) в которой Y и А такие, как определено выше. Реакцию обычно проводят используя соль кислоты соединения А формулы (III bis), например, хлористо-водородной соли, в присутствии основания, например пиридина или карбоната щелочного металла (такого как карбонат натрия), или ацетата щелочного металла (такого как ацетат натрия), или ацетата аммония в таком растворителе, как метанол и/или вода, при температуре от 0 до 100 С. В соответствии с еще одной стороной настоящего изобретения соединения общей формулы (I bis), где R19 представляет амино, могут быть получены путем взаимодействия соединения формулы (IV bis) где R представляет алкил, с соединением формулы (III bis). Реакцию обычно проводят, используя соль кислоты соединения формулы (IIIbis), например хлористо-водородную соль, и необязательно в присутствии основания (например, пиридина или карбоната щелочного металла, такого как карбонат натрия) или ацетата щелочного металла (такого как ацетат натрия или ацетат аммония) в таком растворителе, как метанол и/или вода, и обычно при температуре от 0 до 10 С. В соответствии с еще одной стороной настоящего изобретения соединения общей формулы (I bis), где R19 представляет собой NR34R35,и где как R34, так и R35 являются необязательно замещенными алкилом, могут быть получены путем взаимодействия соответствующего соединения формулы (I), где R19 представляет амино, с алкилирующим агентом формулы Rгалоген, где R представляет алкил, и галоген представляет хлор, бром или йод, предпочтительно йод. Реакцию обычно проводят в присутствии сильного основания, такого как тбутоксид калия или гидрида натрия в таком рас в которой R19 представляет водород или алкил, с соединением формулы (III bis), определенной выше, и используя те же условия, которые применялись выше в реакции соединений формулы(II bis) с соединениями формулы (III bis). В соответствии с еще одной стороной настоящего изобретения соединения формулы (Ibis), где Y представляет -S(O)aR28, -P(O)R29R30,-P(S)R29R30, -Si(R31)(R32)(R33), -C(O)R27, -C(S)R27,циано или нитро, могут быть получены путем реакции соединения формулы (I bis), где Y1 представляет водород, с сульфенилирующим,сульфинилирующим, сульфоналирующим, фосфорилирующим, тиофосфорилирующим, силилирующим, ацилирующим или тиоацилирующим реагентом обычно в присутствии основания, такого как триэтиламин или карбонат натрия, и обычно в растворителе при температуре в пределах от -100 до 100 С. В соответствии с еще одной стороной изобретения для синтеза 5 алкиламино и диалкиламино соединений формулы (I bis), где R21 представляет R43NH- илиR43R44N-, в которых R43 и R44 представляют необязательно замещенный алкил или необязательно замещенный алкенил С 3 или С 6, подходят три основных способа. Первый способ включает непосредственное алкилирование алкилирующим агентом соединений-предшественников формулы (I bis), в которой R21 представляет амино. Второй способ включает двухэтапный последовательный процесс с образованием иминоэфиров и последующим восстановлением. Третий способ получения предусматривает присоединение конъюгата, например, типа Михаэля. Соединения формулы (II bis), где R2, R3,R4, R5, R6 и М такие, как описано выше, могут быть получены способами, описанными в одной или большем количестве следующих работ: WO 94/21606, WO 93/06089, WO 87/03781, WO 97/22593; публикациях европейского патента ЕР 0295117, ЕР 0511845, ЕР 0403309, ЕР 0403300,ЕР 352944, ЕР 780378; патентах США 5232940,5047550, 4918085; публикации патента Герма 21 нии 19511269; или способами, известными специалистам в данной области техники. Синтез соединений формулы (I bis) в высокоокисленном состоянии, т.е. соединений, в которых а, b, с, d, e или f равны 1 или 2, может быть осуществлен путем окисления соответствующих соединений, в которых эти варианты представляют 0 или 1. Промежуточные продукты формулы (IIbis) могут быть получены известными способами (см., например, вышеприведенные ссылки). Соед. No. 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 22 Соединения табл. 1 иллюстрируют некоторые предпочтительные соединения общей формулы (I), где R3 и R5 представляют водород, и которые могут быть получены вышеописанными методами или способами синтеза при выборе подходящих реагентов, условий и методик, широко известных и очевидных для специалистов в данной области техники. В табл. 1 Me обозначает метил, Et обозначает этил, и если индексы пропущены, они должны присутствовать, например, СН 2 означает СН 2. Примеры синтеза соединений Следующие примеры 1-17 и справочные примеры 1-24 иллюстрируют подробные способы синтеза и физические свойства характерных пестицидных соединений формулы (I) (и их химических промежуточных веществ) в соответствии с данным изобретением. Соединения,приведенные в примерах, и другие, полученные таким же образом, следуя подробной методике или другим описанным здесь методам и способам, показаны в табл. 2. Кроме того, для каждого соединения проведен один или большее количество спектроскопических анализов (1R H1 или F19 ЯМР, МС и т.д.) с целью характеристики соединения и определения его химической структуры. В последующих таблицах Me обозначает метил, Et обозначает этил, 2-Tolyl обо 24 значает 2-метилфенил, и С 2 Н обозначает этинил. Пример 1. Смесь 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3 карбоксальдегида (2,74 г), гидрохлорид гидроксиламина (0,99 г) и пиридина (1,68 г) перемешивают в метаноле при 46 С в течение 2,5 ч,выпаривают, промывают (водой) и кристаллизуют из этанола с получением оксима 5-амино 1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида(1,74 г) в виде белого твердого вещества с т.пл. 219-221 С (разрушение). Соединение 1. Таким же способом, какой применялся выше, получают следующие соединения, показанные в табл. 2. Таблица 2 25 Пример 2. Смесь 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилтио-1 Н-пиразол 3-карбоксальдегида (0,66 г), метоксиамина гидрохлорида (0,2 г) и пиридина перемешивают при комнатной температуре в течение 26 ч. Пиридин выпаривают и остаток растворяют в этилацетате/ацетонитриле, промывают 1% водной НСl, сушат (МgSО 4) и выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя гексаном/ этилацетатом, с получением O-метилоксима 5 амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4 трифторметилтио-1H-пиразол-3-карбоксальдегида (0,3 г) в виде белого твердого вещества с т.пл. 129-131 С. Соединение 9. Пример 3. Ацетил хлорид (0,27 мл) добавляют к раствору оксима 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида (1,0 г) и триэтиламина(0,56 г) в тетрагидрофуране при 0 С и смесь перемешивают в течение 1 ч. Растворитель выпаривают и остаток подвергают хроматографии на силикагеле, элюируя смесью дихлорметана/этилацетата 3:1 с получением O-(ацетил) оксима 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3 карбоксальдегида (0,83 г) в виде оранжевого твердого вещества с т.пл. 130-134 С. Соединение 10. Тем же способом, который применялся выше, также получают следующие соединения,показанные в табл. 3. Таблица 3 СоединениеТ.пл., С 11 107-110 12 165 13 52-54 14 205,5-206,5 15 171-173 91 156 92 205 93 112 94 149 95 192 96 194 97 127 98 127 99 112 100 26 киси водорода (1,38 мл) дигидрата вольфрамата натрия (0,17 г) в метаноле/уксусной кислоте перемешивают при 20 С в течение ночи, затем при 50 С в течение 4 ч и снова при 20 С в течение ночи. Добавляют воду и твердое вещество отфильтровывают, промывают водой и сушат с получением оксима 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфонил-1 Нпиразол-3-карбоксальдегида (0,93 г) с т.пл. 209,5-211 С. (разрушение). Соединение 16. Пример 5. Раствор оксима 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксальдегида (0,15 г) в этаноле добавляют к раствору этоксида натрия (0,025 г) в этаноле при 20 С с последующим добавлением подметана (0,023 мл). Реакцию контролируют с помощью ВЭЖХ и в течение последующих 24 ч трижды добавляют дополнительные эквивалентные количества подметана. Затем реакционную смесь концентрируют и распределяют между дихлорметаном и водой. Органический слой промывают водой, сушат (MgSO4) и концентрируют. Затем полученный продукт объединяют с сырым продуктом из другой идентичной полученной порции и хроматографируют на силикагеле, элюируя гексаном/этилацетатом с получением O-(метил)оксима 5-амино-1-[2,6 дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида (0,06 г) в виде желтого твердого вещества с т.пл. 80 С. Соединение 17. Пример 6. Смесь оксима 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксальдегида (1,5 г), метилизоцианата (0,705 г) диацетата дибутилолова (2 капли) перемешивают в дихлорметане при 20 С в закупоренной бутыли в течение 2 дней. Затем смесь распределяют между водой и дихлорметаном, органический слой сушат (Na2SO4) и выпаривают, остаток кристаллизуют из этилацетата/гексана с получением О-(N-метилкарбамоил)оксима 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида (1,22 г) с т.пл. 146147 С. Соединение 18. Пример 7. Смесь 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3 карбоксальдегида (5,15 г) и гемигидрохлорида карбоксиметоксиламина (5,83 г) перемешивают при 20 С в пиридине/метаноле в течение 17 ч. Метанол выпаривают и остаток промывают водой и подвергают флэш-хроматографии на силикагеле,элюируя уксусной кислотой/этилацетатом (1:9) с получением O(карбоксиметил)оксима 5-амино-1-[2,6-дихлор 4-(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксальдегида (1,44 г). Массспектрометрический анализ продукта показывает молекулярный вес 458. Соединение 19. 28 но раствором NaHCOs, 5% раствором НСl и раствором NaHCO3, сушат (MgSO4), фильтруют и выпаривают. Остаток очищают с помощью флэш-хроматографии на силикагеле с получением O-(трет-бутилдиметилсилил)оксима 5 амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4 метилсульфинил-1 Н-пиразол-3-карбоксальдегида (0,76 г) в виде легкого желтого твердого вещества с т.пл. 150-154 С. Соединение 21. Пример 10. К перемешиваемому раствору 1-[2,6 дихлор-4-(трифторметил)фенил]-5-формил-4 трифторметилтио-1 Н-пиразол-3-карбонитрила(3,0 г) в этаноле добавляют раствор гидроксиламина гидрохлорида (0,46 г) раствор карбоната натрия (0,9 г) в воде. Через час смесь выливают в воду, экстрагируют (этиловым эфиром), сушат(над сульфатом натрия) и выпаривают. Очищение с помощью колоночной хроматографии на силикагеле дает 1-[2,6-дихлор-4-(трифторметил) фенил]-5-формил-N-гидрокси-4-трифторметилтио-1 Н-пиразол-3-карбоксимидамид (0,255 г),т.пл. 72-75 С. Соединение 22. Следующие соединения, показанные в табл. 4, получают таким же образом. Пример 8. Трет-бутилнитрит (1,25 г) добавляют к оксиму 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида (2,0 г), в тетрагидрофуране и перемешивают в течение 4,5 ч. После выпаривания полученное в результате твердое оранжевое вещество растирают с четыреххлористым углеродом с получением оксима 1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксальдегида (0,24 г) с т.пл. 239240 С. Соединение 20. Пример 9. Раствор трет-бутилдиметилсилилхлорида(0,8 г) в N,N-диметилформамиде (ДМФ) добавляют к перемешиваемому раствору оксима 5 амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4 метилсульфинил-1 Н-пиразол-3-карбоксальдегида (2,0 г) в (ДМФ), с последующим добавлением по каплям раствора имидазола (0,72 г) в ДМФ в течение 7 мин. Смесь нагревают при 50 С в течение 3,5 ч и затем выдерживают при 20 С в течение 18 ч. Смесь растворяют (в воде),экстрагируют (метил-трет-бутиловым эфиром) и органическую фазу промывают последователь Таблица 4 Пример 11. Смесь 1-[2,6-дихлор-4-(трифторметил) фенил]-5-формил-4-трифторметилтио-1 Н-пиразол-3-карбонитрила (1,0 г), гидроксиламина гидрохлорида (0,48 г) и тригидрата ацетата натрия (0,94 г) в этаноле нагревают с обратным холодильником в течение одного часа. После охлаждения до 20 С смесь концентрируют и распределяют между водой и эфиром. Органическую фазу промывают (солевым раствором),сушат (над сульфатом магния) и выпаривают,получая 1-[2,6-дихлор-4-(трифторметил)фенил]N-гидрокси-5-гидроксииминометил-4-трифторметилтио-1 Н-пиразол-3-карбоксимидамид (0,5 г), т.пл. 68-72 С. Соединение 23. Пример 12. Суспензию этоксида натрия (0,34 г) в этаноле добавляют к перемешиваемому раствору оксима 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида (2,0 г) в этаноле. Затем добавляют 2-йодпропан (1 мл), смесь перемешивают в течение ночи при 20 С и выпаривают. Остаток(в дихлорметане) промывают водой, сушат (над сульфатом магния), концентрируют и очищают с помощью хроматографии на силикагеле, получаяO-(изопропил)оксим 5-амино-1-[2,6 дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегида (0,35 г),т.пл. 128-130 С. Соединение 24. Точно таким же способом получают следующие соединения: О-(этоксикарбонилметил)оксим 5-амино-1[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида,соединение 25, т.пл. 127-128 С; и О-(карбамоилметил)оксим 5-амино-1-[2,6 дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида, соединение 26, т.пл. 165-167 С. Пример 13. Точно таким же способом, который использовали в примере 12, оксим 5 амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4 метилсульфинил-1 Н-пиразол-3-карбоксальдегида, вступает в реакцию с этоксидом натрия и этилвинилсульфоном, давая O-[2-(этилсульфонил)этил]оксим 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1H-пиразол-3-карбоксальдегид, т.пл. 144-148 С. Соединение 27. Пример 14. Точно таким же способом, который использовали в примере 12, этаноловый раствор оксима 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегида, вступает в реакцию с этоксидом натрия и акрилонитрилом, давая O-(2 цианоэтил)оксим 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксальдегид. Соединение 28, как 85% (по весу) компонент смеси, содержащей 8% оксима исходного вещества. Массспектрометрический анализ продукта показал следующее: МС м/е = 453 (M+). Пример 15. 30% раствор перекиси водорода (0,32 мл) добавляют к раствору оксима 1-[2,6-дихлор-4(трифторметил)фенил]-5-метил-4-метилтио-1 Нпиразол-3-карбоксальдегида (0,8 г) в трифторуксусной кислоте при 20 С. Реакционный раствор распределяют между водой и дихлорметаном и органический слой сушат (сульфат магния), выпаривают подвергают флэш-хроматографии на силикагеле, элюируя дихлорметаном/этилацетатом (3:1), получая оксим 1-[2,6 дихлор-4-(трифторметил)фенил]-5-метил-4 метилсульфинил-1H-пиразол-3-карбоксальдегида (0,29 г), т.пл. 210-214 С (соединение 30) и оксим 1-[2,6-дихлор-4-(трифторметил)фенил]-5 метил-4-метилсульфонил-1 Н-пиразол-3-карбоксальдегида (0,2 г), т.пл. 211-212 С (соединение 31). Пример 16. К перемешиваемому раствору метилового эфира 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксимидовой кислоты (1,0 г) в безводном метаноле добавляют безводный метоксиламина гидрохлорид (0,2 г). После 4 ч при 20 С смесь выпаривают и добавляют дихлорметан и воду. Органический слой сушат (MgSO4), выпаривают и хроматографируют на колонке с Флорисилом,элюируя дихлорметаном/этилацетатом 3:1, получая 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-N-метокси-4-метилсульфинил-1H-пиразол-3-карбоксимидамид (0,28 г), т.пл. 140145 С. Соединение 49. Точно таким же способом получают 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-метокси-4-трифторметилсульфинил-1 Н-пиразол-3-карбоксальдегид, т.пл. 169-170 С (соединение 41) и 5-амино-1-[2,6 дихлор-4-(трифторметил)фенил]-N-гидрокси-4 трифторметилсульфинил-1 Н-пиразол-3-карбоксимидамид, т.пл. 222-224 С (соединение 40). Пример 17. Раствор 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-метокси-4-метилсульфинил-1 Н-пиразол-3-карбоксимидамида (0,5 г) в безводном THF" перемешивают 0-5 С и добавляют трет-бутоксид калия (0,13 г) и йодметан(0,081 мл). Спустя 3 ч добавляют еще третбутоксид калия (0,068 г) и йодметан (0,08 мл) при 0-5 С. Смесь перемешивают при этой температуре в течение 16 ч, выпаривают и остаток очищают с помощью хроматографии на силикагеле, элюируя дихлорметаном/этилацетатом 3:1,получая 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-N-метокси-N-метил-4-метилсульфинил-1 Н-пиразол-3-карбоксимидамид (0,13 г),т.пл. 139-142 С. Соединение 50. 31 Пример 18. Смесь 5-амино-3-циано-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразола (550 г), безводного гидразина (700 г) в абсолютном этаноле (1,55 л) перемешивают при температуре окружающей среды в течение 4 ч. Добавляют воду (6,5 л) и осадок отфильтровывают и промывают водой. Через 12 ч фильтруют другую порцию осадка. Все твердые вещества объединяют, получая 568 г соединения 69 в виде белого твердого вещества, т.пл. 210 С. Таким же способом получают соединение 73, т.пл. 170 С; соединение 74, т.пл. 193 С. Пример 19. Смесь соединения 69 (1,0 г) и уксусного ангидрида (327 мг) в п-диоксане (10 мл) перемешивают при комнатной температуре в течение 2 дней. Смесь выпаривают и остаток промывают гексаном с небольшим количеством этилацетата и суспензию фильтруют, получая 1,08 г соединения 75, т.пл. 230 С. Соединение 85 синтезируют, используя ту же методику. Пример 20. Смесь соединения 69 (0,2 г) и пропионового ангидрида (0,07 мл) в тетрагидрофуране (5 мл) перемешивают при комнатной температуре в течение 6 дней. Смесь выпаривают и остаток очищают с помощью хроматографии на силикагеле, получая 70 мг соединения 79, т.пл. 155-162 С. Таким же образом получают следующие соединения: Соединениет.пл. 76 95 77 160 70 118 78 160 79 155 80 160 81 110 82 118 83 152 84 130 71 122 86 масло(4,5 мл) перемешивают при комнатной температуре в течение 5 дней. Смесь выпаривают, остаток очищают с помощью хроматографии на силикагеле, получая 20 мг (0,038 ммоль) соединения 89, т.пл. 95-98 С. Следующие соединения синтезируют по такой же методике, используя соответствующие дикарбонаты: соединение 88, т.пл. 135 С; соединение 90, т.пл. 155 С; соединение 72, т.пл. 196 С. Пример 22. К суспензии 5-амино-3-циано-1-(2,6 дихлор-4-трифторметилфенил)-4-метилсульфинилпиразола (20 г) в метаноле (120 мл) добавляют гидроксиламина гидрохлорид (3,99 г), с последующим добавлением триэтиламина (8,0 мл). Смесь перемешивают при комнатной температуре в течение ночи и затем выпаривают. Остаток распределяют между водой и этилацетатом. Органический слой промывают водой, а затем солевым раствором. Органический слой сушат над безводным сульфатом натрия. Раствор концентрируют выпариванием растворителя. Дают образоваться осадку и собирают его фильтрацией. Твердое вещество промывают небольшим количеством этилацетата, получая соединение 44 (16,1 г), т.пл. 225-226 С. Справочный пример 1. Диизобутилалюминия гидрид (1 М в толуоле, 391 мл) добавляют по каплям в течение 1,5 ч к 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-3-карбонитрилу (50 г) в сухом ТГФ при -20 С. Частично выпаренную смесь затем гасят добавлением в ацетонитрил/воду при 0-5 С. Соли алюминия отфильтровывают, фильтрат выпаривают и остаток экстрагируют дихлорметаном. Экстракт сушат(MgSO4) и выпаривают, получая 5-амино-1-[2,6 дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбоксальдегид (47,1 г). Таким же образом получают следующие соединения, показанные в табл. 5.(b) используется без очистки в следующем этапе. М Справочный пример 2. 1,4 М раствор метиллития (31 мл) в этиловом эфире добавляют к перемешиваемому раствору 5-бром-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилтио-1 Н-пиразол-3-карбонитрила-65 С в течение 15 мин и оставляют нагреваться до 0 С в течение 3 ч. После повторного охлаждения до -65 С добавляют метилйодид (3,06 мл) в ТГФ в течение 3 мин, смесь нагревают до-20 С в течение 1,5 ч и затем распределяют между водным хлоридом аммония и дихлорметаном. Органическую фазу сушат (над сульфатом магния), выпаривают и очищают с помощью флэш-хроматографии на силикагеле, элюируя гексаном/метил-трет-бутиловым эфиром, получая 1-[2,6-дихлор-4-(трифторметил)фенил]-5 метил-4-метилтио-1 Н-пиразол-3-карбонитрил(6,2 г), обладающего 90,7% чистоты по площади пика при ВЭЖХ. Таким же образом также получают следующее соединение: 1-[2,6-дихлор-4-(трифторметил)фенил]-4 этилтио-5-метил-1H-пиразол-3-карбонитрил,т.пл. 79-82 С. Справочный пример 3. 30% перекиси водорода (1,82 мл) добавляют к перемешиваемому раствору 1-[2,6-дихлор 4-(трифторметил)фенил]-5-метил-4-метилтио 1 Н-пиразол-3-карбонитрила (6,2 г) в метаноле,содержащему катализатор i-PrOH/I-USO (5,31 мл), описанный Drabowicz et al., (выше) при 05 С. Смеси позволяют нагреться до 20 С в течение 17 ч. Дополнительное количество перекиси водорода (5,46 мл) добавляют в трех порциях в течение 24 ч вместе с катализатором (5 мл). После перемешивания в течение еще 60 ч добавляют воду,получая 1-[2,6-дихлор-4(трифторметил)фенил]-5-метил-4-метилсульфинил-1 Н-пиразол-3-карбонитрил (6,72 г) в виде желтого масла (91,7% чистоты по площади пика при ВЭЖХ), имеющей время удерживания 3,61 мин в 25,0 см 4,6-миллилитровой колонке SUPERCOSIL С-18,элюируя раствором СН 3 СN/Н 2 О (3:1) при скорости 1 мл/мин. Таким же образом также получают следующие соединения: 1-[2,6-дихлор-4-(трифторметил)фенил]-4 метилсульфинил-5-метил-1-Н-пиразол-3-карбонитрил, т.пл. 109-115 С; 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-[2-(фторэтил)сульфинил]-1-Н-пиразол-3-карбонитрил, т.пл. 182-183 С; 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(метилсульфинил)этиламино]-4-этилсульфинил-1-Н-пиразол-3-карбонитрил, т.пл. 106108 С из 1-[2,6-дихлор-4-(трифторметил) фенил]-5-[2-(метилтио)этиламино]-4-этилсульфинил-1-Н-пиразол-3-карбонитрила; 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(метилсульфинил)этиламино]-4-метилсульфинил-1-Н-пиразол-3-карбонитрил, т.пл. 114116 С из 1-[2,6-дихлор-4-(трифторметил)фенил]-5-[2-(метилтио)этиламино]-4-метилсульфинил-1-Н-пиразол-3-карбонитрила; 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(этилсульфинил)этиламино]-4-этилсульфинил-1-Н-пиразол-3-карбонитрил, т.пл. 138 35 140 С из 1-[2,6-дихлор-4-(трифторметил)фенил]-5-[2-(этилтио)этиламино]-4-этилсульфинил-1-Н-пиразол-3-карбонитрила; 5-амино-1-[3-хлор-5-(трифторметил)пирид-2-ил]-4-этилсульфинил-1-Н-пиразол-3 карбонитрил, т.пл. 150-152 С; и 5-амино-1-[2,6-дибром-4-(трифторметил) фенил]-4-метилсульфинил-1-Н-пиразол-3-карбонитрил, т.пл. 165-166 С. Справочный пример 4. 90% Третичный бутилнитрит (27,9 мл) медленно добавляют к перемешиваемому раствору 5-амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-этилтио-1-Н-пиразол-3-карбонитрила(49,8 г) в бромоформе (600 мл) при 0-5 С. Смесь перемешивают в течение 3 ч, во время чего она нагревается до 20 С, выпаривают и после добавления гексана/этилацетата (1:1) выпаривают еще раз, получая 5-бром-1-[2,6-дихлор-4(трифторметил)фенил]-4-этилтио-1-Н-пиразол 3-карбонитрил (32,65 г), показывающий 93,3% чистоты по площади пика при ВЭЖХ и время удерживания 11,2 мин на 25,0 см на колонке 4,6 мм SUPERCOSIL LC-18, элюируя раствором СН 3 СN/Н 2 О (3:1) при скорости 1 мл/мин. Таким же образом получают следующее соединение: 5-бром-1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилтио-1-Н-пиразол-3-карбонитрил,т.пл. 134-140 С. Справочный пример 5. Озон пробулькивают через раствор 1-(2,6 дихлор-4-трифторметилфенил)-5-(Е-2-(метоксикарбонилэтенил)-4-трифторметилтио-1-Н-пиразол-3-карбонитрил (36,6 г) в дихлорметане при- 78 С в течение 3 ч. Интенсивно синий раствор обесцвечивают газообразным кислородом, затем обрабатывают диметилсульфидом (19 мл) и дают нагреться до 20 С в течение 14 ч. Затем смесь промывают водой, сушат (надсульфатом магния), фильтруют и выпаривают, получая 1(2,6-дихлор-4-трифторметилфенил)-5-формил-4 трифторметилтио-1-Н-пиразол-3-карбонитрил в виде белых кристаллов (30,7 г), т.пл. 90 С. Справочный пример 6. 1,8-Диазобицикло-[5,40]-ундец-7-ен(13 мл) добавляют к раствору 5-(2-бром-2 карбометокси)этил-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтио-1 Н-пиразол-3-карбонитрил (45 г) в толуоле и перемешивают в течение 0,5 ч. Смесь разбавляют (этилацетат) и промывают водой, раствором хлористо-водородной кислоты, насыщенным раствором кислого карбоната натрия и солевым раствором. Органическую фазу сушат (сульфат магния), концентрируют и растирают с холодным пентаном, получая 1-(2,6-дихлор-4-трифторметилфенил)-5-(Е 2-метоксикарбонилэтенил)-4-трифторметилтио 1 Н-пиразол-3-карбонитрил в виде белого твердого вещества (36,6 г) т.пл. 90 С. 36 Справочный пример 7. Раствор 5-амино-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтио-1 Н-пиразол-3 карбонитрила (100 г) в ацетонитриле добавляют по каплям к смеси метилацетата (430 мл), бромида меди(II) (80 г) и 90% трет-бутилнитрита(51 мл) в ацетонитриле при 0 С, нагревают до 20 С и перемешивают в течение 12 ч. Смесь разбавляют (эфиром), промывают (водой), сушат (над сульфатом магния) и концентрируют. Растирание с гексаном дает 5-(2-бром-2 карбометокси)этил-1-(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтио-1 Н-пиразол-3 карбонитрил в виде белого твердого вещества(72,7 г) т.пл. 122 С. Справочный пример 8. К перемешиваемой суспензии 5-амино-1[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3-карбонитрила (5,0 г) в безводном метаноле добавляют 25% (вес./вес.) раствор метоксида натрия (8,95%) в метаноле при 20 С. Смесь перемешивают в течение 16 ч,охлаждают до 0 С и разбавляют охлажденным на льду безводным метанолом. Диоксид углерода помещают в раствор на 15 мин до получения рН 8. Осадок отфильтровывают, промывают(этилацетатом) и выпаривают, получая метиловый сложный эфир 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбоксимидовой кислоты (3,65 г). 1(с, 2 Н); 5,11 (шс, 2 Н); 3,93 (с, 3 Н); 2,94 (с, 3 Н). Таким же образом получают следующее соединение: метиловый сложный эфир 5-амино 1-[2,6-дихлор-4-(трифторметил)фенил]-4-трифторметилсульфинил-1H-пиразол-3-карбоксимидной кислоты, т.пл. 179-180 С. Справочный пример 9. К перемешиваемому раствору 4.4 дитиобис[5-амино-3-циано]-1-2,6-дихлор-4(трифторметил)фенил-1 Н-пиразола (1,0 г) в метаноле добавляют боргидрид натрия (0,03 г). Через 7 мин добавляют 1-бром-2-форэтан (0,05 мл). Еще пять порций боргидрида натрия (0,15 г) и 1-бром-2-фторэтана (0,25 мл) добавляют в течение 5 ч. Смесь выпаривают, добавляют дихлорметан и воду, и органическую фазу сушат(МgSO4) и снова выпаривают, получая 5-амино 1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2(фторэтил)тио]-1H-пиразол-3-карбонитрил (1,09 г) т.пл. 130-131,5 С. Таким же образом получают следующее соединение: 5-амино-1-[2,6-дихлор-4-(трифторметокси) фенил]-4-этилтио-1 Н-пиразол-3-карбонитрил,т.пл. 127-128 С. 4,4-дитиобис[5-амино-3-циано]-1-2,6-дихлор-4-(трифторметокси)фенил 1H-пиразол, используемый выше, может быть превращен таким же образом в 4,4-дитиобис[5 амино-3-циано]-1-2,6-дихлор-4-(трифторме 37 тил)фенил-1H-пиразол, как описано в патентных заявках Франции 8816710 и 8913371. Справочный пример 10. Таким же образом, как в примере 15, 5 амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4[2-(фторэтил)тио]-1 Н-пиразол-3-карбонитрил окисляют перекисью водорода в растворе трифторуксусной кислоты, получая 5-амино-1-[2,6 дихлор-4-(трифторметил)фенил]-4-[2-(фторэтил)сульфонил]-1 Н-пиразол-3-карбонитрил,т.пл. 192-193 С. Таким же образом получают следующие соединения: 5-амино-1-[2-бром-6-хлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3 карбонитрил, т.пл. 150-151 С; 5-амино-1-[2,6-дихлор-4-(трифторметокси) фенил]-4-метилсульфинил-1 Н-пиразол-3-карбонитрил, т.пл. 137-138 С; 5-амино-1-[2-хлор-4-(трифторметил) фенил]-4-метилсульфинил-1 Н-пиразол-3-карбонитрил, т.пл. 146-147 С. Справочный пример 11. Смесь 1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-5-амино-1 Н-пиразол 3-карбонитрила (5,0 г), триметилортоацетата(100 мл) и п-толуолсульфоновой кислоты (0,2 г) в толуоле нагревают до 145 С в течение 2 ч и затем при 130 С с дистилляцией метанола. Смесь выпаривают и остаток очищают с помощью колоночной хроматографии, используя 20% этилацетата в гексане, получая 1-[2,6 дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[1-(метоксиэтилен)амино]-1H-пиразол 3-карбонитрил (3,31 г), т.пл. 164-165 С. Справочный пример 12. К суспензии 1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-5-[(1-метоксиэтилен)амино]-1H-пиразол-3-карбонитрила (6,0 г) в метаноле добавляют боргидрид натрия (0,79 г) за три приема в течение 15 мин при 20 С, затем перемешивают под азотом в течение 45 мин. После выпаривания остаток очищают с помощью колоночной хроматографии на силикагеле,используя 15% этилацетата в метиленхлориде,получая 1-[2,6-дихлор-4-(трифторметил)фенил]4-метилсульфинил-5-этиламино-1 Н-пиразол-3 карбонитрил (1,1 г), т.пл. 130-131 С (разрушение). Таким же образом получают 1-[2,6-дихлор-4-(трифторметил)фенил]-5 метиламино-4-метилсульфинил-1 Н-пиразол-3 карбонитрил, т.пл. 147-150 С (разрушение). Таким же образом, но заменяя боргидрид натрия цианоборгидридом натрия, получают 1[2-бром-6-хлор-4-(трифторметил)фенил]-4 метилсульфинил-5-этиламино-1 Н-пиразол-3 карбонитрил, т.пл. 125-126,5 С. Справочный пример 13. Раствор 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилсульфинил-1 Н-пиразол-3 карбонитрила (4,92 г) в триэтилортоформиате(100 мл) нагревают с обратным холодильником в течение 2 ч, затем перемешивают при 20 С в 38 течение 16 ч и выпаривают. Растирание с кипящим гексаном дает 1-[2,6-дихлор-4-(трифторметил)фенил]-5-[(этоксиметилен)амино]-4 метилсульфинил-1 Н-пиразол-3-карбонитрил(4,05 г) т.пл. 93-95 С. Таким же образом можно получить следующее соединение: 1-[2-бром-6-хлор-4-(трифторметил)фенил]5-[(метоксиметилен)амино]-4-метилсульфинил 1 Н-пиразол-3-карбонитрил. Он непосредственно используется в следующей стадии. Справочный пример 14. К суспензии 35% гидрида калия в масле(0,7 г) в сухом N,N-диметилформамиде (ДМФ) добавляют раствор 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-(метилсульфинил)-1 Нпиразол-3-карбонитрил (10,0 г) в сухом ДМФ по каплям при 4 С в течение 10 мин. После перемешивания в течение 20 мин добавляют винилэтилсульфон (3,13 г) в сухом ДМФ в течение 5 ч при 4 С. Затем смесь перемешивают в течение ночи под азотом с нагреванием до 20 С. Хлорид аммония добавляют при 4 С, и смесь экстрагируют (этилацетатом), дважды промывают водой,сушат (сульфат натрия) и выпаривают. Кристаллизация из этилацетата/метанола/гексана дает 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(этилсульфонил)этиламино]-4-(метилсульфинил)-1H-пиразол-3-карбонитрил (4,08 г) т.пл. 131-132 С. Таким же образом можно получить следующие соединения: 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(цианоэтил)амино]-4-(метилсульфинил)-1Hпиразол-3-карбонитрил, т.пл. 55-57 С; 1-[2,6-дихлор-4-(трифторметил)фенил]-4 метилсульфинил-5-[2-(фенилсульфонил)этиламино]-1H-пиразол-3-карбонитрил, т.пл. 138139 С; и 1-[2-хлор-4-(трифторметил)фенил]-5-[2(этилсульфонил)этиламино]-4-(метилсульфинил)-1H-пиразол-3-карбонитрил, т.пл. 139140 С. Справочный пример 15. К раствору 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбонитрила (0,5 г) в ацетонитриле добавляют 2-бромацетамид (0,18 г) в воде и карбонат кальция (0,13 г). Смесь нагревают с обратным холодильником в течение 1,5 ч, охлаждают до 25 С и добавляют раствор гидроксида натрия (0,05 г) в воде. Затем смесь нагревают с обратным холодильником в течение одного часа, выпаривают и остаток очищают с помощью препаративной тонкослойной хроматографии,элюируя сначала 20% метанолом в дихлорметане, получая 1-[2,6-дихлор-4-(трифторметил) фенил]-4-метилсульфинил-5-[(аминокарбонилметил)амино]-1H-пиразол-3-карбонитрил (0,089 г) т.пл. 155-157 С. Справочный пример 16. К суспензии 5 амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-метилсульфинил-1 Нпиразол-3-карбонитрил (2 г) в толуоле добавля 39 ют метилмагнийбромид (7 мл 1,4 М раствора в толуоле/ТГФ). Смесь перемешивают при 20 С(1 ч) и нейтрализуют насыщенным раствором хлорида аммония. Органический слой сушат(1,4 г) в сухом N,N-диметилформамиде (ДМФ) добавляют раствор 1-[2,6-дихлор-4-(трифторметил)фенил]-5-амино-4-(этилсульфинил)-1 Нпиразол-3-карбонитрил (5,0 г) в сухом ДМФ при 4 С и перемешивают в течение 40 мин, 2 хлорэтилметилсульфид (1,39 г) добавляют при 4 С и перемешиваемой смеси позволяют нагреться до 20 С в течение 40 мин, затем нагревают до 50 С в течение 4 ч и до 20 С в течение 3 дней. Добавляют раствор хлорида аммония и этилацетат и органический слой сушат (над сульфатом магния), выпаривают и очищают с помощью колоночной хроматографии, используя 80% метил-т-бутиловый эфир в гексане, получая 1-[2,6-дихлор-4-(трифторметил)фенил]-52-(метилтио)этил]амино]-4-(этилсульфинил)1H-пиразол-3-карбонитрил (0,26 г) т.пл. 126127 С. Таким же образом можно получить 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(метилтио)этиламино]-4-метилсульфинил 1 Н-пиразол-3-карбонитрил, т.пл. 111-113 С. 1-[2,6-дихлор-4-(трифторметил)фенил]-5[2-(этилтио)этиламино]-4-этилсульфинил-1Hпиразол-3-карбонитрил, т.пл. 27,5-29 С. 1-[2,6-дихлор-4-(трифторметил)фенил]-4 метилсульфинил-5-(2-пропил)амино-1 Н-пиразол-3-карбонитрил, т.пл. 140-141 С. Справочный пример 18. Сульфурилхлорид (1,48 г) добавляют к метилдисульфиду (3,16 г) в метил-т-бутиловом эфире и перемешивают в течение 5 ч, получая метилсульфенилхлорид. Его добавляют по каплям в течение 5 мин к раствору 5-амино-1-[2-бром-6-хлор-4(трифторметил)фенил]-1H-пиразол-3-карбонитрила (4,0 г), нагретого с обратным холодильником в метил-т-бутиловом эфире под азотом. Через 1 ч охлажденную смесь промывают по очереди водой, раствором бикарбоната натрия и водой, сушат (над сульфатом магния) и выпаривают. Очищение с помощью хроматографии на силикагеле, элюируя гексаном/этилацетатом(9:1), дает 5-амино-1-[2-бром-6-хлор-4-(трифторметил)фенил]-4-метилтио-1 Н-пиразол-3 карбонитрил (3,15 г) т.пл. 178-180 С. Таким же образом можно получить следующее соединение: 5-амино-1-[3-хлор-5-(трифторметил)пирид 2-ил]-4-этилтио-1H-пиразол-3-карбонитрил. 40 Справочный пример 19. Этап 1. Бром (0,5 мл) добавляют в течение 10 мин к перемешиваемому раствору тиоцианата натрия (1,7 г) в безводном метаноле при -65 С. Раствор 5-амино-1-[2-хлор-4-(трифторметил) фенил]-1H-пиразол-3-карбонитрила (1,5 г) в безводном метаноле добавляют в течение 10 мин и перемешиваемой смеси дают нагреться до 20 С в течение 16 ч. После выливания в воду осадок собирают и сушат, получая 5-амино-1-[2 хлор-4-(трифторметил)фенил]-4-тиоцианато-1 Нпиразол-3-карбонитрил (1,64 г). ВЭЖХ (колонка С-18, элюация 3:1 СН 3 СN/Н 2 О при 1,0 мл/мин) показывает соединение в виде пика площадью 86,6% на 5,11 мин. Этап 2. Йодметан (0,7 мл) вводят в перемешиваемую суспензию 5-амино-1-[2-хлор-4-(трифторметил)фенил]-4-тиоцианато-1 Н-пиразол-3-карбонитрила (1,64 г) в метаноле при 4 С. Добавляют 10% водный раствор гидроксида натрия(2,8 мл) и реакционную смесь перемешивают в течение 1 ч при 4 С, выливают в воду и экстрагируют дихлорметаном и этилацетатом. Высушенную (Nа 2SO4) объединенную органическую фазу выпаривают и очищают с помощью флэшхроматографии на силикагеле, элюируя 4:1 гексаном/этилацетатом, получая после растирания с гексаном/дихлорметаном 5-амино-1-[2-хлор-4(трифторметил)фенил]-4-метилтио-1 Н-пиразол 3-карбонитрил (0,4 г), т.пл. 129-132 С. Таким же образом, как в вышеприведенном этапе 1, получаютB) 5-амино-1-[2,6-дибром-4-(трифторметил)фенил]-4-тиоцианат-1 Н-пиразол-3-карбонитрил, который используется непосредственно во 2 этапе с йодэтаном и метанолом в качестве растворителя, давая 5-амино-1-[2,6-дибром-4(трифторметил)фенил]-4-метилтио-1 Н-пиразол 3-карбонитрил, т.пл. 211-214 С. Справочный пример 20. Суспензию 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-1H-пиразол-3-карбонитрил(9,8 г) и N-йодсукцинимид (8,87 г) нагревают с обратным холодильником в четыреххлористом углероде в течение 3,5 ч, охлаждают и промывают раствором бисульфита натрия, NaOH и водой. Высушенный (над сульфатом магния) раствор выпаривают и очищают с помощью хроматографии на силикагеле, элюируя дихлорметаном, получая 5-амино-1-[2,6-дихлор-4(трифторметил)фенил]-4-йод-1 Н-пиразол-3 карбонитрил (4,0 г) т.пл. 212-214 С. Справочный пример 21. 5-Амино-1-[2,6-дихлор-4-(трифторметил) фенил]-4-йод-1 Н-пиразол-3-карбонитрил (1,96 г) перемешивают с диметилформамидодиметилацетатом (10 мл) при 20 С в течение 2 ч, затем добавляют избыток льда/воды и твердое вещество фильтруют и сушат в печи, получая 1-[2,6 дихлор-4-(трифторметил)фенил]-4-йод-5-N(диметиламинометиленамино)-1 Н-пиразол-3 карбонитрил (1,53 г) т.пл. 177-180 С. Справочный пример 22. Активированный кадмий получают, промывая кадмий соляной кислотой (10%), водой,этанолом и эфиром и высушивая. Добавляют дибромдифторметан (317,2 г) в сухом N,Nдиметилформамиде (ДМФ) в течение одного часа к смеси активированного кадмия (212,5 г) в сухом ДМФ сначала при 0-5 С, и при инициации при температуре ниже 35 С с перемешиванием под азотом. Добавляют гексаметилфосфамид (1 л сухого) с последующим добавлением бромида меди(I) (108,5 г), и через 15 мин 1-[2,6 дихлор-4-(трифторметил)фенил]-4-йод-5-N-(диметиламинометиленамино)-1H-пиразол-3-карбонитрила (100,0 г), и смесь нагревают при 75 С в течение 2 ч. Охлажденную смесь фильтруют(120,5 г) в тетрагидрофуране и хлористоводородной кислоте (6N) нагревают с обратным холодильником в течение 24 ч, концентрируют и фильтруют. Твердое вещество смешивают с дихлорметаном и фильтруют, получая 5-амино 1-[2,6-хлор-4-(трифторметил)фенил]-4-трифторметил-1H-пиразол-3-карбонитрил (88,2 г), т.пл. 191-193 С. Справочный пример 24. Раствор 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-метилтио-1 Н-пиразол-3-карбонитрила (1,0 г) в тетрагидрофуране добавляют к безводному гидриду натрия (0,13 г), перемешивают под азотом в тетрагидрофуране при 4 С. Через 2 ч добавляют йодметан (0,34 мл) и смесь перемешивают при 20 С в течение ночи и обрабатывают раствором хлорида аммония. За экстракцией (этилацетатом), сушкой (над сульфатом натрия) и выпариванием следует хроматография на силикагеле, элюируя этилацитатом/дихлорметаном (1:9) и получая 1-[2,6 дихлор-4-(трифторметил)фенил]-5-диметиламино-4-метилтио-1 Н-пиразол-3-карбонитрил(0,5 г), т.пл. 118-119 С. Следующие типичные аналитические методики с использованием соединений изобретения проводились для определения пригодности в качестве пестицидов и активности соединений по изобретению против клещей; некоторых насекомых, включая тлю, два вида гусениц, мух и личинок трех видов жуков (один из которых питается листьями, и два питаются корнями); и нематод. Тестировались следующие конкретные виды: Тривиальное название клещик паутинный двупятнистый тля крушинная южные походные черви мексиканский бобовый жук домашняя муха южная блошка длинноусая западная блошка длинноусая яванская галловая нематода тля хлопковая тля злаковая обыкновенная совка Готовые препаративные формы Тестируемые соединения получают в виде готовых препаративных форм для использования в соответствии со следующими способами,применяемыми для каждой аналитической методики. Для клещей, тли, южных походных червей, мексиканского бобового жука и совки раствор или суспензию готовят добавлением 10 мг тестируемого соединения к раствору 160 мг диметилформамида, 838 мг ацетона, 2 мг смеси Тритона Х-172. Тритона Х-152 в соотношении 3:1 (соответственно, в основном анионные и неионные низко пенные эмульгаторы, каждый из которых представляет безводную смесь алкиларильных полиэфировых спиртов с органическими сульфонатами) и 98,99 г воды. В результате получают концентрацию 100 ч.н.м. тестируемого соединения. Для домашней мухи готовую препаративную форму получают таким же образом, как описано выше, но в 16,3 г воды с соответствующими добавками других компонентов, по 43 лучая концентрацию 200 ч.н.м. Конечное разбавление равным объемом 20% (по весу) водного раствора сахарозы дает концентрацию тестируемого соединения 100 ч.н.м Если необходимо, проводится озвучивание ультразвуком для подтверждения полного диспергирования. Для блошки длинноусой раствор или суспензию готовят таким же образом, который применялся при получении концентрации 200 ч.н.м. для домашних мух. Аликвоты этих готовых препаративных форм с концентрацией 200 ч.н.м. затем используют, разбавляя их водой в соответствии с требующейся при анализе концентрацией. Для явайской галловой нематоды и системного анализа южных походных червей готовят исходный раствор, добавляя 15 мг тестируемого соединения к 250 мг диметилформамида, 1250 мг ацетона и 3 мг вышеприведенного эмульгирующего раствора. Затем добавляют воду, получая концентрацию тестируемого соединения 150 ч.н.м. Если необходимо, проводится озвучивание ультразвуком для подтверждения полного диспергирования. Для контактного анализа совки готовят исходный раствор путем растворения соединения в ацетоне, затем разбавляют его, получая необходимые серийные разведения с различной концентрацией. Методики тестирования Вышеприведенные готовые препаративные формы тестируемых соединений затем оцениваются на их пестицидную активность в конкретных концентрациях в ч.н.м. (частях на миллион) по весу в соответствии со следующими аналитическими методиками. Клещик паутинный двупятнистый. Листья,зараженные особями во взрослой стадии и стадии куколки, полученные из культуры штамма,помещают на первичные листья двух бобовых растений, растущих в 6 см торфяном горшочке. Клещей в количестве, достаточном для анализа(150-200), в течение 24 ч переносят на свежие растения. Растения в горшочках (один горшочек на соединение) помещают на вращающийся стол и опрыскивают, смачивания растения до отекания 100 мл готовой препаративной формы соединения с концентрацией 100 ч.н.м., используя распылитель De Vilbiss при давлении воздуха 40 psig (275,8 кП). В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора вода-ацетон-ДМФэмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты, или дихлофосом, или гекситиазоксом,приготовленными в виде такой же готовой препаративной формы, тестируется как стандарт. Опрысканные растения выдерживают в течение шести дней, после чего производят подсчет смертности способных к передвижению форм. 44 Клещик паутинный двупятнистый (анализ яичек). Яички получают от взрослых особей клещика паутинного двупятнистого из культуры штамма. Сильно зараженные листья исследуемой культуры помещают на незараженные бобовые растения. Женским особям позволяют отложить яйца в течение 24 ч, после чего листья растения погружают в раствор ТЭДФ (тетраэтилдифосфата), чтобы убить подвижные формы и предупредить дополнительное откладывание яиц. Эта процедура погружения, которую повторяют после высушивания растения, не влияет на жизнеспособность яиц. Растения в горшочках (один горшочек на растение) помещают на вращающийся стол и опрыскивают достаточным количеством для смачивания до отекания 100 мл готовой препаративной формы тестируемого соединения с концентрацией 100 ч.н.м. с использованием распылителя De Vilbiss при давлении воздуха 40 psig (275,8 кП). В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора вода-ацетон-ДМФ-эмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты, обычно диметоном,приготовленным в виде такой же готовой препаративной формы, тестируется как стандарт. Опрысканные растения выдерживают в течение семи дней, после чего проводят подсчет смертности яичек одновременно с записью остаточной активности против выведенных личинок. Тля крушинная или хлопковая: Особи тли крушинной или тли хлопковой во взрослой стадии и стадии куколки культивируют на карликовой настурции или растении хлопка, соответственно, выращенных в горшочках. Растение в горшочке (один горшочек на одно растение),зараженное 100-150 особями тли, помещают на вращающийся стол и опрыскивают 100 мл готовой препаративной формы тестируемого соединения с концентрацией 100 ч.н.м. с использованием распылителя De Vilbiss при давлении воздуха 40 psig (275,8 кП). В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора вода-ацетонДМФ-эмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты, малатионом или цигалотрином, приготовленными в виде такой же готовой препаративной формы, тестируется как стандарт. После опрыскивания горшочки выдерживают один день для тли крушинной и три дня для тли хлопковой, после чего подсчитывают умершие особи тли. Южные походные черви. Бобовые растения в горшочках помещают на вращающийся стол и опрыскивают 100 мл готовой препаративной формы тестируемого соединения с концентрацией 100 ч.н.м. с использованием распылителя De Vilbiss при давлении воздуха 40 psig(275,8 кП). В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора вода-ацетон-ДМФ-эмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты или циперметрином, или сульпрофосом, приготовленным в виде такой же готовой препаративной формы,тестируется как стандарт. После высушивания листья помещают в пластиковые чашки, покрытые влажной фильтровальной бумагой. Пять случайно выбранных личинок южных походный червей второй возрастной стадии вводят в каждую чашку, которую затем закрывают и выдерживают в течение пяти дней. Личинки, которые неспособны продвинуться на длину тела даже при стимулировании подталкиванием,считаются мертвыми. Совка. Растения хлопка в горшочках помещают на вращающийся стол и опрыскивают 100 мл готовой препаративной формы тестируемого соединения с концентрацией 100 ч.н.м. с использованием распылителя De Vilbiss при давлении воздуха 40 psig (275,8 кП). В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора водаацетон-ДМФ-эмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты или циперметрином, или сульпрофосом, приготовленным в виде такой же готовой препаративной формы, тестируется как стандарт. После высушивания листья помещают в пластиковые чашки, содержащие кусочки фильтровальной бумаги и влажный зубной тампон. Одну случайно выбранную личинку второй возрастной стадии затем вводят в каждую чашку, которую закрывают и выдерживают в течение пяти дней. Личинки, которые неспособны продвинуться на длину тела даже при стимулировании подталкиванием, считаются мертвыми. Мексиканский бобовый жук. Бобовые растения в горшочках помещают на вращающийся стол и опрыскивают 100 мл готовой препаративной формы тестируемого соединения с концентрацией 100 ч.н.м. с использованием распылителя De Vilbiss при давлении воздуха 40 psig(275,8 кП). В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора вода-ацетон-ДМФ-эмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты или циперметрином, или сульпрофосом, приготовленными в виде такой же готовой препаративной формы,тестируется как стандарт. После высушивания листья помещают в пластиковые чашки, покрытые влажной фильтровальной бумагой. Пять случайно выбранных личинок мексиканского бобового жука во второй возрастной стадии вводят в каждую чашку, которую затем закрывают и выдерживают в течение пяти дней. Ли 003186 46 чинки, которые были не способны передвигаться на длину тела даже при стимулировании подталкиванием, считаются мертвыми. Муха домашняя. Четырех- или шестидневные мухи выращены в соответствии с инструкцией Chemical Specialties manufacturing Association (Blue Book, McNair-Dorland Co, NY 1954,pages 243-244,261) при контролируемых условиях. Мух обездвиживают с помощью анестезии диоксидом углерода, и двадцать пять обездвиженных женских и мужских особей переносят в садок, состоящий из стандартного питательного фильтра сита и поверхности, покрытой оберточной бумагой. 10 мл готовой препаративной формы соединения с концентрацией 100 ч.н.м. добавляют в чашку из-под суфле, содержащую слой абсорбирующего хлопка. В качестве необработанного контроля зараженные растения также опрыскивают 100 мл раствора водаацетон-ДМФ-эмульгатор, не содержащего тестируемое соединение. Обработанный контроль с коммерческим соединением с технической степенью чистоты, малатионом, приготовленным в виде такой же готовой препаративной формы,тестируется как стандарт. Чашку с приманкой вводят внутрь пищевого сита до того, как туда помещают анестезированных мух. Через 24 ч мух, которые не проявляют признаков движения при стимуляции, считают мертвыми. Южная и западная блошка длинноусая. В банку, содержащую 60 г песчаной плодородной(супесок) почвы, добавляют 1,5 мл водной готовой препаративной формы, состоящей из аликвот готовой препаративной формы тестируемого соединения с концентрацией 200 ч.н.м., разбавленной водой сколько необходимо для получения конечной концентрации в почве тестируемого соединения, 3,2 мл воды и пять предварительно пророщенных ростков кукурузы. Банку тщательно встряхивают для получения равномерного распределения тестируемого соединения. Вслед за этим двадцать яиц блошки длинноусой, (или необязательно десять личинок первой возрастной стадии в случае WCRW) помещают в сделанную в почве ямку. Затем в ямку добавляют вермикулит (1 мл), используемый необязательно в случае WCRW анализа, и воду(1,7 мл). Таким же образом готовят необработанный контроль, путем аликвот такого же размера раствора вода-ацетон-ДМФ-эмульгатор, не содержащий тестируемого соединения. Кроме того, обработанный контроль с коммерческим соединением с технической степенью чистоты(выбранным обычно из тербуфоса, фонофоса,фората, хлорпирофоса, карбофурана, изазофоса или этопропа) в виде такой же готовой препаративной формы используют при необходимости в качестве аналитического стандарта. Через 7 дней живые личинки хрущика подсчитывают с использованием хорошо известного способа вороночной экстракции по Берлезе. 47 Яванская галловая нематода. Зараженные корни растений томатов, содержащие множество яиц яванской галловой нематоды, удаляют из анализируемой культуры и очищают от почвы встряхиванием и промывая водой из-под крана. Яйца нематод отделяют от корня и промывают в воде. Образцы суспензии яиц помещают на тонкий экран над чашкой для сбора, вода в которой доведена до уровня контакта с экраном. Из чашки молодые особи собираются на тонкий экран. Нижняя часть контейнера конусообразной формы закупоривается вермикулитом грубого помола и затем заполняется внутри на 1,5 см от вершины пастеризованной почвой объемом около 200 мл. Затем в углубление, проделанное в почве в центре конуса, вносится пипеткой доза готовой препаративной формы тестируемого соединения с концентрацией 150 ч.н.м. Обработанный контроль с коммерческим соединением с технической степенью чистоты фенамифосом в виде такой же препаративной формы анализируется в качестве стандарта. Аликвоты раствора вода-ацетон-ДМФ-эмульгатор, не содержащего тестируемое соединение, применяются таким же образом в качестве необработанного контроля. Немедленно после обработки почвы тестируемым соединением на вершину каждого конуса добавляют 1000 юных особей яванской галловой нематоды второй возрастной стадии. Через три дня единственный росток томата пересаживают в конус. Конус, содержащий зараженную почву, и росток томата содержат в теплице в течение 3 недель. В конце теста корни сеянца томата удаляют из конуса и оценивают по шкале повреждения относительно необработанного контроля следующим образом: 1 - сильное повреждение, равное необработанному контролю,3 - легкое повреждение,4 - очень легкое повреждение,5 - нет повреждения, т.е. совершенный контроль. Эти результаты затем переводятся в значения ЕО 3 или ED5 (эффективная доза для обеспечения уровня повреждения с 3 по 5). Южные походные черви на томате - системная оценка. Этот анализ проводится вместе с оценкой южной яванской галловой нематоды(описанной выше). Растения томата, выращенные в почве (при начальной степени скрининга для концентрации в почве, равной 6,6 ч.н.м. или при концентрации в растворе около 150 ч.н.м.) для оценки нематод, затем используют для оценки подъема соединения по корню и последующего системного транспорта в листву томатов. В конце анализа нематод, на 21 день обработки, листву томатов срезают, помещают в пластиковый контейнер и заражают личинками южных походных червей второй возрастной стадии. Через примерно 5 дней личинки исследуют на определение процента смертности. 48 Хлопковая тля и совка (на хлопчатнике) и тля злаковая обыкновенная и совка (на сорго) системная оценка. 7,0 мл аликвоты тестируемого раствора с концентрацией 150 ч.н.м. применяются для получения почвенной концентрации эквивалентной 10,0 ч.н.м. в виде орошения в 6 см горшочек, содержащий растения хлопчатника и сорго. Растения хлопчатника предварительно заражают хлопковой тлей примерно за два дня до обработки и злаковой тлей за один день до обработки. После выдерживания растений около трех дней их оценивают на активность против тли. Еще через шесть дней растения оценивают на активность против тли, подсчитывают и анализируют смертность. Часть листвы хлопчатника и сорго срезают, помещают в изолированный пластиковый контейнер и заражают личинками совки второй возрастной стадии. Растения в горшочках окунают в сульфотеп, чтобы убить оставшуюся тлю, и возвращают в теплицу для повторного роста. Через тридцать дней после обработки оставшуюся листву срезают и дают в корм совке. Смертность оценивают через шесть дней после заражения. Хлопковая тля и южные походные черви(на сорго) - системная оценка. Готовят исходный раствор или суспензию для разведения 5 мл для получения концентрации в почве 20 ч.н.м.(и последующего разведения) с помощью орошения 6 см горшочков, содержащих растения хлопчатника и сорго. Растения хлопчатника предварительно заражали хлопковой тлей примерно за два дня до обработки и злаковой тлей за один день до обработки. После выдерживания растений около трех дней их оценивают на активность против тли. Еще через шесть дней растения оценивают на активность против тли и хлопковую и злаковую тлю подсчитывают и оценивают смертность. Часть листвы хлопчатника и сорго срезают, помещают в изолированный пластиковый контейнер и заражают личинками южных походный червей второй возрастной стадии. Растения в горшочках окунают в сульфотеп, чтобы убить оставшуюся тлю, и возвращают в теплицу для повторного роста. Через тридцать дней после обработки оставшуюся листву срезают и дают в корм южным походным червям. Смертность оценивают через шесть дней после заражения. Хлопковая тля и южные походные черви(на хлопчатнике и овсе) - оценка обработки семян. Веществом с технической степенью чистоты обрабатывают семена овса и хлопчатника,помещая семена в определенного размера банку и вращая ее на шаровой мельнице. Анализ вещества, наносимого на семена, проводят по весу. Затем семена высаживают. При появлении ростков и всходов растения заражают с соответствующими интервалами насекомыми 49 хозяевами. Смертность оценивают по этим насекомым. Совка - оценка контакта. Следующий способ местного применения предусматривает оценку контактной токсичности соединения по отношению к личинкам совки. Тестируемое соединение при последовательном двукратном разведении концентрации от 10 до 0,16 мкг/мл наносят с помощью микрошприца в повторяющихся 1 мкл порциях на дорзальную поверхность приблизительно 20 мг личинок совки. Это количество эквивалентно применяемой дозе от 500 до 8 мкг/г веса тела. Также наносят обработанный ацетоном контроль без каких-либо тестируемых соединений. Обработанный контроль с коммерческим соединением с технической степенью чистоты циперметрином, или тиодикарбом также в ацетоне используют в качестве стандарта. Обработанные личинки помещают по отдельности в изолированные пластиковые чашки, содержащие необработанную листву хлопчатника и влажный зубной тампон. Обработанную листву выдерживают при около 27 С и 50% относительной влажности. Процент смертности оценивают через 1 или 4 дня после обработки. Все соединения с номера 1 по 118 данного изобретения показали инсектицидную активность в одном или большем количестве способов оценки, с особенно хорошей активностью при анализе системной активности. Настоящее изобретение предлагает способ системного подавления артроподов на локусе,особенно некоторых насекомых или клещей,которые питаются наземными частями вышеперечисленных растений. Уничтожение таких лиственных вредителей может быть обеспечено путем непосредственного нанесения на листву или при нанесении на корни растения или семена, например путем почвенного распыления или нанесения гранул, с последующим системным перемещением в надземные части растения. Подобная системная активность включает подавление насекомых, располагающихся не только в точке нанесения, но в отдаленной части растения, например, путем перемещения с одной стороны листвы на другую или с обработанной листвы на необработанную. Примеры классов насекомых-вредителей, которые могут системно контролироваться арилпиразолами изобретения включают отряд Homoptera (прокалывающихсосущих), отряд Hemiptera (прокалывающихсосущих) и отряд Thysanoptera. Изобретение особенно пригодно для тли и трипе. Как очевидно из предшествующего пестицидного использования настоящее изобретение предлагает пестицидно-активные арилпиразолы и способы использования названных арилпиразолов для подавления ряда вредителей, которые включают следующие виды: артроподы, в особенности насекомые или клещи; нематоды растений; или гельминты или протозойные вреди 003186 50 тели. Арилпиразолы формулы (I) или их пестицидно приемлемые соли таким образом успешно используются в практическом применении,например, в сельскохозяйственных и садовых посевах, лесоводстве, ветеринарии или животноводстве или в сфере общественного здоровья. С этого места и далее при использовании термина арилпиразолы формулы (I) этот термин обозначает арилпиразолы формулы (I) и их пестицидно-активные соли. Термин арилпиразол формулы (I) означает арилпиразол формулы (I) и его пестицидно-активную соль. Настоящее изобретение предлагает способ подавления вредных насекомых на локусе, который включает обработку данного очага (например, путем нанесения или прикладывания) эффективным количеством арилпиразола формулы (I) или его пестицидно приемлемой соли,где группы-заместители такие, как определено выше. Очаг включает, например, вредителя самого по себе или то место (растение, животное,поле, сооружение, помещение, лес, фруктовый сад, водный путь, почву, животные и растительные продукты или им подобные), где вредители живут или питаются. Арилпиразолы данного изобретения могут,кроме того, использоваться для подавления почвенных насекомых, таких как блошка длинноусая, термиты (в особенности при защите зданий), корневые личинки насекомых, нематода гемонхус, долгоносик, стеблевой точильщик,совка, корневая тля или червовидные личинки. Их также можно использовать для обеспечения активности против патогенных нематод растений, таких как яванская галловая, цистовая, совковая, повреждающая, или стеблевая или луковичная нематода, или против клещей. Для подавления почвенных вредителей, например блошки длинноусой, арилпиразолы успешно наносятся или включаются с эффективной скоростью в почву, в которой произведены или будут произведены посадки, или на семена или корни растущего растения. В области сохранения общественного здоровья арилпиразолы в особенности пригодны для контроля насекомых, особенно помойных мух или других вредителей отряда двукрылых(Dipteran), таких как домашняя муха, жигалка осенняя, львинки, жигалка коровья малая, оленья муха, лошадиная муха, галлица, мокрецы,скатопсиды или москиты. Арилпиразолы данного изобретения могут использоваться при следующих вариантах использования и на следующих вредителях, включая артроподы, в особенности насекомые или клещи, нематоды или гельминты или протозойные вредители. При защите хранящихся продуктов, например, хлебных злаков, включая крупы или муку, земляных орехов, животных кормов, лесоматериалов или предметов домашнего обихода, например ковров и тканей, арилпиразолы 51 данного изобретения пригодны против нападения артроподов, в особенности жуков, включая долгоносиков, моль или клещей, напримерAcarus spp. (клещи). При подавлении тараканов, муравьев или термитов или подобных артроподных вредителей в зараженных домашних или промышленных помещениях или при подавлении личинок москитов в водных путях, водоемах, резервуарах или другой проточной или стоячей воде. Для обработки фундаментов, зданий или почвы с целью охраны здания от заражения термитами, например, Reticulitermes spp., Heterotermes spp., Coptotermes spp. В сельском хозяйстве против взрослых особей, личинок или яиц Lipidoptera (бабочек и моли), например Heliothis spp., такой как Heliothis virescens (совка), Heliothis armigera и Heliotiszea. Против взрослых особей и личинок Coleoptera (жуков), например Anthonomus spp., например grandis (долгоносика хлопкового), Leptinotarsa decemlineata ( колорадского картофельного жука),DiabrpticaBlattela spp. (тараканов). Против Isoptera, например, Coptotermes spp. (термитов). Против артроподов сельскохозяйственного значения, таких как Acari (клещей), например,Tetranychus spp. и Panonychus spp. Против нематод, которые нападают на растения или деревья, имеющие значение в сельском хозяйстве, лесоводстве или садоводстве или непосредственно, или путем распространения бактериальных, вирусных, микоплазматических или грибковых заболеваний растений. Например, яванские галловые нематоды, такие какMeloidogyne spp. (например, М. incognita). В области ветеринарной медицины или животноводства или в области охраны общественного здоровья против артроподов, гельминтов или протозойных вредителей, которые паразитируют внутри организма или на поверхности тела позвоночных, в особенности теплокровных позвоночных, например, домашних животных,например крупного рогатого скота, овец, коз,лошадей, свиней, домашней птицы, собак или кошек, например, Асаппа, включая иксодовыхOmithodorus spp. (например, Omithodorus moubata) и клещей (например, Damalima spp.), Diptera (например, Aedes spp., Anopheles spp.,Musca spp., Hypoderma spp.), Hemiptera, Dictyoptera (например, Penplaneta spp., Blatella spp.),Hymenoptera, например против инфекций желудочно-кишечного тракта, вызванных паразитическими глистами (нематодами). Например,представителями семейства Tnchostrongylidae, в контроле и лечении протозойных заболеваний,вызванных, например, Eirnena spp., например,Tnchomonadidae spp., Toxoplasma spp. и Theilenaspp. При практическом использовании с целью подавления артроподов, в особенности насекомых и клещей, или паразитирующих нематод растений, способ применения включает, например, нанесение на растения или на среду, в которой они растут, эффективного количества арилпиразола изобретения. Для такого способа на локус, в котором должно подавляться распространение артроподов или нематод, обычно наносят активный арилпиразол в эффективном количестве от около 5 г до 1 кг активного арилпиразола на гектар обрабатываемого очага. При идеальных условиях в зависимости от того, какой вредитель должен подавляться, адекватную защиту может обеспечить более низкая норма. С другой стороны, неблагоприятные погодные условия, устойчивость вредителя или другие факторы могут требовать, чтобы активный ингредиент использовался в большем количестве. Оптимальная доза зависит от ряда факторов,например, от вида контролируемого вредителя,от вида или стадии роста зараженного растения,от их пространственного расположения, а также от способа нанесения. Наиболее предпочтительная эффективная норма соотношения активного арилпиразола колеблется от 50 до 400 г/га. Когда вредитель является почвеннорожденным, активный арилпиразол обычно равномерно распространяется над площадью в виде оформленной композиции, предназначенной для обработки (т.е., например, широкомасштабной или рассеянной) любым подходящим образом и применяется в соотношении от 5 до 1 кг активного ингредиента/га, предпочтительно от около 50 до около 250 г активного ингредиента/га. При применении для погружения корней рассады или капельной ирригации растений,жидкий раствор или суспензия содержат от около 0,075 до около 1000 мг активного ингредиента/л, предпочтительно от около 25 до около 200 мг активного ингредиента/л. При желании нанесение может быть произведено обычно на поле или площади произрастания посевов или вблизи семян или растений, предназначенных для защиты от нападения вредителей. Активный ком 53 понент может быть занесен в почву с жидкостью путем распыления воды над площадью или может быть оставлен на почве для естественного действия дождя. Во время или после нанесения готовая препаративная форма арилпиразола может при желании быть распределена в почве,например, при распахивании, обработке дисковым культиватором или использовании бороны. Нанесение можно проводить до высаживания,при высаживании, после высаживания, но до того, как будет иметь место появление побегов или после появления побегов. Арилпиразолы данного изобретения и способы подавления вредителей, осуществляемые с их помощью, имеют особенное значение в защите полей, лесов, плантаций, оранжерей, урожаев фруктовых садов или виноградников, декоративных растений, или деревьев плантаций,или лесов, например, зерновых культур (таких как пшеница и рис), хлопчатника, овощей (такие как перец), посевов на полях (таких как сахарная свекла, бобы, маслосемянной рапс), луговых или фуражных посевов (таких как маис или сорго), фруктовых садов или лесов (таких как косточковые фрукты или цитрусовые), декоративных растений, цветов или овощей, или кустарников в теплицах или в садах, или парках, или лесных деревьев (как опадающих, так и вечнозеленых) в лесах, на плантациях или питомнике. Они также имеют ценность в защите лесоматериалов (растущих, спиленных, переработанных, хранящихся или в виде сооружений) от нападений, например, пилильщика, или жуков,или термитов. Они применяются для защиты хранящихся продуктов, таких как зерно, фрукты, орехи, специи или табак, как цельных, так и перемолотых с введенным арилпиразолом в продукты, от моли, жучков, клещей или нападения зернового долгоносика. Также защищенными являются хранящиеся животные продукты, такие как кожа, волос, шерсть или перья в природной или переработанной форме (например, в виде ковров или тканей) от нападения моли или жуков, а также хранящееся мясо, рыба или зерновые от нападения жуков, клещей или мух. Кроме того, арилпиразолы данного изобретения и способы их использования имеют особенное значение в контроле артроподов,гельминтов или протозойных вредителей, которые вредны для домашних животных или распространяются или действуют как носитель их заболевания, например, таких, которые уже были упомянуты, и в особенности в контроле иксодовых клещей, клещей, вшей, блох, комаров,надоедливых или вредных мух. Арилпиразолы данного изобретения особенно полезны в контроле артроподов, гельминтов или протозойных вредителей, которые присутствуют внутри домашних животных-хозяев или которые питаются в коже или на поверхности кожи или сосут кровь животных, и в зависимости от цели они 54 могут быть назначены через рот, парентерально,чрескожно или местно. Более того, арилпиразолы данного изобретения могут быть полезны при кокцидозе, заболевании, вызванном инфицированием протозойными паразитами рода Eimeria. Это важная потенциальная причина экономических потерь при разведении домашних животных и птиц,особенно тех, которые выращиваются или содержатся в интенсивных условиях. Например,крупный рогатый скот, овцы, свиньи или кролики могут подвергаться данному заболеванию, но оно имеет особенное значение для домашних птиц, особенно для цыплят. Применение небольшого количества арилпиразола изобретения предпочтительно в сочетании с пищей эффективно в предупреждении или значительном снижении случаев кокцидоза. Арилпиразолы эффективны против как слепокишечных форм,так и для интестинальных форм. Более того,арилпиразолы данного изобретения также могут оказывать ингибиторный эффект на ооциты в виде значительного снижения их числа и споруляции при их производстве. Заболевания домашней птицы в основном распространяются птицами, подбирающими инфекционный организм в помете или на зараженной подстилке,земле, пище или в питьевой воде. Заболевание проявляется кровоизлияниями, накоплением крови в слепой кишке, переходом крови в помет, слабостью и нарушением пищеварения. Заболевание часто заканчивается смертью животного, но домашняя птица, которая выжила после тяжелой инфекции, в результате этой инфекции имеет значительно сниженную рыночную стоимость. Описанные здесь далее композиции для нанесения на растущие посевы или очаг в растущих посевах или в виде покрытия семян могут в целом в качестве альтернативы использоваться для местного применения животным или в защите хранящихся продуктов, предметов домашнего обихода, частных владений или площади общественной окружающей среды. Подходящие средства применения апилпиразолов данного изобретения следующие: для растущих посевов в виде опрыскивателя листьев, дустов, гранул, мелкодисперсного аэрозоля или мыла, или также в виде суспензий тонкоразмельченных или инкапсулированных композиций для обработки почвы или корней жидким орошением, дустами, гранулами, испарением или мылами; для семян посевов через применение в виде покрытия семян жидкой взвесью или дустами; для животных, подвергнутых заражению артроподами, гельминтами или протозойными вредителями путем парентерального, орального или местного применения композиций, активный ингредиент которых оказывает немедленное и/или пролонгированное действие через 55 некоторый период времени против артроподов,гельминтов или простейших, например путем введения в пищу или подходящую проглатываемую через рот фармацевтическую готовую препаративную форму съедобных наживок, кусочков соли, питательных добавок, льющихся готовых препаративных формы, спреев, ванн,растворов для погружения, душей, полива струй, мелких порошков, смазочных веществ, шампуней, кремов, восковых липких веществ или животноводческих систем для самообработки; для окружающей среды в целом или конкретного места, где вредители могут прятаться,включая хранящиеся продукты, лесоматериалы,предметы домашнего обихода, или жилье, или промышленные помещения в виде спреев, мелкодисперсных аэрозолей, дустов, испарений,восковых липких веществ, лаков, гранул, или наживок, или в густого корма в водные пути,водоемы, резервуары и другую проточную или стоячую воду; для домашних животных в пище для контроля личинок мух, питающихся фекалиями. На практике арилпиразолы изобретения наиболее часто входят в состав композиций в виде ее части. Эти композиции могу применяться для контроля: артроподов, особенно насекомых и клещей; нематод; или гельминтов или протозойных паразитов. Композиции могут иметь любой вид, известный в настоящем уровне техники, подходящий для применения желаемого пестицида в любом помещении или на открытом воздухе или для внутреннего или наружного применения позвоночными. Композиции содержат, по крайней мере, один арилпиразол формулы (I) или его пестицидно приемлемую соль, такие как описано ранее, в виде активного ингредиента в комбинации или сочетании с одним или большим количеством совместимых компонентов, которые, например, являются твердыми или жидкими носителями или разбавителями, адъювантами, поверхностноактивными агентами и им подобными, предназначенными или подходящими для данного использования и агрономически и медицински приемлемыми. Эти композиции, которые можно получить любым способом, известным в настоящем уровне техники, также составляют часть настоящего изобретения. Данные композиции могут также содержать другие виды ингредиентов, такие как защитные коллоиды, адгезивные (связывающие) вещества, загустители, токситропные агенты,проникающие агенты, распыляемые масла (особенно для применения против акарид), стабилизаторы, консерванты (особенно плесневые консерванты), извлекающие агенты, или им подобные, а также другие известные активные ингредиенты с пестицидными свойствами (особенно инсектицидные, митицидные, немотодоцидные или фунгицидные) или со свойствами, регулирующими рост растений. Наиболее часто арил 003186 56 пиразолы, применяемые в данном изобретении,могут быть скомбинированы со всеми твердыми или жидкими добавками, соответствующими обычной методике получения готовой препаративной формы. Композиции, пригодные для применения в сельском хозяйстве, садоводстве или им подобном, включают готовые препаративные формы,пригодные для использования в виде, например,спреев, дустов, гранул, мелкодисперсных аэрозолей, мыла, эмульсий и им подобных. Эффективные дозы применения арилпиразола, используемого в данном изобретении, могут варьироваться в широких пределах, особенно в зависимости от природы вредителя, которого необходимо уничтожить, или степени заражения, например, посевов с данными вредителями. В целом композиции в соответствии с настоящим изобретением обычно содержат от около 0,05 до около 95% (по весу) одного или большего количества активных ингредиентов в соответствии с настоящим изобретением, от около 1 до около 95% одного или более твердых или жидких носителей и необязательно от около 0,1 до около 50% одного или более других совместимых компонентов, таких как поверхностно-активные вещества или им подобные. В настоящей оценке термин носитель указывает на органический или неорганический ингредиент, природный или синтетический, с которым объединяется активный ингредиент для облегчения его нанесения, например, на растения, семена или почву. Этот носитель таким образом обычно инертный и должен быть приемлемым (например, агрономически приемлемым, особенно при обработке растений). Носитель может быть твердым, например,глиной, природными или синтетическими силикатами, кремнеземом, камедью, воском, твердым удобрением (например, солями аммония),грунтовыми природными минералами, такими как каолины, глины, тальк, мел, кварц, атапульгит, монтомориллонит, бентонит или диатомитовая земля, или грунтовыми синтетическими минералами, такими как кремнезем, глинозем(окись алюминия) или силикаты, особенно алюминиевые или магниевые силикаты. Для гранул пригодны следующие твердые носители: раздробленные фракционированные природные горные породы, такие как кальцит, мрамор, пемза, сепиолит и доломит; синтетические гранулы неорганической и органической муки; гранулы из органических веществ, таких как скорлупа кокосовых орехов, кочерыжки кукурузного початка, листовая обертка початка кукурузы, и стебли табака; килельгур; трикальция фосфат,порошкообразная кора пробкового дуба или абсорбентная углеродная сажа; водорастворимые полимеры, камеди, смолы; или твердые удобрения. Подобные твердые композиции могут, при желании, содержать один или более совместимых смачивающих, диспергирующих, 57 эмульгирующих или красящих агентов, которые будучи в твердом состоянии могут также служить в качестве разбавителей. Носитель также может быть жидким, например вода; спирты, особенно бутанол или гликоль, а также их эфиры и сложные эфиры,особенно метилгликольацетат; кетоны, особенно ацетон, циклогексанон, метилэтилкетон, метилизобутилкетон или изофорон; петролейные фракции, такие как парафиновые или ароматические углеводороды, особенно ксилены или алкилнафталены; минеральные или растительные масла; алифатические хлорированные углеводороды, особенно трихлорэтан или метиленхлорид; ароматические хлорированные углеводороды, особенно хлорбензолы; водорастворимые или сильно полярные растворители, такие как диметилформамид, диметилсульфоксид илиN-метилпирролидон; газы в жидком состоянии; или им подобные или их смеси. Поверхностно-активные агенты могут представлять из себя эмульгирующий агент,диспергирующий агент или смачивающий агент ионного или нейонного вида или смесь таких поверхностно-активных агентов. Среди них,например, имеются соли полиакриловой кислоты, соли лигносульфоновой кислоты, соли фенолсульфоновой кислоты или нафталенсульфоновой кислот, поликонденсаты этиленоксида с жирными спиртами, или жирными кислотами,или жирными эфирами, или жирными аминами,замещенные фенолы (особенно алкилфенолы или арилфенолы), соли сложных эфиров сульфоянтарной кислоты, тауриновые производные(особенно алкилтаураты), фосфорные сложные эфиры спиртов или поликонденсаты этиленоксида с фонолами, сложных эфиров жирных кислот с полиолами или сульфатные, сульфонатные или фосфатные функциональные производные вышеназванных арилпиразолов. Присутствие, по крайней мере, одного поверхностноактивного агента в целом существенно, когда активный ингредиент и/или инертный носитель является только слегка водорастворимым или не растворимым в воде и агент, являющийся в композиции для нанесения носителем, представляет из себя воду. Композиции данного изобретения могут,кроме того, содержать добавки, такие как адгезивные вещества и красители. Адгезивные вещества, такие как карбоксиметилцеллюлоза или природные или синтетические полимеры в форме порошков, гранул или решеток, такие как камедь, поливиниловый спирт или поливиниловый ацетат, природные фосфолипиды, такие как цефалины или лецитины, или синтетические фосфолипиды могут использоваться в готовых препаративных формах. Возможно использование красителей, таких как неорганические пигменты, например оксиды железа, оксиды титана или берлинская лазурь; органические красящие вещества, такие как ализариновые красители, 003186 58 азокрасители или красители металлического фталоцианина; или следовые питательные вещества, такие как соли железа, марганца, бора,меди, кобальта, молибдена и цинка. Композиции, содержащие арилпиразолы формулы (I) или их пестицидно приемлемые соли, которые могут применяться для контроля артроподов, нематод растений, гельминтов или протозойных вредителей, могут также содержать синергисты (например, пиперонилбутоксид или сесамекс), стабилизирующие субстанции, другие инсектициды, акарициды, растительные нематодоциды, антигельминтные или антикокцидальные средства, фунгициды (удобные для сельскохозяйственного или ветеринарного применения, например беномил и ипродион), бактерициды, аттрактанты или репелленты членистоногих или позвоночных, или феромоны, дезодоранты, ароматизаторы, красители или терапевтические агенты, например, следовые элементы. Они могут включаться в состав для того, чтобы исправить силу, эффект последействия, безопасность, повысить, если желательно, спектр контролируемых вредителей, или для создания возможности для композиции оказывать другие полезные действия в том же самом обрабатываемом животном или на той же площади. Примеры других пестицидно-активных арилпиразолов, которые могут быть включены или использованы вместе с композициями настоящего изобретения, следующие: асефат,хлорпирифос, деметон-с-метил, дисульфотон,этопрофос, фенитротион, фенамифос, фонофос,изазофос, изофенфос, малатион, монокротофос,паратион, форат, фозалон, пиримифос-метил,тербуфос, триазофос, цифлутрин, циперметрин,делтаметрин, фенпропатрин, фенвалерат, перметрин, тефлутрин, алдикарб, карбосульфан,метомил, оксамил, пиримикарб, бендиокарб,тефлубензурон, дикофол, эндосулфан, линдан,бензоксимат, картап, цигексатин, тетрадифон,авермектины, ивермектины, милбемицины,тиофанат, трихлорфон, дихлорвос, диаверидин или диметриадазол. Для их сельскохозяйственного применения арилпиразолы формулы (I) или их пестицидно приемлемые соли обычно представлены в виде композиций в различных твердых или жидких формах. Возможные для использования твердые формы композиций представляют пылеобразный порошок (с содержанием арилпиразола формулы (I) или его пестицидно-активной соли до 80%), смачиваемый порошок или гранулы(включая диспергируемые в воде гранулы), в особенности те, которые получены путем экструзии, уплотнения, пропитывания гранулированного носителя или гранулирования из порошка (содержание арилпиразола формулы (I) или его пестицидно приемлемой соли в этих смачиваемых порошках или гранулах находится 59 между около 0,5 и около 80%). Твердые гомогенные или гетерогенные композиции, содержащие один или более арилпиразолов формулы(I) или их пестицидно приемлемую соль, например гранулы, пилюли, брикеты или капсулы,могут быть использованы для обработки проточной или стоячей воды в течение некоторого периода времени. Такой же эффект может быть достигнут при использовании струйного или прерывистого питания водными диспергируемыми концентратами, как было здесь описано. Жидкие композиции, например, включают водные и неводные растворы или суспензии(такие как эмульгируемые концентраты, эмульсии, текучие составы, дисперсии или растворы) или аэрозоли. Жидкие композиции включают в частности эмульгируемые концентраты, дисперсии, эмульсии, текучие составы, аэрозоли, смачиваемые порошки (или порошки для спрея),сухие текучие составы или пасты как формы композиций, которые являются жидким или предназначены для того, чтобы образовать жидкую композицию при применении, например, в виде водного спрея (включая низкий и ультранизкий объем) или мелкодисперсные арозоли(туманы) или аэрозоли. Жидкие композиции, например, в форме эмульгируемых или растворимых концентратов наиболее часто включают от около 5 до около 80 вес.% активного ингредиента, в то время как эмульсии или растворы, которые готовы к применению, в этом случае содержат от около 0,01 до около 20% активного ингредиента. Кроме раствора, эмульгируемые или растворимые концентраты могут содержать, если требуется, от около 2 до около 50% подходящих добавок, таких как стабилизаторы, поверхностно-активные вещества, проникающие агенты, ингибиторы коррозии, красители и адгезивные вещества. Эмульсии с любой требующейся концентрацией, которые особенно пригодны для нанесения,например, на растения, могут быть получены из этих концентратов путем разбавления водой. Эти композиции входят в область тех композиций, которые могут применяться в настоящем изобретении. Эмульсии могут быть в форме вода-в-масле или масло-в-воде, и могут иметь густую консистенцию. Жидкие композиции данного изобретения могут кроме обычного сельскохозяйственного применения использоваться, например, для обработки заселенных артроподами (или другими вредителями, контролируемыми арилпиразолами данного изобретения) объектов или мест,или мест их возможного заселения, зданий, закрытых и открытых складов или производственных площадей, контейнеров или оборудования, или стоячей или проточной воды. Все эти водные дисперсии, или эмульсии,или распыляемые смеси могут быть нанесены,например, на посевы любыми подходящими способами, в основном распылением, в количе 003186 60 стве, которое обычно составляет от около 100 до около 1200 л распыляемой смеси на гектар, но может быть выше или ниже (например, низкий или ультранизкий объем), в зависимости от необходимости или методики нанесения. Арилпиразолы или композиции в соответствии с изобретением удобно наносить на растения, и в частности на корни или листья, зараженные вредителями, требующими уничтожения. Другим способом нанесения арилпиразолов или композиций по изобретению является способ химигирования, другими словами, добавления готовой препаративной формы, содержащей активный ингредиент, в ирригационную воду. Подобная ирригация для лиственных пестицидов может представлять из себя ирригацию разбрызгиванием или может представлять грунтовую или подземную ирригацию для почвенных или системных пестицидов. Концентрированные суспензии, которые могут быть нанесены с помощью спрея, получают таким образом, чтобы образовался стабильный жидкий продукт, который не дает осадка (тонко размолотый) и обычно содержит от около 10 до около 75 вес.% активного ингредиента, от около 0,5 до около 30% поверхностно-активного агента, от около 0,1 до около 10% токситропного агента, от около 0 до около 30% подходящих добавок, таких как противопенные агенты, ингибиторы коррозии, стабилизаторы,проникающие агенты, адгезивные вещества и в качестве носителя воду или органическую жидкость, в которой активный ингредиент плохо растворим или нерастворим. Некоторые органические твердые вещества или неорганические соли могут быть растворены в носителе для предупреждения осаждения или как антифризы для воды. Смачиваемые порошки (или порошки для распыления с помощью спрея) обычно получают таким образом, чтобы они содержали от около 10 до около 80 вес.% активного ингредиента,от около 20 до около 90% твердого носителя, от около 0 до около 5% смачивающего агента, от около 3 до около 10% диспергирующего агента и, если необходимо, от около 0 до около 80% одного или более стабилизаторов и/или других добавок, таких как проникающие агенты, адгезивные агенты, агенты, препятствующие затвердеванию, красители и им подобные. Для получения подобного смачиваемого порошка активный(ые) ингредиент(ы) тщательно смешиваются в подходящей мешалке с дополнительными веществами, которые могут быть пропитаны через пористый фильтр и размолоты с помощью мельницы или другого подходящего дробильного устройства. В результате получают смачиваемые порошки с удобной смачиваемостью и способностью к образованию эмульсии. Они могут быть суспендированы в воде, давая любую желаемую концентрацию, и эта суспензия
МПК / Метки
МПК: C07D 231/12, A01N 43/56
Метки: пестицидные, 1-арилпиразолы
Код ссылки
<a href="https://eas.patents.su/30-3186-pesticidnye-1-arilpirazoly.html" rel="bookmark" title="База патентов Евразийского Союза">Пестицидные 1-арилпиразолы</a>
Предыдущий патент: Быстрый способ диагностики рака
Следующий патент: Лиганд, родственный фактору некроза опухоли
Случайный патент: Композиции для удаления накипи и очистки на основе микрофибрилл целлюлозы.