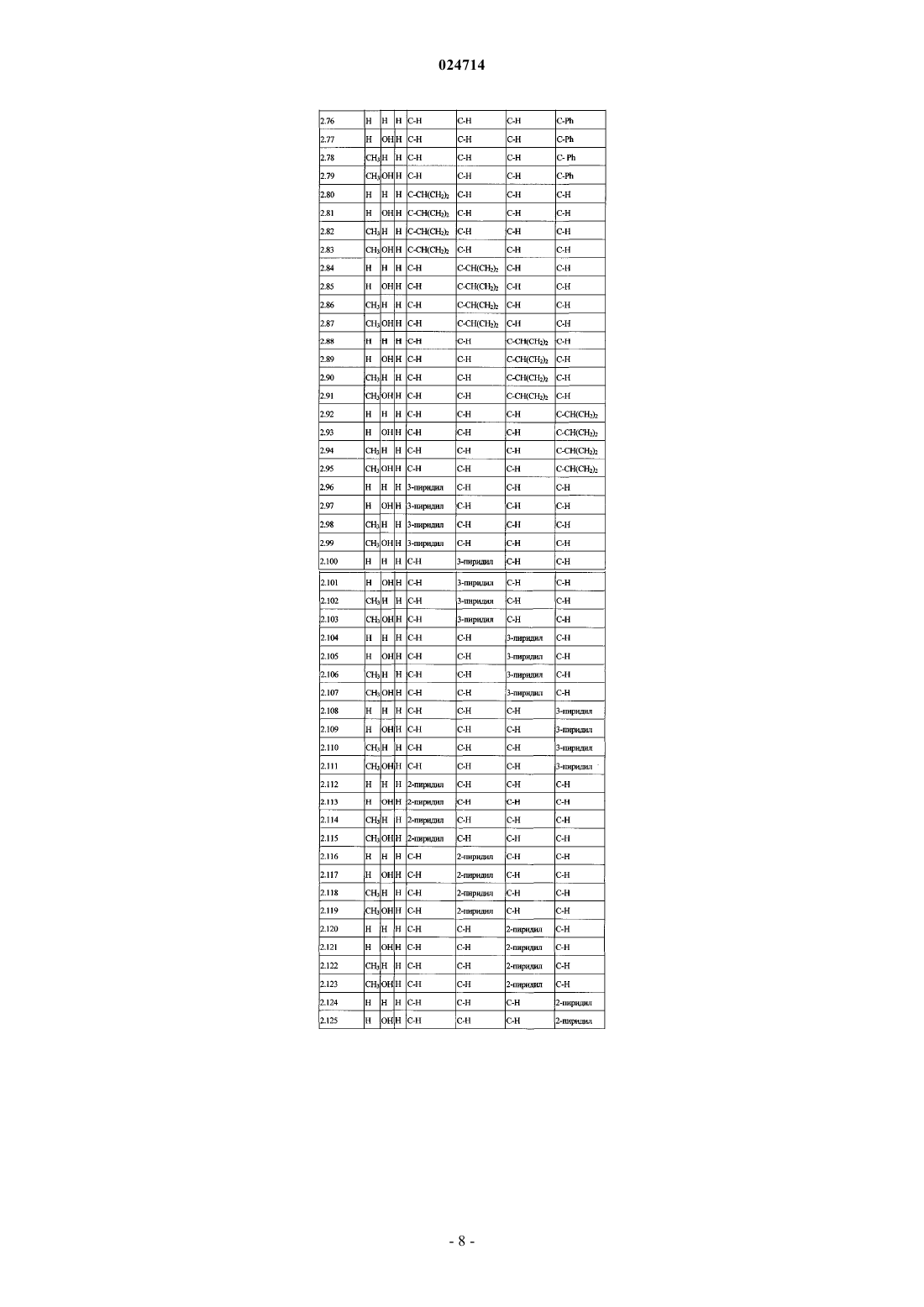
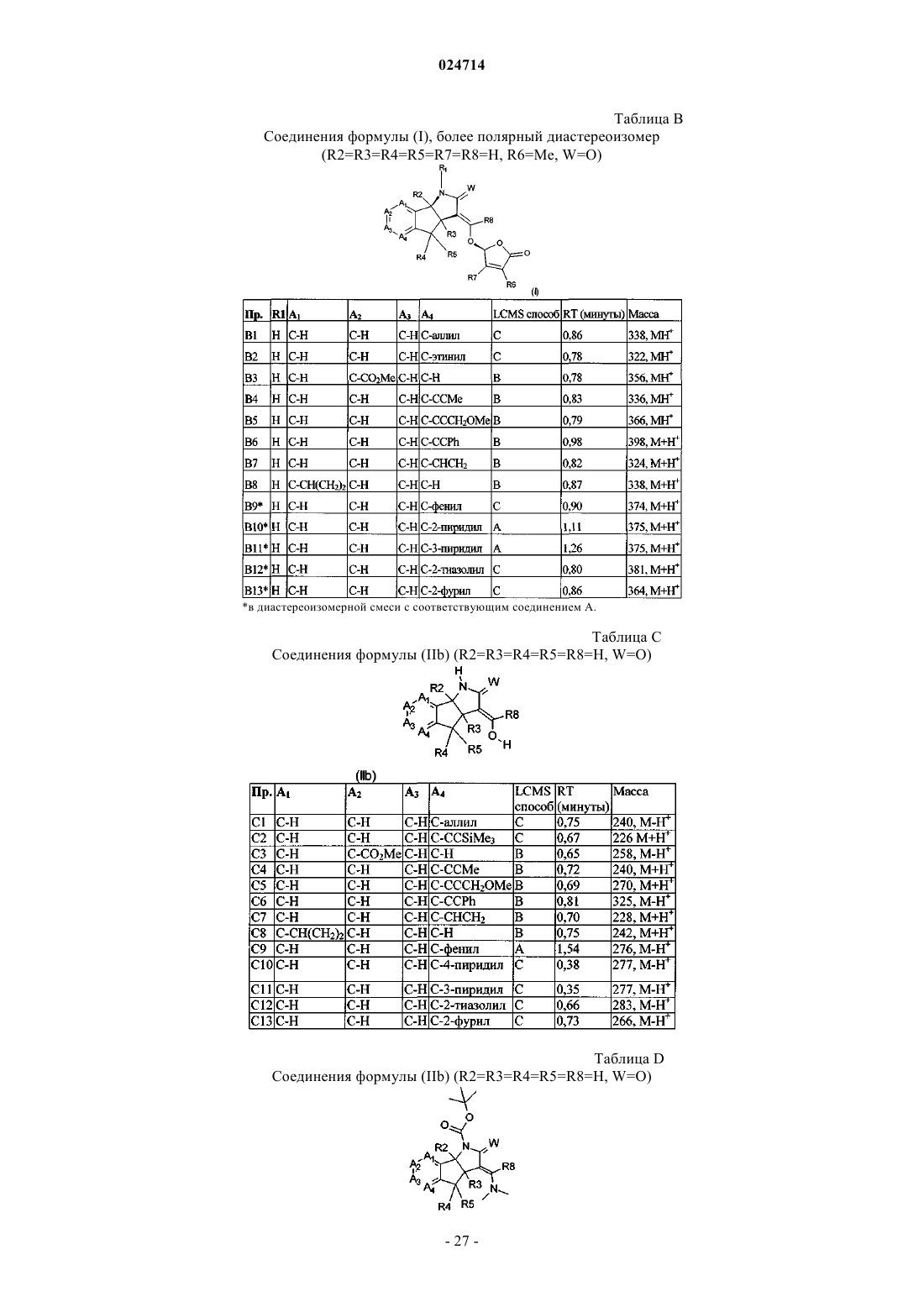
Стриголактоновые производные в качестве соединений, регулирующих рост растений
Номер патента: 24714
Опубликовано: 31.10.2016
Авторы: Ван Ден Вейнгард Паул Виллем Ян, Ланфермейер Франсискус Корнелис, Лашия Матильде Денис, Скрепанти Клаудио, Де Месмакер Ален, Вольф Ханно Кристиан, Вийедьё-Першерон Эмманьюэлль, Жюнг Пьерр Жозеф Марсель
Формула / Реферат
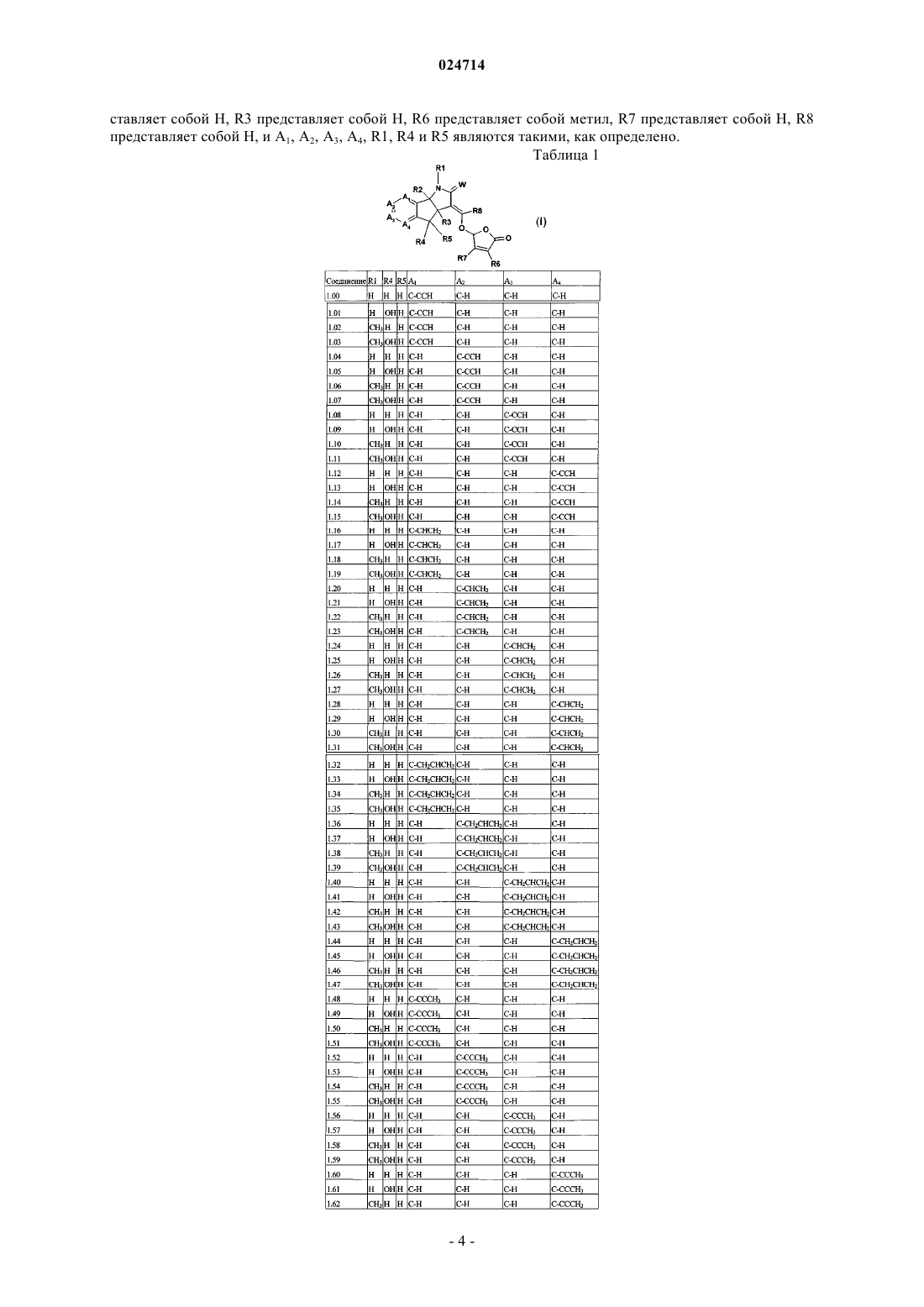
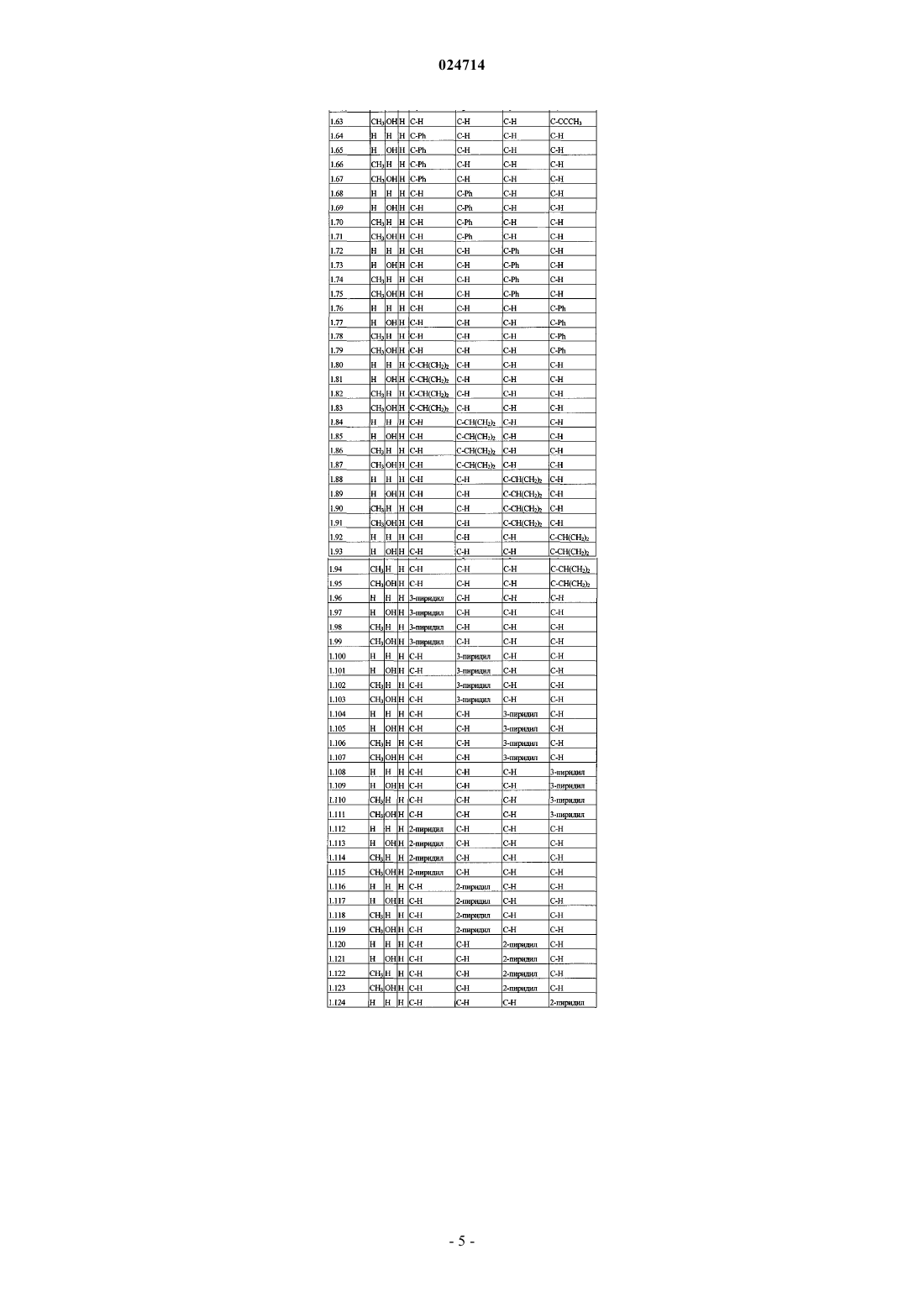
1. Соединение формулы (I)
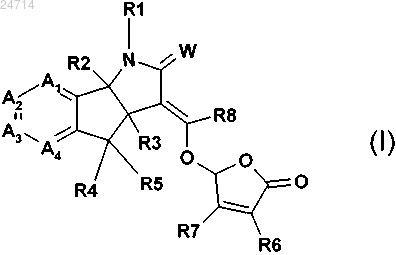
где W представляет собой О;
R2 и R3 независимо представляют собой водород или С1-С3алкил;
R4 и R5 независимо представляют собой водород, галоген, нитро, циано, C1-С3алкил, C1-С3галогеналкил, С1-С3алкокси или гидроксил;
R6 и R7 независимо представляют собой водород, С1-С3алкил, гидроксил, галоген или С1-С3алкокси;
R8 представляет собой водород, нитро, циано, C1-С6алкил, C1-С6галогеналкил или галоген;
R1 представляет собой водород, C1-С6алкокси, гидроксил, C1-С6алкил, необязательно замещенный одним-пятью R10, С1-С8алкилкарбонил или С1-С3алкоксикарбонил;
R10 представляет собой водород, циано, нитро, галоген, C1-С6алкил, С1-С6алкокси, C1-С6галогеналкил, С2-С6алкенил или С2-С6алкинил;
каждый А1, А2, А3 и А4 независимо представляет собой С-Х или C-Y, где каждый X или Y может быть одинаковым или отличаться друг от друга, и при условии, что по меньшей мере один из А1 А2, А3 и А4 представляет собой С-Х;
Y представляет собой водород, галоген, циано, гидроксил, С1-С6алкокси, С1-С6алкил или C1-С6галогеналкил;
X представляет собой С2-С8алкенил, необязательно замещенный одним-пятью R11, С2-С8алкинил, необязательно замещенный одним-пятью R11, С3-С7циклоалкил, С3-С10циклоалкил, замещенный одним-пятью R12, С1-С8алкилкарбонил, C1-С8алкоксикарбонил, фенил, необязательно замещенный одним-пятью R13, пиридил, необязательно замещенный одним-пятью R13, фуранил, необязательно замещенный одним-пятью R13, или тиазолил, необязательно замещенный одним-пятью R13;
каждый R11 независимо представляет собой галоген, циано, нитро, гидрокси, С1-С8галогеналкил, С1-С8алкокси, С1-С8галогеналкокси или фенил;
каждый R12 и R13 независимо представляет собой галоген, циано, нитро, гидрокси, С1-С8алкил, С1-С8алкокси, С1-С8галогеналкокси или фенил;
или его соли или N-оксиды.
2. Соединение по п.1, где W представляет собой О.
3. Соединение по п.1 или 2, где
R2 и R3 независимо представляют собой водород, метил или этил;
R4 и R5 независимо представляют собой водород, гидроксил, метил или этил;
R6, R7 и R8 независимо представляют собой водород, метил или этил;
R1 представляет собой водород, C1-С6алкокси, С1-С6алкил, необязательно замещенный одним-пятью R10, С1-С8алкилкарбонил или С1-С8алкоксикарбонил;
R10 независимо представляет собой водород, циано, нитро, галоген, C1-С6алкил, C1-С6алкокси или C1-С6галогеналкил;
каждый А1 А2, А3 и А4 независимо представляет собой С-Х или C-Y, и при условии, что по меньшей мере один из A1, A2, A3 и А4 представляет собой С-Х;
Y представляет собой водород, гидроксил, галоген, циано, метил, гидроксиметил, трифторметил или метокси;
X представляет собой винил, 1-пропенил, аллил, пропаргил, циклопропан, циклобутан, циклопетан, этинил, бензолэтинил, метилэтинил, фенил, необязательно замещенный одним-пятью R13, пиридил, необязательно замещенный одним-пятью R13, фуранил, необязательно замещенный одним-пятью R13, тиазолил, необязательно замещенный одним-пятью R13, метоксикарбонил или гидроксикарбонил; и
R13 представляет собой галоген, циано, нитро, гидрокси, метокси или метил.
4. Соединение по п.3, где X представляет собой винил, 1-пропенил, аллил, пропаргил, циклопропан, этинил, фенил, пиридил, фуранил, тиазолил, метоксикарбонил или гидроксикарбонил.
5. Композиция для регуляции роста растений или стимуляции прорастания семян, содержащая соединение по любому из предыдущих пунктов и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления.
6. Способ регуляции роста растений путем обработки места произрастания растения регулирующим рост растений количеством соединения по любому из пп.1-4 или композицией по п.5.
7. Способ стимуляции прорастания семян путем обработки места произрастания растения, содержащего семена, стимулирующим прорастание семян количеством соединения по любому из пп.1-4 или композицией по п.5.
8. Способ по п. 7, отличающийся тем, что растением, которому принадлежит семя, является растение, выбранное из рода Brassica.
9. Способ контроля сорных растений путем внесения в место их прорастания, содержащее семена, стимулирующего прорастание семян количества соединения по любому из пп.1-4 или композиции по п.5 с последующей обработкой после всхожести места произрастания растений послевсходовым гербицидом.
10. Применение соединения формулы (I) в качестве регулятора роста растений или стимулятора прорастания семян.
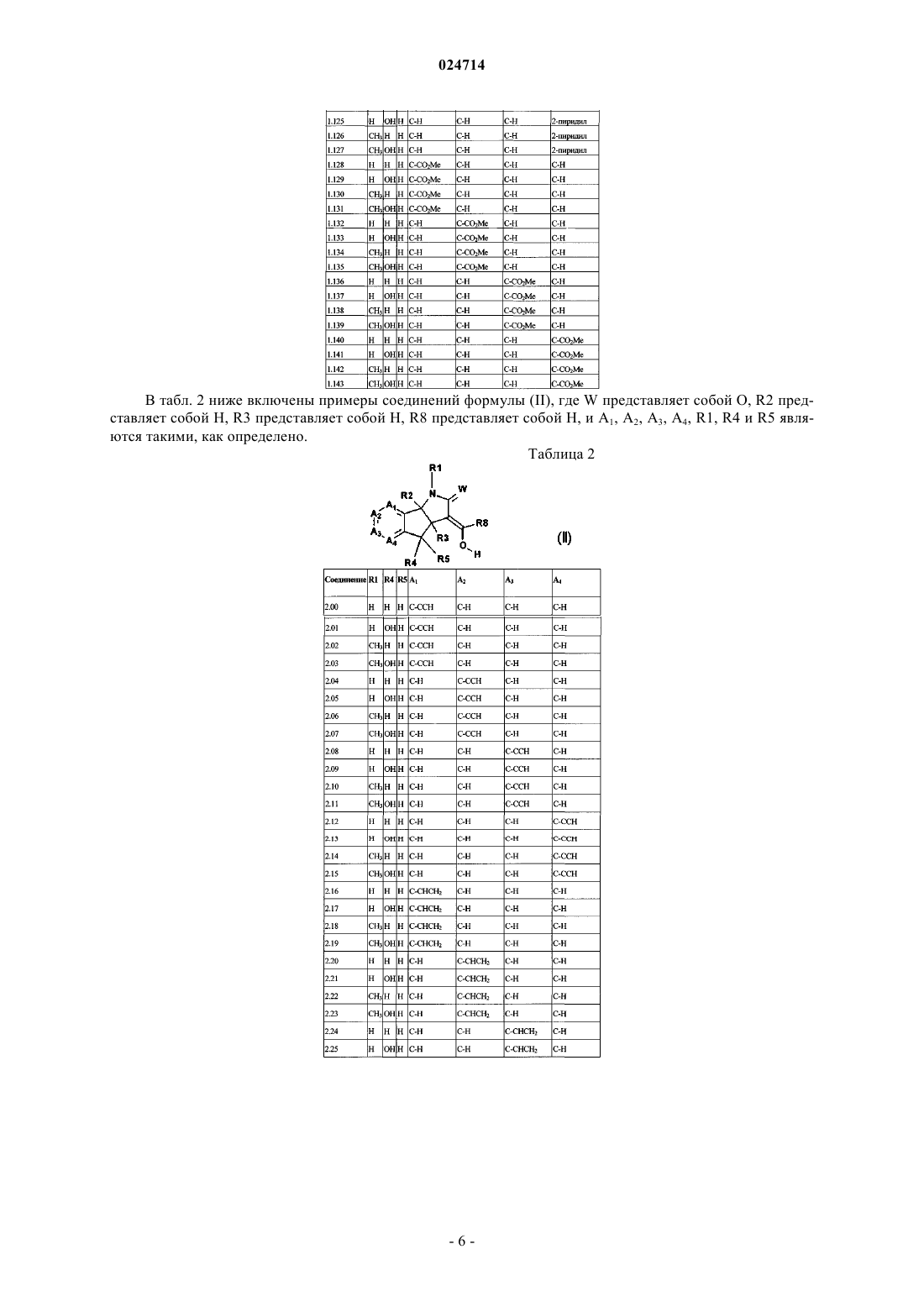
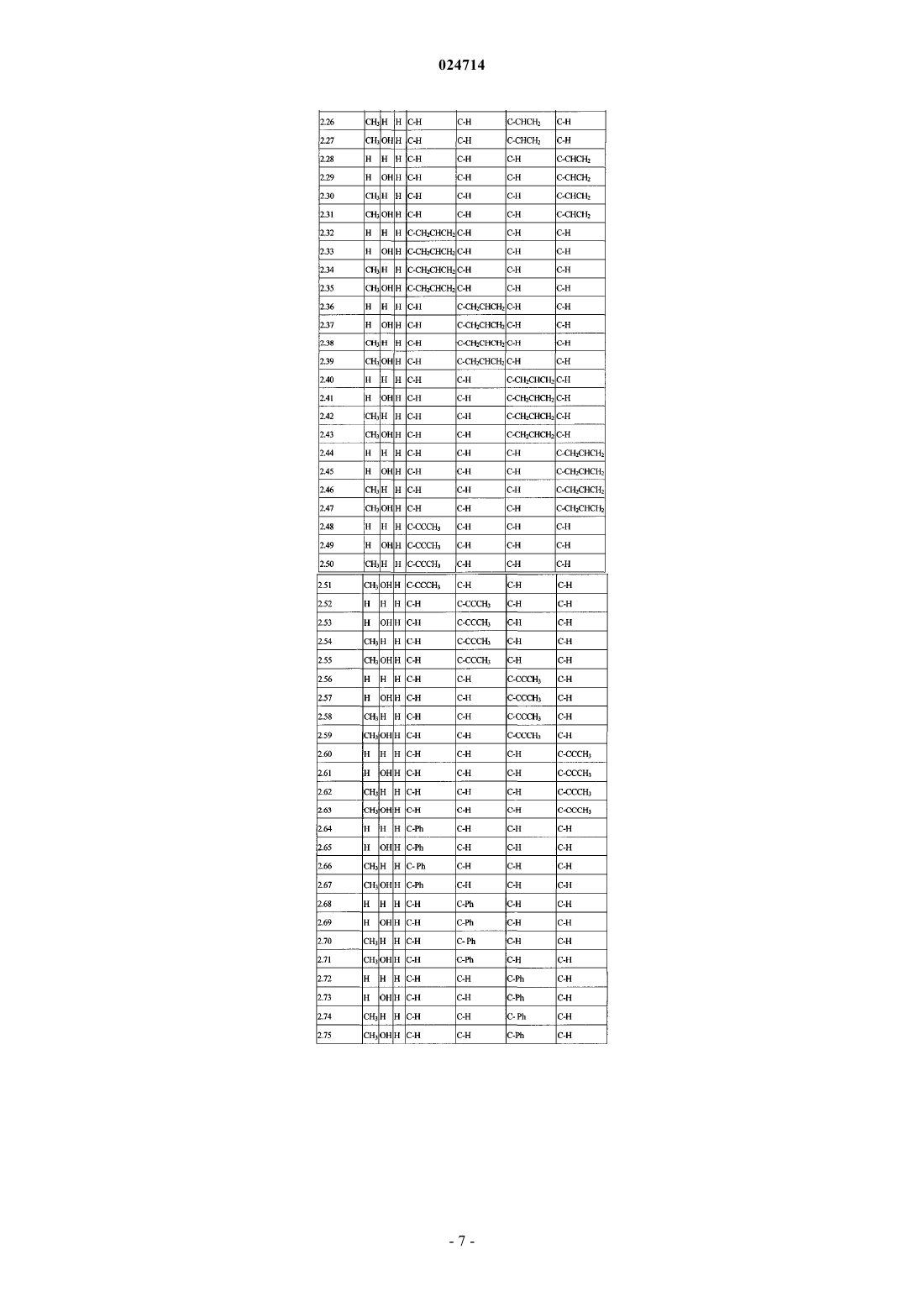
11. Соединение формулы (II)
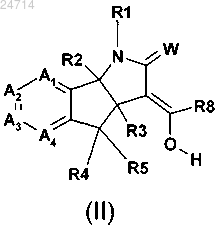
где W представляет собой О;
R2 и R3 независимо представляют собой водород или C1-С3алкил;
R4 и R5 независимо представляют собой водород, галоген, нитро, циано, C1-С3алкил, C1-С3галогеналкил, C1-С3алкокси, гидроксил;
R8 представляет собой водород, нитро, циано, C1-С6алкил, C1-С6галогеналкил или галоген;
R1 представляет собой водород, C1-С6алкокси, гидроксил, С1-С6алкил, необязательно замещенный одним-пятью R10, С1-С8алкилкарбонил или C1-С8алкоксикарбонил;
R10 представляет собой водород, циано, нитро, галоген, C1-С6алкил, C1-С6алкокси, С1-С6галогеналкил, С2-С6алкенил или С2-С6алкинил;
каждый A1, A2, A3 и А4 независимо представляет собой С-Х или C-Y, где каждый X или Y может быть одинаковым или отличаться друг от друга, и при условии, что по меньшей мере один из А1 А2, А3 и А4 представляет собой С-Х;
Y представляет собой водород, галоген, циано, гидроксил, C1-С6алкокси, С1-С6алкил или C1-С6галогеналкил;
X представляет собой С2-С8алкенил, необязательно замещенный одним-пятью R11, С2-С8алкинил, необязательно замещенный одним-пятью R11, С3-С7циклоалкил, С3-С10циклоалкил, замещенный одним-пятью R12, С1-С8алкилкарбонил, C1-С8алкоксикарбонил, фенил, необязательно замещенный одним-пятью R13, пиридил, необязательно замещенный одним-пятью R13, фуранил, необязательно замещенный одним-пятью R13, или тиазолил, необязательно замещенный одним-пятью R13;
каждый R11 независимо представляет собой галоген, циано, нитро, гидрокси, С1-С8галогеналкил, С1-С8алкокси, С1-С8галогеналкокси или фенил; и
каждый R12 и R13 независимо представляет собой галоген, циано, нитро, гидрокси, С1-С8алкил-, С1-С8алкокси-, С1-С8галогеналкокси или фенил;
или его соли или N-оксиды.
12. Способ улучшения урожая растений путем обработки растения, части растения, растительного материала для размножения или места произрастания растений соединением по любому из пп.1-4 или композицией по п.5.
13. Способ повышения эффективности использования затрат по отношению к растению, предусматривающий применение по отношению к растению, части растения, растительному материалу для размножения или месту роста растений соединения по любому из пп.1-4 или композиции по п.5.
14. Способ улучшения мощности растения, и/или качества растения, и/или выносливости растения к стрессовым факторам, предусматривающий применение по отношению к растению, части растения, растительному материалу для размножения или месту роста растений соединения по любому из пп.1-4 или композиции по п.5.
Текст
Изобретение относится к новым стриголактамовым производным, к способам и промежуточным соединениям для их получения, к композициям для регуляции роста растений, содержащим их, и к способам их применения для контроля роста растений и/или обеспечения прорастания семян. Лашия Матильде Денис, Де Месмакер Ален, Вийедь-Першерон Эмманьюэлль (CH), Вольф Ханно Кристиан (DE), Жюнг Пьерр Жозеф Марсель (CH), Ланфермейер Франсискус Корнелис, Ван Ден Вейнгард Паул Виллем Ян (NL),Скрепанти Клаудио (CH) Веселицкая И.А., Кузенкова Н.В.,Веселицкий М.Б., Каксис Р.А.,Белоусов Ю.В., Куликов А.В.,Кузнецова Е.В., Соколов Р.А.,Кузнецова Т.В. (RU) Настоящее изобретение относится к новым стриголактамовым производным, к способам и промежуточным соединениям для их получения, к композициям для регуляции роста растений, содержащим их, и к способам их применения для контроля роста растений и/или обеспечения прорастания семян. Стриголактоновые производные являются фитогормонами со свойствами регуляции роста растений и прорастания семян; они описаны, например, в WO 2009/138655, WO 2010/125065, WO 05/077177, WO 06/098626 и в Annual Review of Phytopathology (2010), 48, p. 93-117. Известно, что стриголактоновые производные, подобно синтетическому аналогу GR24, действуют на прорастание паразитических сорных растений, таких как виды Orobanche. Из уровня техники хорошо известно, что тестирование на прорастание семян Orobanche является тестом, применимым для идентификации стриголактоновых аналогов (см.,например, Plant and Cell Physiology (2010), 51(7), p.1095 и OrganicBiomolecular Chemistry (2009), 7(17),p. 3413). Было обнаружено, что определенные стриголактамовые производные обладают свойствами аналогичными стриголактону. Также было обнаружено, что они обладают свойствами увеличения урожая. В соответствии с настоящим изобретением предусматривается соединение формулы (I)R2 и R3 независимо представляют собой водород или C1-С 3 алкил;R4 и R5 независимо представляют собой водород, галоген, нитро, циано, C1-С 3 алкил, C1 С 3 галогеналкил, C1-С 3 алкокси или гидроксил;R6 и R7 независимо представляют собой водород, C1-С 3 алкил, гидроксил, галоген или С 1 С 3 алкокси;R10 представляет собой водород, циано, нитро, галоген, C1-С 6 алкил, C1-С 6 алкокси, C1 С 6 галогеналкил, С 2-С 6 алкенил или С 2-С 6 алкинил; каждый А 1 А 2, А 3 и A4 независимо представляет собой С-Х или C-Y, где каждый X или Y может быть одинаковым или отличаться друг от друга, и при условии, по меньшей мере один из A1, А 2, А 3 и А 4 представляет собой С-Х;X представляет собой С 2-С 8 алкенил, необязательно замещенный одним-пятью R11, С 2-С 8 алкинил,необязательно замещенный одним-пятью R11, С 3-С 7 циклоалкил, С 3-С 10 циклоалкил, замещенный однимпятью R12, С 1-С 8 алкилкарбонил, C1-С 8 алкоксикарбонил, фенил, необязательно замещенный однимпятью R13, пиридил, необязательно замещенный одним-пятью R13, фуранил, необязательно замещенный одним-пятью R13, или тиазолил, необязательно замещенный одним-пятью R13; каждый R11 независимо представляет собой галоген, циано, нитро, гидрокси, С 1-С 8 галогеналкил,С 1-С 8 алкокси, С 1-С 8 галогеналкокси или фенил; каждый R12 и R13 независимо представляет собой галоген, циано, нитро, гидрокси, С 1-С 8 алкил, С 1 С 8 алкокси или фенил; или его соли или N-оксиды. Соединения формулы (I) могут существовать в виде различных геометрических или оптических изомеров (диастереоизомеров и энантиомеров) или таутомерных форм. Настоящее изобретение охватывает все такие изомеры и таутомеры и их смеси во всех соотношениях, а также изотопные формы, такие как дейтерированные соединения. Настоящее изобретение также охватывает все соли, N-оксиды и металлоидные комплексы соединений формулы (I). Каждый алкильный фрагмент либо отдельно, либо как часть более крупной группы (такой как алкокси, алкоксикарбонил, алкилкарбонил, алкиламинокарбонил, диалкиламинокарбонил) характеризуется прямой или разветвленной цепью и представляет собой, например, метил, этил, н-пропил, н-бутил, нпентил, н-гексил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил или нео-пентил. Алкильные группы предпочтительно представляют собой C1-С 6 алкильные группы, более предпочтительно С 1-С 4 и наиболее предпочтительно C1-С 3 алкильные группы. Каждый алкенильный фрагмент либо отдельно, либо как часть более крупной группы (такой как алкокси, алкоксикарбонил, алкилкарбонил, алкиламинокарбонил, диалкиламинокарбонил) содержит по меньшей мере одну двойную связь углерод-углерод и представляет собой, например, винил, аллил. Алкенильные группы предпочтительно представляют собой С 2-С 6 алкенильные группы, более предпочти-1 024714 тельно C2-C4 алкенильные группы. Используемый в настоящем документе термин "алкенил", если не указано иное, предусматривает алкильные фрагменты, содержащие по меньшей мере одну двойную связь углерод-углерод, где алкил указан выше. Каждый алкинильный фрагмент либо отдельно, либо как часть более крупной группы (такой как алкокси, алкоксикарбонил, алкилкарбонил, алкиламинокарбонил, диалкиламинокарбонил) содержит по меньшей мере одну тройную связь углерод-углерод и представляет собой, например, этинил, пропаргил. Алкинильные группы предпочтительно представляют собой С 2-С 6 алкинильные группы, более предпочтительно С 2-С 4 алкинильные группы. Используемый в настоящем документе термин "алкинил", если не указано иное, предусматривает алкильные фрагменты, содержащие по меньшей мере одну тройную связь углерод-углерод, где алкил указан выше. Галоген представляет собой фтор, хлор, бром или йод. Галогеналкильными группами (либо отдельно, либо как часть более крупной группы, такой как галогеналкокси или галогеналкилтио) являются алкильные группы, которые замещены одним или несколькими одинаковыми или различными атомами галогена и представляют собой, например, -CF3, -CF2Cl, CH2CF3 или -CH2CHF2. Гидроксиалкильными группами являются алкильные группы, которые замещены одной или несколькими гидроксильными группами и представляют собой, например, -СН 2 ОН, -СН 2 СН 2 ОН или СН(ОН)СН 3. В контексте данного описания термин "арил" относится к кольцевой системе, которая может быть моно-, би- или трициклической. Примеры таких колец включают фенил, нафталенил, антраценил, инденил или фенантренил. Предпочтительная арильная группа представляет собой фенил. Если не указано иное, алкенил и алкинил, сами по себе или как часть другого заместителя, могут быть линейными или с разветвленной цепью и могут предпочтительно содержать от 2 до 6 атомов углерода, предпочтительно от 2 до 4, более предпочтительно от 2 до 3 и при необходимости могут быть либо в (Е)-, либо в (Z)-конфигурации. Примеры включают винил, аллил, этинил и пропаргил. Если не указано иное, циклоалкил может быть моно- или бициклическим, может быть необязательно замещен одной или несколькими C1-С 6 алкильными группами и предпочтительно содержит от 3 до 7 атомов углерода, предпочтительнее от 3 до 6 атомов углерода. Примеры циклоалкила включают в себя циклопропил, 1-метилциклопропил, 2-метилциклопропил, циклобутил, циклопентил и циклогексил. Термин "гетероарил" относится к ароматической кольцевой системе, содержащей по меньшей мере один гетероатом и состоящей или из одного кольца, или из двух или более конденсированных колец. Предпочтительно отдельные кольца будут содержать до трех, а бициклические системы до четырех гетероатомов, которые предпочтительно будут выбраны из азота, кислорода и серы. Примеры таких групп включают в себя пиридил, пиридазинил, пиримидинил, пиразинил, фуранил, тиофенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пирролил, пиразолил, имидазолил, триазолил и тетразолил. Термин "гетероциклил" определяется как включающий гетероарил, насыщенные аналоги и в дополнение его ненасыщенные или частично ненасыщенные аналоги, такие как 4,5,6,7-тетрагидробензотиофенил, 9 Н-фторенил, 3,4-дигидро-2 Н-бензо-1,4-диоксепинил, 2,3-дигидро-бензофуранил, пиперидинил, 1,3-диоксоланил, 1,3-диоксанил, 4,5-дигидро-изоксазолил, тетрагидрофуранил и морфолинил. Кроме того, термин "гетероциклил" определяется как включающий "гетероциклоалкил", который определяется как неароматическое моноциклическое или полициклическое кольцо, содержащее атомы углерода и водорода и по меньшей мере один гетероатом, предпочтительно 1-4 гетероатома, выбранных из азота, кислорода и серы, такое как оксиран или тиетан. Предпочтительные значения W, R2, R3, R4, R5, R6, R7, R8, R1, R10, А 1 А 2, А 3, А 4 и X в любой комбинации изложены ниже.W предпочтительно представляет собой кислород.R2 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R2 представляет собой водород.R3 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R3 представляет собой водород.R4 предпочтительно представляет собой водород, гидроксил, метил или этил; наиболее предпочтительно R4 представляет собой водород или гидроксил.R5 предпочтительно представляет собой водород, гидроксил, метил или этил; наиболее предпочтительно R5 представляет собой водород или гидроксил.R6 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R6 представляет собой метил.R7 предпочтительно представляет собой водород, метил, метокси, хлорид или этил; наиболее предпочтительно R7 представляет собой водород.R8 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R8R1 предпочтительно представляет собой водород, C1-С 6 алкокси, C1-С 6 алкил, необязательно замещенный одним-пятью R10, С 1-С 8 алкилкарбонил, C1-С 8 алкоксикарбонил; более предпочтительно R1 представляет собой водород, метил, этил, ацетат, метоксикарбонил или трет-бутоксикарбонил.R10 независимо представляет собой водород, циано, нитро, галоген, C1-С 6 алкил, С 1-С 6 алкокси, C1 С 6 галогеналкил; наиболее предпочтительно R10 представляет собой водород, циано, нитро, хлорид,бром, фтор, метил, метокси или трифторметил. Предпочтительно A1 представляет собой С-Х, и А 2, A3, A4 представляют собой CY. Более предпочтительно A1 представляет собой С-Х, и А 2, A3, A4 представляют собой С-Н. Предпочтительно А 2 представляет собой С-Х, и A1, A3, А 4 представляют собой CY. Более предпочтительно А 2 представляет собой С-Х, и A1, A3, А 4 представляют собой С-Н. Предпочтительно А 3 представляет собой С-Х, и A1, А 2, А 4 представляют собой CY. Более предпочтительно А 3 представляет собой С-Х, и А 1, А 2, А 4 представляют собой С-Н. Предпочтительно А 4 представляет собой С-Х, и A1, А 2, А 3 представляют собой CY. Более предпочтительно А 4 представляет собой С-Х, и А 1, А 2, А 3 представляют собой С-Н. Предпочтительно Y представляет собой водород, гидроксил, галоген, циано, метил, трифторметил или метокси. Более предпочтительно Y представляет собой водород, гидроксил, метил, трифторметил или метокси. Еще более предпочтительно Y представляет собой водород, метил, гидроксил или метокси. Наиболее предпочтительно Y представляет собой водород. Предпочтительно X представляет собой винил, 1-пропенил, аллил, пропаргил, циклопропан, циклобутан, циклопетан, этинил, бензолэтинил, метилэтинил, фенил, необязательно замещенный одним-пятьюR13, пиридил, необязательно замещенный одним-пятью R13, фуранил, необязательно замещенный одним-пятью R13, тиазолил, необязательно замещенный одним-пятью R13, метоксикарбонил, гидроксикарбонил. Более предпочтительно X представляет собой винил, 1-пропенил, аллил, пропаргил, циклопропан, этинил, фенил, пиридил, фуранил, тиазолил, метоксикарбонил, гидроксикарбонил. Предпочтительно R12 и R13 независимо представляют собой галоген, циано, нитро, гидрокси, метокси или метил. В предпочтительном варианте осуществления соединение характеризуется формулой (II)R2 и R3 независимо представляют собой водород или C1-С 3 алкил;R4 и R5 независимо представляют собой водород, галоген, нитро, циано, С 1-С 3 алкил, C1 С 3 галогеналкил, C1-С 3 алкокси, гидроксил;R10 представляет собой водород, циано, нитро, галоген, C1-С 6 алкил, C1-С 6 алкокси, C1 С 6 галогеналкил, С 2-С 6 алкенил или С 2-С 6 алкинил; каждый А 1, А 2, А 3 и А 4 независимо представляет собой С-Х или C-Y, где каждый X или Y может быть одинаковым или отличаться друг от друга, и при условии, что по меньшей мере один из А 1, А 2, А 3 и А 4 представляет собой С-Х;X представляет собой С 2-С 8 алкенил, необязательно замещенный одним-пятью R11, С 2-С 8 алкинил,необязательно замещенный одним-пятью R11, С 3-С 7 циклоалкил, С 3-С 10 циклоалкил, замещенный однимпятью R12, С 1-С 8 алкилкарбонил, C1-С 8 алкоксикарбонил, фенил, необязательно замещенный однимпятью R13, пиридил, необязательно замещенный одним-пятью R13, фуранил, необязательно замещенный одним-пятью R13, или тиазолил, необязательно замещенный одним-пятью R13; каждый R11 независимо представляет собой галоген, циано, нитро, гидрокси, С 1-С 8 галогеналкил,С 1-С 8 алкокси, С 1-С 8 галогеналкокси или фенил; и каждый R12 и R13 независимо представляет собой галоген, циано, нитро, гидрокси, С 1-С 8 алкил-,С 1-С 8 алкокси-, С 1-С 8 галогеналкокси или фенил; или его соли или N-оксиды. Предпочтения для А 1 А 2, A3, А 4, R1, R2, R3, R4, R5, R8 и W являются такими же, как и предпочтения, изложенные для соответствующих заместителей соединений формулы (I). В табл. 1 ниже включены примеры соединений формулы (I), где W представляет собой О, R2 пред-3 024714 В табл. 2 ниже включены примеры соединений формулы (II), где W представляет собой О, R2 представляет собой Н, R3 представляет собой Н, R8 представляет собой Н, и А 1, А 2, A3, A4, R1, R4 и R5 являются такими, как определено. Таблица 2 Соединения формулы (I) в соответствии с настоящим изобретением могут быть использованы как регуляторы роста растений или стимуляторы прорастания семян сами по себе, но, как правило, их составляют в композиции для регулирования роста растений или стимулирования прорастания семян с использованием вспомогательных средств для составления, таких как носители, растворители и поверхностно-активные вещества (SFA). Таким образом, настоящее изобретение, кроме того, относится к композиции для регуляции роста растений, содержащей регулирующее рост растений соединение формулы (I) и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для регуляции роста растений, содержащей в основном регулирующее рост растений соединение формулы (I) и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для регуляции роста растений, содержащей регулирующее рост растений соединение формулы (I) и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для стимуляции прорастания семян, содержащей стимулирующее прорастание семян соединение формулы (I) и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для стимулирования прорастания семян, содержащей в основном стимулирующее прорастание семян соединение формулы (I) и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для стимулирования прорастания семян, содержащей стимулирующее прорастание семян соединение формулы (I) и приемлемое с точки зрения сельского хозяйства вспомогательное средство для составления. Композиция может быть представлена в форме концентратов, которые разводят перед применением, хотя также можно получать готовые к применению композиции. Конечное разведение обычно выполняют при помощи воды,но вместо воды или в дополнение к воде разведение можно выполнять при помощи, например, жидких удобрений, микроэлементов, биологических организмов, масла или растворителей. Композиции, как правило, содержат от 0, 1 до 99 вес.%, в частности от 0, 1 до 95 вес.% соединений формулы (I) и от 1 до 99,9 вес.% вспомогательного средства для составления, которое предпочтительно включает от 0 до 25 вес.% поверхностно-активного вещества. Композиции можно выбрать из ряда типов составов, многие из которых известны из Manual on Development and Use of FAO Specifications for Plant Protection Products, 5th Edition, 1999. Таковые включают порошки для распыления (DP), растворимые порошки (SP), растворимые в воде гранулы (SG), диспергируемые в воде гранулы (WG), смачиваемые порошки (WP), гранулы (GR) (с медленным или быстрым высвобождением), растворимые концентраты (SL), смешиваемые с маслом жидкости (OL), жидкости,применяемые в ультранизком объеме (UL), эмульгируемые концентраты (ЕС), диспергируемые концентраты (DC), эмульсии (как "масло в воде" (EW), так и "вода в масле" (ЕО, микроэмульсии (ME), суспензионные концентраты (SC), аэрозоли, капсулированные суспензии (CS) и составы для обработки семян. Выбранный тип состава в любом случае будет зависеть от конкретного предусматриваемого назначения и физических, химических и биологических свойств соединения формулы (I). Порошки для распыления (DP) можно получать смешиванием соединения формулы (I) с одним или несколькими твердыми разбавителями (например, природными глинами, каолином, пирофиллитом, бентонитом, глиноземом, монтмориллонитом, кизельгуром, мелом, диатомовой землей, фосфатами кальция,карбонатами кальция и магния, серой, известью, тонкодисперсными порошками, тальком и другими органическими и неорганическими твердыми носителями) и механическим измельчением смеси в мелкий порошок. Растворимые порошки (SP) можно получать смешиванием соединения формулы (I) с одной или несколькими растворимыми в воде неорганическими солями (такими как бикарбонат натрия, карбонат натрия или сульфат магния) или с одним или несколькими растворимыми в воде органическими твердыми веществами (такими как полисахарид) и необязательно с одним или несколькими смачивающими средствами, одним или несколькими диспергирующими средствами или смесью указанных средств для улучшения диспергируемости/растворимости в воде. Смесь затем измельчают в мелкий порошок. Подобные композиции можно также гранулировать для получения растворимых в воде гранул (SG). Смачиваемые порошки (WP) можно получать смешиванием соединения формулы (I) с одним или несколькими твердыми разбавителями или носителями, одним или несколькими смачивающими средствами и предпочтительно одним или несколькими диспергирующими средствами, а также необязательно с одним или несколькими суспендирующими средствами для облегчения диспергирования в жидкостях. Смесь затем измельчают в мелкий порошок. Подобные композиции можно также гранулировать для получения диспергируемых в воде гранул (WG). Гранулы (GR) могут быть образованы либо гранулированием смеси соединения формулы (I) и одного или нескольких порошковых твердых разбавителей или носителей, или из предварительно образованных пустых гранул при помощи абсорбции соединения формулы (I) (или его раствора в приемлемом средстве) в пористый материал гранулы (такой как пемза, аттапульгитовая глина, фуллерова земля, кизельгур, диатомовая земля или измельченные кукурузные початки), или при помощи адсорбции соединения формулы (I) (или его раствора в приемлемом средстве) на материале твердого ядра (таком как песок,силикаты, минеральные карбонаты, сульфаты или фосфаты) и сушки, если необходимо. Средства, которые обычно используют для абсорбции или адсорбции, включают растворители (такие как алифатические и ароматические нефтяные растворители, спирты, эфиры, кетоны и сложные эфиры) и средства,способствующие прилипанию (такие как поливинилацетаты, поливиниловые спирты, декстрины, сахара и растительные масла). Одна или несколько других добавок может также содержаться в гранулах (например, эмульгирующее средство, смачивающее средство или диспергирующее средство). Диспергируемые концентраты (DC) можно получать растворением соединения формулы (I) в воде или органическом растворителе, таком как кетон, спирт или гликолевый эфир. Эти растворы могут содержать поверхностно-активное средство (например, для улучшения разбавления водой или предотвращения кристаллизации в резервуаре опрыскивателя). Эмульгируемые концентраты (ЕС) или эмульсии "масло-в-воде" (EW) можно получать с помощью растворения соединения формулы (I) в органическом растворителе (необязательно содержащем одно или несколько смачивающих средств, одно или несколько эмульгирующих средств или смесь указанных средств). Приемлемые органические растворители для применения в ЕС включают ароматические углеводороды (такие как алкилбензолы или алкилнафталены, показанные в SOLVESSO 100, SOLVESSO 150 и SOLVESSO 200; SOLVESSO является зарегистрированным товарным знаком), кетоны (такие как циклогексанон или метилциклогексанон) и спирты (такие как бензиловый спирт, фурфуриловый спирт или бутанол), N-алкилпирролидоны (такие как N-метилпирролидон или N-октилпирролидон), диметиламиды жирных кислот (такие как диметиламид С 8-С 10 жирной кислоты) и хлорированные углеводороды. Продукт ЕС может спонтанно эмульгироваться при добавлении в воду с получением эмульсии с достаточной стабильностью для обеспечения применения распылением посредством подходящего оборудования. Получение EW включает получение соединения формулы (I) либо в виде жидкости (если оно не является жидкостью при комнатной температуре, его можно расплавить при умеренной температуре,обычно ниже 70 С), либо в растворе (путем растворения его в подходящем растворителе) и затем эмульгирование полученной жидкости или раствора в воде, содержащей одно или несколько SFA, при высоком сдвиговом усилии с получением эмульсии. Подходящие растворители для применения в EW включают растительные масла, хлорированные углеводороды (такие как хлорбензолы), ароматические растворители (такие как алкилбензолы или алкилнафталины) и другие подходящие органические растворители, которые имеют низкую растворимость в воде. Микроэмульсии (ME) можно получить смешиванием воды со смесью одного или нескольких растворителей с одним или несколькими SFA с получением самопроизвольно термодинамически стабильного изотропного жидкого состава. Соединение формулы (I) присутствует изначально либо в воде, либо в смеси растворителя с SFA. Растворители, подходящие для применения в ME, включают описанные выше для применения в ЕС или в EW. ME может быть системой или "масло-в-воде", или "вода-в-масле" (какая система присутствует, можно определить измерением электрической проводимости) и может быть подходящей для смешивания растворимых в воде и растворимых в масле пестицидов в этом же составе. ME является подходящей для разведения в воде, при этом либо остается в виде микроэмульсии, либо образует обычную эмульсию масло-в-воде. Суспензионные концентраты (SC) могут содержать водные или неводные суспензии мелко измельченных нерастворимых твердых частиц соединения формулы (I). SC можно получать шаровым или гранулярным размалыванием твердого соединения формулы (I) в приемлемой среде необязательно с одним или несколькими диспергирующими средствами с получением суспензии мелких частиц соединения. Одно или несколько смачивающих средств можно включить в композицию, а также можно включить суспендирующее средство для снижения скорости, с которой частицы оседают. В качестве альтернативы соединение формулы (I) может быть измельчено сухим и добавлено в воду, содержащую средства, описанные выше в данном документе, с получением желаемого конечного продукта. Аэрозольные составы содержат соединение формулы (I) и приемлемый газ-вытеснитель (например,н-бутан). Соединение формулы (I) также можно растворить или диспергировать в подходящей среде (например, в воде или смешивающейся с водой жидкости, такой как н-пропанол) для обеспечения композиций для применения в приводимых в действие вручную насосах для опрыскивания с емкостью, не находящейся под давлением. Капсулированные суспензии (CS) можно получать подобно получению составов EW, но с дополнительным этапом полимеризации так, чтобы получить водную дисперсию капелек масла, в которой каждая капелька масла инкапсулирована полимерной оболочкой и содержит соединение формулы (I) и необязательно носитель или разбавитель для него. Полимерная оболочка может быть получена или при помощи реакции межфазной поликонденсации, или при помощи методики коацервации. Композиции могут быть предусмотрены для контролируемого высвобождения соединения формулы (I) и они могут применяться для обработки семян. Соединение формулы (I) также может быть составлено в биоразлагаемую полимерную матрицу для обеспечения медленного контролируемого высвобождения соединения. Композиция может включать одну или несколько добавок для улучшения биологической активности композиции, например, путем улучшения смачивания, удержания на поверхностях или распределения по поверхностям; устойчивости к смыванию дождем с обработанных поверхностей; или поглощения или подвижности соединения формулы (I). Такие добавки включают поверхностно-активные средства(SFA), добавки для опрыскивания на основе масел, например определенные минеральные масла или природные растительные масла (такие как соевое и рапсовое масло), и их смеси с другими биоусиливающими вспомогательными средствами (ингредиентами, которые могут содействовать или модифицировать действие соединения формулы (I. Смачивающие средства, диспергирующие средства и эмульгирующие средства могут представлять собой SFA катионного, анионного, амфотерного или неионного типа. Подходящие SFA катионного типа включают четвертичные аммонийные соединения (например,цетилтриметиламмония бромид), имидазолины и соли аминов. Подходящие анионные SFA включают соли щелочных металлов жирных кислот, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), соли сульфонированных ароматических соединений (например, додецилбензолсульфонат натрия, додецилбензолсульфонат кальция, бутилнафталин сульфонат и смеси диизопропил- и триизопропилнафталинсульфонатов натрия), эфирсульфаты, эфирсульфаты спиртов (например, лаурет-3-сульфат натрия), эфиркарбоксилаты (например, лаурет-3-карбоксилат натрия), сложные эфиры фосфорной кислоты (продукты реакции между одним или несколькими жирными спиртами и фосфорной кислотой (преимущественно сложные моноэфиры) или пентаоксидом фосфора (преимущественно сложные диэфиры), например, при реакции между лауриловым спиртом и тетрафосфорной кислотой; дополнительно эти продукты могут быть этоксилированы),сульфосукцинаматы, сульфонаты парафина или олефина, таураты и лигносульфонаты. Приемлемые SFA амфотерного типа включают бетаины, пропионаты и глицинаты. Приемлемые SFA неионного типа включают продукты конденсации алкиленоксидов, такие как этиленоксид, пропиленоксид, бутиленоксид или их смеси, с жирными спиртами (такими как олеиловый спирт или цетиловый спирт) или с алкилфенолами (такими как оксилфенол, нонилфенол или октилкрезол); частичные сложные эфиры, полученные из длинноцепочечных жирных кислот или гекситолангидридов; продукты конденсации указанных частичных сложных эфиров с этиленоксидом; блок-полимеры(содержащие этиленоксид и пропиленоксид); алканоламиды; простые сложные эфиры (например, сложные полиэтиленгликолевые эфиры жирных кислот); аминоксиды (например, лаурилдиметиловый аминоксид) и лецитины. Подходящие суспендирующие средства включают гидрофильные коллоиды (такие как полисахариды, поливинилпирролидон или карбоксиметилцеллюлоза натрия) и набухающие глины (такие как бентонит или аттапульгит). Настоящее изобретение, кроме того, относится к способу регулирования роста растений на местоположении, предусматривающему применение по отношению к местоположению регулирующего рост растений количества композиции в соответствии с настоящим изобретением. Настоящее изобретение также относится к способу обеспечения прорастания семян, предусматривающему применение по отношению к семенам или к местоположению, содержащему семена, стимулирующего прорастание семян количества композиции в соответствии с настоящим изобретением. Применение обычно осуществляют путем распыления композиции, как правило, при помощи распылителя на базе трактора для больших территорий, но также можно применять другие способы, такие как опудривание (для порошков), капельный полив или орошение. В качестве альтернативы, композицию можно вносить в борозду или непосредственно применять по отношению к семенам до посева или во время него. Соединение формулы (I) или композицию по настоящему изобретению можно применять по отношению к растению, части растения, органу растения, растительному материалу для размножения или окружающему их участку. В одном варианте осуществления настоящее изобретение относится к способу обработки растительного материала для размножения, предусматривающему применение по отношению к растительному материалу для размножения композиции по настоящему изобретению в количестве, эффективном для обеспечения прорастания и/или регулирования роста растений. Настоящее изобретение также относится к растительному материалу для размножения, обработанному соединением формулы (I) или композицией по настоящему изобретению. Предпочтительно материалом для размножения растений является семя. В варианте осуществления настоящего изобретения семена принадлежат растению, выбранному из родаBrassica. Семя в таком варианте осуществления выбрано из рода Brassica. Общие типы Brassica включают в себя капусту, цветную капусту, брокколи, брюссельскую капусту. Термин "растительный материал для размножения" означает все генеративные части растения, например семена, которые можно применять для размножения последнего, и вегетативные материалы растения, например черенки и клубни. В частности, следует упомянуть семена, корни, плоды, клубни, луковицы и корневища. Способы применения активных ингредиентов по отношению к растительному материалу для размножения, особенно семенам, известны в данной области техники и включают способы применения при помощи протравливания, покрытия, гранулирования и пропитывания материала для размножения. Обработку можно применять по отношению к семенам в любое время между сбором семян и высеванием семян или во время высевания. Семена также можно замачивать до или после обработки. Соединение формулы (I) необязательно можно применять в сочетании с покрытием или технологией для контролируемого высвобождения, вследствие чего соединение высвобождается постепенно. Композицию по настоящему изобретению можно применять до прорастания или после прорастания. Соответственно, если композиция используется для регулирования роста культурных растений, она может быть применена до или после появления всходов, но предпочтительно после появления всходов сельскохозяйственной культуры. Если композиция используется для обеспечения прорастания семян,она может быть применена как довсходовая. Нормы внесения соединений формулы I могут варьировать в широких пределах и зависят от свойств почвы, способа применения (до или после появления всходов; протравливание семян; применение по отношению к борозде для семян; беспахотное внесение и т. д.), культурного растения, преобладающих климатических условий и других факторов, определяемых способом применения, временем применения и целевой сельскохозяйственной культурой. Для лиственного нанесения или дождевания соединения формулы (I) в соответствии с настоящим изобретением, как правило, наносятся при норме от 1 до 2000 г/га, в частности от 5 до 400 г/га. Для обработки семян доза для применения, как правило, составляет 0,0005-150 г на 100 кг семян. Растения, для которых можно использовать композицию в соответствии с настоящим изобретением, включают культуры, такие как зерновые (например, пшеница, ячмень, рожь, овес); свекла (например,сахарная свекла или кормовая свекла); фруктовые (например, семечковые, косточковые или ягоды, такие как яблони, груши, сливы, персики, миндаль, вишни, клубника, малина или ежевика); бобовые растения(например, бобы, чечевица, горох или соя); масличные растения (например, рапс, горчица, мак, оливы,подсолнечник, кокосовая пальма, растения, дающие касторовое масло, какао-бобы или арахис); огуречные (например, кабачки, огурцы или дыни); волокнистые растения (например, хлопчатник, лен, конопля или джут); цитрусовые (например, апельсины, лимоны, грейпфрут или мандарины); овощи (например,шпинат, латук, спаржа, капуста, морковь, лук, томат, картофель, тыква или перец); Lauraceae (например,авокадо, коричное дерево или камфорное дерево); маис; рис; табак; орехи; кофе; сахарный тростник; чай; виноград; хмель; дуриан; банан; растения, дающие натуральный каучук; газонные или декоративные(например, цветы, кустарники, широколиственные деревья или вечнозеленые, такие как хвойные). Этот перечень не представляет никакого ограничения. Настоящее изобретение также может быть использовано для регуляции роста или для обеспечения прорастания семян растений, не являющихся сельскохозяйственными культурами, например, для облегчения контроля сорных растений путем синхронизации прорастания. Следует понимать, что сельскохозяйственные культуры также включают те культуры, которые были изменены при помощи традиционных способов селекции или при помощи генной инженерии. Например, настоящее изобретение можно применять по отношению к сельскохозяйственным культурам, которым была придана выносливость к гербицидам или классам гербицидов (например, ингибиторам ALS,GS, EPSPS, РРО, АССазы и HPPD). Примером культуры, которая стала выносливой к имидазолинонам,например к имазамоксу, общепринятыми способами селекции, является капуста полевая Clearfield (канола). Примеры сельскохозяйственных культур, которым придали выносливость к гербицидам с применением способов генной инженерии, включают, например, устойчивые к глифосату и глюфозинату сорта маиса, коммерчески доступные под торговыми названиями RoundupReady и LibertyLink. Способы придания культурным растениям выносливости к HPPD-ингибиторам известны, например, из WO 0246387; например, культурное растение является трансгенным в отношении полинуклеотида, содержащего последовательность ДНК, которая кодирует устойчивый к HPPD-ингибитору HPPD-фермент, полученный из бактерии, более конкретно, из Pseudomonas fluorescens или Shewanella colwelliana, или из растения, более конкретно, полученный из однодольного растения или, еще более конкретно, из ячменя,маиса, пшеницы, риса, видов Brachiaria, Chenchrus, Lolium, Festuca, Setaria, Eleusine, Sorghum или Avena. Культурами, которые следует рассматривать как ставшие устойчивыми к вредным насекомым с помощью способов генной инженерии, являются, например, маис Bt (устойчивый к мотыльку кукурузному), хлопок Bt (устойчивый к долгоносику хлопковому), а также картофель Bt (устойчивый к колорадскому жуку). Примерами маиса Bt являются гибриды маиса Bt 176 NK (Syngenta семян). Токсин Bt представляет собой белок, который в природе образуется почвенной бактерией Bacillus thuringiensis. Примеры токсинов или трансгенных растений, способных синтезировать такие токсины, описаны в ЕРА-451878, ЕР-А-374753, WO 93/07278, WO 95/34656, WO 03/052073 и ЕР-А-427529. Примерами трансгенных растений, содержащих один или несколько генов, которые кодируют инсектицидную устойчивость и экспрессируют один или несколько токсинов, являются KnockOut (маис), Yield Gard (маис),NuCOTIN33B (хлопчатник), Bollgard (хлопчатник), NewLeaf (разновидности картофеля), NatureGard и Protexcta. Как растительные культуры, так и их семенной материал могут быть устойчивыми к гербицидам и, в то же время, устойчивыми к поеданию насекомыми (трансгенные объекты с "пакетированными" генами). Например, семя может быть способно экспрессировать инсектицидный белок Cry3 и в то же время быть выносливым к глифосату. Сельскохозяйственные культуры также следует понимать как охватывающие культуры, которые получены традиционными способами селекции или генетической инженерии и обладают так называемыми привнесенными признаками (например, улучшенной стабильностью при хранении, более высокой питательной ценностью и улучшенным вкусом). Соединения и композиции в соответствии с настоящим изобретением могут применяться в комбинации с другими активными ингредиентами или продуктами для применения в сельском хозяйстве, в том числе инсектициды, фунгициды, гербициды, регуляторы роста растений, повышающие урожайность соединения, питательные вещества и биологические средства. Примеры приемлемых партнеров смешивания можно найти в Pesticide Manual, 15th edition (опубликованном British Crop Protection Council). Такие смеси можно применять по отношению к растению, растительному материалу для размножения или месту роста растения либо одновременно (например, как предварительно составленная смесь или баковая смесь), либо последовательно с приемлемыми временными рамками. Совместное применение пестицидов в соответствии с настоящим изобретением обладает дополнительным преимуществом, минимизируя затраченное фермером время на применение продуктов по отношению к культурам. В следующем аспекте настоящего изобретения соединения или композицию в соответствии с настоящим изобретением можно применять в комбинации с одним или несколькими другими соединениями, обладающими эффектом повышения урожая. Такие соединения включают в себя микроэлементы,сахариды, аминокислоты, флавоноиды, хинины активаторы/ростовые стимуляторы растений. Например,такие соединения включают в себя природные или синтетические гормоны, ауксины, брассиностероиды,гиббереллины, абсцизовую кислоту, цитокины, жасмонаты, стриголактоны, салициловую кислоту, этилен, 1-метилциклопропен, тринексапак-этил или их производные. Такие соединения также включают в себя пестициды, которые обладают эффектом увеличения урожая, например стробилурины (в том числе азоксистробин, пираклостробин) и неоникотиноиды (в том числе тиаметоксам и имидаклоприд). В настоящий момент показано, что такие стриголактамовые производные в соответствии с настоящим изобретением показывают эффекты улучшения урожая. Следовательно, настоящее изобретение относится к способу повышения и/или увеличения урожая культурных растений путем применения по отношению к растениям, частям растений, растительному материалу для размножения или месту выращивания растений соединения формулы (I). Выражение "повышение урожая" растения означает, что урожай продукта растения увеличивается на измеряемое количество по сравнению с урожаем того же продукта растения, полученного при тех же условиях, но без внесения комбинаций согласно настоящему изобретению. Предпочтительно, чтобы урожай увеличивался, по меньшей мере, на приблизительно 0,5%, предпочтительно на 1%, более предпочтительно на 2%, еще более предпочтительно на 4% или более. Еще более предпочтительным является увеличение урожая, по меньшей мере, на приблизительно 5, 10, 15 или 20% или более."Повышение качества сельскохозяйственных культур" согласно настоящему изобретению означает улучшение мощности растений, улучшение качества растений, усиление выносливости к факторам стресса и/или улучшенную эффективность использования затрат. В соответствии с настоящим изобретением "улучшение мощности растений" означает, что определенные признаки являются улучшенными качественно или количественно по сравнению с тем же признаком у контрольного растения, которое было выращено в таких же условиях в отсутствие способа по настоящему изобретению. Такие признаки включают без ограничения раннее и/или улучшенное прорастание, улучшенную всхожесть, способность к использованию меньшего количества семян, повышенный рост корней, более развитую корневую систему, повышенное образование корневых клубеньков, повышенный рост побегов, повышенное кущение, более сильные ростки, более продуктивные ростки, повышенную или улучшенную густоту стояния растений, меньшее "падение" растений (полегание), увеличение и/или улучшение высоты растений, увеличение массы растений (свежей или сухой), большие листовые пластинки, более зеленый цвет листа, повышенное содержание пигментов, повышенную фотосинтетическую активность, более раннее цветение, более длинные метелки, раннее созревание зерна, увеличенный размер семян, плодов или стручков, увеличенное количество стручков или колосьев, увеличенное количество семян на стручок или колос, увеличенную массу семян, повышенный налив семян,меньшее количество опавших нижних листьев, задержку старения, улучшенную жизнеспособность растения, увеличенные уровни аминокислот в запасающих тканях и/или меньшее количество затрат (например, меньшее количество необходимых удобрения, воды и/или трудовых затрат). Растение с улучшенной мощностью может иметь увеличение любого из вышеупомянутых признаков или любой комбинации или двух или более из вышеупомянутых признаков. В соответствии с настоящим изобретением "улучшение качества растений" означает, что определенные признаки являются улучшенными качественно или количественно по сравнению с тем же признаком у контрольного растения, которое было выращено в таких же условиях в отсутствие способа по настоящему изобретению. Такие признаки без ограничения включают улучшенный внешний вид растения, сниженный этилен (сниженное образование и/или ингибирование рецепции), улучшенное качество собранного материала, например семян, плодов, листьев, овощей (такие улучшенные качества могут проявляться как улучшенный внешний вид собранного материала), улучшенное содержание углеводов(например, увеличенные количества сахара и/или крахмала, улучшенный сахарокислотный коэффициент, снижение содержания редуцирующих сахаров, увеличенный показатель выработки сахара), увеличенное содержание белка, улучшенные содержание и композиция масла, улучшенную питательную ценность, снижение содержания непищевых соединений, улучшенные органолептические свойства (например, улучшенный вкус) и/или увеличенную пользу для здоровья потребителя (например, повышенные уровни витаминов и антиоксидантов), улучшенные послеуборочные свойства (например, увеличенные срок хранения и/или стабильность свойств при хранении, упрощенная перерабатываемость, упрощенное извлечение соединений), более однородное развитие сельскохозяйственной культуры (например, синхронизированные всхожесть, цветение и/или плодоношение растений) и/или улучшенное качество семян(например, для использования в следующих сезонах). Растение с улучшенным качеством может характеризоваться увеличением любого из вышеупомянутых признаков или любой комбинации двух или более из вышеупомянутых признаков. В соответствии с настоящим изобретением "улучшенная выносливость к стрессовым факторам" означает, что определенные признаки являются улучшенными качественно или количественно по сравнению с тем же признаком у контрольного растения, которое было выращено в таких же условиях в отсутствие способа по настоящему изобретению. Такие признаки включают без ограничения усиленную выносливость и/или устойчивость к абиотическим стрессовым факторам, которые вызывают субоптимальные условия роста, таким как засуха (например, любой стресс, который ведет к недостатку содержания воды в растениях, недостатку способности к поглощению воды или снижению обеспечения растений водой), воздействие холода, воздействие тепла, осмотический стресс, УФ-стресс, затопление, увеличенная засоленность (например, в почве), увеличенное воздействие минералов, воздействие озона, воздействие сильного освещения и/или ограниченная доступность питательных веществ (например, питательных веществ азота и/или фосфора). Растение с улучшенной выносливостью к стрессовым факторам может иметь увеличение любого из вышеупомянутых признаков или любой комбинации или двух или более из вышеупомянутых признаков. В случае засухи и питательного стресса такие улучшенные выносливости могут быть обусловлены, например, более эффективным поглощением, использованием или удерживанием воды и питательных веществ. В соответствии с настоящим изобретением "улучшенная эффективность использования затрат" означает, что растения способны расти более эффективно при использовании данных уровней затрат по сравнению с выращиванием контрольных растений, которые выращиваются в таких же условиях в отсутствие способа по настоящему изобретению. В частности, затраты включают без ограничения удобрение (например, азот, фосфор, калий, микроэлементы), свет и воду. Растение с улучшенной эффективностью использования затрат может характеризоваться улучшенным использованием любой из вышеупомянутых затрат или любого сочетания двух или более из вышеупомянутых затрат. Другие улучшения качества сельскохозяйственной культуры по настоящему изобретению включают уменьшение высоты растения или снижение кущения, которые являются полезными свойствами для сельскохозяйственных культур или при условиях, при которых желательно получить меньше биомассы и меньше побегов. Улучшение качества сельскохозяйственной культуры также включает в себя защиту культурных растений от фитотоксической активности пестицидов или других соединений, которые применяют по отношению к культуре. Любое или все из упомянутых выше улучшений качества культур могут вести к улучшенному урожаю путем улучшения, например, физиологии растений, роста и развития растения и/или строения растения. В контексте настоящего изобретения "урожай" включает без ограничения (i) увеличение продукции биомассы, урожай зерна, содержание крахмала, содержание масла и/или содержание белка, что может быть результатом (а) увеличения количества, производимого растением per se, или (b) улучшенной возможности сбора растительного материала, (ii) улучшение композиции собранного материала (например, улучшенные сахарокислотные коэффициенты, улучшенная композиция масла, увеличенная питательная ценность, снижение непищевых соединений, повышенная полезность для здоровья потребителя) и/или (iii) увеличенную/облегченную возможность сбора культуры, улучшенную способность культуры поддаваться переработке и/или лучшую стабильность при хранении/сроке хранения. Увеличенный урожай сельскохозяйственного растения означает, что, там, где возможно сделать количественное измерение, урожай продукта соответствующего растения является увеличенным на измеримое количество по сравнению с урожаем такого же продукта растения, полученного при таких же условиях, но без применения настоящего изобретения. В соответствии с настоящим изобретением предпочтительно, чтобы урожай увеличился по меньшей мере на 0,5%, более предпочтительно по меньшей мере на 1%, еще более предпочтительно по меньшей мере на 2%, еще более предпочтительно по меньшей мере на 4%, предпочтительно на 5% или даже больше. Любые или все вышеприведенные способы повышения качества сельскохозяйственной культуры могут также приводить к улучшенному использованию земли, т. е. земля, которая была ранее недоступной или субоптимальной в отношении культивирования, может стать доступной. Например, растения,которые показывают повышенную способность к выживанию в условиях засухи, могут быть пригодными для культивирования в областях с субоптимальным количеством атмосферных осадков, например,вполне возможно, на краю пустыни или даже в самой пустыне. В одном аспекте настоящего изобретения повышения качества сельскохозяйственной культуры осуществляются в отсутствии, по сути, давления вредителей, и/или болезней, и/или абиотического стресса. В следующем аспекте настоящего изобретения улучшения мощности растения, выносливости к стрессу, качества и/или урожая осуществляются в отсутствии, по сути, давления вредителей и/или болезней. Например, вредителей и/или болезни можно контролировать пестицидной обработкой, которая применяется до осуществления способа в соответствии с настоящим изобретением или одновременно с ним. В еще одном аспекте настоящего изобретения улучшения мощности растения, выносливости к стрессу,качества и/или урожая осуществляются в отсутствии, по сути, давления вредителей и/или болезней. В следующем варианте осуществления улучшения мощности растения, качества и/или урожая осуществляются в отсутствии или в отсутствии, по сути, абиотического стресса. В соответствии с настоящим изобретением обеспечивается применение соединения формулы (I) или композиции, содержащей соединение формулы (I), для улучшения урожая растения, мощности растения, качества растения, выносливости растения к стрессовым факторам и/или улучшенная эффективность использования затрат для растения. Улучшение урожая может быть достигнуто на ряде культур. Приемлемыми целевыми культурами являются, в частности, зерновые, такие как пшеница, ячмень, рожь, овес, рис, маис или сорго. Однако,предпочтительные культурные растения выбраны из группы, состоящей из кукурузы, пшеницы, риса,сои. Соединения в соответствии с настоящим изобретением могут быть получены следующими способами. Схема 1 Соединения формулы (VI), где R представляет собой C1-С 6 алкил, и W представляет собой кислород,могут быть получены из соединений формулы (VII) путем эстерификации с помощью обработки спиртом в присутствии кислоты, например серной кислоты в метаноле или этаноле. В качестве альтернативы, соединения формулы (VI) могут быть получены из коммерческого или некоммерческого исходного материала, такого как инданоновые производные, как описано в литературе (см., например, BioorganicMedicinal Chemistry (2008), 16(8), p. 4438; Journal of the Chemical Society, Perkin Transactions 1: Organic andBio-Organic Chemistry (1999), (18), p. 2617; WO 2005097093; Monatshefte fuer Chemie (1986), 117(5), p. 621). Инданоновые производные могут быть получены известными специалисту в данной области способами.i) Соединения формулы (III) могут быть получены из соединения формулы (VI), где R не является водородом, например R представляет собой метил или этил, путем восстановительного аминирования реакцией замещенного амина, такого как метиламин, и восстанавливающего средства, такого как цианоборгидрид натрия, с последующей in situ внутримолекулярной циклизацией.ii) В качестве альтернативы, соединения формулы (IIIa) могут быть получены из соединения формулы (VI), где R представляет собой Н, путем восстановительного аминирования реакцией амина, такого как ацетат аммония, и восстанавливающего средства, такого как цианоборгидрид натрия, с последующейiii) В качестве альтернативы, соединения формулы (IIIa) могут быть получены из соединения формулы (VI) путем образования оксима с использованием соли гидроксиламина и основания, такого как ацетат натрия или пиридин, с последующим восстановлением промежуточного оксима с использованием гидрогенирования с помощью Н 2 и катализатора, такого как Pd/C или ренеевского никелевого катализатора, или другими известными способами, такими как цинк в уксусной кислоте. Соединения формулы (III), где R1 представляет собой ароматическую или гетероароматическую группу, могут быть получены из соединения формулы (IIIa) (где R1 представляет собой Н) путем реакции амида с ароматическим или гетероароматическим соединением формулы ArX, X является галогеном,в присутствии основания, такого как фосфат калия, и с приемлемым катализатором, часто солью меди (I) и лигандом, таким как диметилэтан-1,2-диамин. Соединения формулы (III), где R1 не является водородом, могут быть получены из соединения формулы (IIIa) (где R1 является Н) путем алкилирования реакцией амида с алкилирующим средством,таким как алкилгалид, в присутствии основания, такого как гидрид натрия. Соединения формулы (III), где R1 представляет собой карбонильное производное, могут быть получены путем ацилирования соединения формулы (IIIa) с соединением формулы (V), где R представляет собой ОН, в присутствии связывающего реагента, такого как DCC (N,N'-дициклогексилкарбодиимид),EDC (1-этил-3-[3-диметиламино-пропил]карбодиимида гидрохлорид) или ВОР-С 1 (бис(2-оксо-3 оксазолидинил)фосфоновый хлорид), в присутствии основания, такого как пиридин, триэтиламин, 4(диметиламино)пиридин или диизопропилэтиламин, и необязательно в присутствии нуклеофильного катализатора, такого как гидроксибензотриазол. Необязательно, если R представляет собой С 1 или ОС(О)С 1-С 6 алкокси, реакция ацилирования может быть выполнена при основных условиях (например, в присутствии пиридина, триэтиламина, 4-(диметиламино)пиридина или диизопропилэтиламина), необязательно в присутствии нуклеофильного катализатора. В качестве альтернативы, реакция может быть проведена в двухфазной системе, включающей органический растворитель, предпочтительно этилацетат, и водный растворитель, предпочтительно раствор бикарбоната натрия. Необязательно, если R представляет собой C1-С 6 алкокси, амид может быть получен путем нагревания производного (V) и амида (IIIa) вместе. R' может быть алкилом или алкоксигруппой. Кроме того, соединения формулы (III) могут быть получены в рацемической форме, как описано в Journal of Pharmaceutical Sciences (1973), 62(8), p. 1363;Journal of Organic Chemistry (1994), 59(2), p. 284; Russian Journal of Organic Chemistry, (2005) 41(3), p. 361; или в WO 84/00962. Соединения формулы (III) или (IIIa), где A1, A2, A3 и А 4 описаны для соединения формулы (I), могут быть получены с помощью реакции соединений формулы (III) или (IIIa), где А 1, А 2, А 3 или А 4 независимо представляют собой C-LG, где LG представляет собой приемлемую уходящую группу, такую как,например, галоген или трифлат, с производным формулы Z-X, где Z представляет собой производные бора или олова, а X описан для соединения формулы (I), в присутствии приемлемой системы катализатора/лиганда, часто комплекса палладия(О). Эти реакции могут быть выполнены или нет при микроволновом излучении. Такие реакции известны специалисту в данной области под названием сочетания Стилла,Сузуки, см. например, Strategic Applications of Named Reactions in Organic Synthesis Kurti, Laszlo; Czako,Barbara; Editors. USA. (2005), Publisher: Elsevier Academic Press, Burlington, Mass, p.448 (сочетание Сузуки) и р.438 (сочетание Стилла), а также упомянутые ссылки. Соединения формулы (III) или (IIIa), где A1, A2, A3 и А 4 представляют собой CCR, где R представляет собой C1-С 6 алкил, арил, гетероарил, также могут быть получены реакцией соединений формулы (III) или (IIIa), где A1, A2, A3 или А 4 независимо представляют собой C-LG, где LG представляет собой приемлемую уходящую группу, такую как, например, галоген или трифлат, с производным формулы HCCR в присутствии приемлемой системы катализатор/лиганд, часто комплексом палладия(0) с источником меди или без источника меди, такого как йодид меди, органического основания, такого как диизопропилэтиламин. Такие реакции известны специалисту в данной области под названием сочетания Соногашира, см. например: Strategic Applications of Named Reactions in Organic Synthesis Kurti, Laszlo; Czako, Barbara; Editors. USA. (2005), Publisher: Elsevier Academic Press, Burlington, Mass, p.424 (сочетание Соногашира), а также упомянутые ссылки. Схема 3 Соединения формулы (II) могут быть получены из соединения формулы (III) путем реакции с производным сложного эфира муравьиной кислоты, таким как метилформиат, в присутствии основания, такого как диизопропиламид лития или трет-бутилат калия. В качестве альтернативы, соединения формулы(II) могут быть получены из соединения формулы (IV) путем гидролиза с кислотой, такой как хлороводород. Соединения формулы (IV) могут быть получены из соединений формулы (III) путем реакции с реагентом Бредерека (т-бутоксибис(диметиламино)метан), где R представляет собой метил или аналог. Соединения формулы (IIb) могут быть получены из соединения формулы (IIa), где R представляет собой алкильную группу, такую как трет-бутил, путем обработки кислотой, такой как трифторуксусная кислота или хлороводород. В качестве альтернативы, соединения формулы (IIb) могут быть получены из соединения формулы (IVa), где R представляет собой алкильную группу, такую как трет-бутил, путем обработки кислотой, такой как хлороводород. Схема 4 Соединения формулы (I) могут быть получены из соединений формулы (II) путем нуклеофильного замещения 5 Н-фуранонового производного, содержащего уходящую группу (LG), и LG является уходящей группой, такой как бром, в положении 5 в присутствии основания, такого как, например, третбутилат калия. В качестве альтернативы, соединения формулы (I), где R1 представляет собой алкильные производные или бензильные производные, могут быть получены из соединения формулы (Ia), где R1 представляет собой Н, путем алкилирования реакцией амина с алкилирующим средством, таким как алкилгалогенид, бензилгалогенид, необязательно в присутствии основания, такого как гидрид натрия. В качестве альтернативы, соединения формулы (I), где карбонильное производное, можгут быть получены из соединения формулы (Ia), где R1 представляет собой Н, путем ацилирования соединением формулы (V), где R представляет собой ОН, в присутствии связывающего реагента, такого как DCC(N,N'-дициклогексилкарбодиимид), EDC (1-этил-3-[3-диметиламино-пропил]карбодиимида гидрохлорид) или ВОР-С 1 (бис(2-оксо-3-оксазолидинил)фосфоновый хлорид), в присутствии основания, такого как пиридин, триэтиламин, 4-(диметиламино)пиридин или диизопропилэтиламин, и необязательно в присутствии нуклеофильного катализатора, такого как гидроксибензотриазол. Необязательно, если R представляет собой С 1 или ОС(О)С 1-С 6 алкокси, реакция ацилирования может быть выполнена при основных условиях (например, в присутствии пиридина, триэтиламина, 4-(диметиламино)пиридина или диизопропилэтиламина), необязательно в присутствии нуклеофильного катализатора. В качестве альтернативы, реакция может быть проведена в двухфазной системе, включающей органический растворитель,предпочтительно этилацетат, и водный растворитель, предпочтительно раствор бикарбоната натрия. Необязательно, если R представляет собой C1-С 6 алкокси, амид может быть получен нагреванием сложного эфира (V) и амида (Ia) вместе. R' может быть алкилом или алкоксигруппой. Соединения формулы (I), где W представляет собой серу, могут быть получены из соединения формулы (I), где W представляет собой кислород, путем нагревания с передающим тиогруппу реагентом,таким как реагент Лавессона или пентасульфид фосфора. Примеры. Для анализа соединений применяли следующие способы HPLC-MS. Способ А. Спектр регистрировали на масс-спектрометре ZQ (Waters Corp. Milford, MA, USA), оснащенном источником электрораспыления (ESI; температура источника 100 С; температура десольватации 250 С; напряжение на конусе 30 В; газовый поток на конусе 50 л/ч, газовый поток десольватации 400 л/ч, диапазон масс: 100-900 Да) и Agilent 1100 LC (колонка: Gemini С 18, размер частиц 3 мкм, 110 Ангстрем, 303 мм (Phenomenex, Torrance, CA, USA); температура колонки: 60 С; скорость потока 1,7 мл/мин; элюент А: Н 2 О/НСО 2 Н 100:0,05; элюент В: MeCN/MeOH/HCO2H 80:20:0,4; градиент: 0 мин 5% В; 2-2,8 мин 100% В; 2,9-3 мин 5% В; УФ-детектирование: 200-500 нм, разрешение 2 нм. Поток делили после колонки перед анализом MS. Способ В. Спектры регистрировали на масс-спектрометре SQD (Waters Corp. Milford, MA, USA), оснащенном источником электрораспыления (ESI; температура источника 150 С; температура десольватации 250 С; напряжение на конусе 45 В; газовый поток на конусе 650 л/ч, диапазон масс: 100-900 Да) и Agilent 1100MeCN/HCOOH 100:0,05; градиент: 0 мин 0% В; 0-1,2 мин 100% В; 1,2-1,50 мин 100% В; УФдетектирование: 210-500 нм, разрешение 2 нм. Поток делили после колонки перед анализом MS. Способ С. Спектры регистрировали на SQD Mass Spectrometer от Waters (одиночный квадрупольный массспектрометр), оснащенный источником электрораспыления (полярность: положительные или отрицательные ионы, капиллярность: 3,00 кВ, конус: 30,00 В, экстрактор: 2,00 В, температура источника: 150 С,температура десольватации: 250 С, газовый поток конуса: 0 л/ч, газовый поток десольватации: 650 л/ч,диапазон массы: 100-900 Да) и Acquity UPLC от Waters (двойной насос, камера нагретой колонки и детектор на диодной матрице, сольвентный дегазатор, двойной насос, камера нагретой колонки и детектор на диодной матрице, колонка: Phenomenex Gemini C18, 3 мкм, 302 мм, температура: 60 С, скорость потока 0,85 мл/мин; диапазон длин волны DAD (нм): 210-500) градиент растворителя: А=H2O+5% МеОН+0,05% НСООН, В=ацетонитрил+0,05% НСООН) градиент: 0 мин 0% В; 0-1,2 мин 100% В; 1,2-1,50 мин 100% В. Во всем этом разделе используются следующие аббревиатуры: s - синглет; bs - широкий синглет; d дуплет; dd - двойной дуплет; dt - двойной триплет; t - триплет, tt - тройной триплет, q - квартет, m - муль- 18024714(3aR,8bS,5'S)-5-аллил-3-[1-(4-метил-5-оксо-2,5-дигидро-фуран-2-илокси)-мет-(Е)-илиден]-3,3 а,4,8bтетрагидро-1 Н-индено[1,2-b]пиррол-2-она(В 1). Этап 1. Этиловый сложный эфир (1-оксо-4-бром-индан-2-ил)-уксусной кислоты К раствору 4-броминданона (15,8 г, 75 ммоль) при -78 С добавляли LiHMDS (1 М в THF, 90 мл). Светло-коричневому раствору позволяли нагреться до 0 С, опять охлаждали до -75 С и добавляли по каплям этил-2-бромацетат (9,1 мл, 82 ммоль). Смеси позволяли нагреться на протяжении ночи (от -75 С до -20 С в течение 12 ч). Смесь гасили насыщенным хлоридом аммония и экстрагировали этилацетатом. Флэш-хроматография давала 19,5 г титульного соединения в смеси с начальным инданон-этил-2-[4-бром 2-(2-этокси-2-оксо-этил)-1-оксо-индан-2-ил]ацетатом, который применяли без дополнительной очистки на следующем этапе (чистота, 60% необходимого продукта). LC-MS (способ A) RT 1,11 мин 297/299 Этот способ использовали для получения сложного этилового эфира (7-бром-1-оксо-индан-2-ил)уксусной кислоты. LC-MS (способ В) RT 0,90 мин, 297/299 (М+Н+). Этап 2. 5-Бром-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-он К раствору сложного этилового эфира (1-оксо-4-бром-индан-2-ил)-уксусной кислоты (3,47 г, 11,7 ммоль) в метаноле (90 мл) добавляли пиридин (1,88 мл, 23,4 ммоль) и гидроксиламин гидрохлорид (1,22 г, 17,5 ммоль). Раствор перемешивали в течение ночи при комнатной температуре, разбавляли водой,экстрагировали этилацетатом, дважды промывали насыщенным раствором гидрокарбоната натрия, сушили над сульфатом магния, фильтровали и концентрировали с получением соответствующего оксима(2,90 г, 80%). Соединение применяли без дополнительной очистки на следующем этапе. Оксим, полученный на предыдущем этапе (4,30 г, 14,4 ммоль), поглощали уксусной кислотой (50 мл) и нагревали до 60 С. Затем порциями добавляли цинковую пыль (9,43 г, 144,2 ммоль) с выдерживанием при температуре 80 С. Раствор перемешивали в течение 30 мин при 60 С и затем фильтровали. Воду добавляли к фильтрату, и раствор нейтрализовали твердым карбонатом калия, пока рН не достигло 7. Раствор экстрагировали дихлорметаном, промывали водной HCl (1 н), сушили и концентрировали с получением лактама G1 (2,9 г, 80%) в виде белого твердого вещества. LC-MS (способ A) RT 1,43 мин,252/254 (М+Н+). Этот способ использовали для получения 8-бром-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2 она. LC-MS (способ В) RT 0,69 мин, 252/254 (М+Н+). Этап 3. трет-Бутил-5-бром-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат К суспензии 5-бром-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (0,85 г, 3,4 ммоль) в водном ацетонитриле (50 мл) добавляли диметиламинопиридин (0,04 г, 0,3 ммоль), триэтиламин (0,944 мл,6,7 ммоль) и ди-трет-бутилдикарбонат (1,47 г, 6,7 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Раствор разбавляли этилацетатом и промывали хлороводородом (1 М) и солевым раствором. Объединенные органические слои высушивали и концентрировали. Остаток очищали флэшхроматографией с элюированием этилацетатом и циклогексаном (2/8) с получением желаемого продукта Этот способ использовали для получения трет-бутил-8-бром-2-оксо-3,3 а,4,8bтетрагидроиндено[1,2-b]пиррол-1-карбоксилата. LC-MS (способ В) RT 0,97 мин, 725/727/729 (2M+Na+). Этап 4. трет-Бутил-5-аллил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат (Е 1) Раствор трет-бутил-5-бром-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата (этап 3,500 мг), Pd(PPh3)4 (80 мг, 0,1 экв.), аллилтрибутилстанната (0,56 г, 1,20 экв.) в толуоле (17 мл) дегазировали и перемешивали с обратным холодильником в течение ночи. Растворитель удаляли под вакуумом. Остаток поглощали ацетонитрилом (40 мл) и промывали дважды н-гексаном. Ацетонитрил удаляли под вакуумом и остаток очищали флэш-хроматографией с элюированием этилацетатом и циклогексаном (125%) с получением 210 мг желаемого продукта El; LCMS (способ В), RT: 1,05 мин; ES+649 (2M+Na+). Аналогичные процедуры использовали для получения следующих соединений Е 4-Е 7 (табл. F) исходя из соответствующего трибутилстаннана (все коммерчески доступные). Этап 5. трет-Бутил-(3Z)-5-аллил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2b]пиррол-1-карбоксилат(D1) Раствор трет-бутил-5-аллил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата (этап 4, 0,21 г, 0,7 ммоль) в трет-бутоксибис(диметиламино)метане (0,415 мл, 2,0 ммоль) в толуоле (3 мл) нагревали при 110 С в течение ночи. Раствор разбавляли этилацетатом и дважды промывали водой, солевым раствором, сушили над сульфатом магния и концентрировали с получением трет-бутил-(3Z)-5 аллил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-1-карбоксилата D1 (бесцветное твердое вещество, 0,24 г, 97%). Данное соединение применяли без дополнительной очистки. LCMS (способ С) RT 1,05 мин, 369 (М+Н+). Этот способ применяли для получения соединения D2-D13 (табл. D). Этап 6. (3Z)-5-Аллил-3-(гидроксиметилен)-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-он С 1(37%, 0,68 мл). Раствор перемешивали в течение ночи при комнатной температуре, а затем разбавляли водой, экстрагировали этилацетатом, промывали солевым раствором, сушили и концентрировали с получением 0,200 г смеси (3Z)-5-аллил-3-(гидроксиметилен)-1,3 а,4,8b-тетрагидро-индено[1,2-b]пиррол-2-она и трет-бутил-(3Z)-5-аллил-3-(гидроксиметилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-1 карбоксилата. Раствор 0,100 г смеси (3Z)-5-аллил-3-(гидроксиметилен)-1,3 а,4,8b-тетрагидро-индено[1,2-b]пиррол 2-она и трет-бутил-(3Z)-5-аллил-3-(гидроксиметилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-1 карбоксилата в дихлорметане (18 мл) добавляли к трифторуксусной кислоте (2 мл) при 0 С. Раствор перемешивали в течение 2,5 ч при 0 С. Насыщенный раствор гидрокарбоната натрия добавляли и водный слой экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным раствором гидрокарбоната натрия, сушили и концентрировали in vacuo с получением (3Z)-5-аллил-3(гидроксиметилен)-1,3 а,4,8b-тетрагидро-индено[1,2-b]пиррол-2-она С 1 (70 мг, колич.). LC-MS (способ С)(0,036 г, 0,3 ммоль). Раствор перемешивали в течение 10 мин и добавляли раствор бромбутенолида (0,062 г, 0,3 ммоль, полученного согласно Johnsonall, J.C.S. Perkin I, 1981, 1734-1743) в тетрагидрофуране (1 мл). Раствор перемешивали при 0 С в течение 3 ч. Раствор разделяли между этилацетатом и водой, и водный слой экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали флэшхроматографией в элюированием в градиенте циклогексана и этилацетата (50-80%) с последующим изократическим периодом 80% этилацетата и циклогексана. Получали два диастереоизомера: диастереоизомер (3aR,8bS,5'R)-5-аллил-3-[1-(4-метил-5-оксо-2,5-дигидро-фуран-2-илокси)-мет(Е)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (А 1) (менее полярный, 5,6 мг); LCMS(способ С) RT 0,86 мин; 338 (М+Н+). Подобный способ использовали для получения соединений А 2-А 13 и В 2-В 13. Пример 2. Синтез диастереоизомера (3aR,8bS, 5'R)-5-этинил-3-[1-(4-метил-5-оксо-2,5-дигидрофуран-2-илокси)-мет-(Е)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (А 2) и диастереоизомера К дегазированному раствору трет-бутил-5-бром-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1 карбоксилата (пример 1, этап 3, 500 мг) последовательно добавляли Pd(PPh3)2Cl2 (0,1 г), йодид меди (0,04 г), триметилсилилацетилен (0,28 г, 0,4 мл) и диизопропиламин (0,40 мл). Реакционную смесь перемешивали при 80 С в течение 20 ч. Реакционную смесь разбавляли водой и этилацетатом, водную фазу дважды экстрагировали этилацетатом и объединенную органическую фазу промывали HCl 1 н и солевым раствором, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматография с градиентом этилацетата в циклогексане давала 130 мг (25%) желаемого продукта и 310 мг чистого исходного материал (63%): LCMS (способ С), RT: 1,22 мин, [761, 2M+Na+]. 1 Н ЯМР (400 МГц, CDC13)7,52 (1 Н, d),7,39 (1 Н, d), 7,19 (1 Н, t), 5,61 (1 Н, d), 3,10-3,23 (2 Н, m), 2,93 (1 Н, m), 2,78 (1 Н, dd), 2,30 (1 Н, dd), 1,61 (9 Н,s), 0,25 (9 Н, s) ppm. Этап 2. трет-Бутил-(3Z)-3-(диметиламинометилен)-2-оксо-5-(2-триметилсилилэтинил)-4,8bдигидро-3 аН-индено[1,2-b]пиррол-1-карбоксилат D2 Продукт получали способом, подобным таковому для продукта D1 (пример 1, этап 5), исходя из трет-бутил-5-триметилэтинил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата Е 2 (пример 2, этап 1, 0,13 г, 0,4 ммоль) получали трет-бутил-(32)-3-(диметиламинометилен)-2-оксо-5-(2 триметилсилилэтинил)-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-1-карбоксилат D2 (0,14 г, 94%). Данное соединение применяли без дополнительной очистки. LC-MS (способ С) RT 1,21, 425 (М+Н+). Этап 3. 3Z)-5-Этинил-3-(гидроксиметилен)-1,3a,4,8b-тетрагидроиндено[1,2-b]пиррол-2-он(С 2)(3Z)-3-(гидроксиметилен)-5-(2 триметилсилилэтинил)-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она в дихлорметане (18 мл) добавляли к трифторуксусной кислоте (2 мл) при 0 С. Раствор перемешивали в течение 1 ч при 0 С. Добавляли насыщенный раствор гидрокарбоната натрия и водный слой экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным раствором гидрокарбоната натрия, сушили и концентрировали Продукт получали способом, подобным таковому для продукта А 1 и В 1 (пример 1, этап 7), исходя из 3Z)-5-этинил-3-(гидроксиметилен)-1,3a,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она С 2 (пример 2,этап 3, 0,070 г, 0,3 ммоль). Получали два диастереоизомера: (А 2) (менее полярный, 15 мг) и (В 2) (более полярный, 6 мг, imp),диастереоизомер (3E,3aR,8bS)-5-этинил-3-[(4-метил-5-оксо-2 Н-фуран-2-ил)оксиметилен]-1,3 а,4,8bтетрагидроиндено[1,2-b]пиррол-2-она (А 2) (менее полярный, 14,9 мг); LCMS (способ С) RT 0,80 мин; 322(3E,3aR,8bR)-3-(2S)-4-метил-5-оксо-2 Н-фуран-2-ил]оксиметилен]-2-оксо-1,3 а,4,8bтетрагидроиндено[1,2-b]пиррол-7-карбоксилата (В 3). Соединения в данном примере синтезировали известным способом, описанным в Journal of Agricultural and Food Chemistry (1997), 45(6), p. 2278-2283, и в Journal of Agricultural and Food Chemistry (1992),40(7), p. 1230-5. Этап 1. Сложный 2-этиловый эфир - сложный 5-метиловый эфир 3-оксо-индан-2,5-дикарбоновой кислоты Перемешиваемую суспензию сложного метилового эфира 3-оксо-индан-5-карбоновой кислоты(коммерчески доступного, 300 мг, 1,5 ммоль) в сухом THF (7,3 мл) охлаждали до -70 С и каплями добавляли 1,0 М раствор лития бис(триметилсилил)амид в THF (3,4 мл, 3,4 ммоль) в течение 20 мин. Реакционной смеси позволяли нагреться до -33 С в течение 1 ч и получали рыжевато-бурый раствор. Реакционную смесь повторно охлаждали до -65 С и добавляли этилцианоформиат (239 мг, 0,24 мл, 2,4 ммоль) за одну минуту. Реакционной смеси позволяли нагреться до 15 С в течение 3 ч. Реакционную смесь разделяли между этилацетатом и 1 н HCl. Органические фазы последовательно промывали водой, насыщенным NaHCO3, солевым раствором и сушили (Na2SO4). Растворитель выпаривали досуха; полученное твердое вещество промывали гексаном, сушили с получением желаемого соединения (295 мг, 71%). 1 Н ЯМР (400 МГц, CDCl3)10,30 (0,25 Н, br, ОН), 8,41 (0,75 Н, s), 8,30 (1,5 Н, m), 8,11 (0,25 Н, m),7,55 (1 Н, m), 4,30 (2 Н, m), 3,77 (3 Н, s), 3,75 (0,75 Н, m), 3,63 (1,25 Н, m), 3,40 (0,75, m), 1,28 (3 Н, m) ppm К перемешиваемому раствору 2-сложного этилового эфира - сложного 5-метилового эфира 3-оксоиндан-2,5-дикарбоновой кислоты (этап 1, 500 мг, 1,9 ммоль) в сухом DMF (0,7 мл) добавляли гидрид натрия (84 мг, 2,0 ммоль, 60% в минеральном масле), а затем нагревали при 60 С в течение 1 ч. Затем этилбромацетат (350 мг, 2,0 ммоль) растворяли в сухом DMF (1,4 мл) и добавляли к реакционной смеси при комнатной температуре, а затем снова нагревали при 60 С в течение 3 ч. После окончания реакционную смесь концентрировали и добавляли Н 2 О (5 мл). Суспензию экстрагировали этилацетатом, и объединенный органический слой промывали солевым раствором, сушили и концентрировали. Неочищенный продукт очищали колоночной хроматографией с использованием 20% этилацетата-гексана с получением желаемого соединения (530 мг). 1 Н ЯМР (400 МГц, CDCl3) d 8,42 (1 Н, s), 8,30 (1 Н, d), 7,57 (1 Н, d), 4,37 Сложный 2-этиловый эфир - сложный 5-метиловый эфир 2-этоксикарбонилметил-3-оксо-индан-2,5 дикарбоновой кислоты (этап 2, 530 мг, 1,5 ммоль) в 1,3 мл смеси 6 н HCl и уксусной кислоты (1:1) нагревали до температуры флегмы в течение 3 ч. Реакционную смесь выпаривали досуха, добавляли 10 мл воды и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, а затем концентрировали. Неочищенный продукт промывали гексаном и передавали на следующий этап без дополнительной очистки (530 мг). К перемешиваемому раствору 2-карбоксиметил-3-оксо-индан-5-карбоновой кислоты (3,5 г, 14,9 ммоль) в метаноле (53 мл) добавляли концентрированную серную кислоту (5,6 мл) при 0 С. После добавления температуру реакционной смеси медленно повышали до комнатной температуры, а затем нагревали до температуры флегмы в течение 5 ч. Реакционную смесь выпаривали. Добавили воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным водным бикарбонатом натрия,солевым раствором, сушили и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с применением ацетона/гексана (25%) с выходом желаемого продукта Круглодонную колбу заполняли метил-2-(2-метокси-2-оксо-этил)-3-оксо-индан-5-карбоксилатом(3,0 г, 11 ммоль), метанолом (60 мл), гидроксиаммония хлоридом (34 ммоль, 2,4 г) и пиридином (46 ммоль, 3,7 мл). Полученный желтый раствор нагревали с обратным холодильником в течение ночи. Добавляли воду (200 мл) и экстрагировали этилацетатом (100 мл 3). Органический слой промывали солевым раствором, сушили (сульфат натрия), концентрировали при пониженном давлении с получением соответствующего оксима (3,28 г, колич.) и держали неочищенным. К раствору неочищенного оксима (3,28 г, 12 ммоль) в уксусной кислоте (35 мл) при 50-60 С пор- 23024714 циями добавляли цинк (120 ммоль, 7,7 г), поддерживали температуру ниже 70 С. Через 15 мин цинк отфильтровывали и промывали водой. Фильтрат выливали в воду и рН регулировали до 8-9 с помощью К 2 СО 3. Белую суспензию дважды экстрагировали этилацетатом. Органическую фазу промывали HCl 1 н с получением неочищенного метил-2-оксо-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-7-карбоксилата К суспензии метил-2-оксо-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-7-карбоксилата (этап 4,0,75 г, 3,2 ммоль) в водном ацетонитриле (30 мл) добавляли диметиламинопиридин (0,40 г, 0,32 ммоль),триэтиламин (2,7 мл, 19 ммоль) и ди-трет-бутилдикарбонат (2,8 г, 13 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Раствор разбавляли этилацетатом и промывали хлороводородом(1 М) и солевым раствором. Объединенные органические слои высушивали и концентрировали. Остаток очищали флэш-хроматографией с элюированием этилацетатом и циклогексаном (1/1) с получением титульного продукта Е 3 (990 мг, 92%). LCMS (способ В): RT: 0,90 мин, ES+685, 2M+Na+. Этап 6. трет-Бутил-7-метил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2b]пиррол-1,7-дикарбоксилат D3 Продукт получали способом, подобным таковому для продукта D1 (пример 1, этап 5), исходя из трет-бутил-7-метил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1,7-дикарбоксилата Е 3 (пример 3,этап 5, 0,500 г, 2,0 ммоль) получали названное соединение D3 (0,610 г, колич.). Данное соединение применяли без дополнительной очистки. LCMS (способ В): RT: 0,93 мин, ES+387, М+Н+. Этап 7. Метил-3-(гидроксиметилен)-2-оксо-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-7-карбоксилат С 3 К раствору трет-бутил-7-метил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2b]пиррол-1,7-дикарбоксилата (610 мг, 1,6 ммоль) в диоксане (20 мл) добавляли HCl (36%, 2,9 мл, 32 ммоль. Раствор перемешивали в течение ночи при комнатной температуре. Раствор разбавляли этилацетатом и дважды промывали водой, солевым раствором, сушили над сульфатом магния и концентрировали с получением титульного соединения (0,300 г, 73%). Данное соединение применяли без дополнительной очистки. LC/MS (способ В) RT: 0,65 мин; ES-258, М-Н+. Этап 8. Диастереоизомер метил-(3E,3aR,8bR)-3-(2R)-4-метил-5-оксо-2 Н-фуран-2 ил]оксиметилен]-2-оксо-1 ,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-7-карбоксилата (A3) и диастереоизомер метил-(3E,3aR,8bR)-3-(2S)-4-метил-5-оксо-2 Н-фуран-2-ил]оксиметилен]-2-оксо-1,3 а,4,8bтетрагидроиндено[1,2-b]пиррол-7-карбоксилата (В 3) Продукт получали способом, подобным таковому для продукта А 1 и В 1 (пример 1, этап 7), исходя из трет-бутил метил-3-(гидроксиметилен)-2-оксо-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-7 карбоксилата с 3 (пример 3, этап 7, 0,30 г, 1,2 ммоль) с получением титульного соединения D3 в виде смеси диастереоизомеров: диастереоизомер метил-(3 Е,3aR,8bR)-3-(2R)-4-метил-5-оксо-2 Н-фуран-2-ил]оксиметилен]-2-оксо 1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-7-карбоксилата (A3) (менее полярный, 73 мг); LCMS (способ(0,16 г, 0,14 ммоль), водой (7 мл) и наконец карбонатом цезия (1,0 г, 3,1 ммоль). Полученную смесь нагревали до температуры флегмы в течение ночи. Добавляли воду и раствор экстрагировали этилацетатом, промывали солевым раствором и концентрировали. Неочищенный материал очищали флэшхроматографией с элюированием этилацетатом/циклогексаном (99:1) с получением 8-циклопропил 3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (0,17 г, 0,7970 ммоль, 57%) в смеси с исходным материалом (77:23). LCMS (способ В) RT 0,75 мин; 214 (М+Н+). Этап 2. трет-Бутил-8-циклопропил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат Е 8 К раствору 8-циклопропил-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (этап 1, 0,170 г, 0,79 ммоль) в ацетонитриле (10 мл, 191 ммоль), добавляли ди-трет-бутилдикарбонат (0,521 г, 2,39 ммоль),диметиламинопиридин (0,097 г, 0,79 ммоль) и наконец триэтиламин (0,673 мл, 4,78 ммоль). Раствор нагревали с обратным холодильником в течение часа. Раствор разделяли между этилацетатом и 1 н HCl,экстрагировали, сушили и концентрировали. Неочищенный материал очищали флэш-хроматографией с элюированием этилацетатом/циклогексаном (3:17) с получением трет-бутил-8-циклопропил-2-оксо 3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата Е 8 (0,13 г, 0,41 ммоль, 52%) в виде желтого масла. LCMS (способ В) RT 1,04 мин; 369, М+Н+-Вос Этап 3. трет-Бутил-(3 Е)-8-циклопропил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро-3 аНиндено[1,2-b]пиррол-1-карбоксилат D8 Продукт получали способом, подобным таковому для продукта D1 (пример 1, этап 5), исходя из трет-бутил-8-циклопропил-2-оксо-3,За,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата Е 8 (пример 4, этап 2, 0,13 г, 0,41 ммоль), с получением титульного соединения D8 (0,16 г, колич.), которое использовали без дополнительной очистки в следующем этапе. LCMS (способ В) RT 1,04 мин; ES+759 (2M+Na+). Этап 4. (3 Е)-8-Циклопропил-3-(гидроксиметилен)-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-он С 8 Продукт получали способом, подобным таковому для продукта С 3 (пример 3, этап 7), исходя из трет-бутил-(3 Е)-8-циклопропил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2b]пиррол-1-карбоксилата D8 (этап 3, 0,16 г, 0,43 ммоль), с получением (3 Е)-8-циклопропил-3(гидроксиметилен)-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она С 8 (0,095 г, 91%), который использовали без дополнительной очистки в следующем этапе. LCMS (способ В) RT: 0,75 мин; ES+242 (М+Н+). Этап 5. Диастереоизомер (3E,3aR,8bS)-8-циклопропил-3-(2R)-4-метил-5-оксо-2 Н-фуран-2 ил]оксиметилен]-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она (А 8) и диастереоизомер (3E,3aR,8bS)-8 циклопропил-3-(2S)-4-метил-5-оксо-2 Н-фуран-2-ил]оксиметилен]-1,3 а,4,8b-тетрагидроиндено[1,2b]пиррол-2-она (В 8) Продукт получали способом, подобным таковому для продукта А 1 и В 1 (пример 1, этап 7), исходя из (3 Е)-8-циклопропил-3-(гидроксиметилен)-1,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она С 8 (0,095 г,0,3937 ммоль). Получали два диастереоизомера: (А 8) (менее полярный, 25 мг) и (В 8) (более полярный, 18 мг); диастереоизомер трет-Бутил-5-бром-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат (пример 1, этап 3, 0,500 г, 1,42 ммоль), трибутил(3-пиридил)станнан (0,784 г, 2,12 ммоль) и тетракис(трифенилфосфин)палладия (0,164 г, 0,142 ммоль) растворяли в толуоле. Смесь облучали в микроволновом реакторе при 160 С и нормальном уровне поглощения в течение 5 мин. Толуол удаляли и смесь поглощали ацетонитрилом и н-гексаном. Слой гексана опять экстрагировали ацетонитрилом, и объединенные ацетонитриловые слои сушили над сульфатом натрия и выпаривали. Неочищенный продукт очищали флэш-хроматографией с получением трет-бутил-2-оксо-5-(3-пиридил)-3,3 а,4,8bтетрагидроиндено[1,2-b]пиррол-1-карбоксилата E11 (0,409 г, 82%); LCMS (способ A) RT 1,45 мин;ES+351 (М+Н+). Соединения Е 9-Е 13 получали согласно данной процедуре. Таблица А Соединения формулы (I), менее полярный диастереоизомер Продукт гидролизуют в ходе анализа. Устанавливали массу соответствующего энола. Биологические примеры. Воздействие соединений формулы (I) на прорастание семян Orobanche cumana Wallr. оценивали на фильтровальной бумаге из стекловолокна (GFFP) в чашках Петри. Семена предварительно кондиционировали при влажности и приемлемой температуре, чтобы сделать восприимчивыми к конкретным химическим стимуляторам прорастания. Тестовые соединения растворяли в DMSO (10000 мг л-1) и хранили при комнатной температуре в эксикаторах с дессикантами. Маточные растворы растворяли деионизированной водой для соответствующей конечной тестовой концентрации. Семена O. cumana расы 'F' собирали с полей подсолнечника в Мансанилье (Севилья, Испания) в 2006 (партия семян IN146) и 2008 (партия семян IN153) и хранили при комнатной температуре. Для того чтобы отделить семена от тяжелых органических остатков, применяли модифицированный способ плавучести в растворе сахарозы, который описан HartmanTanimonure (Plant Disease (1991), 75, p. 494). Семенами заполняли делительную воронку и перемешивали их в воде. Когда семена всплывали на поверхность, водную фракцию, содержащую тяжелые остатки, отбрасывали. Семена повторно суспендировали в 2,5 М растворе сахарозы (относительная плотность 1,20) и тяжелым остаткам позволяли осесть в течение 60 мин. После удаления остатков семена дезинфицировали в 1%-ном растворе гипохлорита натрия и 0,025% (об./об.) Tween 20 в течение 2 мин. Семена сцеживали на двойной слой марли, прополаскивали стерильной деионизированной водой и повторно суспендировали в стерильной деионизированной воде. Два мл суспензии семян, содержащей приблизительно 150-400 семян, равномерно наносили на двойной слой стерильного диска фильтровальной бумаги из стекловолокна ( 9 мм) в чашках Петри ( 9 см). После смачивания дисков 3 мл стерильной деионизированной воды чашки Петри запечатывали парафильмом. Семена инкубировали в течение 10 дней при 20 С в темноте для кондиционирования семян. Верхний диск с кондиционированными семенами быстро сушили, переносили в чашку Петри, покрытую сухим диском GFFP, и смачивали 6 мл соответствующего тестового раствора. Соединения формулы (I) тестировали при концентрациях 0,001, 0,01 и 0,1 мг л-1. Аналог стриголактона GR24 (коммерчески доступный в качестве смеси изомеров) включали в качестве положительного контроля и 0,001%DMSO в качестве отрицательного контроля. Все обработки тестировали в пяти повторностях. Семена повторно инкубировали при 20 С в темноте и исследовали на прорастание 10 дней спустя. Первичные корешки пророщенных семян окрашивали в течение 5 мин синим чернилом (MIGROS, Switzerland) в 5%ной уксусной кислоте согласно Long et al. (Seed Science Research (2008), 18, p. 125). После окрашивания семена сканировали с использованием планшетного сканера с оптическим разрешением 1200 точек на дюйм (PULSTEK, OpticPro ST28) или фотографировали с использованием штатива кинокамеры с установленной цифровой SLR камерой (Canon EOS 5D). Прорастание 100 семян на повторность оценивали по цифровым изображениям. Семена считали пророщенными, если первичный корешок выступал из семенной оболочки. Результаты тестов на прорастание семян Orobanche показаны в табл. 3-6. Результаты показывают, что все тестируемые соединения индуцировали прорастание семян по сравнению с водным контролем. Таблица 3 Прорастание (%) предварительно кондиционированных семянOrobanche cumana партии IN146 расы F, обработанных соединениями формулы (I) при различных концентрацияхOrobanche cumana партии IN146 расы F, обработанных соединениями формулы (I) при различных концентрацияхOrobanche cumana партии IN153 расы F, обработанных соединениями формулы (I) при различных концентрацияхOrobanche cumana партии IN153 расы F, обработанных соединениями формулы (I) при различных концентрациях
МПК / Метки
МПК: A01N 43/38, C07D 209/70, C07D 405/12
Метки: качестве, растений, рост, производные, стриголактоновые, соединений, регулирующих
Код ссылки
<a href="https://eas.patents.su/30-24714-strigolaktonovye-proizvodnye-v-kachestve-soedinenijj-reguliruyushhih-rost-rastenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Стриголактоновые производные в качестве соединений, регулирующих рост растений</a>
Предыдущий патент: Способ определения пластового давления
Следующий патент: Пустотелая плита с межпустотными усилителями
Случайный патент: Составы, полученные из фруктов и овощей