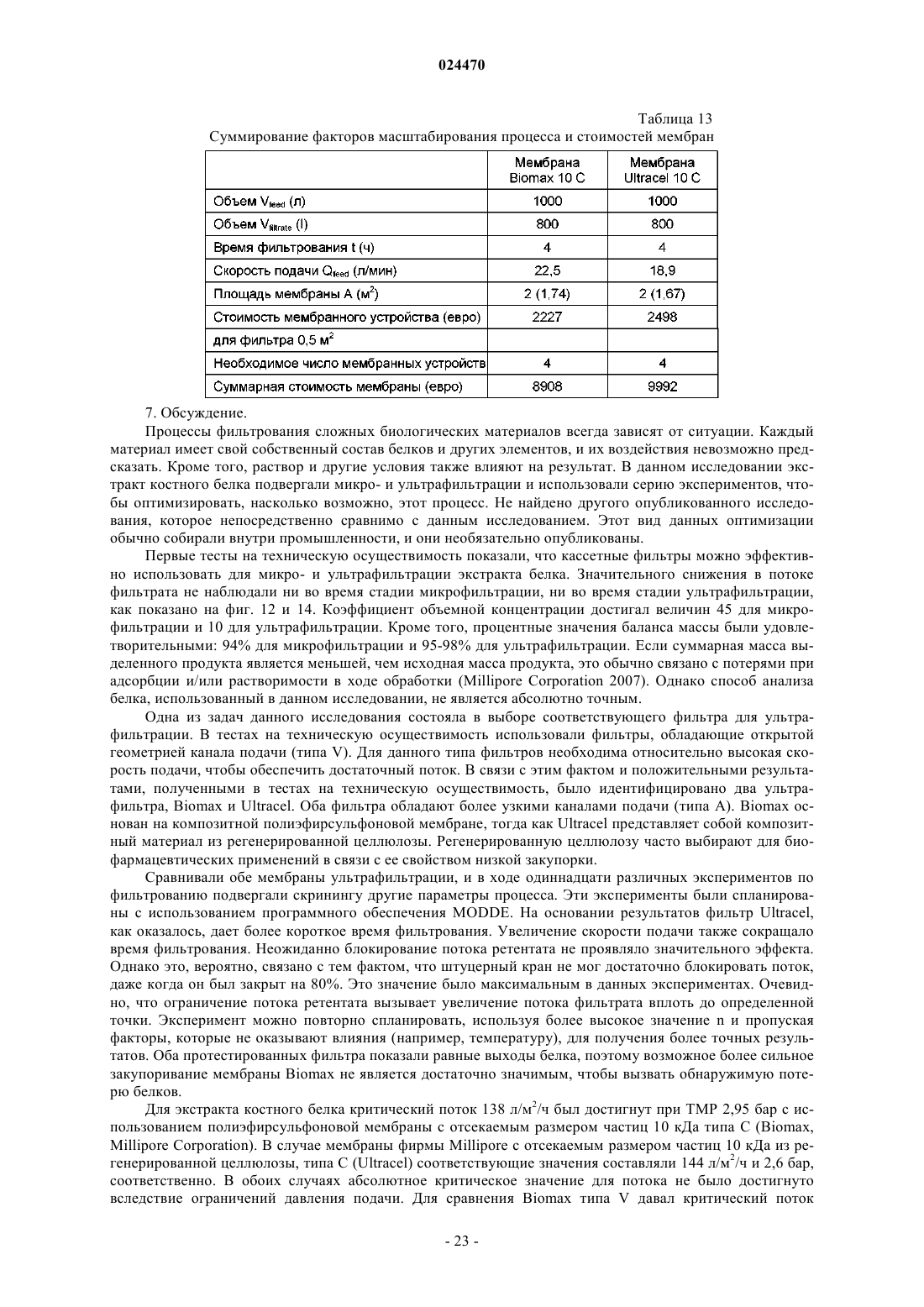
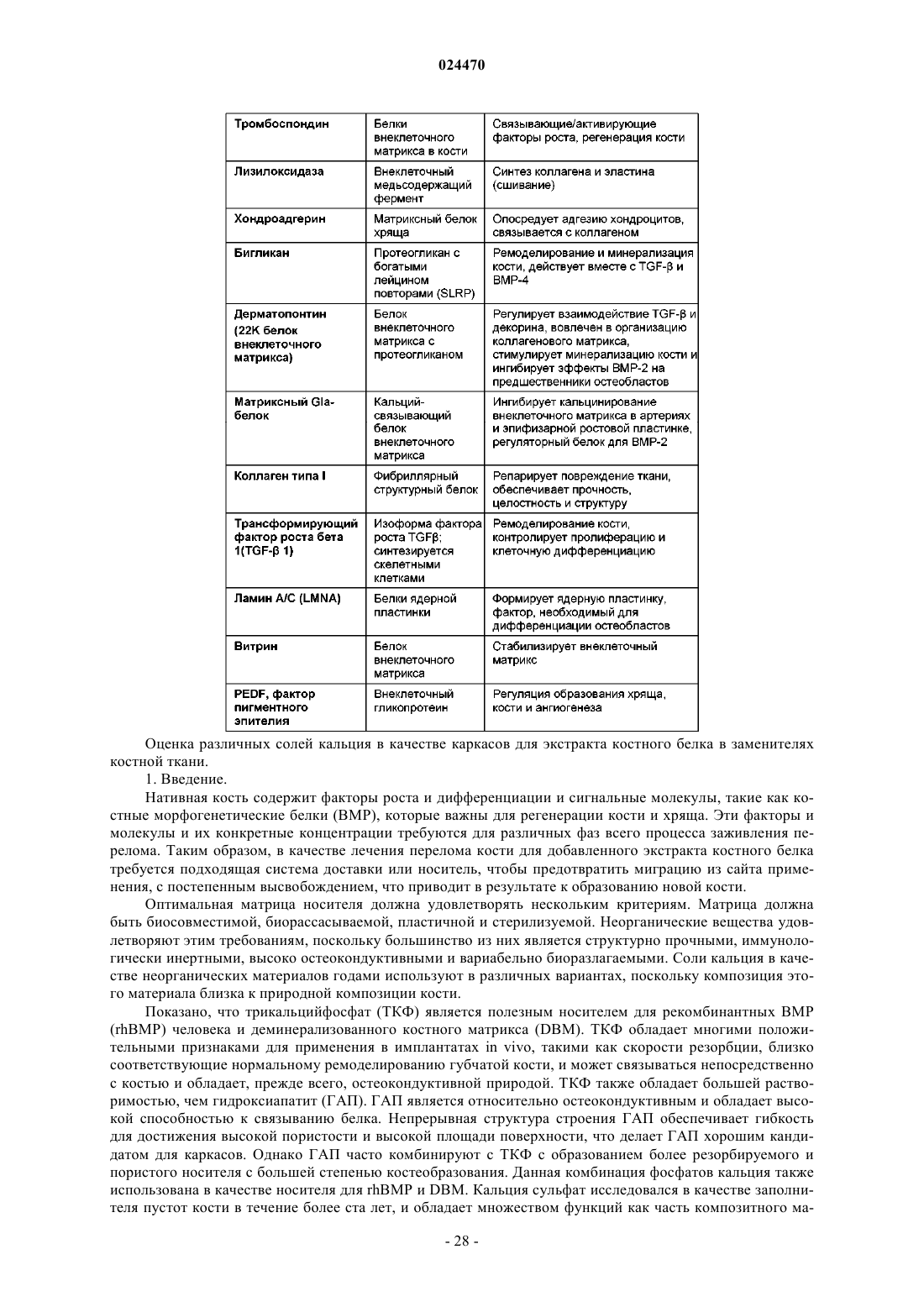
Способ получения препарата костного белка и препарат костного белка
Номер патента: 24470
Опубликовано: 30.09.2016
Авторы: Хайкола Мерья, Тёлли Ханна, Яловаара Пекка, Нярхи Юха-Матти, Виитанен Микко, Сандстрём Бо Кеннет, Бирр Элли, Хиетала Ойли, Лумме Харри
Формула / Реферат
1. Препарат костного белка, включенный в матрицу полиэтиленгликоль/глицерин (PEG-GLY), для обеспечения остеоиндуктивного эффекта, полученный способом, включающим:
a) деминерализацию кости и экстракцию костного матрикса растворителем гуанидингидрохлоридом с получением экстракта костного белка;
b) фильтрование экстракта микрофильтром с отсекаемым размером частиц в диапазоне 0,1-10 мкм (номинальное значение в микронах), достаточным для удаления крупных частиц и небелкового материала, но обеспечивающим прохождение белков;
c) фильтрование фильтрата кассетным ультрафильтром, имеющим отсекаемый размер частиц примерно 5-10 кДа, с выделением препарата костного белка;
d) включение препарата костного белка, полученного на стадии с), в матрицу полиэтиленгликоль/глицерин (PEG-GLY).
2. Препарат костного белка по п.1, отличающийся тем, что отсекаемый размер стадии b) составляет примерно 0,22-0,1 мкм или примерно 1000 кДа.
3. Препарат костного белка по п.1 или 2, отличающийся тем, что препарат костного белка, полученный на стадии с), подвергнут диализу для его концентрирования и дополнительной очистки, такому как диализ водой или раствором цитрата.
4. Препарат костного белка по любому из пп.1-3, отличающийся тем, что кость представляет собой кость млекопитающего, такую как кость северного оленя.
5. Препарат костного белка по п.4, отличающийся тем, что кость представляет собой губчатую или трубчатую кость.
6. Препарат костного белка, содержащий матриксный Gla-белок, SPP-24 (секретируемый фосфопротеин), ВМР-2, ВМР-7 и TGF-β1 в количествах, достаточных, чтобы обеспечить остеоиндуктивный эффект при ведении, отличающийся тем, что он включен в матрицу полиэтиленгликоль/глицерин (PEG-GLY).
7. Препарат костного белка по п.6, отличающийся тем, что он содержит по меньшей мере одно из следующего: бигликан, тромбин, ламин А/С, виментин, хондроадгерин, 22K внеклеточный матриксный белок, лизилоксидазу, остеонектин, коллаген или дерматопонтин в количествах, достаточных, чтобы обеспечить остеоиндуктивный эффект.
8. Препарат костного белка по п.6 или 7, отличающийся тем, что он представляет собой препарат костного белка по любому из пп.1-5.
9. Препарат костного белка по любому из пп.1-8, отличающийся тем, что препарат костного белка находится в форме лиофилизата.
10. Гранула, содержащая препарат костного белка по любому из пп.1-8.
11. Гранула по п.10, отличающаяся тем, что препарат костного белка находится на грануле в виде покрытия.
12. Гранула по п.10 или 11, отличающаяся тем, что представляет собой гранулу β-трикальцийфосфата (ТКФ).
13. Гранула по п.10, отличающаяся тем, что представляет собой гранулу кальция сульфата (КС).
14. Гранула по п.10, отличающаяся тем, что представляет собой гранулу гидроксиапатита (ГАП).
15. Гранула по п.10, отличающаяся тем, что представляет собой гранулу гидроксиапатит/β-трикальцийфосфат/кальция сульфат (ГАП/ТКФ/КС) предпочтительно в соотношении примерно 60:30:10 (мас./мас.).
16. Гранула по любому из пп.10-15, отличающаяся тем, что содержит стеариновую кислоту.
17. Гранула по п.10, отличающаяся тем, что препарат костного белка представляет собой препарат костного белка северного оленя, который находится в матрице полиэтиленгликоль/глицерин (PEG-GLY), содержащей стеариновую кислоту, содержащуюся в гранулах β-трикальцийфосфата (ТКФ).
18. Пеллета, содержащая препарат костного белка по любому из пп.1-8.
19. Пеллета по п.18, отличающаяся тем, что препарат костного белка находится на пеллете в виде покрытия.
20. Паста, содержащая препарат костного белка по любому из пп.1-8 или гранулу по любому из пп.10-17.
21. Остеогенное устройство, представляющее собой имплантат кости, содержащий препарат костного белка по любому из пп.1-8 или гранулу по любому из пп.10-17.
22. Способ лечения расстройств, относящихся к дефектам кости, хряща или зуба, где желательна их регенерация, репарация или рост, включающий введение препарата костного белка по любому из пп.1-8 или гранулы по любому из пп.10-17.
Текст
СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОСТНОГО БЕЛКА И ПРЕПАРАТ КОСТНОГО БЕЛКА В изобретении предложен препарат костного белка, включенный в матрицу полиэтиленгликоль/ глицерин (PEG-GLY), для обеспечения остеоиндуктивного эффекта, полученный способом,включающим a) деминерализацию кости и экстракцию костного матрикса растворителем гуанидингидрохлоридом с получением экстракта костного белка; b) фильтрование экстракта микрофильтром с отсекаемым размером частиц от 0,1 до 10 мкм (номинальное значение в микронах), достаточным для удаления крупных частиц и небелкового материала, но обеспечивающим прохождение белков; c) фильтрование фильтрата кассетным ультрафильтром,имеющим отсекаемый размер частиц от примерно 5 до примерно 10 кДа, с выделением препарата костного белка; d) включение препарата костного белка, полученного на стадии с), в матрицу полиэтиленгликоль/глицерин. Также предложен препарат костного белка, включенный в матрицу полиэтиленгликоль/глицерин (PEG-GLY) и содержащий матриксный Gla-белок, SPP-24(секретируемый фосфопротеин), ВМР-2, ВМР-7 и TGF-1 в количествах, достаточных, чтобы обеспечить остеоиндуктивный эффект при ведении. Кроме того, в изобретении предложены гранула, пеллета и остеогенное устройство, содержащие данные препараты костного белка, и способ лечения расстройств с их использованием. Тлли Ханна, Нярхи Юха-Матти,Лумме Харри, Бирр Элли, Хиетала Ойли, Виитанен Микко, Хайкола Мерья, Яловаара Пекка, Сандстрм Бо Кеннет (FI) Хмара М.В., Рыбаков В.М.,Новоселова С.В., Дощечкина В.В.,Липатова И.И. (RU)(71)(73) Заявитель и патентовладелец: ББС-БИОЭКТИВ БОУН САБСТИТЬЮТС ОЙ (FI) Аспекты настоящего изобретения относятся к способам получения препаратов костного белка. Несколько форм осуществления также относится к препаратам костного белка, полученным этим способом,и к композициям, содержащим один или более чем один из этих препаратов, включая остеогенные устройства. Предшествующий уровень техники В областях ортопедической и периодонтальной хирургии в высокой степени желательно найти эффективные системы для лечения пациентов со скелетными расстройствами и деформациями, включающего исправление крупных дефектов костей в результате травмы, удаления опухолей и врожденных пороков, реконструкцию изношенного костного вещества посредством имплантированного эндопротеза при ревизионных операциях и заживление медленно срастающихся или не срастающихся переломов. Аутологический трансплантат ("аутотрансплантат") является традиционным подходом к регенерации кости, но извлечение костных трансплантатов может привести к осложнениям, таким как кровотечение, боль и инфекция. Аутотрансплантаты также обладают ограниченной доступностью, поэтому в качестве альтернативы используют многие неорганические материалы. Фосфаты кальция, такие как гидроксиапатит (ГАП) и трикальцийфосфаты (ТКФ) и их вариации, являются общеизвестными материалами заменителей костной ткани. Эти материалы обеспечивают остеокондуктивный каркас для формирования новой кости. Биологическую активность неорганических материалов можно повысить путем добавления остеогенного стимула в наполнитель костного трансплантата. Во многих различных исследованиях показано,что аллотрансплантаты, деминерализованные костные матриксы (demineralised bone matrices, DBM) и нативные костные экстракты повышают способность к заживлению кости и усиливают интеграцию. Показано, что комбинации бычьих факторов роста костной ткани в носителях на основе коллагена и DBM или кораллового ГАП (гидроксиапатита) обладают настолько же хорошим эффектом, что и аутогребни подвздошной кости, при исследовании скоростей сращения в позвоночном артродезе у кроликов и обезьян. Имеющиеся в продаже синтезированные биоматериалы разработаны и могут применяться в качестве заполняющего материала или внутренней, а также наружной опоры. К сожалению, у этих материалов отсутствует биологическая активность, необходимая для инициации регенерации кости. Синтетические носители, полученные из таких материалов, включая полимеры молочной кислоты и гиалуроновые кислоты, описаны, например, в патенте US 5366508. Костный морфогенетический белок (bonemorphogenetic protein, BMP) считают важным фактором в остеогенных устройствах, и он активно участвует в процессе имплантации. В ЕР 0883410 В 1 раскрыт способ получения модифицированного комплекса костного морфогенетического белка (BMP) для остеогенного устройства, где этот модифицированный комплекс BMP может быть получен способом, включающим стадии (а) тонкого измельчения деминерализованного костного вещества; (b) экстракции костного вещества на стадии (а) гуанидиния гидрохлоридом (GuHCl); (с) проведения фильтрации с использованием системы тангенциального потока; (d) проведения гельфильтрации, посредством которой получают частично очищенный комплекс BMP, демонстрирующий три пика, содержащих три различных белковых фракции, которые характеризуются тем, что имеют различные молекулярные массы, где фракцию I составляет белок высокой молекулярной массы MW (100700 кДа) с остеоиндуктивной активностью BMP, фракцию II составляет белок средней MW (25-55 кДа),иммуногенный белок, у которого отсутствует активность BMP, и фракцию III составляет белок низкойMW (15-25 кДа) с остеоиндуктивной активностью BMP; и (е) удаления из частично очищенного BMP фракции с иммуногенными и воспалительными свойствами, имеющей MW 25-55 кДа, что определяют с помощью гель-фильтрации. Необходимость в дополнительных остеогенных материалах, которые полезны для ряда применений при регенерации кости, в частности, в материалах, совместимых с материалами носителей, обычно используемых в вышеописанных областях применения, очевидна. Краткое изложение изобретения Неожиданно обнаружено, что экстракт костного белка, содержащий факторы роста, среди других белков, обеспечивает уникальные остеогенные свойства. Экстракт костного белка, например, может ускорить десорбцию каркаса или носителя, в который включен этот экстракт. Соответственно, несколько форм осуществления включают способы получения препарата костного белка, которые осуществляют на практике путем:a) деминерализации кости и экстракции костного матрикса гуанидингидрохлоридом с получением экстракта костного белка;b) фильтрования экстракта с помощью микрофильтра с отсекаемым размером частиц, достаточным для удаления крупных частиц и небелкового вещества, но обеспечивающим прохождение белков;c) фильтрования фильтрата с помощью кассетного ультрафильтра, имеющего отсекаемый размер частиц примерно 5-10 кДа, с выделением препарата костного белка. Несколько форм осуществления, описанных в данной работе, включает препарат костного белка,полученный одним или более чем одним из вышеупомянутых способов. Некоторые формы осуществления включают препарат костного белка, содержащий факторы роста,факторы дифференциации и сигнальные молекулы, которые обеспечивают при их комбинировании синергический эффект и/или активность, которая может быть полезна для остеоиндуктивных целей, например, чтобы усилить преимущественные свойства стимулирования роста кости. Факторы роста, факторы дифференциации и сигнальные молекулы могут включать белки, определенные в данной работе,такие как костный морфогенетический белок (белки) (BMP) и белки, находящиеся в нативных деминерализованных костных экстрактах. В одной форме осуществления препарат костного белка, содержащий факторы роста, факторы дифференциации и сигнальные молекулы, получают любым способом, описанным в данной работе. Аспекты настоящего изобретения также включают препарат костного белка, содержащий один или более чем один из белков, описанных в данной работе, например, некоторые формы осуществления включают или по существу состоят из матриксного Gla-белка, SPP-24 (secreted phosphoprotein, секретируемого фосфопротеина), ВМР-2, ВМР-7 и/или TGF-1. Аспекты изобретения также включают пасты или гели, такие как инъекционная паста или гель, содержащие один или более чем один из препаратов костного белка, описанных в данной работе. Паста или гель могут быть формуемыми, и их форма может также называться мастикой. Соответственно, некоторые формы осуществления включают мастику, пеллету (пилюлю), диск,блок или гранулу, содержащие препарат костного белка, который включает один или более чем один из белков, описанных в данной работе, например, некоторые формы осуществления включают или по существу состоят из матриксного Gla-белка, SPP-24 (секретируемого фосфопротеина), ВМР-2, ВМР-7 и/илиTGF-1. Некоторые формы осуществления также включают остеогенное устройство, такое как костный имплантат, содержащий один или более чем один из препаратов костного белка, описанных в данной работе, например, которым пропитана матрица, такая как пористая матрица. Таким образом, некоторые формы осуществления представляют собой остеогенные устройства, которые содержат один или более чем один из белков, описанных в данной работе, например, некоторые формы осуществления включают или по существу состоят из матриксного Gla-белка, SPP-24 (секретируемого фосфопротеина), ВМР-2, ВМР-7 и/или TGF-1. В некоторых формах осуществления один или более чем один из препаратов костного белка, описанных в данной работе, можно применять для лечения, ослабления, ингибирования или предупреждения расстройства или состояния, относящегося к дефектам кости, хряща, сухожилия или зуба, где желательна их регенерация, репарация или рост, такого как рак. Некоторые формы осуществления, описанные в данной работе, включают фармацевтическую композицию, содержащую один или более чем один из препаратов костного белка, описанных в данной работе. Эти фармацевтические композиции можно применять для лечения, ослабления, ингибирования или предупреждения расстройства или состояния, относящегося к дефектам кости, хряща, сухожилия или зуба, где желательна их регенерация, репарация или рост, такого как рак. В некоторых формах осуществления рассмотрены способы стимулирования (индукции) образования кости, хряща, сухожилия или зубов, in vitro или in vivo, и эти способы осуществляют на практике путем предоставления или введения одного или более чем одного из костных препаратов, описанных в данной работе (желательно в остеогенном устройстве или подходящей матрице), субъекту, нуждающемуся в этом, например человеку или животному (включая домашних животных и животныхкомпаньонов). Необязательно, субъект может быть идентифицирован или классифицирован как субъект,нуждающийся в агенте, который индуцирует образование кости, хряща, сухожилия или зубов, и такую оценку может осуществить врач, стоматолог или хирург путем клинической диагностики. Необязательно, эти способы также могут включать анализ, наблюдение, измерение или клиническую оценку образования кости, хряща, сухожилия или зубов до и/или после предоставления или введения одного или более чем одного из костных препаратов, описанных в данной работе (желательно в остеогенном устройстве или подходящей матрице), субъекту, нуждающемуся в этом. В следующих формах осуществления рассмотрены способы лечения, ослабления, ингибирования или предупреждения расстройства или состояния, относящегося к дефектам кости или хряща, такого как рак. Эти способы можно осуществлять на практике путем предоставления или введения одного или более чем одного из костных препаратов, описанных в данной работе (желательно в остеогенном устройстве или подходящей матрице), субъекту, нуждающемуся в этом, например, человеку или животному(включая домашних животных и животных-компаньонов). Необязательно, субъект может быть идентифицирован или классифицирован как субъект, нуждающийся в агенте, который лечит, ослабляет, ингибирует или предупреждает расстройство или состояние, относящееся к дефектам кости или хряща, такое как рак, и такую оценку может осуществить врач, стоматолог или хирург путем клинической диагностики. Необязательно, эти способы также включают анализ, наблюдение, измерение или клиническую оценку образования кости, хряща, сухожилия или зубов до и/или после предоставления или введения одного или более чем одного из костных препаратов, описанных в данной работе (желательно в остеогенном устройстве или подходящей матрице), субъекту, нуждающемуся в этом. Необязательно, эти способы также могут включать анализ, наблюдение, измерение или клиническую оценку прогрессирования, ингибирования, ослабления или лечения заболевания, расстройства или состояния, связанного с ними, и эти анализы, наблюдения или измерения можно проводить путем клинической оценки или диагностических методов. Кроме того, в следующих формах осуществления один или более чем один экстракт костного белка,описанный в данной работе, комбинируют с каркасом или носителем, таким как трикальцийфосфат или кальция сульфат, и полученную в результате композицию применяют для ускорения десорбции каркаса или носителя, улучшая посредством этого процесс заживления кости у субъекта, нуждающегося в заживлении кости. Соответственно, рассмотрены способы ускорения образования кости, хряща, сухожилия или зубов in vitro или in vivo, и эти способы осуществляются путем предоставления или введения композиции, содержащей один или более чем один из экстрактов костного белка, описанных в данной работе,и трикальцийфосфат или кальция сульфат, субъекту, нуждающемуся в этом, например, человеку или животному (включая домашних животных и животных-компаньонов). Необязательно, субъект может быть идентифицирован или классифицирован как субъект, нуждающийся в агенте, который ускоряет образование кости, хряща, сухожилия или зубов, и такую оценку может осуществить врач, стоматолог или хирург путем клинической диагностики. Необязательно, эти способы также могут включать анализ, наблюдение, измерение или клиническую оценку образования кости, хряща, сухожилия или зубов до и/или после предоставления или введения одного или более чем одного из костных препаратов, описанных в данной работе (желательно в остеогенном устройстве или подходящей матрице), субъекту, нуждающемуся в этом. Краткое описание графических материалов На фиг. 1 показаны изменения в потоке фильтрата в течение 1000 кДа фильтрации. Суммарный объем партии составлял 45 л. На фиг. 2 показана концентрация суммарного белка (мг/мл) в потоках пермеата и ретентата в течение микрофильтрации. Взятие образцов всегда осуществляли, когда накапливалось 4 л пермеата и в конечной точке. На фиг. 3 показаны скорости потока в течение ультрафильтрации через фильтры типа V 10 кДа. А обозначает 22-литровую партию, а В - 23-литровую партию. На фиг. 4 показан анализ с помощью SDS-PAGE электрофореза (электрофорез в полиакриламидном геле с додецилсульфатом натрия, ДСН-ПААГ) конечного пермеата в результате фильтрации через кассетный фильтр типа V 10 кДа (дорожка 2). Электрофорез проводили, используя восстанавливающие условия и постоянное напряжение 200 В, в течение 50 мин. Размеры белков-стандартов молекулярной массы (дорожка 1), начиная сверху, составляют 250, 150, 100, 75, 50, 37, 25, 20, 15 и 10 кДа. На фиг. 5 показано определение критического потока для микрофильтрации. Поток (сверху) и ТМР(transmembrane pressure, трансмембранное давление) (снизу) при начальных скоростях поперечного потока 1,15 л/мин (А) и 1,66 л/мин (В). На фиг. 6 показано определение критического потока для микрофильтрации через 1000 кДа кассетный фильтр. Поток (сверху) и ТМР (снизу) при начальных скоростях поперечного потока 2,15 л/мин (А) и 2,75 л/мин (В). На фиг. 7 показаны кривые оптимизации потока в зависимости от ТМР в случае VCF (volumetricconcentration factor, коэффициент объемной концентрации) 1 для ультрафильтрации через кассетный фильтр типа V 10 кДа. Используемые начальные скорости поперечного потока составляли 1,15 л/мин(А), 1,66 л/мин (В), 2,15 л/мин (С) и 2,75 л/мин (D). Фиг. 8 показана оптимизация потока в зависимости от ТМР в случае VCF 10 для ультрафильтрации через кассетный фильтр типа V 10 кДа. Используемые начальные скорости поперечного потока составляли 1,66 л/мин (А) и 2,75 л/мин (В). На фиг. 9 приведено краткое описание модели, подобранной с использованием метода частных наименьших квадратов (PLS) в программе MODDE. Два результата в модели представляли собой время и концентрацию белка (выход). На фиг. 10 показано воздействие изучаемых параметров на продолжительности ультрафильтрации,рассчитанное с использованием программы MODDE. Сокращение "pum" относится к скорости подачи,"ret" к блокированию потока ретентата, "Temp" к температуре фильтрации, "Mem(А)" к мембране А (полиэфирсульфоновый фильтр Biomax типа С) и "Mem(В)" к мембране В (фильтр из регенерированной целлюлозы Ultracel типа С). На фиг. 11 показаны профили белка четырех пермеатов ультрафильтрации, построенные с использованием программы MODDE. Анализ с помощью электрофореза в SDS-PAGE проводили, используя невосстанавливающие условия и постоянное напряжение 200 В, в течение 50 мин. Дорожка 1: Стандарт молекулярной массы, дорожка 2: пермеат из пробега 1 (мембрана В), дорожка 3: пермеат из пробега 4(мембрана В), дорожка 4: пермеат из пробега 7 (мембрана А) и дорожка 5: пермеат из пробега 10 (мембрана А). Размеры белков-стандартов молекулярной массы (дорожка 1), начиная сверху, составляют 250,150, 100, 75, 50, 37, 25, 20, 15 и 10 кДа. На фиг. 12 показаны кривые для оптимизации потока в зависимости от ТМР для кассеты ультрафильтрации Biomax типа С. VCF составлял 1, и начальные скорости поперечного потока составляли 0,945 л/мин (А), 1,125 л/мин (В) и 1,350 л/мин (С). На фиг. 13 показаны кривые для оптимизации потока в зависимости от ТМР для кассеты ультрафильтрации Biomax типа С. VCF составлял 5, и начальные скорости поперечного потока составляли 0,945 л/мин (А) и 1,350 л/мин (В). На фиг. 14 показаны кривые для оптимизации потока в зависимости от ТМР для кассеты ультрафильтрации Ultracel типа С. VCF составлял 1, и начальные скорости поперечного потока составляли 0,730 л/мин (А), 0,945 л/мин (В) и 1,125 л/мин (С). На фиг. 15 показаны кривые для оптимизации потока в зависимости от ТМР для кассеты ультрафильтрации Ultracel типа С. VCF составлял 5, и начальные скорости поперечного потока составляли 0,945 л/мин (A) and 1,125 л/мин (В). На фиг. 16 показано восстановление NWP (normalized water permeability, нормализованной водопроницаемости) фильтров Biomax и Ultracel типа С после цикла промывки 0,1 М NaOH при 37 С в течение 30 мин. Предшествующие фильтрации проводили, используя объем подачи 3 л при VCF 10. На фиг. 17 показана диаграмма иллюстративной установки в маломасштабном процессе получения. На фиг. 18 показана блок-схема иллюстративного способа получения экстракта костного белка. На фиг. 19 показан электрофорез в SDS-PAGE нативного экстракта, деминерализованного муравьиной кислотой. Полосы белка выделяли из SDS-PAGE и анализировали с помощью MS-MALDI-TOF(времяпролтной масс-спектрометрии с лазерной ионизацией и десорбцией из матрицы). На фиг. 20 показан электрофорез в SDS-PAGE нативного экстракта, деминерализованного HCl. Полосы белка выделяли из SDS-PAGE и анализировали с помощью MS-MALDI-TOF. На фиг. 21 показаны объемы кости, измеренные из изображений микроКТ (компьютерной томографии). При статистических сравнениях все остальные группы были значимо лучше, чем группа деминерализованного костного матрикса (Grafton Plus DBM) (ар 0,02). Во всех группах имплантата экстракта костного белка, в группе аутотрансплантата, а также в других контрольных группах, за исключением группы DBM, заживление было значимо лучше, чем в необработанных дефектах (bp0,02). Группа аутотрансплантата была значимо лучше по объему кости, чем группа пасты 4 (ср 0,02). Контрольные группы отмечены как прик-паттерн. На фиг. 22 представлено гистологическое исследование, которое показывает, что биологическая активность и образование новой кости для дозы 3 мг экстракта костного белка северного оленя в желатиновой капсуле в мышиной модели кармана. В = кость. (Исходное увеличение 10). На фиг. 23 представлено гистологическое исследование, которое показывает образование новой кости и ответ имплантата в мышиной модели кармана с использованием различных носителей с экстрактом костного белка северного оленя: (а) ГАП/ТКФ/КС 30:60:10 активное вещество, (b) ГАП/ТКФ/КС 30:60:10 контроль без экстракта костного белка, (с) КС полугидрат активное вещество, (d) КС полугидрат контроль, (е) КС дигидрат + стеариновая кислота активное вещество и (f) КС дигидрат + стеариновая кислота контроль. С = кальцинированные хрящевые клетки, В = кость, М = мышца, F = фиброзная ткань и I = носитель имплантата. (Исходное увеличение 10). На фиг. 24 показана радиографическая оценка образования новой кости в мышиной модели кармана с использованием различных носителей с экстрактом костного белка северного оленя. Контроль без экстракта костного белка был расположен на правой стороне, а активный имплантат был расположен на левой стороне: (а) ГАП/ТКФ/КС 30:60:10, (b) КС полугидрат и (с) КС дигидрат + стеариновая кислота. На фиг. 25 показаны примеры микроКТ групп КС активное вещество (Р 2.1) и КС контроль (Р 2.2) после 3 недель наблюдения. Пеллеты резорбированы и видно некоторое костеобразование. На фиг. 26 показаны примеры микроКТ групп КС активное вещество (Р 7.1) и контроль (P3U.3) после 8 недель наблюдения. На активной стороне видно большее костеобразование по сравнению с контрольной стороной. На фиг. 27 показаны примеры микроКТ групп -ТКФНП активное вещество (Р 2.3) и контроль(Р 2.4) после 3 недель наблюдения. Видно некоторое костеобразование вокруг гранул. Резорбция гранул еще медленная. На фиг. 28 показаны примеры микроКТ групп -ТКФНП активное вещество (Р 7.3) и контроль(Р 7.4) после 8 недель наблюдения. Большинство гранул ТКФ резорбировано на активной стороне и замещено новой костью. Hf контрольной стороне гранулы резорбируются медленнее, и костеобразование можно обнаружить только вокруг гранул. В активной группе костеобразование явно больше, чем в контрольной группе. На фиг. 29 показан пример микроКТ группы -ТКФВП активное вещество после 3 недель наблюдения. Гранулы еще не резорбированы, и костеобразование можно обнаружить вокруг гранул. Контрольный пример отсутствует. На фиг. 30 показаны примеры микроКТ групп -ТКФВП активное вещество (Р 9.1) и контроль(Р 10.3) после 8 недель наблюдения. Костеобразование более эффективно, и резорбция гранул быстрее на активной стороне по сравнению с контрольной стороной. На фиг. 31 показан пример микроКТ группы пустого дефекта после 3 недель наблюдения. Дефектный сайт пустой, и костеобразования не видно. На фиг. 32 показаны примеры микроКТ групп пустого дефекта после 8 недель наблюдения. Нормальное, очень малое костеобразование видно по краям дефекта, но дефект не заживлен. На фиг. 33 показан гистологический срез КС активное вещество, 3 недели наблюдения (окрашивание MG, исходное увеличение 6,3, BF = область образования новой кости). Видно небольшое костеобразование. На фиг. 34 показаны гистологические срезы КС активное вещество, 8 недель наблюдения (окрашивание MG, исходное увеличение 6,3, BF = образование новой кости). В дефектном сайте видно образование большого количества кости. На фиг. 35 показан гистологический срез КС контроль, 3 недели наблюдения (окрашивание MG,исходное увеличение 6,3, PR = остатки пеллетов (Remnants of pellets. Остатки пеллетов видны в дефектном сайте, но нет признаков образования новой кости. На фиг. 36 показаны гистологические срезы КС контроль, 8 недель наблюдения (окрашивание MG,исходное увеличение 6,3, BF = образование новой кости). В дефектном сайте видно некоторое образование новой кости. Сечения срезов не являются параллельными по оси дефекту. На фиг. 37 показан гистологический срез -ТКФНП активное вещество, 3 недели наблюдения (окрашивание MG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Видно начало резорбции гранул, и образование новой кости видно вокруг гранул. На фиг. 38 показаны гистологические срезы -ТКФНП активное вещество, 8 недель наблюдения(окрашивание MG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Дефект хорошо заполнен новой костью, и видна заметная резорбция гранул. На фиг. 39 показан гистологический срез -ТКФНП контроль, 3 недели наблюдения (окрашиваниеMG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Имеется лишь небольшой признак резорбции гранул и небольшое образование новой кости вокруг гранул. На фиг. 40 показаны гистологические срезы -ТКФНП контроль, 8 недель наблюдения (окрашивание MG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Видны гранулы и образование новой кости вокруг гранул. Но количество образовавшейся кости значительно ниже, и резорбция гранул значительно медленнее по сравнению с активной группой -ТКФНП (фиг. 38). На фиг. 41 показан гистологический срез -ТКФВП активное вещество, 3 недели наблюдения (окрашивание MG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Видно начало резорбции гранул и образование новой кости вокруг гранул. На фиг. 42 показаны гистологические срезы -ТКФВП активное вещество, 8 недель наблюдения(окрашивание MG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Видны небольшие остатки гранул и отличное образование новой кости. Дефект полностью заполнен новой костью, и резорбция гранул очень высокая. На фиг. 43 показан гистологический срез -ТКФВП контроль, 3 недели наблюдения (окрашиваниеMG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Резорбция гранул идет медленно, и видно небольшое образование новой кости вокруг гранул. На фиг. 44 показаны гистологические срезы -ТКФВП контроль, 8 недель наблюдения (окрашивание MG, исходное увеличение 6,3, BF = образование новой кости, Gr = гранула ТКФ). Видны гранулы и образование новой кости вокруг гранул. Костеобразование значительно меньше, и резорбция гранул медленнее, чем в активной группе (фиг. 42). На фиг. 45 показан гистологический срез пустого дефекта, 3 недели наблюдения (окрашивание MG,исходное увеличение 6,3). Пустой дефект пуст. На фиг. 46 показан гистологический срез пустого дефекта, 3 недели наблюдения (окрашивание MG,исходное увеличение 6,3). Пустой дефект пуст (некоторое образование нормальной кости видно по краям дефекта). На фиг. 47 показана резорбция гранул ТКФНП контроль (слева) и активное вещество (справа) (окрашивание MG, исходное увеличение 10, Gr = гранула ТКФ). На фиг. 48 показана резорбция гранул ТКФВП контроль (слева) и активное вещество (справа) (окрашивание MG, исходное увеличение 10, Gr = гранула ТКФ). Описание изобретения Аспекты настоящего изобретения относятся к способам получения препарата костного белка, которые осуществляют на практике путем:a) деминерализации кости и экстракции костного матрикса гуанидингидрохлоридом с получением экстракта костного белка;b) фильтрования экстракта с помощью микрофильтра с отсекаемым размером частиц, достаточным для удаления крупных частиц и небелкового вещества, но обеспечивающим прохождение белков;c) фильтрования фильтрата с помощью кассетного ультрафильтра, имеющего отсекаемый размер частиц примерно от 5 до 10 кДа, с получением препарата костного белка. В одной форме осуществления обработку раствором гуанидингидрохлорида на стадии а) можно заменить обработкой раствором мочевины, которая является известным эквивалентом. Как правило, можно использовать раствор 4 М гуанидингидрохлорида. Термин "микрофильтр" на стадии b) относится к любому подходящему фильтру, который является достаточным для удаления крупных частиц и небелкового материала, но обеспечивает прохождение белков. Эта стадия может быть также названа "осветлением" или "предварительным фильтрованием", которую проводят с целью удаления, например, суспендированных частиц, коллоидов, макромолекул, клеток и клеточного дебриса из раствора. Молекулы, представляющие интерес, пройдут через микрофильтр. Примеры таких фильтров или способов фильтрования включают фильтрование с нормальным потокомfiltration). Указанный отсекаемый размер частиц на стадии b) может находиться в диапазоне от 0,1 до 10 мкм (номинальное значение в микронах), например приблизительно от 0,22 до 0,1 мкм или приблизительно 1000 кДа. На стадии ультрафильтрации с) может быть применим даже диапазон отсекаемого размера частиц 1-500 кДа. Ультрафильтр может представлять собой фильтр из регенерированной целлюлозы или полиэфирсульфоновый фильтр. В одной форме осуществления настоящего изобретения препарат костного белка подвергают диализу, например, водой, чтобы сконцентрировать и дополнительно очистить его. В другой форме осуществления препарат костного белка дополнительно подвергают диализу раствором цитрата, чтобы способствовать правильной укладке белков. Еще в одной другой форме осуществления кость представляет собой кость млекопитающего. Еще в одной другой форме осуществления кость представляет собой кость северного оленя. Еще в одной другой форме осуществления кость представляет собой кость оленьего рога. Еще в одной другой форме осуществления кость представляет собой длинную (трубчатую) кость. Аспекты изобретения также включают препарат костного белка, содержащий, например, один или более чем один белок, находящийся в нативном экстракте, деминерализованном HCl, препарат которого описан в данной работе, включая бигликан, тромбин, ламин А/С, виментин, остеонектин, лизилоксидазу,SPP-24 (секретируемый фосфопротеин), дерматопонтин, хондроадгерин и/или матриксный Gla-белок. По меньшей мере, перечисленные ниже белки рассматривают как стимулирующие, индуцирующие или ускоряющие остеоиндукцию: матриксный Gla-белок, SPP-24 (секретируемый фосфопротеин), ВМР-2,ВМР-7 и/или TGF- 1. Соответственно, композиция костного белка может также содержать по меньшей мере одно из перечисленного: бигликан, тромбин, ламин А/С, виментин, хондроадгерин, белок внеклеточного матрикса 22K, лизилоксидазу, остеонектин, коллаген или дерматопонтин, в существенных количествах. В некоторых формах осуществления композиция костного белка содержит, по меньшей мере, матриксный Gla-белок, бигликан, SPP-24, хондроадгерин, белок внеклеточного матрикса 22K лизилоксидазу, остеонектин, коллаген, ВМР-2, ВМР-7 и/или TGF-1. Также может быть включен один или более чем один из других белков, упомянутых в данной работе. Препарат костного белка содержит указанные белки в существенных количествах, например, в количестве, достаточном, чтобы обеспечить физиологический эффект, такой как остеоиндуктивный эффект, или активность. Другие белки могут также присутствовать в следовых количествах, таких как количество, слишком низкое, чтобы видеть на окрашенномSDS-PAGE или секвенировать, и такие белки не являются существенными или необходимыми для остеоиндуктивной или ускоряющей активности белкового препарата или композиции, содержащей этот белковый препарат. Например, в табл. 14 "белки в нативном экстракте, деминерализованном HCl", приведено руководство, как получать костный препарат по настоящему изобретению. Эти препараты могут быть получены вышеописанным способом, но можно также использовать любой другой подходящий способ. В следующих формах осуществления препарат костного белка включают в матрицу, либо пропитывают им матрицу, такую как пористая матрица. Матрица, носитель или каркас, где эти слова можно использовать взаимозаменяемо, усиливает активность и терапевтический потенциал экстракта костного белка в сайте применения (например, матрица, носитель или каркас при добавлении к экстракту костного белка дает возможность постепенного высвобождения активных белков и снижает миграцию этих факторов). Желательно матрица-носитель удовлетворяет нескольким критериям. Предпочтительно эта матрица является биосовместимой, биорассасывающейся, пластичной и стерилизуемой. Желательные материалы являются структурно прочными, иммунологически инертными, в высокой степени остеокондуктивными и вариабельно биоразлагаемыми. Примеры известных органических и неорганических матриц описаныDelivery Reviews 43 (2000), 65-92, и Moore et al., Synthetic bone graft substitutes, ANZ J. Surg. (2001), 71,354-361, где все статьи полностью точно включены в данную работу посредством ссылки. В другой форме осуществления препарат костного белка, полученный, как описано в данной работе, включен в гранулы. Еще в одной другой форме осуществления эти гранулы представляют собой гранулы -трикальцийфосфата (ТКФ), либо эти гранулы содержат -трикальцийфосфат. Еще в одной другой форме осуществления эти гранулы представляют собой гранулы кальция сульфата, либо эти гранулы содержат кальция сульфат. Еще в одной другой форме осуществления эти гранулы представляют собой гранулы гидроксиапатита, либо эти гранулы содержат гидроксиапатит. В другой форме осуществления препарат костного белка, полученный, как описано в данной работе, включен (встроен) в матрицу. Еще в одной другой форме осуществления препарат костного белка включен (встроен) в гранулы в матрице. В одной форме осуществления матрица представляет собой полиэтиленгликоль/глицериновую матрицу(PEG-GLY). В следующей форме осуществления данный препарат содержит стеариновую кислоту. Все эти формы осуществления могут быть применены в любой из областей применения, в любых способах или применениях, описанных в данной работе. Еще в одной другой форме осуществления препарат костного белка, полученный, как описано в данной работе, находится в форме лиофилизата. Некоторые формы осуществления также включают пасту, такую как инъекционная паста или гель,содержащую один или более чем один из препаратов костного белка, описанных в данной работе. Паста может быть также формуемой, где ее форма может также быть названа мастикой. Соответственно, некоторые формы осуществления включают мастику, содержащую один или более чем один из препаратов костного белка, полученных способом, описанным в данной работе. Также некоторые формы осуществления включают пеллету (пилюлю), диск, блок или гранулу, содержащую один или более чем один из препаратов костного белка, полученных способом, описанным в данной работе. В другой форме осуществления препарат костного белка представлен в виде покрытия на пеллете, диске, блоке или грануле. Несколько форм осуществления также включает остеогенное устройство, такой как костный имплантат, содержащий один или более чем один из препаратов костного белка, описанных в данной работе, например, матрица, такая как пористая матрица, пропитанная или покрытая одним или более чем одним из препаратов костного белка, полученных способом, описанным в данной работе. В некоторых формах осуществления препарат костного белка, полученный, как описано в данной работе, применяют в качестве лекарственного средства, например, для лечения расстройств, относящихся к дефектам кости, хряща, сухожилия или зуба, где желательна их регенерация, репарация или рост,либо других заболеваний. Также рассмотрена фармацевтическая композиция, содержащая данные препараты костного белка. Предпочтительно данные фармацевтические композиции содержат терапевтически эффективное количество одного или более чем одного из препаратов костного белка, полученных, как описано в данной работе, и фармацевтически приемлемый растворитель, носитель и/или наполнитель. Данную фармацевтическую композицию можно применять для лечения расстройств, относящихся к дефектам кости, хряща,сухожилия или зуба, где желательна их регенерация, репарация или рост, либо других заболеваний, таких как рак. В аспектах настоящего изобретения также предложен способ стимулирования (индукции) образования кости, хряща, сухожилия, зуба или тому подобного, in vitro или in vivo, где кость, хрящ, сухожилие, зуб или т.п. обрабатывают одним или более чем одним из препаратов костного белка, описанным в данной работе, либо остеогенным устройством, либо другой формой применения, содержащейся в нем. Дополнительные формы осуществления включают способы лечения расстройств, относящихся к дефектам кости, хряща, сухожилия или зуба, где желательна их регенерация, репарация или рост, либо других заболеваний, таких как рак, путем введения данного изолированного препарата костного белка пациенту, страдающему этими расстройствами. Термин "расстройства, относящиеся к дефектам кости, хряща, сухожилия или зуба", как он использован в данной работе, относится в целом к любому известному расстройству, где желательно заживление или реконструкция, например, регенерация, кости, хряща, сухожилия или периодонта. Не ограничивающими примерами методов лечения расстройств, относящихся к кости, хрящу, сухожилию, или периодонтальных дефектов или заболеваний или тому подобного является регенерация, репарация (восстановление) и рост кости и периодонтальной ткани; регенерация, репарация и рост кости у млекопитающих, таких как человек или любое другое животное; лечение аномалий формирования или регенерации кости; заживление раны, эктопическая индукция кости и заживление сегментарных дефектов кости у позвоночных; лечение скелетных расстройств и деформаций; репарация крупных дефектов кости в результате травмы, удаления опухолей или врожденных пороков, восстановление изношенного костного вещества с помощью имплантируемого эндопротеза при ревизионных операциях и сращивание медленно срастающихся или не срастающихся переломов; репарация дефектов кости и хряща, таких как дефекты критического размера, дефекты некритического размера, несрастающиеся переломы, сегментарные несрастающиеся переломы; острые переломы, хондральные дефекты, остеохондральные дефекты, субхондральные дефекты; локальное образование кости и хряща; дефекты в результате дегенеративных заболеваний; стоматологические применения, такие как репарация периодонтальных тканей, альвеолярной кости, цементного вещества, околозубной ткани корня зуба, заполнение корневого канала зуба и улучшение или усиление фиксации зубного имплантата. Примеры таких расстройств можно найти в Ann Rheum Dis,Vol. 62, 2003, 73-78: Reddy AH: Cartilage morphogenetic proteins: role in joint development,homoeostasis and regeneration, где весь документ полностью явным образом включен в данную работу посредством ссылки. В одной форме осуществления предложено остеогенное устройство, такое как имплантат, содержащее препарат костного белка. Остеогенное устройство может содержать биосовместимую матрицу,такую как кальция фосфат, карбоксиметилцеллюлоза или коллагеновая матрица, или их комбинации. В одной форме осуществления кальцийфосфатная матрица представляет собой гидроксиапатитную матрицу. Данная матрица может обеспечить медленное высвобождение препарата костного белка и/или подходящую окружающую среду для подачи препарата костного белка. Остеогенное устройство может также содержать металлический имплантат, окруженный биосовместимой матрицей. Одним из примеров такого металла является титан. Некоторые примеры такого остеогенного устройства раскрыты в работеWO 98/51354, которая полностью явным образом включена в данную работу посредством ссылки. Неограничивающими примерами различных каркасных материалов, носителей или каркасов для формования, например, различных видов остеогенных устройств или тому подобного с белком по настоящему изобретению являются среды в форме порошка, губки, полоски, пленки, геля, сетки, либо раствора или суспензии; полутвердый жидкий носитель, пригодный для внутримышечной, внутривенной,интрамедуллярной или внутрисуставной инъекции; изолированные мезенхимные стволовые клетки; любой фармацевтически приемлемый растворитель; покрытый ауто- или аллотрансплантат; любая фармацевтически приемлемая матрица; материал, выбранный из группы, включающей гидроксиапатит, коллаген, полимеры (например, полимер молочной кислоты, полимер гликолевой кислоты), синтетические полимеры, гиалуроновая кислота, -BSM, кальция фосфат, трикальцийфосфат, непористые керамические биополимеры, непористые резорбируемые биополимеры, коралл, деминерализованная кость, биокерамика, любой биоразлагаемый материал и их комбинации; связующие агенты, выбранные из группы, включающей маннит, декстраны, белый петролатум, алкил- и метилцеллюлозы, увлажняющие агенты, такие как натриевая соль, фибриновый клей, фибриноген и тромбин млекопитающих и их комбинации и смеси. Остеогенное устройство может представлять собой, например, структурно стабильный, трехмерный имплантат в форме куба, цилиндра или блока или в форме анатомической формы или инъекционной формы. Примеры остеогенных устройств, полезных материалов и методов раскрыты в книге "Skeletal reconstruction and bioimplantation" (T. Sam Lindholm, 1997, Springer-Verlag, Heidelberg, Germany), которая полностью явным образом включена в данную работу посредством ссылки. В дополнительной форме осуществления предложен способ стимулирования (индукции) образования кости, хряща, сухожилия, зуба или тому подобного, где кость, хрящ, сухожилие, зуб или т.п. обрабатывают препаратом костного белка, in vitro или in vivo. Еще в одной другой форме осуществления предложен способ лечения расстройств, описанных в данном описании, включающий введение препарата костного белка пациенту, страдающему этими расстройствами. Данный препарат костного белка можно вводить в виде фармацевтической композиции или остеогенного устройства, описанного выше. Дополнительные морфогенетические белки или другие полезные агенты можно вводить вместе с данным препаратом костного белка, как описано выше, для усиления терапевтического эффекта. Примеры Оптимизация и масштабирование фильтрования экстракта костного белка с тангенциальным потоком. Нижеописанное исследование основано на кандидатской диссертации "Optimization and scale-up oftangential flow filtration of bone protein extract", Viitanen, M. University of Oulu, 2010, которая полностью точно включена в данную работу посредством ссылки. Цель данного исследования состояла в изучении микро и ультрафильтрации с тангенциальным потоком экстракта костного белка животных. Эти способы были оптимизированы и основаны на результатах, масштабированных до промышленного масштаба. В биофармацевтических применениях раствор, содержащий желаемые компоненты, часто подвергают фракционированию и концентрированию. Обычно эти стадии осуществляют с использованием фильтрования. Фильтрование с тангенциальным потоком является отличным выбором для фильтрования больших объемов, поскольку фильтр не закупоривается настолько легко, как при традиционном тупиковом фильтровании. Это связано с тем, что поток подачи параллелен мембране, и, следовательно, уносит частицы. Во время данного исследования параметры процесса микро- и ультрафильтрации экстракта костного белка были оптимизированы, чтобы достичь насколько возможно эффективного процесса. Для целей ультрафильтрации также сравнивали две различные мембраны и два типа канала подачи. Для разработки экспериментов и оптимизации использовали программное обеспечение, чтобы изучить действие переменных процесса. Результаты показывают, что экстракт костного белка животных можно эффективно обрабатывать,используя фильтрование с тангенциальным потоком. Выход белка был хорошим, как при микро-, так и при ультрафильтрации. Ни один из протестированных материалов мембраны не обладал значительной закупоркой. Однако были различия в максимальных потоках фильтрации. Эти процессы можно даже дополнительно оптимизировать. На основании полученных результатов были проведены вычисления для масштабирования процесса фильтрования до промышленного масштаба. Эти вычисления показывают,что процесс можно осуществлять в желаемый период времени и при разумных затратах. 1. Введение. Фильтрование с тангенциальным потоком широко применяют в биофармацевтической и во многих других отраслях промышленности, например, для концентрирования или фракционирования белков путем ультрафильтрации, либо для удаления микроорганизмов и клеток путем микрофильтрации. В данном исследовании оценивали микрофильтрацию и ультрафильтрацию экстракта костного белка. Фильтрование с тангенциальным потоком при использовании кассетных фильтров может быть идеальным методом для крупномасштабной обработки экстракта, полученного из данного типа ткани. Исследование начали с изучения технической осуществимости обеих стадий, микрофильтрации и ультрафильтрации. Сравнивали различные кассетные фильтры для ультрафильтрации. Для планирования эксперимента использовали программу системного проектирования и моделирования (MODDE). Детализированную оптимизацию параметров процесса проводили для всех тестируемых фильтров. Наконец,были проведены вычисления для масштабирования процесса на основании полученных результатов. По результатам экспериментов по оптимизации доступны немногие опубликованные данные, которые непосредственно соответствуют данному исследованию. Большинство из них охватывают ультрафильтрацию молочной сыворотки. Обычно данный вид информации создается фирмами, имеющими фильтрацию в качестве стадии процесса. Следовательно, ее необязательно публикуют. Кроме того, каждый способ биологической фильтрации уникален, при этом решение, присущее конкретному случаю,включает выбор материала мембраны и других характеристик. Поведение системы трудно предсказать, и всегда необходима оптимизация для каждого конкретного случая. 2. Фильтрование с тангенциальным потоком. 2.1. Общее описание фильтрования с тангенциальным потоком. Фильтрование можно в целом разделить на две различные операционные категории. Они представляют собой фильтрование с нормальным потоком (Normal flow filtration, NFF) и фильтрование с тангенциальным потоком (Tangential flow filtration, TFF). При NFF раствор течет посредством давления или даже самотеком в перпендикулярном направлении к мембране или объемному фильтру. Частицы крупнее определенного размера будут задерживаться на поверхности мембраны или внутри сетчатой структуры объемного фильтра. Однако накопление частиц будет, в конечном счете, закупоривать фильтр. NFF обычно используют для стерильного фильтрования и предварительного фильтрования перед микро- или ультрафильтрацией. В противоположность NFF, TFF использует подающий поток, который параллелен мембране. Это создает уносящий эффект, который предотвращает закупоривание мембраны частицами. Поток пермеата,который означает поток, проходящий через мембрану, создается за счет давления. Молекулы меньшего размера, чем поры мембраны, пройдут с пермеатом, а более крупные сконцентрируются в потоке ретентата. Как правило, TFF используют для концентрирования растворов и/или разделения молекул или частиц на основе различия их размера. Разделение молекул посредством мембраны обычно следует распределению Гаусса вокруг среднего размера пор (отсекаемая величина). Кроме теоретического размера молекул, форма и заряд также оказывают влияние на их прохождение через поры (Millipore Corporation 1992). Нижеследующий раздел относится к различным типам процессов TFF, фильтровальным устройствам, мембранам и факторам, влияющим на них, где особое внимание уделено ультрафильтрации. 2.2. Определение процессов мембранного разделения. Процессы разделения можно классифицировать в соответствии с диапазоном размеров разделяемых частиц. Общепринято используемые определения включают микрофильтрацию (МФ), ультрафильтрацию (УФ), нанофильтрацию (НФ) и обратный осмос (ОО), который также назван гиперфильтрацией в более старой литературе. Фильтрование частиц часто используют в качестве стадии предварительного фильтрования перед микро- или ультрафильтрацией с целью удаления крупных твердых частиц и коллоидных веществ, которые могут вызвать закупоривание каналов подачи последующих фильтров. Границы между классами не являются точными. 2.2.1. Микрофильтрация. Отсекающий размер пор мембраны (номинальное значение в микронах), используемый в большинстве применений микрофильтрации, находится в диапазоне от 0,1 до 10 мкм. Микрофильтрацию используют для отделения суспендированных частиц, коллоидов и макромолекул от растворов. Микрофильтрацию широко используют, например, в химической и минеральной промышленности и в применениях очистки воды. В биотехнологической промышленности ее часто используют для отделения клеток и клеточного дебриса от среды после периода ферментации. Продукты могут представлять собой рекомбинантные белки, метаболиты организма или сами клетки, как при культивировании пекарских дрожжей. МФ можно также использовать как способ стерильного фильтрования растворов. В этом случае обычно используют отсекающий размер пор менее 0,45 мкм либо может быть выбран отсекаемый размер 0,2 мкм, если желательно полное удерживание. 2.2.2. Ультрафильтрация. Ультрафильтрация является отличным выбором для концентрирования и фракционирования белков. Данный способ является менее агрессивным для белков по сравнению с выпариванием и более экономичным по сравнению с гельпроникающей хроматографией. При УФ диапазон разделения составляет от 1 до 500 кДа. Многие изготовители мембран предлагают УФ кассеты с отсекающим размером 1000 кДа, эквивалентным примерно 0,1 мкм. Диапазон давления при УФ обычно составляет примерно 1,5-6,5 бар. УФ широко применяют в биофармацевтической промышленности при выделении и очистке моноклональных антител и рекомбинантных белков. Молочная промышленность была одной из первых, где этот метод широко адаптирован. Характерные применения метод находит в сыроделии и при фракционировании сырной сыворотки. 3. Цели работы. Цели данной работы состояли в изучении пригодности мембранных кассетных фильтров для микро- и ультрафильтрации экстракта костного белка и в оптимизации этих процессов в малом масштабе. Выбор типа мембраны был одной из главных целей. Работа была в большей степени сфокусирована на ультрафильтрации, поскольку она является более критической и сложной с точки зрения оптимизации. Микрофильтрация служила, в основном, в качестве стадии очистки для удаления частиц и макромолекул большего размера, чем типичные белки. Хотя в данной работе она отнесена к категории микрофильтрации, эту стадию выполняли, используя фильтр, имеющий тип мембраны, подобный фильтрам, используемым для ультрафильтрации. Однако этот фильтр имел настолько большой размер пор, что оптимизация проведена, как для микрофильтров. Сначала были проведены предварительные эксперименты по микро- и ультрафильтрации с использованием одного типа фильтра. На основании результатов и приобретенного опыта для дальнейших исследований были выбраны два новых и несколько различающихся ультрафильтра. Программу планирования эксперимента (MODDE) использовали для изучения различных параметров, влияющих на процесс ультрафильтрации. Кроме типа фильтра, изучаемыми параметрами были температура, давление и скорость подачи с объемной дозировкой. Фильтры подвергали различным протоколам оптимизации, чтобы найти лучшие установки и, следовательно, сделать крупномасштабный процесс по возможности более экономичным. Процесс микрофильтрации был также оптимизирован по отношению к критическому потоку. На протяжении всего исследования отдельное слово поток означает поток фильтрата. Регенерацию мембран после стадии очистки, следующей за фильтрованием, изучали физическими и химическими методами. На основании результатов оценивали методы очистки. Наконец, были проведены вычисления для масштабирования процесса с использованием данных, полученных в маломасштабных экспериментах. 4. Оборудование. Эксперименты по фильтрации проводили при Университете Оулу, лаборатория биотехнологии консорциума университета Каяани в Соткамо. 4.1. Оборудование для фильтрации. 4.1.1. Лабораторное устройство Millipore BenchScale. В данном исследовании лабораторное устройство Millipore BenchScale (Millipore Corp., USA) использовали исключительно в целях предварительного фильтрования и для измерений целостности фильтра. Устройство имело 2-литровый контейнер подачи, который считали слишком маленьким для планируемых объемов опытных партий фильтрования. Капсульный фильтр для предварительного фильтрования был присоединен к шлангу насоса. 4.1.2. Устройство Millipore ProScale. Эксперименты по фильтрованию проводили, используя устройство Millipore ProScale. Оно имеет 10-литровый стеклянный контейнер подачи. Если нужны большие объемы, раствор выкачивали из дополнительного контейнера. В данном случае поток ретентата направляли в этот контейнер, чтобы гарантировать правильное смешивание раствора. Нагревание и охлаждение устройства ProScale было достигнуто с помощью циркуляции горячей или холодной водопроводной воды в теплообменнике. 4.2. Мембраны. Все мембраны, используемые в данном исследовании, были получены от фирмы Millipore Corp.,USA. В соответствии с рекомендацией изготовителя раствор предварительно фильтровали через фильтр по меньшей мере 100 мкм перед фильтрованием МФ и/или УФ. Всегда использовали капсульный фильтр Каждый капсульный фильтр использовали максимум два раза. Между фильтрованиями капсулы автоклавировали при 121 С в течение 20 мин. 4.2.7. Мембрана для микрофильтрации. Для микрофильтраций раствор белка фильтровали через кассету Pellicon 2 Biomax, имеющую отсекаемое значение молекулярной массы (MWCO) 1000 кДа. Площадь фильтрования составляла 0,1 м 2,и фильтр представлял собой фильтр V-сетчатого типа. Материалом мембраны был полиэфирсульфон. Фирма Millipore классифицирует каналы подачи мембраны как V, С и А. Тип V имеет максимально открытую геометрическую форму канала подачи, тогда как форма А является самой плотной. 4.2.2. Мембраны для ультрафильтрации. В данном исследовании тестировали три различных кассеты для ультрафильтрации, которые перечислены в табл. 1. Предварительные эксперименты проводили, используя кассету Biomax V-сетчатого типа. Тип V был выбран, поскольку было ничего не известно о возможном эффекте закупорки или образовании агрегатов во время фильтрования в случае данного конкретного раствора. Каналы подачи являются наиболее открытыми в кассетах типа V, в связи с чем они не закупориваются слишком легко. Кассеты типа С, имеющие более узкий диаметр канала подачи, были выбраны для дальнейших экспериментов на основании полученных положительных результатов. Таблица. 1 Кассеты, используемые для экспериментов ультрафильтрации 5. Эксперименты. Эксперименты проводили в лаборатории биотехнологии консорциума университета Каяани в Соткамо в четыре этапа. На первом этапе проводили тесты технической осуществимости, чтобы определить, как система ведет себя в целом. Второй этап экспериментов включал стадии оптимизации потока и трансмембранного давления (ТМР) для обеих кассет 1000 и 10 кДа (тип V). На третьем этапе использовали проектный план эксперимента, созданный с использованием программы моделирования и планирования "MODDE". Цель состояла в определении факторов, которые обладают самым сильным воздействием на ультрафильтрацию, включая тип мембраны. Кассеты, исследуемые на этом этапе, представляли собой кассеты фирмы Biomax и Ultracel типа С. На конечном этапе обе кассеты типа С 10 кДа (Biomax и Ultracel) подвергали тестам оптимизации потока в зависимости от ТМР. Перед каждым фильтрованием кассеты промывали водой обратного осмоса (00), так, что со стороны пермеата собирали по меньшей мере 5 л. Затем систему уравновешивали путем циркуляции 1 л чистого четырехмолярного (4 М) раствора GuHCl в системе в течение 10 мин. Затем систему опорожняли,после чего экстракт белка наливали в контейнер подачи. После каждого фильтрования канал ретентата опорожняли и промывали известным объемом 4 М GuHCl перед очисткой. 5.1. Первый этап: Тесты технической осуществимости. Фильтруемость предварительно профильтрованного экстракта белка через кассету 1000 кДа исследовали сначала путем фильтрования одной партии 45 л. Использовали частоту вращения насоса 5 Гц. Диапазон ТМР оставался от 0,65 до 0,73 бар. Образцы для анализа белка всегда брали из потоков пермеата и ретентата, когда собирали 4 л пермеата. Когда собирали 44 л пермеата, в контейнер подачи добавляли 1 л 4 М GuHCl. Это так называемое вытеснение использовали, чтобы повысить выход белка в пермеате. Фильтрование продолжали до тех пор, пока не собирали еще один литр пермеата. Образцы также отбирали по окончании вытеснения. Коэффициент объемной концентрации (VCF, volumetric concentrationfactor) фильтрования составлял 45. Пермеат из предшествующего фильтрования 1000 кДа подвергали ультрафильтрации. Проводили две отдельные фильтрации, используя объемы партии 22 и 23 л. Применяемые VCF составляли 10,5 и 8,5 соответственно. В обоих прогонах было получено ТМР 0,75-0,78 путем использования частоты вращения насоса 12 Гц. Образцы отбирали для анализа таким же способом, как использован при выполнении микрофильтрации. 5.2. Второй этап: Оптимизация потока и ТМР для кассет типа V. 5.2.1. Оптимизация потока и ТМР для кассеты микрофильтрации. Для открытых мембран, подобных тем, которые общепринято используют при микрофильтрации,критический поток определяют в полном режиме рециркуляции. В данном исследовании 5 л предварительно профильтрованного экстракта белка подвергали циркуляции в системе, используя четыре различные скорости подающего потока. Частоты вращения насоса 5, 7,5, 10 и 12,5 Гц использовали для созда- 11024470 ния скоростей подающего потока примерно 1,15, 1,66, 2,15 и 2,75 л/мин соответственно. Поскольку поток фильтрата был слишком незначительным в начале эксперимента, эти значения также соответствуют первоначальным скоростям поперечного потока. Термин "скорость поперечного потока" относится к скорости потока ретентата, и ее обычно используют в контексте кривых потока в зависимости от ТМР. Исходно штуцерный кран пермеата был закрыт. При данной скорости потока в результате простого открытия клапана поток несколько увеличился. Системе давали возможность стабилизироваться в течение 10-20 мин. Поток и ТМР регистрировали через 5-минутные интервалы. Эту операцию продолжали до тех пор, пока клапан не был полностью открыт и ТМР больше не было линейным по отношению к потоку. В последнем случае было достигнуто критическое значение для потока (потока фильтрата). 5.2.2. Оптимизация потока и ТМР для кассеты ультрафильтрации типа V. Оптимизация параметров для кассеты ультрафильтрации отличается от таковой для микрофильтрации. В данном исследовании кривые потока в зависимости от ТМР определяли для экстракта, подвергнутого микрофильтрации, при двух концентрациях (VCF 1 и 10), используя пару различных скоростей подающего потока. В случае VCF 1 скорости подающего потока (и исходные скорости поперечного потока) составляли 1,15, 1,66 и 2,75 л/мин. Соответствующие частоты вращения насоса составляли 5, 7,5, 10 и 12,5 Гц. В случае VCF 10 используемые скорости подающего потока составляли 1,66 и 2,75 л/мин соответственно. Эксперименты начинали путем циркуляции 10 л белкового экстракта в полном режиме рециркуляции. При каждой скорости потока ТМР прогрессивно повышали через 5-10-мин интервалы путем закрытия штуцерного крана ретентата. Регистрировали изменения в потоке. Если наклон кривой потока в зависимости от ТМР начинал снижаться, была достигнута оптимальная точка ТМР. После проведения операции со всеми четырьмя скоростями поперечного потока белковый экстракт концентрировали до VCF 10. Затем вышеописанную операцию повторяли. 5.3. Третий этап: План эксперимента с использованием MODDE. Системный план экспериментов создавали, используя программное обеспечение моделирования и планирования MODDE (MODDE 8, Umetrics AB, Umea, Sweden). Все факторы, вовлеченные в процесс ультрафильтрации, сначала суммировали в диаграмме Исикавы (Ishikawa), также известной как причинно-следственная диаграмма. Четыре фактора, выбранные для экспериментов, перечислены в табл. 2. Эти факторы могут быть либо качественными, либо количественными. Значение количественного фактора можно регулировать. Тип мембраны является характерным примером качественного фактора. Ответами,измеренными во время тестов, были продолжительность каждого фильтрования и выход (суммарная концентрация белка в концентрированном растворе). Таблица 2 Факторы, выбранные для экспериментов MODDE, и их свойства Вся установка тестов представлена в табл. 3. Всего было 11 тестовых прогонов. Во время исследования мембрану Biomax С обозначали как мембрану "А", а мембрану Ultracel С - как мембрану "В". Диапазон "блокирования потока ретентата" (20-80%) определяли как процент закрытия штуцерного крана ретентата. Скорости вращения насоса 3, 4,5 и 6 Гц создавали скорости потока 730, 1035 и 1350 мл/мин соответственно. Температура от 15 до 30 С была четвертым выбранным фактором. Некоторые факторы, а именно объем, исходную концентрацию, различия партий и блокирование потока пермеата, игнорировали. Обнаружено, что различия между партиями несущественны (результаты не представлены). Объем и концентрация экстракта белка будут постоянны в конечном процессе фильтрования. Использование блокирования потока пермеата только замедлит процесс, поэтому не было причин изучать его влияние. Считали, что оператор и оборудование, за исключением мембран, обладает пренебрежимо малым воздействием на результат фильтрования. Серию из 11 фильтраций в рандомизированном порядке создавали, используя программное обеспечение и выбирая "Скрининг" для параметра и линейный "Дробный факторный эксперимент" для модели планирования. Разрешение составляло IV. Затем этот план был выполнен с использованием исходного объема 3 л при каждом фильтровании. Затем применяли VCF 10, что останавливало фильтрование, когда собирали 2,7 л пермеата. Регистрировали время, необходимое для фильтрования (точность 1 мин), и образцы отбирали из пермеата и концентрата для определения суммарной концентрации белка. Профиль белка также анализировали для некоторых из прогонов (см. глава 5.6.2). Результаты оценивали с помощью MODDE, используя методы частных наименьших квадратов (partial least squares, PLS). Эксперимен- 12024470 ты по фильтрованию 9, 10 и 11 представляли собой так называемые прогоны центральной точки. Процесс повторяли три раза, используя те же параметры установки факторов. В прогонах центральной точки значения факторов всегда находятся в середине диапазона каждого фактора. Эти повторяющиеся прогоны используют для оценки вариабельности тестов, включая аналитические способы. Таблица 3 План тестов по фильтрованию, созданный с использованием программы MODDE 5.4. Четвертый этап: Оптимизация потока и ТМР для кассет ультрафильтрации типа С. По сравнению с кассетами типа V каналы подачи в кассетах типа С являются более плотными. Следовательно, для создания значений ТМР, равных кассетам типа V необходима более низкая скорость потока. В данном исследовании кривые потока в зависимости от ТМР определяли при двух концентрациях(VCF 1 и 5). Значения исходных скоростей подающего потока для обеих кассет и VCF представлены в табл. 4. Кассету Biomax называют мембраной А, а кассету Ultracel - мембраной В. Эксперименты начинали с 5 л экстракта белка в полном режиме рециркуляции. Альтернативно методика является такой же, как описано в главе 5.2.3. Одним дополнительным пунктом была проверка так называемого гистерезиса: Когда была достигнута самая высокая точка ТМР, ТМР постепенно снижалось. Если поток возвращался к своему исходному значению, мембрана не была закупорена. Таблица 4 Выбранные характеристики для оптимизации потока в зависимости от ТМР кассет типа С 10 кДа 5.5. Протокол очистки мембраны. После каждого цикла фильтрования мембраны подвергали очистке. Объем раствора для очистки составлял 1 л (10 л/м 2 площади мембраны). Раствор подвергали циркуляции в системе и температуру регулировали посредством теплообменника. Использовали диапазон температуры примерно от 35 до 45 С. Гидроксид натрия (NaOH) использовали в качестве очищающего агента при концентрации от 0,1 до 0,4 М. Диапазон времени контакта составлял 30, 45 или 60 мин в зависимости от ситуации. Систему промывали водой ОО, так что на выходе собирали суммарно от 5 до 7 л пермеата. Затем измеряли значение нормализованной водопроницаемости (NWP, normalized water permeability), как описано в главе 5.6.4. При необходимости очистку повторяли, возможно, в более жестких условиях. 5.6 г Проведенные измеренияг Образцы для анализа концентрации белка и электрофореза в SDS-PAGE были проведены в финской фирме Оулу. Другие измерения проводили в лаборатории биотехнологии при консорциуме университета Каяани. Должно быть отмечено, что не все измерения обязательно проводили для каждого образца. 5.6.1. Концентрация белка. Образцы из тестов на техническую осуществимость (первого этапа) анализировали на их концентрацию белка, используя устройство NanoDrop 2000 (Thermo Scientific, USA). Этот анализ основан на УФ-спектрометрии. Определение концентрации суммарного белка из всех других образцов проводили,- 13024470 используя колориметрический анализ по Бредфорду (Bradford 1976). Используемый реагент для окрашивания покупали в фирме Bio-Rad Laboratories, USA, и бычий сывороточный альбумин (БСА) приобретали в фирме MP Biomedicals, USA. БСА использовали в качестве стандартного белкового материала для построения стандартных кривых концентрации белка. Однако результаты варьировались в зависимости от используемого способа тестирования. Поэтому результаты, полученные из предварительных тестов с использованием NanoDrop, использовали только в целях скрининга. 5.6.2. Анализ с помощью электрофореза в SDS-PAGE. Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) является общепринятым способом разделения белков в соответствии с их размером. Профиль белка можно визуализировать на геле, используя краситель, специфичный для белка. В процессах фильтрования электрофорез вSDS-PAGE обеспечивает отличную информацию о том, насколько успешно фильтрование. Например,можно четко увидеть, функционирует ли фильтр в соответствии с его номинальным отсекаемым значением молекулярной массы. В данном исследовании электрофорез в SDS-PAGE проводили, используя устройство Bio-Rad Mini-Protean II в соответствии с инструкциями изготовителя (Bio-Rad Laboratories,USA). Этот способ основан на системе, описанной Лэммли (1970). Поскольку GuHCl препятствует анализу в SDS-PAGE, образцы из экспериментов по фильтрованию сначала необходимо подвергнуть диализу против воды. Во время диализа большая часть белков в экстракте осаждается. Поэтому осадок и супернатант лиофилизировали вместе после диализа. Часть лиофилизированного белкового материала взвешивали и растворяли в 6 М мочевине. Концентрацию белка измеряли, используя метод Бредфорда (1976). Затем готовили образцы для электрофореза в SDS-PAGE в соответствии с инструкциями изготовителя (Bio-Rad Laboratories, USA). В случае пермеата фильтрации количество лиофилизированного материала иногда было настолько мало, что взвешивание было невозможно. Вместо этого их случайным образом растворяли в 6 М мочевине, а затем анализировали концентрацию белка. В лунки геля обычно наносили пятнадцать микрограммов белка. В случае образцов пермеата количество может быть ниже. В качестве стандарта молекулярной массы использовали Precision Plus DualColor Protein Standard (BioRad Laboratories, USA). Электрофорез проводили, используя постоянное напряжение 200 В, и среднее время пробега составляло примерно 50 мин. 5.6.3. Скорости потока и трансмембранное давление. Система Millipore Proscale была оборудована цифровым расходомером пермеата. Скорость потока ретентата или скорость поперечного потока измеряли, используя контрольный таймер и градуированный стеклянный цилиндр на 1 или 2 л. Скорость потока пермеата измерялась в кг/мин, но по измерениям она была достаточно близка к л/мин, также при использовании растворов 4 М гуанидингидрохлорида. Скорость подающего потока можно вычислить путем сложения вместе скоростей потока ретентата и пермеата. Трансмембранное давление (ТМР) показано непосредственно в системе ProScale, но также может быть вычислено с использованием уравнения (1): где Pfeed представляет собой давление подачи (бар);Pretentate представляет собой давление ретентата (бар);Ppermeate представляет собой давление пермеата (бар). 5.6.4. Нормализованная водопроницаемость. Когда фильтр используют в первый раз, должна быть определена его исходная нормализованная водопроницаемость. Она будет представлять собой значение, с которым сравнивают последние измерения. Целесообразно всегда использовать одни и те же параметры процесса для определения NWP. Уравнение (2) используют для вычисления NWP: где Qpermeate представляет собой скорость потока пермеата (л/ч); А представляет собой общую площадь фильтра (м 2); ТМР представляет собой трансмембранное давление (бар);F представляет собой коэффициент поправки на температуру из Приложения 1. Измерение NWP всегда проводили после промывки и перед фильтрованиями. Измерение NWP представляет собой самую прямую демонстрацию эффективности промывки. Чем ближе оно может быть восстановлено до его исходного значения, тем лучше эффективность очистки. 5.6.5. Целостность фильтра. Для подтверждения целостности фильтров должен регулярно проводиться тест удельного потока воздуха. Фильтровальный модуль был присоединен к лабораторной системе Millipore Benchscale, и тест проводили в соответствии с методикой, предложенной изготовителем (Millipore Corporation 1998). Кратко, промытый и высушенный фильтровальный модуль присоединяли к регулируемой подаче газа (воздуха или азота). Газ пропускали от подающей стороны фильтра при давлении, специфичном для мембраны. Пластмассовую трубку соединяли с выходом пермеата. Другой конец трубки вводили в перевернутый градуированный стеклянный цилиндр, наполненный водой. Этот цилиндр помещали в контейнер большего объема, наполненный водой. Тогда скорость потока воздуха можно определить путем измерения объема воздуха, вытесняемого в стеклянный цилиндр в данный период времени. Каждый тип и размер мембраны имел собственный максимальный предел потока воздуха для выполнения требований к целостности. 5.6.6. Закупорка мембраны. В характерном случае степень закупорки мембраны можно вычислить, используя приведенное ниже уравнение (3): где Flowstart представляет собой поток пермеата в начале фильтрования;Flowend представляет собой поток пермеата в конце фильтрования. Одним из способов вычисления закупорки мембраны является сравнение скоростей потоков воды до и после фильтрования перед промывкой. В данном исследовании многие из белков в экстракте осаждаются, когда вступают в контакт с водой. Таким образом, вычисленные проценты закупорки необязательно указывают на закупорку, которая происходит в процессе фильтрования. Мониторинг общей закупорки можно также проводить по время фильтрования, наблюдая уменьшение потока. Эффект закупорки можно вычислить по снижению потока в данный период, используя уравнение (3). 5.6.7. Баланс массы. Чтобы понять, как белки распределяются в данном процессе, проводят вычисление баланса массы. Полезным уравнением для этой цели является уравнение (4): где Vret представляет собой объем ретентата (л);Cret представляет собой концентрацию белка ретентата (мг/мл или г/л);Vperm представляет собой объем пермеата (л);Cperm представляет собой концентрацию белка пермеата (мг/мл или г/л);Vfiush представляет собой объем раствора, используемого для промывки системы (л);Cfiush представляет собой концентрацию белка раствора, используемого для промывки системыVinitial представляет собой объем исходного подаваемого раствора (л);Cinitial представляет собой концентрацию белка исходного подаваемого раствора (мг/мл или г/л). По многим причинам процент баланса массы редко составляет 100. Некоторая часть белков будет осаждаться на мембране. Всегда имеется некоторый удерживаемый объем в кассете и оборудовании. Способы определения также не являются точными. 6. Результаты 6.1. Целостность фильтров. Целостность всех анализируемых мембранных фильтров находилась на допустимом уровне. Результаты этих тестов в данной работе не представлены. 6.2. Техническая осуществимость кассетной микрофильтрации. Техническую осуществимость для полиэфирсульфонового кассетного фильтра на 1000 кДа исследовали, используя объем партии 45 л и конечную VCF 45. На фиг. 1 показано, как изменялся поток фильтрата в ходе фильтрования. Четко видно, что поток сохраняет от 36 до 30 л/м 2/ч большую часть времени. Падение в конце, вероятно, связано с повышенной поляризацией концентрации. В конце фильтрования был резкий подъем суммарной концентрации белка в потоке ретентата (фиг. 2). Концентрация в пермеате оставалась почти постоянной в ходе фильтрования. 6.2.1. Баланс массы при микрофильтрации. Определяли баланс массы микрофильтрации. Результаты суммированы в табл. 5. Процент баланса массы, вычисленный с использованием уравнения (4), составлял 94, что означает, что 6% белка какимлибо путем теряется в ходе фильтрования. Всегда существует некоторая потеря в связи с удерживаемым объемом фильтровальной кассеты, трубок и насоса. Некоторая потеря, вероятно, происходит в результате закупорки мембраны. Удерживаемый объем кассет, используемых в данной работе, находится в пределах 30 мл. После стадии промывки количество белка в удерживаемом объеме, следовательно, считали незначительным. Таблица 5 Вычисление баланса массы для фильтрования 1000 кДа 6.3. Техническая осуществимость кассетной ультрафильтрации. Партии 22 и 23 л после микрофильтрации подвергали ультрафильтрации, используя фильтр типа V 10 кДа. Достижение VCF 10,5 и 8,5 соответственно занимало 5 ч. Две фильтрации проявляли в целом сходные характеристики, что видно из скоростей потока (фиг. 3 А и В). В обоих случаях падение потока в пределах первых 10 мин составляло 6-7%. Это обычно вызвано поляризацией концентрации и, возможно,закупоркой. Когда были достигнуты конечные VCF, потоки составляли 72 и 73% (39 и 38,4 л/м 2/ч) от исходных значений 54 и 52,8 л/м 2/ч соответственно. 6.3.1. Балансы массы при ультрафильтрациях. Балансы масс в результате двух ультрафильтраций были очень близкими друг к другу. Проценты потери баланса масс составляли 3 и 5%. Большую часть белка можно было обнаружить в концентрате(ретентате), что видно в табл. 6. Одно резкое различие составляла концентрация белка (Сбелка) в подаче. Измеренные концентрации составляли 0,47 и 0,555 мг/мл, хотя материал был одинаковым. Это могло быть связано с вариациями в способе анализа. Таблица 6 Вычисление баланса массы для двух фильтраций 10 кДа (кассета типа V) 6.3.2. Анализ пермеата при ультрафильтрации с помощью электрофореза в SDS-PAGE. Профиль белка пермеата отлично показывает, насколько хорошо мембрана отвечает ее спецификациям. Тест на целостность обычно выявляет, если мембрана потеряла свою селективность, но анализ с помощью электрофореза в SDS-PAGE также показывает подробности для интактной кассеты. На фиг. 4 показан профиль белка пермеата из 23-литровой ультрафильтрации. Четко видно, что отсутствуют белки большего размера, чем примерно 13 кДа. Это является очень хорошим результатом для кассеты с отсекаемым размером частиц 10 кДа. 6.4. Оптимизация потока и ТМР для кассеты микрофильтрации. Оптимизация характеристик потока для микрофильтрации описана в главе 5.2.2. Цель состояла в том, чтобы определить условия, при которых был достигнут самый стабильный поток. Использовали четыре различных скорости поперечного потока. Результаты представлены на фиг. 4 и 5. Общим признаком всех четырех случаев было падение потока в начале экспериментов. Это, вероятно, связано с эффектом закупорки или с поляризацией концентрации. После первых 15 мин видно, что поток стабилизируется. Из фиг. 5 невозможно сделать вывод, что критический поток был достигнут с использованием скоростей поперечного потока 1,15 или 1,66 л/мин. Однако в момент времени примерно 70 мин происходило снижение потока при постоянном ТМР в обоих случаях. При полном открытии крана пермеата на последующем этапе потоки, по-видимому, стабильны. При использовании скоростей поперечного потока 2,15 и 2,75 л/мин (фиг. 6) сделать выводы более сложно. Имеется некоторое снижение потока в течение первых 15 мин каждой стадии. Однако более значительное снижение в обоих случаях видно в течение последней стадии. Критические потоки можно,таким образом, определить около 60-66 л/м 2/ч, когда исходная скорость поперечного потока составляет 2,15 л/мин, и около 72-78 л/м 2/ч, когда скорость поперечного потока составляет 2,75 л/мин. 6.5. Оптимизация потока и TMP для кассеты ультрафильтрации типа V. Как описано в главе 5.2.2, поток в зависимости от ТМР исследовали, используя четыре различные скорости поперечного потока и два значения VCF (1 и 10). Полученные кривые представлены на фиг. 7(VCF 1) и 8 (VCF 10). Когда VCF была равна 1, наклон кривой начинал снижаться только при скоростях поперечного потока 1,15 и 1,66 л/мин (фиг. 7 А и В). Это происходило в обоих случаях при ТМР около 2,5 бар, и соответствующие оптимальные потоки составляли примерно 84 и 96 л/м 2/ч соответственно. При самом высоком давлении промывка поверхности мембраны могла быть недостаточной для этих двух более низких скоростей поперечного потока. При более высоких скоростях поперечного потока (2,15 и 2,75 л/мин) это явление не наблюдали (фиг. 7 С и D). ТМР могло подняться больше, но давление подачи уже составляло почти 3 бар, когда ТМР составляло 2,36 и 2,27 бар соответственно. Потоки при этих давлениях составляют 105 и 108 л/м 2/ч и находятся в линейном диапазоне. При использовании более высокой концентрации раствора белка (VCF 10) снижение наклона было более четко видно. Как показано на фиг. 8 А, оптимальное ТМР составляет 1,8 бар, что дает поток 60 л/м 2/ч при скорости поперечного потока 1,66 л/мин. Когда скорость поперечного потока составляла 2,75 л/мин, сравнимыми значениями являются 2 бар для ТМР и примерно 78 л/м 2/ч для потока(фиг. 8 А). Все эти результаты, включая результаты для VCF 1, суммированы в табл. 7. Таблица 7 Оптимальные ТМР и соответствующие значения потока для различных исходных скоростей поперечного потока и VCFMODDE. Она состояла из 11 ультрафильтраций с различными комбинациями параметров. Измеряемые ответы представляли собой продолжительность концентрирования 3 л экстракта белка до VCF 10 и конечную концентрацию белка. Прямые результаты представлены в табл. 8. Значения ТМР варьировались в зависимости от частоты вращения насоса и блокирования потока ретентата. Диапазон составлял 0,51,45 бар в случае мембраны А и 0,65-1,85 в случае мембраны В. Таблица 8 Суммирование параметров и ответов, полученных из экспериментов по ультрафильтрации, спланированных с использованием программного обеспечения MODDE 6.7.1. Соответствие модели. Значения ответов (время и концентрация белка, или выход) вводили в программу MODDE. Модель подбирали, используя метод частных наименьших квадратов (PLS), и подвергали анализу отклонения(ANOVA). На фиг. 9 представлена диаграмма, названная Краткое изложение соответствий. Для каждого соответствующего ответа на диаграмме представлено 4 столбика. Согласно руководству к программеMODDE значения для R2 и Q2 обеспечивают лучшее краткое изложение модели. Переменная R2 описы- 17024470 вает, насколько модель регрессии может быть приведена в соответствие с необработанными данными и названа "качество соответствия". Переменная Q2 названа "качество предсказания" и описывает предсказательную способность модели. Как правило, R2 и Q2 должны быть высокими и не разделенными более чем на 0,2-0,3. Столбик "MV" на фиг. 20 описывает адекватность модели. Если значение составляет ниже 0,25, ошибка модели является значимо большей, чем воспроизводимость, представленная столбиком"RE" (Umetrics AB 2003). Для значения времени все оцениваемые параметры являются хорошими за исключением адекватности модели (фиг. 9). Адекватность модели невозможно вычислить, поскольку повторные прогоны центральной точки дали точно такой же результат (100% воспроизводимость). Для выхода (концентрации белка) качество модели и предсказания является низким или нулевым, что означает, что система фильтрования является очень надежной в отношении выхода: Изменения в пределах выбранного диапазона параметра, таким образом, не оказывают влияния на выход. Табл. 9 (ANOVA для выхода) показывает, что отсутствие соответствия не является значимым при уровне значимости 95%, поскольку р более 0,05. Как видно также на фиг. 9, в отношении выхода ошибка модели отсутствует. Значение р регрессии составляет 0,730, что находится далеко за пределами критического значения 0,05. Таким образом, регрессия не является значимой при уровне значимости 95%, и выход не может быть предсказан с использованием модели. Для значения времени табл. ANOVA (табл. 10) выглядит иначе. Значение р для отсутствия соответствия (ошибки модели) не может быть определено. Все прогоны центральной точки привели в результате именно к одинаковым значениям времени. Следовательно, в модели нет действительной ошибки. Для регрессии р=0,000, что указывает на очень хорошую модель в отношении времени фильтрования. Таблица 9 Таблица ANOVA для выхода.DF представляет собой степень свободы,SS представляет собой сумму квадратов,MS представляет собой среднее квадратов, иSD представляет собой стандартное отклонениеDF представляет собой степень свободы,SS представляет собой сумму квадратов,MS представляет собой среднее квадратов, иSD представляет собой стандартное отклонение 6.7.2. Оценка результатов. Время было единственным ответом, на который можно оказать влияние. На фиг. 10 показано, как каждый параметр влиял на время ультрафильтрации. Четко видно, что частота вращения насоса (т.е. скорость подающего потока) обладает основным воздействием на продолжительность фильтрования. Более высокая скорость приводит в результате к более быстрому фильтрованию. Блокирование потока ретентата обладает минимальным влиянием. Температура, по-видимому, не играет никакой роли, поскольку столбик ее ошибки даже больше, чем действительный столбик, описывающий эффект. При сравнении мембран кажется очевидным, что мембрана В является лучшим выбором. Выбор мембраны В обеспечивает более короткое время фильтрования более чем на 5 мин по сравнению со средним временем. Для мембраны А соответствующее время более чем на 5 мин больше. Качество фильтрования является другим важным фактором. Это было исследовано путем отбора образцов из пермеатов и измерения концентрации белка в них. Во всех образцах концентрация была ниже 0,05 мг/мл за исключением пермеата прогона 4, где концентрация составляла 0,06 мг/мл. Профиль белка четырех пермеатов исследовали, используя анализ с помощью электрофореза в SDS-PAGE. Профили представлены на фиг. 11. Пермеаты из прогонов 1 и 4 (дорожки 2 и 3) были получены из ультрафильтраций с использованием мембраны В, а пермеаты из прогонов 7 и 10 (дорожки 4 и 5) были получены с использованием мембраны А. Видимые белки большего размера, чем 13 кДа, отсутствуют в любом из образцов. Это означает, что при всех фильтрациях, исследованных в данной работе, мембрана функционировала в соответствии с ее теоретическим значением отсекаемого размера частиц. В случае прогона 1 с трудом видны какие-либо белки. 6.8. Оптимизация потока в зависимости от ТМР для кассет ультрафильтрации типа С. Доказано, что фильтры типа С являются хорошим выбором для ультрафильтрации экстракта костного белка. Они обеспечивают лучшую турбулентность и меньшее напряжение при сдвиге, чем фильтры типа V, которые имеют более открытые каналы подачи. Сдвиг является более низким при фильтрах типа С, поскольку такое же ТМР, как для фильтра типа V, получают при более низкой скорости подающего потока. Оптимизация потока в зависимости от ТМР была исследована в соответствии с планом, показанным в табл. 4. В случае фильтровальной кассеты Biomax результаты представлены на фиг. 12 для VCF 1 и на фиг. 13 для VCF 5. Для фильтровальной кассеты Ultracel соответствующими графическими материалами являются фиг. 14 и 15. В данном исследовании концентрирование с VCF 1 до VCF 5 не проводили, используя самые высокие возможные значения. Балансы массы определяли после экспериментов по оптимизации. 6.8.1. Фильтр Biomax. В случае VCF 1 единственное четкое свидетельство о снижении потока наблюдали при исходной скорости поперечного потока 0,945 л/мин (фиг. 12 А). Эти и все остальные значения, включая проверку гистерезиса, представлены в табл. 11. При ТМР 2,3 бар поток составлял примерно 108 л/м 2/ч. При более высоких скоростях поперечного потока снижения потока не наблюдали при ТМР около 2,8 бар. Более высокие значения не тестировали, поскольку давление подачи уже составляло около 3,6 бар за счет блокирования потока ретентата. Следовательно, поток по меньшей мере 138 л/м 2/ч может быть безопасно достигнут при скорости поперечного потока 1,125 л/мин и 132 л/м 2/ч при 1,350 л/мин соответственно. При более высокой концентрации (VCF 5) экстракта белка, тестируемого при исходной скорости поперечного потока 0,945 л/мин, было небольшое снижение потока при высоких значениях ТМР(фиг. 13). Это может указывать на то, что точка критического потока находится близко. Опять же, эксперимент был остановлен в связи с высоким давлением подачи. При самой высокой скорости поперечного потока (1,350 л/мин) точку перегиба наблюдали, когда ТМР составляло 2,5 бар при потоке 108 л/м 2/ч. 6.8.2. Фильтр Ultracel. Фильтры Ultracel и Biomax различаются по материалу мембраны. Это вызывает различные характеристики потока. Влияние этих характеристик на события фильтрования зависит от ситуации. В данном исследовании с использованием экстракта костного белка равная скорость потока 0,945 л/мин приводила к исходному ТМР 1,04 бар и потоку 57 л/м 2/ч в случае фильтра Ultracel по сравнению с исходным ТМР 0,62 бар и потоком 30 л/м 2/ч для фильтра Biomax (фиг. 14 В и 12 А). При сравнении соответствующие значения для фильтра Biomax типа V даже при более высокой скорости поперечного потока (1,15 л/мин) составляли всего лишь 0,17 бар и практически нулевой поток (фиг. 7 А). Это должно обосновывать использование кассеты Ultracel типа С. Из фиг. 14 и 15 можно сделать вывод, что ни при одной из скоростей поперечного потока, использованных в данном исследовании, верхний предел ТМР и, следовательно, максимальный поток, не был достигнут. Это было в обоих случаях, VCF 1 и VCF 5. Данный результат связан с ограничениями в давлении подачи, которое превышало 3,6 бар. По-видимому, фильтр Ultracel не закупоривался легко даже при высоких давлениях и потоках. Проверка гистерезиса подтвердила это, поскольку после экспериментов был достигнут исходный поток. В табл. 16 суммированы все результаты. 6.8.3. Суммирование результатов оптимизации ультрафильтрации с использованием кассет типа С. В табл. 11 суммированы результаты, полученные в ходе стадий оптимизации для кассетных фильтров Biomax и Ultracel типа С. Четко видно, что оптимальный поток был достигнут в нескольких случаях. Таким образом, оба типа мембран проявляют хорошие характеристики. В качестве сравнения, фильтрBiomax типа V показал критический поток 84 л/м 2/ч при скорости поперечного потока 1,15 л/мин, тогда как критический поток фильтра типа С составляет более 138 л/м 2/ч при почти равной скорости поперечного потока. Результаты проверки гистерезиса указывают на то, что мембрана Biomax закупоривается легче, чем мембрана Ultracel. Скорости потока фильтра Ultracel возвращались к исходным значениям во всех случаях, кроме одного. Для фильтра Biomax средние скорости потока составляли 97% от исходных значений,что является хорошим результатом. Однако следует провести дополнительные тесты прежде, чем сделать окончательные выводы. Таблица 11 Суммирование результатов оптимизации потока в зависимости от ТМР для ультрафильтров типа С Были вычислены балансы массы представленных выше экспериментов, и результаты представлены в табл. 12. В обоих случаях в пермеате не было обнаружено обнаружимого количества белка. Концентрации белка в промывающем растворе и растворе подачи были одинаковыми. Единственное отличие было обнаружено в концентрате, который содержал 87% суммарного белка, измеренного при подаче, в случае фильтра Biomax. Соответствующее значение для фильтра Ultracel составляло 95%. Это высокое значение привело в результате к 6% увеличению конечного баланса массы. Однако это единственное сравнение не показывает достоверно, что фильтр Ultracel обеспечивает более высокий выход. При вычислении средних выходов из семи фильтрований с использованием фильтра Biomax и четырех фильтрований с использованием фильтра Ultracel (табл. 8) результаты составляют 2,18 и 2,12 мг/мл соответственно. Как уже оценено с использованием программы MODDE, заметные несоответствия в отношении выхода отсутствуют. Таблица 12 Вычисления баланса массы ультрафильтраций с использованием кассетных фильтров Biomax и Ultracel типа С 6.9. Эффективность очистки мембран. Значение NWP было измерено после стадии очистки, проводимой после каждого фильтрования. Результаты суммированы в данном разделе. Мембрана Biomax, по-видимому, закупоривается легче, чем мембрана Ultracel. На фиг. 16 показана эффективность очистки, оцениваемая по значениям NWP. Семь циклов фильтрования было проведено с использованием мембраны Biomax и четыре с использованием мембраны Ultracel. Фильтрование было описано в главе 5.3. Эксперименты по очистке проводили, используя 0,1 М NaOH в течение 30 мин при 37 С. В случае фильтра Ultracel NWP возвращалась почти к своему исходному значению при всех четырех очистках. Фильтр Biomax проявлял более низкое восстановление, хотя оно, как правило, составляло выше 90%, за исключением фильтрования номер 7. После экспериментов оптимизации потока в зависимости от ТМР (см. главу 6.8) с использованием тех же фильтров восстановление NWP составляло 99% для фильтра Ultracel и 72% для фильтра Biomax, когда очистку проводили с использованием 0,1 М NaOH в течение 30 мин при 37 С. Затем, когда фильтр Biomax подвергали более жесткой очистке 0,2 М NaOH в течение 60 мин при 45 С, NWP возвращалась к 78% ее исходного значения. Повышение концентрации NaOH до 0,3 М и циркуляция его в течение 45 мин при 45 С обеспечивали значение NWP 80%. Было обнаружено, что такой протокол необходим с целью восстановления NWP кассеты ультрафильтрации Biomax типа V и кассеты микрофильтрации типа V до значений выше 80% (результаты не представлены). 6.10. Масштабирование процесса фильтрования. Кассетные фильтры являются линейно масштабируемыми. Следовательно, необходимую площадь мембраны и скорость подающего потока в конечном масштабе изготовления можно вычислить на основании результатов, полученных в малом масштабе. В данном исследовании вычисления для масштабирования процесса ультрафильтрации были проведены для фильтров Biomax и Ultracel типа С. Использовали значения, полученные в экспериментах, описанных в главе 6.8. Значение VCF было равно 5. Абсолютный максимум для потоков фильтрата для фильтров Biomax и Ultracel в этих экспериментах не был достигнут. Самые высокие значения, представленные в табл. 11, используют при вычислениях масштабирования. Суммирование результатов масштабирования представлено в табл. 13. 6.10.1. Определение среднего потока фильтрата. Поток обычно снижается в ходе фильтрования. Для целей масштабирования необходимо среднее значение. Средний поток фильтрата Jf можно вычислить, используя уравнение (5): где Jinitial представляет собой исходный поток фильтрата (л/м 2/ч);Jfinal представляет собой поток фильтрата в конце фильтрования (л/м 2/ч). Таким образом, Jinitial представляет собой поток, когда VCF равно 1, и Jfinal в данном случае представляет собой поток для VCF 5. Самые высокие значения потока из табл. 11 для обеих VCF используют при вычислениях с использованием уравнения (5). Когда VCF равно 1, эти значения равны 138 л/м 2/ч дляBiomax и 144 л/м 2/ч для Ultracel. Когда VCF равно 5, соответствующие значения равны 114 л/м 2/ч и 129 л/м 2/ч, соответственно. Подстановка этих значений в уравнение (5) дает Jf 121 л/м 2/ч для Biomax и 134 л/м 2/ч для Ultracel. Если желательна очень надежная система, можно использовать исключительноJfinal в качестве Jf. Необходимо отметить, что, к сожалению, критический поток для Biomax в случаеVCF 5 не тестировали для скорости подачи 1,125 л/мин. Использование данной скорости подачи привело к получению самых высоких значений потоков, когда VCF равно 1. Значение 114 л/м 2/ч, полученное в результате скорости подачи 0,945 л/мин, используют в вычислениях, которые могут в некоторой степени искажать результаты. 6.10.2. Масштабирование площади мембраны. Площадь мембраны, необходимая для фильтрования (концентрирования) определенного объема раствора в течение желаемого времени процесса, может быть определена из уравнения (6): где Vfiltrate представляет собой объем фильтрата, подлежащий обработке (л);Jf представляет собой средний поток фильтрата (л/м 2/ч), определенный в малом масштабе;t представляет собой желаемое время процесса фильтрования (ч). Если объем фильтрата в масштабе изготовления составляет 800 л (VCF 5 из партии 1000 л), а желаемое время составляет четыре часа, необходимая площадь мембраны А может быть вычислена с использованием уравнения (6). Подстановка значений Jf, вычисленных выше, даст площадь мембраны 1,65 м 2 для мембраны Biomax и 1,49 м 2 для мембраны Ultracel. Рекомендован дополнительный коэффициент запаса прочности 20% для площади мембраны (Millipore 2008). Следовательно, значения равны 1,98 и 1,79 м 2. На практике это означает использование четырех мембран по 0,5 м 2 с получением конечной площади мембраны 2 м 2. Масштабированная площадь мембраны может быть также вычислена с использованием уравнения (7). Конечный результат является таким же, как получен с помощью уравнения (6). где Аехр представляет собой площадь мембраны, использованную в эксперименте (м 2);Vscaled представляет собой объем крупномасштабного процесса (л);tscaled представляет собой желаемое время фильтрования в крупномасштабном процессе (ч);texp представляет собой время фильтрования эксперимента (ч). 6.10.3. Вычисление скорости подачи в масштабированном процессе. Для крупномасштабного процесса фильтрования скорость подачи также должна быть масштабирована. Ее можно определить из уравнения (8): где Qfeed, exp представляет собой скорость подачи, использованную в эксперименте (л/мин); Аехр представляет собой площадь мембраны, использованную в эксперименте (м 2);Ascaled представляет собой площадь мембраны в крупномасштабном процессе (м 2). Скорости подачи, использованные в маломасштабных экспериментах, выбраны из табл. 16. Для самого высокого значения потока фильтрата с использованием фильтра Biomax это значение было равно 1,125 л/мин. Для фильтра Ultracel оно было равно 0,945 л/мин. Площадь мембраны Аехр в экспериментах была равна 0,1 м 2. При введении значений масштабированных площадей мембраны, вычисленных в Главе 6.10.2, и округлении до следующего более высокого значения (2 м 2 для обеих мембран) уравнение (8) дает Qfeed, scaled 22,5 л/мин для Biomax и 18,9 л/мин для Ultracel. В фильтровальном оборудовании конечного масштаба емкость насоса должна быть рассчитана, чтобы удовлетворять этим требованиям. Иначе приходится принимать увеличенное время процесса. 6.10.4. Суммирование результатов масштабирования. Теоретический пример партии 1000 л и VCF 5 использовали при вычислениях для масштабирования процесса. Полномасштабное время процесса было установлено на 4 ч. Обычно рекомендуют временную рамку 3-4 ч (Millipore 2008). Результаты суммированы в табл. 13. Стоимости мембранных устройств представляют собой стартовые цены из веб-страниц Millipore Corporation (www.millipore.com ). Линейная масштабируемость кассетных фильтров дает возможность быстрой регуляции вычислений. Например, если объем фильтрования удваивается, а время фильтрования поддерживают постоянным, это потребует удвоения площади мембраны. Как видно в табл. 13, различия между двумя мембранами не являются большими в данном эксперименте. Фильтр Ultracel является немного менее дорогостоящим,чем фильтр Biomax. Таблица 13 Суммирование факторов масштабирования процесса и стоимостей мембран 7. Обсуждение. Процессы фильтрования сложных биологических материалов всегда зависят от ситуации. Каждый материал имеет свой собственный состав белков и других элементов, и их воздействия невозможно предсказать. Кроме того, раствор и другие условия также влияют на результат. В данном исследовании экстракт костного белка подвергали микро- и ультрафильтрации и использовали серию экспериментов, чтобы оптимизировать, насколько возможно, этот процесс. Не найдено другого опубликованного исследования, которое непосредственно сравнимо с данным исследованием. Этот вид данных оптимизации обычно собирали внутри промышленности, и они необязательно опубликованы. Первые тесты на техническую осуществимость показали, что кассетные фильтры можно эффективно использовать для микро- и ультрафильтрации экстракта белка. Значительного снижения в потоке фильтрата не наблюдали ни во время стадии микрофильтрации, ни во время стадии ультрафильтрации,как показано на фиг. 12 и 14. Коэффициент объемной концентрации достигал величин 45 для микрофильтрации и 10 для ультрафильтрации. Кроме того, процентные значения баланса массы были удовлетворительными: 94% для микрофильтрации и 95-98% для ультрафильтрации. Если суммарная масса выделенного продукта является меньшей, чем исходная масса продукта, это обычно связано с потерями при адсорбции и/или растворимости в ходе обработки (Millipore Corporation 2007). Однако способ анализа белка, использованный в данном исследовании, не является абсолютно точным. Одна из задач данного исследования состояла в выборе соответствующего фильтра для ультрафильтрации. В тестах на техническую осуществимость использовали фильтры, обладающие открытой геометрией канала подачи (типа V). Для данного типа фильтров необходима относительно высокая скорость подачи, чтобы обеспечить достаточный поток. В связи с этим фактом и положительными результатами, полученными в тестах на техническую осуществимость, было идентифицировано два ультрафильтра, Biomax и Ultracel. Оба фильтра обладают более узкими каналами подачи (типа A). Biomax основан на композитной полиэфирсульфоновой мембране, тогда как Ultracel представляет собой композитный материал из регенерированной целлюлозы. Регенерированную целлюлозу часто выбирают для биофармацевтических применений в связи с ее свойством низкой закупорки. Сравнивали обе мембраны ультрафильтрации, и в ходе одиннадцати различных экспериментов по фильтрованию подвергали скринингу другие параметры процесса. Эти эксперименты были спланированы с использованием программного обеспечения MODDE. На основании результатов фильтр Ultracel,как оказалось, дает более короткое время фильтрования. Увеличение скорости подачи также сокращало время фильтрования. Неожиданно блокирование потока ретентата не проявляло значительного эффекта. Однако это, вероятно, связано с тем фактом, что штуцерный кран не мог достаточно блокировать поток,даже когда он был закрыт на 80%. Это значение было максимальным в данных экспериментах. Очевидно, что ограничение потока ретентата вызывает увеличение потока фильтрата вплоть до определенной точки. Эксперимент можно повторно спланировать, используя более высокое значение n и пропуская факторы, которые не оказывают влияния (например, температуру), для получения более точных результатов. Оба протестированных фильтра показали равные выходы белка, поэтому возможное более сильное закупоривание мембраны Biomax не является достаточно значимым, чтобы вызвать обнаружимую потерю белков. Для экстракта костного белка критический поток 138 л/м 2/ч был достигнут при ТМР 2,95 бар с использованием полиэфирсульфоновой мембраны с отсекаемым размером частиц 10 кДа типа С (Biomax,Millipore Corporation). В случае мембраны фирмы Millipore с отсекаемым размером частиц 10 кДа из регенерированной целлюлозы, типа С (Ultracel) соответствующие значения составляли 144 л/м 2/ч и 2,6 бар,соответственно. В обоих случаях абсолютное критическое значение для потока не было достигнуто вследствие ограничений давления подачи. Для сравнения Biomax типа V давал критический поток- 23024470 108 л/м 2/ч при ТМР 2,5 бар. Как наблюдали во время исследований по оптимизации, ультрафильтры типа С обеспечивали более высокие потоки при более низких скоростях подачи по сравнению с фильтрами типа V. Фильтры типа А имеют самые узкие и наиболее способствующие турбулентности каналы подачи. Поэтому с этими фильтрами могут быть получены высокие или даже более высокие потоки по сравнению с фильтрами типа С(и типа V). Это означает, что такая же эффективность может быть достигнута, но при более низких скоростях подачи или более низких эксплуатационных расходах. Меньше энергии требуется для работы насоса, и, кроме того, уменьшается сдвиговое напряжение насоса по отношению к продукту. Такой же вид дополнительной оптимизации можно применить к микрофильтрации. В данном исследовании использовали только один тип микрофильтра (Biomax типа V с отсекаемым размером 1000 кДа). Анализ эффективности протоколов очистки мембраны посредством мониторинга изменений NWP показал некоторые различия между полиэфирсульфоновой мембраной (Biomax) и мембраной из регенерированной целлюлозы (Ultracel). Стандартный протокол очистки с использованием 1 л 0,1 М гидроксида натрия при 7 С в течение 30 мин был достаточен, чтобы восстановить исходную NWP. Такой же протокол использовали для мембраны Biomax, и он был способен восстановить 90% исходной NWP в большинстве случаев (фиг. 16). NWP20% исходной в характерном случае приводит в результате к воспроизводимости процесса (Millipore 2000). Однако в тех случаях, когда достаточная NWP не была достигнута,была необходима очистка 0,3 М NaOH при 45 С в течение 45 мин, чтобы восстановить 80% исходнойNWP. Это позволяет предположить закупоривание мембраны. Для фильтра Biomax время от времени может требоваться очистка гипохлоритом. Исследована эффективность очистки фильтров Biomax и Ultracel после фильтрования раствора, содержащего 2-25% сывороточного альбумина человека (Millipore Corporation 2000). Было показано, что очистка 0,25 М NaOH при 40 С в течение 60 мин была достаточна для мембраны Ultracel, чтобы вернуть значения NWP к уровням, близким к исходным. Подобный эффект был получен для мембраны Biomax с использованием такого же раствора, усиленного 250 гипохлорита натрия. После очистки должно быть проверено удаление хлора из мембраны, что требует дополнительной стадии анализа. Вычисления для масштабирования процесса ультрафильтрации, хотя они не являются окончательными, дают понятие о том, как можно проводить масштабирование. Предполагаемый 1000-литровый процесс может быть завершен в течение четырех ч. Это связано с тем, что целесообразно высокие потоки были получены с обеими мембранами (Biomax и Ultracel) даже по сравнению с потоками, приведенными в литературе. 8. Выводы. Было обнаружено, что кассетные фильтры пригодны для микро- и ультрафильтрации с тангенциальным потоком экстракта костного белка. Только один тип фильтра подвергали исследованиям микрофильтрации. Используемый фильтр представлял собой фильтр Biomax, в котором в качестве материала мембраны использован полиэфирсульфон. Значение отсекаемой молекулярной массы составляло 1000 кДа, и тип канала сетки представлял собой тип V. Был достигнут критический поток примерно 75 л/м 2/ч. Эти результаты могут быть улучшены путем введения фильтра, обладающего более плотными каналами подачи, такого как тип С или А. Альтернативно, для применения при микрофильтрации можно также исследовать фильтры на основе регенерированной целлюлозы. Было обнаружено, что при ультрафильтрации регенерированная целлюлоза менее склонна к закупорке, чем полиэфирсульфон. Ультрафильтрация была исследована с использованием трех фильтров, имеющих значение отсекаемой молекулярной массы 10 кДа. Они представляли собой фильтры Biomax, имеющий тип канала сетки V или С, и Ultracel с каналом сетки типа С. Материалы мембраны представляли собой полиэфирсульфон и регенерированную целлюлозу, соответственно. Было обнаружено, что тип С дает лучшее отношение потока фильтрата к скорости подачи. Поэтому дополнительно сравнивали фильтры Biomax иUltracel типа С. Полученный средний критический поток составлял 121 л/м 2/ч для Biomax и 134 л/м 2/ч дляUltracel. Полученные потоки не являлись максимальными значениями для этих фильтров, поскольку поток возрастал линейно с трансмембранным давлением в обоих случаях, когда был достигнут предел давления подачи оборудования. Это предполагает дальнейшее тестирование фильтров типа А. Они не обязательно дают более высокие средние критические потоки по сравнению с фильтрами типа С, но эти потоки могут быть достигнуты при более низких скоростях подачи. Различные параметры, оказывающие влияние на процесс ультрафильтрации, были систематически изучены с использованием программного обеспечения (MODDE) для планирования и анализа экспериментов. Параметрами, исследованными в отношении продолжительности каждого фильтрования и выхода, были температура, скорость подачи (частота вращения насоса), блокирование потока ретентата и мембрана. Значительных различий в выходе не наблюдали. Мембрана Ultracel давала более высокую скорость фильтрования по сравнению с фильтром Biomax. Увеличенная скорость подачи обладала подобным эффектом, как ожидали. Эксперимент планировали и оценивали способом, который не учитывает взаимодействия между параметрами. Для того чтобы полностью исследовать возможные взаимодействия, была бы необходима серия большего числа экспериментов. Между полиэфирсульфоновой мембраной (Biomax) и мембраной из регенерированной целлюлозы(Ultracel) наблюдали различия в очистке. Результаты очистки оценивали путем сравнения значенийNWP. Мембрана Ultracel эффективно очищалась путем использования 0,1 М NaOH в течение 30 мин при 37 С. Во многих случаях мембраны Biomax требовали очистки с использованием 0,3 М NaOH в течение 45 мин при 45 С. На основании литературных данных известно, что полиэфирсульфон более склонен к закупорке, чем регенерированная целлюлоза. Этот предмет можно систематически исследовать с использованием MODDE. Использование хлора в качестве добавки для очистки полиэфирсульфоновых мембран является одним из путей улучшения результатов. Оно может сократить продолжительность очистки, а также дает возможность использовать более низкую температуру. Эти усовершенствования непосредственно влияют на экономичность процесса. Может быть протестирована даже очистка при комнатной температуре. В данном исследовании использовали фильтры Pellicon-2, изготавливаемые фирмой MilliporeCorporation. Было бы возможно использовать и тестировать фильтры других изготовителей, если бы они обладали идентичными наружными размерами. Однако никакие данные, полученные в данном исследовании, не будут применимы к другим фильтрам. Внутренняя геометрия фильтров, мембрана и диапазон значений отсекаемой молекулярной массы различаются между изготовителями. Результаты, рекомендации и вычисления для масштабирования процесса, таким образом, действительны только для конкретных фильтров, оцененных в данном исследовании. 9. Краткое изложение. Цель данной работы состояла в том, чтобы исследовать кассетное фильтрование с тангенциальным потоком экстракта костного белка. После дальнейшей обработки эти белки можно применять в ортопедических имплантатах для улучшения роста кости. Фильтрование с тангенциальным потоком уже длительное время применяют в различных промышленных областях применения. В биофармацевтических областях применения часто предпочитают кассетные фильтры в связи с их линейной масштабируемостью, высоким выходом и воспроизводимостью изготовления от партии к партии. В теоретической части данного исследования были освоены различные конструкции фильтрационного оборудования, различные типы мембран и их свойства. Кассетная ультрафильтрация и ее использование в биофармацевтических областях применения было основным центром внимания данного исследования. Оно также относилось к закупорке, очистке и дезинфекции мембран. Экспериментальная часть исследования состояла в различных экспериментах по фильтрованию,оценке эффективности очистки и проведении вычислений масштабирования процесса. Сначала экстракт фильтровали через кассету, имеющую отсекаемое значение молекулярной массы 1000 кДа. Эту стадию рассматривали как микрофильтрацию, хотя формат мембраны является таким же, как в ультрафильтре. Очень открытый размер пор, однако примерно приближен к нижней границе диапазона микрофильтрации (0,1 мкм). Протокол оптимизации параметров для открытой мембраны является таким же, как для микрофильтров. Затем пермеат микрофильтрации подвергали ультрафильтрации через кассету, имеющую отсекаемое значение 10 кДа. Параметры, влияющие на фильтрации, были тщательно исследованы и оптимизированы. Две марки фильтров, исследованных для ультрафильтрации, представляли собой Biomax и Ultracel.Biomax состоит из полиэфирсульфонового материала мембраны, тогда как мембрана Ultracel состоит из регенерированной целлюлозы. Фильтр Biomax проявлял несколько большую закупорку, чем фильтр Ultracel, однако, для него также требовались более жесткие условия очистки. В результате закупорки Ultracel давал несколько более высокие потоки и, следовательно, является лучшим выбором фильтра для конечного процесса. Абсолютные критические потоки фильтрата не могли быть достигнуты ни в одном из двух случаев. Необходимы дальнейшие исследования с использованием фильтров с более плотными каналами подачи как для микро-, так и для ультрафильтрации. Тогда при меньших давлениях могли бы быть достигнуты более высокие потоки фильтрата, что значительно улучшает экономичность процесса. Вычисления для масштабированного процесса были основаны на 1000-литровом объеме партии иVCF 5. Для протестированных ультрафильтров процесс может быть завершен в течение 4 ч при использовании 2 м 2 суммарной площади фильтра со стоимостью примерно 9000 . Такие же фильтры можно часто использовать в течение нескольких лет. Таким образом, стоимость мембраны на партию является умеренной. Микрофильтрация не была оптимизирована так тщательно, как ультрафильтрация. Поэтому вычисления по масштабированию не проводили. Однако на основании уже полученных результатов общая стоимость стадии микрофильтрации должна находиться примерно в таком же диапазоне, как стоимости ультрафильтрации. Ниже приведен экспериментальный протокол для экстракции кости северного оленя. Различные описанные стадии можно применять к другим подобным протоколам по отдельности. Примеры таких протоколов также раскрыты на фиг. 17 и 18. На фиг. 19 и 20 показаны электрофорезы в SDS-PAGE нативных экстрактов, деминерализованных с использованием либо муравьиной кислоты, либо HCl. 1. Очистка и измельчение сырой кости до костных гранул (все стадии отмывки проводили при температуре менее 10 С). 1.1. Кости, которые хранили при -20 С, взвешивают и эпифизарные концы костей отрезают и отбрасывают. Наружную поверхность промывают водой при высоком давлении. 1.2. Кости режут медицинской пилой до длин примерно 10 см и внутренние поверхности промывают водой при высоком давлении. Промывку осуществляют с целью удаления костного мозга и мягких тканей. 1.3. После промывки очищенные кортикальные слои костей замораживают в жидком азоте в течение примерно 20 мин, а затем измельчают до размера частиц 1,0 мм 3, используя режущую мельницуHeavy-Duty Cutting Mill SM 2000 (Retsch GmbH, Haan, Germany). 1.4. Костные гранулы хранят при -20 С. 1.5. Берут образец из каждой измельчаемой партии для последующего подсчета общего числа жизнеспособных аэробных микроорганизмов (total viable aerobic count, TVAC). 2. Деминерализация костных гранул. 2.1. Примерно 30 кг костных гранул промывают три раза в холодной воде из обратного осмоса (ОО)(менее 10 С) при времени перемешивания примерно 5 мин на промывку. Затем костные гранулы деминерализуют за три стадии разбавленной 0,6 М HCl. 2.2. На первой стадии деминерализации к промытым костным гранулам добавляют примерно 120 кг воды 00 и примерно 40 кг 2,4 М соляной кислоты (HCl) до достижения концентрации HCl 0,6 М. Скорость подачи HCl составляет примерно 2,4 л/мин. Перемешивание осуществляют в контейнере, изготовленном по заказу, с охлаждением (BBS Oy, Bioengineering) и непрерывно перемешивают. Температуру для этой стадии и всех последующих стадий добавления HCl поддерживают ниже 10 С. Мониторинг рН и температуры осуществляют непрерывно. 2.3. После завершения подачи HCI и дополнительно еще 15 мин перемешивания мешалку останавливают и костным гранулам дают возможность осесть в течение 20 мин. Водную смесь после деминерализации удаляют перистальтическим насосом и отбрасывают как отходы. 2.4. Вторую деминерализацию проводят идентично первой стадии деминерализации. 2.5. Третью стадию деминерализации проводят путем добавления 120 кг воды к смеси костных гранул, а затем добавления примерно 20 кг 2,4 М HCl за период 1 ч. Перемешивание продолжают в течение примерно 16 ч до тех пор, пока рН остается постоянным от 2,8 до 3,0 в течение по меньшей мере 2 ч. Затем водную смесь после деминерализации удаляют перистальтическим насосом и отбрасывают как отходы. 2.6. Деминерализованную кость промывают пять раз примерно 60 кг воды 00 в течение 15 мин. рН воды при последней стадии промывки должен составлять от 2,4 до 2,6. 3. Экстракция костного матрикса гуанидингидрохлоридом (GuHCl) 3.1. Примерно 100 кг 4 М GuHCl (GuHCl, NlGU Chemie GmbH) добавляют к деминерализованной кости и перемешивают в течение 22 ч с целью экстракции костного белка. Деминерализованным и экстрагированным костным гранулам дают возможность осесть в течение 20 мин, после чего экстракт белкаGuHCl собирают в качестве продукта рН и температуру измеряют непрерывно. 3.2. Вторую экстракцию проводят таким же способом путем добавления примерно 100 кг 4 МGuHCl объединяют с первым экстрактом. Измеряют рН, и он должен составлять от рН 3,9 до 4,5. 3.3. Концентрацию суммарного белка экстракта белка GuHCl определяют методом Бредфорда как после первой, так и после второй экстракции, и она должна составлять примерно 56 мг/мл 10%. 4. Центрифугирование для удаления твердой фазы и гелевых компонентов 4.1. Экстракт белка GuHCl поддерживают при температуре ниже 10 С при непрерывном перемешивании в течение 24 ч, после чего его осветляют, используя центрифугирование с непрерывным потоком(СЕРА Zentrifuge Z 41). Отделенный материал отбрасывают как отходы. 5. Фильтрование. 5.1. Полученный экстракт белка GuHCl фильтруют, используя капсульные фильтры однократного применения (капсула 20 м 2 STAX со средой EKSP, Pall Life Science) или альтернативно используя 2 мкм МФ-фильтрацию (Pellicon, Millipore Corporation). 5.2. Профильтрованный экстракт белка GuHCI концентрируют с помощью УФ-фильтрации при температуре ниже 10 С, используя кассетные фильтры 10 кДа (Pellicon, Millipore Corporation). 5.3. По окончании стадии УФ-фильтрации примерно 26 кг УФ-концентрата собирают и хранят при температуре ниже 10 С. УФ-пермеат отбрасывают как отходы. 6. Водный диализ. 6.1. Водный диализ осуществляют, используя изготовленное по заказу оборудование для диализа(Spectra/Рог Dialysis Membrane, 34 мл/см, MWCO: 12-14,000 Spectrum) обрабатывают дистиллированной водой в течение 20 мин перед сборкой. 6.2. Диализные мембраны заполняют концентрированным экстрактом белка GuHCl через асептические мембраны, примерно 3 л на мембрану. 6.3. Установки параметров для водного диализа представляют собой: 10 продолжительность 47 ч,температура ниже 10 С, количество перекачиваемой воды ОО 16 л/ч. Проводимость с внутренней стороны мембраны измеряют непрерывно с конечной проводимостью 2,2-3,5 мСм/см. Нерастворимый в воде осадок тонет на дне мембраны во время диализа. 6.4. Осадок и водную фазу центрифугируют при температуре ниже 10 С (CEPA Zentrifuge GLE) и осадок собирают в качестве влажного экстракта. Количество влажного экстракта составляет примерно 160 г. 7. Повторное растворение и фильтрование перед цитратным диализом. 7.1. Влажный экстракт повторно растворяют в 4 М GuHCl и перемешивают магнитной мешалкой в течение 16-20 ч. Измеряют рН и проводимость. Проводимость доводят до 230 мСм/см 6 М фильтрованным GuHCl. Температура во время перемешивания ниже 10 С. 7.2. Повторно растворенный экстракт фильтруют в вакууме через дисковые фильтры 0,45 мкм(GN-6 стерильный, PALL) и 0,2 мкм (Supor 200, стерильный, PALL). 8. Цитратный диализ. 8.1. Цитратный диализ осуществляют, используя изготовленное по заказу оборудование для диализа (BBS Oy/Bioengineering). 8.2. Диализную мембрану (4 Spectra/Por Dialysis Membrane, 18 мл/см, MWCO: 12-14000, Spectrum) обрабатывают 0,25 М цитратным буфером (рН 3,1) в течение 20 мин перед сборкой. 8.3. Установки параметров для диализа представляют собой: 47 ч, 9 С, 200 кг 0,25 М цитратного буфера, производительность насоса 1,6 л/ч. Проводимость с внутренней стороны мембраны измеряют непрерывно. Конечная проводимость обычно составляет 9,5-10 мСм/см. 8.4. Материал, нерастворимый в цитратном буфере, центрифугируют (цилиндрический ротор) при температуре ниже 10 С. 8.5. Чистый цитратный буфер декантируют в отходы, и осадок сохраняют. 9. Промывание и лиофилизация осадка. 9.1. Осадок промывают три раза водой для инъекций. Между промывками воду удаляют центрифугированием. 9.2. Промытый осадок взвешивают и отбирают образцы для анализа. Количество осадка составляет примерно 80 г с допустимым содержанием сухого вещества 36%. 9.3. К осадку добавляют наполнители (полисорбат 20, трегалозу, глицин, маннит) в качестве лиопротекторов, а затем заполняют в лотки для лиофилизации (Lyoguard). 9.4. Сушку вымораживанием (лиофилизацию) проводят при -20 С в лиофилизаторе (Christ Оценка различных солей кальция в качестве каркасов для экстракта костного белка в заменителях костной ткани. 1. Введение. Нативная кость содержит факторы роста и дифференциации и сигнальные молекулы, такие как костные морфогенетические белки (BMP), которые важны для регенерации кости и хряща. Эти факторы и молекулы и их конкретные концентрации требуются для различных фаз всего процесса заживления перелома. Таким образом, в качестве лечения перелома кости для добавленного экстракта костного белка требуется подходящая система доставки или носитель, чтобы предотвратить миграцию из сайта применения, с постепенным высвобождением, что приводит в результате к образованию новой кости. Оптимальная матрица носителя должна удовлетворять нескольким критериям. Матрица должна быть биосовместимой, биорассасываемой, пластичной и стерилизуемой. Неорганические вещества удовлетворяют этим требованиям, поскольку большинство из них является структурно прочными, иммунологически инертными, высоко остеокондуктивными и вариабельно биоразлагаемыми. Соли кальция в качестве неорганических материалов годами используют в различных вариантах, поскольку композиция этого материала близка к природной композиции кости. Показано, что трикальцийфосфат (ТКФ) является полезным носителем для рекомбинантных BMP(rhBMP) человека и деминерализованного костного матрикса (DBM). ТКФ обладает многими положительными признаками для применения в имплантатах in vivo, такими как скорости резорбции, близко соответствующие нормальному ремоделированию губчатой кости, и может связываться непосредственно с костью и обладает, прежде всего, остеокондуктивной природой. ТКФ также обладает большей растворимостью, чем гидроксиапатит (ГАП). ГАП является относительно остеокондуктивным и обладает высокой способностью к связыванию белка. Непрерывная структура строения ГАП обеспечивает гибкость для достижения высокой пористости и высокой площади поверхности, что делает ГАП хорошим кандидатом для каркасов. Однако ГАП часто комбинируют с ТКФ с образованием более резорбируемого и пористого носителя с большей степенью костеобразования. Данная комбинация фосфатов кальция также использована в качестве носителя для rhBMP и DBM. Кальция сульфат исследовался в качестве заполнителя пустот кости в течение более ста лет, и обладает множеством функций как часть композитного ма- 28024470 териала костного трансплантата. Кальция сульфат действует в качестве связующего вещества для улучшения общего контакта с костью и объемом, окружающим имплантат. Размер пор важен для прорастания внутрь кости, и увеличение размера пор улучшает воздействие на заживление кости неорганических материалов, таких как сульфаты кальция. Кальция сульфат использовался в качестве носителя для DBM в течение ряда лет, и в клинических исследованиях показана его отличная биосовместимость. Смесь костных морфогенетических белков (BMP), факторов роста и других костных белков экстрагирована из костных материалов различных видов животных, людей и костных опухолей. В предшествующих работах продемонстрировано, что экстракт костного белка северного оленя является эффективным стимулятором образования новой кости в мышиной модели мышечного кармана. Кроме того, хорошая заживляющая способность костного экстракта северного оленя в сегментарном дефекте кости ранее продемонстрирована у кролика и крысы. Способность костного экстракта северного оленя к заживлению различных травм кости является лучшей, чем для других экстрактов, например бычьего экстракта или экстракта страуса, что объясняется тем фактом, что северные олени обновляют рога ежегодно. Кроме того, предположили, что большее количество белкового материала, экстрагированного из кости северного оленя, находится в однокомпонентной форме по сравнению с другими видами, такими как крупный рогатый скот, овцы и свиньи. Экстракт костного белка северного оленя подобен по составу, способу изготовления и предназначенному использованию и применению другим экстрактам костной ткани животного происхождения. Близко сравнимыми препаратами являются Colloss и Colloss E, которые представляют собой деминерализованные костные экстракты, полученные из костей крупного рогатого скота и лошадей, и препараты деминерализованного костного матрикса (DBM), такие какOsteoset DBM Pellets. Данное исследование спланировано как оценка in vivo неорганических компонентов каркаса, которые объединяют с костным экстрактом северного оленя в гетеротопической мышиной модели индуцированной эктопической минерализации мышечного кармана мыши. Для того чтобы определить ответы имплантата и потенциальное образование эктопической новой костной ткани через три недели после имплантации, использовали гистологические и радиографические оценки. 2. Материалы и методы. 2.1. Экстракт костного белка. Экстракт костного белка был экстрагирован и очищен из диафизарной кости северного оленя (Jortikka L., Marttinen A., Lindholm T.S. Partially purified reindeer (Rangifer Tarandus) bone morphogenetic protein has a high bone-forming activity compared with some other artiodactylis. Clin Orthop Relat Res. 1993; 297: 33-7). Полученный экстракт костного белка был лиофилизирован при -20 с использованием наполнителей (сурфактанта (полисорбата 20, Fluka, Sigma-Aldrich), лиопротектора (D-(+)-трегалозы дигидрата,Fluka, Sigma-Aldrich), объемообразующего агента ("агента-наполнителя") (глицина, Riedel-de Han,Sigma-Aldrich) и буфера (D-маннита, Fluka, Sigma-Aldrich. Профиль белков и биологическую активность экстракта костного белка оценивали, используя электрофорез в SDS-PAGE и исследования модели мышечного кармана мыши (фиг. 22). 2.2. Материалы каркаса и группы исследования. Используемые материалы каркаса и группы исследования представляли собой а) пористые диски размером 53 мм (Berkeley Advanced Biomaterials Inc, USA) композиции 30% гидроксиапатита (ГАП),60% трикальцийфосфата (ТКФ) и 10% кальция сульфата (КС); b) пористые диски Cem-Ostetic (BerkeleyAdvanced Biomaterial Inc., USA) размером 53 мм композиции 90% ТКФ и 10% КС; с) порошок для мастики Cem-Ostetic (Berkeley Advanced Biomaterial Inc., USA); d) порошок для мастики КС полугидрат(97%, Sigma-Aldrich); e) непористые диски (Berkeley Advanced Biomaterials Inc, USA) композиции 60% ГАП, 30% ТКФ и 10% КС; и f) гранулы КС дигидрата со стеариновой кислотой композиции: стеариновая кислота 50, смесь жирных кислот, которая состояла в основном из стеариновой кислоты и 40-60% пальмитиновой кислоты (Fluka, Sigma-Aldrich). 2.3. Образец препарата. Лиофилизированный костный экстракт северного оленя (3 мг, BBS-Bioactive Bone Substitutes Ltd,Finland) восстанавливали в 0,9% физиологическом растворе (Natriumchlorid, Fagron, Tamro, Finland) и пропитывали им пористые диски (а, b) и непористый диск (е) или смешивали с порошком Cem-Ostetic (с) и КС полугидратом (d) с образованием формованного диска, либо смешивали в сухом виде с гранулами КС дигидрата и стеариновой кислоты (f) с образованием прессованного диска. Правую лапу использовали в качестве контроля с содержанием соответствующего носителя и наполнителей, но исключая костный экстракт. 2.4. Животные. Использовали суммарно 48 мышей линии BALB/c. Животные были получены из Центра лабораторных животных университета Оулу. Возраст животных составлял 7-12 недель в момент операции. План исследования включал 6 групп по 8 животных на группу. Одна мышь из группы b погибла в течение суток операции без какой-либо видимой причины. Одна мышь из группы с погибла в течение суток операции в связи с проблемами дыхания. Кроме того, две
МПК / Метки
МПК: A61K 35/32, A61L 27/54, A61L 27/36, A61K 38/18, A61L 24/00, A61L 24/10, A61L 27/12, A61P 19/00
Метки: белка, получения, способ, костного, препарата, препарат
Код ссылки
<a href="https://eas.patents.su/30-24470-sposob-polucheniya-preparata-kostnogo-belka-i-preparat-kostnogo-belka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения препарата костного белка и препарат костного белка</a>
Предыдущий патент: Способ изготовления рабочего органа почвообрабатывающего орудия
Следующий патент: Состав для цементирования ствола скважины и способ его приготовления и использования
Случайный патент: Способ получения минеральных удобрений пролонгированного антиоксидантно-восстанавливающего действия