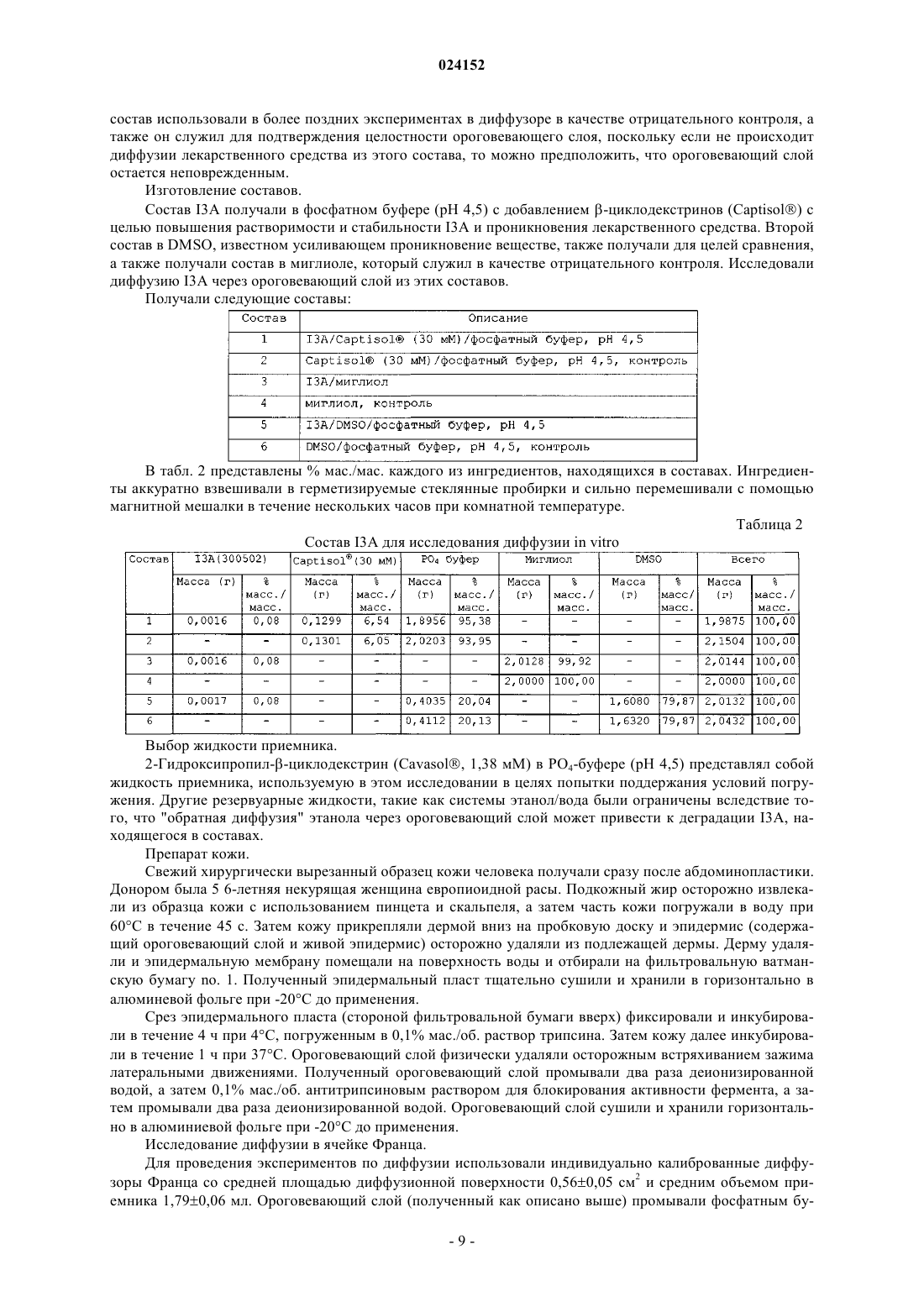
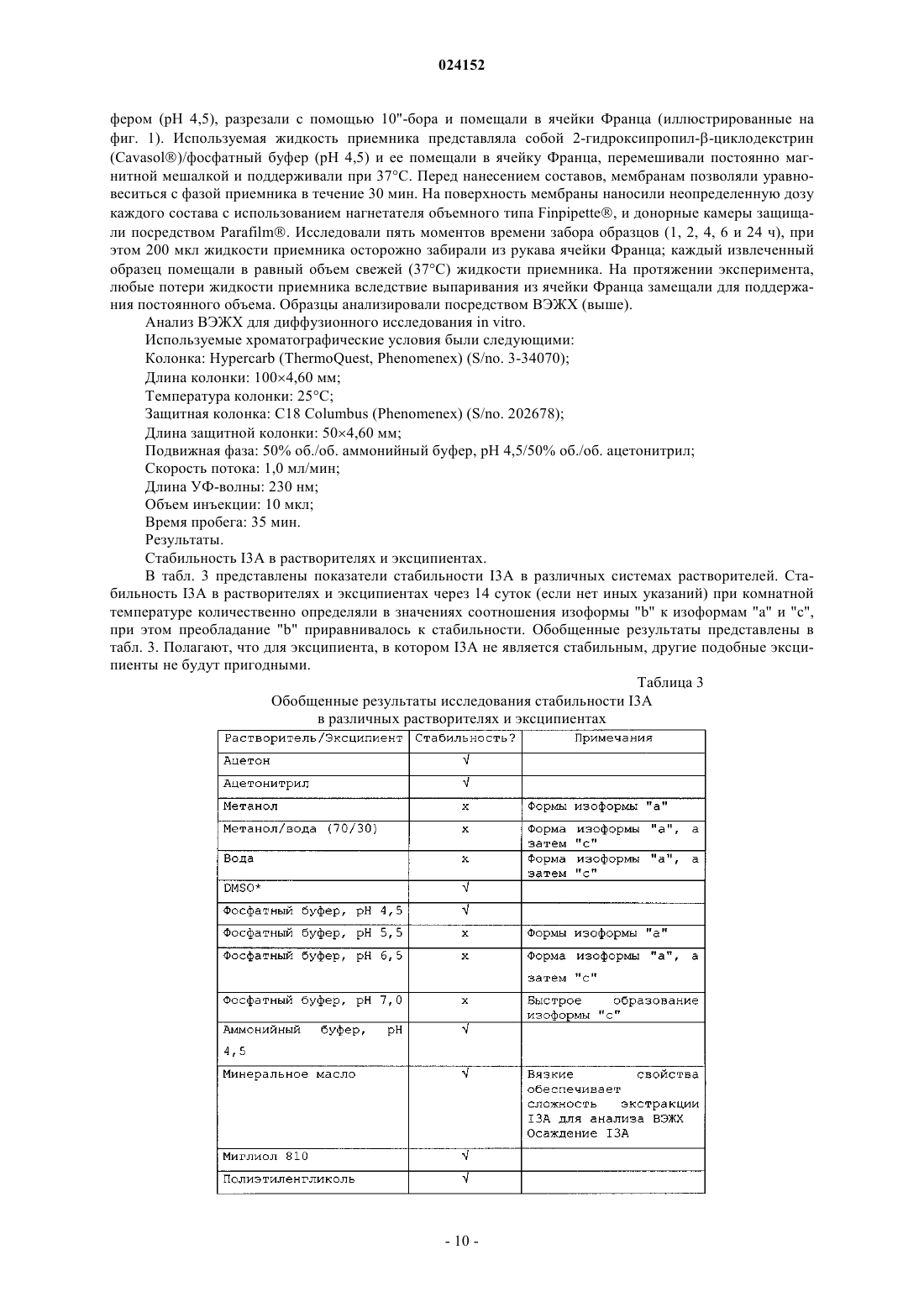
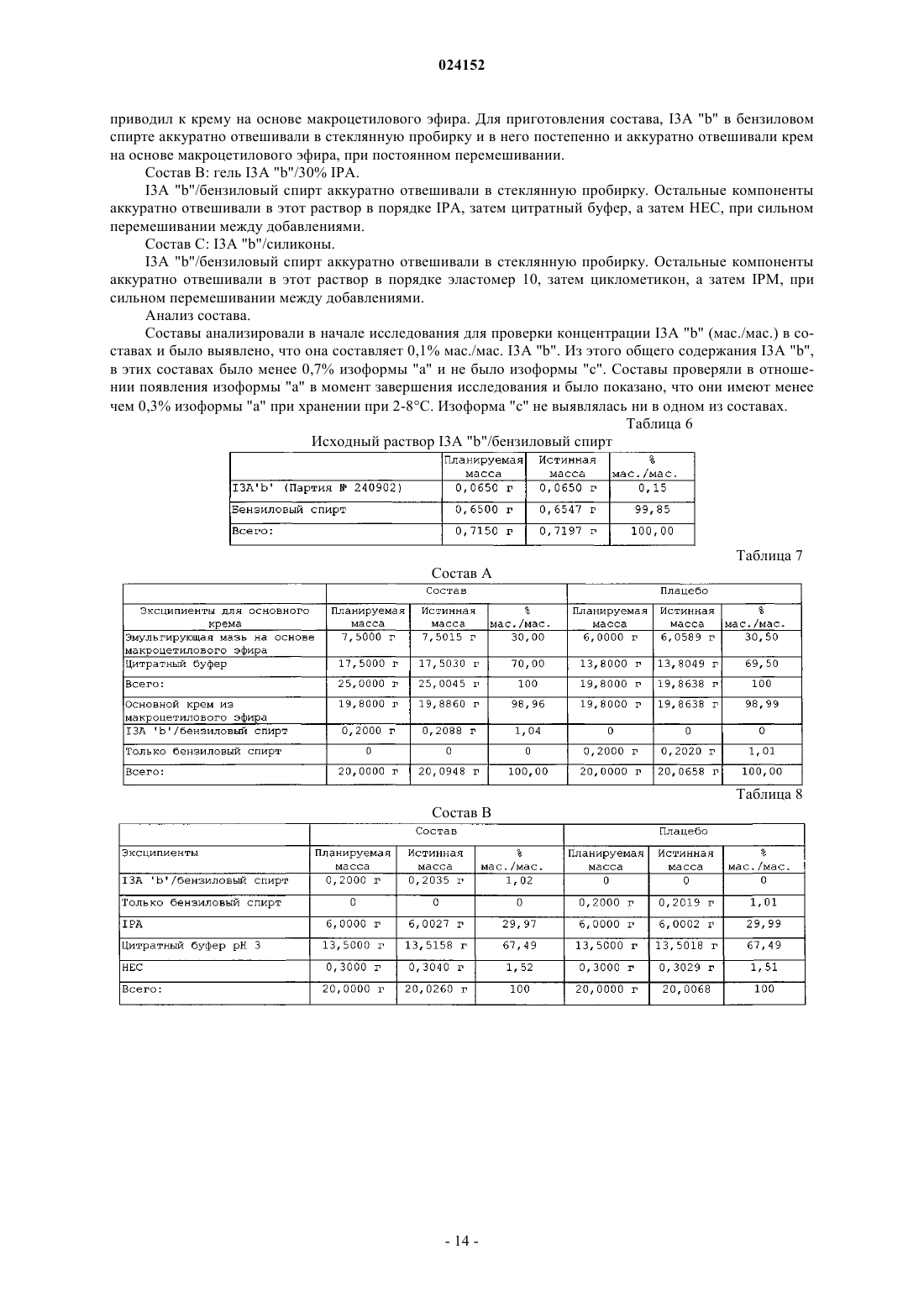
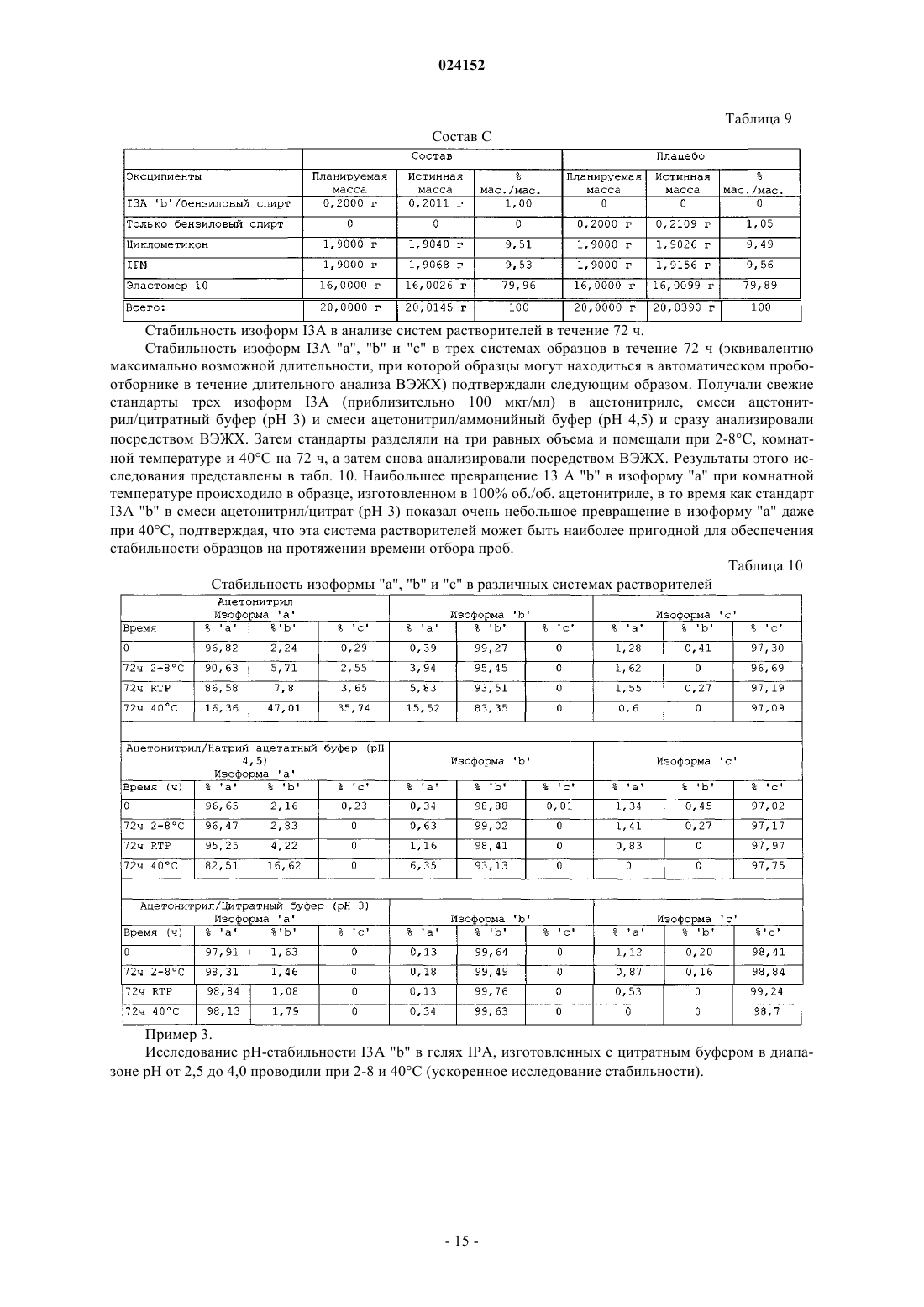
Композиция для местного введения для лечения или профилактики рака кожи
Номер патента: 24152
Опубликовано: 31.08.2016
Авторы: Назир Тахир, Кродерз Майкл Эдвард Дональд, Браун Марк Барри
Формула / Реферат
1. Композиция для местного введения для лечения или профилактики рака кожи, содержащая а) 3-ангелат ингенола; b) усиливающее проникновение вещество; с) консервант; d) гелеобразующее вещество; е) буфер; при этом композиция имеет кажущееся значение рН от 3 до 4 включительно.
2. Композиция по п.1, где усиливающее проникновение вещество выбрано из изопропилового спирта, сульфоксида, азона, пирролидона, алканола или гликоля.
3. Композиция по любому из предыдущих пунктов, где консервант представляет собой парабен, бензойную кислоту или бензиловый спирт.
4. Композиция по любому из предыдущих пунктов, где гелеобразующее вещество представляет собой растворимый в воде полимер, образованный из целлюлозы, карбомер или каррагенан.
5. Композиция по любому из предыдущих пунктов, где гелеобразующее вещество представляет собой полимер гидроксиалкилцеллюлозы, карбоксиметилцеллюлозу, метилгидроксиэтилцеллюлозу или метилцеллюлозу.
6. Композиция по любому из предыдущих пунктов, где буфер представляет собой цитратный или фосфатный буфер.
7. Композиция по любому из предыдущих пунктов, которая имеет кажущееся значение рН между 3 и 4.
8. Композиция по п.7, которая имеет кажущееся значение рН между 3 и 3,5.
9. Композиция по любому из предыдущих пунктов, где буфер представлен в количестве между 0,5 и 10% мас./мас. композиции.
10. Композиция по любому из предыдущих пунктов, содержащая а) 0,1% мас./мас. 3-ангелата ингенола; b) 30% мас./мас. изопропилового спирта; с) 0,9% мас./мас. бензилового спирта; d) 1,5% мас./мас. гидроксиэтилцеллюлозы; е) 67,5% мас./мас. цитратного буфера при рН 3.
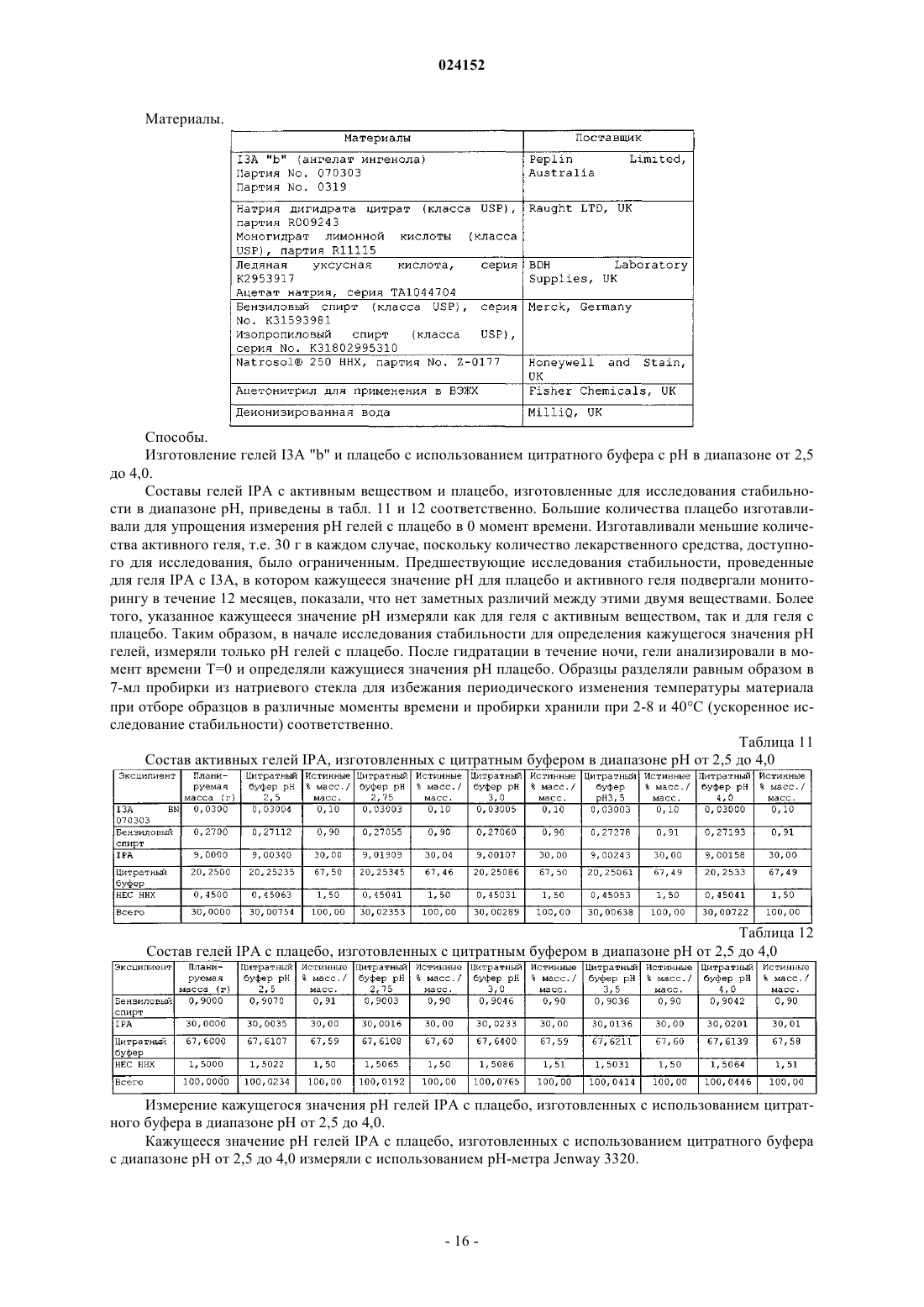
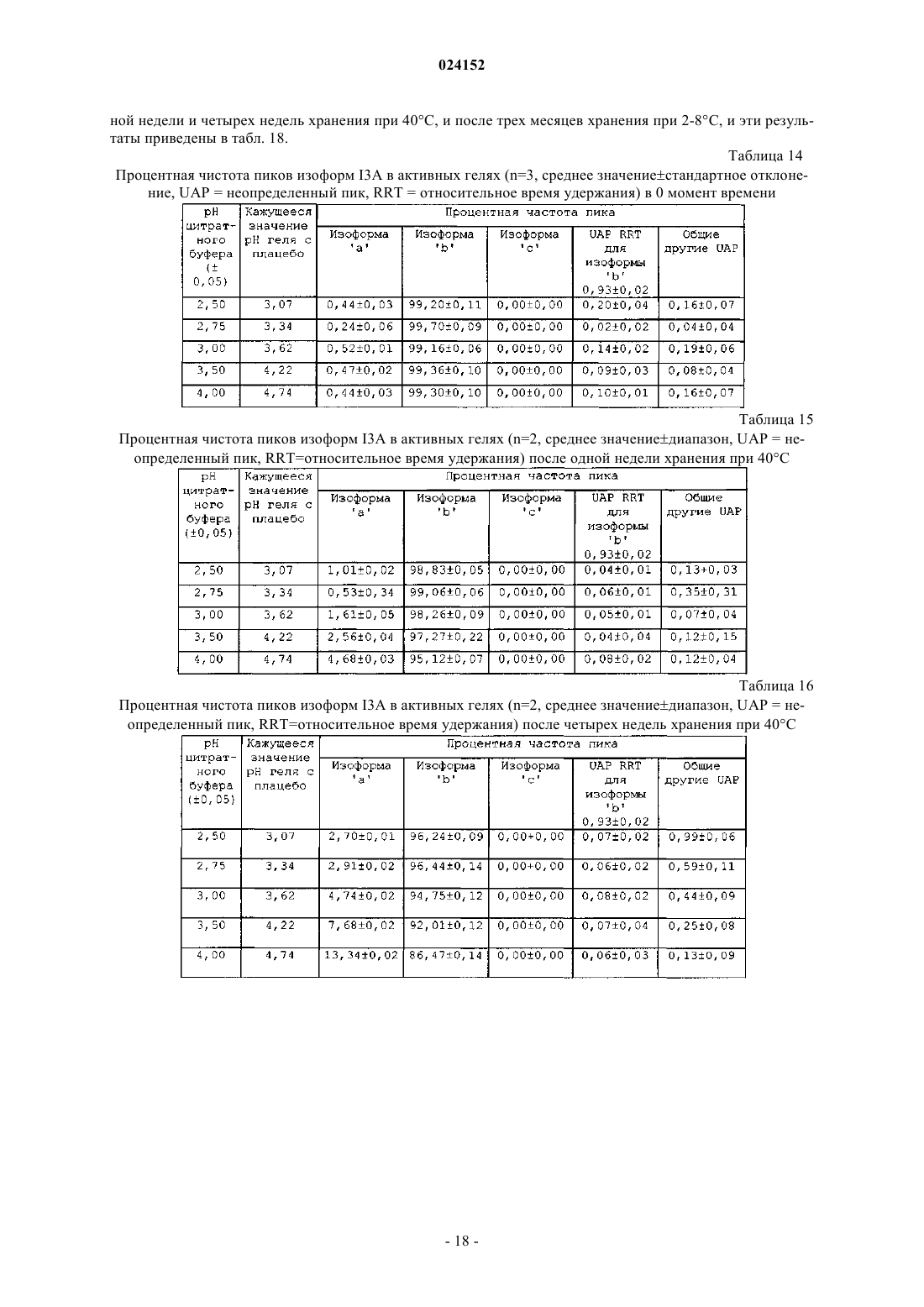
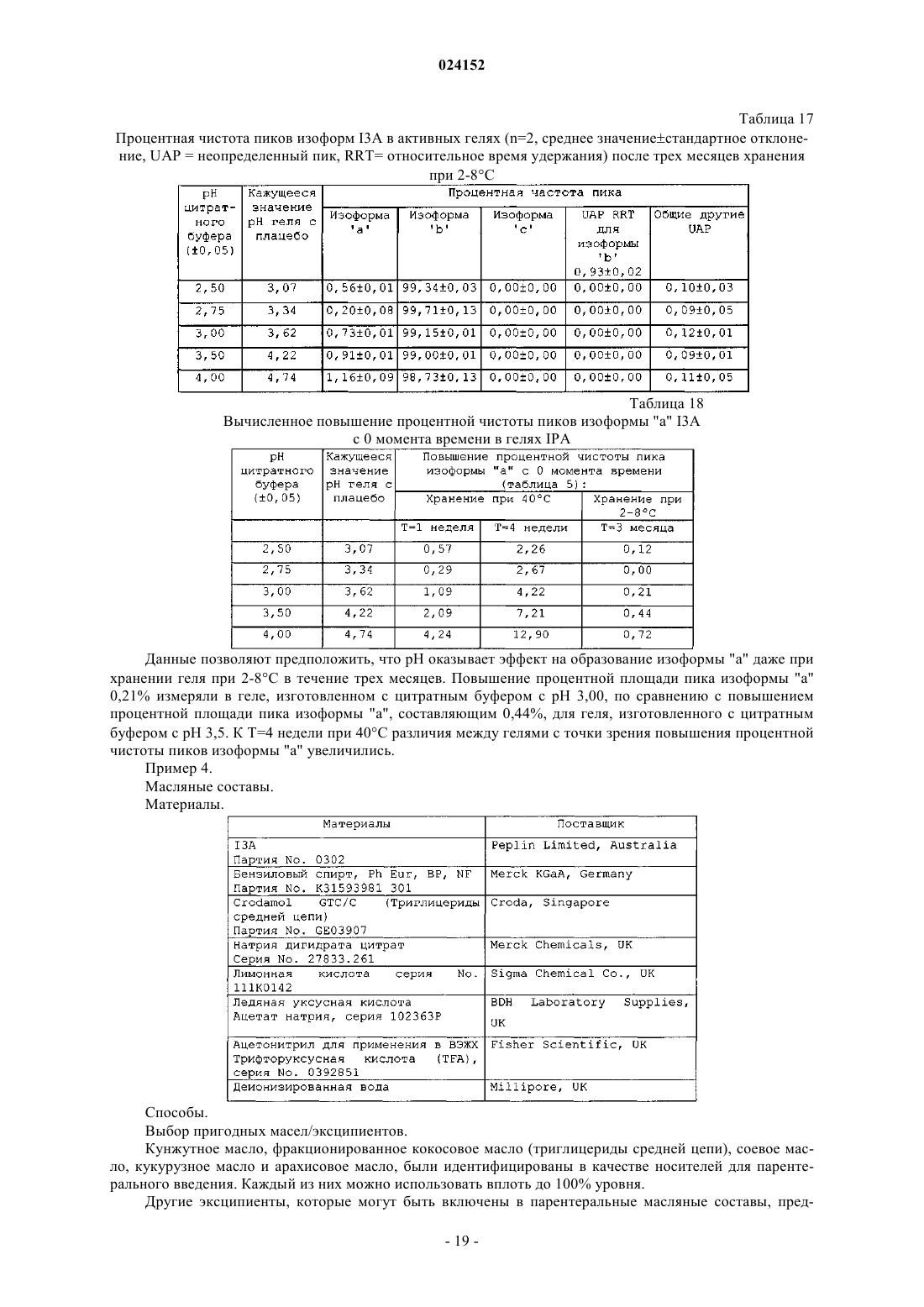
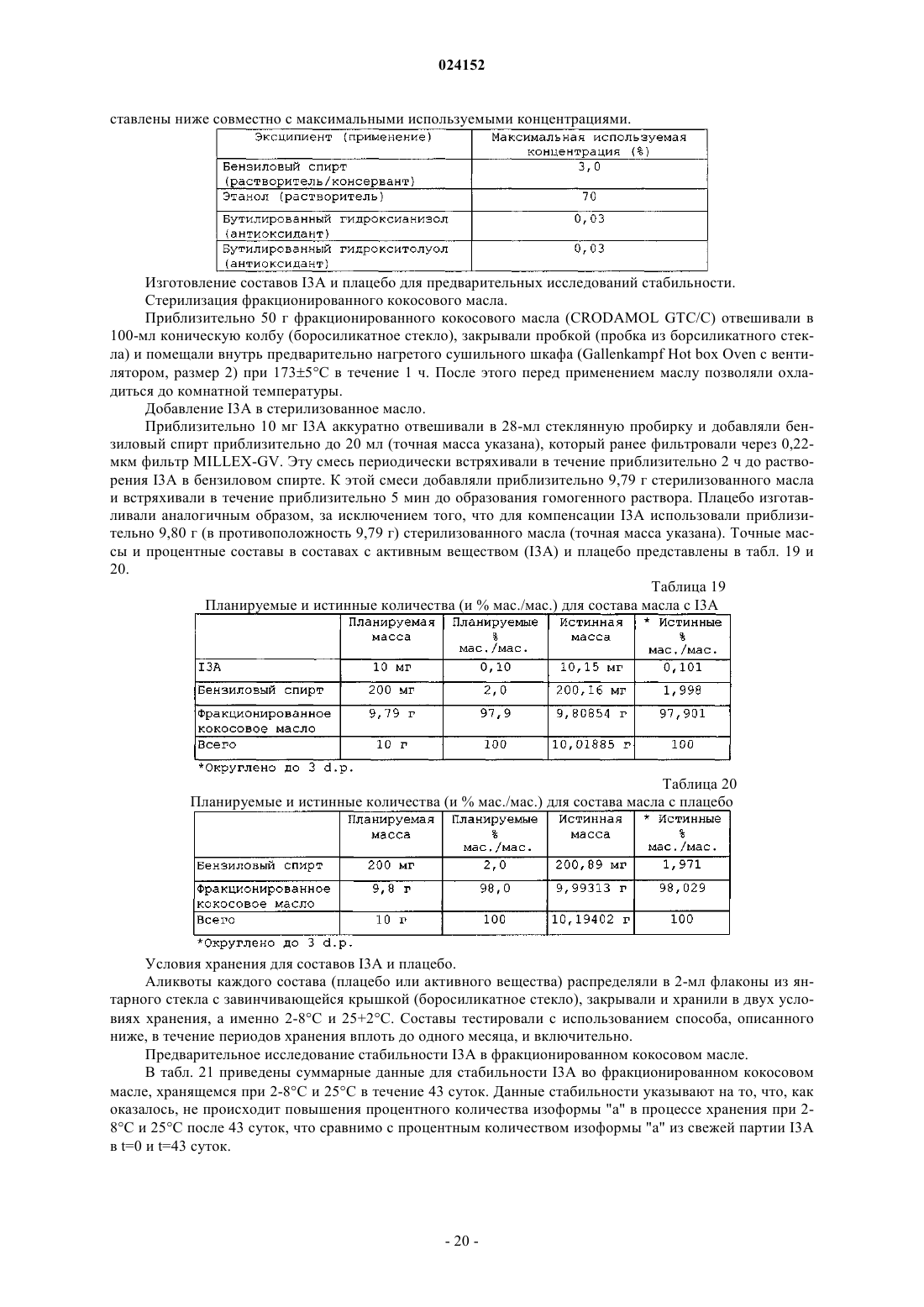
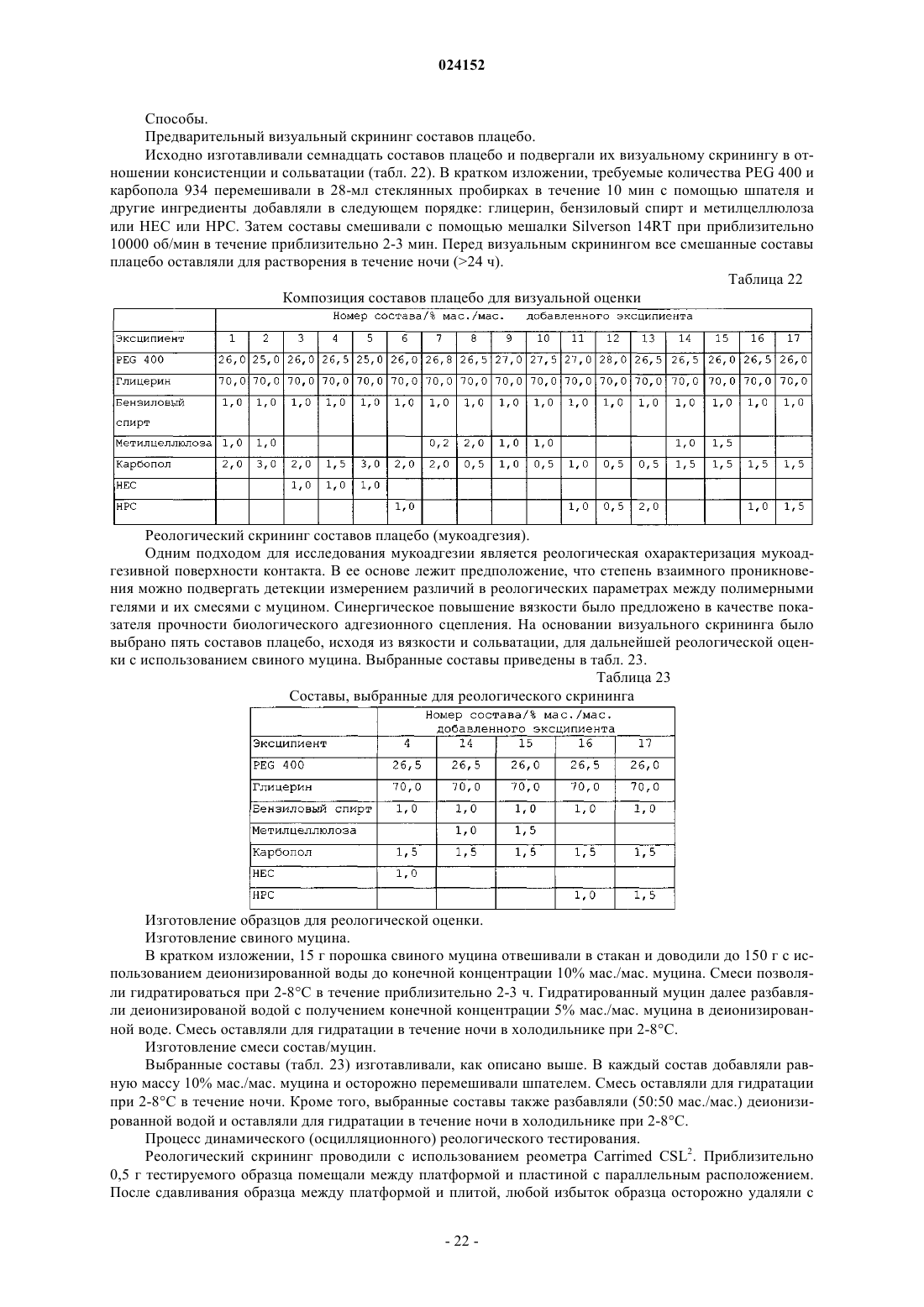
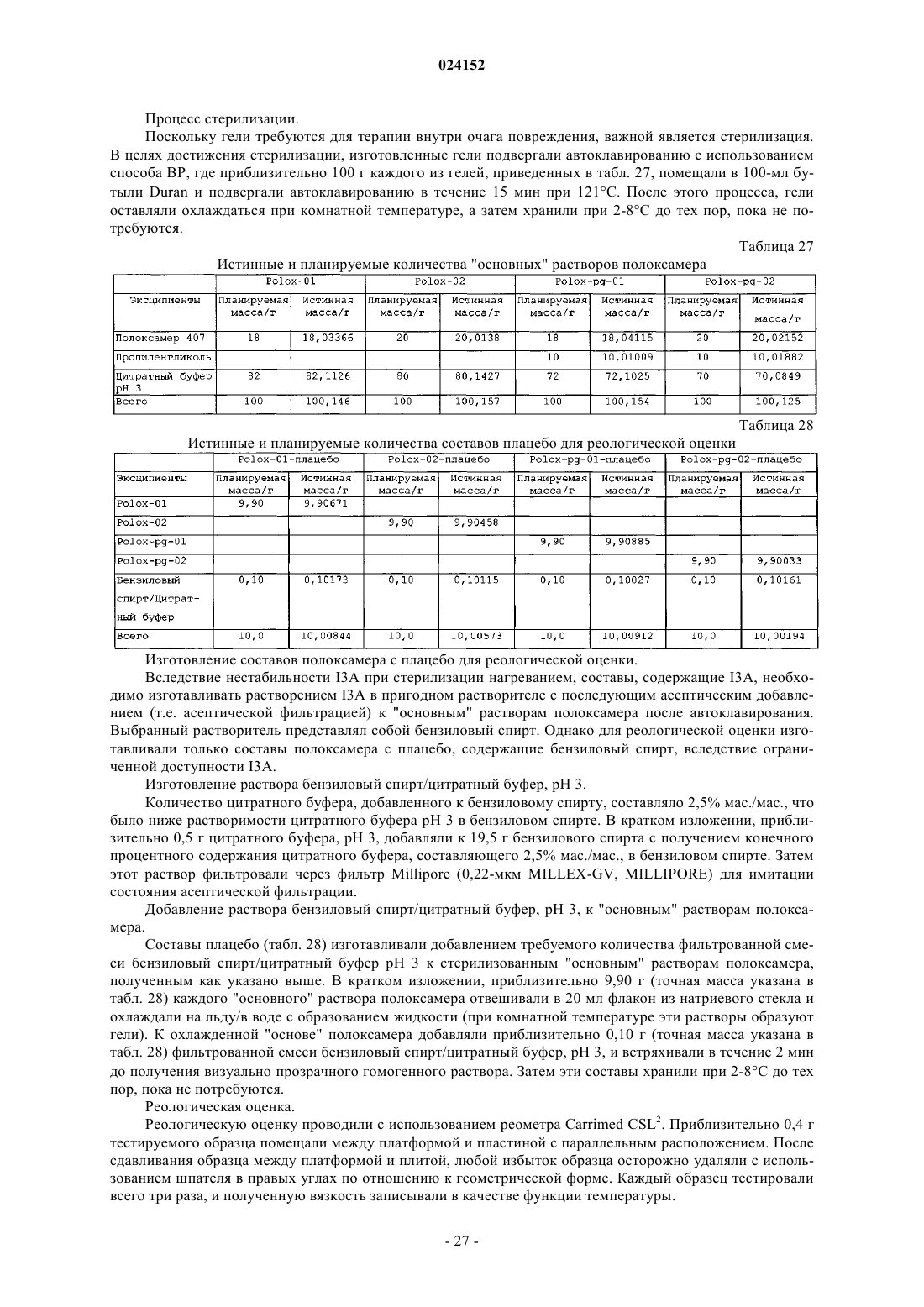
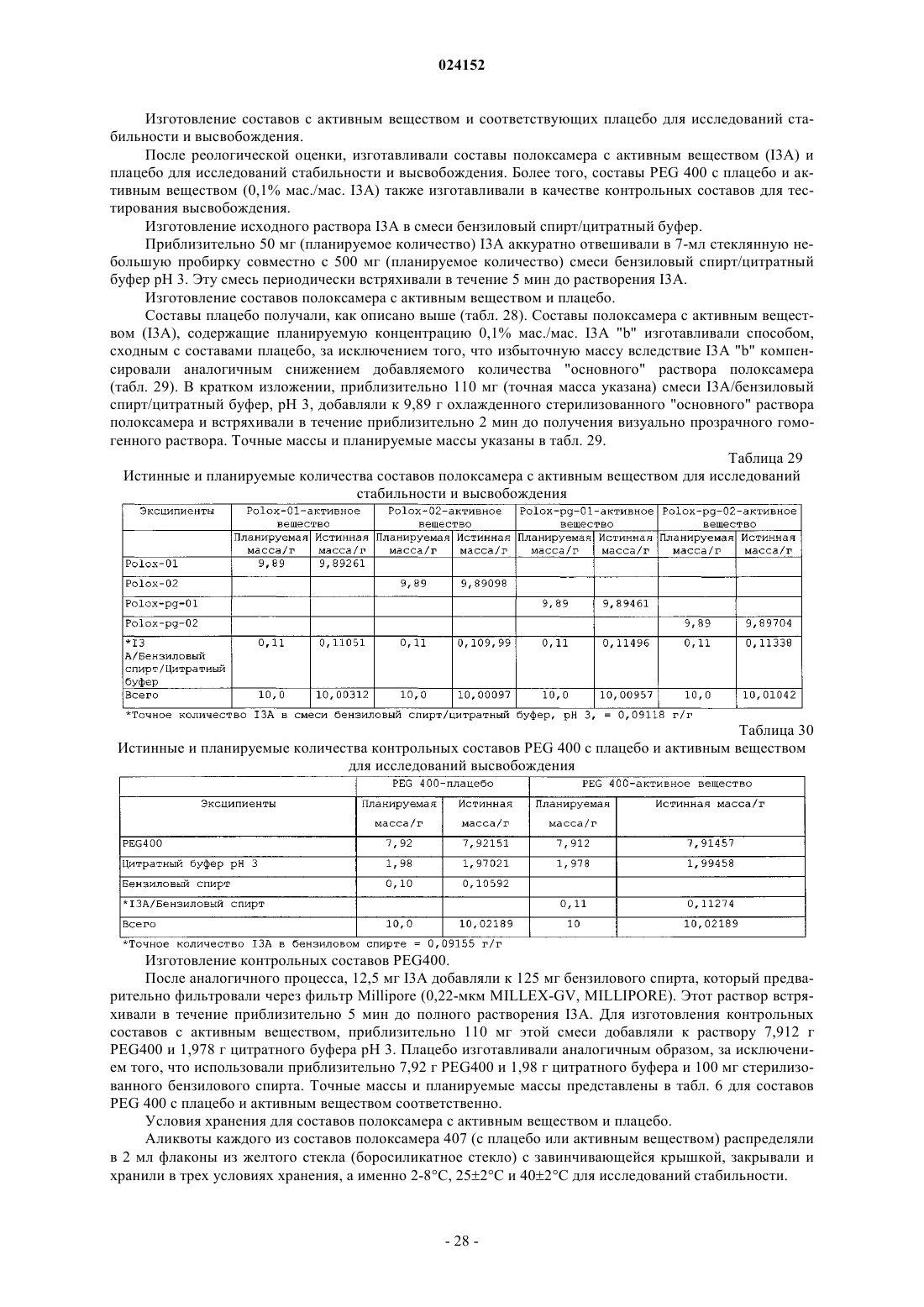
Текст
КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ВВЕДЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАКА КОЖИ Изобретение относится к композиции для местного введения для лечения или предотвращения рака кожи, содержащей а) 3-ангелат ингенола; b) усиливающее проникновение вещество; с) консервант;d) гелеобразующее вещество; е) буфер; при этом композиция имеет кажущееся значение рН от 3 до 4 включительно. Настоящее изобретение предоставляет стабильный состав ангелата ингенола для местного применения. Браун Марк Барри, Кродерз Майкл Эдвард Дональд, Назир Тахир (GB) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЛЕО ЛЭБОРЕТЕРИЗ ЛИМИТЕД (IE) Настоящее изобретение относится к композициям соединений, получаемых из видов Euphorbia и пригодных для лечения или предотвращения злокачественных опухолей кожи. Соединение ангелата ингенола можно выделять из различных видов Euphorbia, в частности из Euphorbia peplus и Euphorbia drummondii. Ангелат ингенола существует в трех изоформах: ингенол-3 ангелат (изоформа "b"), ингенол-5-ангелат (изоформа "а") и ингенол-20-ангелат (изоформа "с"). Первую из этих изоформ также обозначают в настоящем документе как I3A и она имеет следующую структуру: Было выявлено, что ангелат ингенола является высокотоксичным для клеток рака кожи вследствие быстрого разрушения митохондрий и гибели клеток посредством первичного некроза, при этом здоровые клетки остаются неповрежденными. В US-A-6432452 описаны соединения, находящиеся в действующем веществе, полученном из растений видов Euphorbia peplus, Euphorbia hirta и Euphorbia drummondii, которые показывают селективную цитотоксичность против нескольких злокачественных клеточных линий. Соединения пригодны для эффективного лечения злокачественных опухолей, в частности злокачественных меланом и плоскоклеточного рака (SCC). Соединения выбраны из ятрофанов, пеплуанов, паралианов и ингенанов. Предпочтительным соединением является ангеноилзамещенный ингенан, получаемый из сока Euphorbia peplus. Микрограммовые количества ангелата ингенола, как правило, являются терапевтически эффективными. Однако тенденция к перестройке изоформы "b" в изоформу "а", а затем в изоформу "с" является проблемой в составе, где является желательным ограничение состава либо до конкретной изоформы,либо до соотношения изоформ. В частности, это является проблемой для I3A, поскольку различные изоформы обладают различной растворимостью. Существует необходимость в эффективном способе местного лечения рака кожи, поскольку системное лечение, вовлекающее другие лекарственные средства, неизбежно приводит к воздействию на чувствительные здоровые клетки в частях организма, не являющихся мишенью для цитотоксических химических веществ. Кроме того, системные лекарственные средства против злокачественной опухоли,вводимые как перорально, так и посредством инъекции, являются менее приемлемыми для пациентов. Существует необходимость в предоставлении стабильного состава ангелата ингенола, предпочтительно для местного введения. В первом аспекте настоящее изобретение предоставляет композицию для местного введения для лечения или профилактики рака кожи, содержащая а) 3-ангелат ингенола; b) усиливающее проникновение вещество; с) консервант; d) гелеобразующее вещество; е) буфер; при этом композиция имеет кажущееся значение рН от 3 до 4 включительно. Неожиданно в ходе данной работы было выявлено, что растворимость ангелата ингенола можно повышать по существу без преобразования между изоформами в приемлемом апротонном растворителе в присутствии приемлемого смешивающегося кислого буфера. Настоящее описание относится к составу ангелата ингенола для применения в целях лечения, где ангелат ингенола растворен в фармацевтически приемлемом апротонном растворителе, при этом указанный состав дополнительно содержит фармацевтически приемлемый подкислитель, который, по меньшей мере частично, совместим с растворителем и который обеспечивает в составе кажущееся значение рН не более 4,5. Настоящее описание относится к составам любой из изоформ ангелата ингенола, или их смесей. В настоящее время, предпочтительной изоформой является изоформа "b", также обозначаемая в настоящем описании как I3A. Будет понятно, что указание на "ангелат ингенола" и "I3A" включает указание на другие изоформы и их смеси, если не является очевидным иное. Ангелат ингенола можно растворять во многих растворителях, и различные растворители проиллюстрированы в прилагаемом примере 1. Однако ангелат ингенола, главным образом, имеет предрасположенность к преобразованию в протонных растворителях, и любая существенная степень преобразования,как правило, более 1% для полученных из растений продуктов, однако более предпочтительно приблизительно 0,5%, является нежелательной в фармацевтическом составе. В апротонных растворителях, которые, главным образом, представляют собой растворители, которые не обеспечивают протоны в растворе, такие как полиэтиленгликоль, растворение может занимать некоторый существенный период времени и это, совместно с требуемыми температурами, также может приводить к преобразованию на уровне выше приемлемых уровней. Вещества, такие как ацетон и ацетонитрил, способны растворять I3A, однако они, как правило, не являются фармацевтически приемлемыми, и могут быть не пригодными для длительного хранения. Более приемлемыми могут быть вещества, такие как метилэтилкетон, этилацетат или диэтиловый эфир,однако, главным образом, наиболее предпочтительным является бензиловый спирт. Множество веществ пригодно для растворения I3A, однако без гарантии стабильности, и, как правило, неприемлемые уровни преобразования можно наблюдать после периодов времени в диапазоне между от 12 ч и до 6 месяцев или года. В отсутствии воды или другого протонного растворителя измеримого значения рН не будет. В таких условиях, и особенно при повышенных температурах, вероятным является преобразование. Таким образом, было выявлено, что обычно является возможным ингибирование преобразования посредством наличия пригодной кислоты. Пригодные кислоты, как правило, представляют собой органические кислоты, поскольку было выявлено, что I3A может разрушаться при рН значительно ниже 3, в то время как преобразование, вероятно, может происходить при более высоком значении рН, составляющем приблизительно 4,5. Когда предполагается хранение состава в течение периодов времени любой длительности, таких как месяц или более, является предпочтительным, чтобы кислота находилась в форме буфера. Пригодные буферы включают цитратный буфер, фосфатный буфер, ацетатный буфер и цитратно-фосфатный буфер, хотя другие буферы будут очевидны специалистам в данной области. В частности, является предпочтительным, чтобы буфер обеспечивал кажущееся значение рН в составе не более 4,5 и не менее 2,5. рН состава менее 4 является более предпочтительным и особенно предпочтительным является, чтобы кажущееся значение рН в составе составляло 3,8 или менее, предпочтительно приблизительно 3,5 или менее. Пригодным является кажущееся значение рН приблизительно 3. Было выявлено, что буфер с рН 2,75 является особенно предпочтительным, обеспечивая кажущееся значение рН приблизительно рН 3,5 в конечном составе,когда его используют в количествах, как проиллюстрировано в прилагаемых примерах. Предпочтительный диапазон рН буфера находится между 2,6 и 2,85, предпочтительно рН 2,7-рН 2,8, и буфер предпочтительно представляет собой цитратный буфер. Будет понятно, что кислота, главным образом, будет находиться в форме водного раствора, предпочтительно в деионизированной воде, если нет иных указаний. Предпочтительным является цитратный буфер. Когда используют ацетатный буфер, он, как правило,может обладать диапазоном рН от 3,5 до 5,5, в то время как цитрат-фосфатный буфер, как правило, может обладать диапазоном рН от 2,75 до 7,0. Будет понятно, что раствор, в котором растворитель является апротонным, не может обладать рН,поскольку это значение представляет собой показатель ионов Н+. Однако когда такой раствор является,по меньшей мере частично, смешивающимся с кислотой или кислым буфером, и он представлен в таком виде, тогда попытки измерить рН приведут к результату. Составы по этому изобретению изготовлены в качестве форм для местного введения, и, главным образом, их большую часть будут составлять буфер или ионный раствор, однако они всегда будут содержать апротонный растворитель, так что можно измерить только кажущееся, а не абсолютное значение рН, поскольку измеренное значение рН относится только к ионному компоненту. Пригодные способы измерения кажущегося значения рН представляют собой способы с помощью рН-метра Jenway 3320. Таким образом, результат может не обладать значением, в норме приписываемым ионному раствору,особенно где количество кислоты или буфера является небольшим, но значение состоит в том, что, поскольку имеется какое-либо ионное окружение, окружение является кислым. По мере повышения количества кислоты, кажущееся значение рН становится более эквивалентным значению рН. Без связи с какой-либо конкретной теорией, вероятно, что ангелат ингенола, главным образом, растворяется в апротонном растворителе, поскольку он обладает очень низкой растворимостью в воде. Последующее добавление раствора ангелата ингенола в растворителе к подкисленному ионному раствору дает возможность получения пригодного, необязательно водного, ионного раствора ангелата ингенола, избегая посредством этого растворения ангелата ингенола непосредственно в протонном растворителе, при котором повидимому происходит наибольший уровень преобразования. Таким образом, контакт с протонным растворителем может непосредственно приводить к образованию других изоформ, однако это можно минимизировать, если добавить небольшое количество кислоты или кислого буфера, и эти термины используют синонимично в настоящем документе, если не является очевидным иное. Даже действие растворения в протонных растворителях, с учетом необходимой длительности и условий, может приводить к нежелательно высоким уровням образования изоформ, а именно к предрасположенности ангелата ингенола к преобразованию. Апротонный растворитель и кислота являются, по меньшей мере частично, совместимыми в том,что из этих двух компонентов может образовываться стабильный препарат. Кислота и растворитель предпочтительно являются смешивающимися, и предпочтительно они являются смешивающимися во всех соотношениях. В частности, в основном является предпочтительным добавление небольшого количества буфера в растворитель в процессе растворения ангелата ингенола, или сразу после этого, в целях поддержания кажущегося значения рН на относительно низком уровне. Затем может быть желательным получение растворенного ангелата ингенола в избытке буфера, который использовали в ходе первоначального растворения. Стабильные препараты, изготовленные с избытком буфера, проиллюстрированы ниже в примере 9. Будет понятно, что предпочтительно, чтобы кислота и растворитель были достаточно смешивающимися для возможности образования одной фазы, хотя несмешивающиеся или менее смешивающиеся растворители и кислоты могут быть получены в форме эмульсий или микроэмульсий. Такие эмульсии могут быть стабильными, хотя обеспечение смеси растворителя и кислоты в виде одной фазы, как правило, дополнительно минимизирует какой-либо риск преобразования ангелата. Растворители, которые являются особенно пригодными, представляют собой растворители, которые проявляют как гидрофильные, так и липофильные свойства, такие как кольцевые системы, которые предпочтительно являются гомоциклическими и которые имеют на них гидроксигруппы, замещенные,но отделенные от кольцевой структуры по меньшей мере одним атомом углерода. Особенно предпочтительным примером такого растворителя является бензиловый спирт. Несмотря на то что можно вместо буфера можно использовать кислоту, для минимизации колебаний значения рН, главным образом, является предпочтительным применение кислого буфера. По существу, будет понятно, что, как правило, когда в настоящем документе будет использоваться термин "буфер", этот термин также включает кислоты и препараты кислот, когда это целесообразно. Особенно предпочтительным буфером является цитратный буфер, рН 3 или менее, предпочтительно рН 2,75. В бензиловом спирте, количество 2,5% мас./мас. цитратного буфера с рН 2,5 будет, главным образом, приводить к не поддающемуся измерению кажущемуся значению рН, однако, при более высоких количествах, оно приводит к рН приблизительно рН 3. Взаимосвязь между рН буфера и кажущимся значением рН рассмотрена в прилагаемых примерах. В случае низких количеств буфера при растворении I3A в растворителе является предпочтительным просто поддержание кислого окружения, и свойства предпочтительного буфера на этих уровнях являются сходными со свойствами предпочтительного буфера при последующем разбавлении состава для применения. Главным образом, перед добавлением I3A является предпочтительным подкисление растворителя, предпочтительно бензилового спирта, количеством кислого буфера, предпочтительно между 1 и 10% по массе, более предпочтительно между 2 и 5%. Несмотря на то что состав не нужно разбавлять для применения, обычно I3A является сильнодействующим веществом, и можно изготавливать исходные растворы I3A в растворителе, предпочтительно в бензиловом спирте, для хранения, предпочтительно при 8 С или менее. Затем, если желательно, при изготовлении любого конечного состава или препарата такие исходные растворы можно разбавлять, предпочтительно буфером. Используемое количество буфера при растворении ангелата ингенола может варьировать между приблизительно 0 и 100%. Когда количество составляет 0, предпочтительным является добавление количества буфера сразу после добавления ангелата ингенола в растворитель, в целях минимизации вероятности того, что произойдет какое-либо преобразование. Как правило, предпочтительным является избегание применения количеств буфера, превышающих 100% по массе растворителя, поскольку растворение непосредственно в буфере, как правило, не является легко достижимым. Предпочтительным является использование буфера в качестве средства для поддержания кажущегося значения рН растворителя на низком уровне, без добавления какого-либо существенного количества протонного растворителя в процессе растворения ангелата ингенола. После растворения по существу ангелата ингенола, возможно, и даже желательно, изготовление состава с избытком буфера, содержащего, если желательно, другие необязательно протонные компоненты, например, такие как антибиотики. Предпочтительные уровни буфера находятся в диапазоне 0,5-10%, и предпочтительно между 1 и 5%, при этом приблизительно 2-3% являются наиболее предпочтительными в процессе фазы растворения. Фаза растворения включает растворение по меньшей мере большей части ангелата ингенола в растворителе, предпочтительно по меньшей мере 95% мас./мас. ангелата ингенола в растворителе, более предпочтительно по меньшей мере 99% мас./мас. Составы по настоящему изобретению можно использовать сразу или их можно хранить для последующего применения. Кроме того, составы по настоящему изобретению могут представлять собой основной состав, который можно далее модифицировать перед применением. Например, как описано выше, состав можно изготавливать в избытке буфера. Также было выявлено, что составы по настоящему изобретению, как правило, являются более стабильными при более низких температурах. Особенно предпочтительные составы по настоящему изобретению, такие как составы, содержащие бензиловый спирт и цитратный буфер, могут проявлять значительную стабильность при температурах менее 40 С, однако, как правило, повышение стабильности наблюдают при температурах ниже комнатной температуры и давления (RTP), и наибольшую стабильность наблюдают при температурах ниже приблизительно 8 С. Замораживание, по-видимому, не повышает стабильность, так что более высокой стабильности достигают просто помещением составов по этому изобретению в обычный холодильник при температуре между приблизительно 2 и 8 С. Кроме того, настоящее описание относится к способу получения раствора ангелата ингенола, включающему растворение ангелата ингенола в фармацевтически приемлемом апротонном растворителе, при этом указанный состав дополнительно содержит фармацевтически приемлемый подкислитель, который является, по меньшей мере частично, совместимым с растворителем и который приводит к составу с кажущимся значением рН не более 4,5, где указанную кислоту добавляют одновременно с ангелатом ингенола, до или после него. Альтернативно, настоящее описание относится к способу получения раствора ангелата ингенола,включающему растворение ангелата ингенола в фармацевтически приемлемом апротонном растворителе, при этом указанный способ включает добавление фармацевтически приемлемого подкислителя, который является, по меньшей мере частично, совместимым с растворителем и который приводит к составу с кажущимся значением 4,5, где указанный подкислитель добавляют одновременно с ангелатом ингенола, до или после него. Подкислитель предпочтительно представляет собой буфер. Для обеспечения преобразования изоформы "b" в изоформу "а" не более приблизительно 1%, предпочтительно не более приблизительно 0,5%, предпочтительным является добавление кислоты или буфера достаточно быстро после добавления I3A. Предпочтительно кислоту или буфер добавляют в растворитель перед добавлением I3A, хотя все три ингредиента можно комбинировать одновременно. Этот последний вариант является наименее предпочтительным вариантом. Также этот способ можно использовать для получения составов ангелата ингенола с использованием других соединений и растворителей, таких как полиэтиленгликоль, где прямое растворение может быть ассоциировано с неприемлемым уровнем преобразования. Хотя I3A может растворяться в PEG, это занимает приблизительно 1 ч при повышенной температуре, что, как правило, приводит к образованию неприемлемых уровней изоформы "а". Если I3A сначала растворяют в забуференном бензиловом спирте,то затем его можно добавлять непосредственно к PEG без длительного воздействия нагревания. Поскольку только достаточное количество бензилового спирта требуется для растворения I3A, то общее количество бензилового спирта в конечном составе PEG должно составлять только приблизительно 1% мас./мас. или менее. Эти составы можно хранить в течение длительных периодов времени, особенно если их держать при температурах 8 С или ниже. В предпочтительных композициях через 3 месяца, более предпочтительно через 6 месяцев выявляют не более приблизительно 1%, предпочтительно не более приблизительно 0,5% преобразования изоформы "b" в изоформу "а". Кроме того, описанием предусмотрено применение состава по этому изобретению для лечения рака кожи. Также это описание относится к применению ангелата ингенола для изготовления лекарственного средства для лечения или профилактики рака кожи, где ангелат ингенола растворен в фармацевтически приемлемом апротонном растворителе, при этом указанный состав дополнительно содержит фармацевтически приемлемый подкислитель, который, по меньшей мере частично, совместим с растворителем и который приводит к составу с кажущимся значением рН не более 4,5. Пригодные злокачественные опухоли для лечения в соответствии с настоящим изобретением включают плоскоклеточный рак и рак из базальных клеток. Будет понятно, что "лечение", как используют в настоящем документе, включает как терапию, так и профилактику. Также настоящее описание относится к способу лечения субъекта, страдающего злокачественным состоянием кожи, включающему местное применение терапевтически эффективного количества композиции, раскрытой в данном документе, в области злокачественного состояния. Пригодными для лечения субъектами являются млекопитающие, включая человека, приматов, домашний скот (включая коров, лошадей, овец, свиней и коз), животных-компаньонов (включая собак, кошек, кроликов, морских свинок), находящихся в неволе диких животных и лабораторных животных, таких как кролики, мыши, крысы, морские свинки и хомяки. Композиции по настоящему изобретению являются особенно пригодными для лечения рака кожи человека. Будет понятно, что составы по настоящему описанию можно применять для профилактики или лечения любого пригодного рака. Формы для введения могут представлять собой любые пригодные формы и они включают кремы, гели, мази, лосьоны, аэрозоли, лаки и наносимые кисточкой лекарственные средства для местного применения, порошки, растворы и суспензии для дыхательных путей, растворы и эмульсии для инъекции, капсулы, сиропы и эликсиры для перорального введения, и пессарии и суппозитории. Другие пригодные формы для введения будут хорошо понятны специалистам в данной области, и они могут включать, например, чрескожные пластыри. Составы ангелата ингенола по настоящему изобретению изготавливают для местного введения. Во всех случаях, первоначальный состав является таким, как состав по этому изобретению. Состав можно превращать в конечную форму непосредственно перед применением, как только это становится желательным, после изготовления состава, однако, как правило, состав будет оставаться составом по этому изобретению все время. Составы могут содержать дополнительные ингредиенты, как рассмотрено ниже. Особенно предпочтительным является использование антиоксидантов, поскольку они участвуют в обеспечении повы-4 024152 шенной стабильности в составах. Пригодные примеры антиоксидантов включают ретинол, аскорбиновую кислоту, ликопен, бутилированный гидрокситолуол и токоферол. Количество ангелата ингенола, требуемое для фармацевтической эффективности, будет очевидно специалистам в данной области, и его можно адаптировать в соответствии с физиологическими параметрами, такими как возраст, масса и пол пациента, а также размер какого-либо повреждения. Как правило,можно применять количество ангелата ингенола, пригодное для обеспечения между приблизительно 0,01 мкгсм-2 до приблизительно 1 мгсм-2, при этом диапазон от 0,1 мгсм-2 до приблизительно 100 мкгсм-2 является более предпочтительным. В прилагаемых примерах использовали состав, обеспечивающий 15 мкгсм-2, однако было выявлено, что составы 1 мкгсм-2 или менее являются более эффективными. В альтернативном случае, составы по этому изобретению могут содержать I3A в количестве от 0,001 до 0,15% мас./мас., более предпочтительно вплоть до приблизительно 0,1-0,12% мас./мас. Композиции по настоящему изобретению представляют собой местные составы. В этом отношении,ранее не известное свойство ангелатов ингенола является особенно пригодным, поскольку было выявлено, что они обладают сосудосуживающими свойствами. Таким образом, системное распределение активного ингредиента минимизируют, вследствие сниженного кровотока вблизи области лечения. Будет понятно, что свойства состава будут определять скорость проникновения через кожу. По существу, главным образом, предпочтительно, чтобы состав был получен таким образом, чтобы обеспечивалась скорость проникновения по меньшей мере приблизительно 11 нгсм-2 ч-1. Не существует конкретного верхнего предела, хотя, главным образом, предпочтительно, чтобы он не превышал приблизительно 1 мкгсм-2 ч-1. Местные составы могут обладать пригодной формой. Как правило, является предпочтительным,чтобы они обладали некоторым уровнем вязкости для того, чтобы их можно было нацеливать на требуемую область без стекания. Таким образом, особенно предпочтительным является изготовление ангелата ингенола в качестве кремов, гелей, мазей и лекарственных средств в вязком носителе. С учетом эффективности ангелата ингенола, можно использовать лекарственные средства в вязком носителе, поскольку их можно применять экономно, в зависимости от уровней активного ингредиента. В предпочтительных составах по настоящему изобретению можно использовать полоксамеры. Они представляют собой сополимеры, которые состоят из гидрофобной молекулы полоксипропилена (POP),расположенной посередине между двумя гидрофильными молекулами полоксиэтилена (РОЕ). Таким образом, они обладают способностью растворять липофильные лекарственные средства в гидрофобной основе. Более того, водные гелевые составы на основе полоксамеров проявляют термореологические свойства, которые могут быть преимущественными для локализованной длительной доставки лекарственных средств. Выше определенной температуры, известной как критическая мицеллярная температура(cmt), вязкость полоксамерного геля резко повышается. Повышение вязкости приводит к снижению диффузии любых лекарственных средств, растворенных в геле, что замедляет высвобождение лекарственного средства из геля и приводит к замедленной доставке. Повышение вязкости также может обеспечивать длительное локализованное "депо" в той же области действия.Cmt зависит от ряда переменных, таких как концентрация полоксамера и других добавок, таких как пропиленгликоль. В идеальном случае, cmt должна представлять собой температуру, при которой состав можно инъецировать в область повреждения в качестве жидкости (простота введения) и при контакте с температурой тела образуется гель с целью достижения локализованной замедленной доставки лекарственного средства. В USP приведено пять полоксамеров, и они включают полоксамер 188 и полоксамер 407. Полоксамер 188 был одобрен в качестве эксципиента для внутривенных составов(http://www.accessdata.fda.gov). Полоксамерные гели использовали для подкожной доставки инсулина (Barichello et al., 1999) и других систем для доставки лекарственного средства для подкожного применения (Tobiyama et al., 1994). Один конкретный сополимер, полоксамер 407, вводили подкожно для медленного высвобождения пептидов и терапевтических белков, которые включали интерлейкин-2 и гормон роста человека (Morikawa etal., 1987; Katakama et al., 1997). После введения гели медленно высвобождали заключенные в него молекулы белка в течение 1-2 суток. Более того, существенная часть этого полоксамера в конце концов подвергалась экскреции почками. Полоксамеры, как правило, считаются нетоксичными и не вызывающими раздражения материалами. Исследования токсичности на животных с использованием собак и кроликов показали, что полоксамеры являются не вызывающими раздражения и несенсибилизирующими при применении в концентрации 5% мас./об. и 10% мас./об. в глазах, деснах и коже. В 14-суточном исследовании внутривенного введения кроликам в концентрациях вплоть до 0,5 г/кг/суток, не было отмечено выраженных неблагоприятных эффектов. Сходное исследование с собаками также показало отсутствие неблагоприятных эффектов при уровнях дозирования вплоть до 0,5 г/кг/сутки. Более того, не было выявлено гемолиза кровяных клеток человека в течение 18 часов при 25 С для 0,001-10% мас./об. растворов полоксамера (Wade andWeller, 1994). Однако была описана гиперлипидемия у крыс при введении внутрибрюшинной (IP) инъекции (1,0 г/кг) полоксамера 407 (Wasan et al., 2003). В настоящем изобретении также можно использовать масла. Применение состава на основе эмульсии внутри повреждения описано для лечения псориаза (Но et al., 1990). Перед введением носитель, такой как полиоксиэтилированное касторовое масло, обычно разбавляют физиологическим раствором с образованием эмульсии. Однако исследования авторов настоящего изобретения показали, что разбавление I3A нормальным физиологическим раствором повышает превращение изоформы "b" в "а". Это превращение можно минимизировать, если время введения состава является коротким. Существует множество липофильных продуктов, которые изготавливают в качестве масляных растворов для внутримышечного введения (IM), например проликсина энантат (Bristol Myers Squibb). Используемый носитель (масло) широко варьирует среди растительных масел, таких как арахисовое масло(используемое с бензилбензоатом в димеркапроле для инъекций В.Р.) и кунжутное масло (используемое в инъекции замедленного всасывания флуфеназина энантата для инъекций В.Р). Применение масляных носителей может замедлять всасывание вследствие замедленного высвобождения лекарственного средства из масла в водные жидкости организма (Ford, 1987). При инъекции в водную среду (такую как мышечная ткань) относительно липофильное лекарственное средство, такое как I3A, растворенное в масляной фазе, будет иметь тенденцию не выходить из масла и не высвобождаться "мгновенно" в водную фазу. Таким образом, может быть достигнут эффект замедленного высвобождения. Также можно использовать буккальные составы. Доставка лекарственных средств через слизистую оболочку представляет собой распространенную форму введения, поскольку слизистые мембраны являются относительно проницаемыми, что дает возможность быстрого захвата лекарственного средства в системный кровоток и избежания пресистемного метаболизма. Продукты для доставки через слизистую оболочку можно разрабатывать для введения назальным способом и оральным/буккальным способом с использованием мукоадгезивных веществ. При разработке этих систем для доставки лекарственных средств, адгезия к слизистой оболочке устройства/состава является ключевым элементом. Термин "мукоадгезивный" обычно используют для материалов, которые обладают адгезией к муциновому слою биологической мембраны. В попытках достигнуть системной и локализованной доставки лекарственных средств через различные слизистые оболочки мукоадгезивные полимеры использовали во множестве различных дозированных форм. Эти дозированные формы включают таблетки, пластыри, ленты, пленки,полутвердые вещества и порошки. Для того чтобы выступать в качестве мукоадгезивных полимеров, полимеры должны обладать физико-химическими свойствами, такими как анионные свойства с наличием множества групп, образующих водородные связи, пригодные поверхностные свойства для смачивания поверхности слизистой оболочки/слизистой ткани и достаточная гибкость и длина (молекулярная масса) для проникновения через слизистую сеть или щели в ткани. В качестве потенциальных мукоадгезивных веществ были описаны различные классы полимеров, такие как карбомеры (полиакриловая кислота), гидроксипропилметилцеллюлоза (НРМС), а также встречающиеся в природе полимеры, такие как гиалуроновая кислота и хитозан. Получение пригодных составов относится к пределам квалификации специалистов в данной области, и пригодные эксципиенты для включения в любой такой состав включают, например, гелеобразующие вещества, загустители, усиливающие проникновение вещества, консерванты, такие как антибиотики и противогрибковые вещества, и косметические ингредиенты, такие как ароматизаторы и красители. Пригодные гелеобразующие вещества включают растворимые в воде полимеры, образованные из целлюлозы, такие как полимеры гидроксиалкилцеллюлозы (например, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза), карбоксиметилцеллюлоза, метилгидроксиэтилцеллюлоза и метилцеллюлоза, карбомер (например карбопол); и каррагенаны. Образующее гель вещество можно добавлять в любом пригодном количестве, таком как 1-5% мас./мас. Предпочтительными гелеобразующими веществами являются образованные из целлюлозы вещества, наиболее предпочтительно гидроксиалкилцеллюлоза, в частности гидроксиэтилцеллюлоза. Пригодные консерванты будут очевидны специалисту в данной области, и они включают парабены(метил, этил, пропил и бутил), бензойную кислоту и бензиловый спирт. Консерванты, используемые исключительно для этой цели, будут, главным образом, составлять 1% мас./мас. или менее от конечного местного состава. Пригодные усиливающие проникновение вещества включают изопропиловый спирт, сульфоксиды(такие как диметилсульфоксид, DMSO), азоны (например, лаурокапрам), пирролидоны (например, 2 пирролидон), алканолы (например, деканол) и гликоли (например, пропиленгликоль). Композиции по этому изобретению включают:e) буфер,где композиция обладает кажущимся значением рН между 3 и 4 включительно. Особенно предпочтительная композиция включает следующее:e) 67,5% мас./мас. цитратный буфер, рН 3, предпочтительно рН 2,75. Далее это изобретение описано на основании прилагаемых фигур. Фиг. 1: представлено схематическое изображение ячейки Франца. Фиг. 2: процентная доля изоформы "b" в изопропаноловом геле (рН 6,5). Фиг. 3: процентная доля I3A "b" в 30% IPA/цитратном буфере (рН 3). Фиг. 4: процентная доля I3A "b" в 100% бензиловом спирте при 2-8 С, RTP и 40 С. Фиг. 5: процентная доля I3A "b" в 100% феноксиэтаноле при 2-8 С, RTP и 40 С. Фиг. 6: представлена блок-схема для получения 0,1% мас./мас. состава I3A 16 и соответствующего плацебо ( для состава плацебо к 24,75 г основного состава добавляли 0,25 г бензилового спирта). Фиг. 7: относительные величины G' и G" для составов 4, 14, 15, 16 и 17 (n=5SD). Фиг. 8: соответствующие значения tan d для составов 4, 14, 15, 16 и 17. Фиг. 9: график среднего количества I3A "b", высвобожденного после 26 ч (мкг/см 2) из 0,1% мас./мас. составов из геля на основе полоксамера и PEG 400, (n=3SE). Фиг. 10: График среднего количества I3A "b", высвобожденного через 26 ч (мкг/см 2) из 0,1% мас./мас. составов из масла и PEG 400, (n=3SE). Настоящее изобретение далее будет проиллюстрировано с помощью следующих неограничивающих примеров. Пример 1. Стабильность I3A исследовали в различных системах растворителей, включая ацетон, ацетонитрил,метанол/воду, воду, DMSO, фосфатные буферы (диапазон рН от 4,5 до 7) и аммонийный буфер (рН 4,5),и было показано, что он является стабильным в ацетоне, ацетонитриле, DMSO, фосфатном буфере, рН 4,5, и аммонийном буфере (рН 4,5). Преобразование ангелата ингенола, как оказалось, происходило в порядке преобразования изомера "b" в изомер "а", а затем в изомер "с". Вследствие небольших количеств используемого активного вещества, показатель стабильности соединения вычисляли в качестве соотношения площади пика "b" к площади пика "а". Материалы. Таблица 1 Поставщики материалов, используемых в этом примере Все используемые в конечном составе I3A эксципиенты были нормативного класса. Способы. Исследование стабильности I3A в растворителях/эксципиентах. Исследование стабильности I3A в следующих сочетаниях растворитель/эксципиенты/эксципиент проводили в течение 14 суток (за исключением того, когда указано иное) при комнатной температуре: Ацетон; Ацетонитрил; Метанол; Метанол/вода (70/30); Вода; Фосфатный буфер рН 4,5, рН 5,5, рН 6,5, рН 7,0;-циклодекстрина сульфобутиловый эфир (Captisol)/PO4, рН 4,5; Гиалуронат натрия (НА)/РО 4 рН 4,5; Гиалуронат натрия (НА)/Н 2 О рН 4,5;исследование в течение 10 суток;исследование в течение 7 суток;исследование в течение 2 суток. Получали исходный раствор 0,5 мг/мл I3A в ацетонитриле. Аликвоты по 1,0 мл переносили в отдельные стеклянные пробирки с помощью бюретки; растворы сушили струей воздуха, а затем в пробирки добавляли 1,0 г соответствующего сочетания растворитель/эксципиент/эксципиент. На 0 сутки, 5 сутки и 14 сутки аликвоты образцов для исследования стабильности удаляли для анализа посредством ВЭЖХ с использованием условий хроматографии, описанных в разделе "Стабильность в DMSO", ниже. Стабильность выражали в качестве соотношения пика "b" к пику "а" (и пику "с" при его наличии), при этом высокое соотношение указывает на стабильность в конкретном эксципиенте. Анализ ВЭЖХ для исследования стабильности I3A в эксципиентах. Дополнительный способ ВЭЖХ проводили в целях разделения "выступа", появившегося на пике"b", который был выявлен в некоторых препаратах I3A. Хроматографические условия, используемые для исследования стабильности в эксципиентах, были следующими: Колонка: Hypercarb (ThermoQuest, Phenomenex) (S/no. 3-34070); Длина колонки: 1004,60 мм; Температура колонки: 25 С; Защитная колонка: С 18 Columbus (Phenomenex) (S/no. 202678); Длина защитной колонки: 504,60 мм; Подвижная фаза: 50% об./об. фосфатный буфер рН 4,5/50% об./об. ацетонитрил; Скорость потока: 1,0 мл/мин; Длина УФ-волны: 230 нм; Объем инъекции: 10 мкл; Время пробега: 35 мин. Предварительное исследование диффузии in vitro. После установления стабильности I3A в эксципиентах и усиливающих проникновение веществах можно было проводить предварительный эксперимент по диффузии in vitro в целях определения проникновения I3A из некоторых простых составов через ороговевающий слой. Диффузор Франца был сконструирован для имитации физиологических и анатомических условий в коже in situ. Он представляет собой статическую ячейку с воздушной/жидкой фазой, которая содержит донорный отдел, приемный отдел и отверстие для забора образцов бокового рукава (см. фиг. 1). Хирургически вырезанную кожу помещают между двумя половинами, при этом ороговевающий слой расположен в сторону донорного отдела для обеспечения нанесения лекарственного средства. Проводили первоначальный эксперимент по диффузии in vitro с использованием простого составаI3A в миглиоле. Прохождения лекарственного средства через ороговевающий слой не было совсем, подтверждая, что термодинамическая активность I3A, полученная в миглиоле, не была максимальной. Этот состав использовали в более поздних экспериментах в диффузоре в качестве отрицательного контроля, а также он служил для подтверждения целостности ороговевающего слоя, поскольку если не происходит диффузии лекарственного средства из этого состава, то можно предположить, что ороговевающий слой остается неповрежденным. Изготовление составов. Состав I3A получали в фосфатном буфере (рН 4,5) с добавлением -циклодекстринов (Captisol) с целью повышения растворимости и стабильности I3A и проникновения лекарственного средства. Второй состав в DMSO, известном усиливающем проникновение веществе, также получали для целей сравнения,а также получали состав в миглиоле, который служил в качестве отрицательного контроля. Исследовали диффузию I3A через ороговевающий слой из этих составов. Получали следующие составы: В табл. 2 представлены % мас./мас. каждого из ингредиентов, находящихся в составах. Ингредиенты аккуратно взвешивали в герметизируемые стеклянные пробирки и сильно перемешивали с помощью магнитной мешалки в течение нескольких часов при комнатной температуре. Таблица 2 Состав I3A для исследования диффузии in vitro Выбор жидкости приемника. 2-Гидроксипропилциклодекстрин (Cavasol, 1,38 мМ) в PO4-буфере (рН 4,5) представлял собой жидкость приемника, используемую в этом исследовании в целях попытки поддержания условий погружения. Другие резервуарные жидкости, такие как системы этанол/вода были ограничены вследствие того, что "обратная диффузия" этанола через ороговевающий слой может привести к деградации I3A, находящегося в составах. Препарат кожи. Свежий хирургически вырезанный образец кожи человека получали сразу после абдоминопластики. Донором была 5 6-летняя некурящая женщина европиоидной расы. Подкожный жир осторожно извлекали из образца кожи с использованием пинцета и скальпеля, а затем часть кожи погружали в воду при 60 С в течение 45 с. Затем кожу прикрепляли дермой вниз на пробковую доску и эпидермис (содержащий ороговевающий слой и живой эпидермис) осторожно удаляли из подлежащей дермы. Дерму удаляли и эпидермальную мембрану помещали на поверхность воды и отбирали на фильтровальную ватманскую бумагу no. 1. Полученный эпидермальный пласт тщательно сушили и хранили в горизонтально в алюминевой фольге при -20 С до применения. Срез эпидермального пласта (стороной фильтровальной бумаги вверх) фиксировали и инкубировали в течение 4 ч при 4 С, погруженным в 0,1% мас./об. раствор трипсина. Затем кожу далее инкубировали в течение 1 ч при 37 С. Ороговевающий слой физически удаляли осторожным встряхиванием зажима латеральными движениями. Полученный ороговевающий слой промывали два раза деионизированной водой, а затем 0,1% мас./об. антитрипсиновым раствором для блокирования активности фермента, а затем промывали два раза деионизированной водой. Ороговевающий слой сушили и хранили горизонтально в алюминиевой фольге при -20 С до применения. Исследование диффузии в ячейке Франца. Для проведения экспериментов по диффузии использовали индивидуально калиброванные диффузоры Франца со средней площадью диффузионной поверхности 0,560,05 см 2 и средним объемом приемника 1,790,06 мл. Ороговевающий слой (полученный как описано выше) промывали фосфатным бу-9 024152 фером (рН 4,5), разрезали с помощью 10"-бора и помещали в ячейки Франца (иллюстрированные на фиг. 1). Используемая жидкость приемника представляла собой 2-гидроксипропилциклодекстрин(Cavasol)/фосфатный буфер (рН 4,5) и ее помещали в ячейку Франца, перемешивали постоянно магнитной мешалкой и поддерживали при 37 С. Перед нанесением составов, мембранам позволяли уравновеситься с фазой приемника в течение 30 мин. На поверхность мембраны наносили неопределенную дозу каждого состава с использованием нагнетателя объемного типа Finpipette, и донорные камеры защищали посредством Parafilm. Исследовали пять моментов времени забора образцов (1, 2, 4, 6 и 24 ч), при этом 200 мкл жидкости приемника осторожно забирали из рукава ячейки Франца; каждый извлеченный образец помещали в равный объем свежей (37 С) жидкости приемника. На протяжении эксперимента,любые потери жидкости приемника вследствие выпаривания из ячейки Франца замещали для поддержания постоянного объема. Образцы анализировали посредством ВЭЖХ (выше). Анализ ВЭЖХ для диффузионного исследования in vitro. Используемые хроматографические условия были следующими: Колонка: Hypercarb (ThermoQuest, Phenomenex) (S/no. 3-34070); Длина колонки: 1004,60 мм; Температура колонки: 25 С; Защитная колонка: С 18 Columbus (Phenomenex) (S/no. 202678); Длина защитной колонки: 504,60 мм; Подвижная фаза: 50% об./об. аммонийный буфер, рН 4,5/50% об./об. ацетонитрил; Скорость потока: 1,0 мл/мин; Длина УФ-волны: 230 нм; Объем инъекции: 10 мкл; Время пробега: 35 мин. Результаты. Стабильность I3A в растворителях и эксципиентах. В табл. 3 представлены показатели стабильности I3A в различных системах растворителей. Стабильность I3A в растворителях и эксципиентах через 14 суток (если нет иных указаний) при комнатной температуре количественно определяли в значениях соотношения изоформы "b" к изоформам "а" и "с",при этом преобладание "b" приравнивалось к стабильности. Обобщенные результаты представлены в табл. 3. Полагают, что для эксципиента, в котором I3A не является стабильным, другие подобные эксципиенты не будут пригодными. Таблица 3 Обобщенные результаты исследования стабильности I3A в различных растворителях и эксципиентах Предварительное исследование диффузии in vitro. В табл. 4 приведено сравнение прохождения между составами I3A, как определяют из общего количества проникающего I3A на единицу площади. DMSO представляет собой один из наиболее ранних и наиболее широко исследованных усиливающих проникновение веществ, и во многих экспериментах invitro и in vivo было показано, что он усиливает чрескожное проникновение многих лекарственных средств. По существу, DMSO представлял собой пригодный эксципиент сравнения для подтверждения проникновения через ороговевающий слой I3A. Однако с учетом высокотоксичных свойств этого растворителя и того факта, что он приводит к необратимому повреждению кожи, DMSO не будут использовать в конечном составе. Не было выявлено проникновения I3A в случае состава с миглиолом. Возможным объяснением этого отсутствия диффузии I3A из миглиола через ороговевающий слой является то,что I3A высокорастворим в этом эксципиенте. Таблица 4 Сравнение проникновения между составами I3A, как определяют исходя из общего количества проникающего I3A на единицу площади (среднее значениеs.e.m, n=3 и 4 соответственно) Результаты показывают, что I3A диффундирует через ороговевающий слой (который образует основной барьер для диффузии большинства лекарственных средств) на поддающихся детекции уровнях. Исследование стабильности при 4-8 С. Исследовали стабильность I3A в различных растворителях при 4-8 С. Исходный раствор 1,26 мгI3 А отвешивали и растворяли в 2 мл ацетона. Этот исходный раствор использовали для получения образцов для исследования стабильности следующим образом: Аликвоты по 100 мкл исходного раствора переносили в отдельные стеклянные пробирки для ВЭЖХ посредством шприца Hamilton, с осторожным промыванием и высушиванием шприца между образцами. Образцы высушивали потоком воздуха, а затем добавляли 0,5 мл соответствующей тестируемой системы растворителей. Системы растворителей тестировали по три образца и они перечислены ниже: 1) 100% об./об. ацетон; 2) 100% об./об. ацетонитрил; 3) 100% об./об. метанол; 4) 70% об./об. метанол: 30% мас./мас. вода; 5) 100% мас./мас. вода. Также получали пустые образцы в трех экземплярах с использованием 100 мкл ацетона вместо исходного раствора. Затем пустые образцы высушивали и в каждую пробирку добавляли 0,5 мл ацетона. Все пробирки обжимали, закрывали посредством parafilm и помещали при 4-8 С для исследования длительности стабильности. Анализ ВЭЖХ проводили в образцах на 0 сутки, 1 сутки, 5 сутки и 14 сутки исследования стабильности. Образцы для анализа ВЭЖХ получали, как описано ниже: Образцы для исследования стабильности извлекали из 4-8 С и оставляли при температуре окружающей среды в течение 30 мин. Аликвоты по 100 мкл переносили в свежие стеклянные пробирки для ВЭЖХ с использованием шприца Hamilton, при осторожном промывании и высушивании шприца между образцами. Для способствования высушиванию образцов, в каждую пробирку добавляли 0,5 мл ацетона,а затем образцы высушивали струей воздуха. Образцы разбавляли 1 мл ацетонитрила и анализировали посредством ВЭЖХ с использованием хроматографических условий, указанных выше. Таким образом, I3A является стабильным в ацетоне и ацетонитриле при 4-8 С, что отражается преобладанием пика "b" для обоих растворителей в течение 14 суток. В протонных растворителях образование изомера "а", а затем изомера "с" быстро возрастет. Стабильность при различных значениях рН. Стабильность I3A исследовали при рН 4,5 в двух буферах, а именно монофосфат калия/дифосфат натрия и уксусная кислота/ацетат аммония в течение 24 ч при комнатной температуре. Анализ ВЭЖХ показал, что I3A является стабильным в обоих буферах при рН 4,5 т.е. через 24 ч все еще существует преобладание изоформы "b" (фиг. 1). Стабильность I3A исследовали при рН 5,5, 6,5 и 7,0 в течение 14 суток при комнатной температуре,и было выявлено ее снижение при повышении рН, т.е. к 14 суткам происходит образование изоформыI3A исследовали в отношении стабильности в DMSO при комнатной температуре и при 37 С в течение 10 суток. Контрольный образец I3A в ацетонитриле хранили при тех же условиях, что и тестируемый образец. Образцы анализировали посредством ВЭЖХ в начале эксперимента (0 сутки), через 48 часов (2 сутки) и снова через 10 суток. Используемые хроматографические условия были следующими: Колонка: Hypercarb (ThermoQuest, Phenomenex) (S/no. 3-34070); Длина колонки: 1004,60 мм; Температура колонки: 25 С; Защитная колонка: С 18 Columbus (Phenomenex) (S/no. 202678); Длина защитной колонки: 504,60 мм; Подвижная фаза: 50% об./об. фосфатный буфер, рН 4,5/50% об./об. ацетонитрил; Скорость потока: 1,0 мл/мин; Длина УФ-волны: 230 нм; Объем инъекции: 10 мкл; Время пробега: 35 мин; Время удержания: 15 мин, 24 мин. Оказалось, что I3A является стабильным в DMSO при комнатной температуре и при 37 С в течение 10 суток. Пример 2. Изопропаноловый гель, рН 6,5. Исследовали стабильность I3A "b" в препарате изопропанолового геля (рН 6,5). Протокол был следующим. Состав изопропанолового геля (рН 6,5)Carbopol диспергировали в воде и глицерине и растворяли нагреванием до 40 С на водяной бане. Затем в этот раствор добавляли пропиловый спирт. Циклометикон растворяли в изопропиловом спирте и этот второй раствор хорошо перемешивали с раствором carbopol, а затем при перемешивании добавляли воду до 100%. рН геля доводили до 6,5 капельным добавлением этаноламина. Изопропаноловый гель хранили при 2-8 С до применения. Для исследования стабильности I3A "b" в изопропаноловом геле (рН 6,5), изготавливали состав 0,02% мас./мас. I3A "b"/изопропаноловый гель и разделяли на три образца для хранения при 2-8 С, RTP и 40 С. В регулярные моменты времени образцы анализировали в отношении стабильности I3A "b" с точки зрения образования изоформы "а" в двух экземплярах, и эти результаты приведены на фиг. 2. I3A"b" преобразуется в изоформу "а", а затем в изоформу "с". Возможно, это является следствием более высокого значения рН и наличия воды в изопропаноловом геле, что способствует этому превращению I3AI3A "b" в смеси 30% мас./мас. изопропиловый спирт/цитратный буфер, рН 3,0. Стабильность I3A "b" (партия 240902) в смеси 30% мас./мас. IPA/цитратный буфер (рН 3), при хранении при 2-8 С и 40 С исследовали в двух экземплярах, и эти результаты приведены на фиг. 3. Консерванты. Различные консерванты исследовали в отношении их пригодности для применения в составах I3A"b" в концентрациях, в которых они, вероятно, пройдут тест на эффективность консерванта. Первоначально консерванты получали в цитратном буфере (рН 3) и анализировали посредством ВЭЖХ для проверки пиков на хроматограммах, которые могут препятствовать анализу изоформ I3A. Обобщенные результаты приведены в табл. 5. Таблица 5 Анализ консервантов посредством ВЭЖХ Не желательно наличие многих помеховых пиков от консервантов на хроматограммах, поскольку это приводит к трудности анализа лекарственного средства в составах, и это может делать необходимым проведение отдельного анализа для консервантов.I3A "b" (0,05% мас./мас.) растворяли отдельно в выбранных консервантах (бензиловый спирт и феноксиэтанол), хранили при 2-8 С, RTP и 40 С и проверяли в отношении стабильности с точки зрения образования изоформы "а" в двух экземплярах через регулярные промежутки времени. Результаты этого исследования стабильности приведены на фиг. 4 и 5. Результаты указывают на то, что бензиловый спирт является наиболее пригодным консервантом среди тестированных консервантов. Изготовление составов I3A "b". Изготавливали следующие три состава и соответствующие им плацебо:C) 0,1% мас./мас. I3A "b"/9,5% мас./мас. циклометикон/9,5% мас./мас. IPM/1,0% мас./мас. бензиловый спирт/эластомер 10. Исходный раствор I3A "b" изготавливали в бензиловом спирте (табл. 6) и этот исходный раствор использовали для изготовления составов. Для плацебо, вместо исходного раствора I3A "b"/бензиловый спирт использовали бензиловый спирт отдельно. Точные массы компонентов составов I3A "b" подробно представлены в табл. 7-9. Составы и соответствующие им плацебо изготавливали следующим образом: Состав А: крем из I3A "b"/макроцетилового эфира. Эмульгирующую мазь из макроцетилового эфира аккуратно отвешивали в стеклянную пробирку, а затем плавили на водяной бане при 60 С. Свежий приготовленный цитратный буфер (рН 3) аккуратно отвешивали в отдельную стеклянную пробирку, нагревали на водяной бане, а затем постепенно добавляли в расплавленную эмульгирующую мазь при постоянном перемешивании до охлаждения. Этот процесс приводил к крему на основе макроцетилового эфира. Для приготовления состава, I3A "b" в бензиловом спирте аккуратно отвешивали в стеклянную пробирку и в него постепенно и аккуратно отвешивали крем на основе макроцетилового эфира, при постоянном перемешивании. Состав В: гель I3A "b"/30% IPA.I3A "b"/бензиловый спирт аккуратно отвешивали в стеклянную пробирку. Остальные компоненты аккуратно отвешивали в этот раствор в порядке IPA, затем цитратный буфер, а затем НЕС, при сильном перемешивании между добавлениями. Состав С: I3A "b"/силиконы.I3A "b"/бензиловый спирт аккуратно отвешивали в стеклянную пробирку. Остальные компоненты аккуратно отвешивали в этот раствор в порядке эластомер 10, затем циклометикон, а затем IPM, при сильном перемешивании между добавлениями. Анализ состава. Составы анализировали в начале исследования для проверки концентрации I3A "b" (мас./мас.) в составах и было выявлено, что она составляет 0,1% мас./мас. I3A "b". Из этого общего содержания I3A "b",в этих составах было менее 0,7% изоформы "а" и не было изоформы "с". Составы проверяли в отношении появления изоформы "а" в момент завершения исследования и было показано, что они имеют менее чем 0,3% изоформы "а" при хранении при 2-8 С. Изоформа "с" не выявлялась ни в одном из составах. Таблица 6 Исходный раствор I3A "b"/бензиловый спирт Стабильность изоформ I3 А в анализе систем растворителей в течение 72 ч. Стабильность изоформ I3A "а", "b" и "с" в трех системах образцов в течение 72 ч (эквивалентно максимально возможной длительности, при которой образцы могут находиться в автоматическом пробоотборнике в течение длительного анализа ВЭЖХ) подтверждали следующим образом. Получали свежие стандарты трех изоформ I3A (приблизительно 100 мкг/мл) в ацетонитриле, смеси ацетонитрил/цитратный буфер (рН 3) и смеси ацетонитрил/аммонийный буфер (рН 4,5) и сразу анализировали посредством ВЭЖХ. Затем стандарты разделяли на три равных объема и помещали при 2-8 С, комнатной температуре и 40 С на 72 ч, а затем снова анализировали посредством ВЭЖХ. Результаты этого исследования представлены в табл. 10. Наибольшее превращение 13 А "b" в изоформу "а" при комнатной температуре происходило в образце, изготовленном в 100% об./об. ацетонитриле, в то время как стандартI3A "b" в смеси ацетонитрил/цитрат (рН 3) показал очень небольшое превращение в изоформу "а" даже при 40 С, подтверждая, что эта система растворителей может быть наиболее пригодной для обеспечения стабильности образцов на протяжении времени отбора проб. Таблица 10 Стабильность изоформы "а", "b" и "с" в различных системах растворителей Пример 3. Исследование рН-стабильности I3A "b" в гелях IPA, изготовленных с цитратным буфером в диапазоне рН от 2,5 до 4,0 проводили при 2-8 и 40 С (ускоренное исследование стабильности). Способы. Изготовление гелей I3A "b" и плацебо с использованием цитратного буфера с рН в диапазоне от 2,5 до 4,0. Составы гелей IPA с активным веществом и плацебо, изготовленные для исследования стабильности в диапазоне рН, приведены в табл. 11 и 12 соответственно. Большие количества плацебо изготавливали для упрощения измерения рН гелей с плацебо в 0 момент времени. Изготавливали меньшие количества активного геля, т.е. 30 г в каждом случае, поскольку количество лекарственного средства, доступного для исследования, было ограниченным. Предшествующие исследования стабильности, проведенные для геля IPA с I3A, в котором кажущееся значение рН для плацебо и активного геля подвергали мониторингу в течение 12 месяцев, показали, что нет заметных различий между этими двумя веществами. Более того, указанное кажущееся значение рН измеряли как для геля с активным веществом, так и для геля с плацебо. Таким образом, в начале исследования стабильности для определения кажущегося значения рН гелей, измеряли только рН гелей с плацебо. После гидратации в течение ночи, гели анализировали в момент времени Т=0 и определяли кажущиеся значения рН плацебо. Образцы разделяли равным образом в 7-мл пробирки из натриевого стекла для избежания периодического изменения температуры материала при отборе образцов в различные моменты времени и пробирки хранили при 2-8 и 40 С (ускоренное исследование стабильности) соответственно. Таблица 11 Состав активных гелей IPA, изготовленных с цитратным буфером в диапазоне рН от 2,5 до 4,0 Таблица 12 Состав гелей IPA с плацебо, изготовленных с цитратным буфером в диапазоне рН от 2,5 до 4,0 Измерение кажущегося значения рН гелей IPA с плацебо, изготовленных с использованием цитратного буфера в диапазоне рН от 2,5 до 4,0. Кажущееся значение рН гелей IPA с плацебо, изготовленных с использованием цитратного буфера с диапазоне рН от 2,5 до 4,0 измеряли с использованием рН-метра Jenway 3320. Экстракция I3A из гелей IPA. Лекарственное средство экстрагировали из гелей IPA следующим образом. Один грамм каждого из гелей или соответствующих им плацебо аккуратно отвешивали в 10-мл мерную колбу в двух или трех экземплярах. Сначала образцы смешивали с 1 мл цитратного буфера (рН 3) сильным и повторяющимся перемешиванием на вихревой мешалке, установленной на максимальную скорость, а затем оставляли для встряхивания на орбитальном устройстве для встряхивания в течение 30 мин при 400 об/мин. Затем мерные колбы доводили до отметки объема ацетонитрилом для применения в ВЭЖХ и образцы снова сильно перемешивали повторяющимся перемешиванием на вихревой мешалке, установленной на максимальную скорость, а затем оставляли для встряхивания на орбитальном устройстве для встряхивания в течение 60 мин при 400 об/мин. Аликвоты переносили в пробирки для анализа посредством ВЭЖХ. Экстракцию I3A из геля проводили в трех экземплярах, т.е. три отдельных отвеса с двойными инъекциями в момент времени 0 и момент времени = три месяца (образцы при 2-8 С) и в двух экземплярах,т.е. два отдельных отвеса с двойными инъекциями для момента времени = одна неделя и четыре недели(образцы при 40 С). Анализ ВЭЖХ. Анализ проводили с использованием следующих систем и условий: Инструменты. Сепараторный модуль Waters Alliance 2695 Separations Module (S/no. B98SM4209M); Детектор поглощения Waters 2487 DualAbsorbance detector (S/no. M97487050N); Сепараторный модуль Waters Alliance 2695 D Separations Module (S/no. G98SM8039N); Детектор поглощения Waters 2487 DualAbsorbance detector (S/no. L02487106M); Программное обеспечение Empower Pro Empower. Используемые хроматографические условия были следующими: Колонки: Hypercarb (ThermoQuest, Phenomenex) S/no. 3-34070 и S/no. 1034024A; Длина колонки: 1004,60 мм; Температура колонки: температура окружающей среды; Защитные колонки: С 18 Columbus (Phenomenex) S/no. 202678 и S/no. 74554-7; Длина защитной колонки: 504,60 мм; Подвижная фаза: 50% об./об. натрий-ацетатный буфер рН 4,5/50% ацетонитрил (об./об.); Скорость потока: 1,0 мл/мин; Длина УФ-волны: 2 30 нм; Объем инъекции: 30 мкл; Время исследования: 35 мин; Температура в автоматическом пробоотборнике: 82 С; Время удержания: 132 мин для изоформы "а"; 222 мин для изоформы "b"; 232 мин для изоформы "с"; неопределенный пик с относительным временем удержания изоформы "b" 0,930,02. Результаты. Измерение кажущегося значения рН гелей плацебо в 0 момент времени. Результаты для измерения кажущегося значения рН для гелей с плацебо приведены в табл. 13. Измерений рН в какой-либо момент времени для стабильности не проводили. Таблица 13 Измерение кажущегося значения рН гелей IPA с плацебо (n=1) Определение процентной чистоты пиков изоформ I3A в активном геле. Процентные чистоты пиков I3A "b" в гелях с активным веществом в начале исследования стабильности (Т=0), и после одной недели хранения при 40 С, четыре недели хранения при 40 С, и после трех месяцев хранения при 2-8 С, приведены в табл. 14, 15, 16 и 17 соответственно. Процентная частота пикаI3A "b" составляла более 98%, в то время как процентная чистота пика изоформы "а" составляла менее 1,2% для всех гелей после трех месяцев хранения при -28 С. Для ускоренного исследования стабильности при 40 С, наибольшее снижение процентной чистоты пика "b" в течение четыре недель наблюдали в геле с кажущимся значением, составляющим 4,74 для плацебо. Поскольку было показано, что I3A "b" превращается в изоформу "а", образование изоформы "а" также исследовали в качестве маркера стабильности. Вычисляли повышение процентной чистоты пиков изоформы "а" от 0 момента времени после од- 17024152 ной недели и четырех недель хранения при 40 С, и после трех месяцев хранения при 2-8 С, и эти результаты приведены в табл. 18. Таблица 14 Процентная чистота пиков изоформ I3A в активных гелях (n=3, среднее значениестандартное отклонение, UAP = неопределенный пик, RRT = относительное время удержания) в 0 момент времени Таблица 15 Процентная чистота пиков изоформ I3A в активных гелях (n=2, среднее значениедиапазон, UAP = неопределенный пик, RRT=относительное время удержания) после одной недели хранения при 40 С Таблица 16 Процентная чистота пиков изоформ I3A в активных гелях (n=2, среднее значениедиапазон, UAP = неопределенный пик, RRT=относительное время удержания) после четырех недель хранения при 40 С Таблица 17 Процентная чистота пиков изоформ I3A в активных гелях (n=2, среднее значениестандартное отклонение, UAP = неопределенный пик, RRT= относительное время удержания) после трех месяцев хранения при 2-8 С Таблица 18 Вычисленное повышение процентной чистоты пиков изоформы "а" I3A с 0 момента времени в гелях IPA Данные позволяют предположить, что рН оказывает эффект на образование изоформы "а" даже при хранении геля при 2-8 С в течение трех месяцев. Повышение процентной площади пика изоформы "а" 0,21% измеряли в геле, изготовленном с цитратным буфером с рН 3,00, по сравнению с повышением процентной площади пика изоформы "а", составляющим 0,44%, для геля, изготовленного с цитратным буфером с рН 3,5. К Т=4 недели при 40 С различия между гелями с точки зрения повышения процентной чистоты пиков изоформы "а" увеличились. Пример 4. Масляные составы. Материалы. Способы. Выбор пригодных масел/эксципиентов. Кунжутное масло, фракционированное кокосовое масло (триглицериды средней цепи), соевое масло, кукурузное масло и арахисовое масло, были идентифицированы в качестве носителей для парентерального введения. Каждый из них можно использовать вплоть до 100% уровня. Другие эксципиенты, которые могут быть включены в парентеральные масляные составы, пред- 19024152 ставлены ниже совместно с максимальными используемыми концентрациями. Изготовление составов I3A и плацебо для предварительных исследований стабильности. Стерилизация фракционированного кокосового масла. Приблизительно 50 г фракционированного кокосового масла (CRODAMOL GTC/C) отвешивали в 100-мл коническую колбу (боросиликатное стекло), закрывали пробкой (пробка из борсиликатного стекла) и помещали внутрь предварительно нагретого сушильного шкафа (Gallenkampf Hot box Oven с вентилятором, размер 2) при 1735 С в течение 1 ч. После этого перед применением маслу позволяли охладиться до комнатной температуры. Добавление I3A в стерилизованное масло. Приблизительно 10 мг I3A аккуратно отвешивали в 28-мл стеклянную пробирку и добавляли бензиловый спирт приблизительно до 20 мл (точная масса указана), который ранее фильтровали через 0,22 мкм фильтр MILLEX-GV. Эту смесь периодически встряхивали в течение приблизительно 2 ч до растворения I3A в бензиловом спирте. К этой смеси добавляли приблизительно 9,79 г стерилизованного масла и встряхивали в течение приблизительно 5 мин до образования гомогенного раствора. Плацебо изготавливали аналогичным образом, за исключением того, что для компенсации I3A использовали приблизительно 9,80 г (в противоположность 9,79 г) стерилизованного масла (точная масса указана). Точные массы и процентные составы в составах с активным веществом (I3A) и плацебо представлены в табл. 19 и 20. Таблица 19 Планируемые и истинные количества (и % мас./мас.) для состава масла с I3A Таблица 20 Планируемые и истинные количества (и % мас./мас.) для состава масла с плацебо Условия хранения для составов I3A и плацебо. Аликвоты каждого состава (плацебо или активного вещества) распределяли в 2-мл флаконы из янтарного стекла с завинчивающейся крышкой (боросиликатное стекло), закрывали и хранили в двух условиях хранения, а именно 2-8 С и 25+2 С. Составы тестировали с использованием способа, описанного ниже, в течение периодов хранения вплоть до одного месяца, и включительно. Предварительное исследование стабильности I3A в фракционированном кокосовом масле. В табл. 21 приведены суммарные данные для стабильности I3A во фракционированном кокосовом масле, хранящемся при 2-8 С и 25 С в течение 43 суток. Данные стабильности указывают на то, что, как оказалось, не происходит повышения процентного количества изоформы "а" в процессе хранения при 28 С и 25 С после 43 суток, что сравнимо с процентным количеством изоформы "а" из свежей партии I3A в t=0 и t=43 суток. Таблица 21 Процентное количество изоформы "а" в качестве процентного количества изоформы "а" и I3A "b", хранящихся в двух условиях в течение 43 суток Результаты. Не было значимых отличий (р 0,05) в площади пика и времени удержания изоформ I3A "а" и "b" между образцами, инъецированными в ацетонитриле или смеси ацетонитрил/масло. Из списка доступных масел, два считали пригодными для составления I3A, а именно фракционированное кокосовое масло и кунжутное масло. Рекомендованная стерилизация кунжутного масла составляет 2 ч при 170 С, в то время для фракционированного кокосового масла она составляет 1 ч при 170 С. Это обладает преимуществами в отношении количества времени и энергии, потраченных для изготовления состава. Вследствие нестабильности I3A при нагревании (экспериментально показано, данные не представлены), масло необходимо стерилизовать отдельно и I3A добавлять в асептических условиях (с фильтрацией) в виде раствора, растворенного в бензиловом спирте. Было выявлено, что материал фильтра, а именно фильтр 0,22-мкм MILLEX-GV, является пригодным для фильтрации смеси I3 А/бензиловый спирт, однако адсорбцию I3A на мембрану фильтра, еще необходимо исследовать. Если желательно,вследствие относительно низкой вязкости этого масла (приблизительно 30 мП по сравнению с кунжутным маслом, которое обладает вязкостью приблизительно 44 мП), также состав можно получать in situ со смесью I3 А/бензиловый спирт и полный состав стерилизовать фильтрацией. Пример 5. Пероральные составы. Выбирали ряд эксципиентов для буккальных составов, и 17 неводных составов изготавливали и визуально оценивали в отношении консистенции и сольватации. Множество полимеров представляли собой потенциальные мукоадгезивные носители. Вследствие присущей нестабильности I3A в водных системах, исследованные составы были неводными, с замещением глицерина и полиэтиленгликоля (PEG) водной фазой. Способы. Предварительный визуальный скрининг составов плацебо. Исходно изготавливали семнадцать составов плацебо и подвергали их визуальному скринингу в отношении консистенции и сольватации (табл. 22). В кратком изложении, требуемые количества PEG 400 и карбопола 934 перемешивали в 28-мл стеклянных пробирках в течение 10 мин с помощью шпателя и другие ингредиенты добавляли в следующем порядке: глицерин, бензиловый спирт и метилцеллюлоза или НЕС или НРС. Затем составы смешивали с помощью мешалки Silverson 14RT при приблизительно 10000 об/мин в течение приблизительно 2-3 мин. Перед визуальным скринингом все смешанные составы плацебо оставляли для растворения в течение ночи (24 ч). Таблица 22 Композиция составов плацебо для визуальной оценки Реологический скрининг составов плацебо (мукоадгезия). Одним подходом для исследования мукоадгезии является реологическая охарактеризация мукоадгезивной поверхности контакта. В ее основе лежит предположение, что степень взаимного проникновения можно подвергать детекции измерением различий в реологических параметрах между полимерными гелями и их смесями с муцином. Синергическое повышение вязкости было предложено в качестве показателя прочности биологического адгезионного сцепления. На основании визуального скрининга было выбрано пять составов плацебо, исходя из вязкости и сольватации, для дальнейшей реологической оценки с использованием свиного муцина. Выбранные составы приведены в табл. 23. Таблица 23 Составы, выбранные для реологического скрининга Изготовление образцов для реологической оценки. Изготовление свиного муцина. В кратком изложении, 15 г порошка свиного муцина отвешивали в стакан и доводили до 150 г с использованием деионизированной воды до конечной концентрации 10% мас./мас. муцина. Смеси позволяли гидратироваться при 2-8 С в течение приблизительно 2-3 ч. Гидратированный муцин далее разбавляли деионизированой водой с получением конечной концентрации 5% мас./мас. муцина в деионизированной воде. Смесь оставляли для гидратации в течение ночи в холодильнике при 2-8 С. Изготовление смеси состав/муцин. Выбранные составы (табл. 23) изготавливали, как описано выше. В каждый состав добавляли равную массу 10% мас./мас. муцина и осторожно перемешивали шпателем. Смесь оставляли для гидратации при 2-8 С в течение ночи. Кроме того, выбранные составы также разбавляли (50:50 мас./мас.) деионизированной водой и оставляли для гидратации в течение ночи в холодильнике при 2-8 С. Процесс динамического (осцилляционного) реологического тестирования. Реологический скрининг проводили с использованием реометра Carrimed CSL2. Приблизительно 0,5 г тестируемого образца помещали между платформой и пластиной с параллельным расположением. После сдавливания образца между платформой и плитой, любой избыток образца осторожно удаляли с использованием шпателя в правых углах по отношению к геометрической форме. Каждый образец тестировали всего пять раз, с получением механических спектров. Полученные конечные параметры G', G" и tanиспользовали для оценки мукоадгезивной прочности составов, где G' представляет собой модуль упругости, G" представляет собой модуль вязкости и tanпредставляет собой соотношение G' и G". Оптимизация и изготовление выбранных составов с активным веществом и плацебо. После реологического тестирования было выбрано два состава для дальнейшей оптимизации (составы 16 и 17) в отношении изготовления партии состава для исследования стабильности. Оптимизированный процесс изготовления использовали для получения партий активного вещества (содержащегоI3A) и плацебо (по 25 г каждого). На фиг. 6 представлено изготовление состава 16 активного вещества и плацебо с планируемыми количествами используемых эксципиентов/лекарственного средства. В кратком изложении, требуемое количество карбопола 934 добавляли к PEG 400 в боросиликатную бутыль и нагревали до 50 С в течение приблизительно 2 ч до полного растворения смеси. Эту смесь охлаждали до комнатной температуры; добавляли требуемое количество глицерина и смесь нагревали до приблизительно 60 С в воде на водяной бане в течение 2 ч до образования гомогенной пасты. Добавляли требуемое количество НЕС и перемешивали до охлажденной смеси с использованием смесителя SilversonL4RT, установленного приблизительно на 10000 об/мин в течение 2-3 мин. Затем этой смеси позволяли полностью раствориться в течение ночи (приблизительно 12 ч) при комнатной температуре. Как показано на фиг. 6, это приводит к "основному составу". Активный состав изготавливали первоначальным растворением I3A в бензиловом спирте. Требуемое количество смеси I3 А/бензиловый спирт добавляли к растворенному основному составу и осторожно перемешивали шпателем с получением конечной концентрации 0,1% мас./мас. I3A. Аналогично, изготавливали состав плацебо добавлением бензилового спирта в растворенную смесь, и осторожно перемешивали. Состав 17 изготавливали аналогичным образом. В табл. 24 представлены планируемые% мас./мас. смеси эксципиенты/I3 А в составах активного вещества и плацебо. Приблизительно 1 г составов плацебо и активного вещества разделяли на аликвоты в 2-мл флаконы с завинчивающейся крышкой и помещали для исследования стабильности при 2-8, 25 и 40 С (последнюю температуру использовали для краткосрочных ускоренных исследований стабильности). Таблица 24 Планируемые % мас./мас. (до 1 d.p.) в оптимизированных составах активного вещества и плацебо Анализ I3 А в составе. Экстракция I3A из активного состава. Для оценки лекарственного продукта в целях оценки деградации I3A "b" в изоформу "а" (чистота хроматографического пика) был проведен способ экстракции. Экстракцию I3A из активного состава проводили следующим образом (указанный процесс также использовали для состава плацебо). В кратком изложении, приблизительно 1 г состава аккуратно отвешивали в 10-мл мерную колбу, а затем добавляли 1 мл цитратного буфера (рН 3). Смесь осторожно встряхивали рукой в течение приблизительно 5 мин до гомогенного состояния и объем доводили метанолом для применения в ВЭЖХ. Затем колбу встряхивали на механическом устройстве для встряхивания в течение приблизительно 2 ч. Содержимое колбы переносили в 15-мл полипропиленовую пробирку и центрифугировали в течение 5 мин при 2200 об/мин. Супернатант разделяли на аликвоты в пробирки для ВЭЖХ и анализировали. Предварительные данные по выделению (не представлены) указывают на то, что приблизительно 80% или более I3A "b" было выделено из состава с активным веществом, и более существенно, ни один из эксципиентов не оказывал влияния в составе. Способ ВЭЖХ. Способ анализа для исследования I3A в буккальном составе представлен ниже. Колонка: симметричная, С 18 - 5 мкм (Waters) (S/no. T636515 07, P/no. WAT054205); Длина колонки: 1503,90 мм; Температура колонки: 30 С; Защитная колонка: симметричная, С 18 - 5 мкм (Waters) (P/no. WAT054225); Длина защитной колонки: 203,90 мм; Подвижная фаза: 0,02% об./об. TFA в воде (А); 0,02% об./об. TFA в ацетонитриле (В), А:В; 50:50(исходный состав) (градиент, см. таблицу ниже); Скорость потока: 1,0 мл/мин; Длина УФ-волны: 230 нм (PDA); Объем инъекции: 10; Время исследования: 20 мин; Температура автоматического пробоотборника: 8 С. Образцы и плацебо тестировали в нулевой момент времени. Приблизительно через 1-2 недели образцы, хранящиеся при 40 С, также тестировали в целях получения некоторых данных по ускоренному исследованию стабильности. Результаты. Визуальный скрининг. Визуальный скрининг проводили количественно и он представляет собой относительно эффективный способ предварительного скрининга ряда составов в отношении вязкости и сольватации. Составы плацебо оценивали два независимых эксперта и отбраковывали их на основе слишком высокой или слишком низкой вязкости. Более того, любой состав, который не был растворен полностью, также отбраковывали. Было совершенно очевидно, что в соответствии со способом изготовления, концентрация карбопола 934 более 1,5% мас./мас. приводит к неводным гелям, которые являются слишком вязкими и/или не полностью растворенными. Снижение количества карбопола 934 до 0,5% мас./мас. и добавление метилцеллюлозы в концентрации 2,0% мас./мас. приводит к гелю низкой вязкости. Однако повышение концентрации карбопола 934 до 1,0% мас./мас. и одновременное снижение концентрации метилцеллюлозы до 1,0% мас./мас., тем не менее, приводит к гелю, который обладает низкой вязкостью. Исходя из визуальных наблюдений, будет понятно, что добавление метилцеллюлозы не влияет на вязкость значительно, по сравнению с добавлением карбопола 934. Однако было показано, что метилцеллюлоза обладает мукоадгезивными свойствами и, таким образом, были получены дополнительные составы, которые содержали 1,0 и 1,5% мас./мас. метилцеллюлозу в сочетании с 1,5% мас./мас. карбополом 934. Визуальная оценка этих составов показала, что они являются гомогенными и обладают требуемой консистенцией для дальнейшей оценки. Аналогично, было выявлено, что НРС не влияет на вязкость по сравнению с добавлением карбопола 934. Однако поскольку НРС также добавляют в качестве потенциального мукоадгезивного вещества, было выявлено, что составы, содержащие НРС в концентрации 1,0 и 1,5% мас./мас., совместно с карбополом 934 в концентрации 1,5% мас./мас. являются визуально приемлемыми для дальнейшей реологической оценки. Также было выявлено, что состав 4 является визуально приемлемым в отношении вязкости и сольватации, и он включал НЕС (другой потенциальный мукоадгезивный полимер). Таким образом, пять составов (состав 4, 14, 15, 16 и 17) реологически оценивали в отношении их мукоадгезивной прочности с использованием свиного муцина. Реологическая оценка составов 4, 14, 15, 16 и 17. Модуль упругости G' представляет собой показатель устойчивости образца к упругой деформации(т.е. он отражает связанность полимерной сети) и G" представляет собой показатель устойчивости образца к вязкой деформации. Средние значения G' и G" при 5 Гц, усредненные для 5 образцов, получали на основании конечных данных для возможности сравнения между различными составами. Выражение, которое позволяет определение синергических различий в значениях G' и G" между смесью состав/муцин и отдельными компонентами этой смеси, приведено в уравнении 1. Чем больше относительные показатели G', тем больше взаимодействие состава с муцином. Сходное уравнение можно использовать для вычисления G". tanвычисляли с использованием относительных величин G' и G" с использованием уравнения 2. На фиг. 7 представлены относительные показатели G' и G" для всех пяти тестируемых составов, и на фиг. 8 представлены соответствующие значения tan . Исходя из реологической оценки, был выявлен следующий порядок повышения мукоадгезивной прочности: состав 17 состав 16 состав 14 состав 15 состав 4. Однако составы 14 и 15 показали большие отклонения (как выявили вследствие больших стандартных отклонений). Это может быть следствием негомогенных взаимодействий этих составов с муцином. Более того, также было выявлено, чтоG', полученный для составов в деионизированной воде, обладает большими отклонениями, указывая,таким образом, на то, что эти составы обладают негомогенной гидратацией. Было выявлено, что состав 4 обладает наибольшими значениями G' при смешивании с муцином, однако относительное значение G' было значимо ниже (р 0,05) по сравнению со всеми другими тестируемыми составами. Это было объяснено за счет того факта, что значения G' для состава 4, диспергированного в воде, были значительно бо- 24024152 лее высокими по сравнению со всеми составами, диспергированными в воде. Оказалось, что состав 4 приводил к относительно более хорошему вязкоупругому гелю в воде (по сравнению с другими составами в воде), однако, по-видимому, он обладает относительно небольшим взаимодействием с муцином,поскольку относительное значение G', которое устраняет эффект состава (а также эффект муцина), было значительно более низким. Исходя из относительных значений G', составы 16 и 17 показали наибольшее взаимодействие со свиным муцином, что предполагает, что эти два состава можно использовать в качестве потенциальных мукоадгезивных составов. Составы 14 и 15 показали небольшое взаимодействие с муцином, однако гидратация/взаимодействие этих составов могут быть негомогенными, исходя из больших стандартных отклонений. Состав 4 показал наименьшее относительное значение G' и, таким образом, наиболее низкое взаимодействие. Соответствующие значения tanпредставляют собой относительный показатель вязкоэластичности, более низкое значение tanуказывает на относительно более высокое переплетение и, наоборот, более высокое значение tanуказывает на относительно низкое переплетение (вследствие относительно большего количества вязкого компонента) и, таким образом, подтверждает эти наблюдения. Оптимизация и изготовление выбранных составов с активным веществом и плацебо. Процесс оптимизации проводили в целях снижения времени изготовления составов от приблизительно 24 ч до приблизительно 12 ч. Составы 16 и 17 были выбраны для оптимизации и исследований стабильности. Анализ ВЭЖХ составов I3A. В табл. 25 представлена процентная чистота пиков для I3A "b", а также процентная площадь для изоформы "а" и других неопределенных пиков (UAP), в составах 16 и 17 в нулевой момент времени. Также для сравнения представлена процентная чистота пика образца 0,1% мас./мас. геля IPA с I3A в нулевой момент времени. Все пики для буккальных составов вручную интегрировали и сравнивали с соответствующими составами плацебо. Таблица 25 Процентная чистота пиков составов в нулевой момент времени В табл. 26 представлена процентная чистота пиков для I3A "b", а также процентная площадь для изоформы "а" и других неопределенных пиков (UAP) в составах 16 и 17 приблизительно через две недели после хранения при 2-8 С и 40 С (ускоренное исследование стабильности). Также для сравнения в таблице представлена процентная чистота пика 0,1% мас./мас. геля IPA с I3A, хранящегося при 40 С в течение одной недели. Все пики для буккальных составов вручную интегрировали и сравнивали с соответствующими составами плацебо. Таблица 26 Процентная чистота хроматографических пиков составов в момент времени приблизительно 1-2 недель, хранящихся при 2-8 и 40 С Оказалось, что нет заметных отличий между процентной чистотой пика I3A в любом из составов в нулевой момент времени и исходным значением на рецептуре (99,3% I3A "b", данные РВ 21001/24). Более того, процентная площадь изоформы "а" на рецептуре составляла 0,40%, что является сходным с процентной областью пика для изоформы "а" в нулевой момент времени (табл. 25). Не было заметного повышения процентного количества изоформы "а" после приблизительно 1-2 недель хранения буккальных составов при 2-8 С (табл. 26), в то время как повышение процентного содержания изоформы "а" наблюдали для всех буккальных образцов, хранящихся при 40 С. Однако повышение процентного количества изоформы "а", выявленное для 0,1% мас./мас. геля IPA, было выше(1,60%) после хранения в течение 1 недели при 40 С. Исходя из процентной чистоты пиков, эти предварительные данные, по-видимому, могут указывать на то, что буккальные составы I3A, по меньшей мере,настолько же стабильны, как и 0,1% гель IPA с I3A и, возможно, являются более стабильными. Пример 6. Составы полоксамеров. Исследовали четыре состава полоксамеров. Материалы. Способы. Выбор эксципиентов. Перед исследованием предварительного состава было идентифицировано несколько пригодных эксципиентов для составов полоксамеров, и они перечислены ниже, совместно с максимальными рекомендованными концентрациями. Изготовление составов для реологических исследований. Различные составы полоксамера 407 с плацебо изготавливали с использованием эксципиентов, перечисленных выше, в целях оценки реологических свойств. Изготовление цитратного буфера, рН 3. Моногидрат лимонной кислоты (ММ 211 г/моль) изготавливали в деионизированной воде в концентрации 0,1 М. Раствор трицитратацитрата натрия дигидрата, 0,1 М, (ММ 294,1 г/моль) также изготавливали в деионизированной воде. Раствор цитратного буфера, рН 3, изготавливали смешиванием 40% об./об. раствора моногидрата лимонной кислоты (0,1 М), 10% об./об. раствора трицитрата натрия дигидрата (0,1 М) и 50% об./об. деионизированной воды и конечное значение рН измеряли с использованием рН-метра (3320 JENWAY). Изготовление "основных" растворов полоксамера 407. Предварительные исследования показали, что растворы полоксамера 407 в диапазоне концентраций между 18-20% мас./мас. являются пригодными для обеспечения диапазона вязкостей с варьирующими значениями cmt. Растворы полоксамера изготавливали с использованием холодного способа, описанногоSchmolka (1972). В кратком изложении, требуемые количества полоксамера 407 (табл. 27) добавляли либо в цитратный буфер, рН 3, либо в пропиленгликоль/цитратный буфер, рН 3, в 100-мл стеклянных бутылях из боросиликатного стекла Duran. Пропиленгликоль/цитратный буфер, рН 3, предварительно изготавливали взвешиванием соответствующего количества пропиленгликоля и цитратного буфера рН 3 (табл. 27) и встряхивания в течение 1-2 мин до визуально гомогенного состояния. Бутыли Duran, содержащие ингредиенты закрывали и помещали на баню лед/вода на 4 ч с частым встряхиванием каждые 15 мин, до образования прозрачных растворов. Эти растворы хранили при 2-8 С до тех пор, пока не потребуются. Процесс стерилизации. Поскольку гели требуются для терапии внутри очага повреждения, важной является стерилизация. В целях достижения стерилизации, изготовленные гели подвергали автоклавированию с использованием способа ВР, где приблизительно 100 г каждого из гелей, приведенных в табл. 27, помещали в 100-мл бутыли Duran и подвергали автоклавированию в течение 15 мин при 121 С. После этого процесса, гели оставляли охлаждаться при комнатной температуре, а затем хранили при 2-8 С до тех пор, пока не потребуются. Таблица 27 Истинные и планируемые количества "основных" растворов полоксамера Таблица 28 Истинные и планируемые количества составов плацебо для реологической оценки Изготовление составов полоксамера с плацебо для реологической оценки. Вследствие нестабильности I3A при стерилизации нагреванием, составы, содержащие I3A, необходимо изготавливать растворением I3A в пригодном растворителе с последующим асептическим добавлением (т.е. асептической фильтрацией) к "основным" растворам полоксамера после автоклавирования. Выбранный растворитель представлял собой бензиловый спирт. Однако для реологической оценки изготавливали только составы полоксамера с плацебо, содержащие бензиловый спирт, вследствие ограниченной доступности I3A. Изготовление раствора бензиловый спирт/цитратный буфер, рН 3. Количество цитратного буфера, добавленного к бензиловому спирту, составляло 2,5% мас./мас., что было ниже растворимости цитратного буфера рН 3 в бензиловом спирте. В кратком изложении, приблизительно 0,5 г цитратного буфера, рН 3, добавляли к 19,5 г бензилового спирта с получением конечного процентного содержания цитратного буфера, составляющего 2,5% мас./мас., в бензиловом спирте. Затем этот раствор фильтровали через фильтр Millipore (0,22-мкм MILLEX-GV, MILLIPORE) для имитации состояния асептической фильтрации. Добавление раствора бензиловый спирт/цитратный буфер, рН 3, к "основным" растворам полоксамера. Составы плацебо (табл. 28) изготавливали добавлением требуемого количества фильтрованной смеси бензиловый спирт/цитратный буфер рН 3 к стерилизованным "основным" растворам полоксамера,полученным как указано выше. В кратком изложении, приблизительно 9,90 г (точная масса указана в табл. 28) каждого "основного" раствора полоксамера отвешивали в 20 мл флакон из натриевого стекла и охлаждали на льду/в воде с образованием жидкости (при комнатной температуре эти растворы образуют гели). К охлажденной "основе" полоксамера добавляли приблизительно 0,10 г (точная масса указана в табл. 28) фильтрованной смеси бензиловый спирт/цитратный буфер, рН 3, и встряхивали в течение 2 мин до получения визуально прозрачного гомогенного раствора. Затем эти составы хранили при 2-8 С до тех пор, пока не потребуются. Реологическая оценка. Реологическую оценку проводили с использованием реометра Carrimed CSL2. Приблизительно 0,4 г тестируемого образца помещали между платформой и пластиной с параллельным расположением. После сдавливания образца между платформой и плитой, любой избыток образца осторожно удаляли с использованием шпателя в правых углах по отношению к геометрической форме. Каждый образец тестировали всего три раза, и полученную вязкость записывали в качестве функции температуры. Изготовление составов с активным веществом и соответствующих плацебо для исследований стабильности и высвобождения. После реологической оценки, изготавливали составы полоксамера с активным веществом (I3A) и плацебо для исследований стабильности и высвобождения. Более того, составы PEG 400 с плацебо и активным веществом (0,1% мас./мас. I3A) также изготавливали в качестве контрольных составов для тестирования высвобождения. Изготовление исходного раствора I3A в смеси бензиловый спирт/цитратный буфер. Приблизительно 50 мг (планируемое количество) I3A аккуратно отвешивали в 7-мл стеклянную небольшую пробирку совместно с 500 мг (планируемое количество) смеси бензиловый спирт/цитратный буфер рН 3. Эту смесь периодически встряхивали в течение 5 мин до растворения I3A. Изготовление составов полоксамера с активным веществом и плацебо. Составы плацебо получали, как описано выше (табл. 28). Составы полоксамера с активным веществом (I3A), содержащие планируемую концентрацию 0,1% мас./мас. I3A "b" изготавливали способом,сходным с составами плацебо, за исключением того, что избыточную массу вследствие I3A "b" компенсировали аналогичным снижением добавляемого количества "основного" раствора полоксамера(табл. 29). В кратком изложении, приблизительно 110 мг (точная масса указана) смеси I3 А/бензиловый спирт/цитратный буфер, рН 3, добавляли к 9,89 г охлажденного стерилизованного "основного" раствора полоксамера и встряхивали в течение приблизительно 2 мин до получения визуально прозрачного гомогенного раствора. Точные массы и планируемые массы указаны в табл. 29. Таблица 29 Истинные и планируемые количества составов полоксамера с активным веществом для исследований стабильности и высвобождения Таблица 30 Истинные и планируемые количества контрольных составов PEG 400 с плацебо и активным веществом для исследований высвобождения Изготовление контрольных составов PEG400. После аналогичного процесса, 12,5 мг I3A добавляли к 125 мг бензилового спирта, который предварительно фильтровали через фильтр Millipore (0,22-мкм MILLEX-GV, MILLIPORE). Этот раствор встряхивали в течение приблизительно 5 мин до полного растворения I3A. Для изготовления контрольных составов с активным веществом, приблизительно 110 мг этой смеси добавляли к раствору 7,912 гPEG400 и 1,978 г цитратного буфера рН 3. Плацебо изготавливали аналогичным образом, за исключением того, что использовали приблизительно 7,92 г PEG400 и 1,98 г цитратного буфера и 100 мг стерилизованного бензилового спирта. Точные массы и планируемые массы представлены в табл. 6 для составовPEG 400 с плацебо и активным веществом соответственно. Условия хранения для составов полоксамера с активным веществом и плацебо. Аликвоты каждого из составов полоксамера 407 (с плацебо или активным веществом) распределяли в 2 мл флаконы из желтого стекла (боросиликатное стекло) с завинчивающейся крышкой, закрывали и хранили в трех условиях хранения, а именно 2-8 С, 252 С и 402 С для исследований стабильности. Тестирование стабильности I3A в составах полоксамера. Для оценки лекарственного продукта проводили способ экстракции в целях оценки деградации I3A"b" в изоформу "а" (чистота хроматографического пика). Экстракцию I3A из активного состава проводили следующим образом (указанный процесс также использовали для состава плацебо). В кратком изложении, приблизительно 0,5 г состава аккуратно отвешивали в 5-мл мерную колбу, и доводили до отметки смесью ацетонитрил/цитратный буфер, рН 3, (90:10 об./об.) для применения в ВЭЖХ. Раствор разделяли на аликвоты в пробирки для ВЭЖХ и анализировали. Предварительные данные по выделению (не представлены) указывают на то, что приблизительно 80% или более I3A "b" было выделено из состава с активным веществом, и более существенно, ни один из эксципиентов не оказывал влияния в составе. Составы анализировали в t=0 и ускоренные исследования стабильности (40 С) проводили при t=5 недель. Предварительные исследования высвобождения I3A. Высвобождение I3A "b" из составов через синтетическую мембрану исследовали с использованием диффузоров Франца в закрытых условиях. Выбор жидкости приемника. Жидкость приемника, используемая для проверки и поддержания условий погружения, представляла собой смесь 20% об./об. этанол/цитратный буфер (рН 3,0) и ее помещали в ячейку Франца и перемешивали постоянно магнитной мешалкой. Предварительные исследования стабильности проводили наI3A в смеси 20% об./об. этанол/цитратный буфер (рН 3,0) при 37 С в течение приблизительно 18 ч. Было выявлено, что повышение процентной площади пика в изоформе "а" через 18 ч составляет 0,26%. В целях исследования в ячейке Франца этот показатель считали приемлемым. Кинетическую растворимостьI3A в смеси 20% об./об. этанол/цитратный буфер (рН 3,0) определили как 509,73 мкг/мл при 25 С. Исследования высвобождения in vitro (ячейка Франца). Для проведения исследования высвобождения использовали калиброванные по отдельности диффузоры Франца со средней диффузионной площадью поверхности 0,53 см 2 и средним объемом приемника 1,850,02 мл. Изготавливали регенерированные целлюлозные мембраны (MWCO 12000-14000), разрезали и помещали в ячейки Франца. Мембранам давали возможность уравновеситься с фазой приемника в течение 30 мин, а затем наносили составы. На поверхность мембраны наносили избыточную дозу, составлявшую 0,5 г, каждого состава с использованием нагнетателя объемного типа Finnpipette. Проводили одно исследование образца (26 ч после нанесения геля), после чего 200 мкл жидкости приемника осторожно отбирали из рукава ячейки Франца. На протяжении эксперимента, любые потери жидкости приемника вследствие выпаривания из ячеек Франца заменяли для подержания постоянного объема. Эксперимент проводили в закрытых условиях (верхнюю часть верхних донорных лунок накрывали Parafilm), для всех составов (n=3 ячейки Франца на активный состав и n=1 ячейка Франца на состав плацебо). Образцы анализировали посредством ВЭЖХ, как описано в примере 1, и концентрацию высвобожденного I3A "b" оценивали с использованием серии калибровочных стандартов, изготовленных в смеси 80% об./об. цитратный буфер/20% об./об. этанол. Результаты. Стерилизация "основных" растворов полоксамера. Сразу после стерилизации "основных растворов" полоксамера, Ро 1 ох-01 и Ро 1 ох-02 без пропилена,было показано разделение фаз. После охлаждения на льду/в воде, эти составы превратились в прозрачные гомогенные фазы. Однако "основные" растворы, содержащие пропиленгликоль, Polox-pg-01 и Poloxpg-02 показали отсутствие разделения фаз сразу после стерилизации, подтверждая, что добавление пропиленгликоля ингибирует этот эффект. Реологическая оценка. Реологические исследования проводили на составах полоксамера с плацебо и вязкость (П) определяли как функцию температуры (С), в диапазоне температур 4-40 С. Значение cmt определяли с помощью средней точки изгиба. Для всех составов плацебо происходило небольшое повышение вязкости при повышении температуры до определенной точки, в cmt происходило резкое повышение вязкости при небольшом повышении температуры. Было выявлено, что значение cmt зависит от концентрации, т.е. чем ниже концентрация полоксамера 407, тем выше значение cmt. Более того, добавление пропиленгликоля к составу полоксамера с плацебо далее снижало cmt. Однако выше cmt, вязкость указанных образов повышалась приблизительно в 1,5-2 раза по сравнению с соответствующими не содержащими пропиленгликоль составами. Например, было выявлено, что при 37 С вязкость Polox-01-плацебо составляет приблизительно 1,2 П, в то время как было выявлено, соответствующий состав пропиленгликоля с плацебо (Polox-pg-01-плацебо) обладает вязкостью 2,4 П. Таким образом, может оказаться, что добавление пропиленгликоля повышает вязкость выше значения cmt, однако истинное значение cmt снижается. В табл. 31 представлены обобщенные значения cmt и вязкости при 37 С для всех составов.
МПК / Метки
МПК: A61K 31/22, A61P 35/00, A61K 9/00, A61K 47/00, A61K 36/47
Метки: профилактики, композиция, местного, кожи, рака, лечения, введения
Код ссылки
<a href="https://eas.patents.su/30-24152-kompoziciya-dlya-mestnogo-vvedeniya-dlya-lecheniya-ili-profilaktiki-raka-kozhi.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция для местного введения для лечения или профилактики рака кожи</a>
Предыдущий патент: Анододержатель цельнолитой для электролизеров производства алюминия
Следующий патент: Растягиваемый и сжимаемый шланг
Случайный патент: Муфта для соединения силовых кабелей напряжением до 10 кв