Очистка нейротрофинов
Номер патента: 2349
Опубликовано: 25.04.2002
Авторы: Бек Джоан Т., Шмельцер Чарлес Х., Бэртон Луис Е.
Формула / Реферат
1. Способ выделения нейротрофина из смеси, содержащей варианты данного нейротрофина, которая может включать ошибочно упорядоченный вариант, неправильно протеолитически процессированный вариант и гликозилированный вариант данного нейротрофина, включающий
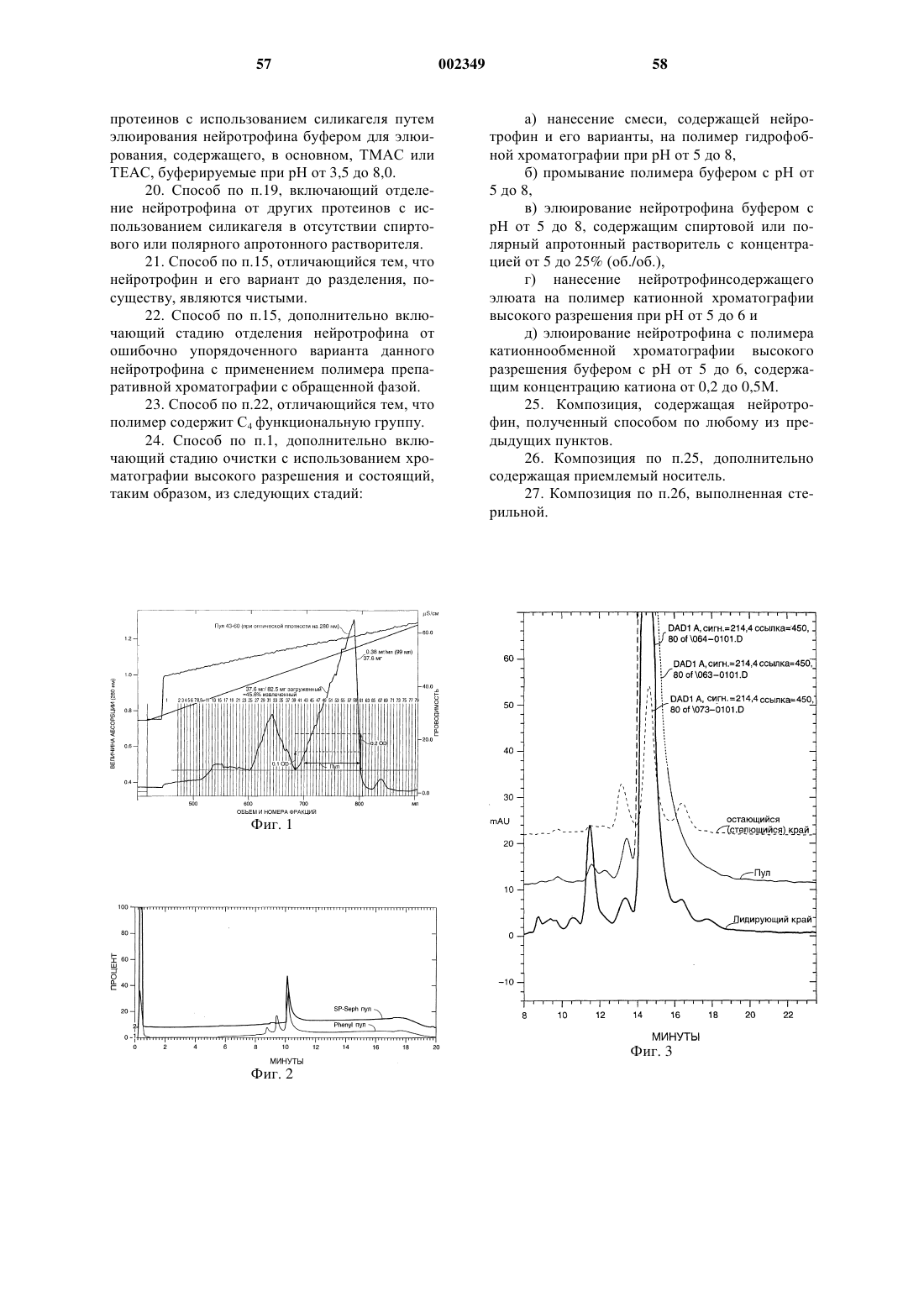
а) нанесение смеси на полимер гидрофобной хроматографии,
б) элюирование нейротрофина с полимера буфером для элюирования в условиях, при которых нейротрофин отделяется от варианта, и
с) сбор нейротрофина.
2. Способ по п.1, отличающийся тем, что полимер содержит фенильную функциональную группу.
3. Способ по п.1, отличающийся тем, что смесь, нанесенная на полимер гидрофобной хроматографии, имеет рН от 5 до 8.
4. Способ по п.1, отличающийся тем, что смесь, нанесенная на полимер, имеет концентрацию соли от 0,5 до 3М.
5. Способ по п.4, отличающийся тем, что смесь, нанесенная на полимер, имеет концентрацию соли от 0,5 до 2,5М.
6. Способ по п.5, отличающийся тем, что смесь, нанесенная на полимер, имеет концентрацию соли 0,7М ацетата или от 1,0 до 2,5М NaCl.
7. Способ по п.1, отличающийся тем, что буфер для элюирования содержит органический растворитель.
8. Способ по п.7, отличающийся тем, что концентрация органического растворителя составляет от 5 до 20 об.%.
9. Способ по п.1, отличающийся тем, что рН буфера для элюирования составляет от 5 до 8.
10. Способ по п.1, отличающийся тем, что элюирование включает уменьшающийся градиент соли.
11. Способ по п.1, отличающийся тем, что нейротрофин относится к NGF-семейству.
12. Способ по п.11, отличающийся тем, что нейротрофин представляет собой NGF, NT-4/5 или NT-3.
13. Способ по п.1, отличающийся тем, что нейротрофин получают из бактериальной культуры и переупорядочивают in vitro с применением гидрофобного полимера.
14. Способ по п.1, отличающийся тем, что нейротрофин отделяют от культуры клеток млекопитающих.
15. Способ по п.1, дополнительно включающий стадию отделения нейротрофина от его вариантов с использованием полимера катионообменной хроматографии высокого разрешения.
16. Способ по п.15, отличающийся тем, что стадия отделения с помощью катионообменной хроматографии высокого разрешения включает нанесение смеси, содержащей нейротрофин и его варианты, на полимер катионообменной хроматографии высокого разрешения и элюирование нейротрофина с полимера в условиях, при которых нейротрофин отделяется от вариантов, при этом нейротрофин имеет высокую pI.
17. Способ по п.16, отличающийся тем, что катионообменным полимером высокого разрешения является SP-сефароза HP, полиаспарагиновая кислота, полисульфоэтилкатионообменный или Fractogel EMD S03 полимер.
18. Способ по п.16, отличающийся тем, что нейротрофинсодержащий элюат от катионообменного полимера высокого разрешения обессоливают или подвергают диафильтрации и далее используют с носителем для получения композиции.
19. Способ по п.1, дополнительно включающий отделение нейротрофина от других протеинов с использованием силикагеля путем элюирования нейротрофина буфером для элюирования, содержащего, в основном, ТМАС или ТЕАС, буферируемые при рН от 3,5 до 8,0.
20. Способ по п.19, включающий отделение нейротрофина от других протеинов с использованием силикагеля в отсутствии спиртового или полярного апротонного растворителя.
21. Способ по п.15, отличающийся тем, что нейротрофин и его вариант до разделения, по-существу, являются чистыми.
22. Способ по п.15, дополнительно включающий стадию отделения нейротрофина от ошибочно упорядоченного варианта данного нейротрофина с применением полимера препаративной хроматографии с обращенной фазой.
23. Способ по п.22, отличающийся тем, что полимер содержит С4 функциональную группу.
24. Способ по п.1, дополнительно включающий стадию очистки с использованием хроматографии высокого разрешения и состоящий, таким образом, из следующих стадий:
а) нанесение смеси, содержащей нейротрофин и его варианты, на полимер гидрофобной хроматографии при рН от 5 до 8,
б) промывание полимера буфером с рН от 5 до 8,
в) элюирование нейротрофина буфером с рН от 5 до 8, содержащим спиртовой или полярный апротонный растворитель с концентрацией от 5 до 25% (об./об.),
г) нанесение нейротрофинсодержащего элюата на полимер катионной хроматографии высокого разрешения при рН от 5 до 6 и
д) элюирование нейротрофина с полимера катионнообменной хроматографии высокого разрешения буфером с рН от 5 до 6, содержащим концентрацию катиона от 0,2 до 0,5М.
25. Композиция, содержащая нейротрофин, полученный способом по любому из предыдущих пунктов.
26. Композиция по п.25, дополнительно содержащая приемлемый носитель.
27. Композиция по п.26, выполненная стерильной.
Текст
1 Область изобретения Изобретение относится к улучшенному способу очистки нейротрофинов, особенно нейротрофинов NGF-семейства, в частности фактора роста нервной ткани (nerve growth factor,NGF), нейротрофина-4/5 (neurotrophin-4/5, NT4/5) и нейротрофина-3 (neurotrophin-3, NT-3) от других нейротрофинов, и связанных с ними примесей и загрязнений (контаминантов), особенно, когда нейротрофины продуцируются ферментацией бактериальными клетками или клетками млекопитающих. Предпосылки изобретения Продуцирование больших количеств относительно чистых, биологически активных полипептидов и протеинов с экономической точки зрения является важным для производства фармацевтических композиций для человека и животных, ферментов и других специальных химических продуктов. Для продуцирования многих протеинов преимущественным способом стала генная инженерия, так как большие количества экзогенных протеинов могут экспрессироваться в клетках-хозяинах млекопитающих и бактерий, и в других клетках-хозяинах. Первичная структура NGF млекопитающих (NGF мыши) впервые изложена в работеAngeletti, Bradshaw. Proc. Natl. Acad. Sci. USA 68: 2417 (1971). Первичная структура его предшественника - пре-про-NGF установлена из нуклеотидной последовательности NGF к ДНК мыши (Scott et at., Nature 302: 538 (1983); Ullrichet al., Nature 303: 821 (1983. Также был идентифицирован гомологичный NGF ген человека (hNGF) (Ullrich, Symp. onQuan. Biol., Cold Spring Harbor 48: 435 (1983); патент США 5288622, опубликован 22 февраля,1994, который приведен в данном изобретении в виде ссылки). Его гомология по отношению кNGF мыши составляет около 90% и 87% от уровней аминокислотной последовательности и нуклеотидной последовательности, соответственно. Вследствие дефицита встречающегося в природе NGF, относящегося к человеку, он не был получен из природных источников в количествах, достаточных для детального биохимического описания. Позже были идентифицированы дополнительные нейротрофические факторы, относящиеся к NGF. Они включают нейротрофическии фактор, связанный с мозгом (brain-derived neurotrophic factor, BDNF) (Leibrock, et al., Nature,341: 149-152 (1989, нейротрофин-3 (NT-3)Rosenthal, et at., Neuron, 4:767 (1990 и нейротрофин 4/5 (NT-4/5) (Berkmeier, et al., Neuron, 7: 857-866 (1991. GDNF, отдаленный член TGFсуперсемейства, и неуртурин (neurturin, "NTN") являются двумя, недавно идентифицированными, структурно связанными мощными факторами продолжительного функционирования для 2 симпатических сенсорных нейронов и нейронов центральной нервной системы (Lin et al., Science 260: 1130-1132 (1993); Henderson et al., Science 266: 1062-1064 (1994); Buj-Bello et al., Neuron 15: 821-828 (1995); Kotzbauer et al., Nature 384:467-470(1996. Продуцирование химерного (рекомбинантного) протеина включает трансфектирование клеток-хозяина ДНК-той, кодирующей протеин, и культивирование клеток в условиях,способствующих экспрессии химерного протеина. Прокариотическая Е.соli является подходящим хозяином, поскольку может продуцировать химерные протеины с высокими выходами и низкой стоимостью. Существуют многочисленные патенты США по общей бактериальной экспрессии ДНК, кодирующей протеины, включая патент США 4565785 по рекомбинантной ДНК молекуле, включающей бактериальный ген внеклеточного или периплазменного белканосителя и небактериальный ген; патент США 4673641 по совместному продуцированию"чужеродного" полипептида с совокупностьобразующим полипептидом; патент США 4738921 по экспрессирующему вектору с trp промоторным оператором и trp LE слиянию с полипептидом, например, IGF-1; патент США 4795706 по экспрессирующим регулярным последовательностям для включения с "чужеродным" протеином; и патент США 4710473 по специфическим плазмидам кольцевой ДНК,например, кодирующих IGF-1. Биофармацевтические препараты, полученные генной инженерией, обычно очищают от кондиционированной среды (супернатанта),содержащей целый ряд разных контаминантов клеток-хозяина. В частности, сообщалось, чтоNGF очищали до той или иной степени с тем или другим успехом, используя разнообразные способы (см., например, Longo et al., IBROHandbook, vol. 12, pp. 3-30 (1989; U.S. Pat. 5082774, который описывает продуцирование СНО клеток NGF; Bruce, Heinrich (Neurobio.Aging 10: 89-94 (1989); Schmelzer et al., J. Neurochem 59: 1675-1683 (1992); Burton et al., J. Neurochem. 59: 1937-1945 (1992. Данные попытки осуществлены, главным образом, в масштабах лаборатории. Однако препаративное выделение рекомбинантного NGF человека, приводящее к фармацевтической чистоте и высокому выходу,практически не содержащего других видов, ранее не рассматривалось. Соответственно, имеется потребность в эффективных процедурах для селективного разделения нейротрофинов, в частности, нейротрофинов NGF и NGF-семейства, от других нейротрофинов (вариантов) и молекул и от других полипептидов с высокой изоэлектрической точкой - pI. Способ очистки нейротрофинов в крупном масштабе, чтобы обеспечить в них потребность клиник, должен быть пригоден для 3 исходного материала от различных источников,включая ферментационную питательную среду,вызывающую лизис бактериальных клеток или клеток млекопитающих. Кроме того, поскольку в данном изобретении открыты ранее неизвестные, трудные для разделения виды нейротрофинов, например, NGF-виды (варианты), способы,представленные здесь особенно пригодны для обеспечения коммерческих количеств рекомбинантных нейротрофинов, включая нейротрофины NGF (rhNGF), rhNT-3 и rhNT-4/5 человека и подходящие мутанты их, полученные генной инженерией, которые практически не содержат ненужных видов нейротрофинов. Эти и другие цели изобретения будут ясны специалистам. Сущность изобретения В одном варианте изобретения предлагается способ очистки нейротрофина, особенно нейротрофина NGF-семейства, включая NGF, NT-3,NT-4/5 и BDNF, которые участвуют в распознавании с помощью высокогомологичного семейства рецепторов (trks), предпочтительно rhNGF,rNT-3, rhNT-4/5, rhBDNG или подходящих форм их, полученных генной инженерией, с применением гидрофобной хроматографии (hydrophobicinteraction chromatography, HIC). Ввиду открытия в данном изобретении некоторых непригодных видов (вариантов) нейротрофинов, являющихся результатом рекомбинантного продуцирования нейротрофина, как уже сообщалось,при применении НIС можно разделить химически отличающиеся или даже ошибочно упорядоченные формы нейротрофина от подходящего правильно упорядоченного интактного нейротрофина. Варианты, которые могут отделяться,являются вариантами, которые отличаются от зрелого, правильно упорядоченного нейротрофина по гидрофобности, включая частично процессированные последовательности предшественников, гликозилированные созревшие формы и предшественник-содержащие формы (когда присутствуют от эукариотической клеточной культуры) и ошибочно упорядоченные или частично упорядоченные варианты (обычно из бактериальной клеточной культуры, когда используют стадии упорядочения in vitro). Например, НIС особенно пригодна для удаления частично процессированных последовательностей предшественника NGF, гликозилированных видов NGF и предшественника (когда присутствуют от эукариотической клеточной культуры) и ошибочно упорядоченных или частично упорядоченных вариантов (обычно из бактериальной клеточной культуры, когда используют стадии упорядочения in vitro) из смесей зрелыхNGF. NGF имеет один N-связанный сайт гликозилирования при Asn45. В случае бактерийэкспрессирующего заново упорядоченногоrhNT-4/5, HIC разделяет правильно упорядоченные NT-4/5 и неправильно упорядоченные формы. Благодаря способу, описанному в данном изобретении, нейротрофин, в основном, не со 002349 4 держит других видов (вариантов). Для очистки нейротрофина предпочтительной функциональной группой для HIC полимера является фенильная группа, хотя могут применяться полимеры с октильной и бутильной группами. Особенно предпочтительные варианты включаютHIC полимеры - Phenyl Toyopearl, низкозамещенную фенилсефарозу быстрого пропускания(Phenyl Sepharose Fast Flow Low Substitution),TSK-Phenyl 5PW или похожие полимеры. В другом варианте предлагается способ очистки нейротрофина, особенно нейротрофинаNGF-семейства, предпочтительно rhNGF, rNT-3,rhNT-4/5 или их подходящие формы, полученные генной инженерией, с применением препаративной катионообменной хроматографии,которая разделяет зарядомодифицированные варианты, например окисленные, изоаспартатные и деамидированные формы от зрелого нейротрофина. Особенно предпочтительные варианты используют SP-сефарозу высокого разрешения (SP-Sepharose High Performance), Fractogel EMD S03 или полимер полиаспарагиновой кислоты, из которых PolyCAT А особенно предпочтителен. Наиболее предпочтительными для использования в крупном масштабе являются полимеры SP-Sepharose High Performance илиFractogel EMD S03. Еще в другом варианте изобретения используют и НIС и катионообменную хроматографию для получения композиции нужного нейротрофина, например, рекомбинантного зрелого NGF, предпочтительно NGF, относящегося к человеку, который практически гомогенен, т.е. практически не содержит и процессированных и заряженных видов (вариантов), например, ошибочно упорядоченных и химических вариантов и также практически свободен от протеинов. В одном варианте данного изобретения предлагается усовершенствованный способ разделения нейротрофинов, особенно нейротрофинов NGF-семейства, предпочтительно, рекомбинантных NGF, NT-3, NT-4/5 нейротрофинов,относящихся к человеку, и их подходящих форм, полученных генной инженерией, от родственных нежелательных вариантов, например,ферментационных, расщепляемых протеазой видов, гликозилированных вариантов, ошибочно упорядоченных видов, с помощью жидкостной хроматографии с обращенной фазой. Наиболее предпочтительный NGF представляет собой 120/120 или 118/118 гомодимерную форму. В соответствии со способом, описанным в данном изобретении, самым предпочтительным является нейротрофин, по существу, не содержащий других видов (вариантов). В другом варианте предлагается способ очистки нейротрофинов, особенно нейротрофинов NGF-семейства, от родственных вариантов с использованием условий элюирования, включающих физиологическое рН. 5 Еще в другом варианте предлагается способ очистки нейротрофина, который приводит к значительному улучшению его гомогенности. В другом варианте предлагается способ разделения нейротрофинов NGF-семейства от его вариантов, включающий: а) нанесение буфера, содержащего нейротрофин и его вариант при рН от 5 до 8, на гидрофобную хроматографическую колонку; б) промывку колонки; в) элюирование нейротрофина буфером с рН от 5 до 8; г) нанесение нейротрофинсодержащего элюата на катионообменную хроматографическую колонку при рН от -5 до 8; и д) элюирование нейротрофина из колонки буфером при градиенте концентрации соли при рН от 5 до 8, предпочтительно, с рН 6. Наиболее предпочтительным нейротрофином являетсяrhNGF. В одном варианте изобретения предлагается стадия хроматографирования на силикагеле,которая практически удаляет протеины клетокхозяина из фракции нейротрофина, которая,предпочтительно, является NGF-фракцией. В одном варианте изобретения предлагается стадия, в которой 120 аминокислотный NGF подвергается обработке трипсиноподобной протеазой для селективного отделения терминального RA дипептида от VRRA С-терминального с образованием 118 аминокислотного образца. Предпочтительной является колонка с иммобилизованным трипсином. Изобретение также относится к композиции нейротрофина и составу, полученному с помощью способа, изложенного в данном изобретении, а также к применению композиции и состава. Предлагается композиция нейротрофина, которая является практически гомогенной,т.е. практически не содержащей и процессированных и заряженных вариантов, например,ошибочно упорядоченных и химических вариантов, и также практически не содержащей протеина. Предпочтительно предлагаются следующие формы - зрелый NGF человека, зрелый NT3 человека или крысы и зрелый NT-4/5 человека. В предпочтительном варианте NGF является 120 формой, и более предпочтительно 118 формой и наиболее предпочтительно гомодимером, например, 118/118. Краткое описание чертежей Фиг. 1 изображает хроматограмму на SPSepharose HP. NGF-содержащую смесь от 12kL ферментации после HIC хроматографии наносили на колонку с SP-сефарозой высокого разрешения (SP-Sepharose High Perfomance) (размер колонки 1,0 х 35 см; объем слоя 25 omnifit(23 ms). Буфер В представлял собой 0,7 М NaCl,20 mM сукцинат, рН 6,0 (63 ms). Вначале колонка уравновешивалась буфером А. НIС пул из 6 345 мл при концентрации 24 мг/мл доводили до 25 mM сукцината, рН 6,0 (17 ms), 362 мл которого наносили с получением загрузки 3 мг/мл полимера; наносили 82,5 мг NGF. Скорость нанесения составляла 40 см/ч. NGF элюировали,применяя градиент буфера В от 30 до 80% (с 0,35 до 0,60 М NaCl; с 37 до 57 ms) с объемом,соответствующим 22 объемам колонки. Скорость элюирования составляла 60 см/ч. Представлена зависимость величины абсорбции (при 280 нм) от номеров фракций и объема элюирования, измеряемого в мл. Определяли и объединяли фракции, содержащие NGF. В данном случае фракции с 43 до 60 объединяли с получением 99 мл образца с концентрацией NGF - 0,38 мг/мл, выход составлял около 46%. На фиг. 2 представлен SP-NPR HPLC катионообменный (HPIEX) анализ пула на фенилсефарозе быстрого пропускания (Phenyl Sepharose Fast Flow) и SP-Sepharose HP пула. Хроматограммы для каждого случая на фиг. 2 обозначены. На фиг. 3 представлен С 4 RP-HPLC анализ выбранных фракций (основной пул, лидирующий край и отстающий (стелющийся) край пика основного пула) с помощью SP-Sepharose HP хроматографической стадии. Три сигнала перекрываются и каждый из них на фиг. 3 обозначен. Как видно, основной пик (содержащий зрелый NGF) отделяется от нескольких меньших пиков, которые содержат варианты NGFs. Фиг. 4 описывает последовательность пpeпpo-NGF (SEQ ID No: 1) человека. Приведенными на фиг. 4 являются первая аминокислота зрелого NGF (положение 1) и последняя аминокислота 120 NGF формы (положение 120). Предпочтительной аминокислотной последовательностью NGF является последовательность зрелой 118 формы (с положения 1 до 118). Также представленными являются варианты форм: зрелый 120 (с положения 1 до 120); зрелый 117(с положения 1 до 117), R120 (с положения 1 до 120); и сайты для другого ошибочного процессирования, которое происходит на N- и Сконцах, включая зрелые 114 (аминокислоты от 1 до 114), 115 (аминокислоты от 1 до 115) и 117(аминокислоты от 1 до 117) варианты. Основной ошибочно процессированный вариант, протеолитически ошибочно процессированный, имеетN-концевое расщепление между двумя аминокислотами R(-39) и S(-38) в про-последовательности NGF. Возможное инициированиеMet обозначено. Другие N-концевые варианты включают процессированные (усеченные) формы NGF, обладающие самым свойственным расщеплением между аминокислотами Н 8 и R9 и между R9 и G10. Фиг. 5 описывает аминокислотные последовательности нейротрофинов NGF (SEQ ID No: 2) человека; NGF (SEQ ID No: 3), BDNF (SEQ 7 указывают на гомологичные цистеинсодержащие области, включающие цистеин в качестве основного лейтмотива (De Young et al., ProteinSci. 5(8): 1554-66(1996. Фиг. 6 описывает хроматографию rhNT-4/5 на колонке DEAE - сефарозы быстрого пропускания (DEAE - Sepharose Fast Flow, DEFF). Хроматограмма, обозначенная "NT45DE1:1UV",представляет собой измерение УФ - абсорбции при 280 нм. Хроматограмма, обозначенная"NT45DE1:1Cond1" представляет собой измерение проводимости элюируемых фракций. Нейротрофинсодержащие фракции, которые объединены, обозначены горизонтальной стрелкой "Пул". Фиг. 7 описывает хроматографию rhNT-4/5 на колонке SP-сефарозы быстрого пропускания(SP-Sepharose Fast Flow). Хроматограмма, обозначенная "NT45SFFI:1UV", представляет собой измерение УФ-абсорбции при 280 нм. Хроматограмма, обозначенная "NT45SFF1:1Cond1" представляет собой измерение проводимости элюируемых фракций. Нейротрофинсодержащие фракции, которые объединены, обозначены горизонтальной стрелкой "Пул". Фиг. 8 описывает препаративную C4-RPHPLC хроматографию rhNT-4/5 в условиях,описанных в тексте. Контролировалась абсорбция при 280 нм. Нейротрофинсодержащие фракции, которые объединяли, обозначены горизонтальной стрелкой "Пул". Фиг. 9 представляет аналитическую HPLC хроматографию NT-4/5 образцов, контролируемых во время переупорядочения для указанного времени. Условия для колонки описаны в тексте. "NT-4/5 Std" указывает путь элюирования правильно упорядоченного, интактного NT-4/5,используемого в качестве стандарта. Путь, обозначенный "SSFF (0,5m)" описывает анализ NT4/5, элюируемый 0,5 М NaCl с колонки Sсефарозы быстрого пропускания (S-SepharoseFast Flow) до переупорядочения. Поскольку NT4/5 переупорядочивается, путь элюирования приближается к таковому для стандарта. Фиг. 10 описывает хроматограмму, демонстрирующую разделение интактного, правильно упорядоченного NT-4/5 и ошибочно упорядоченных вариантов на гидрофобной хроматографической колонке - Phenyl Toyopearl 650 М. Ошибочно упорядоченные варианты, которые менее, гидрофобны, чем правильно упорядоченный NT-4/5, элюируются беспрепятственно(первым), в то время как ошибочно упорядоченные варианты (пик В), которые являются более гидрофобными, элюируются при больших концентрациях органического растворителя, чем это требуется для элюирования правильно упорядоченного NT-4/5 (пик А). Фиг. 11 описывает путь элюирования NT4/5 и его вариантов с катионообменного полимера SP-сефарозы (SP-Sepharose). Контролировалась абсорбция при 280 нм. Пик А содержит 8 карбамилированные и усеченные (clipped) варианты, в то время как пик В содержит интактный,правильно упорядоченный NT-4/5. NT-4/5 содержащие фракции, которые объединялись,обозначены горизонтальной стрелкой "Пул". Фиг. 12 описывает типичную препаративную хроматографию rhNT-4/5 на polyCAT А полимере в условиях, описанных в тексте. На фиг. 13 представлен 16% SDS-PAGE анализ (Tris-глициновая система, предварительно отлитая от Novex, Inc., San Diego, CA) в восстановительных условиях для оценки чистоты и гомогенности образцов, взятых из указанных стадий способа очистки rhNT-4/5, описанного в тексте. Для обнаружения протеина гель окрашивали Coomassie-R250 (Andrews, Electrophoresis, Oxford University Press: New York, 1986). Полоса, обозначенная "DE Load" содержит образец PEI-смеси, которую наносили на колонкуPool" содержит образец из объединенных фракций, содержащих NT-4/5, элюируемых из колонки S-сефарозы быстрого пропускания (SSepharose Fast Flow) до переупорядочения: полоса "Refold Pool" содержит образец пула после завершения переупорядочения; полоса "С 4Pool" содержит образец объединенных фракций после препаративной С 4 RP-HPLC; и полоса"PolyCAT A Pool" содержит образец из объединенных NT-4/5 фракций из PolyCAT A HPLC колонки. На фиг. 14 представлена УФ-абсорбция фракций при хроматографировании смеси на Sсефарозе быстрого пропускания (S-SepharoseFlow),содержащей бактериальнопродуцированный сульфонилированный rhNT-3. На фиг. 15 представлена Macroprep High S катионообменная хроматография смеси, содержащей in vitro переупорядоченные формы rhNT3. Полимер поставлялся Biorad. Размеры колонки 9 х 9 см. 700 мл SSFF пул, содержащий переупорядоченный (после 36 ч переупорядочения),рН 6,8, наносили на Macroprep колонку при скорости потока около 310 мл/мин. Условия приведены в тексте. На фиг. 16 представлена хроматография на высокозамещенной фенилсефарозе быстрого пропускания (PhenylSepharose Fast Flow) (гидрофобная хроматография) очищенного от ошибочно упорядоченных вариантов с помощью катионообменной хроматографии переупорядоченного rhNT-3. Фиг. 17 описывает хроматографию высокого разрешения на SP-сефарозе высокого разрешения (SP-Sepharose High Performance) HICrhNT-3 пула. 9 Подробное описание изобретения Определения Термин "нейротрофин", используемый в данном изобретении, относится к нейротрофину, предпочтительно, к нейротрофину NGFсемейства, включая NGF, NT-3, NT-4/5 и BDNF,из любого вида, в том числе, относящегося к мышам, овце, свинье, лошади, птице и, предпочтительно, человеку, в форме нативной последовательности или в форме, полученной генной инженерией от любого источника - природного, синтетического или полученного рекомбинантным способом. Например, "NGF" относится к фактору роста нервной ткани, из любого вида, в том числе относящегося к мышам, быку,овце, свинье, лошади, птице и, предпочтительно, к человеку, в форме нативной последовательности или в форме, полученной генной инженерией, из любого источника - природного,синтетического или полученного рекомбинантным способом. Предпочтительно, если нейротрофин получен рекомбинантным способом. В предпочтительном способе нейротрофин клонировали, и его ДНК экспрессировала, например, в клетках млекопитающих, в бактериальных клетках. Способы и методы, разработанные в данном изобретении, могут также применяться кGDNF нейротрофинам и нейртурину. Предпочтительной при использовании для человека является нативная последовательность зрелого NGF человека, более предпочтительно 120 аминокислотная последовательность и даже более предпочтительной является 118 аминокислотная последовательность. Более предпочтительным является, когда данную нативную последовательность NGF продуцируют рекомбинантно. Предпочтительная аминокислотная последовательность для пре-про-NGF человека и зрелого NGF человека предлагается в патенте США 5288622, который специально приведен в данном изобретении в качестве ссылки. Предпочтительной формой является форма из 120 аминокислот без дополнительных посттрансляционных модификаций, а именно, гомодимерная форма (т.е. 120/120). Еще более предпочтительной является форма из 118 аминокислот без дополнительных посттрансляционных модификаций, особенно, гомодимер (т.е. 118/118). Термин "существенно чистый" означает степень чистоты всего нейротрофина, например,NGF, по отношению ко всему протеину, в котором, по крайней мере, 70% нейротрофина, более предпочтительно, по крайней мере, 80% и даже более предпочтительно увеличение содержания нейротрофина до, по крайней мере, 90, 95 или 99%. Особенно предпочтительна чистота 95%. Термин "по существу чистый" означает,что композиция является, по крайней мере, 90% чистоты или более чистой по нужному нейротрофину. Термин "практически не содержащий варианта нейротрофина" означает композицию, в 10 которой процентное содержание нужного вида нейротрофина ко всему нейротрофину (в том числе менее желаемый вид нейротрофина) составляет, по крайней мере, 70% требуемого вида нейротрофина, более предпочтительно, по крайней мере, 80% и даже более предпочтительно увеличение, по крайней мере, до 90, 93,95 или 99%. "Практически не содержащий" означает, что композиция содержит, по крайней мере, 90% или более необходимого нейротрофина. Особенно предпочтительным уровнем является, по крайней мере, 95% необходимого нейротрофина, например, правильно упорядоченного, интактного 118/118 rhNGF вида. Другими нежелательными видами или формами могут быть ошибочно процессированные формы или химические варианты, например, варианты с измененным зарядом, являющиеся результатом ферментации или способа очистки или всего вышеперечисленного. Например, когда NGF упорядочен in vitro после бактериального синтеза "виды" или "варианты" могут включать ошибочно упорядоченные или частично упорядоченные формы. Термин "ошибочно упорядоченный вариант" означает вариант нейротрофина, который отличается от нейротрофина спариванием его остатков цистеина или отдельными остатками цистеина, которые доступны или блокированы. Ошибочно упорядоченные варианты могут иметь также одинаковое с нейротрофином спаривание остатков цистеина, но отличаться трехмерной конформацией, являющейся следствием ошибочного упорядочения. Под "химическим" вариантом понимается вариант, который отличается от нейротрофина химически, например, имеющий измененный заряд или отличающийся карбамилированием,деамидированием, окислением, гликозилированием или протеолитическим расщеплением. Буферы, используемые в данном изобретении для колонки, обычно имеют рН в пределах от 5 до 8. Буферы, которые способны контролировать рН в данном пределе, включают, например, цитратный, сукцинатный, фосфатный,MES, ADA, BIS-TRIS Propane, PIPES, ACES,имидазольный, буфер на основе диэтилмалоновой кислоты, MOPS, MOPSO, TES, TRIS-буфер,например, TRIS-HCl, HEPES, HEPPS, TRICINE,глицинамидный, BICINE, глицилглициновый и боратный буферы. Предпочтительным является буфер MOPSO. Под употребляемым в данном изобретении термином "спирты" и "спиртовые растворители" понимают обычно применяемую терминологию для спирта, предпочтительно спирты с числом атомов углерода от 1 до 10, более предпочтительно - метанол, этанол, изопропанол, нпропанол или трет-бутанол, а также глицерин,пропиленгликоль, этиленгликоль, гексиленгликоль, полипропиленгликоль и полиэтиленгликоль и наиболее предпочтительно этиловый 11 спирт или изопропиловый спирт. Эти спирты являются растворителями, которые при добавлении к водному раствору увеличивают его гидрофобность при уменьшении полярности раствора.HEPES является N-2-гидроксиэтилпиперазинN'-2-этансульфокислотой. Реактивный спирт состоит из 95 объемных частей особо денатурированного спирта формулы 3 А и 5 объемных частей изопропилового спирта). MES представляет собой 2-(N-морфолино)этансульфокислоту.UF/DF означает ультрафильтрацию/диафильтрацию. ТМАС является тетраметиламмоний хлоридом. ТЕАС представляет собой тетраэтиламмоний хлорид. NGF-120 означает фактор роста нервной ткани с полной длиной 120/120. NGF118 означает молекулу гомодимерного зрелогоNGF из 118 остатков. Окисленный NGF означает разновидность молекулы NGF - Метсульфоксидзу, о котором в данном изобретении сообщается, что его биологическая активность составляет 80% от зрелого нативного NGF. "Isoasp"NGF означает изомеризованный вариант молекулы NGF, Asp93. Деамидированный NGF означает NGF, у которого Asn45 превращен в Asp45.RNGF означает NGF молекулу с дополнительным остатком аргинина на ее N-конце. СНО означает клетки яичника китайского хомячка. Полимеры, описанные в данном изобретении включают MACROPREP HIGH S катионообменную смолу (BIO-RAD Laboratories; сильная катионообменная смола с SО 3 функциональной группой; номинальный размер частицы 50 мк; номинальный размер пор 1000 А); силикагель (недериватизированный); низкозамещенную фенилсефарозу быстрого пропусканияToyopearl 650 М (TosoHaas; размер частиц 40-90 микрон); и Fractogel EMD SO3-650 S (ЕМ Separations, американский партнер Е.Меrсk (Германия); размер частиц 25-40 микрон). Способы осуществления изобретения Нейротрофины принадлежат к семейству малых щелочных (основных) протеинов, которые играют решающую роль в развитии и сохранении нервной системы. Первым идентифицированным и, вероятно, наиболее изученным представителем данного семейства является фактор роста нервной ткани (NGF). См. U.S. Pat.No. 5169762, issued December 8, 1992. За последнее время были идентифицированы являющиеся продолжением родственных, но отличные от них полипептиды с подобными NGF функциями. Например, относящийся к мозгу нейротрофический фактор (BDNF), называемый также нейротрофином-2 (NT2), клонировали и 12 секвенировали согласно Leibrock et al. (Nature,341: 49-152 (1989. Несколько групп, первоначально определяющих нейротрофический фактор, назывались нейронным фактором (neuronalfactor, NF) и в настоящее время называются нейротрофином-3 (NT3) (Ernfors et al., Proc.(называемый или NT4 или NT5) идентифицирован авторами в работе (Hallbook et al., Neuron, 6: 845-858 (1991); Berkmeier et al., Neuron 7: 857866 (1991); Ip et al., Proc. Natl. Acad. Sci. USA,89: 3060-3064 (1992). В патенте США (патент США 5364769, опубликован 15 ноября, 1994) описан NT-4/5 человека и способы его рекомбинантного экспрессирования, в данном изобретении этот патент приведен в качестве ссылки. Также сообщалось о химерных и пантропических нейротрофинах, например, о тех, которые описаны в американском патенте (патент США 5488099, опубликован 30 января, 1966), в работе(Urfer et al., EMBO J. 13(24): 5896-5909 (1994), и в международной заявке WO 95/33829, опубликованной 14 декабря 1995 г. (приведенной в качестве ссылки), в которых нейротрофин был модифицирован для связывания более одного рецептора или содержал рецепторсвязывающую активность, обычно в значительной степени не присутствующую в нативном нейротрофине. Особый интерес представляют нейротрофины,названные MNTS-1 и D15A NT3. Также особый интерес представляют нейротрофины, имеющие аминокислотный остов NGF, но модифицированные для связывания рецепторов, отличных от trkA, например, trkB или trkC. Предпочтительны те, в которых замещения аминокислот вNGF осуществлены аминокислотой из соответствующего положения в NT-3, которое ответственно за связывание trk рецептора NT-3. ТакиеNGF мутанты имеют подобную NT-3 рецепторсвязывающую активность, сохраняя в то же время фармакокинетическое поведение и способ очистки NGF (Urfer, et al., Biochemistry 36 (16): 4775-4781 (1997. У данных NGF мутантов может также отсутствовать trkA связывающая активность (Shin, et al., J. Biol. Chem. 269 (44): 27679-86 (1994. Такие NGF мутанты являются особенно предпочтительными нейротрофинами для описанного в данном изобретении применения. Выделение рекомбинантного нейротрофина человека, например, rhNGF, включает отделение протеина от целого ряда разнообразных контаминантов клеток-хозяина. Каждая стадия включает специальные буферные растворы, которые позволяют осуществить достаточное разделение. Конечная или предпоследняя стадия обработки для нейротрофина осложняется при 13 сутствием нескольких вариантов нейротрофина,которые подвергаются совместной очистке при использовании стандартной хроматографической процедуры. Если в способ выделения и очистки включена стадия переупорядочения, то варианты включают ошибочно упорядоченные формы нейротрофина. Варианты также могут включать химически отличающиеся от нейротрофина варианты, например, карбамилированные, деамидированные формы или протеолитически расщепленные формы. В случае NGF данные разновидности содержат, главным образом, димерные формы - гомодимеры, например,120/120 или 117/117, если требуется 118/118 или гетеродимеры, например, 120/118, 117/118, химически модифицированные варианты изоаспартатные, моноокисленные, гликозилированные варианты, N-концевые и С-концевые процессированне формы и их димеры. Изобретение делает возможным продуцирование нейротрофинов, особенно, rhNGF, в больших количествах, достаточных для терапевтического применения, например, лечения болезни Альцгеймера, периферических нейропатий, включая диабетическую и связанную со СПИДом нейропатии и др. Ввиду сходства последовательности и конформации NGF и других нейротрофинов,особенно нейротрофинов NGF-семейства, способы, описанные в данном изобретении, могут применяться для получения данных нейротрофинов, практически не содержащих ошибочно процессированных, ошибочно упорядоченных или частично упорядоченных, гликозилированных и/или заряженных варантов. В данном изобретении предложены полимеры для колонок и условия, которые удобны для селективного разделения нейротрофинов от этих и других близких вариантов. Нейротрофины включают NT-3,NT-4/5, NT-6, BDNF и формы, полученные генной инженерией, включая гетеродимерные, химерные или пантропические формы его. Предпочтительными являются нейротрофины человека или нейротрофины с близко гомологичной человеку аминокислотной последовательностью, предпочтительно, если эта гомологичность составляет более 80%, более предпочтительно - более 90% и наиболее предпочтительно - более 95% от последовательности, относящейся к человеку. Полученный генной инженерией нейротрофин должен сохранять, по крайней мере, 50% trk-рецепторсвязывающей функции нативного нейротрофина, предпочтительно, по крайней мере, 75% и более предпочтительно, по крайней мере, 80%. Данные формы, полученные генной инженерией, сохраняют достаточно высокую рI или гидрофобный характер нативного нейротрофина, чтобы гарантировать аналогичное выполнение способов,описанных в данном изобретении. Способы, описанные в данном изобретении, как это будет видно ниже, успешно были 14 применены к rhNGF, rhNT-3 и rhNT-4/5. Например, rhNT-4/5, который произведен в E.coli, изолировали во внутриклеточных тельцах и восстанавливали и солюбилизировали из внутриклеточных телец. Восстановленный NT-4/5 частично очищали хроматографией на DE-сефарозе быстрого пропускания (DE-Sepharose Fast Flow) и на S-сефарозе быстрого пропускания (SSepharose Fast Flow). Пул от S-сефарозы быстрого пропускания переупорядочивали в гуанидинсодержащем буфере в течение 24 ч. Ошибочно упорядоченные формы NT-4/5 удаляли с помощью хроматографии, как описано в данном изобретении для больших количеств. Большие количества карбамилированных и усеченных(ошибочно процессированных форм) NT-4/5 удаляли с помощью катионообменной хроматографии высокого разрешения на колонке сPolyCat A HPLC или SP-сефарозой HP. Для приготовления композиции очищенный rhNT-4/5 подвергали ультрафильтрации и диафильтрации в кислый буфер. Один вариант изобретения включает очистку нейротрофина от его родственных вариантов, обычно после того, как нейротрофин уже был очищен от большинства других примесей,как правило, на последней или близкой к последней стадии до обессоливания или диафильтрации, предшествующей получению композиции. Смесь родственных вариантов может включать не только варианты остаточных продуктов ферментации, но также продуцированные варианты, если нейротрофин разрушается при хранении или во время процессирования. Нейротрофины, пригодные для применения, могут быть получены любыми способами,но предпочтителен рекомбинантный метод. Молекула нуклеиновой кислоты, кодирующая нейротрофины, рассматриваемая в данном изобретении, пригодна из различных источников, например, полученная с помощью химического синтеза с использованием известной ДНКпоследовательности или стандартной методики клонирования, известной специалистам. кДНК клоны, содержащие нейротрофин, например,hNGF-кодирующую последовательность, могут быть идентифицированы с применением олигонуклеотидных зондов гибридизации, специально созданных на основе известной последовательности нейротрофина. До получения молекулы, имеющей нейротрофин-кодирующую последовательность, молекула вставлялась в клонирующий вектор,подходящий для экспрессии в выбранных клетках-хозяина. Кодирующий вектор создавали так,чтобы обеспечить подходящие регуляторные функции, необходимые для эффективной транскрипции, трансляции и процессинга кодирующей последовательности. Если нейротрофин получен рекомбинантным способом, подходящими клетками хозяина для экспрессии ДНК, кодирующей нейротро 15 фин, являются прокариотические, дрожжевые или высшие эукариотические клетки. Подходящие прокариоты для данных целей включают бактерии, такие как архебактерии и эубактерии. Предпочтительными бактериями являются эубактерии, такие как грамотрицательные и грамположительные организмы, например, Enterobacteriaaceae, такие как Escherichia, например,E.coli, Enterobacter, Erwinia, Klebsiella, Proteus,Salmonella, например, Salmonella typhimurium,Serratia, например, Serratia marcescans и Shigella;E.coli W3110 (АТСС 27325), E.coli 94 (АТСС 31446), E.coli В и Е.соli Х 1776 (АТСС 31537). Данные примеры являются иллюстративными, а не ограничивающими. Полностью приведенной в данном изобретении является заявка РСТ WО 95/30686, опубликованная 16 ноября 1995. В заявке подробно описывается бактериальный синтез и способ упорядочения NGF in vitro. Продукты, полученные данным способом, могут подвергаться описанным в данном изобретении методам очистки. Также могут применяться мутантные клетки любых вышеупомянутых бактерий. Конечно,необходимо отбирать подходящие бактерии,принимая во внимание способность репликации репликона в клетках бактерий. Например, разновидности E.coli, Serratia или Salmonella могут соответствующим образом использоваться в качестве хозяина, когда применяются известные плазмиды, такие как pBR322, pBR325,pACYA177 или pkN410 для поставки репликона. Е.coli штамм W3110 является предпочтительным хозяином или предшественником (родителем) хозяина, так как он является обычным штаммом-хозяином для ферментации продукта рекомбинантной ДНК. Предпочтительно, когда клетка-хозяин выделяет минимальные количества протеолитических ферментов. Например,штамм W3110 может быть модифицирован,чтобы оказывать воздействие на генетическую мутацию в генах, кодирующих протеины, эндогенные к хозяину, с примерами таких хозяинов,включающих Е.coli W3110 штамм 1 А 2, который имеет полный генотип tоnА ; E.coli W3110 штамм 9 Е 4, который имеет полный генотипtonAрtr3; E.coli W3110 штамм 27 С 7 (АТСС 55244), который имеет полный генотип tonAompTkanr; E.coli W3110 штамм 37D6, который имеет полный генотип tonA ptr3 phoAЕ 15(argF-lac)169degPоmрТ rbs7 ilvGkan r; E.coli W3110, штамм 40 В 4, который является штаммом 37D6 с неканамициновой резистентной degP мутацией делеции, и E.coli 16 штамм, содержащий мутантную периплазмическую протеазу, описанную в U.S. Patent4946783 issued August 7, 1990.hNGF, и его экспрессия в качестве гетерологичного протеина в E.coli описана в U.S. Pat.5288622. Проведенные исследования также пригодны для того, чтобы дать возможность клеткам млекопитающих продуцировать зрелыйNGF, принадлежащий человеку. При использовании генной инженерии экпрессировался NGF, принадлежащий человеку, не содержащий других протеинов млекопитающих. ЭкспрессияhNGF в Е.соli при использовании двух генов,которые содержат измененные аминокислотные концевые остатки, приводит к экспрессии слитого протеина, который описан в Iwai et al.,Chem. Pharm. Bull. 34: 4724 (1986). Кроме того прокариоты, эукариотические микробы, такие как нитчатые грибы или дрожжи, являются подходящими хозяинами экспрессии для нейротрофин-кодирующих векторов. Среди низших эукариотических микроорганизмов хозяина наиболее часто используют Saccharomyces cerevisiae или обычные пекарские дрожжи. Однако обычно доступны и пригодны ряд других видов, разновидностей и штаммов,например, Schizosaccharomyces pombe (Beach,Nurse, Nature, 290: 140 (1981); ЕР 139383 published May 2, 1985), Kluyveromyces хозяины(Kelly, Hynes, EMBO J., 4: 475-479 (1985. Подходящие клетки-хозяина, пригодные для экспрессии ДНК, кодирующей нейротрофин, могут также происходить от многоклеточных организмов. Такие клетки-хозяина способны к сложной процессированной и гликозили 17 рованной активностям. По существу, пригодна любая высшая эукариотическая клеточная культура из позвоночной или беспозвоночной культуры. Примеры беспозвоночных клеток включают клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие рекомендуемые клетки-хозяины насекомых из хозяинов, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes afbopictusBombyx mori (см. Luckow et al., Bio/Technology,6: 47-55 (1988); Miller et al., in Genetic Engineering, Setlow, J.K. et al., eds., Vol. 8 (Plenum Publishing, 1986), pp. 277-279; и Maeda et al., Nature,315: 592-594 (1985. Публично доступен целый ряд вирусных штаммов для трансфекции, например, L-1 вариант Autographa californica NPV и Bm-5 штамм Bombyx mori NPV, и такие вирусы могут использоваться в данном изобретении,особенно для трансфекции клеток Spodopterafrugiperda. NGF, принадлежащий человеку, был продуцирован в клетках насекомых, о чем сообщалось в патенте США 5272063, опубликован 21 декабря, 1993. В качестве хозяинов могут использоваться растительные клеточные культуры хлопка, кукурузы, картофеля, сои, петунии, томата и табака. Обычно растительные клетки трансфектируют при инкубировании с определенными штаммами бактерий Agrobacterium tumefaciens,на которые предварительно воздействовали,чтобы содержали ДНК, кодирующую нейротрофин. Во время инкубирования растительной клеточной культуры с A. tumefaciens, ДНК, кодирующая нейротрофин, переносится в клеткухозяина растения так, что она трансфектирует, и при определенных условиях будет экспрессировать ДНК, кодирующую нейротрофин. Кроме того, доступны (пригодны) регуляторная и сигнальная последовательности, совместимые с растительными клетками, такие как последовательность промотора нопалинсинтетазы и сигнальная последовательность полииаденилирования (Depicker et al., J. Mol. Appl. Gen., 1: 561(1982. Кроме того, ДНК сегменты, отделенные от области в 3'-5' направлении Т-ДНК 780 гена,способны активировать или увеличивать уровни транскрипции способных экпрессировать растения генов в рекомбинантной ДНК-содержащей растительной ткани (ЕР 321196 published June,1989). Примерами пригодных линий клетокхозяна млекопитающих являются CVI линия почки обезьяны, трансформированная SV40(COS-7, ATCC CRL 1651); линия эмбриональной почки человека (293 или 293 клетки, субклонированные для роста в суспендированной культуре, Graham et al., J. Gen. Virol., 36:59(1977; клетки почки детеныша хомячка (ВНК,ATCC CCL 10); клетки DHFR яичника китайского хомячка (СНО, Urlaub, Chasin, Proc Natl.Acad. Sci. USA, 77: 4216 (1980; клетки Сертоли мыши (ТМ 4, Mather. Вiol. Reprod., 23: 243251 (1980; клетки почки обезьяны (CVI, ATCCCCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA,ATCC CCL 2); клетки почки собаки (MDCK,ATCC CCL 34); клетки печени буйвольной крысы (BRL 3 А, АТСС CRL 1442); клетки легкого человека (W 138, АТСС CCL 75), клетки печени человека (Нер G2, НВ 8065); опухоль молочной железы мыши (ММТ 060562, АТСС CCL51);TRI клетки (Mather et al., Annals N.Y. Acad. Sci.,383: 44-68 (1982; MRC 5 клетки; FS4 клетки; и линия гепатомы человека (Нер G2). Предпочтительным методом является экспрессия в СНО клетки. Экзон NGF, принадлежащего человеку,содержащий препро-NGF, можно использовать для достижения экспрессии секретируемого зрелого NGF (включая 118 и 120 формы), используя подходящие промоторы и вектора (патент США 5288622). Пригодны, описанные в примерах изобретения, культуры стабильных СНО клеток, стабильно трансфектированных и секретирующих зрелые формы NGF. Клетки-хозяины трансфектировали и,предпочтительно, трансформировали вышеописанными экспрессирующими или клонирующими векторами и культивировали в обычной(стандартной) питательной среде, модифицированной надлежащим образом для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности. Трансфекция относится к поглощению экспрессирующего вектора клеткой-хозяином независимо от того, экспрессируются ли в действительности какие-либо кодирующие последовательности. Специалистам известны многочисленные способы трансфекции, например, СаРО 4 и электропорация. Удачная трансфекция обычно распознается, если какое-либо указание действия данного вектора происходит в клетке-хозяине. Трансформация означает введение ДНК в организм с тем, чтобы ДНК стала способной реплицировать или как внехромосомный элемент или хромосомной составной частью. В зависимости от используемой клетки-хозяина трансформацию выполняют с применением стандартных методик, пригодных для таких клеток. Кальциевая обработка, использующая хлорид кальция, как описано в разделе 1.82 монографии Sambrook et al., Molecular Cloning: ALaboratory Manual (New York, Cold Spring Harbor Laboratory Press, 1989), или электропорация обычно применяются для прокариотов или других клеток, которые содержат значительные барьеры клеточной оболочки. Для трансформации некоторых клеток растений используют инфекцию (заражение) Agrobacterium tumefaciens, как описано в работе Shaw et al., Gene 23: 315 (1983) и в заявке WO 89/05859, опублико 19 ванной 29 июня 1989. Кроме того, растения могут трансформироваться под влиянием ультразвука, как описано в WO 91/00358, опубликованной 10 января 1991. Для клеток млекопитающих без таких клеточных оболочек предпочтителен метод осаждения фосфата кальция, описанный в работеGraham, van der Eb, Virology, 52: 456-457 (1978). Общие аспекты систем трансформации клеткихозяина млекопитающих описаны Axel в патенте США 4399216, опубликован 16 августа, 1983. Трансформации в дрожжах обычно проводят по методу Van Solingen et al., J. Bact, 130: 946(1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA),76: 3829 (1979). Однако могут использоваться также и другие методы для введения ДНК в клетки, например, такие как нуклеарная микроинъекция, электропорация, слияние бактериального протопласта с интактными клетками или поликатионами, например, полибрином, полиорнитином и.т.д. По различным методикам трансформирования клеток млекопитающих см.Keown et al Methods in Enzymology (1990) Vol. 185, pp. 527-537, и Mansour et al., Nature, 336: 348-352 (1988). Предпочтительно, если ген для hNGF вставляется в вектор с тем, чтобы получить доступный метионин-инициирующий кодон, предпочтительно один из двух метионининициирующих кодонов, как определено в работе Ullrich et al., Nature 303: 821-825 (1983).Symposia on Quant. Biol. XLVIII, p. 435 (1983); патент США 5288622) имеет два практически по-соседству расположенных остатков метионина, которые, вероятно, должны использоваться в качестве трансляционных инициирующих кодонов (положение 1 относится к N-концевому остатку серина зрелого hNGF). Наоборот, кДНК субмаксиллярной (подчелюстной) железы мыши для NGF, наиболее тщательно изученные факторы роста нервной ткани, имеют метионин в положении - 187 в дополнении к остаткам метионина в положениях -121 и -119. В предпочтительном варианте для экспрессии в клетках млекопитающих имеется препро-NGF последовательность. Если для продуцирования нейротрофина используются прокариотические клетки, они культивируются в подходящей среде, в которой промотор может конструктивно или искусственно индуцироваться, как описано в общем,например, в монографии Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold SpringHarbor Laboratory Press, New York 1989). Любые необходимые конглютинины (добавки), кроме источников углерода, азота и неорганического фосфата, также могут включаться в соответствующих концентрациях, вводиться одни или в виде смеси с другим конглютинином или средой, например, источником комплексносвязанного азота. 20 Если для продуцирования нейротрофина используются клетки-хозяины млекопитающих,они могут культивироваться в целом ряде сред. Для культивирования клеток-хозяинов пригодны коммерчески доступные среды, такие как,Ham's F10 (Sigma), минимальная поддерживающая среда (Minimal Essential Medium, MEM,Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (Dulbecco's Modified Eagle's Medium, DMEM, Sigma). Кроме того, любая среда, описанная в обзорах,работах, патентах и заявках, (Ham, Wallace,Meth. Enz., 58: 44 (1979); Barnes, Sato, Anal. Biochem., 102: 255 (1980); патенты США 4767704; 4657866; 4927762; 5122469; или 4560655; международные заявки WO 90/03430;WO 87/00195; или патент США . Re. 30985,которые приведены в данном изобретении в виде ссылок, может использоваться в качестве культуральной среды для клеток-хозяинов. Любые из этих сред могут дополняться при необходимости гормонами и/или другими факторами роста (например, инсулином, трансферрином или эпидермальным фактором роста), солями(такими, как хлористый натрий, кальций, магний и фосфат), буферами (например, HEPES),нуклеозидами (такими как, аденозин и тимидин), антибиотиками (например, препаратом гентамицин - Gentamycin ТМ), микроэлементами (определенными как неорганические соединения обычно присутствующие в конечных концентрациях на микромолярном уровне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые конглютинины(добавки) также могут включаться в соответствующих концентрациях, которые известны специалистам. Условия культивирования, например, температура, рН и другие, являются условиями, ранее используемыми для клеткихозяина, выбранной для экспрессии, и будут ясны специалистам. Обычно, о принципах, схемах и практических методиках для доведения до максимума продуктивности клеточных культур млекопитающих in vitro можно найти в Mammalian CellBiotechnology: A Practical Approach, M. Butler,ed. (IRL Press at Oxford University Press, Oxford,1991). Вышеупомянутый способ можно применять независимо от того, продуцируется ли нейротрофин внутриклеточно, продуцируется ли в периплазмическом пространстве или непосредственно секретируется в среду. Обычно культуральную жидкость собирают после соответствующего периода и выполняют стандартные идентификационные анализы, например, иммуноанализ, такой как ELISA(Greene, L.A. Trends Neurosci., 7: 91 (1986. Анализы для определения типа и размера варианов, описанных в данном изобретении, из 21 вестны или приведены, или упомянуты в примерах (см. например, Schmelzer et at., J Neurochem. 59(5): 1675-83 (1992) и Burton et al., J.Neurochem. 59(5): 1937-45(1992). Композицию нейротрофина, полученную из клеток, предпочтительно, подвергают, по крайней мере, одной стадии очистки, предшествующей HIC. Примеры соответствующих стадий очистки включают стадии, которые описаны в данном изобретении, в том числе аффинную хроматографию, другие способы очистки протеинов, такие как хроматографию на силикагеле, хроматографию на гепарин-сефарозе, хроматографии на амино- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование и препаративную SDS-PAGE, в зависимости от выделяемого нейротрофина и используемой исходной культуры. В одном варианте, где нейротрофин непосредственно секретирует в среду, среду отделяют от клеточного дебриса центрифугированием и осветленный ферментационный бульон или среду затем используют для очистки на силикагеле. В случае хроматографии на силикагеле,бульон обычно пропускают через недериватизированные частицы силикагеля так, что полипептид нейротрофина подвергается адгезии на частицах силикагеля; частицы силикагеля промывают для удаления контаминантов; и полипептид элюируют с поверхности частиц силикагеля буфером, содержащим спиртовый растворитель или полярный апротонный растворитель и соль щелочно-земельного, щелочного металла или неорганической соли аммония. В предпочтительном варианте изобретения для отделения нейротрофина от его вариантов, а также для уменьшения количества контаминантов, применяют Macroprep High S катионообменную хроматографию. Данный полимер может применяться на предварительной стадии очистки нейротрофина от культуры клеток млекопитающих, предпочтительно, для фракционирования (разделения) собранной клеточной культуральной среды. В другом варианте Масrорrер High S катионообменную хроматографию наиболее предпочтительно использовать непосредственно после стадии переупорядочения протеина. Очень высокая способность пропускания жидкости данной катионообменной колонки позволяет большому объему разбавленного заново упорядоченного раствора протеина или собранной клеточной культуральной среды нейротрофина легко концентрироваться перед последующими хроматографическими стадиями, например, НIС или на SP-сефарозе,путем регулирования условий с тем, чтобы нейротрофины связывались на колонке. Кроме того,катионообменная природа смолы позволяет удалять несвязанные массы протеинов и некоторых ошибочно процессированных и химически модифицированных вариантов (например, 002349 22 измененный заряд, МЕТ 37-окисленный вариант). Наиболее важно, когда присутствуют ошибочно упорядоченные или химически модифицированные варианты (например, ошибочно процессированные варианты, гликозилированный вариант (как при продуцировании культуры клеток млекопитающих, которые отличаются по гидрофобности от нативного нейротрофина; Масrорrер полимер позволяет, по крайней мере,частично удалить эти гидрофобные варианты,существенно обогащая нативным нейротрофином, как описано в данном изобретении. Ясно,что главная цепь полимера содержит гидрофобные группы, которые промотируют неспецифические взаимодействия между нейротрофинами и полимером, что дает преимущество, как показано в данном изобретении. Обычно для элюирования пригоден буфер с рН от 5 до 8, более предпочтительно от 6 до 8 и концентрацией ТМАС от 0 до 3 М. Ацетат натрия, когда присутствует для увеличения ионной силы буфера для элюирования, позволяет использовать более низкую концентрацию ТМАС. Предпочтительно хлорид ион заменить на ион ацетата. В одном примере варианта, где нейротрофин продуцируют в периплазмическом пространстве, культуральную среду или лизат центрифугируют для удаления частиц клеточного дебриса. Мембрана и фракции растворимого протеина могут при необходимости разделяться. Нейротрофин может далее очищаться от фракции растворимого протеина и от мембранной фракции культурального лизата в зависимости от того, является ли нейротрофин мембраносвязанным, растворимым или присутствует в агрегированной форме. Нейротрофин впоследствии солюбилизируют и далее переупорядочивают с применением соответствующего буфера. Детали данного метода отделения от периплазмы для продуцирования переупорядоченного протеина описываются ниже. Нерастворимый ненативный нейротрофин изолируют от прокариотических клетокхозяинов в пригодном для отделения буфере любым подходящим способом, например,включающим выдерживание клеток в буфере соответствующей ионной силы для солюбилизации большинства протеинов хозяина, но в которых агрегированный нейротрофин практически нерастворим, и разрушение клеток с тем,чтобы выделить внутриклеточные тельца и осуществить удачное выделение, например,центрифугированием. Данный способ хорошо известен и описан, например, в патенте США N 4511503. Если кратко, клетки суспендируют в буфере (обычно при рН от 5 до 9, предпочтительно,от 6 до 8, при ионной силе от 0,01 до 2 М,предпочтительно, от 0,1 до 0,2 М). Для поддержания достаточной величины ионной силы пригодна любая соль, включая хлористый натрий. Клетки, суспендированные в данном буфере, 23 далее разрушались лизисом с использованием обычно применяемых технических приемов,например, механических методов, таких как например, "Manton-Gaulin" пресс-микрофлюидизатор, "French" пресс или ультразвуковой осциллятор, или с помощью химических или ферментативных способов. Примеры химических или ферментативных способов разрушения клеток включают сферопластирование, которое влечет за собой использование лизозима для разрушения стенок бактерий (Neu et al., Biochem. Biophys. Res.Comm., 17: 215 (1964 и осмотический шок,который включает обработку жизнеспособных клеток раствором высокой тоничности (концентрации) и промывку холодной водой низкой тоничности для высвобождения полипептидов(Neu et al., J Biol. Chem., 240: 3685-3692 (1965. Третий метод, описанный в патенте США 4680262, включает контактирование трансформированных клеток бактерий с эффективным количеством низших спиртов, содержащих от 2 до 4 атомов углерода, в течение времени и при температуре, достаточных чтобы вызвать киллинг и лизис клеток. После разрушения клеток суспензию обычно центрифугируют для осаждения внутриклеточных телец (включений). В одном варианте изобретения данную стадию проводят приот 500 до 15000 хg, предпочтительно около 12000 хg в стандартной центрифуге, в течение достаточного времени, которое зависит от объема и конструкции центрифуги, как правило от 10 мин до 0,5 ч. Полученный после центрифугирования осадок содержит практически все фракции нерастворимого полипептида, но если процесс разрушения клеток не завершен, осадок может также содержать интактные клетки или фрагменты разрушенных клеток. Полнота разрушения клеток может проверяться повторным суспендированием осадка в малом количестве того же самого буферного раствора и исследованием суспензии с помощью фазовоконтрастного микроскопа. Присутствие фрагментов разрушенных клеток или целых клеток указывает на то, что необходимо дополнительное разрушение для удаления фрагментов или клеток и связанных неспособных к рефракции полипептидов. После такого дополнительного разрушения суспензию, если требуется, повторно центрифугируют и отделенный осадок ресуспендируют и анализируют. Процесс повторяют до тех пор, пока при визуальной проверке не обнаруживаются фрагменты разрушенных клеток в осажденном центрифугированием материале или пока дополнительная обработка не уменьшает размера полученного осадка. В другом варианте нейротрофин изолируют от периплазмического пространства солюбилизацией в соответствующем буфере. Данная процедура может быть солюбилизацией in situ,включающей непосредственное прибавление 24 реагентов в ферментер после того, как нейротрофин продуцирован рекомбинантно, тем самым, избегая дополнительных стадий сбора,гомогенизации и центрифугирования при получении нейротрофина. Оставшиеся частицы могут удаляться центрифугированием или фильтрацией, или совместным использовaнием этих процедур. Если нейротрофин не являлся упорядоченным, степень неупорядоченности соответственно определялась с помощью хроматографии ненативного нейротрофина, включая RP-HPLC. Увеличение площади пика ненативной материи указывает, как много присутствует ненативного нейротрофина. Если получали из солюбилизированных внутриклеточных телец (включений) или на более поздней стадии очистки, нейротрофин,сответственно, переупорядочивают в активную конформацию, как описано ниже. Если нейротрофин уже находится в нерастворимой форме, перед тем как его переупорядочивают, он может солюбилизироваться при инкубировании в щелочном буфере, содержащем "chaotropic" агент и восстановитель в количествах, необходимых для солюбилизации в значительной степени нейротрофина. Инкубирование происходит при концентрирации нейротрофина, температуре и времени инкубирования, которые позволят осуществить солюбилизацию нейротрофина в щелочном буфере. Определение степени солюбилизации нейротрофина в буфере осуществляют по мутности,анализируя фракционирование нейротрофина между супернатантом и осадком после центрифугирования на восстановленном SDS геле с помощью протеинового анализа (например, набор Bio-Rad протеинового анализа) или HPLC. Диапазон рН щелочного буфера для солюбилизации обычно от, по крайней мере, 7,5 с предпочтительным диапазоном от 8 до 11. Примеры соответствующих буферов, которые обеспечат рН в пределах указанного диапазона,включают: глицин, CAPSO (3-[циклогексиламино]-2-гидрокси-1-пропансульфокислоту),АМР (2-амино-2-метил-1-пропанол), CAPS(3[циклогексиламино]-1-пропансульфокислоту),CHES (2-[N-циклогексиламино] этансульфокислоту) и TRIS HCl (трис[гидроксиметил] аминометан гидрохлорид. Предпочтительным буфером является глицин или CAPSO, предпочтительно при концентрации от 20mМ, рН от 8,5 до 11, предпочтительно 10-11. Концентрация нейротрофина в буферном растворе для солюбилизации должна быть такой, чтобы нейротрофин в значительной степени солюбилизировался и частично или полностью восстанавливался и денатурировался. Наоборот, нейротрофин вначале может быть нерастворимым. Точное количество для использования будет зависеть, например, от концентраций и типов других ингредиентов в буферном 25 растворе, особенно от типа и количества восстановителя, типа и количества "chaotropic" агента и рН буфера. Например, концентрация нейротрофина может увеличиваться, по крайней мере, в три раза, если концентрация восстановителя, например, ДТТ, одновременно увеличивается, поддерживая соотношение ДТТ : нейротрофин от 3:1 до 10:1. Желательно продуцировать более концентрированный раствор солюбилизированного протеина до переупорядочения в разбавленном растворе. Таким образом,предпочтительная концентрация нейротрофина составляет около 30 мг/мл, наиболее предпочтительным диапазоном является 30-50 мг/мл. Например, нейротрофин может солюбилизироваться до концентраций 30-50 мг/мл при концентрациях мочевины - от 5 М до 7 М, ДТТ - 10mM и разбавляться до, например, 1 мг/мл для переупорядочения. После того, как нейротрофин солюбилизирован, его помещают или разбавляют в буфере для переупорядочения, содержащем 5-40%(об./об.) спиртового или апротонного растворителя, "chaotropic" агента и соли щелочного, щелочно-земельного металла или аммония. Буфером может быть любой буфер первоначального буферного раствора с CAPSO, глицином и причем CAPS предпочтителен при рН 8,5-11, особенно при концентрации 20 mM и наиболее предпочтителен CAPSO и глицин. Нейротрофин может разбавляться буфером для переупорядочения, по крайней мере, в пять раз, более предпочтительно, по крайней мере, почти в десять раз. Наоборот, нейротрофин можно подвергать диализу относительно буфера переупорядочения. Переупорядочение можно проводить при 245 С, наиболее предпочтительно при 2-8 С, по крайней мере, в течение часа. Возможно, чтобы раствор содержал восстановитель и осмолит. Восстановитель, соответственно, выбирают из тех, которые описаны выше для стадии солюбилизации в данном диапазоне концентраций. Его концентрация будет зависеть особенно от концентраций соли щелочного металла, щелочно-земельного металла или аммония, нейротрофина и растворителя. Предпочтительно, когда концентрация восстановителя составляет от 0,5 до 8 mM, более предпочтительно от 0,5 до 5mM и наиболее предпочтительно от 0,5 до 2mM. Предпочтительными восстановителями являются ДТТ и цистеин. Содержание кислорода в переупорядоченном растворе можно, вероятно, уменьшить добавлением инертного газа, например, гелия и аргона для вытеснения кислорода. Возможным осмолитом предпочтительно является сахароза (при концентрации 0,25-1 М) или глицерин (при концентрации 1-4 М). Более предпочтительной концентрацией сахарозы является 1 М концентрация и 4 М концентрация глицерина. 26 Начальная концентрация нейротрофина в буфере переупорядочения является такой, чтобы соотношение правильно упорядоченного к ошибочно упорядоченному выделенному конформеру было максимальное, определенное с помощью HPLC, RIA или биоанализа. Предпочтительной концентрацией нейротрофина (приводящей к максимальному выходу правильно уложенного конформера) является концентрация в диапазоне от 0,1 до 15 мг/мл, более предпочтительно от 0,1 до 6 мг/мл и наиболее предпочтительно от 0,2 до 5 мг/мл. Степень переупорядочения, которая происходит при этом инкубировании, соответственно определяют с помощью RIA титра нейротрофина или с помощью HPLC по увеличениюRIA титра или размеру пика правильно упорядоченного нейротрофина, непосредственно коррелирующих с увеличенными количествами правильного упорядоченного, биологически активного конформера нейротрофина, присутствующего в буфере. Инкубирование проводят для увеличения выхода правильно упорядоченного конформера нейротрофина до максимума и увеличения до максимума соотношения правильно упорядоченного выделенного конформера нейротрофина к ошибочно упорядоченному конформеру нейротрофина, определенных поRIA или HPLC и для уменьшения до минимума выхода мультимерного связанного нейротрофина, определенного по материальному балансу. Наоборот, разновидность может определяться с помощью способов, приведенных ниже и в примерах. Гуанидин является предпочтительным денатурирующим агентом переупорядочения. После того, как нейротрофин переупорядочен, следующие методики, предложенные в данном изобретении, отдельно или в комбинации, применяются для получения продукта более высокой чистоты и гомогенности: фракционирование на катионообменных колонках; гидрофобная хроматография (HIC); и хроматография на силикагеле. В зависимости от того, является ли стадия переупорядочения частью процесса или нет,предпочтительной стадией для отделения нейротрофина от его вариантов является разделение на полимерной колонке для гидрофобной хроматографии. Во время ферментации, очистки или переупорядочения протеина in vitro, некоторые протеины могут химически модифицироваться, ошибочно процессироваться или могут не переупорядочиваться в нативную трехмерную структуру, а скорее в другие структуры,которые отличаются по их стабильности, растворимости, иммуногенности или биоактивности. Данные варианты должны удаляться во время выделения, чтобы избежать нежелательных побочных эффектов, например, антигенности или потери эффективности. Если вариант нерастворим, его легко удалить способом отделения твердых тел от жидкости, например, цен 27 трифугированием и фильтрацией. Однако, если вариант растворим, для его отделения потребуется адсорбционный способ более высокого разрешения, такой как хроматография. Нейротрофины образуют растворимый стабильный ошибочно упорядоченный вариант, если продуцируются в прокариотических клетках или когда переупорядочиваются in vitro. Ошибочно упорядоченный нейротрофин имеет измененную структуру дисульфидного спаривания и трехмерную структуру по сравнению с нативным нейротрофином и испытывает недостаток нативной фармакологической активности. Если продуцировали в эукариотической клеточной культуре, например, клеточной культуре млекопитающих, формы вариантов обычно являются ошибочно процессированными формами. Они также обычно испытывают недостаток нативной фармакологической активности и должны удаляться. В данном изобретении было найдено,что НIС пригоден для отделения этих вариантов от нативного нейротрофина. НIС включает последовательную адсорбцию и десорбцию протеина с твердой матрицы,обусловленную нековалентным гидрофобным связыванием. Обычно образцы молекул в буфере с высокой концентрацией соли наносили на НIС колонку. Соль в буфере взаимодействует с молекулами воды, уменьшая сольватацию молекул в растворе, тем самым, раскрывая гидрофобные области в молекулах образцов, которые в результате адсорбируются НIС колонкой. Чем более гидрофобна молекула, тем меньше соли требуется для промотирования связывания. Обычно для элюирования образцов с колонки используют уменьшающийся солевой градиент. По мере того, как ионная сила уменьшается,раскрытие гидрофобных областей молекул увеличивается и молекулы элюируются с колонки в порядке увеличения гидрофобности. Элюирование образца также может быть достигнуто прибавлением мягких органических модификаторов или детергентов к буферу для элюирования. Обзор по НIС приведен в ProteinPurification, 2d Ed., Springer- Verlag, New York,pp. 175-179(1988). Сила связывания между протеином и матрицей зависит от нескольких факторов, включая размер и гидрофобные свойства иммобилизованной функциональной группы, полярности и поверхностного натяжения окружающего растворителя и гидрофобности протеина. Связывающая способность HIC матриц имеет тенденцию снижаться вследствие необходимого иммобилизованного гидрофобного лиганда широко размещаться. Кроме того, емкость среды для данного протеина изменяется обратно пропорционально с уровнем (количеством) гидрофобных примесей в образце. Для того, чтобы отделить нужный протеин от вариантов и других примесей, одновременно увеличивая до максимума емкость, необходимо определить подхо 002349 28 дящую HIC твердофазную среду, а также подходящие подвижные фазы для нанесения, промывки и элюирования. Как найдено в данном изобретении, самой подходящей средой для разделения правильно упорядоченных и ошибочно упорядоченных нейротрофинов или ошибочно процессированных форм от интактных правильно процессированных форм, являлась среда с иммобилизованными фенильными функциональными группами. HIC среда на основе фенильных групп от различных поставщиков проявляла различную эффективность для разделения этих форм нейротрофина. Самые лучшие результаты достигались с Phenyl Toyopearl средой от TosoHaas и низкозамещенной фенилсефарозой быстрого пропускания (Phenyl Sepharose Fast Flow LowHIC-иммобилизованные функциональные группы могут действовать для разделения данных форм. Примерами являлись октильные группы,как например, на Octyl Sepharose CL4B среде отHIC пригодна для отделения нейротрофинов от их вариантов в среде клеток млекопитающих. Например, как определено в данном изобретении, rhNGF-экспрессирующая СНОклеточная культура содержала ошибочно протеолитически процессированные варианты, как например, такие, в которых присутствует частичная последовательность предшественника,например, последовательности предшественника NGF, гибридного предшественника NGF и усеченного (clipped) предшественника NGF. Также найдено, что в культуральной среде клеток млекопитающих имелись гликозилированные NGF и гликозилированные формы ошибочно протеолитически процессированных вариантов. Нежелательные гликозилированные формы,которые в случае NGF можно рассматривать в качестве частиц более высокого молекулярного веса (+2000 KD), могут генерировать нежелательную антигенную реакцию у пациентов и приводить к плохому качеству и активности продукта. НIС эффективно разделяла гидрофобные варианты, главным образом, N-концевые протеолитически ошибочно процессированные варианты, включая гликозилированные формыrhNGF. Как показано в примерах, содержащий последовательность предшественника и последовательность усеченного (clipped) предшественника NGF и гликозилированные формы иNGF и содержащего NGF последовательности предшественника элюировали в лидирующем(основном) крае NGF пика во время фенил-HIC. Таким образом, может быть получена rhNGF композиция, которая практически не содержала этих частиц и которая особенно годилась для последующей стадии, такой как катионообмен 29 ная хроматография высокого разрешения. НIС применима к другим нейротрофинам, а также кNGF, независимо от источника. Например, НIС пригодна для отделения NGF мономеров от димеров или гомо- или гетеродимеров в зависимости от присутствующих мономерных форм, а также различает димерные формы, которые также отличаются по гидрофобности, которые получают после переупорядочения in vitro или когда продуцируют и секретируют из клеток млекопитающих. Предпочтительным источником смесей нейротрофинов при использвании НIС является культура клеток млекопитающих,более предпочтительно СНО клеточная культура. Культуру предпочтительно подвергают, по крайней мере, одной предшествующей стадии очистки, как описано в настоящем изобретении. НIС особенно эффективна при отделении ошибочно процессированного(ых) гликозилированного(ых) варианта(ов) от нативного рекомбинантного нейротрофина. В случае rhNGF, гликозилированные и препро-NGF формы менее гидрофобны, чем нативный NGF, тем самым,элюируются раньше нативного NGF. Ошибочно упорядоченные формы нейротрофинов (при бактериальном продуцировании) также более гидрофобны и элюируются раньше нативного нейротрофина. Наиболее предпочтительным НIС полимером для отделения форм нейротрофинов являлись полимеры, содержащие иммобилизованные фенильные функциональные группы. Фенилсодержащая НIС среда от различных поставщиков обнаруживала различную эффективность в разделении этих NGF форм. Из фенилHIC полимеров наиболее предпочтительнаPhenyl Toypearl среда от TosoHaas и предпочтительны также низкозамещенная фенилсефароза быстрого пропускания (Phenyl Sepharose FastFlow Low Sub) и TSK Phenyl 5PW. Предпочтительные НIС функциональные группы включают алкоксигруппы, бутильные и изоамильные группы. При использовании НIС может применяться целый ряд подвижных фаз для промывки и дифференцированного элюирования форм нейротрофина. Эти подвижные фазы могут содержать несколько различных химических фрагментов, которые влияют по-разному на связывание нейротрофина со стационарной фазой. Правильно упорядоченные и ошибочно упорядоченные нейротрофины, например, NT-4/5 могут разделяться на НIС колонке путем уменьшения градиентов солей или ступенчатого уменьшения, например, концентрации соли в подвижной фазе, таких как сульфата аммония,хлористого натрия, ацетата натрия. Соли могут влиять на связывание нейротрофина с полимером путем модуляции поверхностного натяжения подвижной фазы. Другими агентами, которые воздействуют на поверхностное натяжение,являлись цитрат натрия и тетраметиламмоний 30 хлорид, как рассмотрено в примерах. Варианты могут также разделяться с помощью колоночной хроматографии при элюировании связанных протеинов возрастающими градиентами или ступенчатым увеличением концентрации относительно полярных органических растворителей. Примеры приемлемых растворителей включают этанол, ацетонитрил и пропанол. Прочность связывания форм нейротрофина и НIС полимера также зависела от рН подвижной фазы, предпочтение отдавалось нейтральным растворам. Относительная гидрофобность правильно упорядоченного и ошибочно упрядоченного нейротрофина также зависела от рН раствора. Разделение вариантов и нативного нейротрофина также может осуществляться путем одновременного изменения нескольких свойств подвижной фазы во время градиента или ступенчатого элюирования. Например, подвижная фаза, которая одновременно изменялась по концентрации соли и концентрации неполярного растворителя во время элюирования, приводила к лучшему разрешению, чем когда только изменяли концентрацию соли. Соли, использумые для НIС и рассматриваемые в данном изобретении, включали сульфат, цитрат и ацетат аммония и хлорид калия. В зависимости от применяемой соли, концентрация ее, чтобы достигнуть связывания нейротрофина с полимером, обычно составляет от 0,5 М до 3 М, более предпочтительно от 0,5 М до 2,5 М. Например, для NGF предпочтителен связывающий буфер с концентрацией соли от 0,8 М до 1,5 М, при более высоких концентрациях солей происходит осаждение NGF на полимере, приводящее к снижению выделения. Для NT-3 предпочтителен связывающий буфер с рН 7 и концентрацией соли от 1,0 М до 2,5 М, более предпочтительным является хлористый натрий с концентрацией от 1,25 М до 1,75 М и наиболее предпочтителен с концентрацией 1,5 М. Для NT4/5 предпочтителен связывающий буфер с рН 7 и концентрацией соли от 1 М до 3 М, более предпочтителен с концентрацией от 2 М до 2,75 М и наиболее предпочтителен хлористый натрий с концентрацией 2,5 М. В случае NT-4/5, если при загрузке (нанесении) предпочтителен 2,5 МNaCl, тогда для элюирования предпочтителен 2 М NaCl с добавкой органического растворителя (например, 10% спирт, рН 7). Предпочтительно использовать снижающуюся концентрацию соли для элюирования и разделения нейротрофина и его вариантов. Для того, чтобы достигнуть элюирования, концентрация соли в буфере для элюирования обычно ниже, чем ее концентрации в буфере для нанесения, но эти концентрации могут быть одинаковыми, если компенсируются органическим растворителем. Кроме того, применение органического растворителя имеет другое преимущество, о котором сообщалось в данном изобретении,заключающееся в том, что добавка органическо 31 го растворителя улучшает характер элюирования, приводящего к более узкому профилю пика. Кроме этанола могут использоваться другие органические растворители, рассматриваемые в данном изобретении, включающие пропанол,изопропанол и низшие алкиленгликоли, такие как пропиленгликоль, этиленгликоль и гексиленгликоль. Правильно упорядоченные нейротрофины обычно элюируются органическим растворителем с 5 до 25% (об./об.), более предпочтительно с 5 до 20% (об./об.). Элюирование органическим растворителем может быть либо в градиенте или ступенчатым. Предпочтителен рН от близко к нейтральному до слабокислого; с рН от 5 до 8, более предпочтительно с рН от 6 до 8, рН от 6,5 до 7,5 и наиболее предпочтительно рН 7. Любые буферы, рассматриваемые в данном изобретении, включающие MOPSO,MOPS, HEPES, фосфатный, цитратный, аммонийный, ацетатный, могут применяться пока они оказывают буферное действие при нужном рН. Согласно данному изобретению для некоторых нежелательных вариантов нейротрофина,являющихся результатом рекомбинантного продуцирования нейротрофина, применение катионообменной хроматографии высокого разрешения предпочтительно в препаративной форме,что позволяет разделить зарядмодифицированные варианты, например, карбамилированные,окисленные, изоаспартатные, деамидированные и некоторые усеченные (clipped) формы (например, С-концевые процессированные формыNGF) и нативный нейротрофин. Например, Nконцевые усеченные (clipped) формы (например,от 2 до 4 N-концевых аминокислотных делеций), которые приводят к изменению заряда,которое может происходить во время бактериальной ферментации, как в случае NT-4/5 так иNT-3, можно в настоящее время удалять. В случае нейротрофинов, продуцируемых в культуре клеток млекопитающих, С-концевое процессирование может происходить в высокозаряженной концевой области. Например, 118 формаNGF может ошибочно процессироваться или расщепляться у его С-конца до 117, 114 и 115 форм. Они могут отделяться от нативного 118NGF с помощью катионообменной хроматографии высокого разрешения. В особенно предпочтительных вариантах используют SP-сефарозу высокого разрешения (SP-Sepharose High Performance), Fractogel EMD S03 или полимеры на основе полиаспарагиновой кислоты, из которыхPolyCAT особенно предпочтителен. Для крупных масштабов особенно предпочтительно использовать SP-сефарозу высокого разрешенияEMD S03. Композиции, полученные с помощью описанных в данном изобретении способов, будут представлять практически чистый нейротрофин,чаще и предпочтительнее, по существу, чистый, 002349 32 и не будут практически содержать вариантов нейротрофина, более предпочтительно, по существу, не содержать вариантов нейротрофина. Например, типичный SP-Sepharose пул после очистки NGF от СНО клеточной культуры содержит около 92% 118, 4,6% 120, 1% деамидированного NGF, 1% окисленного NGF и 1% изоаспартатной формы NGF. Обычно количество каждого вида варьируется от 85 до 93% для 118, от 0 до 5% для 120 (в большой степени зависящего от степени эндогенного или экзогенного протеолиза, который применялся), от 0 до 5% для 117, от 0 до 3% для деамидированных форм, 0-2% для изоаспартатных форм и от 0 до 2% для окисленных форм. Чистота NGF (всех видов) обычно выше 99,5%. После того, как нейротрофин элюируют из колонки, его соответственно используют для получения композиции с носителем, предпочтительно фармацевтической композиции с физиологически приемлемым носителем. Композиции нейротрофина, предпочтительно, являются стерильными. Композиции нейротрофина также нашли применение in vitro, например, для промотирования роста и выживания нейронов в культуре. Химическую устойчивость и физическую стабильность рекомбинантного фактора роста нервной ткани (NGF), относящегося к человеку,в водном растворе исследовали в температурном интервале от 5 до 37 С, и в интервале рН от 4,2 до 5,8. Химическая устойчивость NGF увеличивалась с ростом рН. В сукцинатном буфере при рН 5,8 физическая стабильность NGF уменьшалась вследствие агрегации протеина. Основываясь, как на данных по устойчивости при 5 С, так и на исследованиях по ускоренной деградации (разрушению) при 37 С, найдено,что оптимальным составом являлся ацетатный буфер с рН 5,5 (см. WO 97/17087, приведенную в данном изобретении в виде ссылки). HPLC с обращенной фазой являлась основным методом,свидетельствующим об устойчивости, показывающей, что превращение Asn-93 в iso-Asp является основным направлением деградации при 5 С. Проведение количественной оценки NGF деградации с помощью катионообменной хроматографии осложнялось перегруппировкой(реаранжировкой) NGF мономерных вариантов в различные смешанные димеры с течением времени (димерный обмен). Обработка образцов и контрольных образцов разбавленной кислотой быстро уравновешивала мономерное распределение в димерах, позволяющее провести количественную оценку NGF деградации в отсутствие димерного обмена. Бензиловый спирт и фенол оценивали по их совместимости с rhNGF и его устойчивости в двух жидких составах (композициях) многократного назначения. Данные две композиции содержат 0,1 мг/мл протеина в 20 mM ацетата натрия с рН 5,5 и 136 mM хлорида натрия с 0,01% плуроновой кислоты (F68) 33 или без нее в качестве поверхностно-активного вещества. Конечные концентрации бензилового спирта и фенола в каждой из этих двух композиций составляли 0,9 и 0,25%, соответственно. Основываясь на 12-месячных данных по стабильности, в этих композициях rhNGHF более устойчив с бензиловым спиртом, чем с фенолом. Сохраняющаяся с помощью бензилового спирта rhNGF композиция, в присутствии поверхностно-активного вещества является такой же стабильной, как композиция без добавок поверхностно-активного вещества, указывая на то,что добавка F68 к rhNGF многодозовой композиции для ее стабильности не требуется. Поэтому композиция, содержащая 0,1 мг/мл протеина в 20 mM ацетата, 136 mM NaCl, 0,9% бензилового спирта, рН 5,5, рекомендуется для использования rhNGF в качестве многократного назначения в III фазе клинического лечения. ДаннаяUSP и ЕР тест на эффективность хранения, по истечении 6 месяцев при 5 С являлась такой же стабильной, как обычная жидкая композиция с 2 мг/мл. Однако композицию следует предохранять от воздействия интенсивного света из-за присутствия бензилового спирта в качестве консерванта, который является светочувствительным. Обычно композиции могут содержать другие компоненты в количествах, предпочтительно не влияющих на получение стабильных жидких или лиофилизированных форм, и в количествах, пригодных для эффективного безопасного фармацевтического введения. Нейротрофин используется в получении композиции с фармацевтически приемлемым носителем, т.е. носителем, который не является токсичным к реципиентам в применяемых дозах и концентрациях и совместим с другими ингредиентами композиции. Например, композиция предпочтительно не включает окислителей и других соединений, о которых известно, что они вредны для полипепитидов. Данная технология приготовления композиции достигается обессоливанием или диафильтрацией с использованием стандартной технологии. Обычно композиции получают путем контактирования нейротрофина при хорошем перемешивании с жидкими носителями или мелко размельченными твердыми носителями, или и теми и другими. Далее, если необходимо, продукт принимает форму нужной композиции. Предпочтительным носителем является парентеральный носитель, более предпочтительным раствор, который является изотоническим с кровью реципиента. Примеры таких носителей включают воду, физиологический раствор, раствор Рингера и раствор глюкозы. Также пригодны неводные носители, такие как жирные масла и этилолеат, а также липосомы. Носитель, соответственно, содержит незначительные количества добавок, например, 002349 34 веществ, которые увеличивают изотоничность и химическую устойчивость. Такие вещества являются нетоксичными для реципиентов при применяемых дозах и концентрациях, и включают буферные растворы, такие как фосфатный,цитратный, сукцинатный, уксусную кислоту и другие органические кислоты и их соли; антиоксиданты, например, аскорбиновую кислоту; низкомолекулярные (менее десяти остатков) полипептиды, например, полиаргинин или трипептиды; протеины, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например, поливинилпирроллидон; аминокислоты, такие как глицин,глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, включая целлюлозу или ее производные - трегалозу, глюкозу, маннозу или декстрины; комплексообразующие агенты, например, EDTA; сахарные (углеводные) спирты, такие как маннит или сорбит; противоионы, например, натрий; и/или неионные поверхностноактивные вещества, например, полисорбаты,полоксамеры или PEG. Конечный препарат может быть жидким или в лиофилизированной твердой форме. Нейротрофин, применяемый для терапевтического назначения, должен быть стерильным. Стерильность легко достигается фильтрацией через стерильные фильтрационные мембраны (например, мембраны 0,2 мкн). Терапевтические композиции нейротрофина обычно помещают в сосуд, имеющий стерильное входное отверстие, например, мешок или флакон с пробкой, протыкаемой иглой для подкожной инъекции. Вышеперечисленные композиции также пригодны для использования in vitro. Нейротрофин обычно должен храниться в одно- или многодозовых сосудах (флаконах),например, запаянных ампулах или флаконах, в виде водного раствора или лиофилизированного состава для получения композиции. Примером лиофилизированной композиции служат 10 мл флаконы, которые заполняли 5 мл стерильно-фильтрованным 1% (мас./об.) водным раствором нейротрофина и полученную смесь лиофилизировали. Инфузионный раствор получали путем растворения лиофилизированного нейротрофина, используя бактериостатическую воду для инъекций (Water-for-Injection). Пациенту назначают (вводят) терапевтически эффективную дозу композиции нейротрофина. Под терапевтически эффективной дозой понимают дозу, которая вызывает эффекты, ради чего она назначается. Точная доза будет зависеть от болезни, которую лечат, и должна быть установлена специалистами с использованием известных способов. Обычно композиции нейротрофина, описанные в настоящем изобретении, назначают от 0,01 мкг/кг до 100 мкг/кг в день. Предпочтительно от 0,1 до 0,3 мкг/кг. Кроме того, как известно, необходимо 35 регулировать величину дозы с учетом возраста,а также веса тела, общего состояния здоровья,пола, питания, времени введения, взаимодействия лекарств и тяжести болезни,и должна устанавливаться обычным экспериментированием специалистами. Обычно лечащий врач должен вводить композиции нейротрофина, пока достигнет дозу, которая исправит, сохранит и оптимально восстановит функцию нейронов. Достижение данной терапии легко контролируется обычными анализами. Нейротрофин, возможно, комбинируют с другими нейротрофическими факторами, включая NGF, NT-4/5, NT-3 и/или BDNF или их сообща вводят и применяют с другими принятыми методами лечения нервных расстройств. В случае NGF, композиция предпочтительно включает фармацевтически эффективное количество фактора роста нервной ткани и фармацевтически приемлемый ацетатсодержащий буфер. Композиция может быть с рН от 5 до 6. Предпочтительным буфером является ацетат натрия. Концентрация ацетата натрия предпочтительно составляет от 0,1 до 200 mM. Композиция содержит NGF, предпочтительно, в концентрации от 0,07 до 20 мг/мл. И композиция,возможно, дополнительно содержит фармацевтически приемлемый консервант, например,бензиловый спирт, фенол, м-крезол, метилпарабен или пропилпарабен. Предпочтительным консервантом является бензиловый спирт. Концентрация бензилового спирта, предпочтительно, составляет от 0,1 до 2,0%. Композиция, возможно, содержит фармацевтически приемлемое поверхностно-активное вещество. И композиция предпочтительно, возможно, содержит физиологически приемлемую концентрацию хлористого натрия. Предпочтительнее, если композиция содержит фактор роста нервной ткани в концентрации, по крайней мере, 0,1 мг/мл и концентрацию ионов ацетата от 10 до 50 mМ. Даже предпочтительнее, если композиция содержит фактор роста нервной ткани при концентрации от 0,1 до 2,0 мг/мл и ионов ацетата от 10 mM до 50 mM. Наиболее предпочтительно,если композиция содержит NGF при концентрации 0,1 мг/мл, концентрация ацетата натрия 20mM, pH 5,5, концентрация хлористого натрия 136 mM и бензилового спирта 0,9% (об./об.). Другой вариант содержит NGF в концентрации 2,0 мг/мл, ацетат натрия в концентрации 10 mM, pH 5,5 и хлористый натрий при концентрации 142 mM. Предпочтительно готовить композицию с 0,1 мг/мл NGF, 20 mM ацетата натрия, 136 mM хлорида натрия, 0,9% (об./об.) бензилового спирта с pH 5,5. Как рассматривается в данном изобретении, предпочтительной формой NGF является 118/118 гомодимер. NGF очищают при pH от 6 до 8, чтобы сохранить нормальную димерную форму. Однако процентное содержание (протеолитически) усеченных (clipped) форм представляется мономерны 002349 36 ми формами, которые становятся очевидными и определяются HPLC с обращенной фазой. В кислых условиях аналитической HPLC димеры диссоциируют. О существовании различных димерных форм NGF-120/120, 120/118, 118/118 и т.д. опубликовано в работе (Schmelzer et al., J.Neurochem 59: 1675-1683 (1992), работа, специально приведенная здесь полностью, главным образом, для аналитических и биоанализов, которые применяли в данном исследовании, а также для общего обучения). В публикации сообщалось, что активности in vitro были одинаковыми для каждой димерной формы. Однако наоборот, настоящие исследования, используя радиорецепторный анализ, впервые продемонстрировали, что 120/120 димер менее активен и его активность составляет 80-90% от активности 118/118 вида. В одном типе анализа мембраныPC-12 клеток крысы изолировали и использовали при конкурентном связывании стандартногоNGF и различных проверяемых видов. RRA имеет и Р 75 и trkA рецепторы. В данном изобретении найдено, что 117/117 вид также активен, как и 118/118 вид. Кроме того, применение анализа на основе PC-12 подтвердило полученные на основе рецепторного анализа данные,показывающие, что активность 120/120 формы составляет 60% от активности 118/118 формы. Также полностью в качестве ссылки приведена работа Burton et at., J. Neurochem. 59: 1937-1945(1992), главным образом, для аналитического и биологического анализа, которые применяли в данных исследованиях, а также для общего знания. Считается, что форма 118/118 более биологически доступна у людей, чем 120/120 форма. Увеличение биологической доступности является, по крайней мере, 4-5-кратной. Данное различие значительно, удивительно и неожиданно с точки зрения науки. Следующие примеры приведены с целью иллюстрации, а не с целью ограничения. Процитированная литература специально приведена в виде ссылок. Примеры Пример 1. Очистка 118/118 NGF гомодимера. Данный пример иллюстрирует очисткуNGF и разумное объяснение каждой стадии. Также в каждом из примеров специалисты могут легко определить и регулировать размеры колонки и скорости потока, чтобы уравнять начальные объемы культуры и концентрации протеина. Собранная клеточная культуральная жидкость Рекомбинантную СНО клетку трансфектировали экспрессирующим вектором, содержащим NGF, относящийся к человеку, с 120 аминокислотными остатками, кодирующий ДНК последовательность. Для промотирования секреции и процессирования также имелась NGF препро-последовательность. После культивиро 37 вания рекомбинантных СНО клеток, собирали клеточную культуральную среду. Собранная клеточная культуральная жидкость (HarvestedCell Culture Fluid, HCCF) содержала NGF формы 120, 118 и 117. Около 40-70% NGF обычно являлось 118/118 гомодимером и остальное гетеродимеры 120/118, 120/120 и небольшое количество 118/117. Как указывается в данном изобретении, данные формы могут разделяться на колонке с SP-сефарозой HP (SP-SepharoseHP). Собранную клеточную культуральную жидкость концентрировали примерно 20 кратно, используя Millipore 10 Kd мембраны(применяли взаимозаменяющиеся мембраны из целлюлозы, композита или полисульфона). К концентрату прибавляли 0,1 объем 1,0 М Tris,pH 8,2. Разбавленный раствор подвергали микрофильтрации, используя 0,22 um фильтр, и переносили в емкость для выдерживания при 37 С в течение от 2 до 18 часов. Превращение 120/120 формы в 118/118 форму катализируется эндогенной протеазой во время выдерживания. Хроматография на силикагеле Микрофильтрат доводили до 1 М NaCl и использовали колонку из силикагеля, уравновешенную 1 М NaCl, 25mM MOPSO, pH 7. Колонку промывали 1 М NaCl, 25mM MOPSO, pH 7. Подходящий диапазон pH составляет от 6 до 8,предпочтительно pH 7. Далее колонку промывали 25 mM MOPSO, pH 7. Промывание раствором низкой проводимости удаляет протеины клетки-хозяина. Связанный NGF элюировали 50mM MOPSO, 0,5 М ТМАС, 20% реактивным безводным спиртом (94-96% специально денатурированный спирт формулы 3 А (5 объемов метанола и 100 объемов 200 этанола определенной концентрации) и 4-6% изопропанола). Могут использоваться другие спирты, например,20% пропанол, 20% изопропанол и 20% метанол. "Спирт" и "спиртовые растворители" означают общепринятую терминологию для спирта,предпочтительно спирты, содержащие от 1 до 10 атомов углерода, более предпочтительно метанол, этанол изопропанол, н-пропанол или трет-бутанол и наиболее предпочтительно этанол или изопропанол. Эти спирты являются растворителями, которые при добавлении к водному раствору увеличивают гидрофобность раствора при уменьшении его полярности. Наиболее предпочтителен этанол. Низший предел спирта является спиртом любого процентного содержания, который элюирует и верхний предел устанавливается таковым, чтобы предотвратить денатурирование протеина. Концентрация растворителя предпочтительно от 5 до 25%, более предпочтительно от 5 до 20%, даже более предпочтительно от 5 до 15%. ТМАС представляет собой тетраметиламмоний хлорид, который добавляют для элюирования NGF. Концентрация ТМАС может изменяться от 0,1 до 1 М. Интервал от 0,3 до 0,7 М более предпочтителен. 38 Количество ТМАС, применяемое для элюирования NGF, является функцией pH и концентрации спирта. Чем ниже pH, тем меньше количества спирта и ТМАС требуются. pH может быть в пределах от 4 до 8. В данном примере предпочтительным рН являлся рН 7, который предусматривает совсем минимальное регулирование объединенных фракций до нанесения их на следующую колонку. Верхний предел рН определяется величиной рН, необходимой для загрузки следующей колонки, и нижний предел - величиной рН, пригодной для эффективного элюирования NGF. Хроматография на S-сефарозе быстрого пропускания Элюат, содержащий NGF, собирали, разбавляли очищенной водой до проводимости меньшей, чем 15,5 мс/см и рН доводили до 7,0. Раствор выдерживали не более 8 ч, поскольку еще присутствовало несколько протеаз; однако,не наблюдалась активность эндогенной протеазы, которая превращает 120 аминокислотнойNGF в 118 форму. Вещество наносили на хроматографическую колонку с S-сефарозой быстрого пропускания (S-Sepharose Fast Flow) (катионообменная колонка S-SEPHAROSE TMagarose Fast Flow TM (Pharmacia, уравновешенную 25 mM MOPSO, рН 7. Колонку промывали 25 mM MOPSO, рН 7. Подходящий интервал рН составлял от 6 до 8, предпочтительно 7. Колонку далее промывали 0,16 М NaCl, рН 7. Связанный NGF элюировали 0,5 М NaCl, рН 7. Молярность соли для элюирования может варьироваться от 0,3 до 1,0 М, более предпочтительно от 0,4 до 0,6 М. Нижний предел определяется способностью элюировать весь NGF и верхний предел определяется необходимостью предотвратить удаление контаминантов и причину гидрофобного взаимодействия на колонке, что будет мешать элюированию NGF. Могут использоваться другие соли, предпочтительной является KCl. Элюирование 0,5 М NaCl, рН 7 предпочтительно для того, чтобы получить пул малого объема. При более высоких концентрациях, например, выше 1 М, можно элюировать прочносвязанные контаминанты. Хроматография на Phenyl Toyopearl 650M Фракции SSFF колонки, содержащие NGF,собирали, доводили до 1 М NaCl и наносили наPhenyl Toyopearl 650M колонку. Колонку промывали 25 mM MOPSO, рН 7. Подходящее значение рН находится в диапазоне от 5 до 8. Связанный NGF элюировали 10 CV (объем колонки) линейным градиентом, начиная с градиентного буфера А (25 mM MOPSO, рН 7, 1,0 МNaCl) и заканчивая градиентным буфером В(20% спирт в 80% 25mM, MOPSO, pH 7). Фракции, содержащие NGF, анализировали SDS-PAGE электрофорезом в полиакриламидном геле, чтобы определить, какие фракции содержали формы предшественника NGF. Фракции, содержащие NGF, собирали и объе 39 диняли для удаления, главным образом, ошибочно процессированных вариантов, например таких, в которых присутствует последовательность частичного предшественника, например,последовательности предшественника NGF,гибридного предшественника NGF и усеченного(clipped) предшественника NGF, чтобы получить NGF композицию, практически не содержащую любые последовательности NGF предшественников. Фенильная колонка также удаляла малое количество последовательностей гликозилированного NGF и гликозилированногоNGF пика. Таким образом, данная колонка легко разделяет NGF и различные формы NGF,позволяя получить NGF композицию, практически не содержащую эти формы. На данной стадии при использовании НIС разделялись гидрофобные NGF варианты, главным образом, ошибочно процессированные варианты, включающие протеолитические и гликозилированные варианты. Наиболее пригодной средой для разделения NGF форм являлись среды, содержащие иммобилизованные фенильные функциональные группы. Фенилсодержащая НIC среда от различных поставщиков проявляла различную эффективность в разделении этих NGF форм. Наилучшие результаты достигались с помощьюPhenyl Toyopearl среды отТоsоНааs. Низкозамещенная фенилсефароза быстрого пропускания (Phenyl Sepharose Fast Flow Low Sub) и TSKPhenyl 5PW работали хорошо. Другие НIС функциональные группы менее пригодны и менее эффективны в этих условиях, включая алкоксигруппы, бутильные и изоамильные группы.NGF, оставшиеся 2,8% представляли другие неидентифицированные NGF формы. Обычно, объединенные фракции подкисляли для достижения вирусной инактивации при рН ниже 3,95, минимум в течение 15 мин. Хроматография на SP-сефарозе HP НIС пул разбавляли 0,5-1 объемом воды и разбавленный пул доводили до рН 6. Пул наносили на колонку с SP-сефарозой HP, уравновешенной 0,2 М хлорида натрия, 20 mM сукцината натрия, рН 6, содержащую 5% реактивного спирта (как в стадии на колонке из силикагеля). Колонку промывали раствором 0,2 М NaCl, 20mM сукцината натрия, рН 6, содержащим 5% реактивного спирта (спирт формулы SDA-3A; спирт обычно присутствует). Спирт помогает уменьшить неспецифические (главным образом гидрофобные) взаимодействия NGF с главной 40 цепью полимера. Пригоден диапазон концентрации спирта от 0 до 10%. рН при загрузке составляет от 5 до 8, он выбран таким, чтобы достигнуть и сохранить максимальную стабильность NGF и разделить NGF варианты. Колонку промывали уравновешенным буфером, объем которого соответствовал двум объемам колонки. Связанный NGF элюировали и отделяли от вариантов с помощью линейного градиента,объем которого соответствовал 22 объемам колонки, смешиванием 11 колоночных объемов градиентного буфера А (0,25 М NaCl, 0,02 М сукцината, рН 6, содержащий 5% спирта) и 11 колоночных объемов градиентного буфера В(0,5 М NaCl, рН 6). Спирт не является обязательной добавкой. 118/118 NGF обычно элюировалиNaCl с концентрацией 0,35 - 0,40 М. Фракции из колонки анализировали на содержание NGF и NGF-вариантов. Фракции,предпочтительно, анализировали с помощьюal. (1992), supra и Burton et al. (1992), supra. Фракции собирали и объединяли для получения композиции NGF, которая практически не содержала модифицированных NGF вариантов,например, заряженных форм, таких как окисленных, деамидированных и изоаспартатныхNGF форм. Предыдущая HIC колонка не могла эффективно удалять другие формы вариантовNGF. HIC колонка эффективно удаляла ошибочно упорядоченные протеины и гликозилированные формы, которые связываются более прочно с HIC полимером, чем правильно упорядоченные NGF, т.к. они более гидрофобны. Соответственно, катионообменный полимер, например, SP-сефарозу HP использовали для удаления вариантов с измененным зарядом, не удаляемые HIC полимером. Пул с колонки с SP-сефарозой обычно содержал 92% 118, 4,6% 120, 1% деамидированного NGF, 1% окисленного NGF и 1% изоаспартатного NGF. Обычно количество каждой формы варьируется от 85 до 93% для 118, от 0 до 5% для 120, от 0 до 5% для 117, от 0 до 3% для деамидированных форм, от 0 до 2% для изоаспартатных форм и от 0 до 2% для окисленных форм. Чистота NGF (все формы) обычно выше 99,5%. Приготовление композиции Пул SP-сефарозы HP получали для приготовления композиции ультрафильтрацией/диафильтрацией в буфере, применяемой в композиции. Предпочтительно использовать кислый буфер, предпочтителен ацетатный буфер с рН 5,как рассматривалось выше. 118/118 NGF композиция практически не содержит NGF вариантов и является практически чистым NGF. Вещества,входящие в композицию, пригодны для лечения неврологических нарушений, особенно периферической нейропатии, связанной с диабетом, и 41 периферической сенсорной нейропатией, связанной со СПИДом. Пример 2. Очистка 120/120 NGF гомодимера в крупном масштабе. Собранная клеточная культуральная жидкостьHCCF обычно получали из 12000 л СНО клеточной структуры, как описано в примере 1. Распределение NGF форм в HCCF составляло 40-65% 120/120 гомодимера с 120/118 гетеродимером и оставшимся количеством 118/118 гомодимера. Обычно среду быстро процессировали, чтобы довести до минимума протеолитическое превращение 120 в 118.HCCF наносили на Macroprep High S катионообменную хроматографическую колонку,промывали 1,5 М ацетата натрия, 50 mM HEPES рН 7. Связанный NGF элюировали 1,5 М NaCl,0,25 М ТМАС, 0,2% тиодигликоля, рН 7. Macroprep колонка может работать при рН от 5 до 8 с регулированием концентрации ацетата. Хлорид является предпочтительным заместителем ацетат-иона. NGF элюировали в ТМАС градиенте. ТМАС представляет собой соль, обладающую и ионным, и гидрофобным свойством, что является полезным свойством, поскольку главная цепь некоторых полимеров содержит гидрофобный фрагмент, который промотирует неспецифическое взаимодействие между NGF и полимером. Обычно для буфера элюирования с рН от 6 до 8,пригоден ТМАС с концентрацией от 0 до 3 М. Собирали фракции, содержащие NGF. Хроматография на силикагеле Пул непосредственно наносили на хроматографическую колонку из силикагеля. Силикагель относится к смешанному типу хроматографического носителя, обладающего ионными,полярными и гидрофобными взаимодействиями,которые играют роль в протеинсвязывающих свойствах. Колонка уравновешивалась 1 М NaCl,25 mM MOPSO, рН 7. Колонку промывали 1 МNaCl, 25 mM MOPSO, рН 7 (предпочтительно от рН 5,0 до 8,5, более предпочтительно с рН от 6 до 8 и наиболее предпочтительно рН 7). Связанный NGF элюировали 25 mM сукцината, рН 3,9,50 mM TEAC (тетраэтиламмоний хлорид).TEAC представляет собой более мощный элюент, чем ТМАС. рН предпочтительно варьируется от 3,5 до 8. Однако рН выше 7,5 необходимо избегать в течение продолжительного периода времени для того, чтобы предотвратить или уменьшить образование деамидированных формNGF. Обычно чем ниже рН буфера, тем ниже концентрация соли со смешанными свойствами,такой как ТМАС или TEAC, необходимой для элюирования NGF с колонки силикагеля. Для применения пригодны буферы, обладающие хорошей буферной емкостью при рН около 4-5. Возможно присутствие соли в буфере для элюирования, так что колонка может промыватьсяMOPSO буфером без соли до применения буфера для элюирования. Хроматография на фенилсефарозе быстрого пропускания (Phenyl Sepharose Fast Flow) Идентифицировали и объединяли фракции, содержащие NGF. Пул доводили до 0,7 М ацетата, рН 7, 25 mM MOPSO. Доведенный пул наносили на хроматографическую колонку с фенилсефарозой быстрого пропускания, уравновешенную градиентным буфером А (0,7 М ацетат, 25 mM MOPSO, рН 7). Колонку промывали градиентом из 90% градиентного буфера А(0,7 М ацетат, 25 mM MOPSO, рН 7) и 10% градиентного буфера В (25 mM MOPSO, рН 7, 20% пропиленгликоль). Можно заменить другими гликолями,например,гексиленгликолем. Обычно промывание составляло от 2 до 3 CV или до тех пор, пока не достигалась стабильная нулевая линия OD. Промывание удаляло некоторые протеины клеток-хозяина. СвязанныйNGF элюировали линейным 10 CV градиентом от смеси из 90% градиентного буфера А и 10% градиентного буфера В до 10% градиентного буфера А и 90% градиентного буфера В. В HIC буферах ацетат можно заменить на хлорид или сульфат натрия. Предпочтителен рН от 5 до 8,более предпочтителен от 5,5 до 7,5 с приемлемым значением рН от 6 до 8 и наиболее предпочтителен около 7. Колонка отделяла любые последовательности оставшихся предшественников, последовательности частичных предшественников или гликозилированные формы,присутствующие в виде гомодимера или гетеродимера зрелого NGF мономера и NGF мономера, который еще содержал часть имеющейся последовательности предшественника. Предшественник и гликозилированные формы NGF присутствуют в лидирующем (основном) крае элюируемого пика, так что объединяли NGFсодержащие фракции, практически исключая другие формы.HIC пул содержал около 72% 120 мономера, 17% 118 мономера, 2,8% 117 мономера, 3,6%R120 мономера, 0,8% изоаспартатных форм,1,3% окисленных форм и 1% деамидированных форм по данным разделения и определения с помощью аналитической HPLC системы. Хроматография на SP-сефарозе HP Объединяли фракции, содержащие NGF,от HIC стадии. В большом масштабе это достигалось направлением потока, вытекающего из колонки в соответствующее время, в сборную емкость (бак-сборник). рН пула доводили до рН 6 и наносили на хроматографическую колонку сSP-сефарозой HP. Колонку промывали 20 mM сукцината, 0,2 М NaCl, рН 6 (градиентный буфер А). Связанный NGF элюировали 22 CV градиентом, начиная смесью из 70% градиентного буфера А и 30% градиентного буфера В и заканчивая смесью 80% градиентного буфера В (0,7 МNaCl/pH 6) и 20% градиентного буфера А. рН предпочтительно составляет 5-8, более предпоч 43 тительно с 5,7 до 6,5 и наиболее предпочтительно рН 6. Характерная хроматограмма приведена на фиг. 1. Пул SP-сефарозы HP обычно содержал около 95% 120 формы, 3% R120 формы, 0,65% изоаспартатной формы, 0,6% окисленной формы, 0,6% деамидированной формы. Другие неидентифицированные формы составляли 0,6% и включали двуокисленный NGF (Met37 и Met92) с присутствием деамидированного Asn45.HPIEX анализ, сравнивающий характерный HIC пул (нанесенный на SP-сефарозу) и пул, полученный после хроматографии на SP-сефарозе,показан на фиг. 2. Каждая из трех основных усеченных (clipped) форм NGF - 120, 118 и 117,может иметь варианты, но варианты, например,окисленные и изоаспартатные формы, преобладающей усеченной формы во время очистки (в данном примере 120-форма) могут мешать анализу вариантов менее преобладающей формы (в данном примере 118 и 117 - формы). HPLC анализ фракций характерного опыта показан на фиг. 3.SP-сефароза HP эффективно удаляла варианты, присутствующие в НIС пуле. R120 форма имеет дополнительный остаток аргинина у Nконца NGF; обычно N-концевой аминокислотной последовательностью rhNGF являетсяSSSHP, но R120 имеет RSSSHP N-концевую последовательность. Таким образом, R120 форма более основная, чем зрелый NGF и отделялась с помощью SP-SHP. Она характеризуется также более низкой биологической активностью, возможно связанной с тем фактом, чтоNGF N-конец необходим для связывания рецептора (trkA). Окисленная NGF форма является моноокисленной формой, содержащей метионин в положении 37, который окислен, образуя более кислую форму, которая элюируется в лидирующем (основном) крае NGF пика. Изоаспартатная форма содержит модифицированную аспарагиновую кислоту в положении 93. Изоаспартатная форма является немного более основной и поэтому связывается немного более прочно с полимером SP-сефарозы HP. NGF формы,содержащие isoAsp93, элюировали в отстающемNGF, содержащий деамидированный Asn, который образует Asp в положении 45, является несколько более кислым и элюировался в лидирующем (основном) крае пика элюирования.Fractogel EMD S03 является менее предпочтительным альтернативным полимером по сравнению с SP-сефарозой HP для разделения заряженных вариантов NGF форм. При использовании данного менее предпочтительного полимера для элюирования NGF требуются более высокие концентрации NaCl. 44 Получение композиции Вещество, находящееся в объеме, использовали для получения композиции путем UF/DF в буфер, использующийся для получении композиции, как в предыдущем примере. В конечном объеме продукта 120 форма обычно варьировалась от 92 до 97%, R120 от 1 до 4%, изоаспартатная форма от 0,2 до 1,5%, окисленная форма от 0,2 до 2% и деамидированная форма от 0,2 до 2%. Содержание 117 и 118 форм обычно составляло менее 2%. Конечный продукт обычно представлял собой, по крайней мере,чистый NGF с содержанием 99,5% NGF (включая все формы). Пример 3. Выделение 118/118 формы. В одном предпочтительном варианте, чтобы получить, по существу, чистую 118/118 NGF композицию, которая практически не содержала бы NGF вариантов, следовали методу, описанному в примере 2, со следующим изменением. Между Macroprep High S колонкой и колонкой из силикагеля использовали колонку с иммобилизованным трипсином. Пул Macroprep непосредственно подавали в колонку с иммобилизованным трипсином, доводя далее рН до 5-8,5,лучше до 6,5-7,5, если необходимо. Пул пропускали через колонку в течение времени, при котором большая часть NGF превращалась в 118 форму. Гидролизом протеазой 120 форма превращается в 118 форму при расщеплении (гидролизе) С-концевого VRRA в VR. Для достижения неполного и селективного расщепления(гидролиза) используют трипсин или трипсиноподобную протеазу, предпочительно трипсин,более предпочтительно легкодоступный трипсин свиньи или, наоборот, бычий трипсин или рекомбинантный трипсин. Может использоваться любой протеолитический метод, который обеспечивает практически неполное и селективное расщепление (гидролиз), но предпочтительной является колонка с иммобилизованным трипсином для того, чтобы свести до минимума контаминацию NGF продукта. Колонка работает при рН, способствующем протеазной активности, предпочтительно при рН 5,5-8,5, более предпочтительно 6,0-8,0 и наиболее предпочтительно от 6,5 до 7,5. В данном примере гликозилированныйNGF удаляли с помощью НIС, как предлагается в данном изобретении. После стадии на SPсефарозе HP, приведенной в примере 2, но,предпочительно, используя от 0,3 М до 0,55 М солевого градиента с объемом, равным 22 кратному объему колонки, получают композицию NGF для клинического применения. Исходя из RP-HPLC анализов, может быть получена композиция, содержащая более 70% 118 мономера, менее 10% 120 мономера и менее 15% 117 мономера. Обычно получают композицию, которая по содержанию больше или равна 90% 118/118 rhNGF, обычно, чаще больше или равна 93% 118/118 rhNGF с меньшим или равным 7% 45 содержанием деамидированных, изоаспартатных и окисленных вариантов. Один путь для достижения более высокой чистоты заключается в том, чтобы избежать сбора фракции, содержащей значительные количества вариантов, как например, можно получить в лидирующем (основном) или отстающем (стелющемся) крае основного пика нейротрофина, например, 118/118rhNGF пика. Пример 4. Частичная очистка и переупорядочение rhNT-4/5 из бактериальных включений. В данном примере очищали rhNT-4/5, начиная с 10 или 60 л ферментации. Хозяин, используемый для продуцирования рекомбинантного NT-4/5, относящегося к человеку, ферментацией, описанный в данном примере, являлся Е. coli штаммом, обозначенным 27C7/pmNT5DT; хотя NT-4/5, продуцированные другими штаммами и организмами, пригодны для описанного в данном изобретении способа очистки. Используемая в данном примере, экспрессирующая плазмида содержала кодирующую последовательность зрелого NT-4/5 под транскрипционной и трансляционной контрольной последовательностями, необходимыми для экспрессии NT-4/5 гена в E. coli. В NT-4/5 экспрессирующей плазмиде трансляционные последовательности, используемые для экспрессии гена в Е.coli, обеспечивались последовательностью щелочного фосфатазного промотора. "Лямбда" по отношению к терминатору транскрипции располагалась вблизи NT-4/5 терминирующего кодона. Секреция протеина из цитоплазмы управлялась STII сигнальной последовательностью. Большую часть rhNT-4/5 обнаруживали в клеточном периплазмическом пространстве как способное к рефракции тельце. Плазмиде приписывалась устойчивость к тетрациклину при трансформированном хозяине. Процесс ферментации осуществляли при 35-39 С и рН 7,0-7,8. Ферментацию проводили в течение 25-40 ч, в течение этого времени культуру охлаждали до сбора клеток, выросших в культуре. Культуру инактивировали с помощью тепловой обработки, используя аппарат с непрерывным потоком при 60 С или используя тепловую инактивацию в сосуде при этой температуре в течение 5-15 мин. Теплоинактивированную культуру центрифугировали, используя AX Alpha-Iaval или равноценную центрифугу. Клетки Е. coli отделяли в виде осадка. Клетки E.coli, экспрессирующие рекомбинантный NT-4/5, принадлежащий человеку, во внутриклеточные тельца, разрушали стандартными способами для получения пастообразной массы, содержащей NT-4/5 во внутриклеточных тельцах. В буфер не включались протеазные ингибиторы. Для отделения внутриклеточных телец от клеточного дебриса Е.соli NT-5 пасту ресуспендировали в 0,02 М Tris, рН 8,5 mM EDTA (10 мл буфера/г пасты), используя ротационное уст 002349 46 ройство механического диспергирования, например, Turrax. Клеточную суспензию пропускали через микрофлюидизатор три раза при 6000 psi (фунт/дюйм 2). Полученный гомогенат центрифугировали в Sorvall RC-3B центрифуге при 5000 об/мин в течение 45 мин. Супернатант отбрасывали и осадок ресуспендировали в 20mM Tris, рН 8,5 mM EDTA (экстракционный буфер), используя turrax в течение 2-3 мин при средней скорости. Гомогенат центрифугировали, как описано выше. Осадок ресуспендировали в экстрационном буфере и центрифугировали, как описано выше. Полученный осадок(и)(относящийся к NT-4/5 внутриклеточным тельцам или способным к рефракции тельцам) хранили при -70 С.NT-4/5 отделяли от внутриклеточных телец следующим образом. Осадок внутриклеточных телец суспендировали в 20 mM Tris, рН 8,6 М мочевина, 25 mM DTT (10 мл буфера/г внутриклеточного тельца), применяя turrax при средней скорости в течение 10 мин. Суспензию перемешивали в течение 40 мин при 2-8 С и центрифугировали в Sorvall RC3B при 5000 об/мин в течение 45 мин. Добавляли PEI (полиэтиленимин) до концентрации 0,1% в супернатанте, который перемешивали при 2-8 С в течение 30 мин. РЕI осаждает нуклеиновую кислоту и другие за кислоту ответственные молекулы. Смесь центрифугировали в Sorvall RC3B при 5000 об./мин в течение 45 мин. РЕI супернатант наносили на колонку с DEFF сефарозой быстрого пропускания (DEFF Sepharose Fast Flow)(10 смх 14 см; DEFF представляет собой диэтиламиноэтилсодержащий полимер), уравновешенную 0,02 М Tris, 6M мочевина, 10 mM DTT, рН 8. Эквивалент из 1 кг солюбилизированных способных к рефракции телец наносили на DEFF колонку. Поскольку восстановленный и денатурированный NT-4/5 не связывается с DEFF полимером, полученный пул, содержащий NT-4/5 и 6M мочевину, собирали (фиг. 6) и рН пула снижали до 5,0 уксусной кислотой. Пул с колонки DEFF с отрегулированным рН наносили на колонку с S-сефарозой быстрого пропускания (S-Sepharose Fast Flow) (S относится к SO3 функциональной группе на полимере), уравновешенную 20 mM ацетата, рН 5, содержащий 6 М мочевину при условиях, когда NT-4/5 связывается с полимером. После нанесения колонку с S-сефарозой быстрого пропускания промывали несколькими объемами, кратными объемам колонки, уравновешивающего буфера. Связанный NT-4/5 элюировали 0,5 М NaCl, 20 mM ацетата натрия, 6M мочевины, рН 5 (фиг. 7). 0,5 МNaCl SSFF пул подвергали диализу в течение ночи против 20 mM Tris, 0,14 М NaCl, рН 8, условия, которые позволяют переупорядочить NT4/5, хотя и ошибочных. Ошибочно упорядоченные rhNT-4/5 молекулы агрегировались, образуя осадок. 47 Агрегированный, ошибочно упорядоченный rhNT-4/5 процессировали, чтобы получить правильно упорядоченный NT-4/5. Агрегированный, ошибочно упорядоченный rhNT-4/5 собирали центрифугированием в виде осадка. Осадок ресуспендировали в 0,2 М Tris, рН 8, 4 М мочевины, 5 mM DTT и перемешивали при 28 С в течение 1-2 ч или пока осадок не растворится. Конечную концентрацию протеина доводили до 10 мг/мл протеина, исходя из коэффициента экстинкции 1,8 при 280 нм. К раствору солюбилизированного осадка добавляли окисленный глутатион до концентрации 20 mM, за которым следовало слабое перемешивание в течение 15-30 мин при 2-8 С. Окисленный глутатион реагирует с NT-4/5 сульфгидрильными группами,образуяNT-4/5-S-глутатионсмешанный дисульфид. NT-4/5-SG смешанный дисульфид разбавляли до конечной концентрации 0,1 - 0,5 мг/мл протеина в 100 mM Tris, 20mМ глицина, 15% PEG-300, 1 М гуанидин HCl,pH 8,3. Для инициирования соответствующего переупорядочения NT-4/5, к переупорядоченной смеси добавляли цистеин при концентрации от 2 до 4 mM, за которым следовало аэрирование(путем барботирования) раствора азотом или гелием в течение 5-60 мин перед герметизацией сосуда, чтобы исключить кислород. Переупорядочение NT-4/5 проводили в течение 18-24 ч при 2-8 С. Наоборот, rhNT-4/5 переупорядочивали с использованием сульфитолиза следующим образом. Осадок внутриклеточных телец (110 г) суспендировали в 1,1 л 20 mM Tris, 7M мочевины, 10 mM глицина, 100 mM сульфита натрия,10 mM тетратионата натрия и солюбилизировали с применением turrax в течение 10 мин при средней скорости. Далее смесь (1260 мл) перемешивали при 2-8 С в течение 45 мин. Добавляли PEI до конечной концентрации 0,1% PEI. Смесь перемешивали дополнительно 30 мин при 4 С и центрифугировали в течение 45 мин при 5500 об./мин в RC3B центрифуге. Супернатант наносили на DEFF колонку (4,4 смх 25 см),уравновешенную 20 mM Tris, 6 М мочевины, pH 8. DEFF сток доводили до pH 5 уксусной кислотой и наносили на колонку S-сефарозы быстрого пропускания (S-Sepharose Fast Flow)mM глицина, 15% PEG-300, pH 8,3. Переупорядочение NT-4/5 начинали добавлением от 2 до 4mM цистеина. Реакция переупорядочения, посуществу, завершается в течение 24 ч. Аэрирование инертным газом, например, гелием или азотом, может осуществляться для вытеснения кислорода из раствора. 48 Пример 5. Изолирование правильно упорядоченного rhNT-4/5 от конформационных(ошибочно упорядоченных) вариантов. Переупорядоченную смесь rhNT-4/5 примера 4 подвергали диализу против раствора сpH от 4 до 5 в течение ночи для удаления гуанидина и других реагентов. Для осветления раствора, раствор или центрифугировали в течение 45 мин при 5000 об/мин или пропускали через 0,2 мкн фильтр. Осветленный супернатант, содержащий от 0,5 до 5 г протеина, доводили до рН 3-5 путем добавления уксусной кислоты и или наносили на С 4 RP-HPLC колонку, или хранили в замороженном состоянии при -20 С, пока не был готов для очистки. В данном примере подкисленный и осветленный раствор наносили на С 4RP-HPLC (3 смх 50 см) колонку, на которой полимер связывал упорядоченный rhNT-4/5. Правильно упорядоченный NT-4/5 элюировали с использованием градиента ацетонитрила в растворе 0,05% трифторуксусной кислоты (TFA): градиент от 26 до 40% ацетонитрила (в пределах 95 минутного периода) в 0,05% TFA при скорости потока 25 мл/мин. Фракции собирали с интервалом в 1-1,5 мин (фиг. 8). Фракции анализировали на правильно упорядоченный NT-4/5 путем сравнения времени элюирования на аналитической С 4 HPLC Vydac (0,21 х 15 см) колонке со временем элюирования правильно упорядоченного NT-4/5 стандарта (фиг. 9). Стандартный правильно упорядоченный, интактный NT4/5 обычно элюировали 19 мин при скорости потока 2,5 мл/мин с 0,5% TFA/ ацетонитрил буферной системой. Фракции, содержащие правильно упорядоченный rhNT-4/5, объединяли и рН доводили до 5-7. Данный пул правильно упорядоченного rhNT-4/5 также содержал карбамилированные и N-концевые усеченные(clipped) формы NT-4/5. Полимер препаративной жидкостной хроматографии с обращенной фазой представляет собой полимер с диаметром частиц 10-40 микрон, размером пор около 200-400 и С 4-, С 8 или C18- алкильной группой. Более предпочтительно, если диаметр частиц носителя 15-40 микрон и размер пор 300 и представляет собой С 4 силикагель. Пример 6. Альтернативное изолирование правильно упорядоченного rhNT-4/5 от конформационных (ошибочно упорядоченных) вариантов. Переупорядоченную rhNT-4/5 смесь примера 4 концентрировали примерно 10-кратно с использованием Millipore-Pellicon ультрафильтрационной системы с 20 квадратофутовой целлюлозной (или полисульфоновой, или эквивалентной) мембраной с 10kD - ограничением молекулярного веса. Сконцентрированную смесь или подвергали диализу в течение ночи против 50 л 50 mM ацетата, рН 5,5, 50 mM NaCl или 49 диафильтрации в 50 mM ацетата 50 mM NaCl,рН 5,5 до фильтрации через 0,2 мкн мембрану. Отфильтрованную переупорядоченную смесь доводили до 2,5 М NaCl, 20 mM MOPSO,рН 7 и наносили на НIС колонку, Phenyl Toyopearl 650M колонку (10 смх 19 см), предварительно уравновешенную 2,5 М NaCl, 20 mM MOPSO,рН 7. Далее колонку промывали уравновешивающим буфером. Некоторые ошибочно упорядоченные формы rhNT-4/5 молекулы элюировали в полученных фракциях, в то время как другие ошибочно упорядоченные формы элюировались при высоких концентрациях органических растворителей, как, например, от 20 до 40% реактивного спирта. Правильно упорядоченный rhNT-4/5 элюировали с фенильной колонки с применением 2 М хлорида натрия, 10% реактивного спирта, рН 7 (фиг. 10). Вместо полимера с остовом Toyopearl могут использоваться другие полимеры, содержащие фенильные группы, как например, фенилсефароза(Phenyl Sepharose). Могут использоваться соли,предлагаемые в данном изобретении, и включающие сульфат, цитрат, ацетат аммония и хлорид калия. В зависимости от применяемой соли,концентрация соли обычно составляет от 1 М до 3 М, причем 2,5 М NaCl предпочтителен для нанесения и 2 М NaCl предпочтителен для элюирования при наличии органического растворителя. Предпочтительно использовать более низкие концентрации соли для элюирования и разделения нейротрофина и его вариантов. Для того, чтобы достигнуть элюирования, концентрация соли в буфере элюирования обычно ниже, чем концентрация ее в буфере для нанесения, но эти концентрации могут быть одинаковыми, если компенсируются органическим растворителем. Кроме того, применение органического растворителя имеет другое преимущество,как было установлено в данном изобретении,добавление органического растворителя улучшает характер элюирования, приводящий к более узкому профилю пиков. Кроме этанола, могут использоваться другие органические растворители, рассматриваемые в данном изобретении, включая пропанол, изопропанол и низшие алкиленгликоли, как например, пропиленгликоль, этиленгликоль и гексиленгликоль. Органический растворитель при концентрации от 5 до 25% (об/об), более предпочтительно при 5 до 20% (об/об), наиболее предпочтительно от 5 до 15% обычно элюирует правильно упорядоченный нейротрофин. Элюирование органическим растворителем может быть или в градиенте, или ступенчатым. Интервал рН предпочтительно от близко к нейтральному до слегка кислого, от рН 5 до 8, более предпочтительно рН от 5,5 до 7,5 и наиболее предпочтительно рН 7. Может применяться любой из буферов, рассматриваемый в данном изобретении, включая MOPSO, MOPS,HEPES, фосфатный, цитратный, аммонийный, 002349 50 ацетатный, пока они оказывают буферное действие при требуемом рН. Пример 7. Очистка правильно упорядоченного rhNT-4/5 от химических вариантов. Отделение правильно упорядоченного, интактного rhNT-4/5 от химических вариантов,включая карбамилированные и N-концевые усеченные (clipped) формы rhNT-4/5, достигалось катионообменной хроматографией высокого разрешения с использованием полимера SP сефарозы HP (SP-Sepharose HP) или полимераPolyCATa для HPLC. Если для удаления ошибочно упорядоченных вариантов использовали С 4 RP-HPLC колонку С 4 HPLC пул доводили до рН 5-7 и наносили на колонку 7 смх 19 см с SP-сефарозой HPNaCl. Полимер со связанным NT-4/5 промывали буфером для уравновешивания. СвязанныйrhNT-4/5 элюировали и отделяли от карбамилированных и N-концевых усеченных (clipped) форм с применением градиента от 0,2 М NaCl до 0,4 М NaCl, рН 6 (т.е. градиент соли в буфере для уравновешивания), объем которого соответствовал 22 объемам колонки (CV) (фиг. 11). Фракции, содержащие NT-4/5, объединяли и использовали для приготовления композиции в 0,05 М ацетата с рН от 4 до 5. Интактный rhNT4/5 идентифицировали и отличали от вариантов во фракциях, предпочтительно аналитическойRP - HPLC или SDS-PAGE, сравнивая со стандартом. Наоборот, вариантные формы NT-4/5 удаляли с помощью катионообменной хроматографии высокого разрешения HPLC на колонке с полиаспарагиновой кислотой(PolyCATa,PolyLC, Columbia, Md) (9,4 х 200 мм) (фиг. 12). С 4 HPLC пул доводили до рН 5-6 и далее наносили на PolyCAT колонку. Условия хроматографирования были следующие: буфер А представлял собой 20 mM фосфата, 5% ацетонитрила, рН 6; буфер В представлял собой 20 mM фосфата, 5% ацетонитрила, 0,8 М КСl, рН 6.rhNT-4/5 элюировали с использованием градиента от 25 до 60% буфера В в пределах 65 мин(фиг. 12). Фракции собирали с 1 минутными интервалами и анализировали с помощью аналитической С 4 HPLC, как описано выше. Если для удаления ошибочно упорядоченных вариантов использовали HIC (пример 6 выше), правильно упорядоченный NT-4/5 пул подвергали диализу в течение ночи в 20 mM сукцината, 0,1 М NaCl, 5% реактивного спирта,рН 6 или ультрафильтрации/диафильтрации в 20mM сукцинатном буфере. Далее пул после диализа или UF/DF наносили на колонку с SPсефарозой HP (SP-Sepharose HP) или PolyCATa колонку, как описано выше. Приготовление композиции Фракции, содержащие правильно упорядоченный интактный NT-4/5 (от SP-Sepharose HP 51 или PolyCATa HPLC стадии), объединяли и концентрировали до 1-5 мг/мл в 20 mM ацетата с рН 4-5 буфере для приготовления композиции. Наоборот, NT-4/5 применялся для приготовления композиции, используя ультрафильтрацию/диафильтрацию. Конечный раствор анализировали с помощью аминокислотного анализа, анализом Nконцевой последовательности, масс-спектрометрией, SDS-PAGE (фиг. 13) и биологическим анализом, активационным анализом киназного рецептора (kinase receptor activation, KIRA) рецептора, который детектирует NT-4/5 активацию аутофосфорилирования тирозинкиназного(trk В), расположенного в клеточной мембране. Все способы применяли для характеристики очищенного rhNT-4/5. Использовали СНО клетки, экспрессирующие trk В с gD tag. В WO 95/14930, published June 1, 1995 описан KIRA анализ и данная заявка приведена в настоящем изобретении в качестве ссылки. Согласно этому анализу rhNT-4/5 содержал ЕС 50 в количестве 12,6 нг/мл. Обычно ЕС 50 правильно упорядоченного интактного NT-4/5, очищенного, как описано в данном изобретении, составляет от 5 до 30, наиболее предпочтительно, от 10 до 20. Чистота rhNT-4/5 по отношению к не NT4/5 протеинам обычно составляла от 90 до 99%. Гомогенность NT-4/5, что касается карбамилированных и N-концевых усеченных (clipped) вариантов, составляла от 90 до 99%. Наиболее часто и предпочтительно чистота и гомогенность составляют 99% или выше. Пример 8. Первичная очистка, переупорядочение и конечная очистка rhNТ-3 от бактериальных внутриклеточных телец. Для изолирования внутриклеточных телец от клеточного дебриса, Е.coli NT-3 пастообразную массу (1 кг) ресуспендировали в 10 л 100mM ацетата натрия, рН 5 с применением ротационной установки механического диспергирования, например, turrax. Клеточную суспензию пропускали через микрофлюидайзер три раза при 6000 psi (фунт/дюйм 2). Полученный гомогенат центрифугировали в Sorvall RC-3B центрифуге при 5000 об./мин в течение 30 мин.NT-3 отделяли от внутриклеточных телец следующим образом. Осадок внутриклеточных телец суспендировали в 100 mM Tris, 100 mMmM тетратионата натрия, 7,5 М мочевины, рН 8,3 (10 мл/г внутриклеточного тельца) с использованием turrax при средней скорости в течение 10 мин. Суспензию перемешивали в течение одного часа при 2-8 С. Добавляли PEI (полиэтиленимин) до 0,15% (конечная концентрация) и перемешивали при 2-8 С в течение 30 мин. Смесь центрифугировали в Sorval RC3B при 5000 об/мин в течение 30 мин. Супернатант фильтровали через Gelman Preflow кассету. Отфильтрованный супернатант разбавляли тремя объемами S-Sepharose Fast Flow буфера для 52 уравновешивания (50 mM ацетата натрия, 50 М мочевины, рН 5). Разбавленный отфильтрованный супернатант (проводимость менее 7 mS) наносили на колонку с S-сефарозой FF (SSepharose FF), уравновешенную 50 mM ацетата натрия, 5 М мочевины, рН 5,0. Колонку вначале промывали 50 mM ацетата натрия, 5 М мочевины, рН 5, за которым следовало 50 mM MOPS,5M мочевины, 10 mM глицина рН 7,0. Сульфитолизированный NT-3 элюировали из колонки с применением 10 колоночных объемов градиента от 0 до 0,6 М NaCl в 50 mM MOPS, 5 М мочевины, 10 mM глицина, рН 7. Частично очищенный NT-3 переупорядочивали разбавлением S-Sepharose FF пула до 0,1 мг/мл протеина в буфере переупорядочения, содержащем 0,1 М Tris, 2 М мочевины, 0,1 МNaCl, 15% PEG 300, 10 mM глицина, 25 mM этаноламина, рН 9,1. Переупорядочение инициировали добавлением цистеина до примерно 5 mM и перемешиванием в течение 2-5 дней при 2-8 С. Буфер для переупорядочения может разбрызгиваться гелием или аргоном, чтобы уменьшить концентрацию кислорода в растворе для переупорядочивания. рН переупорядоченного пула доводили до рН 7, фильтровали и наносили на MacroprepHigh S катионообменную хроматографическую колонку, уравновешенную 50 mM HEPES, рН 7. После нанесения рН доведенного переупорядоченного пула на Macroprep колонку, в начале колонку промывали 50 mM, MOPS, рН 7, за которым следовало 50 mM MOPS, 0,1 М ТМАС,0,3 М NaCl, рН 7. NT-3 элюировали 50 mMMacroprep пул далее дополнительно очищали на колонке с высокозамещенной фенилсефарозой быстрого пропускания (Phenyl Sepharose Dast Flow High Substitution). Колонку, содержащую фенильные группы, уравновешивали 50 mM HEPES, 1,5 М NaCl, рН 7 и Macroprep пул непосредственно наносили на фенильную колонку. Колонку промывали уравновешивающим буфером и затем правильно упорядоченный NT-3 элюировали с использованием 15 колоночных объемов градиента, начиная с 50 mMHEPES, 1,5 М NaCl, рН 7 до 50 mM HEPES, 10% реактивного спирта, рН 7. Фракции анализировали или с С 4 HPLC или SDS-PAGE и фракции,содержащие правильно упорядоченный NT-3,объединяли. Фенильный пул разбавляли до менее, чем 25 mS (обычно 2 объемами воды) и наносили на колонку с SP-сефарозой HP (SP-SepharoseMOPSO, рН 7. В начале колонку промывали уравновешенным буфером и NT-3 элюировали с колонки, применяя объем градиента, соответствующего 20 объемам колонки, начиная с 0,35 М ТМАС до 0,65 М ТМАС в 25 mM MOPSO, рН 7. Фракции, содержащие rhNT-3 (исходя из С 4SP-сефарозный HP (SP-Sepharose HP) пул концентрировали до 1 мг/мл на 10000 молекулярного веса мембране и далее подвергали диафильтрации 6 объемами 10 mM ацетата, 140 mM ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ выделения нейротрофина из смеси, содержащей варианты данного нейротрофина, которая может включать ошибочно упорядоченный вариант, неправильно протеолитически процессированный вариант и гликозилированный вариант данного нейротрофина,включающий а) нанесение смеси на полимер гидрофобной хроматографии,б) элюирование нейротрофина с полимера буфером для элюирования в условиях, при которых нейротрофин отделяется от варианта, и с) сбор нейротрофина. 2. Способ по п.1, отличающийся тем, что полимер содержит фенильную функциональную группу. 56 3. Способ по п.1, отличающийся тем, что смесь, нанесенная на полимер гидрофобной хроматографии, имеет рН от 5 до 8. 4. Способ по п.1, отличающийся тем, что смесь, нанесенная на полимер, имеет концентрацию соли от 0,5 до 3 М. 5. Способ по п.4, отличающийся тем, что смесь, нанесенная на полимер, имеет концентрацию соли от 0,5 до 2,5 М. 6. Способ по п.5, отличающийся тем, что смесь, нанесенная на полимер, имеет концентрацию соли 0,7 М ацетата или от 1,0 до 2,5 МNaCl. 7. Способ по п.1, отличающийся тем, что буфер для элюирования содержит органический растворитель. 8. Способ по п.7, отличающийся тем, что концентрация органического растворителя составляет от 5 до 20 об.%. 9. Способ по п.1, отличающийся тем, что рН буфера для элюирования составляет от 5 до 8. 10. Способ по п.1, отличающийся тем, что элюирование включает уменьшающийся градиент соли. 11. Способ по п.1, отличающийся тем, что нейротрофин относится к NGF-семейству. 12. Способ по п.11, отличающийся тем, что нейротрофин представляет собой NGF, NT-4/5 или NT-3. 13. Способ по п.1, отличающийся тем, что нейротрофин получают из бактериальной культуры и переупорядочивают in vitro с применением гидрофобного полимера. 14. Способ по п.1, отличающийся тем, что нейротрофин отделяют от культуры клеток млекопитающих. 15. Способ по п.1, дополнительно включающий стадию отделения нейротрофина от его вариантов с использованием полимера катионообменной хроматографии высокого разрешения. 16. Способ по п.15, отличающийся тем, что стадия отделения с помощью катионообменной хроматографии высокого разрешения включает нанесение смеси, содержащей нейротрофин и его варианты, на полимер катионообменной хроматографии высокого разрешения и элюирование нейротрофина с полимера в условиях, при которых нейротрофин отделяется от вариантов,при этом нейротрофин имеет высокую pI. 17. Способ по п.16, отличающийся тем, что катионообменным полимером высокого разрешения является SP-сефароза HP, полиаспарагиновая кислота, полисульфоэтилкатионообменный или Fractogel EMD S03 полимер. 18. Способ по п.16, отличающийся тем, что нейротрофинсодержащий элюат от катионообменного полимера высокого разрешения обессоливают или подвергают диафильтрации и далее используют с носителем для получения композиции. 19. Способ по п.1, дополнительно включающий отделение нейротрофина от других 57 протеинов с использованием силикагеля путем элюирования нейротрофина буфером для элюирования, содержащего, в основном, ТМАС или ТЕАС, буферируемые при рН от 3,5 до 8,0. 20. Способ по п.19, включающий отделение нейротрофина от других протеинов с использованием силикагеля в отсутствии спиртового или полярного апротонного растворителя. 21. Способ по п.15, отличающийся тем, что нейротрофин и его вариант до разделения, посуществу, являются чистыми. 22. Способ по п.15, дополнительно включающий стадию отделения нейротрофина от ошибочно упорядоченного варианта данного нейротрофина с применением полимера препаративной хроматографии с обращенной фазой. 23. Способ по п.22, отличающийся тем, что полимер содержит С 4 функциональную группу. 24. Способ по п.1, дополнительно включающий стадию очистки с использованием хроматографии высокого разрешения и состоящий,таким образом, из следующих стадий: 58 а) нанесение смеси, содержащей нейротрофин и его варианты, на полимер гидрофобной хроматографии при рН от 5 до 8,б) промывание полимера буфером с рН от 5 до 8,в) элюирование нейротрофина буфером с рН от 5 до 8, содержащим спиртовой или полярный апротонный растворитель с концентрацией от 5 до 25% (об./об.),г) нанесение нейротрофинсодержащего элюата на полимер катионной хроматографии высокого разрешения при рН от 5 до 6 и д) элюирование нейротрофина с полимера катионнообменной хроматографии высокого разрешения буфером с рН от 5 до 6, содержащим концентрацию катиона от 0,2 до 0,5 М. 25. Композиция, содержащая нейротрофин, полученный способом по любому из предыдущих пунктов. 26. Композиция по п.25, дополнительно содержащая приемлемый носитель. 27. Композиция по п.26, выполненная стерильной.
МПК / Метки
МПК: C07K 14/475
Метки: нейротрофинов, очистка
Код ссылки
<a href="https://eas.patents.su/30-2349-ochistka-nejjrotrofinov.html" rel="bookmark" title="База патентов Евразийского Союза">Очистка нейротрофинов</a>
Предыдущий патент: Соединения 1-арил-2-ациламиноэтана и их применение в качестве антагонистов нейрокинина, в частности нейрокинина 1.
Следующий патент: Замещенные пиразол-3-илбензазолы
Случайный патент: 1,2,4-оксадиазольные соединения для лечения аутоиммунных заболеваний