Микроэлектрод и пучок микроэлектродов, содержащие устройства для высвобождения лекарственных средств в ткани
Номер патента: 23177
Опубликовано: 31.05.2016
Авторы: Шоуэнборг Йенс, Эк Фредрик, Петерссон Пер, Эрикссон Линсмейер Йенни, Даниельсен Нильс
Формула / Реферат
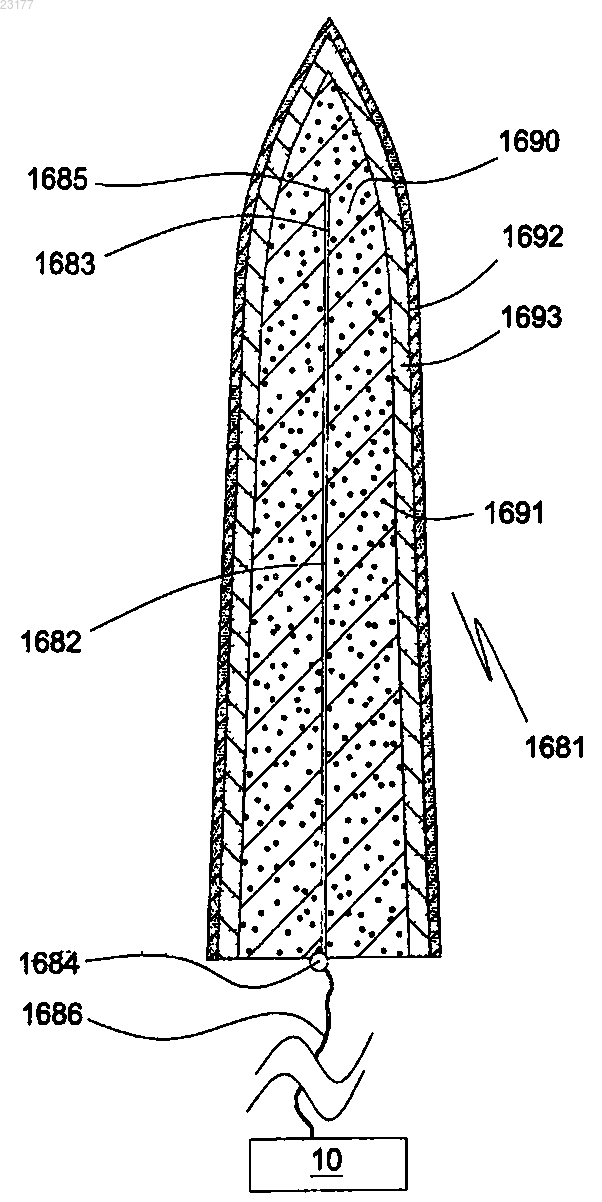
1. Медицинский микроэлектрод для введения в мягкую ткань, содержащий электропроводящее удлиненное тело электрода, имеющее первый проксимальный конец и второй дистальный конец, причем тело электрода содержит концевую часть, проходящую от его дистального конца, основную часть тела, проходящую в проксимальном направлении от концевой части, и соединительную часть, проходящую в проксимальном направлении от основной части тела; при этом концевая часть, основная часть тела и соединительная часть встроены в первый электродный матричный элемент, который является, по существу, жестким, биосовместимым и растворимым или биоразлагаемым в жидкости организма, при этом указанный микроэлектрод дополнительно содержит один или оба из следующего:
замедляющий растворение слой на первом электродном матричном элементе;
второй электродный матричный элемент, расположенный между первым электродным матричным элементом и телом электрода;
при этом лекарственное средство, способное к высвобождению после растворения или биологического разложения первого электродного матричного элемента, содержится в первом электродном матричном элементе или втором электродном матричном элементе.
2. Микроэлектрод по п.1, содержащий фиксирующее средство, расположенное в концевой части.
3. Микроэлектрод по п.1 или 2, в котором тело электрода содержит непроводящую сердцевину, один или более электропроводящих слоев на сердцевине, изолирующий слой на одном или более электропроводящих слоях и, возможно, один или несколько каналов, проходящих через изолирующий слой перпендикулярно сердцевине и обеспечивающих электрический контакт с электропроводящим слоем/слоями.
4. Микроэлектрод по любому из пп.1-3, в котором концевая часть, основная часть тела и фиксирующее средство полностью встроены в первый электродный матричный элемент.
5. Микроэлектрод по любому из пп.1-4, в котором первый электродный матричный элемент содержит две или более частей, различающихся по своей скорости растворения или разложения.
6. Микроэлектрод по любому из пп.1-5, в котором диаметр тела электрода составляет от приблизительно 10-7 м до приблизительно 10-4 м.
7. Микроэлектрод по любому из пп.1-6, в котором лекарственное средство содержится в микрокапсуле или в стержне из биоразлагаемого материала или материала, растворимого в жидкости организма.
8. Микроэлектрод по любому из пп.1-7, в котором основная часть тела содержит части, выполненные с возможностью перемещения друг относительно друга по мере растворения или разложения первого электродного матричного элемента так, чтобы расстояние между ними вдоль тела электрода увеличивалось или уменьшалось.
9. Микроэлектрод по любому из пп.1-8, в котором второй электродный матричный элемент содержит две или более частей.
10. Микроэлектрод по любому из пп.1-9, в котором первый электродный матричный элемент содержит первое лекарственное средство, а второй электродный матричный элемент содержит второе лекарственное средство.
11. Пучок медицинских микроэлектродов, содержащий два или более электрода по любому из пп.1-10, причем тела этих электродов расположены, по существу, параллельно и используют общий указанный первый электродный матричный элемент или содержат матричный элемент пучка, охватывающий указанные первые матричные элементы.
12. Пучок по п.11, содержащий замедляющее растворение покрытие на общем первом электродном матричном элементе или на матричном элементе пучка.
13. Пучок по п.11 или 12, в котором проксимальные концы двух или более электродов расположены, по существу, в одной плоскости.
14. Пучок по любому из пп.11-13, содержащий устройство для формирования пучков, расположенное на проксимальных концах или около проксимальных концов электродов.
15. Пучок по любому из пп.11-14, содержащий одно или более оптических волокон.
16. Пучок по любому из пп.11-15, в котором два или более первых или вторых электродных матричных элемента содержат разные количества лекарственного средства.
17. Пучок по любому из пп.11-15, в котором два или более первых или вторых электродных матричных элемента отличаются по своим свойствам в отношении высвобождения лекарственного средства.
18. Пучок по любому из пп.11-17, содержащий съемное соединительное средство для элемента для введения пучка.
Текст
МИКРОЭЛЕКТРОД И ПУЧОК МИКРОЭЛЕКТРОДОВ, СОДЕРЖАЩИЕ УСТРОЙСТВА ДЛЯ ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ТКАНИ Медицинский микроэлектрод (1681) для введения в мягкую ткань содержит электропроводящее удлиненное тело электрода (1682), имеющее концевую часть (1683), основную часть тела и соединительную часть. Концевая часть, основная часть тела и соединительная часть встроены в первый электродный матричный элемент (1693), который является, по существу, жестким,биосовместимым и растворимым или биоразлагаемым в жидкости организма. Кроме того,микроэлектрод дополнительно содержит замедляющий растворение слой (1692) на первом электродном матричном элементе и/или второй электродный матричный элемент (1690),расположенный между первым электродным матричным элементом и телом электрода. По мере растворения или биоразложения первого электродного матричного элемента лекарственное средство, содержащееся в первом электродном матричном элементе или втором электродном матричном элементе, высвобождается в ткань. Также описан пучок медицинских микроэлектродов. Область изобретения Данное изобретение относится к медицинскому микроэлектроду и к множественным медицинским микроэлектродам. В частности, изобретение относится к медицинскому микроэлектроду, к пучку микроэлектродов и к массиву микроэлектродов и/или микроэлектродных пучков. Микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно настоящему изобретению предназначены для введения в мягкую ткань, такую как головной мозг, спинной мозг, эндокринные органы, мышцы и соединительная ткань. Предшествующий уровень техники Микроэлектроды, которые могут быть имплантированы на длительный срок в центральную нервную систему (ЦНС), имеют широкую область применения. В данном изобретении термин "электрод" относится к микроэлектроду. В принципе, с использованием таких электродов можно осуществлять запись со всех ядер головного мозга или стимуляцию всех ядер головного мозга и проводить мониторинг их функционирования. Особое значение в стимуляции ядер головного мозга имеет использование многоканальной конструкции. В такой конструкции группы электродов или даже отдельные электроды могут быть использованы по отдельности. Это позволяет пользователю выбирать те электроды, под действием которых стимуляция вызывает улучшенный по сравнению с неселективной стимуляцией терапевтический эффект. Стимуляция головного мозга или спинного мозга может иметь особое значение в ситуациях, когда ядра головного мозга подвержены дегенеративным изменениям или повреждениям. В некоторых ситуациях также было бы полезно иметь возможность совмещения контролируемой электрической стимуляции и локального переноса генов. Благодаря многоканальной конструкции пользователь также будет способен эффективно измерить то влияние, которое оказывает системное или локальное введение лекарственного средства или локальный перенос генов на многочисленные нейроны и другие клетки. Особый интерес представляет возможность одновременного измерения влияния разнообразных кандидатов в лекарственные средства на нейронные функции. Мониторинг активности головного мозга через имплантированные электроды также может быть полезен, если его используют для контроля доставки лекарственных средств локально или системно либо для контроля других терапевтических методов, таких как электрическая стимуляция ядер головного мозга. Многоканальные электроды также могут быть использованы для внесения повреждений в конкретные и ограниченные участки в ткани после детектирования аномальной импульсной активности, зарегистрированной с использованием электродов или изображений, таких как получаемые с использованием fMRI (ФМРТ; функциональной магнитнорезонансной томографии) или PET (ПЭТ, позитронно-эмиссионной томографии). Для записи и стимуляции структур головного мозга разработаны различные формы имплантируемых электродов (US 6253110 В 1, US 5957958, US 4573481, US 7146221 В 2, US 5741319, US 4920979, US 5215008, US 5031621, US 6993392 B2, US 6032062, US 4852573, US 3995560, US 7041492, US 6421566 B1,US 4379462, US 5417719, US 3822708, US 5501703, US 7099718 B1, US 3724467; US 2007/0197892 A1). Однако травмам и осложнениям, вызываемым процедурой имплантации, уделено мало внимания. Мало того, что эти последствия могут приводить к нарушению функционирования имплантата, они также могут наносить вред субъекту, которому электроды имплантированы. Функционирование имплантированных электродов, а также ткани, в которую данный имплантат вводится, может быть нарушено в результате или 1) острого повреждения тканей, включая кровотечение и инфаркт ткани, или 2) инфекции, или 3) тканевых реакций, включая воспаление и активацию глиальных клеток, вызванных процедурой имплантации, или 4) продолжительной тканевой реакции, включая активацию глиальных клеток и образование рубцов, приводящей к изолированию имплантата, и/или 5) движений между электродом и тканью. Обычно эти последствия наблюдаются в разные промежутки времени во время и после имплантации. 1) При имплантации микроэлектродов в ткань центральной нервной системы существует, помимо общего риска, связанного с открытым оперативным вмешательством, локальные риски, такие как кровотечения, а также инфаркты данной ткани. В процессе имплантации электроды могут повредить кровеносные сосуды. Это может привести к кровотечению и вазоконстрикции. В результате этого может быть инициирован сильный воспалительный ответ на клетки и белки крови, которые просочились в нервную ткань, и такое воздействие на ткань может продолжаться в течение длительных периодов времени. В свою очередь, это может привести к гибели клеток в области, питание которой осуществляется через пострадавший сосуд. Как следствие, функции электродного имплантата могут быть нарушены. 2) Общая хирургия и особенно имплантация искусственных устройств также увеличивают риск инфекций. Область проведения хирургической операции может быть инфицирована во время операции или в ранней фазе восстановления после операции. Присутствие в организме инородного материала (самого имплантата) также может приводить к образованию locus minoris для порождения инфекции в ткани, окружающей электроды. Как правило, инфекции тканей вокруг имплантатов труднее поддаются лечению антибиотиками, чем другие инфекции тканей. Инфекции вблизи имплантированных электродов помимо ухудшения функции ткани также могут поставить под угрозу функционирование имплантированных электродов, и в крайних случаях, чтобы справиться с инфекцией, может потребоваться удаление устройства. В дополнение к общей защите посредством системного введения антибиотиков было бы предпоч-1 023177 тительно иметь возможность локального лечения инфекций вблизи имплантированных электродов. 3) Имплантация электродов в ткань центральной нервной системы всегда будет вызывать острое воспаление вследствие причиненных повреждений (Ghirnikar, R.S. et al., Neurochemical Research, 1998,23(3): 329-340; Norton, W.T., Neurochemical Research, 1999, 24(2): 213-218). Это является нормальной физиологической реакцией и это необходимо для процесса заживления. В случае наличия в данной ткани постоянно закрепленного материала этот инородный для организма материал может, помимо всего прочего, индуцировать хроническое воспаление, которое в худших случаях может поставить под угрозу функционирование имплантата и ткани. Следовательно, материал и процедуры, связанные с данными устройствами, должны минимизировать хроническое воспаление. Еще одним осложнением, которое нуждается в рассмотрении, является реакция глиальных клеток, в частности, астроцитов и микроглий. В случае прободных повреждений ткани центральной нервной системы астроциты будут пролиферировать и формировать астроглиальный рубец (Eng, F.E. et al., Neurochemical Research, 2000, 25: 1439-1451; Polikov, V.S. et al., 2005, J. Neuroscience Methods, 148: 1-18). Такой рубец может образовывать капсулообразную структуру, окружающую имплантированный электрод, и, тем самым, изолировать его от остальной ткани центральной нервной системы. В случаях большой астроглиальной капсулы это может ухудшить функционирование электродов. Таким образом, реакцию астроглиальных клеток необходимо контролировать. Тем не менее, ее не следует полностью избегать, поскольку имеются указания на то, что отсутствие участия астроцитов в действительности будет вызывать обширное воспаление и тканевую реакцию,ухудшающую ситуацию (Eng, F.E. et al., Neurochemical Research, 2000, 25: 1439-1451; Sofroniew, M.V. etal., Neuroscientist, 2005, 11 (5): 400-407). Микроглии также могут пролиферировать после имплантации. Эти клетки обладают фагоцитарной способностью и также высвобождают ряд веществ, которые могут вызывать воспаление хронического типа. Благодаря контролю за микроглиями можно уменьшить вероятность образования астроцитарной капсулы. Помимо представления риска для здоровья тканевые реакции, вызванные различными типами глиальных клеток, могут привести к нарушению функционирования имплантированных электродов. Например, в том случае, когда вокруг электродов создается зона, лишенная нейронов, или образуется рубец, потребуется намного большая величина тока для активации живых нейронов. Повышенные величины тока, необходимые для стимуляции отдаленных нейронов, в свою очередь могут вызывать дальнейшее повреждение ткани в результате рассеяния тепла и/или в результате индукции необратимых восстановительных или окислительных реакций (см. также US 6316018). 4) Сама конструкция многоканального электрода также может инициировать задержанные и продолжительные тканевые ответы после имплантации, по меньшей мере отчасти из-за движений между электродным имплантатом и тканью. Особое значение имеют эндогенные движения, вызываемые дыханием и сердцебиением. Являющиеся результатом этого пульсирующие движения обычно неравномерно распространяются в данной ткани. Например, движение, вызванное сердцебиением вокруг основной артерии, распространяется через эту ткань неравномерным образом. Движения между имплантатом и тканью происходят, если имплантат является жестким или прикреплен к жесткой структуре, которая не двигается вместе с мягкой тканью, в которую электроды имплантированы. Поэтому было бы предпочтительно использовать гибкие электроды, которые после имплантации закреплены в ткани, а не в черепе или скелете, и которые могут следовать за движениями ткани и, тем самым, позволят избежать трения между электродами и тканью, которое в противном случае может возникать и может инициировать тканевые ответы. Движения между электродом и тканью могут привести к ситуации с неустойчивой регистрацией/стимуляцией и тем самым нарушению функционирования имплантата. Поэтому, чтобы уменьшить движение между отдельными электродами и прилегающей к ним тканью, вызванное такими эндогенными движениями, электроды должны быть в состоянии следовать за движениями ткани во всех направлениях. Дополнительная трудность при использовании многоканальных электродов для научных исследований, в частности, многоканальных электродов, состоящих из множества электродов, заключается в том, что обычно трудно или невозможно идентифицировать нейроны или клетки, регистрируемые/стимулируемые отдельными электродами. Это значительно затрудняет интерпретацию результатов,поскольку не позволяет связать регистрируемые сигналы с типом клетки или клеточной морфологией. Это также может вызывать проблемы в интерпретации эффектов стимуляции, поскольку не ясно, какие клетки были подвергнуты стимуляции. Поэтому существенным преимуществом было бы, если бы вышеупомянутых осложнений можно было избежать или, по меньшей мере, их облегчить. Задачи изобретения Данным изобретением решается задача разработки медицинского микроэлектрода, пучка микроэлектродов или массива микроэлектродов либо пучков микроэлектродов, лишенных одного или более недостатков микроэлектродов, пучков микроэлектродов или массивов микроэлектродных пучков, известных в данной области. Другая задача изобретения заключается в разработке способа изучения фармакологического действия различных концентраций лекарственного средства на живую ткань, в частности, нервную ткань, такую как головной мозг. Другие задачи изобретения станут очевидны из последующего описания сущности изобретения, ряда предпочтительных вариантов его выполнения, проиллюстрированных графическими материалами, и формулы изобретения. Сущность изобретения Согласно настоящему изобретению описан гибкий медицинский микроэлектрод, пучок микроэлектродов и массив микроэлектродов и/или микроэлектродных пучков, содержащий устройство для высвобождения лекарственного средства и/или генетического вектора в ткань, в которую введен этот электрод,пучок или массив. В дальнейшем подразумевается, что термин "лекарственное средство" также включает"генетический вектор". Микроэлектрод согласно изобретению, независимо от того, является ли он одиночным электродом или содержится в пучке электродов либо массиве электродных пучков согласно изобретению, содержит электропроводящее тело электрода и не проводящий электрический ток электродный матричный элемент, стабилизирующий тело электрода во время его введения в ткань. Электродный матричный элемент состоит из материала или содержит материал, растворимый и/или разлагаемый в ткани, то есть в жидкости организма. Устройство для высвобождения лекарственного средства и/или генетического вектора представляет собой матрицу или содержится в матрице согласно изобретению,как, например, частицы, распределенные во всей матрице согласно изобретению или в части данной матрицы, способные образовывать водный раствор лекарственного средства при контакте с жидкостью организма во время растворения или разложения матрицы. Данные частицы могут представлять собой частицы лекарственного средства или частицы носителя, содержащие лекарственное средство, например микрокапсулы или пористые либо многослойные микросферы, содержащие лекарственное средство. Кроме того, в объеме настоящего изобретения находится ситуация, когда лекарственное средство связано с матрицей согласно изобретению или с частицами, распределенными в матрице согласно изобретению, связью, которая расщепляется, в частности в результате гидролиза или под действием фермента,при контакте с жидкостью организма. Лекарственное средство или содержащие лекарственное средство частицы могут быть распределены по всему матричному элементу или в частях матричного элемента, в частности, в частях матричного элемента, окружающих конец электрода. Их распределение может быть равномерным или таким, которое обеспечивает градиент концентрации. Тело микроэлектрода согласно изобретению содержит дистальную концевую часть электрода,включая острый, тупой или даже сферический конец, основную часть тела, проходящую в проксимальном направлении от концевой части, и, возможно, проксимальную соединительную часть, проходящую в проксимальном направлении от основной части тела. Определения "дистальный", или "первый", и "проксимальный", или "второй", относятся к направлению введения электрода в ткань, начиная с конца электрода. После введения микроэлектрода согласно изобретению в ткань либо как такового, либо в составе пучка электродов или массива электродов или электродных пучков, и растворения или разложения электродного матричного элемента под действием жидкости организма и, в случае пучка электродов или массива электродов либо электродных пучков, (дополнительного) растворения матрицы или матриц пучка или массива под действием жидкости организма, электрод согласно изобретению превращается в микроэлектрод, размещенный в мягкой ткани. Предпочтительно, чтобы тело электрода, в частности его концевая часть, содержало средство для фиксации тела электрода в ткани, такое как крючок. Предпочтительно, чтобы части тела электрода были изолированы. Особенно предпочтительна схема изоляции, при которой основная часть тела или большая его часть изолирована, в то время как концевая часть не изолирована. Предпочтительно, чтобы диаметр тела электрода, в частности, его основной части, составлял приблизительно от 10-7 до 10-4 м. За исключением элементов, проходящих латерально относительно тела электрода, например, крючков для фиксации в ткани, предпочтительно, чтобы основная часть тела электрода имела одинаковый диаметр. В частности, поперечное сечение основной части тела имело бы форму круга. Предпочтительно, чтобы основная часть тела была цилиндрической или была изготовлена из(цилиндрической) металлической проволоки посредством ее скручивания. Альтернативно, основная часть тела предпочтительно является плоской и прямоугольной в поперечном сечении; электроды с плоскими тонкими частями тела могут быть изготовлены, например, с использованием литографических способов травления, применяемых для обработки тонкого слоя металла на электроизолирующей подложке. Альтернативно, плоские тонкие части тела, которые могут состоять из одного или более электропроводящих слоев и одного или более электроизолирующих слоев, можно нарезать, например, с использованием лазерной резки, из соответствующего многослойного листа материала. Возможно также, чтобы каждый такой слой состоял из электропроводящих частей и электроизолирующих частей. Тем не менее,согласно данному изобретению, не исключается использование другой геометрии, нежели упомянутая выше. Согласно предпочтительному аспекту изобретения в теле микроэлектрода отсутствует проксимальная соединительная часть, при этом основная часть тела представляет собой единое целое с электрическим проводником, что необходимо для создания электрического контакта между телом электрода и блоком управления электродом. Предпочтительно, чтобы тело электрода и электрический проводник состояли из одного и того же материала, например из тонкой металлической проволоки с хорошей электропроводностью. В отсутствие проксимальной соединительной части номинальной длиной тела электрода согласно изобретению является длина, на которую он встроен в электродную матрицу. В варианте выполнения настоящего изобретения, характеризующемся отсутствием проксимальной соединительной части, проксимальный конец тела электрода задается проксимальным концом матрицы. В процессе использования электрод согласно изобретению, независимо от того, используется ли он в виде одиночного электрода или содержится в пучке электродов либо массиве электродов или электродных пучков, электрически связан с блоком управления. Блок управления согласно изобретению подает электрический ток в электрод и/или осуществляет обнаружение электрического тока или электрического потенциала, передаваемого этим электродом, при этом ток или потенциал возникает в ткани, в которую введен электрод. Блок управления согласно изобретению содержит микропроцессор и управляющее программное обеспечение, хранящееся в памяти микропроцессора. Блок управления согласно изобретению может быть размещен внутри или снаружи человека или животного, в котором установлен электрод, пучок электродов или массив электродов либо электродных пучков согласно изобретению. Между ним и электродом согласно изобретению может быть установлен электрический контакт с помощью электрического провода, либо контакт с ним может быть установлен с использованием излучающих средств. Кроме того, возможно объединение блока управления с электродом согласно изобретению в форме сверхминиатюрного микропроцессора, расположенного в проксимальной части тела электрода, электродного пучка или массива электродов либо электродных пучков. Микропроцессор может регистрировать электрический ток или потенциал, возникающий в мягкой ткани возле конца электрода, и хранить в памяти результат, который может быть считан, например, после извлечения электрода из ткани. Кроме того, настоящее изобретение основано на понимании того, что введение защищающего ткань лекарственного средства в ткань, окружающую введенный электрод, может способствовать применению электрода. Помимо этого, настоящее изобретение основано на понимании того, что введение лекарственного средства, отличного от защищающего ткань лекарственного средства, в ткань, окружающую введенный электрод, может способствовать применению электрода. Введение лекарственного средства посредством электрода согласно изобретению не ограничивается одним лекарственным средством. Можно также вводить два или более лекарственных средств одновременно или последовательно. Два или более лекарственных средств могут находиться в одном электродном матричном элементе или в разных отделениях или частях электродного матричного элемента, при этом такие отделения образованы из одного матричного материала или различных матричных материалов. Если матричный элемент согласно изобретению содержит два или более отделений, они предпочтительно могут быть размещены в осесимметричных слоях, проходящих вдоль тела электрода или его части, или в соседних частях матрицы, каждая из которых проходит вдоль части тела электрода. В результате встраивания одиночных электродов, пучков электродов и массивов электродов или электродных пучков в твердую электродную матрицу, которая растворяется или разлагается в жидкости организма, даже электроды с очень тонкими телами электрода, такими как тела электрода в микрометровом или даже нанометровом диапазоне, могут быть введены в ткань в исправном состоянии. Таким образом, одна из задач, связанная с созданием электродного матричного элемента согласно изобретению, заключается в обеспечении при введении электрода, пучка электродов и массива электродов или электродных пучков согласно изобретению в ткань, защиты целостности тела электрода и его конца и, если таковые имеются,фиксирующих в ткани элементов, таких как крючки, идущие от конца или тела электрода. Для удобства введения электродный матричный элемент предпочтительно имеет зауженную в дистальном направлении форму. На своем дистальном конце электродный матричный элемент предпочтительно имеет форму тупого или острого конца. Этот конец может быть коническим или приблизительно коническим, но также может быть плоским. Для сравнения, матрицу, окружающую множество электродов или электродных пучков согласно изобретению и выполненную с целью формирования массива электродов или электродных пучков, причем эти электроды или электродные пучки содержат и встроены в один или более электродных матричных элементов, называют матричным элементом массива. Предпочтительно, чтобы осевая длина (то есть длина в направлении планируемого введения электрода в ткань) электрода и/или электродной матрицы, электродного пучка и/или матрицы электродных пучков, массива электродов или массива электродных пучков и/или соответствующей матрицы, составляла 100 мм или меньше, или 50 мм, или даже 15 мм или меньше. В исключительных случаях осевая длина любого из указанных выше электродов, электродных массивов, электродных пучков и/или соответствующих матриц составляет более 100 мм. Наиболее важным является то, что электродный матричный элемент согласно изобретению не является тонким покрытием на теле электрода, а представляет собой элемент для физической стабилизации тела электрода, включая его конец и, если таковые имеются, фиксирующие в ткани элементы, в процессе введения в ткань и в течение желаемого периода времени после введения. Электродный матричный элемент согласно изобретению, окружающий и стабилизирующий электрод или электродный пучок, пред-4 023177 почтительно является осесимметричным. Предпочтительной формой является форма миниатюрного снаряда с заостренной верхушкой и плоским основанием в тыльной части. Предпочтительно, чтобы электродный матричный элемент располагался осесимметрично относительно электрода или электродного пучка, при этом его продольная ось совпадает с продольной осью тела электрода или электродного пучка. Соответственно, электродный матричный элемент согласно изобретению предпочтительно имеет круговое или эллиптическое поперечное сечение относительно его продольной оси. Согласно изобретению, предпочтительно, чтобы поперечный диаметр или короткий диаметр эллипса электродной матрицы согласно изобретению значительно превышал диаметр тела электрода, которое она окружает, например,превышал в 2, 5, 10 и даже 25 раз или более. Согласно изобретению важно, чтобы комбинация а) электрода, электродного пучка или массива электродов или электродных пучков и б) одного или нескольких матричных элементов имела достаточную физическую стабильность или жесткость для обеспечения введения ее в мягкую ткань по большей части по прямолинейной траектории, которая начинается в точке воздействия соответствующего конца на ткань. Таким образом, указанный конец делает в ткани прорез. Этот способ размещения электрода,пучка электродов, массива электродов или массива пучка электродов согласно изобретению в желаемом месте в мягкой ткани по существу отличается от имплантации, в которой требуется открыть доступ к указанной траектории хирургическим путем. Без поддержки, оказываемой матричным элементом (элементами), электрод, электродный пучок или массив электродов или электродных пучков невозможно было бы ввести в ткань вследствие недостатка жесткости, приводящего к сгибанию вводимого устройства и, тем самым, к отклонению от желаемой траектории введения. Согласно предпочтительному аспекту изобретения предложена поверхность матрицы со слоем материала, облегчающим введение, такого как материал с низким коэффициентом трения при контакте с мягкой тканью. С другой стороны, облегчающий введение слой должен легко растворяться и/или разлагаться после введения. Предпочтительный облегчающий введение слой может содержать липид или состоять из липида, имеющего температуру плавления на несколько градусов выше, чем температура ткани, в которую его намереваются ввести, такую как температура плавления от 40 до 43 С. Дополнительно или альтернативно слой на поверхности матрицы может быть сконструирован таким образом, чтобы, по существу, задерживать растворение и/или разложение матрицы, например, на 1 или 10 мин либо больше. Подходящий слой такого рода может быть образован полимерами, используемыми в фармацевтической промышленности для нанесения покрытия на таблетки для медленного высвобождения в водное окружение с рН примерно 7-7,5. Согласно предпочтительному аспекту изобретения тело электрода полностью окружено электродным матричным элементом за исключением его проксимального конца, при этом конец электрода расположен на некотором расстоянии в проксимальном направлении от конца электродной матрицы. Согласно другому предпочтительному аспекту настоящего изобретения желательно, чтобы тело электрода обладало после имплантации свободой перемещения его частей не только в поперечном направлении, но и в продольном направлении независимо от того, относится ли это к одиночному электроду или электроду, содержащемуся в электродном пучке или массиве электродных пучков. Тем самым можно избежать негативного влияния неоднородного перемещения окружающей ткани на тело электрода, в частности, влияния, приводящего к смещению тела электрода и/или заставляющего его двигаться таким образом, что это вызывает повреждение окружающей ткани. Упоминание в данном описании о свободе перемещения тела электрода относится к телу электрода в ткани после растворения и/или разложения электродной матрицы, то есть к тому моменту, когда тело электрода больше не ограничено в своем перемещении электродным матричным элементом. В частности, настоящее изобретение основано на понимании того, что для такого тела электрода преимуществом является наличие в его конструкции частей, способных перемещаться друг относительно друга так, чтобы расстояние между ними вдоль электрода увеличивалось или уменьшалось. Изобретение также основано на понимании того, что для имплантации или введения, в частности, имплантации или введения в желаемой конфигурации, тела электрода согласно изобретению требуется стабилизации конфигурации, независимо от того, относится ли сказанное к пучку электродов, или массиву электродных пучков, или массиву одиночных электродов и электродных пучков. В данной заявке термин "конфигурация" относится к пространственным формам или состояниям, которые электрод согласно изобретению может принимать или будет вынужден принимать вследствие своей гибкости. Согласно изобретению стабилизация конфигурации обеспечивается, по меньшей мере частично, встраиванием электрода в электродный матричный элемент, который устраняется в результате растворения в жидкости организма или в результате разложения после того, как электрод помещен в желаемое положение в мягкой ткани. Таким образом, электродным матричным материалом или поддерживающим электрод материалом является такой материал, который способен растворяться или способен разлагаться в жидкости организма, то есть в водном окружении, а также, если электрод вводится в жировую ткань, в среде, богатой жирами. После растворения или разложения электродный матричный материал или продукты его разложения, соответственно, удаляются из места введения благодаря механизмам транспорта растворенных веществ, работающих в живой ткани, и/или подвергаются метаболизму. Электродный матричный элемент согласно изобретению может быть изготовлен из мате-5 023177 риала, который, чтобы стать растворимым или повысить свою растворимость в жидкостях организма,должен быть подвергнут разложению; такое разложение осуществляется с помощью механизмов, действующих в живой ткани, и/или под действием адъюванта, такого как фермент, содержащийся в электроде. Таким образом, согласно настоящему изобретению описан медицинский микроэлектрод для введения в мягкую ткань, содержащий электропроводящее удлиненное тело электрода, имеющее первый проксимальный конец и второй дистальный конец, причем тело электрода содержит концевую часть, проходящую от его дистального конца, основную часть тела, проходящую в проксимальном направлении от концевой части, и возможно соединительную часть, проходящую в проксимальном направлении от основной части тела, при этом концевая часть, основная часть тела и возможно соединительная часть встроены в первый электродный матричный элемент, который является, по существу, жестким, биосовместимым и растворимым или биоразлагаемым в жидкости организма, при этом указанный микроэлектрод дополнительно содержит один или оба из следующего: замедляющий растворение слой на первом электродном матричном элементе и/или второй электродный матричный элемент, который возможно может содержать две или более частей, расположенных между первым электродным матричным элементом и электродом, при этом лекарственное средство, которое может высвобождаться после растворения или биологического разложения первого электродного матричного элемента, содержится в первом электродном матричном элементе или втором электродном матричном элементе. Лекарственное средство может быть диспергировано или растворено в матрице, или может содержаться в матрице в микроинкапсулированной форме, или содержаться в стержне из биоразлагаемого материала или материала, растворимого в жидкости организма. В предпочтительном варианте выполнения настоящего изобретения микроэлектрод содержит фиксирующее средство, расположенное в концевой части. В другом предпочтительном варианте выполнения настоящего изобретения тело электрода содержит непроводящую сердцевину, один или более электропроводящих слоев на сердцевине, изолирующий слой на одном или более электропроводящих слоях и возможно один или несколько каналов, проходящих через изолирующий слой перпендикулярно сердцевине и обеспечивающих электрический контакт с электропроводящим слоем (слоями). Желательно, чтобы концевая часть, основная часть тела и фиксирующие средства, если они имеются, были полностью встроены в первый электродный матричный элемент. В предпочтительном аспекте изобретения первый электродный матричный элемент содержит две или более частей, различающихся по своей скорости растворения или разложения. Предпочтительный диаметр тела электрода составляет приблизительно от 10-7 до 10-4 м. Согласно другому предпочтительному аспекту настоящего изобретения основная часть тела содержит части, способные перемещаться друг относительно друга по мере растворения или разложения первого электродного матричного элемента так, чтобы расстояние между ними вдоль тела электрода увеличивалось или уменьшалось. Согласно другому предпочтительному аспекту изобретения первый электродный матричный элемент содержит первое лекарственное средство, а второй электродный матричный элемент содержит второе лекарственное средство. Кроме того, согласно настоящему изобретению, описан пучок медицинских микроэлектродов, содержащий два или более электродов согласно изобретению, причем тела этих электродов расположены по существу параллельно и имеют общий указанный первый электродный матричный элемент или содержат матричный элемент пучка, окружающий указанные первые матричные элементы. Согласно предпочтительному аспекту изобретения микроэлектродный пучок содержит замедляющее растворение покрытие на общем первом электродном матричном элементе или на матричном элементе пучка. Предпочтительно, чтобы проксимальные концы двух или более электродов пучка были расположены, по существу, в одной плоскости. Согласно другому предпочтительному аспекту изобретения микроэлектродный пучок содержит помимо общего первого электродного матричного элемента или матричного элемента пучка, устройство для формирования пучков, расположенное на проксимальных концах или около проксимальных концов электродов, причем устройство для формирования пучков не содержит растворимой или биоразлагаемой матрицы. Микроэлектродный пучок согласно изобретению может содержать одно или более оптических волокон. Согласно другому предпочтительному аспекту изобретения, два или более первых или вторых электродных матричных элементов микроэлектродного пучка содержат различные количества лекарственного средства или отличаются по своим свойствам в отношении высвобождения лекарственного средства. Введение микроэлектродного пучка согласно изобретению в мягкую ткань облегчается благодаря применению элемента для введения пучка, такого как стержень. Для такого применения микроэлектродный пучок согласно изобретению обеспечивается съемным соединительным устройством. Кроме того, согласно настоящему изобретению описан массив медицинских микроэлектродов или микроэлектродных пучков, содержащий два или более микроэлектродов согласно изобретению либо два или более микроэлектродных пучков согласно изобретению, при этом указанные два или более микроэлектродов либо два или более микроэлектродных пучков расположены с промежутками на поверхности твердого основания. Предпочтительно, чтобы два или более микроэлектродов либо два или более микроэлектродных пучков массива были встроены в по существу жесткий биосовместимый матричный элемент массива, который является растворимым или биоразлагаемым в жидкости организма. Предпочтительно, чтобы скорость растворения или разложения матричного элемента массива в указанной жидкости организма была выше, чем скорость растворения или разложения указанного первого электродного матричного элемента или матричного элемента пучка. Матричный элемент массива может дополнительно содержать покрытие на матричном элементе массива, замедляющее растворение или разложение. Одиночные электроды Тело микроэлектрода, которое предпочтительно имеет приблизительно круговое или эллиптическое поперечное сечение, содержит электропроводящую или непроводящую сердцевину, электропроводящий слой на сердцевине, если сердцевина не проводит электрический ток, и изоляционный слой на электропроводящем слое или сердцевине. Тем не менее, можно также использовать другие тела электродов с другими поперечными сечениями, такими как прямоугольное или многоугольное. Альтернативно, тело электрода содержит непроводящую полимерную трубку, заполненную электропроводящим материалом,или состоит из нее. Непроводящая сердцевина предпочтительно представляет собой природное, полусинтетическое или синтетическое полимерное волокно, как например волокно шелка, хлопка, искусственного шелка (ацетата целлюлозы), полиэтилена, полипропилена, полиамида и т.д Проводящая сердцевина представляет собой тонкую металлическую проволоку, например, из золота, платины, титана,иридия, сплава, содержащего вышеупомянутые или другие металлы, нержавеющей стали или электропроводящих полимерных волокон. Электропроводящий слой на непроводящей сердцевине представляет собой или содержит металл с высокой электропроводностью, такой как серебро, золото и/или подходящий сплав металлов, например платиноиридиевый, осажденный на сердцевине с использованием, например способов ионного распыления или испарения. В случае использования слоя золота адгезию к сердцевине можно улучшить путем введения слоя хрома или вольфрама между слоем золота и сердцевиной. Такое же введение возможно при использовании слоев других металлов. Толщина осажденного металлического проводящего слоя составляет от 0,1 мкм до приблизительно 100 мкм. Альтернативно, электропроводящий слой может представлять собой или содержать электропроводящий полимер. Изолирующий слой содержит неэлектропроводящий полимер или предпочтительно состоит из него. В большинстве случаев практического применения диаметр тела электрода составляет приблизительно от 10-7 до 10-4 м, предпочтительно менее чем приблизительно 2,510-5 м. Тем не менее, в некоторых случаях практического применения тело электрода может иметь больший диаметр, в частности, если электрод предназначен для того, чтобы вызывать повреждение мягкой ткани. Изолирующий слой тела электрода проходит предпочтительно от проксимального конца тела к дистальному концу тела, то есть все тело электрода изолировано. Примерами материалов, пригодных для изоляции, являются стекло, поливинилформаль, эпоксидная смола, поли(п-ксилилен), полиамид, кремнийорганический каучук или водостойкий лак. Однако по всему телу электрода через изолирующий слой к проводящей сердцевине можно проложить каналы, в частности, каналы, расположенные примерно перпендикулярно сердцевине. Если предполагается электрическая стимуляция большого объема ткани, то может быть предпочтительно не изолировать часть тела электрода, предназначенного для введения в ткань-мишень. Альтернативно, тело электрода может содержать области, которые не изолированы, чтобы обеспечить стимуляцию/регистрацию многочисленных участков в данной ткани. Чтобы облегчить введение в ткань, тело электрода согласно изобретению по меньшей мере частично встроено в жесткий или по существу жесткий элемент или тело из биосовместимого матричного материала, называемого электродным матричным элементом. Электродный матричный материал предпочтительно макроскопически однороден. Такое встраивание охватывает по меньшей мере часть тела электрода, более предпочтительно конец электрода и концевую часть тела электрода, проходящую от указанного конца. Термин "по существу жесткий" указывает на то, что такое тело может быть упруго-гибким лишь в незначительной степени. Электродный матричный элемент или тело представляет собой или содержит твердый материал матрицы, который растворим или биоразлагаем в жидкости организма, в частности водной жидкости организма, но, альтернативно, также в жидкости с большим содержанием жира. Введение электрода в тело матрицы позволяет не только вводить или имплантировать электрод в ткань и располагать его там в желаемом положении, но и создает желаемую конфигурацию. Тело электрода или по меньшей мере его части могут быть закреплены в электродном матричном элементе с сохранением конфигурации. После растворения или разложения электродного матричного элемента тело электрода может сохранять свою первоначальную или первую конфигурацию в ткани либо принимать или вынужденно принимать вторую конфигурацию или неограниченное число конфигураций. Под "начальной конфигурацией" понимается конфигурация электрода или тела электрода либо части тела электрода, встроенного в матрицу. Изогнутые или другие непрямые формы тела электрода улучшают фиксацию электрода в ткани, поскольку клетки ткани будут расти вплотную к указанному телу. В отличие от прямого тела электрода изогнутая или другая непрямая форма тела электрода улучшает способность электрода согласно изобретению к перемещению без смещения, в унисон с неравномерными движениями ткани, в которую электрод имплантирован или введен. Согласно важному аспекту изобретения тело матрицы содержит лекарственное средство или генетический вектор, способные высвобождаться в жидкость организма, в частности в водную жидкость организма, при имплантации электрода. Лекарственное средство может высвобождаться из тела матрицы до ее растворения или разложения, в частности, по меньшей мере частично. Лекарственное средство может содержаться, например, в матрице с открытой структурой, такой как матрица, снабженная открытыми микроканалами. Лекарственное средство может высвобождаться из матрицы одновременно с растворением или разложением матрицы. Лекарственное средство может присутствовать в матрице в диспергированном или растворенном состоянии, в состоянии адсорбции на стенках пор пористой матрицы и даже в виде пролекарства, связанного ковалентной связью с матрицей. Альтернативно лекарственное средство может присутствовать в матрице в микроинкапсулированной форме или содержаться в теле матрицы, которое растворяется в жидкости организма или является биоразлагаемым в тканях человека. В исключительных случаях лекарственное средство может содержаться в некотором теле, отдельном от электродного матричного элемента, причем данное тело либо может быть растворимым в жидкости организма или нет, либо может быть биологически разлагаемым или нет. Предпочтительно лекарственное средство представляет собой лекарственное средство, защищающее от повреждения ткань, в которую вводится электрод, и/или способствующее восстановлению поврежденной ткани. Независимо от этого лекарственное средство согласно изобретению представляет собой лекарственное средство, оказывающее фармакологическое действие на ткани, прилегающие к введенному электроду, в частности, нервную ткань, в особенности ткань ядер или белого вещества головного и спинного мозга. В варианте выполнения тела электрода и, таким образом, электрода согласно изобретению, имеющего конфигурацию, позволяющую увеличивать и/или уменьшать расстояние от его проксимального конца до его дистального конца после имплантации в ткань человека или животного, принятие телом электрода второй конфигурации может быть обеспечено несколькими способами. Если тело электрода является упруго-гибким или содержит упруго-гибкие части, то его можно ввести в электродный матричный элемент в сжатом или растянутом состоянии, с тем чтобы после растворения электродного матричного элемента после имплантации электрода в ткань тело электрода могло расшириться или сжаться соответственно. В своей исходной конфигурации тело электрода, являясь в целом в значительной степени вытянутым в одном направлении, может быть прямым или содержать регулярные или нерегулярные изгибы,спирали, петли, зигзагообразные участки и т.д. Другими словами, в своей исходной конфигурации длина тела электрода может существенно превышать расстояние между его проксимальным и дистальным концами. Под словами "существенно превышать" понимают, длину, превышающую расстояние между первым и вторым концами электрода, например, на 2% или более, в частности на 5% или более, даже на 20% или более и до 50% или более. Тем не менее, концевая часть электрода, проходящая от второго, дистального конца, предпочтительно имеет прямую или лишь немного согнутую конфигурацию. Дистальный конец или концевая часть электрода, которая не изолирована, может иметь любую подходящую форму. Острые концы особенно предпочтительны, если электрод предназначен для осуществления регистрации. Если предполагается использование электрода для стимуляции, предпочтительно,чтобы концевая часть электрода не содержала острых краев, а имела бы плавный контур для уменьшения разрушения концевой части. Возможно, площадь поверхности концевой части электрода можно увеличить посредством придания шероховатости для увеличения контакта с окружающими клетками и снижения сопротивления электрода. Шероховатую поверхность можно получить, например, путем нанесения на электрод платиновой черни или посредством травления. На проксимальном конце тела электрода имеется электропроводящий контакт с электронным оборудованием, обеспечиваемый изолированным гибким электрическим проводом. Концевая часть и/или основная часть тела электрода согласно изобретению может быть снабжена фиксирующими средствами, например участками шероховатой поверхности или участками поверхности,обеспечивающими адгезию к окружающей ткани. Части тела электрода, способные к адгезии к прилегающей ткани, могут быть изготовлены, например, из титана, или иметь участки, покрытые оксидом титана, что позволяет осуществлять адгезию к ткани или врастание в ткань. Тонкие, проходящие латерально нити, которые прикреплены к концевой части и проходят в проксимальном направлении во время процедуры введения, а затем расправляются при вытягивании электрода на небольшое расстояние, известны из документа WO 2007/040442; электрод согласно изобретению может быть снабжен такими нитями для его закрепления в ткани человека или животных. Предпочтительно, чтобы эти тонкие проходящие латерально нити имели диаметр, равный или предпочтительно меньше диаметра тела электрода,и/или имели длину, позволяющую им выступать в латеральном направлении на подходящее расстояние,например, до пятидесяти микрон включительно или более и до ста микрон включительно или более, от электрода. Предпочтительно, чтобы эта проходящая латерально нить (нити) действовала в качестве дополнительных электродов, в этом случае по меньшей мере их концы не изолированы. Предпочтительно также, чтобы проходящая латерально нить представляла собой или содержала электропроводящий мате-8 023177 риал электрода и чтобы этот материал составлял единое целое с материалом тела электрода. Однако в объем данного изобретения входят также проходящие латерально нити из материала, отличающегося от материала электрода. Поскольку проходящие латерально нити не препятствуют введению встроенного в матрицу электрода в ткань ввиду того, что они окружены электродной матрицей, они могут проходить от электрода в любом направлении, например дистальном, радиальном или проксимальном направлении. Возможно также, что электрод содержит множество проходящих латерально нитей и что эти нити проходят в одном или нескольких направлениях от электрода. Аналогично, предпочтительно, чтобы сердцевина или поддерживающая электрод трубка была изготовлена из того же материала, что и концевая часть, и составляла с ним единое целое. В электроде, оснащенном выступающими элементами в его концевой части, такое указанное действие по вытягиванию может позволить выступающим элементам закрепиться в ткани и препятствовать извлечению электрода. Проталкивание дальше в ткань электрода,имеющего соответствующую конструкцию конца, например изогнутый конец или конец, отклоняющийся от продольной оси тела электрода, задаваемой прямой линией, соединяющей его первый и второй концы, может вызвать отклонение его концевой части в сторону от направления продольной оси. Электрод согласно изобретению предназначен для введения в мягкую живую ткань, в частности в ткань головного и спинного мозга, но также, например, в печень, почки, скелетные мышцы, сердечные мышцы, висцеральные мышцы и соединительную ткань. Электрод согласно изобретению может быть использован для регистрации и/или стимуляции нервных окончаний. В случае использования для регистрации провода для электрода согласно изобретению могут быть снабжены миниатюрным предусилителем. Предпочтительно, чтобы для улучшения отношения сигнала к шуму усилитель был размещен на небольшом расстоянии от конца, например, на стыке основной части тела и концевой части. Для дальнейшего облегчения введения в мягкую ткань предпочтительно, чтобы стержень микроманипулятора или аналогичного приспособления был прикреплен к матрице или был встроен в матрицу вблизи ее проксимального конца или на ее проксимальном конце. Альтернативно может быть предусмотрено съемное крепление микроманипулятора посредством стыковочного устройства, входящего в состав проксимальной соединительной части электрода. Электродные пучки В некоторых практических применениях предпочтительно использовать множество соответственно размещенных электродов описанного выше типа. Комбинация двух или более электродов согласно изобретению в едином или общем теле матрицы называется электродным пучком. Общая матрица формирует матричный элемент электродного пучка. Она является растворимой или биоразлагаемой в жидкости организма. Важной особенностью электродного пучка согласно изобретению является то, что по меньшей мере два электрода, входящие в состав пучка, должны быть электрически изолированы друг от друга. При этом предпочтительно, чтобы все или по существу все электроды пучка были электрически изолированы друг от друга. Матричный элемент пучка является жестким или по существу жестким. Задача матричного элемента пучка состоит в придании физической стабильности электродному пучку для обеспечения введения его в ткань по существу по прямолинейной траектории. Это позволяет осуществлять размещение множества электродов в желаемой области мягкой ткани. В объем изобретения также входит электродный пучок с обычными прямыми электродными проводами, оптическими проводами, сократительными полимерами или жесткими электродными чипами, содержащими электроды и/или электронные устройства, элементы которых по меньшей мере частично расположены в теле матрицы. Возможно, что электрод или матричный элемент пучка содержит две или более частей матричных материалов, различающихся по скорости их растворения в водном окружении. Разделенный на части матричный элемент для электродного пучка согласно изобретению соответствует, в плане его характеристик, электродному матричному элементу согласно изобретению, описанному выше. Помимо общего матричного элемента для электродного пучка согласно изобретению один или более электродов пучка, в частности все электроды пучка, могут быть снабжены электродным матричным элементом согласно изобретению; в таком случае матричный элемент для электродного пучка объединяет или даже может заключать в себе один или более электродных матричных элементов пучка. Предпочтительно, чтобы тела электродов, содержащиеся в электродном пучке согласно изобретению могли быть разной длины и, если матричный элемент или тело матрицы электродного пучка имеет осесимметричную форму, например, цилиндрическую, были размещены симметрично относительно их центральной оси. Предпочтительно, чтобы наиболее длинные тела электродов, были расположены на небольшом расстоянии от центральной оси, а более короткие - на большем расстоянии от оси, с тем, чтобы совокупность их концов повторяла форму конца матрицы. Их проксимальные концы предпочтительно расположены в пределах или вблизи плоскости, перпендикулярной оси вращения. Тем не менее, в объем изобретения также входит расположение тел электродов, при котором формируется односторонний скос или иным образом несимметричный конец электродного пучка. Таким образом, матричный элемент электродного пучка может сужаться в дистальном направлении с образованием, например, конической или плоской треугольной дистальной концевой части. Дистальная концевая часть матричного элемента электродного пучка может иметь тупую форму, чтобы свести к минимуму риск разрыва сосу-9 023177 дов во время введения электродного пучка в мягкую ткань. Согласно другому предпочтительному аспекту изобретения электродный пучок содержит одно или более оптических волокон для осуществления стимуляции ткани или ее компонентов излучением и/или для регистрации излучения, исходящего от окружающей ткани. Способом, аналогичному используемому для тел электродов, одно или более оптических волокон фиксируются в выбранном положении в электродном пучке с помощью матричного элемента электродного пучка. Согласно другому предпочтительному аспекту изобретения два или более тел электродов во встроенном в матрицу электродном пучке согласно изобретению могут быть соединены в пределах или вблизи их первых концов посредством опорной пластины, например из керамического или полимерного материала. Соединенные таким образом электроды могут быть одинаковой или разной длины. Опорная пластина может быть оборудована электронными компонентами, такими как усилители, и быть подключена к электронному оборудованию, находящемуся вне ткани, с целью стимуляции и регистрации с использованием кабеля или телеметрии; ее также можно использовать для установки средства для размещения микроманипулятора. Согласно еще одному предпочтительному аспекту изобретения электродный пучок содержит один или более сократительных биметаллических элементов, способных изменять свою форму, например изгибаться, при прохождении через них электрического тока. Такие сократительные элементы можно использовать для регулирования траектории введения встроенного в матрицу электродного пучка. Чтобы ввести электродный пучок согласно изобретению в мягкую ткань микроманипулятор присоединяют или он может быть присоединен к участку на проксимальном конце электродного массива, от которого он проходит в проксимальном направлении. Жесткость электродного пучка согласно изобретению, обеспечиваемая электродной матрицей, общей для электродов данного пучка, облегчает его введение в ткань. После введения электродная матрица может быстро или медленно растворяться или разлагаться. Желаемую скорость растворения или разложения можно выбрать с использованием соответствующего материала матрицы. Вследствие этого тело электрода приобретает способность к латеральному смещению относительно соседних тел электродов. Массивы электродов и/или электродных пучков Согласно изобретению два или более встроенных в матрицу электродов и/или электродных пучков,расположенных параллельно или приблизительно параллельно, могут быть объединены с использованием, по существу, твердой матрицы или связующего материала (glue) массива, которые могут растворяться или разлагаться под действием водной среды, такой как жидкость организма, а также в жидкости организма с высоким содержанием жира, как например, в нервной ткани. Матрица массива должна быть биосовместимой. Подходящие материалы включают связующие материалы на основе углеводов или белков, такие как алкилированные и/или карбоксилированные производные целлюлозы, амилозы и желатина, но также могут иметь другую природу, например, поливиниловый спирт, поливинилпирролидон и щелочные соли полиакриловой кислоты. Таким образом электроды и/или электродные пучки могут быть скомпонованы в массив в желаемой геометрической форме, подходящей для имплантации. Тем самым время, необходимое для имплантации, значительно сокращается по сравнению со временем, необходимым при имплантации отдельных электродов и/или электронных пучков для получения той же самой геометрической формы. Одно или более встроенных в матрицу тел электродов и/или один или более встроенных в матрицу электродных пучков согласно изобретению в таком массиве могут быть заменены двумя или более встроенными в матрицу телами электродов согласно изобретению, которые временно или постоянно поддерживаются в фиксированном взаиморасположении друг относительно друга. Средства для поддержания их в таком постоянном взаиморасположении могут содержать один или большее количество или состоять из одного или большего количества матричных материалов согласно изобретению или быть автономными. В случае автономности это средство может быть таким, которое растворяется и/или разлагается в водном окружении медленнее, чем любой другой матричный материал встроенного в матрицу электродного пучка, или быть стабильным, как например средство для поддержания электродного пучка в фиксированном взаиморасположении, описанное в WO 2007/040442. Аналогичным образом, один или более электродных пучков в электродном массиве согласно изобретению может быть заменено одним или более электродными пучками, описанными в WO 2007/040442. Подходящее расстояние между электродными пучками в массиве электродных пучков согласно изобретению составляет от 50 до 500 мкм или больше. В одном из вариантов выполнения отдельные встроенные в матрицу тела электродов электродного пучка согласно изобретению монтируются в конфигурации с промежутками,при этом их проксимальные концы закреплены в опорной пластине, которая растворима в водной жидкости организма. Такая схема размещения облегчает введение в ткань пучка или массива, содержащего два или более таких пучков. Массив встроенных в матрицу пучков электродов или массив комбинации встроенных в матрицу электродов согласно изобретению и встроенных в матрицу электродных пучков согласно изобретению подходит для длительной стимуляции, многоканальной регистрации электрической активности нейронов и уровней вещества-трансмиттера или других биологически активных молекул посредством измерений окислительно-восстановительных реакций и для внесения точно направленных повреждений в ткань в научных целях, в целях здравоохранения и ухода за животными. Согласно настоящему изобретению предпочтительным устройством для высвобождения лекарственного средства является матричный элемент. Лекарственное средство встраивается в матрицу путем растворения, диспергирования, образования связи посредством биоразлагаемого линкера или любым другим подходящим способом. Другим предпочтительным устройством для высвобождения лекарственного средства является отделение: такое как микросфера или другая микрочастица, диспергированная в матрице. Следующим предпочтительным устройством для высвобождения лекарственного средства является электродное покрытие, содержащее это лекарственное средство, при этом электродное покрытие заключено в матрицу. Лекарственное средство согласно изобретению включает, но им не ограничивается, агент, влияющий на физиологические и/или патологические процессы в ткани, в которую введен электрод, электродный пучок или массив электродных пучков согласно изобретению. Матричный элемент или тело массива согласно изобретению изготовлено из биосовместимого материала, который растворяется в водном окружении, например в жидкостях организма. Перед растворением он может быть подвергнут или не подвергнут набуханию. Матричный элемент массива предпочтительно имеет продолговатую форму в дистальном направлении, то есть формирует переднюю часть встроенного в матрицу электрода, которая первой вводится в ткань. Он может иметь форму, например,бруска с длиной, по меньшей мере, равной расстоянию между первым и вторым концами электрода в его исходной конформации. Матричный элемент массива предпочтительно сужается в направлении его дистального конца. Его дистальная концевая часть предпочтительно имеет приблизительно коническую форму для облегчения введения в мягкую ткань. Дистальный конец может быть острым или тупым. Тупая форма сводит к минимуму риск разрыва сосудов во время введения, в то время как острый конец уменьшает сопротивление ткани при введении. Форма матричного элемента массива позволяет следовать траектории введения по прямой линии при введении электрода глубоко в мягкую ткань и, тем самым,позволяет пользователю точно расположить электроды массива в ткани. Смачиваемая матрица также будет создавать скользкую поверхность, сводящую к минимуму силы деформации в ткани по всем направлениям вдоль сторон матричного элемента массива. Чтобы в исследованиях на животных осуществить быстрый скрининг эффективных концентраций лекарственного средства или скрининг временной зависимости высвобождения эффективного лекарственного средства, отдельные электроды или электродные пучки массива электродов или электродных пучков соответственно могут быть встроены в один и тот же матричный элемент, содержащий одно лекарственное средство в одной концентрации; альтернативно, два или более таких отдельных электродов или электродных пучков могут быть встроены в два или более матричных элементов соответственно, при этом данная матрица содержит одно указанное лекарственное средство в соответствующем количестве концентраций или соответствующее количество другого лекарственного средства в той же концентрации или в других концентрациях. При такой схеме размещения скрининг различных концентраций одного лекарственного средства или различных лекарственных средств может осуществляться путем использования одного массива такого вида. Возможно также нанесение на матрицы двух или более электродов или электродных пучков, предназначенных для включения в массив, соответствующего количества покрытий, различающихся по своим барьерным свойствам в отношении влажности и в связи с этим задерживающих в большей или меньшей степени разложение или растворение матриц, защищенных таким образом. Согласно предпочтительному варианту выполнения изобретения в матричном элементе, содержащем две или более частей, эти части могут быть размещены таким образом, что одна внешняя часть будет полностью или частично окружать одну или более внутренних частей, в которые встроен электрод согласно изобретению. Лекарственное средство или лекарственные средства, предназначенное (предназначенные) для высвобождения, содержится (содержатся) только во внутренней части (частях). Внутренняя часть (части) матричного элемента предпочтительно не окружает конец электрода, тогда как внешняя часть окружает конец, а также внутренние части. Поэтому внешняя часть предназначена, главным образом, для защиты физической целостности электрода во время введения в ткань и характеризуется профилем растворения или разложения, по существу, отличающимся от профиля для внутренней части(частей), то есть растворяется и/или разлагается, по существу, более легко, чем внутренняя часть (части) матрицы, например, с фактором 5, 10 или даже 100. Согласно другому предпочтительному варианту выполнения изобретения расстояние между концами/дистальными концами электродов в электродных пучках или в массивах электродных пучков после растворения или разложения матрицы или матриц, окружающих их, должно быть не менее 200 мкм или больше, предпочтительно 500 мкм или больше. Такое конечное расстояние при проведении имплантации получается в результате того, что в пучке электроды не разворачиваются благодаря наличию "сердечника" из набухающего в воде полимерного материала, расположенного в центре электродного пучка, то есть вместе с окружающими его электродами пучка. Альтернативно или дополнительно данное конечное расстояние при проведении имплантации обеспечивают с использованием электродов, у которых основ- 11023177 ная часть тела инкорпорирована в матрицу в состоянии, сжатом в аксиальном направлении и/или изогнутом в радиальном направлении. По мере разложения и/или растворения матрицы они возвращаются в свое первоначальное несжатое и/или неизогнутое состояние. Матрицы Полимеры, которые можно использовать для формирования матрицы, включают полимеры, которые могут быть растворены и подвергнуты сшиванию или полимеризации с нанесением на медицинское устройство, или полимеры с относительно низкими точками плавления, которые могут быть смешаны с терапевтическими агентами. Такие биосовместимые полимеры, известные в данной области, включают: желатин, коллаген, гуммиарабик, полигликолевую кислоту, карбоксивиниловый полимер, полиакрилат натрия, карбоксиметилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, пуллулан, поливинилпирролидон, камедь карайи, пектин, ксантановую камедь, трагакант, альгиновую кислоту, поликарбонаты,полиоксиметилены, полиимиды, полиэфиры, целлюлозу, ацетат целлюлозы, бутират целлюлозы, ацетатбутират целлюлозы 65, нитрат целлюлозы, пропионат целлюлозы, простые эфиры целлюлозы, карбоксиметилцеллюлоза-коллагены, хитины, полимолочную кислоту, полигликолевую кислоту и сополимеры полимолочной кислоты и полиэтиленоксида, полиамиды, полиортоэфиры, полиангидриды (PAN), поликапролактон (PCL), сополимеры малеинового ангидрида, сополимеры полигидроксибутирата, а также их смеси и композиции, но этим не ограничиваются. Примеры приведенных выше соединений включают поли-1,3-(бис(п-карбофенокси)пропановый ангидрид РСРР) ароматический полиангидрид), полимер,образованный в результате сополимеризации п-СРР с себациновой кислотой (то есть сополимер ароматической дикислоты и алифатической дикислоты) и политерефталевой кислотой (то есть политерефталевого ангидрида и ароматического ангидрида), поли(L-лактид) (PLLA), поли(D,L-лактид) (PLA), полигликолид (PGA), поли(L-лактид-ко-D,L-лактид) (PLLAJPLA), поли(L-лактид-когликолид) (PLLNPGA), поли(D,L-лактид-когликолид) (PLAJPGA), поли(гликолид-котриметиленкарбонат) (PGNPTMC), полиэтиленоксид (PEG), полидиоксанон (PDS), полипропиленфумарат, поли(этилглутамат-коглутаминовая кислота), поли(трет-бутилоксикарбонилметилглутамат), поликапролактон (PCL), поликапролактонкобутилакрилат, полигидроксибутират (РНВТ) и сополимеры полигидроксибутирата, поли(фосфазен),поли(D,L-лактид-кокапролактон) (PLN PCL), поли(гликолид-кокапролактон) (PGAJPCL), полиэфир фосфорной кислоты, полиаминокислоту и поли(гидроксибутират), полидепсипептиды, сополимеры малеинового ангидрида, полифосфазены, полииминокарбонаты, поли-[(97,5% диметил-триметиленкарбоната)ко-(2,5% триметиленкарбоната)], цианакрилат, полиэтиленоксид, гидроксипропилметилцеллюлозу, полисахариды, такие как гиалуроновая кислота, хитозан и регенерированная целлюлоза, поли(этиленковинилацетат) (EVA); сополимеры изобутилена на основе изобутилена и по меньшей мере одной другой повторяющейся единицы (например, бутилакрилата, бутилметакрилата, замещенного стирола (например, аминостирола, гидроксистирола, карбоксистирола, сульфированного стирола и т.д., гомополимеры поливинилового спирта, сополимеры поливинилового спирта и по меньшей мере одной другой повторяющейся единицы, такой как простой винилциклогексиловый эфир, гидроксиметилметакрилат, полиэтиленгликоли с концевой гидроксильной или аминогруппой и т.д., сополимеры на основе акрилата(например, метакриловой кислоты, метакриламида, гидроксиметилметакрилатов и т.д.), сополимеры этилена и винилового спирта, кремнийсодержащие сополимеры арил- или алкилсилоксана и по меньшей мере одной повторяющейся единицы (например, бутилакрилата, бутилполимера (например, сополимера бутилметакрилата и PEG) (US 2005/0187146 А 1), но этим не ограничиваются. Предпочтительные материалы могут варьировать в зависимости от типа практического применения, и их примеры приведены в разделах, описывающих различные варианты выполнения изобретения. Биологически активные и биосовместимые полимеры могут быть объединены нековалентными связями с образованием полимерных смесей и ковалентными связями с образованием взаимопроникающих полимерных сеток, сополимеров и привитых полимеров. Предпочтительные комбинации биологически активных и биосовместимых полимеров включают полиуретаны, гепарансульфат и RGD(Arg-Gly-Asp)содержащие пептиды, полиэтиленоксиды, хондроитинсульфат и пептиды YIGSR (Tyr-Ile-Gly-Ser-Arg),кремнийсодержащие полимеры, кератансульфат и пептиды-биомиметики VEGF, SIBS (трехблочный блоксополимер стирол-изобутилен-стирол), перлекан и IKVAV-пептиды (Ile-Lys-Val-Ala-Val) и Nбутилметакрилат, фрагменты гепарина и фибрина, но этим не ограничиваются. Возможно, что матрица электрода или массива согласно изобретению содержит две или более частей матричных материалов, различающихся по скорости растворения в водном окружении. Например, в некоторых практических применениях предпочтительно, чтобы матрица содержала две части или состояла из двух частей, проксимальной части и дистальной части, при этом скорость растворения материала дистальной части, по существу, выше, чем у материала проксимальной части, для того, чтобы продолжительность растворения дистальной части сократить на промежуток времени от одной до десяти минут. Такая конструкция позволяет осуществить введение электрода согласно изобретению вблизи ткани-мишени, оставляя неповрежденными обе части матрицы; по мере растворения матричного материала дистальной части, в которую встроен дистальный или второй конец тела электрода и/или концевая часть,электрод можно вытягивать назад из ткани на короткое расстояние или проталкивать глубже в ткань на небольшое расстояние. В объем изобретения входит матрица согласно изобретению, содержащая средство, повышающее растворение, такое как каналы, в которые может проникать жидкость организма. Таким образом, тело матрицы или его часть может иметь непористую или пористую структуру. В объем изобретения также входит матрица вместе со средством для замедления растворения. Замедление растворения матричного материала может быть достигнуто путем нанесения одного или более слоев покрытия, замедляющего растворение, на тело матрицы или на его части. Покрытие, замедляющее растворение матрицы, представляет собой материал, который растворяется в водном окружении со значительно меньшей скоростью, чем защищаемое им тело матрицы или часть тела матрицы. Покрытие, замедляющее растворение матрицы, также может представлять собой покрытие, которое не является легко растворимым, но разлагается в водном окружении, как например, полиэфирное покрытие, например покрытие из полигликолата, полилактата, поли(гликолат-ко-лактата) или поликарбоната либо пептидное покрытие, такое как покрытие из коллагена. Согласно другому предпочтительному аспекту изобретения, предпочтительно обеспечить наличие внешнего слоя материала, который уменьшает трение относительно ткани при имплантации. Наружный слой или наружное покрытие из материала с низким трением может уменьшить повреждение, причиняемое процедурой имплантации. Его использование также может снизить риск внесения таких клеток, как фибробласты оболочек головного мозга, из поверхностной ткани в более глубокую ткань при имплантации электродов. Подходящие материалы покрытия включают поливиниловый спирт, коллаген, хитин,агар, гиалуроновую кислоту, см. патентную заявку США 2008234790 А 1, включенную в данное описание посредством ссылки. Лекарственные средства Согласно настоящему изобретению любое лекарственное средство или любая комбинация лекарственных средств, представляющие интерес, могут быть введены в мягкую ткань посредством электродной матрицы и/или матрицы массива согласно изобретению. Предпочтительные лекарственные средства согласно изобретению включают лекарственные средства для лечения кровотечения, инфекции и воспаления. Лекарственные средства, уменьшающие или предотвращающие инкапсуляцию врезультате образования рубцов и предотвращающие гибель клеток, также являются предпочтительными. Согласно изобретению лекарственное средство высвобождается в ткань, прилегающую к телу электроду. Согласно предпочтительному аспекту изобретения лекарственное средство встроено в отдельный биосовместимый материал, образующий покрытие на одном электроде или на одном или нескольких телах электродов электродного пучка. Матрица электрода или массива может быть нанесена в виде одного или нескольких слоев. Например, только один из нескольких слоев могут содержать лекарственное средство, либо два или несколько слоев покрытия могут содержать разные лекарственные средства. Благодаря обеспечению электродов таким покрытием в пучке электродов или массиве электродных пучков, различные лекарственные средства могут высвобождаться в непосредственной близости от отдельных электродов согласно изобретению. Лекарственные средства также могут содержаться в микросферах или других видах микрочастиц, встроенных в матрицу, и могут высвобождаться из микросфер и микрочастиц по мере растворения или разложения матрицы одновременно или последовательно. Согласно предпочтительному аспекту изобретения различные лекарственные средства высвобождаются из матрицы регулируемым во времени образом. Например, высвобождение биологически активных компонентов, предназначенных для сведения к минимуму риска кровотечения, инфекции и/или апоптоза, может быть благоприятным во время ранней фазы после имплантации. В этом случае матрица может быть сконструирована таким образом, что высвобождение встроенных в нее соединений начинается в процессе или сразу после имплантации. В случае лекарственных средств, действующих в течение длительного периода времени, предпочтительно, чтобы лекарственное средство высвобождалось медленно в течение нескольких суток или недель. Для достижения длительного эффекта вместо лекарственного средства можно использовать генетический вектор, или он может быть включен в матрицу в дополнение к лекарственному средству. Комбинируя различные механизмы высвобождения, можно регулировать задержку и скорость высвобождения биологически активных компонентов, встроенных в матрицу электрода или зонда. По мере введения матрицы в физиологическое окружение активный компонент/компоненты высвобождаются в окружающую жидкость организма с помощью различных механизмов, таких как диффузия, набухание с последующими диффузией или разложением. Могут быть использованы любой или все эти механизмы, называемые в данном описании механизмами пассивного высвобождения. Скорость пассивного выброса активного ингредиента зависит от структуры матрицы и ее ответа на такие физиологические параметры, как температура, рН, ионная сила, концентрации ферментов. Лекарственные средства, предназначенные для высвобождения с задержкой, могут быть заключены в отдельные ячейки в виде, например, микрокапсул или стержней, вводимых параллельно с электродом,электродным пучком или массивом. Микросферы и микростержни или микробруски могут содержать материал, который растворяется медленнее, чем матрица. Возможно также, хотя это и не является предпочтительным, использование материалов, которые не растворяются после имплантации и, таким образом, после высвобождения лекарственных средств, например через поры, остаются в ткани. Лекарственное средство согласно изобретению также может быть встроено в отдельный биосовмес- 13023177 тимый матричный материал для нанесения в виде покрытия на тело электрода. Расположение нескольких слоев матричного материала на теле электрода, каждый из которых содержит другое лекарственное средство или другую комбинацию лекарственных средств, также находится в объеме изобретения. Ввиду этого лекарственные средства, содержащиеся в наружном слое матрицы, могут высвобождаться раньше лекарственного средства, содержащегося во внутреннем слое матрицы. В некоторых практических применениях необходимо обеспечить непрерывное высвобождение лекарственного средства в течение одного месяца и даже в течение нескольких месяцев. Медленное высвобождение и/или высвобождение с задержкой может быть особенно подходящим для высвобождения веществ, способствующих стимуляции трофических процессов в ткани для улучшения взаимодействия между тканью и электродом и для заживления. В этом случае наиболее дальняя внутренняя часть матричного материала предпочтительно должна иметь низкую растворимость в жидкостях организма, но быть биоразлагаемой. Разложение материала покрытия может быть необходимо для того, чтобы замедлить доступ к лекарственному средству. Медленно растворяющийся или разлагающийся матричный материал будет постепенно высвобождать лекарственное средство. Для осуществления медленного высвобождения лекарственное средство может быть связано химически с матричным материалом или стерически блокировано от диффузии через набухшую матрицу. Лекарственное средство согласно изобретению также может быть частью полимерного матричного материала, становясь доступным в виде биологически активного мономера по мере разложения полимера. Согласно другому предпочтительному аспекту изобретения на электродную матрицу или матрицу массива нанесено тонкое покрытие, содержащее лекарственное средство, как например лекарственное средство, противодействующее возможным острым негативным последствиям, обусловленным процедурой введения, таким как кровотечения или микробные заражения, при этом данное покрытие высвобождается в течение короткого промежутка времени после введения электродов в ткань. В следующем варианте выполнения изобретения доступ к заряженным биологически активным компонентам может быть осуществлен посредством активного высвобождения, например при приложении напряжения между внутренней сердцевиной электрода и другим электродом и/или окружающей тканью. Это будет приводить к электрофорезу заряженных компонентов, содержащихся в покрытии электрода. Этот вариант выполнения также может быть объединен с использованием заряженных слоев для облегчения, если это желательно, постепенной миграции (патент США 6316018). Альтернативно,высвобождение можно регулировать посредством использования прилагаемых извне стимулирующих воздействий, таких как ультразвук или электрические/магнитные поля. Незаряженные биологически активные компоненты также могут быть заключены в растворимые заряженные микрокапсулы, миграцию которых к поверхности покрытия можно вызвать посредством приложения напряжения. Для лекарственного средства, сконструированного с целью высвобождения при нагревании или сжигании ткани (например, для абляции ткани, опухолей, лигирования сосудов и т.д.), можно использовать значительно более высокий температурный порог (по сравнению с высвобождением при температуре организма). Повышение температуры будет изменять физические свойства покрытия, позволяя таким образом осуществляться диффузии биологически активного компонента в прилегающую ткань. Примером материала, обладающего таким свойством, является сополимер поли(N-изопропилакриламид-коакриламид). Соотношение между N-изопропилакрил-амидом и акриламидом будет определять температурный порог. (Fundueanu, Acta Biomaterialia, Volume 5, Issue 1, January 2009, Pages 363-373). Регулируемое во времени высвобождение биологически активных компонентов также можно регулировать посредством специфического расщепления или разложения под действием ферментов определенных частей матрицы. Это может быть осуществлено путем добавления тонких ферментативно разлагаемых слоев с инкапсулированными биологически активными компонентами (Itoh и соавт., 2008) или посредством конъюгирования биологически активных компонентов с другими молекулами, для высвобождения которых необходимо расщепление. В одном из вариантов выполнения этой конструкции биологически активные молекулы составляют часть самой полимерной матрицы, высвобождаясь таким образом в результате биологически регулируемого расщепления/разложения матрицы. Альтернативно/помимо этого, агент, встроенный в матрицу, изначально может не быть биологически активным, но может стать таковым в результате процесса активации, например в результате гидролитического расщепления или разложения под действием ферментов. Ввиду этого лекарственное средство может быть сделано избирательно доступным в различных типах клеток или тканей и различным контролируемым во времени образом. Полагают, что для получения продолжительного терапевтического эффекта перенос генов будет более эффективным, чем фармакологическое лечение, и что поэтому он может быть методом лечения, выбранным для устранения воспаления/рубцевания ткани, окружающей имплантат. Помимо сведения к минимуму воспалительной реакции ткани генная терапия также дает возможность экспериментального изменения свойств окружающих нейронов, тем самым позволяя проводить экспериментальные манипуляции на молекулярном уровне. Стимулирование изменений в экспрессии генов дает возможность осуществления дополнительных интересных экспериментальных практических применений в сочетании с электрофизиологическими подходами к стимуляции с использованием имплантированных электродов. В случае, когда желательно вводить лекарственные средства в точных количествах в течение длительных периодов времени, для доставки лекарственного средства в ткань, в которую введен имплантат,можно дополнительно использовать катетеры, присоединенные к системе доставки лекарственного средства. В этом случае катетеры предпочтительно встроены в матрицу. Катетеры могут иметь одно или несколько отверстий, через которые раствор лекарственного средства может поступать в ткань. В данной области техники известны несколько систем доставки лекарственных средств, работающих или как имплантируемые минипомпы (интратекальные помпы: US 5820589, US 6375655, US 7229477; ЦНС-помпа:US 7351239; осмотические помпы: US 6471688, US 6632217), или как внешние помпы (чрескожные помпы: US 7471689, US 6632217). Катетеры могут быть изготовлены либо из медленно растворимого материала, либо из нерастворимого материала. Кроме того, в объем изобретения входит комбинирование электродов и микродиализа или электродов и вольтамперометрии для измерения высвобожденных биологически активных молекул в ткани как следствия электрической стимуляции или естественной активности ткани, то есть нейротрансмиттеров, таких как низкомолекулярные нейротрансмиттеры (например,ацетилхолин, дофамин, серотонин, гистамин, норадреналин и адреналин), аминокислот (например,GABA (гамма-аминомасляной кислоты), глицина и глутамата), нейроактивных пептидов (например, брадикинина, вещества Р, нейротензина, эндорфинов, энкефалина, динорфинов, нейропептида Y, соматостатина, холецистокинина) и растворимых газов (например, оксида азота). Также предпочтительным является лекарственное средство, которое останавливает незначительные кровотечения, вызванные процедурой введения электрода, например, фактор свертывания крови. Наиболее предпочтительным является фактор VIII или его функциональное производное. Другие предпочтительные стимулирующие свертывание крови лекарственные средства составляют комбинации факторовIX, II, VII и X; фактор IX; комбинацию фактора Виллебранда и фактора VIII; фактор Vila или фибриноген человека. Также предпочтительным является лекарственное средство, регулирующее вазоконстрикцию, такое как лекарственное средство, способствующее продуцированию NO, в частности, нитроглицерин или его функциональное производное. В случаях, когда существует риск того, что местная вазоконстрикция может привести к инфаркту головного мозга вследствие закупоривания пораженного сосуда, можно использовать лекарственное средство против агрегации тромбоцитов, такое как, например, клопидогрел,тиклопидин, ацетилсалициловая кислота, дипирамидол, илопрост, абциксимаб, эптифибатид, тирофибан. Местную вазоконстрикцию также можно лечить лекарственным средством для стимуляции периферической вазодилатации, таким как эрголоида мезилат. Для профилактики или борьбы с местной инфекцией лекарственное средство, содержащееся в матрице электрода или массива, выбирают из группы антибиотиков. При выборе надлежащего антибиотика необходимо принимать во внимание вид бактериального штамма, с которым ведется борьба, и особенности его резистентности. Примерами полезных антибиотиков являются доксициклин; лимециклин; окситетрациклин, тетрациклин; тигециклин; хлорамфеникол; ампициллин; амоксициклин; пивмециллинам; мециллинам; бензилпенициллин; феноксиметилпенициллин; диклоксациллин; клоксациллин; флуклоксациллин; амоксициллин в сочетании с блокаторами ферментов; пиперациллин в сочетании с блокаторами ферментов; цефалексин; цефадроксил; цефуроксим; лоракарбеф; цефотаксим; цефтазидим; цефтриаксон; цефтибутен; цефепим; азтреонам; меропенем; артапенем; имипенем в сочетании с блокаторами ферментов; триметоприм; сульфаметоксазол и триметоприм; эритромицин; рокситромицин; кларитромицин; азитромицин; телитромицин; клиндамицин, тобрамицин, гентамицин, амикацин; нетилмицин,офлоксацин, ципрофлоксацин, норфлоксацин, левофлоксацин, моксифлоксацин; ванкомицин; тейкопланин; фузидиевая кислота; метронидазол; тинидазол; нитрофурантоин; метенамин; линезолид; даптомицин. Лекарственные средства согласно изобретению для регулирования ответов астроцитов и микроглий содержат природные агенты, выбранные из интерлейкинов, нейрокининов, трансформирующих факторов роста, эпидермальных факторов роста, эстрогенов, нейропептидов, каннабиноидов и нейротрофических факторов и их комбинаций. Также можно использовать искусственно произведенные агенты, например миноциклин. Также включены антагонисты интерлейкинов и факторов роста в той степени, в которой они способны регулировать ответ глиальных клеток после введения электрода, пучка электродов или массива пучков электродов согласно изобретению в ткань центральной нервной системы. Другие лекарственные средства согласно изобретению включают NSAID (нестероидные противовоспалительные лекарственные средства), глюкокортикоиды, простагландины и агенты, способствующие клеточной адгезии. Кроме того, включены противовоспалительные лекарственные средства и иммунодепрессанты, которые могут быть использованы для регулирования ответа глиальных клеток, такие как натуральные или синтетические глюкокортикоиды, например дексаметазон, и некоторые NSAID,такие как индометацин. Лекарственные средства, способствующие выживанию нейронов, такие как нейротрофины и их комбинации, также охватываются данным изобретением. Нейротрофины, представляющие особый интерес, включают фактор роста нервов, нейротрофический фактор головного мозга, основный фактор роста фибробластов, глиальный нейротрофический фактор, нейротрофин-3, нейротрофин-4/5, нейротрофин-6,- 15023177 инсулиноподобный фактор роста, эпидермальный фактор роста и нейротурин. Кроме того, включены лазароиды, супероксиддисмутаза, ингибиторы каспазы, ингибитор белков апоптоза (IAP), члены семейства Bcl-2 (В-клеточной лимфомы 2) и флунаризин, которые могут способствовать выживаемости клеток или препятствовать гибели клеток, апоптозу и/или некрозу нейронов после травмы или ишемии. Кроме того, в качестве лекарственного средства, обладающего как нейропротекторным действием, так и противовоспалительным действием, можно использовать тетрациклин. Другие полезные агенты включают белки ЕСМ (белки внеклеточного матрикса, в основном протеогликаны), тенасцины, гиалуроновую кислоту и ламинин, которые могут способствовать поддержанию и выживанию нейронов (см. патентную заявку США 2007/0198063 и патент США 5202120, которые включены в данное описание посредством ссылки). Кроме того, лекарственное средство согласно изобретению включает агенты, предупреждающие образование соединительной ткани и стимулирующие ангиогенез, например вазоактивный интестинальный пептид (VIP) и сосудистый эндотелиальный фактор роста (VEGF). В другом варианте выполнения изобретения клетками ткани, окружающей электрод, пучок электродов или массив электродных пучков согласно изобретению манипулируют посредством доставки генетических векторов, что приводит к изменению экспрессии генов и трансляции некоторых белков(Lowenstein и соавт., 2007; Storek и соавт., 2008). Этот генетический материал предпочтительно доставляют в окружающие клетки посредством вирусного вектора, встроенного в материал покрытия или инкапсулированного в размещенные в нем микросферы. В данной области известны аденоассоциированные вирусные векторные системы, которые при введении в головной мозг будут вызывать экспрессию введенного гена в соседних нейронах в течение по меньшей мере 10 месяцев (патент США 6436708,включенный в данное описание посредством ссылки). Другие вирусные векторные системы, как например, системы на основе вируса простого герпеса (HSV), аденовируса или лентивируса, известные как эффективные в отношении местной доставки генов в нейроны и/или глиальные клетки, также включены в объем настоящего изобретения. Хотя и не особенно предпочтительно, но ретровирусный вектор возможно может продуцироваться другими клетками, иммобилизованными в матрице (см. патент США 6027721). Для некоторых практических применений предпочтительными средствами доставки генов являются невирусные векторные системы. Такие системы включают, например, плазмидо-липосомные комплексы или катионные липидные системы. Чтобы облегчить перенос плазмид в окружающие клетки с использованием невирусных систем трансфекции, через электрод согласно изобретению могут быть пропущены импульсы электрического тока, вызывающие эффект электропорации плазматических мембран, что приводит к локализованной и регулируемой генной трансфекции (Jaroszeski и соавт., 1999). Хотя лекарственные средства упомянутых выше типов служат для уменьшения побочных реакций и осложнений, вызываемых реакцией мягкой ткани на чужеродные имплантаты, в матрице и/или покрытии отдельного электрода могут также содержаться лекарственные средства с другими свойствами. В одном из вариантов выполнения изобретения биологически активная молекула, рассматриваемая в качестве кандидата в лекарственное средство, встроена в матрицу или покрытие регистрирующего электрода. Встраивание различных биологически активных молекул этого рода в покрытия электродов электродного пучка позволяет регистрировать электрические сигналы от различных нейронов и таким образом осуществлять одновременный скрининг нескольких кандидатов в лекарственные средства. В другом варианте выполнения изобретения в покрытие различных электродов встроены маркеры,используемые для окрашивания или идентификации нейронов, с которых производится регистрация. Такие маркеры включают флуорофоры, в том числе потенциал- и кальцийзависимые молекулы (например, Fluo3, который можно использовать для измерения концентрации кальция), которые захватываются нейронами или глиями вблизи концов электродов. Флуорофоры, которые с трудом высвобождаются из электродов, могут быть использованы для идентификации электродов. Флуорофоры могут служить не только для окрашивания нейронов, но также могут быть использованы для измерения, например внутриклеточной концентрации кальция в клетках, или измерения потенциала мембраны нейрона. Используя комбинацию конфокальной микроскопии или 2-фотонной микроскопии с регистрацией/стимуляцией посредством отдельных электродов согласно изобретению и/или оптической стимуляцией посредством введенных оптических волокон, можно затем определить, какие нейроны регистрируются/стимулируются и с помощью какого электрода в многоканальном электроде. В одном из предпочтительных вариантов выполнения изобретения лекарственное средство, предназначенное для введения в матрицу согласно изобретению инкапсулировано в микросфере. Размер микросферы может изменяться в диапазоне от нескольких нанометров до десятых долей миллиметра. Например, для инкапсулирования лекарственного средства согласно изобретению можно использовать следующие технологии микроинкапсулирования: распылительную сушку, охлаждение распылением, распыление с использованием вращающегося диска, нанесение покрытия в псевдоожиженном слое, коэкструзию с использованием неподвижного сопла, коэкструзию с использованием центробежного напора,коэкструзию с использованием погруженного сопла, нанесение покрытия в котлах, фазовое разделение,выпаривание растворителя, экстракцию растворителя, межфазную полимеризацию, простую или слож- 16023177 ную коацервацию, полимеризацию in situ, липосомную технологию, наноинкапсулирование. Например, в качестве строительного материала оболочки микрокапсулы можно использовать следующие материалы: белки, полисахариды, крахмал, воски, жиры и другие природные и синтетические полимеры. Оптимальная скорость высвобождения инкапсулированного лекарственного средства может быть достигнута посредством надлежащего выбора материала, используемого для конструирования сфер, размера сфер, типа и количества встраиваемого лекарственного средства и вспомогательных веществ, инкорпорированных в такие сферы. Скорости высвобождения из микросфер обычно соответствуют реакции первого порядка. Тем не менее, используя различные способы, как например обеспечение оптимального соотношения частиц разного размера и способы с применением депо-слоя, можно достичь скоростей высвобождения, соответствующих реакции нулевого порядка. Сами микросферы согласно изобретению могут содержать более мелкие сферы, в которые встроено лекарственное средство. Можно сконструировать микросферы, которые будут растворяться, но с меньшей скоростью, чем окружающая их матрица. Альтернативно, можно сконструировать микросферы, которые будут нерастворимыми. Для этой цели можно использовать, например, биосовместимые синтетические полимеры, такие как полиуретан (в том числе поликарбонат-уретаны), изобутилен, полистирол-изобутилен-полистирол, силикон (например, полисилоксан и замещенный полисилоксан), термопластичный эластомер, сополимер этилена и винилацетата, полиолефиновый эластомер, этиленпропилендиеновый каучук класса М, полиамидный эластомер, гидрогель или их комбинации. Такие гидрогелевые полимеры включают производные 2 гидроксиэтилметакрилата, поливинилового спирта, полиэтиленоксида, полиэтиленгликоля, полиуретанового гидрогеля, природных гидрогелей, например желатина, гиалуроновой кислоты, поперечносшитого альбумина и т.д., или их комбинации, но этим не ограничиваются. Способ изготовления Согласно изобретению описан способ изготовления тела электрода, согласно изобретению встроенного в матрицу. Данный способ включает обеспечение наличия фиксирующего средства, фиксацию тела электрода и, возможно, дополнительных встраиваемых элементов, например оптических волокон, сократительных элементов и т.д., в фиксирующем средстве в желаемой конфигурации, нанесение оболочки,покрывающей фиксированные вышеуказанным способом тело электрода и аксессуары за исключением проксимальной соединительной части, нанесение раствора или суспензии первого матричного материала на электрод так, чтобы покрыть части электрода, предназначенные для встраивания, обеспечение возможности испарения или затвердевания соответственно растворителя/диспергирующего вещества раствора или суспензии матрицы, удаление оболочки и извлечение электрода из фиксирующего средства. Для встраивания электрода в два матричных материала с образованием соответствующих отделений матрицы, каждое из которых окружает часть электрода, на соответствующую часть тела электрода, фиксированную с помощью фиксирующего средства, как описано выше, наносят раствор или суспензию первого матричного материала, растворитель/диспергирующее вещество которого впоследствии испаряют, после чего на оставшуюся без покрытия часть тела электрода наносят раствор или суспензию второго матричного материала с последующим испарением растворителя/диспергирующего вещества второго матричного материала и извлечением электрода из фиксирующего средства. Согласно данному способу тело электрода предпочтительно помещают в оболочку из гладкого материала с низкой смачиваемостью,такого как полифторированный углеводородный полимер или кремнийорганический каучук, и фиксируют в ней. Для облегчения испарения растворителя используют преимущественно пористый материал оболочки, в частности, микропористый. После нанесения и сушки матричного материала (материалов) электрод извлекают из оболочки. Альтернативный способ встраивания тела электрода согласно изобретению в два матричных материала с образованием раздельных отделений матрицы включает встраивание всего тела электрода в первый матричный материал, растворение части первого матричного материала, предпочтительно дистальной части, проходящей от дистального конца, покрытие в данный момент невстроенной дистальной части тела электрода вторым матричным материалом, например с помощью создания оболочки на невстроенной дистальной части, заполнение указанной оболочки раствором или суспензией второго матричного материала, испарение растворителя для высыхания/затвердевания второго матричного материала и удаление оболочки. Покрытие на тело электрода согласно изобретению может быть нанесено с использованием способа нанесения одиночного покрытия или комбинации способов нанесения покрытия, таких как нанесение покрытия погружением, нанесение покрытия распылением, процессы плавления, включая экструзию,компрессионное формование и литьевое формование или комбинация различных способов. В репрезентативном примере поэтапной процедуры сначала на тело электрода способом погружения наносят покрытие с использованием подходящего рассасывающегося полимера или подходящей смеси полимеров, в частности коллагена, желатина, поливинилового спирта и крахмала, растворенных в надлежащем растворителе. Также можно использовать другие полимеры. Толщину полимерного слоя регулируют способом, известным специалистам в данной области техники. Затем покрытие подвергают стадии сушки. Стадии нанесения покрытия погружением и сушки можно выполнить один раз или можно повторять в зависимости от необходимой толщины конечного покрытия. На следующей стадии в поли- 17023177 мер вводят лекарственное средство. Электрод погружают в раствор, содержащий лекарственное средство. Используемый растворитель должен быть таким, в котором полимер набухает и в котором лекарственное средство растворяется. По истечении подходящего времени контакта, например, от менее одной секунды до 5 мин или больше, электрод извлекают из раствора и матрицу сушат, выпаривая растворитель, возможно при пониженном давлении. В однореакторной процедуре тело электрода погружают в раствор полимера и выбранного лекарственного средства в оптимальной концентрации для получения желаемой толщины покрытия и желаемой нагруженности лекарственным средством. Затем электрод удаляют из раствора и растворитель выпаривают, возможно при пониженном давлении. Альтернативно покрытие создают путем нанесения покрытия распылением, при этом раствор полимера/лекарственного средства в подходящем растворителе распыляют на тело электрода. Толщину покрытия можно регулировать количеством циклов распыления и сушки (выпаривания) и количеством полимера и лекарственного средства в растворе. Изобретением также охватываются гидрогелевые покрытия из частично гидролизованных водорастворимых полимеров, таких как поливиниловый спирт, полиакриловая кислота и производные полиакриловой кислоты, например, поли(N-изопропилакриламид). Повышение температуры приводит к сокращению этих гидрогелей, тем самым заставляя лекарственное средство покидать покрытие. Альтернативно, чувствительный к температуре гидрогель представляет собой взаимопроникающую гидрогелевую сеть поли(акриламида) и поли(акриловой кислоты), и повышение температуры приводит к набуханию гидрогеля, давая тем самым возможность лекарственному средству диффундировать из геля. Изобретением также охватывается применение полимера или полимерных смесей для электрически инициируемого высвобождения, как например поливинилового спирта/хитозана. Способ имплантации Согласно изобретению описан способ введения или имплантации электрода, электродного пучка и массива электродов или электродных пучков согласно изобретению в мягкую ткань. Способ введения или имплантации гибкого медицинского микроэлектрода согласно изобретению в ткань в желаемой конфигурации включает обеспечение наличия электрода в желаемой конфигурации, по меньшей мере частично встроенного, по существу, в жесткую биосовместимую водорастворимую или биоразлагаемую матрицу, содержащую лекарственное средство, способное высвобождаться в жидкости организма, введение или имплантацию встроенного в матрицу электрода в ткань, обеспечение возможности растворения или разложения матрицы in situ. Предпочтительно, чтобы матрица содержала проксимальную часть с более низкой скоростью растворения или разложения и дистальную часть с более высокой скоростью растворения или разложения. Способ введения или имплантации пучка медицинских микроэлектродов согласно изобретению в ткань в желаемой конфигурации, включает обеспечение наличия электродного пучка в желаемой конфигурации, встроенного, по существу, в жесткую биосовместимую общую электродную матрицу, растворимую или биоразлагаемую в жидкости организма, при этом общая электродная матрица содержит лекарственное средство, способное высвобождаться в жидкости организма; введение или имплантацию встроенного в матрицу электродного пучка в ткань; обеспечение возможности растворения или разложения общей электродной матрицы in situ. Предпочтительно, чтобы общая электродная матрица содержала проксимальную часть с более низкой скоростью растворения или разложения и дистальную часть с более высокой скоростью растворения или разложения. Способ введения или имплантации массива встроенных в электродную матрицу медицинских микроэлектродов или микроэлектродных пучков согласно изобретению, встроенных в общую матрицу массива, в ткань в желаемой конфигурации, включает обеспечение наличия массива микроэлектродов или микроэлектродных пучков в желаемой конфигурации, встроенных, по существу, в жесткую матрицу массива, растворимую или биоразлагаемую в жидкости организма, при этом матрица массива содержит лекарственное средство, способное высвобождаться в жидкости организма, введение или имплантацию встроенного в матрицу массива микроэлектродов или микроэлектродных пучков в ткань, обеспечение возможности растворения или разложения электродных/общих электродных матриц и матрицы массиваin situ. Применения Данное изобретение также относится к применению встроенного в матрицу электрода, встроенного в матрицу электродного пучка или массива встроенных в матрицу электродных пучков для длительной стимуляции нерва, многоканальных регистрации электрической активности нейронов и уровней вещества-нейротрансмиттера посредством измерений окислительно-восстановительных реакций и для внесения повреждений в ткань в научных целях, в целях здравоохранения и ухода за животными. Согласно предпочтительному аспекту изобретения микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению применяют на пациенте или животном для регистрации сигналов от нейронов, сохранившихся после повреждения головного и/или спинного мозга; стимуляции нейронов с целью компенсации утраченных функций; обеспечения облегчения боли посредством стимуляции центров аналгетического действия ствола головного мозга; обеспе- 18023177 чения ослабления или уменьшения тремора и других двигательных симптомов при болезни Паркинсона; ослабления или уменьшения хореатических и других непроизвольных движений посредством стимуляции в базальных ганглиях или связанных с ними ядрах; улучшения памяти посредством стимуляции холинергических и/или моноаминергических ядер в случае болезни Альцгеймера или другого дегенеративного заболевания; регуляции настроения, агрессивности, тревоги, фобии, аффекта, чрезмерной сексуальной активности, импотенции, расстройств приема пищи посредством стимуляции лимбических центров или других областей головного мозга; обеспечения реабилитации после инсульта или повреждения головного мозга и/или спинного мозга посредством стимуляции сохранившихся связей в коре головного мозга или нисходящих двигательных путях; обеспечения восстановления регуляции спинальных функций, таких как опорожнение мочевого пузыря и кишечника, после травмы спинного мозга посредством стимуляции релевантных областей спинного мозга; обеспечения регуляции спастичности посредством стимуляции тормозных супраспинальных нисходящих центров или соответствующих областей мозжечка; обеспечения восстановления соматосенсорных, слуховых, зрительных, обонятельных ощущений посредством стимуляции релевантных ядер в спинном мозге и головном мозге. Согласно другому предпочтительному аспекту изобретения, микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению применяют на пациенте или животном для комбинированного мониторинга и стимуляции, в частности для мониторинга эпилептических припадков с использованием электродов, имплантированных в эпилептический очаг,в сочетании с системой доставки противоэпилептических лекарственных средств или электрических импульсов; компенсации потери связи в двигательной системе посредством регистрации центральных моторных команд, а затем стимуляции исполнительных звеньев двигательной системы, отдаленных от мест повреждения; регистрации уровней глюкозы в крови с целью регуляции выработки гормонов. Согласно другому предпочтительному аспекту изобретения, микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению применяют на пациенте или животном для локального повреждения ткани, в частности, опухолевой или аномально активной или эпилептогенной нервной ткани, пропуская через указанный электрод, электродный пучок или массив электродных пучков ток достаточной величины. В медико-биологическом исследовании микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению можно применять для изучения нормальной и патологической функций головного и спинного мозга, в особенности в течение длительного времени. На пациентах с нейропротезным устройством микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению можно применять для формирования интерфейса между нервом и указанным устройством. На пациенте или животном микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению можно применять в регуляции функции эндокринного или экзокринного органа, например для контроля секреции гормонов. На пациенте или животном микроэлектрод, микроэлектродный пучок и массив микроэлектродов или микроэлектродных пучков согласно изобретению можно применять в регуляции функции одной или более скелетных мышц или сердечной мышцы. Ниже изобретение будет разъяснено более подробно со ссылкой на ряд предпочтительных вариантов выполнения, проиллюстрированных эскизами, содержащими ряд графических материалов, которые однако показаны не в масштабе. Описание графических материалов На фиг. 1 а показано продольное сечение первого варианта выполнения электрода согласно изобретению, содержащего тело электрода, в том числе концевую часть и основную часть с непроводящей сердцевиной из шелка, покрытой серебром и золотом, при этом на основной части имеется изоляционное полимерное покрытие, основная часть имеет волнистую конфигурацию, матрица не показана; на фиг. 1b и 1 с показаны поперечные сечения А-А, В-В тела электрода, показанного на фиг. 1 соответственно, матричный элемент при этом не показан; на фиг. 1d показан вариант выполнения, показанный на фиг. 1 а, в растянутом состоянии после растворения матрицы в жидкости организма; на фиг. 2 а показано продольное сечение второго варианта выполнения электрода согласно изобретению в состоянии, соответствующем варианту выполнения, показанному на фиг. 1a, матричный элемент при этом не показан; на фиг. 2b показан увеличенный вид концевой части электрода, показанного на фиг. 2 а, матричный элемент при этом не показан; на фиг. 3 а показано продольное сечение третьего варианта выполнения электрода согласно изобретению в состоянии, соответствующем фиг. 1 а, матричный элемент при этом не показан; на фиг. 3b показан увеличенный вид концевой части электрода, показанного на фиг. 3 а, матричный элемент при этом не показан; на фиг. 4 а-4 с показаны продольные сечения четвертого варианта выполнения электрода согласно изобретению, встроенного в растворимую матрицу (4 а), в состоянии после введения в мягкую ткань и после растворения матрицы (4b) и в растянутом состоянии (4 с) в ткани; на фиг. 5 а показано продольное сечение первого варианта выполнения пучка электродов согласно изобретению; на фиг. 5b показано поперечное сечение С-С варианта выполнения, показанного на фиг. 5 а; на фиг. 6 показано продольное сечение второго варианта выполнения пучка электродов согласно изобретению, встроенного в комбинацию растворимых матриц в виде, соответствующем виду пучка электродов на фиг. 5 а; на фиг. 7 а показано продольное сечение первого варианта выполнения массива электродных пучков согласно изобретению, содержащего четыре электродных пучка, соответствующих варианту выполнения, показанному на фиг. 5 а, 5b; на фиг. 7b показано поперечное сечение D-D массива электродных пучков, показанного на фиг. 7 а; на фиг. 8 показано продольное сечение F-F (фиг. 8 а) второго варианта выполнения массива электродных пучков согласно изобретению, встроенного в комбинацию растворимых матриц и содержащего средство для набухания; на фиг. 8 а показано поперечное сечение Е-Е (фиг. 8) массива электродных пучков, показанного на фиг. 8; на фиг. 8b-8f проиллюстрирован процесс последовательного растворения растворимых матриц массива, показанного на фиг. 8, 8 а и введенного в мягкую ткань, в той же проекции, как на фиг. 8; на фиг. 9 показан третий вариант выполнения массива электродных пучков согласно изобретению,содержащий оптическое волокно, в продольном сечении в соответствии с фиг. 8; на фиг. 10-11 показаны четвертый и пятый варианты выполнения электрода согласно изобретению в видах, соответствующих показанному на фиг. 1 а, матричный элемент при этом не показан; на фиг. 12 показан шестой вариант выполнения электрода согласно изобретению в продольном сечении G-G (фиг. 12 а) в виде, соответствующем показанному на фиг. 1 а, матричный элемент при этом не показан; на фиг. 12 а показан увеличенный вид сверху, в проксимальном направлении, электрода, показанного на фиг. 12, матричный элемент при этом не показан; на фиг. 13 показано продольное сечение третьего варианта выполнения пучка электродов согласно изобретению, объединенных на своих проксимальных концах диском держателя электродов, в виде, соответствующем виду пучка электродов, показанного на фиг. 5 а; на фиг. 14 показано продольное сечение четвертого варианта выполнения массива электродных пучков согласно изобретению, содержащего четыре электродных пучка вида, показанного на фиг. 13,установленных на диске держателя массива, в виде, соответствующем виду массива пучков электродов,показанного на фиг. 7, но с исключенной дистальной концевой частью; на фиг. 15 а-15b показан четвертый вариант выполнения пучка электродов согласно изобретению,содержащего биоразлагаемый стержень для непрерывного высвобождения лекарственного средства, в видах, соответствующих видам пучка электродов на фиг. 5 а, 5b (поперечное сечение Н-Н); на фиг. 16 а-16b показан вариант выполнения электродного массива согласно изобретению, установленного на опоре, растворимой в водной жидкости организма, в виде, соответствующем виду пучка электродов на фиг. 5 а; на фиг. 17 а-17 с показан другой вариант выполнения электрода согласно изобретению в осевом сечении и в двух поперечных сечениях (K-K, L-L); на фиг. 18 показано осевое сечение еще одного варианта выполнения электрода согласно изобретению в том же виде, что и для варианта выполнения, показанного на фиг. 17 а; на фиг. 19 показан дополнительный вариант выполнения электрода согласно изобретению в осевом сечении М-М (фиг. 19 а), содержащего тело электрода, изготовленное из одиночной металлической проволоки, которая также обеспечивает электрический контакт между телом электрода и блоком управления. Электрод показан в состоянии сборки на приспособлении для введения в ткань; на фиг. 19 а показан вид сверху приспособления для введения в ткань, показанного на фиг. 19, в проксимальном направлении; на фиг. 20 показан примерный вид осевого сечения электродного массива согласно изобретению на уровне немного выше опорной пластины, но с показанной опорной пластиной. Подробное описание изобретения Первый вариант выполнения 1 электрода согласно изобретению (фиг. 1a-1c), содержит, по существу, удлиненное тело (2, 3, 4) электрода, в том числе основную часть 2 волнообразной формы, сочлененную с проксимальной соединительной частью 4 на ее первом, проксимальном конце и концевой частью 3 на ее втором, дистальном конце, при этом концевая часть имеет наконечник или конец 5, который может быть острым или тупым. Тупой конец 5 имеет то преимущество, что позволяет избежать повреждения кровеносных сосудов, если размещен в ткани, богатой такими сосудами. Проксимальная соединительная часть 4 представляет собой шарик припоя, соединяющего тело 2, 3, 4 электрода на его проксимальном конце с тонким изолированным проводником для электрического подключения тела 2, 3, 4 электрода к электрическому устройству 10. Электрическое устройство 10 может быть различного типа, например,для питания электрическим током электрода и/или для получения электрических сигналов от электрода. Тело 2, 3, 4 электрода является гибким, но, по существу, неупругим. Как показано на увеличенном поперечном сечении на фиг. 1c, оно состоит из сердцевины 7, промежуточного слоя 8 и покрытия 9. Сердцевина 7 представляет собой шелковую нить, на которую с использованием ионного напыления нанесен тонкий промежуточный слой 8 хрома. На промежуточный слой 8 нанесено покрытие 9 из поливинилформаля. В отличие от основной части 2 концевая часть 3 не изолирована, то есть на ней отсутствует покрытие 9 (фиг. 1b). Приложение небольшого усилия к противоположным концам тела 2, 3, 4 электрода с целью их удаления друг от друга приводит к получению растянутой, по существу прямолинейной конфигурации тела электрода, показанной на фиг. 1d. Второй вариант 101 выполнения электрода согласно изобретению, показанный на фиг. 2 а, 2b, отличается от первого варианта выполнения волнообразной формой основной части 102 тела. Позиции 103,104 относятся к концевой части, которая заканчивается наконечником 105, и к проксимальной соединительной части электрода соответственно. Третий вариант 201 выполнения электрода согласно изобретению, показанный на фиг. 3 а, 3b, отличается от первого варианта выполнения наличием участка 210 с шероховатой поверхностью в концевой части 203, проходящего от тупого конца 205 в направлении основной части волнообразного тела 202 электрода и проксимальной соединительной части 204 электрода. Шероховатость улучшает удержание в месте имплантации и увеличивает площадь контакта электрода с окружающими клетками, тем самым снижая электрическое сопротивление между электродом и клетками. На фиг. 4 а четвертый вариант 321 выполнения электрода согласно изобретению показан вместе с концевой частью 303 и основной частью 302 тела, встроенными в матричную оболочку 312 из водорастворимого материала таким образом, что острый конец 305 электрода ориентирован в том же направлении, что и тупой конец 313 матричной оболочки. На некотором расстоянии от конца 305 располагается зубец 314, идущий под углом в проксимальном направлении от концевой части 303. За исключением своего проводящего соединительного провода 306, удерживающего проксимальную соединительную часть 304, основная и концевая части электрода 202, 203 полностью встроены в матричную оболочку 312. Встроенная основная часть 302 тела электрода имеет зигзагообразную конфигурацию. Комбинация 321 концевой части 303 электрода и основной части 301, с одной стороны, и матричной оболочки 312, с другой стороны, представляет собой электрод со стабилизированной конформацией. В этой стабилизированной форме 321 электрод может быть введен в мягкую ткань с сохранением зигзагообразной конфигурации своей основной части 203 тела. В течение короткого времени после введения матричная оболочка 312 растворяется в жидкости организма (фиг. 4b); основная часть 203 электрода, по существу, сохраняет зигзагообразную конфигурацию, в которой он был встроен в матричную оболочку 312 и в которой он был введен в ткань. С помощью зубца 314 комбинация 301, включающая концевую и основную части электрода 202, 203, закрепляется в ткани, в частности, препятствуя силе, направленной на извлечение. При приложении к проксимальной соединительной части 304 силы, направленной на извлечение, основная часть 302 тела электрода выпрямляется, то есть растягивается, принимая выпрямленную конфигурацию 302', показанную на фиг. 4 с. В типичном варианте выполнения изобретения матричная оболочка 312 представляет собой гиалуронат натрия, содержащий диспергированный в нем антагонист серотонина (5 НТ 3-антагонист) ондансетрон (12 мас.%). Первый вариант выполнения встроенного в матрицу пучка 411 из четырех тел электродов согласно изобретению показан на фиг. 5 а, 5b. Тела 402 а, 403 а, 402x, 403 с электродов, которые имеют тот же вид,что и электрод 101 на фиг. 2 а, 2b, расположены параллельно и на равном удалении от оси S вращения пучка 411 в растворимом теле 412 матрицы из гиалуроната натрия, содержащем твердый 0,05%-ый(мас./мас.) раствор ондансетрона, антагониста серотонина (5-НТ 3). По отношению к телу 402 а электрода первого электрода тела 402b, 402c, 402d других электродов расположены под углом 90, 180 и 240 соответственно. На фиг. 5 а также показаны концевые части 403 а, 403 с и проксимальные соединительные части 404 а, 404 с первого и третьего электродов соответственно. По существу, цилиндрическое с конусообразным сужением тело матрицы 412 сужается в дистальном направлении лишь незначительно в начале и более явно ближе к дистальному заостренному концу 413. Второй вариант выполнения встроенного в матрицу электродного пучка 511 из четырех тел электродов согласно изобретению, показанный на фиг. 6, содержит четыре тела 502 а, 502b электродов вида,описанного на фиг. 2 а, 2b, и в том же расположении относительно оси S' вращения, как и во встроенном в матрицу электродном пучке 411 на фиг. 5 а, 5b. В отличие от варианта выполнения, показанного на фиг. 5 а, 5b, тело матрицы содержит две части проксимальную часть 512', охватывающую основные части 502 а, 502 с и т.д. тел электродов, и дистальную часть 512", охватывающую концевые части 503 а, 503 с. Скорость растворения проксимальной части 512' тела матрицы меньше, чем дистальной части 512" тела матрицы. Это позволяет, например, осуществлять введение всего встроенного в матрицу пучка 511 до желаемой первой глубины или уровня в мягкую ткань и по мере растворения дистальной части 512",дальнейшее введение пучка 511 уже без своей дистальной части 512" до второй глубины или уровня, в ходе чего уже не встроенные в матрицу концевые части 503 а, 503 с могут сгибаться, например отклоняться от направления центральной оси S'. В типичном варианте выполнения изобретения проксимальная часть 512' тела матрицы состоит из желатина/лактозы (9:1, мас./мас.), тогда как дистальная часть 512" тела состоит из маннозы, содержащей 5% по массе желатина и 0,01% по массе фактора VIII. Массив 620 электродных пучков согласно изобретению с дистальным концом 631, содержит четыре встроенных в матрицу электродных пучка, расположенных на одинаковом расстоянии и осесимметрично(четырехкратная осевая симметрия) относительно оси R массива согласно изобретению (фиг. 7 а, 7b). Массив 620 содержит четыре электродных пучка вида, показанного на фиг. 5 а, 5b, у которых позициями обозначены только основные части 602a-602d тел электродов первого пучка. Электродные пучки встроены в твердые растворимые электродные матрицы 612a-612d одного и того же типа соответственно,включающие микросферы полигликолевой кислоты 619, содержащие 10% по массе диспергированного в них метопролола сукцината. Четыре встроенных в матрицу электродных пучка расположены параллельно относительно концов 613 а, 613 с матриц, обращенных в том же самом дистальном направлении. Встроенные в матрицу электродные пучки объединены посредством матрицы 630 массива, состоящей из смеси 2:1 (мас./мас.) галактозы и агарозы, которая растворима в водном окружении. Предпочтительно,чтобы матрица 630 массива отличалась по составу и скорости растворения или набухания от материала электродных матриц 612 а-612d. Материал встраивающих матриц, то есть электродных матриц и матриц массива, может быть одним и тем же, но для одной или большего количества из них также можно использовать материал (материалы) с разными скоростями растворения или набухания. Массив 620 снабжен охватывающим соединительным элементом 640, расположенным по центру матрицы 630 массива на поверхности ее проксимального плоского конца. Этот соединительный элемент 640 выполнен с целью приема съемного манипуляторного стержня 641, предназначенного для введения массива 620 в ткань. Другой массив 720 электродных пучков в форме снаряда 731, имеющий ту же симметрию, что и массив, показанный на фиг. 7 а, 7b, показан на фиг. 8, 8 а. Помимо водорастворимой матрицы 730 массива,объединяющей электродные пучки массива 720, данный массив содержит набухающий "сердечник" 750,расположенный по центру относительно оси Т массива и проходящий от нее в радиальном направлении до самых внутренних частей стенок тел 712a-d матриц из поливинилпирролидона, содержащих 2% по массе бромперидола в микросферах из d,l-полимолочной кислоты 719 (ЕР 669128 В 1), при этом каждое тело 712a-d матриц дополнительно содержит встроенный в матрицу электродный пучок с четырьмя электродами, каждый электрод которого имеет растяжимое тело 702a-d электрода и т.д., тогда как в осевом направлении проксимальные и дистальные поверхности "сердечника" 750 примыкают к матрице или связующему материалу массива 730, посредством чего четыре встроенных в матрицу электродных пучка удерживаются вместе. Стержень 741 для введения встраивается в центральный проксимальный участок матрицы 730 массива. На фиг. 8b-8f проиллюстрировано поведение массива 720 после введения в мягкую ткань 760. На фиг. 8b показана ситуация сразу же после введения массива 720 в ткань 760. Массив 720 пока остается без изменений. На фиг. 8b показана ситуация примерно через 2 мин после введения, за этот период времени матрица массива 730 растворилась в водной среде ткани 760. Позицией 760 показана как мягкая ткань, так и жидкость, образованная в результате растворения связующего материала 730. Тела матриц 712a-d теперь отделены за исключением возможной адгезии к набухающему "сердечнику" 750 из агарозы. Кроме того, набухающий "сердечник" 750, находящийся в контакте с жидкостью ткани,теперь начинает набухать. Ситуация после значительного набухания вставки 750 показана на фиг. 8d. Набухающий "сердечник" 750 состоит из материала, который сначала набухает, а позже растворяется в контакте с водными жидкостями организма. Его изготавливают, например, из агарозы или желатина. Набухание "сердечника" приводит к перемещению встроенных в матрицу электродных пучков в радиальном направлении друг от друга, результат чего показан на фиг. 8 е. В конечном итоге тела матриц 712a712d медленно растворяются в жидкости организма, в результате чего основные части 702 а, 702 с тел электродов первого электродного пучка, основные части 702 а", 702 с" тел электродов третьего электродного пучка и основные части тел электродов других электродных пучков располагаются в ткани так, как показано на фиг. 8f. Контакт с жидкостью организма приводит к вытеканию из микросфер 719 водного раствора бромперидола, предназначенного для воздействия на нейроны (не показаны) в непосредственной близости от электродов. Путем введения различного количества микросфер 719 в каждую матрицу 712a-d можно регулировать количество водного бромперидола, вытекающего из микросфер 719, относящихся к соответствующему телу матрицы и, таким образом, к соответствующему электродному пучку. Это может быть использовано для изучения влияния различных концентраций вещества на нейроны в одном эксперименте. Для получения по существу сходного эффекта в каждую из матриц 721a-d можно включить партии микросфер одной и той же массы, но различающихся по содержанию в них бромперидола. Альтернативно, в каждое из тел матриц 712a-d можно включить другое лекарственное средство,содержащееся в том же количестве микросфер того же типа; это позволило бы провести сравнение влияния различных лекарственных средств на нейроны в одном эксперименте. Третий вариант выполнения электродного пучка согласно изобретению, показанный на фиг. 13, содержит четыре проходящих в продольном направлении основных частей 802 а, 802 с тел электродов, присоединенных к проксимальным соединительным частям 804 а, 804 с. Пучок встроен в растворимую мат- 22023177 рицу 812, сужающуюся к своему дистальному концу 813. Проксимальные соединительные части 804 а,804 с смонтированы на диске 807 держателя электродов, из которого выходят их тыльные части, снабженные проводниками 806 а, 806 с. Диск 807 держателя электродов выполнен из непроводящего полимерного материала. Этот вариант выполнения позволяет поддерживать проксимальные области основных частей тел электродов на нужном расстоянии друг относительно друга, тогда как их дистальные области могут более свободно перемещаться друг относительно друга. Тело 812 матрицы из агарозы содержит 10 мас.% диспергированных в ней частиц леводопа 819. Третий вариант выполнения массива электродных пучков согласно изобретению показан на фиг. 9. Массив 920 электродных пучков содержит четыре встроенных в матрицу электродных пучка, из которых показаны только два. Он отличается от массива 620 электродных пучков, показанного на фиг. 7 а, 7b, тем,что первый электродный пучок, встроенный в тело 912 а матрицы первого электродного пучка, составляют электроды согласно изобретению с концевыми частями 903 а, 903 с различной длины и основными частями 902 а, 902 с тел электродов одинаковой длины, в то время как третий электродный пучок, встроенный в тело 912 с матрицы третьего электродного пучка, содержит электрод согласно изобретению, содержащий основную часть 902 с" тела электрода и оптическое волокно 970, расположенное параллельно этому электроду. Агарозные тела 912 а, 912 с электродных матриц содержат микрокапсулы 919 из поли(лактид-ко-гликолида) с непрерывным высвобождением, содержащие примерно 2% по массе лейпролида (патент США 4954298). Основные части 902 а, 902 с, 902 с" тел электродов массива подключены через тонкие гибкие проводники 906 а, 906 с, 906 с" к блоку 960 управления, посредством которого они могут получать питание или в который они могут передавать электрические сигналы из нервных клеток. Показано оптическое волокно 970, подключенное к центральному блоку, который может содержать источник света для подачи излучения через волокно в ткань, в которую волокно 970 имплантировано, или который может содержать устройства для детектирования излучения, испускаемого тканью и принимаемого через волокно 970. На фиг. 10-12 проиллюстрированы другие предпочтительные варианты выполнения тела электрода согласно изобретению с модифицированными концевыми частями. Тело 1001 электрода, показанное на фиг. 10, содержит растяжимую удлиненную основную часть 1002 тела электрода и концевую часть 1003, из которой радиально/дистально расходятся и располагаются вдоль концевой части 1003 короткие отростки 1011-1011". Тело 1101 электрода, показанное на фиг. 11, содержит растяжимую удлиненную основную часть 1102 тела электрода и концевую часть 1103, из которого приблизительно радиально расходятся и располагаются вдоль концевой части 1103 отростки 1111-1111 с двойной кривизной. Тело 1201 электрода, показанное на фиг. 12, 12 а, содержит нерастяжимую прямую основную часть 1202 тела электрода и концевую часть 1203, от которой в радиальной плоскости отходят двадцать четыре отогнутые назад отростка, из которых только первый и двенадцатый отростки 1211-01, 1211-13 расходятся в зонтичной конфигурации. Массив 1320 электродных пучков согласно изобретению, показанный на фиг. 14, содержит четыре электродных пучка вида, показанного на фиг. 13. В сечении на фиг. 14 можно видеть только два из них. За исключением тел 1312 а, 1312 с матриц и дисков 1307, 1307" держателей электродов позициями обозначены только элементы первого пучка, который содержит четыре тела электрода. На указанном чертеже видны только два из электродов первого пучка, причем первый электрод содержит основную часть 1302 а тела электрода, а третий электрод содержит основную часть 1302 с тела электрода. Тела электродов встроены в растворимую, по существу, коническую матрицу 1312 а массива, сужающуюся в направлении своего дистального конца. Проксимальные соединительные части 1304 а, 1304 с соответствующих электродов смонтированы на диске 1307 держателя электродов из непроводящего полимерного материала. Диски 1307, 1307" держателя адгезивно впрессованы (не показано) в диск 1335 держателя массива вместе со своими проксимальными поверхностями, примыкающими к дистальной поверхности диска 1335 держателя массива. Для подвода провода 1306 а, 1306 с от электродов через диск 1335 держателя массива в последнем имеются сквозные отверстия 1337 а, 1337 с, обращенные к проксимальным соединительным частям 1304 а, 1304 с электродов. Электродные пучки расположены симметрично и на одинаковом расстоянии относительно продольной оси массива (не показано). Расстояние между ними позволяет центральной цилиндрической части 1336 проходить в дистальном направлении от дистальной поверхности диска 1335 держателя массива, размещаясь между ними. Центральное отверстие в проксимальной поверхности цилиндрической части 1336 выполнено с целью удержания съемного манипуляторного стержня 1341, посредством которого массив 1320 может быть введен в мягкую ткань. Оставшийся зазор между электродными пучками заполняют биосовместимым связующим материалом 1330 матрицы, который растворяется в водном окружении. Тела 1312 а, 1312 с матриц состоят из ксантановой камеди, содержащей микросферы с 8% по массе Eudragit S100/инсулина (Jain D et al., Eudragit S100 entrapped insulin microspheres for oral delivery. AAPS Pharm. Sci. Tech. 6(2005)E100-E107). Четвертый вариант выполнения 1411 электродного пучка согласно изобретению, показанный на фиг. 15 а, 15b, содержит четыре тела 1402 а, 1403 а, 1402 с, 1403 с электродов, соединенные с проксимальными соединительными частями 1404 а, 1404 с. Тела электродов встроены в растворимое тело 1412 мат- 23023177 рицы, сужающееся к своему дистальному концу 1413. По центру в теле 1412 матрицы из альгината расположен стержень 1419 из каррагинана, содержащий 5% по массе фентанила цитрата и проходящий в осевом направлении несколько дальше, чем концы 1403 а, 1403 с электродов. Проксимальные соединительные части 1404 а, 1404 с электродов смонтированы на диске держателя электродов, из которого выходят их тыльные части, снабженные проводниками. После растворения тела 1412 матрицы стержень 1419 вступает в контакт с биологическими жидкостями, в результате чего концевая область электрода погружается в раствор фенантила. Массив 1511 из четырех электродов согласно изобретению, показанный на фиг. 16 а-16b, содержит проксимальную плоскую опору 1507, растворимую в водной жидкости организма. Четыре электрода (тела 1502a-d электродов; тела 1512a-d электродных матриц) смонтированы на опоре 1507. Проксимальные соединительные части 1502a-d проходят сквозь опору 1507, что позволяет осуществить их электрический контакт с блоком управления (не показан) на тыльной (проксимальной) поверхности посредством гибких проводников, в то время как четыре тела электродных матриц проходят в дистальном направлении от дистальной поверхности опоры 1507 и окружены матричным элементом 1530 массива, который растворим в жидкости организма. Частицы 1519 циклоспорина (0,1 мг на один электрод, 2-5 мкм (95% равномерно распределены в каждой из электродных матриц 1512a-d из карбоксиметилцеллюлозы (MW 2000040000)/альбумин (9:1 (мас./мас Следующий вариант 81 выполнения электрода согласно изобретению показан на фиг. 17 а-с. На большей части своей длины прямое, нерастяжимое тело 82 электрода из меди 87, покрытое тонким слоем 88 золота, изолировано с использованием лака 89. Только дистальная концевая часть 83, включая острый конец 85 электрода, не изолирована. В точке 84 спайки, расположенной на проксимальном конце тела электрода, тело 83 электрода соединено с блоком 10 управления с помощью тонкого гибкого медного провода 86. Тело 83 электрода, кроме точки 84 спайки, заключено в матричный элемент 90 из глюкозы/желатина гиалуроната натрия (95:5, мас./мас.), в котором равномерно распределены частицы нифедипина (0,05 мг на один электрод, 5-10 мкм (90%. Еще один вариант 1681 выполнения электрода согласно изобретению показан на фиг. 18. На большей части своей длины прямое, нерастяжимое тело 1682 электрода из серебра, покрытого тонким слоем платины, изолировано с помощью тонкого покрытия из полиамида; за исключением случаев, когда используются другие материалы, конструкция тела 1682 электрода соответствует той, что показана на фиг. 17 а-17 с. Вновь, только дистальная концевая часть 1683, включая острый конец 1685 электрода, не изолирована. В точке 1684 спайки, расположенной на проксимальном конце тела электрода, тело 1683 электрода соединено с блоком 10 управления с помощью тонкого гибкого медного провода 1686. Тело 1683 электрода, кроме точки 1684 спайки, заключено в тело матрицы из глюкозы/гиалуроната натрия 1690(95:5, мас./мас.), в котором равномерно распределены частицы нифедипина (0,05 мг на один электрод, 510 мкм (90%. В свою очередь первая глюкозная/желатинированная матрица 1690 покрыта второй матрицей 1693 из глюкозы/гиалуроната натрия того же состава, за исключением того, что она вместо нифедипина содержит 0,1 мг человеческого гепарина. Второй слой матрицы 1693 из глюкозы/гиалуроната натрия покрыт тонким слоем 1692 низкомолекулярной карбоксиметилцеллюлозы, содержащей 10-15 ME(международных единиц) гиалуронидазы. Дополнительный вариант 1721 выполнения электрода согласно изобретению показан на фиг. 19. Растяжимое тело электрода из позолоченного серебра, состоящее из концевой части 1703, оканчивающейся крючком 1714, и основной части 1702, встроено в тело 1712 матрицы из глюкозы/низкомолекулярного поливинилпирролидона (8:2 (мас./мас., в котором распределены микрокапсулы из крахмала 1719, содержащие 10% по массе пирувата натрия. Тело 1702, 1703 электрода полностью встроено в тело 1712 матрицы и составляет одно целое с гибким электрическим проводником 1706 из того же материала и того же диаметра. Проводник 1706 и тело 1702, 1703 электрода изготовлены из одиночной позолоченной серебряной проволоки, изолированной тонким слоем из полиамида (не показан),который удаляют с концевой части 1703 после того, как телу электрода придана его зигзагообразная форма. Окончательно концевую часть 1703 сгибают с формированием крючка 1714. Номинальная длинаIn тела 1702, 1703 электрода определяется длиной принявшей требуемую форму проволоки, встроенной в тело 1712 матрицы. Тело 1712 матрицы имеет форму снаряда с плоской тыльной (проксимальной) поверхностью и тупым дистальным концом 1713. В тыльной поверхности тела 1712 матрицы имеется два отверстия 1710 для вставки соединительных шпилек 1731, проходящих от приблизительно полукруглого поддерживающего элемента 1732 приспособления 1730 для введения электрода. С противоположной стороны от поддерживающего элемента в противоположном направлении проходит манипуляторный стержень 1733 для ручного введения электрода в ткань субъектом. Тело 1702, 1703 электрода соединено с блоком 10 управления электродами посредством гибкого проводника 1706. Вариант выполнения массива 1800 электродов согласно изобретению показан на фиг. 20. Данный массив содержит опорную пластину 1808 из поли(лактид-когликолида), в которой тела 1809 электродов согласно изобретению закреплены своими вторыми концами. Изолированные тонкие золотые проволоки 1804, которые электрически связаны с тыльными концами тел 1809 электродов, собраны в экранированный кабель 1806. Провода 1804, проходящие в кабеле 1806, электрически связаны с микропроцессорным управляющим устройством (не показано). Короткая тыльная концевая часть 1809 тел электродов проходит от соответствующих электродных матриц 1801, 1802, 1803. Все вышеупомянутые элементы окружены телом 1810 углеводной матрицы массива из матричного материала, который растворяется в течение нескольких минут при контакте с мягкой тканью. От тела 1810 матрицы массива из всего массива 1800 отходит только кабель 1806. Тело 1810 матрицы приблизительно имеет форму снаряда с центральной осью R-R. Оно имеет тупой конец 1805 и плоскую тыльную поверхность 1811. После введения массива 1800 в мягкую ткань в продольном направлении, начиная с конца 1805, матрица массива быстро растворяется. При этом электроды вместе со своими матрицами 1801, 1802, 1803 проходят подобно волосинкам щетки примерно перпендикулярно относительно опорной пластины 1808. За исключением тыльной концевой части тел электродов, идущих из соответствующих матриц, электроды массива 1800 соответствуют электроду, показанному на фиг. 17 а. Прилегающая ткань (не показана), которая теперь примыкает к концам матриц 1801, 1802, 1803, легко пронизывается ими при перемещении в сторону ткани субъектом,осуществляющим введение массива. Это перемещение выполняется по существу в направлении, перпендикулярном направлению введения массива в его исходном состоянии. Оно может быть осуществлено путем манипулирования опорной пластиной 1808 с использованием инструмента для введения массива(не показан), который соединен с возможностью последующего снятия с пластиной 1808 и позволяет смещать пластину 1808 в обоих направлениях, то есть в направлениях, перпендикулярных друг другу. Матрицы 1801, 1802, 1803 содержат лекарственное средство, которое высвобождается при их медленном растворении в ткани. Кроме того, в процессе растворения происходит установление электрического контакта между электродами и тканью, и это позволяет осуществлять регистрацию, например, сигналов от нервных клеток под воздействием высвобождаемого лекарственного средства. Таким же образом можно сконструировать массив электродных пучков (не показан), при этом электроды, показанные на фиг. 20, можно заменить на электродные пучки, и ими можно манипулировать соответствующим образом. Изготовление высвобождающего лекарственное средство медицинского электрода, электродного пучка и массива электродных пучков согласно изобретению Ниже сначала описано изготовление индивидуальных компонентов высвобождающего лекарственное средство медицинского электрода, электродного пучка и массива электродных пучков согласно изобретению, затем описана их сборка с формированием высвобождающего лекарственное средство медицинского электрода, электродного пучка и массива электродных пучков согласно изобретению. Нанесение покрытия на электрод В приведенных ниже общих методиках описывается создание на электроде покрытия с типом высвобождения от быстрого до умеренного. Нанесение покрытия на электрод (описанный выше) может быть осуществлено путем использования одного способа или комбинации способов, типичными примерами которых являются нанесение покрытия погружением, нанесение покрытия распылением, процессы плавления, включая экструзию, компрессионное формование и литьевое формование или комбинация различных способов, но этим перечень не ограничивается. В иллюстрируемом примере пошаговой процедуры сначала на электрод наносят покрытие погружением в подходящий рассасывающийся полимер или смесь полимеров из полимеров, перечисленных выше, в особенности в коллаген, желатин, поливиниловый спирт и крахмал, растворенные в надлежащем растворителе. Кроме того, можно использовать полимеры. Толщину полимерного слоя тщательно контролируют способами, известными специалисту в данной области техники. Затем покрытие проходит стадию сушки. Стадии нанесения покрытия погружением и сушки могут быть проделаны однократно или многократно в зависимости от необходимой толщины конечного покрытия. На следующей стадии в полимер вводят лекарственное средство. Электрод погружают в раствор, содержащий лекарственное средство. Растворитель должен вызвать рассасывание полимера, а также растворение лекарственного средства. Через оптимальный промежуток времени электрод извлекают из раствора и матрицу сушат. В процедуре, проводимой в одном реакционном сосуде, электрод погружают в раствор, содержащий подходящий полимер и выбранное лекарственное средство в концентрации, оптимальной для получения необходимой толщины матрицы и нагрузки лекарственным средством. Электрод извлекают из раствора и затем сушат. Покрытие также можно создавать путем нанесения распылением, при котором на электрод распыляют раствор полимера/лекарственного средства. Толщину покрытия можно регулировать числом циклов распыления и сушки и количеством полимера и вспомогательного вещества в растворе. Электроды для индуцируемого температурой и электроиндуцируемого высвобождения Для этих практических целей применимы указанные выше способы с использованием надлежащего полимера или надлежащей смеси полимеров вместе с оптимальными вспомогательными веществами и выбранным лекарственным средством. Примерами полимеров или смесей полимеров с оптимальными вспомогательными веществами в случае температурного регулирования являются: полностью или умеренно гидролизуемые водорастворимые полимеры, такие как поливиниловый спирт, полиакриловая кислота или ее производное, например гелеобразный поли(N-изопропилакриламид), и увеличение температуры приводят к сокращению данного гидрогеля, принуждая тем самым лекарственное средство поки- 25023177 дать покрытие. Альтернативно, чувствительным к температуре гидрогелем является взаимопроникающая сетчатая структура гидрогеля из поли(акриламида) и полиакриловой кислоты, а увеличение температуры вызывает набухание гидрогеля, позволяя лекарственному средству диффундировать из геля. (Dinarvand и соавт. 1995; WO 2005/067896; патент США 7066904). Примерами полимеров или смесей полимеров с оптимальными вспомогательными веществами для электроиндуцируемого высвобождения являются: смесь поливиниловый спирт/хитозан (Seon Jeong Kim et al., 2002, J. Appl. Polymer Sci.), смесь поливиниловый спирт/полиакриловая кислота (Li L. et al. 2005, Nanotechnology, 16, 2852-2860). Микроинкапсулирование лекарственных средств В одном из предпочтительных вариантов выполнения изобретения биологически активные компоненты инкапсулированы в микросферы. Диаметр микросфер может меняться в диапазоне от нескольких нанометров до милиметров. Для получения микросфер можно использовать следующие технологии микроинкапсулирования: распылительную сушку, охлаждение распылением, распыление с использованием вращающегося диска, нанесение покрытия в псевдоожиженном слое, коэкструзию с использованием неподвижного сопла, коэкструзию с использованием центробежного напора, коэкструзию с использованием погруженного сопла, нанесение покрытия в котлах, фазовое разделение, выпаривание растворителя,экстракцию растворителя, межфазную полимеризацию, коацервацию, полимеризацию in situ, липосомную технологию, наноинкапсулирование, но этим не ограничиваясь. Стандартные способы изготовления микросфер приведены в работе Microencapsulation: Methods and Industrial Applications. S Benita, 1996,ISBN-10: 0824797035, которая включена в данное описание посредством ссылки. Для получения микрокапсул особенно полезными в качестве строительных материалов оболочки являются: белки, полисахариды, крахмалы, воски, жиры, другие природные и синтетические полимеры. Возможно, что в дополнение к строительным материалам оболочки можно использовать одно или более вспомогательных веществ для увеличения или уменьшения скорости высвобождения лекарственного средства из микрокапсул. Оптимальная скорость высвобождения инкапсулированного лекарственного средства может быть достигнута посредством выбора материала оболочки, размера сфер, типа и количества встраиваемого лекарственного средства и вспомогательных веществ, инкорпорированных в такие сферы. Скорость высвобождения лекарственного средства из микросфер обычно соответствует реакции первого порядка. Тем не менее, в данной области техники также известны микрокапсулы, демонстрирующие скорости высвобождения, соответствующие реакции нулевого порядка. Микросфера согласно изобретению может содержать более мелкие сферы, в которые встроено лекарственное средство. Используя перечисленные выше материалы для матрицы, можно сконструировать растворимые сферы, но обладающие более низкой растворимостью, чем окружающая их матрица. Альтернативно, нерастворимые сферы можно сконструировать, используя биологически более устойчивые материалы. Например,биосовместимые синтетические полимеры, такие как полиуретан (в том числе поликарбонат-уретаны),изобутилен, полистирол-изобутилен-полистирол, силикон (например, полисилоксан и замещенный полисилоксан), термопластичный эластомер, сополимер этилена и винилацетата, полиолефиновый эластомер,тройной сополимер этиленпропилендиеновый каучук (EPDM; от англ. ethylene propylene diene monomer),полиамидный эластомер, гидрогель или их комбинации (WO 2005/082430). Такие гидрогелевые полимеры включают производные 2-гидроксиэтилметакрилата, поливинилового спирта, полиэтиленоксида, полиэтиленгликоля, полиуретанового гидрогеля, природных гидрогелей, например желатина, гиалуроновой кислоты, поперечно сшитого альбумина и т.д., или их комбинации (WO 2005/082430), но этим не ограничиваются. Например, когда микроинкапсулирование проводят с использованием способа сушки из водного окружения, указанную w/o эмульсию (типа вода-в-масле) дополнительно добавляют к другой водной фазе (далее называемой внешней водной фазой) с получением w/o/w эмульсии (типа вода-в-масле/вводе), затем удаляют органический растворитель в масляной фазе, получая микрокапсулы. К описанной выше внешней водной фазе может быть добавлен эмульгатор. Можно использовать любой фармацевтически приемлемый эмульгатор, если только он дает обычно стабильную w/o/w эмульсию. Примеры таких эмульгаторов включают анионные поверхностно-активные вещества (например, олеат натрия, стеарат натрия, лаурилсульфат натрия), неионные поверхностно-активные вещества (например, Твин 80, Твин 60, НСО-60, НСО-70), поливиниловый спирт, поливинилпирролидон и желатин. Два или более из этих эмульгаторов могут быть использованы в комбинации в приемлемом соотношении. Концентрация эмульгатора во внешней водной фазе изменяется в диапазоне, например приблизительно от 0,01 до 20%,предпочтительно приблизительно от 0,05 до 10%. Удаление органического растворителя из микрокапсул может быть достигнуто известными способами, включая способ, в котором растворитель удаляют при нормальном или постепенно снижающемся давлении при перемешивании с использованием пропеллерной мешалки, магнитной мешалки или аналогичного устройства, и способ, при котором растворитель удаляется, когда достигнут требуемый уровень вакуума и температуры с использованием роторного испарителя или аналогичного устройства. Полученные таким образом микрокапсулы подвергают центрифугированию или фильтрации для их отделения и затем несколько раз повторно промывают дистиллированной водой для удаления свободного физиологически активного вещества, вещества, удерживающего лекарственное средство, эмульгатора и т.д., приставших к поверхности микрокапсул. Затем промытые микрокапсулы сушат при пониженном давлении или подвергают сублимационной сушке после повторного диспергирования в дистиллированной воде для дальнейшего удаления органического растворителя. Чтобы приготовить микросферы способом фазового разделения, к w/o эмульсии постепенно добавляют агент для коацервации, перемешивая при этом эмульсию для осаждения и отвердевания полимера молочной кислоты. Можно использовать любой фармацевтически приемлемый агент для коацервации, в частности, минеральное или растительное масло, которое смешивается с полимерным растворителем и в котором не растворяется полимер, используемый для инкапсулирования. Примеры таких агентов для коацервации включают силиконовое масло, кунжутное масло, соевое масло, кукурузное масло, хлопковое масло, кокосовое масло, льняное масло, минеральное масло, н-гексан и н-гептан. Два или более из них могут быть использованы в комбинации. Количество используемого агента для коацервации составляет, например, примерно от 0,01 до 1000-кратного по объему, предпочтительно примерно от 0,1 до 200 кратного по объему по отношению к w/o эмульсии. Полученные таким образом микросферы подвергают центрифугированию или фильтрации для их отделения, после чего их повторно промывают жидкостью для промывки, такой как гексан и гептан, для удаления агента для коацервации. Затем жидкость для промывки выпаривают, используя нагревание или пониженное давление. Если необходимо, таким же образом, как в описанном выше способе сушки из водного окружения,удаляют свободное физиологически активное вещество и органический растворитель. Чтобы получить микрокапсулы способом распылительной сушки, w/o эмульсию или w/o/w эмульсию, полученную таким же образом, как и в способе сушки из водного окружения, распыляют в виде мелких капель через сопло в сушильную камеру распылительной сушилки для испарения органического растворителя и воды в течение очень короткого промежутка времени с тем, чтобы образовались микрокапсулы. Примеры сопл включают, например сопла пневмораспылительного типа, сопла нагнетательного типа и сопла с использованием вращательного диска. Если необходимо, полученные таким образом микрокапсулы несколько раз повторно промывают дистиллированной водой для удаления свободного физиологически активного вещества, вещества, удерживающего лекарственное средство, эмульгатора и т.д., приставших к поверхности микрокапсул. Затем промытые микрокапсулы можно сушить при пониженном давлении или подвергать сублимационной сушке после повторного диспергирования в дистиллированной воде для дальнейшего удаления органического растворителя. Кроме того, когда физиологически активное вещество растворяется 1) в масляной фазе, состоящей из одного гидрофобного органического растворителя (например, дихлорметана, хлороформа, дихлорэтана, четыреххлористого углерода, этилацетата, циклогексана) и по меньшей мере одного гидрофобного органического растворителя (например, метанола, этанола, ацетонитрила), или 2) в масляной фазе, состоящей из раствора полимера в гидрофобном органическом растворителе, или 3) в масляной фазе, приготовленной посредством добавления по меньшей мере одного поверхностно-активного вещества (например, сложного эфира глицерина и жирной кислоты, сложного эфира пропиленгликоля и жирной кислоты, сложного эфира сахарозы и жирной кислоты) к описанному выше гидрофобному органическому растворителю; эти масляные фазы могут быть диспергированы во внешней водной фазе, используемой в описанном выше способе сушки из водного окружения, с получением o/w эмульсии (типа масло-в-воде) с последующим удалением органического растворителя в масляной фазе таким же образом, как и в описанном выше способе сушки из водного окружения, чтобы образовались микрокапсулы. Далее эту o/w эмульсию можно подвергнуть описанному выше способу фазового разделения или способу распылительной сушки для приготовления микрокапсул. Композиция с непрерывным высвобождением согласно настоящему изобретению предпочтительно содержит эксципиент. Желательно, чтобы эксципиент обладал низкой токсичностью при введении в живой организм, легко поддавался сублимационной сушке или распылительной сушке и быстро растворялся при введении в живой организм или растворялся во время использования. Примеры такого эксципиента включают, например, сахара, производные целлюлозы, аминокислоты, белки, производные полиакриловой кислоты, органические соли и неорганические соли. Два или более таких эксципиентов могут быть использованы в комбинации в приемлемом соотношении. Растворимые или разлагаемые бруски, содержащие лекарственные средства Бруски или стержни из конъюгированного с лекарственным средством материала можно изготовить посредством распределения лекарственного средства на листовом материале, растворимом в жидкости организма, и затем покрытия лекарственного средства материалом того же вида. Альтернативно, лекарственное средство можно нанести на поверхность покрывающего материала, затем покрыть этот слой лекарственного средства покрывающим материалом того же типа. Затем этот 3-слойный лист нарезают на тонкие полоски. Одну или более полосок размещают параллельно электроду согласно изобретению,после чего заключают электрод и полоски в матричный материал. Аналогичным образом можно изготовить по отдельности и заключить в матричный материал в комбинации и по соседству с электродом согласно изобретению жесткие стержни из материала, растворимого в жидкости организма, или биоразлагаемого материала, содержащего лекарственное средство. Подходящими материалами для стержней являются, например биосовместимые синтетические полимеры, такие как, например полиуретан (в том числе поликарбонат-уретаны), изобутилен, полистирол-изобутилен-полистирол, силикон (например, полисилоксан и замещенный полисилоксан), термопластичный эластомер, сополимер этилена и винилацетата, полиолефиновый эластомер, тройной сополимер этиленпропилендиеновый каучук (EPDM), полиамидный эластомер, гидрогель или их комбинации (WO 2005/082430). Такие гидрогелевые полимеры включают производные 2-гидроксиэтилметакрилата, поливинилового спирта, полиэтиленоксида, полиэтиленгликоля, полиуретанового гидрогеля, природных гидрогелей, например желатина, гиалуроновой кислоты, поперечно сшитого альбумина и т.д., или их комбинации (WO 2005/082430), но этим не ограничиваются. Альтернативно, для регулирования высвобождения лекарственных средств можно использовать электрод, изолированный только частично, как например электрод, покрытый изолирующим материалом только проксимально, или электрод, содержащий множество неизолированных участков. Бруски или стержни предпочтительно вводят в середину электродного пучка. Также возможны другие расположения в пределах электрода. Бруски можно присоединить к индивидуальным электродам,чтобы те следовали за последними в процессе развертывания. В этом случае необходимо, чтобы бруски были относительно гибкими и имели диаметр, сходный с диаметром индивидуального электрода, хотя возможны также другие размеры. Бруски также могут быть относительно жесткими в случаях, когда желательно обеспечить следование брусков по основной линии траектории во время введения, и тогда лекарственные средства будут высвобождаться только из сердцевины каждого электрода или электродного пучка. Бруски в этом случае могут играть двойную роль, высвобождая лекарственные средства и добавляя жесткость электродному ансамблю в целом в процессе имплантации. Встраивание электродов и лекарственных средств в матрицу Лекарственные средства могут быть введены в матрицу или отделение матрицы посредством смешивания лекарственных средств с материалами, используемыми для построения матрицы или некоторого подотделения матрицы и/или посредством смешивания микросфер с матричными материалами или материалом для отделения матрицы. Кроме того, параллельно электродам могут быть введены подготовленные содержащие лекарственное средство бруски или стержни из биоразлагаемого материала или материала, растворимого в жидкости организма. Электроды могут иметь покрытие в виде одного или более слоев содержащего лекарственное средство матричного материала и/или содержащего лекарственное средство материала подотделения матрицы. Выбирая разные материалы для отделений матрицы, можно получить разные скорости высвобождения лекарственного средства. Комбинация разных слоев матрицы или слоев подотделений матрицы, а также содержащих лекарственное средство микросфер и брусков, должна быть устойчивой, то есть внешние слои не должны никак влиять на внутренние слои/структуры до имплантации. Электрод, или электродный пучок, или массив электродных пучков согласно изобретению помещают в оболочку из гладкого материала с низкой смачиваемостью, такого как полифторированный углеводородный полимер или кремнийорганический каучук, и фиксируют в ней. Таким образом, данная оболочка действует как форма (для отливки). Для облегчения испарения растворителя используют преимущественно пористый материал оболочки, в частности, микропористый. После добавления матричного материала или материала отделения, содержащего лекарственное средство, возможно в микроинкапсулированной форме, в оболочку и сушки (выпаривания растворителя, возможно при пониженном давлении) продукт извлекают из оболочки. Оболочка может иметь ту же форму, что и готовый зонд, но также может быть меньшего размера в том случае, когда впоследствии к зонду добавляют дополнительный материал посредством нанесения покрытия погружением или нанесения покрытия распылением. Чтобы облегчить эксплуатацию электродов или других компонентов, таких как содержащие лекарственные средства бруски, оптические волокна или биметаллические компоненты, для введения их в форму (для отливки) используют микроманипулятор, прикрепленный к данным компонентам посредством растворимого связующего материала. Кроме того, предпочтительно, чтобы отдельные электроды можно было монтировать по указанному шаблону и затем на них нанести покрытие распылением или погружением, чтобы зафиксировать их друг относительно друга перед погружением в матрицу. Материал, используемый для фиксации электродов или других компонентов в определенной конфигурации, предпочтительно изготовлен из тех же растворимых материалов, из которых состоит матрица. Данный способ включает изготовление матричного материала,содержащего выбранные лекарственные средства и/или микросферы. Этого можно достичь простым растворением лекарственных средств или микросфер в материале, используемом для получения конкретного отделения матрицы. Помимо этого данный способ включает обеспечение наличия фиксирующего средства; фиксацию электродов и брусков, содержащих лекарственные средства и, возможно, подлежащих встраиванию элементов, таких как оптические волокна, сократительные элементы и т.д., в данном фиксирующем средстве в желаемой конфигурации, как описано выше; нанесение оболочки, покрывающей фиксированные таким образом элементы за исключением их проксимальной соединительной части; нанесение раствора или суспензии первого матричного материала на электрод таким образом, чтобы покрыть части элементов, предназначенные для встраивания; обеспечение возможности растворителю/диспергирующему веществу раствора или суспензии матрицы соответственно испаряться или затвердевать; удаление оболочки и извлечение элементов из фиксирующего средства. Для встраивания электродов и других элементов в два матричных материала с целью формирования соответствующего отделения матрицы, каждое из которых охватывает часть электрода, на соответствующую часть тела электрода, фиксированную с помощью фиксирующего средства, как описано выше, наносят раствор или суспензию первого матричного материала, растворитель/диспергирующее вещество которого впоследствии испаряется, после чего на оставшуюся без покрытия часть тела электрода наносят раствор или суспензию второго матричного материала с последующим испарением растворителя/диспергирующего вещества второго матричного материала и извлечением электрода из фиксирующего средства. Альтернативный способ встраивания электрода согласно изобретению в два матричных материала с образованием индивидуальных отделений матрицы, в которые встроены части электрода, включает встраивание всего электрода в первый матричный материал, растворение части первого матричного материала, предпочтительно дистальной части, проходящей от дистального конца, нанесение покрытия с использованием второго матричного материала на оставшуюся невстроенной дистальную часть электрода, например, с применением оболочки, охватывающей невстроенную дистальную часть, заполнение оболочки раствором или суспензией второго матричного материала, испарение растворителя для высыхания/затвердевания второго матричного материала и удаление оболочки. Можно сформировать внутри матрицы заданные отделения, содержащие высвобождаемые биологически активные молекулы, чтобы сфокусировать эффекты, вызываемые данным лекарственным средством, в концевых областях или хвостовых областей электродов. Этого можно достичь, изготавливая конструкцию матрица-электрод за две или более стадий, добавляя на каждой стадии по одному отделению. Материалы и размеры Размеры электродов. Подходящий диаметр электродов согласно изобретению составляет от 10-4 до 10-7 м, в частности от 0,5 до 25 мкм. Больший диаметр проволоки, например, до 1,510-3 м включительно, можно использовать в случае подхода с применением обширной стимуляции/регистрации, например с целью внесения повреждений в мягкую ткань. Диаметр электродов может меняться по всей длине для облегчения введения в ткань, в частности, электрод может быть конусообразным в направлении своего дистального конца. В случае использования электрода для регистрации электрической активности его дистальный конец может быть острым или тупым, но острый конец является предпочтительным. Дистальная часть даже может иметь диаметр меньше 10-7 м. Поверхность электродов может быть гладкой или не гладкой либо быть частично гладкой и частично не гладкой, то есть шероховатой. Негладкая или шероховатая поверхность вблизи конца электрода предпочтительна для улучшения закрепления и снижения электрического сопротивления конца электрода. Электрод согласно изобретению предпочтительно является изолированным, за исключением частей,проходящих от его проксимального и дистального концов. Тем не менее, тело электрода может быть снабжено средствами, обеспечивающими стимуляцию/регистрацию многочисленных участков в данной ткани. Такие средства могут, например, состоять из электропроводящих выступающих сверхтонких нитей или участков с шероховатой или негладкой поверхностью, занимающих по длине до 10 мкм включительно или больше. Такие участки не будут электрически изолированными, если подразумевать наличие электрического контакта с тканью. Они также могут служить в качестве фиксирующего средства, а также для электрической стимуляции/регистрации. Если планируется электрическая стимуляция большего объема ткани, то, напротив, предпочтительно не изолировать большую часть, проходящую от конца электрода, например, длиной до 100 мкм или даже до 1 мм включительно. Подходящими материалами для изоляции электродных проволок являются, например, стекло, поливинилформаль, парилен С, поликсилол, эпоксидная смола, полиамид, кремнийорганический каучук, не растворимый в воде лак. Форма электрода. Важным признаком настоящего изобретения является то, что расстояние от дистального конца до проксимальной соединительной части электрода может многократно и обратимо увеличиваться и уменьшаться без разрыва электрода, обеспечивая проволоке плавное следование за неоднородными движениями в окружающей мягкой ткани, которые могут иметь место в окрестности артериальных или венозных сосудов, в сердце или легких либо между мягкой и твердой тканью. Это достигается путем придания электроду множественных изгибов, которые могут соответствовать определенному шаблону, но не обязательно. Таким образом, электроды могут иметь волнистую, скрученную, извилистую, спиральную или другую непрямую конфигурацию, позволяющую, когда вдоль этой проволоки действует сила, легко увеличивать/уменьшать расстояние между проксимальной соединительной частью и дистальной концевой частью по меньшей мере на 1%, но предпочтительно по меньшей мере на 5%. Например, расстояние от конца до основания электрода длиной 1 мм легко может быть увеличено/уменьшено по меньшей мере на 10 мкм и даже на 50 мкм или больше. Предпочтительно использовать плавную изогнутую форму, например с волнистой или спиральной конфигурацией. Форма, характеризующаяся резкими изгибами, менее предпочтительна, поскольку силы,вызываемые увеличением/уменьшением расстояния между концом и проксимальной соединительной частью электрода, не должны существенно влиять на отдельные участки в теле электрода или короткие
МПК / Метки
МПК: A61B 5/0478, A61N 1/05
Метки: лекарственных, устройства, ткани, содержащие, микроэлектродов, микроэлектрод, высвобождения, средств, пучок
Код ссылки
<a href="https://eas.patents.su/30-23177-mikroelektrod-i-puchok-mikroelektrodov-soderzhashhie-ustrojjstva-dlya-vysvobozhdeniya-lekarstvennyh-sredstv-v-tkani.html" rel="bookmark" title="База патентов Евразийского Союза">Микроэлектрод и пучок микроэлектродов, содержащие устройства для высвобождения лекарственных средств в ткани</a>
Предыдущий патент: Арилсульфонилпиразолинкарбоксамидиновые производные в качестве антагонистов 5-нт6
Следующий патент: Фотокаталитический материал
Случайный патент: Способ измерения суммарного люфта рулевого управления автотранспортного средства












