Применение источника l3 и/или l5 в качестве вакцины или диагностического средства для паразитарного заболевания
Номер патента: 22221
Опубликовано: 30.11.2015
Авторы: Алонсо-Бедате Карлос, Сото Альварес Мануэль, Рамирес Гарсия Лаура
Формула / Реферат
1. Применение источника L5 и/или L3 для лечения, или профилактики, или задержки начала лейшманиоза или малярии у индивидуума,
причем указанный источник L3 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:2, или
причем указанный источник L3 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:2, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:1, и
причем указанный источник L5 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:3 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:4, или
причем указанный источник L5 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:4, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:3.
2. Применение по п.1, где источник S4 и/или S6 комбинируют с источником L3 и/или L5,
причем указанным источником S4 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:32 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:33, или
причем указанным источником S4 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:33, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:32; и/или
причем указанным источником S6 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35, или
причем указанным источником S6 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:35, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:34.
3. Применение по любому из пп.1 или 2, где присутствует адъювант.
4. Применение по любому из пп.1-3, где источником L3, и/или L5, и/или S4, и/или S6, определенным в п.1 или 2, является вакцина.
5. Применение по любому из пп.1-4, где источником L3, и/или L5, и/или S4, и/или S6, определенным в п.1 или 2, является белок, фрагмент белка, пептид, нуклеиновая кислота.
6. Применение по любому из пп.3-5, где адъювантом является Th1-стимулирующий адъювант.
7. Применение по п.6, где Th1-стимулирующим адъювантом является CpG ODN.
8. Композиция, содержащая источник L3 и/или L5,
причем указанный источник L3 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:2, или
причем указанный источник L3 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:2, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:1, и/или
причем указанный источник L5 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:3 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:4, или
причем указанный источник L5 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:4, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:3.
9. Композиция по п.8, где указанная композиция содержит источник S4 и/или S6,
причем указанным источником S4 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:32 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:33, или
причем указанным источником S4 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:33, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:32; и/или
причем указанным источником S6 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35, или
причем указанным источником S6 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:35, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:34.
10. Композиция по любому из пп.8, 9, дополнительно содержащая адъювант.
11. Композиция по п.10, где адъювантом является Th1-стимулирующий адъювант.
12. Композиция по п.11, где Th1-стимулирующим адъювантом является CpG ODN.
13. Композиция по любому из пп.8-12, дополнительно содержащая фармацевтически приемлемый адъювант и/или носитель.
14. Композиция по любому из пп.8-13 для применения в качестве лекарственного средства.
15. Композиция по п.14, где лекарственное средство является вакциной.
16. Применение источника L3 и/или L5,
причем указанный источник L3 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:2, или
причем указанный источник L3 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:2, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:1, и/или
причем указанный источник L5 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:3 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:4, или
причем указанный источник L5 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:4, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:3,
для диагностики лейшманиоза или малярии у индивидуума in vitro.
17. Применение по п.16, где дополнительно используют источник S4 и/или S6,
причем указанным источником S4 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:32 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:33, или
причем указанным источником S4 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:33, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:32; и/или
причем указанным источником S6 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35, или
причем указанным источником S6 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:35, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:34.
18. Применение по любому из пп.1-7, 16 или 17, где источник L3, и/или L5, и/или S4, и/или S6, определенный в п.1 или 2, получают из видов Leishmania.
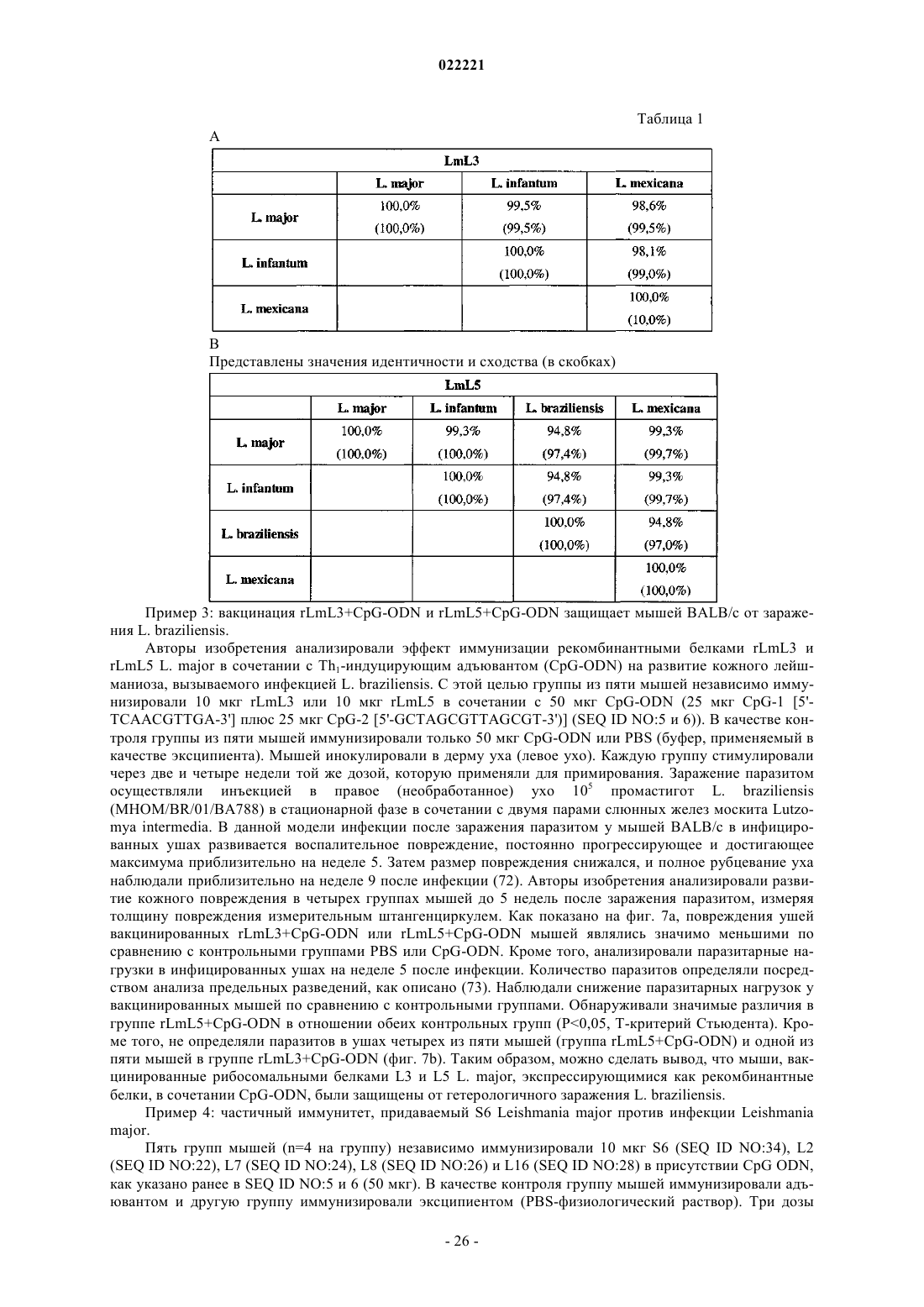
19. Применение по п.18, где видами Leishmania являются Leishmania major, Leishmania infantum, Leishmania braziliensis или Leishmania mexicana.
20. Применение по любому из пп.1-7 или 16-19, где лейшманиоз или малярия вызваны видами Leishmania или Plasmodium.
21. Применение по любому из пп.1-7 или 16-20, где лейшманиоз или малярия вызваны видами, иными, чем виды, из которых получают источник L3, и/или L5, и/или S4, и/или S6.
22. Способ диагностики лейшманиоза или малярии у индивидуума с использованием источника L3 и/или L5, включающий определение того, присутствует ли антитело, распознающее указанный источник, в образце, полученном от индивидуума,
причем указанный источник L3 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:2, или
причем указанный источник L3 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:2, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:1, и/или
причем указанный источник L5 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:3 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:4, или
причем указанный источник L5 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:4, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:3.
23. Способ по п.22, где также используют источник S4 и/или S6,
причем указанным источником S4 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:32 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:33, или
причем указанным источником S4 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:33, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:32; и/или
причем указанным источником S6 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35, или
причем указанным источником S6 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:35, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:34.
24. Набор для диагностики лейшманиоза или малярии у индивидуума, где набор содержит источник L3 и/или L5,
причем указанный источник L3 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:2, или
причем указанный источник L3 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:2, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:1, и/или
причем указанный источник L5 является полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:3 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:4, или
причем указанный источник L5 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:4, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:3.
25. Набор по п.24, где в указанном наборе также присутствует источник S4 и/или S6,
причем указанным источником S4 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:32 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:33, или
причем указанным источником S4 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:33, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:32; и/или
причем указанным источником S6 является полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35, или
причем указанным источником S6 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:35, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:34.
26. Набор по любому из пп.24 или 25, где указанным анализом является ELISA.
Текст
ПРИМЕНЕНИЕ ИСТОЧНИКА L3 И/ИЛИ L5 В КАЧЕСТВЕ ВАКЦИНЫ ИЛИ ДИАГНОСТИЧЕСКОГО СРЕДСТВА ДЛЯ ПАРАЗИТАРНОГО ЗАБОЛЕВАНИЯ Изобретение относится к композиции, содержащей источник L3 и/или L5 и необязательно адъювант, для получения лекарственного средства для лечения или предотвращения паразитарного заболевания и ее диагностическому применению при указанном паразитарном заболевании. Алонсо-Бедате Карлос, Сото Альварес Мануэль, Рамирес Гарсия Лаура (ES) Медведев В.Н. (RU) Область изобретения Изобретение относится к источнику L3 и/или L5 для получения лекарственного средства для применения в лечении, профилактике и/или диагностике паразитарного заболевания. Предпосылки изобретения Лейшманиоз включает несколько заболеваний, вызываемых внутриклеточными простейшими паразитами, принадлежащими роду Leishmania, в основном инфицирующими макрофаги различных млекопитающих, включая людей и собак. Главным образом, в зависимости от вида паразита и состояния иммунокомпетентности человека-хозяина спектр заболеваний находится в диапазоне от самозаживляющегося кожного лейшманиоза (CL) до смертельного висцерального лейшманиоза (VL) или кала-азар (18). Висцерально-кожный лейшманиоз собак (VCL), вызываемый Leishmania infantum и L. chagasi, является важным новым зоонозом, обнаруженным в странах Средиземноморского бассейна, на Среднем Востоке и в Латинской Америке (16); собаки являются основным резервуаром для данных паразитов, играя центральную роль в передаче людям через москитов рода Phlebotomus (44). Исход инфекции определяется взаимодействиями между иммунной системой хозяина и различными видами паразитов, тем не менее,патогенез лейшманиоза остается неясным, и знание механизмов, участвующих в иммунном ответе наLeishmania у людей и собак, пока ограничено. Как правило, защитный иммунитет связан с классическим клеточно-опосредованным иммунным ответом, индуцирующим активацию макрофагов цитокинами, выделяемыми Т-клетками. С другой стороны, невылечиваемое заболевание связано с формированием сильных гуморальных ответов (15, 24). Исследования для разработки вакцин второго поколения на основе неочищенных фракций паразита или определенных антигенов паразита направлены на идентификацию различных поверхностных или секретируемых молекул паразита, тестируемых в качестве кандидатов для вакцины на нескольких экспериментальных моделях с применением различных адъювантов (1, 17, 20, 43, 45, 46, 49, 50). Скрининг экспрессионных библиотек с помощью сывороток инфицированных животных или людей также позволяет выбирать несколько антигенов в качестве кандидатов для вакцины (обзор в (9. Те из них, которые проявляют в клетках инфицированных мышей или пациентов-людей иммунный ответ, главным образом,Th1-типа независимо от их клеточной локализации, участвуют в формировании защитных ответов на различных моделях на животных (48, 51, 52). С другой стороны, некоторые из выделенных антигенов являются внутриклеточными консервативными белками, преимущественно стимулирующими гуморальные ответы у людей или собак, страдающих VL, или Th2-опосредованные гуморальные ответы у экспериментально инфицированных мышей (3, 33, 35, 37, 39). Считается, что неадекватный гуморальный ответ, индуцируемый против них у собак, страдающих лейшманиозом, приводит к иммунопатологии, такой как увеит (13), повреждения центральной нервной системы (14) или нефрит (21, 22, 30, 31), в основном, по причине неблагоприятных воздействий иммунных комплексов. Также недавно показано, что наличие иммунных комплексов IgG у людей с VL коррелирует с неспособностью устранять инфекции,свидетельствуя о том, что иммунные комплексы могут приносить вред инфицированному хозяину (27). Несмотря на первоначальное неприятие в качестве кандидатов для вакцины, белки, индуцирующие высокий гуморальный ответ при инфекционном процессе, связаны с индукцией защитного ответа. Например, тубулины и гистон Н 2 В паразита распознаются Т-клеточными клонами, происходящими из иммунокомпетентного донора (36). Кроме того, rK39 вызывает пролиферацию и продукцию IFN Т-клетками от иммунокомпетентных мышей (23). Также показано, что генная иммунизация генами Н 2 В, Н 3 и Н 4 паразита индуцирует иммунитет на моделях висцерального лейшманиоза мыши (62). Кроме того, иммунизация рецептором активированной киназы С (LACK) (29), некоторыми цистеиновыми протеиназами паразита (38, 41) или образующими нуклеосомы гистонами паразита (11, 19), вводимыми с Th1 стимулирующими адъювантами, вызывает иммунные ответы, коррелирующие с иммунитетом против кожного лейшманиоза на моделях на мышах. Несколько линий доказательств позволяют предположить, что среди эволюционно консервативных антигенов Leishmania рибосомальные белки являются иммунологически значимыми молекулами при инфекции Leishmania. В некоторых случаях рибосомальные элементы могут участвовать в дисфункции иммунной системы хозяина посредством своей способности модулировать активности клетки и высвобождение цитокинов при инфекции. Таким образом, инъекция рибосомального белка S3a L. major мышам BALB/c индуцировала поликлональную активацию В-клеточных клонов и ингибировала пролиферацию Т-клеток (10). Кроме того, генная иммунизация ДНК-вакциной, кодирующей предполагаемый рибосомальный белок 60S L31, ухудшает заболевание на модели на мышах посредством индукции IL-10 и Th2-цитокинов (41, 63). Кроме того, некоторые рибосомальные белки паразита, такие как кислые Рбелки паразита, связаны с формированием сильных гуморальных ответов у собак и людей, страдающих лейшманиозом (обзор (39. Однако также показано, что некоторые тестируемые рибосомальные белки не способны индуцировать иммуногенный защитный ответ или получаемый иммуногенный защитный ответ являлся недостаточным (55, 41). Несмотря на все предпринимаемые до сих пор попытки, все еще не существует полноценных вакцин против паразитарного заболевания, такого как лейшманиоз. Таким образом, по-прежнему существует необходимость в такой вакцине. Описание изобретения В настоящей работе авторы изобретения неожиданно показали, что два рибосомальных белка L.major L3 и L5 являются антигенными. Это означает, что каждый из этих двух белков распознается сыворотками индивидуумов, страдающих лейшманиозом. Кроме того, на модели кожного лейшманиоза мыши обнаруживали антитела изотипа IgG1 против L3 и против L5. Иммунизация обоими белками у мышей BALB/c в присутствии CpG-ODN индуцировала Th1-ответ против этих белков. В результате вакцинации мыши были защищены от развития CL после заражения L. major. Кроме того, авторы изобретения продемонстрировали, что белки L. major также могут придавать иммунитет против инфекции L. braziliensis. Авторы изобретения также продемонстрировали, что рибосомальные белки L3 и L5 высококонсервативны, по меньшей мере, между различными видами Leishmania. Такие композиции очень привлекательны для применения в качестве фармацевтических композиций, предпочтительно в качестве диагностического средства, вакцины или терапевтического средства. Дополнительно изобретение описывают ниже. Применение. Первый аспект изобретения относится к применению источника L3 и/или L5 и необязательно адъюванта для получения лекарственного средства (medicine) или лекарственного средства (medicament) для лечения или предотвращения паразитарного заболевания у индивидуума. Белки L3 и L5 являются рибосомальными белками. Рибосомальные белки являются достаточно консервативными цитозольными белками. Таким образом, источник L3 и/или L5 можно получать из любых эукариотических организмов, будь это растение или животное, будь это млекопитающие, пресмыкающиеся, рыбы, насекомые или любой другой несущий хромосомы организм, такой как простейшие. Предпочтительно источник L3 и/или L5 получают из организма, близкого в эволюционном древе к организму, вызывающему заболевание, предпочтительно паразитарное заболевание. Таким образом, особый интерес в качестве источника L3 и/или L5 для применения в предотвращении и/или лечении паразитарного заболевания представляют простейшие, такие как Plasmodium и, в частности, члены семейства Трипаносоматид, в частности различные виды трипаносомных простейших Leishmania. Существует более 20 известных видов Leishmania, включая виды подрода Leishmania, включающего комплекс L. major, включая L. major, комплекс L. donovani, включая L. chagasi, L. donovani и L. infantum, комплекс L. mexicana,включая L. amazonensis и L. mexicana, а также подвиды Viannia, включающие комплекс L. braziliensis,включая L. braziliensis и L. peruviana, и комплекс L. guyanensis, включая L. guyanensis и L. panamensis. Представляющими особый интерес видами Plasmodium являются Plasmodium falciparum и Plasmodiumvivax. В предпочтительном варианте осуществления источник L3 и/или L5 получают из видовmexicana, Leishmania chagasi и/или Leishmania braziliensis. Более предпочтительно источник L3 получают из видов Leishmania, предпочтительно Leishmania major, Leishmania infantum и/или Leishmania mexicana. Более предпочтительно источник L5 получают из видов Leishmania, предпочтительно Leishmania major,Leishmania infantum, Leishmania braziliensis и/или Leishmania mexicana. В примере 2 авторы изобретения продемонстрировали существование высококонсервативных гомологов L3 и L5 (идентичность по меньшей мере 90%, см. табл. 1) по меньшей мере в трех различных видах Leishmania. В другом предпочтительном варианте осуществления источник L3 и/или L5 получают из видов Plasmodium. Специалисту в данной области будет понятно, что источник L3 и/или L5 также можно получать смешиванием источника L3 и/или L5 из нескольких различных организмов, как указано в настоящем описании. В настоящем описании показано, что применение источника L3 и/или L5 в вакцине обладает привлекательными иммуногенными свойствами, так как показано, что он индуцирует иммунный защитный ответ у подвергаемого лечению индивидуума. Термин "источник L3 и/или L5" можно заменять "источником L3 и/или L5". Источник L3 и/или L5 предпочтительно содержит белок L3 и/или L5, пептид, происходящий из L3 и/или L5, или фрагмент белка и/или нуклеиновую кислоту, кодирующую белок L3 и/или L5, или происходящий из них пептид или фрагмент белка. Предпочтительный белок L3 представлен в SEQ ID NO:1. Этот предпочтительный белокL3 происходит из Leishmania major, его предпочтительно кодирует SEQ ID NO:2. Другой предпочтительный белок L3 представлен в SEQ ID NO:48. Этот предпочтительный белок L3 происходит из Leishmaniainfantum, его предпочтительно кодирует SEQ ID NO:49. Другой предпочтительный белок L3 представлен в SEQ ID NO: 50. Данный предпочтительный белок L3 происходит из Leishmania mexicana, его предпочтительно кодирует SEQ ID NO:51. Предпочтительный белок L5 представлен в SEQ ID NO:3. Этот предпочтительный белок L5 происходит из Leishmania major, его предпочтительно кодирует SEQ ID NO:4. Другой предпочтительный белок L5 представлен в SEQ ID NO:52. Этот предпочтительный белок L5 происходит из Leishmania infantum, его предпочтительно кодирует SEQ ID NO:53. Другой предпочтительный белок L5 представлен вSEQ ID NO:54. Этот предпочтительный белок L5 происходит из Leishmania mexicana, его предпочтительно кодирует SEQ ID NO:55. Другой предпочтительный белок L5 представлен в SEQ ID NO:56. Этот предпочтительный белок L5 происходит из Leishmania braziliensis, его предпочтительно кодирует SEQ ID На всем протяжении настоящего изобретения каждый раз, когда ссылаются на конкретную нуклеотидную последовательность SEQ ID NO (например, SEQ ID NO:2, или 4, или 49, или 51, или 53, или 55,или 65), можно заменять ее нуклеотидной последовательностью, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с SEQ IDNO:2, или 4, или 49, или 51, или 53, или 55, или 65. На всем протяжении настоящего изобретения каждый раз, когда ссылаются на конкретную аминокислотную последовательность SEQ ID NO (например, SEQ ID NO:1, или 3, или 48, или 50, или 52, или 54, или 56), можно заменять ее полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1, или 3, или 48, или 50, или 52, или 54, или 56. Таким образом, в предпочтительном варианте осуществления источник L3 является полипептидом,содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1, или 48, или 50,и/или кодируемым нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность сSEQ ID NO:2, или 49, или 51. Таким образом, в предпочтительном варианте осуществления источник L5 является полипептидом,содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:3, или 52, или 54, или 56, и/или кодируемым нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:4, или 53, или 55, или 65. Таким образом, в предпочтительном варианте осуществления источник L3 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:2, или 49, или 51, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:1, или 48, или 50. Таким образом, в предпочтительном варианте осуществления источник L5 является нуклеиновой кислотой, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:4, или 53, или 55, или 65, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ ID NO:3, или 52, или 54, или 56. Предпочтительно указанная аминокислотная последовательность или нуклеотидная последовательность, имеющие по меньшей мере 60% идентичность или сходство с конкретной определенной аминокислотной или нуклеотидной последовательностью, находятся в объеме данного изобретения, и их указывают как функциональные, если кодируемый белок или полипептид, фрагмент белка, пептид все еще способен вызывать, по меньшей мере, иммунный ответ, получаемый с помощью SEQ ID NO:1, или 3, или 48, или 50, или 52, или 54, или 56, по меньшей мере, в некоторой степени. По меньшей мере, в некоторой степени, предпочтительно означает по меньшей мере 50%, по меньшей мере 60, 70, 80%, по меньшей мере 90 или 100%. Вызывающий иммунный ответ в настоящем описании ниже определяют следующим образом: соединение является функциональным, если оно способно вызывать иммунный ответ у подвергаемого лечению индивидуума, что предпочтительно означает, что оно способно стимулировать или запускать Th1-иммунный ответ против указанного антигена L3 и/или L5 и/или что оно способно предотвращать и/или замедлять развитие повреждения кожи или слизистой оболочки, и/или индуцировать значимое снижение паразитарной нагрузки в повреждении кожи, и/или слизистой оболочки, и/или в ухе,и/или в дренирующем лимфоузле (DLN), предпочтительно дренирующем любую из данных инфицированных областей (область кожи, слизистой оболочки, ухе), а также во внутреннем органе, таком как печень, селезенка, костный мозг, почка, головной мозг и т.д. Аминокислотная последовательность, включенная в настоящее изобретение, может содержать одну, две, три, четыре, пять или более замен, и/или инсерций, и/или делеций, и/или дополнительные N- или С-концевые аминокислоты или химические остатки для повышения стабильности, растворимости и иммуногенности. Как указано в настоящем описании, фрагмент белка L3 и/или L5 или пептид, происходящий из L3 и/или L5, предпочтительно является фрагментом, содержащим по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более смежных аминокислот из соответствующего белка L3 и/или L5 и способным вызывать иммунный ответ, как указано в настоящем описании выше. Таким образом, как указано в настоящем описании, в предпочтительном варианте осуществления фрагмент белка L3 и/или L5 или пептид, происходящий из L3 и/или L5, предпочтительно является фрагментом, содержащим по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18,19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более смежных аминокислот из SEQ ID NO:1, или 3, или 48, или 50, или 52, или 54, или 56. В качестве предпочтительного варианта осуществления предпочтительный фрагмент белка L3 или предпочтительный пептид, происходящий из L3, содержит последние 40, 39, 38, 37, 36, 35, 34, 33, 32, 31,30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20 смежных аминокислот С-концевой части белка L3 или состоит из них. Более предпочтительно он содержит последние 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26,-3 022221 25, 24, 23, 22, 21, 20 смежных аминокислот SEQ ID NO:1, или 48, или 50 или состоит из них. Более предпочтительно он содержит аминокислоты 394-419 из SEQ ID NO:1 или состоит из них. В качестве другого предпочтительного варианта осуществления предпочтительный фрагмент белка L5 или предпочтительный пептид, происходящий из L5, содержит первые 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26,25, 24, 23, 22, 21, 20 смежных аминокислот N-концевой части белка L5 или состоит из них. Более предпочтительно он содержит первые 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21,20 смежных аминокислот SEQ ID NO:3, или 52, или 54, или 56 или состоит из них. Более предпочтительно он содержит аминокислоты 1-23 из SEQ ID NO:3 или состоит из них. В качестве другого предпочтительного варианта осуществления предпочтительный фрагмент белка L5 или предпочтительный пептид,происходящий из L5, содержит последние 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23,22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 смежных аминокислот С-концевой части белка L5 или состоит из них. Более предпочтительно он содержит последние 40, 39, 38, 37, 36, 35, 34, 33, 32, 31,30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 смежных аминокислотSEQ ID NO:3, или 52, или 54, или 56 или состоит из них. Более предпочтительно он содержит аминокислоты 322-328 из SEQ ID NO:3 или состоит из них. В другом предпочтительном варианте осуществления источник L3 и L5 содержит белок, содержащий по меньшей мере один фрагмент белка L3 и по меньшей мере один фрагмент белка L5. Более предпочтительно фрагмент белка L3 и фрагмент белка L5 слиты вместе для образования химерного белка. Таким образом, изобретение также включает нуклеиновую кислоту или нуклеиновую кислоту, кодирующую такой источник L3 и L5. В предпочтительном варианте осуществления источник L3 и/или L5 содержит по меньшей мере один белок L3 и/или L5 и/или по меньшей мере один фрагмент белка L3 и/или L5. В более предпочтительном варианте осуществления источник L3 и/или L5 содержит по меньшей мере два белка L3 и/илиL5 и/или по меньшей мере два фрагмента белка L3 и/или L5. Этот вариант осуществления относится к источнику на основе белка, предпочтительно вакцине на основе белка. Необходимо отметить, что в предпочтительном варианте осуществления источник L3 и/или L5, как указано в настоящем описании, не следует понимать как включающий экстракт рибосомального белка(RPE), как указано в WO 2009/090175. RPE можно получать осуществлением следующих стадий с использованием клеток паразита, вызывающего паразитарное заболевание при его наличии у индивидуума:a) смешивание клеток паразита с лизирующим буфером,b) центрифугирование полученной смеси для получения цитозольного экстракта,c) получение RPE из полученного цитозольного экстракта. Таким образом, в предпочтительном варианте осуществления источник L3 и/или L5 не является RPE, как указано выше. В другом предпочтительном варианте осуществления источник L3 и/или L5 содержит по меньшей мере одну нуклеиновую кислоту, кодирующую L3 и/или L5 и/или по меньшей мере одну нуклеиновую кислоту, кодирующую фрагмент белка L3 и/или L5. В более предпочтительном варианте осуществления источник L3 и/или L5 содержит по меньшей мере две нуклеиновые кислоты, кодирующие белок L3 и/илиL5, и/или по меньшей мере две нуклеиновые кислоты, кодирующие фрагменты белка L3 и/или L5. Этот вариант осуществления относится к источнику на основе нуклеиновой кислоты, предпочтительно вакцине на основе нуклеиновой кислоты. Источник L3 и/или L5 может являться белком, продуктом расщепления белка и/или его фрагмента,который может находится в очищенной форме или который может содержаться в неочищенной композиции, предпочтительно биологического происхождения, такой как бактериальный лизат, дрожжевой лизат, грибной лизат, соникат или fixate. Альтернативно, источник L3 и/или L5 можно химически синтезировать или ферментативно получать in vitro. Источник белка L3 и/или L5, или его фрагмент, также может являться нуклеиновой кислотой, кодирующей указанный белок или его фрагмент, на матрице РНК или ДНК. Молекулы РНК или ДНК могут являться депротеинизированной ДНК, предпочтительно содержащейся в везикулах или липосомах, или их может содержать вектор. Вектор может являться любым(рекомбинантным) ДНК- или РНК-вектором, известным в данной области, и предпочтительно является плазмидой; где гены, кодирующие латентные антигены, функционально связаны с регуляторными последовательностями, обеспечивающими экспрессию и трансляцию кодируемых посредников. Вектор также может являться любым ДНК- или РНК-вирусом, в качестве неограничивающих примеров, таким как аденовирус, аденоассоциированный вирус (AAV), ретровирус, лентивирус, модифицированный вирус вакцины против натуральной оспы Анкара (MVA) или вирус оспы птиц, или любой другой вирусный вектор, способный обеспечивать экспрессию полипептидов в выбранном индивидууме. ДНК-векторы могут являться неинтегрируемыми, такими как эписомно реплицирующиеся векторы, или могут являться векторами, интегрируемыми в геном хозяина посредством случайного встраивания или гомологичной рекомбинации. Молекулы ДНК, содержащие гены, кодирующие белок L3 и/или L5, или их фрагменты по настоящему изобретению необязательно встраивают в вектор, такой как вирус или плазмида, который может встраиваться в геном индивидуума. В предпочтительном варианте осуществления изобретения таким хозяином может являться микроорганизм. Предпочтительно таким рекомбинантным микроорганизмом является Mycobacterium, например, видов М. tuberculosis, M. smegmatis (Yue. Y. et al. (2007), J. Virol.Meth., 141: 41-48, Cayabiyab Y. et al. (2006), J. Virol, 80: 1645-1652), или М. bovis и наиболее предпочтительно М. bovis бацилла Кальметта-Герена (BCG) или М. smegmatis, способные доставлять хозяину полипептиды или их фрагменты по изобретению. Рекомбинантная BCG и способы рекомбинации известны в данной области; например, в WO2004094469. Такой рекомбинантный микроорганизм можно составлять как живую рекомбинантную и/или живую аттенуированную вакцину, как, например, в Jacobs et al. 1987, Nature, 327 (6122):532-5). Вектор может содержать хозяин бактериального происхождения, в качестве неограничивающих примеров, такой как, живые аттенуированные и/или рекомбинантные бактерииShigella или Salmonella. В настоящем изобретении можно использовать любой известный адъювант. Специалисту в данной области известно несколько подходящих адъювантов. Наиболее предпочтительны адъюванты, выбранные из следующего списка адъювантов: катионные (противомикробные) пептиды, сапонин и лигандыToll-подобных рецепторов (TLR), в качестве неограничивающих примеров, такие как, поли(I:С), CpGмотивы, LPS, липид, липопептид Pam3Cys и бактериальные флагеллины, или их части, и их производные с химическими модификациями. Другими предпочтительными адъювантами для использования в способе и в композициях по изобретению являются: смеси с живой или убитой BCG, комплексы иммуноглобулинов с указанными латентными антигенами или их частями, IC31 (из www.intercell.com; в WO 03047602), QS21/MPL (US2003095974), DDA/MPL (WO 2005004911), DA/TDB (WO 2005004911; HoltenAndersen et al., 2004 Infect Immun. 2004 Mar; 72(3): 1608-17) и растворимый LAG3 (CD223) (изwww.Immunotep.com; US2002192195) Кроме того, другой предпочтительный адъювант включает использование Corynebacterium paryum или Propionobacterium acnes (64, 65, 66). Особенно предпочтительными адъювантами являются действующие через Toll-подобные рецепторы. Адъюванты, способные активировать врожденную иммунную систему, могут особенно хорошо активировать через Toll-подобные рецепторы (TLR), включая TLR 1-10 и/или через белок RIG-1 (ген, индуцируемый ретиноевой кислотой-1) и/или через рецептор эндотелина. Соединения, способные активировать рецепторы TLR, и их модификации и производные хорошо известны в данной области. TLR1 могут активировать бактериальные липопротеины и их ацетилированные формы, кроме того, TLR2 могут активировать гликолипиды грамположительных бактерий, LPS, LPA, LTA, фимбрии, внешние мембранные белки, белки теплового шока бактерий или хозяина и липоарабиноманнаны микобактерий. TLR3 могут активировать дцРНК, в частности, вирусного происхождения или химическое соединение поли(LC). TLR4 могут активировать LPS грамотрицательных бактерий, LTA, белки теплового шока хозяина или бактериального происхождения, белки вирусной оболочки, таксол или его производные, содержащие гиалуроновую кислоту олигосахариды и фибронектины. TLR5 могут активировать бактериальные жгутики или флагеллин. TLR6 могут активировать липопротеины микобактерий и термолабильный растворимый фактор (GBS-F) Streptococcus группы В или модулины Staphylococcus. TLR7 могут активировать имидазохинолины и производные. TLR9 могут активировать неметилированная CpG-ДНК или комплексы хроматин-IgG. В частности, TLR3, TLR4, TLR7 и TLR9 играют важную роль в опосредовании врожденного иммунного ответа на вирусные инфекции, и соединения, способные активировать данные рецепторы, особенно предпочтительны для использования в изобретении. Особенно предпочтительные адъюванты включают в качестве неограничивающих примеров синтетически получаемые соединения,содержащие дцРНК, поли(LC), неметилированную CpG-ДНК, запускающие рецепторы TLR3 и TLR9,IC31, агонист TLR9, IMSAVAC, агонист TLR4. В другом предпочтительном варианте осуществления адъюванты физически связывают с источником L3 и/или L5, как указано в настоящем описании выше. Физическая связь адъювантов и костимуляторных соединений или функциональных групп с пептидами,содержащими эпитопы HLA класса I и HLA класса II, обеспечивает усиленный иммунный ответ посредством одновременной стимуляции антигенпредставляющих клеток, в частности дендритных клеток, интернализирующих, метаболизирующих и представляющих антиген. Другим предпочтительным иммуномодифицирующим соединением является ингибитор Т-клеточной адгезии, более предпочтительно ингибитор рецептора эндотелина, такой как BQ-788 (67). BQ-788 является N-цис-2,6 диметилпиперидинокарбонил-L-гамма-метиллейцил-D-1-метоксикарбонилтриптофанил-D-норлейцином. Однако любые производные BQ-788 или модифицированное соединение BQ-788 также включены в объем настоящего изобретения. Другие адъюванты включают MPL-SE (Glaxo Smithkline Biologicals, Belgium) или ЕМ 005 (IDRIAmerica). В предпочтительном варианте осуществления адъювант является Th1-стимулирующим адъювантом(например, адъювантом, содержащим мотив CpG ODN). Th1-стимулирующий адъювант описывают в литературе (68) как адъювант, способный стимулировать или запускать Th1-иммунный ответ против указанного антигена при применении совместно с данным антигеном (здесь источник L3 и/или L5), как определяли в супернатантах спленоцитов подвергнутого лечению индивидуума при культивировании с антигеном. В качестве контроля оценивают стимуляцию или запуск Th1-иммунного ответа в популяции спленоцитов того же индивидуума, не подвергнутого лечению антигеном и адъювантом, или с той же популяцией, обработанной только антигеном. Запуск или стимуляцию Th1-иммунного ответа предпочтительно определяют по индукции IFN, определяемой культивированием спленоцитов подвергнутого ле-5 022221IgG2a. Оценку индукции данного цитокина предпочтительно осуществляют посредством ELISA на спленоцитах, как описано в примере. Оценку индукции IgG2a предпочтительно осуществляют посредствомELISA или Вестерн-блоттинга, как описано в примере 1. Индукция IFN и/или IgG2a после стимуляции спленоцитов источником L3 и/или L5 и адъювантом предпочтительно означает, что адъювант относится к Th1-стимулирующим адъювантам. Альтернативно или в сочетании с первым определением запуска или стимуляции указанного вышеTh1-иммунного ответа, запуск или стимуляцию Th1-иммунного ответа можно дополнительно определять по отсутствию (или отсутствию индукции) Th2-иммунного ответа. Th2-иммунный ответ характеризуют по определяемому повышению индукции IL-4, IL-10 и/или продукции определяемых иммуноглобулиновIgG1 при сравнении с необработанными спленоцитами. Оценку индукции IL-4 и/или IL-10 предпочтительно осуществляют посредством ELISA на спленоцитах, как описано в примере. Оценку индукцииIgGl предпочтительно осуществляют посредством ELISA или Вестерн-блоттинга, как описано в примере 1. Альтернативно или в сочетании с двумя первыми определениями запуска или стимуляции указанного выше Th1-иммунного ответа, запуск или стимуляцию Th1-иммунного ответа можно дополнительно определять по возникновению повышения соотношения IFN/IL-10 и/или соотношения IFN/IL-4 и/или повышения соотношения IgG1/IgG2a против определенного антигена, в данном случае, источника L3 и/или L5. В предпочтительном варианте осуществления изменение (повышение или снижение, как указано выше) любого из этих соотношений более чем на 2 свидетельствует о том, что адъювант обладает свойствами Th1. Оценку индукции каждого из указанных цитокинов предпочтительно осуществляют посредством ELISA на спленоцитах, как описано в примере. Оценку индукции иммуноглобулина IgG1 илиIgG2a предпочтительно осуществляют посредством ELISA или Вестерн-блоттинга, как описано в примере 1. В предпочтительном варианте осуществления Th1-стимулирующий адъювант является, или включает, или состоит из олигодезоксинуклеотида. Более предпочтительно олигодезоксинуклеотид (ODN) содержит CpG, в котором С неметилирован (CpG ODN): 3'пурин-CpG-5'пиримидин, или состоит из него. Предпочтительный олигодезоксинуклеотид является фосфотиоат-модифицированной последовательностью ODN, или содержит ее, или состоит из нее. Использование олигодезоксинуклеотидов, обладающих такой модификацией, представляет преимущество, так как используемые олигодезоксинуклеотиды, таким образом, являются более стабильными, чем немодифицированные олигонуклеотиды и, таким образом, не будут быстро деградировать при попадании в кровоток. Предпочтительный Th1-стимулирующий адъювант состоит по меньшей мере из одного мотива CpG, по меньшей мере двух или по меньшей мере трех или содержит их. Предпочтительными последовательностями иммуностимуляторной ODN (от 5' к 3') являлись TCAACGTTGA (SEQ ID NO:5) и GCTAGCGTTAGCGT (SEQ ID NO:6). Специалист в данной области не ограничен последовательностями, подробно описываемыми в настоящем описании. Он/она может конструировать другие последовательности и затем тестировать их на Th1 стимулирующие свойства, как указано выше в настоящем описании. Этот предпочтительный определенный адъювант CpG ODN является весьма привлекательным, поскольку, как было продемонстрировано в примере, костимуляция LRPE этим Th1-стимулирующим адъювантом индуцирует иммунитет против заражения паразитами L. major у мышей линий и BALB/c, и C57BL/6. На обеих моделях иммунитет коррелирует со специфической продукцией IFN. У BALB/c также определяли ограничение продукции IL-4 и IL-10. Изобретение относится к применению источника L3 и/или L5, подходящего для 1) предотвращающей (профилактической), 2) постконтактной/постинфекционной или 3) терапевтической/лечебной вакцины. Одним из преимуществ настоящего изобретения является то, что он позволяет получать медицинский препарат для лечения широкого спектра паразитарных заболеваний, т.е. медицинского препарата с перекрестно-видовой специфичностью. При многих паразитарных заболеваниях вакцина, направленная против конкретных видов, работает только против конкретных видов. Одним из примеров паразитарного заболевания, при котором это имеет место, является лейшманиоз. В настоящее время заболевание контролируют лекарственными средствами, но медикаментозное лечение не предотвращает распространение заболевания и, во многих случаях, не очень эффективно. В предпочтительном варианте осуществления паразитарное заболевание является лейшманиозом или малярией. Более предпочтительно паразитарное заболевание вызывают виды Leishmania или Plasmodium. В дополнительном предпочтительном варианте осуществления паразитарное заболевание вызывают виды, иные, чем виды, из которых получают источник L3 и/или L5. В частности, лейшманиоз, вызываемый одними видами рода Leishmania, можно лечить с применением композиции на основе источника L3 и/или L5 из других видов Leishmania, поскольку, как показано в экспериментальной части (см. пример 2), гомологи L3 и L5 из нескольких видовLeishmania высококонсервативны (по меньшей мере на 90% идентичны, см. табл. 1). Кроме того, авторы изобретения уже продемонстрировали в экспериментальной части (см. примеры 1 и 3), что белки L3 и L5Leishmania major способны защищать от инфекции Leishmania major или Leishmania braziliensis. В одном из вариантов осуществления лейшманиоз, вызываемый L. major, успешно лечили композицией, содержащей источник L3 и/или L5 из L. infantum, L. chagasi, L. amazonensis или L. braziliensis. В другом варианте осуществления лейшманиоз, вызываемый L. chagasi или L. amazonensis, успешно лечили композицией, содержащей источник L3 и/или L5 из L. infantum. В другом варианте осуществления лейшманиоз,вызываемый L. major или L. braziliensis, успешно лечили композицией, содержащей источник L3 и/илиL5 из L. major. Альтернативно, другие паразитарные заболевания, такие как малярия, можно успешно лечить композицией на основе источника L3 и/или L5 других видов, например на основе источника L3 и/или L5 из L. Infantum, или L. major, или L. mexicana, или L. braziliensis. В контексте изобретения индивидуум означает человека или животное. Животное, включенное в объем изобретения, включает млекопитающее, предпочтительно собаку. В предпочтительном варианте осуществления лекарственное средство (или медицинский препарат,или фармацевтическая композиция, или лекарственное средство), как указано в настоящем описании,применяют для повышения способности иммунной системы человека или животного бороться с инфекцией и/или заболеванием, более предпочтительно паразитарной инфекцией и/или паразитарным заболеванием. В частности, его можно использовать для введения человеку или животному. Как указано в настоящем описании, лекарственное средство предпочтительно вводят парентерально, например, инъекцией или вливанием внутривенным, подкожным, интраперитонеальным, внутримышечным, интраартериальным путем или в пораженные ткани. Предпочтительным способом введения является подкожный. Изобретение не ограничено конкретным способом введения источника L3 и/или L5. Предпочтительным способом введения является пероральное введение с применением капсулы или таблетки. Альтернативно, источник L3 и/или L5 можно вводить местно через катетер, или насос, или суппозиторий. Альтернативно, источник L3 и/или L5 можно вводить местно. Состав источника L3 и/или L5 или композиции, содержащей источник L3 и/или L5, зависит от предполагаемого способа введения и (терапевтического) применения. Фармацевтический носитель может являться любым совместимым нетоксичным веществом, подходящим для доставки источника L3 и/или L5 индивидууму. Например, стерильную воду, или инертные твердые вещества, или эксципиенты можно использовать в качестве носителя, как правило, дополненного фармацевтически приемлемыми адъювантами, буферными средствами, диспергирующими средствами и т.п. Композиции могут находиться в жидкой форме, например стабилизированной суспензии источника L3 и/или L5, или композиции, содержащей источник L3 и/или L5, или в твердой и/или сухой формах, например порошке. Для перорального и ректального введения источник L3 и/или L5 можно вводить в твердых лекарственных формах, таких как капсулы, таблетки, суппозитории и порошки, или в жидких лекарственных формах, таких как эликсиры, сиропы, крем, мазь и суспензии. Другая форма может являться полутвердой или полужидкой формой, где L3 и/или L5 присутствует в жидкой форме в твердом носителе, таком как пластырь, или на нем. Лекарственное средство можно комбинировать обычными способами, известными в данной области, с фармацевтически приемлемой средой или средством доставки. Например, источник L3 и/или L5 и необязательно адъювант можно растворять в фосфатно-солевом буфере (PBS). Способы получения парентерально вводимых композиций хорошо известны в данной области и подробно описаны в различных источниках, включая, например, Remington's Pharmaceutical Sciences, Ed. AR Gennaro, 20th edition, 2000,WilliamsWilkins, PA, USA. Лекарственное средство предпочтительно вводят в терапевтически эффективной дозе, т.е. в повышающей способность иммунной системы человека или животного бороться с инфекцией и/или заболеванием, как указано в настоящем описании. Предпочтительно терапевтически эффективная доза медицинского препарата по изобретению способна вызывать иммунный ответ, как указано в настоящем описании: доза является терапевтически эффективной, если она способна вызывать иммунный ответ у подвергаемого лечению индивидуума, что предпочтительно означает, что она способна стимулировать или запускать Th1-иммунный ответ на указанный антиген L3 и/или L5, и/или что она способна предотвращать и/или замедлять развитие повреждения кожи или слизистой оболочки, и/или индуцировать значимое снижение паразитарной нагрузки в повреждении кожи или слизистой оболочки,и/или в ухе, и/или в дренирующем лимфоузле (DLN), предпочтительно дренирующем любую из данных инфицированных областей (область кожи, слизистой оболочки, ухо), а также во внутреннем органе, таком как печень, селезенка, костный мозг, почка, головной мозг и т.д. Оценку наличия повреждения кожи описывают в примере 1 (см. фиг. 4: отек подушечки стопы). Оценку паразитарной нагрузки описывают в примере (см. фиг. 4). Терапевтически эффективная доза лекарственного средства по изобретению предпочтительно будет предотвращать развитие повреждения кожи и/или предпочтительно будет индуцировать снижение паразитарной нагрузки в ухе приблизительно на 3 порядка величины и/или приблизительно схожей величины в DLN после периода времени, включающего первую вакцинацию с применением композиции по изобретению с последующим инфицированием паразитом и временем ожидания приблизительно 6 недель. В предпочтительном варианте осуществления, как указано в настоящем описании,лекарственное средство является вакциной. В более предпочтительном варианте осуществления в вакцине используют по меньшей мере 12 мкг источника L3 и/или L5. Количество используемого источника L3 и/или L5 относится к общему количеству используемого L3 и L5. В более предпочтительном варианте осуществления для обеспечения иммунного ответа необходимо использовать по меньшей мере 12-20 мкг источника L3 и/или L5, необязательно в комбинации по меньшей мере с 50 мкг адъюванта, предпочтительно Th1-стимулирующего адъюванта, такого как, например, CpG ODN. Как указано в настоящем описании, вакцина может являться профилактической или терапевтической вакциной. Объем, в котором можно растворять источник L3 и/или L5 и необязательно адъювант, предпочтительно Th1 стимулирующий адъювант, может варьировать от 100-500 мкл. Композиция. В дополнительном аспекте изобретение относится к композиции, содержащей источник L3 и/илиL5 и необязательно адъювант, предпочтительно Th1-стимулирующий адъювант. Источник L3 и/или L5 и адъювант уже определяли в настоящем описании. В предпочтительном варианте осуществления композиция состоит из источника L3 и/или L5 и Th1-стимулирующего адъюванта. Предпочтительным Th1 стимулирующим адъювантом является CpG ODN. Предпочтительная композиция содержит источник L3 и/или L5 или состоит из него, и необязательно адъювант, предпочтительно Th1-стимулирующий адъювант, растворенный в PBS. В дополнительном предпочтительном варианте осуществления настоящее изобретение также включают то, что источник L3 и/или L5 и адъювант, предпочтительно Th1 стимулирующий адъювант, вводят последовательно. Таким образом, оба компонента могут физически не присутствовать в одной композиции при условии, что их обоих вводят индивидууму. Такая композиция может дополнительно содержать фармацевтически приемлемый адъювант и/или носитель. Такая композиция является предпочтительной для применения в качестве лекарственного средства. Лекарственное средство предпочтительно является вакциной. Лекарственное средство, адъювант и вакцина уже подробно определены в настоящем описании. Композиция может находиться в жидкой, твердой, или полужидкой, или полутвердой форме, как уже определено в настоящем описании. В предпочтительном варианте осуществления другие соединения используют последовательно или одновременно с источником L3 и/или L5 для улучшения специфичности терапевтического или профилактического лечения. Предпочтительно, например, использовать другие соединения, дополнительно усиливающие иммунный ответ подвергнутого лечению индивидуума. Более предпочтительно такие соединения не присутствуют совместно в одной композиции с источником L3 и/или L5. Например, указанные соединения выбраны из группы, состоящей из источника других белков паразита, вызывающего паразитарное заболевание (19), такое как лейшманиоз. Источник указанного белка указывают в том же значении, что и источник белка L3 и/или L5, как указано в настоящем описании выше. В этом контексте предпочтительным белком является гистон, такой как Н 2 А, Н 2 В, Н 3, Н 4, другой рибосомальный белок, такой как Li2ANO:9. Предпочтительная нуклеиновая кислота, кодирующая Н 2 В, представлена в SEQ ID NO:10. Предпочтительный белок Н 3 представлен в SEQ ID NO:11. Предпочтительная нуклеиновая кислота, кодирующая Н 3, представлена в SEQ ID NO:12. Предпочтительный белок Н 4 представлен в SEQ ID NO:13. Предпочтительная нуклеиновая кислота, кодирующая Н 4, представлена в SEQ ID NO:14. Предпочтительный белок Li2 А, также называемый LiP2a, представлен в SEQ ID NO:15 или 16. Предпочтительная нуклеиновая кислота, кодирующая Li2 А, представлена в SEQ ID NO:17. SEQ ID NO:17 является такой последовательностью. Специалист в данной области может получать предпочтительные кодирующие последовательности из данной такой последовательности. Такие предпочтительные кодирующие последовательности соответствуют нуклеиновой кислоте, кодирующей мРНК, кодирующей белок Li2A, представленный в SEQ ID NO:15 или 16: одна от нуклеотида 791 до 1111 и другая от 1662 до 1982 из SEQ IDSEQ ID NO:8, 10, 12, 14, 19 и 21 являются геномными последовательностями. Специалист в данной области может получать другие предпочтительные кодирующие последовательности из данных геномных последовательностей. Такие другие предпочтительные кодирующие последовательности соответствуют нуклеиновой кислоте, кодирующей мРНК, кодирующей соответствующий белок: данные последовательности нуклеиновой кислоты представлены в SEQ ID NO:68, 69, 70, 71, 72 и 73 соответственно. Предпочтительный белок L2 представлен в SEQ ID NO:22. Предпочтительная нуклеиновая кислота,кодирующая L2, представлена в SEQ ID NO:23. Предпочтительный белок L7 представлен в SEQ IDS6 представлен в SEQ ID NO:34. Предпочтительная нуклеиновая кислота, кодирующая S6, представлена в SEQ ID NO:35. Другим примером является применение некоторых содержащих полибелки антигенов паразита (63, 65). Примером полибелка является белок Q, как указано в ЕР 1141305. Молекула нуклеиновой кислоты, кодирующая белок Q, представлена в SEQ ID NO:36. Соответствующий кодируемый белокQ представлен в SEQ ID NO:37. Белок Q, или его часть, или фрагмент, или источник белка Q, или источник фрагмента белка Q можно использовать в комбинации с источником L3 и/или L5. Другим примером полибелка является Leish-110f (69). Leish-110f, или его часть, или его фрагмент, или источник Leish-110f,или источник фрагмента Leish-110f можно использовать в комбинации с источником L3 и/или L5. В следующем ниже параграфе источник гистонового белка взят как пример белка, который можно использовать в комбинации с источником белка L3 и/или L5. То же самое справедливо и для других определенных выше белков, предпочтительно рибосомальных белков, иных, чем L3 и/или L5. Предпочтительные соединения включают гистоновый белок, или его фрагмент, или молекулу нуклеиновой кислоты, кодирующую указанный гистон или фрагмент указанного гистона. Более предпочтительно гистоновым белком является Н 2 А, Н 2B, Н 3 и/или Н 4, как указано в ЕР 1687023. Гистоны Н 2 А, Н 2 В, Н 3 и Н 4 являются достаточно консервативными ядерными белками и их последовательности хорошо известны в данной области, см. ссылку 39. Предпочтительно гистоны получают из организма, близкого в эволюционном древе к организму, вызывающему заболевание. Таким образом, особый интерес в качестве источника гистонов для применения в лечении паразитарных заболеваний, таких как лейшманиоз, представляют простейшие и, в частности, члены семейства Трипаносоматид, в частности, различные виды трипаносомных простейших Leishmania. Другие предпочтительные соединения включают другой рибосомальный белок, или его фрагмент,или молекулу нуклеиновой кислоты, кодирующую указанный белок или его фрагмент. Примеры другого рибосомального белка включают L19 и S4. Другие предпочтительные соединения включают экстракт рибосомального белка, как указано в WO 2009/090175. Каждое из соединений или источники каждого из данных соединений можно использовать в комбинации с источником L3 и/или источником L5. Комбинированное применение может являться последовательным или одновременным. В предпочтительном варианте осуществления источник L3 и/или L5 используют в комбинации с источником S4 и/или S6. Более предпочтительно источники L3, L5, S4 и S6 используют в комбинации. В другом более предпочтительном варианте осуществления источники L3, L5 и S4 используют в комбинации. В другом более предпочтительном варианте осуществления источники L3, L5 и S6 применяют в сочетании. Авторы изобретения продемонстрировали (см. пример 5), что комбинированное применениеL3, L5 и S4 обеспечивало синергичный иммунитет по сравнению с применением только L3 или L5, илиS4. В этом контексте предпочтительный белок S4 представлен в SEQ ID NO:32. Предпочтительная нуклеиновая кислота, кодирующая S4, представлена в SEQ ID NO:33. Предпочтительный белок S6 представлен в SEQ ID NO:34. Предпочтительная нуклеиновая кислота, кодирующая S6, представлена в SEQID NO:35. При использовании в выражении "источник S4 и/или S6" термин "источник" обладает тем же значением, что и термин "источник" при использовании в выражении "источник L3 и/или L5". Таким образом, в предпочтительном варианте осуществления источником S4 является полипептид,содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:32 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:33. Таким образом, в предпочтительном варианте осуществления источником S6 является полипептид,содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35. Таким образом, в предпочтительном варианте осуществления источником S4 является нуклеиновая кислота, содержащая нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:33, и/или кодирующую аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с SEQ IDNO:32. В зависимости от типа используемого источника (на основе белка или на основе нуклеиновой кислоты) специалист в данной области будет знать, какой тип состава является подходящим. Источник можно вводить как таковой (очищенный белок или нуклеиновая кислота). Альтернативно, источник на основе нуклеиновой кислоты можно вводить с применением конструкции нуклеиновой кислоты, как указано в настоящем описании. Источник S6. В дополнительном аспекте предоставляют источник S6 или композицию, содержащую источник S6 или состоящую из него, но не содержащую источник L3, и/или L5, и/или S4. Авторы изобретения продемонстрировали (см. пример 4), что только S6 обеспечивал иммунитет к инфекции Leishmania. При использовании в выражении "источник S6" термин "источник" имеет то же значение, что и термин "источник" при использовании в выражении "источник L3 и/или L5". Каждое из применений, или способов, или типов композиций, определяемых в настоящем описании, содержащих источник L3 и/или L5, также используют для источника S6. Таким образом, в предпочтительном варианте осуществления источником S6 является полипептид,содержащий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:34 и/или кодируемую нуклеотидной последовательностью, имеющей по меньшей мере 60% идентичность с SEQ ID NO:35. Таким образом, в предпочтительном варианте осуществления источником S6 является нуклеиновая кислота, содержащая последовательность нуклеиновой кислоты, имеющую по меньшей мере 60% идентичность или сходство последовательности с нуклеотидной последовательностью SEQ ID NO:35, и/или кодирующая аминокислотную последовательность, имеющую по меньшей мере 60% идентичность сSEQ ID NO:34. Способ. В другом аспекте изобретение относится к способу профилактики, и/или лечения паразитарного заболевания, и/или замедления его прогрессирования, и/или способному вызывать иммунный ответ, как указано в настоящем описании: способ является терапевтически эффективным, если он способен вызывать иммунный ответ у подвергаемого лечению индивидуума, что предпочтительно означает, что он способен стимулировать или запускать Th1-иммунный ответ на указанный антиген L3 и/или L5 и/или на указанный источник L3 и/или L5, и/или что он способен предотвращать и/или замедлять развитие повреждения кожи или слизистой оболочки и/или индуцировать значимое снижение паразитарной нагрузки в повреждении кожи и/или слизистой оболочки, и/или в ухе, и/или в дренирующем лимфоузле (DLN),предпочтительно дренирующем любую из данных инфицированных областей (область кожи, слизистой оболочки, ухо), а также во внутреннем органе, таком как печень, селезенка, костный мозг, почка, головной мозг и т.д. в настоящем описании. В данном способе вакцина по изобретению функционирует как терапевтическая вакцина. Как правило, существует период времени между инфекцией и заболеванием. В данном случае вакцина будет действовать как фармакологический иммунологический препарат, который будет предотвращать и/или лечить заболевание, и/или замедлять его прогрессирование, вызывая у хозяина иммунный ответ, противодействующий патологическому эффекту инфекции. Терапевтическая вакцина отличается от профилактической вакцины тем, что терапевтическая вакцина будет индуцировать иммунитет у пациента, уже имеющего инфекцию или заболевание. Изобретение относится к терапевтической или профилактической вакцине. В этом способе необязательно можно применять источник S4 и/илиS6 в сочетании с источником L3 и/или L5. Применение. В дополнительном аспекте изобретение относится к дополнительному применению источника L3 и/или L5 для диагностики паразитарного заболевания у индивидуума. Паразитарное заболевание, источник L3 и/или L5 и индивидуум определены в настоящем описании выше. В этом применении необязательно источник S4 и/или S6 можно использовать в комбинации с источником L3 и/или L5. Одним из преимуществ настоящего изобретения является то, что оно позволяет достигать специфичной и ранней диагностики широкого спектра паразитарных заболеваний. Одним из примеров паразитарного заболевания, при котором это имеет место, является лейшманиоз. В предпочтительном варианте осуществления паразитарное заболевание является лейшманиозом или малярией. Более предпочтительно паразитарное заболевание вызывают виды Leishmania или Plasmodium. В дополнительном предпочтительном варианте осуществления паразитарное заболевание вызывают виды, иные, чем виды, из которых получают L3 и/или L5. В частности, лейшманиоз, вызванный одними видами рода Leishmania, можно диагностировать с использованием композиции на основе источника L3 и/или L5 из других видов Leishmania. В одном из вариантов осуществления лейшманиоз, вызываемый L. major успешно диагностируют композицией, содержащей источник L3 и/или L5 из L. major, L. infantum, L. brazilienzis или L. mexicana. Альтернативно, другие паразитарные заболевания, такие как малярия, можно успешно диагностировать композицией на основе источника L3 и/или L5 из других видов, например, на основе источника L3 и/илиL5 L. infantum, L. major, L. brazilienzis или L. mexicana. В принципе, с использованием изобретения можно ставить диагноз любому индивидууму. Способ диагностики можно использовать у индивидуума так часто, как необходимо. Предпочтительно индивидуумом, которому ставят диагноз, является индивидуум, у которого подозревают риск быть инфицированным указанным паразитом, вызывающим указанное паразитарное заболевание. Индивидуум, у которого подозревают риск быть инфицированным указанным паразитом, может проживать в эндемической области или посещать эндемическую область. Эндемические области включают Северную Африку от Алжира до Саудовской Аравии, Кению, Судан, Эфиопию. Они также включают Южную Европу: Средиземноморские страны - Испанию, Францию, Грецию и т.д. Они также включают Центральную (все страны) и Южную Америку: Бразилию, Венесуэлу, Перу, Боливию, Колумбию, север Аргентины, Парагвай,- 10022221 Уругвай, область от Центральной до Юго-Восточной Азии: Индию, Иран, Ирак, Монголию, Афганистан,Непал, Бангладеш. В контексте изобретения, как указано в настоящем описании, применение предпочтительно является применением in vitro или ex vivo. Предпочтительно это означает, что указанное применение осуществляют на образце от указанного индивидуума. Предпочтительные образцы включают кровь, сыворотку,плазму, слюну, цереброспинальную жидкость или мочу. Более предпочтительно образец является образцом крови или сыворотки, полученным от индивидуума. В предпочтительном варианте осуществления диагноз ставят до появления симптома указанного паразитарного заболевания, так называемая пресимптомная диагностика или диагностика у бессимптомного индивидуума. В этом контексте "пресимптомный" предпочтительно означает по меньшей мере 1 день, по меньшей мере 2 дня, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней,по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 15 дней, по меньшей мере 20 дней, по меньшей мере 25 дней, по меньшей мере 30 дней или более до появления первого симптома. Первый симптом или первый клинический признак, ассоциированный с паразитарным заболеванием, таким как лейшманиоз, можно выбирать из следующего списка: лихорадка, спленомегалия, гепатомегалия, лимфоаденопатия, конъюнктивит,дерматит, онихогрифоз, кератоконъюнктивит, апатия и кахексия. Большинство из них можно просто определять при внешнем физикальном осмотре. Каждый из конъюнктивита, дерматита, онихогрифоза, кератоконъюнктивита является формой кожных изменений. Предпочтительным первым симптомом, связанным с лейшманиозом, является лимфоаденопатия. Ее можно определять при внешнем физикальном осмотре, таком как пальпация. В другом предпочтительном варианте осуществления диагноз ставят до появления некоторых из симптомов указанного паразитарного заболевания, так называемая диагностика у олигосимптомного индивидуума. В данном контексте "олигосимптомный" предпочтительно означает индивидуума, имеющего максимум три из симптомов, определенных выше. В другом предпочтительном варианте осуществления диагноз ставят до появления всех симптомов указанного паразитарного заболевания, так называемая диагностика у индивидуума с симптомами. В данном контексте "с симптомами" предпочтительно означает индивидуума, имеющего по меньшей мере четыре из определенных выше симптомов, включая форму кожного изменения, как указано выше. Специалисту в данной области будет понятно, что наиболее важным типом диагностики является диагностика у бессимптомных индивидуумов, так как она будет помогать предотвращать дальнейшее распространение заболевания и бессимптомным индивидуумам можно помогать и лечить более эффективно, если им ставят диагноз на такой стадии. В этом применении источником L3, и/или L5, и/или S4, и/или S6 может являться белок L3, и/илиL5, и/или S4, и/или S6 или фрагмент белка, используемый для определения наличия антитела в образце,как описано в следующем разделе. Альтернативно, источником L3, и/или L5, и/или S4, и/или S6 может являться молекула нуклеиновой кислоты, применяемая для определения наличия нуклеиновой кислотыL3, и/или L5, и/или S4, и/или S6 в образце, как описано в следующем разделе. Способ. В дополнительном аспекте изобретение относится к способу диагностики паразитарного заболевания у индивидуума с использованием источника L3 и/или L5, включающему определение того, присутствует ли антитело, распознающее источник L3 и/или L5, в образце, полученном от индивидуума. Необязательно источник S4 и/или S6 также можно использовать в комбинации с источником L3 и/или L5. Предпочтительный способ по изобретению для предпочтительного использования по изобретению предпочтительно осуществляют in vitro или ex vivo. Определения указаны в настоящем описании выше. В предпочтительном способе источник L3 и/или L5 присутствует в композиции. В предпочтительном варианте осуществления другое соединение присутствует в указанной композиции. Альтернативно,другое соединение не присутствует в указанной композиции. В предпочтительном варианте осуществления другие соединения используют последовательно или одновременно с источником L3 и/или L5 для улучшения специфичности способа. Предпочтительно, например, использовать другие соединения, позволяющие выявлять различия между бессимптомным, олигосимптомным индивидуумом или индивидуумом с симптомами и вакцинированным индивидуумом. Более предпочтительно такие соединения не присутствуют в одной композиции совместно с источникомL3 и/или L5. Каждый из белков, определенных в разделе "Композиция", можно использовать в этом контексте. Например, указанные соединения выбирают из группы, состоящей из источников других белков паразита, вызывающего паразитарное заболевание (19), такое как лейшманиоз. Источник указанного белка указывают в том же значении, что и источник L3 и/или L5, как указано в настоящем описании выше. В данном контексте предпочтительным белком является гистон, такой как Н 2 А, Н 2 В, НЗ, Н 4, другой рибосомальный белок, такой как Li2A (LiP), LiP2b (LiP'), LiP0, L2, L7, L8, L16, S6, L19 и S4. Другим примером является использование некоторых содержащих полибелки антигенов паразита (59, 61). Примером полибелка является белок Q, как указано в ЕР 1141305. Белок Q, или его часть, или фрагмент, или источник белка Q, или источник фрагмента белка Q можно использовать в комбинации с источником L3 и/или L5. Предпочтительные антигены включают гистоновый белок, или его фрагмент, или молекулу нуклеиновой кислоты, кодирующую указанный гистон. Более предпочтительно гистоновый белок является Н 2 А, H2 В, Н 3 и/или Н 4, как указано в ЕР 1687023. Гистоны Н 2 А, Н 2 В, Н 3 и Н 4 являются достаточно консервативными ядерными белками, и их последовательности хорошо известны в данной области,см. ссылку 39. Предпочтительно гистоны получают из организма, близкого в эволюционном древе организму, вызывающему заболевание. Таким образом, особый интерес в качестве источника гистонов для применения в лечении паразитарных заболеваний, таких как лейшманиоз, представляют простейшие и, в частности, члены семейства Трипаносоматид, как, например, Plasmodium, такие как Plasmodium falciparum или более, в частности, различные виды трипаносомных простейших Leishmania. В более предпочтительном способе диагностики паразитарное заболевание диагностируют, когда присутствует определяемое количество антитела, распознающего источник L3 и/или L5, предпочтительно белок, или пептид, или часть белка, и/или когда присутствует повышение количества указанного антитела. В контроле или здоровом индивидууме указанное антитело, как правило, не определяемо. Определение наличия указанного антитела осуществляют с использованием способов, известных специалисту в данной области, таких как ELISA. Предпочтительные способы определения описаны в примере 1. Антитело, распознающее источник L3 и/или L5, предпочтительно белок, или пептид, или часть белка, предпочтительно означает, что присутствует по меньшей мере одно антитело, способное распознавать по меньшей мере одно соединение, присутствующее в источнике L3 и/или L5. Указанное соединение может являться белком L3 и/или L5, или фрагментом белка L3 и/или L5, или частью белка, или пептидом. Это справедливо и для антитела, распознающего источник S4 и/или S6. В другом способе молекулу нуклеиновой кислоты L3 и/или L5 определяют с применением другой молекулы нуклеиновой кислоты. Молекула нуклеиновой кислоты L3 и/или L5 предпочтительно является молекулой нуклеиновой кислоты, кодирующей молекулу L3 и/или L5, как указано в настоящем описании выше, или ее часть. Другая молекула нуклеиновой кислоты предпочтительно является праймером, сконструированным так, чтобы делать возможным определение наличие молекулы нуклеиновой кислоты L3 и/или L5 посредством реакции ПЦР или "нозерн"-блоттинга. Это справедливо и для праймера, позволяющего определять наличие молекулы нуклеиновой кислоты S4 и/или S6. Предпочтительные праймеры для определения наличия молекулы нуклеиновой кислоты L3 и/или L5 содержат следующие последовательности или состоят из них: Последовательности праймеров для специфического определения L3 посредством ПЦР: смысловая, 5'-AACACGAAGGAGGGCAAGGTC-3' (нуклеотиды с 418 по 438 из последовательности LmL3) (SEQ ID NO:38); антисмысловая, 5'-CTTCTTCGCGGCCTTTGCCTTG-3' (обратная и комплементарная нуклеотидам с 1242 по 1263 из последовательности LmL3) (SEQ ID NO:39). Последовательности праймеров для специфического определения L5 посредством ПЦР: смысловая, 5'-TGCACGCTGGCAAATTGGGTAC-3' (нуклеотиды с 10 по 31 из последовательностиLmL5) (SEQ ID NO:40); антисмысловая, 5'-CTTCTTCGTGCGCACAGCAG-3' (обратная и комплементарная нуклеотидам с 464 по 483 из последовательности LmL5) (SEQ ID NO:41). Последовательности праймеров для специфического определения L3 посредством "нозерн"блоттинга: 5'-CTTCTTCGCGGCCTTTGCCTTG-3' (обратная и комплементарная нуклеотидам с 1242 по 1263 из последовательности LmL3) (SEQ ID NO:42). Последовательности праймеров для специфического определения L5 посредством "нозерн"блоттинга: 5'-CTTCTTCGTGCGCACAGCAG-3' (обратная и комплементарная нуклеотидам с 464 по 483 из последовательности LmL5) (SEQ ID NO:43). Определение или повышение уровня экспрессии молекулы нуклеиновой кислоты L3 и/или L5 предпочтительно определяют как определяемое изменение уровня экспрессии указанной молекулы нуклеиновой кислоты по сравнению с уровнем экспрессии указанной молекулы нуклеиновой кислоты в контрольном индивидууме. Как правило, контрольный индивидуум не будет содержать такую молекулу нуклеиновой кислоты L3 и/или L5. Предпочтительно повышение уровня экспрессии молекулы нуклеиновой кислоты L3 и/или L5 означает повышение уровня экспрессии нуклеотидной последовательности по меньшей мере на 5%, определяемое с применением ПЦР. Анализ. В дополнительном аспекте изобретение относится к аналитическому устройству для диагностики паразитарного заболевания у индивидуума, где устройство содержит источник L3 и/или L5. Необязательно источник S4 и/или S6 также может присутствовать в этом аналитическом устройстве в комбинации с источником L3 и/или L5. Наличие антитела, специфически распознающего указанный источник,можно определять любыми стандартными способами, известными специалистам в данной области (см.,например, Harlow и Lane, Antibodies: Laboratory Manual, Cold Spring Harbor Laboratory, 1988, включен- 12022221 ный в настоящее описание путем ссылки). Подходящие способы включают аффинную хроматографию с электрофорезом (АСЕ) и ELISA (твердофазный иммуноферментный анализ). Предпочтительно анализ включает ELISA. Некоторые анализы более подробно описаны ниже. В предпочтительном варианте осуществления анализ включает использование источника L3 и/илиL5, иммобилизованного на твердой подложке для связывания с антителом и его удаления из образца. Затем указанное связанное антитело можно определять с использованием реагента для определения, связывающегося с комплексом антитело/источник L3 и/или L5 и содержащего определяемую репортерную группу. Подходящие реагенты для определения включают антитела, связывающиеся с комплексом антитело/источник L3 и/или L5, и свободный полипептид, меченый репортерной группой (например, в полуконкурентном анализе). Альтернативно, можно использовать конкурентный анализ, в котором антитело,связывающееся с источником L3 и/или L5, метят репортерной группой и позволяют связываться с иммобилизованным источником L3 и/или L5 после инкубации источника с образцом. Степень, до которой компоненты образца ингибируют связывание меченого антитела с указанным источником L3 и/или L5,свидетельствует о способности образца реагировать с иммобилизованным источником L3 и/или L5. Твердая подложка может состоять из любого материала, известного специалистам в данной области, к которому можно прикреплять источник L3 и/или L5. Например, подложка может являться тестовой лункой в планшете для микротитрования или нитроцеллюлозой или другой подходящей мембраной. Альтернативно, подложка может являться бусиной или диском, например, из стекла, стекловолокна, латекса или пластикового материала, такого как полистирол или поливинилхлорид. Подложкой также может являться магнитная частица или оптико-волоконный сенсор, такой как описываемый, например, в патенте США 5359681. Источник L3 и/или L5 можно связывать с твердой подложкой с применением различных способов,известных в данной области. В контексте настоящего изобретения термин "связанный" относится и к нековалентному соединению, такому как адсорбция, и ковалентному соединению (которое может являться прямой связью между антигеном и функциональными группами на подложке или может являться связью посредством сшивающего средства). Предпочтительным является связывание посредством адсорбции с лункой планшета для микротитрования или с мембраной. В таких случаях адсорбции можно достигать контактом источника L3 и/или L5 в подходящем буфере с твердой подложкой в течение подходящего периода времени. Время контакта варьируется в зависимости от температуры, но, как правило,составляет от 1 часа до 1 дня. В основном, контакт лунки пластикового планшета для микротитрования(такого как полистирол или поливинилхлорид) с количеством источника L3 и/или L5 в диапазоне от 10 до 1 г и предпочтительно 100 нг является достаточным для связывания подходящего количества источника L3 и/или L5. Кроме того, если указывают количество (quantity) или количество (amount) источникаL3 и/или L5, оно обозначает общее количество применяемого источника L3 и/или L5. Ковалентного соединения источника L3 и/или L5 с твердой подложкой, как правило, можно достигать сначала реакцией подложки с бифункциональным реагентом, который будет реагировать и с подложкой, и с функциональной группой, такой как гидроксил или аминогруппа, на полипептиде. Например, источник L3 и/или L5 можно связывать с подложкой, имеющей соответствующее полимерное покрытие, с применением бензохинона или посредством конденсации альдегидных групп на подложке с амином и активным водородом на полипептиде (см., например, Pierce Immunotechnology Catalog andHandbook (1991), A12-A13). В некоторых вариантах осуществления анализ является твердофазным иммуноферментным анализом (ELISA). Этот анализ можно осуществлять, сначала приводя в контакт источник L3 и/или L5, иммобилизованный на твердой подложке, как правило, лунке планшета для микротитрования, с образцом,таким образом, что антителам, специфичным к указанному источнику L3 и/или L5, в образце позволяют связываться с иммобилизованным источником L3 и/или L5. Затем несвязавшийся образец удаляют с иммобилизованного источника и добавляют реагент для определения, способный связываться с иммобилизованным комплексом антитело-источник L3 и/или L5. Затем определяют количество реагента для определения, остающегося связанным с твердой подложкой, с применением способа, соответствующего конкретному реагенту для определения. Как только источник L3 и/или L5 иммобилизировали на подложке, оставшиеся участки связывания белка на подложке, как правило, блокируют. Можно использовать любое подходящее блокирующее средство, известное специалистам в данной области, такое как бычий сывороточный альбумин (BSA) илиTween 20 (Sigma Chemical Co., St. Louis, МО). Затем иммобилизованный источник L3 и/или L5 инкубируют с образцом, и антителу (если присутствует в образце) позволяют связываться с указанным источником. Образец можно разводить подходящим разбавителем, таким как фосфатно-солевой буфер (PBS), до инкубации. В основном, соответствующее время контакта (т.е. время инкубации) является таким периодом времени, достаточным для определения наличия антитела в образце. Предпочтительно времени контакта достаточно для достижения уровня связывания, составляющего по меньшей мере 95% от достигаемого при равновесии между связавшимся и несвязавшимся антителом. Специалистам в данной области понятно, что время, необходимое для достижения равновесия, легко можно определять, анализируя уровень связывания, имеющий место в течение периода времени. При комнатной температуре, как правило,- 13022221 достаточным является время инкубации приблизительно 30 мин. Затем несвязавшийся образец можно удалять промыванием твердой подложки соответствующим буфером, таким как PBS, содержащим 0,1% Tween 20. Затем на твердую подложку можно добавлять реагент для определения. Соответствующим реагентом для определения является любое соединение, связывающееся с иммобилизованным комплексом антитело-источник L3 и/или L5 и которое можно определять любым из множества способов, известных в данной области. Предпочтительно реагент для определения содержит связывающее средство (такое как, например, белок А, белок G, иммуноглобулин, лектин или свободный антиген), конъюгированное с репортерной группой. Предпочтительные репортерные группы включают ферменты (такие как пероксидаза хрена), субстраты, кофакторы, ингибиторы, красители, радионуклиды, люминесцентные группы, флуоресцентные группы и биотин. Конъюгацию связывающего средства с репортерной группой можно осуществлять с использованием стандартных способов,известных специалистам в данной области. Типичные связывающие средства также можно приобретать конъюгированными с множеством репортерных групп во многих источниках (например, Zymed Laboratories, San Francisco, CA и Pierce, Rockford, IL). Затем реагент для определения инкубируют с иммобилизованным комплексом антитело/источникL3 и/или L5 в течение периода времени, достаточного для определения связавшегося антитела. Соответствующий период времени, как правило, можно определять по инструкции производителя, или анализируя уровень связывания, имеющий место в течение периода времени. Затем удаляют несвязавшийся реагент для определения и определяют связавшийся реагент для определения с применением репортерной группы. Способ, используемый для определения репортерной группы, зависит от природы репортерной группы. Для радиоактивных групп, как правило, используют сцинтилляционные измерения или авторадиографические способы. Спектроскопические способы можно применять для определения красителей,люминесцентных групп и флуоресцентных групп. Биотин можно определять с применением авидина,соединенного с различными репортерными группами (как правило, радиоактивной или флуоресцентной группой или ферментом). Ферментные репортерные группы, как правило, можно определять добавлением субстрата (как правило, в течение конкретного периода времени) с последующим спектроскопическим или другим анализом продуктов реакции. Для определения наличия или отсутствия антитела, специфичного для паразитарного заболевания,такого как лейшманиоз, в образце, определяемый сигнал от репортерной группы, остающейся связавшейся с твердой подложкой, как правило, сравнивают с сигналом, соответствующим предварительно определенной пороговой величине. В одном из предпочтительных вариантов осуществления пороговая величина предпочтительно является средним сигналом, получаемым при инкубации иммобилизованного источника L3 и/или L5 с образцом от неинфицированного индивидуума. В основном, образец, генерирующий сигнал на три стандартных отклонения выше предварительно определенной пороговой величины считают положительным (т.е. реагирующим с источником L3 и/или L5). В альтернативном предпочтительном варианте осуществления пороговую величину определяют с применением ROC-кривой по способу Sackett et al., Clinical Epidemiology: Basic Science for Clinical Medicine, p. 106-7 (Little Brown иCo., 1985). В кратком изложении в этом варианте осуществления пороговую величину можно определять по графику пар долей истинно-положительных результатов (т.е. чувствительность) и ложноположительных результатов (100%-специфичность), соответствующих каждой возможной пороговой величине для результатов диагностического теста. Пороговая величина на графике, наиболее близкая к верхнему левому углу (т.е. величина, охватывающая наибольшую область), является наиболее точной пороговой величиной, и положительным можно считать образец, генерирующий сигнал выше, чем пороговая величина, определяемая данным способом. Альтернативно, пороговую величину можно смещать влево на графике для минимизации доли ложноположительных результатов или вправо для минимизации ложноположительных результатов. В связанном варианте осуществления анализ осуществляют в проточном формате и с помощью индикаторной полоски, где источник L3 и/или L5 иммобилизируют на мембране, такой как нитроцеллюлоза. В проточном тесте антитела в образце связываются с иммобилизованным источником L3 и/или L5,когда образец проходит через мембрану. Затем реагент для определения (например, белок А-коллоидное золото) связывается с комплексом антитело/источник L3 и/или L5, когда раствор, содержащий реагент для определения, проходит через мембрану. Затем можно осуществлять определение связавшегося реагента для определения, как описано выше. В формате с применением индикаторных полосок один конец мембраны, с которым связан источник, погружают в раствор, содержащий образец. Образец мигрирует в мембране через область, содержащую реагент для определения, и в область иммобилизованного полипептида. Концентрация реагента для определения у источника L3 и/или L5 свидетельствует о наличии антитела, специфичного для антигена паразита, вызывающего паразитарное заболевание, такое как лейшманиоз, в образце. Как правило, концентрация реагента для определения в том участке приводит к образованию узора, такого как линия, который можно оценивать визуально. Отсутствие такого узора указывает на отрицательный результат. В основном, количество источника L3 и/или L5, иммобилизованного на мембране, выбирают для получения визуально различимого узора, когда образец содержит уро- 14022221 вень антитела, достаточные для генерации положительного сигнала в ELISA, как указано выше. Предпочтительно количество L3 и/или L5, иммобилизованных на мембране, находится в диапазоне от 25 до 500 нг. Как правило, такие тесты можно осуществлять с очень небольшим количеством (например, одной каплей) сыворотки или крови индивидуума. Описание каждого элемента аналитического устройства, применяемое к источнику L3 и/или L5,также можно применять к источнику S4 и/или S6, если источник S4 и/или S6 применяют в сочетании с источником L3 и/или L5 в данном аналитическом устройстве. Любой индивидуум или врач может использовать это устройство в офисе/дома, повторяя использование такого устройства так часто, как необходимо. Как правило, дополнительные молекулы применяют в анализе в качестве положительного или отрицательного контроля. Типичным положительным контролем может являться антитело, распознающее молекулу, о которой известно, что она присутствует в образце для тестирования. Типичным отрицательным контролем может являться антитело, распознающее молекулу, о которой известно, что она отсутствует в образце для тестирования. Общие определения. В контексте изобретения белок или фрагмент белка представлен аминокислотной последовательностью. В контексте изобретения молекула нуклеиновой кислоты представлена нуклеиновой кислотой или нуклеотидной последовательностью, кодирующей белок, или полипептид, или фрагмент белка. Молекула нуклеиновой кислоты может содержать регуляторную область. Следует понимать, что каждая молекула нуклеиновой кислоты, или белка, или фрагмента белка, как указано в настоящем описании посредством указанного идентификационного номера последовательности (SEQ ID NO), не ограничена данной конкретной последовательностью, как указано. Каждая последовательность гена или нуклеотидная последовательность, как указано в настоящем описании, кодирует указанный белок, или полипептид, или фрагмент белка, или сама является белком или фрагментом белка. На всем протяжении настоящего изобретения каждый раз ссылаясь на конкретную нуклеотидную последовательность SEQ ID NO (например, SEQ ID NO:2 или 4), можно заменять ее:i) нуклеотидной последовательностью, содержащей нуклеотидную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с SEQ ID NO:2, или 4, или 49, или 51, или 53, или 55, или 65 (например);ii) нуклеотидными последовательностями, комплементарная цепь которых гибридизуется с молекулой нуклеиновой кислоты последовательности (i);iii) нуклеотидной последовательностью, последовательность которой отличается от последовательности молекулы нуклеиновой кислоты (iii) по причине вырожденности генетического кода;iv) нуклеотидной последовательностью, кодирующей аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство аминокислот с аминокислотной последовательностью, кодируемой нуклеотидной последовательностью SEQ ID NO:2, или 4, или 49, или 51, или 53, или 55, или 65. На всем протяжении настоящего изобретения каждый раз ссылаясь на конкретную аминокислотную последовательность SEQ ID NO (например, SEQ ID NO:1, или 3, или 48, или 50, или 52, или 54, или 56), можно заменять ее полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 60% идентичность или сходство последовательности с аминокислотной последовательностью SEQ ID NO:1, или 3, или 48, или 50, или 52, или 54, или 56. Каждая нуклеотидная последовательность или аминокислотная последовательность, описываемая в настоящем описании посредством процентной доли своей идентичности или сходства (по меньшей мере 60%) с указанной нуклеотидной последовательностью или аминокислотной последовательностью, соответственно, в дополнительном предпочтительном варианте осуществления имеет идентичность или сходство по меньшей мере 65, 70, 75, 80, 85, 90, 95, 97, 98, 99% или больше идентичности или сходства с указанной нуклеотидной или аминокислотной последовательностью соответственно. В предпочтительном варианте осуществления идентичность или сходство последовательности определяют сравнением полноразмерных последовательностей, как указано в настоящем описании. В настоящем описании "идентичность последовательности" определяют как отношение между двумя или более аминокислотными (полипептидными или белковыми) последовательностями или двумя или более последовательностями нуклеиновой кислоты (полинуклеотида), как определяют сравнением последовательностей. В предпочтительном варианте осуществления идентичность последовательности вычисляют на основе полного размера двух указанных SEQ ID NO или их частей. Их часть предпочтительно означает по меньшей мере 50, 60, 70, 80, 90 или 100% обеих SEQ ID NO. В данной области "идентичность" также означает степень родства последовательности между аминокислотными последовательностями или последовательностями нуклеиновой кислоты, соответственно, как определяют по совпадению между цепями таких последовательностей."Сходство" между двумя аминокислотными последовательностями определяют сравнением аминокислотной последовательности и ее консервативных аминокислотных заместителей одного полипептида с последовательностью второго полипептида. "Идентичность" и "сходство" легко можно вычислять известными способами, включая, в качестве неограничивающих примеров, описываемые в Computational(1988). Предпочтительные способы определения идентичности являются такими, чтобы получать наибольшее совпадение между тестируемыми последовательностями. Способы определения идентичности и сходства кодифицируют в общедоступных компьютерных программах. Предпочтительные способы определения идентичности и сходства между двумя последовательностями с применением компьютерных программ включают, например, пакет программ GCG (Devereux, J., et al., Nucleic Acids Research 12 (1): 387 (1984, BestFit, BLASTP, BLASTN, и FASTA (Altschul, S. F. et al., J. Mol. Biol. 215:403-410 (1990). Программа BLAST X является общедоступной в NCBI и других источниках (BLAST Manual, Altschul, S.,et al., NCBI NLM NIH Bethesda, MD 20894; Altschul, S., et al., J. Mol. Biol. 215:403-410 (1990). Для определения идентичности также можно применять хорошо известный алгоритм Смита-Уотермана. Предпочтительные параметры сравнения полипептидных последовательностей включают следующие: алгоритм: Needleman и Wunsch, J. Mol. Biol. 48:443-453 (1970); матрица сравнения: BLOSSUM62from Hentikoff и Hentikoff, Proc. Natl. Acad. Sci. USA. 89:10915-10919 (1992); штраф за пропуск в последовательности: 12; и штраф за длину пропуска: 4. Программа, применимая с данными параметрами, является общедоступной, как программа "Ogap" от Genetics Computer Group, находящейся в Madison, WI. Указанные выше параметры являются параметрами по умолчанию для сравнения аминокислот (вместе с отсутствием штрафов за концевые пропуски). Предпочтительные параметры для сравнения нуклеиновой кислоты включают следующие: алгоритм: Needleman и Wunsch, J. Mol. Biol. 48:443-453 (1970); матрица сравнения: совпадение: +10, несовпадение: 0; штраф за пропуск в последовательности: 50; штраф за длину пропуска: 3. Доступная как программа Gap от Genetics Computer Group, находящейся в Madison, Wis. Указанные выше параметры являются параметрами по умолчанию для сравнений нуклеиновых кислот. Необязательно, как будет ясно специалисту в данной области, в определении степени сходства аминокислотных последовательностей специалист в данной области может также принимать во внимание так называемые "консервативные" замены аминокислот. Консервативные аминокислотные замены относятся к взаимозаменяемости остатков, имеющих схожие боковые цепи. Например, группой аминокислот,имеющих алифатические боковые цепи, являются глицин, аланин, валин, лейцин и изолейцин; группой аминокислот, имеющих алифатически-гидроксильные боковые цепи, являются серин и треонин; группой аминокислот, имеющих амидсодержащие боковые цепи, являются аспарагин и глутамин; группой аминокислот, имеющих ароматические боковые цепи, являются фенилаланин, тирозин и триптофан; группой аминокислот, имеющих основные боковые цепи, являются лизин, аргинин и гистидин; и группой аминокислот, имеющих серосодержащие боковые цепи, являются цистеин и метионин. Предпочтительными группами консервативных замен аминокислот являются: валин-лейцин-изолейцин, фенилаланинтирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин. Вариантами замен аминокислотных последовательностей, описываемых в настоящем описании, являются те, в которых в описываемых последовательностях удаляли по меньшей мере один остаток и в это место встраивали различные остатки. Предпочтительно замена аминокислоты является консервативной. Предпочтительными консервативными заменами для каждой из природных аминокислот являются следующие: Ala на Ser; Arg на Lys; Asn на Gln или His; Asp на Glu; Cys на Ser или Ala; Gln на Asn; Glu на Asp; Gly на Pro; His на Asn или Gln; Ile на Leu или Val; Leu на Ile или Val; Lys на Arg; Gln или Glu; Met на Leu или Ile; Phe на Met, Leu или Tyr; Ser наThr; Thr на Ser; Trp на Tyr; Tyr на Trp или Phe; и Val на Ile или Leu. Конструкция нуклеиновой кислоты. Конструкция нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую белок или фрагмент белка, как указано в настоящем описании. Конструкция нуклеиновой кислоты, содержащая молекулу нуклеиновой кислоты, кодирующую указанный белок или фрагмент белка, как указано в настоящем описании, будет обеспечивать экспрессию указанной молекулы нуклеиновой кислоты и соответствующего белка или фрагмента белка у подвергаемого лечению индивидуума. В более предпочтительном варианте осуществления конструкция нуклеиновой кислоты содержит больше одной молекулы нуклеиновой кислоты, каждая из молекул нуклеиновой кислоты кодирует указанный белок или фрагмент белка. В более предпочтительном варианте осуществления конструкция нуклеиновой кислоты содержит две, три, четыре молекулы нуклеиновой кислоты, каждая из молекул нуклеиновой кислоты кодирует указанный белок или фрагмент белка. В предпочтительном варианте осуществления конструкция нуклеиновой кислоты содержит экспрессирующую кассету, указанная экспрессирующая кассета содержит каждую необходимую молекулу нуклеиновой кислоты. Каждая молекула нуклеиновой кислоты функционально связана с другой присутствующей молекулой нуклеиновой кислоты. Наиболее предпоч- 16022221 тительно подходящий промотор функционально связан с экспрессирующей кассетой для обеспечения экспрессии молекулы нуклеиновой кислоты у индивидуума. В настоящем описании и в формуле изобретения глагол "содержать" и его сопряжения применяют в его неограничивающем смысле в том значении, что следующие за словом пункты включены, но не исключают не указанные конкретно пункты. Кроме того, глагол "состоять" можно заменять на "по существу, состоять из" в значении, что продукт или композиция, или источник L3 или L5, как указано в настоящем описании, может содержать дополнительный компонент(ы), которые конкретно определяют, указанный дополнительный компонент(ы) не изменяет уникальную характеристику изобретения. Кроме того, ссылка на элемент в единственном числе не исключает возможности наличия нескольких элементов, если контекст четко не указывает на один и только один элемент. Таким образом, как правило, форма единственного числа означает "по меньшей мере один". Все патентные и литературные ссылки, цитируемые в настоящем описании, таким образом, включены в качестве ссылки в полном объеме. Изобретение дополнительно иллюстрируют следующим примером, не предназначенным для ограничения объема настоящего изобретения. Описание чертежей Фиг. 1. Экспрессия и очистка рекомбинантных белков rLmL3 и rLmL5 Leishmania major. Окрашенные Кумасси синим 13% полиакриламидные гели лизатов Escherichia coli, трансфицированных векторами pQELmL3 (фотография L3) или pQELmL5 (фотография L5), после индукции (линии 1), после пропускания через Ni-NTA агарозных колонки (линии 2) и очищенных рекомбинантных rLmL3 и rLmL5 (линии 3). Фиг. 2. Антигенность белков L3 и L5.(а) Двенадцать мышей BALB/c инфицировали s.c. 5104 промастигот L. major в стационарной фазе в подушечку левой стопы и через восемь недель после заражения получали сыворотки. Соотношения антител IgG1 и IgG2a в сыворотках от мышей с кожным лейшманиозом (MCL) для rLmL3 и rLmL5 определяли отдельно посредством ELISA. Также представлено отсутствие реакционной способности сывороток от одних и тех же мышей до инфекции. Реакционная способность в ELISA сывороток собак с CVL с симптомами и контрольными сыворотками по сравнению с рекомбинантными белками rLmL3 (b) иrLmL5 (с). Фиг. 3. Продукция цитокинов, индуцированная вакцинацией мышей BALB/c. Мышей BALB/c (шесть на группу) иммунизировали s.c. три раза 10 мкг rLmL3 плюс 50 мкг CpGODN (L3+CpG) или 10 мкг rLmL5 плюс 50 мкг CpG-ODN (L5+CpG), 50 мкг CpG-ODN (CpG) или PBS(солевым). Через четыре недели после вакцинации получали клетки селезенки и культивировали in vitro в течение 48 ч в присутствии rLmL3 (а, c и e), rLmL5 (b, d и f) и только в среде. Уровень IFN (а и b) , IL4 (c и d) и IL-10 (е и f) оценивали посредством ELISA в супернатантах культур. Каждый столбик представляет собой среднееSD для данных от отдельных мышей. Фиг. 4. Течение инфекции L. major у вакцинированных мышей BALB/c после заражения.(а) Отек подушечки стопы указывают как разницу толщины между инфицированной и неинфицированной противоположными подушечками стоп, (b) количество жизнеспособных паразитов в подколенном дренирующем лимфоузле инфицированной ноги и селезенке определяли отдельно посредством предельного разведения на восьмой неделе после заражения. (, Р 0,01). Фиг. 5. Клеточные иммунные ответы, вызываемые инфекцией у вакцинированных L3+CpG ODN мышей. На восьмой неделе после заражения паразитом получали культуры клеток селезенки. Клетки не стимулировали (среда) или раздельно стимулировали LRP (рибосомальные белки Leishmania)(12 мкгмл-1) или L3 (6 мкгмл-1) в течение 48 ч в 5% СО 2 при 37 С. Уровни IFN (a), IL-4 (b) и IL-10 (с) измеряли в супернатантах культур посредством твердофазного иммуноферментного анализа с захватом антигена. Каждый столбик представляет собой среднее плюс стандартное отклонение для уровней цитокина, определяемых у шести отдельных мышей на группу. Фиг. 6. Клеточные иммунные ответы, вызываемые инфекцией у вакцинированных L5+CpG ODN мышей. На восьмой неделе после заражения паразитом получали культуры клеток селезенки. Клетки не стимулировали (среда) или раздельно стимулировали LRP (12 мкгмл-1), SLA (12 мкгмл-1), MRP (12 мкгмл-1) или L5 (6 мкгмл-1) в течение 48 ч в 5% СО 2 при 37 С. Уровни IFN (a), IL-4 (с) и IL-10 (b) измеряли в супернатантах культур посредством твердофазного иммуноферментного анализа с захватом антигена. Каждый столбик представляет собой среднее плюс стандартное отклонение для уровней цитокина,определяемых у шести отдельных мышей на группу. Фиг. 7. Течение инфекции L. braziliensis у вакцинированных мышей BALB/c после заражения. мышами, вакцинированными rLmL5+CpG-ODN или rLmL3+CpG-ODN, и обеими контрольными группами. (b) Паразитарная нагрузка в дерме уха, количественно анализируемая на пятой неделе после инфекции. Результаты выражают как среднееSD для пяти ушей на группу. Р 0,05 значимое повышение между rLmL5+CpG-ODN и обеими контрольными группами мышей. Фиг. 8. Рибосомальная локализация белков LmL3 и LmL5. Один мкг белка rLmL3 (а), 1 мкг белка rLmL5 (b) и 10 мкг экстрактов LRP Leishmania major (a и b) подвергали электрофорезу в 10-13% линейно-градиентных PAGE в присутствии SDS. Окрашивание гелей кумасси синим представлено на левых фотографиях (а и b). Эквивалентные гели подвергали блоттингу и обрабатывали сыворотками мышей, иммунизированных rLmL3 (фотографии - LmL3) (a) и аффинно очищенной фракцией антител против LmL5 из сывороток пяти собак с висцеральным лейшманиозом (фотографии - LmL5) (b). Фиг. 9. Анализ параметров инфекции у мышей, вакцинированных рибосомальными белками S6, L2,L7, L8 и L6 в присутствии CpG.(a) Развитие повреждений в инфицированных группах контролировали еженедельно до восьмой недели после инфекции. Различия в отеке подушечек стоп между группами S6+CpG ODN и контроля (физиологический раствор и адъювант) являлись статистически значимыми на восьмой неделе после инфекции (Р 0,05). (b) Паразитарную нагрузку в DLN и селезенках анализировали через восемь недель после инфекции. Различия в паразитарных нагрузках в селезенках вакцинированной S6+CpG ODN группы и селезенках контрольных (физиологический раствор и адъювант) групп являлись статистически значимыми (Р 0,05). Для наглядности представлено только SD для группы, которой вводили физиологический раствор, и группы, вакцинированной S6+CpG ODN. Фиг. 10. Иммунные ответы, вызываемые вакцинацией S6+CpG ODN. Через четыре недели после введения последней дозы получали образцы сыворотки от мышей, иммунизированных S6+CpG ODN, CpG ODN и физиологическим раствором. Сыворотки тестировали отдельно посредством ELISA для определения наличия антител, специфичных против S6 IgG, антител IgG1 и IgG2a. (P0,05) Статистически значимые различия между группой S6+CpG ODN и контрольными(физиологический раствор и CpG) группами. (b) Клетки селезенки не стимулировали (среда) или стимулировали S6 в течение 48 ч в 5% СО 2 при 37 С. Уровни IFN, IL-4 и IL-10 измеряли в супернатантах культур посредством твердофазного иммуноферментного анализа с захватом антигена. Каждый столбик представляет собой среднее плюс стандартное отклонение для уровней цитокинов, определяемых у четырех отдельных мышей на группу. (Р 0,05) Статистически значимые различия между группой S6+CpGODN и контрольными (физиологический раствор и CpG) группами. Фиг. 11. Развитие повреждений у мышей, иммунизированных L3, L5 и S4 отдельно или в смешанных препаратах в отсутствие или наличие CpG. Повреждения контролировали ежедневно до шестой недели после инфекции. (a) Контрольные группы мышей и группы мышей, вакцинированных рекомбинантными белками без адъюванта. (b) Контрольные группы мышей и группы мышей, вакцинированных рекомбинантными белками плюс CpGODN. (P0,05) Различия в отеке подушечек стопы между L3+CpG ODN, L5+CpG ODN, L3+L5+CpGODN или L3+L5+S6+CpG ODN и контрольные (физиологический раствор и адъювант) группы являлись статистически значимыми на шестой неделе после инфекции. Фиг. 12. Паразитарные нагрузки в вакцинированных мышах. На седьмой неделе после инфекции определяли паразитарные нагрузки в селезенке и в DLN. (a) Контрольные группы мышей и группы мышей, вакцинированных рекомбинантными белками без адъюванта. (b) Контрольные группы мышей и группы мышей, вакцинированных рекомбинантными белками плюс CpG ODN. (P0,05) Различия в паразитарных нагрузках в селезенке между L3+CpG ODN, L5+CpGODN, L3+L5+CpG ODN или L3+L5+S6+CpG ODN и контрольных (физиологический раствор и адъювант) группах являлись статистически значимыми. (Р 0,05) Различия в паразитарных нагрузках в подколенной области между L3+L5+CpG ODN или L3+L5+S6+CpG ODN и контрольными (физиологический раствор и адъювант) группами являлись статистически значимыми. Фиг. 13. Графическое представление предполагаемых химерных конструкций. Представлены сконструированные праймеры и участки расщепления, выбранные для клонирования. Примеры Пример 1: клонирование белков L3 и L5 Leishmania major и защитный эффект против инфекции(Barcelona, Spain). Паразитов L. major (WHOM/IR/-/173) сохраняли в вирулентном состоянии пассированием в мышей(SEQ ID NO:5, 6) синтезировали в Isogen (The Netherlands). Клонирование ДНК-последовательностей, кодирующих рибосомальные белки L3 и L5 L. Major. Открытую рамку считывания (ORF), кодирующую белки L3 и L5 L. major, получали из базы данных генома L. major (www.genedb.org/genedb/leish) с применением последовательностей белков L3 и L5 S. cerevisiae в качестве зондов (56). Для экспрессии белков rLmL3 и rLmL5 их кодирующие области (CR) амплифицировали посредством ПЦР с применением ДНК из L. major (MHOM/IL/80(Friedlin в качестве матрицы. Амплифицированную ДНК клонировали в плазмиду pBluescript (Stratagene, La Jolla CA) и секвенировали до клонирования в экспрессирующий вектор PQE30 (QIAGEN, Hilden, Germany). Для клонированияID NO:44); антисмысловая, 5'-AACTGCAGTTACTTCTTCGCGGCCTTTG-3' (обратная и комплементарная положениям с 1241 по 1260 в LmL3 CR (LmjF34, 2880 (SEQ ID NO:45). В целях клонирования включали участки рестрикции BamHI и PstI (подчеркнуты). Для клонирования LmL5 CR применяли праймеры: смысловая, 5'-CGGGATCCATGTGCACGC TGGCAAATTG-3' (положения с 1 по 20 в LmL5(обратная и комплементарная положениям 968-987 в LmL5 CR (LmjF35, 1890, 319 (SEQ ID NO:47). В целях клонирования включали участки рестрикции BamHI и HindIII (подчеркнуты). Очистка белка. Белки rLmL3 и rLmL5 гиперэкспрессировали в Escherichia coli, трансформированных плазмидамиpQE-LmL3 или pQE-LmL5, и очищали в денатурирующих условиях на агарозных колонках с Niнитрилотриуксусной кислотой (Ni-NTA) (Qiagen). После связывания с Ni-NTA агарозой рекомбинантные белки подвергали рефолдингу на колонке для аффинной хроматографии, как описано (57). Рекомбинантные белки пропускали через полимиксин-агарозную колонку (Sigma, St. Louis, Mo.). Измеряли остаточное содержание эндотоксина (12 пг/мкг рекомбинантного белка) посредством Quantitative ChromogenicLimulus Amebocyte Assay QCL-1000 (BioWhittaker, Walkersville, Md.). Иммунизации, заражение паразитом и количественный анализ паразита. Две независимые группы мышей BALB/c (шесть на группу) инокулировали подкожно (s.c.) в подушечку правой стопы 10 мкг rLmL3 или 10 мкг rLmL5, смешанными с 25 мкг каждого CpG-ODN. В качестве контроля две дополнительные группы мышей инокулировали 25 мкг каждого CpG-ODN в отдельности, или фосфатно-солевым буфером (PBS). Каждую группу стимулировали через две и четыре недели той же дозой, которую применяли для примирования. Заражение паразитом осуществляли инокуляциейs.c. 5104 промастигот L. major (WHOM/IR/-/173) в стационарной фазе в подушечку левой стопы (необработанную) через четыре недели после последней инокуляции. Отек подушечки стопы измеряли измерительным штангенциркулем и вычисляли как толщину подушечки левой стопы минус толщина подушечки правой стопы. Количество паразитов определяли в ушах, дренирующих лимфоузлах (DLN) и селезенке посредством анализа предельных разведений, как описано (70). Антигены Leishmania и рибосомальные белки мыши. Для получения LRP L. major собирали 109 промастигот, промывали дважды в предварительно охлажденном PBS, ресуспендировали в 1 мл лизирующего буфера NP40 (10 мМ Трис-HCl, рН 8,0, 150 мМNaCl, 1,5 мМ MgCl2 и 0,5% NP40) и пипетировали 10 раз. После лизиса образцы центрифугировали на микроцентрифуге при 3000g в течение 2 мин при 4 С до осаждения ядер. Супернатант центрифугировали на микроцентрифуге дважды при 13000g в течение 15 мин при 4 С и из цитозольного супернатанта получали рибосомы, как описано в [57]. В кратком изложении цитозоль подвергали центрифугированию на высокой скорости при 90000 об/мин в течение 30 мин при 4 С в роторе Beckman TL100.3. Неочищенный рибосомальный осадок ресуспендировали в буфере (20 мМ Трис-HCl, рН 7,4, 500 мМ(20/40%) в буфере при 90000 об/мин при 4 С в роторе TL100.3. Осадок промытых рибосом растворяли вPBS и подвергали воздействию ультразвука до полной деградации рибосомальной РНК. Экстракты рибосомальных белков мыши (MRP) получали из 5107 макрофагов мыши RAW 264.7 с применением того же способа. Общие белки L. major (растворимый антиген Leishmania [SLA]) получали, как описано (70). В кратком изложении промастиготы L. major (1010) промывали в PBS дважды, ресуспендировали в 500 мл PBS и лизировали тремя циклами замораживания и оттаивания. После лизиса клеток растворимые антигены отделяли от нерастворимой фракции посредством центрифугирования в течение 15 мин при 12000g с применением микроцентрифуги. Супернатанты аликвотировали и хранили при -70 С. Измерение цитокинов в супернатантах. Высвобождение IFN, IL-10 и IL-4 измеряли в супернатантах культур спленоцитов, стимулирован- 19022221 ных рекомбинантными белками с применением коммерческих наборов ELISA (Diaclone, Besancon,France). В кратком изложении 3106 клеток селезенки высевали в 48-луночные планшеты на 48 ч при 37 С в присутствии rLmL3 (6 мкгмл-1) или rLmL5 (6 мкгмл-1) или только среды. Определение гуморального ответа против L3 и против L5 у мышей и собак. Образцы сыворотки собак собирали у 20 собак с клиническими симптомами, инфицированныхLeishmania infantum естественным образом, из области Эстремадура (Испания). Инфицированных животных клинически и аналитически исследовали в Department of Parasitology of the Veterinary School, Extremadura University, Caceres, Spain. Все сыворотки являлись положительными при тестировании непрямым иммунофлуоресцентным анализом, и наличие амастиготных форм паразита подтверждали прямым наблюдением в подколенных и предлопаточных лимфоузлах. Контрольные сыворотки получали из 8 здоровых животных, содержащихся в Department of Parasitology (Extremadura University). На восьмой неделе после инфекции собирали сыворотки 12 мышей BALB/c, экспериментально инфицированных 5104 промастигот L. major (WHOM/IR/-/173) стационарной фазы. В качестве контроля собирали сыворотки от тех же мышей до инфекции. Стандартные планшеты для ELISA сенсибилизировали в течение ночи при комнатной температуре 100 мкл каждого из рекомбинантных рибосомальных белков (2 мкгмл-1 в PBS). Образцы сыворотки собак и мышей анализировали при разведении 1/200 вPBS-Tween 20 (0,5%)-казеин (5%). В качестве вторичных антител применяли конъюгированные с пероксидазой хрена антитела против IgG собаки (1/1000), против IgG1 мыши (1/1000) и против IgG2a мыши(1/500), приобретенные в Nordic Immunological Laboratories (Tilburg, The Netherlands). Ортофенилддиамин дигидрохлорид (OPD) (Dako, A/S, Glostrup, Denmark) применяли в качестве субстрата пероксидазы для анализов ELISA. Через 15 мин реакцию останавливали добавлением 100 мкл 1 М H2SO4 и поглощение считывали при 450 нм. Статистический анализ. Статистический анализ осуществляли посредством t-критерия Стьюдента. Различия считали значимыми при Р 0,05. Результаты и обсуждение. Идентификация, клонирование и экспрессия белков LmL3 и LmL5. Для идентификации кодирующих областей L3 и L5 L. major авторы изобретения осуществляли поиск BLASTP с применением аминокислотных последовательностей L3 и L5 S. cerevisiae в качестве зондов (YOR063w и YPL131w, соответственно) [58]. Находили две различные записи (LmjF34.2880 иLmjF35.1890), обозначенные как предполагаемые белки LmL3 и LmL5, со значительными величинами баллов BLAST. На основе данных о последовательности из базы данных конструировали праймеры для ПЦР для амплификации LmL3 и LmL5 CR, в целях клонирования включающие участки расщепления для различных рестрицирующих ферментов. Амплифицированную ДНК субклонировали в pBluescript и секвенировали. Предполагаемый белок L3 L. major содержал 419 аминокислот, обладая молекулярной массой 47,5 кДа и прогнозируемой изоэлектрической точкой 11,67. Предполагаемый белок L5 L. major содержал 328 аминокислот с молекулярной массой 36,6 кДа и прогнозируемой изоэлектрической точкой 10,69. При сравнении предполагаемых аминокислотных последовательностей L3 и L5 L. major с их эквивалентами S. cerevisiae выявляли высокую степень гомологии: 57% идентичность, 73,5% сходство для белка L3; 51,2% идентичность, 66,3% сходство для белка L5 (см. "Выравнивание"). Выравнивание, представленное в настоящем описании, показало, что белки L3 и L5 Leishmania содержат некоторые домены с высокой степенью сходства. Кроме того, было удивительно наблюдать, что оба белка паразита являлись более длинными, чем белки дрожжей, демонстрируя дополнительные аминокислотные остатки на карбоксильном конце -LmL3 и на обоих концах LmL5. Необычная первичная структура белков Leishmania,принадлежащих к семействам консервативных белков, по-видимому, связана с иммунологией, так как гуморальный и клеточный ответы, вызываемые против данных белков при инфекции, являются специфическими против паразита без перекрестной реактивности с гомологичными белками из аналогов хозяина (39, 36, 58).LmL3 и LmL5 CR субклонировали в экспрессирующий вектор pQE30. Аминокислотные последовательности предполагаемых рекомбинантных белков представлены в частях С и D выравнивания. В обоих белках присутствует N-концевая метка, включающая 6 гистидинов, применяемых для очистки аффинной хроматографией. Затем оба белка гиперэкспрессировали в культурах Е. coli и очищали. Как показано на фиг. 1, очищенные белки rLmL3 и rLmL5 продемонстрировали предполагаемую молекулярную массу 48 и 38 кДа, соответственно, в соответствии с наличием удлинения на дополнительные 12 аминокислот полигистидиновой метки в N-концевых областях. Продемонстрировали чистоту белка, так как для обоих рекомбинантных белков наблюдали одну полосу при окрашивании SDS-PAGE Кумасси синим (фиг. 1).LmL3 и LmL5 распознаются сыворотками собак с висцеральным лейшманиозом (CVL) и сыворотками мышей BALB/c, инфицированных L. major (MCL). Для определения антигенности белков L3 и L5 L. major в собаки, страдающих VL, применяли рекомбинантные белки rLmL3 и rLmL5 в качестве антигенов в анализах ELISA с применением сывороток 20 собак, инфицированных L. infantum. В качестве контроля анализировали реакционную способность сывороток, полученных из 8 здоровых собак, против обоих рекомбинантных белков. Из сывороток CVL 75% (15/20) распознавали белок rLmL3 (фиг. 2b), и 90% (18/20) распознавали белок rLmL5 с более высокими значениями реакционной способности, чем пороговое значение (фиг. 2 с). Спектр значений поглощения отличался между сыворотками против rLmL3 и rLmL5, так как реакционная способность сывороток CVL против rLmL5 являлась более высокой (среднее=0,610, 36), чем полученное для rLmL3 (среднее=0,280,10). Можно предполагать, что оба белка паразита подвергнуты воздействию иммунной системы при природном лейшманиозе у собак, где белок LmL5 являлся преобладающим иммуногеном относительно LmL3. Хотя применяли ограниченное количество сывороток, полученные данные можно применять как свидетельство того, что для разработки серодиагностических тестов CVL можно применять оба рекомбинантных белка паразита в сочетании с другими антигенами. Затем авторы изобретения анализировали антигенность белков LmL3 и LmL5 с применением сывороток мышей BALB/c, страдающих кожным лейшманиозом (MCL) по причине инфекции L. major. С этой целью анализировали наличие антитела IgG1 и IgG2a против обоих рекомбинантных белков посредством ELISA. Оба белка распознавали сыворотками MCL, где антитела изотипа IgG1 против этих белков были заранее индуцированы (фиг. 2 а). Не наблюдали реакционную способность против этих белков у тех же мышей до инфекции (фиг. 2 а). Так как индукцию антител IgG1 и IgG2a применяют в качестве маркера иммунных ответов Th2-типа и Th1-типа, соответственно (8), мы можем предполагать, что при инфекции L. major у мышей BALB/c индуцируется Th2-подобный гуморальный ответ против данных антигенов. Иммунизация рекомбинантными рибосомальными белками rLmL3 и rLmL5 в присутствии CpGODN индуцирует у мышей BALB/c ответ Th1-типа против этих белков Авторы изобретения анализировали иммунизацию rLmL3 и rLmL5 в присутствии Th1 индуцирующего адъюванта (CpG-ODN), так как у инфицированных BALB/c мьшей развивается Th2 опосредованный гуморальный ответ против этих белков. С этой целью группы из шести мышей независимо иммунизировали rLmL3 и rLmL5 в сочетании с CpG-ODN. В качестве контроля группы из шести мышей иммунизировали только CpG-ODN и с PBS (буфер, применяемый в качестве эксципиент). После трех доз анализировали клеточные ответы, обусловленные иммунизацией. Получали клетки селезенки и культивировали их в присутствии и в отсутствие соответствующих антигенов rLmL3 или rLmL5. Клетки селезенки мышей, иммунизированных rLmL3+CpG-ODN, продуцировали высокий уровень IFN после стимуляции антигеном rLmL3 (фиг. 3). Схожий уровень IFN определяли в супернатантах культур клеток селезенки мышей, иммунизированных rLmL5+CpG-ODN после стимуляции rLmL5 (фиг. 3b). В отличие от них клетки селезенки мышей, иммунизированных адъювантом или эксципиентом, продуцировали низкие уровни IFN в ответ на стимуляцию rLmL3 или rLmL5 (фиг. 3 а, b). В отношении продукции IL-4 определяли очень низкие уровни данного цитокина после стимуляции rLmL3 или rLmL5 клеток селезенки, полученных из мышей, иммунизированных rLmL3+CpG-ODN (фиг. 3 с) или rLmL5+CpG-ODN (фиг. 4d) соответственно. В конечном итоге, не определяли специфическую продукцию IL-10 в любой группе(фиг. 3 е, f). Таким образом, можно сделать вывод, что адъювант CpG-ODN сдвигает иммунный ответ против рекомбинантных антигенов в сторону Th1-ответа. Вакцинация rLmL3+CpG-ODN и rLmL5+CpG-ODN защищает мышей BALB/c от заражения L.major. Авторы изобретения анализировали, способно ли введение обоих рекомбинантных белков индуцировать иммунитет против инфекции L. major у восприимчивых мышей BALB/c. Отек подушечки стопы вакцинированных rLmL3+CpG-ODN или rLmL5+CpG-ODN мышей был значимо ниже по сравнению с отеком подушечки стопы контрольных групп PBS или CpG-ODN (фиг. 4 а). Кроме того, наблюдали приблизительно 2-кратное снижение логарифма паразитарной нагрузки в клетках дренирующих лимфоузлов мышей, иммунизированных rLmL3+CpG-ODN или rLmL5+CpG-ODN. В конечном итоге не определяли паразитов в селезенке, в то время как в селезенках мышей обеих контрольных групп паразитов определяли (фиг. 3b). Можно сделать вывод, что мыши, иммунизированные смешанными с CpG-ODN белкамиLmL3 и LmL5 паразита, экспрессирующимися как рекомбинантные белки, защищены от инфекции L.major. У вакцинированных мышей патология кожи отсутствовала или являлась очень низкой. У данных мышей наличие паразитов ограничивалось подколенным дренирующим лимфоузлом. Наблюдаемый иммунитет являлся схожим с полученным иммунизацией мышей смесью ДНК-плазмид, кодирующих нуклеосомные гистоны Leishmania (19), белком Р 0, вводимым в качестве ДНК-вакцины (54), и экстрактамиLRP в сочетании с CpG-ODN (55). Таким образом, авторы изобретения охарактеризовали два рибосомальных компонента, иммунизация которыми может вносить вклад в более рациональную разработку эффективных молекулярных вакцин против лейшманиоза. Анализ иммунологических параметров, связанных с иммунитетом. Для определения иммунологических параметров, связанных с иммунитетом, авторы изобретения анализировали продукцию цитокинов (IFN, IL-4 и IL-10), регулируемую SLA, LRP, MRP и соответствующими рекомбинантными белками (L3 и L5), у вакцинированных и контрольных групп мышей на неделе 8 после заражения. Клетки селезенки вакцинированных L3 и L5 мышей продуцировали большеIFN, специфичного для SLA, LRP и рекомбинантных антигенов, чем таковые у контрольных мышей на восьмой неделе после заражения (фиг. 5 а для L3 и фиг. 6 а для L5). Обнаруживали, что продукцию IFN специфически индуцируют рибосомальные белки Leishmania, так как стимуляция культур клеток селезенки MRP не приводила к продукции данного цитокина (фиг. 5 а для L3 и фиг. 6 а для L5). Кроме того,обнаруживали более низкие уровни SLA- и LRP-специфичных IL-10 (фиг. 5b для L3 и фиг. 6b для L5) иIL-4 (фиг. 5 с для L3 и фиг. 6 с для L5) в супернатантах клеток селезенки, полученных из защищенных мышей, по сравнению с контрольными мышами (CpG и физиологический раствор). Кроме того, MRPспецифичная L3- и L5-зависимая продукция IL-10 и IL-4 являлась очень низкой у защищенных мышей. Таким образом, можно сделать вывод, что защитный фенотип после инфекции ассоциирован с индукцией L3 и L5 Th1-ответов, способных контролировать IL-4-и IL-10-ответы, индуцируемые паразитом. Выравнивания данных о последовательностях LmL3 и LmL5. Выравнивания аминокислотных последовательностей белков L3 (А) и L5 (В) Leishmania major с их ортологами Saccharomyces cerevisiae. Заштриховывали консервативные аминокислоты. Указывали количество аминокислот LmL3 и LmL5. Аминокислотные последовательности L. major прогнозировали с помощью соответствующих им последовательностей ДНК. (С и D) Аминокислотные последовательности или спрогнозированные аминокислотные последовательности рекомбинантных белков LmL3 (rLmL3)(С) и LmL5 (rLmL5) (D) экспрессировали в бактериях. Дополнительную последовательность полигистидиновой метки, локализованной на их N-концах, указывают полужирным шрифтом и подчеркивают. Указывают количество аминокислот белков rLmL3 и rLmL5. Пример 2: анализ гомологов L3 и L5. Выравнивание гомологов L3 и L5. Авторы изобретения анализировали степень консервативности рибосомальных белков L3 и L5 между различными видами Leishmania. С этой целью искали аминокислотные последовательности белка L3L. infantum и L. mexicana (SEQ ID NO:48 и 50) и белка L5 L. infantum (клон JPCM5 [MCAN/ES/98/LLM877]), L. braziliensis (MHOM/BR/75/M2904) и L. mexicana (MHOM/GT/2001/U1103) (SEQ ID NO:52, 56 и 54) анализом in silico в базе данных геномов (www.genedb.org) и сравнивали с аминокислотными последовательностями ортологов L. major (SEQ ID NO:1 для L3 и SEQ ID NO:3 для L5) (выравнивание представлено на следующей странице, часть А и В). За исключением наличия N-концевого удлинения в белкеL5 L. major, наблюдали высокую степень консервативности между различными видами. В табл. 1 А-В представлены процентные доли идентичности и сходства между ортологами L3 и L5 соответственно. Локализация L3 и L5 Leishmania major в рибосомах. Для демонстрации того, что применяемые в данной работе рекомбинантные LmL3 и LmL5 соответствуют белкам, локализованным в рибосомах паразита, авторы изобретения применяли антитела, специфичные для рекомбинантных белков, в вестерн-блоттинге, включающем рекомбинантные белки и экстракты LRP. На фиг. 8a представлены антитела против LmL3, полученные из мышей, иммунизированных распознаваемым рекомбинантным белком, видимые как одна полоса с ожидаемой молекулярной массой(47,5 кДа) в экстрактах LRP. Схожий результат наблюдали для белка L5 (фиг. 8b). Наблюдали одну полосу 36,6 кДа в экстрактах LRP при применении антител против LmL5, очищенных из сывороток собак,инфицированных L. infantum естественным образом, посредством аффинной хроматографии в колонкеrLmL5-сефарозы 4 В, как описано ранее (71). В качестве положительного контроля в обоих случаях спе- 23022221 цифические антитела распознавали соответствующий рекомбинантный белок. Сравнение последовательностей L3 и L5 Leishmania. Выравнивания аминокислотных последовательностей L. major, L. infantum и L. mexicana L3 (A) (SEQ ID NO:1, 48 и 50) и L. major, L. braziliensis, L.mexicana (идентификатор GeneDB LmxM34, 1880) выравнивали с применением настроек по умолчанию В Представлены значения идентичности и сходства (в скобках) Пример 3: вакцинация rLmL3+CpG-ODN и rLmL5+CpG-ODN защищает мышей BALB/c от заражения L. braziliensis. Авторы изобретения анализировали эффект иммунизации рекомбинантными белками rLmL3 иrLmL5 L. major в сочетании с Th1-индуцирующим адъювантом (CpG-ODN) на развитие кожного лейшманиоза, вызываемого инфекцией L. braziliensis. С этой целью группы из пяти мышей независимо иммунизировали 10 мкг rLmL3 или 10 мкг rLmL5 в сочетании с 50 мкг CpG-ODN (25 мкг CpG-1 [5'TCAACGTTGA-3'] плюс 25 мкг CpG-2 [5'-GCTAGCGTTAGCGT-3')] (SEQ ID NO:5 и 6. В качестве контроля группы из пяти мышей иммунизировали только 50 мкг CpG-ODN или PBS (буфер, применяемый в качестве эксципиента). Мышей инокулировали в дерму уха (левое ухо). Каждую группу стимулировали через две и четыре недели той же дозой, которую применяли для примирования. Заражение паразитом осуществляли инъекцией в правое (необработанное) ухо 105 промастигот L. braziliensis(MHOM/BR/01/BA788) в стационарной фазе в сочетании с двумя парами слюнных желез москита Lutzomya intermedia. В данной модели инфекции после заражения паразитом у мышей BALB/c в инфицированных ушах развивается воспалительное повреждение, постоянно прогрессирующее и достигающее максимума приблизительно на неделе 5. Затем размер повреждения снижался, и полное рубцевание уха наблюдали приблизительно на неделе 9 после инфекции (72). Авторы изобретения анализировали развитие кожного повреждения в четырех группах мышей до 5 недель после заражения паразитом, измеряя толщину повреждения измерительным штангенциркулем. Как показано на фиг. 7a, повреждения ушей вакцинированных rLmL3+CpG-ODN или rLmL5+CpG-ODN мышей являлись значимо меньшими по сравнению с контрольными группами PBS или CpG-ODN. Кроме того, анализировали паразитарные нагрузки в инфицированных ушах на неделе 5 после инфекции. Количество паразитов определяли посредством анализа предельных разведений, как описано (73). Наблюдали снижение паразитарных нагрузок у вакцинированных мышей по сравнению с контрольными группами. Обнаруживали значимые различия в группе rLmL5+CpG-ODN в отношении обеих контрольных групп (Р 0,05, Т-критерий Стьюдента). Кроме того, не определяли паразитов в ушах четырех из пяти мышей (группа rLmL5+CpG-ODN) и одной из пяти мышей в группе rLmL3+CpG-ODN (фиг. 7b). Таким образом, можно сделать вывод, что мыши, вакцинированные рибосомальными белками L3 и L5 L. major, экспрессирующимися как рекомбинантные белки, в сочетании CpG-ODN, были защищены от гетерологичного заражения L. braziliensis. Пример 4: частичный иммунитет, придаваемый S6 Leishmania major против инфекции Leishmaniamajor. Пять групп мышей (n=4 на группу) независимо иммунизировали 10 мкг S6 (SEQ ID NO:34), L2(SEQ ID NO:22), L7 (SEQ ID NO:24), L8 (SEQ ID NO:26) и L16 (SEQ ID NO:28) в присутствии CpG ODN,как указано ранее в SEQ ID NO:5 и 6 (50 мкг). В качестве контроля группу мышей иммунизировали адъювантом и другую группу иммунизировали эксципиентом (PBS-физиологический раствор). Три дозы вводили с 2-недельными интервалами. Все иммунизации осуществляли в подушечку правой стопы. Через один месяц после последней дозы мышей инфицировали 105 промастигот L. major стационарной фазы, введенными подкожно в подушечку левой стопы. Оценивали развитие повреждения кожи, измеряя отек подушечки стопы до восьмой недели после заражения (фиг. 9a). У мышей из всех групп развивались воспалительные повреждения, хотя отек подушечки стопы у мышей, вакцинированных S6+CpG ODN,являлся значимо меньшим, чем отек, наблюдаемый у контролей и у мышей, иммунизированных другими четырьмя белками. Кроме того, анализировали паразитарные нагрузки в дренирующих лимфоузлах(DLN) и в селезенках мышей. Животные, иммунизированные S6+CpG ODN, продемонстрировали 2 кратное снижение логарифма количества паразитов в селезенке по сравнению с группами с физиологическим раствором и CpG ODN, соответственно (фиг. 9b). Однако паразитарные нагрузки, обнаруживаемые в DLN группы S6+CpG ODN, являлись схожими с нагрузками, наблюдаемыми в контролях. По результатам данного анализа можно сделать вывод, что вакцинация рекомбинантным белком S6 в присутствии адъюванта CpG ODN индуцировала иммунное состояние, приводящее к частичному иммунитету против CL по причине инфекции L. major у мышей BALB/c: наличие меньших воспалительных повреждений в участке инфекции и более низких паразитарных нагрузок в селезенке, чем у контролей. С другой стороны, вакцинация другими четырьмя антигенами (L5, L7, L8 и L16) не приводила к значимым изменениям прогрессирования CL относительно контролей. Для анализа иммунного ответа, индуцируемого вакцинацией, сравнивали гуморальные и клеточные ответы, вызываемые у мышей вакцинацией S6+CpG ODN, с мышами, иммунизированными адъювантом и разбавителем для вакцины. На фиг. 10 показано, что состав вакцины индуцировал смешанный Th1/Th2 ответ против белка S6, так как антитела IgG2a и IgG1, специфичные против S6, определяли в сыворотках вакцинированных мышей (см. фиг. 10a). Кроме того, хотя IFN продуцировался после стимуляции S6 invitro клеток селезенки, полученных от вакцинированных мышей, наличие определяемого цитокина IL-4 также наблюдали в супернатантах культур (см. фиг. 10b). Можно сделать вывод, что вакцинация индуцировала преобладающий Th1-ответ против белка S6,но также наблюдали небольшую стимуляцию Th2-ответа на белок (определяемые уровни S6 специфичного IL-4 и S6-специфичных антител IgG1). Пример 5: вакцины на основе рекомбинантных белков L3, L5 и S4 Leishmania major. Для более подробного анализа иммунитета, индуцированного рибосомальными белками L3, L5 иS4, осуществляли новый эксперимент иммунизации-инфекции. В анализ включали двенадцать групп мышей (n=4 на группу). Во всех случаях мышей иммунизировали подкожно три раза (через две недели) в подушечку правой стопы. Анализировали следующие группы: Эксципиент для вакцины: физиологический раствор. Адъювант для вакцины: CpG-ODN. На дозу: 50 мкг CpG ODN (25 мкг CpG-ODN-1 [5'TCAACGTTGA-3'] (SEQ ID NO:5) и 25 мкг CpG-ODN-2 [5'-GCTAGCGTTAGCGT-3'] (SEQ ID NO:6).L3+CpG ODN. На дозу: 10 мкг рекомбинантного белка и 50 мкг CpG ODN.L5+CpG ODN. На дозу: 10 мкг рекомбинантного белка и 50 мкг CpG ODN.S4+CpG ODN. На дозу: 10 мкг рекомбинантного белка и 50 мкг CpG ODN.L3+L5+CpG ODN. На дозу: всего 10 мкг рекомбинантных белков и 50 мкг CpG ODN.L3+L5+S4+CpG ODN. На дозу: всего 10 мкг рекомбинантных белков и 50 мкг CpG ODN. В кратком изложении три антигена анализировали в присутствии или в отсутствие CpG ODN. Кроме того, сочетания L3+L5 и L3+L5+S4 анализировали в присутствии и в отсутствие CpG ODN. Через месяц после последней дозы мышей инфицировали 105 промастигот L. major стационарной фазы, введенных подкожно в подушечку левой стопы. Оценивали развитие повреждение кожи, измеряя отек подушечки стопы до шестой недели после заражения. На фиг. 11a представлены обе контрольных группы (физиологический раствор и CpG ODN) и пять групп, вакцинированных антигенами без адъюванта. Не наблюдали различий в воспалительных повреждениях между контрольными группами и пятью группами мышей, вакцинированных белками в отсутствие адъюванта. На фиг. 11b представлены обе контрольные группы (физиологический раствор иCpG ODN) и пять групп, вакцинированных антигенами в сочетании с адъювантом. В данном случае все группы мышей, вакцинированных рекомбинантными белками в присутствии адъюванта, продемонстрировали снижение отека подушечки стопы, кроме группы S4+CpG ODN. Наблюдали меньшие воспалительные повреждения в группах L5+CpG ODN, L3+L5+CpG ODN и L3+L5+S4+CpG ODN. Паразитарные нагрузки в DLN и в селезенках во всех группах мышей анализировали на седьмой неделе после инфекции. Не наблюдали статистических различий между мышами, включенными в контрольные группы, и мышами, иммунизированными рибосомальными белками без адъюванта (фиг. 12a). С другой стороны, мыши, иммунизированные рибосомальными белками плюс CpG ODN, продемонстри- 27022221 ровали значимое снижение паразитарных нагрузок в селезенке, кроме группы S4+CpG ODN (фиг. 12b). Что касается паразитарных нагрузок в подколенном лимфоузле, авторы изобретения обнаруживали только значимое снижение в группах, вакцинированных сочетанием двух (L3+L5) или трех (L3+L5+S4) рибосомальных белков плюс CpG ODN. Мыши, вакцинированные L3+CpG ODN и L5+CpG ODN, также продемонстрировали более низкие паразитарные нагрузки, чем контроли. Однако, по причине высокой степени вариабельности, обнаруженной между различными животными, результаты не являлись статистически значимыми. Данные анализы необходимо повторять с большим количеством мышей для анализа влияния вакцин на местные паразитарные нагрузки, так как в предыдущих анализах авторы изобретения обнаруживали статистические различия между мышами, вакцинированными L3+CpG ODN и L5+CpGODN и контролями. Что касается применения вакцин на основе отдельных антигенов или совместного введения различных антигенов, наши результаты свидетельствуют о том, что комбинированные вакцины индуцируют более высокую степень иммунитета, чем вакцины, составленные из отдельных антигенов. Пример 6: план способов клонирования для конструирования рекомбинантных молекул, сочетающих четыре уже описанных защитных рибосомальных антигена (L3, L5, S4 и S6 из Leishmania major). На основе предыдущих результатов авторы изобретения планировали получать новые рекомбинантные препараты на основе белков L3 (SEQ ID NO:1), L5 (SEQ ID NO:3), S4 (SEQ ID NO:32) и S6 (SEQID NO:34) Leishmania major. Во-первых, вставки ДНК, кодирующей четыре белка, будут клонировать в эукариотический экспрессирующий вектор (pcDNA-3; Stratagene). Данный вектор, делающий возможной экспрессию белковLeishmania в клетках млекопитающих, можно применять для тестирования ДНК-вакцин. Во-вторых, авторы изобретения планировали способ клонирования различных химерных белков с различными сочетаниями четырех антигенов (фиг. 13). Сначала генные химеры клонировали в pBluescript (аналитическая плазмида) и затем вставки ДНК клонировали в две различные экспрессирующие плазмиды:pcDNA3, эукариотическая экспрессирующая плазмида. Данная стратегия клонирования позволит нам иметь и ДНК-вакцину, и рекомбинантные белки, экспрессирующиеся в Е. coli, с предполагаемыми антигенными сочетаниями. Применяли следующие праймеры:LmL5 прямой 5'-GCGATATCGGGATGTGCACGCTGGCAAATTG-3' (SEQ ID NO:63); обратный 5'-GGGGTACCGGATCCTTACTTGCCGAGGCGCTCGC-3' (SEQ ID NO:64). Полученный химерный белок представлен аминокислотной последовательностью, состоящей изSEQ ID NO:67. Данный химерный белок, кодируемый нуклеиновой кислотой, представленной молекулой нуклеиновой кислоты, состоящей SEQ ID NO:66. Ссылки 1. Aguilar-Be, I., R. da Silva Zardo, E. Paraguai de Souza, G.P. Borja-Cabrera, M. Rosado-Vallado, M.
МПК / Метки
МПК: A61K 39/008, G01N 33/569, C07K 14/44
Метки: средства, заболевания, источника, качестве, диагностического, вакцины, паразитарного, применение
Код ссылки
<a href="https://eas.patents.su/30-22221-primenenie-istochnika-l3-i-ili-l5-v-kachestve-vakciny-ili-diagnosticheskogo-sredstva-dlya-parazitarnogo-zabolevaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Применение источника l3 и/или l5 в качестве вакцины или диагностического средства для паразитарного заболевания</a>
Предыдущий патент: Способ получения и очистки рекомбинантной лизосомальной альфа-маннозидазы
Следующий патент: Предмет одежды одноразового использования
Случайный патент: Способ и устройство для выделения ароматической карбоновой кислоты из ее суспензии в растворителе