Антагонисты мускариновых рецепторов ацетилхолина
Номер патента: 21994
Опубликовано: 30.10.2015
Авторы: Макклеланд Брент У., Палович Майкл Р., Томас Соня М., Нейпп Кристофер Э., Лэн Драман И.
Формула / Реферат
1. Соединение формулы (I), представленное ниже:
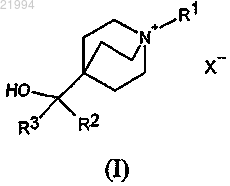
где R1 представляет собой
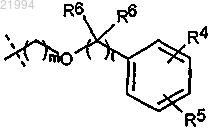
R2 и R3 независимо выбирают из группы, состоящей из:
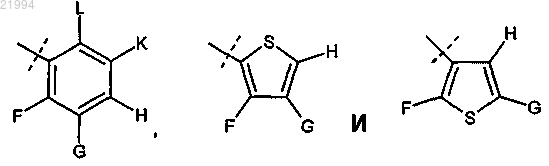
F, G, Н, K и L независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, галоидзамещенного C1-C4-алкила, гидроксизамещенного C1-C4-алкила и C1-C4-алкокси;
R4 и R5 независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, арила, C1-C4-алкиларила, циано, нитро, (CR7R7)pORb, (CR7R7)pNRbRb, или R4 и R5 вместе могут образовывать 5-6-членное насыщенное или ненасыщенное кольцо;
m представляет собой целое число, имеющее значение от 1 до 5;
t равно 0, 1 или 2;
p равно 0, 1 или 2;
R6 выбирают из группы, состоящей из водорода, C1-C4-алкила;
Rb выбирают из группы, состоящей из водорода, C1-C4-алкила и арил-C1-C4-алкила;
R7 выбирают из группы, состоящей из водорода и C1-C4-алкила;
X представляет собой физиологически приемлемый анион, такой как хлорид, бромид, йодид, гидроксид, сульфат, нитрат, фосфат, ацетат, трифторацетат, фумарат, цитрат, тартрат, оксалат, сукцинат, манделат, метансульфонат и п-толуолсульфонат;
арил представляет собой фенил или нафтил,
при условии, что соединение формулы (I) не включает 4-[гидрокси(дифенил)метил]-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид.
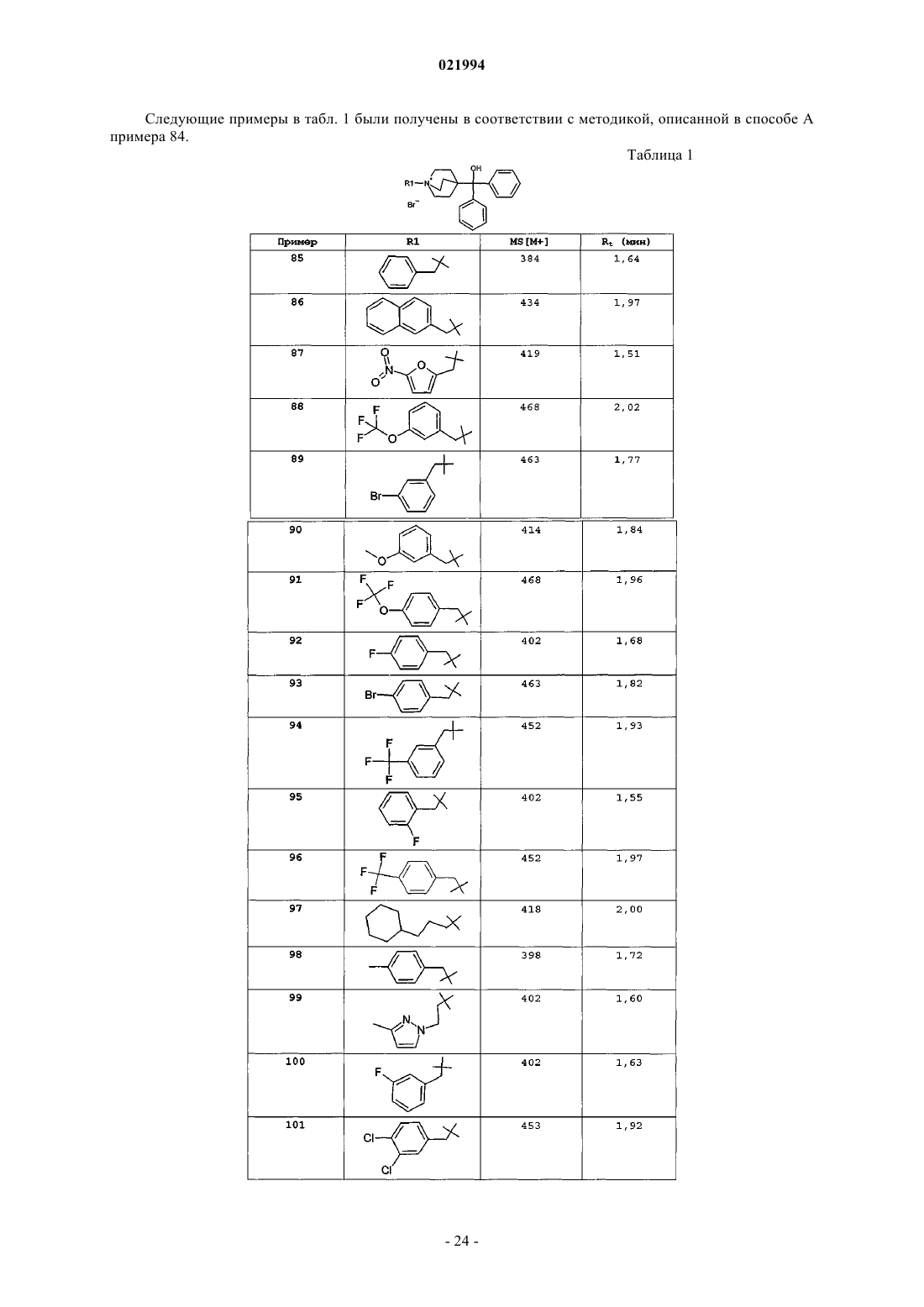
2. Соединение по п.1, выбранное из группы, включающей:
1-(2-{[(3-фторфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-бромфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-хлорфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[бис-(4-фторфенил)(гидрокси)метил]-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
4-{гидрокси[бис-(3-метилфенил)]метил}-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-фторфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(3-фторфенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-{гидрокси[бис-(4-метилфенил)]метил}-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
4-[бис-(3-фторфенил)(гидрокси)метил]-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(3-хлорфенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(ди-2-тиенил)метил]-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-цианофенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(4-бромфенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[бис-(4-фторфенил)(гидрокси)метил]-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(4-фторфенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{2-[(1-метил-1-фенилэтил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(ди-3-тиенил)метил]-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-[2-(фенилокси)этил]-1-азониабицикло[2.2.2]октанбромид;
4-{гидрокси[бис-(3-метилфенил)]метил}-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
4-{гидрокси[бис-(4-метилфенил)]метил}-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-(3-{[4-(метилокси)фенил]окси}пропил)-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-[2-({[3-(метилокси)фенил]метил}окси)этил]-1-азониабицикло[2.2.2]октанбромид;
4-[бис-(3-фторфенил)(гидрокси)метил]-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(ди-2-тиенил)метил]-1-[2-(фенилокси)этил]-1-азониабицикло[2.2.2]октанбромид;
4-(гидрокси{бис-[3-(метилокси)фенил]}метил)-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{3-[(4-нитрофенил)окси]пропил}-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(2-фторфенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{3-[(3-нитрофенил)окси]пропил}-1-азониабицикло[2.2.2]октанбромид;
1-[3-(4-бифенилилокси)пропил]-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{3-[(2-метилфенил)окси]пропил}-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{3-[(фенилметил)окси]пропил}-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-[4-(фенилокси)бутил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{3-[(2-гидроксифенил)окси]пропил}-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(ди-3-тиенил)метил]-1-[2-(фенилокси)этил]-1-азониабицикло[2.2.2]октанбромид;
4-(гидрокси{бис-[4-(метилокси)фенил]}метил)-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(4-цианофенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-[2-({[4-(1,1-диметилэтил)фенил]метил}окси)этил]-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-(гидрокси{бис-[4-(метилокси)фенил]}метил)-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
1-{3-[(2-бромфенил)окси]пропил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{4-[(фенилметил)окси]бутил}-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси{бис-[3-(метилокси)фенил]}метил]-1-[3-(фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромид;
1-(3-{[3-(диэтиламино)фенил]окси}пропил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-{2-[(2,4-дибромфенил)окси]этил}-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-[3-({2-[(фенилметил)окси]фенил}окси)пропил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-(3-{[2-(метилокси)фенил]окси}пропил)-1-азониабицикло[2.2.2]октанбромид.
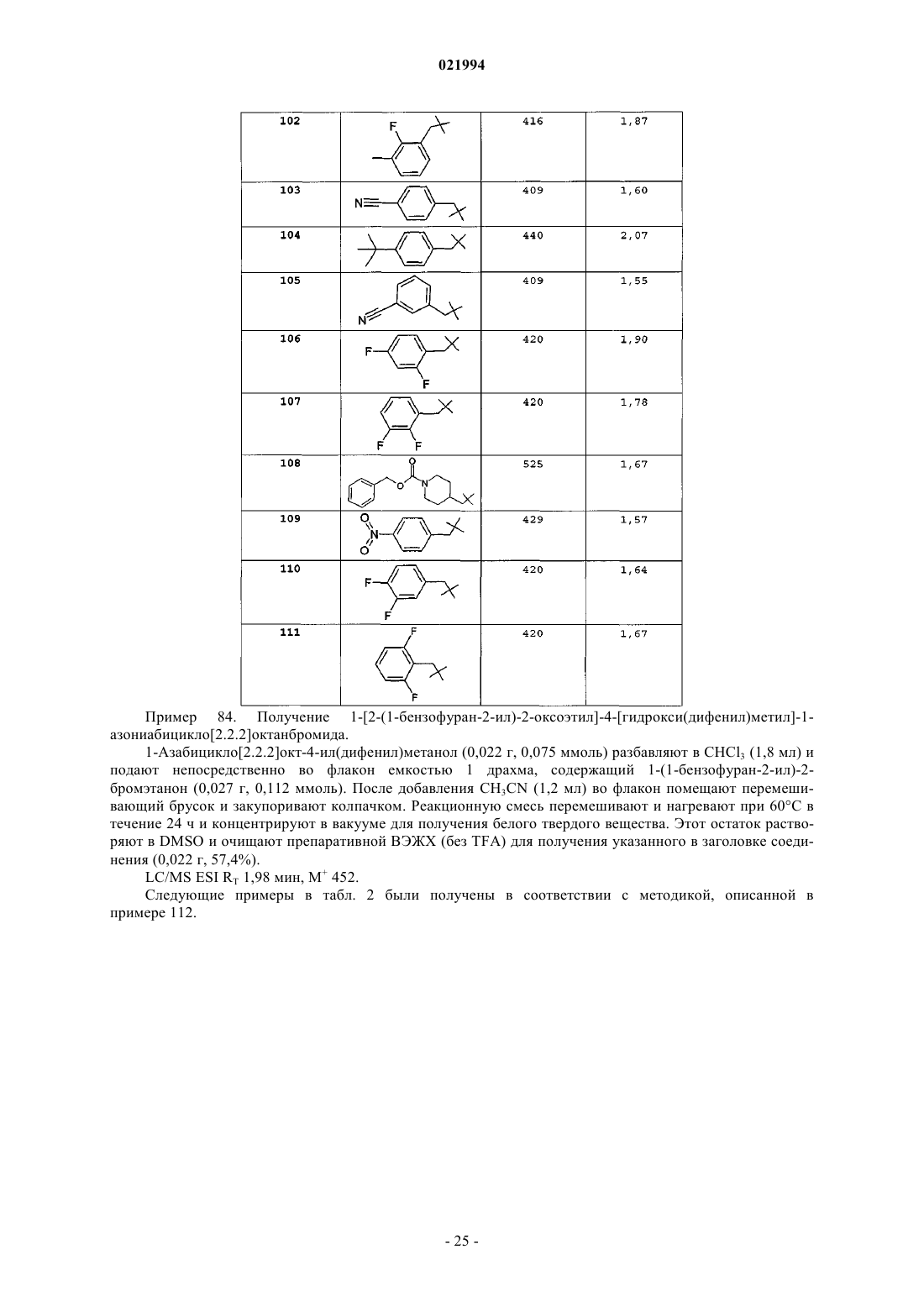
3. Соединение по п.1, выбранное из группы, включающей:
1-(2-{[(3-фторфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-бромфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-хлорфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[бис-(4-фторфенил)(гидрокси)метил]-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
4-{гидрокси[бис-(3-метилфенил)]метил}-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид;
1-(2-{[(4-фторфенил)метил]окси}этил)-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид;
4-[гидрокси(дифенил)метил]-1-{2-[(фенилкарбонил)окси]этил}-1-азониабицикло[2.2.2]октанбромид.
4. Фармацевтическая композиция для лечения заболеваний, опосредованных мускариновыми рецепторами ацетилхолина, содержащая соединение по п.1 и его фармацевтически приемлемый носитель.
5. Применение соединения по любому из пп.1-3 для лечения заболеваний, опосредованных мускариновыми рецепторами ацетилхолина, где ацетилхолин связывается с указанным рецептором.
6. Применение по п.5, где заболевание представляет собой хроническое обструктивное легочное заболевание.
7. Применение по п.5, где заболевание представляет собой астму.
Текст
(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB)R3 независимо выбирают из группы, состоящей изL независимо выбирают из группы, состоящей из водорода, галогена, С 1-С 4-алкила, галоидзамещенного С 1-С 4-алкила, гидроксизамещенного С 1-С 4-алкила и С 1-С 4-алкокси; R4 и R5 независимо выбирают из группы, состоящей из водорода, галогена, С 1-С 4-алкила, арила, С 1-С 4-алкиларила, циано, нитро, (CR7R7)pORb,(CR7R7)pNRbRb, или R4 и R5 вместе могут образовывать 5-6-членное насыщенное или ненасыщенное кольцо; m представляет собой целое число, имеющее значение от 1 до 5; t равно 0, 1 или 2; p равно 0, 1 или 2; R6 выбирают из группы, состоящей из водорода, С 1-С 4-алкила; Rb выбирают из группы,состоящей из водорода, С 1-С 4-алкила и арил-С 1-С 4-алкила; R7 выбирают из группы, состоящей из водорода и С 1-С 4-алкила; X представляет собой физиологически приемлемый анион, такой как хлорид, бромид, йодид,гидроксид, сульфат, нитрат, фосфат, ацетат, трифторацетат, фумарат, цитрат, тартрат, оксалат, сукцинат,манделат, метансульфонат и п-толуолсульфонат; где арил представляет собой фенил или нафтил; при условии,что соединение формулы (I) не включает 4-[гидрокси(дифенил)метил]-1-2-[(фенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромид. Изобретение также относится к фармацевтической композиции,содержащей указанное соединение, и к его применению для лечения заболеваний, опосредованных мускариновыми рецепторами ацетилхолина, где ацетилхолин связывается с указанным рецептором. Область изобретения Изобретение относится к новым производным хинуклидинов, фармацевтическим композициям и их применению для лечения заболеваний дыхательных путей, опосредованных мускариновыми рецепторами ацетилхолина. Предпосылки изобретения Ацетилхолин, высвобождаемый из холинергических нейронов в периферической и центральной нервных системах, воздействует на многие различные биологические процессы посредством взаимодействия с двумя основными классами рецепторов ацетилхолина - никотиновыми и мускариновыми рецепторами ацетилхолина. Мускариновые рецепторы ацетилхолина (mAChRs) относятся к суперсемейству рецепторов, соединенных с белком G, которые имеют семь трансмембранных доменов. Существуют пять подтипов mAChRs, именуемых M1-M5, и каждый из них представляет собой продукт определенного гена. Каждый из этих пяти подтипов проявляет уникальные фармакологические свойства. Мускариновые рецепторы ацетилхолина широко распределены в органах позвоночных, где они опосредуют многие из жизненно важных функций. Мускариновые рецепторы могут опосредовать и ингибирующие, и возбуждающие действия. Например, в гладкой мускулатуре, обнаруживаемой в дыхательных путях, M3 mAChRs опосредуют сократительные реакции (обзор представлен в публикации Caulfield (1993, Pharmac. Ther. 58:319-79. В легких локализация mAChRs была определена в гладких мышцах в трахее и бронхах, подслизистых железах и парасимпатических ганглиях. Плотность мускариновых рецепторов самая высокая в парасимпатических ганглиях, и затем их плотность уменьшается от подслизистых желез к гладкой мускулатуре трахеи и бронхов. Мускариновые рецепторы почти отсутствуют в альвеолах. Обзор экспрессии и функции mAChRs в легких представлен в публикации Fryer and Jacoby (1998, Am. J. Respir. Crit. CareMed. 158 (5, pt. 3), p. 154-60. Три подтипа mAChRs были идентифицированы как важные в легких, M1, M2 и М 3 mAChRs. M3mAChRs, локализующиеся на гладких мышцах дыхательных путей, опосредуют мышечное сокращение. Стимуляция М 3 mAChRs активирует фермент фосфатазу С через связывание стимулирующего белка GGq/11 (Gs), приводя к освобождению фосфатидил инозитол-4,5-бисфосфата, приводя к фосфорилированию сократительных белков. М 3 mAChRs также обнаруживаются на легочных подслизистых железах. Стимуляция этой популяции М 3 mAChRs приводит к секреции слизи. М 2 mAChRs составляют приблизительно 50-80% популяции холинергических рецепторов на гладких мышцах дыхательных путей. Хотя их точная функция еще неизвестна, они ингибируют катехоламинергическое расслабление мышц дыхательных путей через ингибирование генерирования цАМФ. Нейронные М 2 mAChRs локализуются на постганглионарных парасимпатических нервах. В нормальных физиологических условиях нейронные М 2 mAChRs обеспечивают жесткий контроль высвобождения ацетилхолина из парасимпатических нервов. Ингибиторные М 2 mAChRs были также продемонстрированы на симпатических нервах в легких некоторых видов. Эти рецепторы ингибируют высвобождение норадреналина, таким образом уменьшая входящую в легкие симпатическую импульсацию.M1 mAChRs обнаруживаются в легочных парасимпатических ганглиях, где они функционируют для усиления нейропередачи. Локализация этих рецепторов была также установлена в периферической легочной паренхиме, однако их функция в паренхиме неизвестна. Дисфункция мускариновых рецепторов ацетилхолина в легких была отмечена при множестве различных патофизиологических состояний. В частности, при астме и хроническом обструктивном легочном заболевании (COPD) воспалительные состояния приводят к потере ингибиторной функции М 2 мускариновых ауторецепторов ацетилхолина на парасимпатических нервах, снабжающих легочную гладкую мускулатуру, вызывая увеличенное высвобождение ацетилхолина после стимуляции блуждающих нервов (Fryer et al. 1999, Life Sci. 64 (6-7), 449-55). Эта дисфункция mAChR приводит к гиперреактивности и гиперреагированию дыхательных путей, опосредованных увеличенной стимуляции М 3 mAChRs. Таким образом, идентификация сильнодействующих антагонистов mAChRs была бы полезна с учетом возможности их применения в качестве лечебных средств при этих патологических состояниях, опосредованныхCOPD представляет собой неточный термин, который охватывает разнообразные прогрессирующие медицинские проблемы, включая хронический бронхит, хронический бронхиолит и эмфизему, и оно является основной причиной смертности и заболеваемости в мире. Курение представляет собой основной фактор риска развития COPD; только в США сигареты курят около 50 млн. людей, и, по оценкам, ежедневно 3000 людей приобретают эту привычку. В результате ожидается, что к 2020 г. COPD станет одной из пяти главных проблем здравоохранения во всем мире. Ингаляционная антихолинергическая терапия в настоящее время считается "золотым стандартом" в качестве терапии первой линии по поводуCOPD (Pauwels et al. 2001, Am. J. Respir. Crit. Care Med. 163:1256-1276). Несмотря на большое количество доказательств в поддержку применения антихолинергической терапии для лечения заболеваний, связанных с гиперреактивностью дыхательных путей, имеется сравнительно немного антихолинергических соединений для применения в клинике по поводу легочных показаний. Конкретнее, в США ипратропий бромид (Atrovent и Combivent в комбинации с албутеролом) представляет собой единственный имеющийся в продаже ингаляционный антихолинергический препарат для лечения заболеваний, связанных с гиперреактивностью дыхательных путей. Хотя это соединение представляет собой сильнодействующее антимускариновое средство, оно характеризуется коротким действием, и, таким образом, его необходимо вводить до четырех раз в сутки для обеспечения облегчения у пациента с COPD. В Европе и Азии недавно был допущен к применению длительно действующий антихолинергический препарат тиотропий бромид (Spiriva), однако в США этот продукт в настоящее время недоступен. Таким образом, остается необходимость в новых соединениях, которые способны вызвать блокаду mAChRs, имеют длительное действие и могут вводиться 1 раз/день, для лечения заболеваний,связанных с гиперреактивностью дыхательных путей, таких как астма и COPD. Поскольку mAChRs широко распределены по всему организму, возможность наносить антихолинергические средства локально и/или местно в дыхательные пути имеет особые преимущества, поскольку они бы обеспечили возможность использования более низких доз препарата. Кроме того, возможность создания топически активных препаратов, которые имеют большую длительность действия и, в частности, удерживаются или у рецептора, или легкими, позволила бы избежать нежелательных побочных эффектов, которые могут наблюдаться при системном применении антихолинергических средств. Краткое изложение сущности изобретения Настоящее изобретение предоставляет новые соединения формулы (I) и фармацевтические композиции, включающие соединение формулы (I) и фармацевтический носитель или разбавитель. Соединения формулы (I), которые можно применять в настоящем изобретении, представлены структурой:R2 и R3 независимо выбирают из группы, состоящей из:F, G, Н, K и L независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, галоидзамещенного C1-C4-алкила, гидроксизамещенного C1-C4-алкила и C1-C4-алкокси;R4 и R5 независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, арила,C1-C4 алкиларила, циано, нитро, (CR7R7)pORb, (CR7R7)pNRbRb, или R4 и R5 вместе могут образовывать 5-6-членное насыщенное или ненасыщенное кольцо;m представляет собой целое число, имеющее значение от 1 до 5;R7 выбирают из группы, состоящей из водорода и C1-C4-алкила;X представляет собой физиологически приемлемый анион, такой как хлорид, бромид, йодид, гидроксид, сульфат, нитрат, фосфат, ацетат, трифторацетат, фумарат, цитрат, тартрат, оксалат, сукцинат,манделат, метансульфонат и п-толуолсульфонат; арил представляет собой фенил или нафтил,при условии, что соединение формулы (I) не включает 4-[гидрокси(дифенил)метил]-1-2[(фенилметил)окси]этил-1-азониабицикло[2.2.2]октанбромид. Подробное описание изобретения Настоящее изобретение относится к новым соединениям биарил-8-азониабицикло[3.2.1]октана,фармацевтическим композициям и их применению для лечения заболеваний, опосредованных mAChR. В предпочтительном варианте осуществления настоящего изобретения соединение имеет формулу (I)R2 и R3 независимо выбирают из группы, состоящей из:F, G, Н, K и L независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, галоидзамещенного C1-C4-алкила, гидроксизамещенного C1-C4-алкила и C1-C4-алкокси;R4 и R5 независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, арила,C1-C4-алкиларила, циано, нитро, (CR7R7)pORb, (CR7R7)pNRbRb, или R4 и R5 вместе могут образовывать 5-6-членное насыщенное или ненасыщенное кольцо;m представляет собой целое число, имеющее значение от 1 до 5;R7 выбирают из группы, состоящей из водорода и C1-C4-алкила;X представляет собой физиологически приемлемый анион, такой как хлорид, бромид, йодид, гидроксид, сульфат, нитрат, фосфат, ацетат, трифторацетат, фумарат, цитрат, тартрат, оксалат, сукцинат,манделат, метансульфонат и п-толуолсульфонат; арил представляет собой фенил или нафтил,при условии, что соединение формулы (I) не включает 4-[гидрокси(дифенил)метил]-1-2[(фенилметил)окси]этил-1-азониабицикло[2.2.2]октанбромид. В изобретении используются следующие термины. Термин "галоид" относится ко всем галогенам, т.е. хлор-, фтор-, бром- и йод-. Термин "C1-C10-алкил" или "алкил" относится как к прямым, так и к разветвленноцепочечным фрагментам из 1-10 атомов углерода, причем длина цепи иначе не ограничена, включая, но не ограничиваясь, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил и им подобные. Термин "арил" относится к фенилу и нафтилу. Иллюстративные соединения формулы (I) включают: Способы получения Соединения формулы (I) могут быть получены применением синтетических методик, некоторые из которых проиллюстрированы ниже на схемах. Синтез, представленный на этой схеме, применим для получения соединений формулы (I), имеющих варианты различных групп R1, R2 и R3, которые взаимодействуют с использованием заместителей, которые подходящим образом защищены, для достижения совместимости с описанными здесь реакциями. Последующее снятие защиты в указанных случаях дает затем соединения раскрытой природы. Хотя схемы показаны только с соединениями формулы (I), это сделано только с целью иллюстрации. Как показано на схеме 1, желательные соединения формулы (I) могут быть получены в 4 стадии синтеза из имеющегося в продаже предшественника 1 этил-4-пиперидинкарбоксилата. Соединение 1 взаимодействует с 1-бром-2-хлорэтаном в соответствии со стандартными методиками алкилирования,хорошо известными в данной области, таким как карбонат калия в ацетоне, с последующим взаимодействием промежуточного соединения с диизопропиламидом лития в апротонном растворителе, таком как тетрагидрофуран, для получения промежуточного хинуклидинового соединения 2. Конденсация соединения 2 с металлоорганическими реагентами, такими как реагент Гриньяра, или литийорганическое производное в апротонном растворителе, таком как тетрагидрофуран, приводит к образованию третичного спирта 3 формулы (I) (R1 отсутствует). Далее N-алкилирование соединения 3 подходящим алкилгалидом в органическом растворителе, таком как хлороформ или ацетонитрил, дает соединение 4 формулы (I) (R1 присутствует). Схема 1 Примеры синтеза Изобретение будет описано со ссылкой на следующие примеры, которые являются просто иллюстративными, и их не следует рассматривать как ограничение объема настоящего изобретения. Все величины температуры даны в C. Тонкослойную хроматографию (t.l.c.) проводили на диоксиде кремния и колоночную хроматографию - на диоксиде кремния (при отсутствии других указаний, колоночную флэш-хроматографию с использованием Merck 9385). Ниже представлены экспериментальные условия для LC-MS (жидкостной хроматографии - масс спектрометрии). Экспериментальные условия LC-MS. Жидкостный хроматограф: Препаративную ВЭЖХ проводили, используя систему ВЭЖХ Gilson в следующих условиях: Колонка: 75 внутренний диаметр 33 мм, S-5 мкм, 12 нм. Скорость потока: 30 мл/мин. Объем инжекции: 0,800 мл. Комнатная температура. Растворитель А: вода. Растворитель В: ацетонитрил. Все используемые здесь растворители имеют самую высокую имеющуюся чистоту и, пока нет других указаний, все реакции проводят в безводных условиях в воздушной атмосфере. Пример 1. Получение 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола. Этил-1-(2-хлорэтил)-4-пиперидинкарбоксилат. К раствору этилнипекотата (20,0 мл, 130 ммоль) в ацетоне (180 мл) добавляют 1-бром-2-хлорэтан(21,6 мл, 260 ммоль) с последующим добавлением безводного K2CO3 (27,12 г, 196 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О (75 мл) и экстрагируют Et2O. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме. Очистка неочищенного остатка флэш-хроматографией (50% Et2O/50% гексан) на силикагеле дает указанное в заголовке соединение (10,99 г, 38,6%).EI-MS m/z 220 (M+H+), Rt (1,20 мин). Этил-1-азабицикло[2.2.2]октан-4-карбоксилат. Раствор этил-1-(2-хлорэтил)-4-пиперидинкарбоксилата (20,42 г, 92,9 ммоль) в THF (600 мл) охлаждают до -50 С в атмосфере Ar. LDA (2,0 М в гептан/THF/этилбензоле, 70 мл, 140 ммоль) медленно добавляют к раствору при -50 С в течение 25 мин. Реакционной смеси дают возможность согреться до комнатной температуры в течение 16 ч. Реакцию гасят K2CO3 (насыщенным водным) (500 мл) и экстрагируют Et2O (3500 мл). Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме. Полученное оранжевое масло совместно выпаривают 3 раза с DCM (дихлорметаном) для удаления избыточного этилбензола, что приводит к получению указанного в заголовке соединения (16,29 г,95,7%). 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол. Раствор фениллития (1,5-1,7 М в 70 циклогексана/30 простого эфира, 20,0 мл, 32 ммоль) охлаждают до -30 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (1,51 г, 8,23 ммоль) в THF (20 мл) медленно добавляют к реакционной смеси при -30 С в течение 25 мин. Реакционной смеси дают возможность согреться до комнатной температуры в течение 16 ч. Реакцию гасят H2O и затем выпаривают до сухости в вакууме. Добавляют H2O и EtOAc, вызывая выпадение белого твердого вещества. Это твердое вещество отфильтровывают для получения указанного в заголовке соединения (0,79 г). Водную фазу дополнительно экстрагируют EtOAc, объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме. Полученный неочищенный продукт обрабатывают EtOAc и гексаном и фильтруют для выхода дополнительного количества указанного в заголовке соединения (0,67 г). Общий выходCH3CN/DCM/MeOH (2 мл/2 мл/1 мл) добавляют (2-бромэтил)бензол (0,38 мл, 2,78 ммоль). Раствору дают возможность перемешиваться при комнатной температуре в течение 4 дней и затем концентрируют в вакууме для получения белого твердого вещества. Этот осадок растворяют в DMSO (диметилсульфоксиде) и очищают препаративной ВЭЖХ для получения указанного в заголовке соединения (0,0612 г,48,6%).EI-MS m/z 398 (M+), Rt (2,06 мин). Пример 3. Получение 4-[гидрокси(дифенил)метил]-1-[2-(фенилокси)этил]-1 азониабицикло[2.2.2]октанбромида. Общая методика образования соли без очистки ВЭЖХ. К раствору 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0550 г, 0,187 ммоль) в 2 CH3CN/3CHCl3 (2,5 мл) добавляют простой 2-бромэтилфенилэфир (0,060 г, 0,29 ммоль). Раствор перемешивают при 60 С в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и затем разбавляют этилацетатом и гексаном, вызывая выпадение твердого вещества из раствора. Это твердое вещество отфильтровывают и промывают гексаном для получения указанного в заголовке соединения (0,063 г,67,6%).EI-MS m/z 414 (M+), Rt (1,94 мин). Пример 4. Получение 1-(циклопропилметил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Общая методика образования соли без очистки ВЭЖХ. К раствору 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0552 г, 0,188 ммоль) в 2 CH3CN/3CHCl3 (2,5 мл) добавляют (бромэтил)циклопропан (0,025 г, 0,257 ммоль). Раствор перемешивают при 60 С в течение 16 ч, охлаждают до комнатной температуры и растворители выпаривают в вакууме. Остаток собирают в 2,5 мл DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (0,0319 г, 39,9%).(0,0487 г, 0,245 ммоль) в 2 CH3CN/3 CHCl3 (2,5 мл) для получения желаемого продукта (0,0410 г, 43%).(0,045 г,0,153 ммоль) и простого 3-бромпропилфенилэфира (0,035 г, 0,222 ммоль) в 2 CH3CN/3 CHCl3 (3 мл) для получения желаемого продукта (0,0662 г, 86%).(0,0604 г,0,206 ммоль) и простого 4-бромбутилфенилэфира (0,106 г, 0,463 ммоль) в 2 CH3CN/3 CHCl3 (5,0 мл) для получения желаемого продукта (0,0649 г, 64,9%).(0,0696 г,0,237 ммоль) и 2-[(2-бромэтил)окситетрагидро-2 Н-пирана (0,080 г, 0,529 ммоль) в 2 CH3CN/3 CHCl3 (5,0 мл) для получения желаемого продукта (0,0348 г, 31,6%).(0,0646 г,0,220 ммоль) и простого 4-бромбутилфенилметилэфира (0,090 г, 0,472 ммоль) в 2 CH3CN/3 CHCl3 (5,0 мл) для получения желаемого продукта (0,0531 г, 48,3%).(0,0677 г,0,231 ммоль) и простого 3-бромпропилфенилметилэфира (0,070 г, 0,396 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0663 г, 55,2%).EI-MS m/z 442 (M+), Rt (2,23 мин). Пример 11. Получение 1-2-[(2,4-дибромфенил)окси]этил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 4, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0557 г, 0,190 ммоль) и простого 2-бромэтил-2,4 дибромфенилэфира (0,110 г, 0,306 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 572 (M+), Rt (2,26 мин). Пример 12. Получение 1-(3-бромпропил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0979 г, 0,334 ммоль) и 1,3-дибромпропана (0,35 мл,3,448 ммоль) в 2 CH3CN/3 CHCl3 (15,0 мл) для получения желаемого продукта (0,0712 г, 43,1%).EI-MS m/z 415 (M+), Rt (1,79 мин). Пример 13. Получение 4-[гидрокси(дифенил)метил]-1-(тетрагидро-2 Н-пиран-2-илметил)-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 4, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0677 г, 0,231 ммоль) и 3-(бромметил)тетрагидро-2 Нпирана (0,050 мл, 0,390 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0508 г,50,8%).(0,040 мл, 0,386 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0112 г, 12,4%).EI-MS m/z 380 (M+), Rt (1,64 мин). Пример 15. Получение 1-этил-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0581 г, 0,198 ммоль) и бромэтана (0,030 мл,0,402 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0434 г, 54,9%).EI-MS m/z 322 (M+), Rt (1,56 мин). Пример 16. Получение 4-[гидрокси(дифенил)метил]-1-нонил-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 4, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0561 г, 0,191 ммоль) и 1-бромнонана (0,055 мл,0,288 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0435 г, 45,8%).EI-MS m/z 420 (M+), Rt (2,34 мин). Пример 17. Получение 4-[гидрокси(дифенил)метил]-1-(4-пентен-1-ил)-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0608 г, 0,207 ммоль) и 5-бром-1-пентена (0,045 мл,0,380 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0806 г, 88,6%).EI-MS m/z 362 (M+), Rt (1,88 мин). Пример 18. Получение 4-[гидрокси(дифенил)метил]-1-(2-гидроксиэтил)-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0638 г, 0,217 ммоль) и 2-бромэтанола (0,035 мл,0,494 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0541 г, 60,1%).EI-MS m/z 338 (M+), Rt (1,42 мин). Пример 19. Получение 1-(5-гексен-1-ил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0637 г, 0,217 ммоль) и 6-бром-1-гексена (0,050 мл,0,373 ммоль) в 2 CH3CN/3 CHCl3 (5,0 мл) для получения желаемого продукта (0,0664 г, 67,1%).EI-MS m/z 376 (M+), Rt (1,90 мин). Пример 20. Получение 4-[гидрокси(дифенил)метил]-1-метил-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0638 г, 0,217 ммоль) и бромметана (2,0 М в простом т-бутилметилэфире, 0,250 мл, 0,500 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта(0,0597 г,0,203 ммоль) и простого 2-бромэтилметилэфира (0,030 мл, 0,319 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0372 г, 42,8%).EI-MS m/z 352 (M+), Rt (1,69 мин). Пример 22. Получение 1-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-4[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0916 г, 0,312 ммоль) и 2-(2-бромэтил)-1 Н-изоиндол 1,3(2 Н)-диона (0,130 г, 0,512 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 467 (M+), Rt (1,91 мин). Пример 23. Получение 1-[3-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)пропил]-4[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0861 г, 0,293 ммоль) и 2-(3-бромпропил)-1 Н-изоиндол 1,3(2 Н)-диона (0,118 г, 0,440 ммоль) в 2 CH3CN/3 CHCl3 (5,0 мл) для получения желаемого продукта(0,050 мл, 0,329 ммоль) в 2 CH3CN/3 CHCl3 (5,0 мл) для получения желаемого продукта (0,0722 г, 72,2%).(0,0665 г,0,227 ммоль) и 1-бром-2-[2-(метилокси)этил]оксиэтана (0,055 мл, 0,405 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0843 г, 78,8%).EI-MS m/z 396 (M+), Rt (1,64 мин). Пример 26. Получение 1-[4-(этилокси)-4-оксобутил]-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 4, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0679 г, 0,231 ммоль) и этил-4-бромбутаноата (0,055 мл,0,524 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0637 г, 57,9%). реакционной смеси в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры в течение 16 ч. Реакцию гасят водой и затем выпаривают до сухости. Добавляют H2O иDCM, вызывая выпадение светло-коричневого твердого вещества. Это твердое вещество отфильтровывают для получения указанного в заголовке соединения (0,4161 г, 59,5%).(0,0693 г,0,227 ммоль) и простого 2-бромэтилфенилэфира (0,056 г, 0,279 ммоль) в 1 MeOH/1 CHCl3 (3 мл) для получения желаемого продукта (0,0822 г, 74,7%).(0,0578 г,0,189 ммоль) и простого 3-бромпропилфенилэфира (0,033 мл, 0,209 ммоль) в 1 MeOH/1 CHCl3 (4 мл) для получения желаемого продукта (0,0448 г, 45,4%).(0,050 мл, 0,366 ммоль) в 1 MeOH/1 CHCl3 (4 мл) для получения желаемого продукта (0,0514 г, 48,9%).(0,070 мл, 0,460 ммоль) в 1 MeOH/1 CHCl3 (4 мл) для получения желаемого продукта (0,0685 г, 62,3%).EI-MS m/z 424 (M+), Rt (1,97 мин). Пример 32. Получение 1-бутил-4-[гидрокси(ди-3-тиенил)метил]-1 азониабицикло[2.2.2]октанбромида. Раствор н-бутиллития (2,5 М в гексанах, 5,0 мл, 12,5 ммоль) охлаждают до -78 С в атмосфере Ar. 3-Бромтиофен (1,15 мл, 12,3 ммоль), растворенный в простом этиловом эфире (4 мл), медленно добавляют к реакционной смеси. Реакционную смесь перемешивают в течение 30 мин и затем добавляют этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,7640 г, 4,16 ммоль) в THF/Et2O (4 мл/4 мл). Реакционной смеси дают возможность нагреться с -78 С до комнатной температуры в течение 16 ч, затем медленно гасят водой. Реакционную смесь концентрируют и полученное коричневое твердое вещество собирают в воду и DCM. Органическую фазу отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме для получения коричневого твердого вещества. Твердое вещество растворяют в DMSO и очищают препаративной ВЭЖХ для получения указанного в заголовке соединения (0,1736 г, 9,4%).EI-MS m/z 362 (M+), Rt (1,73 мин). Пример 33. Получение 1-азабицикло[2.2.2]окт-4-ил(ди-3-тиенил)метанола. Раствор т-бутиллития (1,7 М в пентанах, 5,8 мл, 9,86 ммоль) охлаждают до -78 С в атмосфере Ar. 3-Бромтиофен (0,46 мл, 4,90 ммоль), растворенный в THF (4 мл), медленно добавляют к реакционной смеси в течение 6 мин. Реакционную смесь перемешивают в течение 30 мин и затем добавляют этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,3132 г, 1,71 ммоль) в THF (4 мл). Реакционной смеси дают возможность нагреться с -78 С до комнатной температуры в течение 16 ч. Через 14 ч реакцию медленно гасят водой. Добавляют EtOAc, вызывая выпадение серого твердого вещества. Твердое вещество отфильтровывают для получения указанного в заголовке соединения (0,3375 г, 64,6%).(0,0787 г,0,258 ммоль) и простого 2-бромэтилфенилэфира (0,0839 г, 0,417 ммоль) в 2 MeOH/3 CHCl3/2 CH3CN (5,0 мл) для получения желаемого продукта (0,0709 г, 54,5%).(0,0808 г,0,264 ммоль) и простого 3-бромпропилфенилэфира (0,070 г, 0,444 ммоль) в 2 MeOH/3 CHCl3/2 CH3CN (5,0 мл) для получения желаемого продукта (0,0613 г, 44,7%).EI-MS m/z 440 (M+), Rt (2,05 мин). Пример 36. Получение 1-бутил-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0496 г, 0,169 ммоль) и 1-бромбутана (0,030 мл,0,279 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0509 г, 70,7%).EI-MS m/z 350 (M+), Rt (1,83 мин). Пример 37. Получение 1-гексил-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0498 г, 0,170 ммоль) и 1-бромгексана (0,040 мл,0,285 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0562 г, 73%).EI-MS m/z 378 (M+), Rt (2,09 мин). Пример 38. Получение 4-[гидрокси(дифенил)метил]-1-пропил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0518 г, 0,176 ммоль) и 1-бромпропана (0,030 мл,0,330 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0548 г, 75,1%).EI-MS m/z 336 (M+), Rt (1,97 мин). Пример 39. Получение 4-[гидрокси(дифенил)метил]-1-(3-[2-(метилокси)фенил]оксипропил)-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0467 г, 0,159 ммоль) и 1-[(3-бромпропил)окси]-2(метилокси)бензола (0,0541 г, 0,221 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта(0,0547 г, 0,236 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0675 г, 75%).EI-MS m/z 444 (M+), Rt (1,91 мин). Пример 41. Получение 4-[гидрокси(дифенил)метил]-1-[3-(2-нафталенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0472 г, 0,160 ммоль) и простого 3-бромпропил-2 нафталенилэфира (0,0618 г, 0,233 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 478 (M+), Rt (2,22 мин). Пример 42. Получение 1-3-[(3-хлорфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0479 г, 0,163 ммоль) и простого 3-бромпропил-3 хлорфенилэфира (0,0552 г, 0,221 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 462 (M+), Rt (2,17 мин). Пример 43. Получение 1-3-[(4-бромфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0486 г, 0,165 ммоль) и простого 4-бромфенил-3 бромпропилэфира (0,0630 г, 0,214 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 506 (M+), Rt (2,18 мин). Пример 44. Получение 4-[гидрокси(дифенил)метил]-1-3-[(4-нитрофенил)окси]пропил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0468 г, 0,159 ммоль) и простого 3-бромпропил-4 нитрофенилэфира (0,0550 г, 0,211 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта Пример 45. Получение 4-[гидрокси(дифенил)метил]-1-[3-(2-[(фенилметил)окси]фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0492 г, 0,168 ммоль) и 1-[(3-бромпропил)окси]-2[(фенилметил)окси]бензола (0,0706 г, 0,220 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0735 г, 71,4%).EI-MS m/z 533 (M+), Rt (2,25 мин). Пример 46. Получение 1-3-[(2-бромфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0472 г, 0,161 ммоль) и простого 2-бромфенил-3 бромпропилэфира (0,0648 г, 0,220 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 507 (M+), Rt (2,18 мин). Пример 47. Получение 4-[гидрокси(дифенил)метил]-1-[3-(4-[(фенилметил)окси]фенилокси)пропил]-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0479 г, 0,163 ммоль) и 1-[(3-бромпропил)окси]-4[(фенилметил)окси]бензола (0,0730 г, 0,227 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0833 г, 83,3%).(0,0632 г,0,215 ммоль) и простого 3-бромпропилметилэфира (0,0461 г, 0,301 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0826 г, 83,3%).EI-MS m/z 366 (M+), Rt (1,55 мин). Пример 49. Получение 4-[гидрокси(дифенил)метил]-1-(2-пропен-1-ил)-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0577 г, 0,197 ммоль) и 3-бром-1-пропена (0,025 мл,0,289 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0646 г, 79,8%).EI-MS m/z 334 (M+), Rt (1,54 мин). Пример 50. Получение 4-[гидрокси(дифенил)метил]-1-(3-[4-(метилокси)фенил]оксипропил)-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1 азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0483 г, 0,164 ммоль) и 1-[(3-бромпропил)окси]-4(метилокси)бензола (0,052 мл, 0,21 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 458 (M+), Rt (2,03 мин). Пример 51. Получение [1-(2-аминоэтил)-1-азониабицикло[2.2.2]окт-4-ил](дифенил)метанолаттрифторацетата. К раствору 1-[2-(1,3-диоксио-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида (0,078 г, 0,142 ммоль) в EtOH (4 мл) добавляют гидразин (0,25 мл. 7,96 ммоль). Раствор перемешивают при комнатной температуре в течение 16 ч и затем фильтруют. Фильтрат концентрируют и собирают в 2,5 мл DMSO и очищают препаративной ВЭЖХ (с TFA) для получения указанного в заголовке соединения (0,0200 г, 31,2%).EI-MS m/z 338 (M+), Rt (1,28 мин). Пример 52. Получение 4-[бис-(4-фторфенил)(гидрокси)метил]-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил[бис-(4-фторфенил)]метанол. Раствор 4-фторфенилмагнийбромида (1,0 М в THF, 4,4 мл, 4,4 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1973 г, 1,08 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане и гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,3152 г, 88,9%). 4-[бис-(4-Фторфенил)(гидрокси)метил]-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(4-фторфенил)]метанола (0,0538 г, 0,163 ммоль) и простого 3-бромпропилфенилэфира (0,0386 мл, 0,245 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,058 г, 65,2%).EI-MS m/z 464 (M+), Rt (2,16 мин). Пример 53. Получение 4-[бис-(4-фторфенил)(гидрокси)метил]-1-2-[(фенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(4-фторфенил)]метанола (0,0489 г, 0,148 ммоль) и простого 2-бромэтилфенилметилэфира (0,0352 мл, 0,222 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0534 г, 66,1%).EI-MS m/z 464 (M+), Rt (1,99 мин). Пример 54. Получение 4-(гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил[бис-[3-(метилокси)фенил]метанол. Раствор 3-(метилокси)фенилмагнийбромида (0,5 М в THF, 3,3 мл, 3,3 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1608 г, 0,877 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане, гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,2881 г, 92,9%).EI-MS m/z 354 (M+H+), Rt (1,46 мин). 4-(Гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-илбис-[3-(метилокси)фенил]метанола (0,0506 г, 0,143 ммоль) и простого 3-бромпропилфенилэфира (0,0338 мл, 0,214 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,027 г, 33,2%).EI-MS m/z 488 (M+), Rt (2,02 мин). Пример 55. Получение 4-(гидроксибис-[3-(метилокси)фенил]метил)-1-2[(фенилметил)окси]этил-1-азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-илбис-[3-(метилокси)фенил]метанола (0,0538 г, 0,152 ммоль) и простого 2-бромэтилфенилметилэфира (0,0361 мл, 0,228 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0292 г, 33,8%).EI-MS m/z 488 (M+), Rt (2,03 мин). Пример 56. Получение 4-(гидроксибис-[4-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-илбис-[4-(метилокси)фенил]метанол. Раствор 4-(метилокси)фенилмагнийбромида (0,5 М в THF, 6,5 мл, 3,25 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1587 г, 0,866 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане, гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,273 г, 89%).EI-MS m/z 354 (M+H+), Rt (1,74 мин). 4-(Гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-илбис-[4-(метилокси)фенил]метанола (0,0525 г, 0,148 ммоль) и простого 3-бромпропилфенилэфира (0,0351 мл, 0,222 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0515 г, 61%).EI-MS m/z 488 (M+), Rt (1,94 мин). Пример 58. Получение 4-[бис-(3-фторфенил)(гидрокси)метил]-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил[бис-(3-фторфенил)]метанол. Раствор 3-фторфенилмагнийбромида (1,0 М в THF, 3,3 мл, 3,3 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1756 г, 0,958 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане, гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,242 г, 76,7%).EI-MS m/z 330 (M+H+), Rt (1,45 мин). 4-(Гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(3-(фторфенил)]метанола (0,0515 г, 0,156 ммоль) и простого 3-бромпропилфенилэфира (0,0370 мл, 0,234 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0381 г, 61%).EI-MS m/z 464 (M+), Rt (2,01 мин). Пример 59. Получение 4-[бис-(3-фторфенил)(гидрокси)метил]-1-2-[(фенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(3-фторфенил)]метанола (0,0507 г, 0,154 ммоль) и простого 2-бромэтилфенилметилэфира (0,0365 мл, 0,230 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0362 г, 43,2%).EI-MS m/z 464 (M+), Rt (2,02 мин). Пример 60. Получение 4-гидрокси[бис-(3-метилфенил)]метил-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил[бис-(3-метилфенил)]метанол. Раствор 3-метилфенилмагнийбромида (1,0 М в THF, 3,3 мл, 3,3 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1484 г, 0,810 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане, гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,1806 г, 69,4%).EI-MS m/z 322 (M+H+), Rt (1,54 мин). 4-(Гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(3-(метилфенил)]метанола (0,0487 г, 0,151 ммоль) и простого 3-бромпропилфенилэфира (0,0358 мл, 0,227 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0284 г, 34,9%).EI-MS m/z 456 (M+), Rt (2,14 мин). Пример 61. Получение 4-гидрокси[бис-(3-метилфенил)]метил-1-2-[(фенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 4, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(3-метилфенил)]метанола (0,0496 г, 0,154 ммоль) и простого 2-бромэтилфенилметилэфира (0,0364 мл, 0,230 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0091 г, 11%).EI-MS m/z 456 (M+), Rt (2,20 мин). Пример 62. Получение 4-гидрокси[бис-(4-метилфенил)]метил-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил[бис-(4-метилфенил)]метанол. Раствор 4-метилфенилмагнийбромида (1,0 М в THF, 3,3 мл, 3,3 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1509 г, 0,823 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане, гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,2291 г, 86,6%).EI-MS m/z 322 (M+H+), Rt (1,57 мин). 4-(Гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(4-(метилфенил)]метанола (0,0618 г, 0,192 ммоль) и простого 3-бромпропилфенилэфира (0,0454 мл, 0,228 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0427 г, 41,5%).EI-MS m/z 456 (M+), Rt (1,99 мин). Пример 63. Получение 4-гидрокси[бис-(4-метилфенил)]метил-1-2-[(фенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил[бис-(4-метилфенил)]метанола (0,0525 г, 0,163 ммоль) и простого 2-бромэтилфенилметилэфира (0,0387 мл, 0,245 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0465 г, 53,1%).EI-MS m/z 456 (M+), Rt (2,09 мин). Пример 64. Получение 4-[гидрокси(ди-2-нафталенил)метил]-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил(ди-2-нафталенил)метанол. Раствор (2-нафталенил)магнийбромида (0,5 М в THF, 6,5 мл, 3,25 ммоль) охлаждают до 0 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (0,1597 г, 0,871 ммоль) в THF (4 мл) медленно добавляют к реакционной смеси при 0 С в течение 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и затем нагревают при 60 С в течение 16 ч. Реакционную смесь охлаждают в ледяной бане, гасят насыщенным NH4Cl и концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме для выхода желаемого продукта (0,265 г, 77,3%).EI-MS m/z 394 (M+H+), Rt (1,90 мин). 4-(Гидроксибис-[3-(метилокси)фенил]метил)-1-[3-(фенилокси)пропил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(ди-2-нафталенил)метанола (0,0547 г, 0,139 ммоль) и простого 3-бромпропилфенилэфира (0,0329 мл, 0,209 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0268 г, 31,7%).EI-MS m/z 528 (M+), Rt (2,88 мин). Пример 65. Получение 4-[гидрокси(ди-2-нафталенил)метил]-1-2-[(фенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромида. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(ди-2-нафталенил)метанола (0,0637 г, 0,162 ммоль) и простого 2-бромэтилфенилметилэфира (0,0384 мл, 0,243 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0246 г, 25%).EI-MS m/z 528 (M+), Rt (2,36 мин). Пример 66. Получение 1-3-[(2-фторфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Простой 3-бромпропил-2-фторфенилэфир. К раствору 2-фторфенола (0,040 мл, 0,448 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,450 мл, 4,43 ммоль) с последующим добавлением Cs2CO3 (0,232 г, 0,713 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают H2O (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для выхода желаемого продукта (0,0274 г, 26,2%).EI-MS Rt (2,24 мин). 1-3-[(2-Фторфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0282 г, 0,0960 ммоль) и простого 3-бромпропил-2 фторфенилэфира (0,0274 г, 0,118 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают H2O (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для выхода желаемого продукта (0,0137 г, 13,2%).EI-MS Rt (2,28 мин). 1-3-[(3-Фторфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0137 г, 0,0467 ммоль) и простого 3-бромпропил-3 фторфенилэфира (0,0137 г, 0,0588 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 446 (M+), Rt (2,03 мин). Пример 68. Получение 1-3-[(4-фторфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Простой 3-бромпропил-4-фторфенилэфир. К раствору 4-фторфенола (0,0567 мл, 0,506 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,520 мл, 5,12 ммоль) с последующим добавлением Cs2CO3 (0,252 г, 0,774 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают H2O (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для выхода желаемого продукта (0,0173 г, 14,7%).EI-MS Rt (2,25 мин). 1-3-[(4-Фторфенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0182 г, 0,0621 ммоль) и простого 3-бромпропил-4 фторфенилэфира (0,0173 г, 0,0742 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 446 (M+), Rt (1,96 мин). Пример 69. Получение 1-[3-(3-бифенилилокси)пропил]-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Простой 3-бифенилил-3-бромпропилэфир. К раствору 3-бифенилола (0,0574 г, 0,337 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,340 мл, 3,35 ммоль) с последующим добавлением Cs2CO3 (0,172 г, 0,529 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают H2O (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения желаемого продукта (0,0568 г, 57,8%).EI-MS Rt (2,59 мин). 1-[3-(3-Бифенилилокси)пропил]-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0433 г, 0,148 ммоль) и простого 3-бифенилил-3 бромпропилэфира (0,0568 г, 0,196 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 504 (M+), Rt (2,37 мин). Пример 70. Получение 1-[3-(4-бифенилилокси)пропил]-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. Простой 4-бифенилил-3-бромпропилэфир. К раствору 4-бифенилола (0,0514 мл, 0,302 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,310 мл, 3,05 ммоль) с последующим добавлением Cs2CO3 (0,154 г, 0,472 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают H2O (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения желаемого продукта (0,0562 г, 64%).EI-MS Rt (2,62 мин). 1-[3-(4-Бифенилилокси)пропил]-4-[гидрокси(дифенил)метил]-1-азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0437 г, 0,144 ммоль) и простого 4-бифенилил-3 бромпропилэфира (0,0562 г, 0,194 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта Пример 71. Получение 4-[гидрокси(дифенил)метил]-1-3-[(3-нитрофенил)окси]пропил-1 азониабицикло[2.2.2]октанбромида. Простой 3-бромпропил-3-нитрофенилэфир. К раствору 3-нитрофенола (0,0689 г, 0,495 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,500 мл, 3,05 ммоль) с последующим добавлением Cs2CO3 (0,244 г, 0,748 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (0,0730 г, 56,6%).EI-MS Rt (2,20 мин). 4-[Гидрокси(дифенил)метил]-1-3-[(3-нитрофенил)окси]пропил-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0608 г, 0,207 ммоль) и простого 3-бромпропил-3 нитрофенилэфира (0,0730 г, 0,281 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 474 (M+), Rt (2,04 мин). Пример 72. Получение 4-[гидрокси(дифенил)метил]-1-3-[(2-метилфенил)окси]пропил-1 азониабицикло[2.2.2]октанбромида. Простой 3-бромпропил-2-метилфенилэфир. К раствору 2-метилфенола (0,0954 г, 0,924 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (1,00 мл, 9,85 ммоль) с последующим добавлением Cs2CO3 (0,469 г, 1,44 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (0,0934 г, 44,1%).EI-MS Rt (2,45 мин). 4-[Гидрокси(дифенил)метил]-1-3-[(2-метилфенил)окси]пропил-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0447 г, 0,152 ммоль) и простого 3-бромпропил-3 метилфенилэфира (0,0934 г, 0,407 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 442 (M+), Rt (2,17 мин). Пример 73. Получение 1-(3-[3-(диэтиламино)фенил]оксипропил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. 3-[(3-Бромпропил)окси]-N,N-диэтиланилин. К раствору 3-(диэтиламино)фенола (0,0104 г, 0,631 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,640 мл, 6,30 ммоль) с последующим добавлением Cs2CO3 (0,313 г, 0,961 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают H2O (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (0,0314 г, 17,4%).EI-MS m/z 286 (M+H+), Rt (1,59 мин). 1-(3-[3-Диэтиламино)фенил]оксипропил)-4-[гидрокси(дифенил)метил-1 азониабицикло[2.2.2]октанбромид. Следуя общей методике, описанной в примере 3, осуществляют взаимодействие 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (0,0257 г, 0,0876 ммоль) и 3-[(3-бромпропил)окси]-N,Nдиэтиланилина (0,0314 г, 0,110 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продуктаEI-MS m/z 500 (M+), Rt (1,58 мин). Пример 74. Получение 1-3-[(4-цианофенил)окси]пропил-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. 4-[(3-Бромпропил)окси]бензонитрил. К раствору 4-гидроксибензонитрила (0,109 г, 0,913 ммоль) в ацетонитриле (4 мл) добавляют 1,3-дибромпропан (0,930 мл, 9,16 ммоль) с последующим добавлением Cs2CO3 (0,439 г, 1,35 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О (4 мл) и экстрагируют DCM (8 мл). Органический слой сушат, пропуская через фазовый сепаратор, и концентрируют в вакууме. Остаток собирают в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (0,156 г, 71,4%).(0,0520 г,0,177 ммоль) и 4-[(3-бромпропил)окси]бензонитрила (0,156 г, 0,652 ммоль) в 2 CH3CN/3 CHCl3 (4 мл) для получения желаемого продукта (0,0726 г, 76,8%).(3 мл) (предостережение: экзотерм). К реакционной смеси добавляют м-метоксибензилхлорид (0,21 мл,1,5 ммоль) и остаточный м-метоксибензилхлорид переносят в реакционную пробирку дополнительнымTHF (1 мл). Затем добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем охлаждают до комнатной температуры в течение 4 ч. Добавляют Н 2 О (2 мл) иEtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете Biotage 12+М(8 г диоксида кремния) с элюированием 30% EtOAc/гексанами при 5 мл/мин для получения указанного в заголовке соединения (114 мг, 42%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 1-[(2-Бромэтил)окси]метил-3-(метилокси)бензол. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 милиэквивалента, Fluka) в DCM (2,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют 2-([3-(метилокси)фенил]метилокси)этанол (114 мг, 0,626 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный сосуд оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассетуEtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (160 мг). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 4-[Гидрокси(дифенил)метил]-1-[2-([3-(метилокси)фенил]метилокси)этил]-1 аэониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 1-[(2-бромэтил)окси]метил-3-(метилокси)бензола (35 мг, 0,143 ммоль) в 2 CH3CN/3 CHCl3 (3 мл). Реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл) и затем MeOH (11 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (7,7 мг, 14%).(3 мл). К реакционной смеси добавляют 1-(бромметил)-4-(1,1-диметилэтил)бензол (0,28 мл, 1,5 ммоль) и остаточный 1-(бромметил)-4-(1,1-диметилэтил)бензол переносят в реакционную пробирку дополнительным THF (1 мл). Затем добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем до комнатной температуры в течение 4 ч. Добавляют H2O (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния),элюируя следующими 10 мл фракциями: 10% EtOAc/гексанами (фракции 1, 2), 30% EtOAc/гексанами(фракции 3, 4) и 50% EtOAc/гексанами (фракции 5, 6) для получения указанного в заголовке соединения(312 мг, 51%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 1-[(2-Бромэтил)окси]метил-4-(1,1-диметилэтил)бензол. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 миллиэквивалента, Fluka) в DCM (2,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют раствор 2-([4-(1,1-диметилэтил)фенил]метилокси)этанола (160 мг, 0,768 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный флакон закупоривают, оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM(фракция 1), 30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (25 мг, 12%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 1-[2-([4-(1,1-Диметилэтил)фенил]метилокси)этил]-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 1-[(2-бромэтил)окси]метил-4-(1,1-диметилэтил)бензола (25 мг, 0,143 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (9 мг, 16%).(3 мл). К реакционной смеси добавляют 1-(бромметил)-4-фторбензол (0,19 мл, 1,5 ммоль) и остаточный 1-(бромметил)-4-фторбензол переносят в реакционную пробирку дополнительным THF (1 мл). Добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем при комнатной температуре в течение 4 ч. Добавляют Н 2 О (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: 30% EtOAc/гексанами (фракции 1, 2), 50% EtOAc/гексанами (фракция 3) и 75%EtOAc/гексанами (фракция 4) для получения указанного в заголовке соединения (122 мг, 48%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 1-[(2-Бромэтил)окси]метил-4-фторбензол. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 миллиэквивалента, Fluka) в DCM (2,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют раствор 2-[(4-фторфенил)метил]оксиэтанола (122 мг, 0,717 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный флакон закупоривают, оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1),30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (80 мг, 48%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 1-(2-[(4-Фторфенил)метил]оксиэтил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 1-[(2-бромэтил)окси]метил-4-фторбензола (33 мг, 0,143 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (9 мг, 16%).(3 мл). К реакционной смеси добавляют 1-(бромметил)-4-хлорбензол (310 мг, 1,5 ммоль) и остаточный 1-(бромметил)-4-хлорбензол переносят в реакционную пробирку дополнительным THF (1 мл). Добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем при комнатной температуре в течение 4 ч. Добавляют Н 2 О (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: 30% EtOAc/гексанами (фракции 1, 2), 50% EtOAc/гексанами (фракция 3) и 75%EtOAc/гексанами (фракция 4) для получения указанного в заголовке соединения (129 мг, 46%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 1-[(2-Бромэтил)окси]метил-4-хлорбензол. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 миллиэквивалента, Fluka) в DCM (2,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют раствор 2-[(4-хлорфенил)метил]оксиэтанола (129 мг, 0,691 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный флакон закупоривают, оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1),30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заго- 20021994 ловке соединения (98 мг, 57%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 1-(2-[(4-Хлорфенил)метил]оксиэтил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 1-[(2-бромэтил)окси]метил-4-хлорбензола (36 мг, 0,143 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (17,4 мг, 32%).(3 мл). К реакционной смеси добавляют 1-бром-4-(бромметил)бензол (370 мг, 1,5 ммоль) и остаточный 1-бром-4-(бромметил)бензол переносят в реакционную пробирку дополнительным THF (1 мл). Затем добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем при комнатной температуре в течение 4 ч. Добавляют Н 2 О (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: 30% EtOAc/гексанами (фракции 1, 2), 50% EtOAc/гексанами (фракция 3) и 75%EtOAc/гексанами (фракция 4) для получения указанного в заголовке соединения (139 мг, 40%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 1-Бром-4-[(2-бромэтил)окси]метилбензол. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 миллиэквивалента, Fluka) в DCM (2,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют раствор 2-[(4-бромфенил)метил]оксиэтанола (139 мг, 0,601 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный флакон закупоривают, оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1),30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (87 мг, 49%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 1-(2-[(4-Бромфенил)метил]оксиэтил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 1-бром-4-[(2-бромэтил)окси]метилбензола (42 мг, 0,143 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (19,4 мг, 32%).(3 мл). К реакционной смеси добавляют 4-(бромметил)бензонитрил (290 мг, 1,5 ммоль) и остаточный 4-(бромметил)бензонитрил переносят в реакционную пробирку дополнительным THF (1 мл). Затем добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем при комнатной температуре в течение 4 ч. Добавляют Н 2 О (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: 10% EtOAc/гексанами (фракции 1, 2), 30% EtOAc/гексанами (фракции 3, 4), 50%EtOAc/гексанами (фракции 5-7) и 75% EtOAc/гексанами (фракция 8) для получения указанного в заголовке соединения (95 мг, 36%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 4-[(2-Бромэтил)окси]метилбензонитрил. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 миллиэквивалента, Fluka) в DCM (2,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют раствор 4-[(2-гидроксиэтил)окси]метилбензонитрила (95 мг, 0,536 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный флакон закупоривают, оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1),- 21021994 30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (60 мг, 47%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 1-(2-[(4-Цианофенил)метил]оксиэтил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 4-[(2-бромэтил)окси]метилбензонитрила (34 мг, 0,143 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (40 мг, 74%).(3 мл). К реакционной смеси добавляют 2-(бромметил)нафталин (330 мг, 1,5 ммоль) и остаточный 2-(бромметил)нафталин переносят в реакционную пробирку дополнительным THF (1 мл). Затем добавляют (Bu)4NI (55 мг, 0,15 ммоль) и реакционную смесь нагревают при 60 С в течение 18 ч и затем при комнатной температуре в течение 4 ч. Добавляют Н 2 О (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (11 мл) и объединенные органические слои концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: 30% EtOAc/гексанами (фракции 1, 2), 50% EtOAc/гексанами (фракция 3) и 75%EtOAc/гексанами (фракция 4) для получения указанного в заголовке соединения (101 мг, 33%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 2-[(2-Бромэтил)окси]метилнафталин. Раствор N-бромсукцинимида (272 мг, 1,53 ммоль) в DCM (2,5 мл) добавляют к связанному со смолой трифенилфосфину (510 мг, 1,53 миллиэквивалента, Fluka) в DCM (2,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют раствор 2-[(2-нафталенилметил)окси]этанола (101 мг, 0,499 ммоль) в DCM (1,5 мл) и остаточный спирт переносят дополнительным DCM (1,5 мл). Реакционный флакон закупоривают, оборачивают алюминиевой фольгой и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1), 30%EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (57 мг, 43%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 4-[Гидрокси(дифенил)метил]-1-2-[(2-нафталенилметил)окси]этил-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (30 мг, 0,102 ммоль) добавляют к раствору 2-[(2-бромэтил)окси]метилнафталина (38 мг, 0,143 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 96 ч. Реакционную смесь концентрируют и неочищенный продукт промывают EtOAc (31 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (48,1 мг, 84%).LC/MS ESI RT 2,04 мин, М+ 478. Пример 82. Получение 1-(2-[(3-фторфенил)метил]оксиэтил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. 2-[(3-Фторфенил)метил]оксиэтанол. Этиленгликоль (0,1 мл, 1,79 ммоль) добавляют к NaH (46 мг, 1,81 ммоль, 95% в масле) в THF (5 мл). К реакционной смеси добавляют 1-(бромметил)-3-фторбензол (0,22 мл, 1,79 ммоль) и реакционную смесь нагревают при 60 С в течение 5 дней. Добавляют Н 2 О (2 мл) и EtOAc (2 мл) и слои разделяют посредством пипетки. Водный слой экстрагируют EtOAc (31 мл) и объединенные органические слои промывают насыщенным NaCl (12 мл), сушат (Na2SO4) и концентрируют. Неочищенный продукт очищают на кассете SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: 30% EtOAc/гексанами (фракции 1, 2), 50% EtOAc/гексанами (фракция 3) и 75% EtOAc/гексанами (фракция 4) для получения указанного в заголовке соединения (76,2 мг, 25%). Продукт характеризуют 1 Н ЯМР (400 МГц) в CDCl3. 1-[(2-Бромэтил)окси]метил-3-фторбензол.N-Бромсукцинимид (146 мг, 0,820 ммоль) добавляют к связанному со смолой трифенилфосфинуDCM (4 мл). Реакционный флакон закупоривают выстланным тефлоном колпачком, оборачивают алюминиевой фольгой и встряхивают при комнатной температуре в течение 17 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1), 30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (75 мг, 78%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 1-(2-[(3-Фторфенил)метил]оксиэтил)-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (94 мг, 0,321 ммоль) добавляют к раствору 1-[(2-бромэтил)окси]метил-3-фторбензола (75 мг, 0,321 ммоль) в 2:3 CH3CN/CHCl3 (4 мл) и реакционную смесь нагревают при 60 С в течение 3 дней. Реакционную смесь концентрируют при пониженном давлении и неочищенный продукт промывают EtOAc (32 мл). Продукт сушат в высоком вакууме для получения указанного в заголовке соединения (50 мг, 30%).LC/MS ESI RT 1,95 мин М+ 446. Пример 83. Получение 4-[гидрокси(дифенил)метил]-1-2-[(1-метил-1-фенилэтил)окси]этил-1 азониабицикло[2.2.2]октанбромида. 2-[(1-Метил-1-фенилэтил)окси]этанол. Каталитическое количество или п-толуолсульфоновой кислотыН 2 О или смолы Bio-Rad SCX (аналитический сорт, 5,1 миллиэквивалента/г, AG 50W-X8) добавляют к метилстиролу (0,5 мл, 3,85 ммоль) и этиленгликолю (0,21 мл, 3,85 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 5 дней. Реакционную смесь загружают непосредственно на кассету SPE (10 г диоксида кремния) и элюируют следующими 10 мл фракциями: 10% EtOAc/гексанами (фракции 1, 2), 30% EtOAc/гексанами(фракции 3, 4) и 50% EtOAc/гексанами (фракции 5, 6) для получения указанного в заголовке соединенияN-Бромсукцинимид (119 мг, 0,666 ммоль) добавляют к связанному со смолой трифенилфосфинуDCM (4 мл). Реакционный флакон закупоривают выстланным тефлоном колпачком, оборачивают алюминиевой фольгой и встряхивают при комнатной температуре в течение 17 ч. Реакционную смесь фильтруют через кассету SPE (5 г диоксида кремния), элюируя следующими 10 мл фракциями: DCM (фракция 1), 30% EtOAc/гексанами (фракция 2) и 50% EtOAc/гексанами (фракция 3) для получения указанного в заголовке соединения (34 мг, 42%). Продукт характеризуют 1H ЯМР (400 МГц) в CDCl3. 4-[Гидрокси(дифенил)метил]-1-2-[(1-метил-1-фенилэтил)окси]этил-1 азониабицикло[2.2.2]октанбромид. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (41 мг, 0,14 ммоль) добавляют к раствору 1-[(2-бромэтил)окси]-1-метилэтилбензола (34 мг, 0,14 ммоль) в 2:3 CH3CN/CHCl3 (3 мл) и реакционную смесь нагревают при 60 С в течение 3 дней. Реакционную смесь концентрируют при пониженном давлении и неочищенный продукт промывают EtOAc (31 мл). Остаток собирают в 2,5 мл DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (18 мг, 24%).CHCl3 (1,8 мл) и подают непосредственно во флакон емкостью 1 драхма, содержащий простой 2-бромэтилфенилметилэфир (0,022 г, 0,102 ммоль). Добавляют CH3CN (1,2 мл); во флакон помещают перемешивающий брусок и закрывают колпачком. Реакционную смесь перемешивают и нагревают при 60 С в течение 24 ч. Содержимое флакона переносят (после удаления перемешивающего бруска) в полипропиленовую пробирку и концентрируют в атмосфере азота. Неочищенный продукт собирают на фритту полипропиленовой пробирки. Избыток бромида удаляют промыванием неочищенного продуктаEtOAc (52 мл) и гексаном (52 мл). Затем продукт сушат в вакууме для получения указанного в заголовке соединения (0,008 г, 23,8%). Способ В. К раствору 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола (3,30 г, 11,2 ммоль) в 2 CH3CN/3 CHCl3 (200 мл) добавляют простой 2-бромэтилфенилметилэфир (2,31 мл, 14,6 ммоль). Раствор перемешивают при 60 С в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют. EtOAc (200 мл) добавляют к твердому веществу и смеси дают возможность перемешиваться в течение 1 ч, затем фильтруют. Полученное твердое вещество собирают в MeOH (125 мл) и нагревают до 60 С. Горячий раствор фильтруют и снова охлаждают до комнатной температуры. Реакционную смесь концентрируют до низкого объема MeOH (20 мл). Затем добавляют воду (75 мл) и полученную смесь нагревают при 55 С при энергичном перемешивании в течение 40 мин. После охлаждения до комнатной температуры твердое вещество отфильтровывают, промывают водой (20 мл) и сушат в вакуумной печи при 45 С в течение 16 ч для получения указанного в заголовке соединения (2,47 г, 43,3%). Пример 84. Получение 1-[2-(1-бензофуран-2-ил)-2-оксоэтил]-4-[гидрокси(дифенил)метил]-1 азониабицикло[2.2.2]октанбромида. 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол (0,022 г, 0,075 ммоль) разбавляют в CHCl3 (1,8 мл) и подают непосредственно во флакон емкостью 1 драхма, содержащий 1-(1-бензофуран-2-ил)-2 бромэтанон (0,027 г, 0,112 ммоль). После добавления CH3CN (1,2 мл) во флакон помещают перемешивающий брусок и закупоривают колпачком. Реакционную смесь перемешивают и нагревают при 60 С в течение 24 ч и концентрируют в вакууме для получения белого твердого вещества. Этот остаток растворяют в DMSO и очищают препаративной ВЭЖХ (без TFA) для получения указанного в заголовке соединения (0,022 г, 57,4%). Аббревиатуры. В описании использования следующие сокращения и аббревиатуры:THF - тетрагидрофуран. Биологические примеры. Ингибирующие эффекты соединений настоящего изобретения на М 3 mAChR определяются следующими функциональными анализами in vitro и in vivo. Анализ ингибирования активации рецепторов мобилизацией кальция. Стимуляцию mAChRs, экспрессируемых на клетках СНО, анализируют мониторингом активируемой рецепторами мобилизации кальция, как описано ранее (Н.М. Sarau et al., 1999. Mol. Pharmacol. 56,657-663). Клетки СНО, устойчиво экспрессирующие М 3 mAChRs, высевают в 96-луночные планшеты с черными стенками/прозрачным дном. Через 18-24 ч среду аспирируют и замещают 100 мкл загружаемой среды (ЕМЕМ с солями Earl, 0,1% BSA сорта RIA (Sigma, St. Louis МО) и 4 мкМ флуоресцентного индикаторного красителя простого флюо-3-ацетоксиметилэфира (Fluo-3 AM, Molecular Probes, Eugene, OR) и инкубируют 1 ч при 37 С. Среду, содержащую краситель, затем аспирируют, замещают свежей средой(без Fluo-3 AM) и клетки инкубируют в течение 10 мин при 37 С. Затем клетки промывают 3 раза и инкубируют в течение 10 мин при 37 С в 100 мкл аналитического буфера (0,1% желатин (Sigma), 120 мМHEPES (рН 7,4. Добавляют 50 мкл соединения (конечная концентрация в анализе 110-11-110-5 M) и планшеты инкубируют в течение 10 мин при 37 С. Затем планшеты помещают в устройство считывания интенсивности флуоресцентного света для планшета (FLIPR, Molecula Probes), где загруженные красителем клетки подвергаются воздействию возбуждающего света (488 нм) от аргонового лазера мощностью 6 Вт. Клетки активируют добавлением 50 мкл ацетилхолина (конечная концентрация 0,1-10 нМ), полученного в буфере, содержащем 0,1% BSA, со скоростью 50 мкл/с. Мониторинг мобилизации кальция в виде изменения концентрации цитозольного кальция проводят измерением изменения интенсивности светоизлучения при 566 нм. Изменение интенсивности светоизлучения прямо связано с уровнями цитозольного кальция. Флуоресценцию, испускаемую из всех 96 лунок, измеряют одновременно с использованием охлажденной CCD камеры. Сбор данных проводят ежесекундно. Затем эти данные наносят на график и анализируют с использованием программного обеспечения GraphPad PRISM. Вызванное метахолином сужение бронхов - сила и длительность действия. Реактивность бронхов на метахолин определяют у бодрствующих, не ограниченных в движении мышей Balb С (n=6 в каждой группе). Барометрическую плетизмографию используют для измерения увеличенной паузы (Penh), не имеющего единицы измерения показателя, который, как было показано,коррелируется с изменениями сопротивления дыхательных путей, которые возникают во время бронхиальной стимуляции метахолином (2). Мышам предварительно вводили 50 мкл соединения(0,003-10 мкг/мышь) в 50 мкл носителя (10% DMSO) интраназально (i.n.) и затем их помещают в плетизмографическую камеру через определенное время после введения препарата (15 мин - 96 ч). Для определения силы действия выполняли определение зависимости реакции от дозы данного препарата и все измерения проводили через 15 мин после i.n. введения препарата. Для определения длительности действия измерения проводили в любое время с 15 мин до 96 ч после i.n. введения препарата. После помещения в камеру животным давали возможность достичь уравновешивания в течение 10 мин перед проведением исходного измерения Penh в течение 5 мин. Затем у мышей проводили стимуляцию аэрозолем метахолина (10 мг/мл) в течение 2 мин. Penh регистрировали непрерывно в течение 7 мин, с начала введения аэрозоля метахолина, и продолжали в последующем в течение 5 мин. Данные по каждой мыши анализировали и наносили на график с использованием программного обеспеченияGraphPad PRISM. Эксперимент обеспечивает возможность определения длительности активности введенного соединения. Соединения по настоящему изобретению можно использовать для лечения по разнообразным показаниям, включая, но не ограничиваясь, расстройства дыхательных путей, такие как хроническое обструктивное легочное заболевание, хронический бронхит, астму, хроническую респираторную обструкцию,пневмосклероз, эмфизему легких и аллергический ринит. Анализ связывания радиолиганда с мускариновыми рецепторами. Исследования связывания радиолиганда с использованием 0,5 нМ [3 Н]-N-метилскополамина (NMS) в формате SPA используются для оценки связывания мускариновых антагонистов с М 1, М 2, М 3, М 4 и М 5 мускариновых рецепторов ацетилхолина. В 96-луночном планшете шарики SPA предварительно инкубируют с содержащей рецепторы мембраной в течение 30 мин при 4 С. Затем добавляют 50 мМ HEPES и испытуемого соединения и инкубируют при комнатной температуре (встряхивая) в течение 2 ч. Затем шарики отделяют центрифугированием и считают, используя сцинтилляционный счетчик. Определение активности и длительности действия на изолированной трахее морских свинок. Трахеи удаляют у взрослых самцов морских свинок Hartley (Charles River, Raleigh, NC; 400-600 г) и помещают в модифицированный раствор Кребса-Хенселейта. Состав раствора (мМ): NaCl - 113,0,KCl - 4,8, CaCl2 - 2,5, KH2PO4 - 1,2, MgSO4 - 1,2, NaHCO3 - 25,0 и декстроза - 11,0, который газировали 95% О 2: 5% СО 2 и поддерживали при 37 С. Каждую трахею очищают от прилипшей ткани и вскрывают по длине. Эпителий удаляют осторожным трением просветной поверхности аппликатором с хлопковым наконечником. Отсекают отдельные полоски шириной приблизительно 2 хрящевых кольца и подвешивают посредством шелковой нити в бане с водяным кожухом емкостью 10 мл для органов, содержащие раствор Кребса-Хенселейта, и соединенные с преобразователями силы-смещения Grass FT03C. Механические реакции регистрируют изометрически устройством, подтверждающим получение данныхMP100WS (BIOPAC Systems, Goleta, CA, www.biopac.com), работающим на компьютерах Apple G4. Уравновешивание тканей проводят при напряжении покоя 1,5 г, определяемом как оптимальное оценкой длины-напряжения и промывают раствором Кребса-Хенселейта через каждые 15 мин в течение 1 ч. После периода уравновешивания легочные ткани подвергают сокращению действием 10 мМ карбахола до достижения плато, которое служит в качестве эталонного сокращения для анализа данных. Затем ткани споласкивают через каждые 15 мин в течение 1 ч до достижения исходного тонуса. Затем препараты оставляют по меньшей мере на 30 мин перед началом эксперимента. Кривые зависимости реакции от концентрации получают кумулятивным добавлением карбахола полулогарифмическими добавками (Van Rossum, 1963, Arch. Int. Pharmacodyn., 143:299), начинающимися при 1 нМ. Каждую концентрацию оставляют в контакте с препаратом до тех пор, пока реакция не выходит на плато, перед добавлением последующей концентрации карбахола. Парные ткани подвергают воздействию соединений - антагонистов mAChR или носителя в течение 30 мин перед построением кривых зависимости реакции от кумулятивной концентрации карбахола. Все данные представлены в виде средней величиныстандартная ошибка средней (S.E.M.), причем n представляет собой количество различных животных. Для исследований суперфузии (длительности действия) ткани непрерывно перфузируют раствором Кребса-Хенселейта со скоростью 2 мл/мин в течение всей продолжительности эксперимента. Маточные растворы агониста и антагониста инфузируют (0,02 мл/мин) через иглу 22 калибра, введенную в перфузинную трубку. Механические реакции регистрировали изометрически, используя имеющееся в продаже устройство, подтверждающее получение данных MP100WS (BIOPAC Systems, Goleta, CA,www.biopac.com), соединенное интерфейсом с компьютером Macintosh G4 (Apple, Cupertino, CAwww.apple.com). Ткани суспендируют при оптимальном напряжении покоя 1,5 г. Через 60 мин периода уравновешивания ткани подвергают сокращению действием карбахола (1 мМ) в течение длительности эксперимента. После достижения длительного сокращения вводят изопротеренол (10 мМ) для максимального расслабления ткани, и это изменение служит в качестве эталона. Воздействие изопротеренола прекращают и дают возможность восстановиться напряжению, вызванному карбахолом. Антагонисты мускариновых рецепторов инфузируют в одной концентрации на ткань до тех пор, пока не достигается стойкий уровень ингибирования. Затем соединение удаляют и снова дают возможность восстановиться напряжению, вызванному карбахолом. Следующие показатели определяют для каждой концентрации антагониста и выражают в виде средней величиныS.E.M для n отдельных животных. Ингибирование вызванного корбахолом сокращения выражают в виде процента эталонной реакции (изопротеренол) и измеряют время, требуемое для достижения половины этого расслабления (начало реакции). Восстановление напряжения после удаления соединения определяют как время, требуемое для достижения восстановления половины максимального напряжения (компенсация реакции). Через 60 и 180 мин после удаления антагониста определяют остающийся уровень ингибирования и выражают в виде процента эталонной реакции на изопротеренол. Кривые зависимости реакции от концентрации антагониста получают нанесением на график данных максимального расслабления через 0, 60 и 180 мин после удаления антагониста. Восстановление,именуемое сдвигом, рассчитывают по отношению кривой ингибирования IC50 через 0 мин к концентрации соединения, дающего аналогичное восстановление напряжения через 60 и 180 мин. Половины времени до начала и компенсации реакции наносят на график зависимости от соответствующей концентрации и данные корригируют нелинейной регрессией. Эти величины экстраполируют при IC50 (определяемой по кривой зависимости реакции от концентрации) и обозначают Ot50 (время при концентрации IC50, требуемое для достижения половины начальной реакции) и Rt50 (время при концентрации IC50, требуемое для достижения половины реакции восстановления). Введение композиции. Соответственно, настоящее изобретение дополнительно предоставляет фармацевтическую композицию, содержащую соединение формулы (I), или его фармацевтически приемлемую соль, или физиологически функциональное производное (например, соли и сложные эфиры) и фармацевтически приемлемый носитель или эксципиент и, необязательно, один или более других терапевтических ингредиентов. Далее, термин "активный ингредиент" означает соединение формулы (I) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное. Соединения формулы (I) должны вводиться посредством ингаляции через рот или нос. Сухие порошковые композиции для местной доставки в легкие путем ингаляции могут, например,быть представлены в капсулах и кассетах, например, из желатина, или блистерах, например, из ламинированной алюминиевой фольги для использования в ингаляторе или инсуффляторе. Композиции порошковой смеси в целом содержат порошковую смесь для ингаляции соединения по изобретению и подходящей порошковой основы (вещества носителя/разбавителя/эксципиента), такой как моно-, ди- или полисахариды (например, лактоза или крахмал), органические или неорганические соли (например, хлорид кальция, фосфат кальция или хлорид натрия), полиспирты (например, маннит) или их смеси, альтернативно, с одним или более дополнительными материалами, причем такие добавки включены в смешанную композицию для улучшения химической и/или физической устойчивости или эффекта композиции, как описано ниже, или ее смесей. Предпочтительно использование лактозы. Каждая капсула или кассета может в целом содержать от 20 мкг до 10 мг соединения формулы (I), необязательно, в комбинации с другим терапевтически активным ингредиентом. Альтернативно, соединение по изобретению может быть представлено без эксципиентов или может быть сформировано в частицы, включающие соединение, необязательно, другие терапевтически активные материалы и материалы эксципиентов, например, совместным осаждением или покрытием. Устройство подачи лекарственного средства может относиться к типу, выбранному из группы, состоящей из ингалятора сухого порошка с резервуаром (RDPI), многодозового ингалятора сухого порошка(MDPI) и ингалятора отмеренной дозы (MDI). Под ингалятором сухого порошка с резервуаром (RDPI) подразумевается ингалятор, имеющий упаковку в форме резервуара для включения множественных (не отмеренных) доз лекарственного средства в форме сухого порошка и включающий средство для отмеривания дозы лекарственного средства из резервуара в положение доставки. Отмеривающее средство может, например, включать мерный колпачок или перфорированную пластину, которая подвижна из первого положения, в котором колпачок может быть заполнен лекарственным средством из резервуара, во второе положение, в котором отмеренная доза лекарственного средства делается доступной для ингаляции пациентом. Под многодозовым ингалятором сухого порошка (MDPI) подразумевается ингалятор, подходящий для подачи лекарственного средства в форме сухого порошка, в котором лекарственное средство содержится внутри многодозовой упаковки, содержащего (или несущего другим образом) множественные,определенные дозы (или их части) лекарственного средства. В предпочтительном аспекте носитель имеет форму блистерной упаковки, но он может также включать, например, форму упаковки на основе капсул или носителя, на который было нанесено лекарственное средство любым подходящим способом,включающим печать, окрашивание и вакуумную окклюзию. Композиция может быть предварительно отмеренной (например, как в Diskus, см. GB 2242134, илиDiskhaler, см. GB 2178965, 2129691 и 2169265) или отмеренной для применения (например, как вTurbuhaler, см. ЕР 69715). Примером устройства стандартной дозы является Rotahaler (см. GB 2064336). Ингаляционное устройство Diskus включает удлиненную полоску, образованную из листка-основания,имеющего множество углублений, расположенных с промежутками вдоль его длины, и листок-крышку,герметично, но отслаиваемо установленный на него, для ограничения множества контейнеров, причем каждый контейнер имеет в себе ингалируемую композицию, содержащую соединение формулы (I),предпочтительно в комбинации с лактозой. Предпочтительно полоска достаточно гибкая для сворачивания в рулон. Листок-крышка и листок-основание предпочтительно имеют части ведущего конца, которые негерметично соединены друг с другом и по меньшей мере одна из указанных частей ведущего конца сконструирована для прикрепления к сворачивающему средству. Также предпочтительно герметичный уплотнитель между листком-основанием и листком-крышкой простирается по всей их ширине. Листок-крышка может предпочтительно отслаиваться от листка-основания в продольном направлении от первого конца указанного листка-основания. В одном аспекте многодозовая упаковка представляет собой блистерную упаковку, включающую множество блистеров для помещения лекарственного средства в форме сухого порошка. Блистеры обычно располагаются в упорядоченном виде для легкости высвобождения лекарственного средства из них. В одном аспекте многодозовая блистерная упаковка включает множество блистеров, расположенных в целом по кругу на блистерной упаковке в форме диска. В другом аспекте многодозовая блистерная упаковка является удлиненной по форме, например, включающей полоску или ленты. Предпочтительно многодозовая блистерная упаковка ограничивается между двумя элементами, отслаиваемо укрепленными друг к другу. В патентах США 5860419, 5873360 и 5590645 описаны упаковки для лекарственных средств этого общего типа. В этом аспекте устройство обычно обеспечено открывающим устройством, включающим отслаивающее средство для отслаивания элементов друг от друга для доступа к каждой дозе лекарственного средства. Подходящим образом средство приспособлено для использования, где отслаиваемые элементы представляют собой удлиненные листки, которые ограничивают множество контейнеров лекарственного средства, расположенных с промежутками вдоль их
МПК / Метки
МПК: C07D 453/02, A61K 31/44
Метки: мускариновых, ацетилхолина, антагонисты, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-21994-antagonisty-muskarinovyh-receptorov-acetilholina.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты мускариновых рецепторов ацетилхолина</a>
Предыдущий патент: Целлюлозные и лигноцеллюлозные материалы и способы и системы для производства таких материалов облучением
Следующий патент: Способ изготовления контейнера с горловиной
Случайный патент: Термостабилизированная полиамидная композиция