Доставка антител посредством модульного домена распознавания
Формула / Реферат
1. Выделенный слитый полипептид для направленной доставки антитела к опухоли, содержащий полноразмерное антитело и по меньшей мере один модульный домен распознавания (MRD), где указанное антитело способно связываться с опухолевым антигеном, а указанный MRD способен связываться с ангиогенным фактором и где MRD состоит из 2-60 аминокислот.
2. Слитый полипептид по п.1, где указанное антитело и указанный MRD функционально связаны посредством линкерного пептида.
3. Слитый полипептид по п.2, где указанный линкерный пептид состоит из 2-20 аминокислот или 4-15 аминокислот.
4. Слитый полипептид по п.2 или 3, где указанный линкерный пептид содержит последовательность, выбранную из группы, состоящей из:

5. Слитый полипептид по любому из пп.1-4, где указанный MRD функционально связан с С-концом тяжелой цепи указанного антитела, с N-концом тяжелой цепи указанного антитела, с С-концом легкой цепи указанного антитела или с N-концом легкой цепи указанного антитела.
6. Слитый полипептид по любому из пп.1-5, где два или более MRD функционально связаны с любым концом указанного антитела или где два или более MRD функционально связаны с двумя или более концами указанного антитела.
7. Слитый полипептид по любому из пп.1-6, где указанный ангиогенный фактор выбран из группы, состоящей из ангиогенного цитокина, васкулярного эндотелиального фактора роста (VEGF) и васкулярного "хоминг"-пептида.
8. Слитый полипептид по п.7, где указанный ангиогенный фактор представляет собой ангиогенный цитокин, а указанный MRD содержит последовательность, выбранную из группы, состоящей из:
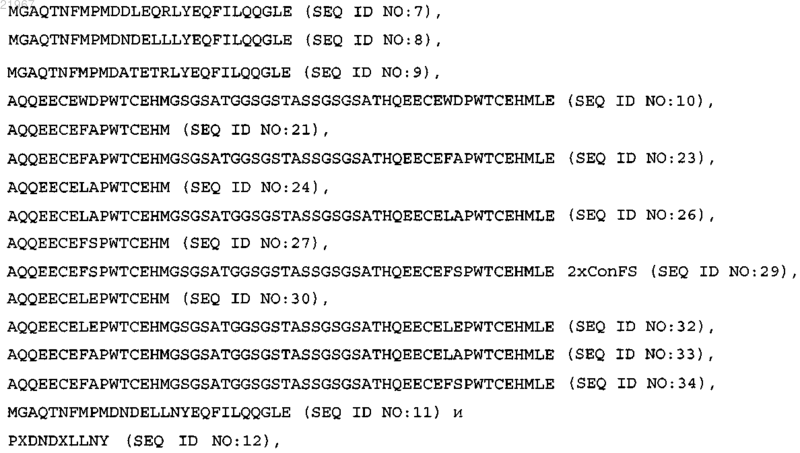
где X выбран из 20 природных аминокислот;
указанный ангиогенный фактор представляет собой VEGF, а указанный MRD содержит последовательность VEPNCDIHVMWEWECFERL (SEQ ID NO:13) или
указанный ангиогенный фактор представляет собой васкулярный "хоминг"-пептид, а указанный MRD содержит последовательность ACDCRGDCFCG (SEQ ID NO:15),
9. Слитый полипептид по любому из пп.1-8, где указанное антитело представляет собой химерное или гуманизированное антитело.
10. Слитый полипептид по любому из пп.1-9, где указанное антитело связывается с ErbB2.
11. Слитый полипептид по п.10, где указанное антитело представляет собой трастузумаб.
12. Слитый полипептид по любому из пп.1-11, где указанный ангиогенный фактор, являющийся мишенью для MRD, представляет собой Ang2.
13. Слитый полипептид по п.12, где указанный MRD содержит SEQ ID NO:8.
14. Слитый полипептид по любому из пп.1-7 и 9-12, где указанный MRD содержит последовательность, выбранную из группы, состоящей из:
MGAQTNFMPMDNDELLLYEQFILQQGLEGGSGSTASSGSGSSLGAQTNFMPMDNDELLLY (SEQ ID NO:20);
XnEFAPWTXn, где n составляет примерно 0-50 аминокислотных остатков (SEQ ID NO:22);
XnELAPWTXn, где n составляет примерно 0-50 аминокислотных остатков (SEQ ID NO:25);
XnEFSPWTXn, где n составляет примерно 0-50 аминокислотных остатков (SEQ ID NO:28);
XnELEPWTXn, где n составляет примерно 0-50 аминокислотных остатков (SEQ ID NO:31);
XnAQQEECEX1X2PWTCEHMXn, где n составляет примерно 0-50 аминокислотных остатков, а X, X1 и Х2 представляют собой любую аминокислоту (SEQ ID NO:57);

15. Выделенный полинуклеотид, содержащий нуклеотидную последовательность, кодирующую слитый полипептид по любому из пп.1-14.
16. Вектор, содержащий полинуклеотид по п.15.
17. Клетка-хозяин, содержащая вектор по п.16, или потомство указанной клетки.
18. Способ лечения рака, включающий введение индивидууму, нуждающемуся в этом, слитого полипептида по любому из пп.1-14.
19. Способ по п.18, где указанный слитый полипептид ингибирует ангиогенез, модулирует ангиогенез или ингибирует рост опухоли.
Текст
ДОСТАВКА АНТИТЕЛ ПОСРЕДСТВОМ МОДУЛЬНОГО ДОМЕНА РАСПОЗНАВАНИЯ В настоящем изобретении описаны антитела, содержащие один или несколько модульных доменов распознавания (MRD), используемых для доставки антител в конкретные участки. В настоящем изобретении также описано применение антител, содержащих один или несколько модульных доменов распознавания, для лечения заболеваний и описаны способы получения антител, содержащих один или несколько модульных доменов распознавания.(71)(73) Заявитель и патентовладелец: ДЗЕ СКРИППС РИСЕРЧ ИНСТИТЬЮТ (US) Область, к которой относится изобретение В общих чертах настоящее изобретение относится к антителам, содержащим один или более модульных доменов распознавания, а более конкретно к применению антител, содержащих один или более указанных модульных доменов распознавания, для лечения заболеваний и к способам получения антител, содержащих один или более указанных модульных доменов распознавания. Предшествующий уровень техники Каталитически активные моноклональные антитела (Ab) могут быть использованы для селективной активации пролекарств и химических превращений. Моноклональные антитела Ab, обладающие альдолазной активностью, действуют как высокоэффективные катализаторы для ряда химических превращений, в частности в альдольных и ретроальдольных реакциях. Ретроальдолазная активность антител Ab,таких как 38 С 2 и 93F3, дает возможность исследователям конструировать, синтезировать и оценивать пролекарства различных химиотерапевтических средств, которые могут активироваться посредством ретроальдольных реакций (конструирование 38 С 2 описано в заявке WO 97/21803, которая вводится в настоящее описание посредством ссылки). 38 С 2 содержит антигенсвязывающий сайт, который катализирует реакцию альдольной конденсации между алифатическим донором и альдегидным акцептором. У сингенных мышей с моделью нейробластомы системное введение пролекарства этопозида и внутриопухолевая инъекция 38 С 2 приводили к ингибированию роста опухоли. Одним из недостатков применения каталитических Ab является отсутствие средства для доставки каталитического Ab в злокачественные клетки. Предварительные исследования показали, что в способе проведения антителозависимой опосредуемой ферментом пролекарственной терапии (ADEPT) или антителозависимой опосредуемой абзимом пролекарственной терапии (ADAPT) ферменты или каталитические антитела могут быть доставлены в опухолевые клетки посредством химического конъюгирования или рекомбинантного присоединения к антителам, предназначенным для доставки. Однако в качестве более эффективной альтернативы может быть использовано каталитическое антитело, присоединенное к пептиду, предназначенному для доставки и расположенному за пределами антигенсвязывающего сайта,что делает активный центр доступным для активации пролекарства. Так, например, присоединение Ab 38C2 к пептиду, связывающемуся с интегрином v3, позволяет антителу селективно локализоваться в опухоли и/или в сосудистой сети опухоли и запускать активацию пролекарства в этой области. Возможность осуществления такого способа терапии была подтверждена данными преклинических и клинических исследований фазы III и дает основание предположить, что пептиды могут быть превращены в полноценные лекарственные средства посредством их присоединения к Fc-областям антитела. Получение биспецифических или мультиспецифических антител, которые могут доставляться одновременно в две или более раковые опухоли-мишени и/или активировать пролекарства, представляет собой новый и перспективный способ лечения раковых и других заболеваний. Такие антитела проиллюстрированы на фиг. 1 настоящего изобретения. Исследования биспецифических антител (BsAb), одновременно нацеленных на два опухолеассоциированных антигена (например, на рецепторы фактора роста), которые проводились для оценки ингибирования путей пролиферации/выживания множества клеток,подтвердили эффективность данного способа. Обычно биспецифические антитела получают путем химического связывания двух различных моноклональных антител или путем слияния двух гибридомных клеточных линий с продуцированием гибридомы-гибрида. Биспецифические четырехвалентные IgGподобные молекулы или иммуноглобулины, состоящие из двух вариабельных доменов, были сконструированы из двух моноклональных антител. Эти иммуноглобулины, состоящие из двух вариабельных доменов, обладают способностью связываться с обоими антигенами в присутствии сыворотки. Однако такие способы имеют определенные недостатки с точки зрения их промышленного получения, выхода и чистоты. Для эффективного получения небольших фрагментов BsAb, таких как диантитело, мини-антитело и гибридные белки Fab-scFv, был разработан ряд рекомбинантных методов. Такие фрагменты BsAb, по сравнению с полноразмерными IgG-подобными молекулами, могут иметь определенные преимущества с точки зрения некоторых клинических применений, таких как радиовизуализация опухолей и доставка в опухоли, поскольку эти фрагменты обладают более высоким уровнем проникновения через ткань и более быстро выводятся из кровотока. С другой стороны, по сравнению с более мелкими фрагментами BsAb,IgG-подобное BsAb может оказаться более предпочтительным для других применений in vivo, а в частности в онкологии, что обусловлено присутствием Fc-домена, который сообщает более длительное время полужизни в сыворотке и сохраняет вторичную иммунную функцию, такую как антителозависимая клеточная цитотоксичность и комплемент-опосредуемая цитотоксичность. Однако в отличие от аналоговфрагментов, конструирование и продуцирование рекомбинантного IgG-подобного BsAb представляет определенные трудности с технической точки зрения, что обусловлено их большим размером (150-200 кДа) и сложностью их структуры. Как показало успешное применение животных-моделей, достигнутый прогресс в данной области оказался очень незначительным. Проведенная недавно оценка ряда конструкций указывает на некоторые успехи в области эффективной экспрессии молекул BsAb, содержащих Fcдомен, в клетках млекопитающих. Другим способом доставки антител является применение пептидных антител. Пептидные антитела,-1 021967 по существу, представляют собой гибриды пептидов с Fc-областями антител. Принимая во внимание успехи в исследованиях рандомизированных пептидных библиотек, проводимых в целях обнаружения пептидных лигандов, обладающих высокой аффинностью по отношению к широкому ряду мишеней, был сделан вывод, что присоединение таких пептидов к Fc-областям антител представляет собой средство,которое превращает пептиды в терапевтические средства-кандидаты благодаря увеличению времени полужизни в кровотоке и повышению активности в результате увеличения валентности. В основе биохимических процессов лежит взаимодействие белков с другими молекулами. Такими взаимодействиями белков являются взаимодействия "рецептор-лиганд", взаимодействия "антителоантиген", контактирование клеток и взаимодействия патогенов с тканями-мишенями. Взаимодействия белков могут включать контактирование с другими белками, углеводами, олигосахаридами, липидами,ионами металлов и с другими веществами. Главным участком взаимодействия белков является область белка, участвующая в контактировании и распознавании, и такая область называется сайтом связывания или сайтом нацеливания. Пептиды, происходящие от библиотеки фагового дисплея, обычно сохраняют свои связывающие свойства при контактировании с другими молекулами. Конкретные пептиды этого типа могут быть получены как модульные блоки специфичности или молекулярные домены распознавания (MRD), которые могут быть объединены для создания единого белка, обладающего специфичностью связывания с несколькими определенными мишенями. Примером такого сайта связывания с определенной мишенью является интегрин. Интегрины представляют собой семейство трансмембранных клеточно-адгезивных молекул, которые состоят из - и субъединиц, и опосредуют присоединение клеток к белкам во внеклеточном матриксе (ЕСМ). В настоящее время известны восемнадцать -субъединиц и восемь -субъединиц, и эти субъединицы образуют 24 различных -гетеродимеров, обладающих различными специфичностями к различным белкам, прикрепляющимся к клеткам ЕСМ. Лигандами для различных интегринов являются фибронектин, коллаген,ламинин, фактор фон Виллебранда, остеопонтин, тромбоспондин и витронектин, каждый из которых является компонентом ЕСМ. Некоторые интегрины могут также связываться с растворимыми лигандами,такими как фибриноген, или с другими адгезивными молекулами на соседних клетках. Известно, что интегрины существуют в различных состояниях активации и обладают различными аффинностями к лиганду. Распознавание растворимых лигандов под действием интегринов строго зависит от специфических изменений конформации рецептора. Это обеспечивает переключение типа молекул, которые регулируют способность клеток к агрегации по интегрин-зависимому механизму и к остановке клеточного цикла в условиях динамической циркуляции в сосудистой системе. Такой механизм был хорошо изучен для лейкоцитов и тромбоцитов, циркулирующих в кровотоке в фазе покоящихся клеток, во время которой экспрессируются неактивированные интегрины. После стимуляции под действием провоспалительных и протромбоцитарных агонистов, клетки этого типа быстро реагируют на ряд молекулярных изменений, включая переход ключевых интегринов, интегринов 2 для лейкоцитов и v3 для тромбоцитов из "покоящегося состояния" в "активированное состояние". Это приводит к остановке клеточного цикла клеток этого типа в сосудистой системе, к стимуляции слипания клеток и к образованию тромбов. Было продемонстрировано, что метастатическая субпопуляция человеческих клеток рака молочной железы экспрессирует интегрин v3 в конститутивно активированной форме. Такое нарушение экспрессии v3 играет определенную роль в метастазировании клеток рака молочной железы, а также рака предстательной железы, меланомы и нейробластомы. Активированный рецептор в высокой степени стимулирует миграцию раковых клеток и приводит к остановке клеточного цикла в кровотоке. Посредством такого механизма активация v3 сообщает метастатическим клеткам ключевые свойства, которые, вероятно, играют решающую роль в их успешной диссеминации и колонизации в органах-мишенях. Опухолевые клетки, которые успешно проникают в орган-мишень, могут также использовать v3 для своего разрастания в новых условиях, поскольку взаимодействие v3 с матриксом может стимулировать выживание и пролиферацию клеток. Так, например, связывание v3 с остеопонтином стимулирует их озлокачествование, а повышение уровней остеопонтина коррелирует с плохим прогнозом рака молочной железы. По этим причинам, и исходя из уже установленной роли интегрина v3 в ангиогенезе, этот интегрин рассматривается как один из наиболее хорошо изученных интегринов. Антагонисты этой молекулы имеют значительный потенциал, который может быть использован для направленной доставки лекарственных средств. Одним из подходов, применяемых для нацеливания на интегрин v3, является способ на основе высокой специфичности связывания пептидов, содержащих последовательность Arg-Gly-Asp(RGD), с v3. Этот трипептид, который обычно присутствует в белках внеклеточного матрикса, представляет собой первичный сайт связывания интегрина v3. Однако при применении репортерных зондов на основе RGD возникают определенные проблемы, связанные с быстрым его клиренсом из кровотока, высоким уровнем поглощения почками и печенью и быстрым выведением из опухоли. Было показано, что химическая модификация циклизованных пептидов RGD приводит к повышению их стабильности и валентности. Затем эти модифицированные пептиды присоединяют к радиоактивным изотопам и используют либо для визуализации опухоли, либо для ингибирования роста опухоли. Интегрин v3 является одним из наиболее хорошо охарактеризованных интегриновых гетеродимеров и одним из нескольких гетеродимеров, участвующих в опухоль-индуцированном ангиогенезе. Несмотря на низкий уровень экспрессии v3 в зрелых кровеносных сосудах, этот интегрин значительно активируется в процессе ангиогенеза in vivo. Экспрессия v3 коррелирует с прогрессированием ракового заболевания молочной железы и шейки матки, а также злокачественной меланомы. Недавно проведенные исследования позволяют предположить, что v3 может быть использован в качестве диагностического или прогностического индикатора для некоторых опухолей. Интегрин v3 является особенно привлекательным в качестве терапевтической мишени, что обусловлено его относительно ограниченным распределением в клетках. Обычно он не экспрессируется на эпителиальных клетках, и на минимальном уровне экспрессируется на клетках других типов. Кроме того, антагонисты v3, включая циклические пептиды RGD и моноклональные антитела, в значительной степени ингибируют индуцированный цитокинами ангиогенез и рост солидных опухолей на куриной хориоаллантоисной мембране. Другой интегриновый гетеродимер, v5, обнаруживает более широкую экспрессию на злокачественных опухолевых клетках и, очевидно, участвует в VEGF-опосредуемом ангиогенезе. Было показано,что v3 и v5 стимулируют ангиогенез различными механизмами: v3 стимулирует ангиогенез посредством bFGF и TNF-, а v5 - посредством VEGF и TGF-. Было также показано, что ингибирование киназы Src может блокировать VEGF-индуцированный, но не FGF2-индуцированный ангиогенез. Полученные результаты явно указывают на то, что FGF2 и VEGF активируют различные пути ангиогенеза, требующие участия v3 и v5 соответственно. Интегрины также участвуют в развитии метастазов опухоли. Метастазы являются основной причиной заболеваемости раком и смертности от рака. Прогрессирование злокачественной меланомы, глиомы,рака яичника и рака молочной железы в высокой степени ассоциируются с экспрессией интегрина v3,а в некоторых случаях, с экспрессией v5. Совсем недавно было показано, что активация интегринаv3 играет значительную роль в развитии метастазов рака молочной железы человека. Была установлена очень строгая корреляция между экспрессией v3 и развитием метастазов рака молочной железы,где нормальный эпителий молочной железы не содержит v3, а приблизительно 50% инвазивных дольчатых карцином и почти все метастазы кости при раке молочной железы экспрессируют v3. Исследования, проводимые на ксенотрансплантатах рака молочной железы, показали, что терапия, проводимая с использованием антагонистов на основе циклического пептида, связывающегося с v3, и применяемая вместе с ней лучевая иммонотерапия оказывают синергическое действие. Ангиогенез, т.е. образование новых кровеносных сосудов из уже существующих сосудов, может играть главную роль в физиологических и патологических процессах. Обычно ангиогенез жестко регулируется про- и антиангиогенными факторами, однако в случае таких заболеваний, как рак, неоваскулярное заболевание глаз, артрит и псориаз, такой процесс может пойти по аномальному пути. Взаимосвязь ангиогенеза с развитием заболеваний делает открытие антиангиогенных соединений особенно привлекательным. Наиболее перспективный фаговый антиангиогенный пептид, описанный в настоящее время и разработанный фирмой Amgen, нейтрализует ангиогенный цитокин Ang2. Что касается ангиогенеза, наиболее широко распространенными молекулами-мишенями являютсяVEGF и их рецепторы, и в настоящее время разрабатываются программы преклинических исследований,нацеленных на совсем недавно открытый путь "ангиопоэтин-Tie2". Оба семейства этих белков участвуют во взаимодействиях "лиганд-рецептор" и включают члены, функции которых в значительной степени ограничены постнатальными эндотелиальными клетками и некоторыми линиями дифференцировки гемопоэтических стволовых клеток. Tie-2 представляет собой тирозинкиназный рецептор с четырьмя известными лигандами, т.е. ангиопоэтинами 1-4 (Ang1-Ang4), из которых наиболее хорошо изучены толькоTie2 оказывает антагонистическое и агонистическое действие на рецептор Tie2. Повышение уровня экспрессии Ang2 в областях нормального и патологического постнатального ангиогенеза косвенно указывает на то, что Ang2 может играть определенную роль в проангиогенезе. Индуцирование Ang2, которое является селективным для определенных сосудов и ассоциируется с ангиогенезом, наблюдается при некоторых заболеваниях, включая рак. У пациентов с карциномой толстой кишки, Ang2 повсеместно экспрессируется в эпителии опухоли, тогда как экспрессия Ang1 в эпителии опухоли, как было обнаружено,происходит достаточно редко. Было высказано предположение, что суммарное повышение активностиAng2 является фактором, инициирующим опухолевый ангиогенез. Другие гибридные белки, направленные против клеточных рецепторов, находятся на стадии клинических испытаний. Герцептин (трастузумаб), разработанный фирмой Genentech, представляет собой рекомбинантное гуманизированное моноклональное антитело, направленное против внеклеточного домена человеческого эпидермального тирозинкиназного рецептора 2 (HER2 или ErbB2). Ген HER2 сверхэкспрессируется в 25% случаев инвазивного рака молочной железы и ассоциируется с плохим прогнозом и изменением чувствительности к действию химиотерапевтических средств. Герцептин блокирует пролиферацию ErbB2-сверхэкспрессирующего рака молочной железы, и в настоящее время, для леченияErbB2-сверхэкспрессирующих метастазов рака молочной железы (МВС), Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) разрешено проведение терапии только антителами против ErbB2. В клетках здорового взрослого человека несколько молекулErbB2 присутствуют на клеточной поверхности, а именно 20000 на клетку, а поэтому могут образовываться несколько гетеродимеров, следовательно, сигналы роста являются относительно слабыми и регулируемыми. При сверхэкпрессии ErbB2, 500000 на клетку, образуется множество гетеродимеров ErbB2,и передача клеточного сигнала усиливается, что приводит к повышению чувствительности к факторам роста и к увеличению числа злокачественных клеток. Это позволяет объяснить, почему сверхэкспрессияErbB2 является индикатором плохого прогноза опухоли молочной железы и может служить прогностическим фактором, позволяющим предсказать ответ на проводимое лечение.ErbB2 представляет собой перспективную и подтвержденную мишень при раке молочной железы, и был обнаружен на участках первичной опухоли и на метастазирующих участках. Герцептин индуцирует быстрое удаление ErbB2 с клеточной поверхности, и снижает его способность к гетеродимеризации и стимуляции роста опухоли. Механизмы действия герцептина, наблюдаемые в экспериментальных моделях in vitro и in vivo, включают ингибирование протеолиза внеклеточного домена ErbB2, нарушение последующих путей передачи сигнала, таких как каскады реакций фосфатидилинозит-3-киназы (P13K) и активированной митогеном протеинкиназы (MAPK), остановку клеточного цикла на фазе G1, ингибирование репарации ДНК, подавление ангиогенеза и индуцирование антителозависимой клеточной цитотоксичности (ADCC). Однако у большинства пациентов с метастазами рака молочной железы, которые вначале были восприимчивыми к действию герцептина, через один год после начала лечения наблюдалось прогрессирование данного заболевания. Другим клеточным рецептором-мишенью является рецептор инсулиноподобного фактора роста-1 типа 1 (IGF-1R), где IGF-1R представляет собой тирозинкиназный рецептор, который играет решающую роль в сохранении передачи клеточного сигнала и в пролиферации клеток. Регуляция системы IGF в раковых клетках часто нарушается в результате образования аутокринных петель, играющих определенную роль в сверхэкспрессии IGF-I или -II и/или IGF-1R. Кроме того, эпидемиологические исследования дают основание предположить о наличии взаимосвязи между повышенными уровнями IGF и развитием большинства человеческих раковых заболеваний, таких как рак молочной железы, рак толстой кишки,рак легких и рак предстательной железы. Экспрессия IGF и их когнатных рецепторов коррелирует со стадией развития заболевания, со снижением выживаемости клеток, с развитием метастазов и дедифференцировкой опухоли. Помимо IGF-1R в онкогенезе различных раковых заболеваний участвует эпидермальный рецептор фактора роста (EGFR). Эффективное ингибирование опухоли было достигнуто экспериментально и клинически с применением ряда стратегий, которые обеспечивают подавление любой активности рецепторов. Из-за большого числа путей передачи сигнала роста в опухолевых клетках, ингибирование одной функции рецептора (например, EGFR) может эффективно компенсироваться активацией путей, опосредуемых другими рецепторами факторов роста (например, IGF-1R). Так, например, недавно проведенные исследования показали, что клеточные линии злокачественной глиомы, экспрессирующие эквивалентный EGFR, имеют значительно отличающуюся восприимчивость к ингибированию EGFR в зависимости от их способности активировать IGF-1R и от последующих путей передачи сигнала. Другие исследования также продемонстрировали, что сверхэкспрессия и/или активация IGF-1R в опухолевых клетках может вносить свой вклад в их резистентность к химиотерапевтическим средствам, к лучевой терапии или терапии с использованием антител, таких как герцептин. А поэтому ингибирование передачи сигнала под действием IGF-1R приводит к повышению восприимчивости опухолевых клеток к герсептину.EGFR представляет собой тирозинкиназный рецептор, который экспрессируется во многих нормальных тканях, а также в области опухолевого поражения большинства органов. СверхэкспрессияEGFR или экспрессия мутантных форм EGFR наблюдается во многих опухолях, а в частности в опухолях эпителия, и ассоциируется с плохим клиническим прогнозом. Ингибирование передачи сигнала посредством этого рецептора приводит к индуцированию противоопухолевого действия. После того как в феврале 2004 г. Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) было дано разрешение на применение антитела Cetuximab, также известного как эрбитукс (Erbitux)(химерное антитело "мышь/человек"), главной мишенью для этого антитела, разрешенного для применения в качестве лекарственного средства для лечения метастазов рака прямой и ободочной кишки, стал EGFR. В марте 2006 г. FDA было также дано разрешение на применение эрбитукса для лечения плоскоклеточной карциномы головы и шеи (SCCHN). Позднее было получено разрешение на применение полностью человеческого антитела против EGFR для лечения метастазов рака прямой и ободочной кишки. Ни одно из этих лекарственных средств не является автономным средством для лечения рака прямой и ободочной кишки, т.е. они были разрешены только как вспомогательные лекарственные средства, которые должны применяться вместе с уже существующими схемами лечения рака прямой и ободочной кишки. При раке прямой и ободочной кишки эрбитукс применяется в комбинации с лекарственным средством иринотеканом, а вектибикс вводят после прогрессирования заболевания при проведении или после проведения химиотерапии с использованием фторпиримидина, оксалиплатины и ирино-4 021967 текана. Эрбитукс был разрешен как единственное средство для лечения рецидивирующей или метастазирующей SCCHN, но только в том случае, если ранее проводимая химиотерапия на основе платины не давала результата. В настоящее время проводится все больше и больше клинических испытаний, в которых эти лекарственные средства используются для нацеливания на немелкоклеточную карциному легких. Последовательность эрбитукса или анти-EGFR антитела хорошо известна специалистам (см., например, публикацию Goldstein, et al., Clin.Cancer Res. 1:1311, 1995; патент США 6217866, которая вводится в настоящее описание посредством ссылки). Проблема, возникающая при применении каталитического антитела в целях селективной активации пролекарства в противораковой терапии, заключается в системной доставке такого антитела в опухоль. В настоящем изобретении описан способ, который основан на адаптации пептидов, связывающихся с мишенью, или модульных доменов распознавания (MRD) и на последующем их присоединении к полноразмерным антителам, эффективным для доставки в опухолевые клетки, или к растворимым молекулам с сохранением способности каталитического антитела активировать пролекарства. Поскольку присоединение MRD к антителу осуществляют так, чтобы это не приводило к значительному снижению уровня связывания с традиционным антигенсвязывающим сайтом, то специфичность такого антитела после присоединения к нему MRD остается неизменной. Как показано на фиг. 2, MRD, обозначенные треугольниками, кружками и квадратами, могут быть присоединены к любому концу тяжелых или легких цепей типичного антитела. Первая схема представляет простое пептидное антитело с пептидом, присоединенным к С-концу Fc. Этот способ позволяет получить би-, три-, тетра- и пента-специфические антитела. Представление одного MRD у каждого N- и Сконца IgG обеспечивает восьмивалентное отображение MRD. В качестве альтернативы к конструированию би- и мультифункциональных антител посредством комбинации вариабельных доменов антител,применение высокоаффинных пептидов, выбранных из библиотек фагового дисплея или происходящих от природных лигандов, дает возможность разработать высокоуниверсальный и модульный способ конструирования многофункциональных антител, который позволяет сохранить преимущества традиционных антител в отношении их связывания и времени полужизни. MRD могут также повышать способность некаталитических антител к связыванию, что дает возможность разработать эффективный способ повышения функционального связывания антител, применяемый, в частности, в терапевтических целях. Описание сущности изобретения Настоящее изобретение относится к полноразмерному антителу, содержащему модульный домен распознавания (MRD). В настоящем изобретении также рассматриваются варианты и производные такихMRD-содержащих антител. В одном из аспектов изобретения антитело и MRD функционально связаны друг с другом посредством пептидного линкера. В одном из аспектов изобретения пептидный линкер имеет длину в 2-20 пептидов или 4-10 или примерно 4-15 пептидов. В одном из аспектов изобретения пептидный линкер содержит последовательность GGGS (SEQ ID NO:1), последовательность или последовательность Настоящее изобретение включает и другие линкеры, содержащие коровую последовательность GGGS, представленную в SEQ ID NO:1, где указанный пептидный линкер имеет примерно 4-20 аминокислот. В соответствии с другим вариантом изобретения MRD функционально связан с С-концом тяжелой цепи антитела. В другом аспекте изобретения MRD функционально связан с N-концом тяжелой цепи антитела. В еще одном аспекте изобретения MRD функционально связан с С-концом легкой цепи антитела. В другом аспекте изобретения MRD функционально связан с N-концом легкой цепи антитела. В другом аспекте изобретения два или более MRD функционально связаны с любым концом антитела. В другом аспекте изобретения два или более MRD функционально связаны с двумя или более концами антитела. В одном из вариантов настоящего изобретения мишенью для MRD является клеточный антиген. В одном из вариантов настоящего изобретения мишенью MRD является CD20. В одном из вариантов изобретения мишенью для MRD является интегрин. В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на интегрин, представляет собойYCRGDCT (SEQ ID NO:3). В другом аспекте изобретения пептидная последовательность MRD, нацеленного на интегрин, представляет собой PCRGDCL (SEQ ID NO:4). В еще одном аспекте изобретения пептидная последовательность MRD, нацеленного на интегрин, представляет собой TCRGDCY (SEQ IDNO:5). В другом аспекте изобретения пептидная последовательность MRD, нацеленного на интегрин,представляет собой LCRGDCF (SEQ ID NO:6). В одном из вариантов изобретения мишенью для MRD является ангиогенный цитокин. В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на ангиогенный цитокин, предВ другом аспекте изобретеставляет собой ния пептидная последовательность MRD, нацеленного на ангиогенный цитокин, представляет собой В еще одном аспекте изобретения пептидная последовательность MRD, нацеленного на ангиогенный цитокин, представляет собой В другом аспекте изобретения пептидная ангиогенный цитокин,представляет собой В другом аспекте изобретения пептидная последовательность MRD, нацеленного на ангиогенный цитокин,представляет собой В другом аспекте изобретения пептидная последовательность MRD, нацеленного на ангиогенный цитокин, представляет собой где X представляет собой одну из 20 природных аминокислот. В другом варианте изобретения нацеливающий пептид MRD имеет коровую последовательность где X представляет собой любую аминокислоту, а n равно примерно от 0 до 15. В другом варианте изобретения нацеливающий пептид MRD содержит коровую последовательность, выбранную из:XnEFAPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:22);XnELAPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:25);XnEFSPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:28);XnELEPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:31);Xn AQQEECEX1X2PWTCEHMXn, где n составляет примерно от 0 до 50 аминокислотных остатков,а X, X1 и X2 представляют собой любую аминокислоту (SEQ ID NO:57). Репрезентативными пептидами, содержащими такие коровые пептиды, являются, например: последовательность В одном из вариантов изобретения мишенью для MRD является ErbB2. В одном из вариантов изобретения мишенью для MRD является ErbB3. В одном из вариантов изобретения мишенью для MRD является эпителиальная клеточно-адгезивная молекула опухолеассоциированного поверхностного антигена(Ер-САМ). В одном из вариантов изобретения мишенью для MRD является VEGF. В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на VEGF, представляет собой В одном из вариантов изобретения мишенью для MRD является рецептор инсулиноподобного фактора роста-I. В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на рецептор инсулиноподобного фактора роста-I,представляет собой Другими репрезентативными MRD, нацеленными наX2 представляет собой любую аминокислоту; Х 3 представляет собой любую аминокислоту; Х 4 представляет собой любую аминокислоту и Х 5 представляет собой любую аминокислоту. Репрезентативными пептидами, имеющими указанную формулу, являются: В одном из вариантов изобретения мишенью для MRD является опухолевый антиген. В одном из вариантов изобретения мишенью для MRD является рецептор эпидермального фактора роста (EGFR). В одном из вариантов изобретения мишенью для MRD является ангиогенный фактор. В одном из вариантов изобретения мишенью для MRD является ангиогенный рецептор. В одном из вариантов изобретения для MRD представляет собой васкулярный "хоминг"-пептид. В одном из аспектов изобретения пептидная последовательность васкулярного "хоминг"-пептида представляет собой В одном из вариантов изобретения мишенью для MRD является фактор роста нервной ткани. В одном из вариантов изобретения указанное антитело связывается с антигеном клеточной поверхности. В одном из вариантов изобретения указанное антитело или MRD связывается с EGFR, ErbB2,ErbB3, ErbB4, CD20, рецептором инсулиноподобного фактора роста-I или с мембранным антигеном,специфичным для предстательной железы. В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на EGFR, представляет собой В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на EGFR, представляет собой В одном из аспектов изобретения пептидная последовательность MRD, нацеленного на ErbB2, представляет собой В одном из вариантов изобретения указанное антитело связывается с ангиогенным фактором. В одном из вариантов изобретения указанное антитело связывается с ангиогенным рецептором. Настоящее изобретение также относится к выделенному полинуклеотиду, содержащему нуклеотидную последовательность антитела. В одном из аспектов изобретения вектор содержит полинуклеотид. В еще одном аспекте изобретения указанный полинуклеотид функционально связан с регуляторной последовательностью, регулирующей экспрессию последовательности в данном полинуклеотиде. В одном из аспектов изобретения клетка-хозяин или ее потомство включает указанный полинуклеотид. Настоящее изобретение также относится к способу лечения заболевания у индивидуума, нуждающегося в этом, где указанный способ включает введение антитела, содержащего MRD. В одном из аспектов изобретения указанным заболеванием является рак. В другом аспекте изобретения нежелательный ангиогенез подвергается ингибированию. В еще одном аспекте изобретения ангиогенез является модулированным. В другом аспекте изобретения рост опухоли подвергается ингибированию. В другом варианте изобретения описан способ лечения, включающий введение дополнительного терапевтического средства вместе с MRD-содержащим антителом. Настоящее изобретение также относится к способу получения полноразмерного антитела, содержащего описанный MRD. В одном из аспектов изобретения указанный MRD происходит от библиотеки фагового дисплея. В другом аспекте изобретения указанный MRD происходит от природных лигандов. В одном из вариантов настоящего изобретения указанное антитело является химерным или гуманизированным. Краткое описание графического материала На фиг. 1 схематически представлены различные конструкции четырехвалентных IgG-подобныхBsAb. На фиг. 2 А показано типичное пептидное антитело в виде С-концевого гибрида с Fc. На фиг. 2 В показано антитело, имеющее С-концевой гибрид MRD с легкой цепью антитела. На фиг. 2 С показано антитело, имеющее N-концевой гибрид MRD с легкой цепью антитела. На фиг. 2D показано антитело, имеющее уникальные пептиды MRD, присоединенные к каждому концу антитела. На фиг. 3 представлены результаты ELISA-анализа, в котором интегрин и Ang2 были связаны посредством антитела против интегрина, присоединенного к MRD, нацеленному на ang-2. На фиг. 4 представлены результаты ELISA-анализа, в котором интегрин и Ang2 были связаны посредством антитела против интегрина, присоединенного к MRD, нацеленному на ang-2. На фиг. 5 представлены результаты ELISA-анализа, в котором анти-ErbB2 антитело было присоединено к MRD, нацеленному на AngZ. На фиг. 6 представлены результаты ELISA-анализа, в котором MRD, нацеленный на Ang2, был присоединен к антителу, связывающемуся с рецептором фактора роста гепатоцитов. На фиг. 7 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин, был присоединен к антителу, связывающемуся с ErbB2. На фиг. 8 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин, был присоединен к антителу, связывающемуся с рецептором фактора роста гепатоцитов. На фиг. 9 представлены результаты ELISA-анализа, в котором MRD, нацеленный на рецептор инсулиноподобного фактора роста-I, был присоединен к антителу, связывающемуся с ErbB2. На фиг. 10 представлены результаты ELISA-анализа, в котором MRD, нацеленный на VEGF, был присоединен к антителу, связывающемуся с ErbB2. На фиг. 11 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин, был присоединен к каталитическому антителу. На фиг. 12 представлены результаты ELISA-анализа, в котором MRD, нацеленный на Ang-2, был присоединен к каталитическому антителу. На фиг. 13 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин иAng-2, был присоединен к антителу, связывающемуся с ErbB2. На фиг. 14 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин, был присоединен к антителу, связывающемуся с ErbB2. На фиг. 15 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин,Ang-2 или рецептор инсулиноподобного фактора роста-I, был присоединен к антителу, связывающемуся с ErbB2 или с рецептором фактора роста гепатоцитов, посредством короткого линкерного пептида. На фиг. 16 представлены результаты ELISA-анализа, в котором MRD, нацеленный на интегрин,Ang-2 или рецептор инсулиноподобного фактора роста-I, был присоединен к антителу, связывающемуся с ErbB2 или с рецептором фактора роста гепатоцитов, посредством длинного линкерного пептида. Подробное описание изобретения Используемый здесь термин "антитело" означает интактные молекулы иммуноглобулина и включает поликлональные и моноклональные антитела, химерные антитела, одноцепочечные антитела и гуманизированные антитела. Интактное антитело включает по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанных между собой дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначаемой здесь VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, СН 2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначаемой здесь VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть также подразделены на гипервариабельные области, называемые комплементарность-определяющими областями (CDR) и перемежающиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, расположенных в направлении от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Используемый здесь термин "биспецифическое антитело" означает молекулу иммуноглобулина,содержащую иммуноглобулины, состоящие из двух вариабельных доменов, где два указанных вариабельных домена могут быть сконструированы из любых двух моноклональных антител."Антигенсвязывающий сайт" представляет собой структурную часть молекулы антитела, состоящую из вариабельных и гипервариабельных областей тяжелой и легкой цепи, которые специфически связываются с антигеном (вступают в иммунную реакцию с антигеном). Термин "иммунная реакция",используемый в своих различных формах, означает специфическое связывание молекулы, содержащей антигенную детерминанту, и молекулы, содержащей антигенсвязывающий сайт, такой как целая молекула антитела или ее часть. Термин "пептидное антитело" означает пептид или полипептид, включающий неполноразмерное интактное антитело. Термин "природный", если он используется в сочетании с биологическими материалами, такими как молекулы нуклеиновой кислоты, полипептиды, клетки-хозяева и т.п., относится к веществам, которые встречаются в природе и не были модифицированы человеком. Термин "моноклональное антитело" означает популяцию молекул антител, которые содержат антигенсвязывающий сайт антитела только одного вида, способный вступать в иммунную реакцию с конкретным эпитопом. Таким образом, моноклональное антитело обычно обладает одинаковой аффинностью связывания с любым эпитопом, с которым оно взаимодействует. Поэтому моноклональное антитело может содержать молекулу антитела, имеющую множество антигенсвязывающих сайтов, каждый из которых является иммуноспецифичным для различных эпитопов, и таким антителом является, например,биспецифическое моноклональное антитело."Модульный домен распознавания" (MRD) или "пептид, связывающийся с мишенью" представляет собой молекулу, такую как белок, гликопротеин и т.п., которая может специфически связываться (т.е. не будет неспецифически связываться) с молекулой-мишенью. Аминокислотная последовательность сайтаMRD может иметь некоторую степень вариабельности и при этом сохранять достаточную способность связываться с молекулой-мишенью. Кроме того, изменения в последовательности могут приводить к изменениям специфичности связывания и константы связывания предварительно выбранной молекулымишени с сайтом связывания. Термин "рецептор клеточной поверхности" означает молекулы и их комплексы, способные принимать сигнал и передавать такой сигнал через плазматическую мембрану клетки. Примером рецептора клеточной поверхности согласно изобретению является активированный интегриновый рецептор, например активированный интегриновый рецептор v3 на метастазирующей клетке."Сайт связывания с мишенью" или "сайт нацеливания на мишень" представляет собой любую известную или пока еще не описанную аминокислотную последовательность, обладающую способностью селективно связываться с предварительно выбранным агентом. Репрезентативные стандартные сайты нацеливания происходят от RGD-зависимых лигандов интегрина, а именно фибронектина, фибриногена,витронектина, фактора фон Виллебранда и т.п., от клеточных рецепторов, таких как VEGF, ErbB2, васкулярный "хоминг"-пептид или ангиогенные цитокины, от рецепторов белковых гормонов, таких как рецептор инсулиноподобного фактора роста-I, рецептор эпидермального фактора роста и т.п., и от опухолевых антигенов. Термин "белок" определен как биологический полимер, содержащий звенья, происходящие от аминокислот, связанных пептидными связями, где указанный белок может состоять из двух или более цепей."Гибридный полипептид" представляет собой полипептид, состоящий по меньшей мере из двух полипептидов и, необязательно, линкерной последовательности, которая функционально связывает два полипептида с образованием одного непрерывного полипептида. Эти два связанных полипептида, образующие гибридный полипептид, обычно происходят от двух независимых источников, а поэтому гибридный полипептид содержит два связанных полипептида, которые обычно не являются связанными в природе. Термин "линкер" означает пептид, расположенный между антителом и MRD. Линкеры могут составлять примерно от 2 до 20 аминокислот, а обычно они составляют от 4 до 15 аминокислот. Термин "клетка-мишень" означает любую клетку индивидуума (например, человека или животного), на которую может быть нацелено MRD-содержащее антитело согласно изобретению. Клеткоймишенью может быть клетка, экспрессирующая или сверхэкспрессирующая сайт связывания с мишенью,такой как активированный рецептор интегрина. Используемые здесь термины "пациент", "индивидуум", "животное" или "млекопитающее" являются взаимозаменяемыми и относятся к млекопитающим, таким как человек и приматы, не являющиеся человеком, а также к экспериментальным животным, таким как кролики, крысы и мыши, и к другим животным. Животными являются все позвоночные, например, млекопитающие и не млекопитающие, такие как овцы, собаки, коровы, куры, амфибии и рептилии. Термины "лечение" или "терапия" включают введение антитела, содержащего MRD согласно изобретению, в целях предупреждения или замедления развития симптомов, осложнений или биохимических признаков заболевания, ослабления симптомов или прекращения или ингибирования дальнейшего развития указанного заболевания, состояния или расстройства. Лечение может быть профилактическим(для предупреждения или замедления развития заболевания, или для предотвращения проявления его клинических или субклинических симптомов), либо оно может быть терапевтическим и применяется для подавления или ослабления симптомов после появления признаков заболевания. Лечение может быть проведено с использованием только композиции "антитело-MRD", либо с использованием комбинации с другим терапевтическим средством. Используемые здесь термины "фармацевтически приемлемый" или "физиологически толерантный" и их грамматические варианты, если они относятся к композициям, носителям, разбавителям и реагентам, являются синонимами и означают, что указанные агенты могут быть введены человеку вовнутрь или наружно, и не продуцируют у него нежелательные физиологические эффекты, такие как тошнота, голо-9 021967 вокружение, расстройство желудка и т.п. Термин "модулировать" означает корректировать или регулировать диапазон, частоту, степень или активность. В другом родственном аспекте изобретения такая модуляция может быть позитивной (например, увеличение частоты, степени или активности) или негативной (например, снижение частоты,степени или активности). Используемые здесь термины "рак", "опухоль" или "злокачественное заболевание" являются синонимами и означают любое заболевание, которое характеризуется нерегулируемой аномальной пролиферацией клеток, способностью пораженных клеток к локальному распространению или проникновению через кровеносную систему и лимфатическую систему в другие части организма (т.е. способностью к метастазированию), а также означают любые характерные структурные и/или молекулярные признаки. Термины "раковые", "опухолевые" или "злокачественные" клетки означают клетки, которые обладают специфическими структурными свойствами, неспособны к дифференциации и обладают способностью к инвазии и метастазированию. Примерами раковых опухолей являются раковые опухоли молочной железы, легких, головного мозга, кости, печени, почек, толстой кишки, головы и шеи, яичника, гемопоэтической системы (например, лейкоз) и предстательной железы. Термины "гуманизированное антитело" или "химерное антитело" включают антитела, в которых последовательности CDR, происходящие от зародышевой линии млекопитающего другого вида, такого как мышь, были присоединены к человеческим каркасным последовательностям. В настоящем изобретении описан способ, основанный на получении связывающихся с мишенью пептидов или модульных доменов распознавания (MRD) в виде гибридов с каталитическими или некаталитическими антителами, которые обеспечивают их эффективное нацеливание на опухолевые клетки или растворимые молекулы, но при этом сохраняют способность интактного каталитического антитела к активации пролекарства. MRD могут также усиливать связывающую способность некаталитических антител, что позволяет получить эффективное средство для усиления функционального связывания антител, в частности, в целях проведения терапии. В одном из своих аспектов настоящее изобретение относится к получению полноразмерного антитела, содержащего модульный домен распознавания (MRD). Взаимодействие белкового лиганда с сайтом его связывания с рецептором часто происходит в относительно широкой области контакта. Однако связывание происходит, главным образом, лишь в нескольких ключевых остатках этой области контакта. Таким образом, молекулы пептидов (обычно длиной 2-60 аминокислот) могут связываться с белком рецептора данного крупного белка-лиганда. При этом предусматривается, что MRD согласно изобретению содержат пептидную последовательность, которая связывается с представляющими интерес сайтами мишени и содержит примерно от 2 до 60 аминокислот). Роль интегринов, таких как v3 и v5, в качестве опухоль-ассоциированных маркеров, была хорошо изучена. Недавно проведенное исследование 25 стабильных человеческих клеточных линий, полученных от клеток прогрессирующей раковой опухоли яичника, продемонстрировало, что все линии были позитивными по экспрессии v5, а многие из них были позитивными по экспрессии v3. Исследования также показали, что v3 и v5 в высокой степени экспрессируются на злокачественных опухолевых тканях шейки матки человека. Было также продемонстрировано, что интегрины обладают терапевтическим действием у животных с моделью саркомы Капоши, меланомы и рака молочной железы. Ряд антагонистов интегринов v3 и v5 проходит клинические испытания. Такими антагонистами являются циклические пептиды RGD и синтетические низкомолекулярные миметики RGD. Два антагониста интегрина на основе антител в настоящее время проходят клинические испытания на возможность их применения для лечения рака. Антагонистом первого ряда является витаксин, т.е. гуманизированная форма мышиного антитела LM609 против человеческого v3. Испытание фазы I, проводимое с увеличением дозы для пациентов, страдающих раком, показало, что такое средство является безопасным для введения человеку. Другим антителом, используемым в клинических испытаниях, является CNT095,т.е. полностью человеческое mAb, которое распознает интегрины v. Исследование фазы I, проводимое путем введения пациентам с различными солидными опухолями средства CNT095, показало, что такое средство хорошо переносится пациентами. Исследования фазы I также подтвердили, что циленгитид,пептидный антагонист v3 и v5, является безопасным. Кроме того, было проведено множество исследований по доставке и визуализации лекарственных средств, и эти исследования были осуществлены с использованием лигандов для этих рецепторов. Указанные преклинические и клинические наблюдения продемонстрировали важную роль нацеливания на v3 и v5, а исследования данной стратегии, проводимые с использованием антител, со всей очевидностью показали, что нацеливание на эти интегрины является безопасным. Примером интегрин-связывающего MRD является сайт связывания, содержащий трипептид RGD, и в настоящей заявке описаны репрезентативные общие методы получения такого MRD. Лиганды, имеющие мотив RGD в качестве минимального домена распознавания, хорошо известны специалистам, и их неполный перечень включает фибронектин (31, 51, v1, IIb3, v3 и 31), фибриноген (М 2 и IIb1), фактор фон Виллебранда (IIb3 и v3) и витронектин (IIb3, v3 и v5), где в скобках В настоящем изобретении также рассматривается MRD, который имитирует независимый от RGD сайт связывания на интегриновом рецепторе, имеющий мишень-связывающую специфичность высокоаффинного лиганда, и который распознает выбранный интегрин. Ангиогенез является главным фактором во многих физиологических и патологических процессах. Было показано, что Ang2 действует как проангиогенная молекула. Введение Ang2-селективных ингибиторов является достаточным для подавления опухолевого ангиогенеза и ангиогенеза роговицы. Поэтому ингибирование только Ang2 или в комбинации с ингибированием других ангиогенных факторов, таких как VEGF, может представлять собой эффективную антиангиогенную стратегию лечения пациентов с солидными опухолями. При этом считается, что MRD, используемые в настоящем изобретении, включают MRD, которые связываются с ангиогенными рецепторами, ангиогенными факторами и/или с Ang-2. Примеры последовательностей MRD, нацеленных на ангиогенные цитокины, перечислены ниже: Очевидно, что такие пептиды могут присутствовать в димерах, тримерах или в других мультимерах, которые по своей природе являются гомологичными или гетерологичными. Так, например, один пептид может димеризоваться подобно Con-содержащим последовательностям, таким как 2ConFA, с образованием гомологичного димера, либо Con-пептиды могут быть смешанными, так, например, ConFA может быть объединен с ConLA для создания гетеродимера ConFA-LA с последовательностью Другим гетеродимером является ConFA, который при объединении с ConFS образует ConFA-FS с последовательностью Для специалиста в данной области очевидно, что в соответствии с приведенным здесь описанием могут быть получены любые другие комбинации для создания описанных здесь функциональных Ang2 связывающих MRD. В одном из своих аспектов настоящее изобретение включает пептид, имеющий последовательность где X1 представляет собой Е или D; X2 представляет собой любую аминокислоту; X3 представляет собой любую аминокислоту; Х 4 представляет собой любую аминокислоту и Х 5 представляет собой любую аминокислоту. Настоящее изобретение также включает пептиды, имеющие коровую последовательность, выбранную из:XnEFAPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:22);XnELAPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:25);XnEFSPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:28);XnELEPWTXn, где n составляет примерно от 0 до 50 аминокислотных остатков (SEQ ID NO:31) илиXnAQQEECEX1X2PWTCEHMXn, где n составляет примерно от 0 до 50 аминокислотных остатков, аX, X1 и X2 представляют собой любую аминокислоту (SEQ ID NO:57). Имеются сообщения об исследованиях по отбору методом фагового дисплея и о структурных исследованиях VEGF-нейтрализующих пептидов в комплексе с VEGF. Эти исследования показали, что пептид v114 является VEGF-специфическим, связывается с VEGF с аффинностью 0,2 мкМ и нейтрализует VEGF-индуцированную пролиферацию человеческих эндотелиальных клеток пупочной вены (HUVEC). Поскольку VEGF представляет собой гомодимер,то пептид занимает два идентичных сайта у любого конца гомодимера VEGF. В настоящем изобретении рассматривается антитело, содержащее MRD, нацеленный на VEGF. Описание анти-VEGF антител можно найти, например, в публикации Cancer Research 57, 4593-4599, Oct. 1997; J. Biol. Chem. 281:10 6625,2006, которая вводится в настоящее описание посредством ссылки. В настоящем изобретении могут быть использованы MRD, специфичные к рецептору инсулиноподобного фактора роста-I. Одним из примеров последовательности MRD, нацеленной на рецептор инсулиноподобного фактора роста-I, является Дополнительными MRD, нацеленными на IGF-1R, являются следующие последовательности: В ряде исследований эффективность связывания васкулярного "хоминг"-пептида с другими белками, такими IL-12, или с лекарственными средствами была охарактеризована с точки зрения возможности их прямой доставки в организм животных. В настоящем изобретении рассматривается применение самих васкулярных "хоминг"-пептидов в качестве MRD. Одним из примеров последовательности MRD, который представляет собой васкулярный "хоминг"-пептид, является В настоящем изобретении рассматривается множество других сайтов связывания с мишенью,включая рецептор эпидермального фактора роста (EGFR), CD20, опухолевые антигены, ErbB2, ErbB3,ErbB4, рецептор инсулиноподобного фактора роста-I, фактор роста нервных тканей (NGR), рецептор фактора роста гепатоцитов и эпителиальная клеточно-адгезивная молекула опухолеассоциированного поверхностного антигена (Ер-САМ). MRD могут быть направлены на указанные сайты связывания с мишенью. Примеры последовательностей MRD, которые связываются с EGFR, перечислены ниже: Пример последовательности MRD, которая связывается с ErbB2, приводится ниже: Последовательность MRD может быть определена несколькими способами. ПоследовательностиMRD могут происходить от природных лигандов или известных последовательностей, связывающихся со специфическим сайтом связывания с мишенью, который может быть использован. Кроме того, технология фагового дисплея была разработана как высокоэффективный метод идентификации пептидов, связывающихся с рецепторами-мишенями. В пептидных библиотеках фагового дисплея, рандомизированные пептидные последовательности могут быть представлены посредством их присоединения к белкам оболочки нитчатого фага. Методы выявления сайтов связывания на полипептидах с применением векторов фагового дисплея были уже описаны, в частности, в WO 94/18221. Такие методы по существу включают использование системы экспрессионных векторов на поверхности нитчатого фага (фагмиды) для клонирования и экспрессии полипептидов, которые связываются с предварительно отобранным и представляющим интерес сайтом-мишенью. Способы согласно изобретению, применяемые для получения MRD, включают использование векторов фагового дисплея в целях их конкретного применения для скрининга очень большой популяции экспрессируемых выявляемых белков и для определения локализации одного или нескольких специфических клонов, кодирующих нужный реакционно-активный сайт связывания с мишенью. После выявления последовательности MRD указанные пептиды могут быть получены любыми методами, описанными в литературе. Варианты и производные MRD входят в объем настоящего изобретения. В объем настоящего изобретения входят варианты с инсерциями, делециями и заменами, а также варианты, включающие представленные здесь MRD с дополнительными аминокислотами у N- и/или С-конца, включая примерно 050, 0-40, 0-30, 0-20 аминокислот и т.п. При этом следует отметить, что конкретный MRD согласно изобретению может содержать варианты одного, двух или всех трех типов. Варианты с инсерциями и заменами могут содержать природные аминокислоты, редкие аминокислоты или то и другое. В настоящем изобретении рассматривается использование каталитических и некаталитических антител. Антитело 38 С 2 представляет собой антитело-секретирующую гибридому, и такое антитело было ранее описано в WO 97/21803. 38 С 2 содержит антигенсвязывающий сайт, катализирующий реакцию альдольной конденсации между алифатическим донором и альдегидным акцептором. У сингенных мышей с моделью нейробластомы системное введение пролекарства этопозида и внутриопухолевая инъек- 13021967 ция Ab 38 С 2 приводили к ингибированию роста опухоли. Другими представляющими интерес антителами согласно изобретению являются A33-связывающие антитела. Человеческий антиген A33 представляет собой трансмембранный гликопротеин, принадлежащий к суперсемейству Ig. Функция человеческого антигена A33 в здоровой и злокачественной ткани толстой кишки пока еще не ясна, однако некоторые свойства антигена A33 позволяют предположить, что он может быть перспективной мишенью для иммунотерапии рака толстой кишки. Такими свойствами являются (i) профиль в высокой степени ограниченной экспрессии антигена A33, (ii) экспрессия больших количеств антигена A33 на раковых клетках толстой кишки, (iii) отсутствие секретированного или слущенного антигена A33, (iv) после связывания анти-A33 антитела с антигеном A33, указанное анти-A33 антитело подвергается интернализации и секвестрации в везикулах, и (v) как показали предварительные клинические исследования, антиген A33, экспрессирующийся в раковой опухоли толстой кишки, является мишенью для анти-A33 антитела. Присоединение MRD, направленного против A33, к каталитическому или некаталитическому антителу, должно приводить к повышению терапевтической эффективности антител, нацеленных на A33. В настоящем изобретении также рассматривается получение моно-, би-, три-, тетра- и пентаспецифических антител. Также предусматривается, что антитела, используемые в настоящем изобретении, могут быть получены любым методом, известным специалистам. В гибридных молекулах "антитело-MRD", полученных в соответствии с настоящим изобретением,MRD может быть присоединен к антителу у N-конца или С-конца посредством пептида. MRD может быть присоединен к антителу у С-конца тяжелой цепи антитела, у N-конца тяжелой цепи антитела, у Сконца легкой цепи антитела или у N-конца легкой цепи антитела. MRD может быть присоединен к антителу непосредственно или посредством необязательного пептидного линкера, который может иметь длину от 2 до 20 пептидов. Пептидный линкер может содержать короткий линкерный пептид с последовательностью GGGS (SEQ ID NO:1), линкерный пептид средней длины с последовательностью или длинный линкерный пептид с последовательностью Настоящее изобретение также относится к двум или болееMRD, связанным с любым концом антитела. При этом также предусматривается, что два или более MRD могут быть присоединены к двум или более концам антитела либо непосредственно, либо посредством линкерного пептида. Множество MRD может быть нацелено на один и тот же сайт связывания с мишенью или на два или более различных сайтов связывания с мишенью. Для повышения in vivo стабильности MRD могут быть присоединены дополнительные пептидные последовательности. Гибридные молекулы "антитело-MRD" могут кодироваться полинуклеотидом, содержащим нуклеотидную последовательность. Вектор может содержать полинуклеотидную последовательность. Полинуклеотидная последовательность может быть также присоединена к регуляторной последовательности,регулирующей экспрессию полинуклеотида в клетке-хозяине. Клетка-хозяин или ее потомство могут содержать полинуклеотид, кодирующий гибридную молекулу "антитело-MRD". В настоящем изобретении рассматриваются терапевтические композиции, которые могут быть использованы для осуществления описанных здесь методов терапии. Терапевтические композиции согласно изобретению содержат физиологически приемлемый носитель вместе с описанным здесь MRDсодержащим антителом по меньшей мере одного вида, которое растворено или диспергировано в данном носителе в качестве активного ингредиента. В предпочтительном варианте изобретения терапевтическая композиция не является иммуногенной, если она вводится человеку в терапевтических целях. Получение фармакологической композиции, содержащей растворенные или диспергированные в ней активные ингредиенты, хорошо известно специалистам. Обычно такие композиции получают в виде стерильных инъекций, либо в виде жидких водных или безводных растворов или суспензий, однако эти композиции могут быть также приготовлены в виде твердых форм, подходящих для приготовления растворов или суспензий в жидкости до их использования. Такой препарат может быть также эмульгированным. Таким образом, композиция, содержащая антитело-MRD, может быть приготовлена в форме растворов, суспензий, таблеток, капсул, препаратов пролонгированного высвобождения или порошков,либо в других композиционных формах. Активный ингредиент может быть смешан с наполнителями, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом, и использован в количествах, подходящих для их применения в описанных здесь методах терапии. Подходящими наполнителями являются, например,вода, физиологический раствор, декстроза, глицерин, этанол или т.п., и их комбинации. Кроме того, если это необходимо, указанная композиция может содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, pH-забуферивающие агенты и т.п., повышающие эффективность активного ингредиента. Терапевтическая композиция согласно изобретению может включать фармацевтически приемлемые соли компонентов указанной композиции. Фармацевтически приемлемыми солями являются кислотноаддитивные соли (образованные свободными аминогруппами полипептида), которые образованы неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или органическими кислотами, такими как уксусная кислота, винная кислота, миндальная кислота и т.п. Соли, образованные свободными карбоксильными группами, могут также происходить от неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа(3), и от таких органических оснований, как изопропиламин, триметиламин, 2-этиламин, этанол, гистидин, прокаин и т.п. Физиологически приемлемые носители хорошо известны специалистам. Репрезентативными жидкими носителями являются стерильные водные растворы, не содержащие каких-либо других веществ,кроме активных ингредиентов и воды, или содержащие буфер, такой как фосфат натрия при физиологическом значении pH, физиологический раствор или то и другое, например, забуференный фосфатом физиологический раствор. Кроме того, водные носители могут содержать более чем одну буферную соль, а также другие соли, такие как хлориды натрия и калия, декстроза, пропиленгликоль, полиэтиленгликоль и другие растворенные вещества. Жидкие композиции могут также содержать, помимо воды или вместо воды, жидкие фазы. Примерами таких дополнительных жидких фаз являются глицерин, растительные масла, такие как масло из семян хлопчатника, органические сложные эфиры, такие как этилолеат, и эмульсии типа "вода в масле". Терапевтическая композиция содержит антитело, включающее MRD согласно изобретению, обычно в количестве по меньшей мере 0,1 мас.% антитела по массе всей терапевтической композиции. Процент по массе представляет собой отношение массы антитела ко всей массе композиции. Так, например,0,1 мас.% представляет собой 0,1 г антитела-MRD на 100 г всей композиции. Антителосодержащая терапевтическая композиция обычно включает антитело в качестве активного ингредиента в количестве примерно 10 микрограммов (мкг) на миллилитр (мл) - примерно 100 миллиграммов (мг) на миллилитр по объему всей композиции, а более предпочтительно, примерно от 1 мг/мл до 10 мг/мл (т.е. примерно 0,1-1 мас.%). В другом варианте изобретения терапевтическая композиция содержит полипептид согласно изобретению обычно в количестве по меньшей мере 0,1 мас.% полипептида по массе всей терапевтической композиции. Процент по массе представляет собой отношение массы полипептида ко всей массе композиции. Так, например, 0,1 мас.% представляет собой 0,1 г полипептида на 100 г всей композиции. Предпочтительно, полипептидсодержащая терапевтическая композиция обычно включает полипептид в качестве активного ингредиента в количестве примерно 10 мкг на 1 мл - примерно 100 мг на 1 мл по объему всей композиции, а более предпочтительно примерно от 1 до 10 мг/мл (т.е. примерно 0,1-1 мас.%). Благодаря эффективному применению гуманизированных или химерных антител для введения человеку in vivo, описанные здесь молекулы антитело-MRD являются особенно подходящими для их применения in vivo в качестве терапевтического реагента. Указанный способ включает введение пациенту терапевтически эффективного количества физиологически приемлемой композиции, содержащей антетело, включающее MRD согласно изобретению. Интервалы доз для введения антитела, содержащего MRD согласно изобретению, являются достаточно широкими для достижения желаемого эффекта, который приводит к ослаблению симптомов заболевания, опосредуемых молекулой-мишенью. Доза не должна быть настолько высокой, чтобы это приводило к возникновению нежелательных побочных эффектов, таких как синдромы повышенной вязкости крови, отек легких, застойная сердечная недостаточность и т.п. Обычно такая доза может варьироваться в зависимости от возраста, состояния здоровья, пола и тяжести заболевания пациента и может быть определена самим специалистом. В случае какого-либо осложнения доза, вводимая пациенту, может быть скорректирована его лечащим врачом. Терапевтически эффективное количество MRD-содержащего антитела согласно изобретению обычно представляет собой такое количество антитела, которое при его введении в виде физиологически приемлемой композиции является достаточным для достижения его концентрации в плазме примерно от 0,1 мкг на 1 мл до 100 мкг/мл, а предпочтительно примерно от 1 до 5 мкг/мл, а обычно примерно 5 мкг/мл. Иначе говоря, доза может варьироваться примерно от 0,1 до 300 мг/кг, предпочтительно примерно от 0,2 до 200 мг/кг, а наиболее предпочтительно примерно от 0,5 до 20 мг/кг и может быть введена один или несколько раз в день в течение одного дня или нескольких дней.MRD-содержащее антитело согласно изобретению может быть введено парентерально путем инъекции или путем непрерывного вливания в течение определенного периода времени. Хотя молекуламишень, присутствующая в организме, обычно является доступной при системном введении, а поэтому наиболее распространенным способом лечения является внутривенное введение терапевтических композиций, однако, может быть осуществлено введение в другие ткани другими способами доставки в том случае, когда есть вероятность того, что ткани, подвергаемые лечению, содержат указанную молекулумишень. Таким образом, MRD-содержащие антитела согласно изобретению могут быть введены внутривенно, внутрибрюшинно, внутримышечно, подкожно, в полость органа, чрескожно и могут быть доставлены с использованием перистальтических средств. Терапевтические композиции, содержащие человеческое моноклональное антитело или полипептид согласно изобретению, обычно вводят внутривенно, например путем инъекции унифицированной дозы. Используемый здесь термин "унифицированная доза", относящийся к терапевтической композиции согласно изобретению, означает физически дискретные единицы, подходящие для их введения индивидууму в виде унитарной дозы, где каждую унифицированную дозу, содержащую предварительно определенное количество активного вещества, вычисляют так, чтобы она давала нужный терапевтический эффект в комбинации с требуемым разбавителем, т.е. носителем или наполнителем. Композиции вводят способом, подходящим для введения указанного лекарственного препарата, в терапевтически эффективном количестве. Количество вводимого лекарственного средства зависит от типа индивидуума, подвергаемого лечению, способности организма индивидуума усваивать активный ингредиент, и от уровня желаемого терапевтического эффекта. Точное количество активного ингредиента, необходимое для введения, зависит от назначения лечащего врача и является индивидуальным для каждого пациента. Однако подходящие интервалы доз для системного применения, описанные в настоящей заявке, зависят от способа введения. Подходящие схемы введения также могут варьироваться, но обычно первую дозу и последующие дозы вводят с интервалом в один час или несколько часов путем инъекции или другим способом введения. Альтернативно рассматривается непрерывное внутривенное вливание, достаточное для поддержания концентраций в крови в интервалах времени, характерных дляin vivo терапии. Нижеследующие примеры приводятся лишь в иллюстративных целях и не ограничивают объема изобретения. Примеры Пример 1. Молекулы "антитело-MRD", нацеленные на интегрин. Новые гибридные молекулы "антитело-MRD" были получены путем присоединения пептидов, нацеленных на интегрин v3, к каталитическому антителу 38 С 2. Наиболее эффективными являются гибриды, полученные у N-конца и С-конца легкой цепи и у С-конца тяжелой цепи. Проточная цитометрия показала, что конъюгаты антител эффективно связываются с раковыми клетками человеческой молочной железы, экспрессирующими интегрин v3. Конъюгаты антител также сохраняют ретроальдольную активность родительского каталитического антитела 38 С 2, как было определено в анализе на активацию пролекарства методола и доксорубицина. Этот анализ показал, что метод, в основу которого была положена доставка антител в клетки и каталитическая функция этих антител, может быть эффективно применен в комбинации с селективной химиотерапией. Пример 2. Молекулы "антитело-MRD", нацеленные на ангиогенный цитокин. Были сконструированы гибридные молекулы "антитело-MRD", нацеленные на ангиогенный цитокин. Используемым антителом является антитело 38 С 2, которое было присоединено к MRD, содержащему пептид 2Con4. Пептид MRD был присоединен у N- или С-конца легкой цепи и у С-конца тяжелой цепи. Аналогичные результаты были получены и для других пептидов MRD, нацеленных на Ang-2. Дополнительными пептидами MRD, нацеленными на Ang-2, являются: Очевидно, что такие пептиды могут присутствовать в димерах, тримерах или в других мультимерах, которые по своей природе являются гомологичными или гетерологичными. Так, например, один из этих пептидов может димеризоваться подобно Con-содержащим последовательностям, таким как 2ConFA, с образованием гомологичного димера, либо Con-пептиды могут быть смешанными, например, ConFA может быть объединен с ConLA для создания гетеродимера ConFA-LA с последовательностью Другим репрезентативным гетеродимером является ConFA, который при объединении с ConFS образует ConFA-FS с последовательностью Для специалиста в данной области очевидно, что в соответствии с приведенным здесь описанием могут быть получены любые другие комбинации для создания описанных здесь функциональных Ang2 связывающих MRD. Пример 3. Гибриды "антитело-MRD" с некаталитическими антителами. Гуманизированное мышиное моноклональное антитело, LM609, направленное против человеческого интегрина v3, было описано ранее (Rader, С. et al., 1998. Rader С., Cheresh D.A., Barbas C.F. 3rd.Proc. Natl. Acad. Sci. USA. 1998 Jul 21; 95(15):8910-5). Человеческое некаталитическое моноклональное антитело Ab, JC7U, было присоединено к антиAng2-MRD, содержащему 2Con4 либо у N-, либо у С-конца легкой цепи. 2Con4 был проанализирован как N-концевой гибрид с цепью каппа антитела (2Con4-JC7U) и как С-концевой гибрид (JC7U-2Con4). Оба гибрида сохраняли способность связываться с интегрином и Ang2. Как показано на левой панели на фиг. 3, обе конструкции антитела (2Con4-JC7U и JC7U-2Con4) специфически связывались с рекомбинантным Ang2, на что указывали ELISA-анализы. Однако уровень связывания сAng2 был значительно выше для JC7U-2Con4, который имеет 2Con4 (SEQ ID NO:10), присоединенный к С-концу легкой цепи антитела. На правой панели фиг. 3 проиллюстрировано связывание Ang2-JC7U и или С-концу легкой цепи не оказывает негативного влияния на связывание mAb JC7U с интегриномv3. На фиг. 4 проиллюстрирован другой ELISA-анализ, проводимый с использованием тех же самых гибридных конструкций "антитело-MRD". Пример 4. Гибридные молекулы "герцептин-MRD". Другим примером гибридов MRD с некаталитическим антителом являются гибридные конструкции"герцептин-MRD". Гибриды "герцептин-MRD" являются многофункциональными, т.е. они являются низкомолекулярными антагонистами интегрина v, и такие антитела, химически запрограммированные на нацеливание на интегрин, обладают высокой эффективностью в предупреждении метастазов рака молочной железы благодаря их способности подавлять v-опосредуемую адгезию и пролиферацию клеток.(которые нацелены на ErbB2 и VEGF) и герцептина-RGD-4C-2Con4 (которые нацелены на ErbB2, ang2 и интегрин), являются эффективными. Пример 5. Молекулы "антитело-MRD", нацеленные на VEGF. Было сконструировано MRD-содержащее антитело, направленное против VEGF. MRD, нацеленный на v114 (SEQ ID NO:13), был присоединен у N-конца цепи каппа антитела 38 С 2 и герцептина с использованием длинной линкерной последовательности (SEQ ID NO:2). Экспрессия и анализ полученных гибридных конструкций "антитело-MRD" указывали на высокий уровень связывания с VEGF. Пример 6. Молекулы "антитело-MRD", нацеленные на IGF-1R. Были проведены исследования по присоединению MRD, нацеленного на IGF-1R к N-концу цепи каппа антитела 38 С 2 и герцептина с использованием длинной линкерной последовательности в качестве связующего звена. Экспрессия и анализ полученных гибридных конструкций "антитело-MRD" указывали на высокий уровень связывания с IGF-1R. Дополнительные клоны, обнаруживающие высокий уровень связывания с IGR-1R,были также идентифицированы после проведения нескольких раундов мутагенеза и скрининга. Предпочтительные последовательности, перечисленные ниже, либо не обладали какой-либо значительной аффинностью связывания с рецептором инсулина, либо вообще не обладали такой аффинностью (см. табл. 2). Таблица 1 Матрица для последующего мутагенеза Пример 7. Молекулы "антитело-MRD", связывающиеся с ErbB2 и нацеленные на Ang-2. Было сконструировано антитело, содержащее MRD, нацеленный на Ang-2 (L17) и присоединенный к легкой цепи антитела, связывающегося с ErbB2. В качестве линкера использовали либо короткую линкерную последовательность, либо длинную линкерную последовательность, либо 4-ю петлю в константной области легкой цепи. На фиг. 5 представлены результаты ELISA-анализа, проводимого с использованием конструкций, содержащих N-концевой гибрид MRD, нацеленного на Ang-2, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием короткого линкерного пептида (GGGS (SEQID NO:1 (L17-sL-Her); С-концевой гибрид MRD, нацеленного на Ang-2, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием короткого линкерного пептида (Her-sL-L17); Сконцевой гибрид MRD, нацеленного на Ang-2, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием 4-й петли в константной области легкой цепи (Her-lo-L17); или N-концевой гибридMRD, нацеленного на Ang-2, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием длинного линкерного пептида(L17-1L-Her). У всех конструкций уровень связывания ErbB2 варьировался. Однако Ang-2 связывался только посредствомHer-sL-L17 и L17-1L-Her. Пример 8. Молекулы "антитело-MRD", связывающиеся с рецептором фактора роста гепатоцитов и нацеленные на Ang-2. Гибрид MRD, нацеленный на Ang-2 (L17), был присоединен к N-концу или С-концу легкой цепи анти-Met антитела, которое связывается с рецептором фактора роста гепатоцитов. В качестве связующего звена использовали короткую линкерную последовательность или длинную линкерную последовательность. На фиг. 6 представлены результаты ELISA-анализа, проводимого с использованием конструкций, содержащих N-концевой гибрид MRD, нацеленного на Ang-2, с анти-Met антителом, где указанный гибрид был получен с использованием короткого линкерного пептида (GGGS (SEQ ID NO:1 (L17-sLMet), N-концевой гибрид MRD, нацеленного на Ang-2, с анти-Met антителом, где указанный гибрид был получен с использованием длинного линкерного пептида(L17-1L-Met), и С-концевой гибрид MRD, нацеленного на Ang-2, с анти-Met антителом, где указанный гибрид был получен с использованием длинного линкерного пептида (Met-IL-L17). Экспрессия и анализ полученных гибридных конструкций "антитело-MRD" указывали на высокий уровень связывания с Ang2 при использовании длинного линкерного пептида. Присоединение MRD, нацеленного на Ang-2, к Сконцу легкой цепи антитела, давало несколько более высокий уровень связывания с Ang-2, чем присоединение MRD, нацеленного на Ang-2, к N-концу легкой цепи данного антитела. Пример 9. Молекулы "антитело-MRD", связывающиеся с ErbB2 и нацеленные на интегрин. Было сконструировано антитело, содержащее MRD, нацеленный на интегрин v3 (RGD4C) и присоединенный к легкой цепи антитела герцептина, которое связывается с ErbB2 (Her). В качестве линкера была использована короткая линкерная последовательность, длинная линкерная последовательность или 4-ая петля в константной области легкой цепи. На фиг. 7 представлены результаты ELISA-анализа, проводимого с использованием конструкций, содержащих N-концевой гибрид MRD, нацеленного на интегрин v3, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием короткого линкерного пептида (GGGS (SEQ ID NO:1 (RGD4C-sL-Her); С-концевой гибрид MRD, нацеленного на интегрин v3, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием короткого линкерного пептида (Her-sL-RGD4C); С-концевой гибрид MRD, нацеленного на интегрин v3, с антиErbB2 антителом, где указанный гибрид был получен с использованием 4-й петли в константной области легкой цепи (Her-lo-RGD4C); или N-концевой гибрид MRD, нацеленного на интегрин v3, с анти-ErbB2 антителом, где указанный гибрид был получен с использованием длинного линкерного пептида(RGD4C-1L-Her). У всех конструкций уровень связывания ErbB2 варьировался. Однако интегрин v3 связывался только посредством RGD4C-1L-Her. Пример 10. Молекулы "антитело-MRD", связывающиеся с рецептором фактора роста гепатоцитов и нацеленные на интегрин. Было сконструировано антитело, содержащее MRD, нацеленный на интегрин v3 (RGD4C) и присоединенный к легкой цепи антитела, которое связывается с рецептором фактора роста гепатоцитов(Met). Были использованы конструкции "антитело-MRD", содержащие длинную линкерную последовательность. На фиг. 8 представлены результаты ELISA-анализа, проводимого с использованием конструкций, содержащих N-концевой гибрид MRD, нацеленного на интегрин v3, с антителом против рецептора фактора роста гепатоцитов (RGD4C-1L-Met), или С-концевой гибрид MRD, нацеленного на интегринv3, с антителом против рецептора фактора роста гепатоцитов (Met-1L-RGD4C). RGD4C-1L-Met продемонстрировал высокий уровень связывания с интегрином v3. Пример 11. Молекулы "антитело-MRP", связывающиеся с ErbB2 и нацеленные на рецептор инсулиноподобного фактора роста-I. Были сконструированы антитела, содержащие MRD, который нацелен на рецептор инсулиноподобного фактора роста-I (RP) и присоединен к легкой цепи антитела, связывающегося с ErbB2 (Her). В качестве линкера были использованы либо короткий линкерный пептид, либо длинный линкерный пептид,либо 4-я петля константной области легкой цепи. (Carter et al., Proc Natl Acad Sci USA. 1992 May 15; 89(10):4285-9).PMID: 1350088 [PubMed - каталожное название для MEDLINE]; патент США 5677171; депозит АТСС 10463, все указанные документы вводятся в настоящее описание посредством ссылки. На фиг. 9 представлены результаты ELISA-анализа, проведенного с использованием конструкций, содержащих Nконцевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с анти-ErbB2 антителом, присоединенным посредством короткого линкера (RP-sL-Her), С-концевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с анти-ErbB2 антителом, присоединенным посредством короткого линкерного пептида (Her-sL-RP), С-концевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с анти-ErbB2 антителом, присоединенным посредством 4-ой петли в константной области легкой цепи (Her-lo-RP), N-концевой гибрид MRD, нацеленного на рецеп- 19021967 тор инсулиноподобного фактора роста-I, с анти-ErbB2 антителом, присоединенным посредством длинного линкерного пептида (RP-1L-Her), или С-концевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с анти-ErbB2 антителом, присоединенным посредством длинного линкерного пептида (Her-1L-RP). У всех конструкций уровень связывания ErbB2 варьировался. Рецептор инсулиноподобного фактора роста-I связывался посредством RP-1L-Her. Пример 12. Молекулы "антитело-MRD", связывающиеся с ErbB2 и нацеленные на VEGF. Гибрид MRD, нацеленный на VEGF (V114), был присоединен к N-концу легкой цепи ErbB2 связывающегося антитела (Her). В качестве связующего звена использовали линкерный пептид средней длины На фиг. 10 представлены результаты ELISAанализа, проводимого с использованием конструкции, содержащей N-концевой гибрид MRD, нацеленного на VEGF, с ErbB2-связывающимся антителом, присоединенным посредством линкерного пептида средней длины (V114-mL-Her). Экспрессия и анализ полученной гибридной конструкции "антителоMRD" указывали на высокий уровень связывания с VEGF и ErbB2. Пример 13. Молекулы "антитело-MRD", нацеленные на интегрин. Было проведено исследование гибрида MRD, нацеленного на интегрин v3 (RGD), с N-концом легкой цепи антитела 38 С 2, присоединенного с использованием линкерного пептида средней длины в качестве связующего звена. На фиг. 11 продемонстрировано, что экспрессия и анализ полученной гибридной конструкции "антитело-MRD" указывали на высокий уровень связывания с интегрином v3. Пример 14. Молекулы "антитело-MRD", нацеленные на Ang-2. Было проведено исследование гибрида MRD, нацеленного на Ang-2 (L17), с С-концом легкой цепи антитела 38 С 2, присоединенного с использованием короткой линкерной последовательности в качестве связующего звена. На фиг. 12 продемонстрировано, что экспрессия и анализ полученной гибридной конструкции "антитело-MRD" указывали на высокий уровень связывания с Ang-2. Пример 15. Молекулы "антитело-MRD", связывающиеся с ErbB2 и нацеленные на интегрин и Ang-2.MRD, нацеленный на интегрин v3 (RGD4C), был присоединен к N-концу легкой цепи антитела против ErbB2 (Her) посредством линкера средней длины, а MRD, нацеленный на Ang-2 (L17), был присоединен посредством короткого линкера к С-концу того же самого антитела против ErbB2 (RGD4C-mLHer-sL-L17). На фиг. 13 показано, что полученная гибридная конструкция "антитело-MRD" связывалась с интегрином, Ang-2 и ErbB2. Пример 16. Молекулы "антитело-MRD", связывающиеся с ErbB2 и нацеленные на интегрин. Антитело, содержащее MRD, нацеленный на интегрин v3 (RGD4C) и присоединенный к N-концу тяжелой цепи антитела, связывающегося с ErbB2 (Her), было сконструировано с использованием линкера средней длины в качестве связующего звена (RGD4C-mL-her-тяжелая цепь). На фиг. 14 представлены результаты ELISA-анализа, проводимого с использованием указанной конструкции. В данной конструкции интегрин и ErbB2 были связаны. Пример 17. Молекулы "антитело-MRD", связывающиеся с ErbB2 или с рецептором фактора роста гепатоцитов и нацеленные на интегрин, Ang-2 или рецептор инсулиноподобного фактора роста-I, которые были получены с использованием короткого линкерного пептида. Были сконструированы молекулы "антитело-MRD", содержащие антитела, связывающиеся с ErbB2 или с рецептором фактора роста гепатоцитов, и области MRD, нацеленные на интегрин v3, Ang-2 или рецептор инсулиноподобного фактора роста-I, где указанные области были присоединены посредством короткого линкерного пептида к легкой цепи антитела. На фиг. 15 представлены результаты ELISAанализа, проводимого с использованием конструкций, содержащих N-концевой гибрид MRD, нацеленного на Ang-2, с анти-ErbB2 антителом (L17-sL-Her), N-концевой гибрид MRD, нацеленного на интегрин, с анти-ErbB2 антителом (RGD4C-SL-Her), N-концевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с ErbB2-связывающим антителом (RP-sL-Her), С-концевой гибрид MRD, нацеленного на Ang-2, с антителом, связывающимся с рецептором фактора роста гепатоцитов (L17-sLMet), С-концевой гибрид MRD, нацеленного на Ang-2, с ErbB2-связывающим антителом (Her-sL-L17), Сконцевой гибрид MRD, нацеленного на интегрин, с ErbB2-связывающим антителом (Her-sL-RGD4C),или С-концевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с ErbB2 связывающим антителом (Her-sL-RP). В конструкциях "антитело-MRD" ErbB2 имел различную степень связывания, за исключением конструкции, содержащей антитело, связывающееся с рецептором фактора роста гепатоцитов. Антиген связывался только посредством конструкции Her-sL-L17. Пример 18. Молекулы "антитело-MRD", связывающиеся с ErbB2 или с рецептором фактора роста гепатоцитов и нацеленные на интегрин, Ang-2 или рецептор инсулиноподобного фактора роста-I, которые были получены с использованием длинного линкерного пептида. Были сконструированы молекулы "антитело-MRD", содержащие антитела, связывающиеся с ErbB2 или с рецептором фактора роста гепатоцитов, и области MRD, нацеленные на интегрин v3, Ang-2 или рецептор инсулиноподобного фактора роста-I, где указанные области были присоединены посредством длинного линкерного пептида к легкой цепи антитела. На фиг. 16 представлены результаты ELISAанализа, проводимого с использованием конструкций, содержащих N-концевой гибрид MRD, нацеленно- 20021967 го на Ang-2, с анти-ErbB2 антителом (L17-1L-Her); N-концевой гибрид MRD, нацеленного на интегрин, с анти-ErbB2 антителом (RGD4C-1L-Her); N-концевой гибрид MRD, нацеленного на рецептор инсулиноподобного фактора роста-I, с ErbB2-связывающим антителом (RP-1L-Her), С-концевой гибрид MRD, нацеленного на Ang-2, с антителом, связывающимся с рецептором фактора роста гепатоцитов (L17-1LMet); С-концевой гибрид MRD, нацеленного на интегрин, с антителом, связывающимся с рецептором фактора роста гепатоцитов (RGD4C-1L-Met); С-концевой гибрид MRD, нацеленного на Ang-2, с антителом, связывающимся с рецептором инсулиноподобного фактора роста-I (Her-1L-RP); С-концевой гибридMRD, нацеленного на Ang-2, с антителом, связывающимся с рецептором фактора роста гепатоцитов(Met-1L-L17), или С-концевой гибрид MRD, нацеленного на интегрин, с антителом, связывающимся с рецептором фактора роста гепатоцитов (Met-1L-RGD4C). Как показано на фиг. 16, гибриды "антителоMRD" эффективно связывались с антигеном и ErbB2. Lu et al. J. Biol. Chem. 2005 May 20; 280 (20): 19665-72. Epub 2005 Mar 9; Lu et al. J. Biol. Chem. 2004 Jan 23; 279 (4):2856-65. Epub 2003 Oct 23. Хотя настоящее изобретение описано со ссылками на вышеупомянутые примеры, однако, следует отметить, что в него могут быть внесены модификации и изменения, не выходящие за рамки существа и объема изобретения. В соответствии с этим настоящее изобретение ограничено только прилагаемой формулой изобретения.
МПК / Метки
МПК: C12P 21/08
Метки: модульного, доставка, домена, антител, распознавания, посредством
Код ссылки
<a href="https://eas.patents.su/30-21967-dostavka-antitel-posredstvom-modulnogo-domena-raspoznavaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Доставка антител посредством модульного домена распознавания</a>
Предыдущий патент: Устройство и способ обработки данных, а также кодирующее устройство и способ кодирования
Следующий патент: Лекарственное средство для внутрикожного введения
Случайный патент: Ик-поглощающая краска для глубокой печати


































