Антитела к dkk-1
Номер патента: 21401
Опубликовано: 30.06.2015
Авторы: Свэнсон Барбара Энн, Гелвин Рашель Жанетт, Чедид Марсио, Дарлинг Райан Джеймс
Формула / Реферат
1. Сконструированное человеческое антитело к DKK-1, содержащее вариабельную область легкой цепи (LCVR) и вариабельную область тяжелой цепи (HCVR), где указанные LCVR и HCVR включают аминокислотные последовательности, выбранные из группы, состоящей из:
(i) LCVR, содержащей аминокислотную последовательность SEQ ID NO:13, и HCVR, содержащей аминокислотную последовательность SEQ ID NO:11;
(ii) LCVR, содержащей аминокислотную последовательность SEQ ID NO:14, и HCVR, содержащей аминокислотную последовательность SEQ ID NO:12;
(iii) LCVR, содержащей аминокислотную последовательность SEQ ID NO:15, и HCVR, содержащей аминокислотную последовательность SEQ ID NO:11;
(iv) LCVR, содержащей аминокислотную последовательность SEQ ID NO:16, и HCVR, содержащей аминокислотную последовательность SEQ ID NO:11.
2. Сконструированное человеческое антитело к DKK-1 по п.1, где LCVR содержит аминокислотную последовательность SEQ ID NO:14 и HCVR содержит аминокислотную последовательность SEQ ID NO:12.
3. Сконструированное человеческое антитело к DKK-1 по п.1, где указанное сконструированное человеческое антитело к DKK-1 включает тяжелую цепь и легкую цепь, выбранные из группы, состоящей из:
a) тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:17, и легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:19;
b) тяжелой цепи, содержащей аминокислотную последовательность тяжелой цепи SEQ ID NO:18, и легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:20;
c) тяжелой цепи, содержащей аминокислотную последовательность тяжелой цепи SEQ ID NO:17, и легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:21; и
d) тяжелой цепи, содержащей аминокислотную последовательность тяжелой цепи SEQ ID NO:17, и легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:22.
4. Сконструированное человеческое антитело к DKK-1 по п.3, содержащее две легкие цепи, где каждая легкая цепь содержит аминокислотную последовательность SEQ ID NO:20, и две тяжелые цепи, где каждая тяжелая цепь содержит аминокислотную последовательность SEQ ID NO:18.
5. Фармацевтическая композиция для лечения заболеваний, патогенез которых опосредован DKK-1, содержащая эффективное количество сконструированного человеческого антитела к DKK-1 по любому из пп.1-4 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
6. Применение человеческого антитела к DKK-1 по любому из пп.1-4 для заживления костей.
7. Применение человеческого антитела к DKK-1 по любому из пп.1-4 для лечения множественной миеломы или немелкоклеточного рака легкого.
Текст
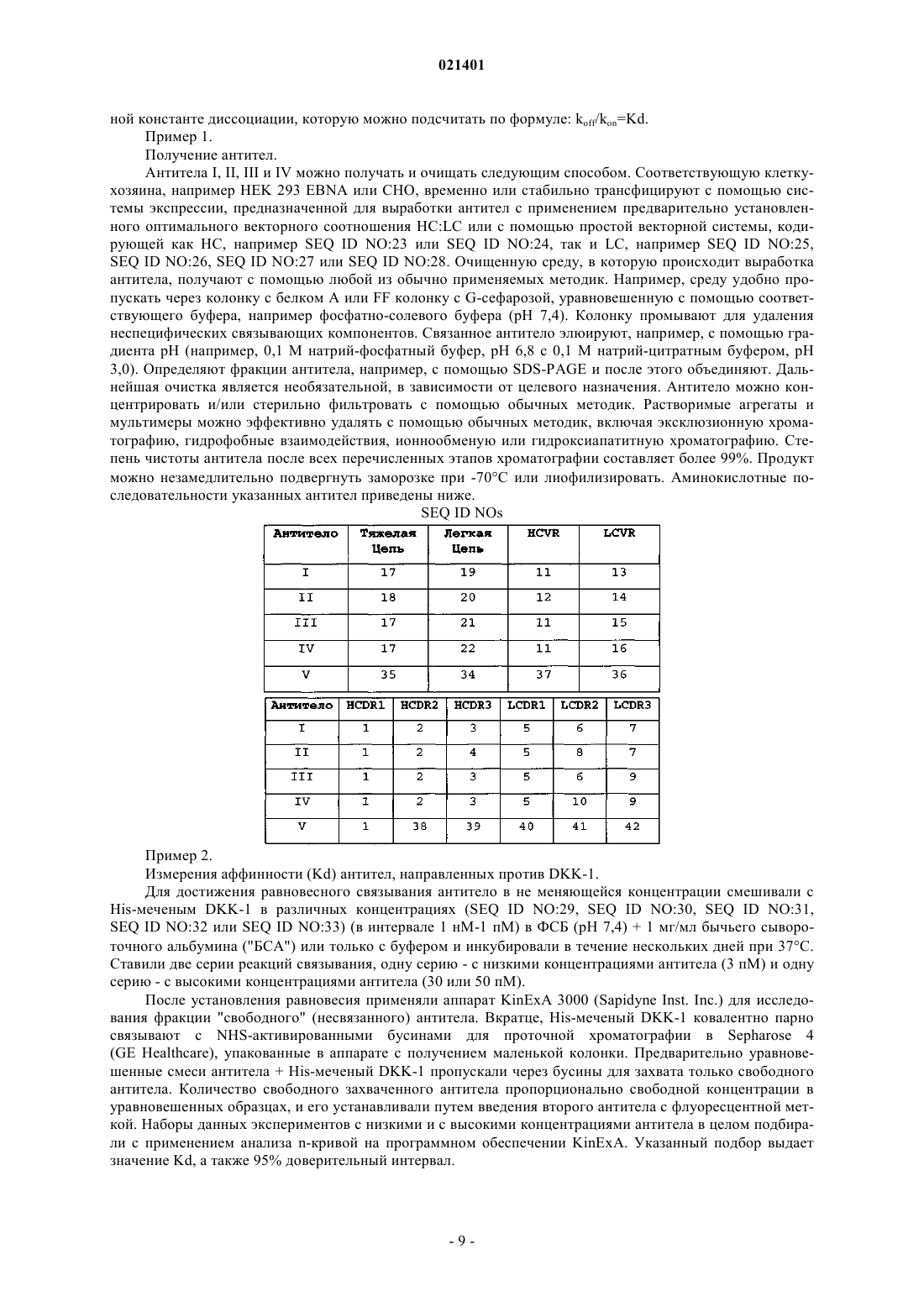
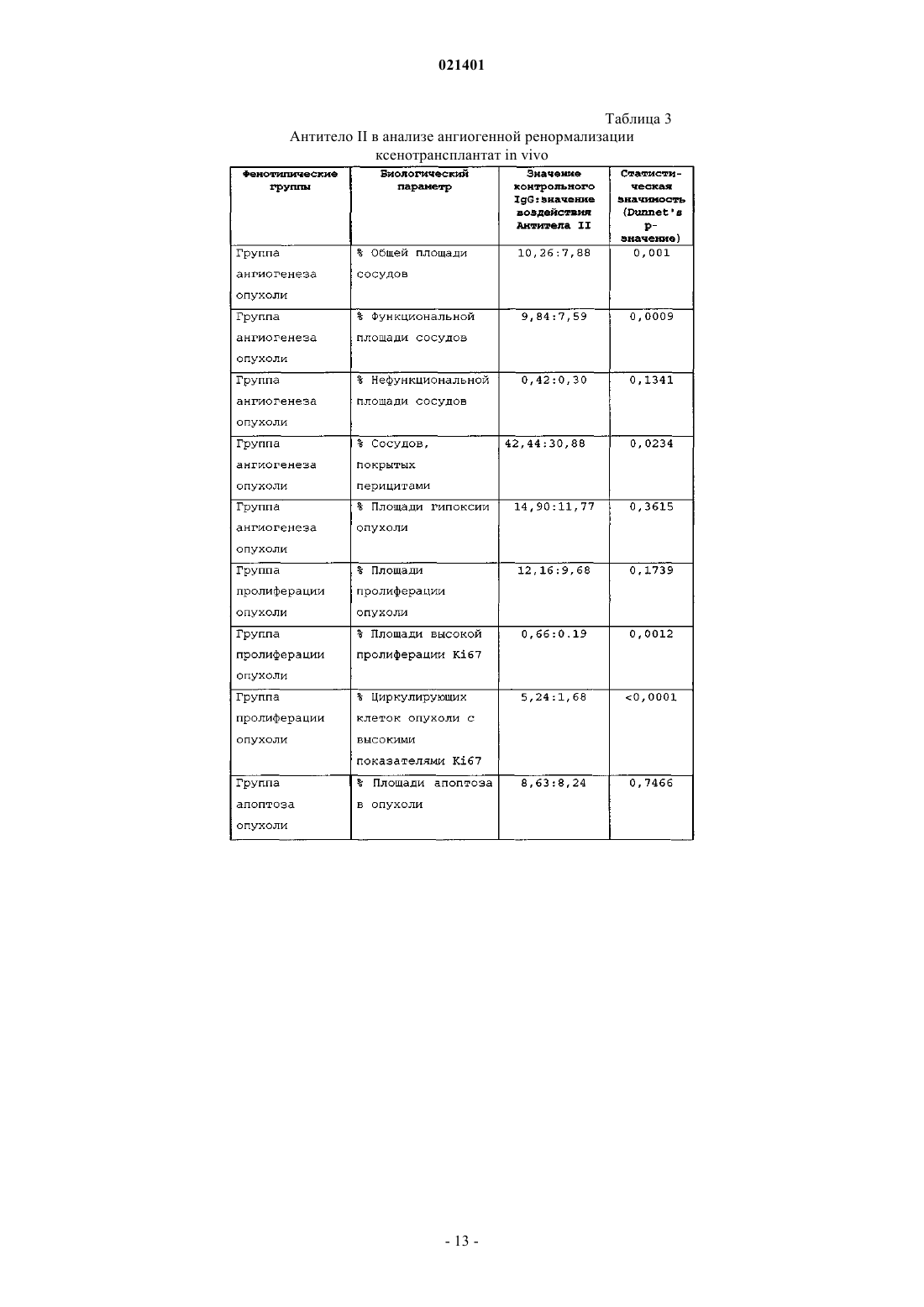
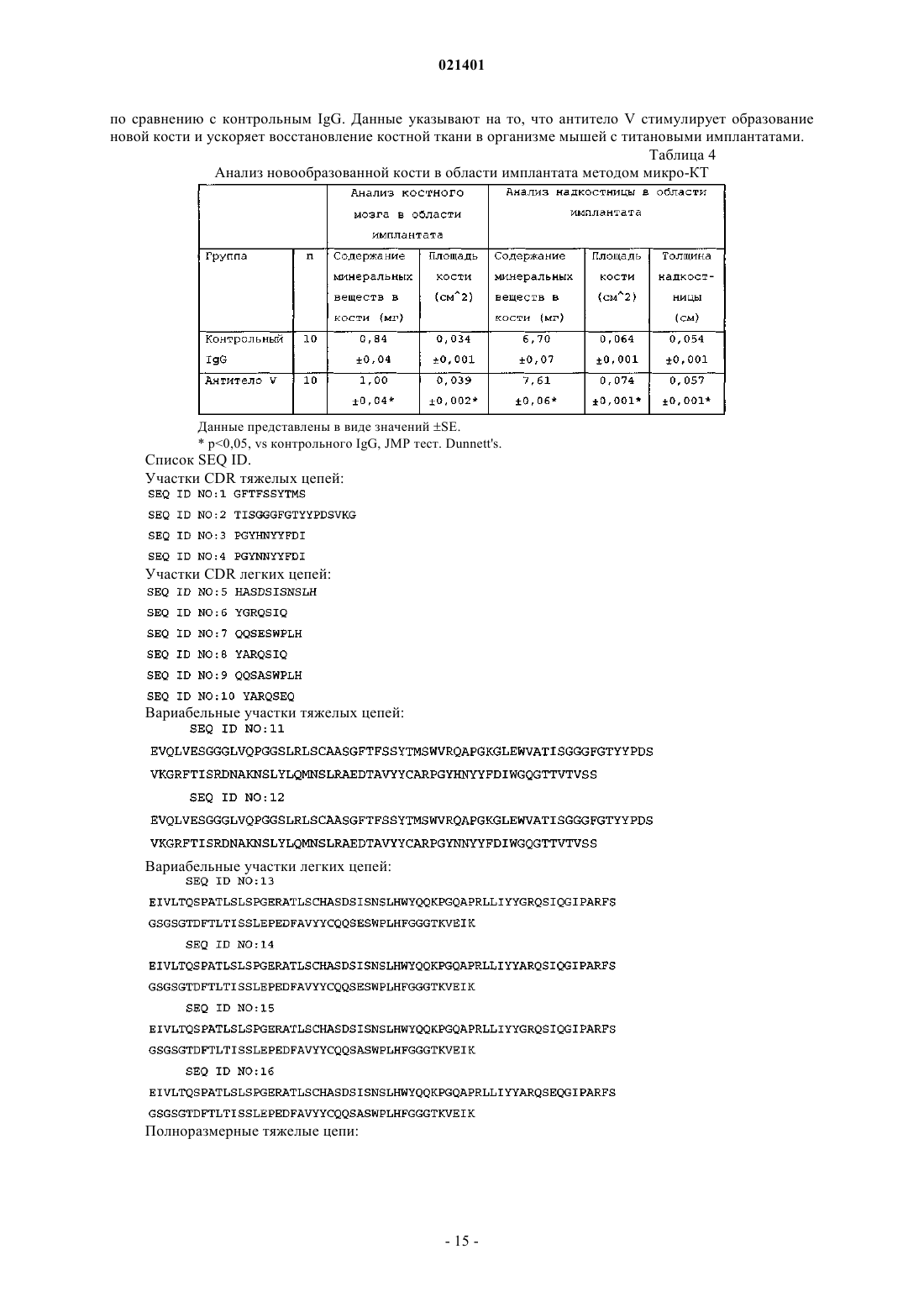
Изобретение обеспечивает сконструированные человеческие антитела к DKK-1 или его антигенсвязывающие фрагменты,которые связываются с и ингибируют активность DKK-1 человека и которые эффективны при лечении заболеваний,патогенез которых опосредован DKK-1. Чедид Марсио, Дарлинг Райан Джеймс,Гелвин Рашель Жанетт, Свэнсон Барбара Энн (US)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к сконструированным человеческим антителам к DKK-1 и к применению указанных антител для лечения заболеваний, патогенез которых опосредован DKK-1.Dickkopf-1 (DKK-1) является представителем семейства белков dickkopf, для которых была показана способность выступать в роли негативных регуляторов канонического пути передачи сигналов черезWnt. Указанный путь играет ключевую роль в образовании и развитии кости. DKK-1 ингибирует передачу сигнала Wnt посредством взаимодействия с корецептором Wnt LRP5 или LRP6 и белками kremen.DKK-1 предотвращает взаимодействия компонентов пути передачи сигнала через Wnt как с LRP5, так и с LRP6, и, соответственно, предотвращает передачу сигнала, опосредованную Wnt. Также было показано, что DKK-1 участвует в развитии рака, образующего метастазы в кости, включая множественную миелому, рак молочной железы, почечно-клеточную карциному и немелкоклеточный рак легкого. Были описаны антитела, связывающие DKK-1 (см., например, WO 2006/015373), тем не менее, все еще существует потребность в терапевтических сконструированных человеческих антителах, направленных против DKK-1, которые будут способны ингибировать взаимодействие DKK-1 с LRP5 и LRP6. Также ввиду участия DKK-1 в регуляции формирования костной ткани существует потребность в сконструированных человеческих антителах к DKK-1, предназначенных для применения при заживлении кости. Также, принимая во внимание участие DKK-1 в развитии рака, существует потребность в сконструированных человеческих антителах к DKK-1, предназначенных для лечения рака, включая множественную миелому, рак молочной железы и немелкоклеточный рак легкого. Антитела согласно настоящему изобретению представляют собой терапевтически эффективные антагонисты DKK-1, которые обладают рядом желательных свойств. Сконструированные человеческие антитела согласно настоящему изобретению проявляют высокую аффинность (Kd) по отношению кDKK-1 человека, DKK-1 яванского макака, DKK-1 крысы, DKK-1 мыши и DKK-1 кролика. Антитела согласно настоящему изобретению блокируют ингибирование щелочной фосфатазы, опосредованноеDKK-1, что является показателем активности остеобластов. Более того, применение антител согласно настоящему изобретению приводит к повышению плотности костной массы как в задней, так и в передней частях надкостницы в модели кортикального дефекта in vivo и существенным образом усиливают ингибирование ксенотрансплантатов немелкоклеточного рака легкого in vivo. Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, значение Kd при 37 С для которого составляет менее 5,010-11 М по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 яванского макака (SEQ ID NO:30),DKK-1 крысы (SEQ ID NO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или связывающий фрагмент указанного антитела, аминокислотной последовательностью LCDR1 которого является SEQ ID NO:5, аминокислотной последовательностью LCDR2 которого являетсяSEQ ID NO:47, аминокислотной последовательностью LCDR3 которого является SEQ ID NO:49, аминокислотной последовательностью HCDR1 которого является SEQ ID NO:1, аминокислотной последовательностью HCDR2 которого является SEQ ID NO:2 и аминокислотной последовательностью HCDR3 которого является SEQ ID NO:44. Также согласно настоящему изобретению предложена фармацевтическая композиция, содержащая сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент согласно настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или эксципиент. Согласно настоящему изобретению предложен способ заживления кости, включающий введение сконструированного человеческого антитела к DKK-1 или его антигенсвязывающего фрагмента согласно настоящему изобретению. Также согласно настоящему изобретению предложен способ лечения рака,включающий введение сконструированного человеческого антитела к DKK-1 или его антигенсвязывающего фрагмента согласно настоящему изобретению, при этом рак выбран из группы, состоящей из множественной миеломы, рака молочной железы и немелкоклеточного рака легкого. Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент согласно описанному в настоящем документе, причем значение Kd составляет менее 1,510-11 M по отношению к DKK-1 человека (SEQ ID NO:29). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значение Kd для которых составляет менее 1,010-11 М по отношению к DKK-1 человека (SEQ ID NO:29). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значение Kd для которого составляет менее 5,010-12 M по отношению к DKK-1 человека (SEQ ID NO:29). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значение Kd для которых находится в интервале от 0,510-12 до 1,510-11 M по отношению кDKK-1 человека (SEQ ID NO:29). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значение Kd для которых находится в интервале от 1,010-12 до 1,010-11 M по отношению кDKK-1 человека (SEQ ID NO:29). Значения Kd устанавливают посредством равновесного связывания при 37 С, как описано в примере 2. Также согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент в соответствии с описанным в настоящем документе,значение Kd для которых составляет менее 5,010-11 M по отношению к DKK-1 человека(SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значение Kd для которого составляет менее 3,010-11 M по отношению кNO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В еще более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, значение Kd для которых составляет менее 2,010-11 М по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 крысы (SEQ ID NO:31) и DKK-1 мыши(SEQ ID NO:33). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значениеKd для которых находится в интервале от 1,010-11 до 5,010-11 М по отношению к DKK-1 человека(SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В дополнительном предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, значение Kd для которых находится в интервале от 1,510-11 до 3,010-11 M по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 крысы (SEQ ID NO:31) и DKK-1 мыши (SEQ ID NO:33). Значения Kd устанавливают посредством равновесного связывания при 37 С, как описано в примере 2. В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, включающее LCVR,которая содержит аминокислотную последовательность SEQ ID NO:14, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:12, при этом значение Kd для указанного сконструированного человеческого антитела к DKK-1 или его антигенсвязывающего фрагмента составляет менее 3,010-11 М по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 яванского макака (SEQ ID NO:30),DKK-1 крысы (SEQ ID NO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В дополнительном предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, включающее LCVR,которая содержит аминокислотную последовательность SEQ ID NO:14, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:12, причем значение Kd для указанного сконструированного человеческого антитела к DKK-1 или его антигенсвязывающего фрагмента составляет менее 2,510-11 M по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 яванского макака (SEQ ID NO:30),DKK-1 крысы (SEQ ID NO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В более предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, которое включает LCVR, которая содержит аминокислотную последовательность SEQ ID NO:14, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:12, причем значение Kd для указанного сконструированного человеческого антитела к DKK-1 или его антигенсвязывающего фрагмента составляет менее 2,010-11 М по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 яванского макака (SEQ ID NO:30), DKK-1 крысы(SEQ ID NO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В дополнительном предпочтительном варианте согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, включающее LCVR, которая содержит аминокислотную последовательность SEQ ID NO:14, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:12, причем значение Kd для сконструированного человеческого антитела кDKK-1 или его антигенсвязывающего фрагмента находится в интервале от 0,510-12 до 3,010-11 М по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 яванского макака (SEQ ID NO:30), DKK-1 крысы(SEQ ID NO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). В более предпочтительном варианте согласно настоящему-изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, включающее LCVR, которая содержит аминокислотную последовательность SEQ ID NO:14, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:12, причем значение Kd для сконструированного человеческого антитела к DKK-1 или его антигенсвязывающего фрагмента находится в интервале от 1,010-12 до 2,510-11 М по отношению к DKK-1 человека (SEQ ID NO:29), DKK-1 яванского макака (SEQ ID NO:30), DKK-1 крысы(SEQ ID NO:31), DKK-1 мыши (SEQ ID NO:33) и DKK-1 кролика (SEQ ID NO:32). Значения Kd устанавливают посредством равновесного связывания при 37 С, как описано в примере 2. Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, которое включает вариабельную область легкой цепи(LCVR) и вариабельную область тяжелой цепи (HCVR), причем LCVR содержит гипервариабельные участки (CDRs) LCDR1, LCDR2 и LCDR3, a HCVR содержит CDRs HCDR1, HCDR2 и HCDR3, при этомLCDR1 имеет аминокислотную последовательность SEQ ID NO:5, HCDR1 имеет аминокислотную последовательность SEQ ID NO:1 и HCDR2 имеет аминокислотную последовательность SEQ ID NO:2. Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, аминокислотной последовательностью LCDR1 в составе которого является SEQ ID NO:46, аминокислотной последовательностью LCDR2 являетсяSEQ ID NO:48, аминокислотной последовательностью LCDR3 является SEQ ID NO:50, аминокислотной последовательностью HCDR1 является SEQ ID NO:1, аминокислотной последовательностью HCDR2 является SEQ ID NO:43 и аминокислотной последовательностью HCDR3 является SEQ ID NO:45. Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, аминокислотной последовательностью LCDR1 в составе которого является SEQ ID NO:5, аминокислотной последовательностью LCDR2 является SEQ ID NO:47,аминокислотной последовательностью LCDR3 является SEQ ID NO:49, аминокислотной последовательностью HCDR1 является SEQ ID NO:1, аминокислотной последовательностью HCDR2 являетсяSEQ ID NO:2 и аминокислотной последовательностью HCDR3 является SEQ ID NO:44. Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, аминокислотной последовательностью LCDR1 в составе которого является SEQ ID NO:5, а аминокислотная последовательность LCDR2 выбрана из группыSEQ ID NO:6, SEQ ID NO:8 и SEQ ID NO:10, аминокислотная последовательность LCDR3 выбрана из группы SEQ ID NO:7 и SEQ ID NO:9, аминокислотной последовательностью HCDR1 являетсяSEQ ID NO:1, аминокислотной последовательностью HCDR2 является SEQ ID NO:2 и аминокислотная последовательность HCDR3 выбрана из группы SEQ ID NO:3 и SEQ ID NO:4. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, аминокислотные последовательности LCDR1,LCDR2, LCDR3, HCDR1, HCDR2 и HCDR3 в составе которого выбраны из группы, состоящей из:(i) LCDR1 имеет аминокислотную последовательность SEQ ID NO:5, LCDR2 имеет аминокислотную последовательность SEQ ID NO:6, LCDR3 имеет аминокислотную последовательностьSEQ ID NO:7, HCDR1 имеет аминокислотную последовательность SEQ ID NO:1, HCDR2 имеет аминокислотную последовательность SEQ ID NO:2 и HCDR3 имеет аминокислотную последовательность(ii) LCDR1 имеет аминокислотную последовательность SEQ ID NO:5, LCDR2 имеет аминокислотную последовательность SEQ ID NO:8, LCDR3 имеет аминокислотную последовательностьSEQ ID NO:7, HCDR1 имеет аминокислотную последовательность SEQ ID NO:1, HCDR2, имеет аминокислотную последовательность SEQ ID NO:2 и HCDR3 имеет аминокислотную последовательность(iii) LCDR1 имеет аминокислотную последовательность SEQ ID NO:5, LCDR2 имеет аминокислотную последовательность SEQ ID NO:6, LCDR3 имеет аминокислотную последовательностьSEQ ID NO:9, HCDR1 имеет аминокислотную последовательность SEQ ID NO:1, HCDR2 имеет аминокислотную последовательность SEQ ID NO:2 и HCDR3 имеет аминокислотную последовательность(iv) LCDR1 имеет аминокислотную последовательность SEQ ID NO:5, LCDR2 имеет аминокислотную последовательность SEQ ID NO:10, LCDR3 имеет аминокислотную последовательностьSEQ ID NO:9, HCDR1 имеет аминокислотную последовательность SEQ ID NO:1, HCDR2 имеет аминокислотную последовательность SEQ ID NO:2 и HCDR3 имеет аминокислотную последовательностьSEQ ID NO:3 Согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, в котором LCVR содержит аминокислотную последовательность SEQ ID NO:52 и HCVR содержит аминокислотную последовательность SEQ ID NO:51. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, в котором LCVR содержит аминокислотную последовательность, выбранную из группы SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15 иSEQ ID NO:16. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, в котором HCVR содержит аминокислотную последовательность, выбранную из группы SEQ ID NO:11 и SEQ ID NO:12. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, в котором LCVR и HCVR содержат последовательности аминокислот, выбранные из группы, состоящей из:(i) LCVR, которая содержит аминокислотную последовательность SEQ ID NO:13, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:11;(ii) LCVR, которая содержит аминокислотную последовательность SEQ ID NO:14, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:12;(iii) LCVR, которая содержит аминокислотную последовательность SEQ ID NO:15, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:11;(iv) LCVR, которая содержит аминокислотную последовательность SEQ ID NO:16, и HCVR, которая содержит аминокислотную последовательность SEQ ID NO:11. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, которые включают LCVR, содержащую аминокислотную последовательность SEQ ID NO:14, и HCVR, содержащую аминокислотную последовательность SEQ ID NO:12. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, причем указанное антитело включает легкую цепь, при этом указанная легкая цепь содержит аминокислотную последовательность, выбранную из группы SEQ ID NO:19, SEQ ID NO:20,SEQ ID NO:21 и SEQ ID NO:22. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, причем антитело включает тяжелую цепь, при этом указанная тяжелая цепь содержит аминокислотную последовательность, выбранную из группы SEQ ID NO:17 и SEQ ID NO:18. Более предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, которое содержит аминокислотные последовательности легкой цепи и тяжелой цепи, которые выбраны из группы, состоящей из:(i) тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:17, и легкой цепи,содержащей аминокислотную последовательность SEQ ID NO:19;(ii) тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:18, и легкой цепи,содержащей аминокислотную последовательность SEQ ID NO:20;(iii) тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:17, и легкой цепи,содержащей аминокислотную последовательность SEQ ID NO:21; и(iv) тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:17, и легкой цепи,содержащей аминокислотную последовательность SEQ ID NO:22. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, включающее две легкие цепи, причем каждая из указанных легких цепей содержит аминокислотную последовательность SEQ ID NO:19, и две тяжелые цепи, причем каждая из указанных тяжелых цепей содержит аминокислотную последовательность SEQ ID NO:17. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, включающее две легкие цепи, причем каждая из указанных легких цепей содержит аминокислотную последовательность SEQ ID NO:21, и две тяжелые цепи, причем каждая из указанных тяжелых цепей содержит аминокислотную последовательность SEQ ID NO:17. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, включающее две легкие цепи, причем каждая из указанных легких цепей содержит аминокислотную последовательность SEQ ID NO:22, и две тяжелые цепи, причем каждая из указанных тяжелых цепей содержит аминокислотную последовательность SEQ ID NO:17. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1, включающее две легкие цепи, причем каждая из указанных легких цепей содержит аминокислотную последовательность SEQ ID NO:20, и две тяжелые цепи, причем каждая из указанных тяжелых цепей содержит аминокислотную последовательность SEQ ID NO:18. Также настоящее изобретение предусматривает антитело или его антигенсвязывающий фрагмент,которые конкурируют со сконструированным человеческим антителом к DKK-1 или его антигенсвязывающим фрагментом настоящего изобретения за связывание с ДКК-1 человека (SEQ ID NO:29), как определено с помощью анализа конкуренции антител. Также согласно настоящему изобретению предложена фармацевтическая композиция, содержащая сконструированное человеческое антитело согласно настоящему изобретению к DKK-1 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель, разбавитель или эксципиент. Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая сконструированное человеческое антитело согласно настоящему изобретению к DKK-1 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель, разбавитель или эксципиент и, возможно, другие терапевтические компоненты. В другом своем аспекте настоящее изобретение обеспечивают способ заживления кости, включающий введение сконструированного человеческого антитела к DKK-1 согласно настоящему изобретению или его антигенсвязывающего фрагмента. В другом своем аспекте настоящее изобретение обеспечивает способ лечения рака, включающий введение сконструированного человеческого антитела к DKK-1 согласно настоящему изобретению или его антигенсвязывающего фрагмента, при этом рак предпочтительно выбран из группы, состоящей из множественной миеломы, рака молочной железы и немелкоклеточного рака легкого. Далее, согласно настоящему изобретению предложено сконструированное человеческое антитело кDKK-1 или его антигенсвязывающий фрагмент, предназначенный для применения в ходе терапии. Предпочтительно согласно настоящему изобретению предложено сконструированное человеческое антитело к DKK-1 или его антигенсвязывающий фрагмент, предназначенный для применения при лечении для заживлении кости или для лечения рака, причем рак предпочтительно выбран из группы, состоящей из множественной миеломы, рака молочной железы и немелкоклеточного рака легкого. Далее, согласно настоящему изобретению предложено применение сконструированного человеческого антитела согласно настоящему изобретению к DKK-1 или его антигенсвязывающего фрагмента для производства лекарственного средства, предназначенного для терапии, для заживления кости или лечения рака, причем рак предпочтительно выбран из группы, состоящей из множественной миеломы, рака молочной железы и немелкоклеточного рака легкого. Определения. Полноразмерное антитело, аналогичное существующему в природе в форме молекулы иммуноглобулина, содержащее 2 тяжелые (Н) и 2 легкие (L) цепи, соединенные между собой с помощью дисульфидных связей. N-концевая часть каждой цепи содержит вариабельную область, длина которой составляет 100-110 аминокислот, основной функцией которой является распознавание антигена с помощью гипервариабельных участков (CDRs), входящих в ее состав. С-концевая часть каждой цепи определяет константную область, которая в основном ответственна за эффекторную функцию. Участки CDRs чередуются с областями, обладающими большей консервативностью, обозначаемые как каркасные участки ("FR"). Каждая вариабельная область легкой цепи (LCVR) и вариабельная область тяжелой цепи (HCVR) состоит из трех CDRs и четырех FRs, расположенных в направлении от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Три участка CDR в составе легкой цепи обозначают как "LCDR1, LCDR2 и LCDR3", а три участка CDR в составе тяжелой цепи обозначают как "HCDR1, HCDR2 и HCDR3." Участки CDR содержат большую часть остатков, образующих специфические взаимодействия с антигеном. Нумерация и расположение аминокислотных остатков CDR в пределах областей LCVR и HCVR соответствует широко известному способу нумерации по Kabat. Легкие цепи подразделяют на каппа или лямбда по признаку наличия определенных константных областей, как известно в данной области. Тяжелые цепи подразделяют на гамма, мю, альфа, дельта или эпсилон, что определяет изотип антитела: IgG, IgM, IgA, IgD или IgE соответственно. Антитела IgG дополнительно подразделяют на подклассы, например IgG1, IgG2, IgG3, IgG4. Для каждого типа тяжелой цепи характерно наличие константной области определенного типа, последовательности которых хорошо известны в данной области. Термин "моноклональное антитело" (Mab), при употреблении в настоящем описании, относится к антителу, которое получили из одной копии или клона, включая, например, любой клон эукариот, прокариот или фагов, но не к способу получения антитела. Моноклональные антитела согласно настоящему изобретению находятся предпочтительно в гомогенной или по существу гомогенной популяции. Полноразмерные моноклональные антитела содержат две тяжелые цепи и две легкие цепи. "Антигенсвязывающие фрагменты" указанных моноклональных антител включают, например, Fab-фрагменты,Fab'-фрагменты, F(ab')2-фрагменты и одноцепочечные Fv-фрагменты. Моноклональные антитела согласно настоящему изобретению и их антигенсвязывающие фрагменты можно получать, например, с помощью методик рекомбинации, фагового отображения, методик синтеза, например CDR-графтинга, или комбинации указанных методик или с помощью других методик, известных в данной области. Например,возможно проведение иммунизации мыши с помощью DKK-1 человека или его фрагментов с последующим извлечением и очисткой полученных антител и определение, обладают ли они функциональными свойствами, сходными или аналогичными свойствам антител, описанных в настоящем документе, возможно с применением способов, описанных ниже, в примерах. Антигенсвязывающие фрагменты также можно получать с помощью стандартных способов. Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны в данной области, и их описание можно найти, например, в Harlow and Lane (1988), Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold SpringHarbor, New York, chapters 5-8 and 15, ISBN 0-87969-314-2. Выражение "химерное антитело" относится к антителу, содержащему домены, полученные от разных видов (обычно от двух видов). Антитело V представляет собой химерное антитело, вариабельные области легкой цепи и тяжелой цепи, в составе которого содержатся остатки, полученные из антитела мыши, тогда как константная область легкой цепи содержит остатки, образующие легкую каппа-цепь антитела крысы, а константная область тяжелой цепи содержит остатки из состава антитела IgG1 крысы. Антитело V представляет собой химеру мыши/крысы и применяется для исследований по снижению вероятности иммунного ответа в долгосрочных преклинических моделях. Выражение "сконструированные человеческие антитела" относится к моноклональным антителам, обладающим связывающими и функциональными свойствами согласно настоящему изобретению и содержащим каркасные области полностью или в существенной степени соответствующие каркасным областям человека, окружающие участки CDR, полученные из антитела, не являющегося человеческим антителом. "Антигенсвязывающие фрагменты" указанных сконструированных человеческих антител включают, например, Fab-фрагменты, Fab'-фрагменты, F(ab')2-фрагменты и одноцепочечные Fv-фрагменты. Выражение "каркасная область" или "каркасная последовательность" относится к любой из каркасных областей с 1 по 4. Сконструированные человеческие антитела и их антигенсвязывающие фрагменты, входящие в объем настоящего изобретения, включают молекулы,любая из каркасных областей или более одной каркасной области 1-4 в составе которых целиком или в существенной степени представляют собой области молекул организма человека, т.е. предусматривается любая комбинация отдельных каркасных областей иммуноглобулина человека или каркасных областей, в существенной степени соответствующих областям 1-4 иммуноглобулина человека. Например, указанное определение включает молекулы, в составе которых каркасная область 1 и каркасная область 2, каркасная область 1 и каркасная область 3, каркасная область 1, 2, 3 и т.д., представляют собой целиком или в существенной степени каркасные области иммуноглобулина человека. Каркасными областями, которые в существенной степени соответствуют каркасным областям человека, являются каркасные области, обладающие по меньшей мере приблизительно 80% идентичности известной каркасной последовательности зародышевой линии человека. Предпочтительно каркасные области, которые в существенной степени соответствуют каркасным областям человека, обладают по меньшей мере приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 99% идентичности известной каркасной последовательности зародышевой линии человека. Полноразмерными каркасными областями человека являются каркасные области, идентичные известной каркасной последовательности зародышевой линии человека. Каркасные последовательности зародышевой линии человека можно получить в ImMunoGeneTics (IMGT) через их сайтhttp://imgt.cines.fr или в The Immunoglobulin FactsBook by Marie-Paule Lefranc and Gerard Lefranc,Academic Press, 2001, ISBN 012441351. Например, зародышевые каркасные области легкой цепи можно выбирать из группы, состоящей из A11, А 17, А 18, А 19, А 20, А 27, А 30, L1, L11, L12, L2, L5, L15, L6, L8,O12, O2 и O8, зародышевые каркасные области тяжелой цепи можно выбирать из группы, состоящей изVH2-5, VH2-26, VH2-70, VH3-20, VH3-72, VH1-46, VH3-9, VH3-66, VH3-74, VH4-31, VH1-18, VH1-69,VI-13-7, VH3-11, VH3-15, VH3-21, VH3-23, VH3-30, VH3-48, VH4-39, VH4-59 и VH5-51. Сконструированные человеческие антитела, обладающие функциональными сходными свойствами согласно настоящему изобретению, в дополнение к описанным в настоящем документе, можно получать с помощью нескольких различных способов. Отдельные соединения на основе антител, описанные в настоящем документе, можно применять в качестве матриц или родительских соединений на основе антител для получения дополнительных соединений на основе антител. В соответствии с одним подходомCDR из состава родительского соединения на основе антитела трансплантируют в каркасную область человека, последовательность которой обладает высокой идентичностью с каркасной областью родительского соединения на основе антитела. Идентичность последовательностей полученной каркасной области обычно будет составлять по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% идентичности соответствующей каркасной области в составе родительского вещества на основе антитела. Подобная трансплантация может приводить к снижению аффинности связывания по сравнению с родительским антителом. В таком случае можно осуществить обратный процесс мутации каркасной области к родительскому варианту в отдельных положениях на основе определенных критериев, описанных Queen et al. (1991), Proc. Natl. Acad. Sci. USA, 88:2869. Дополнительные публикации, описывающие способы, полезные при гуманизировании антител мыши, включают патенты США 4816397; 5225539 и 5693761; компьютерные программы ABMOD и ENCAD согласно описанному в Levitt (1983), J. Mol. Biol. 168:595-620; и способ Winter и его коллег (Jones et al. (1986),Nature, 321:522-525; Riechmann et al. (1988), Nature, 332:323-327 and Verhoeyen et al. (1988), Science,239:1534-1536. Определение остатков для проведения обратной мутации можно проводить следующим способом. Если аминокислота попадает в следующую категорию, присутствующую аминокислоту каркасной области зародышевой последовательности человека ("каркасной области - акцептора") заменяют на аминокислоту каркасной области родительского антитела ("каркасной области - донора"):(a) аминокислота каркасной области человека в составе каркасной области - акцептора является необычной для каркасных областей человека в данном положении, тогда как соответствующая аминокислота в составе молекулы иммуноглобулина - донора является типичной для каркасных областей человека в данном положении;(b) аминокислота в данном положении непосредственно примыкает к одному из CDR или(c) любой атом боковой цепи каркасной области находится на расстоянии приблизительно 5-6 ангс-6 021401 тремов (от центра до центра) от любого атома аминокислоты в составе CDR в трехмерной модели иммуноглобулина. Если каждая из аминокислот в составе каркасной области человека каркасной области - акцептора и соответствующая аминокислота в составе каркасной области - донора является в общем случае необычной для каркасных областей человека в данном положении, указанную аминокислоту можно заменить на аминокислоту, являющуюся типичной для каркасных областей человека в данном положении. Приведенный критерий обратной мутации позволяет восстанавливать активность родительского соединения на основе антитела. Другой подход для получения сконструированных человеческих антител, проявляющих функциональные свойства, сходные с антителами, описанными в настоящем документе, включает внесение случайных мутаций в аминокислоты в пределах трансплантированных участков CDR без изменения каркасной области и скрининг полученных молекул по признаку аффинности связывания и других функциональных свойств, аналогичных или лучших, чем свойства родительских соединений на основе антител. Также можно вносить одиночные мутации в каждом аминокислотном положении каждого участка CDR с последующим измерением действия внесенных мутаций на аффинность связывания или функциональные свойства. Одиночные мутации, приводящие к улучшению свойств, можно сочетать для измерения их воздействия в комбинациях. Кроме того, возможно сочетание обоих приведенных выше подходов. После трансплантации CDR,можно проводить обратную мутацию определенных каркасных областей в дополнение к внесению замен аминокислот в участки CDR. Данная методика описана в Wu et al. (1999), J. Mol. Biol. 294:151-162. При реализации настоящего изобретения специалист в данной области может применять обычные методики, например сайт-направленный мутагенез, для замены аминокислот в составе описанных в настоящем документе CDR и каркасных последовательностей и, следовательно, создать доступные для дальнейшего применения аминокислотные последовательности вариабельной области, полученные на основе последовательностей, приведенных в настоящем документе. Все альтернативные аминокислоты,встречающиеся в природе, можно вносить в определенный сайт замены. Затем способы, описанные в настоящем документе, можно применять для скрининга указанных дополнительных последовательностей вариабельной области для определения последовательностей, обладающих указанной активностьюin vivo. Следовательно, в соответствии с настоящим изобретением можно определять дополнительные последовательности, подходящие для получения сконструированных человеческих антител и их антигенсвязывающих фрагментов. Предпочтительно количество замен аминокислот в составе каркасной области ограничивают в пределах одного, двух или трех положений в составе одной или более из четырех каркасных областей легкой цепи и/или тяжелой цепи, описанных в настоящем документе. Предпочтительно количество замен аминокислот в составе CDR ограничивают в пределах одного, двух или трех положений в составе одного или более из трех участков CDR легкой цепи и/или тяжелой цепи. Также возможны комбинации различных замен в составе указанных каркасных областей и участков CDR, описанных выше. Наиболее предпочтительно указанные методики применяют для получения дополнительных аминокислотных последовательностей вариабельной области на основе аминокислотных последовательностей вариабельных областей тяжелой и легкой цепей, соответствующих SEQ ID NO:12 иSEQ ID NO:14 соответственно. Сконструированные человеческие антитела или их антигенсвязывающие фрагменты, "конкурирующие" с молекулами, описанными в настоящем документе, представляют собой молекулы, связывающие DKK-1 человека (SEQ ID NO:29) в сайте (сайтах), идентичных или перекрывающихся с сайтом (сайтами), с которыми связывается молекула согласно настоящему изобретению. Конкурирующие сконструированные человеческие антитела или их антигенсвязывающие фрагменты можно определить, например, с помощью конкурентного анализа связывания. Например, образец или очищенный или частично очищенный DKK-1 человека (SEQ ID NO:29) закрепляют на твердой подложке. После этого добавляют антитело, описанное в настоящем документе, и исследуемое моноклональное антитело или его антигенсвязывающий фрагмент с внесением метки либо в исследуемое антитело, либо в антитело согласно настоящему изобретению. Если меченое антитело и антитело без метки связываются с разными и отдельными сайтами на DKK-1, уровень связывания меченого антитела будет одинаковым, независимо от присутствия потенциально конкурирующего антитела. Но если сайты взаимодействия идентичны или перекрываются. Немеченное антитело будет конкурировать за них, и количество меченого антитела, связавшегося с антигеном, будет понижено. Если немеченное антитело присутствует в избытке, меченое антитело вообще не будет связываться с мишенью. Для целей настоящего изобретения к конкурирующим сконструированным человеческим антителам или их антигенсвязывающим фрагментам относят молекулы, снижающие связывание антител согласно настоящему изобретению с DKK-1 приблизительно на 50%, приблизительно на 60%, приблизительно на 70%, приблизительно на 80%, приблизительно на 85%,приблизительно на 90%, приблизительно на 95% или приблизительно на 99%. Детали способов проведения указанных конкурентных анализов хорошо известны в данной области, и их можно найти, например,в Harlow and Lane (1988), Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, ColdSpring Harbor, New York, pages 567-569, ISBN 0-87969-314-2. Указанные способы анализа можно прово-7 021401 дить в количественной форме путем применения очищенных антител. Стандартную кривую строят путем титрования одного антитела с его меченой версией. Титруют способность немеченного конкурирующего моноклонального антитела или его антигенсвязывающего фрагмента ингибировать связывание меченой молекулы с планшетом. Результаты наносят на график и сравнивают концентрации, требуемые для достижения целевой степени ингибирования связывания. Обладают ли моноклональные антитела или их антигенсвязывающие фрагменты, конкурирующие со сконструированными человеческими антителами согласно настоящему изобретению или с их антигенсвязывающими фрагментами, аналогичными или сходными функциональными свойствами со сконструированными человеческими антителами согласно настоящему изобретению, можно определить с помощью способов, описанных в примерах в настоящем документе. Термин "ингибирует" обозначает способность в значительной степени антагонизировать, препятствовать, предотвращать, ограничивать, замедлять, прерывать, устранять, останавливать, снижать или обращать вспять биологическое действие DKK-1. Термин "лечение" (или "лечить", или "подвергать лечению") относится к процессам, включающим замедление, прерывание, прекращение, контроль, остановку, снижение или обращение вспять развития или тяжести симптоматики, нарушения, состояния или заболевания, но не обязательно обозначает полное устранение всех симптомов, состояний или нарушений, связанных с активностью DKK-1. Термин "предотвращение" (или "предотвращать") обозначает подавление, сдерживание или ингибирование частоты возникновения симптома, нарушения, состояния или заболевания. Возможно лечение или предотвращение острых приступов или хронических заболеваний. В случае острых приступов антитело или его антигенсвязывающий фрагмент вводят при появлении симптома, нарушения, состояния или заболевания и прекращают после окончания острого приступа. Напротив, хронический симптом, нарушение, состояние или заболевание подвергают лечению в течение более продолжительного времени. Термин "эффективное количество" относится к количеству или дозе соединения на основе антитела согласно настоящему изобретению, которое, в ходе однократного или многократного введения пациенту,обеспечивает целевое лечение или предотвращение. Терапевтически эффективные количества соединений на основе антитела согласно настоящему изобретению могут находиться в интервале приблизительно от 0,1 приблизительно до 20 мг/кг для однократной дозы. Терапевтически эффективное количество для любого отдельного пациента может установить специалист, обеспечивающий медицинское обслуживание, путем отслеживания действия соединений на основе антител на биологический маркер. Термин "заживление кости" относится к стимуляции образования кости в областях повреждения путем блокирования DKK-1. Примеры заживления кости включают, но не ограничиваются заживлением трещины, закреплением/удерживанием имплантата и закреплением/удерживанием зубного имплантата. Сконструированные человеческие антитела согласно настоящему изобретению можно применять в качестве лекарственных средств в медицине человека при введении различными способами. В наиболее предпочтительном варианте указанные композиции предназначают для парентерального введения. Указанные фармацевтические композиции можно получать различными способами, хорошо известными в данной области (см., например, Remington: The Science and Practice of Pharmacy, 19th ed.(1995), A. Gennaro et al., Mack Publishing Co.), и включать в их состав сконструированные человеческие антитела согласно настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или эксципиент. Результаты анализов, приведенные ниже, показывают, что моноклональные антитела согласно настоящему изобретению и их антигенсвязывающие фрагменты эффективны в качестве ингибиторов DKK1. Антитела согласно настоящему изобретению обладают рядом желательных свойств. Например, антитело II согласно настоящему изобретению обладает повышенной химической и физической стабильностью, а также растворимостью. Ускоренные испытания проводят для измерения химической стабильности антител путем инкубирования антител согласно настоящему изобретению в различных буферных условиях (при различных значения рН и концентрациях NaCl) и инкубирования при 4, 25 и 40 С в течение 4 недель. Химические модификации антител согласно настоящему изобретению определяют с помощью катионнообменной хроматографии ("СЕХ") для разделения заряженных вариантов (например,дезаминирование аспарагина до аспарагиновой кислоты) и анализа на жидкостном хроматографе/массспектрографе (LC-MS) для установления определенных сайтов расщепления. Для антитела II с помощью СЕХ показали наименьшее количество расщепления, и данные, полученные с помощью LC-MS, показывающие, что все три остатка аспарагина в составе участков CDR имели наименьшую степень дезаминирования по сравнению с другими антителами, описанными в настоящем документе, после 4 недель инкубирования при 40 С в буфере, значение рН которого составляло 8, подтвердили полученные результаты. Растворимость антитела II является более подходящей по сравнению с антителом I при нахождении при рН 6 + 150 мМ NaCl. Более того, антитело II сохраняло растворимость 105 мг/мл при хранении при 4 С,тогда как растворимость антитела I составляла только 48 мг/мл, и оно образовывало осадок в тех же условиях. Обозначение "ЕС 50", используемое в настоящем описании, относится к концентрации агента,производящей 50% ответа, максимально возможного для указанного агента. "Kd" относится к равновес-8 021401 ной константе диссоциации, которую можно подсчитать по формуле: koff/kon=Kd. Пример 1. Получение антител. Антитела I, II, III и IV можно получать и очищать следующим способом. Соответствующую клеткухозяина, например HEK 293 EBNA или СНО, временно или стабильно трансфицируют с помощью системы экспрессии, предназначенной для выработки антител с применением предварительно установленного оптимального векторного соотношения HC:LC или с помощью простой векторной системы, кодирующей как НС, например SEQ ID NO:23 или SEQ ID NO:24, так и LC, например SEQ ID NO:25,SEQ ID NO:26, SEQ ID NO:27 или SEQ ID NO:28. Очищенную среду, в которую происходит выработка антитела, получают с помощью любой из обычно применяемых методик. Например, среду удобно пропускать через колонку с белком А или FF колонку с G-сефарозой, уравновешенную с помощью соответствующего буфера, например фосфатно-солевого буфера (рН 7,4). Колонку промывают для удаления неспецифических связывающих компонентов. Связанное антитело элюируют, например, с помощью градиента рН (например, 0,1 М натрий-фосфатный буфер, рН 6,8 с 0,1 М натрий-цитратным буфером, рН 3,0). Определяют фракции антитела, например, с помощью SDS-PAGE и после этого объединяют. Дальнейшая очистка является необязательной, в зависимости от целевого назначения. Антитело можно концентрировать и/или стерильно фильтровать с помощью обычных методик. Растворимые агрегаты и мультимеры можно эффективно удалять с помощью обычных методик, включая эксклюзионную хроматографию, гидрофобные взаимодействия, ионнообменую или гидроксиапатитную хроматографию. Степень чистоты антитела после всех перечисленных этапов хроматографии составляет более 99%. Продукт можно незамедлительно подвергнуть заморозке при -70 С или лиофилизировать. Аминокислотные последовательности указанных антител приведены ниже. Пример 2. Измерения аффинности (Kd) антител, направленных против DKK-1. Для достижения равновесного связывания антитело в не меняющейся концентрации смешивали сHis-меченым DKK-1 в различных концентрациях (SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31,SEQ ID NO:32 или SEQ ID NO:33) (в интервале 1 нМ-1 пМ) в ФСБ (рН 7,4) + 1 мг/мл бычьего сывороточного альбумина ("БСА") или только с буфером и инкубировали в течение нескольких дней при 37 С. Ставили две серии реакций связывания, одну серию - с низкими концентрациями антитела (3 пМ) и одну серию - с высокими концентрациями антитела (30 или 50 пМ). После установления равновесия применяли аппарат KinExA 3000 (Sapidyne Inst. Inc.) для исследования фракции "свободного" (несвязанного) антитела. Вкратце, His-меченый DKK-1 ковалентно парно связывают с NHS-активированными бусинами для проточной хроматографии в Sepharose 4(GE Healthcare), упакованные в аппарате с получением маленькой колонки. Предварительно уравновешенные смеси антитела + His-меченый DKK-1 пропускали через бусины для захвата только свободного антитела. Количество свободного захваченного антитела пропорционально свободной концентрации в уравновешенных образцах, и его устанавливали путем введения второго антитела с флуоресцентной меткой. Наборы данных экспериментов с низкими и с высокими концентрациями антитела в целом подбирали с применением анализа n-кривой на программном обеспечении KinExA. Указанный подбор выдает значение Kd, а также 95% доверительный интервал. Пример 3. Активность антител, направленных против DKK-1, в анализе с применением щелочной фосфатазы С 2 С 12. Классическая передача сигнала важна для дифференциации и активности остеобластов. Wnt-3 а СМ(кондиционированная среда) в комбинации с BMP-4 стимулирует дифференциацию плюрипотентных клеток С 2 С 12 мыши в остеобласты с заметным конечным показателем содержания щелочной фосфатазы("АР"), маркера активности остеобластов. DKK-1, ингибитор классической передачи сигнала Wnt, ингибирует дифференциацию и образование АР. Нейтрализующие антитела к DKK-1 предотвращают ингибирование АР, опосредованное DKK-1. Антитела, блокирующие ингибиторную активность DKK-1, предотвращают потерю активности АР. Клетки С 2 С 12 выращивают до плотности, составляющей 60-80%, в колбах для культивирования в среде для выращивания (модифицированная по способу Дульбекко среда Игла ("DMEM"), содержащейL-глутамин, 10% термоинактивированной фетальной бычьей сыворотки ("ФБС"), 1 х антибиотик/антимикотик, 1 х пируват натрия). Клетки С 2 С 12 ресуспендировали до концентрации, составлявшей 30000 клеток/мл, в среде для выращивания и вносили по 100 мкл/лунку на 96-луночный планшет для культуры ткани с последующей инкубацией в течение ночи при 37 С, 95% влажности, 5% СО 2. Среду для выращивания замещали 50 мкл среды для анализа (DMEM, содержащая L-глутамин, 5% термоинактивированной ФБС, 1 х антибиотик/антимикотик, 1x пируват натрия). Для стимуляции дифференциации(и, следовательно, индуцирования образования АР) добавляли по 100 мкл среды для анализа плюс 1,5xWnt-3 а СМ + ВМР-4 (RD Systems catalogue 314-BP). Таким образом достигали итоговых значений концентрации, составлявших концентрацию 1x Wnt-3 а СМ и 25 нг/мл для ВМР-4. Отрицательные контроли содержали только СМ L-клеток (без Wnt-3 а или ВМР-4). Клетки инкубировали при 37 С, 95% влажности, 5% CO2 в течение 72 ч. Среду удаляли, клетки отмывали с помощью 200 мкл фосфатносолевого буфера ("ФСБ"), после чего ФСБ удаляли. Проводили 3 цикла замораживания/оттаивания клеток. В каждую лунку вносили по 100 мкл субстрата One-step pNPP (Thermo Scientific catalogue 37621) и планшет инкубировали при комнатной температуре. Величину поглощения считывали при 405 нм. Для определения концентрации DKK-1, необходимой для ингибирования дифференциации, молекулыDKK-1, полученные из различных видов организмов, титровали для определения минимальной концентрации, требуемой для полного ингибирования индукции АР. Минимальная концентрация DKK-1 каждого вида, полностью ингибирующей индукцию АР, имела следующие значения: DKK-1 человека = 38 нМ, DKK-1 яванского макака = 11,4 нМ, DKK-1 крысы = 5,8 нМ и DKK-1 кролика = 25,0 нМ. После определения концентрации DKK-1, полностью ингибирующей индукцию АР, антитело, направленное против DKK-1, в повышенных концентрациях предварительно инкубировали в среде для анализа с ингибиторной концентрацией DKK-1 в течение 30 мин при комнатной температуре. Индукцию АР определяли с помощью способа, описанного выше. Результаты приведены в виде ЕС 50 (нМстандартная ошибка). Антитело II блокирует ингибирование щелочной фосфатазы С 2 С 12, опосредуемое DKK-1. EC50(приведенные в виде нМстандартная ошибка) для DKK-1 различных видов составляли следующие значения: человека = 9,80,41, яванского макака = 6,40,25, крысы = 2,90,25 и кролика = 6,00,32. Пример 4. Анализ кортикального дефекта (CD) in vivo. Проводили овариэктомию шестимесячных самок крыс линии Sprague-Dawley и оставляли их для потери костной массы в течение двух месяцев. В правую и левую бедренные кости с помощью электрической дрели с 2 мм стоматологическим буром вносили повреждения, диаметр которых составлял 2 мм. Указанное отверстие проходит как через переднюю, так и через заднюю поверхности надкостницы. Заживление кости проверяли в продольном направлении путем измерения плотности костной массы("BMD") с применением количественно компьютерной томографии ("qCT") через 35 дней после операции. В конце эксперимента животных умерщвляли и бедренные кости целиком подвергали испытаниям на разрушение для определения биохимической прочности всего диафиза. Антитела вводили подкожно в приведенных дозах и с указанными интервалами. Антитело II вводили следующим способом: 5 мг/кг раз каждые две недели, с началом через день после операции (группа 1), 1 мг/кг (группа 2), 5 мг/кг (группа 3) или 15 мг/кг (группа 4) вводили раз каждые две недели, с началом через девять дней после операции. BMD измеряли с помощью qCT на 35 день. Для группы 1 показали статистически значимое повышение BMD в области как передней, так и задней надкостницы. Для группы 4 показали статистически значимое повышение BMD в обеих областях надкостницы, хотя для групп 2 и 3 не показали значительного повышения BMD. Пример 5.In vivo анализ эффективности при раке. Мышей (самок мышей С.В-17, Fox Chase модель тяжело комбинированной иммунной недостаточностиCB17SC-M) выдерживали для акклиматизации в виварии в течение недели перед началом эксперимента. После акклиматизации мышей случайным образом разделяли на группы по 10 особей на обработку. Подкожно имплантировали культивированные клетки немелкоклеточного рака легкого человека А 549 в боковую поверхность живота мыши и позволяли достичь средних значений объема опухоли, составлявших 100 мм 3. Антитело II (1 и 5 мг/кг), контрольное антитело IgG (1 и 5 мг/кг) или среду (цитратный буферный солевой раствор с добавлением 0,02% Tween 80) вводили путем подкожной инъекции. Животных подвергали обработке 2 раза с интервалов 7 дней. Опухоли измеряли 2 раза в неделю с помощью электронных штангенциркулей для построения кривых роста. Животных также осматривали дважды в неделю на предмет колебаний в массе тела и признаки токсичности. Результаты измерений объема опухоли, отобранных на 29 день, приведены в табл. 3. Как показано в табл. 2, в группах, получавших антитело II, обнаружено значительное ингибирование роста трансплантатов немелкоклеточного рака легкого человека А 549 in vivo. Таблица 2 Эффективность антитела II в модели трансплантата немелкоклеточного рака легкого человека А 549In vivo анализ ангиогенной ренормализации ксенотрансплантата. Для понимания механизма противоопухолевой эффективности проводили анализ большого количества изображений на опухолях А 549, подвергавшихся обработке антителом II или контролем IgG. Проводили как качественные, так и количественные измерения нескольких фенотипических маркеров для оценки биологического процесса ангиогенеза, связанного с раком (CD31 и актин гладкой мускулатуры,SMA), индукцией гипоксии (переносчик глюкозы 1, GLUT1), пролиферацией клеток (Ki67) и апоптозом(концевая метка UDP Nick-End, TUNEL). Самкам мышей С.В-17 (Fox Chase SCID) модельCB17SC-M в возрасте 7-8 недель позволяли акклиматизироваться в течение недели и питаться ad libitum при соблюдении диеты с нормальным содержанием жира (4,5%), которой придерживались в ходе всего исследования. Клетки А 549 из АТСС выращивали раздельно в среде F-12 Kaighn's media (Invitrogen 21127) с добавлением 10% ФБС (Invitrogen 0, и 100 х разведений пирувата натрия, неосновных аминокислот иpen-strep (Invitrogen 11360, 11140 и 15140 соответственно). Их разъединяли и подготавливали в итоговой концентрации, составлявшей 50106 клеток/мл в ФСБ после 19 пассажа с 95% жизнеспособностью. Клетки рака легкого человека А 549 вводили в количестве 5106 подкожно в бок экспериментальной мыши в смеси ФСБ и Matrigel (Becton Dickinson, Bedford, MA) с соотношением 1:1. Измерения размера опухоли и массы тела проводили дважды в неделю. Перед обработкой мышей рандомизировали на основе размера опухоли с применением алгоритма рандомизации. Когда объем опухолей достигал 200 мм 3, рандомизированных мышей разделяли на 2 группы по 10 животных и подкожно вводили в 1 день и в 8 день по 5 мг/кг антитела II или контрольного IgG4. Исследование останавливали через 10 дней после введения первой дозы антитела. Антитело II готовили в цитратно-солевом буфере (CBS) (10 мМ цитрата, рН 6, 150 мМ NaCl и 0,2% полисорбата). Контрольный IgG4 находился в концентрации 6,0 мг/мл в фосфатно-солевом буфере(ФСБ). Ксенотрансплантаты опухолей извлекали из мышей через 17 дней введения и помещали в фиксатор цинк-трис (BD Pharmingen). Фиксированные опухоли обрабатывали, блокировали в парафине и делали срезы, толщина которых составляла 3 мкм, на стандартных предметных стеклах микроскопа. Срезы запекали при 60F в течение 1 ч, после чего депарафинизировали в ксилене (4 обработки, каждая продол- 11021401 жительностью 10 мин). Срезы дегитратировали с помощью серий погружений в этанол/воду с итоговыми отмывками в трис-буферном солевом растворе с Tween (TBST). После этого срезы блокировали с помощью блокирующего белка (DAKO) в течение 30 мин. Для группы по исследованию опухоли срезы окрашивали комбинацией Hoechst 33324 (Invitrogen), CD31 крысы, направленного против иммуноглобулинов человека (Pharmingen)/Alexa-488, направленного против иммуноглобулинов крысы (Invitrogen), антител кролика, направленных против Ki67 (NeoMarkers)/Alexa 647, направленного против иммуноглобулинов кролика (Invitrogen) и TUNEL-TMR red (разведенного 1:5 в буфере для разведения TUNEL; Roche). Для группы по исследованию ангиогенеза срезы окрашивали комбинацией Hoechst 33324 (Invitrogen), CD31 крысы, направленного против иммуноглобулинов человека (Pharmingen)/Alexa-488, направленного против иммуноглобулинов крысы (Invitrogen), антител кролика, направленных против GLUT1 (Chemicon)/Alexa 647, направленного против иммуноглобулинов кролика (Invitrogen) и антител мыши, направленных против актина гладкой мускулатуры/Су 3 (Sigma). Срезы визуализировали с помощью лазерного сканирующего цитометра iCys (CompuCyte) и рабочей станции Marianas Digital Imaging, оснащенной инвертированным флуоресцентным микроскопом Zeiss Axiovert 200M (Intelligent Imaging Innovations). Сравнения количественных данных исследованных групп проводили с применением анализаDunnet's на статистическом программном обеспечении JMP (SAS). Как показано в табл. 3, ксенотрансплантаты А 549 контрольных животных, подвергавшихся обработке IgG, слабо васкуляризованы, имеют средние показателя миофибробластов и много ограниченных областей гипоксии. Контрольные опухоли, подвергавшиеся обработке IgG, имели обширную сеть сосудов, состоящую как из неоангиогенных отростков сосудов, так и из зрелых сосудов, слабо покрытых перицитами. Контрольные опухоли, подвергавшиеся обработке IgG, содержат области гипоксии (маркером которых является GLUT1), с четко отсутствующим маркером, расположенные на некотором расстоянии от перфузированных сосудов и областей некроза, находящихся еще дальше от сосудов. Обработка антителом II приводила к снижению площади сосудов, снижению площади перицитов и снижению покрытия сосудов перицитами. Тем не менее, указанное лечение не приводило к значительным различиям в гипоксии опухоли. Количественно, похоже, что васкуляризация сосудов, подвергнутая обработке антителом II,состояла из более мелких, менее разветвленных сосудов и с меньшим покрытием перицитами по сравнению с контрольной группой, подвергавшейся воздействию IgG. Как показано в табл.3, опухоли, обрабатываемые IgG, содержали пролиферирующие клетки, даже распространявшиеся наружу, но также содержали одну или более больших областей некроза, не подвергнутых васкуляризации. Обработка антителом II не приводила к изменениям в процессах апоптоза и лишь к легкому незначительному снижению общей площади пролиферации. Тем не менее, произошло основательное снижение процента площади клеток с высокой плотностью Ki67 в опухолях, подвергнутых обработке антителом II, что может указывать на снижение количества клеток, находящихся в фазе Таблица 3 Антитело II в анализе ангиогенной ренормализации ксенотрансплантат in vivoIn vivo анализ эффективности для кости. Для оценки способности антитела V (легкая цепь - SEQ ID NO:34 и тяжелая цепь - SEQ ID NO:35) ускорять образование кости вокруг имплантата и восстановление костной ткани применяли четырехмесячных самцов крыс Sprague-Dawley (Harlan Sprague Dawley Inc), вес которых составлял приблизительно 425 г. Крысам хирургическим путем имплантировали титановый винт (24 мм) в оба ответвления латеральной стороны средней оболочки стенки кровеносного сосуда непосредственно над большеберцовым малоберцовым сочленением. После этого крыс случайным образом разделяли на 2 группы в соответствии с массой тела и вводили антитело V в дозе, составлявшей 10 мг/кг или контрольный IgG в дозе, составлявшей 10 мг/кг путем подкожной инъекции раз в неделю с началом в день проведения операции и продолжительностью курса 21 день. Для ex vivo сканирования оценки новообразованной кости применяли количественную компьютерную томографию (сканер для КТ модели Aloka LaTheta LTC-100) с размеров воксела, составлявшим 60 мкм. Целевой объем (VOI) устанавливали через 28 срезов с интервалом в 0,1 мм от предыдущего места имплантации. Различия в группах измеряли с помощью программного обеспечения JMP версии 5.1. (Cary, North Carolina), сравнение против контрольного IgG проводили с помощью способа Dunnett's при уровне значимости Р 0,05. Количественная оценка с помощью ex vivo факситронных х-лучевых изображений указывает на то, что крысы, подвергнутые обработке антителом V,имели большую массу новообразованной кости или костной мозоли вокруг имплантата. В ходе количественного анализа с методом КТ выявили статистически значимое увеличение кортикального содержания минеральных веществ в области имплантата (14%), площади новой кости (16%), толщины надкостницы (7%), содержания минеральных веществ в костном мозге новообразованной губчатой кости в области имплантата (18%) и площади кости (16%) в организме крыс, подвергнутых обработке антителом V по сравнению с контрольным IgG. Данные указывают на то, что антитело V стимулирует образование новой кости и ускоряет восстановление костной ткани в организме мышей с титановыми имплантатами. Таблица 4 Анализ новообразованной кости в области имплантата методом микро-КТ Вариабельные участки тяжелых цепей: Вариабельные участки легких цепей: Нуклеотидная последовательность - вариабельные области тяжелой цепи: Нуклеотидная последовательность - вариабельные области легкой цепи: Антитело V - вариабельная область легкой цепи: Антитело V - вариабельная область тяжелой цепи: Консенсусная вариабельная область тяжелой цепи: Х 17 представляет собой Н, N. Консенсусная вариабельная область легкой цепи:
МПК / Метки
МПК: C07K 16/18
Код ссылки
<a href="https://eas.patents.su/30-21401-antitela-k-dkk-1.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела к dkk-1</a>
Предыдущий патент: Устройство и способ регулируемого распределения текучей среды и способ производства такого устройства
Следующий патент: Сухопорошковый ингалятор
Случайный патент: Способ и система для производства спиртов и/или кислот