Способ лечения или уменьшения риска возникновения симптомов или заболеваний у постменопаузных женщин, интравагинальная композиция и суппозиторий, применяемые в нем
Формула / Реферат
1. Способ лечения или уменьшения вероятности возникновения симптомов или заболеваний, выбранных из недержания мочи, вагинальной атрофии, атрофического вагинита, вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин, включающий интравагинальное введение эффективного количества предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3β,17β-диола и 4-андростен-3,17-диона в дозе 0,5-13 мг/день.
2. Способ по п.1, где указанное терапевтическое количество предшественника половых стероидных гормонов составляет 0,5-6,5 мг/день и менее.
3. Способ по п.1, где предшественник половых стероидных гормонов вводят посредством препарата интравагинальной рецептуры, выбранного из группы, состоящей из крема, лосьона, геля, мази, вагинной овулы, суппозитория и кольца.
4. Способ по п.1, где предшественник половых стероидных гормонов, при необходимости, комбинируют с селективным модулятором эстрогеновых рецепторов (SERM), чтобы доставлять их последовательно или одновременно.
5. Способ лечения или уменьшения вероятности возникновения симптомов или заболеваний, выбранных из группы, состоящей из недержания мочи, вагинальной атрофии, атрофического вагинита, вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин, включающий интравагинальное введение (а) предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3β,17β-диола и 4-андростен-3,17-диона в дозе 0,5-13 мг/день, а также введение (b) терапевтически эффективного количества SERM, причем указанный предшественник полового стероидного гормона и SERM вводятся последовательно или одновременно, как части комбинированной терапии.
6. Способ по п.4 или 5, где SERM имеет следующую химическую структуру:
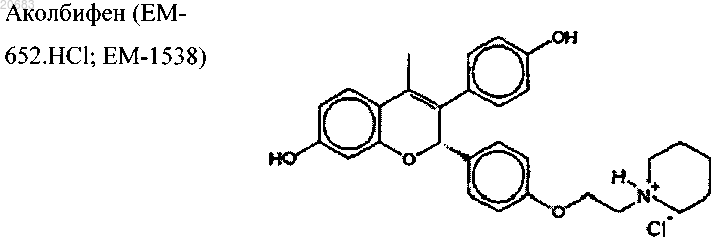
7. Способ по п.5, где указанное терапевтическое количество предшественника половых стероидных гормонов составляет 0,5-6,5 мг/день.
8. Способ по п.5, где предшественник половых стероидных гормонов вводят посредством препарата интравагинальной рецептуры, выбранного из группы, состоящей из крема, лосьона, геля, мази, вагинной овулы, суппозитория и кольца пластыря.
9. Способ по п.1 или 5, где предшественником является дегидроэпиандростерон.
10. Способ по п.1 или 5, где указанное терапевтическое количество предшественника половых стероидных гормонов составляет 0,5-3,25 мг/день и менее.
11. Способ лечения или уменьшения вероятности возникновения симптомов или заболеваний, выбранных из недержания мочи, вагинальной атрофии, атрофического вагинита, вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин, включающий интравагинальное введение предшественника половых стероидных гормонов дегидроэпиандростерона в дозе 0,5-13 мг/день.
12. Способ по пп.1, 5 или 11, где предшественник половых стероидных гормонов вводят в форме единичной дозы.
13. Способ по п.12, где единичная доза содержит порцию крема, геля, раствора, лосьона или мази.
14. Интравагинальная фармацевтическая композиция для применения в способе по пп.1-13, содержащая 0,5-13 мг предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3β,17β-диола и 4-андростен-3,17-диона, и фармацевтически приемлемый эксципиент, применяемый для интравагинального введения, разбавитель или носитель.
15. Интравагинальная фармацевтическая композиция по п.14, в которой количество предшественника половых стероидных гормонов составляет 3,0-13 мг.
16. Интравагинальная фармацевтическая композиция по п.14, в которой эксципиент, разбавитель или носитель, выбраны из группы, состоящей из чистых или смешанных природных или полусинтетических три-, ди- или моноглицеридов насыщенных, ненасыщенных или гидрогенизированных жирных кислот; масла, пальмового, пальмоядрового масла, частично гидрогенизированного хлопкового и кокосового масла и их триглицеридных производных; гидрогенизированных жирных спиртов и эфиров; полиоксистеарата; перегруппированных гидрогенизированных растительных масел; эвтектических смесей моно-, ди-, триглицеридов, полученных из природных масел, сложных триглицеридных эфиров; Твина 61; масла какао, фармацевтически приемлемых жирноосновных эксципиентов и их комбинации.
17. Интравагинальная фармацевтическая композиция по п.14, которая выполнена в форме крема, геля, раствора, лосьона или мази и адаптирована для разделения на одну или более порций, содержащих единичную дозу.
18. Интравагинальная фармацевтическая композиция по п.14, которая дополнительно содержит терапевтически эффективное количество SERM.
19. Интравагинальная фармацевтическая композиция по п.18, в которой предшественник половых стероидных гормонов представляет собой дегидроэпиандростерон, a SERM представляет собой аколбифен.
20. Вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий предшественник половых стероидных гормонов, выбранный из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3β,17β-диола и 4-андростен-3,17-диона, и фармацевтически приемлемый применимый для интравагинального введения эксципиент, причем указанный суппозиторий содержит 0,5-13 мг указанного предшественника половых стероидных гормонов.
21. Вагинальный суппозиторий по п.20, содержащий 6,5 мг предшественника половых стероидных гормонов.
22. Вагинальный суппозиторий по п.20, содержащий 3,25 мг предшественника половых стероидных гормонов.
23. Вагинальный суппозиторий по п.20, содержащий 3-13 мг предшественника половых стероидных гормонов.
24. Вагинальный суппозиторий по п.20, содержащий 3-13 мг предшественника половых стероидных гормонов и липофильный эксципиент.
25. Вагинальный суппозиторий по п.20, содержащий 3-13 мг предшественника половых стероидных гормонов и эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
26. Вагинальный суппозиторий по п.20, содержащий липофильный эксципиент.
27. Вагинальный суппозиторий по п.20, включающий эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
28. Вагинальный суппозиторий по п.20, содержащий 6,5 мг предшественника половых стероидных гормонов и эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
29. Вагинальный суппозиторий по п.20, содержащий 3,25 мг предшественника половых стероидных гормонов и эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
30. Вагинальный суппозиторий по п.20, в котором эксципиентом является Witepsol H-15.
31. 1,3 мл вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий 6,5 мг предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3β,17β-диола и 4-андростен-3,17-диона, и Witepsol Н-15 в качестве эксципиента.
32. Вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий дегидроэпиандростерон, и фармацевтически приемлемый эксципиент, применимый для интравагинального введения, в котором содержание дегидроэпиандростерона составляет 0,5-13 мг.
33. Вагинальный суппозиторий по п.32, в котором содержание дегидроэпиандростерона составляет 6,5 мг.
34. Вагинальный суппозиторий по п.32, в котором содержание дегидроэпиандростерона составляет 3,25 мг.
35. Вагинальный суппозиторий по п.32, в котором содержание дегидроэпиандростерона составляет 3-13 мг.
36. Вагинальный суппозиторий по п.32, содержащий 3-13 мг дегидроэпиандростерона и липофильный эксципиент.
37. Вагинальный суппозиторий по п.32, содержащий 3-13 мг дегидроэпиандростерона и эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
38. Вагинальный суппозиторий по п.32, содержащий 6,5 мг дегидроэпиандростерона и эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
39. Вагинальный суппозиторий по п.32, содержащий 3,25 мг дегидроэпиандростерона и эксципиент, содержащий сложные эфиры насыщенных жирных кислот.
40. Вагинальный суппозиторий по п.32, в котором эксципиентом является Witepsol Н-15.
41. Вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий 6,5 мг дегидроэпиандростерона и Witepsol Н-15 в качестве эксципиента.
42. 1,3 мл вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий 6,5 мг дегидроэпиандростерона и Witepsol Н-15 в качестве эксципиента.
43. Вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий 3,25 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента.
44. 1,3 мл вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий 3,25 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента.
45. Вагинальный суппозиторий для применения в способе по любому из пп.1-5 и 11, содержащий 3-13 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента.
Текст
СПОСОБ ЛЕЧЕНИЯ ИЛИ УМЕНЬШЕНИЯ РИСКА ВОЗНИКНОВЕНИЯ СИМПТОМОВ ИЛИ ЗАБОЛЕВАНИЙ У ПОСТМЕНОПАУЗНЫХ ЖЕНЩИН,ИНТРАВАГИНАЛЬНАЯ КОМПОЗИЦИЯ И СУППОЗИТОРИЙ, ПРИМЕНЯЕМЫЕ В НЕМ Обеспечены новые способы лечения и/или уменьшения вероятности приобретенных симптомов или заболеваний, выбранных из недержания мочи, вагинальной атрофии, атрофического вагинита,вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин,включающие интравагинальное введение эффективного количества предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиантростерона, андрост-5-ен-3,17-диола и 4-андростен-3,17-диона в дозе 0,5-13 мг/ день. Кроме того, обеспечены интравагинальные композиции и вагинальные суппозитории,применяемые в способах по изобретению. Область техники, к которой относится изобретение Данное изобретение обеспечивает новые способы введения и дозирования дегидроэпиандростерона(DHEA) для использования положительных андрогенных действий (например, в вагинальных слоях lamina propia (собственной пластинке слизистой оболочки) и/или слое muscularis (мышечной пластинке слизистой оболочки), без вызывания нежелательных системных эстрогенных эффектов. Кроме DHEA, могут быть использованы другие предшественники половых стероидных гормонов (например, сульфат дегидроэпиандростена, андрост-5-ен-3,17-диол и 4-андростен-3,17-дион). Уровень техники Известны многие связанные с гормонами терапии. Например, многие обеспечивают половой стероидный гормон эстроген или андроген системно и/или в ткань-мишень. Кроме прямого введения андрогенов и/или эстрогенов предшественники половых стероидных гормонов, которые могут превращаться в эстроген и/или андроген в конкретной ткани, также были использованы для многих состояний. Как андрогены, так и эстрогены могут быть полезными в некоторых контекстах и вредными в других. Это зависит inter alia от ткани-мишени, конкретных потребностей, представленных пациентом, и степенью, в которой может поражаться ткань, не являющаяся мишенью. Некоторые терапии, хотя они и являются нацеленными, все еще могут иметь нежелательную активность в другом участке в теле (например, локальное введение этого фармацевтического агента приводит, тем не менее, к увеличенному системному присутствию либо фармацевтического вещества, либо одного из его метаболитов. Механизм действия также не всегда является полностью понятным, особенно относительные вклады в него андрогенов и эстрогенов. Сущность изобретения Таким образом, целью данного изобретения является использование конкретных доз, композиций и способов введения для лучшего достижения полезных эффектов половых стероидных гормонов и лучшей элиминации их нежелательных побочных эффектов. В одном аспекте это изобретение обеспечивает способ лечения или уменьшения вероятности возникновения симптомов или заболеваний, выбранных из недержания мочи, вагинальной атрофии, атрофического вагинита, вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин, включающий интравагинальное введение эффективного количества предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3,17-диола и 4-андростен-3,17-диона в дозе 0,5-13 мг/день. Это терапевтическое количество предшественника половых стероидных гормонов составляет 0,5-6,5 мг/день и менее. Предшественник половых стероидных гормонов вводят посредством препарата интравагинальной рецептуры выбранного из группы, состоящей из крема, лосьона, геля, мази, вагинной овулы, суппозитория и кольца. Предшественник половых стероидных гормонов, при необходимости, комбинируют с селективным модулятором эстрогеновых рецепторов (SERM), чтобы доставлять их последовательно или одновременно. В другом аспекте изобретение обеспечивает способ лечения или уменьшения вероятности возникновения симптомов или заболеваний, выбранных из группы, состоящей из недержания мочи, вагинальной атрофии, атрофического вагинита, вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин, включающий интравагинальное введение (а) предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3,17-диола и 4-андростен-3,17-диона в дозе 0,5-13 мг/день, а также введение (b) терапевтически эффективного количества SERM, причем указанный предшественник полового стероидного гормона и SRRM вводится последовательно или одновременно, как часть комбинированной терапии. В этом аспекте SERM имеет следующую химическую структуру: Терапевтическое количество предшественника половых стероидных гормонов может составлять 0,5-6,5 мг/день, и предшественник половых стероидных гормонов вводят посредством препарата интравагинальной рецептуры, выбранного из группы, состоящей из крема, лосьона, геля, мази, вагинной овулы, суппозитория и кольца пластыря. Предпочтительно предшественником в этих аспектах изобретения является дегидроэпиандростерон. Терапевтическое количество предшественника половых стероидных гормонов составляет 0,5-3,25 мг/день и менее. В другом аспекте изобретение обеспечивает способ лечения или уменьшения вероятности возник-1 020683 новения симптомов или заболеваний, выбранных из недержания мочи, вагинальной атрофии, атрофического вагинита, вагинальной сухости, диспареунии и сексуальной дисфункции у постменопаузных женщин, включающий интравагинальное введение предшественника половых стероидных гормонов дегидроэпиандротерона в дозе 0,5-13 мг/день. Все указанные выше аспекты изобретения предусматривают, что предшественник половых стероидных гормонов вводят в форме единичной дозы, которая может содержать порцию крема, геля, раствора, лосьона или мази. В другом аспекте изобретение обеспечивает интравагинальную фармацевтическую композицию для применения в способах по изобретению, содержащую 0,5-13 мг предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3,17-диола и 4-андростен-3,17-диона и фармацевтически приемлемый эксципиент,применяемый для интравагинального введения, разбавитель или носитель. В этой интравагинальной фармацевтической композиции количество предшественника половых стероидных гормонов составляет 3,0-13 мг и в ней эксципиент, разбавитель или носитель, выбраны из группы, состоящей из чистых или смешанных природных или полусинтетических три-, ди- или моноглицеридов насыщенных, ненасыщенных или гидрогенизированных жирных кислот; масла, пальмового,пальмоядрового масла, частично гидрогенизированного хлопкового и кокосового масла и их триглицеридных производных; гидрогенизированных жирных спиртов и эфиров; полиоксистеарата; перегруппированных гидрогенизированных растительных масел; эвтектических смесей моно-, ди-, триглицеридов,полученных из природных масел, сложных триглицеридных эфиров; Твина 61; масла какао, фармацевтически приемлемых жирноосновных эксципиентов и их комбинации. Интравагинальную фармацевтическую композицию выполняют в форме крема, геля, раствора, лосьена или мази, и она адаптирована для разделения на одну или более порций, содержащих единичную дозу. Интравагинальная фармацевтическая композиция может дополнительно содержать терапевтически эффективное количество SERM. В указанной интравагинальной фармацевтической композиции предшественник половых стероидных гормонов представляет собой предпочтительно дегидроэпиандростерон, a SERM - аколбифен. В другом аспекте изобретение обеспечивает вагинальный суппозиторий для применения в способах по изобретению, содержащий предшественник половых стероидных гормонов, выбранный из группы,состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост-5-ен-3,17-диола и 4-андростен-3,17-диона, и фармацевтически приемлемый применимый для интравагинального введения эксципиент, причем указанный суппозиторий содержит 0,5-13 мг указанного предшественника половых стероидных гормонов. Этот вагинальный суппозиторий предпочтительно содержит 6,5 мг предшественника половых стероидных гормонов, более предпочтительно 3,25 мг предшественника половых стероидных гормонов. Содержание предшественника половых стероидных гормонов в вагинальном суппозитории находится в интервале 3-13 мг, а сам суппозиторий может содержать липофильный эксципиент. Вагинальный суппозиторий, содержащий 3-13 мг предшественника половых стероидных гормонов и эксципиент, может содержать сложные эфиры насыщенных жирных кислот. Эксципиент предпочтительно является липофильным эксципиентом. Предпочтительно эксципиент содержит сложные эфиры насыщенных жирных кислот. Предпочтительно, когда вагинальный суппозиторий содержит 6,5 мг предшественника половых стероидных гормонов и эксципиент, содержащий сложные эфиры насыщенных жирных кислот. Изобретение обеспечивает вагинальный суппозиторий, содержащий 3,25 мг предшественника половых стероидных гормонов и эксципиент, содержащий сложные эфиры насыщенных жирных кислот. В частном варианте изобретения эксципиентом является Witepsol H-15. В другом аспекте изобретение обеспечивает 1,3 мл вагинального суппозитория для применения в способах по изобретению, содержащего 6,5 мг предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, сульфата дегидроэпиандростерона, андрост 5-ен-3,17-диола и 4-андростен-3,17-диона, и Witepsol H-15 в качестве эксципиента. В другом аспекте изобретение обеспечивает вагинальный суппозиторий для применения в способах по изобретению, содержащий дегидроэпиандростерон и фармацевтически приемлемый эксципиент, применимый для интравагинального введения, в котором содержание дегидроэпиандростерона составляет 0,5-13 мг. Предпочтительно этот вагинальный суппозиторий содержит 6,5 мг дегидроэпиандростерона, особенно предпочтительно, когда содержание дегидроэпиандростеронасоставляет 3,25 мг. Предпочтителен вагинальный суппозиторий, в котором содержание дегидроэпиандростерона составляет 3-13 мг, особенно предпочтительно, когда он содержит и липофильный эксципиент, в частности включающий сложные эфиры насыщенных жирных кислот. Предпочтителен вагинальный суппозиторий, содержащий 6,5 мг дегидроэпиандростерона и эксци-2 020683 пиент, содержащий сложные эфиры насыщенных жирных кислот. Также предпочтителен вагинальный суппозиторий, содержащий 3,25 мг дегидроэпиандростерона и эксципиент, содержащий сложные эфиры насыщенных жирных кислот. В частном случае вагинальный суппозиторий содержит в качестве эксципиента Witepsol H-15. В другом аспекте изобретение обеспечивает вагинальный суппозиторий для применения в способах по изобретению, содержащий 6,5 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента. В другом аспекте изобретение обеспечивает 1,3 мл вагинальный суппозиторий для применения в способах по изобретению, содержащий 6,5 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента. В другом аспекте изобретение обеспечивает вагинальный суппозиторий для применения в способах по изобретению, содержащий 3,25 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента. В другом аспекте изобретение обеспечивает 1,3 мл вагинального суппозитория для применения в способах по изобретению, содержащего 3,25 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента. В другом аспекте изобретение обеспечивает вагинальный суппозиторий для применения в способах по изобретению, содержащий 3-13 мг дегидроэпиандростерона и Witepsol H-15 в качестве эксципиента. Краткое описание чертежей Фиг. 1 показывает уровни в сыворотке DHEA и 5-диола в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA. Данные выражены в виде средних величинSEM (n=9 или 10). Фиг. 2 показывает уровни в сыворотке Тесто и DHT в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA (n=8). Данные выражены в виде средних величинSEM (n=8-9). Уровни Тесто (тестостерона) из одного пациента в группе плацебо исключали вследствие необъяснимых высоких уровней Тесто,не отраженных в случае любого другого стероида. Фиг. 3 показывает уровни в сыворотке E1 и Е 2 в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8%DHEA. Данные выражены в виде средних величинSEM (n=9 или 10). Фиг. 4 показывает уровни в сыворотке E1-S и DHEA-S в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA. Данные выражены в виде средних величинSEM (n=9 или 10). Фиг. 5 показывает уровни в сыворотке 4-диона и ADT-G в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA. Данные выражены в виде средних величинSEM (n=9 или 10). Фиг. 6 показывает уровни в сыворотке 3-диол-3G и 3-диол-17G в день 1 или день 7 у 40-75 летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA (n=8). Данные выражены в виде средних величинSEM (n=8-10). Фиг. 7 показывает среднюю 24-часовую концентрацию в сыворотке (AUC0-24 ч/24) DHEA, 5-диола,DHEA-S, 4-диона, Тесто и DHT, измеренную в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA. Данные выражали в виде средних величинSEM (n=8-10). Уровни Тесто из одного пациента в группе плацебо исключали (n=8 в этой группе). Концентрации стероидных гормонов в сыворотке, измеренные у 30-35-летних постменопаузных женщин, добавляли в качестве ссылки. Данные выражали в виде среднего (n=47) с указанием 5-го и 95-го процентилей (пунктирные линии).р 0,05,р 0,01, экспериментальных данных (день 7) против плацебо (день 7). Фиг. 8 показывает среднюю 24-часовую концентрацию в сыворотке (AUC0-24 ч/24) ADT-G, 3-диол 3G, 3-диол-17G, E1, E2 и E1-S, измеренную в день 1 или день 7 у 40-75-летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA. Данные выражали в виде средних величинSEM (n=9 или 10). Концентрации стероидных гормонов в сыворотке, измеренные у 30-35-летних постменопаузных женщин, добавляли в качестве ссылки. Данные выражали в виде среднего (n=47) с указанием 5-го и 95-го процентилей (пунктирные линии).р 0,05, р 0,01, экспериментальных данных (день 7) против плацебо (день 7). Фиг. 9 показывает изменения уровней в сыворотке суммы андрогенных метаболитов ADT-G, 3Diol-17G у постменопаузных женщин с вагинальной атрофией после интравагинального введения увеличивающихся доз DHEA. Эти данные выражены в виде процента уровней в сыворотке одних и тех же стероидных метаболитов, наблюдаемых у молодых взрослых (30-35-летних), имеющих менструальный цикл предменопаузных женщин. Уровень превращения получают делением суммы уровней в сыворотке ADTG, 3-диол-3G и 3-диол-17G у женщин, которые получали дозы 0,5, 1,0 и 1,8% DHEA, на величины,обнаруживаемые у предменопаузных женщин (данные из Labrie et al., 2006). Изменения DHEA в сыворотке в сравнении со здоровыми предменопаузными женщинами показаны также в качестве сравнения для показа эффективности превращения и фоновых уровней андрогенных метаболитов и DHEA соответ-3 020683 ственно. Фиг. 10 показывает индекс зрелости (А) вагинальный рН (В), измеренные в день 1 и день 2 у 40-75 летних постменопаузных женщин после ежедневного введения вагинальных суппозиториев, содержащих 0, 0,5, 1,0 или 1,8% DHEA. Данные выражали в виде средних величинSEM (n=9 или 10).р 0,05,р 0,01, данных в день 7 против данных в день 1. Фиг. 11 показывает временной ход в сыворотке дегидроэпиандростерона (DHEA) (А) и андрост-5 ен-3,17-диола (5-диола) (В) после единственного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Фиг. 12 показывает временной ход в сыворотке андростендиона (4-диона) (А) и тестостерона (В) после единственного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Фиг. 13 показывает временной ход в сыворотке эстрона (E1) (А) и 17-эстрадиола (E2) (В) после единственного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Фиг. 14 показывает временной ход в сыворотке сульфата дегидроэпиандростерона (DHEA-S) (А) и сульфата эстрона (E1-S) (В) после единственного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Фиг. 15 показывает временной ход в сыворотке андростеронглюкуронида (ADT-G) (А) и андростон 3,17-диолглюкуронида (3-diol-G) (В) после ежедневного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Фиг. 16 показывает временной ход в сыворотке дегидроэпиандростерона (DHEA) (А) и андрост-5 ен-3,17-диола (5-диола) (В) после ежедневного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Измерения выполняли в день 14 введения доз. Фиг. 17 показывает временной ход в сыворотке андростендиона (4-диона) (А) и тестостерона (В) после ежедневного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Измерения выполняли в день 14 введения доз. Фиг. 18 показывает временной ход в сыворотке эстрона (Е 1) (А) и эстрадиола (Е 2) после ежедневного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Измерения выполняли в день 14 введения доз. Фиг. 19 показывает временной ход в сыворотке сульфата дегидроэпиандростерона (DHEA-S) (А) и сульфата эстрона (E1-S) (В) после ежедневного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Измерения выполняли в день 14 введения доз. Фиг. 20 показывает временной ход в сыворотке андростеронглюкуронида (ADT-G) (А) и андрост-5 ен-3,17-диол-G (3-diol-G) (В) после ежедневного перорального введения двух капсул по 50 мг DHEA или применения 4 г 10%-го крема или геля DHEA для постменопаузных женщин. Измерения выполняли в день 14 введения доз. Фиг. 21 показывает отношения величин AUC0-24 ч DHEA и его метаболитов в день 14 введения доз в сравнении с фоновыми величинами перед обработкой. Соответствующие численные величины можно найти в табл. 5. Фиг. 22 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на процент вагинальных парабазальных клеток у постменопаузных женщин. Данные выражены в виде средних величинSEM. Фиг. 23 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на процент вагинальных поверхностных клеток у постменопаузных женщин. Данные выражены в виде средних величинSEM. Фиг. 24 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на вагинальный рН у постменопаузных женщин. Данные выражены в виде средних величинSEM. Фиг. 25 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на изменение тяжести симптома вагинальной атрофии,оцениваемого самими женщинами как наиболее беспокоящий симптом. Величины сравнивают относительно дня 1 и выражают в виде средних величинSEM. Фиг. 26 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на изменение вагинальных секретов, оцениваемое при вагинальном обследовании. Данные выражены в виде средних величинSEM. Фиг. 27 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на изменение цвета вагины, оцениваемое при вагинальном обследовании. Данные выражены в виде средних величинSEM. Фиг. 28 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на изменение целостности вагинального эпителия, оцениваемое при вагинальном обследовании. Данные выражены в виде средних величинSEM. Фиг. 29 показывает действие ежедневного интравагинального применения 0,0, 0,25, 0,5 и 1,0%DHEA (Prasterone) в течение 2, 4, 8 и 12 недель на изменение толщины вагинального эпителия, оцениваемое при вагинальном обследовании. Данные выражены в виде средних величинSEM. Фиг. 30 показывает средние 24-часовые концентрации в сыворотке (AUC0-24 ч/24) DHEA, 5-диола,DHEA-S, E1, E2 и E1-S, измеряемые в дни 1 и 7 после введения один раз в день влагалищной овулы (лекарственной формы), содержащей 0,5% DHEA. Данные выражены в виде средних величинSEM (n=10). Концентрации в сыворотке стероидных гормонов, измеренные у 30-35-летних предменопаузных женщин(n=47), а также у 55-65-летних постменопаузных женщин (n=369), добавляли в качестве ссылочных данных, которые выражали в виде средних величин и 5-го и 95-го процентилей (пунктирные линии).р 0,05,р 0,01, экспериментальных данных против фона. (Данные из Labrie, Cusan et al. 2008). Фиг. 31 показывает средние 24-часовые концентрации в сыворотке (AUC0-24 ч/24) 4-диона, тестостерона, DHT ADT-G, 3-диол-3G и 3-диол-17G, измеренные в дни 1 и 7 после введения один раз в день влагалищной овулы (лекарственной формы), содержащей 0,5% DHEA. Данные выражены в виде средних величинSEM (n=10). Концентрации в сыворотке стероидных гормонов, измеренные у 30-35-летних предменопаузных женщин (n=47), и у 55-65-летних постменопаузных женщин (n=369), добавляли в качестве ссылочных данных, которые выражали в виде средних величин и 5-го, и 95-го процентилей (пунктирные линии).р 0,05,р 0,01, экспериментальных данных против фона. (Данные из Labrie, Cusanet al. 2008). Подробное описание изобретения Ниже представлен перечень статей, обсуждаемых здесь в виде цитирования в краткой форме. Вагинальная сухость обнаруживается у 75% постменопаузных женщин (Wines and Willsteed 2001;N.A.M.S. 2007). Вследствие различных причин, в частности опасности осложнений, вызываемых эстрогенами, только 20-25% симптоматических женщин с вагинальной атрофией стремятся к медицинскому лечению (Pandit and Ouslander 1997; N.A.M.S. 2007). Таким образом, существует явная медицинская потребность и основная благоприятная возможность улучшения качества жизни большой популяции женщин, страдающих от вагинальной атрофии в течение большой части их продолжительности жизни. Можно упомянуть о том, что, хотя приступообразные ощущения жара ("приливы") уменьшаются самопроизвольно со временем, симптомы вагинальной атрофии, а именно вагинальная сухость, вульвовагинальное раздражение/зуд и диспареуния со временем увеличиваются в их тяжести в отсутствие лечения. На основе хорошо известного факта, что секреция эстрогена яичниками прекращается во время менопаузы, системные и локальные эстрогены были до сих пор единственным подходом для лечения вагинальной атрофии. Однако было показано, что системные эстрогены + прогестин (HRT) и только эстрогены (ERT) увеличивают риск рака молочной железы (Steinberg, Thacker et al. 1991; Sillero-Arenas, DelgadoRodriguez et al. 1992; Colditz, Egn et al. 1993; Colditz, Hankinson et al. 1995; Collaborative Group on Hormonal Factors in Breast Cancer 1997; Hulley 2002; Beral 2003; Chlebowski, Hendrix et al. 2003; Holmberg andLyytinen, Pukkala et al. 2006), a также эндометриального рака (только эстрогены) (Gambrell, Massey et al. 1980; Persson, Adami et al. 1989; Voigt, Weiss et al. 1991; Jick, Walker et al. 1993; Grady, Gebretsadik et al. 1995; Beral, BuU et al. 2005). Гласность с последующим инициативным исследованием здоровья женщины (Rossouw, Anderson et al. 2002) оказали сильнейшее действие, поставив под сомнение безопасность доступных способов лечения менопаузальных симптомов (Archer 2007). Хотя были разработаны интравагинальные препараты для устранения системного подвергания действию эстрогенов, продолжительный ряд исследований единогласно продемонстрировал, что все интравагинальные препараты эстрогенов приводят к относительно высоким уровням эстрогенов, измеряемым непосредственно или посредством их системных эффектов (Englund and Johansson 1978; Rigg/ Hermann etRioux, Devlin et al. 2000; Manonai, Theppisai et al. 2001; Notelovitz, Funk et al. 2002; Ponzone, Biglia et al. 2005; Weisberg, Ayton et al. 2005; Galhardo, Soares et al. 2006; Kendall, Dowsett et al. 2006; Long, Liu et al. 2006; Bachmann, Lobo et al. 2008). Эти данные, показывающие значительное увеличение уровней эстрогена, ясно указывают на то, что применение интравагинальных препаратов эстрогена также потенциально ассоциировано с увеличенным риском рака молочной железы и рака матки (Kvorning and Jensen 1986;Mattson, Culberg et al. 1989; Rosenberg, Magnusson et al. 2006; N.A.M.S. 2007). Фактически была официально высказана обеспокоенность в отношении стимулирующих эффектов вагинальных препаратов эстрогена на эндометрии N.A.M.S. 2007). Наиболее ранние измерения уровней эстрадиола (E2) сыворотки после интравагинального введения эстрогенов использовали радиоиммуноанализы, технологию, лишенную специфичности, точности, достоверности и чувствительности (Rinaldi, Dechaud et al. 2001). Авторы данного изобретения измеряли эстрогены сыворотки с использованием GLP (Good Laboratory Practice)-валидизированные масс- 15020683 спектрометрических анализов после интравагинального введения двух наиболее обычных препаратов эстрогенов (Labrie, Cusan et al. 2008). Это исследование смогло окончательно показать, что как пилюляE2 (25 мкг E2/день), так и крем конъюгированных эстрогенов (1 г 0,625 мг-конъюгированных эстрогенов/день), после одной недели обработки один раз в день, вызывали приблизительно 5-кратное увеличение сывороточного E2 у постменопаузных женщин. Такие данные указывают на то, что действия эстрогенов, наносимых локально в вагину, вряд ли ограничиваются этой вагиной и что ожидается системное действие, как предполагалось ранее (Englund and Johansson 1978; Rigg, Hermann et al. 1978; Martin, Yen etManonai, Theppisai et al. 2001; Notelovitz, Funk et al. 2002; Ponzone, Biglia et al. 2005; Weisberg, Ayton et al. 2005; Galhardo, Soares et al. 2006; Kendall, Dowsett et al. 2006; Long, Liu et al. 2006; Bachmann, Lobo et al. 2008). Кроме вышеуказанных озабоченностей в отношении безопасности эстрогенов, вводимых как системно, так и локально, недавние данные ясно продемонстрировали, что женщины не только имеют дефицит эстрогенов во время менопаузы, но что они также были прогрессирующим образом, начиная с тридцати лет, лишены андрогенов, производимых в специфических периферических тканях-мишенях посредством интракринного превращения дегидроэпиандростерона (DHEA) в андрогены и/или эстрогены(Labrie, Belanger et al. 1988; Labrie 1991; Labrie, Luu-The et al. 2003; Labrie, Luu-The et al. 2005). Действительно, DHEA и DHEA-сульфат сыворотки прогрессирующим образом уменьшаются от максимума, наблюдаемого в возрасте 30 лет (Orentreich, Brind et al. 1984; Labrie, Belanger et al. 1997; Labrie, Luu-The etal. 2003), до величины на 60% более низкой во время менопаузы (Labrie, Belanger et al. 2006). Что касается роли андрогенов у женщин, важно упомянуть, что женщины секретируют 50% андрогенов в сравнении с наблюдаемым уровнем у мужчин (Labrie, Belanger et al. 1997; Labrie, Luu-The et al. 2005). Поскольку DHEA сыворотки является преобладающим источником андрогенов, которые выполняют ряд физиологических функций у женщин (Labrie, Luu-The et al. 2003; Labrie 2007), 60% уменьшение циркулирующего DHEA, обнаруживаемое уже по время менопаузы, приводит к сходному 60% увеличению общего пула андрогенов (Labrie, Belanger et al. 2006) с получением потенциальных признаков и симптомов гипоандрогенности в кости, мышцах, молочной железе, вагине, головном мозге, а также в метаболизме глюкозы, инсулина и липидов (Labrie, Luu-The et al. 2003; Labrie 2007). Недавние данные показали, что среди этих андрогенных тканей-мишеней вагина является чувствительной к андрогенам после введения DHEA крысе с благоприятными действиями не только на поверхностный эпителиальный слой вагины, но также на коллагеновые волокна в lamina propria (собственной пластинке слизистой оболочки) и на muscularis (мышечную пластинку слизистой оболочки) (Berger, El-Alfy et al. 2005). На основании результатов преклинических исследований авторов (Sourla, Flamand et al. 1998; Berger, El-Alfy et al. 2005) и клинических исследований авторов (Labrie, Diamond et al. 1997; Labrie, Cusan etal. 2008), показывающих благоприятные действия на вагине DHEA, вводимого подкожно или локально,данное клиническое исследование является поисковым (перспективным) рандомизированным и плацебоконтролируемым исследованием действия трех доз интравагинального DHEA, вводимого один раз в день в течение 12 недель, на изменения поверхностных и парабазальных клеток, рН и наиболее беспокоящий симптом вагинальной атрофии в качестве первичных целей. Эти результаты ясно показывают, что локально вводимый DHEA является очень эффективным и быстрым в коррекции всех признаков и симптомов вагинальной атрофии, причем почти максимальное действие достигается уже при 2 неделях при дозеDHEA, не вызывающей значимого изменения в эстрогенах или андрогенах, тогда как все другие стероидные гормоны остаются неизмененными или находящимися вполне в пределах диапазона, обнаруживаемого у здоровых постменопаузных женщин. При введении DHEA локально в вагину полезные действия эстрогенов и андрогенов, производимых локально в вагине, достигаются без какого-либо значимого высвобождения эстрадиола или тестостерона в кровь (Labrie, Cusan et al. J. Ster. Biochem. MoI. Biol. In press). В образовании андрогенов и/или эстрогенов из DHEA посредством процесса интракринологии любая ткань является непредсказуемой, так как эта реакция зависит от активности ферментативного аппарата, конкретно присутствующего в каждой клетке каждой ткани. Таким образом, невозможно предсказать из андрогенов и эстрогенов, которые продуцируются из DHEA в одной ткани, степень, до которой сходные андрогены и эстрогены могут продуцироваться в другой ткани. Результаты клинического исследования ERC-210 (пример 3) ясно демонстрируют впервые, что локальное введение DHEA в качестве заместительной терапии с предшественником гормона (HPRT) является высокоэффективным и быстрым в коррекции всех симптомов и признаков вагинальной атрофии у постменопаузных женщин. Наиболее важно, что это достигается при дозе (0,5%) DHEA, которая не увеличивает уровни в сыворотке активных эстрогенов и андрогенов, и без изменений или с минимальными изменениями сывороточного DHEA и каких-либо его метаболитов, все из которых остаются вполне в пределах диапазона величин, обнаруживаемых у здоровых постменопаузных женщин (Labrie, Cusan et al. 2008). Хотя 75% постменопаузных женщин страдают от вагинальной атрофии (Wines and Willsteed 2001;N.A.M.S. 2007), влияющей, следовательно, на качество их жизни во время большой части их продолжительности жизни, только 20% обращаются за лечением (Pandit and Ouslander 1997). Боязнь рака молочной железы, связанного с увеличенными уровнями эстрогенов в крови, является основной предполагаемой причиной. Поскольку секреция эстрогена в системный кровоток происходит исключительно из яичников и прекращается при менопаузе, введение эстрогенов постменопаузным женщинам, по-видимому, не является физиологическим. После WHI научной проблемой является исследование альтернативных типов и препаратов гормональной терапии, которые могли бы обеспечить все постменопаузные преимущества эстрогенов с улучшением качества жизни женщин, минимизацией рисков и максимизацией пользы(Archer 2007). Поскольку терапии на основе неэстрогенов не показали убедительной эффективности(Nelson, Vesco et al. 2006; Suckling, Lethaby et al. 2006), женщины и их врачи остались без безопасного способа лечения вагинальной атрофии. Различные формы эстрогенов являются эффективными в лечении вульвовагинальной атрофии (Pandit and Ouslander 1997; Utian, Shoupe et al. 2001). Действительно, вагинальная таблетка E2 показала эффективность, подобную эффективности вагинального кольца E2 (Weisberg, Ayton et al. 2005), а также крема конъюгированного эстрогена (Rioux, Devlin et al. 2000; Manonai, Theppisai et al. 2001). Эта новая HPRT находится в заметном контрасте с 5-кратным увеличением в сыворотке E2, измеряемого масс-спектрометрией после лечения интравагинальным E2 или конъюгированными эстрогенами(Labrie, Cusan et al. 2008). Эти недавние результаты в отношении сывороточных эстрогенов подтверждают длинный ряд исследований, показывающих, что все препараты интравагинального эстрогена приводят к повышенным концентрациям сывороточного эстрогена, измеряемого непосредственно радиоиммуноанализами или через их системные эффекты (Englund and Johansson 1978; Rigg, Hermann et al. 1978;Bachmann, Lobo et al. 2008). Наиболее обычными вредными событиями, сообщенными при использовании вагинальных эстрогенов, являются вагинальное кровотечение и боль в молочных железах, оба из которых являются вторичными относительно увеличенных сывороточных эстрогенов (Suckling, Lethaby et al. 2006). Эти побочные эффекты сообщались для E2-кольца, крема конъюгированных эстрогенов, а также таблетки E2 (Ayton,Darling et al. 1996; Weisberg, Ayton et al. 2005). Как упоминалось выше, существует также озабоченность в отношении стимулирующих действий вагинальных эстрогенов на эндометрий (N.A.M.S. 2007). Маточное кровотечение, боль в молочных железах и перинеальная боль наблюдались у 9% женщин, которые принимали вагинальную таблетку в течение 24 недель, тогда как 34% жаловались на эти же симптомы в группе с вагинальным кремом конъюгированного эстрогена (Rioux, Devlin et al. 2000). Suckling, Lethabyet al. 2006, сообщали об отсутствии различия между разными вагинальными препаратами эстрогенов. Хорошо известно, что атрофический вагинит у постменопаузных женщин мог быть ухудшен или индуцирован применением ингибиторов ароматазы для лечения рака молочной железы. Действительно,эти лекарственные средства обнаруживают их преимущества в случае рака молочной железы уменьшением биосинтеза E2 во всех тканях с увеличением посредством этого частоты и тяжести климактерических симптомов (Fallowfield, Cella et al. 2004; Morales, Neven et al. 2004). В недавнем исследовании, где семь пациенток с раком молочной железы, которых лечили ингибиторами ароматазы, получали Вагифем при суточной дозе 25 мкг в течение 2 недель и затем после этого два раза в неделю, сывороточный E2 увеличивался с медианы 3 до 72 пмоль/л при 2 неделях (диапазон 3-232) (Kendall, Dowsett et al. 2006). Сывороточные уровни E2 обычно уменьшались после этого до величин 40 пмоль/л или менее, хотя при неделях 7-10 были обнаружены величины 137 и 219 пмоль/л. Пациентка, которая получала крем Премарин, имела сывороточные уровни E2 83 пмоль/л при 2 неделях. Следует упомянуть, что взятие проб крови для измерения E2 выполняли во время визита пациентки, так что тайминг, вероятно, не соответствовал наивысшим сывороточным уровням E2 после введения Вагифема. Следовательно, более вероятно, что величины, сообщенные в статье Kendall, Dowsett et al. 2006, недооценивают, до неизвестной степени,истинное повышение сывороточного E2 после введения интравагинальной пилюли Вагифема или крема Премарина. Эти авторы сделали вывод, что применение Вагифема с ингибиторами ароматазы является противопоказанным. Эти открытия, полученные на женщинах, лечившихся ингибиторами ароматазы,поднимают серьезную проблему в отношении применения любого вагинального, а также любого перорального или трансдермального препарата эстрогена у постменопаузных женщин. Относительно высокое повышение сывороточного E2 после лечения различными вагинальными препаратами эстрогенов, приводящее к увеличенному риску рака молочной железы, является широко признаваемой проблемой (Rosenberg, Magnusson et al. 2006). Хотя исследование, имеющее малое число событий и короткий мониторинг (подгруппа 4,7% среди 1472 женщин), не обнаружило статистически значимого различия в периоде ремиссии в подгруппе женщин, которые использовали вагинальный эстроген (Dew, Wren et al. 2003), не кажется разумным или приемлемым увеличение сывороточных уровнейE2 во время терапии рака молочной железы, когда целью лечения ингибиторами ароматазы является именно достижение максимального ингибирования биосинтеза E2. В одном раннем исследовании с Вагифемом таблетка E2 при введении в дозе 25 мкг приводила к сывороточным уровням E2 80 пмоль/л с величинами, меньшими 50 пмоль/л при 14 ч и позже (Kvorningand Jensen 1986). В более недавнем исследовании с Вагифемом максимальные и средние сывороточные концентрации E2 при 24 ч при измерении были равны 18099 пмоль/л и 84 пмоль/л для дозы 25 мкг, тогда как величины 8162 пмоль/л и 40 пмоль/л, соответственно, были обнаружены для дозы 10 мкг (Notelovitz, Funk et al. 2002). Другие вагинальные таблетки и кремы эстрогенов приводили даже к более высоким уровням сывороточных эстрогенов (Schiff, Tulchinsky et al. 1977; Rioux, Devlin et al. 2000). С вагинальными таблетками 10 и 25 мкг E2 было обнаружено, что сывороточный E2 увеличивался до максимальных величин приблизительно 90 и 160 пмоль/л, соответственно, от фоновых величин приблизительно 35 пмоль/л (Nilsson and Heimer 1992). Сообщался сывороточный E2 с Вагифемом при Смакс 5134 пг/мл в день 1, причем эта величина является практически неизмененной в дни 14 (4721 пг/мл) и 84 (4927 пг/мл) (Vagifem, Physician Package Insert 1999). В другом исследовании сообщалось, что после 52 недель лечения 25 мкг Вагифема сывороточные уровни E2 оставались неизмененными от 10,321,5 пг/мл - 9,9 пг/мл (Bachmann, Lobo et al. 2008). Такие результаты могут объясняться тем фактом, что взятие проб крови выполняли, наиболее вероятно, спустя 3 или 4 дня после применения Вагифема. Важно также упомянуть, что повышенные сывороточные уровни E2 в этом исследовании, наиболее вероятно, связаны с отсутствием специфичности используемых иммуноанализов, так как нормальные сывороточные уровни E2, измеряемые масс-спектрометрией у постменопаузных женщин, являются в два-три раза более низкими (Labrie, Belanger et al. 2006). В одном раннем исследовании пероральное и вагинальное введение 1,25 мг Премарина приводило к сывороточным уровням E2 и эстрона по меньшей мере до 100 пг/мл и 1000 пг/мл, соответственно, во время 24 ч после введения, причем эти уровни являются несколько более высокими после вагинального введения. Сывороточные уровни гонадотропина уменьшались у большинства субъектов (Englund andJohansson 1978). Сходные результаты сообщались (Rigg, Hermann et al. 1978). В одном недавнем исследовании после 3 месяцев ежедневного перорального или интравагинального введения 0,625 мг Премарина сывороточные уровни E2 увеличивались до 83,1 и 58,6 пг/мл соответственно (Long, Liu et al. 2006),иллюстрируя посредством этого очень важное системное воздействие как после интравагинального, так и после перорального введения эстрогена, так как сывороточный E2 был только на 36% более низким после интравагинального введения в сравнении с пероральным введением конъюгированных эстрогенов. В 12-недельном исследовании с вагинальным кремом Премарином при суточной дозе 2 г, три раза в неделю, 21% женщин испытывали кровотечение после теста прогестогена (Nachtigall 1995). Кроме того, из этих женщин 12% показали увеличение толщины эндометрия при эхографии. При применении вагинального кольца не сообщалось увеличение сывороточных уровней E1, E2 или Е 3 (Nachtigall 1995; Gupta, Ozel et al. 2008), хотя значимые увеличения E1-S и E2 наблюдали у женщин в возрасте более 60 лет (Naessen, Rodriguez-Macias et al. 2001). В группе EST-кольца недавнего исследования сывороточный E2 увеличивался от 1622 пмоль/л до 4964 пмоль/л при неделе 24 (Weisberg, Ayton etal. 2005). В группе Вагифема, с другой стороны, сывороточный E2 увеличивался от 1533 до 3651 пмоль/л. Тем не менее, эти авторы сообщали, что сывороточный E2 оставался в пределах или вблизи величин, обнаруживаемых в здоровых постменопаузальных женщинах. При 48 неделях лечения с использованием EST-кольца или Vagifem, 30-32% жаловались на частоту мочеиспускания и 18-33% жаловались на диспареунию (Weisberg, Ayton et al. 2005). Три исследования документировали, что вагинальное кольцо E2 делает возможным низкий сывороточный E2 во время 90-дневного периода, за исключением вспышки сывороточного эстрогена, который достигает более низкой области вспышек, наблюдаемых в женщинах с нормальным менструальным циклом, или 100-200 пмоль/л во время первых 0,5-8 ч после вставления кольца (Holmgren, Lindskog et al. 1989; Schmidt, Andersson et al. 1994) (Baker and Jaffe 1996). To, что суточная доставка 7,5 мкг E2 интравагинальным способом, имеет системные действия, показано наблюдением значимого увеличения плотности минеральных веществ в костях всего бедра и поясничной области позвоночника после 2 лет лечения такой интравагинальной дозой E2 (Salminen, Saaf et al. 2007). Как упоминалось выше, существует озабоченность в отношении стимуляторных действий вагинальных эстрогенов на эндометрий (N.A.M.S. 2007). После 12 недель лечения 32 женщин 25 мкг интравагинального E2 (Вагифема), одна пациентка имела простую гиперплазию без атипии (Bachmann, Lobo etal. 2008). В 24-недельном исследовании, включающем в себя 80 женщин, был обнаружен один случай пролиферативного эндометрия (Rioux, Devlin et al. 2000), а в другом 52-недельном исследовании с 31 женщиной две имели пролиферативный эндометрий (Mettler and Olsen 1991). В 12-недельном исследовании с вагинальным кремом Премарином в дозе 2 г, три раза в неделю,21% женщин испытывали кровотечение после теста с прогестагеном (Nachtigall 1995). Из них 12% обнаруживали увеличение толщины эндометрия согласно эхографии. Применение дозы 0,3 мг конъюгированных эстрогенов, вводимой интравагинально три раза в неделю, может индуцировать пролиферацию эндометрия, хотя и редко, так как пролиферацию эндометрия наблюдали только в одном из двадцати случаев (Nachtigall 1995). Кольцо эстрадиола с пролонгированным высвобождением (EST-кольцо) индуцировало пролиферацию эндометрия, сходную с вызываемой 0,625 мг крема Премарина (Ayton, Darling et al. 1996), но меньшую чем 1,25 мг крема Премарина (Nachtigall 1995). Фактически было показано, что как вагинальное кольцо (EST-кольцо), так и крем с конъюгированными эстрогенами (крем Premarin) индуцируют пролиферацию эндометрия (Nachtigall 1995; Ayton, Darling et al. 1996). Два случая умеренной пролиферации или гиперплазии эндометрия в эндометриальном полипе были обнаружены с кольцом E2 (Nachtigall 1995), тогда как два случая гиперплазии (один простой и один сложный, без атипии) были обнаружены с кремом конъюгированных эстрогенов в испытании крема конъюгированных эстрогенов в сравнении с таблеткой E2 (Rioux, Devlin et al. 2000). Вагинальная таблетка E2 была ассоциирована с эндометриальной гиперплазией, подобно вагинальной таблетке эстрадиола (Dugal, Hesla et al. 2000; Manonai, Theppisai etal. 2001), но в меньшей степени, чем крем конъюгированных эстрадиолов (Manonai, Theppisai et al. 2001). Хотя уровни эстрогена в сыворотке увеличиваются до более низкой степени после локального интравагинального применения в сравнении с пероральной или подкожной HRT или ERT, риск рака молочной железы остается проблемой, и безопасность интравагинальных эстрогенов является сомнительной (Suckling, Lethaby et al. 2006; N.A.M.S. 2007). Действительно, хотя увеличение сывороточных эстрогенов является более низким после интравагинального способа введения в сравнении с пероральным или чрескожным способом введения, оно значимо повышается выше нормальных постменопаузных уровней для всех интравагинальных препаратов эстрогенов (Ponzone, Biglia et al. 2005). Кроме увеличенного риска рака молочной железы, ассоциированного с введением эстрогенов, важно помнить о том, что истинное гормональное различие между постменопаузными женщинами, которые не страдают от вагинальной атрофии (оцениваемой при 25% постменопаузной популяции), и остальными 75% постменопаузных женщин, которые страдают от вагинальной атрофии (Wines and Willsteed 2001;N.A.M.S. 2007), не связано с секрецией эстрогенов в системный кровоток, так как секреция эстрогенов яичниками прекращается у всех женщин во время менопаузы (климакса). Вследствие этого дефицит секреции эстрогенов не является достоверным объяснением наличия симптомов вагинальной атрофии у большинстве постменопаузных женщин. Однако образование половых стероидных гормонов не останавливается с прекращением функции яичников в менопаузе. Недавний прогресс в понимании эндокринной физиологии у женщин показывает,что после менопаузы, DHEA, секретируемый надпочечниками, является единственным источником половых стероидных гормонов, производимых исключительно в тканях-мишенях (Labrie 1991). В отличие от эстрогенов яичникового происхождения, которые секретируются в общий кровоток, где они могут быть измерены, DHEA является неактивным предшественником, который превращается в периферических тканях при различных скоростях в соответствии с уровнем экспрессии стероидогенных ферментов в каждой ткани. Этот процесс интракринологии делает возможным локальное внутритканное образование активных половых стероидных гормонов без существенного высвобождения этих активных стероидов в кровоток (Labrie, Dupont et al. 1985; Labrie, Belanger et al. 1988; Labrie 1991; Labrie, Luu-The et al. 2005). Однако секреция DHEA уменьшается с возрастом, причем 60% уменьшение наблюдается уже к моменту менопаузы (Labrie, Luu-The et al. 2003; Labrie, Belanger et al. 2005; Labrie, Luu-The et al. 2005; Labrie, Belanger et al. 2006; Labrie, Luu-The et al. 2006; Labrie 2007). Единственным различием между симптоматическими и асимптоматическими женщинами является количество DHEA, секретируемое надпочечниками, или чувствительность вагинальной ткани к DHEA. Это различие чувствительности различных женщин, связано, по-видимому, до неизвестной степени, с уровнем активности ферментативного аппарата, специфического для каждого типа ткани, в каждой ткани (Labrie 1991; Labrie, Belanger et al. 2005). С этим пониманием ясно, что именно DHEA, a не эстрогены, является физиологической гормональной заместительной терапией для постменопаузных женщин. Как хорошо продемонстрировано в предыдущих исследования авторов этого изобретения (Labrie 1991; Labrie, Luu-The et al. 2003; Labrie, Luu-The et al. 2005; Labrie, Belanger et al. 2007), дополнение физиологическими количествами экзогенного DHEA делает возможным биосинтез андрогенов и/или эстрогенов только в подходящих тканях-мишенях, которые содержат требуемые стероидогенные ферменты интракринологии (Labrie, Luu-The et al. 2005). Активные андрогены и эстрогены, синтезированные локально из DHEA в периферических тканях-мишенях, проявляют их действие в тех же самых клетках, в которых происходит их образование. Наиболее важно, что имеет место очень небольшая утечка этих активных половых стероидных гормонов в кровоток, что объясняет заметные полезные эффекты, наблюдаемые в вагине, без значимого изменения в циркулирующих эстрогенах или андрогенах (Labrie, Cusan etal. 2008). Этот локальный биосинтез, действие и инактивация эстрогенов и андрогенов в тканях-мишенях элиминирует подвергание других тканей действию избытка половых стероидов и, следовательно, элиминирует увеличенные риски нежелательных побочных действий от повышенного воздействия эстрогенов,в том числе рака молочной железы, рака яичников и рака матки (Gambrell, Massey et al. 1980; Persson,Adami et al. 1989; Steinberg, Thacker et al. 1991; Voigt, Weiss et al. 1991; Sillero-Arenas, Delgado- RodriguezHolmberg, Iversen et al. 2008; Li, Plummer et al. 2008). Изменение рН признается теперь валидным (достоверным) параметром, который отражает полезное действие терапии вагинальной атрофии. После 12 недель интравагинального лечения 25 мкг E2, процент пациентов, имеющих рН менее 5,0, был равен 51% в сравнении с 21% в группе плацебо (Bachmann, Loboet al. 2008). Однако при фоне 11,2% и 13% женщин имели рН ниже 5,0 в этих двух соответствующих группах. В клиническом исследовании ERC-210 (пример 3), ни один пациент не имел рН ниже 5,0 в начале терапии и 12, 36, 46 и 48% имели величины рН ниже 5,0 при 12 неделях в группах 0, 0,25, 0,5 и 1,0%DHEA соответственно. В клиническом исследовании ERC-210 (пример 3) это действие DHEA на созревание вагинальных эпителиальных клеток было особенно быстрым: с влагалищной овулой 0,5% DHEA, 79% максимального действия на парабазальные клетки наблюдали уже при 2 неделях, тогда как 48% максимального стимуляторного действия проявлялись на поверхностных клетках при том же самом временном интервале. С другой стороны, 85% максимальное стимуляторное действие 0,5% DHEA на процент поверхностных клеток достигалось при 4 неделях. Подобным образом, 63% максимального действия 0,5% DHEA на наиболее беспокоящий симптом наблюдали при 2 неделях и 87% достигали при 4 неделях. Кроме того,только 17,8% женщин сообщали об отсутствии изменений в их наиболее беспокоящем симптоме при 12 неделях в группе 0,5% DHEA в сравнении с 48,8% в группе плацебо. Действие DHEA на парабазальных клетках является быстрым, так как % парабазальных клеток уменьшался до менее 20% при одном месяце с тремя используемыми дозами DHEA. Действие на % поверхностных клеток является также очень быстрым с 100% эффектом, наблюдаемым при 2 неделях с высокой (1%) дозой DHEA. В исследовании с вагинальным кремом или таблеткой эстрогена приблизительно 50% эффекта, измеренного при 12 неделях, наблюдали при 2 неделях (Rioux, Devlin et al. 2000). Такие результаты показывают, что скорость эффекта DHEA не является худшей, а является, возможно,лучшей относительно эффекта вагинальных препаратов E2 и конъюгированных эстрогенов. В одном исследовании действия пероральных эстрогенов в 71 постклимактерической женщине, суточное введение 0,3 мг пероральных синтетических конъюгированных эстрогенов уменьшало парабазальные клетки от 23 до 2,3%, в то время как поверхностные клетки увеличивались в количестве от 2,1 до 15,9% (Marx, Schade et al. 2004). В одном исследовании, сравнивающем дозы 0,3 и 0,625 мг конъюгированных лошадиных эстрогенов (Utian, Shoupe et al. 2001), доза 0,625 мг показала большее действие на% поверхностных клеток. В одном недавнем исследовании, вагинальная величина зрелости (VMV) увеличивалась с 27,45 при фоне до 56,85 (р 0,0001) в обработанной эстрогеном группе (Simon, Reape et al. 2007). Процент поверхностных клеток увеличивался на 17,15 от фона, тогда как процент парабазальных клеток уменьшался на 41,66% в обработанной эстрогеном группе. В том же самом исследовании вагинальный рН уменьшался от 6,64 при фоне до 5,05 (уменьшение 1,69 или 24%) в группе эстрогена. Тяжесть наиболее беспокоящих симптомов уменьшалась от 2,58 до 1,04 (-1,54) в группе эстрогена в сравнении с уменьшением от 2,59 до 1,84 (-0,75) в группе плацебо. Такие результаты, наблюдаемые с эстрогенами, сравнимы с уменьшением 1,56 тяжести наиболее беспокоящих симптомов при 12 неделях в группе 0,5% DHEA и уменьшением 0,67 в группе плацебо, наблюдаемой в клиническом исследовании ERC-210 (пример 3). При неделе 12 11% субъектов группы EST-кольца и 24% субъектов группы Вагифема имели стойкий атрофический эпителий. При неделе 48 соответствующие величины были равны 8 и 14% (Weisberg,Ayton et al. 2005). При 48 неделях лечения с использованием Вагифема или EST-кольца, сухость вагины все еще присутствовала у 33% женщин (Weisberg, Ayton et al. 2005). С другой стороны, зуд вульвы присутствовал у 15 и 20% женщин после лечения с использованием EST-кольца и Вагифема, соответственно, в то время как 33 и 28% женщин все еще имели диспареунию после лечения с использованием ESTкольца и Вагифема соответственно. Кровотечение после теста прогестагена было 7% в группе Вагифема и 0% в группе EST-кольца. После 3 месяцев ежедневного введения 0,625 мг Премарина перорально или интравагинально (в виде крема) наблюдали 70,6 и 75% улучшения диспареунии (Long, Liu et al. 2006). В этом исследовании был сделан вывод, что 1 г 0,625 мг Премарина был минимальной дозой для лечения половой дисфункции. У женщин, которые получали 25 мкг E2 интравагинально, диспареуния сохранялась в 12,4% случаев после 12 месяцев лечения (Simunic, Banovic et al. 2003). Степень успеха терапии локальными таблеткамиE2 84.5%, согласно оцениванию пациентами, и 86,1%, согласно оцениванию врачами (Simunic, Banovic etal. 2003). Bachman et al., 1992 (Bachmann, Notelovitz et al., 1992) сообщали, что 40-50% женщин, получающих пероральную заместительную терапию с использованием эстрогена, имели постоянные жалобы на сухость вагины. Как сообщалось ранее, после 12 месяцев лечения DHEA (Labrie, Diamond et al. 1997) клиническое исследование ERC-210 (пример 3) не обнаруживает действия на гистологию эндометрия после 3 месяцев интравагинального введения предшественника гормона DHEA, как показано гистопатологическим обследованием эндметриальных биопсий, полученных до и после 12 недель лечения. Эти открытия находятся в согласии с отсутствием ароматазной активности в эндометрии человека (Baxendale, Reed et al. 1981; Bulun, Lin et al. 2005). Эти открытия в сильной степени поддерживаются широко признаваемым клиническим наблюдением, что эндометриальная атрофия является характеристикой постменопаузы,несмотря на непрерывную секрецию DHEA на протяжении жизни (Labrie, Luu-The et al. 2005; Labrie,Belanger et al. 2006). Отсутствие в эндометрии человека стероидогенных ферментов, необходимых для превращения DHEA в эстрогены, находится в согласии с физиологической ролью эндометрия, который является активным исключительно во время репродуктивных лет, когда его функция, по существу, контролируется гормонами, происходящими из яичников и плаценты. После наступления менопаузы нет физиологической роли эндометрия, которая могла бы корректировать любое продолжающееся действие эстрогенов после прекращения секреции эстрогенов яичниками. Таким образом, ферменты, необходимые для синтеза эстрогенов из DHEA, не экспрессируются в эндометрии, который является тканью, полностью зависимой от эстрогенов, происходящих из яичников. Давно было известно, что эстрогены, вводимые отдельно, стимулируют пролиферацию эндометрия(Smith, Prentice et al. 1975), тогда как прогестины, вводимые в комбинации с эстрогенами, ингибируют стимулирующее действие эстрогенов (Feeley and Wells 2001). Поскольку рецепторы андрогенов экспрессируются в эндометрии и строме человека (Mertens, Heineman et al. 1996), интересно упомянуть, что клиническое исследование, которое исследовало действие андрогенов, не показало действия на эндометрий относительно высокой дозы тестостерона у постменопаузных женщин (ундеканоата тестостерона, 40 мг каждый второй день) (Zang, Sahlin et al. 2007). У женщин, которые получали валерат эстрадиола (2 мг/день), Ki-мечение увеличивалось на 50% при 3 месяцах лечения, тогда как одновременное введение тестостерона уменьшало пролиферацию до 28%. Ki67-мечение увеличивалось только в двух группах,получающих эстроген, но уменьшалось добавлением тестостерона в строму. Хотя и не было стимулирующего действия на пролиферацию эндометрия у женщин, тестостерон, по-видимому, проявлял некоторое антиэстрогенное действие в эндометрии. Хотя руководство FDA поощряет спонсоров в отношении разработки самых низких доз и воздействий как для эстрогенов, так и для прогестинов, по мнению авторов этого изобретения, следует признать,что хотя эстрогены являются эффективными в коррекции симптомов вагинальной атрофии и вазомоторных симптомов, системные эстрогены не являются физиологическими гормонами, которые позволяют 25% постменопаузным женщинам избежать умеренных-тяжелых симптомов вагинальной атрофии. Эти женщины остаются относительно бессимптомными на протяжении всех их менопаузных лет, поскольку единственным источником половых стероидных гормонов у постменопаузных женщин как симптоматических, так и асимптоматических, является локальный биосинтез эстрогена и андрогена из DHEA надпочечников при помощи механизмов интракринологии. Заместительная терапия с использованием DHEA является единственным физиологическим подходом, который позволяет обеспечивать женщин, страдающих от постменопаузных симптомов, недостающим количеством DHEA, ответственным за их симптомы. С использованием этого подхода, называемого заместительной терапией с использованием предшественника гормона (HPRT), вагинальная атрофия и вазомоторные симптомы должны корректироваться с риском, не превышающим риск таких же постменопаузных женщин, которые не имеют симптомов вагинальной атрофии, вследствие более высокого подвергания действию DHEA и половых стероидных гормонов, производимых внутриклеточно процессом интракринологии. Предшественники половых стероидных гормонов, вводимые в соответствии с этим изобретением,предпочтительно вводят в диапазоне доз (1) 0,5-100 мг в день (предпочтительно 3-50 мг в день и наиболее предпочтительно 3-13 мг в день) при интравагинальном введении; (2) в диапазоне доз 15-200 мг в день (предпочтительно 30-100 мг в день) при введении на кожу; (3) в диапазоне доз 1-200 мг в день(предпочтительно 25-100 мг в день), например 75 мг в день, при пероральном введении или (4) в диапазоне доз 1,0-25 мг в день (предпочтительно 3,25-20 мг в день) при парентеральном введении (т.е. внутримышечном или подкожном). В фармацевтической композиции для вагинального введения DHEA или другой предшественник предпочтительно присутствует в концентрации 0,1-10 мас.% относительно общей массы этой композиции, более предпочтительно 0,2-3,0%, в частности 0,25-2,0%. Например, 1,3 мл вагинального суппозитория, имеющего 0,5 мас.% DHEA (относительно массы всей композиции), вводимые один раз в день,обеспечивают желательно 6,5 мг/день DHEA. Могут быть использованы большие или меньшие суппозитории, так же как и отличающиеся концентрации при сохранении дозы в этом желаемом диапазоне. В фармацевтической композиции для введения на кожу DHEA или другой предшественник предпочтительно присутствует в концентрации 0,1-10 мас.% относительно общей массы этой композиции,более предпочтительно 0,2-2,0%, в частности 0,3-1,5%. В фармацевтической композиции для перорального введения DHEA или другой предшественник предпочтительно присутствует в концентрации 5-98 мас.% относительно общей массы этой композиции,более предпочтительно 10-50%, в частности 15-40%. В фармацевтической композиции для парентерального введения (т.е. внутримышечного или под- 21020683 кожного), DHEA или другой предшественник предпочтительно присутствует в концентрации 0,2-25 мг/мл, более предпочтительно 0,65-15 мг/мл, в частности 2-10 мг/мл. Пример эффективности изобретения Пример 1. Клиническое исследование ERC-213: биодоступность DHEA после введения вагинальных суппозиториев у постменопаузных женщин с вагинальной атрофией в рандомизированном, плацебоконтролируемом исследовании фазы I; фармакокинетика и локальное действие ежедневного введения вагинальных суппозиториев FHEA в течение одной недели. Первичной целью этого изобретения было оценивание системной биодоступности DHEA и его метаболитов после ежедневного интравагинального введения суппозиториев при четырех различных концентрациях DHEA. Это исследование было рандомизированным, плацебоконтролируемым и двойным слепым исследованием с 10 субъектами на одну ветвь исследования. Таким образом, сорок постменопаузных женщин рандомизировали для получения суточной дозы одного суппозитория следующих концентраций DHEA: 0,0%, 0,5% (6,5 мг DHEA/суппозиторий), 1,0% (13 мг DHEA/суппозиторий) или 1,8%(23,4 мг DHEA/суппозиторий). Индекс зрелости, а также вагинальный рН измеряли при предобработке, а также после 7 дней лечения для получения указания на локальное действие DHEA во время короткого периода времени. Как иллюстрируется на фиг. 1 В, в табл. 1 и 2, ежедневное интравагинальное введение 1,3 мл суппозитория, содержащего 0,5, 1,0 и 1,8% DHEA, приводило к прогрессирующему увеличению сывороточного DHEA с величинами AUC0-24 ч 24,84,8 нгч/мл, 56,28,9 нгч/мл (р 0,05), 76,210,3 нгч/мл (р 0,01) и 114,39,97 нгч/мл (р 0,01) соответственно. Таким образом, имелись увеличения 127, 207 и 361% над контролем при дозах 0,5, 1,0 и 1,8% DHEA соответственно. Как наблюдалось для всех других стероидов,сходные величины AUC0-24 ч в дни 1 и 7. Действительно, средняя величина 4,760,42 нг/мл DHEA после лечения самой высокой дозой (табл. 2) является сходной с величиной 4,472,19 нг/мл, обнаруженной у сорока семи (47) 30-35-летних предменопаузных здоровых женщин (Labrie, Belanger et al. 2006). Этот сывороточный DHEA после любой из использованных доз DHEA остается в пределах границ здоровых предменопаузных женщин, как хорошо иллюстрировано на фиг. 7 А. Как наблюдалось ранее после перорального или подкожного введения DHEA (Labrie, Belanger et al. 2007), сывороточный 5-диол обнаруживает картину, почти совмещаемую с картиной DHEA, хотя наблюдаются гораздо более низкие концентрации. Действительно, величина AUC0-24 ч увеличивается от 5,60+ 0,60 нгч/мл в группе плацебо в день 7 до 9,831,14 (р 0,05), 13,81,87 (р 0,01) и 21,01,66 (р 0,01) при дозах 0,5, 1,0 и 1,8% DHEA соответственно (1D, табл. 1). Такие изменения соответствуют 75, 147 и 276% увеличениям над контролем. Только доза 1,8% DHEA вызывает увеличения сывороточного 5-диола, превышающие величины, обнаруженные у здоровых предменопаузных женщин (фиг. 7 В) во время 24 ч после ежедневного интравагинального введения DHEA в день 7. Величина AUC0-24 ч сывороточного тестостерона (Тесто) не обнаруживала значимого изменения при дозе 0,5% (2,790,30 нгч/мл против 2,580,33 нгч/мл в группе плацебо) (фиг. 2 В). При дозах 1,0 и 1,8% были обнаружены величины AUC0-24 ч 4,540,91 нгч/мл (р 0,05) и 5,970,69 нгч/мл (р 0,01) (табл. 1). Эти величины соответствуют средним сывороточным уровням Тесто 0,110,01 (N.S.), 0,120,01 (N.S.),0,190,04 (р 0,05) и 0,250,03 (р 0,01) нг/мл соответственно. Даже при наивысшей использованной дозе 1,8% DHEA, уровни сывороточного Тесто оставались в пределах нормального диапазона предменопаузных женщин, измеренного при 0,180,07 нг/мл (0,06-0,31, 5-95-тый процентили) (Labrie, Belanger etal. 2006) (фиг. 7 Е). С другой стороны, доза 1,0% (0,180,07 нг/мл) соответствует точно величинам, обнаруженным у здоровых предменопаузных женщин, а именно 0,190,4 (фиг. 7 Е). На фиг. 2 С и D сывороточный DHT увеличивался от величины AUC0-24 ч 0,580,07 нгч/мл в группе плацебо в день 7 до 0,930,11 (N.S.), 1,310,26 (р 0,05) и 1,930,23 (р 0,01) нгч/мл в группах 0,5, 1,0 и 1,8% DHEA соответственно (табл. 2). Эти величины соответствуют средним сывороточным уровнямDHT 0,020,01, 0,040,01, 0,050,01 и 0,080,01 нг/мл (табл. 2), достигая, следовательно, при наивысшей дозе DHEA, нормальных уровней сывороточного DHT 0,070,03 нг/мл, наблюдаемых у предменопаузных женщинах (Labrie, Belanger et al. 2006) (фиг. 7F). Средние уровни сывороточного E1 измеряли при 12,61,41 нг/мл в группе плацебо в день 7 (табл. 2), в то время как при дозе 0,5% DHEA не было значимого изменения (15,42,04 нг/мл). Увеличение до 24,13,54 нг/мл (р 0,01) и 25,02,85 нг/мл (р 0,01) наблюдали при дозах 1,0 и 1,5% DHEA соответственно. Соответствующие величины AUC0-24 ч показаны на фиг. 3 В и указаны в табл. 1. Средние уровни сывороточного E2 измеряли при 2,770,29 пг/мл и 4,040,69 пг/мл (N.S.) в группах плацебо и 0,5% DHEA соответственно (табл. 2). Средние сывороточные концентрации Е 2 6,011,31 пг/мл(р 0,05) и 5,680,84 пг/мл (р 0,05) обнаруживали в день 7 у женщинах, которые получали дозы 1,0 и 1,8% DHEA, с абсолютными увеличениями 3,18 и 2,85 пг/мл над плацебо соответственно. Сравнимые открытия наблюдали для средних сывороточных уровней E1-S со средними сывороточными уровнями 0,120,02 нг/мл и 0,13 нг/мл (N.S.) в группе плацебо и группе 0,5% DHEA соответственно (табл. 2). Ве- 22020683 личины 0,180,03 нг/мл и 0,250,25 нг/мл измеряли в группах 1,0 и 1,8% DHEA соответственно. Только группа 1,8% DHEA обнаруживает статистическое различие (р 0,01) с группой плацебо. Как можно видеть в 4 В и D, сравнимую картину наблюдали как для E1-S, так и для DHEA-S. Величину AUC0-24 ч сывороточного DHEA-S измеряли при 8,352,22 нгч/мл в группе плацебо и 13,33,16 нгч/мл в группе 0,5% DHEA group (N.S.). С двумя более высокими дозами DHEA, величины AUC0-24 ч измеряли при 16,52,71 нгч/мл (N.S.) и 19,33,59 нгч/мл (р 0,05) соответственно (фиг. 4D, табл. 1). Эти величины DHEA-S при всех дозах DHEA остаются ниже уровней сывороточного DHEA-S, наблюдаемых у предменопаузных женщин, которые обнаруживают среднее 1,270,62 нгч/мл (7 С). Как иллюстрировано на фиг. 5 В, величины AUC0-24 ч сывороточного 4-диона после введения DHEA в день 7 измеряли при 6,340,80 и 8,710,84 нгч/мл (N.S.) в группе плацебо и группе 0,5% DHEA соответственно. При этих двух более высоких дозах DHEA, величины AUC0-24 ч 4-диона слегка увеличивались до 11,11,51 (р 0,01) и 11,90,81 (р 0,01) нгч/мл соответственно. Как можно видеть в 7D и табл. 2, все эти величины сывороточного 4-диона оставались гораздо более низкими, чем средние концентрации сывороточного 4-диона, наблюдаемые у здоровых предменопаузных женщин. Действительно, наивысшая доза DHEA приводила к средним концентрациям сывороточного 4-диона 0,500,03 нг/мл, тогда как средняя величина у 30-35-летних имеющих менструальный цикл женщин равна 0,960,35 нг/мл (Labrie,Belanger et al. 2006) (Appendix T), достигая, следовательно, только 50% уровней сывороточного 4-диона,наблюдаемых у предменопаузных женщин. С учетом решающей роли измерений сывороточных уровней ADT-G, 3-диол-3G и 3-диол-17G(Labrie, Belanger et al. 2006) интересно отметить, что в 5D и табл. 2 сывороточные уровни ADT-G увеличивались от средней величины 6,971,20 нг/мл в группе плацебо до 19,2+3,99 нгч/мл в группе 0,5%DHEA (p 0,01). Величины 19,72,48 и 25,72,88 нгч/мл были измерены в группах 1,0 и 1,8% DHEA соответственно (р 0,01 против групп плацебо для обеих DHEA-обработанных групп). Сходные изменения можно видеть для минорных метаболитов андрогена 3-диол-3G и 3-диол-17G (6 В, 6D, 8 В и 8 С, табл. 1 и 2). Важно указать на то, что, как показано на фиг. 8, даже при наивысшей использованной дозе DHEA средние сывороточные уровни ADT-G, 3-диол-3G и 3-диол-17G оставались 36, 11 и 6% ниже средних сывороточных уровней, обнаруженных у предменопаузных женщин. Как показано в табл. 2, сумма глюкуронидов метаболитов андрогена, измеренная на протяжении 24 часового периода в день 7 введения 1,3 мл суппозитория, содержащего 1,8% DHEA (23,4 мг DHEA), равна только 28,2 нг/мл, тогда как средняя сывороточная концентрация того же самого метаболита у 30-35 летних предменопаузных женщин равна 42,8 нг/мл (Labrie, Belanger et al. 2006) (приложение 2). Таким образом, наивысшая использованная доза DHEA приводит только к 65,7% величины, соответствующей общим метаболитам андрогенов, обнаруживаемой у здоровых имеющих менструальный цикл женщин. С другой стороны, дозы 0,5 и 1,0% DHEA приводят к суммам метаболитов андрогенов 21,02 и 21,53 нг/мл соответственно, что соответствует, следовательно, только 49,0 и 50,2% величин, наблюдаемых у предменопаузных женщин (фиг. 9). Авторы этого изобретения обнаружили ранее, что ежедневное пероральное введение 100 мг DHEA приводит к 74% уровней, обнаруживаемых у предменопаузных женщин (Labrie,Belanger et al. 2007). Авторы этого изобретения наблюдали, что после перорального или подкожного введения DHEA,изменения в сывороточном DHEA являются приблизительно на 100% завышенной оценкой изменений в образовании стероидов, отражаемых изменениями в сывороточных ADT-G, 3-диол-3G и 3-диол-17G(Labrie, Belanger et al. 2007). Как можно видеть на фиг. 9, средние уровни сывороточного DHEA менялись от 23% величины, наблюдаемой у предменопаузных женщин группы плацебо, до 52, 71 и 106% у женщин, которые получали дозы 0,5, 1,0 и 1,8% DHEA соответственно. Данные фиг. 9 показывают, что изменения в сывороточном DHEA после интравагинального введения DHEA также являются завышенной оценкой изменений в образовании андрогенов и, возможно, даже более в образовании эстрогенов,как иллюстрируется даже еще более низкими количествами сывороточного E1-S (табл. 1). Действительно, при дозе 1,0% сывороточные метаболиты андрогенов увеличивались на 31,6% величины, обнаруживаемой у предменопаузных женщин, тогда как сывороточный DHEA увеличивался на 49,1% (превышение на 55%). При наивысшей дозе DHEA сывороточные метаболиты андрогенов увеличивались на 47,1%, тогда как сывороточный DHEA увеличивался на 83,5 (превышение 77%). Таблица 1 Величины площадей под кривой (AUC0-24 ч) DHEA и одиннадцати его метаболитов в дни 1 и 7 ежедневного введения интравагинальных суппозиториев 40-75-летним постменопаузным женщинам с вагинальной атрофией данные одного пациента исключены. Таблица 2 Средние уровни сывороточных стероидов DHEA и одиннадцати его метаболитов в дни 1 и 7 ежедневного введения интравагинальных суппозиториев 40-75-летним постменопаузным женщинам с вагинальной атрофией Эти величины получали делением величин AUC0-24 ч, измеренных в дни 1 и 7, на 24, с получением посредством этого средней сывороточной концентрации каждого стероида на протяжении 24-часового периода. Концетрации сывороточных стероидов, измеренные у 30-35-летних предменопаузных женщин добавляли в качестве ссылки. данные одного пациента исключены (Labrie, Belanger et al. 2006). Однако следует упомянуть, что, как показано в табл. 3, наблюдали сильную тенденцию в отношении более низких величин перед лечением многих стероидов в группе плацебо. Это относится, в частности, к низким величинам в группе плацебо для DHEA, DHEA-S, 4-диона, Тесто (тестостерона), DHT, E2,ADT-G и 3-диол-17G. Поскольку все средние величины сывороточных стероидов, наблюдаемые после введения доз 0,5 и 1,0% DHEA, остаются в пределах или явно ниже величин, обнаруживаемых у здоровых предменопаузных женщин, попытки коррекции этого явного отклонения не предпринимались. Интересно упомянуть, что средние 24-часовые сывороточные уровни всех стероидов, измеренные в день 7 ежедневного введения суппозитория с 0,5% DHEA, соответствуют почти точно величинам, измеренным у здоровых 55-65-летних женщин, тогда как суппозиторий с 1,0% DHEA приводит к величинам в пределах диапазона, наблюдаемого у 55-65-летних здоровых женщин (Labrie, Belanger et al. 2006). Поскольку метаболиты андрогенов являются наиболее надежным критерием превращения экзогенного DHEA в активные андрогены, представленные результаты показывают, что даже самая высокая доза DHEA, использованная в данном изобретении, удовлетворяет требованиям FDA в отношении сывороточных уровней стероидов, которые остаются в пределах нормального диапазона, обнаруживаемого у здоровых предменопаузных женщин. Таблица 3 Фоновые сывороточные уровни стероидов в дни 1 и 7 ежедневного введения интравагинальных увеличивающихся доз DHEA выражены в нг/мл, за исключением Е 1 и Е 2 (пг/мл) и DHEA-S (мкг/мл) уровни стероидов находятся ниже предела количественного определения для всех субъектов После всего лишь одной недели ежедневного введения суппозиториев DHEA индекс зрелости увеличивался на 107% (р 0,01), 75% (р 0,05) и 150% (р 0,1) в группах 0,5, 1,0 и 1,8% DHEA соответственно (фиг. 10 А). Изменений не наблюдали в группе плацебо между днем 1 и днем 7. С другой стороны,вагинальный рН уменьшался от 6,290,21 до 5,750,27 (р 0,05), от 6,470,23 до 5,760,22 (р 0,01) и от 6,530,25 до 5,860,28 (р 0,05), соответственно, в группах 0,5, 1,0 и 1,8% DHEA (фиг. 10 В). В группе плацебо не наблюдали изменения вагинального рН. Пример 2. Биодоступность и метаболизм перорального и подкожного дегидроэпиандростерона у постменопаузных женщин. 1. Введение. Люди, вместе с другими приматами, являются уникальными среди видов животных в том отношении, что они имеют надпочечники, которые секретируют большие количества неактивных предшественников стероидов DHEA и, в частности, DHEA-S, которые превращаются в активные андрогены и/или эстрогены в периферических тканях (Labrie, 1991; Labrie, Belanger et al., 1995; Labrie, Luu-The et al., 1997;Labrie, Simard et al., 1996; Labrie, Luu-The et al., 2005; Labrie, Poulin et al., 2006 and Simpson 2000). Действительно, уровни DHEA-S в плазме у взрослых мужчин и женщин являются в 100-500 раз более высокими, чем уровни тестостерона, и в 1000-10000 раз более высокими, чем уровни эстрадиола, что обеспечивает большой запас субстрата для превращения в андрогены и/или эстрогены в периферических интракринных тканях, которые имеют ферментативный аппарат, необходимый для превращения DHEA в активные половые стероидные гормоны (Labrie 1991 и Labrie, Luu-The et al., 2005). Действительно, термин интракринология был впервые придуман в 1988 г. (Labrie, Belanger et al., 1988) для описания синтеза активных стероидов, производимых в тех же самых клетках, в которых они проявляют их действие, с отсутствием высвобождения или с минимальным высвобождением во внеклеточное пространство и общий кровоток перед их инактивацией (Labrie, 1991). Заметное уменьшение образования DHEA-S надпочечниками во время старения (Belanger et al.,1994; Vermeulen and Verdonck, 1976; and Migeon et al., 1957) приводит к разительному снижению образования андрогенов и эстрогенов в периферических тканях-мишенях, к ситуации, потенциально ассоциированной со связанными с возрастом заболеваниями, такими как инсулинорезистентность (Schriock et al. 1988 and Coleman et al. 1982) и ожирение (Nestler et al. 1988; MacEwen and Kurman, 1991, and Tchernof etal. 1995). Кроме того, большое внимание уделялось преимуществам DHEA, вводимого постменопаузным женщинам, особенно в отношении кости, кожи, вагины, метаболизма глюкозы и инсулина, массы жира, а также самочувствия после перорального (Villareal and Holloszy, 2004; Baulieu et al., 2000; Morales, et al. 1994; и Kawano et al. 2003) и подкожного (Diamond et al., 1996 и Labrie Diamond et al. 1997) введения. Таким образом, становилось особенно важным получение более точного знания о биодоступности, фармакокинетике и метаболизме DHEA после этих двух способов введения. Поскольку авторы этого изобретения уже показали с использованием фармакологической дозыDHEA, вводимой чрескожно в течение 2 недель, что измерения уровней сывороточного тестостерона(тесто) и эстрадиола (E2) не обеспечивают надежной оценки истинного внутриклеточного пула андрогенов и эстрогенов (Labrie, Belanger et al., 1997; Labrie, Belanger et al., 2006 и Labrie, Belanger, et al, 2007b),авторы этого изобретения сравнили сывороточные уровни DHEA и девяти стероидов, о которых известно, что они наиболее тесно ассоциированы с активными андрогенами и эстрогенами и их метаболитами. Подробный анализ 24-часовых изменений сывороточных уровней стероидов выполняли в первый день и после 2 недель ежедневного введения DHEA пероральным способом, а также чрескожно с использованием крема или геля DHEA. 2. Субъекты и способы. Тридцать шесть здоровых 60-70-летних постменопаузных женщин участвовали в этом исследовании после одобрения IRB и предоставления их письменного информированного согласия. Масса тела была в пределах 20% нормальной массы тела в соответствии с Metropolitan Life Tables. Ни один субъект не страдал от существенного метаболического или эндокринного нарушения, коронарной болезни или гипертензии. Ни одна женщина не лечилась андрогенами или анаболическими стероидами в пределах 6 месяцев перед визитом для участия в скрининге. Все участники имели медицинскую историю, полное физическое обследование и биохимический профиль сыворотки, включающий в себя липиды, клинический анализ крови, анализ мочи и подробные определения сывороточных гормонов во время фазы скрининга этого протокола. 3. Программа исследования, лечение и измерения. Это исследование было рандомизированным, открытым исследованием из 12 субъектов на ветвь исследования. После получения письменного информированного согласия и установления, что женщины являются подходящими для исследования, каждого субъекта рандомизировали для получения DHEA посредством крема, геля или перорально. Ежедневно перед завтраком, в течение 14 дней, субъекты получали в этой исследовательской клинике либо 4 г 10% DHEA-крема, наносимого на общую площадь 3030 см бедра, либо две капсулы по 50 мг DHEA перорально. Взятие проб крови выполняли при 08:00-09:00 ч при скрининге и перед применением DHEA, в первый день принятия доз, а также в дни 2, 4, 7, 10 и 14. В первый и 14-й дни пробы крови получали при 0,5,1, 1,5, 2, 3, 4, 5, 6, 7, 8, 12 и 24 ч после введения DHEA. 4. Анализ сывороточных стероидов. андростан-3,17-диола (3-диол-G) измеряли газовой хроматографией/масс-спектрометрией (DHEA, 5 диол, 4-дион, тестостерон, E1 и E2) с использованием электронной ионизации (удара электронов) или химической ионизации и жидкостной хроматографии/тандемной масс-спектрометрии с использованием турбоионспрея (DHEA-S, E1-S, ADT-G и 3-диол-G), как описано (Labrie, Belanger et al., 2006; Labrie,Belanger, et al, 2007b и Swanson et al. 2007). 5. Расчеты и статистический анализ. В дни 1 и 14 измеряли площадь под кривой концентрации в сыворотке каждого стероида между 0 и 24 ч (AUC0-24 ч). Эти площади под кривыми рассчитывали линейным трапецеидальным способом (независимым от модели). Относительную биодоступность геля DHEA, крема DHEA и капсул DHEA рассчитывали на основе среднего различия в log-трансформированных величинах AUC. Все расчеты выполняли с использованием программы SAS (SAS Institute, Cary, NQ USA). 6. Результаты. Пероральное введение двух капсул 50 мг DHEA приводило к увеличению сывороточного DHEA от 2,30,3 нг/мл до максимальной величины 15,62,5 нг/мл при 1 ч с прогрессирующим уменьшением после этого до 5,70,5 нг/мл при 6 ч с последующим плато до 24 ч (фиг. 11 А). При нанесении 4 г 10% геля или крема DHEA на площадь 3030 см кожи бедер, сывороточные уровни DHEA начинали увеличиваться только при 12 ч, достигая величин 8,22,0 и 8,01,2 нмоль/л, соответственно, при 24 ч (фиг. 11 А). Не было значимого различия между кремом или гелем в сывороточных уровнях DHEA при любом из исследованных временных интервалов до 24 ч после первого нанесения этого стероида-предшественника на кожу. При измерении сывороточного 5-диола после перорального введения DHEA, концентрация 5-диола увеличивалась от концентрации перед лечением 0,310,03 нг/мл до максимальной величины 1,190,13 нг/мл при 1 ч с последующим прогрессирующим уменьшением после этого с достижением 0,790,05 нг/мл при 24 ч (фиг. 11 В). На той же самой фигуре можно видеть, что сывороточные уровни 5-диола увеличивались гораздо более медленно после введения DHEA чрескожно посредством крема или геля с достижением первых статистически различных величин 1,000,14 нг/мл для крема и 0,720,14 нг/мл для геля при 24 ч. После перорально введенного DHEA, сывороточный 4-дион увеличивался от 0,60,1 нг/мл до максимальной величины 9,52,2 нг/мл при 1 ч с последующим быстрым уменьшением до величин, которые оставались на плато приблизительно 1,2 нг/мл между 8 и 24 ч (фиг. 12 А). С другой стороны, после введения DHEA посредством крема или геля первое значимое увеличение сывороточного 4-диона наблюдали только при 24 ч при величинах 0,90,1 и 0,80,1 нг/мл для крема и геля соответственно. Сравнимую картину наблюдали для сывороточного тестостерона. Действительно, после перорального введения двух капсул по 50 мг DHEA, сывороточный тестостерон увеличивался от 0,380,03 нг/мл до максимальной величины 0,790,14 нг/мл при 1 ч. После этого увеличения следовало быстрое уменьшение до 0,300,08 нг/мл при 6 ч с последующим плато после этого до 24 ч (фиг. 12 В). При нанесенииDHEA в виде крема или геля первое увеличение наблюдали при 24 ч при величине приблизительно 0,45 нг/мл. Как можно видеть на фиг. 13 А и В, первое введение DHEA пероральным или чрескожным способом не имело статистически значимого действия на сывороточные уровни Е 1 или Е 2 во время первых 24 ч. С другой стороны, сывороточный DHEA-S имел картину, хотя слегка задержанную, сравнимую сDHEA и 5-диолом после перорального введения двух капсул по 50 мг (фиг. 14 А). Таким образом, сывороточный DHEA-S увеличивался от 0,40,1 до 7,71,0 мкг/мл при 1 ч и до максимальной величины 8,40,6 мкг/мл при 2 ч с прогрессирующим уменьшением до 2,70,3 мкг/мл при 24 ч. Не наблюдали значимого изменения сывороточного DHEA-S во время первых 24 ч после введения DHEA в виде крема или геля. Сывороточный ADT-G, основной метаболит андрогенов, увеличивался от 143 до 760150 нг/мл при 1 ч и 790140 нг/мл при 2 ч с последующим прогрессирующим уменьшением до 925 нг/мл при 12 ч и до 705 нг/мл при 24 ч (фиг. 15 А). С другой стороны, сывороточный 3-диол-G увеличивался от 2,2 0,5 до 14,52,0 нг/мл при 2 ч (фиг. 15 В). Однако наблюдаемое после этого уменьшение для 3-диол-G было гораздо более медленным, чем уменьшение ADT-G, причем наблюдается уменьшение только приблизительно 40% между 2 и 24 ч после перорального введения DHEA. После нанесения 4 г 10% DHEA на кожу не было значимого изменения сывороточного ADT-G или 3-диол-G до 24 ч (фиг. 15 В). При повторении измерений тех же самых кинетических параметров на 14-й день ежедневного введения доз можно было видеть, что введение двух каспул по 50 мг DHEA приводило от величины перед введением доз 4,20,4 нг/мл к максимальной концентрации 14,84,4 нг/мл DHEA при 1 ч с последующим прогрессирующим уменьшением после этого до 4,50,4 нг/мл при 24 ч (фиг. 16 А). С другой стороны,при введении DHEA посредством крема или геля не наблюдали значимого изменения во время 24 часового периода, и сывороточный DHEA оставался между 10 и 15 нг/мл после нанесения крема и между 7 и 11 нг/мл после нанесения геля. Подобным образом, при измерении сывороточного 5-диола на 14-й день лечения сывороточная концентрация этого стероида увеличивалась от 0,460,04 до 1,370,21 нг/мл при 1 ч с медленным уменьшением после этого до достижения 0,640,06 нг/мл при 24 ч (фиг. 16 В). Как наблюдали для DHEA,сывороточный 5-диол оставался постоянным во время 24-часового периода при приблизительно 1,5-1,9 нг/мл после нанесения крема и 1,0-1,3 нг/мл после нанесения геля. При измерении сывороточного 4-диона на 14-й день введения доз сывороточная концентрация этого стероида увеличивалась от 1,30,2 нг/мл до максимальной величины 9,81,7 нг/мл при 1 ч с последующим быстрым уменьшением до 1,50,1 нг/мл при 6 ч с величиной 1,20,1 нг/мл, измеренной при 24 ч(фиг. 17 А). После нанесения DHEA на кожу в виде крема или геля было незначимое увеличение сывороточного 4-диона до приблизительно 2,5 нг/мл при 2 ч с величинами, после этого остающимися на плато при 1,0-1,6 нг/мл до 24 ч (фиг. 17 А). Сывороточный тестостерон увеличивался на 14-й день введения доз после перорального введения 100 мг DHEA от 0,310,04 нг/мл до максимальной величины 0,830,11 нг/мл при 1 ч с последующим прогрессирующим уменьшением до величины 0,370,04 нг/мл при 24 ч (фиг. 17 В). После нанесенияDHEA в виде крема или геля сывороточные уровни тестостерона оставались неизмененными во время 24-часового периода при приблизительно 0,3 нг/мл, причем эта величина не отличалась значимо от величины перед лечением. Как наблюдали в первый день, не было значимого изменения в сывороточных уровнях Е 1 (фиг. 18 А) или Е 2 (фиг. 18 В) во время 24 ч после 14-дневного введения DHEA пероральным или чрескожным способом. Сывороточный DHEA-S увеличивался от уровня перед введением доз 1,950,15 до 8,30,4 мкг/мл при 1 ч с последующим прогрессирующим уменьшением до 2,60,3 мкг/мл при 24 ч (фиг. 19 А). Не наблюдали значимого изменения сывороточного DHEA-S после нанесения DHEA на кожу. С другой стороны, сывороточный E1-S не изменялся во время 24 ч после 14-дневного введения DHEA пероральным или чрескожным способом. При исходном более высоком уровне в день 14, чем в день 1, сывороточный ADT-G увеличивался быстро от 661 до 996105 нг/мл при 1 ч с быстрым уменьшением после этого до 116 нг/мл при 12 ч и 9115 нг/мл при 24 ч (фиг. 20 А). После нанесения DHEA на кожу не наблюдали значимого изменения сывороточных уровней ADT-G. С другой стороны, сывороточный 3-диол-G увеличивался от 122,5 до 29,45,5 нг/мл при 2 ч с медленным уменьшением после этого до достижения 133,0 нг/мл при 24 ч после 14-дневного перорального введения 100 мг DHEA. После чрескожного введения DHEA не наблюдали значимого изменения сывороточного 3-диол-G (фиг. 20 В). Затем для получения более точного критерия накапливания DHEA и его метаболитов авторы этого изобретения сравнивали площади под кривыми концентраций сывороточных стероидов (величиныAUC0-24 ч), измеренных в 1-й и 14-й дни введения доз. Как может быть предсказано из фиг. 11-20, эти величины AUC0-24 ч всех стероидов, за исключением метаболитов эстрогенов (E1-S) и андрогенов (ADT-G и 3-диол-G), вследствие некоторого накапливания этих стероидов, являются сходными в 1-й и 14-й дни введения DHEA пероральным способом (табл. 4). С другой стороны, после чрескожного введения вследствие более медленной абсорбции DHEA после введения в виде крема или геля на 155 и 86% более высокие величины AUC0-24 ч DHEA наблюдаются на 14-й день в сравнении с первым днем введения доз соответственно. Более высокие величины наблюдаются также для всех других стероидов, за исключением величин для E1, E2 и тестостерона, которые не обнаруживали. Таблица 4 Величины AUC0-24 ч, измеренные в 1-й и 14-й дни введения доз, а также их отношениеDHEA вводили пероральным способом (2 капсулы по 50 мг) или нанесением на кожу 4 г 10% крема или геля DHEA. Как можно ясно видеть в табл. 5 и на фиг. 21, не было значимого изменения величин AUC0-24 ч сывороточных E1, E2 или тестостерона, измеренных на 14-й день введения доз в сравнении с уровнями перед введением доз. Однако значимые увеличения наблюдали для двух других стероидов. Так, после ежедневного перорального введения 100 мг DHEA в течение 2 недель площадь под кривой концентрацииDHEA, измеренная во время 24 ч после введения этого стероида, увеличивалась на 167% относительно величины перед лечением, тогда как для 5-диола, 4-диона, DHEA-S, E1-S, ADT-G и 3-диол-G наблюдали соответствующие увеличения 138, 238, 873, 60, 1820 и 874%. Таблица 5 Величины AUC0-24 ч DHEA и его метаболитов перед лечением и в 14-й деньDHEA вводили пероральным способом или чрескожно посредством крема или геля. Фоновые величины AUC0-24 ч рассчитывали умножением уровней сывороточных стероидов перед обработкой, вклю- 29
МПК / Метки
МПК: A61K 31/56, A61P 5/26, A61P 5/32, A61K 31/453, A61P 15/12, A61K 31/5685
Метки: интравагинальная, риска, способ, суппозиторий, нем, композиция, постменопаузных, уменьшения, возникновения, симптомов, применяемые, лечения, женщин, заболеваний
Код ссылки
<a href="https://eas.patents.su/30-20683-sposob-lecheniya-ili-umensheniya-riska-vozniknoveniya-simptomov-ili-zabolevanijj-u-postmenopauznyh-zhenshhin-intravaginalnaya-kompoziciya-i-suppozitorijj-primenyaemye-v-nem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения или уменьшения риска возникновения симптомов или заболеваний у постменопаузных женщин, интравагинальная композиция и суппозиторий, применяемые в нем</a>
Предыдущий патент: Низкоэмиссионное остекление
Следующий патент: Средство для обезвреживания микотоксинов на основе биомассы мицелиальных грибов и его применение
Случайный патент: Способ работы газовой двигательной установки и системы подачи топлива газового двигателя