Антитела к tyrp1 и их применение
Формула / Реферат
1. Моноклональное антитело или его фрагмент, специфически связывающиеся с TYRP1 (тирозиназазависимый белок-1) человека (SEQ ID NO: 28), которые содержат
VH, имеющую последовательность аминокислот:
![]() ;
;
CDRL1, имеющую последовательность
![]() ;
;
CDRL2, имеющую последовательность
![]() ;
;
CDRL3, имеющую последовательность
![]() .
.
2. Антитело или его фрагмент по п.1, содержащие
VL, которая имеет последовательность аминокислот:
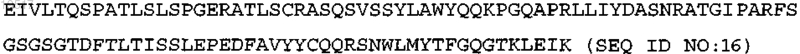
VH, которая имеет последовательность аминокислот:
3. Антитело или его фрагмент по любому из предшествующих пунктов, содержащие тяжелую цепь, соответствующую SEQ ID NO: 30, и легкую цепь, соответствующую SEQ ID NO: 32.
4. Антитело или его фрагмент по любому из пп.1-3, содержащие две тяжелые цепи, соответствующие SEQ ID NO: 30, и две легкие цепи, соответствующие SEQ ID NO: 32.
5. Выделенная нуклеиновая кислота, содержащая последовательность нуклеотидов, кодирующих антитело или фрагмент по любому из пп.1-4.
6. Вектор экспрессии, содержащий нуклеиновую кислоту по п.5, функционально связанную с элементами для контроля экспрессии, так чтобы возможно было экспрессировать кодируемое антитело или фрагмент.
7. Рекомбинантная клетка, содержащая вектор экспрессии по п.6, способная продуцировать антитело или фрагмент по любому из пп.1-4.
8. Антитело или фрагмент, получаемые посредством культивирования рекомбинантной клетки по п.7 и выделения указанного антитела или фрагмента.
9. Фармацевтическая композиция для лечения рака, содержащая антитело или фрагмент по любому из пп.1-4 или 8 в эффективном количестве и фармацевтически приемлемый носитель, разбавитель или эксципиент.
10. Применение антитела или фрагмента по любому из пп.1-4 или 8 в качестве лекарственного средства для лечения рака.
11. Применение антитела или фрагмента по любому из пп.1-4 или 8 при лечении рака.
12. Применение по п.11, где рак представляет собой злокачественную меланому.
Текст
Согласно изобретению предложены полностью человеческие антитела и химерные антитела,которые связываются с антигеном TYRP1 человека с аффинностью, сравнимой или выше чем для ТА 99, антитело мыши, специфичное к TYRP1. Согласно изобретению также предложены полинуклеиновые кислоты и клетки-хозяева, кодирующие и экспрессирующие указанные антитела. Кроме того, согласно изобретению предложены способы изменения активности TYRP1, лечения роста раковых клеток, а также лечения злокачественной меланомы у животных путем введения эффективного количества антитела, самостоятельно или в комбинации с противораковым агентом или лечением. Перекрестная ссылка Заявка на данное изобретение испрашивает приоритет согласно предварительной заявке на патент США 61/069199, поданной 12 марта 2008 г. Область техники Настоящее изобретение относится к антителам человека и химерным антителам, в том числе к их фрагментам или частям, специфичным к тирозиназазависимому белку-1 (TYRP1) человека. Указанные антитела применяют для лечения роста раковых клеток, самостоятельно или в комбинации с антинеопластическим агентом или лечением. Уровень техники Тирозиназазависимый белок-1 (TYRP1) человека, также известный как gp75 (WO 91/14775)(SEQ ID NO: 28) представляет собой меланосомальный мембранный гликопротеин, участвующий в биосинтезе меланина. Данный белок обнаружен преимущественно в меланосомах меланоцитов, а также, как обнаружено, экспрессирован на поверхности клеток меланоцитов и меланом человека.TYRP1-антиген является высокоиммуногенным. Антитела и Т-клетки к TYRP1 были выявлены при меланоме пациентов. Вероятно, что как клеточный, так и гуморальный ответы эффективны для устранения меланомы in vivo. Адаптивный перенос меланома-реактивных Т-клеток также приводит к регрессии опухоли. Ответ антител, индуцированный TYRP1-вакциной, также может подавлять рост меланомы и метастазирование у животных. Несмотря на то что изучено множество различных вариантов лечения меланомы, низкомолекулярные ингибиторы, средства химиотерапии, иммунотерапии, в том числе вакцины (например, патент США 6168946), генную терапию/иммуностимуляторы и антиангиогены, в настоящее время не существует эффективных способов лечения больных меланомой. Чрезвычайно оправдана разработка новых способов лечения для данных неудовлетворенных потребностей медицины. Исследования на животных позволили обнаружить антитело ТА 99. ТА 99 (IgG2a) представляет собой моноклональное антитело мыши (MAb), специфичное к TYRP1 человека и мыши, локализуется на подкожной меланоме человека in vivo. См. источник Welt et al., Proc. Natl. Acad. Sci. USA, 84:4200-4204(1987) и патент США 4798790. Лечение ТА 99 подавляло рост опухоли и метастазирование у мышей. См.Takechi et al., Clin Cancer Res. 2:1837-42 (1996). Мыши, которым вводили ТА 99, часто теряли окраску шерсти (депигментация) предположительно из-за разрушения меланоцитов кожи. Активация эффектора, опосредуемая Fc-рецептором, вероятно, играет критическую роль в элиминировании клеток, на которые направлено действие ТА 99. Противоопухолевый эффект ТА 99 был значительно ослаблен в мышах с выключенным геном FcR. См. Clynes et al.,Proc. Natl. Acad. Sci. USA, 95:652-656 (1998). Тем не менее, мышиная природа ТА 99 может быть препятствием для применения их для людей вследствие потенциальной иммуногенности, и, следовательно, способность указанных антител вызывать активацию иммунных эффекторных функций в прямом направлении (downstream) может быть ограничена. Таким образом, существует необходимость создания альтернативных антител к TYRP1, эффективных для лечения меланомы. Согласно настоящему изобретению предложены альтернативные антитела кTYRP1, которые эффективны для лечения меланомы. Кроме того, существует необходимость создания альтернативных антител к TYRP1, которые имеют улучшенную связывающую способность по отношению к TYRP1 по сравнению с известными в данной области антителами. Согласно настоящему изобретению предложены альтернативные антитела к TYRP1,которые имеют улучшенную связывающую способность по отношению к TYRP1 по сравнению с известными антителами. Существует также необходимость создания антител к TYRP1, которые имеют сниженную иммуногенность для людей и улучшенную способность к активации иммунных эффекторных функций в прямом направлении, таких как антителозависимая клеточная цитотоксичность (ADCC). Согласно настоящему изобретению предложены химерные антитела и антитела человека к TYRP1, которые, по сравнению с известными антителами, имеют сниженную иммуногенность для людей и улучшенную способность к активации иммунных эффекторных функций в прямом направлении, таких как антителозависимая клеточная цитотоксичность (ADCC). Также остается необходимость создания альтернативных антител к TYRP1, которые имеют повышенную стабильность за счет сокращения неправильной укладки белка и некорректного процессинга. Предпочтительные антитела согласно настоящему изобретению имеют улучшенную стабильность за счет сокращения неправильной укладки белка и некорректного процессинга. Краткое описание изобретения Настоящее изобретение относится к человеческим или химерным моноклональным антителам или их фрагментам, которые связываются с антигеном меланомы TYRP1 (SEQ ID NO: 28). Согласно одному из вариантов реализации настоящего изобретения предложено моноклональное антитело, которое специфически связывается с TYRP1 человека, с константой диссоциации KD при комнатной температуре в лаборатории (20-25 С), находящейся в диапазоне от 0,110-9 до 1,610-9 М, при этом значения указанной KD определены методом поверхностного плазмонного резонанса. Согласно другим вариантам реализации настоящего изобретения указанное моноклональное антитело является химерным или человеческим. Фрагменты таких антител, сохраняющие способность специфически связываться с TYRP1 человека, являются частью изобретения, даже если константы диссоциации для таких фрагментов не находятся в указанном диапазоне. Согласно другим вариантам реализации настоящего изобретения моноклональное антитело специфически связывается с TYRP1 человека с KD, составляющей от приблизительно 0,110-9 до приблизительно 1,210-9 М, от приблизительно 0,110-9 до приблизительно 0,810-9 М, от приблизительно 0,110-9 до приблизительно 0,410-9 М, от приблизительно 0,210-9 до приблизительно 1,210-9 М, от приблизительно 0,210-9 до приблизительно 0,810-9 М, от приблизительно 0,210-9 до приблизительно 0,410-9 М,от приблизительно 0,210-9 до приблизительно 0,310-9 или приблизительно 0,2810-9 М. Согласно одному из вариантов настоящего изобретения предложено антитело или его фрагмент,связывающийся с TYRP1, содержащие CDRH1, имеющую последовательность GYTFTSYAMN(SEQ ID NO: 5), и CDRL3, имеющую последовательность QQRSNWLMYT (SEQ ID NO: 6), при этом указанное антитело дополнительно содержит замену аминокислот в одной из указанных последовательностей CDR. Согласно другому варианту реализации указанные выше CDR не содержат замену аминокислот в одной из последовательностей CDR. Согласно другому варианту реализации настоящего изобретения указанное антитело, содержащее указанные выше CDR, специфически связывается с TYRP1 человека с константой диссоциации KD в диапазоне от 0,110-9 до 1,610-9 M. Согласно другому варианту настоящего изобретения указанное антитело или его фрагмент, специфически связывающийся с TYRP1, содержащие CDRH1, имеющую последовательность GFNIKDYFLH(SEQ ID NO: 11), и CDRL3, имеющую последовательность QHFWSLPFT (SEQ ID NO: 12), дополнительно содержат замену аминокислот в одной из указанных последовательностей CDR. Согласно другому варианту реализации указанные выше CDR (SEQ ID NO: 7-12) не содержат замен аминокислот. Согласно другому варианту настоящего изобретения предложено антитело или его фрагмент, который связывается с TYRP1 и содержит Согласно другому варианту реализации настоящего изобретения предложено моноклональное антитело, содержащее тяжелую цепь в соответствии с SEQ ID NO: 29 и легкую цепь в соответствии сSEQ ID NO: 32 или тяжелую цепь в соответствии с SEQ ID NO: 30 и легкую цепь в соответствии сSEQ ID NO: 32. Согласно одному из вариантов реализации настоящего изобретения антитело содержит две тяжелые цепи в соответствии с SEQ ID NO: 29 и две легкие цепи в соответствии с SEQ ID NO: 32 или содержит две тяжелые цепи в соответствии с SEQ ID NO: 30 и две легкие цепи в соответствии сSEQ ID NO: 32. Связывающиеся с TYRP1 фрагменты таких антител являются частью настоящего изобретения. Настоящее изобретение также относится к изолированным ДНК, кодирующим указанные антитела и их части. Другие варианты реализации настоящего изобретения включают изолированную полинуклеиновую кислоту, содержащую последовательность нуклеотидов, кодирующих антитело согласно изобретению или его фрагмент; вектор экспрессии, содержащий указанную последовательность нуклеотидов, связанную с последовательностью экспрессии, или рекомбинантную клетку-хозяина, содержащую указанный вектор экспрессии, или рекомбинантную клетку-хозяина или ее потомство, при этом в указанной клетке экспрессировано антитело согласно изобретению или его фрагмент. Согласно другому варианту реализации настоящего изобретения предложен способ получения или очистки антитела или его фрагмента, включающий культивирование указанных клеток в условиях, способствующих экспрессии антитела согласно изобретению или его фрагмента. Кроме того, настоящее изобретение относится к способам подавления роста раковых клеток и способам лечения меланомы у всех млекопитающих путем введения эффективного количества антитела. Согласно одному из вариантов реализации настоящего изобретения предложено применение описанных ранее антител или их фрагментов в качестве лекарственного средства. Согласно другому варианту описанные ранее антитела или их фрагменты должны быть применены при лечении рака, включающего, но не ограничивающегося, злокачественную меланому. Согласно другому варианту реализации настоящего изобретения предложено применение антитела согласно изобретению для производства лекарственного средства для лечения рака. Согласно предпочтительному варианту реализации рак представляет собой злокачественную меланому. Указанные антитела могут быть применены самостоятельно или в комбинации с антинеопластическим агентом или лечением. Согласно одному из вариантов реализации настоящего изобретения предложено применение описанных ранее антител в комбинации с дополнительным противораковым агентом или лечением. Согласно другому варианту противораковый агент представляет собой дакарбазин. Подробное описание изобретения Согласно настоящему изобретению предложены человеческие и химерные антитела и их фрагменты, специфичные к антигену TYRP1, а также последовательности изолированных или очищенных полинуклеотидов, кодирующих указанные антитела. Антитела согласно настоящему изобретению могут быть применены для лечения неопластических заболеваний, включая солидные и несолидные опухоли, а также для лечения гиперпролиферативных расстройств. Термин "антитело" включает фрагменты, связывающиеся с TYRP1, если не указано иное. Параметры связывания в данном описании относятся к полноразмерным антителам, а не к фрагментам, которые будут обязательно иметь различные параметры связывания ввиду различного размера указанных фрагментов. Существующие в природе антитела, как правило, имеют две идентичные тяжелые цепи и две идентичные легкие цепи, при этом каждая легкая цепь ковалентно связана с тяжелой цепью дисульфидной связью между цепями. Две тяжелые цепи соединены между собой множеством дисульфидных связей. Употребляемый в данном описании термин "антитело" включает молекулы иммуноглобулина, содержащие 4 полипептидные цепи: две тяжелые (Н) и две легкие (L), соединенные между собой дисульфидными связями. Отдельные цепи могут быть свернуты в домены, имеющие сходные размеры (110-125 аминокислот) и структуры, но различные функции. Легкая цепь может содержать один вариабельный домен (обозначенный в данном описании аббревиатурой VL) и/или один константный домен (обозначенный в настоящем описании аббревиатурой CL). Легкие цепи антител (иммуноглобулинов) представляют собой легкие цепи каппаили лямбда . Выражение VL в данном описании включает вариабельные участки легких цепей как каппа-типа (V), так и лямбда-типа (V). Константный участок легкой цепи состоит из одного домена, CL. Тяжелая цепь может также содержать один вариабельный домен (обозначенный в данном описании аббревиатурой VH) и/или, в зависимости от класса или изотипа антитела, три или четыре константных домена (CH1, CH2, СН 3 и СН 4) (вместе обозначенные в данном описании аббревиатурой СН). У человека такими изотипами являются: IgA, IgD, IgE, IgG и IgM, при этом IgA и IgG дополнительно подразделяют на подклассы и подтипы (IgA1-2 и IgG1-4). Настоящее изобретение включает антитела, относящиеся к любому из указанных выше классов или подклассов (изотипов). IgG1 человека является предпочтительным изотипом антител согласно настоящему изобретению. Как правило, вариабельные домены демонстрируют значительные различия в аминокислотных последовательностях для разных антител, в частности, по расположению антигенсвязывающего сайта. В каждом VL и VH найдены три участка, называемые гипервариабельными, или участками, определяющими комплементарность (CDR), которые окружены менее вариабельными участками, называемыми каркасными участками (FR). Аминокислоты относятся к конкретному CDR-участку или домену в соответствии с системой Кабата (Kabat, et al., Ann. NY Acad. Sci. 190:382-93 (1971); Kabat, et al., Sequences ofPublication No. 91-3242 (1991. Каждая VH и VL состоит из трех CDR и четырех FR, организованных в направлении от аминоконца к карбоксиконцу в следующем порядке: FR1-CDR1-FR2-CDR2-FR3-CDR3FR4. Часть антитела, состоящая из VL и VH доменов, обозначена Fv (Fragment variable, вариабельный фрагмент) и образует антигенсвязывающий сайт. Одиночная цепь Fv (scFv) представляет собой фрагмент антитела, содержащий домен VL и домен VH на одной полипептидной цепи, при этом N-конец одного домена и С-конец другого домена соединены гибким линкером (см., например, патент США 4946778 фрагментов на поверхности растворимых рекомбинантных генетических "упаковок" для дисплея, таких как бактериофаг. Пептидные линкеры, применяемые для получения одноцепочечных антител, могут представлять собой гибкие пептиды, выбранные для убеждения в том, что осуществляется правильная трехмерная укладка VL и VH доменов. Такой линкер, как правило, представляет собой 10-50 аминокислотных остатков. Предпочтительно линкер представляет собой 10-30 аминокислотных остатков. Более предпочтительно линкер представляет собой 12-30 аминокислотных остатков. Наиболее предпочтительно линкер представляет собой 15-25 аминокислотных остатков. Пример таких линкерных пептидов включает"Выделенное антитело" представляет собой антитело, которое (1) было частично, существенно или полностью очищено от смеси компонентов; (2) было идентифицировано и отделено от и/или восстановлено из компонента, в котором оно находилось в природе; (3) является моноклональным; (4) не содержит других белков тех же видов; (5) экспрессировано в клетке из различных видов или (6) не встречается в природе. Посторонними компонентами из природной среды являются вещества, затрудняющие применение указанного антитела в диагностических или терапевтических целях, и могут включать ферменты,гормоны и другие растворы белковой и небелковой природы. Примеры выделенных антител включают антитело, очищенное аффинным методом; антитело, полученное при помощи гибридомы или другой клеточной линии in vitro, и антитело человека, полученное из трансгенной мыши. Употребляемый в данном описании термин "моноклональное антитело" обозначает антитело, полученное из популяции, по существу, гомогенных антител, например индивидуальные антитела, содержащие популяцию, по существу идентичны, за исключением возможных встречающихся в природе мутаций или незначительных посттрансляционных изменений, которые могут присутствовать. Моноклональные антитела высокоспецифичны, направлены на один сайт антигена (также известный как детерминант или эпитоп). Кроме того, в отличие от препаратов традиционных (поликлональных) антител, которые,как правило, включают различные антитела, направленные на различные детерминанты, каждое моноклональное антитело направлено на один детерминант на антигене. Определение "моноклональные" обозначает характер антитела, как полученного, по существу, из гомогенной популяции антител, и не должно толковаться как требующего получения антитела любым конкретным способом. В настоящем описании термин "антитела" также включает "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученных из определенных видов или относящихся к определенному классу или подклассу антител, при этом остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям антител, полученных из других видов (например, мыши или крысы) или относящихся к другому классу или подклассу антител, а также фрагменты таких антител такой длины, чтобы они могли реализовать требуемую биологическую активность. См., например, Morrison et al., Proc. Natl.Acad. Sci. USA, 82:6851-6855 (1984). Таким образом, настоящее изобретение включает, например, химерные антитела, содержащие химерную тяжелую цепь и/или химерную легкую цепь. Химерная легкая цепь может содержать любой из вариабельных участков тяжелой цепи (VH), описанных в настоящем изобретении, или их мутантов или вариантов, конденсированных с тяжелой цепью константного участка антитела, не относящегося к человеку. Химерная легкая цепь может содержать любой из вариабельных участков легкой цепи (VL), описанных в настоящем изобретении, или их мутантов или вариантов, конденсированных с легкой цепью константного участка антитела, не относящегося к человеку. Термин "антитело человека" ("человеческое антитело") в данном описании включает антитела,имеющие вариабельные и константные участки, соответствующие последовательностям иммуноглобулина зародыша человека (как описано в источнике Kabat, et al. (1991), Sequences of Proteins of Immunological Interest, 5th Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека согласно изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародыша человека (например, мутации, вызванные случайным или сайт-специфичным мутагенезом in vitro или соматической мутацией in vivo), например, в участкахCDR. Антитело человека может иметь по меньшей мере по одной позиции замещенный аминокислотный остаток, например аминокислотный остаток, увеличивающий активность, но не кодируемый последовательностью иммуноглобулина зародыша человека. Однако термин "антитело человека" в данном описании не включает антитела, в которых CDR-последовательности получены из зародышей других видов млекопитающих, таких как мышь, и внесенных в каркасные последовательности человека. Фраза "рекомбинантное антитело человека" включает антитела человека, которые получены, экспрессированы, созданы или выделены рекомбинантным способом, в том числе антитела, экспрессированные с помощью рекомбинантного вектора экспрессии, перенесенного в клетку-хозяина; антитела,выделенные из рекомбинанта, библиотеки комбинаторных антител человека, антитела, выделенные из животного, которое является трансгенным для генов иммуноглобулина человека; или антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, включающими сплайсинг последовательностей генов иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные участки, полученные из по-4 019517 следовательностей иммуноглобулина зародышей человека (см. ранее указанный источник Rabat, et al.).Fc (кристаллизованный фрагмент) обозначает часть или фрагмент антитела, который содержит константные домены со спаренными тяжелыми цепями. В случае антитела IgG, например, Fc содержит домены СН 2 и СН 3. Fc для IgA или IgM антител дополнительно содержит домен СН 4. Fc отвечает за связывания с Fc рецептором, активацию цитотоксичности, опосредуемой комплементом, и ADCC. Для антител, таких как IgA и IgM, которые представляют собой комплексы IgG-подобных белков, для комплексобразования необходимы константные домены Fc. Таким образом, антитела согласно настоящему изобретению включают, но не ограничены перечисленными, встречающиеся в природе антитела, антитела, антитела человека, гуманизированные антитела,рекомбинантные антитела человека, моноклональные антитела, расщепляемые фрагменты, специфичные части и варианты указанных антител, включая миметики антител или содержащие части антител со сходной структурой и/или функцией антитела или его специфического фрагмента или части; каждое из которых содержит по меньшей мере один участок CDR. Функциональные фрагменты включают антигенсвязывающие фрагменты, которые связываются с антигеном TYRP1. Например, фрагменты антител, способные связываться с TYRP1 или его частью и охватываемые настоящим изобретением, включают бивалентные фрагменты, такие как (Fab')2 с дисульфидными связями между цепями, моновалентные фрагменты, такие как Fab (антигенсвязывающий фрагмент), которыми называют фрагменты антител, состоящие из доменов VL Cl VL CH1, и не сохранившие шарнирный участок тяжелой цепи (например, при расщеплении папаином); Fab, сохранившие шарнирный участок тяжелой цепи; facb (например, при расщеплении плазмином); F(ab')2; Fab' с отсутствием дисульфидных связей; pFc' (например, при расщеплении пепсином или плазмином), Fd (например, при расщеплении пепсином, частичное восстановление и реагрегация) и Fv или scFv (например, полученные с применением методов молекулярной биологии). Фрагменты антител также могут включать, например, антитела с удаленными доменами, линейные антитела,одноцепочечные антитела, scFv, антитела с одним доменом, мультивалентные одноцепочечные антитела,мультиспецифичные антитела, образованные из фрагментов антител, включая диатела, триатела и другие, которые специфически связываются с антигенами. Шарнирный участок разделяет Fab и Fc части антитела, обеспечивая подвижность Fab относительно друг друга и относительно Fc, а также включая множество дисульфидных связей для ковалентной связи двух тяжелых цепей. Антитела или их фрагменты согласно настоящему изобретению специфичны в отношении TYRP1. Специфичностью антител называют селективное распознавание антителом конкретного эпитопа антигена. Антитела или их фрагменты согласно настоящему изобретению, например, могут быть моноспецифичными, биспецифичными и мультиспецифичными. Биспецифичные антитела (BsAb) представляют собой антитела, которые имеют две различные антигенсвязывающие специфичности или сайты. Мультиспецифичные антитела имеют более двух различных антигенсвязывающих специфичностей или сайтов. Если антитело обладает более чем одной специфичностью, то распознаваемые эпитопы могут быть связаны с одним антигеном или более чем с одним антигеном. Таким образом, согласно настоящему изобретению предложены биспецифичные антитела или их фрагменты, которые связываются с двумя различными антигенами по меньшей мере с одной специфичностью к TYRP1. Согласно настоящему изобретению также предложены антитела или их фрагменты, специфичные кTYRP1. Указанный TYRP1 представляет собой белок TYRP1 млекопитающего и предпочтительно человека. Согласно особо предпочтительному варианту реализации антитело согласно настоящему изобретению способно связываться как с TYRP1 человека, так и с TYRP1 мыши [Shibahara et al., Nucleic AcidsRes. 14(6):2413-2427 (1986)], а, следовательно, может быть применено как при доклинических, так и при клинических испытаниях in vivo. Антитела согласно настоящему изобретению способны проявлять одну или более из следующих активностей: 1) проявлять высокую аффинность при связывании (связывающую способность) по отношению исключительно к TYRP1 и 2) подавлять рост опухоли in vitro и in vivo. Специфичность антител или их фрагментов согласно настоящему изобретению в отношении TYRP1 может быть определена на основе аффинности и/или авидности. Аффинность, выраженная константой равновесия при диссоциации антигена и антитела (KD), служит показателем силы связывания между антигенным детерминантом и связывающим сайтом антитела. Антитела согласно настоящему изобретению или их фрагменты также включают и такие антитела и фрагменты, для которых характеристики связывания были изменены или улучшены посредством направленной мутации, методами аффинного созревания, фагового дисплея или перестановки цепи. Аффинность и специфичность могут быть изменены или улучшены путем мутаций участков CDR и скрининга антигенсвязывающих сайтов с необходимыми характеристиками (см., например, Yang et al., J. Mol.Biol. (1995), 254:392-403). CDR изменяют посредством мутаций различными способами. Один из способов представляет собой рандомизацию отдельных остатков или комбинаций остатков таким образом, что в популяции неидентичных антигенсвязывающих сайтов все двадцать аминокислот находятся в конкретных положениях. Альтернативно, мутации могут быть индуцированы в ряде CDR-остатков путем ПЦР пониженной точности (см., например, Hawkins et al., J. Mol. Biol. (1992), 226:889-896). Например, векторы для фагового дисплея, содержащие гены для вариабельных участков тяжелой и легкой цепей, могут быть размножены в мутаторных штаммах Е.coli (см., например, Low et al., J. Mol. Biol. (1996), 250:359368). Данные способы мутагенеза приведены в качестве иллюстрации большого количества способов,известных специалистам в данной области. Удобным способом получения вариантов с заменами является аффинное созревание с фаговым дисплеем. Вкратце, различные сайты CDR-участков подвергают мутации с получением всех возможных аминокислотных замен в каждом сайте. Варианты антител, полученные таким образом, отражают одновалентную разновидность из частиц нитевидного фага, путем слияния с продуктом гена III фага М 13,собранного на каждой частице. Затем проводят скрининг таких вариантов с фаговым дисплеем на их биологическую активность (например, определяют связывающую аффинность (связывающую способность), специфичность, IC50, ЕС 50, KD), как описано в настоящем изобретении. Для того чтобы идентифицировать сайты CDR-участков - кандидаты для модификации, проводят аланин-сканирующий мутагенез для идентификации остатков участков CDR, принимающих значительное участие в связывании антигена. Альтернативно или в дополнение к предыдущему, для одной или более CDR-последовательностей в одном или более положений остатков может быть проведен случайный мутагенез, или если CDR функционально связан с вариабельным участком или если CDR не зависит от последовательности другого вариабельного участка и, таким образом, измененный CDR возвращен в вариабельный участок посредством технологии рекомбинантных ДНК. Когда такие варианты антитела получены и экспрессированы, группу вариантов подвергают скринингу, описанному в настоящем изобретении, и антитела с наилучшими свойствами по результатам одного или более соответствующих анализов выбирают для дальнейшей разработки. В соответствии с настоящим описанием, кроме антител, специально описанных в данном изобретении, могут быть легко созданы и произведены другие, "по существу гомологичные" модифицированные антитела, с использованием различных методик с участием рекомбинантной ДНК, хорошо известных специалистам в данной области. Например, каркасные участки могут отличаться от нативных последовательностей на уровне первичной структуры за счет нескольких замен аминокислот, вставок и делеций по концам и в промежуточных положениях, и т.д. Кроме того, разнообразие различных каркасных участков у человека может быть применено самостоятельно или в комбинации в качестве основы для гуманизированных иммуноглобулинов согласно настоящему изобретению. В большинстве случаев модификации генов могут легко проводиться посредством множества известных методов, таких как сайтнаправленный мутагенез. Настоящее изобретение включает TYRP1-связывающие полипептиды с аминокислотными последовательностями, по существу, аналогичными аминокислотным последовательностям вариабельных или гипервариабельных участков описанных полноразмерных антител к TYRP1. По существу, аналогичная аминокислотная последовательность определена в данном описании как последовательность с гомологичностью по отношению к другой аминокислотной последовательности по меньшей мере 70%, предпочтительно по меньшей мере приблизительно 80% и более предпочтительно по меньшей мере приблизительно 90, 95, 96, 97, 98 или 99%, определенной по поиску в базе данных FASTA в соответствии с методикой Пирсона (Pearson) и Липмана (Lipman) (Proc. Natl. Acad. Sci. USA (1988), 85:2444-8). Антитела согласно настоящему изобретению или их фрагменты включают человеческие антитела с одним, двумя, тремя, четырьмя, пятью и/или шестью участками, определяющими комплементарность(CDR), выбранными из группы, включающей аминокислотные последовательности CDR, представленные в табл. 1. Согласно другому варианту реализации настоящего изобретения данные антитела или их фрагменты могут иметь вариабельный участок тяжелой цепи 20D7 или 20D7S и/или вариабельный участок легкой цепи 20D7 или 20D7S, рассмотренные ниже. 20D7 и 20D7S представляют собой особенно предпочтительные антитела согласно настоящему изобретению. Такие антитела содержат человеческие VH и VL каркасные участки (FR), а также человеческие CDR. Настоящее изобретение включает последовательности нуклеиновых кислот, кодирующих тяжелую цепь антител к TYRP1, содержащую любой из VH участков или их часть или любой из VH CDR-участков,включая любые их варианты, описанные в данном изобретении. Настоящее изобретение также включает молекулы нуклеиновых кислот, кодирующих легкую цепь антител к TYRP1, содержащую любой из VLучастков или его часть или любой из VL CDR-участков, включая любые их варианты, описанные в данном изобретении. Каждый домен антител согласно настоящему изобретению может представлять собой целое антитело с вариабельным доменом тяжелой или легкой цепи или может представлять собой функциональный эквивалент или мутант или производное встречающегося в природе домена, или домен, сконструированный синтетическим способом, например in vitro, с использованием методики, например, такой, как описана в WO 93/11236 (Griffiths et al.). Например, возможно соединить домены, соответствующие вариабельным доменам антитела, но с исключением по меньшей мере одной аминокислоты. Также настоящее изобретение включает антитело с одной или более аминокислотными заменами, мутациями или делециями в одной из последовательностей CDR. Важным характеризующим признаком является способность каждого домена ассоциироваться с комплементарным доменом с образованием антигенсвязываю-6 019517 щего сайта. Соответственно, термины "вариабельный фрагмент тяжелой и легкой цепей" не должны быть сконструированы таким образом, чтобы исключить варианты, включая варианты CDR, которые не оказывают существенного влияния на специфичность. Антитела согласно настоящему изобретению могут быть получены известными в данной области техники способами. Такие способы включают иммунологический способ, описанный авторами Kohler иand Molecular Biology, vol. 13, Elsevier Science Publishers, Amsterdam (1985); а также способ получения рекомбинантной ДНК, описанный в источнике Huse et al., Science, 246:1275-1281 (1989). Фрагменты антител могут быть получены путем расщепления целого антитела или путем экспрессии ДНК, кодирующей данный фрагмент. Фрагменты антител могут быть получены методами, описанными в источнике Lamoyi et al., J. Immunol. Methods 56:235-243 (1983) и Parham, J. Immunol. 131:28952902 (1983). Такие фрагменты могут содержать один или более Fab-фрагментов или фрагмент F(ab')2. Такие фрагменты могут также содержать одноцепочечный фрагмент вариабельного участка антител, т.е.scFv, диатела или другие фрагменты антител. Способы получения таких функциональных эквивалентов представлены в заявке РСТ WO 93/21319; заявке на европейский патент 239400; заявке РСТWO 89/09622; заявке на европейский патент 338745 и европейском патенте ЕР 332424. Предпочтительные клетки-хозяева для трансформации векторов и экспрессии антител согласно настоящему изобретению представляют собой клетки млекопитающих, например NSO-клетки (несекретирующие (0) клетки миеломы мышей), 293 и СНО-клетки и другие клеточные линии лимфоидной природы, такие как клетки лимфомы, миеломы или гибридомы. Как вариант, могут применяться и другие эукариотические клетки-хозяева, такие как дрожжи. Культивирование трансформируемых клеток-хозяев проводят известными в данной области способами в жидкой среде, содержащей ассимилируемые источники углерода (углеводы, такие как глюкоза или лактоза), азота (аминокислоты, пептиды, белки или продукты их разложения, такие как пептоны,аммониевые соли и т.п.) и неорганические соли (сульфаты, фосфаты и/или карбонаты натрия, калия,магния и кальция). Такая питательная среда дополнительно содержит, например, стимуляторы роста,такие как микроэлементы, например железо, цинк, марганец и т.п. При необходимости экспрессии генной конструкции в клетках дрожжей необходимым геном для выбора при использовании в клетках дрожжей является ген trp1, присутствующий в плазмиде YRp7 дрожжей. Stinchcomb et al. Nature, 282:39 (1979); Kingsman et al., Gene, 7:141 (1979). Указанный ген trp1 обеспечивает селекционный маркер для мутантного штамма дрожжей, не способного расти на триптофане, например штамма АТСС 44076 или РЕР 4-1. Jones, Genetics, 85:12 (1977). Наличие такого нарушения в гене trp1 генома дрожжевой клетки-хозяина далее обеспечивает эффективную возможность для определения трансформации по росту в отсутствие триптофана. Аналогичным образом, дефицитные поLeu2. Антитела согласно настоящему изобретению могут быть выделены или очищены любым известным в данной области способом, включая осаждение сульфатом аммония или сульфатом натрия с последующим диализом против раствора соли, ионообменную хроматографию, аффинную или иммуноаффинную хроматографию, а также гель-фильтрацию или зональный электрофорез. Предпочтительным способом для очистки антител согласно настоящему изобретению является аффинная хроматография на протеине-А. ДНК, кодирующая антитела человека, может быть получена рекомбинацией ДНК, кодирующей константные и вариабельные участки у человека, за исключением CDR, полученной в основном или исключительно из соответствующих участков антител человека, и ДНК, кодирующей CDR-участки, полученной из человека. Приемлемые источники ДНК, кодирующих фрагменты антител, включают любые клетки, такие как клетки гибридомы и спленоцита, в которых экспрессированы полноразмерные антитела. Данные фрагменты могут быть применены непосредственно в качестве эквивалентов антител или могут быть рекомбинированы с другими эквивалентами, как описано выше. Делеции и рекомбинации в ДНК, описанные в данном разделе, могут быть осуществлены известными способами. Другим источником ДНК является известная в данной области библиотека фагового дисплея антител. Примеры антител согласно настоящему изобретению были получены путем гибридомной технологии из иммунизированных мышей. Кроме того, согласно настоящему изобретению предложены векторы экспрессии, содержащие описанные ранее полинуклеотидные последовательности, функционально связанные с экспрессирующей последовательностью, промотором и последовательностью энхансера. Разработаны разнообразные векторы экспрессии для эффективного синтеза полипептида для антитела в прокариотических системах,таких как бактерии, и эукариотических системах, включающих, но не ограничивающихся, системы культур клеток дрожжей и млекопитающих. Векторы согласно настоящему изобретению могут включать сегменты последовательностей хромосомальной, нехромосомальной или синтетической ДНК. Любой приемлемый вектор экспрессии может быть применен. Например, прокариотические клонирующие векторы включают плазмиды Е coli, такие как colE1, pCR1, pBR322, pMB9, pUC, pKSM и RP4. Прокариотические векторы также включают производные ДНК фага, такого как М 13, и других нитевидных фагов, содержащих одноцепочечную ДНК. Примером вектора, пригодного для дрожжей, является плазмида 2. Приемлемые векторы для экспрессии в клетках млекопитающих включают известные производные SV-40, аденовируса, последовательности ДНК, полученной из ретровируса, а также "шаттлвекторы", полученные путем комбинации функциональных векторов млекопитающих, в том числе и описанных выше, и функциональных плазмид и фаговых ДНК. Другие эукариотические векторы экспрессии также известны в данной области (например,P.J. Southern and P. Berg, J. Mol. Appl. Genet. 1:327-341 (1982); Subramani et al., Mol. Cell. Biol. 1:854-864(1981); Kaufmann and Sharp, J. Mol. Biol. 159:601-664 (1982); Scahill et al., Proc. Natl. Acad. Sci. USA, 80: 4654-4659 (1983) и Urlaub and Chasin, Proc. Natl. Acad. Sci. USA, 77:4216-4220 (1980). Векторы экспрессии, применяемые в настоящем изобретении, содержат по меньшей мере одну контрольную последовательность, которая функционально связана с последовательностью ДНК или фрагментом, который необходимо экспрессировать. Контрольную последовательность вставляют в вектор для того, чтобы контролировать регуляцию экспрессии клонированной последовательности ДНК. Примерами подходящих для экспрессии контрольных последовательностей являются lac-система,trp-система, tac-система, trc-система, основные участки оператора и промотора фага лямбда, контрольный участок белка оболочки фага fd, промоторы, отвечающие за гликолиз в клетке дрожжей, например промотор для 3-фосфоглицераткиназы, промоторы для дрожжевой кислой фосфатазы, например Pho5,промоторы для факторов альфа-спаривания дрожжей и промоторы, полученные из полиомы, аденовируса, ретровируса и вируса обезьян, например ранние и поздние промоторы вируса SV40, и другие известные последовательности для контроля экспрессии генов в прокариотических или эукариотических клетках и их вирусах или их комбинациях. Согласно настоящему изобретению предложены рекомбинантные клетки-хозяева, содержащие описанные выше векторы экспрессии. Антитела согласно настоящему изобретению могут быть экспрессированы в клеточных линиях, но не в гибридомах. Нуклеиновые кислоты, содержащие последовательность, кодирующую полипептид согласно настоящему изобретению, могут быть использованы для трансформации приемлемых клеток-хозяев, относящихся к млекопитающим. Особенно предпочтительные клеточные линии выбирают на основании высокого уровня экспрессии, конститутивной экспрессии необходимого белка и минимальных примесей белков хозяина. Линии клеток млекопитающих, приемлемые в качестве хозяев для экспрессии, хорошо известны в данной области техники и включают большое количество иммортализированных клеточных линий, таких как (не ограничиваясь перечисленными): NSO-клетки (несекретирующие (0) клетки миеломы мышей), клетки миеломы мышей, клетки яичников китайских хомячков (СНО), клетки почек детенышей хомяков (BHK) и многие другие. Приемлемые дополнительные эукариотические клетки включают клетки дрожжей и других грибов. Пригодные прокариотические хозяева включают, например, Е.coli, в том числе Е.coliSG-936, E.coli HB101, Е.coli W3110, Е.coli X1776, Е.coli X2282, Е.coli DHI и Е.coli MRCl, Pseudomonas,Bacillus, в том числе Bacillus subtilis и Streptomyces. Указанные рекомбинантные клетки-хозяева могут быть применены для получения антитела или его фрагмента путем культивирования данных клеток в условиях, способствующих экспрессии антитела или его фрагмента и очистки данных антитела или его фрагмента от клетки-хозяина или окружающей клетку-хозяина среды. Направленное действие экспрессированного антитела или его фрагмента на секрецию в рекомбинантных клетках-хозяевах может быть усилено за счет вставки сигнальной или секреторной последовательности, кодирующей лидерный пептид (см. Shokri et al. (2003), Appl Microbiol Biotechnol. 60(6):654-64, Nielsen et al., Prot. Eng. (1997), 10:1-6 and von Heinje et al. (1986), Nucl. Acids Res. 14:46834690) к 5'-концу гена, кодирующего необходимое антитело. Элементы такого секреторного лидерного пептида могут быть получены как из прокариотических, так и из эукариотических последовательностей. Соответственно, приемлемо использовать секреторные лидерные пептиды, аминокислотная последовательность которых присоединена к N-концу полипептида для прямого извлечения данного полипептида из цитозоля клетки-хозяина и секреции в среду. Антитела согласно настоящему изобретению могут быть конденсированы с дополнительными аминокислотными остатками. Такие аминокислотные остатки могут представлять собой короткий пептидный участок, улучшающий выделение. Также настоящее изобретение включает и другие аминокислотные остатки для хоуминга (миграции) антител к специфичным органам или тканям. Другой вариант реализации получения антител согласно настоящему изобретению предполагает экспрессию нуклеиновой кислоты, кодирующей антитело согласно изобретению, в трансгенном животном, имеющем существенную часть вставленного генома, продуцирующего антитела человека, и не имеющем возможности продуцировать эндогенные антитела. Трансгенные животные включают, но не ограничены перечисленными, мышей, козу и кролика. Один из дополнительных вариантов реализации настоящего изобретения включает экспрессию гена, кодирующего антитела, например, в молочной железе животного для секреции полипептида в период лактации. Согласно настоящему изобретению также предложен способ лечения роста опухоли у млекопитающих путем введения млекопитающему эффективного количества антитела. Опухоли, которые приемлемо вылечить в соответствии с настоящим изобретением, предпочтительно экспрессируют TYRP1. Не вдаваясь в подробности конкретного механизма, данные способы обеспечивают лечение роста раковых клеток, в том числе злокачественной меланомы. "Лечение" или "лечить" в контексте настоящего изобретения относится к терапевтическому лечению, включающему подавление, замедление, уменьшение или изменение хода данного состояния или нежелательных физиологических изменений, связанных с заболеванием или расстройством, улучшению клинических симптомов состояния или предотвращению появления клинических симптомов состояния. Предпочтительные или требуемые клинические результаты включают, но не ограничены перечисленными, облегчение симптомов, снижение выраженности болезни или расстройства, стабилизацию болезни или расстройства (т.е. болезнь или расстройство не усиливается), задержка или замедление течения заболевания или расстройства, улучшение состояния или временное облегчение болезни или расстройства, как детектируемое, так и недетектируемое. "Лечение" может также означать увеличение времени жизни по сравнению с ожидаемым временем в случае отсутствия лечения. Нуждающиеся в лечении включают тех, кто уже имеет данное заболевание. Согласно одному из вариантов реализации настоящее изобретение может быть применено в качестве лекарственного средства. Термин "меланома" включает, но не ограничен перечисленными, меланомы, метастатические меланомы, меланомы, полученные из меланоцитов или меланоцитсвязанных невусных клеток, меланокарциномы, меланоэпителиомы, меланосаркомы, меланомы in situ, поверхностно распространяющиеся меланомы, модульные меланомы, пигментное пятно злокачественной меланомы, акральную лентигинозную меланому, инвазивную меланому и синдром семейных атипичных родинок и меланомы (FAM-M). Согласно одному из вариантов реализации настоящего изобретения меланома представляет собой особую форму рака. Согласно другому варианту меланома может быть злокачественной. Согласно одному из вариантов реализации настоящего изобретения для первой линии лечения меланомы, как описано ниже,следует применять описанные в настоящем изобретении антитела к TYRP1. Согласно другому варианту реализации описанные в настоящем изобретении антитела к TYRP1 являются средствами первой линии для лечения метастатической меланомы, поэтому указанные антитела необходимо применять при первом круге лечения впервые диагностированной метастатической меланомы. При реализации способов согласно настоящему изобретению терапевтически эффективное количество антитела согласно настоящему изобретению вводят нуждающемуся млекопитающему. Эффективные дозы композиций согласно настоящему изобретению для лечения расстройств, описанных в настоящем изобретении, отличаются в зависимости от множества различных факторов, включая способы введения, сайт-мишень, физиологическое состояние пациента, в зависимости от того, является ли пациент человеком или животным, применяют ли другие лекарственные средства и является ли лечение профилактическим или терапевтическим. Термин "введение" в данном описании обозначает доставку антител согласно настоящему изобретению млекопитающему любым из способов, позволяющим достичь необходимого результата. Например, указанные антитела могут быть введены внутривенно или внутримышечно. Несмотря на то что антитела человека согласно настоящему изобретению особенно пригодны для введения людям, их можно вводить и другим млекопитающим. Термин "млекопитающее", используемый в настоящем описании, включает, но не ограничивается перечисленными, человека, лабораторных животных, домашних животных и сельскохозяйственных животных. Терапевтически эффективное количество означает такое количество антитела согласно настоящему изобретению, которое при введении млекопитающему эффективно оказывает необходимый терапевтический эффект, такой как подавление роста опухоли. Дозы для лечения могут определяться обычными методами, известными специалистам, для оптимизации безопасности и эффективности. Фармацевтические композиции согласно настоящему изобретению могут включать "терапевтически эффективное количество" антитела к TYRP1 согласно изобретению. "Терапевтически эффективным количеством" называют количество, эффективное в необходимых дозах и в течение необходимых периодов времени для достижения требуемого терапевтического результата. Терапевтически эффективное количество антитела может изменяться в зависимости от факторов, таких как состояние болезни, возраст,пол или вес субъекта, а также в зависимости от способности антитела или части антитела вызывать необходимый ответ у субъекта. Терапевтически эффективное количество - это также и такое количество, при котором терапевтически положительные эффекты перевешивают токсические или вредные эффекты антитела или части антитела. Режим дозировки может быть дополнен для обеспечения оптимального необходимого ответа (например, терапевтического или профилактического ответа). Идентификация такого заболевания требует способностей и знаний специалиста в данной области. Например, людям, страдающим злокачественной меланомой или имеющим риск развития клинически значимых симптомов, подходит введение антител к TYRP1 согласно настоящему изобретению. Антитела TYRP1 согласно настоящему изобретению вводят для терапевтического лечения пациенту, страдающему злокачественной меланомой, в количестве, достаточном для подавления или уменьшения развития опухоли или патологического состояния. Развитие включает, например, рост, инвазивность,метастазы и/или рецидив опухоли или патологического состояния. Количество, достаточное для дости-9 019517 жения указанной цели, определяется терапевтически эффективной дозой. Количества, эффективные для такого применения, зависят от степени тяжести заболевания и общего состояния иммунной системы пациента. Режим дозирования может также меняться в зависимости от состояния болезни и статуса пациента и, как правило, меняется от однократной болюсной дозы до продолжительного введения несколько раз в день (например, каждые 4-6 ч) или может быть обусловлен назначением врача и состоянием пациента. В качестве неограничивающего примера диапазон терапевтически эффективного количества антитела согласно настоящему изобретению составляет 0,1-50 мг/кг, более предпочтительно 3-35 мг/кг и более предпочтительно 5-20 мг/кг. Дозировки и частоту применения определяют врачи, лечащие данного пациента, и такие дозировки включают дозы от менее 1 до более 100 мг/кг, принимаемые ежедневно, три раза в неделю, еженедельно, один раз в каждые две недели или менее часто. Доза для введения может быть в диапазоне 1-100, 2-75 или 5-60 мг/кг. Следует отметить, тем не менее, что настоящее изобретение не ограничено какой-либо конкретной дозой. Согласно одному из вариантов реализации настоящего изобретения антитела к TYRP1 можно вводить в комбинации с одним или более других антинеопластических агентов. Можно использовать любой приемлемый антинеопластический агент, в том числе химиотерапевтический агент, радиацию или их комбинации. Данный антинеопластический агент может представлять собой алкилирующий агент или антиметаболит. Примеры алкилирующих агентов включают, но не ограничены перечисленными, цисплатин, циклофосфамид, мелфалан и дакарбазин (DTIC). Проведенные in vivo исследования показывают,что введение 20D7 в комбинации с дакарбазином (DTIC) демонстрирует более сильную противоопухолевую активность по сравнению с монотерапией для ксенотрансплантата человеческого 624mel. В одном из вариантов реализации настоящего изобретения описанные в данном документе антитела к TYRP1 представлены в комбинации с дакарбазином. Примеры антиметаболитов включают, но не ограничены перечисленными, доксорубицин, даунорубицин, паклитаксел, иринотекан (СРТ-11) и топотекан. В случае,когда антинеопластический агент представляет собой радиацию, источник радиации может быть внешним (радиационная терапия внешними лучами - EBRT) или внутренним (брахитерапия - ВТ) по отношению к пациенту, подвергаемому лечению. Доза антинеопластического агента для введения зависит от многочисленных факторов, включая, например, тип агента, тип и степень тяжести опухоли, подвергаемой лечению, путь введения агента. Следует отметить, тем не менее, что настоящее изобретение не ограничено какой-либо конкретной дозой. В настоящем изобретении любой приемлемый способ или путь может быть применен для введения антител к TYRP1 согласно настоящему изобретению и, возможно, для совместного введения антинеопластических агентов и/или антагонистов других рецепторов. Режимы применения антинеопластических агентов согласно настоящему изобретению включают любой режим, который считается оптимально подходящим для лечения неопластического состояния пациента. Различные злокачественные образования могут требовать применения специфичных противоопухолевых антител и специфичных антинеопластических агентов, что определяется в зависимости от пациента. Пути введения включают, например,пероральное, внутривенное, внутрибрюшинное, подкожное или внутримышечное введение. Предпочтительны парентеральные пути. Следует отметить, тем не менее, что настоящее изобретение не ограничено каким-либо конкретным способом или путем введения. Согласно другому аспекту настоящего изобретения антитело к TYRP1 согласно настоящему изобретению может быть химически или биосинтетически связано с одним или более антинеопластическим или антиангиогенным агентами. Настоящее изобретение дополнительно включает антитела к TYRP1, связанные с группами мишени или репортера, включая, например, только антинеопластические агенты, другие антитела или репортеры,такие как изотопы с радиоактивными метками, в диагностической системе, где агент, образующий детектируемый сигнал, соединен с антителом. Понятно, что антитела к TYRP1 согласно настоящему изобретению при применении для млекопитающих в профилактических целях или при лечении необходимо вводить в форме композиции, дополнительно содержащей фармацевтически приемлемый носитель. Подходящие фармацевтически приемлемые носители включают, например, один или более из таких как вода, соль, фосфатно-солевой буферный раствор, декстроза, глицерин, этанол и т.п., а также комбинации указанных носителей. Фармацевтически приемлемые носители могут дополнительно содержать малые количества вспомогательных веществ,таких как увлажняющие агенты или эмульгаторы, консерванты или буферы, увеличивающие срок хранения или эффективность связывающих белков. Указанные композиции для инъекции могут, как известно в данной области, быть составлены так, чтобы обеспечить быстрое, замедленное или отсроченное высвобождение активного ингредиента после введения млекопитающему. Кроме того, настоящее изобретение включает применение антител согласно настоящему изобретению in vivo и in vitro в исследовательских или диагностических методах, известных в данной области. Диагностические методы включают наборы, содержащие антитела согласно настоящему изобретению. Согласно одному из вариантов реализации настоящего изобретения предложено моноклональное антитело человека или его фрагмент, специфичный к TYRP1. Согласно другому варианту реализации настоящего изобретения предложено химерное моноклональное антитело или его фрагмент, специфич- 10019517 ный к TYRP1. В другом варианте реализации CDR-участки антитела идентичны CDR-участкам СТА 99. В различных вариантах CDR-участки антитела идентичны CDR-участкам 20D7 или 20D7S. Согласно одному из вариантов реализации антитело связывается с TYRP1 с константой скорости диссоциации (Kd или koff), находящейся в диапазоне от 1,710-4 до 510-4 1/с(с-1, 1/с), при этом указанную константу скорости диссоциации определяют методом поверхностного плазмонного резонанса, описанного в настоящем изобретении, при комнатной температуре в лаборатории (20-25 С). Согласно другому варианту реализации антитело связывается с TYRP1 с константой Kd или koff, находящейся в диапазоне от 1,710-4 до 3,510-4 1/с. Согласно другому варианту антитело связывается с TYRP1 с константой диссоциации, измеренной методом поверхностного плазмонного резонанса, которая составляет до 10% от константы скорости диссоциации, определенной для 20D7, 20D7S или СТА 99 в тех же условиях. Один из вариантов реализации настоящего изобретения включает моноклональное антитело или его фрагмент, специфичные к TYRP1, содержащие один или более участков, определяющих комплементарность (CDR), выбранных из группы, включающей CDR, представленные в табл. 1 и 2. Согласно другому варианту реализации настоящего изобретения предложено моноклональное антитело или его фрагмент,специфичные к TYRP1, содержащие CDR1-участок легкой цепи с последовательностью:RASQSVSSYLA (SEQ ID NO: 4). Согласно другому варианту настоящего изобретения предложено моноклональное антитело или его фрагмент, специфичные к TYRP1, и имеющий CDR3 легкой цепи с последовательностью: RYSSSWYLDY (SEQ ID NO: 3). Согласно различным вариантам реализации настоящего изобретения предложено моноклональное антитело или его фрагмент, содержащие (i) вариабельный участок легкой цепи, выбранный из группы, включающей 20D7, 20D7S и СТА 99, и (ii) вариабельный участок тяжелой цепи, выбранный из группы, включающей 20D7, 20D7S и СТА 99. Согласно другому варианту реализации настоящего изобретения предложено моноклональное антитело или его фрагмент, специфичные к TYRP1, содержащие (i) вариабельный участок легкой цепи с СТА 99, (ii) вариабельный участок тяжелой цепи с СТА 99 и (iii) константные участки иммуноглобулина человека G1(hIgG1). Согласно другому варианту реализации настоящего изобретения предложен способ лечения рака у млекопитающего, включающий введение млекопитающему эффективного количества антитела или его фрагмента, соответствующего любому из уже описанных вариантов. Согласно данному изобретению предложен способ лечения злокачественной меланомы. Другой способ лечения, предложенный согласно данному изобретению, включает комбинацию применения антител или их фрагментов согласно данному изобретению с введением дополнительного противоракового агента или лечения. В одном из способов лечения указанный противораковый агент представляет собой дакарбазин (DTIC). Следует понимать и предполагать, что специалистами в данной области могут быть предложены изменения к описанным в настоящем изобретении принципам изобретения, и необходимо иметь в виду,что такие модификации также должны быть включены в объем настоящего изобретения. Все указанные ссылки полностью включены в настоящее описание. Примеры Приведенные ниже примеры иллюстрируют данное изобретение, но не имеют цели каким-либо образом ограничивать его объем. Однако данные примеры и не имеют цели расширить объем изобретения. Подробное описание обычных методов, применимых при конструировании векторов и плазмид, вставки генов, кодирующих полипептиды в указанные векторы и плазмиды, введение плазмид в клетки-хозяева и экспрессия и определение экспрессии генов и генных продуктов может быть получено из многочисленных публикаций, включая Sambrook, J. et al. (1989), Molecular Cloning: A Laboratory Manual, 2nd ed., ColdTechnologies) с 10% инактивированной теплом эмбриональной бычьей сывороткой (HyClone Laboratories,Logan, UT) и регулярно проверяли на заражение микроорганизмами Mycoplasma. SKmel23 и SKmel28 были предоставлены Dr. Alan Houghton (Memorial Sloan-Kettering Cancer Center, New York, NY). 624mel и 1102mel были приобретены у Dr. Steve Rosenberg (National Cancer Institute, Bethesda, MD). A375 была приобретена в American Type Culture Collection (Manassas, VA). 6-8-недельные женские особи Nu/Nu мышей были приобретены в Taconic Farms (Germantown, NY). Экспрессия и очистка человеческих и химерных антител к TYRP1. Для каждого антитела конструировали подходящую нуклеотидную последовательность тяжелой цепи, например SEQ ID NO: 21, 22 или 23 (для 20D7, 20D7S и СТА 99 соответственно), в подходящей для экспрессии плазмиде, например pGSHC, и конструировали подходящую нуклеотидную последовательность легкой цепи, например SEQ ID NO: 26 или 27 (для 20D7/20D7S и СТА 99 соответственно), в подходящей для экспрессии плазмиде, такой как pGSLC, любым приемлемым способом, таким как ПЦРклонирование. Для получения стабильной клеточной линии котрансфицировали подходящую линию клеток-хозяев, таких как NSO-клетки, с плазмидами с линейными тяжелой и легкой цепями путем электропорации и культивировали в подходящей среде, такой как среда Dulbecco's Modified Eagle Medium, с отсутствием глутамина с добавкой диализованной эмбриональной телячьей сыворотки и глутаминсинтетазы. Проводили скрининг клонов на экспрессию антител методом твердофазного иммуноферментного анализа (ELISA) и выбирали наилучшего продуцента для культивирования в роллерных колбах. Антитела очищали подходящим способом, таким как аффинная хроматография с протеином А. Согласно одному из вариантов реализации настоящего изобретения предложено рекомбинантное моноклональное тело человека 20D7, полноразмерный IgG1, имеющий в качестве мишени поверхность клеток, экспрессирующих тирозиназазависимый белок-1 (TYRP1 или TRP1). Данное антитело содержит человеческую тяжелую цепь (НС) гамма-1 (подгруппа I) и человеческую легкую цепь каппа (подгруппаIII). Показано, что 20D7 селективно связывается с TYRP1 человека с высокой аффинностью и опосредованной высокой противоопухолевой активностью в моделях ксенотрансплантатов за счет механизма,включающего активацию функции иммунного эффектора. Согласно одному из вариантов настоящего изобретения предложено рекомбинантное моноклональное антитело человека 20D7S, полноразмерный IgG1, имеющий в качестве мишени поверхность клеток,экспрессирующих тирозиназазависимый белок-1 (TYRP1 или TRP1). Данное антитело содержит человеческую тяжелую цепь (НС) гамма-1 (подгруппа I) и человеческую легкую цепь каппа (подгруппа III). 20D7S создано в попытке получить более стабильную молекулу, где свободный остаток цистеина тяжелой цепи вариабельного участка (С 47) преобразован в остаток серина методом сайт-направленного мутагенеза. Данный неспаренный или свободный цистеин имеет потенциал для неправильного связывания с другими цистеинами, участвующими во внутри- и межцепочечных дисульфидных мостиках между полипептидами тяжелой и легкой цепей. Неправильное связывание может потенциально привести к неправильной укладке и процессингу, увеличению неоднородности продукта и потенциальной его стабильности. Описанный в настоящем изобретении анализ методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS PAGE) подтвердил наличие свободной легкой цепи и свободной тяжелой цепи при получении 20D7, но наличие свободных легких цепей и свободных тяжелых цепей снижено или такие цепи отсутствуют при получении 20D7S. Согласно другому варианту реализации настоящего изобретения предложено СТА 99, химерное антитело с константным участком IgG1 человека. Антитело мыши ТА 99 (патент США 4798790) содержит две легкие цепи, при этом одна из легких цепей ТА 99 специфична к TYRP1, а другая взята из исходных клеток миеломы мыши. Такое антитело проявляет пониженную активность, так как легкая цепь с примесями не способна связываться с TYRP1. СТА 99 было сконструировано для того, чтобы устранить данный недостаток и, таким образом, увеличить активность. Согласно одному из вариантов реализации настоящего изобретения СТА 99 сконструировано из двух идентичных тяжелых цепей и двух идентичных легких цепей. Проведенные исследования показали, что СТА 99 обладает повышенной активностью и повышенной связывающей способностью, а также функциями эффектора, более подходящими для человека. В табл. 1 и 2 представлены последовательности аминокислот и номера SEQ ID NO для различныхCDR согласно настоящему изобретению. В табл. 3 представлены номера SEQ ID NO различных последовательностей, относящихся к настоящему изобретению. Последовательности полинуклеиновых кислот,кодирующих описанные ниже аминокислотные последовательности, также включены в объем настоящего изобретения. Таблица 1 Последовательности аминокислот CDR-участков вариабельных областей тяжелой и легкой цепей антител 20D7 и 20D7S Таблица 2 Последовательность аминокислот CDR-участков вариабельных областей тяжелой и легкой цепей антитела СТА 99SEQ ID NO последовательностей аминокислот для антител 20D7, 20D7S и СТА 99 Антитела, используемые для экспериментов, содержали полноразмерную тяжелую и легкую цепи без сигналов, представленные в табл. 3. Таблица 4 Сводные данные об антителах 20D7, 20D7S и СТА 99 Сравнительный твердофазный иммуноферментный анализ (ELISA). 96-луночные плоскодонные планшеты Falcon с рекомбинантным TYRP человека (5 мкг/мл 50 мкл) выдерживали при температуре 4C в течение ночи. На следующий день блокировали планшеты 5% эмбриональной бычьей сывороткой (FBS) в фосфатно-солевом буферном растворе (PBS), содержащем 0,1% Твин-20, в течение 2 ч при комнатной температуре. Добавляли различные количества антител в 100 мкл образцов. Планшет промывали 3 раза составом PBS/Tween и добавляли 100 мкл конъюгированного с пероксидазой хрена антитела козы к человеческому (Biosource, Camarillo, CA), растворенного в соотношении 1:5000 в 100 мкл в планшете и инкубировали в течение 1 ч при комнатной температуре (20-25 С). Планшет промывали 3 раза и добавляли в планшет по 500 мкл на лунку 3,3',5,5'-тетраметилбензилиденового (ТМВ; KPL, Gaithersburg, MD) субстрата. Проводили измерения на планшетах при 450 нм при помощи микропланшетного ридера (такого как Molecular Devices). Таблица 5 Твердофазный иммуноферментный анализ (ELISA) Половина минимальной эффективной концентрации (ЕС 50) измеряется в виде молярной концентрации (М). Антитела, включая 20D7 человека, 20D7S человека и СТА 99, демонстрируют специфическое связывание с TYRP1 человека при анализе ELISA. Проточная цитометрия. Клетки 624mel обрабатывали в течение 1 ч в ледяной бане 5 мкг/мл IgG человека или моноклональными антителами мыши (MAb) к TYRP1 в 1%-ном BSA/PBS. Клетки промывали трижды 1%-нымBSA/PBS и инкубировали в течение 1 ч в флюоресцирующем изотиоцианате (FITC)-меченого IgG козы к человеческому. Клетки промывали и анализировали на подходящем приборе проточной цитометрии,таком как Epics XL Flow Cytometer (Coulter). Анализ методом проточной цитометрии показал, что антитела 20D7S, как представлено в данных примерах, демонстрируют связывание нативного TYRP1, экспрессированного в линиях клеток человека SKmel28 и SKmel23 по сравнению с контрольным IgG1 человека. Аналогичным образом, анализ методом проточной цитометрии показывает, что представленные в данных примерах антитела СТА 99 и 20D7 демонстрируют связывание с нативным TYRP1, экспрессированным в линии клеток человека 624mel по сравнению с контрольным IgG1 человека. Поверхностный плазмонный резонанс/Анализ на приборе Биакор. Определение кинетики связывания антител с рекомбинантным TYRP1 человека при комнатной температуре в лаборатории (20-25 С) проводили методом поверхностного плазмонного резонанса, например, при помощи биосенсора Биакор (Pharmacia). Белок TYRP1 иммобилизовали на чипе СМ 5 сенсора и вводили антитела в концентрациях в диапазоне от 0,5 до 100 нМ. Снимали сенсорограммы для каждой концентрации и определяли константы скорости kon и koff. Kd, также обозначаемую как koff - константа скорости реакции диссоциации, при помощи программы BIA Evaluations 3.2. Ka, также обозначаемая как kon, представляет собой константу скорости реакции ассоциации (соединения). KD является мерой связывающей способности (аффинности); KD рассчитывают из соотношения констант скоростей koff/kon измеряемых в молярных концентрациях (М). Значения Ka, Kd и KD для антител, представленных в данных примерах, ТА 99, СТА 99, 20D7 и 20D7S, сведены в табл. 6. Таблица 6 Кинетика связывания антител с рекомбинантным Биакор-анализ связывания показал, что 20D7 и 20D7S с TYRP1 человека демонстрируют существенную специфическую связывающую способность, соответственно, 20D7 и 20D7S действительно являются кандидатами антител для терапии. Анализ комплементзависимой цитотоксичности (CDC). Клеточную линию меланомы человека 624mel промывали 3 раза и доводили до концентрации 106 жизнеспособных клеток/мл в подходящей среде, такой как AIM V Media (Invitrogen Life Technologies). Помещали 100 мкл клеток в 96-луночные плоскодонные планшеты Falcon и инкубировали с моноклональными антителами MAb 20D7 или hIgG (Jackson Immunoresearch, West Grove, PA), начиная с концентрации 3,7 мкг/мл, разбавляя 1:3, в течение 1 ч при 37 С. Добавляли комплимент кролика с низкой токсичностью (low-Tox-M) (Cedarlane Labs, Westbury, NY), разбавленный 1:5 в AIM V по 50 мкл/лунку и инкубировали в течение 1 ч при 37 С. Проводили подсчет жизнеспособных клеток при помощи TrypanBlue (Invitrogen Life Technologies). В табл. 7 представлены процентные данные по цитотоксичности при различных концентрациях антител, полученные в результате CDC-анализа. Полученные данные показывают, что антитела 20D7 и СТА 99 индуцируют комплементзависимую цитотоксичность по отношению к TYRP1 (+) 624mel клеткам человека in vitro. 20D7 вызывали зависимый от дозировки лизис клеток 624mel, опосредованный комплементом, причем полный лизис клеток при данном исследовании достигался при концентрации антител 3,7 мкг/мл. Соответственно, существует сильный ответ иммунного эффектора на CDC в случае антител 20D7 и СТА 99. % специфического лизиса = определенный % цитотоксичности - % цитотоксичности отрицательного контроля. Таблица 7 Данные CDC-анализа, показывающие активацию комплемента антителами 20D7 и СТА 99 Антителозависимая клеточная цитотоксичность (ADCC) в отношении меланомы человека in vitro. Клетки 624mel собирали и промывали в соответствующей среде, такой как среда AIM V media(Invitrogen Life Technologies), и помещали клетки в 96-луночный планшет Falcon с U-образным дном с плотностью 10000 клеток/лунку в объеме 100 мкл. Добавляли антитела с концентрацией 5 мкг/мл в объеме 50 мкл и инкубировали при 37 С в течение 0,5 ч с клетками-мишенями. Эффекторные клетки добавляли в объеме 50 мкл в различных соотношениях Е:Т (эффектор:мишень). Далее инкубировали планшеты в течение 4 ч при 37 С. После инкубации центрифугировали содержимое планшетов при 800 g и 100 мкг супернатанта аккуратно переносили в 96-луночные плоскодонные планшеты. Добавляли реагент,определяющий лактатдегидрогеназу, указанный производителем (Roche), и проводили детектирование при 490 нм. Контроль для анализа: спонтанный лизис мишени, максимальный лизис мишени (с добавлением 50 мкл 4% тритона). Лизис зависит от соотношения эффектора и мишени, при этом лизис 50% клеток-мишеней происходит при соотношении эффектор:мишень 100:1. При фиксированной концентрации (5 мкг/мл) 20D7 и СТА 99 активируют лизис клеток 624mel. В табл. 8 представлен процент клеточной цитотоксичности при различных отношениях клеток эффекторов к клеткам опухолей (Е:Т) в результате ADCC-анализа. Антитела 20D7S, 20D7 и СТА 99 индуцируют антителозависимую клеточную цитотоксичность в отношенииTYRP1 (+) 624mel клеток человека in vitro. Также наблюдается сильный иммунноэффекторный ответ на% цитотоксичности = (экспериментальное значение - спонтанный лизис мишени)/(максимальный лизис - спонтанный лизис мишени)100. Таблица 8 Антителозависимая клеточная цитотоксичность (ADCC) в отношении меланомы человека in vitro Анализ стабильности 20D7S и 20D7. 20D7 и 20D7S вводили в гель для SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия). Проводили электрофорез в геле с использованием прибора BioRad до тех пор, пока краситель бромфеноловый синий не доходил до конца гелевого блока. Проводили визуализацию разделенных белков при помощи красителя Кумасси. При анализе методом SDS PAGE более стабильные молекулы проявляются в виде одной полосы с несколькими (при наличии) свободными легкими или тяжелыми цепями, присутствие свободных легких цепей и свободных тяжелых цепей является свидетельством менее стабильных молекул. Анализ методомSDS PAGE антител 20D7 показал наличие явно свободных легких и тяжелых цепей. Анализ методомSDS PAGE антител 20D7S показал наличие очень небольшого количества свободных легких и тяжелых цепей. Соответственно, 20D7S является более стабильной молекулой IgG1, чем 20D7. Эффективность CTA99 и 20D7 в отношении лечения ксенотрансплантатов меланомы человека. Для последующих исследований под кожей рассчитывали объемы опухолей по формуле[/6(W1W2W2)], где W1 представляет собой диаметр наибольшей опухоли и W2 представляет собой диаметр наименьшей опухоли. % Т/С = 100(Вылеченный объем/Начальный объем)/(Объем контроля/Начальный объем). Статистический анализ проводили с использованием традиционных методов с доверительной вероятностью (р). Для исследований под кожей значение р рассчитывали на основе объема опухоли у животных, получающих антитела к TYRP, по отношению к объему опухоли контрольных животных. Для последующих исследований метастазов измеряли подавление опухоли путем подсчета узелков на поверхности легких. % подавления = 100(контрольные узелки - вылеченные узелки)/(контрольные узелки). Статистический анализ проводили с использованием традиционных методов с доверительной вероятностью (р). Для исследований метастазов значение р рассчитывали на основе количества наблюдаемых узелков у животных, получающих антитела к TYRP, по отношению к количеству узелков, наблюдаемых у контрольных животных. Активность самостоятельного действия антитела к TYRP1 in vivo на ксенотрансплантатных моделях меланомы человека. Культивированные клетки 624mel собирали, промывали и повторно суспендировали в растворе 50/50 Matrigel и среды RPMI 1640 (10% FBS инактивировано теплом). Для моделирования подкожной опухоли вводили под кожу 2106 клеток в левый бок бестимусных (nude) мышей. Когда опухоли достигали 200 мм 3, вводили мышам антитела к TYRP1 или контроль - IgG человека, введение антител проводили по 1 мг/мышь три раза в неделю. Измеряли опухоли при помощи штангенциркуля два раза в неделю и вычисляли % Т/С. Для оценки активности антител к TYRP1 в качестве самостоятельного агента invivo на ксенотрансплантатных моделях меланомы человека рост SKmel28-ксенотрансплантатов был подавлен под действием 20D7 по сравнению с контролем-IgG человека (Т/С=51%; Р=0,01 на 43 день). Было также показано, что созданные 624mel опухоли были значительно подавлены под действием 20D7. Рост опухоли был подавлен и достигал статистической значимости на 16 день после начала лечения антите- 15019517 лами (Т/С=44%; Р=0,01). Также 20D7 проверяли на противоопухолевую активность по действию на дополнительные ксенотрансплантаты меланомы человека. Было показано, что клеточные линии А 375 и 1102mel были статистически значимо подавлены при самостоятельном действии 20D7 за 11 дней после начала лечения антителом (Т/С=42%; Р=0,01 и Т/С=43%; Р=0,004 для А 375 и 1102mel соответственно). Лизаты кожи различных видов инкубировали с ТА 99 (5 мкг/мл) в течение 2 ч при комнатной температуре. Далее указанные лизаты осаждали протеином А и подвергали электрофорезу в геле SDS-PAGE в восстанавливающих и невосстанавливающих условиях с использованием градиента четырех 12% гелей. После электрофореза гели переносили на PVDF-мембрану (Invitrogen Life Technologies). Данную мембрану обрабатывали 20D7S (5 мкг/мл), а затем HRP-меченым IgG к человеческому (Zymed, South San Francisco,CA). Блот детектировали на хемилюминесцентном субстрате (KPL, Gaithersburg, MD). Полученные данные показали, что 20D7 легко дает поперечную реакцию с TYRP1 мыши. Тем не менее, у любых животных, получавших 20D7, не проявлялось явной токсичности. Масса тела и общий внешний вид животных,получавших 20D7, не существенно отличались по сравнению с контрольными мышами, получавшимиIgG. Влияние дозы антитела к TYRP1 в качестве самостоятельного агента на активность на ксенотрансплантатных моделях меланомы человека in vivo. Смешанные Skmel28-клетки в растворе 50/50 Matrigel и среды RPMI 1640 (10% FBS, инактивированный теплом) 2106 вводят в виде инъекции в левый бок бестимусных (nude) мышей. Когда опухоли достигали 200 мм 3, вводили мышам антитела к TYRP1 (6, 20 или 60 мг/кг) или контроль - IgG человека. Измеряли опухоли при помощи штангенциркуля два раза в неделю и вычисляли % Т/С. Исследование влияния дозы 20D7 на ксенотрансплантаты SKmel28 показало зависимость противоопухолевого ответа от дозы. Даже при дозе 6 мг/кг 20D7 значительно подавляли опухоли (Т/С=69%; Р 0,0001). Противоопухолевые эффекты при каждой дозе были статистически значимыми: 6 и 20 мг/кг(Т/С=50%; Р=0,04), 6 и 60 мг/кг (Т/С=19%; Р 0,003). Активность самостоятельного действия антитела к TYRPl in vivo на двух моделях метастатической меланомы.B16BL6 представляет собой агрессивную и спонтанно возникающую меланому мышей. Она образует метастазы в легких бестимусных мышей после внутривенного введения. КультивированныеSKmel23 и B16BL6 клетки меланомы собирали, промывали и повторно суспендировали в среде RPMI 1640 (10% FBS, инактивированного теплом). Модель 1: 1105 B16BL6 клеток вводили в виде инъекции внутривенно. На второй день после инъекции опухолей мышам вводили антитела к TYRP1 или контроль - IgG человека в трех различных концентрациях (200, 500 мкг/мышь и 1 мг/мышь). Мышей умерщвляли на 20-й день, удаляли легкие, подсчитывали узелки на поверхности легких и рассчитывали процент подавления. На поверхности легких мышей, обработанных IgG человека, обнаружены тяжелые метастазы, сравнительно меньшие метастазы обнаружены у обработанных 20D7 животных. Все три концентрации 20D7 снижали уровень легочных метастазов (подавление = 65, 74 и 95% соответственно). Модель 2: 1105 SKmel23 клеток человека вводили в виде инъекции внутривенно. На второй день после инъекции опухолей мышам вводили антитела к TYRP1 или контроль - IgG человека в трех различных концентрациях (200 и 500 мкг/мышь). Мышей умерщвляли на 20-й день, удаляли легкие, подсчитывали узелки на поверхности легких и рассчитывали процент подавления. Количество метастатических узелков значительно снижено при лечении 20D7 или СТА 99 при дозе 200 и 500 мкг/доза. 20D7 сокращали метастазы на 58 и 73% соответственно. СТА 99 сокращали метастазы на 63 и 75% соответственно. Данные результаты показывают, что в двух различных моделях 20D7 и СТА 99 подавляют метастазы меланомы. Исследование по сравнению антител 20D7 и 20D7S в отношении подавления роста опухоли in vivo на подкожных ксенотрансплантатах и метастатических моделях меланомы человека. Для модели подкожной опухоли собирали, промывали и повторно суспендировали культивированные клетки 624mel в 50/50 растворе Matrigel и среды RPMI 1640 (10% FBS, инактивированный теплом),затем вводили 2106 624mel клеток подкожно в виде инъекции в левый бок бестимусных мышей. Когда опухоли достигали 200 мм 3, вводили мышам 20D7 или 20D7S 40 мг/кг два раза в неделю. Измеряли опухоли при помощи штангенциркуля два раза в неделю и рассчитывали % Т/С. В модели подкожного ксенотрансплантата 624mel антитела 20D7 подавляли рост опухоли Т/С=21%, а для 20D7S Т/С=25%. Как 20D7, так и 20D7S подавляли рост опухоли в модели ксенотрансплантата. В случае метастатической модели собирали, промывали и повторно суспендировали культивированные клетки 888mel в среде RPMI 1640 (10% FBS, инактивированный теплом), вводили 888mel клетки внутривенно в виде инъекции. На второй день после инъекции опухолей мышам вводили антитела кTYRP1 или контроль - IgG человека. Мышей умерщвляли на 20-й день, удаляли легкие, подсчитывали узелки на поверхности легких и рассчитывали процент подавления. В метастатической модели 888mel у бестимусных мышей как 20D7, так и 20D7S значительно подавляли метастазы на поверхности легких: 20D7 ингибирование = 77%, р=0,0005; 20D7S ингибирование = 80%, р=0,0005. Как 20D7, так и 20D7S уменьшали метастазы меланомы в метастатической модели. Лечение комбинацией 20D7 и дакарбазином (DTIC) демонстрировало более сильную противоопухолевую активность по отношению к ксенотрансплантатам человека по сравнению с монотерапией. Для подкожной модели собирали, промывали и повторно суспендировали культивированные клетки 624mel в растворе 50/50 Matrigel и среды RPMI 1640 (10% FBS, инактивированный теплом). Вводили 2106 624mel клеток в виде инъекции в левый бок бестимусных мышей. Когда опухоли достигали 200 мм 3, вводили мышам антитела к TYRP1, DTIC или комбинацию антител к TYRP1 и DTIC. Антитела вводили 40 мг/кг один раз в неделю. DTIC вводили 5 мг/кг один раз в неделю. Измеряли опухоли при помощи штангенциркуля два раза в неделю и рассчитывали % Т/С. Для метастатической модели собирали, промывали и повторно суспендировали культивированные клетки меланомы SKmel23, 888mel и В 16 в среде RPMI 1640 (10% FBS, инактивированный теплом). Вводили SKmel23, 888mel и В 16 клетки меланомы внутривенно в виде инъекции. На второй день после инъекции опухоли вводили мышам антитела кTYRP1 или контроль - IgG человека. Мышей умерщвляли на 20-й день, удаляли легкие, подсчитывали узелки на поверхности легких и рассчитывали процент подавления. Как показано на подкожной модели, лечение комбинацией 20D7 и DTIC подавляло рост опухоли значительно лучше, чем 20D7 (р 0,001) или DTIC (p0,001) по отдельности. Таблица 9 Сводные данные по противоопухолевым активностям 20D7 in vivo В табл. 9 представлены сводные данные по противоопухолевым активностям in vivo для 20D7S по сравнению с монотерапией 20D7 или DTIC на 4 моделях. Противоопухолевые активности 20D7 in vivo представлены в виде процента подавления в метастатических моделях ( - статистическая значимость; н/о - не определено). Противоопухолевые активности 20D7 in vivo представлены в виде процента Т/С на подкожных моделях. Лечение комбинацией 20D7 и дакарбазином (DTIC) показало более высокую противоопухолевую активность по сравнению с монотерапией. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Моноклональное антитело или его фрагмент, специфически связывающиеся с TYRP1 (тирозиназазависимый белок-1) человека (SEQ ID NO: 28), которые содержат. 2. Антитело или его фрагмент по п.1, которые содержатVH, имеющую последовательность аминокислот 3. Антитело или его фрагмент по любому из предшествующих пунктов, содержащие тяжелую цепь,соответствующую SEQ ID NO: 30, и легкую цепь, соответствующую SEQ ID NO: 32. 4. Антитело или его фрагмент по любому из пп.1-3, содержащие две тяжелые цепи, соответствующие SEQ ID NO: 30, и две легкие цепи, соответствующие SEQ ID NO: 32. 5. Выделенная нуклеиновая кислота, содержащая последовательность нуклеотидов, кодирующих антитело или фрагмент по любому из пп.1-4. 6. Вектор экспрессии, содержащий нуклеиновую кислоту по п.5, функционально связанную с элементами для контроля экспрессии, так чтобы возможно было экспрессировать кодируемое антитело или фрагмент. 7. Рекомбинантная клетка, содержащая вектор экспрессии по п.6, способная продуцировать антите- 17019517 ло или фрагмент по любому из пп.1-4. 8. Антитело или фрагмент, получаемые посредством культивирования рекомбинантной клетки по п.7 и выделения указанного антитела или фрагмента. 9. Фармацевтическая композиция для лечения рака, содержащая антитело или фрагмент по любому из пп.1-4 или 8 в эффективном количестве и фармацевтически приемлемый носитель, разбавитель или эксципиент. 10. Применение антитела или фрагмента по любому из пп.1-4 или 8 в качестве лекарственного средства для лечения рака. 11. Применение антитела или фрагмента по любому из пп.1-4 или 8 при лечении рака. 12. Применение по п.11, где рак представляет собой злокачественную меланому.
МПК / Метки
МПК: A61P 35/00, C12N 15/13, A61K 39/395, C07K 16/30
Метки: антитела, tyrp1, применение
Код ссылки
<a href="https://eas.patents.su/30-19517-antitela-k-tyrp1-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела к tyrp1 и их применение</a>
Предыдущий патент: Лечение микробных инфекций
Следующий патент: Производные индола в качестве модуляторов рецептора α7 nachr
Случайный патент: Пестицидная композиция, способ ее получения и способ борьбы с сельскохозяйственным вредителем