Il-6-опосредованная иммунотерапия
Номер патента: 19512
Опубликовано: 30.04.2014
Авторы: Баум Питер Роберт, Мишер Линда, Лофквист Алан Кейт, Томпсон Питер Армстронг
Формула / Реферат
1. Изолированный полипептид, содержащий связывающий домен, специфичный к комплексу IL-6/IL-6R (IL-6xR), который:
(a) связывается с комплексом IL-6xR с большим сродством, чем с IL-6 или IL-6Rα по отдельности, или связывается с комплексом IL-6xR или с IL-6Rα по отдельности с большим сродством, чем только с IL-6; и
(b) конкурирует с мембранным gp130 за связывание с растворимым комплексом IL-6xR (комплексом "sIL-6xR"),
при этом указанный связывающий домен предпочтительно ингибирует транс-сигналинг IL-6 по отношению к цис-сигналингу IL-6,
причем указанный связывающий домен включает вариабельную область легкой цепи, содержащую последовательности участков CDR1, CDR2 и CDR3, определяющих комплементарность, каждый из которых по меньшей мере на 80% идентичен CDR1, CDR2 и CDR3 вариабельной области легкой цепи, соответствующей SEQ ID NO: 373-434 или 799-804; вариабельную область тяжелой цепи, содержащую последовательности участков CDR1, CDR2 и CDR3, определяющих комплементарность, каждый из которых по меньшей мере на 80% идентичен CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи, соответствующей SEQ ID NO: 435-496 и 805-810; или вариабельные области как указанной легкой, так и указанной тяжелой цепей или
причем указанный связывающий домен содержит последовательность, по меньшей мере на 80% идентичную вариабельной области легкой цепи, выбранной из группы, состоящей из SEQ ID NO: 373-434 или 799-804, вариабельной области тяжелой цепи, выбранной из группы, состоящей из SEQ ID NO: 435-496 или 805-810, или вариабельным областям как указанной легкой, так и указанной тяжелой цепей.
2. Полипептид по п.1, отличающийся тем, что указанный связывающий домен связывается с комплексом IL-6xR и с IL-6Rα по отдельности с большим сродством, чем только с IL-6.
3. Полипептид по п.1 или 2, отличающийся тем, что указанный связывающий домен не ингибирует передачу сигналов цитокинами семейства gp130, отличными от IL-6.
4. Полипептид по любому из пп.1-3, отличающийся тем, что указанный связывающий домен включает антигенсвязывающий домен одноцепочечного антитела.
5. Полипептид по любому из пп.1-4, отличающийся тем, что указанный связывающий домен включает вариабельную область легкой цепи, содержащую последовательности участков CDR1, CDR2 и CDR3, определяющих комплементарность, каждый из которых по меньшей мере на 80% идентичен CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области легкой цепи, соответствующей SEQ ID NO: 373-434 и 799-804; и вариабельную область тяжелой цепи, содержащую последовательности участков CDR1, CDR2 и CDR3, определяющих комплементарность, каждый из которых по меньшей мере на 80% идентичен CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области тяжелой цепи, соответствующей SEQ ID NO: 435-496 и 805-810.
6. Полипептид по любому из пп.1-5, отличающийся тем, что комплекс IL-6xR содержит последовательность аминокислот, состоящую из последовательности зрелого полипептида, соответствующей SEQ ID NO: 606.
7. Полипептид по п.1, дополнительно включающий первый линкер и участок константной области иммуноглобулина.
8. Полипептид по п.7, содержащий в направлении от аминоконца к карбоксильному концу (а) полипептидный связывающий домен, специфичный к IL-6xR комплексу, (b) первый линкер и (с) участок константной области иммуноглобулина.
9. Полипептид по п.7 или 8, отличающийся тем, что у указанного участка константной области отсутствуют эффекторные функции антителозависимой клеточно-опосредованной цитотоксичности (ADCC), антителозависимого клеточно-опосредованного фагоцитоза (ADCP), активации системы комплемента и комплементзависимой цитотоксичности (CDC) или их комбинация или такие функции присущи ему в минимальной степени.
10. Полипептид по п.9, отличающийся тем, что дополнительно сохраняет способность к связыванию с рецептором Fc.
11. Полипептид по п.10, отличающийся тем, что рецептор Fc представляет собой рецептор FcRn.
12. Полипептид по п.7 или 8, отличающийся тем, что указанный участок константной области содержит домен Fc иммуноглобулина или один или более доменов СН Fc-домена иммуноглобулина.
13. Полипептид по п.12, отличающийся тем, что один или более доменов СН Fc-домена иммуноглобулина содержат CH2 константную область и CH3 константную область.
14. Полипептид по п.13, отличающийся тем, что Fc-домен иммуноглобулина представляет собой Fc-домен IgG1, содержащий мутации L234A, L235A, G237A, E318A, K320A и K322A.
15. Полипептид по п.7 или 8, отличающийся тем, что указанный линкер представляет собой полипептид шарнирной области иммуноглобулина.
16. Полипептид по п.7 или 8, отличающийся тем, что указанный линкер выбран из группы, состоящей из SEQ ID NO: 497-604 и 823-828.
17. Мультиспецифичный одноцепочечный связывающий гибридный белок, содержащий первый связывающий домен, ковалентно связанный со вторым связывающим доменом посредством промежуточного домена, причем указанный первый связывающий домен включает связывающий домен, специфичный к комплексу IL-6/IL-6R (IL-6xR), который:
(a) связывается с комплексом IL-6xR с большим сродством, чем с IL-6 или IL-6Rα по отдельности, или связывается с комплексом IL-6xR или с IL-6Rα по отдельности с большим сродством, чем только с IL-6; и
(b) конкурирует с мембранным gp130 за связывание с растворимым комплексом IL-6xR (комплексом "sIL-6xR"),
причем указанный первый связывающий домен включает вариабельную область легкой цепи, содержащую последовательности участков CDR1, CDR2 и CDR3, определяющих комплементарность, каждый из которых по меньшей мере на 80% идентичен CDR1, CDR2 и CDR3 вариабельной области легкой цепи, соответствующей SEQ ID NO: 373-434 или 799-804; вариабельную область тяжелой цепи, содержащую последовательности участков CDR1, CDR2 и CDR3, определяющих комплементарность, каждый из которых по меньшей мере на 80% идентичен CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи, соответствующей SEQ ID NO: 435-496 и 805-810; или вариабельные области как указанной легкой, так и указанной тяжелой цепей или
причем указанный первый связывающий домен содержит последовательность, по меньшей мере на 80% идентичную вариабельной области легкой цепи, выбранной из группы, состоящей из SEQ ID NO: 373-434 или 799-804, вариабельной области тяжелой цепи, выбранной из группы, состоящей из SEQ ID NO: 435-496 или 805-810, или вариабельным областям как указанной легкой, так и указанной тяжелой цепей.
18. Мультиспецифичный одноцепочечный связывающий гибридный белок по п.17, отличающийся тем, что указанный второй связывающий домен представляет собой эктодомен рецептора, который не является антагонистом IL-6.
19. Мультиспецифичный одноцепочечный связывающий гибридный белок по п.17 или 18, отличающийся тем, что указанный промежуточный домен содержит константную область иммуноглобулина или ее часть, расположенную между первым и вторым связывающими доменами.
20. Мультиспецифичный одноцепочечный связывающий гибридный белок по п.19, отличающийся тем, что указанная константная область иммуноглобулина расположена между первым и вторым линкерами.
21. Мультиспецифичный одноцепочечный связывающий гибридный белок по любому из пп.17-20, отличающийся тем, что указанный промежуточный домен представляет собой домен димеризации.
22. Полинуклеотид, кодирующий полипептид по любому из пп.1-17 или гибридный белок по любому из пп.18-21.
23. Вектор экспрессии, содержащий полинуклеотид по п.22, функционально связанный с последовательностью контроля экспрессии.
24. Рекомбинантная клетка-хозяин, содержащая вектор экспрессии по п.23.
25. Композиция, содержащая полипептид по любому из пп.1-17, гибридный белок по любому из пп.18-21, полинуклеотид по п.22, вектор по п.23 или клетку-хозяина по п.24 и фармацевтически приемлемый носитель, растворитель или вспомогательное вещество.
26. Применение полипептида по любому из пп.1-17, гибридного белка по любому из пп.18-21, полинуклеотида по п.22, вектора по п.23, клетки-хозяина по п.24 или композиции по п.25 для получения лекарственного средства для лечения IL-6-ассоциированного заболевания у субъекта.
27. Применение по п.26, отличающееся тем, что указанное заболевание представляет собой воспалительное заболевание или рак.
28. Применение полипептида по любому из пп.1-17, гибридного белка по любому из пп.18-21, полинуклеотида по п.22, вектора по п.23, клетки-хозяина по п.24 или композиции по п.25 для получения лекарственного средства для ингибирования у субъекта транс-сигналинга IL-6.
29. Применение полипептида по любому из пп.1-17, гибридного белка по любому из пп.18-21, полинуклеотида по п.22, вектора по п.23, или клетки-хозяина по п.24, или композиции по п.25 для приготовления лекарственного средства для обеспечения конкурирования с мембранным gp130 за связывание с комплексом "sIL-6xR" у субъекта.
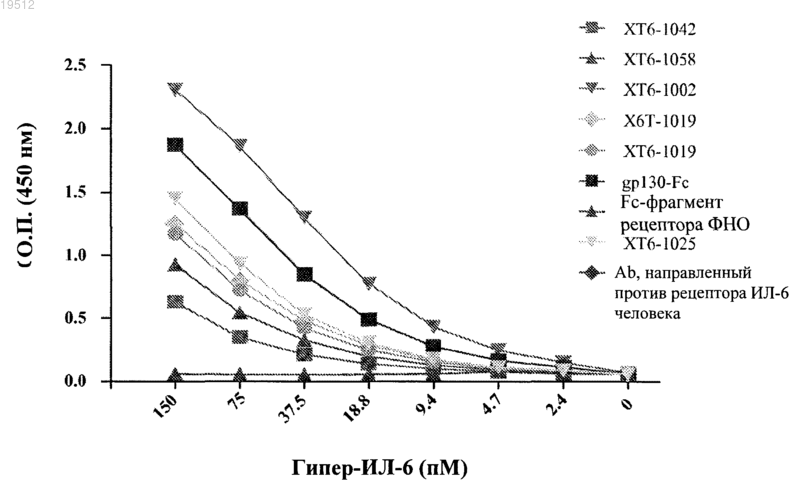
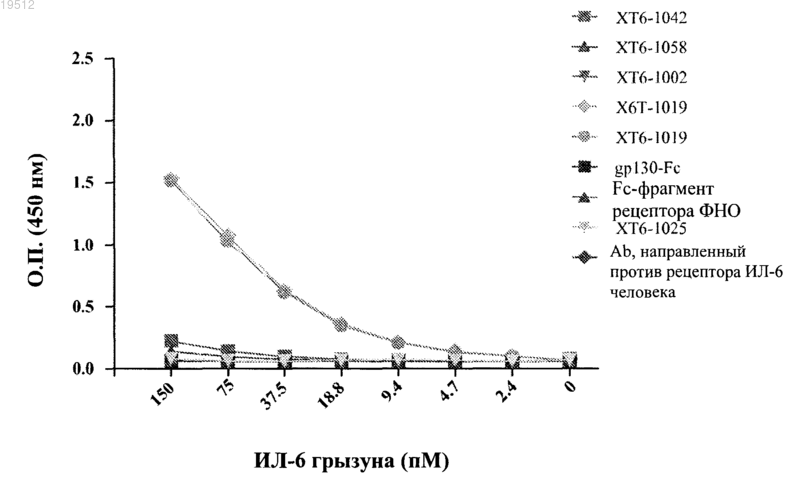
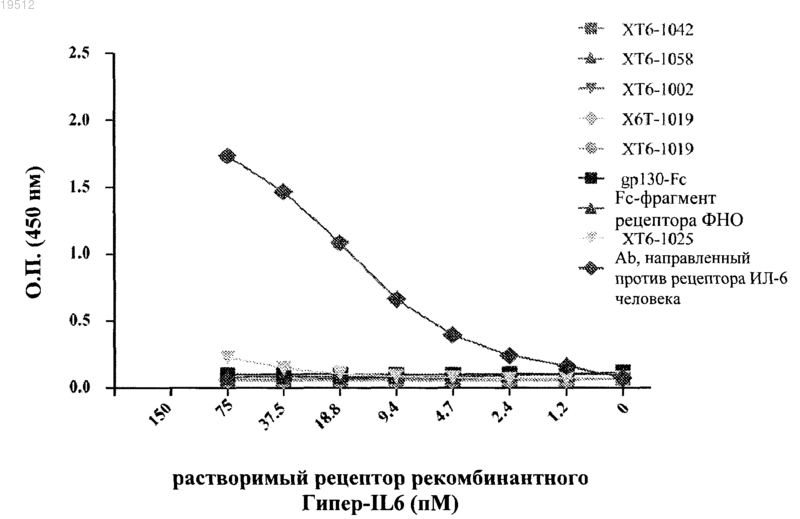
Текст
Изобретение относится к полипептиду связывающего домена и содержащим его гибридным белкам, распознающим комплекс IL-6/рецептор IL-6, а также композициям и способам их применения. Мишер Линда, Лофквист Алан Кейт,Баум Питер Роберт, Томпсон Питер Армстронг (US) Нилова М.И. (RU)(71)(73) Заявитель и патентовладелец: ЭМЕРДЖЕНТ ПРОДАКТ ДИВЕЛОПМЕНТ СИЭТЛ, ЛЛС (US) Интерлейкин-6 (IL-6) представляет собой плейотропный цитокин, регулирующий иммунные ответы хозяина, воспалительные процессы, гемопоэз (кроветворение) и онкогенез в организме хозяина. Биология IL-6 опосредуется многокомпонентной молекулярной системой с двумя различными типами передачи сигналов, действующими на частично совпадающие, но не идентичные популяции клеток. Эти типы принято обозначать как передача сигналов по типу "цис" (цис-сигналинг, также известный как "классическая" передача сигнала) и передача сигналов по типу "транс" (транс-сигналинг). При передаче сигналов по типу "цис" IL-6 связывается с рецепторами IL-6 (IL-6R) на поверхности клетки, а именно с лигандсвязывающим участком IL-6R, обозначаемым как IL-6R или CD126 (ранее обозначаемый как gp80). Связанный с клеткой комплекс IL-6/IL-6R, в свою очередь, связывается с лиганд-несвязывающим мембранным белком gp130, который участвует в передаче сигнала (также известным как IL-6ST, IL-6R или CD130), что приводит к димеризации gp130 и инициации сигнального пути. Таким образом, передача сигналов по типу "цис" ограничивается подгруппой типов клеток, экспрессирующих IL-6R, которая, как правило, включает митоген-активируемые B-клетки, различные T-клетки,моноциты периферической крови и определнные опухоли. Полученный трхкомпонентный комплекс на поверхности клетки собирается в устойчивый гексамер, характеризующийся соотношениемIL-6:IL-6R:gp130 как 2:2:2 (Boulanger et al. (2003), Science, 300:2101). При передаче сигналов по типу "транс" растворимые комплексы IL-6R ("sIL-6R") с IL-6 и образующиеся комплексы sIL-6xR могут связываться с любой клеткой, экспрессирующей gp130 (но не с клетками, которые также экспрессируют IL-6R, Taga et al. (1989), Cell. 58:573), и активировать е. Множество, возможно все или почти все клетки в теле человека экспрессируют gp130. Поскольку gp130 присутствует повсеместно, передача сигналов по типу "транс" может оказывать воздействие на множество типов клеток и, таким образом, иногда быть причиной заболеваний. Мембранный белок gp130 также присутствует в растворимой форме (sgp130), которая может связываться с комплексом sIL-6xR в системе кровообращения. Тем не менее, комплекс sIL-6xR одинаково хорошо связывается с мембранным и растворимым gp130 (см. Jones et al. (2005), J. Interferon Cytokine Res. 25:241). Поэтому молярный избыток sgp130 может ингибировать передачу сигналов по типу "транс" (посредством уменьшения количества доступных комплексов sIL-6xR в системе кровообращения), что, однако, не повлияет в значительной степени на передачу сигналов по типу "цис", так как сродство sgp130 к связанному с клеткой комплексу IL-6/IL-6R на порядки ниже по величине, чем сродство к таким комплексам белка gp130, расположенного на поверхности клетки (см., например, Jostock et al. (2001), Eur. J.Biochem. 268:160). Таким образом, предположили, что sgp130 можно применять для ингибирования активности IL-6 (см., например, Jostock et al. (2001), Eur. J. Biochem. 268:160). Однако, помимо IL-6, gp130 является общим белком переноса сигнала для семейства gp130-цитокинов. Последние включают фактор ингибирования лейкемии (LIF), цилиарный нейротрофический фактор (CNTF), нейропоэтин (NP), кардиотрофин-подобный цитокин (CLC), онкостатин М (OSM), IL-27, IL-31 и кардиотрофин-1 (СТ-1). Таким образом, несмотря на то, что sgp130 может ингибировать передачу сигналов по типу "транс", введение такого соединения пациентам может привести к возникновению некоторых нежелательных побочных эффектов. Повышенная продукция IL-6 вовлечена в процессы различных болезней, включая болезнь Альцгеймера, аутоиммунные заболевания (как, например, ревматоидный артрит, красная волчанка), воспалительные процессы, инфаркт миокарда, болезнь Педжета, остеопороз, тврдые опухоли (как, например,рак толстой кишки, почечно-клеточная карцинома (RCC), рак простаты и рак мочевого пузыря), определнные злокачественные опухоли нервной ткани, B-клеточные злокачественные опухоли, как синдром Каслмана, некоторые подтипы лимфомы, хроническую лимфоцитарную лейкемию (CLL) и, в частности,множественную миелому. В некоторых случаях IL-6 вовлечн в пролиферативные пути, так как этот цитокин действует наряду с другими факторами, такими как гепарин-связывающий эпителиальный фактор роста (ГС-ЭФР) и фактор роста гепатоцитов. Известны различные антитела-антагонисты IL-6 и IL-6R. Например, у Way et al. (заявка на патент США 2007/0178098) описаны антитела, специфичные к IL-6, которые стерически блокируют присоединение IL-6 или комплекса sIL-6xR к gp130 (см. также патент США 7291721). Например, в отношении IL-6R Kishimoto (патент США 5670373) описывает антитела против IL-6R, ингибирующие активность IL-6. Краткое описание чертежей На фиг. 1 А-1 С показано, что мультиспецифичные гибридные белки (Xceptor, Эксцептор), содержащие один из нескольких различных Hyper-IL-6-связывающих доменов, соединнных с эктодоменом рецептора фактора некроза опухолей (TNFR), специфично связываются с Hyper-IL-6, при измерении способом ИФА, причм указанные мультиспецифичные гибридные белки связываются предпочтительно сHyper-IL-6, а не с IL-6 или IL-6R по отдельности. Лишь два тестированных гибридных белка связываются с IL-6 и ни один не связывается с sIL-6R. На фиг. 2 показано, что мультиспецифичные гибридные белки, которые содержат эктодомен TNFR,соединнный с одним из нескольких различных Hyper-IL-6-связывающих доменов, связываются с TNF-1 019512(ФНО-), при измерении способом ИФА. На фиг. 3 показано, что мультиспецифичные гибридные белки, которые содержат один из нескольких различных Hyper-IL-6-связывающих доменов, соединнный с эктодоменом TNFR, могут одновременно связываться с Hyper-IL-6 и TNF-, при измерении способом ИФА. На фиг. 4 показано, что мультиспецифичные гибридные белки, которые содержат один из нескольких различных Hyper-IL-6-связывающих доменов, соединнный с эктодоменом TNFR, блокируют связывание gp130 с Hyper-IL-6, при измерении способом ИФА. На фиг. 5 А и 5 В показано, что мультиспецифичные гибридные белки, которые содержат один из нескольких различных Hyper-IL-6-связывающих доменов, соединнный с эктодоменом TNFR, блокируют индуцированную (A) IL-6 или (В) Hyper-IL-6 пролиферацию клеток линии TF-1. На фиг. 6 показано, что мультиспецифичные гибридные белки, которые содержат один из нескольких различных Гипер-IL-6-связывающих доменов, соединнный с эктодоменом TNFR, блокируют связывание TNF- с TNFR, при измерении способом ИФА. На фиг. 7 показано, что мультиспецифичные гибридные белки, которые содержат эктодомен TNFR,соединнный с одним из нескольких различных Гипер-IL-6-связывающих доменов, блокируют индуцированную TNF- гибель клеток L929. На фиг. 8 показано, что малые модульные иммунофармацевтические гибридные белки (SMIP),которые содержат один из нескольких различных Гипер-IL-6-связывающих доменов (обозначаемых какTRU(S6)-1004, 1007, 1008, 1013, 1018, 1019, 1029 и 1038), связываются с Hyper-IL-6, при измерении способом ИФА. На фиг. 9 показано, что гибридные белки SMIP TRU(S6)-1063-TRU(S6)-1066 связываются с HyperIL-6, при измерении способом ИФА. На фиг. 10 показано, что гибридный белок SMIP TRU(S6)-1002 связывается с комплексомIL-6:sIL-6R, при измерении способом Biacore. На фиг. 11 А и В показаны результаты исследований сайта связывания связывающих доменов, направленных против IL-6, описанных в настоящем описании. На фиг. 12 показано, что мультиспецифичные гибридные белки, которые содержат эктодоменTNFR, соединнный с IL-6-связывающим доменом, не связывался с клетками линии HepG2. На фиг. 13 показано, что мультиспецифичные гибридные белки, которые содержат эктодоменTNFR, соединнный с IL-6-связывающим доменом, блокируют индуцированный HIL-6 SAA-ответ (ответ на сывороточный амилоид А) у мышей. На фиг. 14 показано, что мультиспецифичные гибридные белки, которые содержат эктодоменTNFR, соединнный с IL-6-связывающим доменом, блокируют индуцированный HIL-6 gp130-ответ у мышей. На фиг 15 А и В показаны результаты исследований способности мультиспецифичных гибридных белков, которые содержат эктодомен TNFR, соединнный с IL-6-связывающим доменом, блокировать индуцированный TNF- SAA-ответ у мышей, через 2 и 24 ч после введения соответственно. Подробное описание Настоящее изобретение в целом относится к полипептидам, которые содержат связывающий участок или домен, специфичный к комплексу IL-6 с мембранной или растворимой формой рецептора IL-6(IL-6R) (в настоящем описании комплекс обозначен как IL-6xR, в случае когда он относится к мембранному IL-6R или растворимому IL-6R (sIL-6R) комплексу, и обозначен как sIL-6xR, когда он относится только к комплексу IL-6 с sIL-6R), который предпочтительно ингибирует опосредуемую IL-6 передачу сигналов по типу "транс", по сравнению с опосредованной IL-6 передачей сигналов по типу"цис", например, путм конкуренции с мембранным gp130 за связывание с sIL-6xR, усиления способности растворимого gp130 связываться с sIL-6xR, обладания большим сродством к комплексу IL-6xR, по сравнению с IL-6 или IL-6R по отдельности, либо присутствию любой комбинацией указанных характеристик. Связывающий домен, специфичный к IL-6xR, согласно некоторым вариантам реализации, также не ингибирует передачу сигналов цитокинами семейства gp130, отличными от IL-6. Согласно другим вариантам реализации такой полипептидный связывающий домен, специфичный к комплексу IL-6xR,также может быть частью гибридного белка, в составе которого он соединн с амино- или карбоксильным концом домена димеризации (например, константной области иммуноглобулина или участка в составе этой области, такого как домены CH2 и CH3 IgG), как у малых модульных иммунофармацевтических белках (SMIP) или разврнутых в противоположном направлении молекулах SMIP (обозначенных в настоящем описании как PIMS) и т.п. Настоящее описание также обеспечивает гибридные белки, которые содержат множественные связывающие домены, являющиеся моноспецифичными (и мультивалентными) или мультиспецифичными. Например, моноспецифичные мультивалентные гибридные белки могут содержать по меньшей мере два связывающих домена, специфичных к одной и той же мишени, такой как комплекс IL-6xR, указанный в настоящем описании. Мультиспецифичные гибридные белки, являющиеся примерами белков, содержащих связывающий домен, специфичный к IL-6xR, как описано в настоящем изобретении, могут содержать по меньшей мере один дополнительный связывающий участок или домен, специфичный к мишени, отличной от IL-6xR, такой как TNF- или TGF-. Кроме того, настоящее изобретение обеспечивает молекулы нуклеиновых кислот, которые кодируют такие связывающие полипептиды или гибридные белки, а также векторы и клетки-хозяева для рекомбинантной продукции указанных молекул, композиции и способы применения указанных связывающих полипептидов или гибридных белков согласно настоящему изобретению в различных диагностических и терапевтических областях, включая лечение по меньшей мере одного симптома заболевания или нарушения, такого как гиперпролиферативные (например, миелома), аутоиммунные или воспалительные (например, ревматоидный артрит) заболевания и улучшение состояния больного. Соединения и композиции согласно настоящему описанию также можно применять в качестве инструментов для научноисследовательской работы в экспериментах in vitro и клеточных экспериментах по изучению биологической активности IL-6 и связанных с ним молекул. Прежде чем продолжить более детальное изложение настоящего описания, может быть полезным для его понимания предоставление определений некоторых использованных в настоящем описании терминов. Дополнительные определения изложены в описании ниже. В рамках настоящего описания следует понимать, что любой диапазон концентрации, процентного количества, соотношения или целой величины включает значение любой целой величины в пределах данного диапазона и, когда уместно, е дробь (такую как 1/10 и 1/100 целого числа), если не оговорено иначе. Также считается, что любой числовой диапазон, указанный в данном описании и относящийся к любой физической характеристике, такой как количество полимерных субъединиц, размер или толщина,включает любое целое значение величины в пределах данного диапазона, если не оговорено иначе. В настоящем описании "приблизительно" или "состоящий практически из" означает 20% от указанного диапазона, величины или структуры, если не оговорено иначе. В настоящем описании термины "включает" и "содержит" в настоящем описании используются как синонимы. Также следует считать, что употребляемые в единственном числе термины относятся к одному или нескольким перечисляемым компонентам. Использование альтернативы (например, "или") означает одну из указанных альтернатив, обе альтернативы или любую их комбинацию. Кроме того, следует считать, что отдельные соединения или группы соединений, представляющие собой производные различных комбинаций структур и заместителей, указанных в настоящем изобретении, описаны в той же мере, как если бы каждое соединение или группа соединений были описаны индивидуально. Таким образом, выбранные специфичные варианты структур или заместителей входит в рамки настоящего изобретения."Связывающий домен" или "связывающий участок" согласно настоящему описанию может представлять собой, например, любой белок, полипептид, олигопептид или пептид, обладающий способностью специфично распознавать и связываться с биологической молекулой (например, IL-6, IL-6R), или комплексу из нескольких одинаковых или различных молекул, или совокупности молекул, или молекулярному агрегату, независимо от того, является он устойчивым образованием или нет (например, комплекс IL-6xR). Такие биологические молекулы включают белки, полипептиды, олигопептиды, пептиды,аминокислоты или их производные; липиды, жирные кислоты или их производные; углеводы, сахариды или их производные; нуклеотиды, нуклеозиды, нуклеопептиды, молекулы нуклеиновых кислот или их производные; гликопротеины, гликопептиды, гликолипиды, липопротеины, протеолипиды или их производные; другие биологические молекулы, которые могут присутствовать, например, в биологическом образце; а также любые комбинации вышеуказанных соединений. Связывающие участки включают любые природные, синтетические, полусинтетические или рекомбинантным образом полученные партнры для присоединения к биологической молекуле или другой мишени, представляющей интерес. Известны различные процедуры для идентификации связывающих доменов согласно настоящему описанию, которые специфично связываются с определнной мишенью, включая Вестерн блоттинг, ИФА или анализBiacore. Каждый из терминов, известных специалисту в данной области и относящихся к технологиям, использующим антитела, имеет значение, принятое в данной области, если в настоящем описании не оговорено иначе. Например, обозначения "VL" и "VH" относятся к вариабельным связывающим областям лгких и тяжлых цепей антител соответственно. Вариабельные связывающие области состоят из отдельных, строго определнных участков, известных как "гипервариабельные участки" (участки, определяющие комплементарность) (CDR) и "каркасные участки" (FR). Обозначения "CL" и "CH" относятся к"константным областям иммуноглобулинов", т.е. константным областям, полученным из соответственно лгких или тяжлых цепей антител, притом, что далее область может быть далее разделена на доменыCH1, CH2, CH3 и CH4 константных областей, в зависимости от изотипа антитела (IgA, IgD, IgE, IgG, IgM), из которого данный участок получен. Часть доменов константных областей составляет участок Fc (участок"кристаллизуемого фрагмента"), который содержит домены, ответственные за эффекторные функции иммуноглобулинов, такие как ADCC (антителозависимая клеточно-опосредованная цитотоксичность),ADCP (антителозависимый клеточно-опосредованный фагоцитоз), CDC (комплементзависимая цитотоксичность) и фиксация комплемента, связывание с рецепторами Fc, большее время полужизни in vivo относительно полипептидов, не содержащих участок Fc, связывание с белком А и, возможно, даже транс-3 019512 плацентарный перенос (см. Capon et al. (1989), Nature, 337:525). Кроме того, полипептиды, содержащие участок Fc, обладают способностью к димеризации или мультимеризации. "Шарнирный участок", также обозначаемый в настоящем описании как "линкер", представляет собой последовательность аминокислот, вставленную между вариабельными и константными областями одной и той же цепи антитела и соединяющую их друг с другом, про которую известно в данной области, что она обеспечивает гибкость антител и антитело-подобных молекул, играя роль шарнира. Доменная структура иммуноглобулинов может быть модифицирована таким образом, что антигенсвязывающие домены и домены, ответственные за эффекторные функции, могут быть поменяны между классами и подклассами иммуноглобулинов. Структура и функции иммуноглобулинов описаны, например, у Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, ColdSpring Harbor, 1988). Более разврнутое введение и подробная информация в отношении всех аспектов рекомбинантных технологий антител доступны в научном пособии Recombinant Antibodies (John WileySons, NY, 1999). Исчерпывающие материалы о подробных лабораторных протоколах инженерии антител доступны у R. Kontermann and S. Dbel, Eds., The Antibody Engineering Lab Manual (Springer Verlag,Heidelberg/New York, 2000)."Производное" согласно данному описанию относится к химически или биологически модифицированным формам соединений, структурно схожих с исходным соединением, которые (фактически или теоретически) могут быть получены из исходного соединения. Как правило, "производное" отличается от"аналога" тем, что исходное соединение может являться начальным материалом для получения "производного", в то время как необязательно, чтобы исходное соединение являлось начальным материалом для получении "аналога". Производное может обладать химическими или физическими характеристиками, отличными от таковых, присущих первичному соединению. Например, производное может быть более гидрофильным либо обладать изменнной реакционной способностью (например, CDR, содержащий замену аминокислоты, приводящую к изменению сродства к мишени) в сравнении с исходным соединением. Термин "биологический образец" включает образцы крови, биоптаты, эксплантаты тканей, культуры органов, биологических жидкостей или любых других тканей, клетки и другие препараты, взятые у субъекта или из другого биологического источника. Субъект или биологический источник может представлять собой человека или другое животное, первичную клеточную культуру или культивированную линию клеток, включая генетически модифицированные клеточные линии, которые могут содержать интегрированные в хромосомы или эписомальные рекомбинантные последовательности нуклеиновых кислот, линии гибридных соматических клеток, иммортализированные линии клеток или линии клеток,которые могут быть иммортализированы, дифференцированные линии клеток или линии клеток, которые могут дифференцировать, трансформированные клеточные линии и т.п. Согласно последующим вариантам реализации настоящего изобретения субъектом или биологическим источником может быть субъект или биологический источник с заболеванием, нарушением или патологическим состоянием,включая злокачественные заболевания, нарушения или патологические состояния, нарушения, связанные с B-клетками, либо субъект или биологический источник, подверженный риску такого заболевания, нарушения или состояния. Согласно определнным вариантам реализации субъект или биологический источник может быть подвергнут риску гиперпролиферативного, воспалительного или аутоиммунного заболевания, в то время как согласно другим вариантам реализации настоящего изобретения субъект или биологический источник может быть не подверженным риску указанных заболеваний, нарушений или патологических состояний. Антагонисты IL-6. Как указано выше, настоящее описание обеспечивает полипептиды, содержащие связывающий участок или домен, специфичный к комплексу IL-6xR и обладающий следующими характеристиками:(1) большее сродство к комплексу IL-6xR, чем к IL-6 или IL-6R по отдельности, (2) конкурирование с мембранным или растворнным gp130 за связывание с комплексом а sIL-6xR, (3) предпочтительное ингибирование передачи сигналов IL-6 типа "транс" в сравнении с "цис" и (4) отсутствие ингибирования передачи сигналов цитокинами семейства gp130, отличными от IL-6. Согласно определнным вариантам реализации специфичный к комплексу IL-6xR связывающий домен согласно настоящему описанию обладает следующими характеристиками: (1) большее сродство к комплексу IL-6xR, чем к IL-6 или IL-6R по отдельности, (2) конкурирование с мембранным gp130 за связывание с комплексом а sIL-6xR,(3) предпочтительное ингибирование передачи сигналов IL-6 типа "транс" в сравнении с "цис" и (4) отсутствие ингибирования передачи сигналов цитокинами семейства gp130, отличными от IL-6. Например,связывающий участок или домен, специфичный к IL-6xR, может представлять собой вариабельный связывающий домен иммуноглобулина или его производное, такое как антитело, Fab, scFv и т.п. В контексте настоящего описания следует считать, что связывающий участок или домен, специфичный к IL-6xR,не является белком gp130, описанным в данном изобретении.IL-6, где рецептор IL-6 (также известный как, например, IL-6R, IL-6RA, IL-6R1 и CD 126) представляет собой мембранный белок (обозначенный в данном описании как mIL-6R или mIL-6R) или белок в растворимой форме (обозначенный в данном описании как sIL-6R или sIL-6R). Термин "IL-6R" охватывает как mIL-6R, так и sIL-6R. Согласно одному из вариантов реализации IL-6xR включает комплекс IL-6 иsIL-6R. Согласно определнным вариантам реализации компоненты комплекса IL-6xR связаны посредством одной или нескольких ковалентных связей. Например, карбоксильный конец IL-6R может быть соединн с аминоконцом IL-6 посредством пептидного линкера с получением комплекса, известного какHyper-IL-6 (Hyper-IL-6, см., например, Fischer et al. (1997), Nat. Biotechnol. 15:142). Линкер Hyper-IL-6 может состоять из соединения, образующего поперечные связи, длиной от 1 до 50 аминокислот или из комбинации таких соединений. Кроме того, линкер Hyper-IL-6 может включать домен димеризации, такой как домен Fc или участок константной области иммуноглобулина. Согласно определнным вариантам реализации компоненты комплекса IL-6xR связаны нековалентно, например, водородными связями,электростатическими взаимодействиями, силами Ван-дер-Ваальса, солевыми мостиками, гидрофобными взаимодействиями и т.п. или посредством любых комбинаций вышеуказанного. Например, IL-6 и IL-6R могут быть естественным образом связаны нековалентно (например, как это происходит в природе, либо в случае с синтетическими или рекомбинантными белками) или каждый из них может быть соединн с доменом димеризации, таким как домен Fc иммуноглобулина, для увеличения стабильности комплекса. В настоящем описании "gp130" относится к белку передачи сигнала, который связывается комплексом IL-6xR. Белок gp130 может быть присоединн к мембране (mgp130), может быть в растворимой(sgp130) или любой другой функциональной форме. Типичные белки gp130 включают последовательность, описанную в GenBank Accession No. NP 002175.2, либо могут быть в растворимой форме, либо в форме его производного (см., например, Narazaki et al. (1993), Blood, 82:1120 или Diamant et al. (1997),FEBS Lett. 412:379). В качестве иллюстрации и не желая ограничиваться существующей теорией, белокmgp130 может связываться с комплексом IL-6/mILR или IL-6/sILR, в то время как sgp130 главным образом связывается с комплексом IL-6/SILR (см. Scheller et al. (2006), Scand. J. Immunol. 63:321). Таким образом, определнные варианты реализации связывающих доменов или содержащих их гибридных белков согласно настоящему описанию могут ингибировать передачу сигналов по типу "транс" комплексомIL-6R по отдельности, и посредством конкурирования с комплексом sIL-6xR за связывание с gp130,предпочтительно mgp130, либо посредством усиления связывания sgp130 к комплексу sIL-6xR. Связывающий домен согласно настоящему описанию "конкурирует" с gp130 за связывание с sIL-6xR, когда(1) связывающий домен или содержащий его гибридный белок не допускает связывания gp130 с sIL-6xR и связывающий домен связывается с sIL-6xR со сродством, равным или превышающим сродство gp130 кsIL-6xR, или (2) связывающий домен или содержащий его гибридный белок усиливает или стимулирует связывание sgp130 с комплексом sIL-6xR, таким образом сокращая время, в течение которого комплексsIL-6xR доступен для соединения с mgp130. Связывающие домены и содержащие их гибридные белки согласно настоящему описанию могут быть "иммуноспецифичными", т.е. способными к связыванию в желаемой степени эффективности,включая "специфичное или селективное связывание", с мишенью, не связываясь в то же время в значительной степени с другими компонентами, присутствующими в тестовом образце, когда они связываются с молекулой-мишенью со сродством или Ka (т.е. равновесной константой связывания определнного взаимодействия присоединения, с единицей измерения М-1), например, превышающим или равным приблизительно 105, 106, 107, 108, 109, 1010, 1011, 1012 или 1013 М-1. К связывающим доменам с "высоким сродством" относятся связывающие домены, значение Ka которых не ниже 107 М-1, не ниже 108 М-1, не ниже 109 М-1, не ниже 1010 М-1, не ниже 1011 М-1, не ниже 1012 М-1, не ниже 1013 М-1 или выше указанных значений. В качестве альтернативы сродство может характеризоваться равновесной константой диссоциации (Kd) определнного взаимодействия связывания, с единицей измерения М (например, от 10-5 до 10-13 М). Степени сродства полипептидов связывающих доменов и гибридных белков согласно настоящему описанию могут быть легко определены с помощью стандартных способов (см., например,Scatchard et al. (1949), Ann. N.Y. Acad. Sci. 51:660 and U.S. Patent No. 5283173, 5468614, анализ Biacore или его эквиваленты). Согласно одному аспекту связывающий домен-антагонист IL-6 согласно настоящему описанию обладает сродством к комплексу sIL-6xR, в 2-1000 раз превышающим его сродство к IL-6 или IL-6R по отдельности. Присоединяясь к комплексу sIL-6xR, связывающий домен согласно настоящему описанию предпочтительно ингибирует передачу сигналов по типу "транс" IL-6. Согласно определнным вариантам реализации сродство связывающего домена к комплексу sIL-6xR приблизительно соответствует сродству gp130 к комплексу sIL-6xR, где фраза "приблизительно соответствует" означает, что указанное сродство равно сродству gp130 либо превышает его не более чем вдвое. Согласно определнным вариантам реализации сродство связывающего домена к комплексу sIL-6xR выше сродства gp130 к sIL-6xR по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 50, 100, 1000 или более раз. Например, если сродствоCytokine Netw. 10:337), то связывающий домен, обладающий сродством, по меньшей мере в 10 раз превышающим сродство gp130 к комплексу sIL-6xR, будет характеризоваться константой диссоциации (Kd),приблизительно равной 0.2 нМ или ниже. Согласно другим вариантам реализации связывающий домен-антагонист IL-6 в настоящем описании содержит полипептидную последовательность, которая (а) связывается с комплексом sIL-6xR со сродством, превышающим сродство к IL-6 или IL-6R по отдельности по меньшей мере в 2-1000 раз и(b) конкурирует с gp130 за связывание с комплексом sIL-6xR или усиливает связывание gp130 с комплексом sIL-6xR. Согласно другим вариантам реализации полипептидный связывающий доменантагонист IL-6 согласно настоящему описанию, который связывается с комплексом sIL-6xR со сродством, превышающим его сродство к IL-6 или IL-6R по отдельности по меньшей мере в 2-1000 раз, также может (i) в более существенной степени либо предпочтительно ингибировать передачу сигналов по типу"транс" IL-6 в сравнении с передачей сигналов по типу "цис", (ii) не ингибировать передачу сигналов цитокинами семейства gp130, отличными от IL-6, (iii) предпочтительно ингибировать передачу сигналов по типу "транс", нежели сигналов по типу "цис" и не ингибировать в значительной степени передачу сигналов цитокинами семейства gp130, отличными от IL-6, (iv) может обладать двумя или несколькими вышеуказанными характеристиками или (v) может обладать всеми вышеуказанными характеристиками. Согласно определнным вариантам реализации полипептидный связывающий домен-антагонистIL-6 согласно настоящему описанию связывается с комплексом sIL-6xR со сродством, по меньшей мере в 2-1000 раз превышающим его сродство к IL-6 или IL-6R по отдельности, и предпочтительно ингибирует передачу сигналов IL-6 по типу "транс" в сравнении с сигналами по типу "цис". Фраза "предпочтительно ингибировать передачу сигналов IL-6 по типу "транс" в сравнении с сигналами по типу "цис" значит воздействовать на передачу сигналов по типу "транс" до такой степени, что активность sIL-6xR явно понижается, в то время как передача сигналов IL-6 по типу "цис" не меняется в значительной мере (т.е. ингибирование минимально отсутствует либо его невозможно измерить). Например, биологический маркер активности sIL-6xR (например, экспрессия антихимотрипсина (ACT) в острой фазе клетками HepG2) может быть количественно определн для обнаружения ингибирования передачи сигналов по типу"транс". Показательный эксперимент описывается у Jostock et al. (Eur. J. Biochem., 2001) - вкратце, клетки HepG2 могут быть стимулированы для сверхэкспрессии ACT в присутствии sIL-6xR (передача сигнала по типу "транс") или IL-6 (передача сигнала по типу "цис"), но добавление sgp130 будет ингибировать сверхэкспрессию ACT, вызванную sIL-6xR, не влияя существенно на экспрессию, вызванную IL-6. Таким же образом, полипептидный связывающий домен согласно настоящему описанию, который предпочтительно ингибирует передачу сигналов IL-6 по типу "транс" в сравнении с передачей сигналов по типу "цис", будет ингибировать сверхэкспрессию ACT, вызванную sIL-6xR (т.е. ингибировать передачу сигналов по типу "транс"), не влияя существенно на экспрессию, вызванную IL-6 (т.е. не снижая передачу сигналов по типу "цис" так, что это выявляется). Этот и другие известные в данной области способы можно применять для определения предпочтительного ингибирования передачи сигналов по типу"транс" IL-6 в сравнении с передачей сигналов по типу "цис" (см., например, другие биологические маркеры, описанные у Sporri et al. (1999), Int. Immunol. 11:1053; Mihara et al. (1995), Br. J. Rheum. 34:321;Chen et al. (2004), Immun. 20:59). Согласно другим вариантам реализации передача сигналов, опосредованная цитокинами семействаgp130, отличными от IL-6, не ингибируется в существенной степени связыванием с полипептидными связывающими доменами и содержащими их гибридными белками согласно настоящему описанию. Например, передача сигналов по типу "транс" комплексом IL-6xR посредством gp130 будет ингибироваться, но передача сигналов одним или несколькими другими цитокинами семейства gp130 будет ингибироваться в минимальной степени или не будет ингибироваться вообще. Примерами этого может послужить передача сигналов факторами ингибирования лейкемии (LIF), цилиарным нейротрофическим фактором(CNTF), нейропоэтином (NP), кардиотрофин-подобным цитокином (CLC), онкостатином М (OSM), IL27, IL-31, кардиотрофином-1 (СТ-1) или любой их комбинацией. Кроме того, взаимодействие связывающего домена с молекулой-мишенью может служить мерой кинетической ассоциации или диссоциации указанного взаимодействия. Кинетическая ассоциация (ka),также обозначаемая согласно данному описанию как kON, применяется для измерения скорости, с которой будет происходить взаимодействие и связывание. Согласно одному из вариантов реализации с помощью kON можно определить вероятность того, что свободный связывающий домен свяжется с молекулой-мишенью, в зависимости от среднего периода времени, в течение которого свободная молекула находится на поверхности клетки, к которой она может присоединиться, и от концентрации свободных молекул в данной области поверхности клетки. ka (kON) измеряется в 1/Мс. Согласно определнным вариантам реализации значение kON может превышать приблизительно 103/Мс, приблизительно 104/Мс, приблизительно 105/Мс, приблизительно 106/Мс, приблизительно 107/Мс, приблизительно 108/Мс, приблизительно 109/Мс, приблизительно 1010/Мс или выше. В случае, когда связывающий домен представляет собой scFv, значение kON может меняться от менее чем 104 до приблизительно 107/Мс (Ulrik et al. (2000),-6 019512Cancer Res. 60:6434; Xavier and Willson (1998), Biophys. J. 74:2036). Значение kON связывающего домена может быть определено с помощью способов, известных в данной области, таких как поверхностный плазмонный резонанс (Leonard et al. (2007), J. Immunol. Methods, 323:172). Кинетическая диссоциация (kd), также обозначаемая согласно данному описанию как kOFF, применяется для измерения скорости диссоциации комплекса, и, таким образом, "время удерживания" молекулы-мишени, связанной с полипептидным связывающим доменом согласно настоящему описанию, kd(kOFF) измеряется в 1/с. Специалистам в данной области будет очевидно, что предпочтительный период полужизни in vivo связывающих доменов согласно настоящему описанию будет в пределах нескольких дней или недель, однако, в то время как концентрация связывающих доменов может быть низкой, количество молекул-мишеней может быть весьма высоким, так как продуцирование IL-6 и sIL-6 во время патологических состояний может быть усиленным (см., например, Lu et al. (1993), Cytokine, 5:578). Таким образом, согласно определнным вариантам реализации значение kOFF связывающих доменов согласно настоящему описанию может составлять приблизительно 10-5/с (например, приблизительно 1 день) и менее. Согласно определнным вариантам реализации kOFF может быть равным приблизительно 10-1/с,приблизительно 10-2/с, приблизительно 10-3/с, приблизительно 10-4/с, приблизительно 10-5/с, приблизительно 10-6/с, приблизительно 10-7/с, приблизительно 10-8/с, приблизительно 10-9/с, приблизительно 10-10/с и менее (см. Graff et al. (2004), Protein Eng. Des. Sel. 17:293). Связывающие домены согласно настоящему описанию могут быть получены способами согласно настоящему описанию или различными способами, известными в данной области техники (см., например, патенты США 6291161; 6291158). Источники включают генные последовательности антител различных видов (которые могут быть в форме собственно антител и фрагментов sFv, scFv или Fab, в виде библиотек фагов), включая человека, верблюдовых (верблюдов, дромадеров или лам; Hamers-CastermanNatl. Acad. Sci. (USA), 95:11804), рыб (Nguyen et al. (2002), Immunogenetics, 54:39), грызунов, птиц, овец; последовательности, кодирующие библиотеки пептидов случайного состава, или последовательности,кодирующие заранее заданное разнообразие аминокислот в петлевых доменах альтернативных, не относящихся к антителам каркасов, таких как домены фибриногена (см., например, Weisel et al. (1985),Science, 230:1388), домены Кунитца (см., например, патент США 6423498), домены липокалинов (см.,например, WO 2006/095164), V-подобные домены (см., например, заявку на патент США 2007/0065431), лектиновые домены С-типа (Zelensky and Gready (2005), FEBS J. 272:6179), mAb2 илиFcab (см., например, патентные заявки РСТWO 2007/098934; WO 2006/072620) и т.п. Кроме того,традиционные стратегии получения гибридом с применением одноцепочечных синтетических комплексов IL-6xR, таких как комплекс IL-6xR человека или Hyper-IL-6, как иммуногенов в подходящих системах (например, мышах, HuMAb mouse, TC mouse, KM-mouse, ламах, курицах, крысах, хомяках,кроликах и т.п.) могут применяться для получения доменов согласно настоящему описанию. В иллюстративном примере связывающие домены согласно настоящему описанию, специфичные к комплексу IL-6xR, идентифицировали в фаговой библиотеке фрагментов Fab (см. Hoet et al. (2005),Nature Biotechnol. 23:344) путм отбора по связыванию с синтетическим комплексом IL-6xR. Синтетический комплекс IL-6xR, использованный в этом способе, характеризуется структурой N-IL-6R(frag)-L1IL-6(frag)-L2-ID-C, где N - аминоконец, С - карбоксильный конец, ILR(frag) - полноразмерный фрагмент IL-6R, IL-6(frag) - фрагмент IL-6, L1 и L2 - линкеры, a ID - промежуточный или домен димеризации, такой как домен Fc иммуноглобулинов. Более конкретно, IL-6xR (представляющий собой форму Hyper-IL-6), использованный для идентификации связывающих доменов, специфичных к комплексу IL-6xR, обладает следующей структурой, в направлении от аминоконца к карбоксильному концу: (а) центральный фрагмент, состоящий из 212 аминокислот IL-6R, исключающий первые 110 аминокислот полноразмерного белка, и участок карбоксильного конца, который зависит от используемой изоформы (см. GenBank Accession No. NP 000556.1,изоформа 1 или NP 852004.1, изоформа 2), соединнный с (2) линкером G3S, в свою очередь соединнным с (3) фрагментом карбоксильного конца IL-6 длиной 175 аминокислот (т.е. исключающим первые 27 аминокислот полноразмерного белка; GenBank Accession No. NP 000591.1), который также соединн с(4) линкером, представляющим собой шарнирный домен IgG2A, как указано в SEQ ID NO: 589, который,в завершение, соединн с доменом димеризации, содержащим домен Fc иммуноглобулина G1 (IgG1). Согласно определнным вариантам реализации домен димеризации, включающий домен Fc иммуноглобулина G1, содержит одну или несколько мутированных аминокислот, указанных ниже (т.е. аминокислоты по указанным позициям заменены на другие): лейцин в позиции 234 (L234), лейцин в позиции 235(L235), глицин в позиции 237 (G237), глютамат в позиции 318 (Е 318), лизин в позиции 320 (K320), лизин в позиции 322 (K322), либо любой из комбинаций из вышеуказанного (согласно нумерации ЕС). Например, любая из вышеуказанных аминокислот может быть заменена (мутирована) на аланин. Согласно другим вариантам реализации домен Fc IgG1 характеризуется тем, что каждый из остатков L234, L235, G237,E318, K320 и K322 (согласно нумерации ЕС) замещн остатком аланина (т.е. L234A, L235A, G237A,Е 318 А, K320A и K322A соответственно). Согласно одному из вариантов реализации комплекс IL-6xR, использованный для идентификации связывающих доменов-антагонистов IL-6 согласно настоящему описанию, характеризуется последовательностью аминокислот, соответствующей SEQ ID NO: 606. Согласно определнным вариантам реализации обеспечиваются полипептиды, которые содержат связывающие домены, специфичные к комплексуIL-6xR, где IL-6xR представляет собой sIL-6xR и характеризуется последовательностью аминокислот,соответствующей SEQ ID NO: 606. Согласно другим вариантам реализации полипептиды, которые содержат связывающие домены, специфичные к комплексу IL-6xR, (1) обладают большим сродством к комплексу sIL-6xR, чем к IL-6 или IL-6R по отдельности, где sIL-6xR характеризуется последовательностью аминокислот, соответствующей SEQ ID NO: 606, (2) конкурируют с мембранным или растворимым gp130 за связывание с комплексом sIL-6xR, который характеризуется последовательностью аминокислот, соответствующей SEQ ID NO: 606, (3) предпочтительно ингибируют прередачу сигналов по типу"транс" IL-6, но не сигналов по типу "цис", (4) не ингибируют передачу сигналов цитокинами семействаgp130, отличными от IL-6, (5) характеризуются любой комбинацией свойств по пунктам (1)-(4) или(6) характеризуются всеми свойствами по пунктам (1)-(4). Другие типичные комплексы IL-6xR, которые могут применяться для идентификации связывающих доменов согласно настоящему описанию или применяться в качестве стандартных комплексов для количественного определения вышеуказанных характеристик присоединения, описаны, например, в заявках на патент США 2007/0172458; 2007/0031376 и патентах США 7198781, 5919763. Согласно некоторым вариантам реализации связывающие домены-антагонисты IL-6 согласно настоящему описанию содержат домены VH и VL, специфичные к IL-6, IL-6R или комплексу IL-6xR, как описано в настоящем изобретении, предпочтительно к IL-6 человека, IL-6R человека или комплексуIL-6xR человека. Согласно определнным вариантам реализации домены VH и VL являются доменами VH и VL грызуна (например, мыши или крысы), гуманизироваными доменами или доменами человека. Примеры связывающих доменов, содержащих такие домены VH и VL, описаны в SEQ ID NO: 435-496 и 805810 и в 373-434 и 799-804 соответственно. Согласно другим вариантам реализации обеспечиваются полипептидные связывающие домены, специфичные к комплексу IL-6xR, которые связываются с IL-6xR с большим сродством, чем с IL-6 или IL-6R по отдельности, и конкурируют с mgp130 за связывание с комплексом sIL-6xR либо усиливают связывание sgp130 с sIL-6xR, причм связывающий домен характеризуется последовательностью по меньшей мере на 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99.5 или на 100% идентичной последовательности аминокислот одного или нескольких вариабельных участков лгкой цепи (VL, или одного или нескольких вариабельных участков тяжлой цепи (VH), или обоим участкам,описанным в SEQ ID NO: 373-434, 799-804 и 435-496 и 805-810 соответственно, причм каждый из участков, определяющих комплементарность (CDR), содержит до трх замен аминокислот (т.е. многие из замен находятся в области каркасного участка). Согласно другим вариантам реализации связывающие домены согласно настоящему описанию содержат домены VH и VL, специфичные к IL-6, IL-6R или комплексу IL-6xR, как описано вSEQ ID NO: 435-496 и 805-810, 373-434, 799-804 соответственно, последовательность которых по меньшей мере на 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 99.5% идентична последовательности аминокислот таких доменов VH, VL или обоих, причм каждый CDR содержит от 0 до 3 замен аминокислот. Например, последовательность аминокислот доменов VH, VL или обоих согласно настоящему описанию может быть по меньшей мере на 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92,93, 94, 95, 96, 97, 98, 99 или на 99.5% идентичной последовательности аминокислот домена VH (например, аминокислоты 512-631), домена VL (например, аминокислоты 649-759) или обоих доменов соответственно, взятых из типичного связывающего домена, присущего TRU(XTo)-1002 (см. SEQ ID NO: 608),причм каждый CDR содержит от 0 до 3 замен аминокислот. Термины "идентичный" или "идентичен на%", применнные в контексте двух или более последовательностей полипептидов или нуклеиновых кислот, относятся к двум или более последовательностям или фрагментам последовательностей, являющимся идентичными либо характеризующимся определнным процентом идентичных остатков аминокислот или нуклеотидов в пределах определнного участка (например, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичности), при сравнении и выравнивании для получения максимального соответствия в окне сравнения, либо в пределах обозначенного участка, осуществляемом с помощью способов, известных в данной области техники,таких как алгоритм сравнения последовательностей, выравнивание вручную или визуальное исследование. Например, предпочтительные алгоритмы, которые применяются для определения степени идентичности последовательностей в процентах, включают алгоритмы BLAST и BLAST 2.0, описанные уAltschul et al. (1977), Nucleic Acids Res. 25:3389 и Altschul et al. (1990), J. Mol. Biol. 215:403 соответственно. Согласно любому из указанных вариантов или каким-либо другим вариантам реализации в данном описании домены VL и VH могут быть расположены и в обратном порядке, а также могут разделяться аминокислотным линкером длиной до 30 аминокислот, как описано в данном изобретении, либо любой иной последовательностью аминокислот, способной выполнять функцию промежуточной последова-8 019512 тельности, не препятствующей взаимодействию двух связывающих фрагментов. Согласно определнным вариантам реализации линкер, связывающий домены VH и VL, содержит последовательность аминокислот, описанную в SEQ ID NO: 497-604 и 823-828, такой как Linker 47 (SEQ ID NO: 543) или Linker 80(SEQ ID NO: 576). Мультиспецифичные связывающие домены должны содержать по меньшей мере два специфичных связывающих фрагмента, по аналогии с более известной организацией антител у верблюдовых, либо по меньшей мере четыре специфичных связывающих фрагмента, по аналогии с более известной организацией парных цепей VL и VH антител у млекопитающих. Согласно другим вариантам реализации связывающие домены-антагонисты IL-6 согласно настоящему описанию могут содержать один (предпочтительно CDR3) или несколько участков, определяющих комплементарность ("CDR"), либо множественные копии одного или нескольких таких CDR, полученных, произведнных или синтезированных путм модификации из вариабельных областей антител против IL-6, IL-6R или фрагментов scFv и Fab антител против комплекса IL-6xR либо из вариабельных участков их тяжлой или лгкой цепи. В данной области техники существуют различные описания CDR, например Kabat, Chothia, AbM и контактные описания. Описание Kabat основывается на вариабельности последовательности и является наиболее часто используемым описанием, позволяющим предсказать участки CDR (Johnson et al. (2000),Nucleic Acids Res. 28:214). Описание Chothia основывается на месторасположении структурных участков петель (Chothia et al. (1986), J. Mol. Biol. 196:901; Chothia et al. (1989), Nature 342:877). Описание AbM,представляющее собой нечто среднее между способами Kabat и Chothia, - это интегрированный набор программ для моделирования структуры антител, производимый компанией Oxford Molecular Group(Martin et al. (1989), Proc. Natl. Acad. Sci. (USA), 86:9268; Rees et al., ABMTM, компьютерная программа для моделирования вариабельных областей антител, Оксфорд, Великобритания; Oxford Molecular, Ltd.). Недавно было разработано ещ одно описание, известное как контактное описание (см. MacCallum et al.(1996), J. Mol. Biol. 5:732), которое основано на анализе доступных комплексных кристаллических структур. Домены CDR тяжлой цепи традиционно обозначаются как Н 1, Н 2 и Н 3, где нумерация идт поочердно, в направлении от аминоконца к карбоксильному концу. CDR-H1 состоит из 10-12 остатков и начинается через четыре остатка после цистеина согласно описаниям Chothia и AbM или через пять остатков согласно описанию Kabat. За Н 1 может располагаться триптофан, триптофан-валин, триптофанизолейцин или триптофан-аланин. Согласно описанию AbM длина Н 1 составляет приблизительно 10-12 остатков, в то время как описание Chothia исключает четыре последних остатка. CDR-H2 начинается через 15 остатков после Н 1 согласно описаниям Kabat и AbM, непосредственно за последовательностью лейцин-глутамат-триптофан-изолейцин-глицин (известны также некоторые вариации этой последовательности),за Н 2,как правило,следует последовательность лизин/аргининлейцин/изолейцин/валин/фенилаланин/треонин/аланин-треонин/серин/изолейцин/аланин. Согласно описанию Kabat длина Н 2 составляет 16-19 остатков, в то время как описание AbM предполагает длину Н 2,равную 12 остаткам. CDR-H3, как правило, начинается через 33 остатка после конца Н 2, домену Н 3 обычно предшествует последовательность аминокислот цистеин-аланин-аргинин, а непосредственно за Н 3 расположен глицин. Длина Н 3 составляет 3-25 остатков. Домены CDR лгкой цепи традиционно обозначаются как L1, L2 и L3, где нумерация идт поочердно, в направлении от аминоконца к карбоксильному концу. CDR-L1, как правило, начинается в районе 24-го остатка и обычно следует за цистеином. За CDR-L1 всегда находится триптофан, являющийся первым остатком одной из следующих последовательностей: триптофан-тирозин-глютамин, триптофанлейцин-глютамин, триптофан-фенилаланин-глютамин или триптофан-тирозин-лейцин. Длина CDR-L1 составляет приблизительно 10-17 остатков. CDR-L2 начинается приблизительно через 16 остатков после конца L1, как правило, следуя за остатками изолейцин-тирозин, валин-тирозин, изолейцин-лизин или изолейцин-фенилаланин. Длина CDR-L2 составляет приблизительно 7 остатков. CDR-L3, как правило,начинается через 33 остатка после конца L2 непосредственно за цистеином, а после конца L3, как правило, находится последовательность фенилаланин-глицин-ХХХ-глицин. Длина L3, как правило, составляет 7-11 остатков. Таким образом, связывающий домен согласно настоящему описанию может содержать один доменCDR3 вариабельной области антител против IL-6, IL-6R, против IL-6xR либо он может содержать множество идентичных или различных CDR. Согласно определнным вариантам реализации связывающие домены-антагонисты IL-6 согласно настоящему описанию содержат домены VH и VL, содержащие каркасный участок и участки CDR1, CDR2 и CDR3, где (а) домен VH содержит последовательность аминокислот CDR3 тяжлой цепи, соответствующую одной из следующих SEQ ID NO: 435-496 и 805-810; или(b) домен VL содержит последовательность аминокислот CDR3 лгкой цепи, соответствующую одной из следующих SEQ ID NO: 373-434 и 799-804; или (с) связывающий домен содержит последовательность аминокислот VH согласно (а) и последовательность аминокислот VL согласно (b); либо связывающий домен содержит последовательность аминокислот VH согласно (а) и последовательность аминокислот VL согласно (b), при этом VH и VL принадлежат одной и той же упомянутой последовательности. Согласно другим вариантам реализации связывающие домены согласно настоящему описанию содержат доменыVH и VL, специфичные к IL-6, IL-6R или комплексу IL-6xR, включающие каркасные участки и участкиCDR1, CDR2 и CDR3, где (а) домен VH содержит последовательность аминокислот CDR1, CDR2 и CDR3 тяжлой цепи, соответствующую одной из следующих SEQ ID NO: 435-496 и 805-810; или (b) домен VL содержит последовательность аминокислот CDR1, CDR2 и CDR3 лгкой цепи, соответствующую одной из следующих SEQ ID NO: 373-434 и 799-804; или (с) связывающий домен содержит последовательность аминокислот VH согласно (а) и последовательность аминокислот VL согласно (b); либо связывающий домен содержит последовательность аминокислот VH согласно (а) и последовательность аминокислот VL согласно (b), при этом VH и VL принадлежат одной и той же упомянутой последовательности. Типичные участки CDR вариабельных областей лгкой и тяжлой цепей антагонистов IL-6 приведены вSEQ ID NO: 1-186 и 787-792, 187-372, 793-798 соответственно. Последовательности аминокислот вариабельных участков лгкой и тяжлой цепей антагонистов IL-6 приведены в SEQ ID NO: 373-434 и 799-804,435-496, 805-810 соответственно. Согласно любому из вариантов реализации, описанных в настоящем изобретении и включающих определнные CDR, связывающий домен антигониста IL-6 может содержать (i) домен VH, характеризующийся последовательностью аминокислот, которая по меньшей мере на 80, 85, 90, 91, 92, 93, 94, 95,96, 97, 98 или 99% идентична последовательности домена VH, описанного в SEQ ID NO: 435-496 и 805810, причм в каждом CDR присутствует 0-3 замен аминокислот; или (ii) домен VL, характеризующийся последовательностью аминокислот, которая по меньшей мере на 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична последовательности домена VL, описанного в SEQ ID NO: 373-434 и 799-804, причм в каждом CDR присутствует 0-3 замен аминокислот; или (iii) домен VH согласно (i) и домен VL согласно(ii); или домен VH согласно (i) и домен VL согласно (ii), причм VH и VL принадлежат одной и той же упомянутой последовательности. Согласно определнным вариантам реализации связывающий домен-антагонист IL-6 согласно настоящему описанию может представлять собой иммуноглобулинподобный домен, такой как каркас иммуноглобулина. Рассматриваемые в настоящем описании каркасы иммуноглобулинов включают scFv,Fab, антитела или антитела, состоящие лишь из тяжлых цепей. Согласно другим вариантам реализации обеспечиваются анти-IL-6 или анти-IL-6xR антитела (например, не человеческие, такие как мышиные или крысиные, а также химерные, гуманизированные, человеческие), либо фрагменты Fab, либо фрагменты scFv, характеризующиеся последовательностью аминокислот, которая по меньшей мере на 80, 85,90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентична последовательности аминокислот доменов VH иVL, описанных в SEQ ID NO: 435-496 и 805-810, а также 373-434 и 799-804 соответственно. Указанная последовательность может также обладать одной или несколькими из следующих характеристик:(1) большее сродство к комплексу IL-6xR, чем к IL-6 или IL-6R по отдельности, (2) конкурирует с мембранным или растворимым gp130 за связывание с комплексом sIL-6xR либо усиливает связывание gp130 с комплексом sILBxR, (3) предпочтительно ингибирует передачу сигналов IL-6 по типу "транс", но не сигналов по типу "цис" и (4) не ингибирует передачу сигналов цитокинами семейства gp130, отличными от IL-6. Такого рода антитела, фрагменты Fab или scFvs могут применяться в рамках любого из способов, описанных в данном изобретении. Согласно определнным вариантам реализации настоящее описание обеспечивает полипептиды, которые содержат связывающий домен, представляющий собой антагонист IL-6 (т.е. который может ингибировать передачу сигналов IL-6 по типу "цис" и "транс"). Согласно другим вариантам реализации антагонист IL-6 согласно настоящему описанию не ингибирует передачу сигналов цитокинами семейства gp130, отличными от IL-6. Типичные антагонисты IL-6 включают связывающие домены, специфичные к IL-6, IL-6R или IL-6xR, такие как связывающие домены вариабельных областей иммуноглобулинов или их производные (например, антитела, фрагменты Fab, scFv и т.п.) В качестве альтернативы связывающие домены согласно настоящему описанию могут представлять собой часть каркаса, отличного от иммуноглобулинового. Другие рассматриваемые каркасы включают молекулу домена А, домен фибронектина III, антикалин, синтетическую связывающую молекулу, состоящую из повторов анкирина, аднектин, домены типа ингибитора Кунитца или аффитело к домену белка AZ. Как описано в настоящем изобретении, данное изобретение рассматривает варианты и производные связывающих доменов, такие как вариабельные участки лгкой и тяжлой цепей и участки CDR. В одном из примеров обеспечиваются варианты вставок, в которых один или несколько остатков аминокислот дополняют последовательность аминокислот специфичного связывающего агента. Вставки могут быть расположены на любом из концов или на обоих концах белка либо во внутренних участках последовательности аминокислот сецифического связывающего агента. Различные продукты согласно данному описанию также включают зрелые специфичные связывающие агенты, т.е. специфичные связывающие агенты, лидирующие или сигнальные последовательности которых удалены таким образом, что полученные белки несут дополнительные остатки на аминоконце. Дополнительные остатки на аминоконце могут быть получены из других белков либо могут включать один или несколько остатков, происхождение которых невозможно выявить. Рассматриваются полипептиды, содержащие дополнительный остаток метионина в позиции -1, как и полипептиды согласно настоящему описанию, содержащие остатки метионина или лизина в позициях -2 и -1. Варианты с дополнительными остатками метионина, метионина- 10019512 лизина или лизина (либо одним или несколькими основными остатками) особенно пригодны для интенсивной продукции рекомбинантных белков в бактериальных клетках-хозяевах. В настоящем описании "аминокислоты" относятся к природным (существующим в природе) аминокислотам, замещнным природным аминокислотам, неприродным аминокислотам, замещнным неприродным аминокислотам или любым их комбинациям. Обозначения природных аминокислот в настоящем описании указаны полностью либо посредством стандартного одно- или трхбуквенного кода. Природные полярные аминокислоты включают аспарагин (Asp или N) и глютамин (Gln или Q); основные аминокислоты включают аргинин (Arg или R), лизин (Lys или K), гистидин (His или Н) и их производные; кислотные аминокислоты включают аспарагиновую кислоту (Asp или D) и глютаминовую кислоту (Glu или Е) и их производные. Природные гидрофобные аминокислоты включают триптофан (Trp или W),фенилаланин (Phe или F), изолейцин (Ile или I), лейцин (Leu или L), метионин (Met или M), валин (Val или V) и их производные; к другим неполярным аминокислотам относят глицин (Gly или G), аланин (Ala или A), пролин (Pro или Р) и их производные. Природные аминокислоты средней степени полярности включают серин (Ser или S), треонин (Thr или Т), тирозин (Tyr или Y), цистеин (Cys или С) и их производные. Если не оговорено иначе, любая указанная в настоящем описании аминокислота может быть вD- или L-конфигурации. Замещнные варианты включают такие гибридные белки, в которых один или несколько остатков аминокислот в последовательности удалены и замещены альтернативными остатками. Согласно некоторым вариантам реализации такие замены консервативны по природе, тем не менее, к данному описанию относятся также неконсервативные замены. Аминокислоты могут быть классифицированы по физическим характеристикам и влиянию на вторичную и третичную структуру белка. В данной области техники замена классифицируется как консервативная, если замещающая аминокислота обладает характеристиками, сходными с заменяемой аминокислотой. Стандартные консервативные замены указаны в табл. 1 В качестве альтернативы консервативные аминокислоты могут быть сгруппированы, как описано у Варианты или производные могут также содержать дополнительные остатки аминокислот, полученные в процессе применения специфических систем экспрессии. Например, применение коммерчески доступных векторов, экспрессирующих желаемый полипептид как компонент гибридного продукта с глутатион-S-трансферазой (GST), обеспечивает желаемый продукт, несущий дополнительный остаток глицина в позиции -1 после удаления компонента GST. Варианты, получаемые в результате экспрессии в других векторных системах, также рассматриваются в данном описании, включая варианты с гистидиновыми концами, внедрнными в последовательность аминокислот, как правило, в области амино- или карбоксильного конца. Варианты с делециями, где один или несколько остатков аминокислот в связывающем домене согласно настоящему описанию удалены, также рассматриваются в данном изобретении. Делеции могут быть осуществлены в области одного или обоих концов гибридного белка либо в центральной части последовательности аминокислот. Гибридные белки, содержащие связывающие домены-антагонисты IL-6. Как далее описано, полипептидный связывающий домен согласно настоящему изобретению может также быть частью гибридного белка, в составе которого он соединн с амино- или карбоксильным концом либо с обоими концами в качестве промежуточного домена (например, константного участка иммуноглобулина или его части). Типичные гибридные белки согласно настоящему описанию включают малые модульные иммунофармацевтические гибридные белки SMIP, обратнонаправленные им белки PIMS,гибридные белки, содержащие моноспецифичные, мультивалентные связывающие домены и т.п. Один или несколько связывающих доменов могут быть внедрены в промежуточный домен посредством линкера, известного в данной области техники или описанного в данном изобретении. В настоящем описании "промежуточный домен" относится к последовательности аминокислот, которая непосредственно служит как каркас для одного или нескольких связывающих доменов таким образом, что гибридные белки будут существовать главным образом (например, 50% или более в популяции гибридных белков) или в значительной степени (например, 90% или более в популяции гибридных белков) как одноцепочечные полипептиды в составе композиции. Например, определнные промежуточные домены могут обладать структурной функцией (например, функцией линкера для повышения эластичности или жсткости) либо биологической функцией (например, повышенным периодом полужизни в плазме, например в крови человека). Типичные промежуточные домены, которые могут повысить период полужизни гибридных белков в плазме, включают альбумин, трансферрин, каркасный домен, присоединяющийся к белкам сыворотки, или подобный им белок, или их фрагменты. Согласно предпочтительным вариантам реализации промежуточный домен мультиспецифичного гибридного белка согласно данному описанию представляет собой "домен димеризации", относящийся к последовательности аминокислот, которая может способствовать ассоциации по меньшей мере двух одноцепочечных полипептидов или белков посредством нековалентных или ковалентных взаимодействий,таких как водородные связи, электростатические взаимодействия, Ван-дер-Ваальсовы силы, дисульфидные мостики, солевые мостики, гидрофобные взаимодействия и т.п., либо посредством любой их комбинации. Типичные домены димеризации включают константные области тяжлых цепей иммуноглобулинов или их фрагменты (например, CH2CH3). Следует считать, что домены димеризации также могут способствовать формированию мультимерных комплексов более высокого уровня, включая тримеры, тетрамеры, пентамеры, гексамеры, гептамеры, октамеры и т.п."Константный фрагмент" согласно настоящему описанию относится к предпочтительной пептидной, полипептидной или белковой последовательности, соответствующей части или целой молекуле одного или нескольких константных участков иммуноглобулинов или их производным, в то время как не все домены константных участков присущи исходному антителу. Согласно некоторым вариантам реализации у доменов константных участков гибридных белков согласно настоящему описанию отсутствуют функции антителозависимой клеточно-опосредованной цитотоксичности (ADCC), антителозависимого клеточно-опосредованного фагоцитоза (ADCP), активации системы комплемента и комплементзависимой цитотоксичности (CDC) или такие функции присущи им в минимальной степени, в то время как такие домены не теряют способность к связыванию с некоторыми рецепторами Fc (таким как FcRn) и сохраняют относительно долгое времени полужизни in vivo. Согласно определнным вариантам реализации связывающий домен согласно данному описанию соединн с константным участком человеческогоIgG1 или с его фрагментом, причм константный участок человеческого IgG1 или его фрагмент содержит одну или несколько мутированных аминокислот: лейцин в позиции 234 (L234), лейцин в позиции 235(L235), глицин в позиции 237 (G237), глютамат в позиции 318 (Е 318), лизин в позиции 320 (K320), лизин в позиции 322 (K322) либо любой из комбинаций из вышеуказанного (согласно нумерации ЕС). В данной области техники известны способы получения мутаций внутри домена Fc или вне его, которые могут изменить характер взаимодействия Fc с его рецепторами (CD16, CD32, CD64, CD89, FcR1,FcRn) или с компонентом системы комплемента C1q (см., например, патент США 5624821; Presta(2002), Curr. Pharma. Biotechnol. 3:237). Определнные варианты реализации согласно настоящему описанию включают композиции, содержащие иммуноглобулины или гибридные белки, которые содержат константный участок или фрагмент человеческого IgG, у которых способность связываться с FcRn и белку А сохранена, а домен Fc более не взаимодействует с другими рецепторами Fc или с C1q или взаимодействует с ними в минимальной степени. Например, связывающий домен согласно настоящему описанию может быть соединн с константным участком человеческого IgG1 или его фрагментом, притом что аспарагин в позиции 297 (N297 согласно нумерации ЕС) заменн на другую аминокислоту для понижения вероятности гликозилирования в данном сайте или исключения такой вероятности и, таким образом,предотвращает эффективное связывание Fc с FcR и C1q. Другой типичной мутацией является P331S,исключающая связывание с C1q, но не влияющая на связывание с Fc. Согласно другим вариантам реализации домен Fc иммуноглобулина может характеризоваться изменнной схемой гликозилирования в сравнении со стандартной последовательностью иммуноглобулинов. Например, любая из множества генетических техник может применяться для изменения одного или нескольких определнных остатков аминокислот, формирующих сайт гликозилирования (см. Со et al.(1993), Mol. Immunol. 30:1361; Jacquemon et al. (2006), J. Thromb. Haemost. 4:1047; Schuster et al. (2005),Cancer Res. 65:7934; Warnock et al. (2005), Biotechnol. Bioeng. 92:831). В качестве альтернативы клеткихозяева, в которых продуцируются гибридные белки согласно настоящему описанию, могут быть модифицированы таким образом, чтобони продуцируют белки с изменнной моделью гликозилирования. Например, один из известных в данной области способов обеспечивает гликозилирование в виде разделнных пополам, не фукозилированных вариантов, усиливающих ADCC. Такие варианты получают в результате экспрессии в клектах-хозяевах, содержащих ферменты, модифицирующие олигосахариды. В качестве альтернативы для уменьшения содержания фукозы в гликозилированных молекулах согласно настоящему изобретению рассматривается технология Potelligent компании BioWa/Kyowa Hakko. Согласно одному из известных способов для продуцирования рекомбинантных иммуноглобулинов обеспечиваются клетки-хозяева линии СНО, в результате чего посредством продуцирования ГДФ-фукозы модифицируется схема гликозилирования иммуноглобулиновых фрагментов Fc. В качестве альтернативы для изменения схемы гликозилирования гибридных белков согласно данному описанию применяются химические способы. Например, различные ингибиторы гликозидазы и/или маннозидазы обеспечивают один или несколько желаемых эффектов увеличения активностиADCC, усиления связывания рецепторов Fc и изменения схемы гликозилирования. Согласно определнным вариантам реализации клетки, экспрессирующие гибридные белки согласно настоящему описанию,культивируются в питательной среде, содержащей модификатор углеводов в концентрации, которая повышает уровень ADCC молекул иммуногликопротеинов, продуцируемых указанными клеткамихозяевами, притом что концентрация указанного модификатора углеводов не превышает 800 мкМ. Согласно предпочтительному варианту реализации экспрессирующие такие мультиспецифичные гибридные белки клетки культивируются в среде, содержащей кастаноспермин или кифуненсин, предпочтительно кастаноспермин в концентрации, равной 100-800 мкМ, такой как 100, 200, 300, 400, 500, 600, 700 или 800 мкМ. Способы изменения гликозилирования модификатором углеводов, таким как кастаноспермин, обеспечиваются в патенте США 2009/0041756 или в заявке РСТWO 2008/052030. Согласно другому варианту реализации участки Fc иммуноглобулина могут содержать модификации аминокислот, влияющие на связывание с эффекторным клеточным рецептором Fc. Такие модификации могут быть осуществлены посредством любого известного в данной области техники способа, такого как описанный у Presta et al. (2001), Biochem. Soc. Trans. 50:487. Согласно другой методике для создания фрагментов константных областей, соответствующих участкам Fc, для усиления эффекторной функции уничтожения клеток доступна технология Xencor XmAb (см. Lazar et al. (2006), Proc. Natl Acad. Sci.(USA), 705:4005). Применяя эту технологию, например, можно получить фрагменты константных областей с улучшенными характеристиками специфичности и связывания с FCR и, таким образом, усиленной эффекторной функцией уничтожения клеток. Согласно другим вариантам реализации константный участок или фрагмент может дополнительно повысить время полужизни в плазме или плацентарный перенос в сравнении с соответствующим гибридным белком, лишнным указанного промежуточного домена. Согласно определнным вариантам реализации повышенное время полужизни гибридного белка в организме человека согласно настоящему описанию составляет по меньшей мере 2, 3, 4, 5, 10, 12, 18, 20, 24, 30, 36, 40, 48 ч, по меньшей мере несколько дней, по меньшей мере одну, две, несколько недель, по меньшей мере один, два, несколько месяцев или более. Константный фрагмент может включать некоторые или все нижеуказанные домены: CH2, CH3 (IgA,IgD, IgG, IgE или IgM) и CH4 (IgE или IgM). Поэтому константный фрагмент, как определено в настоящем описании, относится к полипептиду, который соответствует части константного участка иммуноглобулина. Фрагмент константной области может содержать домен CH2 и домен CH3, полученные из одного и того же иммуноглобулина либо из разных иммуноглобулинов, изотипов антител или аллельных вариантов (например, оба могут представлять собой IgG1 либо один может быть IgG1, а другой IgG2). Согласно некоторым вариантам реализации домен CH3 укорочен и содержит одну из последовательностей карбоксильного конца, описанных в заявке РСТWO 2007/146968 как SEQ ID NO: 366-371 и включнных в настоящее описание посредством ссылки. Согласно определнным вариантам реализации константный фрагмент содержит домен CH2 и домен CH3, которые могут содержать линкер на аминоконце,на карбоксильном конце либо на обоих концах либо не содержать его."Линкер" представляет собой пептид, соединяющий или связывающий другие пептиды или полипептиды, такой как линкер длиной приблизительно 2-150 аминокислот. В гибридных белках согласно данному описанию линкер может соединять промежуточный домен (например, константный домен иммуноглобулина) со связывающем доменом либо линкер может соединять два вариабельных фрагмента связывающего домена. Например, линкер может представлять собой последовательность аминокислот,полученную производную или смоделированную из шарнирного участка антитела, последовательности,присоединяющей связывающий домен к рецептору, или последовательности, присоединяющей связывающий домен к трансмембранной области клеточной мембраны или к мембранному якорю. Согласно некоторым вариантам реализации линкер может содержать по меньшей мере один остаток цистеина, способный входить по меньшей мере в один из дисульфидных мостиков в физиологических условиях или других стандартных условиях для белка (например, условиях для очистки белка или для хранения белка). Согласно определнным вариантам реализации линкер, соответствующий пептиду шарнирного участка иммуногобулина или подобный ему, сохраняет цистеин, который соответствует цистеину шарнирного участка, расположенному по направлению к аминоконцу указанного шарнирного участка. Согласно другим вариантам реализации линкер получают из шарнирного участка IgG1, при этом он содержит один или два остатка цистеина, соответствующих остаткам цистеина шарнирного участка. Согласно определнным вариантам реализации один или несколько дисульфидных мостиков формируются как межцепочечные дисульфидные мостики, связывающие взаимодействующие домены. Согласно другим вариантам реализации гибридные белки согласно настоящему описанию могут содержать промежуточный домен,соединнный непосредственно со связывающим доменом (т.е. в отсутствие линкера или шарнирного участка). Согласно некоторым вариантам реализации промежуточный домен представляет собой домен димеризации. Кроме того, связывающий домен может содержать домены VH и VL, и эти домены вариабельной области могут быть соединены линкером. Типичные домены вариабельной области включают домены,принадлежащие к семейству (GlynSer), такие как (Gly3Ser)n(Gly4Ser)1, (Gly3Ser)1(Gly4Ser)n,(Gly3Ser)n(Gly4Ser)n или (Gly4Ser)n, где n представляет собой целое число от 1 до 5 (см., например, Линкеры 22, 29, 46, 89, 90 и 116, соответствующие SEQ ID NO: 518, 525, 542, 585, 586 и 603 соответственно). Согласно предпочтительным вариантам реализации основанные на (GlynSer) линкеры применяются для связывания вариабельных областей, но не для присоединения связывающего домена с промежуточным доменом. Промежуточный домен или домен димеризации гибридных белков согласно настоящему описанию может быть связан с одним или несколькими дистальными или концевыми связывающими доменами посредством пептидного линкера. Помимо обеспечения функции разделения, линкер может обеспечить эластичность или жсткость, удовлетворяющую требованиям правильного ориентирования одного или нескольких связывающих доменов гибридного белка как в составе гибридного белка, так и между гибридными белками и их мишенями. Кроме того, линкер может поддерживать экспрессию полноразмерного гибридного белка и устойчивость очищенного белка in vitro и in vivo после введения нуждающемуся в этом субъекту, такому как человек, а также предпочтительно не обладает иммуногенностью или обладает слабой иммуногенностью в организме указанного субъекта. Согласно определнным вариантам реализации линкер домена димеризации гибридных белков согласно настоящему описанию может содержать часть шарнирного участка иммуноглобулина человека или целый шарнирный участок. Типичные линкеры, применяемые для присоединения промежуточного домена (например, константная область иммуноглобулина) к связывающему домену или для связывания двух вариабельных областей связывающего домена, описаны в SEQ ID NO: 497-604 и 823-828. Линкеры, рассматриваемые в настоящем описании, включают, например, производные любого участка, располагающегося между доменами члена суперсемейства иммуноглобулинов (например, шарнирный участок антитела) или в "стержневом" участке лектинов типа С, семейства мембранных белков типаII. Указанные линкеры характеризуются длиной, приблизительно равной 2-150 аминокислотам, или приблизительно равной 2-40 аминокислотам, или приблизительно равной 8-20 аминокислотам, предпочтительно приблизительно равной 10-60 аминокислотам, более предпочтительно приблизительно равной 1030 аминокислотам и наиболее предпочтительно приблизительно равной 15-25 аминокислотам. Например, линкер 1 (SEQ ID NO: 497) характеризуется длиной, равной 2 аминокислотам, а линкер 116(SEQ ID NO: 603) характеризуется длиной, равной 36 аминокислотам. Оставляя в стороне общие соображения относительно длины, линкер, пригодный для использования в гибридных белках согласно настоящему описанию, включает шарнирный участок антитела, выбранный из шарнирных участков IgG, IgA, IgD, IgE или их вариантов. Согласно определнным вариантам реализации линкер может представлять собой шарнирный участок антитела (верхний и коровый домены), полученный из человеческого IgG1, IgG2, IgG3, IgG4 или из их фрагментов и вариантов. В настоящем описании линкер, представляющий собой "шарнирный участок иммуноглобулина", относится к аминокислотам, располагающимся между карбоксильным концом СН 1 и аминоконцом CH2 (для IgG, IgA иIgD) или аминоконцом CH3 (для IgE и IgM). "Шарнирный участок иммуноглобулина дикого типа" согласно настоящему описанию относится к природной последовательности аминокислот, вставленной между участками СН 1 и CH2 (для IgG, IgA и IgD) и соединяющей их или вставленной между участкамиCH2 и CH3 (для IgE и IgM) и соединяющей их, расположенной в тяжлых цепях антител. Согласно предпочтительным вариантам реализации шарнирные участки иммуноглобулиновых последовательностей дикого типа получены из организма человека. Согласно кристаллографическим исследованиям шарнирный участок IgG может быть функционально и структурно подразделн на 3 области: верхний шарнирный домен, коровый или центральный шарнирный домен и нижний шарнирный домен (Shin et al. (1992), Immunol. Rev. 130:87). Типичные верхние шарнирные домены включают EPKSCDKTHT (SEQ ID NO: 830) из IgG1, ERKCCVEIgG3 и ESKYGPP (SEQ ID NO: 834) из IgG4. Типичные центральные шарнирные домены включаютIgG4. В то время как антитела IgG1, IgG2 и IgG4 характеризуются единственным верхним и центральным шарнирным доменом, IgG3 характеризуется тандемом из четырх-одного ELKTPLGDTT HTCPRCP(SEQ ID NO: 838) и трх EPKSCDTPPP CPRCP (SEQ ID NO: 839). Антитела IgA и IgD, по-видимому, лишены корового домена, подобного коровому домену IgG, aIgD, по-видимому, характеризуется тандемом из двух верхних шарнирных доменов (см. SEQ ID NO: 840 и 841). Типичные верхние шарнирные домены дикого типа, присущие IgA1 и IgA2, описаны вSEQ ID NO: 842 и 843. Антитела IgE и IgM, напротив, вместо типичного шарнирного участка содержат участок CH2, обладающий схожими с шарнирным участком свойствами. Типичные последовательности участка CH2 дикого типа антител IgE и IgM, подобные верхнему шарнирному домену, описаны в SEQ ID NO: 844 (VCSRDFTPPT"Изменнный шарнирный участок иммуноглобулина дикого типа" или "изменнный шарнирный участок иммуноглобулина" относится к (а) шарнирному участку иммуноглобулина дикого типа, не более 30% аминокислот которого замещены (например, до 25, 20, 15, 10 или 5% аминокислот замещены или удалены), (b) части шарнирного участка иммуноглобулина дикого типа длиной по меньшей мере 10 аминокислот (например, по меньшей мере 12, 13, 14 или 15 аминокислот), не более 30% аминокислот которого замещены (например, до 25, 20, 15, 10 или 5% аминокислот замещены или удалены), или (с) части шарнирного участка иммуноглобулина дикого типа, содержащей коровый шарнирный домен (состоящей из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 или по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот). Согласно определнным вариантам реализации один или несколько остатков цистеина шарнирного участка иммуноглобулина дикого типа, такого как шарнирный участок IgG1, содержащего верхний и коровый шарнирные домены, могут быть замещены одним или несколькими другими остатками аминокислот (например, одним или несколькими остатками серина). Изменнный шарнирный участок иммуноглобулина может в качестве альтернативы или дополнительно содержать остаток пролина шарнирного участка иммуноглобулина дикого типа, такого как шарнирный участок IgG1, содержащий верхний и коровый шарнирные домены, замещнный остатком другой аминокислоты (например, остатком серина). Альтернативные последовательности шарнирных участков и линкеров, которые могут использоваться в качестве связывающих доменов, можно также получать из частей рецепторов поверхности клеток, соединяющих IgV-подобные или IgC-подобные домены. Области между IgV-подобными доменами,в случае когда рецептор поверхности клетки содержит множественные IgV-подобные домены в тандеме,и IgC-подобными доменами, когда рецептор поверхности клетки содержит множественныеIgC-подобные домены в тандеме, также могут применяться в качестве связующих участков или пептидных линкеров. Согласно определнным вариантам реализации последовательности шарнирного участка и линкера характеризуются длиной от 5 до 60 аминокислот и могут быть изначально эластичными, но также могут обеспечивать характеристики большей жсткости, могут обладать изначально структурой спирали с минимальной -складчатой составляющей. Предпочтительно последовательности обладают устойчивостью в плазме и сыворотке и не чувствительны к протеолизу. Согласно некоторым вариантам реализации последовательности могут содержать природный или добавленный мотив, такой как СРРС,обладающий способностью формировать один или несколько дисульфидных мостиков для стабилизации С-конца молекулы. Согласно другим вариантам реализации последовательности могут содержать одно или несколько мест гликозилирования. Примеры шарнирных последовательностей и линкеров включают промежуточные доменные участки между IgV-подобными и IgC-подобными или между IgC-подобными и IgV-подобными доменами CD2, CD4, CD22, CD33, CD48, CD58, CD66, CD80, CD86, CD96, CD150,CD166 и CD244. Альтернативные шарнирные участки также могут быть получены из содержащих дисульфиды участков рецепторов II типа, не принадлежащих к суперсемейству иммуноглобулинов, таких как CD69, CD72 и CD161. Согласно некоторым вариантам реализации линкер шарнирного участка содержит один остаток цистеина для формирования межцепочечного дисульфидного мостика. Согласно другим вариантам реализации линкер содержит два остатка цистеина для формирования межцепочечных дисульфидных мостиков. Согласно другим вариантам реализации линкер шарнирного участка получают из области иммуноглобулина, располагающейся между доменами (например, шарнирного участка антитела), или стержневого участка лектина II типа (полученного из мембранного белка II типа; см., например, последовательности типичных стержневых участков, описанные в заявке РСТWO 2007/146968, такие как указанного описания), последовательности которых включены в настоящее описание посредством ссылки. Согласно одному из аспектов гибридные белки согласно настоящему описанию содержат связывающий домен, специфичный к IL-6, IL-6R или IL-6xR, в форме белка SMIP. Способы получения белковSMIP описаны в настоящем описании и известны в данной области техники (см. патенты США 2003/0133939, 2003/0118592 и 2005/0136049). Согласно определнным вариантам реализации гибридный белок содержит полипептидный связывающий домен, специфичный к комплексу IL-6xR и обладающий к нему большим сродством, чем к IL-6 или IL-6R по отдельности, и конкурирует с gp130 за связывание с комплексом sIL-6xR либо усиливает связывание gp130 с sIL-6xR, притом что в направлении от амино- к карбоксильному концу (а) полипептидный связывающий домен соединн с первым линкером, (b) полипептид CH2-домена константной области тяжлой цепи иммуноглобулина или его фрагмент соединн со вторым линкером и (с) полипептид CH3-домена константной области тяжлой цепи иммуноглобулина или его фрагмент соединн с полипептидом CH2-домена константной области или его фрагментом. В качестве альтернативы, структура белка SMIP может быть описана так: N-BD-L1-CH2CH3 С, где N - аминоконец гибридного белка, BD - связывающий домен анти-IL-6xR комплекса или scFv,L1 - линкер, CH2 и CH3 - константные участки 2 и 3 тяжлой цепи иммуноглобулина, а С - карбоксильный конец гибридного белка. Согласно некоторым вариантам реализации линкер представляет собой(Gly4Ser)n, где n - целое число от 1 до 6, такой как 46 (SEQ ID NO: 542), или указанный линкер представляет собой шарнирный участок IgG1, IgA или IgE, мутированный шарнирный участок IgG1, содержащий 0, 1 или 2 остатка цистеина, такой как линкер 47 (SEQ ID NO: 543) или линкер 80 (SEQ ID NO: 576). Согласно некоторым вариантам реализации гибридный белок соединяют посредством линкера или без него с доменом, отличным от константного участка или иммуноглобулина или его фрагмента, таким образом,что гибридный белок остатся в композиции в большей степени или в основном в форме одноцепочечного полипептида. Согласно другим вариантам реализации гибридный белок SMIP согласно данному описанию включает связывающий домен, содержащий вариабельную область лгкой цепи, включающую последовательности CDR1, CDR2 и CDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1,CDR2 и CDR3 по меньшей мере одной вариабельной области лгкой цепи, описанной в одной изSEQ ID NO: 373-434 и 799-804 соответственно, причм каждый CDR содержит 0-3 замен аминокислот, и несущий вариабельную область тяжлой цепи, включающую последовательности CDR1, CDR2 и CDR3,каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области тяжлой цепи, описанной в одной из SEQ ID NO: 435-496 и 805-810 соответственно, причм каждый CDR содержит 0-3 замены аминокислот. Согласно другим вариантам реализации гибридный белок SMIP согласно данному описанию содержит последовательность аминокислот, по меньшей мере на 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичную последовательности аминокислот, соответствующей одной из SEQ ID NO: 671-694, включающую лидерную пептидную последовательность или не включающую е. Согласно другим вариантам реализации полипептиды SMIP могут содержать связывающий участок или домен, представляющий собой антагонист IL-6, притом что передача сигналов по типу "цис" или"транс" заметно ингибируется. Согласно определнным вариантам реализации антагонист IL-6 согласно настоящему описанию не ингибирует передачу сигналов цитокинами семейства gp130, отличными отIL-6. Согласно другим вариантам реализации гибридные белки согласно данному описанию содержат связывающие домены-антагонисты IL-6 в форме белка PIMS, где связывающий домен расположен на карбоксильном конце гибридного белка. Концепция и способы получения белков PIMS описаны в заявке РСТWO 2009/023386. Как правило, молекула PIMS представляет собой одноцепочечный полипептид,несущий, в направлении от амино- к карбоксильному концу, промежуточный домен (например, константная область иммуноглобулина, полученная из вышеуказанного, включает домены CH2 и CH3 одного и того же (предпочтительно) или разных видов животных, изотипов иммуноглобулинов и/или подклассов иммуноглобулинов), пептидный линкер (например, шарнирный участок иммуноглобулина) и специфический связывающий домен. Согласно некоторым вариантам реализации молекула PIMS также содержит расположенный на аминоконце шарнирный участок иммуноглобулина, притом что указанный шарнирный участок на аминоконце может быть идентичным или отличным от линкера, расположенного между доменом димеризации и связывающим доменом. Согласно некоторым вариантам реализации линкер на аминоконце содержит природный или добавленный мотив (такой как СРРС) для активации формирования по меньшей мере одного дисульфидного мостика для стабилизации аминоконца мультимеризованной молекулы. Таким образом, типичная схематическая организация некоторых молекул PIMS включает N-домен димеризации-линкер-связывающий домен-С или N-шарнирный линкер-домен димеризации-линкер-связывающий домен-С. Согласно некоторым вариантам реализации гибридный белок содержит промежуточный домен, притом что гибридный белок остатся в большей степени или в значительной степени в форме одноцепочечного полипептида в составе композиции либо в форме димера в составе композиции. Согласно определнным вариантам реализации гибридный белок содержит полипептидный связы- 16019512 вающий домен-антагонист IL-6, который связывается с комплексом IL-6xR с большим сродством, нежели с IL-6 или IL-6R по отдельности, и конкурирует с gp130 за связывание с комплексом sIL-6xR, притом что в направлении от карбоксильного конца к аминоконцу (а) полипептидный связывающий домен соединн с первым линкером, (b) первый линкер соединн с полипептидом CH3-домена константной области тяжлой цепи иммуноглобулина или его фрагментом, (с) полипептид СН 3-домена константной области или его фрагмент соединн с полипептидом CH2-домена константной области или его фрагментом и (d) полипептид CH2-домена константной области или его фрагмент соединн со вторым линкером. Согласно другим вариантам реализации гибридный белок PIMS согласно данному описанию содержит связывающий домен, несущий вариабельную область лгкой цепи, включающую последовательностиCDR1, CDR2 и CDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области лгкой цепи, соответствующей одной из SEQ ID NO: 373434 и 799-804 соответственно, причм каждый CDR содержит 0-3 замен аминокислот, и несущий вариабельную область тяжлой цепи, включающую последовательности CDR1, CDR2 и CDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области тяжлой цепи, соответствующей одной из SEQ ID NO: 435-496 и 805-810 соответственно,причм каждый CDR содержит 0-3 замен аминокислот. Согласно другим аспектам гибридные белки согласно данному описанию содержат связывающие домены, специфичные к IL-6 или IL-6xR в форме многофункциональных связывающих белков, таких как белок SCORPION. Способы получения белков SCORPION описаны в настоящем изобретении и известны в данной области техники (см. заявку РСТ . WO 2007/146968). Другие типичные многофункциональные гибридные белки описаны, например, в заявке на патент США 2006/0051844 и патенте США 7166707. Согласно определнным вариантам реализации моноспецифичный мультивалентный гибридный белок содержит первый и второй связывающие домены, первый и второй линкеры домена и димеризации, причм каждый конец домена димеризации соединн посредством линкера со связывающим доменом вариабельной области иммуноглобулина или его производного, каждый из которых специфичен к IL-6xR, как описано в данном патенте. В качестве альтернативы структура белкаSCORPION может быть описана нижеследующим образом: N-BD1-ID-BD2-C, где BD1 - первый связывающий домен, ID - промежуточный домен и BD2 - второй связывающий домен. В некоторых таких конструкциях ID содержит константную область иммуноглобулина или е фрагмент, расположенный между первым и вторым связывающим доменами. Согласно другим вариантам реализации гибридный белок содержит промежуточный домен, притом что гибридный белок остатся в большей или в значительной степени в форме одноцепочечного полипептида в составе композиции. В некоторых конструкциях ID представляет собой домен димеризации. Согласно определнным вариантам реализации гибридный белок содержит по меньшей мере два полипептидных связывающих домена, специфичных к комплексу IL-6xR, которые связываются с комплексом IL-6xR с большим сродством, нежели с IL-6 или IL-6R по отдельности, и конкурируют с gp130 за связывание с комплексом sIL-6xR, притом что в направлении от амино- к карбоксильному концу (а) первый полипептидный связывающий домен соединн с первым линкером, (b) первый линкер соединн с полипептидом CH2-домена константной области тяжлой цепи иммуноглобулина или его фрагментом, (с) полипептид CH2-домена константной области тяжлой цепи иммуноглобулина или его фрагмент соединены с полипептидом CH3-домена константной области тяжлой цепи иммуноглобулина или его фрагментом, (d) полипептид CH3-домена константной области или его фрагмент соединены со вторым линкером и (е) второй линкер соединн со вторым полипептидным связывающим доменом. Согласно другим вариантам реализации гибридный белок SCORPION согласно данному описанию включает по меньшей мере два связывающих домена, которые независимо друг от друга содержат вариабельную область лгкой цепи, включающую последовательности CDR1, CDR2 и CDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области лгкой цепи, соответствующей одной из SEQ ID NO: 373-434 и 799-804 соответственно, где каждый CDR содержит 0-3 замены аминокислот, и вариабельную область тяжлой цепи, включающую последовательности CDR1, CDR2 и CDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 иCDR3 по меньшей мере одной вариабельной области тяжлой цепи, соответствующей одной из SEQ IDNO: 435-496 и 805-810 соответственно, причм каждый CDR содержит 0-3 замен аминокислот. Согласно некоторым вариантам реализации линкер представляет собой (Gly4Ser)n, где n - целое число от 1 до 5,такой как 46 (SEQ ID NO: 542). Согласно другим вариантам реализации первый или второй линкер представляет собой IgG1, IgA или IgE или мутированный шарнирный участок IgG1, содержащий 0, 1 или 2 остатка цистеина, такой как любой из линкеров, соответствующих SEQ ID NO: 497-604 и 823-828. Согласно другому аспекту стандартные мультиспецифичные гибридные белки, содержащие связывающий домен-антагонист IL-6, как описано в данном патенте, могут включать по меньшей мере один связывающий участок или домен, не являющийся антагонистом IL-6. Согласно определнным вариантам реализации мультиспецифичный гибридный белок содержит первый и второй связывающие домены,первый и второй линкеры и промежуточный домен, притом что один конец промежуточного домена по- 17019512 средством линкера соединн с первым связывающим доменом вариабельной области иммуноглобулина,специфичной к IL-6xR, а другой конец посредством линкера соединн со вторым связывающим доменом,представляющим собой лигандсвязывающий эктодомен рецептора, такой как эктодомен рецептора интерлейкина, эктодомен рецептора фактора роста (например, TGFR) или эктодомен рецептора суперсемейства факторов некроза опухолей (TNFSFR). Согласно некоторым вариантам реализации используется лишь часть эктодомена. В частности, используются участвующие в связывании лиганда участки эктодомена. Подразумевается, например, что домен-антагонист ФНО- (TNF-) может находиться на аминоконце, а связывающий домен-антагонист IL-6 может находиться на карбоксильном конце гибридного белка либо связывающий домен-антагонист IL-6 может находиться на аминоконце, а домен-антагонист ФНО- (TNF-) может находиться на карбоксильном конце. Как описано в данном патенте, связывающие домены согласно настоящему описанию могут быть соединены с каждым концом промежуточным доменом (например, константной области иммуноглобулина или е фрагмента, такого как CH2CH3 IgG1). Более того, каждый их двух или более связывающих доменов может быть присоединн к промежуточному домену посредством одного и того же или различных линкеров, известных в данной области техники или описанных в настоящем изобретении. Типичные структуры таких мультиспецифичных гибридных белков, обозначаемых в данном описании как молекулы Xceptor, включают N-BD-ID-ED-C, N-LD-ID-BD-C, N-ED1-ID-LD2-C, где BD - иммуноглобулиновый или иммуноглобулиноподобный связывающий домен вариабельной области, ID - промежуточный домен, ED - лигандсвязывающий домен, такой как рецептор эктодомена, семафориновый домен и т.п. В некоторых конструкциях ID представляет собой домен димеризации. В некоторых конструкциях ID может содержать константную область иммуноглобулина или е фрагмент, расположенный между первым и вторым связывающими доменами. Согласно другим вариантам реализации гибридный белок содержит промежуточный домен, притом что гибридный белок остатся в большей степени или в значительной степени в форме одноцепочечного полипептида в составе композиции. Согласно некоторым вариантам реализации мультиспецифичный гибридный белок согласно данному описанию содержит антагонист ФНО-, который включает эктодомен TNFRSF или его фрагмент,такой как цистеин-богатый домен CRD1, CRD2, CRD3, 50' ФНО-связывающий петельный домен, 90' ФНО-связывающий петельный домен или любую их комбинацию. Например, антагонист ФНО- может содержать эктодомен TNFRSF1A, как описано в SEQ ID NO: 696 (включая или исключая нативную лидерную пептидную последовательность, содержащуюся в указанной последовательности), либо эктодомен TNFRSF1B, как описано в SEQ ID NO: 695 (включая или исключая нативную лидерную пептидную последовательность, содержащуюся в указанной последовательности). Согласно определнным вариантам реализации гибридный белок содержит (а) полипептидный связывающий домен, специфичный к комплксу IL-6xR, который связывается с IL-6xR с большим сродством,чем с IL-6 или IL-6R по отдельности, и конкурирует с gp130 за связывание с комплексом sIL-6xR либо усиливает связывание gp130 с комплексом sIL-6xR и (b) полипептидный связывающий домен, содержащий эктодомен TNFRSF1B, притом что в направлении от амино- к карбоксильному концу(а) анти-IL-6xR связывающий домен или эктодомен TNFRSF1B соединены с первым линкером, (b) первый линкер соединн с полипептидом CH2-домена константной области тяжлой цепи иммуноглобулина или его фрагментом, (с) полипептид CH2-домена константной области или его фрагмент соединены с полипептид CH3-домена константной области тяжлой цепи иммуноглобулина или его фрагментом, (d) полипептид СН 3-домена константной области или его фрагмент соединены со вторым линкером, (е) второй линкер соединн с анти-IL-6xR связывающим доменом или эктодоменом TNFRSF1B. Согласно определнным вариантам реализации мультиспецифичный гибридный белок Xceptor согласно данному описанию содержит IL-6xR-связывающий домен, включающий вариабельную область лгкой цепи, включающую последовательности CDR1, CDR2 и CDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области лгкой цепи, соответствующей одной из SEQ ID NO: 373-434 и 799-804 соответственно, причм каждый CDR содержит 0-3 замен аминокислот, и вариабельную область тяжлой цепи, включающую последовательности CDR1, CDR2 иCDR3, каждая из которых по меньшей мере на 80-100% идентична CDR1, CDR2 и CDR3 по меньшей мере одной вариабельной области тяжлой цепи, соответствующей одной из SEQ ID NO: 435-496 и 805810 соответственно, причм каждый CDR содержит 0-3 замен аминокислот. Согласно сходному варианту реализации эктодомен TNFRSF1B содержит последовательность аминокислот, соответствующуюSEQ ID NO: 695, при условии, что лидерная пептидная последовательность не включена. Согласно другим вариантам реализации гибридный белок Xceptor согласно данному описанию характеризуется последовательностью аминокислот по меньшей мере на 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичной одной из последовательностей, соответствующих SEQ ID NO: 607-668, включая или исключая лидерную пептидную последовательность, притом что каждый CDR содержит 0-3 замен аминокислот. В целом, такие конструкции содержат эктодомен рецептора I типа на аминоконце либо эктодомен рецептора II типа на карбоксильном конце мультиспецифичного гибридного белка согласно настоящему изобретению. Примером конструкции, содержащей эктодомен рецептора I типа, является конструкция,содержащая эктодомен рецептора суперсемейства фактора некроза опухолей (TNFRSF) на аминоконце и эктодомен связывающего домена комплекса IL-6xR на карбоксильном конце. Неожиданно, конструкция с эктодоменом рецептора I типа, содержащая эктодомен TNFRSF на карбоксильном конце, также оказалась функциональной (см. SEQ ID NO: 669 и 670). В случае с полипептидом согласно настоящему изобретению, содержащим множественные связывающие домены, например связывающий домен-1 (BD1) и связывающий домен-2 (BD2), один из которых, например, представляет собой анти-IL-6xR, низкое значение kOFF максимально увеличивает ингибиторную активность и концентрацию полипептида или гибридного белка согласно настоящему изобретению, присоединяющихся по всем валентным положениям, таким образом, что диапазон концентрации в отношении форм полипептида или гибридного белка, в которых взаимодействует лишь BD1 или BD2,расширяется (см. Perelson (1980), Math. Biosci. 49:87). Также определнный интерес может представлять отбор связывающих доменов с высоким значением kOFF. Например, высокий kOFF может быть желателен для рецептора, у которого короткое время нахождения в комплексе предпочтительно для получения желаемого фенотипа передачи сигнала (см. Matsui et al. (1994), Proc. Natl. Acad. Sci. (USA), 91:12862; Lyonset al. (1996), Immunity. 5:53). Специалист в данной области техники понимает, что для композиции, содержащей два связывающих домена, например молекулы SCORPION, как описано в данном патенте,возможно независимо контролировать kOFF доменов BD1 и BD2. В качестве другого, не ограничивающего настоящее изобретение примера, желательно, чтобы значение kOFF для одного связывающего домена было очень низким, а для другого связывающего домена относительно высоким. Это может позволить мультиспецифичному связывающему полипептиду, присоединившемуся к молекуле-мишени, долгое время находиться на клеточной поверхности, соответственно характеризующемуся низким kOFF связывающемуся домену, в то же время последовательно взаимодействуя с молекулами-мишенями, соответствующими связывающему домену с высоким kOFF. Это может усиливать передачу сигналов при низких концентрациях белка SCORPION (см. Kalergis et al. (2001), Nature Immunol. 2:229). Специалист в данной области техники понимает, что kOFF может быть изменн посредством модификации связывающих доменов или посредством отбора связывающих доменов, обладающих желаемыми кинетическими характеристиками (см. Su et al. (2007), J. Immunol. Methods, 322:94; Steukers et al. (2006), J. Immunol. Methods,310:126; Jermutus et al. (2001), Proc. Natl. Acad. Sci. (USA), 98:75). Для эффективной продукции любого из полипептидных связывающих доменов или гибридных белков согласно настоящему изобретению лидерная пептидная последовательность используется для улучшения секреции экспрессируемых полипептидов или гибридных белков. Предполагается, что применение любой из стандартных лидерных пептидных последовательностей (сигнальных последовательностей) будет направлять вновь экспрессируемые полипептиды или гибридные белки в секреторный путь, в результате чего лидерная пептидная последовательность отщепляется от зрелого полипептида или гибридного белка в точке соединения лидирующей пептидной последовательности и полипептида или гибридного белк, либо непосредственно вблизи не. Конкретные лидерные пептидные последовательности отбираются, основываясь на критериях, известных в данной области техники, таких как применение последовательностей, кодируемых полинуклеотидами, которые позволяют беспрепятственно добавить сайт расщепления рестрикционных эндонуклеаз в начале или в конце кодирующих последовательностей для того, чтобы лидерные пептидные последовательности могли облегчить молекулярную модификацию,при условии, что указанные внедрнные последовательности характеризуются аминокислотами, которые не оказывают нежелательного влияния на ожидаемое отщепление лидирующих пептидных последовательностей от вновь экспрессируемых белков и не оказывают нежелательного влияния на любую из ожидаемых функций полипептидов или гибридных белков, в случае если лидирующая пептидная последовательность не отщепляется в процессе созревания полипептидов или гибридных белков. Типичные лидерные пептидные последовательности согласно настоящему изобретению включают природные и иные лидерные последовательности, такие как H3N-MDFQVQIFSFLLISASVIMSRG(X)n-CO2H,где X - любая аминокислота и n - целое число от 0 до 3 (SEQ ID NO: 785) либоH3N-MEAPAQLLFLLLLWLPDTTG-CO2H (SEQ ID NO: 786). Согласно определнным иллюстративным вариантам реализации указанный белок подвергается гликозилированию, при том что схема гликозилирования зависит от различных факторов, включая клетку-хозяина, в которой данный белок экспрессируется (если белок получают в рекомбинантных клеткаххозяевах), и условия культивирования. Настоящее описание также обеспечивает производные связывающих доменов согласно настоящему изобретению, а также гибридных белков, содержащих указанные связывающие домены. Производные включают специфические полипептидные связывающие агенты, характеризующиеся модификациями,отличными от вставок, делеций и замещений аминокислотных остатков. Предпочтительно модификации являются ковалентными по природе и включают, например, химические связи с полимерами, липидами,- 19019512 другими органическими и неорганическими агентами. Производные согласно настоящему изобретению могут быть получены для увеличения времени полужизни циркулирования специфических пептидных связывающих агентов или для улучшения характеристик направленности полипептидов на желаемые клетки, ткани или органы. Согласно определнным вариантам реализации время полужизни in vivo полипептидных связывающих доменов или гибридных белков согласно данному описанию может быть увеличено известными в данной области техники способами увеличения времени полужизни больших молекул. Например, данное описание подразумевает, что ковалентно модифицированные или являющиеся производными гибридные белки включают одну или несколько водорастворимых составляющих, таких как полиэтиленгликоль, полиоксиэтиленгликоль или полипропиленгликоль (см., например, патенты США 4640835; 4496689; 4301144; 4670417; 4791192; 4179337). Другие полимеры, которые могут использоваться и известны в данной области техники, включают монометоксиполиэтиленгликоль, декстран, целлюлозу и другие полимеры на основе углеводов, поли(N-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры оксида полипропилена/оксида полиэтилена, полиоксиэтилированные полиолы (например, глицерин) и поливиниловые спирты, а также смеси указанных полимеров. Особенно предпочтительны белки-производные полиэтиленгликоля (PEG). Водорастворимые полимеры могут быть присоединены по специфическим позициям, например, на аминоконцах белков и полипептидов согласно настоящему описанию либо произвольно присоединены к одной или нескольким боковым цепям полипептидов. Применение PEG для улучшения терапевтических характеристик описано в патенте США 6133426. Указанные способы также включают создание гибридных белков, в которых связывающие домены соединены с белками, обеспечивающими более длительное время полужизни гибридным белкам, чем связывающие домены сами по себе. Такие гибридные белки могут включать белки, которые сами присоединяются к белкам, обладающим длительным временем полужизни, например иммуноглобулину,домену Fc иммуноглобулинов, трансферрину, G-белку стрептококка или альбумину. Указанные гибридные продукты связывающих доменов с устойчивыми белками плазмы описаны, например, в патентах США 5428130, 5116964. Конкретный вариант реализации настоящего изобретения представляет собой гибридный белок, содержащий иммуноглобулин или Fc. Такой гибридный белок может обладать длительным временем полужизни, например в пределах нескольких часов, суток и более или даже недели и более, особенно если домен Fc способен взаимодействовать с FcRn, неонатальным рецептором Fc. Сайт связывания FcRn домена Fc также является сайтом связывания бактериальных белков А и G. Прочная связь между этими белками может использоваться в способе выделения антител или гибридных белков согласно настоящему изобретению посредством, например, аффинной хроматографии с белком А или белком G в процессе очистки белка. Способы очистки белка хорошо известны специалисту в данной области техники. Эти способы включают, на одном из этапов, грубое разделение полипептидных и неполипептидных фракций. Часто желательна дальнейшая очистка с применением хроматографии и электрофореза для достижения частичной или полной очистки (либо очистки до получения однородного продукта). К аналитическим способам, особенно применимым для получения чистого гибридного белка, относят ионообменную хроматографию, вытеснительную хроматографию (гель-фильтрацию), электрофорез в полиакриламидном геле и изоэлектрическое фокусирование. К особо эффективным способам очистки пептидов относят скоростную белковую жидкостную хроматографию и высокоэффективную жидкостную хроматографию (HPLC). Определнные аспекты настоящего изобретения относятся к очистке и согласно отдельным вариантам реализации существенной очистке полипептидов согласно данному описанию. Термин "очищенный" согласно данному описанию относится к композиции, которую можно отделить от других компонентов,где гибридный белок очищен в любой степени в сравнении с его образцами, полученными естественным путм. Поэтому очищенный белок также относится к указанному белку, изолированному от компонентов среды, в которой он находится в естественных условиях. Как правило, "очищенный" относится к полипептидной композиции, подвергшейся фракционированию для удаления различных иных компонентов, притом что указанная композиция в существенной степени сохраняет присущую ей биологическую активность, представляющую интерес. Термин "очищенный в существенной степени" относится к белковой композиции связывающего домена, в которой белок составляет основной компонент композиции, например составляя приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%,приблизительно 99% композиции по массе. Различные способы количественного определения степени очистки известны специалисту в данной области техники в свете настоящего описания. Указанные способы включают, например, определение специфической связывающей активности активной фракции или определение количества белка в фракции посредством электрофореза на полиакриловом геле в присутствии додецилсульфата натрия(SDS/PAGE). Предпочтительный способ определения степени очистки белковой фракции заключается в вычислении связывающей активности фракции для сравнения со связывающей активностью первичного экстракта и, таким образом, вычисления степени очистки, согласно данному описанию обозначаемой как"очистка N-й степени". Фактические единицы, применяемые для выражения степени связывающей активности, безусловно, будут зависеть от конкретной выбранной методики, осуществляемой после очистки, и от того, проявляет ли экспрессируемый белок заметную связывающую активность. Различные способы, применимые при очистке белков, хорошо известны специалисту в данной области техники. К ним относят, например, осаждение с сульфатом аммония, PEG, антителами и т.п. либо посредством денатурирования при нагревании и последующего центрифугирования; хроматографические стадии, такие как ионный обмен, гель-фильтрация, хроматография с обращенной фазой, хроматография с гидроксиапатитом, аффинная хроматография; изоэлектрическое фокусирование; гельэлектрофорез; а также комбинации этих и других способов. Как, в целом, известно в данной области,порядок осуществления различных стадий очистки может меняться либо некоторые стадии могут пропускаться, тем не менее, результатом окажется применимый способ получения существенно очищенного белка. Полинуклеотиды, векторы экспрессии и клетки-хозяева. Данное описание обеспечивает полинуклеотиды (изолированные, очищенные или чистые полинуклеотиды), кодирующие гибридные белки согласно настоящему изобретению, векторы (включая векторы клонирования и экспрессии), содержащие указанные полинуклеотиды, и клетки (например, клеткихозяева), трансформированные или трансфицированные полинуклеотидами или векторами согласно настоящему изобретению. Согласно определнным вариантам реализации подразумевается полинуклеотид (ДНК или РНК),кодирующий связывающий домен согласно настоящему изобретению или гибридный белок, содержащий один или несколько таких связывающих доменов. Кассеты экспрессии, кодирующие конструкции SMIP и Xceptor, обеспечиваются в примерах, приведнных в данном описании. Настоящее изобретение также относится к векторам, которые включают полинуклеотид согласно настоящему описанию, и, в частности, к рекомбинантным экспрессируемым конструкциям. Согласно одному из вариантов реализации настоящее описание подразумевает вектор, содержащий полинуклеотид, который кодирует связывающий домен согласно настоящему изобретению или полипептид, который содержит указанный связывающий домен, например SMIP, PIMS, SCORPION, Xceptor или другой моно-, би- или многофункциональный гибридный белок наряду с другими полинуклеотидными последовательностями, которые активируют или способствуют транскрипции, трансляции и процессингу указанных кодирующих связывающие домены последовательностей. Подходящие векторы клонирования и экспрессии для использования в прокариотических и эукариотических хозяевах описаны, например, у Sambrook et al., Molecular Cloning: A Laboratory Manual,Second Edition, Cold Spring Harbor, NY (1989). Типичные векторы клонирования/экспрессии включают векторы клонирования, челночные векторы и экспрессионные конструкции, которые могут быть производными плазмид, фагмид, фазмид, космид, вирусов, искусственных хромосом или любых переносчиков нуклеиновых кислот, известных в данной области техники и применимых для амплификации, переноса и/или экспрессии полинуклеотидов согласно настоящему описанию. В настоящем описании "вектор" означает молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту, с которой он связан. Типичные векторы включают плазмиды, дрожжевые искусственные хромосомы и вирусные геномы. Определнные векторы могут автономно реплицироваться в клетке-хозяине, в то время как другие могут быть интегрированы в геном клетки-хозяина и, таким образом, реплицируются вместе с геномом хозяина. Кроме того, определнные векторы обозначаются согласно данному описанию как "рекомбинантные векторы экспрессии" (или просто "векторы экспрессии"), которые содержат последовательности нуклеиновых кислот, функционально связанные с последовательностью контроля экспрессии и поэтому способны управлять экспрессией указанных последовательностей. Согласно определнным вариантам реализации экспрессионные конструкции представляют собой производные плазмидных векторов. Иллюстративные конструкции включают модифицированный векторpNASS (Clontech, Palo Alto, CA), последовательности нуклеиновых кислот которого кодируют ген устойчивости к ампициллину, полиаденилирующий сигнал и сайт промотора Т 7; pDEF38 и pNEF38 (CMCICOS Biologies, Inc.), содержащие промотор CHEF1; и pD18 (Lonza), содержащий промотор цитомегаловируса (CMV). Другие подходящие векторы экспрессии хорошо известны (см., например, Ausubel et al.,1995; Sambrook et al., supra; см. также, например, каталоги Invitrogen, San Diego, CA; Novagen, Madison,WI; Pharmacia, Piscataway, NJ). Кроме того, можно синтезировать подходящие конструкции, которые включают последовательность, кодирующую дигидрофолатредуктазу (DHFR) под соответствующим регуляторным контролем, для способствования увеличению уровня продукции гибридных белков, где уровень продукции повышается вследствие амплификации генов после введения соответствующего селективного агента (например, метотрексата). Как правило, рекомбинантные векторы экспрессии включают точки начала репликации и маркеры селекции, позволяющие трансформировать клетку-хозяина, а также промотор сильно экспрессируемого гена для управления транскрипцией структурной последовательности, расположенной по ходу транс- 21019512 крипции, как описано выше. Вектор, функционально связанный с полинуклеотидом согласно настоящему изобретению, представляет собой клонируемую или экспрессируемую конструкцию. Типичные клонируемые/экспрессируемые конструкции содержат по меньшей мере один элемент контроля экспрессии, например промотор, функционально связанный с полинуклеотидом согласно настоящему изобретению. В данном описании подразумевается, что дополнительные элементы контроля экспрессии, такие как энхансеры, фактор-специфичные сайты присоединения, терминаторы и сайты связывания рибосом, также включены в векторы и клонируемые/экспрессируемые конструкции. Гетерологичные структурные последовательности полинуклеотидов согласно настоящему изобретению скомбинированы надлежащим образом с последовательностями инициации и терминации трансляции. Таким образом, например, кодирующие гибридные белки нуклеиновые кислоты согласно данному описанию могут быть включены в любую из различных экспрессируемых векторных конструкций как рекомбинантные экспрессируемые конструкции для экспрессии указанных белков в клетке-хозяине. Соответствующие последовательности ДНК могут быть интегрированы в вектор различными способами. Как правило, последовательность ДНК вставляется в соответствующий распознаваемый рестрикционной эндонуклеазой сайт посредством известных в данной области техники процедур. Настоящее изобретение подразумевает стандартные способы клонирования, выделения, амплификации и очистки ДНК для ферментативных реакций, в которых участвуют ДНК-лигазы, ДНК-полимеразы, рестрикционные эндонуклеазы и т.п., а также стандартно применяемые способы разделения. Некоторые стандартные способы описаны, например, у Ausubel et al. (1993), Current Protocols in Molecular Biology, Greene Publ.and Higgins (Eds.) (1985), Nucleic Acid Hybridization, IRL Press, Oxford, UK и т.п. Последовательность ДНК в векторе экспрессии функционально связана по меньшей мере с одной соответствующей последовательностью контроля экспрессии (например, конститутивным или регулируемым промотором) для управления синтезом мРНК. Характерные примеры указанных последовательностей контроля экспрессии включают промоторы эукариотических клеток или их вирусов, как описано выше. Промоторные участки могут быть взяты из любого желаемого гена с помощью векторов с CAT(хлорамфениколтрансферазой) или других векторов с маркерами селекции. Эукариотические промоторы включают немедленный ранний промотор цитомегаловируса, промотор тимидинкиназы вируса герпеса,ранний и поздний промоторы вируса SV40, промоторы длинных концевых повторов ретровирусов и промотор мышиного металлотионеина-1. Выбор соответствующего вектора и промотора полностью определяется специалистом в данной области техники, а синтез определнных особенно предпочтительных рекомбинантных экспрессируемых конструкций, содержащих по меньшей мере один промотор или регулируемый промотор, функционально связанный с нуклеиновой кислотой, которая кодирует белок или полипептид согласно настоящему изобретению, описан в данном патенте. Также данным описанием подразумеваются варианты полинуклеотидов. Варианты полинуклеотидов по меньшей мере на 90% и предпочтительно на 95, 99 или 99,9% идентичны одному из полинуклеотидов с определнной последовательностью, описанной в данном патенте, либо полинуклеотиду, который гибридизируется с одним из указанных полинуклеотидов с определнной последовательностью в жстких условиях гибридизации: 0.015 М хлорида натрия, 0.0015 М цитрата натрия приблизительно при 65-68 С либо 0.015 М хлорида натрия, 0.0015 М цитрата натрия и 50% формамида приблизительно при 42 С. Указанные варианты полинуклеотидов сохраняют способность кодировать связывающий домен или соответствующий гибридный белок и обладающий функциями, описанными в данном изобретении. Термин "жсткие" относится к условиям, как правило, определнным в данной области техники как жсткие. Жсткость гибридизации в первую очередь определяется температурой, концентрацией ионов и концентрацией денатурирующих агентов, таких как формамид. Примеры жстких условий гибридизации и отмывки включают: 0.015 М хлорида натрия, 0.0015 М цитрата натрия приблизительно при 65-68 С,либо 0.015 М хлорида натрия, 0.0015 М цитрата натрия и 50% формамида приблизительно при 42 С (см.Spring Harbor, N.Y. 1989). Также могут применяться более жсткие условия (такие как более высокая температура, пониженная концентрация ионов, повышенная концентрация формамида или другого денатурирующего агента); однако в таком случае скорость гибридизации изменится. В случаях, когда рассматривается гибридизация дезоксиолигонуклеотидов, дополнительные типичные жсткие условия гибридизации включают отмывку буфером 6xSSC, 0.05% пирофосфата натрия при 37 С (для олигонуклеотидов, состоящих из 14 оснований), 48 С (для олигонуклеотидов, состоящих из 17 оснований), 55 С (для олигонуклеотидов, состоящих из 20 оснований) и 60 С (для олигонуклеотидов, состоящих из 23 оснований). Другой аспект согласно данному описанию обеспечивает клетки-хозяева, трансформированные или трансфицированные (либо содержащие каким-либо другим образом) любой из полинуклеотидов или векторов/экспрессируемых конструктов согласно настоящему изобретению. Полинуклеотиды или клонируемые/экспрессируемые конструкции согласно настоящему изобретению вводятся в соответствующие клетки любым из способов, известных в данной области, включая трансформацию, трансфекцию или трансдукцию. Клетки-хозяева включают клетки субъекта, подвергшиеся клеточной терапии ex vivo, например генной терапии ex vivo. Эукариотические клетки-хозяева, подразумеваемые как один из аспектов данного описания в случае, если они содержат полинуклеотид, вектор или белок согласно настоящему изобретению, включают, помимо собственных клеток субъекта (например, собственные клетки пациента-человека), клетки VERO, HeLa, клеточные линии яичников китайских хомячков (СНО) (включая модифицированные клетки СНО, способные к модификации схемы гликозилирования экспрессируемых мультивалентных связывающих молекул, см. заявку на патент США 2003/0115614), клетки COS (такие как COS-7), W138, BHK, HepG2, 3 Т 3, RIN, MDCK, A549, PC12, K562, HEK293, HepG2, N-клетки,клетки 3 Т 3, клетки Spodoptera frugiperda (например, Sf9), Saccharomyces cerevisiae и любые другие эукариотические клетки, известные в данной области техники как применимые для экспрессии и, возможно,выделения белков или пептидов согласно настоящему изобретению. Кроме того, данное описание подразумевает прокариотические клетки, включая Escherichia coli, Bacillus subtilis, Salmonella typhimurium,стрептомицеты или любые другие прокариотические клетки, известные в данной области техники как применимые для экспрессии и, возможно, выделения белков или пептидов согласно настоящему изобретению. В процессе выделения белка или пептида из прокариотических клеток, в частности, подразумевается, что могут применяться способы выделения белка из телец включения, известные в данной области техники. Выбор соответствующего хозяина находится в пределах уровня знаний специалиста в данной области техники в соответствии с рекомендациями, описанными в настоящем описании. В частности,подразумеваются клетки-хозяева, гликозилирующие гибридные белки согласно настоящему изобретению. Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") относится к клеткам, содержащим рекомбинантный вектор экспрессии. Следует понимать, что такого рода термины должны относиться не только к определнным клеткам субъекта, но и к потомству таких клеток. Так как определнные модификации могут появиться в последующих поколениях ввиду мутаций или влияния среды, такого рода потомство может не быть фактически идентичным материнской клетке, но тем не менее включено в рамки значения термина "клетка-хозяин", применяемого в данном описании. Рекомбинантные клетки-хозяева могут культивироваться в стандартной питательной среде, соответственно модифицированной для активации промоторов, отбора трансформированных клеток или амплификации определнных генов. Условия культивирования определнных клеток-хозяев, отобранных для экспрессии, такие как температура, рН и т.п., очевидны для специалиста в данной области техники. Различные системы культур клеток млекопитающих могут также применяться для экспрессии рекомбинантных белков. Примеры систем культур клеток млекопитающих включают линии COS-7 фибробластов почек обезьян, описанные у Gluzman (1981), Cell. 23:175, и другие клеточные линии, способные экспрессировать совместимый вектор, например клеточные линии С 127, 3 Т 3, СНО, HeLa и BHK. Векторы экспрессии в млекопитающих содержат точку начала репликации, соответствующий промотор и, возможно,энхансер, а также любые необходимые сайты связывания рибосом, сайты полиаденилирования, донорские и акцепторные сайты сплайсинга, последовательности терминации транскрипции и 5'фланкирующие нетранскрибируемыепоследовательности, например, подобные описанным в данном описании в отношении синтеза экспрессируемых конструкций мультивалентных связывающих белков. Последовательности ДНК, полученные из сайтов сплайсинга SV40, и последовательности полиаденилирования могут применяться для обеспечения необходимых нетранскрибируемых генетических элементов. Введение конструкций в клетки-хозяева может осуществляться различными способами, известными специалистам в данной области техники, включая трансфекцию с фосфатом кальция, диэтиламиноэтилдекстран-опосредованную трансфекцию или электропорацию (Davis et al. (1986), Basic Methods in Molecular Biology). Согласно одному из вариантов реализации клетка-хозяин трансдуцируется рекомбинированной вирусной конструкцией, управляющей экспрессией белка или полипептида согласно данному описанию. Трансдуцированные клетки-хозяева продуцируют вирусные частицы, которые содержат экспрессированный белок или полипептид, полученный из частей мембраны клетки-хозяина и внедрнный вирусными частицами в процессе размножения вируса. Применяемые композиции и способы. При лечении человека или другого животного, страдающего от ассоциированного с передачей сигналов IL-6 по типу "транс" патологического состояния, связывающий домен согласно настоящему изобретению, как правило, внедряют в более крупный белок, как описано выше, и затем вводят субъекту в количестве, эффективном для улучшения симптомов патологического состояния, с последующим курсом из одного или нескольких введений. Являясь полипептидами, белки согласно настоящему изобретению могут быть ресуспендированы или растворены в фармацевтически приемлемом растворителе, возможно,содержащем стабилизирующий агент или другое фармацевтически приемлемое вспомогательное вещество, которое может применяться при внутривенном введении путм инъекции или инфузии, как более подробно описано ниже. Фармацевтически эффективная доза представляет собой дозу, необходимую для предотвращения,ингибирования появления или лечения (улучшения какого-либо симптома в определнной степени,предпочтительно всех симптомов) патологического состояния. Фармацевтически эффективная доза зависит от типа заболевания, применяемой композиции, пути введения, типа субъекта, подвергающегося лечению, физического состояния данного субъекта, подлежащего лечению, сопутствующего лечения и других факторов, определяемых специалистами в области медицины. Например, количество от 0.1 до 100 мг/кг веса тела (которое может вводиться одной дозой, ежедневно, еженедельно, ежемесячно или через любой соответствующий временной интервал) активного ингредиента может вводиться в зависимости от эффективности полипептидного связывающего домена или гибридного белка согласно настоящему изобретению. Согласно определнным вариантам реализации передача сигналов IL-6 по типу "цис" ингибируется в минимальной степени или не ингибируется вообще, т.е. любое ингибирование передачи сигналов по типу "цис" несущественно, что означает, что указанное ингибирование отсутствует, не изменяет симптомы или не выявляется. Степень ингибирования передачи сигналов IL-6 по типу "транс" может меняться,но, как правило, передача сигналов по типу "транс" меняется в такой мере, что оказывает положительное влияние на симптомы патологического состояния, опосредованного или ассоциированного с указанной передачей сигналов. Согласно определнным вариантам реализации ингибирование передачи сигналовIL-6 по типу "транс" посредством полипептидных связывающих доменов или гибридных белков согласно настоящему изобретению может замедлить, остановить или обратить прогрессирование заболевания. Композиции согласно настоящему изобретению могут применяться для лечения патологических состояний человека и других животных, опосредуемых передачей сигналов IL-6. Считается, что усиленное продуцирование IL-6 и, таким образом, усиленная передача сигналов IL-6 вовлечены в различные патологические процессы, включая болезнь Альцгеймера, аутоиммунные заболевания (как, например,ревматоидный артрит, красная волчанка), воспалительные реакции, инфаркт миокарда, болезнь Педжета,остеопороз, тврдые опухоли (как, например, рак толстой кишки, почечно-клеточная карцинома (RCC),рак простаты и рак мочевого пузыря), определнные злокачественные опухоли нервной ткани,B-клеточные злокачественные опухоли (например, синдром Каслмана, некоторые подтипы лимфомы,хроническую лимфоцитарную лейкемию (CLL) и, в частности, множественную миелому). В некоторых случаях IL-6 вовлечн в пролиферативные пути, так как этот цитокин действует наряду с другими факторами, такими как гепарин-связывающий эпидермальный фактор роста (ГС-ЭФР) и фактор роста гепатоцитов (см., например, Grant et al. (2002), Oncogene, 21:460; Badache and Hynes (2001), Cancer Res. 61:383;Wang et al. (2002), Oncogene, 21:2584). Блокирование передачи сигналов IL-6 может, таким образом, оказать положительный эффект во многих патологических ситуациях. Считается, что передача сигналов IL6 по типу "транс" играет роль в развитии многих злокачественных опухолей, а также аутоиммунных и воспалительных состояний, включая рак толстой кишки, воспалительные заболевания кишечника и ревматоидный артрит. Считается, что передача сигналов IL-6 по типу "цис" играет роль в развитии как злокачественных опухолей, так и аутоиммунных состояний, включая, помимо указанных ниже, рак молочной железы. В целом, считается, что передача сигналов по типу "транс" может быть в большей степени ассоциирована с аутоиммунными и воспалительными процессами, а передача сигналов по типу "цис" - со злокачественными опухолями (см., например, Rabe et al. (2008), Blood, 111:1021); Sansone et al. (2007), J.Clin Invest. 117:3988). Таким образом, агенты, содержащие связывающие домены согласно настоящему изобретению,применимы для лечения аутоиммунных заболеваний, включая ревматоидный артрит, синдром Сьгрена,рассеянный склероз, системную красную волчанку, болезнь Гравеса, болезнь Хашимото и синдром Каслмана, острые и хронические воспаления, остеопороз и другие нарушения, включающие потерю костной массы, а также злокачественные опухоли, включая гормон-независимый рак простаты, нарушения пролиферации B-клеток, такие как неходжкинская лимфома, и злокачественные опухоли почек, молочной железы, толстой кишки, лгких, мозга и других тканей. Согласно другому аспекту данным описанием обеспечиваются композиции, включающие гибридные белки. Фармацевтические композиции согласно настоящему изобретению, как правило, содержат один или несколько типов связывающих доменов или гибридных белков в комбинации с фармацевтически приемлемым носителем, вспомогательным веществом или растворителем. Указанные носители должны быть нетоксичны в отношении реципиентов в применяемых дозах и концентрациях. Фармацевтически приемлемые носители для терапевтического применения известны специалистам в фармацевтике и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro (Ed.),1985). Например, можно применять стерильный солевой раствор и солевой раствор в фосфатном буфере с физиологическим значением рН. Консерванты, стабилизирующие вещества, красители и т.п. могут добавляться в состав фармацевтической композиции. Например, бензоат натрия, сорбиновая кислота или сложные эфиры р-гидроксибензойной кислоты могут добавляться в качестве консервантов. Id. в 1449. Кроме того, могут применяться антиоксиданты и суспендирующие агенты. Id. Соединения согласно настоящему изобретению могут применяться в форме свободных оснований или солей, притом что обе указанные формы находятся в рамках настоящего изобретения. Фармацевтические композиции могут также содержать растворители, такие как буферы, антиоксиданты, такие как аскорбиновая кислота, низкомолекулярные (менее 10 остатков) полипептиды, белки,аминокислоты, углеводы (например, глюкозу, сахарозу или декстрины), хелатирующие агенты (например, этилендиаминтетрауксусную кислоту), глутатион и другие стабилизирующие агенты и вспомогательные вещества. Нейтральные буферные солевые растворы или солевые растворы, смешанные с неспецифическим сывороточным альбумином, являются обычно применяемыми растворителями. Предпочтительно продукт предоставляется в форме лиофилизата с использованием раствора подходящего вспомогательного вещества (например, сахарозы), служащего растворителем. Также подразумевается введение специфичных композиций мультиспецифичных гибридных белков согласно настоящему изобретению в комбинации с дополнительными агентами. Дополнительным агентом может быть агент, применяющийся в данной области техники в качестве стандартного препарата при лечении определнного патологического состояния, такого как воспалительный, аутоиммунный процесс или злокачественная опухоль. Типичные дополнительные агенты включают цитокины, факторы роста,стероиды, нестероидные противовоспалительные средства, базисные препараты для лечения ревматоидного артрита, химиотерапевтические, радиотерапевтические либо другие активные и вспомогательные агенты, а также любые их комбинации."Фармацевтически приемлемая соль" относится к соли полипептидного связывающего домена или гибридного белка согласно настоящему изобретению, являющейся фармацевтически приемлемой и обладающей желаемым фармацевтическим действием первичного соединения. Указанные соли включают(1) соли, образованные при добавлении кислот, полученные при взаимодействии с минеральными кислотами, такими как соляная, бромисто-водородная, серная, азотная, фосфорная и т.п.; либо с органическими кислотами, такими как уксусная, пропионовая, капроновая, циклопентанпропионовая,гликолевая, пировиноградная, молочная, малоновая, янтарная, яблочная, малеиновая, фумаровая, тартаровая, лимонная, бензойная, 3-(4-гидроксибензоил)бензойная, коричная, миндальная, метансульфоновая,этансульфоновая,1,2-этандисульфоновая,2-гидроксиэтансульфоновая,бензолсульфоновая,4-хлорбензолсульфоновая,2-нафталинсульфоновая,4-толуолсульфоновая,камфорсульфоновая,4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая, глюкогептоновая, 3-фенилпропионовая, триметилуксусная,трет-бутилуксусная, лаурилсерная, глюконовая, глютаминовая, гидроксинафтойная, салициловая, стеариновая, муконовая кислоты и т.п.; либо (2) соли, где кислый протон исходного соединения замещается либо ионом металла, например щелочного металла, щелочно-земельного металла или ионом алюминия; либо скоординирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин,N-метилглюкамин и т.п. Согласно определнным иллюстративным вариантам реализации полипептид или гибридный белок согласно данному описанию вводится внутривенно, например инъекцией болюса или в процессе инфузии. Пути введения, помимо внутривенного, включают оральное, локальное, парентеральное (например,подъязычно или в щчный карман), подъязычное, ректальное, вагинальное и интраназальное. Термин парентеральное согласно данному описанию включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные, внутрипазуховые, интратекальные, интрамеатальные, интрауретральные инъекции и инфузии. Фармацевтическая композиция изготавливается в форме, которая позволяет содержащимся в ней активным компонентам оставаться биологически доступными после введения указанной композиции пациенту. Композиции, вводимые пациенту, могут быть в форме единичной дозы или нескольких доз,где, например, таблетка может быть формой единичной дозы, а мкость, содержащая одно или несколько соединений согласно настоящему изобретению, в форме аэрозоля может содержать множество доз. При пероральном введении может применяться вспомогательное или связывающее вещество, такое как сахароза, каолин, глицерин, декстраны из крахмала, циклодекстрины, алгинат натрия, карбоксиметилцеллюлоза и этилцеллюлоза. Также могут применяться подсластители, консерванты, красители, ароматизаторы или любые их комбинации. Кроме того, может применяться оболочка. Также композиции для введения инъекцией могут включать один или несколько сурфактантов,консервантов, увлажняющих агентов, диспегрирующих агентов, суспендирующих агентов, буферов, стабилизирующих веществ, изотонических агентов или любых их комбинаций. Формы, произведнные на основе нуклеиновых кислот или содержащие продукты экспрессии согласно настоящему изобретению, вводятся в дозах, составляющих приблизительно от 0.01 мкг/кг до 100 мг/кг веса тела, например, внутрикожно, подкожно, внутримышечно или внутривенно либо любым другим подходящим путм, известным в данной области техники, в соответствии с конкретными обстоятельствами. Например, предпочтительная дозировка может составлять приблизительно от 1 мкг/кг до 20 мг/кг, особенно предпочтительно приблизительно от 5 мкг/кг до 10 мг/кг. Специалистам в данной области техники, безусловно, очевидно, что количество и частота введения будут зависеть от реакции пациента. Фармацевтические композиции согласно настоящему изобретению могут быть изготовлены в любой форме, применимой для введения пациенту, например в тврдой, жидкой или газообразной форме(аэрозоль). Композиция может быть в жидкой форме, например в форме эликсира, сиропа, раствора,- 25019512 эмульсии или суспензии. В качестве двух примеров жидкость может вводиться перорально или посредством инъекции. Жидкая фармацевтическая композиция, как описано в данном патенте, в форме раствора, суспензии или в любой другой подобной форме может включать один или несколько нижеуказанных компонентов: стерильные растворители, такие как вода для инъекций, солевые растворы, предпочтительно физиологический раствор, раствор Рингера, изотоничный хлорид натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителей или среды для суспензии, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты; и агенты для контроля тоничности, такие как натрий, хлорид или декстроза. Парентеральные препараты могут быть в ампулах, одноразовых шприцах или пластиковых или стеклянных мкостях, содержащих несколько доз. Физиологический солевой раствор является предпочтительным добавочным компонентом. Вводимые посредством инъекций композиции предпочтительно стерильны. Также предпочтительно включение в лекарство других компонентов, таких как средства доставки,включая соли алюминия, водномасляные эмульсии, биорасщепляемые масляные средства доставки, масляноводные эмульсии, биорасщепляемые микрокапсулы и липосомы. Примеры адъювантов для применения в такого рода средствах доставки включают N-ацетилмурамил-L-аланил-D-изоглютамин (MDP),липополисахариды (LPS), глюкан, IL-12, гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF), -интерферон и IL-15. В то время как любое приемлемое средство доставки, известное специалисту в данной области техники, может применяться в фармацевтических композициях согласно настоящему изобретению, тип средства доставки будет меняться в зависимости от способа введения и от того, желательно ли замедленное высвобождение. При парентеральном введении, средство доставки может содержать воду, солевой раствор, спирт, жир, воск, буфер или любую их комбинацию. При пероральном введении могут применяться любые из вышеуказанных средств доставки либо тврдые средства доставки, такие как маннит,лактоза, крахмал, стеарат магния, сахаринат натрия, тальк, целлюлоза, глюкоза, сахароза, карбонат магния или любая их комбинация. Данное описание подразумевает единицу дозировки, содержащую фармацевтическую композицию согласно настоящему изобретению. Такие единицы дозировки включают, например, ампулы или шприцы для введения одной или нескольких доз, включая двухъмкостные ампулы или шприцы, первая из мкостей которых содержит фармацевтическую композицию согласно настоящему изобретению в лиофилизированной форме, а вторая содержит растворитель для их объединения. Содержащие множество доз мкости могут представлять собой, например, пакет или трубку, присоединяемую к устройству для внутривенной инфузии. Настоящее описание также подразумевает набор, содержащий фармацевтическую композицию согласно настоящему изобретению в единичных или множественных дозах, мкость, например ампулу, и инструкцию к применению указанной композиции в отношении пациентов, страдающих нарушением,например одним из нарушений, описанных выше. Все патенты США, опубликованные заявки на патенты США, заявки на патенты США, патенты других стран, заявки на патенты других стран, не относящиеся к патентам публикации, таблицы, последовательности, интернет-ресурсы и т.п., упомянутые в настоящем описании, полностью включены в данное описание посредством ссылки. Нижеследующие примеры не ограничивают настоящее изобретение в какой-либо мере и являются исключительно иллюстративными. Примеры Последовательности SMIP и Xceptor. Последовательности аминокислот типичных молекул SMIP и Xceptor (SEQ ID NO: 231-292), содержащих связывающий домен анти-IL-6xR, приведены в SEQ ID NO: 671-694 и 607-668 соответственно, а соответствующие нуклеотидные кассеты экспрессии гибридных белков приведены в SEQ ID NO: 761-784 и 697-758 соответственно (необходимо отметить, что зрелые белки не содержат сигнальную пептидную последовательность, обнаруживаемую в SEQ ID NO: 671-694 и 607-668). В настоящем описании молекулы Xceptor, содержащие эктодомен TNFRSF1B на аминоконце и связывающий домен анти-IL-6xR на карбоксиконце, называются TRU(XT6)-1001 - TRU(XT6)-1062. В настоящем описании молекулы Xceptor в обратной ориентации, т.е. содержащие связывающий домен анти-IL-6xR на аминоконце и эктодоменTNFRSF1B на карбоксиконце, называются TRU(X6T)-1008 и TRU(X6T)-1019. В настоящем описании конструкции SMIP, содержащие связывающий домен анти-IL-6xR, называются TRU(S6)-1002, TRU(S6)-1004, TRU(S6)-1007, TRU(S6)-1008, TRU(S6)-1011, TRU(S6)-1013,TRU(S6)-1014, TRU(S6)-1018, TRU(S6)-1019, TRU(S6)-1022, TRU(S6)-1024 - TRU(S6)-1026,TRU(S6)-1029,TRU(S6)-1038, TRU(S6)-1040,TRU(S6)-1047,TRU(S6)-1051, TRU(S6)-1052,TRU(S6)-1054, TRU(S6)-1056 и TRU(S6)-1059 - TRU(S6)-1061. Фаговую библиотеку связывающих доменов Fab подвергали скринингу для выявления связывающих доменов, обладающих специфичностью к комплексу IL-6xR, по существу, как описано Hoet et al.(2005), Nature Biotechnol. 23:344. Связывающие домены клонировали путм амплификации методом ПЦР, вкратце, области VL и VH из клонов библиотеки Fab амплифицировали с использованием PCRSuperMix (Invitrogen, San Diego, CA) и подходящих праймеров, образующих линкер G4S за счт перекрывания, с предварительным отжигом при 56 С на протяжении 9 циклов, затем 62 С на протяжении еще 20 циклов. Продукты ПЦР разделяли на агарозном геле и очищали с использованием колонки PCR Purification Qiagen (Chatsworth, CA). Сшивающая реакция второго этапа включала смешивание молярного эквивалента продуктов VL и VH с буфером Expand и водой, денатурированных при 95 С в течение 5 с, затем медленно охлажднных до комнатной температуры. Для амплификации добавляли смесь dNTPs с ферментом Expand и инкубировали при 72 С в течение 10 с. Добавляли внешние праймеры (5' VH и 3' VL) и цикл повторяли 35 раз с отжигом при 62 С и 45-минутной реакцией удлинения цепи. Полученный продукт, состоящий из 750 пар оснований, очищали в геле, расщепляли с помощью EcoRI и NotI и клонировали в плазмиду pD28 (подробнее см. публикацию заявки на патент США 2005/0136049 и публикацию заявки РСТWO 2007/146968). Активность связывания исследовали методом ELISA (твердофазного иммуноферментного анализа), как описано в Hoet et al. (2005). Различные гибридные белки SMIP и Xceptor, указанные в настоящем описании, тестировали на предмет активности анти-IL-6xR, активности анти-TNF или обоих видов активности, как описано ниже. Используемые в следующих примерах аббревиатуры включают следующие термины: ФСБ-Т: ФСБ, рН 7.2-7.4 и 0.1% Tween20; рабочий буфер: ФСБ-Т с 1% BSA; блокирующий буфер: ФСБ-Т с 3% BSA. Пример 1. Экспрессия гибридных белков. Экспрессию некоторых гибридных белков, указанных в настоящем описании, в 293 клетках осуществляли с использованием системы экспрессии FreeStyle 293 (Invitrogen, Carlsbad, CA) в соответствии с инструкциями изготовителя. Для каждой трансфекции 30 мл использовали 3107 клеток в 28 мл среды для экспрессииFreeStyle 293. В день трансфекции небольшую аликвоту суспензии клеток переносили в микроцентрифужную пробирку и определяли выживаемость и степень агрегации клеток с использованием метода невключения красителя трипанового синего. Суспензию энергично встряхивали в течение 45 с с разрушением агрегатов клеток и определяли общее количество клеток с использованием счтчика"Coulter Counter" или гемоцитометра. Выживаемость клеток составляла более 90%. Колбу для качалки,содержащую необходимые клетки, помещали в инкубатор с температурой 37 С на орбитальную качалку. Для каждого образца для трансфекции получали комплексы липид-ДНК следующим образом. 30 мкг плазмидной ДНК разводили в Opti-MEM I до общего объема, равного 1 мл, и осторожно перемешивали. 60 мкл 293fectin разводили в Opti-MEM I до общего объема, равного 1 мл, осторожно перемешивали и инкубировали в течение 5 мин при комнатной температуре. После инкубации в течение 5 мин разведенную ДНК добавляли к разведенному 293fectin с получением общего объема, равного 2 мл, и осторожно смешивали. Полученный раствор инкубировали в течение 20-30 мин при комнатной температуре для образования комплексов ДНК-293fectin. В то время как происходила инкубация комплексов ДНК-293fectin, суспензию клеток извлекали из инкубатора и подходящий объем указанной суспензии клеток помещали в стерильные одноразовые 125 мл колбы Эрленмейера для качалки. Добавляли свежую, предварительно нагретую среду для экспрессии FreeStyle 293 до общего объема, равного 28 мл, для трансфекции 30 мл. По завершении инкубации комплекса ДНК-293fectin добавляли 2 мл комплекса ДНК-293fectin в колбы для качалки. В колбу отрицательного контроля добавляли 2 мл Opti-MEM I вместо комплекса ДНК-293fectin. Каждая колба содержала общий объем, равный 30 мл, с конечной плотностью клеток,равной приблизительно 1106 жизнеспособных клеток/мл. Клетки инкубировали в инкубаторе с температурой 37 С с увлажненной атмосферой 8% СО 2 в воздухе на орбитальной качалке с вращением при 125 об/мин. Клетки собирали приблизительно через 7 дней после трансфекции и анализировали на предмет экспрессии рекомбинантного белка. Гибридные белки, содержащие связывающий домен - антагонист IL-6, экспрессировали в клетках 293, как описано выше. Пример 2. Связывание Xceptor с IL-6 и Hyper-IL-6 по данным ELISA. Активность в отношении связывания с Hyper-IL-6 (HIL-6 или IL-6xR), с рекомбинантным IL-6 человека (rhIL-6) и растворимым IL-6R человека исследовали для молекул Xceptor TRU(XT6)-1002, 1019,1025, 1042, 1058 и TRU(X6T)-1019 (SEQ ID NO: 608, 625, 631, 648, 664 и 670 соответственно), по существу, следующим образом. Связывание HIL-6 и IL-6. В каждую лунку 96-луночного планшета добавляли 100 мкл раствора козьего IgG-Fc против сыворотки человека в ФСБ (Jackson ImmunoResearch, West Grove, PA) концентрации 2 мкг/мл, рН 7.2-7.4. Планшет закрывали и инкубировали в течение ночи при 4 С. После четырхкратной промывки ФСБ-Т в каждую лунку добавляли 250 мкл блокирующего буфера (ФСБ-Т с 3% BSA или 10% нормальной сыво- 27019512 роткой козы), планшет закрывали и инкубировали при комнатной температуре в течение 2 ч (или при 4 С в течение ночи). После трхкратной промывки планшета ФСБ-Т в парные лунки планшета, на который нанесн античеловеческий IgG-Fc, добавляли 100 мкл/лунку образцов Xceptor TNFRSF1Bанти-HIL6 и химерного белка gp130-Fc человека (RD Systems, Minneapolis, MN), трхкратно разведнную сериями в рабочем буфере, начиная с 300 нг/мл, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т в парные лунки добавляли 100 мкл/лунку 150 пМ раствора Hyper-IL-6 человека или рекомбинантного IL-6 человека в рабочем буфере, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора 150 нг/мл античеловеческого IL-6-биотина (RD Systems) в рабочем буфере, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку конъюгата стрептавидина с пероксидазой хрена (Zymed, San Francisco, СА), разведнного в рабочем буфере в соотношении 1:4,000, планшет закрывали и инкубировали при комнатной температуре в течение 30 мин. После шестикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора субстрата 3,3,5,5-тетраметилбензидина (ТМБ) (Pierce, Rockford, IL) в течение 3-5 мин, а затем реакцию останавливали добавлением по 50 мкл стоп-буфера (1 н. H2SO4) на лунку. Поглощение в каждой лунке измеряли при 450 нм. Связывание sIL-6R. В каждую лунку 96-луночного планшета добавляли 100 мкл раствора козьего IgG-Fc против сыворотки человека (ICN Pharmaceuticals, Costa Mesa, CA) концентрации 2 мкг/мл в ФСБ, рН 7.2-7.4. Планшеты закрывали и инкубировали в течение ночи при 4 С. После четырхкратной промывки ФСБ-Т в каждую лунку добавляли 250 мкл блокирующего буфера (ФСБ-Т с 3% BSA или 10% нормальной сывороткой козы), планшет закрывали и инкубировали при комнатной температуре в течение 2 ч (или при 4 С в течение ночи). После трхкратной промывки планшета ФСБ-Т в парные лунки планшета, на который нанесн античеловеческий IgG-Fc, добавляли 100 мкл/лунку образцов Xceptor TNFRSF1Bанти-HIL-6,античеловеческого IL-6R (RD Systems, Minneapolis, MN) в качестве положительного контроля и IgG человека или гибридного белка gp130-Fc человека (RD Systems) в качестве отрицательных контролей,каждый трхкратно серийно разведнный в рабочем буфере, начиная с 300 нг/мл, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т в парные лунки добавляли 100 мкл/лунку 75 пМ раствора рекомбинантного sIL-6R человека (RD Systems) в рабочем буфере, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора античеловеческого IL-6R-биотина (RD Systems) концентрации 100 нг/мл в рабочем буфере,планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку конъюгата стрептавидина с пероксидазой хрена (Zymed, San Francisco, CA), разведнного в рабочем буфере в соотношении 1:4,000, планшет закрывали и инкубировали при комнатной температуре в течение 30 мин. После шестикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора субстрата 3,3,5,5-тетраметилбензидина (ТМБ)(Pierce, Rockford, IL) в течение 3-5 мин, а затем реакцию останавливали добавлением 50 мкл стоп-буфера(1 н. H2SO4). Поглощение в каждой лунке измеряли при 450 нм. Данные на фиг. 1 А и 1 В демонстрируют, что все гибридные белки Xceptor, независимо от того, находится ли эктодомен TNFRSF1B на амино- или карбоксиконце молекул указанного гибридного белка,могут связываться с HIL-6. Кроме того, данные исследования показывают, что белки Xceptor обладают специфичностью к комплексу IL-6xR, поскольку только два белка Xceptor связываются с rhIL-6 (фиг. 1 В) и ни один не связывается с sIL-6R (фиг. 1 С). В родственных исследованиях было обнаружено, чтоTRU(XT6)-1002 и SMIP TRU(S6)-1002 перекрестно реагируют с IL-6 низшего примата, макаки-резуса. Пример 3. Связывание Xceptor с TNF- по данным ELISA. Активность в отношении связывания с TNF- исследовали для молекул Xceptor TRU(XT6)-1002,1042, 1058, 1019 и TRU(X6T)-1019 (SEQ ID NO: 608, 648, 664, 625 и 670 соответственно), по существу,следующим образом. В каждую лунку 96-луночного планшета добавляли 100 мкл раствора козьего IgG-Fc против сыворотки человека (ICN Pharmaceuticals, Costa Mesa, CA) концентрации 2 мкг/мл в ФСБ, рН 7.2-7.4. Планшет закрывали и инкубировали в течение ночи при 4 С. После четырхкратной промывки ФСБ-Т в каждую лунку добавляли 250 мкл блокирующего буфера планшет закрывали и инкубировали при комнатной температуре в течение 2 ч (или при 4 С в течение ночи). После трхкратной промывки планшета ФСБ-Т в парные лунки планшета, на который нанесн античеловеческий IgG-Fc, добавляли 100 мкл/лунку образцов Xceptor TNFRSF1Bанти-HIL-6, Энбрела (этанерцепта) и рекомбинантного гибридного белкаTNFR2 (TNFRSF1B)-Fc человека (RD Systems, Minneapolis, MN) в качестве положительных контролей и IgG человека или гибридного белка gp130-Fc человека (RD Systems) в качестве отрицательных контролей, каждый трхкратно серийно разведнный в рабочем буфере, начиная с 300 нг/мл, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной про- 28019512 мывки планшета ФСБ-Т в парные лунки добавляли 100 мкл/лунку раствора рекомбинантного TNF- человека (RD Systems) концентрации 2 нг/мл в рабочем буфере, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора античеловеческого TNFбиотина (RD Systems) концентрации 200 нг/мл в рабочем буфере, планшет закрывали и инкубировали при комнатной температуре в течение примерно 1-2 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку конъюгата стрептавидина с пероксидазой хрена (Jackson ImmunoResearch, West Grove, PA), разведенного в рабочем буфере в соотношении 1:1,000, планшет закрывали и инкубировали при комнатной температуре в течение 30 мин. После шестикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора субстрата 3,3,5,5-тетраметилбензидина (ТМБ) (Pierce, Rockford, IL) в течение 3-5 мин, а затем реакцию останавливали добавлением по 50 мкл стоп-буфера (1 н. H2SO4) на лунку. Поглощение в каждой лунке измеряли при 450 нм. Данные на фиг. 2 показывают, что все тестируемые гибридные белки Xceptor могут связываться сTNF-, независимо от того, находится ли эктодомен TNFRSF1B на амино- или карбоксиконце указанного гибридного белка. Пример 4. Связывание двойного лиганда Xceptor по данным ELISA. Параллельное связывание с TNF- и комплексом IL-6xR исследовали для TRU(XT6)-1006(SEQ ID NO: 612) гибридного белка Xceptor, по существу, следующим образом. В каждую лунку 96-луночного планшета добавляли 100 мкл раствора HIL-6 человека (5 мкг/мл в ФСБ, рН 7.2-7.4). Планшет закрывали и инкубировали в течение ночи при 4 С. После четырхкратной промывки ФСБ-Т в каждую лунку добавляли 250 мкл блокирующего буфера планшет закрывали и инкубировали при комнатной температуре в течение 2 ч (или при 4 С в течение ночи). После трхкратной промывки планшета ФСБ-Т в парные лунки планшета, на который нанесен HIL-6, добавляли 100 мкл/лунку образцов Xceptor TNFRSF1BHIL-6, трхкратно серийно разведнных в рабочем буфере,начиная с 300 нг/мл. Отрицательные контроли включали только гибридный белок gp130-Fc человека(RD Systems, Minneapolis, MN), Энбрел (этанерцепт) и рабочий буфер. Планшет закрывали и инкубировали при комнатной температуре в течение 1.5 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора рекомбинантного TNF- человека (RD Systems, Minneapolis, MN) концентрации 2 нг/мл в рабочем буфере планшет закрывали и инкубировали при комнатной температуре в течение 1.5 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора античеловеческого TNFбиотина (RD Systems) концентрации 200 нг/мл в рабочем буфере, планшет закрывали и инкубировали при комнатной температуре в течение 1.5 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку конъюгата стрептавидина с пероксидазой хрена (JacksonImmunoResearch, West Grove, PA), разведенного в рабочем буфере в соотношении 1:1000, планшет закрывали и инкубировали при комнатной температуре в течение 30 мин. После шестикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку раствора субстрата 3,3,5,5-тетраметилбензидина (ТМБ)(Pierce, Rockford, IL) в течение 3-5 мин, а затем реакцию останавливали добавлением по 50 мкл стопбуфера (1 н. H2SO4) на лунку. Поглощение в каждой лунке измеряли при 450 нм. Данные на фиг. 3 демонстрируют, что белки Xceptor могут связываться с двумя лигандами одновременно (в данном случаеTNF- и Гипер IL-6). Пример 5. Блокирование Xceptor связывания Hyper-IL-6 с GP130 по данным ELISA. Блокирование связывания Hyper-IL-6 (IL-6xR) с растворимым рецептором gp130 гибридными белками Xceptor TRU(XT6)-1004, 1006, 1007, 1008, 1013 и 1019 (SEQ ID NO: 610, 612, 613, 614, 619 и 625 соответственно) исследовали, по существу, следующим образом. В каждую лунку 96-луночного планшета добавляли 100 мкл раствора гибридного белка gp130-Fc человека (RD Systems, Minneapolis, MN) концентрации 0.25-0.5 мкг/мл в ФСБ, рН 7.2-7.4. Планшеты закрывали и инкубировали в течение ночи при 4 С. После четырхкратной промывки ФСБ-Т в каждую лунку добавляли 250 мкл блокирующего буфера (ФСБ-Т с 3% BSA или 10% нормальной сывороткой козы), планшет закрывали и инкубировали при комнатной температуре в течение 2 ч (или при 4 С в течение ночи). Осуществляли пятикратные серийные разведения следующих образцов: образцы Xceptor(RD Systems) в качестве положительных контролей и античеловеческий IL-6 (RD Systems), IgG человека или Энбрел (этанерцепт) в качестве отрицательных контролей, в рабочем буфере, начиная с 50 мкг/мл. Равные объемы серийно разведнных образцов Xceptor смешивали с Hyper-IL-6 (конечная концентрация Hyper-IL-6 равна 2.5 нг/мл) и инкубировали при комнатной температуре в течение 1 ч. После трхкратной промывки планшета ФСБ-Т в парные лунки планшета, на который нанесн gp130-Fc человека, добавляли 100 мкл/лунку серийных разведений смесей Xceptor/HIL-6, гибридного белка gp130Fc человека, античеловеческого IL-6R, античеловеческого IL-6, IgG человека и Энбрела (этанерцепта),планшет закрывали и инкубировали при комнатной температуре в течение примерно 1.5 ч. После пятикратной промывки планшета ФСБ-Т добавляли 100 мкл/лунку конъюгата антитела против IgG-Fc мыши с пероксидазой хрена (Pierce, Rockford, IL), разведнного в рабочем буфере в соотношении 1:10,000,- 29
МПК / Метки
МПК: C07K 16/24, A61K 39/395, C07K 16/46, C07K 16/28
Метки: il-6-опосредованная, иммунотерапия
Код ссылки
<a href="https://eas.patents.su/30-19512-il-6-oposredovannaya-immunoterapiya.html" rel="bookmark" title="База патентов Евразийского Союза">Il-6-опосредованная иммунотерапия</a>
Предыдущий патент: Замещенные производные аминопропионовой кислоты в качестве ингибиторов неприлизина
Следующий патент: Неорганическая плита и способ ее изготовления
Случайный патент: Способ утяжеления пластмассовых труб и утяжеленные пластмассовые трубы






























