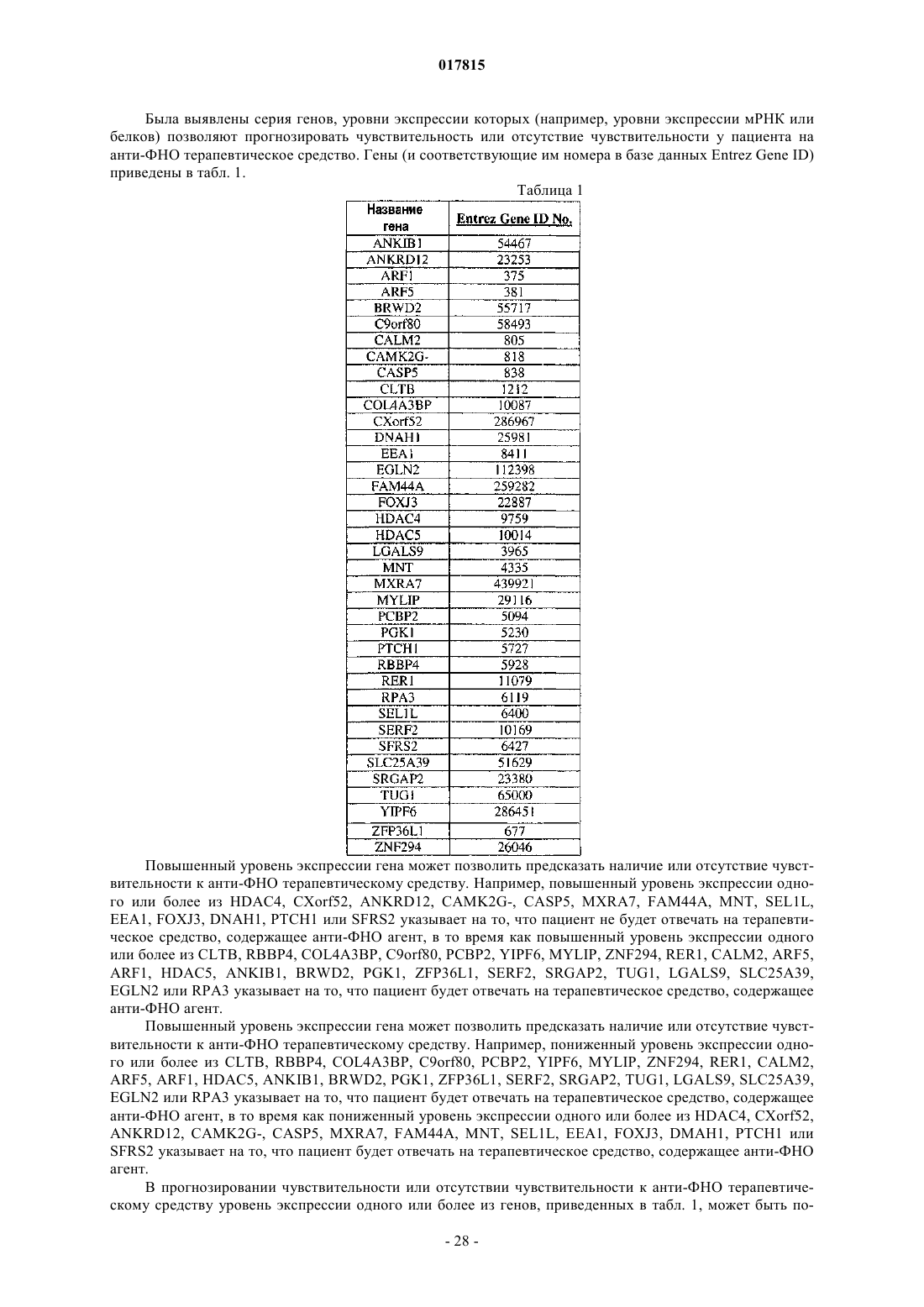
Биомаркеры для прогнозирования чувствительности или отсутствия чувствительности к анти-фно агентам
Номер патента: 17815
Опубликовано: 29.03.2013
Авторы: Лю Чуньюй, Бьенковска Ядвига, Карулли Джон П., Батливалла Франак, Грегерсен Питер К.
Формула / Реферат
1. Способ прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент, при этом указанный способ включает
получение биологического образца от пациента, страдающего иммунным нарушением; и
измерение уровня экспрессии одного или более генов в указанном биологическом образце, причем указанные один или более генов включают по меньшей мере один ген, выбранный из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2,
при этом по меньшей мере один признак из:
(i) повышенного по сравнению со здоровым лицом уровня экспрессии одного или более из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, РСВР2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1 или
(ii) пониженного по сравнению со здоровым лицом уровня экспрессии одного или более из ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, РТСН1, SEL1L или SFRS2,
указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент.
2. Способ прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент, при этом указанный способ включает
получение биологического образца от пациента, страдающего иммунным нарушением; и
измерение уровня экспрессии одного или более генов в указанном биологическом образце, причем указанные один или более генов включают по меньшей мере один ген, выбранный из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2, при этом по меньшей мере один признак из следующих:
(i) повышенный по сравнению со здоровым лицом уровень экспрессии одного или более из ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, РТСН1, SEL1L или SFRS2 или
(ii) пониженный по сравнению со здоровым лицом уровень экспрессии одного или более из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, РСВР2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1
указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент.
3. Способ лечения иммунного заболевания, включающий введение пациенту эффективного количества терапевтического средства, содержащего анти-ФНО агент, в котором у указанного пациента выявлен по меньшей мере один признак из следующих:
(i) повышенный по сравнению со здоровым лицом уровень экспрессии одного или более из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1 или
(ii) пониженный по сравнению со здоровым лицом уровень экспрессии одного или более из ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, РТСН1, SEL1L или SFRS2.
4. Способ по п.1, который включает
определение того, что уровень экспрессии одного или более из
(i) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 повышен по сравнению со здоровым лицом или
(ii) ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 понижен по сравнению со здоровым лицом; и
выбор для указанного пациента терапевтического средства, содержащего анти-ФНО агент.
5. Способ по п.2, который включает
определение того, что уровень экспрессии одного или более из:
(i) ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 повышен по сравнению со здоровым лицом или
(ii) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 понижен по сравнению со здоровым лицом;
выбор для указанного пациента терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом.
6. Способ по любому из пп.1, 2, 4 или 5, в котором измеряют уровень РНК одного или более генов.
7. Способ по любому из пп.1, 2, 4 или 5, в котором измеряют уровень белка одного или более генов.
8. Способ по п.1, дополнительно включающий создание записи, указывающей, что пациент, вероятно, будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если уровень экспрессии одного или более из генов:
(i) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1 повышен по сравнению со здоровым лицом или
(ii) ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 понижен по сравнению со здоровым лицом.
9. Способ по п.2, дополнительно включающий создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если уровень экспрессии одного или более из:
(i) ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 повышен по сравнению со здоровым лицом или
(ii) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1 понижен по сравнению со здоровым лицом.
10. Способ по п.8 или 9, в котором запись создают на машиночитаемом носителе.
11. Способ по любому из пп.1-10, в котором уровень экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2, повышен или понижен по сравнению со здоровым лицом по меньшей мере примерно в 1,5 раза.
12. Способ по любому из пп.1, 2 или 4-11, который включает измерение уровня экспрессии по меньшей мере пяти генов, выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2.
13. Способ по п.3, в котором у пациента выявлен повышенный или пониженный по сравнению со здоровым лицом уровень экспрессии по меньшей мере пяти генов, выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2.
14. Способ по п.12 или 13, в котором указанные по меньшей мере пять генов выбирают из группы, состоящей из ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6.
15. Способ по любому из пп.12-14, в котором указанные по меньшей мере пять генов включают пять или более генов из CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7, PGK1, SFRS2 или YIPF6.
16. Способ по любому из пп.1, 2 или 4-11, который включает измерение уровня экспрессии по меньшей мере восьми генов, выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, РСВР2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2.
17. Способ по п.16, в котором указанные по меньшей мере восемь генов включают восемь или более генов из ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6.
18. Способ по любому из пп.16 или 17, в котором указанные по меньшей мере восемь генов включают CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7, PGK1, SFRS2 и YIPF6.
19. Способ по любому из пп.1, 2 или 4-11, который включает измерение уровня экспрессии по меньшей мере 24 генов, выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2.
20. Способ по п.19, в котором указанные по меньшей мере 24 гена включают ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2, YIPF6.
21. Способ по любому из пп.1-20, дополнительно включающий прописывание пациенту терапевтического средства, содержащего анти-ФНО агент.
22. Способ по любому из пп.1-21, дополнительно включающий введение пациенту анти-ФНО агента.
23. Способ по любому из пп.1-22, в котором пациент страдает воспалительным заболеванием.
24. Способ по любому из пп.1-23, в котором пациент страдает ревматоидным артритом или болезнью Крона.
25. Способ по любому из пп.1-24, в котором пациент представляет собой человека.
26. Композиция, содержащая по меньшей мере пять полинуклеотидов, которые селективно гибридизуются с каждым по меньшей мере из пяти генов, выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2.
27. Композиция по п.26, в которой указанные по меньшей мере пять генов выбраны из группы, состоящей из ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6.
28. Композиция по п.26 или 27, в которой указанные по меньшей мере пять генов выбраны из группы, состоящей из CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7, PGK1, SFRS2 и YIPF6.
29. Набор, включающий
биочип, содержащий множество полинуклеотидов, связанных с твердой подложкой, где указанное множество включает по меньшей мере пять полинуклеотидов, которые селективно гибридизуются с каждым по меньшей мере из пяти генов, выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2; и
инструкции по обнаружению присутствия или количества одного из более полинуклеотидов в образце.
30. Набор по п.29, дополнительно включающий один или более реагентов для выделения нуклеиновых кислот из образца.
31. Набор по любому из пп.29 и 30, дополнительно включающий средства для амплификации нуклеиновых кислот.
Текст
БИОМАРКЕРЫ ДЛЯ ПРОГНОЗИРОВАНИЯ ЧУВСТВИТЕЛЬНОСТИ ИЛИ ОТСУТСТВИЯ ЧУВСТВИТЕЛЬНОСТИ К АНТИ-ФНО АГЕНТАМ Согласно настоящему изобретению предложены биомаркеры, которые позволяют предсказать чувствительность или отсутствие чувствительности пациента к терапевтическому средству,содержащему анти-ФНО агент. Биомаркеры, композиции и способы, описанные в настоящем изобретении, можно использовать при выборе подходящих способов лечения (например, не терапевтического средства, содержащего анти-ФНО агент, или терапевтического средства, не содержащего анти-ФНО агент) для пациента, страдающего заболеванием, таким как иммунное нарушение.(71)(73) Заявитель и патентовладелец: БАЙОДЖЕН АЙДЕК МА ИНК.; ДЗЕ ФЕЙНСТЕЙН ИНСТИТЬЮТ ФОР МЕДИКАЛ РИСЕРЧ (US) Перекрестная ссылка на родственные заявки По заявке на данное изобретение испрашивается приоритет согласно временной заявке США 60942937, поданной 8 июня 2007 г., описание которой полностью включено посредством ссылки. Заявление о федеральном субсидировании исследования или разработки Описанное в настоящем патенте исследование было проведено при поддержке гранта номер 1-AR-1-2256 Национального института артрита и заболеваний опорно-двигательного аппарата и кожи Национального института здравоохранения США. Правительство США может иметь определенные права на настоящее изобретение. Уровень техники Фактор некроза опухолей альфа (ФНО) представляет собой цитокин, который играет ключевую роль в патогенезе воспалительных заболеваний, таких как ревматоидный артрит. Для устранения симптомов некоторых воспалительных заболеваний можно использовать блокирование сигнального пути ФНО с помощью моноклональных антител к ФНО (например, адалимумаб или инфликсимаб) или белков слияния с рецептором ФНО (например, этанерецепт). Хотя анти-ФНО лечение является весьма успешным, оно не вызывает значимого клинического ответа у всех пациентов, которые его получают. Идентификация пациентов как возможно имеющих ответную реакцию или возможно не имеющих ответной реакции на анти-ФНО терапию очень важна для выбора оптимальной схемы лечения пациентов. Пациенты с выявленными биомаркерами, указывающими на то, что пациент вряд ли будет отвечать на анти-ФНО лечение, могут быть либо сразу переведены на другие терапевтические средства (т.е. без применения анти-ФНО лечения), либо после неудачи первичного лечения анти-ФНО агентами. Краткое описание изобретения Настоящее изобретение основано, по меньшей мере частично, на обнаружении биомаркеров, которые позволяют предсказать чувствительность или нечувствительность пациента к анти-ФНО терапии. Например, уровень экспрессии одного или более из генов, приведенных в табл. 1, или присутствие одного или более однонуклеотидного полиморфизма, приведенного в табл. 2-4 или 13, позволяют предсказать вероятность, с которой данный пациент ответит или не ответит на анти-ФНО терапию. Соответственно,биомаркеры, композиции и способы, описанные в настоящем патенте, могут быть использованы при выборе подходящих способов лечения (например, анти-ФНО терапии или других видов терапии) пациента,страдающего заболеванием, таким как иммунное или воспалительное заболевание (например, ревматоидный артрит или болезнь Крона). В одном аспекте изобретение относится к способу лечения иммунного нарушения, который включает стадию введения пациенту эффективного количества терапевтического средства, содержащего антиФНО агент, при этом у пациента выявлен по меньшей мере один признак (например, по меньшей мере 2,по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17,по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22 или по меньшей мере 24) из:(i) повышенного по сравнению со здоровым лицом уровня экспрессии одного или более из генов(ii) пониженного по сравнению со здоровым лицом уровня экспрессии одного или более геновANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7,PTCH1, SEL1L или SFRS2. В другом аспекте изобретение относится к способу лечения иммунного нарушения, который включает стадию введения пациенту эффективного количества терапевтического средства, которое содержит агент, не являющийся анти-ФНО агентом, при этом у пациента выявлен по меньшей мере один признак(например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22 или по меньшей мере 24) из:(i) повышенного по сравнению со здоровым лицом уровня экспрессии одного или более из генов(ii) понижения уровня экспрессии по сравнению со здоровым лицом одного или более из генов В некоторых вариантах осуществления любого из указанных выше способов у пациента выявляют повышенный или пониженный по сравнению со здоровым лицом уровень экспрессии по меньшей мере два гена (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16,по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23 или по меньшей мере 24 или более), выбираемых из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5,LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6,ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4,MNT, MXRA7, PTCH1, SEL1L и SFRS2. По меньшей мере пять генов могут включать, например,ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2,FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6. По меньшей мере пять генов могут включать, например, CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7,PGK1, SFRS2 или YIPF6. По меньшей мере восемь генов могут включать, например, ANKIB1, ARF1,ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4,HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и/или YIPF6. По меньшей мере восемь генов могут состоять из или включать, например, CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7,PGK1, SFRS2 и/или YIPF6. По меньшей мере 24 гена могут состоять из или включать, например,ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2,FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агенты. Способ включает стадии получения биологического образца от пациента с иммунным нарушением и измерения уровня экспрессии одного или более генов в биологическом образце, причем указанные один или более ген включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6,по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16,по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22 или по меньшей мере 24) гена, выбранного из группы, состоящей из ANKIB1,ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2,PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12,CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L иSFRS2, при этом (i) повышенный по сравнению со здоровым лицом уровень экспрессии по меньшей мере один из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5,LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6,ZNF294 или ZFP36L1 или (ii) пониженный по сравнению со здоровым лицом уровень экспрессии один или более из ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT,MXRA7, PTCH1, SEL1L или SFRS2 указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, при этом по меньшей мере один признак из (i) повышенного по сравнению со здоровым лицом уровня экспрессии одного или более из ANKRD12, CAMK2G-, CASP5,CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 или (ii) пониженного по сравнению со здоровым лицом уровня экспрессии одного или более из ANKIB1, ARF1,ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1,RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1 указывает на то,что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. Для одного или более генов можно измерять экспрессию РНК или белка. Уровень экспрессии РНК одного или более генов можно измерить, используя, например, анализ с помощью микрочипов (microarray) и/или количественной полимеразной цепной реакции. В некоторых вариантах осуществления способ включает определение того, что уровень экспрессии одного или более из (i) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2,HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1,YIPF6, ZNF294 или ZFP36L1 повышен по сравнению со здоровым лицом или (ii) ANKRD12, CAMK2G-,CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 понижен по сравнению со здоровым лицом; и выбор для пациента терапевтического средства, содержащего анти-ФНО агент. Способ может далее включать введение пациенту терапевтического средства, содержащего анти-ФНО агент. В некоторых вариантах осуществления способ может далее включать создание записи, указывающей, что пациент, вероятно, даст ответ на анти-ФНО терапевтическое средство, если уровень экспрессии одного или более из генов (i) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80,EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2,TUG1, YIPF6, ZNF294 или ZFP36L1 повышен по сравнению со здоровым лицом или (ii) ANKRD12,-2 017815CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 понижен по сравнению со здоровым лицом. Запись может быть создана, например, на машиночитаемом носителе. В некоторых вариантах осуществления способ может включать определение того, что уровень экспрессии одного или более из (i) ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА 1, FAM44A,FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 повышен по сравнению со здоровым лицом,или (ii) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9,MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 илиZFP36L1 понижен по сравнению со здоровым лицом; и выбор для лица терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. Способ далее может включать введение пациенту средства, содержащего не анти-ФНО агент. В некоторых вариантах осуществления способ может далее включать создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если уровень экспрессии одного или более из (i) ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1,EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 повышен по сравнению со здоровым лицом, или (ii) ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2,HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1,YIPF6, ZNF294 или ZFP36L1 понижен по сравнению со здоровым лицом. Запись может быть создана,например, на машиночитаемом носителе. В некоторых вариантах осуществления любого из способов, описанных в настоящем изобретении,уровень экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из ANKIB1, ARF1,ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1,RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12,CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L иSFRS2, повышен или понижен по сравнению со здоровым лицом по меньшей мере примерно в 1,5 раза(например, по меньшей мере примерно в 2 раза, по меньшей мере примерно в 2,5 раза, по меньшей мере примерно в 3,0 раза, по меньшей мере примерно в 3,5 раза, по меньшей мере примерно в 4,0 раза или по меньшей мере примерно в 5 раз или более). Описанные способы могут включать измерение уровня экспрессии по меньшей мере двух генов (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, или по меньшей мере 24), выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5,LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6,ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4,MNT, MXRA7, PTCH1, SEL1L и SFRS2. По меньшей мере пять генов могут включать, например,ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2,FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6. По меньшей мере пять генов могут включать, например, CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7,PGK1, SFRS2 или YIPF6. По меньшей мере восемь генов могут включать, например, ANKIB1, ARF1,ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4,HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и/или YIPF6. По меньшей мере восемь генов могут состоять из или включать, например, CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7,PGK1, SFRS2 и/или YIPF6. По меньшей мере 24 гена могут состоять из или включать, например,ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2,FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент, который включает стадию оценки уровня экспрессии (например, уровня экспрессии РНК или белка) одного или более генов в биологическом образце, полученном от пациента, причем указанные гены включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17,по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22 или по меньшей мере 24) ген, выбранный из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2,CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1,RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5,CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L и SFRS2, при этом повышенный уровень экспрессии ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80,EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2,TUG1, YIPF6, ZNF294 или ZFP36L1 или пониженный уровень экспрессии ANKRD12, CAMK2G-,-3 017815CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент,а повышенный уровень экспрессии ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A,FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2 или пониженный уровень экспрессииZFP36L1 указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее антиФНО агент. В некоторых вариантах осуществления способ может включать определение того, что уровень экспрессии одного или более (например, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более,15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более или 22 или более) генов из ANK1B1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2,HDAC5, LGALS9, MYLIP, РСВР 2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1,YIPF6, ZNF294 или ZFP36L1 повышен или ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА 1,FAM44A, FOXJ3, HDAC4, MNT, MXRA7, РТСН 1, SEL1L или SFRS2 понижен; и прогнозирование того,что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В некоторых вариантах осуществления способы включают, после прогнозирования того, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, введение указанному пациенту терапевтического средства, содержащего анти-ФНО агент. В некоторых вариантах осуществления способ может включать определение того, что уровень экспрессии одного или более (например, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более,15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более или 22 или более) из ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, ЕЕА 1, FAM44A, FOXJ3, HDAC4, MNT,MXRA7, РТСН 1, SEL1L или SFRS2 повышены или ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB,COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2,SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294 или ZFP36L1 понижен; и прогнозирование, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В некоторых вариантах осуществления способы включают, после предсказания того, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, введение указанному пациенту терапевтического средства,не являющегося анти-ФНО агентом. В еще одном аспекте изобретение относится к способу лечения иммунного нарушения. Способ включает стадию введения пациенту эффективного количества терапевтического средства, содержащего анти-ФНО агент, при этом у пациента выявлен один или более (например, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более,20 или более или все) генотипов по однонуклеотидным полиморфизмам (SNP), выбранных из группы,состоящей из В другом аспекте изобретение относится к способу лечения иммунного нарушения, который включает стадию введения пациенту эффективного количества терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом, при этом у пациента выявлен один или более (например, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более,18 или более, 19 или более, 20 или более или все) генотипов по SNP, выбранных из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13. В некоторых вариантах осуществления у пациента выявлен один или более (например, 2 или более,3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или всех) генотипов по SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления у пациента выявлен один или более (например, 2 или более,3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или всех) генотипов SNP, выбранных из группы, состоящей из любого из В некоторых вариантах осуществления у пациента выявлен один или более (например, 2 или более,3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или всех) генотипов SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления у пациента выявлен один или более (например, 2 или более,3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 илиболее, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или всех) генотипов SNP, выбранных из группы, состоящей из любых генотипов SNP, приведенных в табл. 13. В другом аспекте изобретение относится к способу лечения иммунного заболевания, который включает стадию введения пациенту, нуждающемуся в таком лечении, эффективного количества терапевтического средства, содержащего анти-ФНО агент, в котором у указанного пациента выявлен один или более (например, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. Способ включает стадии: получение биологического образца от пациента, страдающего иммунным нарушением; и обнаружение присутствия или отсутствия в биологическом образце одного или более генотипа SNP, где один или более генотипов по SNP включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20) генотип SNP, выбранный из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13, где присутствие одного или более из указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент,и где присутствие одного или более из или любого из генотипов SNP, приведенных в табл. 13, указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. Способ включает стадии: получение биологического образца от пациента, страдающего иммунным нарушением; и обнаружение присутствия или отсутствия в указанном биологическом образце одного или более генотипов SNP, при этом указанный один или более генотипов по SNP включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3,по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18,по меньшей мере 19 или по меньшей мере 20) генотип SNP, выбранный из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13, при этом присутствие одного или более из или любого из генотипов SNP, приведенных в табл. 13, указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. Способ включает стадии: получение биологического образца от пациента, страдающего иммунным нарушением; и определение присутствия или отсутствия в указанном биологическом образце одного или более генотипов SNP, при этом указанный один или более генотипов по SNP включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3,по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18,по меньшей мере 19 или по меньшей мере 20) генотип SNP, выбранный из группы, состоящей из при этом присутствие любого одного или более из указывает на то, что пациент не даст ответ на терапевтическое средство, содержащее анти-ФНО агент. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. Способ включает стадии: получение биологического образца от пациента, страдающего иммунным нарушением; и обнаружение присутствия или отсутствия в биологическом образце одного или более генотипов SNP, где один или более генотипов по SNP включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, поменьшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14,-9 017815 по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20) генотип SNP, выбранный из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13, при этом присутствие одного или более из указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. Способ включает стадии: получение биологического образца от пациента, страдающего иммунным нарушением; и обнаружение присутствия или отсутствия в биологическом образце одного или более генотипов SNP, причем указанные один или более генотипов по SNP включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20) генотип SNP, выбранный из группы, состоящей из каждого из генотиповSNP, приведенных в табл. 13, и при этом присутствие любого одного или более из генотипов SNP, приведенных в табл. 13, указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В другом аспекте изобретение относится к способу прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. Способ включает стадии: получение биологического образца от пациента, страдающего иммунным нарушением; и обнаружение присутствия или отсутствия в указанном биологическом образце одного или более генотипов SNP, причем указанные один или более генотипов по SNP включают по меньшей мере один (например, по меньшей мере 2, по меньшей мере 3,по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18,по меньшей мере 19 или по меньшей мере 20) генотип SNP, выбранный из группы, состоящей из указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент,а присутствие одного или более из указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из и выбор для пациента терапевтического средства, содержащего анти-ФНО агент. Способ может далее включать введение пациенту терапевтического средства, содержащего анти-ФНО агент. В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, даст ответ на терапевтическое средство, содержащее анти-ФНО агент, если присутст- 11017815 вуют один или более из Запись может быть создана на машиночитаемом носителе. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из и выбор для пациента терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. Способ может далее включать введение пациенту терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из или любого из генотипов SNP, приведенных в табл. 13; и выбор для пациента терапевтического средства,содержащего агент, не являющийся анти-ФНО агентом. Способ может далее включать введение пациенту терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из или любого из генотипов SNP, приведенных в табл. 13; и выбор для пациента терапевтического средства,содержащего агент, не являющийся анти-ФНО агентом. Способ может далее включать введение указанному пациенту терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из и выбор для пациента терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из и выбор для пациента терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. В некоторых вариантах осуществления способ может включать обнаружение присутствия одного или более из генотипов SNP, приведенных в табл. 13; и выбор для пациента терапевтического средства,содержащего агент, не являющийся анти-ФНО агентом. Способ может дополнительно включать введение пациенту терапевтического средства, содержащего агент, не являющийся анти-ФНО агентом. В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если присутствует один или более из или любой из генотипов SNP, приведенных в табл. 13. Запись может быть создана на машиночитаемом носителе. В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если присутствует один или более генотипов по SNP из или любой из генотипов SNP, приведенных в табл. 13. Запись может быть создана на машиночитаемом носителе. В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, не даст ответ на терапевтическое средство, содержащее анти-ФНО агент, если присутствует один или более из В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если присутствуют один или более из В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если присутствуют один или более генотипов по SNP, приведенных в табл. 13. Запись может быть создана на машиночитаемом носителе. В некоторых вариантах осуществления способ может включать создание записи, указывающей, что пациент, вероятно, не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, если присутствуют один или более генотипов из Запись может быть создана на машиночитаемом носителе. В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13. В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13. В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено два или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из табл. 13. В некоторых вариантах осуществления пациент может представлять собой пациента, у которого выявлено 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления способ может включать обнаружение присутствия или отсутствия 2 или более (например, например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP,выбранных из группы, состоящей из В некоторых вариантах осуществления способ может включать обнаружение присутствия или отсутствия 2 или более (например, например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP,выбранных из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13. В некоторых вариантах осуществления способ может включать обнаружение присутствия или отсутствия 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления способ может включать обнаружение присутствия или отсутствия 2 или более (например, например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP,выбранных из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13. В некоторых вариантах осуществления способ может включать обнаружение присутствия или отсутствия 2 или более (например, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более или все) генотипов SNP, выбранных из группы, состоящей из Любой из описанных в настоящем изобретении способов может дополнительно включать стадию введения пациенту терапевтического средства, содержащего анти-ФНО агент или агент, не являющийся анти-ФНО агентом (причем выбор зависит от результата описанных выше способов прогнозирования). Биологический образец в любом из описанных выше способов может состоять из или содержать,например, кровь. В некоторых вариантах осуществления любого из описанных в настоящем изобретении способов пациент может страдать заболеванием, таким как иммунное нарушение (например, воспалительное), инфекция или любое заболевание, поддающееся лечению терапевтическим средством, содержащим антиФНО агент, описанный в настоящем патенте. Например, пациент может страдать ревматоидным артритом или болезнью Крона. Пациент может представлять собой человека. В некоторых вариантах осуществления любого из описанных в настоящем изобретении способов анти-ФНО агент может состоять из или содержать антитело к ФНО или растворимый рецептор ФНО. Антитело ФНО может представлять собой, например, адалимумаб или инфликсимаб. Растворимый рецептор ФНО может представлять собой, например, этанерецепт. В некоторых вариантах осуществления агент, не являющийся анти-ФНО агентом, может состоять из или содержать нестероидные противовоспалительные препараты (NSAID), кортикостероиды, модифицирующие заболевание противоревматические препараты (DMARD), антитела к CD20, ингибиторыTWEAK, ингибиторы IL-6, ингибиторы рецептора IL-6, растворимый рецептор лимфотоксина-бета или растворимый антагонист BAFF. NSAID может представлять собой ингибитор СОХ-2. DMARD может представлять собой метотрексат, золото, пеницилламин или гидроксихлорхинин. В другом аспекте изобретение относится к композиции, содержащей по меньшей мере два (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7,- 19017815 по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12,по меньшей мере 15, по меньшей мере 20, по меньшей мере 22 или по меньшей мере 24 или более) полинуклеотида, которые селективно гибридизуются с каждым (полностью или с его частью) из по меньшей мере двух (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере шести, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11,по меньшей мере 12, по меньшей мере 15, по меньшей мере 20, по меньшей мере 22 или по меньшей мере 24 или более соответственно) выбранных из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2,CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5, LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1,RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6, ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5,CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, PTCH1, SEL1L или SFRS2. По меньшей мере пять генов могут включать, например, ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5,CLTB, COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4, HDAC5, LGALS9, MXRA7,PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6. По меньшей мере пять генов могут включать, например, CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7, PGK1, SFRS2 или YIPF6. По меньшей мере восемь генов могут включать, например, ANKIB1, ARF1, ARF5, C9orf80, CALM2, CASP5, CLTB,COL4A3BP, CXorf52, DNAH1, EEA1, EGLN2, FAM44A, HDAC4, HDAC5, LGALS9, MXRA7, PGK1,RBBP4, RER1, SEL1L, SERF2, SFRS2 и/или YIPF6. По меньшей мере восемь генов могут состоять из или включать, например, CLTB, COL4A3BP, CXorf52, FAM44A, MXRA7, PGK1, SFRS2 и/или YIPF6. По меньшей мере 24 гена могут состоять из или включать, например, ANKIB1, ARF1, ARF5, C9orf80,CALM2, CASP5, CLTB, COL4A3BP, CXorf52, DNAH1, ЕЕА 1, EGLN2, FAM44A, HDAC4, HDAC5,LGALS9, MXRA7, PGK1, RBBP4, RER1, SEL1L, SERF2, SFRS2 и YIPF6. В еще одном аспекте изобретение относится к композиции, содержащей по меньшей мере два (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 или более) полинуклеотида, которые селективно гибридизуются соответственно с каждым по меньшей мере из двух (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере шести, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 или более соответственно) генотипов SNP, выбранных из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13. В еще одном аспекте изобретение относится к композиции, содержащей по меньшей мере два (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 или более) полинуклеотида, которые селективно гибридизуются с каждым по меньшей мере из двух (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере шести, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 или более соответственно) генотипов SNP, выбранных из группы, состоящей из любого из и любого из генотипов SNP, приведенных в табл. 13. В другом аспекте изобретение относится к композиции, содержащей по меньшей мере два (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7,по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12,по меньшей мере 15 или по меньшей мере 20 или более) полинуклеотида, которые селективно гибридизуются с каждым по меньшей мере из двух (например, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере шести, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 или более соответственно) генотипов SNP, выбранных из группы, состоящей из В некоторых вариантах осуществления в любой из описанных ранее композиций указанные по меньшей мере два полинуклеотида могут быть связаны с твердой подложкой. Твердая подложка может представлять собой микрочип, частицу (например, кодированную, магнитную или магнитную и кодированную частицу) или любую другую твердую подложку, описанную в настоящем патенте. Любая из композиций, описанных выше, может содержать менее чем 100000 (например, менее чем 90000; менее чем 80000; менее чем 70000; менее чем 60000; менее чем 50000; менее чем 40000; менее чем 30000; менее чем 20000; менее чем 15000; менее чем 10000; менее чем 5000; менее чем 4000; менее чем 3000; менее чем 2000; менее чем 1500; менее чем 1000; менее чем 750; менее чем 500, менее чем 200,менее чем 100 или менее чем 50) различных полинуклеотидов. В еще одном аспекте изобретение относится к набору для определения уровней экспрессии или обнаружения присутствия или отсутствия одного или более генотипов SNP. Набор может включать любую из описанных выше композиций и, возможно, инструкции по определению уровней экспрессии (например, уровни экспрессии РНК и/или белка) или инструкции по обнаружению одного или более генотиповSNP. Набор может также включать, например, один или более дополнительный реагент для определения уровней экспрессии или обнаружения присутствия или отсутствия одного или более генотипа SNP. Например, набор может включать одно или более антител, специфичных в отношении белка, кодируемого целевым геном, праймеры (например, случайные гексамерные или олиго(dT)-праймеры), обратную транскриптазу, ДНК полимеразу (например, Taq полимеразу), полинуклеотид киназу Т 4, одну или более из детектируемых меток (такую как любая из описанных в настоящем изобретении) или любые другие реагенты, описанные в настоящем патенте. В некоторых вариантах осуществления набор может включать инструкции по введению терапевтического средства, содержащего анти-ФНО агент, если было определено, что уровень экспрессии одного или более из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5,LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6,ZNF294 или ZFP36L1 повышен или что уровень экспрессии одного или более из ANKRD12, CAMK2G-,CASP5, CXorf52, DNAH1, ЕЕА 1, FAM44A, FOXJ3, HDAC4, MNT, MXRA7, РТСН 1, SEL1L или SFRS2 понижен. В некоторых вариантах осуществления набор может включать инструкции по введению терапевтического средства, содержащего анти-ФНО агент, если обнаружен один или более из В другом аспекте изобретение относится к профилю ответа пациента на средство, содержащее антиФНО агент, полученному способом, который включает стадии: получение биологического образца, взятого от пациента; измерение в биологическом образце уровня экспрессии одного или более генов, при- 22017815 чем указанные один или более генов включает по меньшей мере один ген, выбранный из группы, состоящей из ANKIB1, ARF1, ARF5, BRWD2, CALM2, CLTB, COL4A3BP, C9orf80, EGLN2, HDAC5,LGALS9, MYLIP, PCBP2, PGK1, RBBP4, RER1, RPA3, SERF2, SLC25A39, SRGAP2, TUG1, YIPF6,ZNF294, ZFP36L1, ANKRD12, CAMK2G-, CASP5, CXorf52, DNAH1, EEA1, FAM44A, FOXJ3, HDAC4,MNT, MXRA7, PTCH1, SEL1L и SFRS2; и оценка уровня экспрессии в образце по меньшей мере два из одного или более генов в биологическом с получением профиля ответа пациента на анти-ФНО. В еще одном аспекте изобретение относится к профилю ответа пациента на применение анти-ФНО,полученному способом, который включает стадии: получение от пациента биологического образца; и обнаружение в биологическом образце от пациента, присутствия или отсутствия 2 или более генотиповSNP, где один или более генотипов по SNP включают по меньшей мере один генотип SNP, выбранный из группы, состоящей из для получения профиля ответа пациента на применение анти-ФНО. В еще одном аспекте изобретение относится к профилю ответа пациента на средство, содержащее анти-ФНО агент, полученному способом, который включает стадии: получение биологического образца от пациента; и обнаружение в указанном биологическом образце от пациента, присутствия или отсутствия 2 или более генотипов SNP, причем указанные один или более генотипов по SNP включают по меньшей мере один генотип SNP, выбранный из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13, с получением профиля ответа пациента на антиФНО. В еще одном аспекте изобретение относится к профилю ответа пациента на анти-ФНО терапевтическое средство, полученному способом, который включает стадии: получение биологического образца от пациента и обнаружение в указанном биологическом образце от пациента, присутствия или отсутствия 2 или более генотипов SNP, причем один или более генотипов по SNP включают по меньшей мере один генотип SNP, выбранный из группы, состоящей из и любого из генотипов SNP, приведенных в табл. 13, для получения профиля ответа пациента на применение анти-ФНО. Любой из профилей ответа, описанных выше, может быть использован для прогнозирования ответа пациента на терапевтическое средство, содержащее анти-ФНО агент. В настоящем изобретении анти-ФНО агент представляет собой агент, который подавляет активность ФНО. Подавление активности ФНО включает, например, подавление экспрессии ФНО (экспрессии мРНК или белков), подавление выхода ФНО из клетки, в которой он был синтезирован, или подавление способности ФНО связывать и/или активировать соответствующий рецептор. Агенты, которые подавляют активность ФНО включают, но не ограничиваются, небольшие молекулы, малые интерферирующие РНК (интРНК), антисмысловые РНК, антитела, которые специфично связываются с ФНО, растворимые рецепторы ФНО или доминантно-негативные к ФНО молекулы (такие как доминантно-негативный к ФНО белок или нуклеиновая кислота, кодирующая доминантно-негативный к ФНО белок). Понятно, что агент, который подавляет ФНО, может подавлять способность ФНО активировать рецептор, но не подавлять связывание ФНО с рецептором. Антитела к ФНО включают, например, инфликсимаб (Remicade),D2E7 (адалимумаб; Humira), цертолизумаб (CDP-870) и CDP-571 (см., например, Sandborn et al. (2004),Gut. 53(10):1485-1493; Choy et al. (2002), Rheumatology. 41(10):1133-1137 и Kaushik et al. (2005), ExpertOpinion on Biological Therapy. 5(4):601-606(6. Растворимые рецепторы ФНО включают, например, этанерецепт (sTFN-RII:Fc; Enbrel). Примеры терапевтического средства, содержащего анти-ФНО агент,описаны, например, в патенте США 6270766. Не анти-ФНО агент может представлять собой, например, нестероидное противовоспалительное лекарственное средство (NSAID), кортикостероид (например, глюкокортикоид или минералкортикоид) или модифицирующее заболевание противоревматическое лекарственное средство (DMARD). NSAID включают, например, ингибиторы СОХ-2 (например, целекоксиб, эторикоксиб или люмиракоксиб), салицилаты (например, аспирин, амоксипирин, бенорилат, холин салицилат магния, дифлунизал, файсламин, метил салицилат, салицилат магния или салицил салицилат (сальсалат, арилалкановые кислоты(например, диклофенак, ацеклофенак, ацеметацин, бромфенак, этодолак, индометацин, кеторолак, набуметон, сулиндак или толметин) или производные пиразолидина (такого как фенилбутазон, азапропазон,метамизол, оксифенбутазон или сульфинпразон). DMARD включают, но не ограничиваются, адалимумаб, азатиоприн, противомалярийные препараты (например, хлорохин или гидроксихлорхинин), циклоспорин А, D-пеницилламин, соли золота (например, ауротиомалат натрия или ауранофин), лефлуномид,метотрексат (МТХ), миноциклин или сульфалазин (SSZ). Терапия не анти-ФНО агентами также включает антитела к CD20 (например, рутиксимаб (Rituxan, ингибиторы TWEAK (например, антитела антагонисты TWEAK, см., например, патент WO 06/122187, который включен в настоящее описание посредством ссылки в полном объеме), растворимые рецепторы бета лимфотоксина (например, LTBR-Fc), антагонисты BAFF, такие как BR3-Fc; и ингибиторы IL-6 (например, антитела антагонисты IL-6, растворимые рецепторы IL-6) и ингибиторы рецептора IL-6 (например, антитела антагонисты рецептора IL-6, таких как тосилизумаб или атлизумаб (Actemra) см., например, WO 2004/096273; EP 1536012,WO 2006/119115, патенты США 5559012 и 5888510 и предварительная заявка США 20010001663,которые включены в настоящее описание посредством ссылки в полном объеме). В некоторых вариантах осуществления агент не антагонист ФНО может быть противовоспалительным агентом, который не содержит анти-ФНО агент. Заболевания, поддающиеся лечению терапевтическим средством, содержащим анти-ФНО агент,включают, например, иммунные заболевания (например, воспалительные), инфекции, нейродегенеративные заболевания, злокачественные патологии, включая секретирующие ФНО опухоли или другие злокачественные новообразования, содержащие ФНО, и вызванный алкоголем гепатит. Иммунные или воспалительные заболевания включают, но не ограничиваются ими, аллергический бронхолегочный аспергиллез; аллергический ринит, аутоиммунную гемолитическую анемию; черный акантоз; аллергический контактный дерматит; болезнь Аддисона; атопический дерматит; зональную алопецию; полную алопецию; амилоидозы; анафилактическую пурпуру; анафилактическую реакцию; апластическую анемию; наследственную ангиоэдему; идиопатическую ангиоэдему; анкилозный спондилит; черепной артериит; гигантококлеточный артериит; артериит Такаясу; временный артериит; астму; атаксию-телангиэктазию; аутоиммунный оофорит; аутоиммунный орхит; аутоиммунные полиэндокринные заболевания; болезнь Бекета; болезнь Бергера; болезнь Бюргера; бронхит; буллозную пузырчатку; хронический кожнослизистый кандидоз; синдром Каплана; синдром последствий инфаркта миокарда; синдром последствий перикардиотомии; кардит; целиакию; болезнь Чагас; синдром Чедиак-Хигаши; болезнь Чарг-Штраусса; синдром Когана; холодная болезнь агглютинина; синдром Креста; болезнь Крона; криоглобулинемию; криптогенный фиброзный альвеолит; герпесный дерматит; дерматомиозит; сахарный диабет; синдром Даймонд-Блекфан; синдром ДиДжорджи; дискоидную эритематозную волчанку; эозинофильный фасцилит; эписклеритит; стойкую возвышающуюся эритему; краевую эритему; мультиформную эритему; узловую эритему; семейную Средиземноморскую лихорадку; синдром Фелти; легочный фиброз; анафилактический гломерулонефрит; аутоиммунный гломерулонефрит; гломерулонефрит после стрептококков; гломерулонефрит после трансплантации; мембранная гломерулопатия; синдром Гудпасчера; иммунную гранулоцитопению; кольцевую гранулему; аллергический грануломатоз; грануломатозный миозит; болезнь Грейва; тироидит Хашимото; гемолитическую болезнь новорожденных; идиопатический гемохроматоз; пурпура Шенляйн-Геноха; хронический активный и хронический прогрессирующий гепатит; гистоцитоз X; гиперэозинофильный синдром; идиопатическая тромбоцитопеническая пурпура; синдром Джобс; юношеский дермацитомиозит; юношеский ревматоидный артрит(юношеский хронический артрит); болезнь Кавасаки; кератит; синдром сухих глаз; синдром ЛандриГуллиан-Барре-Штроля; лепроматозную проказу; синдром Лефлера; волчанку; синдром Лиелля; болезнь Лайма; лимфоматозный грануломатоз; системный мастоцитоз; заболевания смешанной соединительной ткани; мультиплексный мононеврит; синдром Макли-Уэллс; синдром кожнослизистых лимфоузлов; мультицентрический ретикулогистиоцитоз; множественный склероз; миастению гревис; грибковый микоз; системный некротический васкулит; нефротический синдром; синдром перекрытия; панникулит; судорожную холодовую гемоглобинурию; судорожную ночную гемоглобинурию; пемфигоид; пузырчатку; эритематозную пузырчатку; фоликуллярную пузырчатку; обыкновенную пузырчатку; болезнь заводчиков голубей; пневмоническую гиперчувствительность; узловой полиартрит; полимиальгический ревматизм; полимиозит; идиопатический полиневрит; португальские семейные полинейропатии; предэклампсия/эклампсия; первичный билиарный цирроз; прогрессивный системный склероз (склеродермия); псориаз; псориатический артрит; легочный альвеолярный протеиноз; фиброз феномен/синдром Рейно; тироидит Рейделя; синдром Рейтера, повторный полихондрит; ревматизм суставов; ревматоидный артрит; саркоидоз; склеритит; склеротический холангит; заболевания плазмы; синдром Сезари; синдром Сьорен; синдром Стивена-Джонсона; болезнь Стила; подострый склеротический панэнцефалит; симпатическую офтальмию; системную эритематозную волчанку; отторжение трансплантанта; язвенный колит; заболевания недифференцированной соединительной ткани; хроническую крапивницу; холодовую крапивницу; увеит; витилиго; болезнь Вебер-Кристиан; грануломатоз Вегенера или синдром ВискоттЭлдрич. Инфекции могут включать, например, синдром сепсиса, кахексию, нарушение кровообращения и шок, возникающий в результате острой или хронической бактериальной инфекции, острых и хронических паразитарных и/или инфекционных заболеваний, бактериальных инфекций, вирусных инфекций или грибковых инфекций. Нейродегенеративные заболевания включают, например, заболевания демиелинизации (такие как множественный склероз и острый трансверзальный миелит); заболевания экстрапирамидной системы и мозжечка, такие как повреждения кортикоспинальной системы; заболевания основных ганглиев или расстройства мозжечка; двигательные заболевания с гиперкинезией, такие как хорея Хантингтона и старческая хорея; двигательные заболевания, вызываемые лекарствами, такими как лекарства, блокирующие дофаминовые рецепторы ЦНС; двигательные заболевания с гиперкинезией, такие как болезнь Паркинсона; прогрессирующий супрануклеарный паралич; заболевания головного и спинного мозга, такие как бесструктурные повреждения мозжечка; спинномозговая дегенерация (спинная атаксия, атаксия Фридрейха, дегенерация коры головного мозга, множественная системная дегенерация (синдромы Менцеля,Дежерина-Томаса, Шая-Дрейджера и Мачадо-Джозефа) и системные заболевания (болезнь Рефсума, абета липопротеинемия, атаксия телангиэктазия и мультисистемные заболевания митохондрий); связанные с демиелинизацией заболевания, такие как множественный склероз, острый трансверзальный миелит; заболевания двигательных единиц, таких как нейрогенные мышечные атрофии (дегенерация клеток передних корешков, таких как латеральный амиотрофический склероз, детская спинная мышечная атрофия и юношеская спинная мышечная атрофия); болезнь Альцгеймера; синдром Дауна в среднем возрасте; болезнь рассеянных телец Леви; старческое слабоумие с тельцами Леви; синдром Корсакова-Вернике; хронический алкоголизм; болезнь Крейцтфельдта-Якоба; подострый склеротический панэнцефалит; болезнь Халлеррордена-Шпатц и деменция боксеров. Злокачественные патологии, включая секретирующие ФНО опухоли или другие злокачественные образования, содержащие ФНО, включают, но не ограничиваются лейкемии (острые, хронические миелоидные, хронические лимфоидные и/или миелодиспластический синдром) или лимфомы (ходжкинские и неходжкинские лимфомы, такие как злокачественные лимфомы (лимфома Беркита или mycosis fungoides). Другие заболевания, которые можно лечить в соответствии с описанными в данном изобретении способами, рассмотрены, например, в WO 06/74399, WO 06/122187, или патентах США 5656272 и 5919452, которые включены в настоящее описание посредством ссылки в полном объеме и для любых целей."Комплементарность" последовательности в настоящем патенте относится к химической аффинности (сродству) между конкретными азотистыми основаниями, которые являются результатом из свойства образовывать водородные связи (т.е. свойства двух цепей нуклеиновых кислот, имеющих такие последовательности оснований, которые обеспечивают образование антипараллельных дуплексов между аденином и урацилом (или тимином, в случае ДНК или модифицированной РНК), расположенными напротив друг друга, и гуанином и цитозином, расположенными напротив друг друга). Полностью комплементарными последовательностями, таким образом, будут две последовательности, которые имеют полное взаимнооднозначное соответствие (т.е. аденин с урацилом и гуанин с цитозином) последовательностей оснований, когда последовательности нуклеотидов формируют антипараллельный дуплекс. Если не указано иное, все технические и научные термины, использованные в описании, имеют значение, которое обычно понимается специалистом в той области, к которой принадлежит это изобретение. Хотя на практике или при испытании настоящего изобретения могут быть использованы способы и материалы, аналогичные или эквивалентные тем, что описаны выше, примеры способов и материалов описаны ниже. Все публикации, заявки на патент, патенты и другие упомянутые в описании источники включены в настоящее описание посредством ссылки в полном объеме. В случае конфликта следует руководствоваться настоящим описанием, включая определения. Материалы, способы и примеры являются только иллюстративными и не предполагают ограничений. Другие характеристики и преимущества изобретения станут понятными из последующего подробного описания и формулы изобретения. Подробное описание Предложенные согласно настоящему изобретению способы и композиции (например, чипы с нуклеиновыми кислотами и наборы) для прогнозирования ответа пациента (такого как пациент-человек) на анти-ФНО терапевтическое средство. Кроме того, изобретение обеспечивает прогностические биомаркеры (например, уровни экспрессии гена или генотипы SNP) для определения таких пациентов, для которых применение терапевтического средства, содержащего анти-ФНО агент, вероятно, будет эффективным или неэффективным. Такие биомаркеры, композиции и способы, которые можно применять при Была выявлены серия генов, уровни экспрессии которых (например, уровни экспрессии мРНК или белков) позволяют прогнозировать чувствительность или отсутствие чувствительности у пациента на анти-ФНО терапевтическое средство. Гены (и соответствующие им номера в базе данных Entrez Gene ID) приведены в табл. 1. Таблица 1 Повышенный уровень экспрессии гена может позволить предсказать наличие или отсутствие чувствительности к анти-ФНО терапевтическому средству. Например, повышенный уровень экспрессии одного или более из HDAC4, CXorf52, ANKRD12, CAMK2G-, CASP5, MXRA7, FAM44A, MNT, SEL1L,EEA1, FOXJ3, DNAH1, РТСН 1 или SFRS2 указывает на то, что пациент не будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, в то время как повышенный уровень экспрессии одного или более из CLTB, RBBP4, COL4A3BP, C9orf80, PCBP2, YIPF6, MYLIP, ZNF294, RER1, CALM2, ARF5,ARF1, HDAC5, ANKIB1, BRWD2, PGK1, ZFP36L1, SERF2, SRGAP2, TUG1, LGALS9, SLC25A39,EGLN2 или RPA3 указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. Повышенный уровень экспрессии гена может позволить предсказать наличие или отсутствие чувствительности к анти-ФНО терапевтическому средству. Например, пониженный уровень экспрессии одного или более из CLTB, RBBP4, COL4A3BP, C9orf80, РСВР 2, YIPF6, MYLIP, ZNF294, RER1, CALM2,ARF5, ARF1, HDAC5, ANKIB1, BRWD2, PGK1, ZFP36L1, SERF2, SRGAP2, TUG1, LGALS9, SLC25A39,EGLN2 или RPA3 указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент, в то время как пониженный уровень экспрессии одного или более из HDAC4, CXorf52,ANKRD12, CAMK2G-, CASP5, MXRA7, FAM44A, MNT, SEL1L, ЕЕА 1, FOXJ3, DMAH1, PTCH1 илиSFRS2 указывает на то, что пациент будет отвечать на терапевтическое средство, содержащее анти-ФНО агент. В прогнозировании чувствительности или отсутствии чувствительности к анти-ФНО терапевтическому средству уровень экспрессии одного или более из генов, приведенных в табл. 1, может быть по- 28017815 вышен или понижен по меньшей мере примерно в 1,5 раза (например, по меньшей мере примерно в 2 раза, по меньшей мере примерно в 2,5 раза, по меньшей мере примерно в 3,0 раза, по меньшей мере примерно в 3,5 раза, по меньшей мере примерно в 4,0 раза или по меньшей мере примерно в 5 раз или более). Экспрессию гена можно определять как, например, экспрессию белка или мРНК целевого гена. То есть присутствие или уровень экспрессии (количество) гена можно определить путем обнаружения и/или измерения уровня экспрессии мРНК или белка данного гена. В некоторых вариантах осуществления экспрессию гена можно определять по активности белка, кодируемого геном, таким как ген, приведенный в табл. 1. Для обнаружения и/или измерения уровня экспрессии мРНК гена можно применять различные подходящие способы. Например, экспрессию мРНК можно определять, используя Нозерн-блоттинг или анализ точечного блота, обратную транскрипцию и ПЦР (ОТ-ПЦР; например количественную ОТ-ПЦР), insitu гибридизацию (например, количественную in situ гибридизацию) или анализ с помощью чипов с нуклеиновыми кислотами (например, чипы с олигонуклеотидами или чипы с генами). Детали таких способов описаны ниже и, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual Second Editionet al. (1999), Genome Res. 6(10):995-1001 и Zhang et al. (2005), Environ. Sci. Technol. 39(8):2777-2785; заявке на изобретение США 2004086915; в Европейском патенте 0543942 и патенте США 7101663; содержание которых включено в настоящее описание посредством ссылки во всей их полноте. В одном примере присутствие или количество одной или более из дискретных популяций мРНК в биологическом образце можно определить путем выделения тотальной мРНК из биологического образца(см., например, Sambrook et al. (ранее) и патент США 6812341), и подвергали выделенную мРНК электрофорезу в агарозном геле для разделения мРНК по размеру. Разделенную по размеру мРНК затем переносили (например, путем диффузии) на твердую подложку, такую как мембрана из нитроцеллюлозы. Присутствие или количество одной или более популяции мРНК в биологическом образце затем можно определять, используя один или более детектируемый меченый полинуклеотидный зонд, комплементарный последовательности мРНК интереса, которая связывается и, таким образом, позволяет обнаружить соответствующую ей популяцию мРНК. Детектируемые метки включают, например, флуоресцентные(например, умбеллиферон, флуоресцин, флуоресцин изотиоцианат, родамин, дихлортриазиниламин флуоресцин, дансил хлорид, аллофикоцианин (АРС) или фикоэритрин), люминесцентные (например,европий, тербий, наноточки Qdot, поставляемые Quantum Dot Corporation, Palo Alto, CA), радиоактивные (например, 125I, 131I, 35S, 32P, 33P или 3 Н) и ферментные метки (пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинестераза). В другом примере присутствие или количество отдельной популяции мРНК (например, мРНК, кодируемой одним или более генами, приведенными в табл. 1) в биологическом образце можно определить, используя нуклеиновую кислоту (или олигонуклеотид), биочипов (матриц, например, чип, описанный далее в разделе "Биочипы и наборы"). Например, мРНК, выделенную из биологического образца,можно амплифицировать с применением ОТ-ПЦР со случайными гексамерными или олиго(dT)праймерами для синтеза первой нити. Стадию ОТ-ПЦР можно использовать для детектируемого мечения ампликонов или, возможно, ампликоны можно снабжать детектируемой меткой после стадии ОТ-ПЦР. Например, детектируемая метка может быть ферментативно (например, в ходе ник-трансляции или киназного переноса, например, с помощью Т 4 полинуклеотидкиназы) или химически связанной с ампликонами с применением любого из множества подходящих способов (см., например, Sambrook et al., ранее). Снабженные детектируемой меткой ампликоны затем приводят в контакт с множеством наборов полинуклеотидных зондов, каждый набор содержит один или более из полинуклеотидных зондов (например,олигонуклеотидов), специфичных к соответствующему ампликону (и способных связываться с ним),причем указанное множество содержит много наборов зондов, каждый из которых соответствует своему ампликону. Обычно наборы зондов связаны с твердой подложкой, и положение на твердой подложке каждого набора зондов определено заранее. Связывание детектируемого меченого ампликона с соответствующим зондом из набора зондов указывает на присутствие или количество искомой мРНК в биологическом образце. Дополнительные способы обнаружения экспрессии мРНК с применением биочипов с нуклеиновыми кислотами описаны, например, в патентах США 5445934; 6027880; 6057100; 6156501; 6261776 и 6576424; содержание которых включено в настоящее описание посредством ссылки во всей их полноте. Способы обнаружения и/или определения количества детектируемой метки зависят от природы метки. Продукты реакций, катализируемых подходящими ферментами (если детектируемая метка является ферментом, см. выше), могут быть, без ограничения флуоресцентными, люминесцентными или радиоактивными или они могут поглощать видимый или ультрафиолетовый свет. Примеры детекторов,пригодных для обнаружения таких детектируемых меток, включают, без ограничения, рентгеновскую пленку, счетчики радиоактивности, счетчики сцинтилляции, спектрофотометры, колориметры, флуориметры, люминометры и денситометры.
МПК / Метки
МПК: C12Q 1/68
Метки: анти-фно, биомаркеры, агентам, чувствительности, прогнозирования, отсутствия
Код ссылки
<a href="https://eas.patents.su/30-17815-biomarkery-dlya-prognozirovaniya-chuvstvitelnosti-ili-otsutstviya-chuvstvitelnosti-k-anti-fno-agentam.html" rel="bookmark" title="База патентов Евразийского Союза">Биомаркеры для прогнозирования чувствительности или отсутствия чувствительности к анти-фно агентам</a>
Предыдущий патент: Способ удаления целевого газа из смеси газов с помощью адсорбции за счет перепада давления или температуры
Следующий патент: Стенд и нагрузочное устройство для обкатки и испытания под нагрузкой коробки передач
Случайный патент: Формовочная смесь для изготовления литейных форм для металлообработки, имеющая улучшенную текучесть