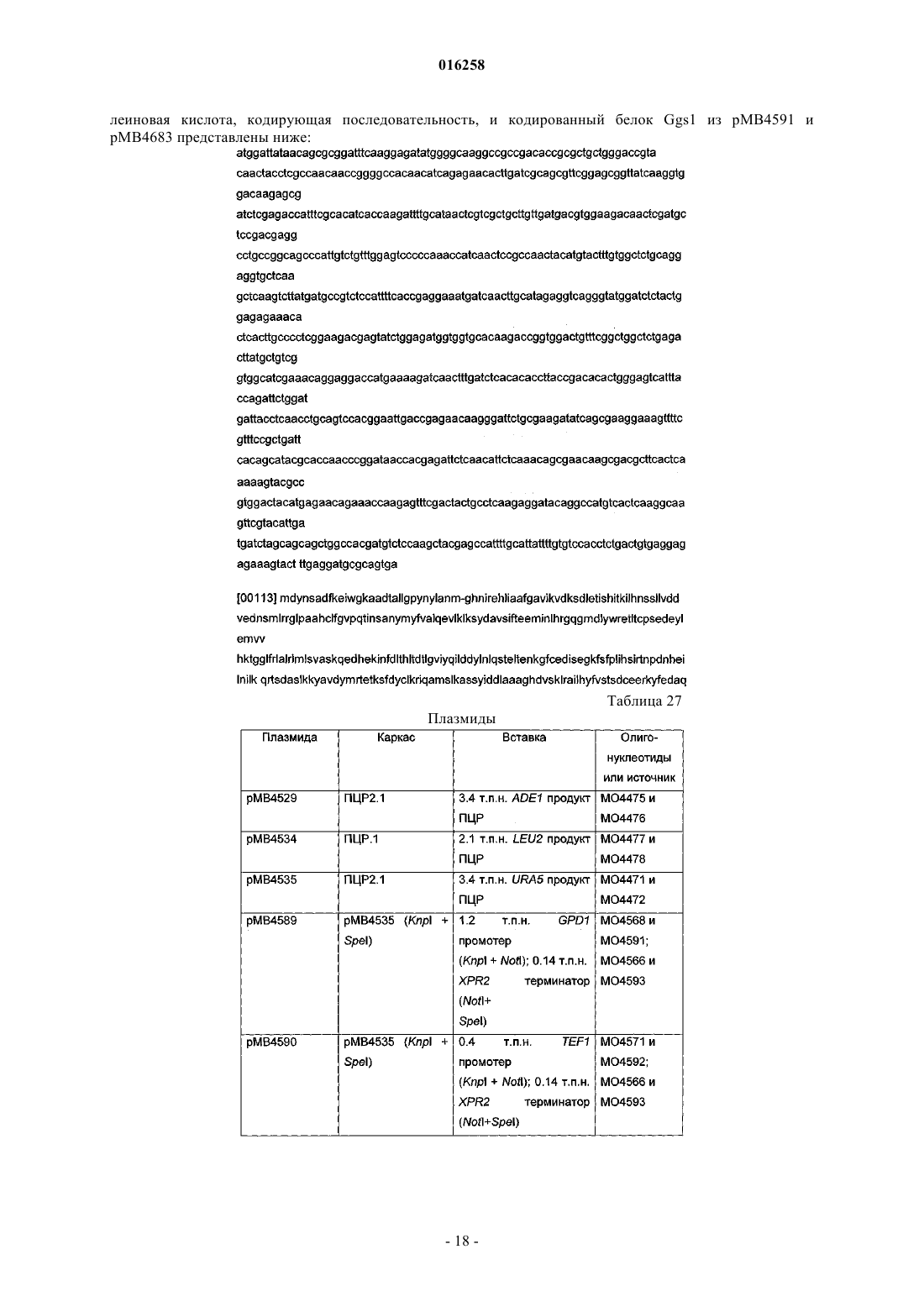
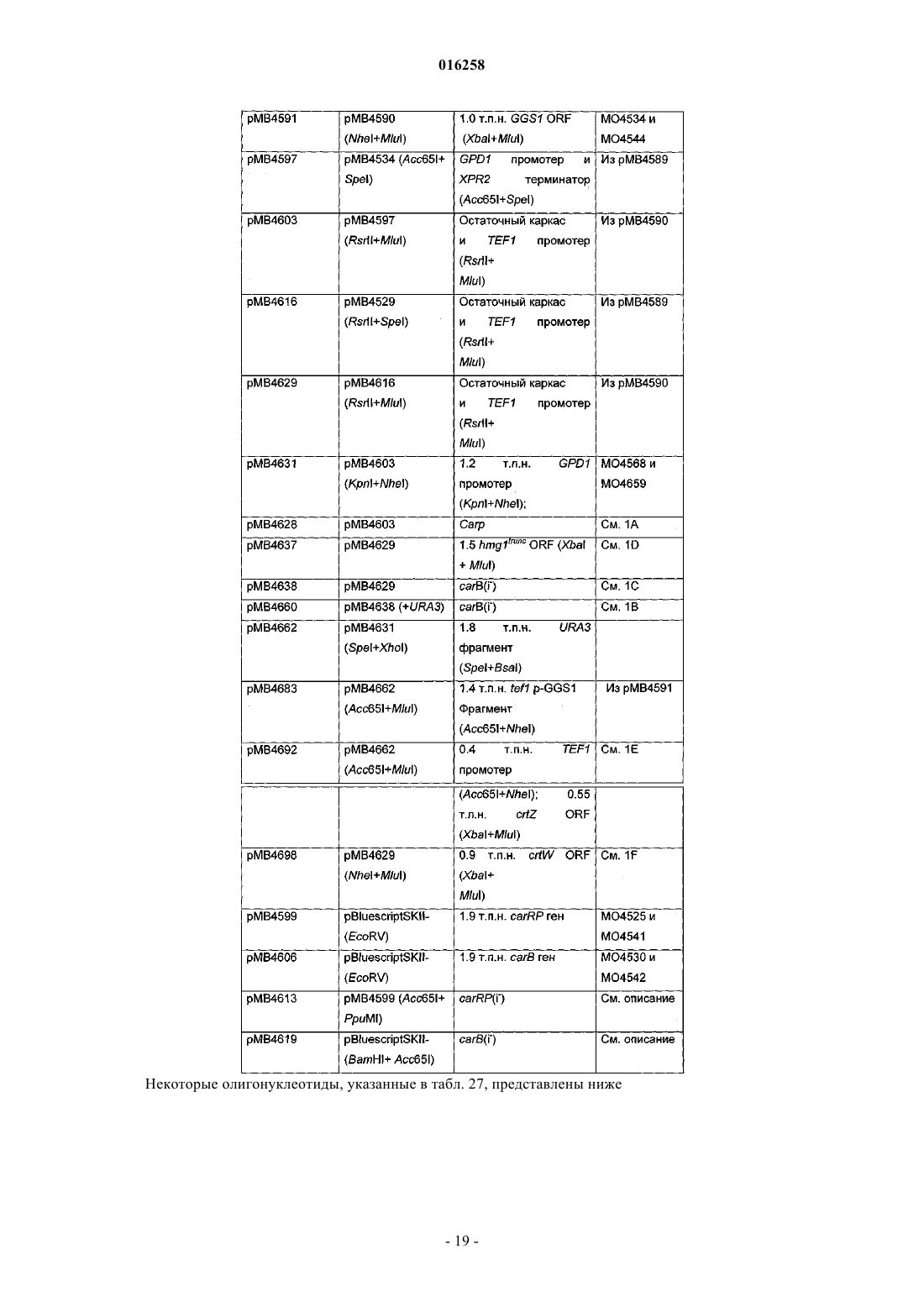
Рекомбинантные грибы, продуцирующие каротиноиды, и способы их применения
Формула / Реферат
1. Рекомбинантный гриб, характеризующийся тем, что:
а) указанный гриб является олеагенным и способен аккумулировать липид по меньшей мере примерно до 20% от своей сухой клеточной массы;
б) указанный гриб продуцирует по меньшей мере один каротиноид и способен аккумулировать продуцированный каротиноид по меньшей мере примерно до 1% от своей сухой клеточной массы;
при этом указанный гриб содержит по меньшей мере одну модификацию, выбранную из группы, включающей каротиногенные модификации, олеагенные модификации и их комбинации, и при этом указанная по меньшей мере одна модификация изменяет олеагенность гриба, придает грибу олеагенность, придает грибу способность продуцировать по меньшей мере один каротиноид до уровня по меньшей мере примерно 1% от своей сухой клеточной массы или придает грибу способность продуцировать по меньшей мере один каротиноид, который гриб не продуцирует в естественных условиях.
2. Гриб Yarrowia, характеризующийся тем, что:
а) указанный гриб является олеагенным и способен аккумулировать липид по меньшей мере примерно до 20% от своей сухой клеточной массы;
б) указанный гриб продуцирует по меньшей мере один каротиноид и способен аккумулировать продуцированный каротиноид по меньшей мере примерно до 1% от своей сухой клеточной массы;
при этом указанный гриб содержит по меньшей мере одну модификацию, выбранную из группы, включающей каротиногенные модификации, олеагенные модификации и их комбинации, и при этом указанная по меньшей мере одна модификация изменяет олеагенность гриба, придает грибу олеагенность, придает грибу способность продуцировать по меньшей мере один каротиноид до уровня по меньшей мере примерно 1% от своей сухой клеточной массы или придает грибу способность продуцировать по меньшей мере один каротиноид, который гриб не продуцирует в естественных условиях.
3. Гриб Yarrowia по п.2, отличающийся тем, что указанная по меньшей мере одна каротиногенная или олеагенная модификация представляет собой генетическую модификацию.
4. Гриб Yarrowia по любому из пп.2, 3, отличающийся тем, что указанный гриб Yarrowia представляет собой штамм Yarrowia lipolytica.
5. Гриб Yarrowia по любому из пп.2, 3, отличающийся тем, что указанный гриб содержит по меньшей мере одну олеагенную модификацию.
6. Гриб Yarrowia по п.5, отличающийся тем, что по меньшей мере одна олеагенная модификация изменяет олеагенность гриба.
7. Гриб Yarrowia по п.5, отличающийся тем, что указанный гриб содержит дополнительно более одной каротиногенной модификации.
8. Гриб Yarrowia по п.5, отличающийся тем, что указанная по меньшей мере одна олеагенная модификация увеличивает экспрессию или активность по меньшей мере одного олеагенного полипептида.
9. Гриб Yarrowia по п.5, отличающийся тем, что по меньшей мере одна олеагенная модификация уменьшает экспрессию или активность по меньшей мере одного олеагенного полипептида.
10. Гриб Yarrowia по п.5, отличающийся тем, что по меньшей мере одна олеагенная модификация увеличивает экспрессию или активность по меньшей мере одного олеагенного полипептида и уменьшает экспрессию или активность по меньшей мере одного другого олеагенного полипептида.
11. Гриб Yarrowia по п.8 или 9, отличающийся тем, что по меньшей мере один олеагенный полипептид выбран из группы, включающей полипептиды ацетил-КоА-карбоксилазы, полипептиды пируватдекарбоксилазы, полипептиды изоцитратдегидрогеназы, полипептиды АТФ (аденозинтрифосфат)цитратлиазы, полипептиды малатдегидрогеназы, полипептиды АМФ (аденозинмонофосфат)деаминазы и их комбинации.
12. Гриб Yarrowia по п.8 или 9, отличающийся тем, что указанный по меньшей мере один олеагенный полипептид является по меньшей мере одним полипептидом, выбранным из группы, включающей полипептиды, которые представлены в табл. 1-6.
13. Гриб Yarrowia по любому из пп.8-10, отличающийся тем, что указанная по меньшей мере одна олеагенная модификация включает экспрессию по меньшей мере одного гетерологичного олеагенного полипептида в грибе.
14. Гриб Yarrowia по п.13, отличающийся тем, что по меньшей мере одна олеагенная модификация включает экспрессию по меньшей мере одного гетерологичного гена, кодирующего по меньшей мере один гетерологичный олеагенный полипептид.
15. Гриб Yarrowia по п.13, отличающийся тем, что по меньшей мере один гетерологичный олеагенный полипептид включает полипептид животного, в частности полипептид млекопитающего, полипептид насекомого, полипептид растения, грибной полипептид, дрожжевой полипептид, водорослевый полипептид, бактериальный полипептид, цианобактериальный полипептид, архебактериальный полипептид или протозойный полипептид.
16. Гриб Yarrowia по п.13, отличающийся тем, что указанный гриб экспрессирует по меньшей мере два гетерологичных олеагенных полипептида.
17. Гриб Yarrowia по п.16, отличающийся тем, что указанные по меньшей мере два гетерологичных олеагенных полипептида происходят из одного организма-источника.
18. Гриб Yarrowia по п.16, отличающийся тем, что указанные по меньшей мере два гетерологичных олеагенных полипептида происходят меньшей мере из двух различных организмов-источников.
19. Гриб Yarrowia по любому из пп.2, 3, отличающийся тем, что указанный гриб содержит более одной каротиногенных модификаций.
20. Гриб Yarrowia по п.19, отличающийся тем, что указанные каротиногенные модификации придают грибу способность продуцировать по меньшей мере один каротиноид до уровня по меньшей мере примерно 1% от его сухой клеточной массы.
21. Гриб Yarrowia по п.19, отличающийся тем, что указанные каротиногенные модификации придают грибу способность продуцировать по меньшей мере один каротиноид, который указанный гриб не продуцирует в природных условиях.
22. Гриб Yarrowia по п.19, отличающийся тем, что указанный гриб дополнительно содержит по меньшей мере одну олеагенную модификацию, при этом указанная олеагенная модификация изменяет олеагенность гриба.
23. Гриб Yarrowia п.19, отличающийся тем, что указанные каротиногенные модификации придают указанному грибу способность продуцировать по меньшей мере один каротиноид до уровня, выбранного из группы, включающей по меньшей мере примерно 2%, по меньшей мере примерно 3%, по меньшей мере примерно 5% и по меньшей мере примерно 10% от сухой клеточной массы гриба.
24. Гриб Yarrowia по п.19, отличающийся тем, что указанный по меньшей мере один каротиноид выбран из группы, состоящей из астаксантина, β-каротина, кантаксантина, зеаксантина, лютеина, ликопина и их комбинации.
25. Гриб Yarrowia по п.19, отличающийся тем, что преобладающий тип каротиноида выбран из группы, состоящей из астаксантина, зеаксантина и ликопина.
26. Гриб Yarrowia по п.19, отличающийся тем, что указанная по меньшей мере одна каротиногенная модификация увеличивает экспрессию или активность каротиногенного полипептида.
27. Гриб Yarrowia по п.19, отличающийся тем, что указанная по меньшей мере одна каротиногенная модификация уменьшает экспрессию или активность каротиногенного полипептида.
28. Гриб Yarrowia по п.19, отличающийся тем, что указанная по меньшей мере одна каротиногенная модификация увеличивает экспрессию или активность по меньшей мере одного каротиногенного полипептида и уменьшает экспрессию или активность по меньшей мере одного другого каротиногенного полипептида.
29. Гриб Yarrowia по любому из пп.26-28, отличающийся тем, что указанные каротиногенные модификации включают экспрессию по меньшей мере одного гетерологичного каротиногенного полипептида.
30. Гриб Yarrowia по п.29, отличающийся тем, что каротиногенные модификации включают экспрессию по меньшей мере одного гетерологичного гена, кодирующего по меньшей мере один гетерологичный каротиногенный полипептид.
31. Гриб Yarrowia по п.26 или 27, отличающийся тем, что каротиногенный полипептид выбран из группы, включающей полипептид биосинтеза изопреноидов, полипептид биосинтеза каротиноидов, конкурентный полипептид биосинтеза изопреноидов и их комбинации.
32. Гриб Yarrowia по п.31, отличающийся тем, что полипептиды биосинтеза изопреноидов выбраны из группы, включающей полипептиды ацетоацетил-КоА-тиолазы, полипептиды HMG-CoA-синтазы, полипептиды HMG-CoA-редуктазы, полипептиды мевалонаткиназы, полипептиды фосфомевалонаткиназы, полипептиды мевалонатпирофосфатдекарбоксилазы, полипептиды IPP-изомеразы, полипептиды FPP-синтазы и полипептиды GGPP-синтазы.
33. Гриб Yarrowia по п.31, отличающийся тем, что полипептиды биосинтеза каротиноидов выбраны из группы, включающей полипептиды фитоенсинтазы, полипептиды фитоендегидрогеназы, полипептиды ликопинциклазы, полипептиды каротиноидкетолазы, полипептиды каротиноидгидроксилазы, полипептиды астаксантинсинтазы, полипептиды каротиноидэпсилонгидроксилазы, полипептиды каротиноидглюкозилтрансферазы, полипептиды ликопинциклазы (субъединицы бета и эпсилон) и полипептиды ацил-КоА:диацилглицеринтрансферазы.
34. Гриб Yarrowia по п.31, отличающийся тем, что конкурентные полипептиды биосинтеза изопреноидов выбраны из группы, включающей полипептиды скваленсинтазы, полипептиды пренилдифосфатсинтазы и полипептида ПГБ-полипренилтрансферазы.
35. Гриб Yarrowia по п.31, отличающийся тем, что каротиногенный полипептид выбран из группы, включающей полипептиды, представленные в табл. 7-25, 29 и 30, а также комбинации указанных полипептидов.
36. Гриб Yarrowia по любому из пп.26-28, отличающийся тем, что каротиногенные модификации включают полипептид животного, в частности полипептид млекопитающего, полипептид насекомого, полипептид растения, грибной полипептид, дрожжевой полипептид, водорослевый полипептид, бактериальный полипептид, цианобактериальный полипептид, архебактериальный полипептид или протозойный полипептид.
37. Гриб Yarrowia по любому из пп.26-28, отличающийся тем, что каротиногенные модификации включают экспрессию по меньшей мере двух гетерологичных каротиногенных полипептидов.
38. Гриб Yarrowia по п.37, отличающийся тем, что указанные по меньшей мере два гетерологичных каротиногенных полипептида происходят из одного организма-источника.
39. Гриб Yarrowia по п.37, отличающийся тем, что указанные по меньшей мере два гетерологичных каротиногенных полипептида происходят по меньшей мере из двух различных организмов-источников.
40. Гриб Yarrowia по любому из пп.2, 3, отличающийся тем, что указанный гриб аккумулирует продуцированный по меньшей мере один каротиноид до уровня, выбранного из группы, включающей более примерно 1%, более примерно 2%, более примерно 3%, более примерно 5% и более примерно 10% от сухой клеточной массы гриба.
41. Гриб Yarrowia по любому из пп.2, 3, отличающийся тем, что указанный гриб аккумулирует липид в форме цитоплазматических телец.
42. Гриб Yarrowia по п.41, отличающийся тем, что по меньшей мере один каротиноид аккумулируется в форме цитоплазматических масляных телец.
43. Штамм Yarrowia lipolytica, содержащий одну или более модификаций, выбранных из группы, включающей олеагенную модификацию, каротиногенную модификацию и их комбинации, при этом указанный штамм аккумулирует по меньшей мере один каротиноид в количестве от 1 до 10% от сухой клеточной массы штамма.
44. Штамм по п.43, отличающийся тем, что он аккумулирует липид в количестве от 20 до 50% от своей сухой клеточной массы.
45. Штамм по п.44, отличающийся тем, что указанный штамм аккумулирует липид в количестве от 20 до 50% от своей сухой клеточной массы в форме цитоплазматических масляных телец.
46. Штамм по п.43, отличающийся тем, что указанный штамм содержит каротиногенную модификацию, выбранную из группы, включающей:
а) экспрессию полипептида, выбранного из группы, состоящей из усеченного эндогенного полипептида HMG-CoA-редуктазы, в котором отсутствует N-концевой мембранный домен, ацетоацетил-КоА-тиолазы, HMG-CoA-синтазы, FPP-синтазы и GGPP синтазы;
б) экспрессию гетерологичного полипептида, выбранного из группы, включающей фитоинсинтазу, фитоиндесатуразу, ликопинциклазу, каротиноидкетолазу, каротиноидгидроксилазу и их комбинации.
47. Штамм по любому из пп.43-46, отличающийся тем, что указанный штамм аккумулирует каротиноид в количестве 1-10% от своей сухой клеточной массы, при этом каротиноид выбран из группы, состоящей из β-каротина, астаксантина, зеаксантина и ликопина.
48. Штамм по п.43, отличающийся тем, что указанный штамм содержит каротиногенную модификацию, выбранную из группы, включающей:
а) экспрессию полипептида, выбранного из группы, включающей усеченный эндогенный полипептид HMG-CoA-редуктазы, в котором отсутствует N-концевой мембранный домен, ацетоацетил-КоА-тиолазы, HMG-CoA-синтазы, FPP-синтазы и GGPP синтазы;
б) экспрессию гетерологичного полипептида, выбранного из группы, включающей фитоенсинтазу, фитоендесатуразу, ликопинциклазу, каротиноидкетолазу, каротиноидгидроксилазу, астаксантинсинтазу, каротиноидэпсилонгидроксилазу, ликопинциклазу (субъединицы бета и эпсилон), каротиноидглюкозилтрансферазу, ацил-КоА:диацилглицеринацилтрансферазу и их комбинации.
49. Способ продуцирования каротиноида, включающий культивирование генетически модифицированного гриба в условиях, которые обеспечивают продуцирование каротиноида, причем указанный гриб характеризуется тем, что:
а) указанный гриб является олеагенным и способен аккумулировать липид по меньшей мере примерно до 20% от своей сухой клеточной массы;
б) указанный гриб продуцирует по меньшей мере один каротиноид и способен аккумулировать продуцированный каротиноид по меньшей мере примерно до 1% от своей сухой клеточной массы;
при этом указанный гриб содержит по меньшей мере одну модификацию, выбранную из группы, включающей каротиногенные модификации, олеагенные модификации и их комбинации, и при этом указанная по меньшей мере одна модификация изменяет олеагенность гриба, придает грибу олеагенность, придает грибу способность продуцировать по меньшей мере один каротиноид до уровня по меньшей мере примерно 1% от своей сухой клеточной массы или придает грибу способность продуцировать по меньшей мере один каротиноид, который гриб не продуцирует в естественных условиях.
50. Способ по п.49, отличающийся тем, что указанный способ дополнительно включает выделение продуцируемого каротиноида.
51. Способ по п.50, отличающийся тем, что выделение включает фракционирование среды культивирования с получением по меньшей мере одной фракции, обогащенной каротиноидом.
52. Способ по п.50, отличающийся тем, что стадия культивирования включает культивирование гриба в условиях, которые обеспечивают аккумулирование каротиноида в цитоплазматических масляных тельцах, а выделение включает получение масла из цитоплазматических телец.
53. Способ по п.49, отличающийся тем, что каротиноид выбран из группы, включающей астаксантин, β-каротин, кантаксантин, зеаксантин, лютеин, ликопин и их комбинации.
54. Способ по п.49, отличающийся тем, что указанный каротиноид включает астаксантин.
55. Способ по п.49, отличающийся тем, что указанный каротиноид включает β-каротин.
56. Способ по п.49, отличающийся тем, что указанный каротиноид включает ликопин.
57. Способ по п.49, отличающийся тем, что указанный каротиноид включает зеаксантин.
58. Способ получения пищевой или кормовой добавки, включающей каротиноид, который содержит следующие стадии:
а) культивирование гриба по любому из пп.1-4 в условиях, которые обеспечивают продуцирование каротиноида;
б) выделение каротиноида и
в) объединение выделенного каротиноида с одним или более другими кормовыми или пищевыми дополнительными компонентами.
59. Способ продуцирования каротиноида, включающий культивирование генетически модифицированного гриба Yarrowia в условиях, которые обеспечивают продуцирование каротиноида;
при этом указанный генетически модифицированный гриб Yarrowia характеризуется следующим:
а) указанный гриб является олеагенным и способен аккумулировать липид по меньшей мере примерно до 20% от своей сухой клеточной массы;
б) в результате генетической модификации указанный гриб продуцирует по меньшей мере один каротиноид и способен аккумулировать продуцированный каротиноид по меньшей мере примерно до 1% от своей сухой клеточной массы.
60. Способ по п.59, отличающийся тем, что указанный способ дополнительно включает выделение продуцируемого каротиноида.
61. Способ по п.60, отличающийся тем, что указанное выделение включает фракционирование среды культивирования с получением по меньшей мере одной фракции, обогащенной каротиноидом.
62. Способ по п.60, отличающийся тем, что стадия культивирования включает культивирование гриба в условиях, которые обеспечивают аккумулирование каротиноида в цитоплазматических масляных тельцах, а выделение включает получение масла из цитоплазматических телец.
63. Способ по п.59, отличающийся тем, что каротиноид выбран из группы, включающей астаксантин, β-каротин, кантаксантин, зеаксантин, лютеин, ликопин и их комбинации.
64. Способ по п.59, отличающийся тем, что указанный каротиноид включает астаксантин.
65. Способ по п.59, отличающийся тем, что указанный каротиноид включает β-каротин.
66. Способ по п.59, отличающийся тем, что указанный каротиноид включает ликопин.
67. Способ по п.59, отличающийся тем, что указанный каротиноид включает зеаксантин.
Текст
Настоящее изобретение обеспечивает системы для продуцирования рекомбинантных олеагенных дрожжей или грибов, которые экспрессируют каротиноиды. 016258 Родственные заявки Настоящая заявка на патент испрашивает приоритет предварительной заявки на патент US60/663621 от 18 марта 2005 г., содержание которой полностью включается в настоящее описание в качестве ссылки. Предпосылки изобретения Каротиноиды представляют собой органические пигменты, которые имеют цвет от желтого до красного и вырабатываются в естественных условиях определенными организмами, в том числе фотосинтетическими организмами (например, растениями, водорослями, цианобактериями), а также некоторыми грибами. Каротиноиды являются ответственными за оранжевый цвет моркови, а также за розовую окраску фламинго и лосося и за красную окраску омаров и креветок. Однако животные не могут вырабатывать каротиноиды и должны получать их в пищевом рационе. Каротиноидные пигменты (например, -каротин и астаксантин) используют в промышленности в качестве ингредиентов пищевого и кормового сырья, которые одновременно выполняют питательную функцию и повышают потребительские свойства. Так, например, астаксантин широко используют при разведении лососевых рыб, чтобы обеспечить оранжевую окраску, характерную для их диких сородичей. Некоторые каротиноиды являются предшественниками витамина А. Кроме того, каротиноиды обладают антиоксидантными свойствами и могут быть полезными для здоровья (см., например, Jyonouchi et al.,Nutr. Cancer 16:93, 1991; Giovannucci et al., J. Natl. Cancer Inst. 87:1767, 1995; Miki, Pure Appl. Chem. 63:141, 1991; Chew et al., Anticancer Res. 19:1849, 1999; Wang et al., Antimicrob. Agents Chemother. 44:2452, 2000). Некоторые каротиноиды, в частности -каротин, ликопин и лютеин, в настоящее время поступают в продажу в качестве пищевых добавок. В общем случае биологические системы, которые вырабатывают каротиноиды, не поддаются промышленной обработке и/или вырабатывают эти соединения в таком малом количестве, что их производство в промышленных масштабах является нецелесообразным. Поэтому большинство каротиноидов,применяемых в промышленности, получают путем химического синтеза. Таким образом, существует потребность в усовершенствованных биологических системах, продуцирующих каротиноиды. Ранее предпринимались попытки модифицировать определенные бактерии или грибы при помощи генной инженерии, чтобы получать более высокое содержание каротиноидов (см., например, Misawa et al., J. Biotechnol. 59:169, 1998; Visser et al., FEMS Yeast Research 4:221, 2003). Однако при этом сохраняется потребность в усовершенствованных системах, которые обеспечивают более высокую производительность и простоту выделения. Краткое описание изобретения Настоящее изобретение обеспечивает усовершенствованные системы, предназначенные для биологической выработки каротиноидов. Согласно одному аспекту изобретение охватывает открытие, которое желательно для получения каротиноидов в олеагенных организмах. Не желая ограничиваться какой-либо конкретной теорией, авторы настоящего изобретения предполагают, что биологические системы могут аккумулировать каротиноиды в большом количестве, если указанные соединения заключены в липидные тела. Однако, несмотря на высокое абсолютное содержание, каротиноиды, аккумулированные в липидных телах в олеагенных организмах, можно легко выделять посредством выделения липидных тел. Таким образом, настоящее изобретение обеспечивает олеагенные грибы (включая, например,дрожжи или другие одноклеточные грибы), которые вырабатывают один или несколько каротиноидов. Кроме того, настоящее изобретение обеспечивает способы получения указанных дрожжей и грибов, способы применения таких дрожжей и грибов для получения каротиноидов, а также способы получения составов, содержащих каротиноиды, в частности, в форме пищевых или кормовых добавок либо питательных добавок с использованием каротиноидов, которые вырабатываются в указанных дрожжах или грибах. В частности, настоящее изобретение обеспечивает системы и способы получения дрожжей и грибов,содержащих одну или несколько олеагенных и/или каротиногенных модификаций и/или изменений их способности вырабатывать каротиноиды по сравнению с идентичными организмами, в которых такие модификации отсутствуют. Настоящее изобретение включает также общее представление о том, что аккумулирующие липиды системы являются полезными для получения и/или выделения липофильных агентов (в частности, но без ограничения, изопреноидов или производных соединений изопреноидов). Таким образом, согласно изобретению желательно сконструировать организмы для получения таких липофильных агентов и/или для аккумулирования липидов. Различные другие аспекты настоящего изобретения станут очевидны для специалистов в данной области техники из данного описания, включающего прилагаемую формулу изобретения. Краткое описание чертежей На фиг. 1A-1D представлены некоторые известные каротиноиды. Фиг. 2 показывает путь возможного аккумулирования достаточного количества ацетил-КоА (кофермент А-редуктазы) и NADPH (nicotinamide adenine dinucleotide фосфат, никотинамидадениндинуклеотидфосфат) в цитозоле олеагенных организмов, чтобы обеспечить получение цитозольных липидов в-1 016258 значительном количестве. Ферменты: 1 - пируватдекарбоксилаза, 2 - малатдегидрогеназа, 3 - малатдегидрогеназа, 4 - пируватдегидрогеназа, 5 - цитратсинтаза, 6 - АТФ-(аденозинтрифосфат)цитратлиаза, 7 цитрат/малаттранслоказа. На фиг. 3 А и 3 В представлен путь мевалонатного биосинтеза изопреноидов, который обычно происходит в эукариотах, включая грибы. На фиг. 4 показан путь мевалонат - независимого биосинтеза изопреноидов, известный также как путь DXP, который обычно реализуется в бактериях и в пластидах растений. На фиг. 5 показаны промежуточные соединения, образующиеся на пути биосинтеза изопреноидов и их встраивание в пути биосинтеза других биомолекул, включая каротиноиды, а также некаротиноидные соединения, в частности стеролы, стероиды и витамины, например витамин Е или витамин K. На фиг. 6 А-6D показаны различные пути биосинтеза каротиноидов. На фиг. 6 А выделены ветви, ведущие к различным циклическим и ациклическим ксантофиллам, на фиг. 6 В показаны некоторые пути синтеза дрожжевого гриба X. dendrorhous, который вырабатывает дициклические и моноциклические каротиноиды, включая астаксантин, на фиг. 6 С - соединительные пути для превращения -каротина в один из множества других каротиноидов, включая астаксантин, а на фиг. 6D - возможные пути синтеза циклических каротиноидов и обычных растительных и водорослевых ксантофиллов из нейроспорина. На фиг. 7 А-7 С показана структура некоторых репрезентативных грибных полипептидов редуктазыHMG-CoA (3-гидрокси-3-метилглутарил-КоА). Можно видеть, что эти полипептиды обладают очень высокой идентичностью в каталитической зоне, а также содержат комплексные трансмембранные домены. В некоторых вариантах реализации изобретения эти трансмембранные домены разрушают или удаляют,чтобы получить, например, гиперактивную версию полипептида. На фиг. 8 А-8D показаны схематические представления плазмид, которые образуются и подробно описываются в приведенных далее примерах. Определения Каротиногенная модификация: термин "каротиногенная модификация", используемый в данном описании, относится к модификации организма-хозяина, который регулирует продуцирование одного или нескольких каротиноидов в соответствии с настоящим описанием. Так, например, каротиногенная модификация может повышать уровень продуцирования одного или нескольких каротиноидов и/или изменять относительные уровни продуцирования различных каротиноидов. В принципе, каротиногенная модификация согласно изобретению может представлять собой любую химическую, физиологическую,генетическую или иную модификацию, которая соответствующим образом изменяет в организмехозяине продуцирование одного или нескольких каротиноидов, вырабатываемых этим организмом, по сравнению с уровнем продуцирования в идентичном организме, не подвергнутом такой же модификации. Однако в большинстве вариантов реализации изобретения каротиногенная модификация является генетической модификацией, которая обычно приводит к повышению продуцирования одного или нескольких выбранных каротиноидов. В некоторых вариантах реализации изобретения выбранный каротиноид представляет собой один или несколько из следующих каротиноидов: астаксантин, -каротин, кантаксантин, лютеин, ликопин, фитоин, зеаксантин и/или модификации зеаксантина или астаксантина (например, глюкозид, этерифицированный зеаксантин или астаксантин). В некоторых вариантах реализации изобретения выбранный каротиноид представляет собой один или несколько ксантофиллов и/или их модификацию (например, глюкозид, этерифицированные ксантофиллы). В некоторых вариантах реализации изобретения указанный ксантофилл выбирают из группы, включающей астаксантин, лютеин, зеаксантин, ликопин и их модификации. В некоторых вариантах реализации изобретения выбранный каротиноид представляет собой один или несколько из следующих каротиноидов: астаксантин, -каротин, кантаксантин, лютеин, ликопин и зеаксантин и/или модификации зеаксантина или астаксантина. В некоторых вариантах реализации изобретения указанный каротиноид представляет собой -каротин. В некоторых вариантах реализации изобретения выбранный каротиноид представляет собой астаксантин. В некоторых вариантах реализации изобретения выбранный каротиноид не является -каротином. Каротиногенный полипептид: термин "каротиногенный полипептид", используемый в данном описании, относится к любому полипептиду, который участвует в процессе выработки каротиноидов в клетке и может включать полипептиды, которые участвуют в процессах, отличных от продуцирования каротиноидов, однако, активность которых оказывает влияние на объем или уровень продуцирования одного или нескольких каротиноидов, например, за счет потребления субстрата или реагента, используемого каротиноидным полипептидом, непосредственно участвующим в продуцировании каротиноидов. Каротиногенные полипептиды включают полипептиды биосинтеза изопреноидов, полипептиды биосинтеза каротиноидов и конкурентные полипептиды биосинтеза каротиноидов в соответствии с приведенными здесь определениями терминов. Данный термин включает также полипептиды, которые могут оказывать влияние на степень аккумулирования каротиноидов в липидных телах. Каротиноид: термин "каротиноид", используемый в данном описании, относится к разнообразному по структуре классу пигментов, которые получают из промежуточных соединений изопреноидного пути. Важным этапом в биосинтезе каротиноидов является образование фитоена из геранилгеранилпирофос-2 016258 фата. Каротиноиды могут быть ациклическими или циклическими и могут содержать или не содержать кислород, поэтому термин "каротиноиды" включает как каротины, так и ксантофиллы. В общем случае каротиноиды представляют собой углеводородные соединения, имеющие полиенуглеродный каркас,формально полученные из пятиуглеродного соединения IPP (изопентилпирофосфат), включая тритерпены (С 30 диапокаротиноиды) и тетратерпены (С 40 каротиноиды), а также их кислородосодержащие производные и другие соединения, которые имеют длину, например, С 35, С 50, С 60, С 70, С 80 или иную длину. Многие каротиноиды обладают сильными абсорбирующими свойствами и могут иметь длину более С 200. С 30 диапокаротиноиды обычно состоят из шести изопреноидных единиц, соединенных таким образом,что расположение изопреноидных единиц является противоположным в центре молекулы, при этом две центральные метильные группы находятся в позициях 1, 6, а остальные неконцевые метильные группы находятся в позициях 1, 5. Такие С 30 каротиноиды можно формально получить из ациклической структуры С 30 Н 42, имеющей длинную центральную цепь из конъюгированных двойных связей, способом: (1) гидрогенизации, (2) дегидрогенизации, (3) циклизации, (4) окисления, (5) этерификации/гликозилирования или комбинации этих способов. С 40 каротиноиды обычно состоят из восьми изопреноидных единиц, соединенных таким образом, что расположение изопреноидных единиц является противоположным в центре молекулы, при этом две центральные метильные группы находятся в позициях 1, 6, а остальные неконцевые метильные группы находятся в позициях 1, 5. Такие С 40 каротиноиды можно формально получить из ациклической структуры С 40 Н 56, имеющей длинную центральную цепь из конъюгированных двойных связей, способом: (1) гидрогенизации, (2) дегидрогенизации, (3) циклизации,(4) окисления, (5) этерификации/гликозилирования или комбинации этих способов. Класс С 40 каротиноидов включает также некоторые соединения, которые получаются в результате перестройки углеродного каркаса или (формального) удаления части этой структуры. В природе идентифицировано более 600 различных каротиноидов. Некоторые распространенные каротиноиды представлены на фиг. 1. Каротиноиды включают, в частности, но без ограничения: антераксантин, адонирубин, адониксантин, астаксантин,кантаксантин, капсорубин, -криптоксантин, -каротин, -каротин, ,-каротин, -каротин, -каротин,эхиненон, 3-гидроксиэхиненон, 3'-гидроксиэхиненон, -каротин, -каротин, 4-кетокаротин, -каротин,-криптоксантин, деоксифлексиксантин, диатоксантин, 7,8-дидегидроастаксантин, дидегидроликопин,фукоксантин, фукоксантинол, изорениератин, -изорениератин, лактукаксантин, лютеин, ликопин, миксобактон, неоксантин, нейроспорин, гидроксинейроспорин, перидинин, фитоин, родопин, родопин глюкозид, 4-кеторубиксантин, сифонаксантин, сфероиден, сфероиденон, спириллоксантин, торулин, 4 кетоторулин, 3-гидрокси-4-кетоторулин, уриолид, уриолид ацетат, виолаксантин, зеаксантин-диглюкозид, зеаксантин и С 30 каротиноиды. Кроме того, каротиноидные соединения включают производные этих молекул, которые могут содержать гидрокси-, метокси-, оксо-, эпокси-, карбокси- или альдегидные функциональные группы. Указанные каротиноидные соединения включают также сложный эфир (например, сложный гликозидный эфир, сложный эфир жирных кислот) и сульфатные производные(например, этерифицированные ксантофиллы). Полипептид биосинтеза каротиноидов: термин "полипептид биосинтеза каротиноидов" относится к любому полипептиду, который участвует в синтезе одного или нескольких каротиноидов. Такие полипептиды биосинтеза каротиноидов включают, например, полипептиды фитоинсинтазы, фитоиндегидрогеназы (или десатуразы), ликопинциклазы, каротиноидкетолазы, каротиноидгидроксилазы, астаксантинсинтазы, каротиноидэпсилонгидроксилазы, ликопинциклазы (субъединицы бета и эпсилон), каротиноидглюкозилтрансферазы и ацил-КоА: диацилглицеринацилтрансферазы. Репрезентативные примеры последовательностей полипептидов биосинтеза каротиноидов представлены в табл. 17-25. Ген: термин "ген", используемый в данном описании, в общем случае относится к нуклеиновой кислоте, кодирующей полипептид и, возможно, включающей некоторые регуляторные элементы, которые могут оказывать влияние на экспрессию одного или нескольких генных продуктов (т.е. РНК или белка). Гетерологичный: термин "гетерологичный", используемый в данном описании применительно к генам или полипептидам, относится к гену или полипептиду, который не встречается естественным образом в организме, в котором он экспрессируется. Следует понимать, что, в общем случае, когда гетерологичный ген или полипептид выбирают для введения в клетку-хозяина и/или для экспрессии клеткойхозяином, конкретный организм-источник, из которого могут быть выбраны гетерологичный ген или полипептид, не является существенным для реализации настоящего изобретения. Учитываемые обстоятельства могут включать, например, насколько близко связаны в эволюции организмы источника и хозяина или как организм-источник связан с другими организмами-источниками, из которых выбраны последовательности других соответствующих полипептидов. Клетка-хозяин: используемый в данном описании термин "клетка-хозяин" представляет собой дрожжевую или грибную клетку, которую подвергают определенным манипуляциям согласно настоящему изобретению, чтобы аккумулировать липид и/или экспрессировать один или несколько каротиноидов в соответствии с данным описанием. Термин "модифицированная клетка-хозяин", используемый в данном описании, представляет собой клетку-хозяина, которая содержит по меньшей мере одну олеагенную модификацию и/или по меньшей мере одну каротиногенную модификацию согласно настоящему-3 016258 изобретению. Выделенный: термин "выделенный", используемый в данном описании, означает, что выделенный элемент отделен по меньшей мере от одного компонента, с которым он был предварительно объединен. Если большинство других компонентов удалено, то выделенный элемент является "очищенным". Выделение и/или очистку можно выполнить любым способом, известным специалистам в данной области техники, включая, например, фракционирование, экстракцию, осаждение или иной способ разделения. Конкурентный полипептид биосинтеза изопреноидов: термин "конкурентный полипептид биосинтеза изопреноидов", используемый в данном описании, относится к полипептиду, экспрессия которого в клетке уменьшает содержание геранилгеранилпирофосфата (GGPP), необходимого для реализации пути биосинтеза каротиноидов. Например, конкурентные полипептиды биосинтеза изопреноидов включают ферменты, которые действуют на промежуточные соединения изопреноидов прежде GGPP, что приводит к уменьшению продуцирования GGPP (см., например, фиг. 5). Скваленсинтаза является одним из конкурентных полипептидов биосинтеза изопреноидов согласно настоящему изобретению; репрезентативные последовательности скваленсинтазы представлены в табл. 16. Другими конкурентными полипептидами биосинтеза изопреноидов согласно настоящему изобретению являются ферменты пренилдифосфатсинтазы и парагидроксибензоат (ПГБ) полипренилтрансферазы; репрезентативные ферменты пренилдифосфатсинтазы и полипептиды ПГБ полипренилтрансферазы представлены в табл. 29 и 30 соответственно. Полипептид биосинтеза изопреноидов: термин "полипептид биосинтеза изопреноидов" относится к любому полипептиду, который участвует в синтезе изопреноидов. Например, как рассматривается в данном описании, ацетоацетил-КоА-тиолаза, HMG-CoA-синтаза, HMG-CoA-редуктаза, мевалонаткиназа,фосфомевалонаткиназа, мевалонатпирофосфатдекарбоксилаза, IPP изомераза, FPP (фарнезилпирофосфат)синтаза и GGPP-синтаза участвуют в мевалонатном пути биосинтеза изопреноидов. Каждый из этих белков является также полипептидом биосинтеза изопреноидов в рамках настоящего изобретения. Последовательности репрезентативных примеров этих ферментов представлены в табл. 7-15. Изопреноидный путь: термин "изопреноидный путь", используемый в данном описании, относится к метаболическому пути, который вырабатывает или использует пятиуглеродный метаболит - изопентилпирофосфат (IPP). Как указано в данном описании, распространенный предшественник изопреноиодов IPP можно получить двумя различными путями - "мевалонатным путем" и "немевалонатным путем". Термин "изопреноидный путь" является достаточно общим и включает оба этих типа пути. Биосинтез изопреноидов из IPP происходит в результате полимеризации нескольких пятиуглеродных изопреновых субъединиц. Изопреноидные метаболиты, полученные из IPP, имеют различные размеры и химические структуры и включают циклические и ациклические молекулы. Изопреноидные метаболиты включают, в частности, но без ограничения, монотерпены, сесквитерпены, дитерпены, стерины и полипренолы, в частности каротиноиды. Олеагенная модификация: термин "олеагенная модификация", используемый в данном описании,относится к модификации организма-хозяина, которая обеспечивает желаемую олеагенность указанного организма-хозяина в соответствии с данным описанием. В некоторых случаях организм-хозяин уже в исходном состоянии является олеагенным, т.е. способным аккумулировать липид с содержанием по меньшей мере около 20% от сухой клеточной массы. Тем не менее, может оказаться желательным применить к такому организму олеагенную модификацию в соответствии с настоящим изобретением, чтобы,например, увеличить (или в некоторых случаях, возможно, уменьшить) его суммарное аккумулирование липидов или отрегулировать типы или содержание одного или нескольких конкретных липидов, которые он аккумулирует (например, увеличить относительное аккумулирование триацилглицерина). В других случаях организм-хозяин может быть неолеагенным (хотя при этом он может содержать некоторые ферментные и регуляторные компоненты, используемые в других организмах для аккумулирования липидов) и может потребовать олеагенной модификации, чтобы стать олеагенным согласно настоящему изобретению. Настоящее изобретение включает также применение олеагенной модификации к неолеагенным штаммам-хозяевам, чтобы повысить их олеагенность, однако даже после такой модификации они могут не стать олеагенными согласно приведенному здесь определению. В принципе, олеагенная модификация может представлять собой любую химическую, физиологическую, генетическую или иную модификацию, которая соответствующим образом изменяет олеагенность организма-хозяина по сравнению с идентичным организмом, не подвергнутым олеагенной модификации. Однако в большинстве вариантов реализации изобретения олеагенная модификация включает генетическую модификацию, которая обычно вызывает повышение продуцирования и/или активности одного или нескольких олеагенных полипептидов. В некоторых вариантах реализации изобретения олеагенная модификация включает по меньшей мере одну химическую, физиологическую, генетическую или иную модификацию. В других вариантах реализации изобретения олеагенная модификация включает более чем одну химическую, физиологическую, генетическую или иную модификацию. В некоторых аспектах изобретения при использовании более чем одной модификации такие модификации могут содержать любую комбинацию химических,физиологических, генетических или иных модификаций (например, одну или несколько генетических модификаций и химических или физиологических модификаций). Олеагенный полипептид: термин "олеагенный полипептид", используемый в данном описании, от-4 016258 носится к любому полипептиду, который участвует в процессе аккумулирования липидов в клетке, и может включать полипептиды, которые участвуют в процессах, отличных от биосинтеза липидов, однако их активность оказывает влияние на степень или уровень аккумулирования одного или нескольких липидов, например, путем потребления субстрата или реагента, используемого олеагенным полипептидом,который непосредственно участвует в аккумулировании липидов. Например, как рассматривается в настоящем описании, ацетил-КоА-карбоксилаза, пируватдекарбоксилаза, изоцитратдегидрогеназа, АТФ(аденозинтрифосфат)цитратлиаза, маликфермент и АМФ (аденозинмонофосфат)деаминаза среди других белков участвуют в аккумулировании липидов в клетках. В общем случае ожидается, что снижение активности пируватдекарбоксилазы или изоцитратдегидрогеназы и/или повышение активности ацетилКоА-карбоксилазы, АТФ-цитратлиазы, маликфермента и/или АМФ-деаминазы способствует олеагенности. Каждый из этих белков представляет собой олеагенный полипептид, используемый в настоящем изобретении. Последовательности репрезентативных примеров этих ферментов представлены в табл. 1-6. Олеагенный: термин "олеагенный" относится к способности организма аккумулировать липид в количестве по меньшей мере около 20% от его сухой клеточной массы. В некоторых вариантах реализации изобретения олеагенные дрожжи или грибы аккумулируют липид по меньшей мере до примерно 25% их сухой клеточной массы. В других вариантах реализации изобретения олеагенные дрожжи или грибы аккумулируют липид в пределах примерно 20-45% их сухой клеточной массы. В некоторых вариантах реализации изобретения олеагенные организмы могут аккумулировать липид примерно до 70% их сухой клеточной массы. В некоторых вариантах реализации изобретения олеагенные организмы могут аккумулировать большую долю всех аккумулированных липидов в форме триацилглицерина. В некоторых вариантах реализации изобретения основная часть аккумулированного липида находится в форме триацилглицерина. Альтернативно или дополнительно, липид можно аккумулировать в форме внутриклеточных липидных тел или масляных тел. В некоторых вариантах реализации настоящее изобретение использует дрожжи или грибы, которые являются природно олеагенными. В некоторых аспектах природно олеагенные организмы модифициуют (например, генетическим, химическим или иным способом), чтобы дополнительно увеличить содержание аккумулированного липида в организме. В других вариантах реализации изобретения дрожжи или грибы, которые не являются природно олеагенными, модифицируют(например, генетическим, химическим или иным способом), чтобы аккумулировать липид согласно данному описанию. Для задач настоящего изобретения Xantophyllomyces dendrorhous (Phaffia rhodozyma) иCandida utilis не являются природно олеагенными грибами. Полипептид: термин "полипептид", используемый в данном описании, в общем случае имеет свое традиционное значение полимера по меньшей мере трех аминокислот. Однако этот термин используется также применительно к специфическим функциональным классам полипептидов, например олеагенные полипептиды, каротиногенные полипептиды, полипептиды биосинтеза изопреноидов, полипептиды биосинтеза каротиноидов и конкурентные полипептиды биосинтеза изопреноидов. Для каждого такого класса в настоящем описании приведено несколько примеров известных последовательностей этих полипептидов. Однако для рядовых специалистов в данной области техники очевидно, что термин "полипептид" является достаточно общим и включает не только полипептиды, имеющие полную последовательность,приведенную в данном описании (или в ссылке или конкретно указанной базе данных), но также и полипептиды, которые представляют собой функциональные фрагменты (т.е. сохраняющие по меньшей мере одну функцию) таких полных полипептидов. Кроме того, специалисты в данной области техники понимают, что последовательности белка обычно допускают некоторое замещение без нарушения функциональности. Таким образом, любой полипептид, который сохраняет функциональность и имеет идентичность общей последовательности по меньшей мере примерно 30-40%, часто более чем примерно 50, 60,70 или 80%, и, кроме того, обычно содержит по меньшей мере одну область с более высокой идентичностью, часто более чем 90% или даже 95, 96, 97, 98 или 99% в одной или нескольких высоко консервативных областях (например, полипептиды изоцитратдегидрогеназы часто содержат консервативный АМФсвязывающий фрагмент; полипептиды HMG-CoA редуктазы обычно содержат высоко консервативный каталитический домен (см., например, фиг. 7); ацетил-СоА-карбоксилаза обычно содержит домен карбоксилтрансферазы; см., например, Downing et al., Chem. Abs. 93:484, 1980; Gil et al., Cell 41:249, 1985;Jitrapakdee et al. Curr Protein Pept Sci. 4:217, 2003; патент US5349126, все из которых полностью включены в данное описание в качестве ссылки), обычно включающие по меньшей мере 3-4 и часто до 20 или более аминокислот, с другим полипептидом того же самого класса, включается в соответствующий термин "полипептид", используемый в данном описании. Организм-источник: термин "организм-источник", используемый в данном описании, относится к организму, в котором конкретную полипептидную последовательность можно найти в естественных условиях. Так, например, если один или несколько гетерологичных полипептидов экспрессируются в организме-хозяине, то организм, в котором указанные полипептиды экспрессируются в природе (и/или из которого их гены были первоначально клонированы), называют "организмом-источником". Если несколько гетерологичных полипептидов экспрессируются в организме-хозяине, то один или несколько организмов-источников можно использовать для независимой селекции каждого из таких гетерологичных полипептидов. Следует понимать, что все организмы, которые в естественных условиях содержат-5 016258 соответствующие полипептидные последовательности, в соответствии с настоящим изобретением можно использовать в качестве организмов-источников. Репрезентативные организмы-источники включают,например, животных, млекопитающих, насекомых, а также растительные, грибные, дрожжевые, водорослевые, бактериальные, цианобактериальные, архебактериальные и протозойные организмыисточники. Подробное описание некоторых предпочтительных вариантов реализации изобретения Как указано выше, согласно настоящему изобретению каротиноиды желательно получать в олеагенных дрожжах и грибах. В соответствии с настоящим изобретением штаммы, которые (1) аккумулируют липид, часто в форме цитоплазматических масляных тел и обычно по меньшей мере около 20% их сухой клеточной массы, и (2) продуцируют каротиноиды на уровне по меньшей мере около 1%, а в некоторых вариантах реализации изобретения по меньшей мере около 3-20% их сухой клеточной массы, получают посредством обработки клеток-хозяев (т.е. штаммы, включающие, например, природные штаммы, штаммы, которые были предварительно модифицированы и т.п.). Затем эти обработанные клеткихозяева используют для получения каротиноидов таким образом, чтобы иметь возможность легкого выделения каротиноидов, отделенных в липидных телах. В общем случае желательно сбалансировать олеагенность и продуцирование каротиноидов в клетках согласно изобретению таким образом, чтобы после достижения минимального желательного уровня олеагенности практически весь остальной углерод, который можно использовать и превращать в продукты биосинтеза, направлялся по пути продуцирования каротиноидов. В некоторых вариантах реализации изобретения эта стратегия включает конструирование олеагенных клеток; в других вариантах реализации изобретения она включает конструирование клеток, которые аккумулируют более высокое содержание липида, в особенности цитоплазматического липида, чем при отсутствии такого конструирования, хотя эти сконструированные клетки могут не стать "олеагенными" согласно определению, приведенному в данном описании. В других вариантах реализации изобретения степень аккумулирования липида олеагенной клеткой-хозяином фактически снижают, чтобы использовать остальной углерод для продуцирования каротиноидов. Клетки-хозява. Рядовым специалистам в данной области техники известно, что существует множество дрожжевых и грибных штаммов, которые являются природно олеагенными и которые продуцируют каротиноиды в естественных условиях. Такие штаммы можно использовать согласно настоящему изобретению в качестве штаммов-хозяев, а также можно конструировать или иным образом обрабатывать, чтобы получать олеагенные штаммы, продуцирующие каротиноиды, в соответствии с изобретением. Альтернативно можно использовать штаммы, которые в естественных условиях не являются ни олеганенными, ни продуцирующими каротиноиды. Кроме того, даже если какой-либо конкретный штамм имеет природную способность к олеагенности или к продуцированию каротиноидов, его природные способности можно откорректировать согласно данному описанию, чтобы изменить уровень продуцирования липида и/или каротиноида. В некоторых вариантах реализации изобретения конструирование или обработка штамма приводит к модификации типа продуциремого липида и/или каротиноида. Так, например, штамм может быть природно олеагенным и/или каротиногенным, однако при помощи инженерии или модификации штамма можно изменить тип липида, который аккумулируется, или тип каротинида, который продуцируется этим штаммом. При выборе конкретного дрожжевого или грибного штамма для применения согласно настоящему изобретению, как правило, желательно выбирать такой штамм, характеристики культивирования которого позволяют обеспечить производство в промышленном масштабе. Так, например, обычно (хотя не обязательно всегда) является желательным избежать использования филаментных организмов или организмов, которые требуют необычных или строгих условий роста. Однако если можно обеспечить условия промышленного производства, которые позволяют применять филаментные организмы, их можно выбрать в качестве клеток-хозяев. В некоторых вариантах реализации изобретения в качестве клеток-хозяев желательно использовать съедобные организмы, поскольку их при желании можно непосредственно применять в пищевых или кормовых добавках или в качестве питательных добавок. Для простоты производства в некоторых вариантах реализации используют клетки-хозева, которые поддаются генетической модификации средствами молекулярной генетики (например, могут быть эффективно трансформироваными, в особенности с помощью адаптированных или имеющихся векторов; возможно, могут включать и/или объединять различные гены, например, последовательно; и/или имеют известную генетическую последовательность и т.п.), не требуют сложных условий для роста (например, необходимости освещения), являются мезофильными (например, предпочитают для роста температуру в пределах примерно 2532 С), способны ассимилировать разнообразные источники углерода и азота и/или способны к росту до высокой плотности клеток. Альтернативно или дополнительно, в различных вариантах реализации изобретения используют клетки-хозяева, которые растут в форме отдельных клеток, а не многоклеточные организмы (например, как мицелии). В общем случае, если в соответствии с настоящим изобретением желательно использовать природный олеагенный организм, то возможно применение любого модифицируемого или культивируемого-6 016258 олеагенного организма. В некоторых вариантах реализации изобретения применяют дрожжи или грибы,включая, в частности, но без ограничения, виды Blakeslea, Candida, Cryptococcus, Cunninghamella, Lipomyces, Mortierella, Mucor, Phycomyces, Pythium, Rhodosporidium, Rhodotorula, Trichosporon и Yarrowia. В некоторых конкретных вариантах реализации применяют организмы видов, которые включают, в частности, но без ограничения, Blakeslea frispora, Candida pulcherrima, C. revkaufi, С. tropicalis, Cryptococcuspinicola, Trichosporon pullans, T. cutaneum и Yarrowia lipolytica. Одни из этих природных олеагенных штаммов также естественно продуцируют каротиноиды, а другие - нет. Встречающиеся в природе каротиногенные олеагенные дрожжи или грибы в большинстве случаев продуцируют каротиноиды лишь в небольшом количестве (менее чем примерно 0,05% сухой клеточной массы). Иногда -каротин продуцируется в большем количестве, однако высокое содержание других каротиноидов, как правило, не наблюдается. В общем случае любой организм, который является природно олеагенным и не продуцирующим каротиноиды (например, продуцирует менее чем примерно 0,05% сухой клеточной массы, не продуцирует каротиноид, представляющий интерес), можно использовать в соответствии с настоящим изобретением в качестве клетки-хозяина. В некоторых вариантах реализации изобретения организм представляет собой дрожжи или гриб, в частности, но без ограничения, рода Candida, Cryptococcus, Cunninghamella,Lipomyces, Mortierella, Pythium, Trichosporon и Yarrowia; в некоторых вариантах реализации изобретения организм относится, в частности, но без ограничения, к виду Mortierella alpina и Yarrowia lipolytica. Для сравнения, настоящее изобретение позволяет использовать в качестве клетки-хозяина также любой природно олеагенный организм, продуцирующий каротиноиды. В общем случае настоящее изобретение можно использовать для увеличения потока углерода, направляемого по изопреноидному пути в природных организмах, продуцирующих каротиноиды (в особенности для организмов, отличных отBlakeslea и Phycomyces), и/или для сдвига продуцирования от одного каротиноида (например, от каротина) к другому (например, к астаксантину). Введение одной или нескольких каротиногенных модификаций (например, увеличение экспрессии одного или нескольких эндогенных или гетерологичных каротиногенных полипептидов) в соответствии с настоящим изобретением может обеспечить достижение этих целей. В некоторых вариантах реализации изобретения используемый олеагенный организм, продуцирующий каротиноиды, представляет собой дрожжи или гриб, в частности, но без ограничения, родаBlakeslea, Mucor, Phycomyces, Khodosporidium и Rhodotorula; в некоторых вариантах реализации изобретения организм относится к видам Mucor circinelloides и Rhodotorula glutinis. В тех случаях, когда в качестве клеток-хозяев в соответствии с настоящим изобретением желательно использовать штаммы, которые являются природно неолеагенными, роды неолеагенных дрожжей или грибов включают, в частности, но без ограничения, Aspergillus, Botrytis, Cercospora, Fusarium (Gibberella),Kluyveromyces, Neurospora, Penicillium, Pichia (Hansenula), Puccinia, Saccharomyces, Sclerotium, Trichoderma и Xanthophyllomyces (Phaffia); в некоторых вариантах реализации изобретения организм относится к роду, включая, в частности, но без ограничения, Aspergillus nidulans, A. niger, A. terreus, Botrytis cinerea,Cercospora nicotianae, Fusarium fujikuroi (Gibberella zeae), Kluyveromyces lactis, K. lactis, Neurospora crassa,Pichia pastoris, Puccinia distincta, Saccharomyces cerevisiae, Sclerotium rolfsii, Trichoderma reesei и Xanthophyllomyces dendrorhous (Phaffia rhodozyma). Следует понимать, что термин "неолеагенный", используемый в данном описании, включает штаммы, которые обладают некоторой естественной способностью аккумулировать липид, в частности, цитоплазматически, однако, не до такого уровня, который можно квалифицировать как "олеагенный" согласно приведенному здесь определению, а также штаммы, которые не обладают естественной способностью аккумулировать внешний липид, например внемембранный липид. Следует также понимать, что в некоторых вариантах реализации изобретения достаточно увеличить естественный уровень олеагенности конкретной клетки-хозяина, даже если модифицированная клетка не квалифицируется как олеагенная согласно приведенному здесь определению. Как и природно олеагенные организмы, одни из природно неолеагенных грибов в естественных условиях продуцируют каротиноиды, а другие - нет. Роды природно неолеагенных грибов, которые в естественных условиях не продуцируют каротиноиды (например, продуцируют менее чем примерно 0,05% сухой клеточной массы, не продуцируют каротиноид, представляющий интерес) и могут быть использованы в качестве клеток-хозяев в соответствии с настоящим изобретением, включают, в частности, но без ограничения, Aspergillus, Kluyveromyces, Penicillium, Saccharomyces и Pichia; виды включают, в частности, но без ограничения, Aspergillus niger и Saccharomyces cerevisiae. Роды природно неолеагенных грибов, которые в естественных условиях продуцируют каротиноиды и могут быть использованы в качестве клеток-хозяев в соответствии с настоящим изобретением, включают, в частности, но без ограничения,Botrytis, Cercospora, Fusarium (Gibberella), Neurospora, Puccinia, Sclerotium, Trichoderma и Xanthophyllo-7 016258rhodozyma). Как указано выше, любые из множества организмов можно использовать в качестве клеток-хозяев в соответствии с настоящим изобретением. В некоторых вариантах реализации изобретения клеткихозяева представляют собой клетки Yarrowia lipolytica. Достоинства Y. lipolytica включают, например,возможность регулирования генетики и молекулярной биологии, наличие геномной последовательности(см., например, Sherman et al. Nucleic Acids Res. 32 (Database issue):D315-8, 2004), пригодность разнообразных экономичных условий для роста и способность роста до высокой плотности клеток. Кроме того,Y. lipolytica является природно олеагенным, поэтому может требоваться меньшая обработка для получения олеагенного штамма Y. lipolytica, продуцирующего каротиноид, чем для других организмов. Кроме того, в настоящее время существует обширный опыт промышленного применения Y. lipolytica.Saccharomyces cerevisiae также является полезной клеткой-хозяином согласно настоящему изобретению, в особенности благодаря удобству ее применения в экспериментах и богатому опыту, который приобрели исследователи при использовании этого организма. Хотя культивирование Saccharomyces при высоком содержании углерода может приводить к увеличению образования этанола, это обычно можно преодолеть при помощи технологических или генетических изменений. Другие полезные клетки-хозяева включают Xanthophyllomyces dendrorhous (Phaffia rhodozyma), который является удобным для экспериментов и обладает природной каротиногенностью. Штаммы Xanthophyllomyces dendrorhous (Phaffia rhodozyma) могут продуцировать несколько каротиноидов, включая астаксантин.Aspergillus niger и Mortierella alpina в больших количествах аккумулируют лимонную кислоту и жирную кислоту соответственно; Mortierella alpina также является олеагенной.Neurospora или Gibberella также являются полезными. Они не являются природно олеагенными и имеют тенденцию продуцировать очень низкое количество каротиноидов, поэтому в соответствии с настоящим изобретением может потребоваться значительная модификация. Neurospora и Gibberella считаются относительно удобными для экспериментов. Оба являются мицелиальными грибами, поэтому производство в промышленных масштабах может представлять собой сложную задачу, которую необходимо решить для использования таких штаммов. Другим полезным видом является Mucor circinelloides. Хотя его молекулярная генетика менее доступна для изменений, чем у других организмов, он продуцирует -каротин в естественных условиях и поэтому может требовать меньшей модификации, чем другие имеющиеся виды. Молекулярно-генетические преобразования можно выполнить в Blakeslea, хотя это может потребовать значительных усилий. Кроме того, возможна необходимость создания рентабельных условий для ферментации, например может потребоваться смешивание двух типов спаривания. Грибы рода Phycomyces также являются возможными источниками, которые могут требовать определенных условий процесса ферментации, и эти грибы также могут быть менее пригодными для обработки, чем некоторые другие потенциальные организмы-хозяева. Для специалистов в данной области техники очевидно, что на выбор конкретной клетки-хозяина для применения в соответствии с настоящим изобретением оказывает влияние, например, выбор последовательностей экспрессии, используемых с гетерологичным полипептидом, который вводят в клетку, а также оказывают влияние различные аспекты условий культивирования и т.п. Известно много о различных требованиях генной регуляции, требованиях к направленным последовательностям белков и требованиям к культивированию различных клеток-хозяев, используемых в соответствии с настоящим изобретением (см., например, относительно Yarrowia, Barth et al. FEMS Microbiol. Rev. 19:219, 1997; Madzak etLeeuwenhoek. 73(2):147-53, 1998; Kim et al. Appl. Environ Microbiol. 64(5): 1947-9, 1998; Wery et al. Ген. 184(1):89-97, 1997; см., например, относительно Saccharomyces, Guthrie and Fink Methods in Enzymology 194:1-933, 1991). Так, например, в некоторых аспектах направленные последовательности клеткихозяина (или тесно связанных аналогов) могут быть полезными для включения направляющих гетерологичных белков в субклеточную локализацию. Например, такие полезные направленные последовательности можно добавлять к гетерологичной последовательности для соответствующей внутриклеточной локализации активности. В других аспектах (например, добавление митохондриальных направленных последовательностей), гетерологичные направленные последовательности можно удалять или изменять в выбранной гетерологичной последовательности (например, изменение или удаление направленных последовательностей растительного хлоропласта организма-источника). Конструирование олеагенности. Все живые организмы синтезируют липиды для использования их в своих мембранах и других различных структурах. Однако большинство организмов не аккумулируют суммарный липид в количестве более чем примерно 10% от их сухой клеточной массы, при этом основная часть этого липида обычно располагается в клеточных мембранах. Была проведена большая биохимическая работа для определения метаболических ферментов, необ-8 016258 ходимых для обеспечения олеагенности микроорганизмов (главным образом в целях конструирования одноклеточных масел в качестве промышленных источников арахидоновой кислоты и докозагексаеновой кислоты; см., например, работу Ratledge Biochimie 86:807, 2004, все содержание которой включается в данное описание в качестве ссылки). Хотя эта биохимическая работа была опубликована до настоящего изобретения, нет сообщений об олеагенности de novo, полученной посредством генной инженерии с использованием генов, кодирующих ключевые метаболические ферменты. Следует отметить, что олеагенные организмы обычно аккумулируют липид только будучи выращенными при избытке углерода и ограничении азота или других питательных веществ. В этих условиях организм легко исчерпывает запасы ограниченного питания, но продолжает ассимилировать источник углерода. "Избыток" углерода потребляется биосинтезом липидов, таким образом липиды (обычно триацилглицерины) аккумулируются в цитозоле обычно в форме липидных тел. Как правило, считается, что олеагенный организм должен продуцировать в цитозоле ацетил-КоА иNADPH, которые затем могут использоваться механизмом синтазы жирных кислот для выработки липидов. По меньшей мере, в некоторых олеагенных организмах ацетил-КоА вырабатывается в цитозоле под действием АТФ-цитратлиазы, которая катализирует реакцию Разумеется, для того чтобы АТФ-цитратлиаза вырабатывала соответствующее количество ацетилКоА в цитозоле, сначала необходимо иметь определенный запас лимонной кислоты в его субстрате. Лимонная кислота вырабатывается в митохондриях всех эукариотных клеток в результате цикла трикарбоновых кислот (ЦТК) и может перемещаться в цитозоль (на смену малату) цитрат/малаттранслоказой. В большинстве олеагенных организмах и в некоторых неолеагенных организмах фермент изоцитратдегидрогеназа, который функционирует в митохондриях как часть цикла ЦТК, сильно зависит от АМФ. Поэтому, если АМФ выводится из митохондрий, этот фермент инактивируется. Если изоцитратдегидрогеназа является неактивной, изоцитрат аккумулируется в митохондриях. Затем этот аккумулированный изоцитрат уравновешивается лимонной кислотой предположительно под действием аконитазы. Таким образом, в условиях низкого содержания АМФ цитрат аккумулируется в митохондриях. Как указано выше, митохондриальный цитрат легко транспортируется в цитозоль. Уменьшение содержания АМФ, который, как предполагается, инициирует в олеагенных организмах каскад реакций, приводящий к аккумулированию цитрата (и, следовательно, ацетил-КоА) в цитоплазме,происходит в результате вышеупомянутого истощения запаса питательного вещества. Когда олеагенные клетки выращивают в присутствии источника избыточного углерода, но в условиях ограничения азота или других питательных веществ, активность АМФ-деаминазы, которая катализирует реакцию резко повышается. Повышенная активность этого фермента истощает запасы клеточного АМФ как в цитозоле, так и в митохондриях. Удаление АМФ из митохондрий, как полагают, инактивирует АМФзависимую изоцитратдегидрогеназу, что приводит к аккумулированию цитрата в митохондриях и, следовательно, в цитозоле. Эта последовательность событий схематично представлена на фиг. 2. Как указано выше, олеагенность требует продуцирования как цитозольного ацетил-КоА, так и цитозольного NADPH. Предполагается, что во многих олеагенных организмах соответствующие уровни цитозольного NADPH обеспечиваются под действием малатдегидрогеназы (фермент 3 на фиг. 2). Некоторые олеагенные организмы (например, Lipomyces и некоторые Candida), видимо, не содержат малатдегидрогеназ, поэтому, вероятно, другие ферменты могут обладать сравнимой с ними активностью, хотя предполагается, что для синтеза жирных кислот требуется специальный источник NADPH (см., например, работы Wynn et al., Microbiol. 145:1911, 1999; Ratledge Adv. Appl. Microbiol. 51:1, 2002, обе из которых полностью включены в данное описание в качестве ссылки). Таким образом, согласно настоящему изобретению олеагенность организма-хозяина можно увеличить, модифицируя экспрессию или активность одного или нескольких полипептидов, участвующих в продуцировании цитозольного ацетил-КоА и/или NADPH. Например, модифицируя экспрессию или активность одного или нескольких полипептидов из группы, включающей ацетил-КоА карбоксилазу, пируватдекарбоксилазу, изоцитратдегидрогеназу, АТФ-цитратлиазу, малатдегидрогеназу и АМФдеаминазу, можно повысить олеагенность в соответствии с настоящим изобретением. Типичные полипептиды, которые можно использовать или модифицировать, чтобы повысить олеагенность, в соответствии с настоящим изобретением, включают, в частности, но без ограничения, полипептиды ацетил-КоАкарбоксилазы, пируватдекарбоксилазы, изоцитратдегидрогеназы, АТФ-цитратлиазы, малатдегидрогеназы и АМФ-деаминазы, представленные в табл. 1-6 соответственно. В некоторых вариантах реализации изобретения, в которых используется олеагенная клетка-хозяин,ферменты и регуляторные компоненты, ответственные за олеагенность, уже имеются, однако могут быть при желании модифицированы, например, путем изменения экспрессии или активности одного или нескольких олеагенных полипептидов и/или введения одного или нескольких гетерологичных олеагенных полипептидов. При использовании в таких вариантах реализации изобретения неолеагенной клеткихозяина, как правило, ожидается, что будет введено по меньшей мере один или несколько гетерологич-9 016258 ных олеагенных полипептидов. Настоящее изобретение предполагает не только введение гетерологичных олеагенных полипептидов, но также и корректировку уровней экспрессии или активности гетерологичных или эндогенных олеагенных полипептидов, включая, например, изменение конститутивных или индуцируемых паттернов экспрессии. В некоторых вариантах реализации изобретения паттерны экспрессии корректируют таким образом, что для индуцирования олеагенности не требуется выращивание в условиях ограничения питания. Например, генетические модификации, содержащие изменение и/или добавление регуляторных последовательностей (например, промоторных элементов, терминаторных элементов), можно использовать для обеспечения определенной регуляции паттернов экспрессии. Такие генетические модификации можно использовать в сочетании с эндогенными генами (например, для регуляции эндогенных олеагенных полипептидов). Альтернативно, такие генетические модификации могут быть включены для того, чтобы обеспечить регуляцию экспрессии по меньшей мере одного гетерологичного полипептида (например,олеагенных полипептидов). Так, для модификации паттернов экспрессии эндогенных олеагенных полипептидов и/или гетерологичных олеагенных полипептидов можно использовать, в частности, но без ограничения, промоторы Tef1, Gpd1 в сочетании с эндогенными генами и/или гетерологичными генами. Аналогично этому типичные концевые последовательности включают, в частности, но без ограничения,применение концевых последовательностей XPR2 Y. lipolytica. В некоторых вариантах реализации изобретения по меньшей мере один олеагенный полипептид вводят в клетку-хозяин. В некоторых вариантах реализации изобретения в одну и ту же клетку-хозяин вводят несколько (например, два или более) различных олеагенных полипептидов. В некоторых вариантах реализации изобретения несколько олеагенных полипептидов содержат полипептиды из одного и того же организма-источника, в других вариантах реализации изобретения эти несколько полипептидов выбирают независимо из различных организмов-источников. Репрезентативные примеры олеагенных полипептидов, которые могут быть введены в клеткихозяева или модифицированы в них согласно настоящему изобретению, включают, в частности, но без ограничения, полипептиды, представленные в табл. 1-6. Как указано выше, ожидается, что, по меньшей мере, некоторые из этих полипептидов (например, малатдегидрогеназа и АТФ-цитратлиаза) должны действовать согласованно и, возможно, совместно с одним или несколькими компонентами синтеза жирных кислот, при этом в некоторых вариантах реализации изобретения желательно использовать два или более олеагенных полипептидов от одного и того же организма-источника. В общем случае организмы-источники для олеагенных полипептидов, используемые в соответствии с настоящим изобретением, включают, в частности, но без ограничения, Blakeslea, Candida, Cryptococcus,Cunninghamella, Lipomyces, Mortierella, Mucor, Phycomyces, Pythium, Rhodosporidium, Bliodotorula,Trichosporon, Yarrowia, Aspergillus, Botrytis, Cercospora, Fusarium (Gibberella), Kluyveromyces, Neurospora,Penicillium, Pichia (Hansenula), Puccinia, Saccharomyces, Sclerotium, Trichoderma и Xanthophyllomyces(Phaffia). В некоторых вариантах реализации изобретения виды источников для полипептидов ацетилКоА-карбоксилазы, АТФ-цитратлиазы, малатдегидрогеназы и/или АМФ-деаминазы включают, в частности, но без ограничения, Aspergillus nidulans, Cryptococcus neoformans, Fusarium fujikuroi, Kluyveromyceslipolytica. В некоторых вариантах реализации изобретения виды источников для полипептидов пируватдекарбоксилазы или изоцитратдегидрогеназы включают, в частности, но без ограничения, Neurosporacrassa, Xanthophyllomyces dendrorhous (Phaffia rhodozyma), Aspergillus niger, Saccharomyces cerevisiae,Mucor circinelloides, Khodotorula glutinis, Candida utilis, Mortierella alpina и Yarrowia lipolytica. Конструирование продуцирования каротиноидов. Каротиноиды синтезируют из изопреноидных предшественников, некоторые из которых участвуют также в продуцировании стероидов и стеролов. Наиболее распространенный путь биосинтеза изопреноидов, иногда называемый "мевалонатным путем", в общем виде представлен на фиг. 3. Как показано, ацетил-КоА превращается в гидроксиметилглютарил-КоА (HMG-СоА), а затем в мевалонат. После этого мевалонат фосфорилируется и превращается в пятиуглеродное соединение изопентенилпирофосфат(IPP). После изомеризации IPP в диметилаллилпирофосфат (DMAPP) в результате трех последовательных реакций конденсации с дополнительными молекулами IPP образуется десятиуглеродная молекула геранилпирофосфата (GPP), затем пятнадцатиуглеродная молекула фарнезилпирофосфата (FPP) и, наконец, двадцатиуглеродное соединение геранилгеранилпирофосфат (GGPP). Альтернативный путь изопреноид биосинтеза изопреноидов, который используют некоторые организмы (в частности, бактерии) и который иногда называют "мевалонат-независимым путем ", показан на фиг. 4. Этот путь инициирует синтез 1-деокси-D-ксилоглюкоза-5-фосфата (DOXP) из пирувата и глицеральдегид-3-фосфата. Затем в результате последовательности реакций, показанных на фиг. 4, DOXP превращается в IPP, который изомеризуется в DMAPP, а затем через GPP и FPP превращается в GGPP, как показано на фиг. 3 и описано выше. Различные белки, участвующие в биосинтезе изопреноидов, идентифицированы в ряде организмов,и их характеристики описаны. Кроме того, различные аспекты изопреноидного пути биосинтеза широко сохраняются в грибном, бактериальном, растительном и животном мире. Например, полипептиды, соот- 10016258 ветствующие ацетоацетил-КоА тиолазе, HMG-CoA синтазе, HMG-CoA редуктазе, мевалонаткиназе,фосфомевалонаткиназе, мевалонатпирофосфатдекарбоксилазе, IPP-изомеразе, FPP-синтазе и GGPPсинтазе, показанным на фиг. 3, идетифицированы и выделены из широкого спектра организмов и клеток. Репрезентативные примеры из множества таких полипептидов представлены в табл. 7-15. Один или несколько полипептидов, выбранных из табл. 7-15, можно использовать или модифицировать для применения в способах и составах в соответствии с настоящим изобретением. Согласно настоящему изобретению продуцирование каротиноидов в организме-хозяине можно регулировать, модифицируя экспрессию или активность одного или нескольких белков, участвующих в биосинтезе изопреноидов. В некоторых вариантах реализации изобретения такая модификация включает введение одного или нескольких гетерологичных полипептидов биосинтеза изопреноидов в клеткухозяин; альтернативно или дополнительно, можно модифицировать экспрессию или активность одного или нескольких эндогенных или гетерологичных полипептидов биосинтеза изопреноидов. При сохранении в достаточной степени компонентов полипептидов биосинтеза изопреноидов ожидается, что гетерологичные полипептиды биосинтеза изопреноидов часто будут функционировать даже в значительно отличающихся организмах. Кроме того, если окажется желательным ввести несколько гетерологичных полипептидов биосинтеза изопреноидов, во многих случаях полипептиды из различных организмовисточников будут функционировать совместно. В некоторых вариантах реализации изобретения множество различных гетерологичных полипептидов биосинтеза изопреноидов вводили в одну и ту же клеткухозяин. В некоторых вариантах реализации изобретения это множество содержит только полипептиды из одного и того же организма-источника (например, две или более последовательности, полученные или модифицированные из одного организма-источника); в других вариантах реализации изобретения указанное множество включает полипептиды, независимо выбранные из различных организмов-источников(например, две или более последовательности, полученные или модифицированные по меньшей мере из двух независимых организмов-источников). В некоторых вариантах реализации настоящего изобретения, которые используют гетерологичные полипептиды биосинтеза изопреноидов, организмы-источники включают, в частности, но без ограничения, грибы родов Blakeslea, Candida, Cryptococcus, Cunninghamella, Lipomyces, Mortierella, Mucor, Phycomyces, Pythium, Bliodosporidium, Rhodotorula, Trichosporon, Yarrowia, Aspergillus, Botrytis, Cercospora,Fusarium (Gibberella), Kluyveromyces, Neurospora, Penicillium, Pichia (Hansenula), Puccinia, Saccharomyces,Schizosaccharomyces, Sclerotium, Thchoderms, Ustilago и Xanthophyllomyces (Phaffia). В некоторых вариантах реализации изобретения организмы-источники относятся к видам, которые включают, в частности,но без ограничения, Cryptococcus neoformans, Fusarium fujikuroi, Kluyverimyces lactis, Neurospora crassa,Saccharomyces cerevisiae, Schizosaccharomyces pombe, Ustilago maydis и Yarrowia lipolytica. Как указано выше, изопреноидный путь биосинтеза участвует также в продуцировании некаротиноидных соединений, в частности стеролов, стероидов и витаминов, например витамина Е или витаминаK. Следовательно, белки, которые воздействуют на промежуточные соединения изопреноидного пути биосинтеза и отводят их в биосинтез некаротиноидных соединений, являются косвенными ингибиторами биосинтеза каротиноидов (см., например, фиг. 5, на которой указаны точки вывода изопреноидных промежуточных соединений на другие пути биосинтеза). Поэтому такие белки считают конкурентными полипептидами биосинтеза изопреноидов. Ожидается, что снижение содержания или активности этих конкурентных полипептидов биосинтеза изопреноидов увеличит продуцирование каротиноидов в клеткаххозяевах согласно настоящему изобретению. В некоторых вариантах реализации настоящего изобретения продуцирование или активность эндогенных конкурентных полипептидов биосинтеза изопреноидов в клетках-хозяевах можно уменьшить или устранить. В некоторых вариантах реализации изобретения такое уменьшение или устранение активности конкурентных полипептидов биосинтеза изопреноидов можно обеспечить обработкой организмахозяина низкомолекулярными ингибиторами ферментов пути синтеза эргостеролов. Ферменты пути синтеза эргостеролов включают,например,скваленсинтазу,скваленэпоксидазу,2,3 оксидоскваленланостеролциклазу, цитохром Р 450-ланостерол-14-деметилазу, С-14 стеролредуктазу, С 4 стеролметилоксидазу, SAM:C-24 стеролметилтрансферазу, С-8 стеролизомеразу, С-5 стеролдесатуразу,С-22 стеролдесатуразу и С-24 стеролредуктазу. Каждый из этих ферментов считается конкурентным полипептидом биосинтеза изопреноидов. Регуляторы этих ферментов также можно считать конкурентными полипептидами биосинтеза изопреноидов (например, дрожжевые белки Sut1 (номер в базе данных Genbank JC4374 GI:2133159) и Mot3 (номер в базе данных Genbank NP013786 GI:6323715), которые могут иметь или не иметь гомологов в других организмах. В других вариантах реализации изобретения уменьшение или устранение активности конкурентного полипептида биосинтеза изопреноидов можно обеспечить путем уменьшения активности пути биосинтеза убихинона. Ключевым шагом в биосинтезе убихинона является образование парагидроксибензоата (ПГБ) из тирозина или фенилаланина у млекопитающих или из хоризмата у бактерий, с последующей конденсацией ПГБ и предшественника изопрена, что приводит к добавлению пренильной группы. Эта реакция катализируется ПГБ-полипренилтрансферазой. Цепь убихинона со стороны изопреноида определяется ферментом пренилдифосфатсинтазой. 3-Декапренил-4-гидроксибензойную кислоту, кото- 11016258 рая получается в результате реакции конденсации ПГБ и декапренилдифосфата, подвергают дальнейшим модификациям, которые включают гидроксилирование, метилирование и декарбоксилирование, чтобы получить убихинон (CoQ10). Таким образом, ингибирование пренилдифосфатсинтазы, которое приводит к образованию изопреноидов с удлиненной цепью из фарнесилдифосфата, или ингибирование ПГБполипренилтрансферазы может быть полезным для увеличения содержания изопреноида, используемого(примеры ферментов пренилдифосфатсинтазы и ПГБдля биосинтеза каротиноидов полипренилтрансферазы представлены в табл. 29 и 30 соответственно). Известные низкомолекулярные ингибиторы конкурентных ферментов биосинтеза изопреноидов включают, в частности, но без ограничения, зарагосовую кислоту (в том числе ее аналоги, например, TAN1607A (Biochem. Biophys. Res. Commun. 1996 Feb. 15; 219(2):515-520, RPR 107393 (3-гидрокси-3-[4-(хинолин-6-ил)фенил]1-азабицикло[2-2-2]октан дигидрохлорид; J. Pharmacol. Exp. Ther. 1997 Мау; 281(2):746-52), ER-28448 тринатриевую соль (5-N-[2-бутенил-3-(2-метоксифенил)]-N-метиламино-1,1-пентилиден-бис-(фосфоновой кислоты);Apr. 11; 466(1-2):155-61), YM-53601 Е)-2-[2-фтор-2-(хинуклидин-3-илиден)этокси]-9 Н-карбазолмоногидрохлорид; Br. J. Pharmacol. 2000 Sep.; 131 (1):63-70), или сквалестатин I, который ингибирует скваленсинтазу; тербинафин, который ингибирует скваленэпоксидазу; различные азолы, которые ингибируют цитохром Р 450-ланостерол-14-деметилазу, и фенпропиморф, который ингибирует С-14 стеролредуктазу и С-8 стеролизомеразу. В других вариантах реализации изобретения можно использовать гетерологичный конкурентный полипептид биосинтеза изопреноидов (функциональный или нефункциональный; в некоторых вариантах реализации изобретения используют доминатные негативные мутанты). Одним из конкурентных полипептидов биосинтеза изопреноидов, пригодным для настоящего изобретения, является скваленсинтаза, которая идентифицирована и охарактеризована во многих организмах. Репрезентативные примеры последовательностей полипептида скваленсинтазы представлены в табл. 16. В некоторых вариантах реализации изобретения, в которых используют скваленсинтазу (или модификации скваленсинтазы), организмы-источники включают, в частности, но без ограничения, Neurospora crassa, Xanthophyllomyces dendrorhous (Phaffia rhodozyma), Aspergillus niger, Saccharomyces cerevisiae, Mucor circinelloides, Rhotorula glutinis, Candida utilis, Mortierella alpina и Yarrowia lipolytica. Путь биосинтеза каротиноидов ответвляется от пути биосинтеза изопреноидов в точке образованияGGPP. Решающим этапом биосинтеза каротиноидов является образование фитоена в результате конденсации двух молекул GGPP с расположением "голова к голове" при катализации фитоинсинтазой (часто называемой crtB; см. фиг. 6). Последовательность реакций дегидрогенизации, каждая из которых увеличивает на два число конъюгированных двойных связей, превращает фитоин в нейроспорин, а затем в ликопин. Путь разветвляется в различных точках до и после образования ликопина, что позволяет получать широкий спектр каротиноидов. Так, например, действие фермента циклазы на ликопин приводит к образованию -каротина, в то время как действие десатуразы вызывает образование 3,4 дидегидроликопина. -Каротин превращается в -каротин под действием циклазы, -каротин можно превратить в один из нескольких продуктов (см., например, фиг. 6 С), включая астаксантин (путем последовательного превращения в эхинон, гидроксиэхинон и феникоксантин). Согласно настоящему изобретению продуцирование каротиноидов в организме-хозяине можно регулировать, модифицируя экспрессию или активность одного или нескольких белков, участвующих в биосинтезе каротиноидов. Как указано выше, в некоторых вариантах реализации изобретения в качестве клеток-хозяев желательно использовать организмы, которые в естественных условиях продуцируют один или несколько каротиноидов. Иногда в таких случаях делают упор на увеличение продуцирования природно вырабатываемого каротиноида, например, путем увеличения уровня и/или активности одного или нескольких белков, участвующих в синтезе этого каротиноида и/или путем уменьшения уровня или активности одного или нескольких белков, участвующих в конкурентном пути биосинтеза. Альтернативно или дополнительно, в некоторых вариантах реализации изобретения желательно продуцировать один или несколько каротиноидов, которые клетка-хозяин не вырабатывает в естественных условиях. Согласно некоторым вариантам реализации изобретения в клетку-хозяин желательно вводить один или несколько гетерологичных каротиногенных полипептидов. Для специалистов в данной области техники очевидно, что для этой цели можно использовать множество гетерологичных полипептидов, выбор которых будет зависеть, в частности, от конкретного каротиноида, продуцирование которого следует увеличить. Настоящее изобретение включает не только введение гетерологичных каротиногенных полипептидов, но также и регуляцию уровней экспрессии или активности гетерологичных или эндогенных каротиногенных полипептидов, включая, например, изменение конститутивных или индуцируемых паттернов экспрессии. В некоторых вариантах реализации изобретения паттерны экспрессии регулируют таким образом, чтобы для индуцирования олеагенности не требовалось выращивания в условиях ограниченного питания. Так, например, генетические модификации, включающие изменение и/или добавление регуляторных последовательностей (например, промоторных элементов, терминаторных элементов),- 12016258 можно использовать для конкретной регуляции паттернов экспрессии. Такие генетические модификации можно применять в сочетании с эндогенными генами (например, для регуляции эндогенной каротиногенности); альтернативно, такие генетические модификации можно включать, чтобы обеспечить регуляцию экспрессии по меньшей мере одного гетерологичного полипептида (например, каротиногенного полипептида). Так, для модификации паттернов экспрессии эндогенных каротиногенных полипептидов и/или гетерологичных каротиногенных полипептидов можно использовать промоторы, включающие, в частности, но без ограничения, Tef1 и Gpd1 в сочетании с эндогенными генами и/или гетерологичными генами. Аналогично этому типичные терминаторные последовательности включают, в частности, но без ограничения, применение терминаторных последовательностей XPR2 Y. lipolytica. Как показано на фиг. 6 и в литературе, белки, участвующие в биосинтезе каротиноидов, включают,в частности, но без ограничения, фитоинсинтазу, фитоиндегидрогеназу, ликопинциклазу, каротиноидкетолазу, каротиноидгидроксилазу, астаксантинсинтазу (одиночный многофункциональный фермент, обнаруженный в некоторых организмах-источниках и обычно обладающий функциями кетолазы и гидроксилазы), эпсилонкаротиноидгидроксилазу, ликопинциклазу (субъединицы бета и эпсилон), каротиноидгликозилтрансферазу и ацил-КоА: диацилглицерин ацилтрансферазу. Репрезентативные примеры последовательностей полипептидов биосинтеза этих каротиноидов представлены в табл. 17-25. Ксантофиллы могутотличаться от других каротиноидов присутствием функциональных групп, содержащих кислород, в их циклических концевых группах. Так, например, лютеин и зеаксантин содержат одну гидроксильную группу в каждой из своих терминальных кольцевых структур, в то время как астаксантин содержит в каждом терминальном кольце кетогруппу и гидроксил. Это свойство делает ксантофиллы более полярными, чем каротины, в частности бета-каротин и ликопин, и поэтому кардинально снижает их растворимость в жирах и липидах. Природные ксантофиллы часто находятся в форме сложных эфиров терминальных гидроксильных групп сложных моно- и диэфиров жирных кислот. Они также встречаются в форме глюкозидов некоторых видов бактерий. Растворимость и диспергируемость ксантофиллов можно в значительной степени модифицировать добавлением сложных эфирных групп, при этом известно, что эстерификация может оказывать влияние также на абсорбционную способность и/или биологическую доступность данного каротиноида. Задачей настоящего изобретения является максимизация содержания определенного ксантофилла, который аккумулируется во внутриклеточной фракции триацилглицерида олеагенных дрожжей, при этом один из механизмов решения этой задачи заключается в увеличении гидрофобности аккумулируемого ксантофилльного продукта. Одним из путей достижения этого является конструирование продуцирования ацильных сложных моно- и/или диэфиров требуемого ксантофилльного соединения. Многие ферменты могут этерифицировать каротиноиды. Например, в нескольких видах бактерий идентифицированы каротиноидглюкозилтрансферазы (см., например, табл. 24). Кроме того, ацилКоА:диацилглицеринацилтрансфераза (трансфераза ДГАТ) и ацил-КоА:моноацилглицеринацилтрансферазы (трансферазаМГАТ), которые функционируют на последних этапах биосинтеза триацилглицерина, вероятно, играют дополнительную роль в этерификации ксантофиллов. Репрезентативные полипептиды ДГАТ представлены в табл. 25. При этом другие ферменты могут специфически модифицировать каротиноиды и молекулы аналогичной структуры (например, стеролы) и быть доступными для модификации и продуцирования сложных эфиров. В некоторых вариантах реализации изобретения потенциальные организмы-источники для полипептидного биосинтеза каротиноидов включают, в частности, но без ограничения, роды природно олеагенных или неолеагенных грибов, которые продуцируют каротиноиды в естественных условиях. Они включают, в частности, но без ограничения, Botrytis, Cercospora, Fusarium (Gibberella), Mucor,Neurospora, Phycomyces, Puccina, Rhodotorula, Sclerotium, Trichoderma и Xanthophyllomyces. Типичные виды включают, в частности, но без ограничения, Neurospora crassa, Xanthophyllomyces dendrorhous(Phaffla rhodozyma), Mucor circinelloides и Rhodotorula glutinis. Каротиноиды продуцируются широким спектром разнообразных организмов, в частности растениями, водорослями, дрожжами, грибами, бактериями, цианобактериями и т.п. Согласно настоящему изобретению такие организмы могут представлять собой организмы-источники для полипептидного биосинтеза каротиноидов. Следует понимать, что конкретная каротиногенная модификация клетки-хозяина в соответствии с настоящим изобретением зависит от каротиноидов, которые желательно получить. Например, полипептиды биосинтеза изопреноидов связаны с продуцированием большинства каротиноидов. Полипептиды биосинтеза каротиноидов также широко связаны с этим. Так, например, кетолаза, в частности, связана с продуцированием кантаксантина, в то время как гидроксилаза связана с продуцированием лютеина и зеаксантина. Гидроксилаза и кетолаза (или астаксантинсинтаза) особенно полезны для продуцирования астаксантина. Продуцирование и выделение каротиноидов. Как указано выше, аккумулирование липидных тел в олеагенных организмах обычно индуцируется ростом соответствующего организма в присутствии источника избытка углерода и при ограничении азота. Специфические условия, индуцирующие такое аккумулирование, были установлены ранее применительно к ряду различных олеагенных организмов (см., например, работы Wolf (ed.) NonconventionalExp. Biol. 35(3):313, 1997; J. Ind. Microbiol. Biotechnol. 30(1):75, 2003; Bioresour. Technol. 95(3):287, 2004,все из которых полностью включены в данное описание в качестве ссылки). В общем случае желательно культивировать клетки-хозяева, модифицированные согласно настоящему изобретению, при условиях, которые позволяют аккумулировать в форме липида по меньшей мере около 20% их сухой клеточной массы. В других вариантах реализации изобретения клетки-хозяева, модифицированные согласно настоящему изобретению, выращивают при условиях, которые позволяют аккумулировать в форме липида по меньшей мере примерно 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30,35, 40, 45, 50, 55, 60, 65, 70, 75 или даже 80% или более их сухой клеточной массы. В некоторых вариантах реализации изобретения применяемые клетки-хозяева представляют собой клетки, которые являются природно олеагенными и в которых индуцируется выработка липида до желаемого уровня. В других вариантах реализации изобретения клетки-хозяева являются клетками, которые в естественных условиях продуцируют липид, однако их модифицируют таким образом, чтобы обеспечить продуцирование и аккумулирование липида на желательном уровне. В некоторых вариантах реализации изобретения клетки-хозяева согласно изобретению являются не природно олеагенными, а модифицированными для продуцирования липида таким образом, чтобы обеспечить выработку липида на желаемом уровне. Для специалистов в данной области техники очевидно,что в общем случае условия выращивания, эффективные для индукции аккумулирования липидов в организме-источнике, можно также использовать, чтобы индуцировать аккумулирование липидов в клеткехозяине, в которую введены олеагенные полипептиды организма-источника. Разумеется, с учетом характеристик клетки-хозяина могут потребоваться модификации, которые способны провести рядовые специалисты в данной области техники. Для специалистов в данной области техники очевидно также, что в общем случае желательно, чтобы продуцирование требуемого каротиноида клеткой-хозяином, модифицированной согласно изобретению, происходило в течение соответствующего времени по отношению к индуцированию олеагенности таким образом, чтобы в липидных телах аккумулировались каротиноиды. В некоторых вариантах реализации изобретения желательно индуцировать выработку каротиноидов в клетке-хозяине, которая в естественных условиях не продуцирует каротиноиды, чтобы обеспечить получение каротиноидов на обнаруживаемом уровне. В некоторых аспектах клетки-хозяева, которые не производят в естественных условиях одних каротиноидов, способны продуцировать другие каротиноиды (так, например, некоторые клетки-хозяева могут в естественных условиях продуцировать -каротин, но не могут продуцировать в естественных условиях астаксантин), в других аспектах клетки-хозяева не продуцируют каротиноиды в естественных условиях. В некоторых других вариантах реализации изобретения желательно повысить уровни продуцирования каротиноидов в клетке-хозяине, которая в естественных условиях вырабатывает каротиноиды в малом количестве таким образом, чтобы получить каротиноиды на повышенном обнаруживаемом уровне. В некоторых аспектах клетки-хозяева, которые в естественных условиях продуцируют одни каротиноиды (например, -каротин), продуцируют также и другие каротиноиды (например, астаксантин и др.), в других аспектах клетки, которые в естественных условиях продуцируют одни каротиноиды (например, -каротин), не продуцируют других каротиноидов. В некоторых вариантах реализации изобретения желательно аккумулировать каротиноиды до уровней (т.е. считая суммарное количество всех продуцируемых каротиноидов), превышающих по меньшей мере примерно 1% от сухой массы клеток. В некоторых вариантах реализации изобретения уровень суммарного аккумулирования каротиноидов в липидных телах составляет по меньшей мере примерно 2%,по меньшей мере примерно 3%, по меньшей мере примерно 4%, по меньшей мере примерно 5%, по меньшей мере примерно 6%, по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 11%, по меньшей мере примерно 12%, по меньшей мере примерно 13%, по меньшей мере примерно 14%, по меньшей мере примерно 15%, по меньшей мере примерно 16%, по меньшей мере примерно 17%, по меньшей мере примерно 18%, по меньшей мере примерно 19%, по меньшей мере примерно 20% или более от суммарной сухой массы клеток. В некоторых вариантах реализации изобретения желательно достичь уровней суммарного аккумулирования каротиноидов в липидных телах (т.е., считая суммарное продуцирование всех каротиноидов), превышающих по меньшей мере примерно 1% от сухой массы клеток. В некоторых вариантах реализации изобретения уровень суммарного аккумулирования каротиноидов в липидных телах составляет по меньшей мере примерно 2%, по меньшей мере примерно 3%, по меньшей мере примерно 4%, по меньшей мере примерно 5%, по меньшей мере примерно 6%, по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 11%, по меньшей мере примерно 12%, по меньшей мере примерно 13%, по меньшей мере примерно 14%, по меньшей мере примерно 15%, по меньшей мере примерно 16%, по меньшей мере примерно 17%, по меньшей мере примерно 18%, по меньшей мере примерно 19%, по меньшей мере примерно 20% или более от суммарной сухой массы клеток. Показано, что бактериальные каротиногенные гены могут передаваться другим организмам, поэто- 14016258 му они особенно полезны в соответствии с настоящим изобретением (см., например, Miura et al., Appl.Environ. Microbiol. 64:1226, 1998). В других вариантах реализации изобретения может быть желательным использовать гены от других организмов-источников, в частности растений, водорослей или микроводорослей. Эти организмы обеспечивают множество потенциальных источников полипептидов кетолазы и гидроксилазы. Другие полезные организмы-источники включают грибные, дрожжевые, инсектиционные,протозойные и млекопитающие источники полипептидов. В некоторых вариантах реализации изобретения в Yarrowia lipolytica могут быть экспрессированы гены многофункциональной фитоинсинтазы/ликопинциклазы Mucor circinelloides и фитоендегидрогеназы Neurospora crassa. Последующий сверхсинтез каталитического домена из гидроксиметилглютарилКоА-редуктазы N. crassa и/или обработка модифицированных штаммов Y. lipolytica зарагосовой кислотой, которая является ингибитором скваленсинтазы, увеличивает продуцирование каротиноидов. И, наконец, гены Paracoccus marcusii, кодирующие ферменты каротиноидгидроксилазу и каротиноидкетолазу,экспрессируются в штаммах Y. lipolytica, вырабатывающих -каротин, и эта модификация приводит к аккумулированию астаксантина. Аналогичные подходы можно использовать для повышения продуцирования каротиноидов в других олеагенных или неолеагенных организмах-хозяевах, используя те же самые гомологичные или функционально схожие каротиногенные полипептиды. Следует отметить, что для организмов согласно изобретению, которые продуцируют несколько каротиноидов, в некоторых случаях можно регулировать относительные количества отдельных продуцируемых каротиноидов путем изменения условий выращивания. Например, имеются сообщения о том, что управление концентрацией растворенного кислорода в культуре в процессе культивирования позволяет регулировать относительные уровни продуцирования определенных каротиноидов, в частности каротина, эхиненона, -криптоксантина, 3-гидроксиэхиненона, астероиденона, кантаксантина, зеаксантина, адонирубина, адониксантина и астаксантина (см., например, патент US6825002, авторы Tsubokura et al., содержание которого полностью включено в данное описание в качестве ссылки). В особенности для вариантов реализации настоящего изобретения, направленных на продуцирование астаксантина, часто оказывается желательным использовать один или несколько генов из природного организма, вырабатывающего астаксантин. В тех случаях, когда требуется экспрессировать несколько гетерологичных полипептидов, может быть желательным использовать для всех из них один и тот же организм-источник или близкородственные организмы-источники. Одно из достоинств настоящего изобретения состоит в том, что кроме получения высоких уровней каротиноидов настоящее изобретение позволяет легко выделять эти полученные соединения, поскольку они аккумулируются в липидных телах олеагенных организмов. Способы и системы выделения липидных тел разработаны для широкого спектра олеагенных организмов (см., например, патенты US5164308, 5374657, 5422247, 5550156, 5583019, 6166231, 6541049, 6727373, 6750048 и 6812001, все из которых полностью включены в настоящее описание в качестве ссылки). Вкратце, клетки обычно извлекают из культуры, часто способами распылительной сушки, фильтрации или центрифугирования. В некоторых случаях клетки гомогенизируют, а затем экстрагируют сверхкритической жидкостью или растворителями (например, такими растворителями, как хлороформ, гексан, метиленхлорид, метанол, изопропанол, этилацетат и т.п.), получая неочищенную масляную суспензию. Такую масляную суспензию можно очистить способами, известными специалистам в данной области техники. Очищенные масла можно непосредственно использовать в качестве пищевых или кормовых добавок. Альтернативно или дополнительно, каротиноиды можно выделить из масла, используя известные способы. Учитывая, что каротиноиды, как правило, чувствительны к окислению, во многих вариантах реализации используют стабилизаторы окисления (например, токоферолы, витамин С, этоксихин, витамин Е,БОТ (бутилокситолуол), БОА (бутилоксианизол), ТБГХ (третичный бутилгидрохинон) и т.п. или их комбинации) во время или после выделения каротиноидов. Альтернативно или дополнительно, можно использовать микроинкапсуляцию, например, с белками, чтобы создать дополнительный физический барьер от окисления и/или сделать более удобным обращение с каротиноидами (см., например, заявку на патент US2004/0191365). Применение. Каротиноиды, полученные согласно настоящему изобретению, можно использовать в различных областях, например использовать их биологические или пищевые свойства (в частности,антиоксидантные, антипролиферативные и т.п.) и/или их пигментные свойства. Например, согласно настоящему изобретению каротиноиды можно использовать в лекарственных средствах (см., например, Bertram, Nutr.Photochem Photobiol. 41:189, 1997; заявку на патент US 2004/0116514; заявку на патент US 2004/0259959),в пищевых добавках (см., например, Koyama et al., J. Photochem Photobiol. 9:265, 1991; Bauernfeind, Carotenoids as colorants and vitamin A precursors, Academic Press, NY, 1981; заявку на патент US 2004/0115309; заявку на патент US 2004/0234579), в электрооптике, в кормовых добавках для животных (см., например,Krinski, Pure Appl. Chem. 66:1003, 1994; Polazza et al., Meth. Enzymol. 213:403, 1992), в косметике (в качестве антиоксидантов и и/или косметических средств, включая ароматизаторы; см., например, заявку на- 15016258 патент US 2004/0127554) и т.п. Каротиноиды, получаемые в соответствии с настоящим изобретением,можно использовать также в качестве промежуточных соединений при производстве других соединений(например, стероидов и т.п.). В частности, астаксантин и/или его сложные эфиры можно использовать во многих фармацевтических средствах и продуктах лечебного питания, в том числе для лечения воспалительных заболеваний,астмы, атопического дерматита, аллергий, множественной миеломы, артериосклероза, сердечнососудистых заболеваний, заболеваний печени, цереброваскулярных болезней, тромбоза, заболеваний,связанных с неоангиогенезом, включая рак, ревматизма и диабетической ретинопатии; дистрофии желтого пятна и мозговых нарушений, гиперлипидемии, почечной ишемии, диабета, гипертензии, пролиферации и метастаза, а также нарушений обмена веществ. Кроме того, каротиноиды и астаксантин могут использоваться для предотвращения и лечения утомления, для улучшения функции почек при нефропатии от воспалительных заболеваний, а также для предотвращения и лечения других заболеваний, связанных с образом жизни. Установлено также, что астаксантин играет роль ингибитора различных биологических процессов, в том числе ингибитора интерлейкинов, ингибитора фосфодиэстеразы, ингибитора фосфолипазы А 2, ингибитора циклооксигеназы-2, ингибитора матриксной протеиназы, ингибитора пролиферации клеток эндотелия капилляров и ингибитора липоксигеназы. См., например, японскую публикацию 2006022121, опубликованную 20060126 (японская заявка 2005-301156, поданная 20051017), японскую публикацию 2006016408, опубликованную 20060119 (японская заявка 2005-301155, поданная 20051017), японскую публикацию 2006016409, опубликованную 20060119 (японская заявка 2005301157, поданная 20051017), японскую публикацию 2006016407, опубликованную 20060119 (японская заявка 2005-301153, поданная 20051017), японскую публикацию 2006008717, опубликованную 20060112 (японская заявка 2005-301151, поданная 20051017), японскую публикацию 2006008716,опубликованную 20060112 (японская заявка 2005-301150, поданная 20051017), японскую публикацию 2006008720, опубликованную 20060112 (японская заявка 2005-301158, поданная 20051017), японскую публикацию 2006008719, опубликованную 20060112 (японская заявка 2005-301154, поданная 20051017), японскую публикацию 2006008718, опубликованную 20060112 (японская заявка 2005301152, поданная 20051017), японскую публикацию 2006008713, опубликованную 20060112 (японская заявка 2005-301147, поданная 20051017), японскую публикацию 2006008715, опубликованную 20060112 (японская заявка 2005-301149, поданная 20051017), японскую публикацию 2006008714,опубликованную 20060112 (японская заявка 2005-301148, поданная 20051017) и японскую публикацию 2006008712, опубликованную 20060112 (японская заявка 2005-301146, поданная 20051017). Следует понимать, что в некоторых вариантах реализации изобретения каротиноиды, продуцируемые модифицированными клетками-хозяевами согласно данному описанию, вводили в конечный продукт (например, в пищевую или кормовую добавку, фармацевтический или косметический препарат, в состав, содержащий краситель и т.п.) в среде клетки-хозяина. Так, например, клетки-хозяева могут быть лиофизированы, сублимированы, заморожены или инактивированы любым способом, после чего цельные клетки можно вводить в конечный продукт или использовать в качестве конечного продукта. Клетку-хозяин можно также обработать перед введением в продукт, чтобы повысить биологическую доступность (например, способом лизиса). Альтернативно или дополнительно, в конечный продукт можно вводить только часть клетки-хозяина (например, фракционированную по размеру или растворимости), отделенную от целого. Например, в некоторых вариантах реализации изобретения липидные капли выделяют из клетки-хозяина и вводят в конечный продукт или используют в качестве конечного продукта. В других вариантах реализации изобретения сами каротиноиды или отдельные каротиноидные соединения выделяют и преобразуют в конечный продукт. Как указано выше, сложные эфиры жирных кислот и глюкозидов являются преобладающими сложными эфирами каротиноидов, найденными в природе, в то время как другие сложные эфиры (например,с органическими кислотами или с неорганическим фосфатом) можно синтезировать, чтобы получить полезные формы продуктов. Для доставки каротиноидные сложные эфиры можно получить также в форме солей сложных эфиров (см., например, публикацию патента US20050096477). Количество каротиноида, вводимого в данный продукт, может существенно изменяться в зависимости от указанного продукта и конкретных участвующих каротиноидов. Это количество может лежать в пределах, например, от менее чем 0,01 мас.% продукта, до более чем 1, 10, 20, 30% или выше; в некоторых случаях каротиноид может составлять 100% продукта. В некоторых вариантах реализации изобретения один или несколько полученных каротиноидов вводят в пищевой или кормовой компонент (например, в пищевую добавку). Типы пищевых продуктов, в которые можно вводить каротиноиды согласно настоящему изобретению, не имеют особых ограничений и включают напитки, в частности чаи, соки и алкогольные напитки; кондитерские изделия, в частности желе и сухое печенье; жиросодержащую пищу и напитки, в частности молочные продукты; бакалейные продукты, в частности рис и размягченный рис (или кашу); продукты детского питания и т.п. В некоторых вариантах реализации этого аспекта изобретения может оказаться полезным введение каротиноидов в тела съедобных липидов, поскольку это может способствовать их введению в жиросодержащие пищевые продукты.- 16016258 Примеры кормовых продуктов, в которые можно вводить каротиноиды, полученные в соответствии с настоящим изобретением, могут включать, например, корма для животных, например корма для кошек,собак и т.п., корма для аквариумных рыб, рыбы или ракообразных, разводимых в искусственных условиях и т.п., корм для сельскохозяйственных животных (включая домашний скот, а также рыбу и ракообразных, разводимых в промышленных масштабах). Пищевой или кормовой материал, в который введены каротиноиды, полученные в соответствии с настоящим изобретением, предпочтительно имеет привлекательный вкус для предполагаемого потребителя. Такой пищевой или кормовой материал может обладать свойствами, которые известны для соответствующего материала (например, твердый, жидкий, мягкий). В некоторых вариантах реализации изобретения один или несколько полученных каротиноидов вводят в косметический продукт. Примеры таких косметических продуктов включают, в частности, косметику для кожи (например, лосьоны, эмульсии, кремы и т.п.), губную помаду, препараты для защиты от солнечных ожогов, косметику для макияжа, душистые композиции, продукты для ежедневного применения (например, зубные пасты, жидкости для полоскания рта, агенты для предотвращения неприятного запаха изо рта, твердое мыло, жидкое мыло, шампуни, кондиционеры) и т.п. В некоторых вариантах реализации изобретения один или несколько полученных каротиноидов вводят в лекарственные средства. Примеры таких лекарственных средств включают, в частности, различные типы таблеток, капсул, питьевых препаратов, пастилок, полосканий и т.п. В некоторых вариантах реализации изобретения лекарственное средство является пригодным для местного применения. Лекарственные формы не имеют особых ограничений и включают капсулы, масла, гранулы, кишечнорастворимые гранулы, порошки, таблетки, пилюли, пастилки и т.п. Масла и капсулы с масляным наполнением могут иметь дополнительные преимущества, поскольку они не содержат компонентов, вызывающих разложение в процессе приготовления, и, кроме того, капли липидов, содержащие каротиноиды согласно изобретению, можно легко вводить в составы на масляной основе. Лечебные препараты согласно настоящему изобретению можно приготовить известными способами, включая, например, стандартную процедуру, описанную в Фармакопее США. Каротиноиды, полученные согласно настоящему изобретению, можно вводить в любой продукт,содержащий пигмент, включая, например, ткань, краску и т.п. Их можно также вводить в продукт, который является индикатором окружающей среды или прибором, в частности биосенсором, применяемым в качестве агента обнаружения. Примеры В табл. 26 представлены некоторые штаммы Yarrowia lipolytica, которые используются в приведенных ниже примерах. Таблица 26 Штаммы Yarrowia lipolytica(Генотипы в LYC1, LYS1, XPR2 и РЕХ 17 не определяли в кроссах и не проверяли на соответствие штаммам АТСС (Американской коллекции типовых культур. Все основные описанные здесь молекулярно-биологические процедуры и модификации ДНК выполняли в соответствии с работами Sambrook et al. или Ausubel et al. (Sambrook J., Fritsch E.F., Maniatis T.Protocols in Molecular Biology. Wiley: New York). Пример 1. Получение плазмид для конструирования каротиноидных штаммов. Получили плазмиды для конструирования штаммов, продуцирующих каротиноиды. В следующих разделах описано получение плазмид, кодирующих каротиногенные полипептиды. Плазмиды, используемые в этих исследованиях, и детали их конструирования описаны в табл. 27. Дополнительные детали конструирования плазмид и описание их применения приведено в тексте соответствующего раздела. Если не указано иного, для всех амплификаций полимеразных цепных реакций (ПЦР) в качестве матрицы использовали геномную ДНК Y-1095 NRRL. Ген URA 5, описанный ниже, является аллельным с ауксотрофом ura2-21, указанным выше. Промоторы GPD1 и TEF1 получены из Y. lipolytica, как и терминаторGGS1 представляет собой ген Y. lipolytica, кодирующий геранилгеранилпирофосфатсинтазу. Нук- 17016258 леиновая кислота, кодирующая последовательность, и кодированный белок Ggs1 из рМВ 4591 и рМВ 4683 представлены ниже: 1 А. Продуцирование рМВ 4628 (tef1p-carRP LEU2), кодирующего фитоенсинтазу/ликопинциклазу: интронсодержащий carRP амплифировали из геномной ДНК (АТСС 90680) М. circinelloides, используя МО 4525 и МО 4541 а полученный фрагмент размером 1,9 т.п.н. (тысяч пар нуклеотидов) фосфорилировали полинуклеотидкиназой Т 4. Образовавшийся фрагмент лигировали тупым концом в pBluescriptSKII, расщепленный Альтернативно, рМВ 4599 также использовали в качестве матрицы для амплификации при помощи ПЦР с применением МО 4318, МО 4643, МО 4644 и МО 4639 получив фрагменты размером 0,5 и 0,95 т.п.н., которые затем расщепили Acc651 и BsaI и BsaI и PpuMI соответственно. Эти фрагменты лигировали в рМВ 4599, который подвергли гидролизу с Асс 651 иPpuMI, получив рМВ 4613, содержащий безинтронный carRP. Фрагмент XbaI-MluI размером 1,85 т.п.н. из рМВ 4613 можно инсертировать в рМВ 4603, расщепленный NheI и MluI, чтобы получить pCarRPdelI. 1 В. Продуцирование РМВ 4638 (tef1p-carB ADE1), кодирующего фитоендегидрогеназу: интронсодержащий carB амплифицировали из геномной ДНК (АТСС 90680) М. circinelloides, используя МО 4530 и МО 4542 а полученный фрагмент размером 1,9 т.п.н. фосфорилировали полинуклеотидкиназой Т 4 и лигировали тупым концом в pBS-SKII, расщепленный EcoRV, получив рМВ 4606. Затем рМВ 4606 использовали в качестве матрицы для амплификации при помощи ПЦР с применением МО 4318 и МО 4648, МО 4646 и МО 4647, МО 4343 и МО 4645 получив фрагменты по 0,4, 0,85 и 0,7 т.п.н., которые затем расщепили Acc651 и BsaI и BsaI, BsaI иBamHI соответственно. Эти фрагменты лигировали в pBS-SKII, который был вырезан с Асс 651 и BamRI,получив рМВ 4619, содержащий безинтронный carB. Фрагмент XbaI-MluI размером 1.75 т.п.н. из рМВ 4619 инсертировали в рМВ 4629, расщепленный NheI и MluI, получив рМВ 4638. Полученная последовательность, кодирующая нуклеиновую кислоту, и кодированный белок CarB рМВ 4638 представлены нижеXhoI-NotI 4,3 т.п.н. и фрагмент NotI-SpeI 1,8 т.п.н. из рМВ 4638 лигировали в ген URA3 размером 1,9 т.п.н., расщепленный BsaI и SpeI и полученный путем амплификации ПЦР геномной ДНК Y. lipolytica с использованием МО 4684 и МО 4685 для образования рМВ 4660 1D. Продуцирование рМВ 4637 и pTef-HMG, кодирующих усеченный HMGI. Для продуцирования усеченного варианта гена редуктазы ГМГ-СоА, который кодирует также лидерную последовательность 77 аминокислот, полученную из S. cerevisiae, синтезировали следующие олигонуклеотиды: Праймеры О и Р использовали для амплификации фрагмента размером 0,23 т.п.н., кодирующегоMet-Ala с последующими остатками от 530 до 604 белка HmgI S. cerevisiae, применяя геномную ДНК в качестве матрицы. Праймеры Q и MO4658 использовали для амплификации фрагмента размером 1,4 т.п.н., кодирующего 448 С-концевых остатков белка Hmg1 Y. lipolytica, применяя геномную ДНК в качестве матрицы. Эти остатки лигировали в соответствующий клонирующий вектор, а полученные плазмиды, обозначенные как рОР и pQMO4658, проверили секвенированием. Фрагмент OP выделили при помощи XbaI иAseI, а фрагмент QMO4658 - при помощи MaeI и MluI. Затем эти фрагменты, вырезанные с XbaI и MluI,лигировали в вектор рМВ 4629 экспрессии ADE1 Tef1p, чтобы получить pTefHMG. Альтернативно, нативный ген Hmg1 из Y. lipolytica можно модифицировать без последовательностей S. cerevisiae, как показано в приведенной выше таблице, используя праймеры МО 4658 (описан выше) и МО 4657, чтобы получить рМВ 4637 Полученная последовательность, кодирующая нуклеиновую кислоту, и кодированный белок 1 Е. Продуцирование рМВ 4692 (URA3 tef1p-crtZ), кодирующего каротингидроксилазу. Синтезировали следующую последовательность каротингидроксилазы (CrtZ) ORF на основе последовательности белка Novosphmgobium aromaticivorans, используя склонность кодона Y. lipolytica к кодированию Эту последовательность расщепили при помощи XbaI и MluI и лигировали с фрагментом промотораAcc651-NheI TEF1 из рМВ 4629 в рМВ 4662, вырезанный с Асс 651 и MluI, чтобы получить рМВ 4692. Последовательность, кодирующая нуклеиновую кислоту, показана выше полужирным шрифтом и подчеркнута. Полученный кодированный белок crtZ белок рМВ 4692 представлен ниже 1F. Продуцирование of pMB4698 (ADE1 tef1p-crtW), кодирующего каротинкетолазу. Синтезировали следующую последовательность каротинкетолазы (CrtW) ORP на основе последовательности природного белка, выделенного из Саргассова моря (номер в базе данных Genbank: Эту последовательность расщепили при помощи XbaI и MluI и лигировали в рМВ 4629, вырезав сNheI и MluI, чтобы получить рМВ 4698. Последовательность, кодирующая нуклеиновую кислоту, показана выше полужирным шрифтом и подчеркнута. Полученный кодированный белок crtW рМВ 4698 представлен ниже Пример 2. Конструирование Yarrowia lipolytica для повышения продуцирования каротиноидов. 2 А. Продуцирование of Y. lipolytica, экспрессирующего геранилгеранилпирофосфатсинтазу и фитоендегидрогеназу: MF350 (МАТВ ura2-21 leu2-35 ade1) трансформировали с рМВ 4591 (tef1p-GGS1), который был расщеплен выше URA5 с SspI; идентифицировали трансформант Ura+, содержащий плазмиду в локусе ura2, и обозначили его как MF364. Затем его трансформировали с рМВ 4638 (tef1p-ca), который расщепили в ADE1 с SspI, и выбрали прототропный трансформант, который закрепил плазмиду в локусеade1. Этот штамм обозначили как MF502. 2 В. Продуцирование Y. lipolytica, экспрессирующего геранилгеранил-пирофосфатсинтазу, фитоендегидрогеназу и фитоенсинтазу/ликопинциклазу MF502 траснформировали с рМВ 4628 (tef1p-carRP),предварительно обработанным SspI. Выбрали девять прототрофных колоний, которые были неокрашенными, оранжевыми или интенсивно оранжевыми на питательной среде для трансформации (агар YNB с 1% глюкозы и 0,1% глютамата [YNBglut]) после выращивания в течение двух-трех суток. Две из них MF597 и MF600 (интенсивно оранжевые) продуцировали более 4 мг каротина на 1 г сухой клеточной массы (dry cell weight, DCW) после четырех суток выращивания в среде, содержащей декстрозу и пептон,при 30 С. Анализ методом саузерн-блоттинга выявил одинарную полосу KpnI-HindIII в геномной ДНК,отличную от MF597 и MF600, ни одна из которых не предполагала гомологичной интеграции в leu2-270. 2 С. Продуцирование of Y. lipolytica, экспрессирующего фитоенсинтазу/ликопин циклазу и фитоендегидрогеназу: АТСС 201249 (МАТА ura3-302 leu2-270 lys8-11) трансформировали с рМВ 4628, расщепленным SspI. Сотни колоний Leu+ объединили, дополнительно вырастили и трансформировали с рМВ 4660 (tef1p-carB), который предварительно расщепили SalI выше URA3. Выбрали одну колонию,которая имела заметный желтый цвет после выращивания в течение 5 суток при 30 С в YNBglut плюс 0,6 мМ лизина, обозначили как MF447 и установили, что она продуцирует 0,2 мг каротина на 1 г сухой клеточной массы после выращивания в среде, содержащей декстрозу и пептон, в течение 4 суток.MF447 стимулировали 1 г/л 5-фтороротовой кислоты и выбрали сегреганты для Ura-. Неожиданно оказалось, что все они сохраняют идентичный желтый свет своей материнской клетки, что указывает на то, что потеря функционального гена URA3 не совпадает с потерей функционального фермента CarB. Анализ способом саузерн-блоттинга показал, что два фрагмента из гидролизата KpnI-HindIII ДНК MF447 содержали URA3p-гибридизирующие последовательности, только одна из которых также гибридизирует в carB. Другая - отсутствует в MF578, сегреганте Ura3-, выбранном для дальнейшей работы. Выделение- 27016258 плазмиды и анализ последовательности ДНК, содержащей интрон carRP в штаммах MF447, MF597 (пример 2 С) и MF600 (пример 2 С), показал, что экзоны 1 и 2 являются смежными, при этом каждый из них отделен интронной последовательностью, в которой отсутствует исходный внутренний сайт SspI (присутствующий в РМВ 4628). 2D. Продуцирование Y. lipolytica, экспрессирующего фитоинсинтазу/ликопинциклазу, фитоендегидрогеназу и геранилгеранилпирофосфатсинтазу: MF578 трансформировали с рМВ 4683 (tef1p-GGS1),который предварительно расщепили SalI (выше URA3) или StuI (в GGS1 ORF). В обоих случаях колонииUra+ Leu+ были ярко-оранжевыми на YNBglut+Lys и на среде, содержащей декстрозу и пептон, при этом некоторые из них, будучи выращенными, как описано выше, продуцировали более 4 мг каротина на 1 г сухой клеточной массы. Одна колония, MF633, содержала единственную копию плазмиды в локусеGGS1, как показал анализ методом сузерн-блоттинга. Остальные являлись результатом негомологичных или более сложных интеграций. 2 Е. Продуцирование Y. lipolytica, экспрессирующего фитоинсинтазу/ликопинциклазу, фитоиндегидрогеназу и геранилгеранилпирофосфатсинтазу: MF364 скрестили с MF578 и поместили споры полученного диплоида в среду, содержащую декстрозу и пептон, (Yeast Peptone Dextrose, дрожжевая пептонная декстроза) на двое-трое суток при 30 С. Провели контроль оранжевых колоний Leu+ Ade- Ura- на присутствие tefp-carB, tefp-carRP и tefp-GGS1 при помощи ПЦР и на высокое продуцирование каротиноидов (4 мг/г сухой клеточной массы) после выращивания в жидкой среде, содержащей декстрозу и пептон. Колонии, соответствовавшие этим критериям, а также проявлявшие стойкость к 5-фтороротовой кислоте, что является показателем содержания аллеля ura3-302, выбрали для дальнейших исследований и далее обозначили как штаммы GBRPua. Этот штамм выбрали для последующего анализа и модификации. Пример 3. Экстракция каротиноидов из клеток Yarrowia lipolytica. Провели испытание полученных штаммов во встряхиваемой колбе, используя среду, содержащую декстрозу и пептон (1% экстракта дрожжей, 2% пептона, 2% глюкозы). 20 мл культур выращивали в колбах емкостью 125 мл при 30 С. Клетки Y. lipolytica отбирали от культур, выращенных в течение 72-96 ч,и проводили экстракцию, чтобы определить форму и количество каротиноидов. 1,8 мл культуры поместили в микропробирку типа "Эппендорф". Клетки суспендировали и дважды промыли 1 мл Н 2 О. После второй промывки ресуспендированные клетки перенесли в предварительно взвешенную пробирку с защелкивающейся крышкой с отверстием в верхней части и лиофилизировали клетки в течение ночи. После сушки до постоянной массы пробирку взвесили, чтобы рассчитать величину сухой клеточной массы. 0,25 мл культуры из той же самой встряхиваемой колбы поместили в пробирку объемом 2 мл с завинчивающейся крышкой для экстракции каротиноидов. Клетки осадили центрифугированием и надосадочный слой слили. Суспендированные клетки можно заморозить при -80 С и хранить. К осажденным центрифугированием клеткам добавили гранулы кубического циркония вместе с 1 мл охлажденного до 0 С экстракционного растворителя (смесь 50/50 по объему гексана и этилацетата, содержащего 0,01% бутилгидрокситолуола (БГТ. Затем смесь перемешали (Mini-BeadBeater-8, BioSpec Products, Inc.) при максимальной скорости в течение 5 мин при 4 С. После этого смесь центрифугировали при максимальной скорости в течение 1 мин, отобрали надосадочный слой и поместили в холодный стеклянный флакон емкостью 16 мл. Остальной клеточный дебрис повторно экстрагировали по меньшей мере три раза без добавления гранул циркония. Все надосадочные слои объединили в стеклянном флаконе емкостью 16 мл. После экстракции стеклянный флакон центрифугировали в течение 5 мин со скоростью 2000 об/мин при 4 С в настольной центрифуге Sorvall и перенесли надосадочный слой в новый холодный стеклянный флакон емкостью 16 мл. Для концентрирования надосадочного слоя (в темноте, при комнатной температуре) использовали установку Speed Vac. Образцы хранили при -20 или -80 С вплоть до проведения анализа методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Перед анализом образцы ресуспендировали в 1 мл охлажденного до 0 С растворителя, а затем перенесли в холодный флакон из оранжевого стекла. На протяжении всего протокола следили за тем, чтобы исключить контакт с кислородом,светом, теплом и кислотами. Пример 4. Количественное определение продуцирования каротиноидов методом ВЭЖХ. Для проведения анализа каротиноидов образцы ресуспендировали в растворителе-экстрагенте(смесь 50/50 по объему гексана и этилацетата, содержащего 0,01% бутилгидрокситолуола (БГТ, охлажденного до 0 С. Установку ВЭЖХ Alliance 2795 (Waters), оснащенную колонкой Waters XBridge C18 (3,5 мкм, 2,150 мм) и защитной колонкой Thermo Basic 8 (2,110 мм) использовали для разделения каротиноидов при 25 С. В качестве стандартов использовали аутентичные образцы каротиноидов. Подвижные фазы и скорости потоков указаны ниже (растворитель А = этилацетат; растворитель В = вода; растворитель С = метанол; растворитель D = ацетонитрил). Вводимый объем составлял 10 мкл. Детектор представлял собой фотодиодный матричный детектор Waters 996. Время удерживания для липофильных молекул: астаксантин (1,159 мин), зеаксантин (1,335), -апо-8'-каротинал (2,86 мин), эргостерол (3,11 мин),ликопин (3,69 мин), -каротин (4,02 мин) и фитоин (4,13 мин). Астаксантин, зеаксантин, -апо-8'каротиналь, ликопин и -каротин определяли при 475 нм, а эргостерол и фитоин при 286 нм.- 28016258 Таблица 28 Время удерживания для липофильных молекул Пример 5. Экспрессия редуктазы HMG-CoA в усеченной форме приводит к повышению продуцирования каротиноидов. Для увеличения продуцирования каротиноидов усиливали поток углерода по изопреноидному пути за счет использования усеченного варианта гена редуктазы ГМГ-СоА. В одном из вариантов реализации усеченный вариант гена редуктазы ГМГ-СоА, который также кодирует лидерную последовательность 77 аминокислот, полученную из Hmg1 S. cerevisiae, ввели в штаммBsu36I, чтобы направить интеграцию в локус ade1, или BamHI, чтобы направить интеграцию в локусHMG1, или EcoRV, чтобы способствовать рандомизированной интеграции в штаммах GRPBua, возвращая их к прототрофии аденина. В полученных трансформантах Ade+ проверяли повышенное продуцирование каротиноидов. Альтернативно, нативный ген HMG1 из Y. lipolytica можно модифицировать без последовательности S. cerevisiae, как описано выше в примере 1D, чтобы получить рМВ 4637. Эту плазмиду можно гидролизовать, как описано для pTefHMG, трансформировать в штаммы GRPBua и произвести контроль полученных трансформантов, как описано для увеличенного продуцирования каротиноидов. В другом варианте реализации может быть использован усеченный вариант гена редуктазы HMGCoA N. crassa и введен в штаммы Y. lipolytica. Для получения плазмиды, пригодной для экспрессии гетерологичной редуктазы HMG-CoA, модифицировали р 641 Р (Yeasts 2001; 18 (2001): 97-113) путем замены промотора ICL1 на промотор GPD и добавления последовательностей, придающих резистентность к флеомицину. Геномную ДНК Y. lipolytica амплифировали двумя праймерамиBamHI и KpnI, получив плазмиду "p641Pgpd". Затем ген ble под контролем промотора GPD A. nidulans удалили из pBCphleo (Silar, Fungal Genetics Newsletter 42:73) в форме фрагмента BclI-BamHI размером 3,2 т.п.н. и ввели в уникальный сайт BamHI "p641Pgpd" с ориентацией, которая препятствует сайту а полученный фрагмент расщепили BamHI и ввели с нормальной ориентацией в "p641Pgpdble", гидролизованной BamHI. Образовавшаяся плазмида "pZg" содержала последовательности, кодирующие усеченный цитозольный каталитический домен гидроксиметилглютарил-КоА-редуктазы из N. crassa (номер в базе данных Genbank: XP324892) под контролем конститутивного промотора GPD. Эту плазмиду можно ввести в штамм Y. lipolytica, полученный в приведенном выше примере 2 Е, а трансформанты выбрать по их резистентности к флеомицину (100 мкг/мл). Отобранные трансформанты тестировали на продуцирование -каротина, как описано выше. Пример 6. Введение гетерологичных генов каротингидроксилазы и каротинкетолазы в штаммы Y.lipolytica, продуцирующие каротиноид, для продуцирования астаксантина. Для введения каротингидроксилазы и каротинкетолазы в штаммы Y. lipolytica, продуцирующие каротиноиды, рМВ 4692 и рМВ 4698, описанные выше в примерах 1 Е и 1F, можно последовательно ввести в штамм GRPBua (описанный в примере 2 Е). Для введения рМВ 4692 плазмиду можно расщепить SalI илиBsrGI, чтобы направить интеграцию в локус ura3, или XbaI, чтобы способствовать рандомизированной
МПК / Метки
МПК: A23L 1/275, C12P 23/00, C12N 15/80
Метки: продуцирующие, каротиноиды, способы, рекомбинантные, грибы, применения
Код ссылки
<a href="https://eas.patents.su/30-16258-rekombinantnye-griby-produciruyushhie-karotinoidy-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантные грибы, продуцирующие каротиноиды, и способы их применения</a>
Предыдущий патент: Устройство подачи материала для ударной дробилки с вертикальным валом и способ дробления материала
Следующий патент: Применение кальций-пептидного компонента для снижения веса тела
Случайный патент: Устройство с индикацией несанкционированного вскрытия