Азагетероциклильные производные андростанов и андростенов в качестве лекарственных средств от сердечно-сосудистых расстройств
Номер патента: 15622
Опубликовано: 31.10.2011
Авторы: Феррари Патриция, Бениккио Алессандра, Бьянки Джузеппе, Черри Альберто, Федрицци Джорджо, Микелетти Розамария, Гоббини Мауро, Поцци Марко, Скотти Пьеро Энрико
Формула / Реферат
1. Соединения формулы (I)
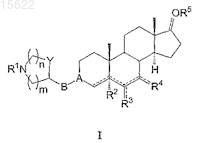
где A представляет собой CH ![]() X, C=N
X, C=N ![]() O, CR6
O, CR6![]() CH=CH
CH=CH ![]() , CR7
, CR7![]() XC=O, где левый концевой атом углерода в любой из указанных групп находится в положении 3 андростанового кольца;
XC=O, где левый концевой атом углерода в любой из указанных групп находится в положении 3 андростанового кольца;
X представляет собой O, S(O)x или NR8;
x представляет собой число 0, или 1, или 2;
В представляет собой C1-C4линейный или разветвленный алкилен или может представлять собой простую связь так, чтобы A был непосредственно связан с азотсодержащим гетероциклом;
Y представляет собой CH2, кислород;
R1 представляет собой H, C1-C6 линейный или разветвленный алкил;
R2 представляет собой H, C1-C6 линейный или разветвленный алкил или OR11;
R11 представляет собой H;
когда связи ![]() , связывающие атом углерода в положении 6 андростанового скелета с R3и/или атом углерода в положении 7 с R4, представляют собой двойные связи, R3и R4 при условии, что R3и R4 являются одинаковыми или отличными друг от друга, представляют собой O со значением кетогруппы, N
, связывающие атом углерода в положении 6 андростанового скелета с R3и/или атом углерода в положении 7 с R4, представляют собой двойные связи, R3и R4 при условии, что R3и R4 являются одинаковыми или отличными друг от друга, представляют собой O со значением кетогруппы, N ![]() OR12 или CR13R14;
OR12 или CR13R14;
R12 представляет собой H, C1-C6 линейную или разветвленную алкильную группу, или R12 представляет собой аллил или пропаргил;
R13 и R14, которые могут быть одинаковыми или отличными друг от друга, представляют собой H, C1-C6линейную или разветвленную алкильную группу, или R13 и R14, которые могут быть одинаковыми или отличными друг от друга, представляют собой F;
когда связи ![]() , связывающие атом углерода в положении 6 андростанового скелета с R3 и/или атом углерода в положении 7 с R4, представляют собой простые связи, R3 и/или R4, которые могут быть одинаковыми или отличными друг от друга, представляют собой H, C1-C6 линейную или разветвленную алкильную группу, винил, этинил, COOR15, CN, CONR16R17, OR18, ONO2, NHCHO, NHCOCH3, CH=N
, связывающие атом углерода в положении 6 андростанового скелета с R3 и/или атом углерода в положении 7 с R4, представляют собой простые связи, R3 и/или R4, которые могут быть одинаковыми или отличными друг от друга, представляют собой H, C1-C6 линейную или разветвленную алкильную группу, винил, этинил, COOR15, CN, CONR16R17, OR18, ONO2, NHCHO, NHCOCH3, CH=N ![]() OH, спироциклопропан, спирооксиран, где алкильная группа, необязательно, может быть замещена одним или несколькими гидрокси, метокси, этокси;
OH, спироциклопропан, спирооксиран, где алкильная группа, необязательно, может быть замещена одним или несколькими гидрокси, метокси, этокси;
R15 представляет собой C1-C6 линейный или разветвленный алкил;
R16 и R17 представляют собой H;
R18 представляет собой H, C1-C6 линейный или разветвленный алкил;
R5 представляет собой H, когда связь ![]() в положении 17 андростанового скелета представляет собой простую связь, и R5 не может присутствовать, когда связь
в положении 17 андростанового скелета представляет собой простую связь, и R5 не может присутствовать, когда связь ![]() в положении 17 представляет собой двойную связь со значением кетогруппы;
в положении 17 представляет собой двойную связь со значением кетогруппы;
n представляет собой число 0 или 1;
m представляет собой число 0, или 1, или 2;
R15, R16 и R17, когда присутствуют в одном и том же соединении в разных положениях, могут быть одинаковыми или отличными друг от друга,
символ ![]() представляет собой a или b простую связь или E или Z диастереоизомер, когда он связан с двойной связью,
представляет собой a или b простую связь или E или Z диастереоизомер, когда он связан с двойной связью,
символ ![]() в положениях 4, 5, 6, 7 и 17 представляет собой простую или двойную связь, и когда он представляет собой простую экзоциклическую связь в положениях 6, 7 или 17, он может представлять собой a или bпростую связь;
в положениях 4, 5, 6, 7 и 17 представляет собой простую или двойную связь, и когда он представляет собой простую экзоциклическую связь в положениях 6, 7 или 17, он может представлять собой a или bпростую связь;
при следующих условиях:
когда A представляет собой CR7![]() XC=O, где R7 представляет собой водород и X представляет собой кислород, и
XC=O, где R7 представляет собой водород и X представляет собой кислород, и
когда A представляет собой CH ![]() X, где X представляет собой кислород, тогда символ
X, где X представляет собой кислород, тогда символ ![]() в положении 6 связывания с R3 представляет собой простую связь, или когда символ
в положении 6 связывания с R3 представляет собой простую связь, или когда символ ![]() в положении 6 связывания с R3 представляет собой двойную связь, R4 является отличным от кислорода, и символ
в положении 6 связывания с R3 представляет собой двойную связь, R4 является отличным от кислорода, и символ ![]() в положении 7 связывания с R4 означает двойную связь, или R4 является отличным от OR18, при этом символ
в положении 7 связывания с R4 означает двойную связь, или R4 является отличным от OR18, при этом символ ![]() в положении 7 связывания с R4 означает простую связь,
в положении 7 связывания с R4 означает простую связь,
что по меньшей мере один из R2, R3 и R4 в одной и той же структуре является отличным от водорода;
их фармацевтически приемлемые соли.
2. Соединения по п.1, где R2 и R4 представляют собой H, символ R3 представляет собой кислород со значением кето; метилен, дифторметилен, гидроксиимино, метоксиимино и символ

представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, [3-(R)-(1-метил)пирролидинил]оксиимино, [3-(S)-(1-метил)пирролидинил]оксиимино, 3a-[3-(S)-пирролидинилтио], 3a-[3-(R)-пирролидинилтио], 3a-[3-(RS)-пирролидинилтио], 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], 3a-[2-(пиперидин-4-ил)-(Z)-винил], их фармацевтически приемлемые соли.
3. Соединения по п.1, где R2 и R4 представляют собой H, символ R3 представляет собой a-гидрокси, a-метил, a-карбамоил, a-метоксикарбонил, a-гидроксиметил, a-(2-гидроксиэтил), a-метоксиметил, a-нитрокси, a-формиламино, a-этинил, b-гидрокси, спироциклопропил, символ ![]() в положении 17 представляет собой двойную связь или b-простую связь, тогда как другие символы
в положении 17 представляет собой двойную связь или b-простую связь, тогда как другие символы ![]() представляют собой простые связи и символ
представляют собой простые связи и символ
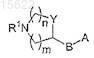
представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, [3-(R)-(1-метил)пирролидинил]оксиимино, [3-(S)-(1-метил)пирролидинил]оксиимино, 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], 3a-[2-(пиперидин-4-ил)-(Z)-винил], их фармацевтически приемлемые соли.
4. Соединения по п.1, где R2 представляет собой гидрокси, символ R4 представляет собой H, символ R3представляет собой кислород со значением кето; метилен, дифторметилен, гидроксиимино, метоксиимино, когда символы ![]() в положении 6 связывания с R3 и в положении 17 представляют собой двойные связи, тогда как другие символы
в положении 6 связывания с R3 и в положении 17 представляют собой двойные связи, тогда как другие символы ![]() представляют собой простые связи и символ
представляют собой простые связи и символ
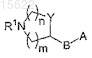
представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, [3-(R)-(1-метил)пирролидинил]оксиимино, [3-(S)-(1-метил)пирролидинил]оксиимино, 3a-[3-(S)-пирролидинилтио], 3a-[3-(R)-пирролидинилтио], 3a-[3-(RS)-пирролидинилтио], 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], 3a-[2-(пиперидин-4-ил)-(Z)-винил], их фармацевтически приемлемые соли.
5. Соединения по п.1, где R2 и R3представляют собой H, символ R4 представляет собой кислород со значением кето; метилен, дифторметилен, гидроксиимино, метоксиимино, когда символы ![]() в положении 7 связывания с R4и в положении 17 представляют собой двойную связь, тогда как другие символы
в положении 7 связывания с R4и в положении 17 представляют собой двойную связь, тогда как другие символы ![]() представляют собой простые связи и символ
представляют собой простые связи и символ

представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3a-[3-(S)-пирролидинилтио], 3a-[3-(R)-пирролидинилтио], 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], их фармацевтически приемлемые соли.
6. Соединения по п.1, где R2 и R3представляют собой H, символ R4 представляет собой a-гидрокси, a-метил, a-карбамоил, a-метоксикарбонил, a-гидроксиметил, a-метоксиметил, a-нитрокси, a-формиламино, a-этинил, b-гидрокси, b-метил, b-карбамоил, b-метоксикарбонил, b-гидроксиметил, b-метоксиметил, b-нитрокси, b-формиламино, b-этинил, спироциклопропил, символ ![]() в положении 17 представляет собой двойную связь, тогда как другие символы
в положении 17 представляет собой двойную связь, тогда как другие символы ![]() представляют собой простые связи и символ
представляют собой простые связи и символ
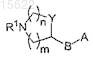
представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3a-[3-(S)-пирролидинилтио], 3a-[3-(R)-пирролидинилтио], 3a-[3-(RS)-пирролидинилтио], 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], 3a-[2-(пиперидин-4-ил)-(Z)-винил], их фармацевтически приемлемые соли.
7. Соединения по п.1, где R2 представляет собой гидрокси, символы R3 и R4представляют собой H, символ ![]() в положении 17 представляет собой двойную связь, тогда как другие символы
в положении 17 представляет собой двойную связь, тогда как другие символы ![]() представляют собой простые связи и символ
представляют собой простые связи и символ
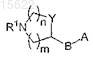
представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3a-[3-(S)-пирролидинилтио], 3a-[3-(R)-пирролидинилтио], 3a-[3-(RS)-пирролидинилтио], 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], 3a-[2-(пиперидин-4-ил)-(Z)-винил], их фармацевтически приемлемые соли.
8. Соединения по п.1, где R2 представляет собой H, символы R3 представляет собой a-гидроксиметил и R4представляет собой a-гидрокси или кето, когда символ ![]() в положении 17 представляет собой двойную связь, тогда как другие символы
в положении 17 представляет собой двойную связь, тогда как другие символы ![]() представляют собой простые связи и символ
представляют собой простые связи и символ
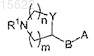
представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, [3-(R)-(1-метил)пирролидинил]оксиимино, [3-(S)-(1-метил)пирролидинил]оксиимино, 3a-[3-(S)-пирролидинилтио], 3a-[3-(R)-пирролидинилтио], 3a-[3-(RS)-пирролидинилтио], 3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3a-[2-(азетидин-3-ил)-(Z)-винил], 3a-[2-(пиперидин-4-ил)-(Z)-винил], их фармацевтически приемлемые соли.
9. Соединения по п.1, выбранные из группы, включающей
(E) 3-[3'-(R)-(1-метил)пирролидинил]оксииминоандростан-6,17-дион;
гидрохлорид (E) 3-(4-пиперидил)оксииминоандростан-6,17-дион;
(Е,Z) 3-(3-азетидинил)оксииминоандростан-6,17-дионфумарат;
гидрохлорид (E) 3-[3-(RS)-пирролидинил]оксииминоандростан-6,17-дион;
гидрохлорид (E,Z) 3-[3-(S)-пирролидинил]оксииминоандростан-6,17-дион;
гидрохлорид (Е,Z) 3-[3-(R)-пирролидинил]оксииминоандростан-6,17-дион;
гидрохлорид (E) 3-[3-(R)-пирролидинил]оксииминоандростан-6,17-дион;
гидрохлорид (Z)-3-[3'-(R)-пирролидинил]оксииминоандростан-6,17-дион;
гидрохлорид (E,Z) 3-[2-(R)-пирролидинил]метоксииминоандростан-6,17-дион;
гидрохлорид (Е,Z) 3-[2-(S)-пирролидинил]метоксииминоандростан-6,17-дион;
гидрохлорид (E) 3-[3'-(R,S)-пиперидинил]оксииминоандростан-6,17-дион;
гидрохлорид (E,Z) 3-[3'-(S)-(1-метил)пирролидинил]оксииминоандростан-6,17-дион;
(Е,Z) 3-(3-(R)-пирролидинил)оксиимино-5a-гидроксиандростан-17-он гемифумарат;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6a-гидроксиандростан-17-он;
гидрохлорид (E,Z) 3-[3-(S)-пирролидинил]оксиимино-6a-гидроксиандростан-17-он;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-17-оксоандростан-6a-илнитрата;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-метиленандростан-17-он;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6a-гидроксиметиландростан-17-он;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6a-метоксиметиландростан-17-он;
гидрохлорид (Z,E) 3-(3-(R)-пирролидинилоксиимино)-6a-карбамоиландростан-17-он;
гидрохлорид (Z,E) 3-(3-(R)-пирролидинилоксиимино)-6a-метоксикарбониландростан-17-он;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6(E)-гидроксииминоандростан-17-он;
(E) 3-[3-(R)-пирролидинил]оксиимино-6a-метиландростан-17-онфумарат;
гидрохлорид (Z) 3-[3-(R)-пирролидинил]оксиимино-6a-метиландростан-17-он;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6a-формамидоандростан-17-он;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-дифторметиленандростан-17-он;
гидрохлорид (Z,E) 3-(3-(R)-пирролидинилоксиимино)-6-(спироциклопропан)андростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-6a-этиниландростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-6a-(2-гидроксиэтил)андростан-17-он;
гидрохлорид (E,Z) 3-(3'-(R)-пирролидинилоксиимино)-6-(E)-метоксииминоандростан-17-он;
(Е,Z) 3-[3'-(S)-пирролидинил]оксиимино-6-(E)-метоксииминоандростан-17-онфумарат;
гидрохлорид (E,Z) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-6-(E)-метоксииминоандростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-(E)-6-метоксииминоандростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-он;
(Z) 3-[3'-(S)-пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
(E) 3-[3'-(S)-пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
(Е,Z) 3-[3'-(S)-пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
(Z) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
(E) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
(Z) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
(E) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-метиленандростан-17-онфумарат;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-он;
гидрохлорид (Е,Z) 3-[3-(S)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-он;
(Z) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-он гемифумарат;
(E) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(Z) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(E) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(Е,Z)-3-(3'-(S)-пирролидинилоксиимино)-5a-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат;
(Е,Z) 3-[3'-(R)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат;
(Z) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат;
(E) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат;
(Z) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат;
(E) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат;
(Е,Z) 3-[3-(R)-пирролидинил]оксииминоандростан-7,17-дионфумарат;
(Е,Z) 3-[3'-(S)-пирролидинил]оксииминоандростан-7,17-дионфумарат;
(Е,Z) 3-[3-(R)-пирролидинил]оксиимино-7-(E)-гидроксииминоандростан-17-онфумарат;
(Е,Z) 3-[3-(R)-пирролидинил]оксиимино-7-(E)-метоксииминоандростан-17-онфумарат;
(Е,Z) 3-[3'-(R)-пирролидинил]оксиимино-7-(E)-аллилоксииминоандростан-17-онфумарат;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7-метиленандростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7a-гидроксиметиландростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7-гидроксиметиландростан-17-он;
(Е,Z) 3-[3'-(R)-пирролидинил]оксиимино-7a-гидроксиандростан-17-онфумарат;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7a-метиландростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-он;
гидрохлорид (E) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-он;
гидрохлорид (Z) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-он;
гидрохлорид (Z,E) 3-(3'-(R)-пирролидинилоксиимино)-7-(спироциклопропан)андростан-17-он;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7a-формамидоандростан-17-он;
гидрохлорид (E) 3-[3'-(R)-пирролидинил]оксиимино-7a-метоксикарбониландростан-17-он;
гидрохлорид (E,Z) 3-(3'-(R)-пирролидинилоксиимино)-6-(E)-гидроксиимино-7a-гидроксиандростан-17-он;
(Е,Z) 3-[3'-(R)-пирролидинил]оксиимино-6a-гидроксиметиландростан-7,17-дионфумарат;
(Е,Z) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-6a-гидроксиметиландростан-7,17-дионфумарат;
(Е,Z) 3-[3'-(S)-(1-метил)пирролидинил]оксиимино-6a-гидроксиметиландростан-7,17-дионфумарат;
гидрохлорид 3b-(3-(R,S)-пиперидинилкарбонилокси)андростан-6,17-дион;
гидрохлорид 3b-(4-пиперидинилкарбонилокси)андростан-6,17-дион;
гидрохлорид 3b-(3-азетидинкарбонилокси)андростан-6,17-дион;
3b-(3(R,S)-пирролидинилкарбонилокси)андростан-6,17-дионфумарат;
3b-(2(R,S)-морфолинилкарбонилокси)андростан-6,17-дионфумарат;
дигидрохлорид 3-(2-(R,S)-пиперазинилкарбонилокси)андростан-6,17-диона;
3a-[3-(RS)-пирролидинилтио]-6-метиленандростан-17-онфумарат;
3a-[3-(RS)-пирролидинилтио]андростан-6,17-дионфумарат;
3a-[3-(RS)-пирролидинилтио]-6-(E)-гидроксииминоандростан-17-онфумарат;
3a-[2-(пирролидин-3-(S)-ил)-(Z)-винил]андростан-6,17-дионформиат;
3a-[2-(пирролидин-3-(R)-ил)-(Z)-винил]андростан-6,17-дионформиат;
3a-[2-(пиперидин-4-ил)-(Z)-винил]андростан-6,17-дионформиат;
3a-[2-(азетидин-3-ил)-(Z)-винил]андростан-6,17-дионформиат;
(Z)-3-[3-(S)-пирролидинил]оксиимино-6a-гидроксиметиландростан-7,17-дионфумарат;
(E)-3-[3-(S)-пирролидинил]оксиимино-6a-гидроксиметиландростан-7,17-дионфумарат;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6a-гидроксиметил-7a-гидроксиандростан-17-он;
гидрохлорид (E,Z) 3-[3-(S)-пирролидинил]оксиимино-6a-гидроксиметил-7a-гидроксиандростан-17-она;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7a-метоксиметиландростан-17-она;
(Е,Z) 3-[3-(R)-пирролидинил]оксиимино-7a-метоксиандростан-17-онфумарат;
гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксииминоандростан-6a,17b-диола;
гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-6-гидроксиандростан-17-он;
(Е,Z) 3-[3'-(R)-(1-метил)пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(Z) 3-[3-(R)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(E) 3-[3-(R)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(Z) 3-[3-(S)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(E) 3-[3-(S)-пирролидинил]оксиимино-5a-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат;
(Е,Z) 3-[3-(S)-пирролидинил]оксиимино-6-(E)-гидроксииминоандрост-4-ен-17-онфумарат;
(Z) 3-[3-(S)-пирролидинил]оксиимино-6-(E)-гидроксииминоандрост-4-ен-17-он и
(E) 3-[3-(S)-пирролидинил]оксиимино-6-(E)-гидроксииминоандростан-4-ен-17-он.
10. Способ получения соединений по п.1, где A представляет собой C=N ![]() O, включающий взаимодействие соединения формулы (II)
O, включающий взаимодействие соединения формулы (II)
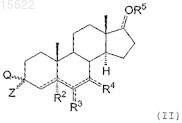
где Q и Z вместе представляют собой кетогруппу (=O), R2, R3, R4, R5имеют значения, определенные в п.1, с соединением общей формулы (III)
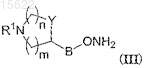
где R1, B, Y, m и n имеют значения, определенные в п.1.
11. Способ получения соединений по п.1, где A представляет собой CH ![]() X, где X представляет собой O, S или NR8, при этом R8 определен в п.1, включающий взаимодействие соединения формулы (II)
X, где X представляет собой O, S или NR8, при этом R8 определен в п.1, включающий взаимодействие соединения формулы (II)
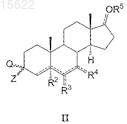
где символы R2, R3, R4, R5и ![]() имеют значения, определенные в п.1, и где Q представляет собой гидрокси, меркапто, NHR8, где R8 определен в п.1, и Z представляет собой водород, с соединением общей формулы (VII)
имеют значения, определенные в п.1, и где Q представляет собой гидрокси, меркапто, NHR8, где R8 определен в п.1, и Z представляет собой водород, с соединением общей формулы (VII)

где W представляет собой R1N или PGN и R1, Y, m, n и B имеют значения, определенные в п.1, PG представляет собой защитную группу, LG представляет собой удаляемую группу, и необязательное удаление защитной группы.
12. Способ получения соединений по п.1, где A представляет собой CR6![]() CH=CH
CH=CH ![]() , где R6 представляет собой водород, включающий взаимодействие соединения формулы (II)
, где R6 представляет собой водород, включающий взаимодействие соединения формулы (II)

где символы R2, R3, R4, R5 и ![]() имеют значения, определенные в п.1, и где Q представляет собой CHO и Z представляет собой водород, с соединением общей формулы (IX)
имеют значения, определенные в п.1, и где Q представляет собой CHO и Z представляет собой водород, с соединением общей формулы (IX)
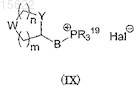
где W представляет собой R1N, PGN и R1, Y, m, n и B имеют значения, определенные в п.1, R19 представляет собой C1-C6 алкил или арил, Hal представляет собой галоген, PG представляет собой защитную группу, и необязательное удаление защитной группы.
13. Способ получения соединений по п.1, где A представляет собой CR7![]() XC=O, где R7 представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, X представляет собой O, S или NR8, где R8 имеет значения, определенные в п.1, включающий взаимодействие соединения формулы (II) по п.7
XC=O, где R7 представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, X представляет собой O, S или NR8, где R8 имеет значения, определенные в п.1, включающий взаимодействие соединения формулы (II) по п.7
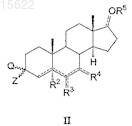
с соединением общей формулы (X)

где W представляет собой R1N, PGN и R1, Y, m, n и B имеют значения, определенные в п.1, PG представляет собой защитную группу, и необязательное удаление защитной группы.
14. Фармацевтическая композиция, содержащая, по меньшей мере, соединение по пп.1-9 в смеси по меньшей мере с одним фармацевтически приемлемым носителем и/или эксципиентом.
15. Применение соединений по пп.1-9 в качестве лекарственных средств.
16. Применение соединений по пп.1-9 для получения лекарственного средства для лечения сердечно-сосудистых расстройств.
17. Применение по п.16, где указанные сердечно-сосудистые расстройства представляет собой сердечную недостаточность и/или гипертензию.
18. Применение соединений по пп.1-9 для получения лекарственного средства для ингибирования ферментативной активности Na+,K+-АТФазы.
19. Применение соединений по пп.1-9 для получения лекарственного средства для лечения заболевания, вызванного гипертензивными эффектами эндогенного уабаина.
20. Применение по п.19, где заболевание, вызванное гипертензивными эффектами эндогенного уабаина, включает прогрессирование почечной недостаточности при аутосомальном доминантном поликистозном почечном заболевании (ADPKD), преэкламптической гипертензии и протеинурии и прогрессирование почечной недостаточности у пациентов с аддуциновым полиморфизмом.
Текст
Дата публикации и выдачи патента Номер заявки АЗАГЕТЕРОЦИКЛИЛЬНЫЕ ПРОИЗВОДНЫЕ АНДРОСТАНОВ И АНДРОСТЕНОВ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОТ СЕРДЕЧНО-СОСУДИСТЫХ РАССТРОЙСТВ Соединения формулы (I), где группы имеют значения, определенные в описании изобретения,являются полезными для получения лекарственных средств для лечения сердечно-сосудистых расстройств, в частности сердечной недостаточности и гипертензии. Соединения являются ингибиторами ферментативной активности Na+, K+-АТФазы. Они являются полезными для получения лекарственного средства для лечения заболевания, вызванного гипертензивными эффектами эндогенного уабаина, такого как прогрессирование почечной недостаточности при аутосомальном доминантном поликистозном почечном заболевании (ADPKD), преэкламптической гипертензии и протеинурии и прогрессирование почечной недостаточности у пациентов с аддуциновым полиморфизмом. Черри Альберто, Федрицци Джорджо,Бениккио Алессандра, Бьянки Джузеппе, Феррари Патриция,Гоббини Мауро, Микелетти Розамария, Поцци Марко, Скотти Пьеро Энрико (IT)(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. 015622 Настоящее изобретение относится к новым азагетероциклильным производным по 3 положению 5-,и/или 6-, и/или 7-замещенных андростанов и андростенов, способам их получения и содержащим их фармацевтическим композициям для лечения сердечно-сосудистых расстройств, таких как сердечная недостаточность и гипертензия. Предпосылки изобретения Сердечно-сосудистые заболевания все еще остаются главной причиной заболеваемости и смертности в западном мире; из них гипертензия и сердечная недостаточность являются двумя наиболее часто встречающимися заболеваниями. Гипертензия является одним из наиболее серьезных сердечнососудистых факторов риска, и этим заболеванием страдают более одной трети населения страше 60 лет. Застойная сердечная недостаточность поражает 1-2% населения и даже 10% людей преклонного возраста; и этот процент, как ожидается, будет расти (Sharpe, N. et al., The Lancet, 1998, 352 (suppl. 1), 3-17). Кроме того, гипертензия может быть одной из наиболее серьезных причин сердечной недостаточности у пожилых людей (Eur. Heart J., 2001, 22, 1527-1560). Несмотря на то что в настоящее время являются доступными эффективные лекарственные средства для лечения как гипертензии, так и сердечной недостаточности, продолжаются исследования, направленные на поиск более эффективных и безопасных соединений. Некоторые лекарственные средства применяют в сочетании для лечения сердечной недостаточности, и из положительных инотропных средств дигоксин представляет собой наиболее часто назначаемое для лечения гликозидное сердечное средство на основе наперстянки (дигиталиса), которое может улучшить работу миокарда. Хорошо известным недостатком лекарственных средств на основе наперстянки является их вызывающие аритмию побочные эффекты. Доказательства токсичности наперстянки проявляются при концентрациях в сыворотке, в два-три раза превышающих терапевтические дозы, такие как поведенческие расстройства и сердечные аритмии, которые являются характерными признаками токсичности наперстянки (Hoffman, B.F.; Bigger, J.T. Digitalis and Allied Cardiac Glycosides. In The Pharmacological Basis of Therapeutics, 8th ed.; Goodman Gilman, A.; Nies, A.S.; Rail, T.W.; Taylor, P., Eds.; PergamonPress, New York, 1990, pp. 814-839). Способность соединений на основе природной наперстянки повышать сократительную способность миокарда непосредственно связана с их карденолидной структурой, содержащей 17-лактон на 14 гидрокси-5,14-андростановом скелете. Предпосылки изобретения В области стероидных производных некоторые группы соединений согласно сообщениям обладают положительными инотропными свойствами или другой активностью, связанной с сердечно-сосудистой системой. В частности, что касается прегнановых производных, представляют интерес следующие публикации.GB 868303 раскрывает производные прегнан-20-онов, обладающие гестагенным и антифибрилляторным действием. Другие аминоалкиловые сложные эфиры 3-гидроксипрегн-5-ен-20-оновых производных раскрыты в GB 966060, как обладающие аноретической, антиаритмической и антиатерогенной активностью, а также в US 3013009, как обладающие эуритмической, противосудорожной и антигипертензивной активностью.US 5144017 раскрывает "соединения, которые связываются с рецептором дигиталиса", включающие андростановые и прегнановые производные. В соответствии с раскрытием этого изобретения связывание с рецептором дигиталиса является параллельным способности вызывать характерный клеточный ответ. Авторы этого изобретения делают акцент на способности различных классов стероидов обеспечивать производные гликозидов с типичным дигоксинподобным действием на сердце, а также другие ткани,которая, по-видимому, является важной для уменьшения токсичности этих соединений. Хотя и сообщается о некоторых андростановых производных, более интересными соединениями являются 3-гликозиды прегнановых производных. О прегнангуанигидразонах с положительным инотропным сердечным эффектом сообщается в S.Schtz, et al., Arzneimittel-Forschung, 1969, 19, 69-75. Особое значение для активности этих соединений имеет гуанилгидразоновый заместитель, поскольку "замещение гуанилгидразоновых групп другими соответствующими остатками приводит к потере активности". Другие прегнен-20-оновые производные, такие как клормадинон ацетат и мегестрол ацетат, как это сообщалось, ингибируют активность Na+,K+-АТФазы, но "сами по себе они не были способны вызывать инотропное действие" (K. Temma, et al., Research. Comm. Chem. in Pathology and Pharmacology, 1983, 41,51-63). Как сообщалось, в области 5,14-андростановых производных некоторые группы соединений обладают положительными инотропными свойствами.GB 1175219 и US 3580905 раскрывают 3-(аминоалкоксикарбонилалкиллен)стероидные производные, которые обладают дигиталисподобной активностью, при этом соотношение между дозой, которая-1 015622 вызывает токсические симптомы (приступ сердечной аритмии), и эффективной дозой сопоставимо с таким соотношением, определенным для стандартных сердечных гликозидов. Кроме того, что они не обладают явным преимуществом над гликозидами дигиталиса, эти соединения при наивысшем соотношении обеспечивают наименьшее усиление сократительной способности. 6-Гидрокси и 6-оксоандростановые производные раскрываются в EP 0825197 в качестве лигандов и ингибиторов Na+, K+-АТФазы и положительных инотропных агентов, обладающих меньшей токсичностью по сравнению с дигоксином, как было определено на основании общей токсичности у мышей. О таких же соединениях сообщается в S. De Munari, et al., J. Med. Chem. 2003, 64, 3644-3654. Подтверждение того, что высокие уровни эндогенного убаина (EO), ближайшего родственного изомера убаина, имеют отношение к гипертензии и сердечной гипертрофии и недостаточности у человека, стимулировало фармакологические исследования, направленные на разработку новых антигипертензивных средств с активностью антагонистов убаина. Патогенетические механизмы, через которые повышенные уровни EO влияют на сердечно-сосудистую систему, включают модуляцию Na-KАТФазы, ключевого фермента, ответственного за почечное тубулярное повторное поглощение натрия и активацию путей сигнальной трансдукции, принимающих участие в транскрипции генов роста. При исследовании как генетических, так и экспериментальных моделей крыс с гипертензией и сранении их с человеком было продемонстрировано, что повышенные уровни циркулирующего EO и генетический полиморфизм цитоскелетного белка аддуцина связаны с гипертензией и повышенной активностью почечного Na-K насоса. Сам по себе убаин индуцирует гипертензию и активирует почечный Na-K насос при его постоянной инфузии в низких дозах крысам (OS). В культивируемых клетках почек, либо инкубированных в течение нескольких дней с наномолярными концентрациями убаина, либо трансфицированных генетическим вариантом гипертензивного аддуцина, результаты Na-K насоса повышаются. Более того, как EO, так и аддуциновый полиморфизм влияют на сердечные осложнения, связанные с гипертензией, первый - через активацию пути сигнальной трансдукции. Как следствие этого, соединение, способное к взаимодействию с клеточными и молекулярными изменениями, поддерживаемыми EO или мутированным аддуцином, может представлять собой подходящее средство для лечения таких пациентов, у которых такой механизм находится в состоянии работы (Ferrandi M., et al., Curr Pharm Des. 2005; 11 (25): 3301-5). Как указано выше, основным свойством положительных инотропных средств является их способность к разграничению между активностью, вызывающей усиление сократительной способности миокарда и проявлениями сердечной аритмии. На сегодняшний день все еще остается потребность в создании доступных лекарственных средств,демонстрирующих лучший терапевтический индекс и/или большую продолжительность действия, поскольку оба этих фактора являются важными для лечения пациентов. Предпочтительно такие лекарственные средства должны быть предназначены для введения пероральным путем. Дегидроэпиандростероновые простые 3-аминоэфиры или сложные аминозфиры, замещенные в положении 7 кетогруппой или необязательно замещенными алкоксигруппами, раскрываются в US 2003/0054021 и WO 03/035023 A1 для косметического или терапевтического лечения кожных расстройств, связанных с ороговением. 3-Диалкиламиноэфиры и 3-диалкиламинотиоэфиры 3-гидрокси-6-метиландростанов или 3 гидрокси-6-метил-5-андростенов раскрываются в US 3210386 как гипохолестеринемические и антипаразитические средства. Краткое описание изобретения Было обнаружено, что 3-азагетероциклильные производные 5-, и/или 6-, и/или 7-замещенных андростанов и андростенов отвечают требованиям обеспечения лекарственных средсв с лучшим терапевтическим индексом и/или большей продолжительностью действия. Соединения по настоящему изобретению показывают более высокую эффективность и/или лучший терапевтический индекс и/или большую продолжительность действия; все эти факторы являются важными для многих пациентов. Соединения по настоящему изобретению имеют общую формулу (I) где A представляет собой CH X, C=N O, CR6 CH=CH , CR7 XC=O, где левый концевой атом углерода в любой из указанных групп находится в положении 3 андростанового кольца;x представляет собой число 0, или 1, или 2;B представляет собой C1-C4 линейный или разветвленный алкилен или может представлять собой простую связь так, чтобы A был непосредственно связан с азотсодержащим гетероциклом;R1 представляет собой H, C1-C6 линейный или разветвленный алкил;R2 представляет собой H, C1-C6 линейный или разветвленный алкил или OR11;, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, независимо представляют собой двойную связь, R3 и R4, при условии, чтоR3 и R4 являются одинаковыми или отличными друг от друга, представляют собой O, со значением кетогруппы, N OR12 или CR13R14;R12 представляет собой H, C1-C6 линейную или разветвленную алкильную группу, или R12 представляет собой аллил или пропаргил;R13 и R14, которые могут быть одинаковыми или отличными друг от друга, представляют собой H,C1-C6 линейную или разветвленную алкильную группу, или R13 и R14 представляют собой F; когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, независимо представляют собой простые связи, R3 и R4, которые могут быть одинаковыми или отличными друг от друга, представляют собой H, C1-C6 линейную или разветвленную алкильную группу, винил, этинил, COOR15, CN, CONR16R17, OR18, ONO2, NHCHO, NHCOCH3,CH=N OH, спироциклопропан, спирооксиран, где алкильная группа, необязательно, может быть замещена одним или несколькими гидрокси, метокси, этокси;R15 представляет собой C1-C6 линейный или разветвленный алкил;R18 представляет собой H, C1-C6 линейный или разветвленный алкил;R5 представляет собой H, когда связь в положении 17 андростанового скелета представляет собой простую связь, и R5 отсутствует, когда связь в положении 17 представляет собой двойную связь со значением кетогруппы;n представляет собой число 0 или 1;m представляет собой число 0, или 1, или 2;R15, R16 и R17, когда присутствуют в одном и том же соединении в разных положениях, могут быть представляет собойилипростую связь или одинаковыми или отличными друг от друга, символE или Z диастереоизомер, когда он связан с двойной связью, символ в положениях 4, 5, 6, 7 и 17 представляет собой простую или двойную связь, и когда он представляет собой простую экзоциклическую связь в положениях 6, 7 или 17, он может представлять собойилипростую связь; при следующих условиях: когда A представляет собой CR7 XC=O, где R7 представляет собой водород и X представляет собой кислород, и когда A представляет собой CH X, где X представляет собой кислород, тогда символ в положении 6 связывания с R3 представляет собой простую связь, или когда символ в положении 6 связывания с R3 представляет собой двойную связь, R4 является отличным от кислорода, и символ в положении 7 связывания с R4 означает двойную связь, или R4 является отличным от OR18, при этом символ в положении 7 связывания с R4 означает простую связь, что по меньшей мере один из 2 3 4R , R и R в одной и той же структуре является отличным от водорода; и их фармацевтически приемлемые соли. Фармацевтически приемлемые соли представляют собой соли, которые сохраняют биологическую активность основания и получены из таких известных фармакологически приемлемых кислот, как, например, хлористо-водородная, бромисто-водородная, серная, фосфорная, азотная, фумаровая, янтарная,щавелевая, яблочная, винная, малеиновая, лимонная, метансульфоновая или бензойная кислота, и других, хорошо известных из уровня техники.C1-C6 алкильные группы могут представлять собой группы с разветвленной цепью, линейной цепью или циклические группы, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, циклопентил или циклогексил.C1-C4 алкилен предпочтительно представляет собой метилен, этилен, триметилен, пропилен, тетраметилен или диметилэтилен.C2-C6 ацильные группы могут представлять собой группы с разветвленной цепью, линейной цепью или циклические группы и предпочтительно представляют собой ацетил, пропионил, бутирил, пивалоил,циклопентанкарбонил. Следующей целью настоящего изобретения является применение указанных соединений общей формулы (I) в качестве лекарственного средства, в частности, для получения лекарственного средства,полезного для лечения сердечно-сосудистых заболеваний, таких как сердечная недостаточность и гипертензия.-3 015622 Подробное описание изобретения В соответствии с одним предпочтительным вариантом воплощения настоящего изобретения соединения формулы (I) представляют собой такие, в которых символы R2 и R4 представляют собой H, символR3 представляет собой кислород со значением кето, метилен, дифторметилен, гидроксиимино, метоксиимино, когда символы в положении 6 связывания с R3 и в положении 17 представляют собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3(S)-ил)-(Z)-винил], 3-[2-(азетидин-3-ил)-(Z)-винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. Во втором предпочтительном варианте воплощения настоящего изобретения соединения формулы (I) представляют собой такие, в которых символы R2 и R4 представляют собой H, символ R3 представляет собой -гидрокси, -метил, -карбамоил, -метоксикарбонил, -гидроксиметил, -(2-гидроксиэтил), метоксиметил, -нитрокси, -формиламино, -этинил, -гидрокси, символ в положении 17 представляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3-[2-(азетидин-3-ил)-(Z)винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В третьем предпочтительном варианте воплощения настоящего изобретения соединения формулы (I) представляют собой такие, в которых символ R2 представляет собой гидрокси, символ R4 представляет собой H, символ R3 представляет собой кислород со значением кето, метилен, дифторметилен, гидроксиимино, метоксиимино, когда символы в положении 6 связывания с R3 и в положении 17 представляют собой двойные связи, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинил-окси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3-[2-(азетидин-3-ил)-(Z)винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В четвертом предпочтительном варианте воплощения настоящего изобретения соединения формулы (I) представляют собой такие, в которых символ R2 представляет собой гидрокси, символы R4 представляют собой H, символ R3 представляет собой -гидрокси, -метил, -карбамоил, метоксикарбонил, -гидроксиметил, -метоксиметил, -нитрокси, -формиламино, -этинил, символ в положении 17 представляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3-[2-(азетидин-3-ил)-(Z)винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В пятом предпочтительном варианте воплощения настоящего изобретения соединения формулы (I) представляют собой такие, в которых символы R2 и R3 представляют собой H, символ R4 представляет собой кислород со значением кето, метилен, дифторметилен, гидроксиимино, метоксиимино, когда символы в положении 7 связывания с R4 и в положении 17 представляют собой двойную связь, тогда как другие символы представляют собой простые связи и символ[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)-винил], 3-[2-(азетидин-3-ил)-(Z)винил]. В шестом предпочтительном варианте воплощения настоящего изобретения соединения формулы(I) представляют собой такие, в которых символы R2 и R3 представляют собой H, символ R4 представляет собой -гидрокси, -метил, -карбамоил, -метоксикарбонил, -гидроксиметил, -метоксиметил, нитрокси, -формиламино, -этинил, -гидрокси, -метил, -карбамоил, -метоксикарбонил, гидроксиметил, -метоксиметил, -нитрокси, -формиламино, -этинил, символ в положении 17 представляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[3-(RS)-пирролидинилтио], 3-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)винил], 3-[2-(азетидин-3-ил)-(Z)-винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В седьмом предпочтительном варианте воплощения настоящего изобретения соединения формулы(I) представляют собой такие, в которых символ R2 представляет собой гидрокси, символы R3 представляют собой H, символ R4 представляет собой кислород со значением кето, метилен, гидроксиимино, метоксиимино, когда символ в положении 7 связывания с R4 и в положении 17 представляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[3-(RS)-пирролидинилтио], 3-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)винил], 3-[2-(азетидин-3-ил)-(Z)-винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В восьмом предпочтительном варианте воплощения настоящего изобретения соединения формулы(I) представляют собой такие, в которых символ R2 представляет собой гидрокси, символы R3 представляют собой H, символ R4 представляет собой -гидрокси, -метил, -карбамоил, -метоксикарбонил, гидроксиметил, -метоксиметил, -нитрокси, -формиламино, -этинил, -метил, -карбамоил, метоксикарбонил, -гидроксиметил, -метоксиметил, -нитрокси, -формиламино, -этинил, символ в положении 17 представляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[3-(RS)-пирролидинилтио], 3-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)винил], 3-[2-(азетидин-3-ил)-(Z)-винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В девятом предпочтительном варианте воплощения настоящего изобретения соединения формулы(I) представляют собой такие, в которых символ R2 представляет собой гидрокси, символы R3 и R4 представляют собой H, символ в положении 17 представляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[3-(RS)-пирролидинилтио], 3-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)винил], 3-[2-(азетидин-3-ил)-(Z)-винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. В десятом предпочтительном варианте воплощения настоящего изобретения соединения формулы (I) представляют собой такие, в которых символ R2 представляет собой H, символ R3 представляет собой в положении 17 представгидроксиметил и R4 представляет собой -гидрокси или кето, когда символ ляет собой двойную связь, тогда как другие символы представляют собой простые связи и символ представляет собой (R-3-пирролидинилокси)имино, (S-3-пирролидинилокси)имино, (RS-3-пирролидинилокси)имино, 3-азетидинилоксиимино, 3-[3-(S)-пирролидинилтио], 3-[3-(R)-пирролидинилтио], 3[3-(RS)-пирролидинилтио], 3-[2-(пирролидин-3-(R)-ил)-(Z)-винил], 3-[2-(пирролидин-3-(S)-ил)-(Z)винил], 3-[2-(азетидин-3-ил)-(Z)-винил], 3-[2-(пиперидин-4-ил)-(Z)-винил]. Предпочтительными примерами конкретных соединений (I) по настоящему изобретению являются следующие:EZ 3-(R-3-пирролидинилокси)имино-5-гидроксиандростан-17-он,EZ 3-(S-3-пирролидинилокси) имино-5-гидроксиандростан-17-он,EZ 3-(RS-3-пирролидинилокси)имино-5-гидроксиандростан-17-он,EZ 3-(3-азетидинилоксиимино)-5-гидроксиандростан-17-он,3-[3-(S)-пирролидинилтио]-5-гидроксиандростан-17-он,3-[3-(R)-пирролидинилтио]-5-гидроксиандростан-17-он,3-[3-(RS)-пирролидинилтио]-5-гидроксиандростан-17-он,3-[2-(пирролидин-3-(R)-ил)-(Z)-винил]-5-гидроксиандростан-17-он,3-[2-(пирролидин-3-(S)-ил)-(Z)-винил]-5-гидроксиандростан-17-он,3-[2-(азетидин-3-ил)-(Z)-винил]-5-гидроксиандростан-17-он,3-[2-(пиперидин-4-ил)-(Z)-винил]-5-гидроксиандростан-17-он,EZ 3-(R-3-пирролидинилокси)имино-6-гидроксиметиландростан-7,17-дион,EZ 3-(S-3-пирролидинилокси)имино-6-гидроксиметиландростан-7,17-дион,EZ 3-(RS-3-пирролидинилокси)имино-6-гидроксиметиландростан-7,17-дион,EZ 3-(3-азетидинилоксиимино)-6-гидроксиметиландростан-7,17-дион,3-[3-(S)-пирролидинилтио]-6-гидроксиметиландростан-7,17-дион,3-[3-(R)-пирролидинилтио]-6-гидроксиметиландростан-7,17-дион,3-[3-(RS)-пирролидинилтио]-6-гидроксиметиландростан-7,17-дион,3-[2-(пирролидин-3-(R)-ил)-(Z)-винил]-6-гидроксиметиландростан-7,17-дион,3-[2-(пирролидин-3-(S)-ил)-(Z)-винил]-6-гидроксиметиландростан-7,17-дион,3-[2-(азетидин-3-ил)-(Z)-винил]-6-гидроксиметиландростан-7,17-дион,3-[2-(пиперидин-4-ил)-(Z)-винил]-6-гидроксиметиландростан-7,17-дион,EZ 3-(R-3-пирролидинилокси)имино-6-гидроксиметил-7-гидроксиандростан-17-он,EZ 3-(S-3-пирролидинилокси)имино-6-гидроксиметил-7-гидроксиандростан-17-он,EZ 3-(RS-3-пирролидинилокси)имино-6-гидроксиметил-7-гидроксиандростан-17-он,EZ 3-(3-азетидинилоксиимино)-6-гидроксиметил-7-гидроксиандростан-17-он,3-[3-(S)-пирролидинилтио]-6-гидроксиметил-7-гидроксиандростан-17-он,3-[3-(R)-пирролидинилтио]-6-гидроксиметил-7-гидроксиандростан-17-он,3-[3-(RS)-пирролидинилтио]-6-гидроксиметил-7-гидроксиандростан-17-он,3-[2-(пирролидин-3-(R)-ил)-(Z)-винил]-6-гидроксиметил- 7-гидроксиандростан-17-он,3-[2-(пирролидин-3-(S)-ил)-(Z)-винил]-6-гидроксиметил- 7-гидроксиандростан-17-он,3-[2-(азетидин-3-ил)-(Z)-винил]-6-гидроксиметил-7-гидроксиандростан-17-он,3-[2-(пиперидин-4-ил)-(Z)-винил]-6-гидроксиметил-7-гидроксиандростан-17-он,и соответствующие чистые E и Z изомеры смесей EZ, указанные выше. Настоящее изобретение, кроме того, обеспечивает способ получения соединений общей формулы(I), исходя из соединений общей формулы (II) имеют значения, определенные выше, и Q и Z вместе представляют согде символы R2, R3, R4, R5 и бой кетогруппу (=O), когда символы взяты вместе со значением двойной связи или когда символы представляют собой простые связи, Q представляет собой гидрокси, меркапто, NHR8, CHO или удаляемую группу, когда Z представляет собой водород, или Q представляет собой гидрокси, меркапто, NHR8,когда Z представляет собой C1-C6 линейную или разветвленную алкильную группу. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой C=N O, можно получить из соединений формулы (II), где Q и Z вместе представляют собой кетогруппу (=O), когда символы взяты вместе со значением двойной связи, путем взаимодействия с соединениями общей формулы (III) где R1, B, Y, m и n имеют значения, определенные выше, в форме свободного основания или соли, такой-8 015622 как, например, дигидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан,метанол, этанол, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником. Реакцию можно осуществлять в присутствии основания,такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как хлористо-водородная кислота, бромисто-водородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, вторичный кислый фосфат натрия или калия, первичный кислый фосфат натрия или калия. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CR6 CH=CH , CR6 CH2, где R6 представляет собой гидрокси,можно получить из соединений формулы (II), где Q и Z вместе представляют собой кетогруппу (=O),когда символы взяты вместе со значением двойной связи, путем взаимодействия с соединениями общей формулы (IV) и (V) где B, Y, m и n имеют значения, определенные выше, Met представляет собой атом металла и T может отсутствовать или представляет собой галоген или атом другого металла в зависимости от состояния окисления атома металла Met, такого как, например, Li, MgCl, MgBr, MgI и CuLi, и W представляет собой R1N или PGN, где R1 представляет собой линейный или разветвленный алкил или фенилалкил и PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, с получением соединений общей формулы (I) непосредственно или после преобразования защитной группы. Металлоорганическое взаимодействие можно осуществить в растворителе, таком как диоксан, тетрагидрофуран,1,2-диметоксиэтан, диэтиловый эфир, гексан, толуол или их смеси, при температуре в пределах от -70C до температуры кипения с обратным холодильником. Реакцию можно осуществить в присутствии соли переходного металла, такой как, например, Li2CuCl4, CeCl3. Когда W содержит защитную группу, эту защитную группу можно удалить после металлоорганического взаимодействия в соответствии с общепринятыми процедурами, описанными в органической химии, с получением соединений общей формулы (I). Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CH X, где X представляет собой NR8, можно получить из соединений формулы (II), где Q и Z вместе представляют собой кетогруппу (=O), когда символы взяты вместе со значением двойной связи, путем взаимодействия с соединениями общей формулы (VI) где W представляет собой R1N или PGN, и R1, PG, Y, m, n, R8 и B имеют значения, определенные выше, в форме свободного основания или соли, в растворителе, таком как диоксан, тетрагидрофуран, 1,2 диметоксиэтан, метанол, этанол, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником, в присутствии восстановителя, такого как,например, борогидрид натрия или цианоборогидрид натрия. Реакцию можно осуществлять в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как хлористо-водородная кислота, бромисто-водородная кислота,уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, вторичный кислый фосфат натрия или калия, первичный кислый фосфат натрия или калия, вплоть до достижения желаемого значения pH. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CH X, где X представляет собой O, S или NR8, можно получить из соединений формулы (II), где Q представляет собой гидрокси, меркапто, NHR8, когда Z представляет собой водород, путем взаимодействия с соединениями общей формулы (VII) где W представляет собой R1N или PGN, и R1, Y, m, n и B имеют значения, определенные выше, PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, с получением соединений общей формулы (I) непосредственно или после преобразования группы PGN, и LG представляет собой удаляемую группу, такую как, например, хлор, бром, иод, мезилокси, п-толуолсульфонилокси,трифторметансульфонилокси. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир,-9 015622 диоксан, тетрагидрофуран, 1,2-диметоксиэтан, N,N-диметилформамид, диметилсульфоксид, толуол или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником. Реакцию можно осуществить в присутствии основания, такого как, например, гидроксид натрия или калия,карбонат натрия или калия, гидрокарбонат натрия или калия,гидрид натрия или калия, метоксид натрия или калия, трет-бутоксид натрия или калия, и, необязательно, соли, такой как, например, иодид натрия или калия. Реакцию можно осуществить также в смеси органического растворителя, такого как, например, дихлорметан, хлорбензол, толуол, гексан и воды, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, например, тетрабутиламмонийхлорид или бромид или иодид или бисульфат, при температуре в пределах от 0C до температуры кипения смеси с обратным холодильником. имеют значения, опредеСоединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и ленные выше, и A представляет собой CH X, где X представляет собой O, S или NR8, можно получить из соединений формулы (II), где Q представляет собой удаляемую группу, такую как, например, хлор,бром, иод, мезилокси, п-толуолсульфонилокси, трифторметансульфонилокси, и Z представляет собой водород, путем взаимодействия с соединениями общей формулы (VIII) где W представляет собой R1N, PGN и R1, Y, m, n и B имеют значения, определенные выше, PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, и X представляет собойO, S или NR8, где R8 имеет значения, определенные выше, с получением соединений общей формулы (I) непосредственно или после преобразования группы PGN. Реакцию можно осуществить в тех же условиях, которые указаны выше для взаимодействия соединений общей формулы (II) с соединениями общей формулы (VII). Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CR6 CH=CH , где R6 представляет собой водород, можно получить из соединений общей формулы (II), где Q представляет собой CHO и Z представляет собой водород, путем взаимодействия с соединениями общей формулы (IX) где W представляет собой R1N, PGN и R1, Y, m, n и B имеют значения, определенные выше, PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, R19 представляет собойC1-C6 линейный или разветвленный алкил или арил, такой как, например, метил, н-бутил, фенил, отолил, и Hal представляет собой галоген, такой как, например, хлор, бром, иод. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол или их смеси, при температуре в пределах от -78C до температуры кипения с обратным холодильником. Реакцию осуществляют в присутствии основания, такого как, например, гидрид натрия или калия, метоксид натрия или калия, трет-бутоксид натрия или калия. Реакцию можно осуществить также в смеси органического растворителя, такого как, например, дихлорметан, хлорбензол, толуол, гексан, и воды, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, например, тетрабутиламмонийхлорид или бромид или иодид или бисульфат, при температуре в пределах от 0C до температуры кипения смеси с обратным холодильником. имеют значения, опредеСоединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и ленные выше, и A представляет собой CR7 XC=O, где R7 представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, X представляет собой O, S или NR8, можно получить из соединений формулы (II), где Q представляет собой гидрокси, меркапто, NHR8 и Z представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, путем взаимодействия с соединениями общей формулы (X) где W представляет собой R1N, PGN и R1, Y, m, n и B имеют значения, определенные выше, PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, с получением соединений общей формулы (I) непосредственно или после преобразования группы PGN. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан,толуол, ацетон, этилацетат, дихлорметан, хлороформ, N,N-диметилформамид, диметилсульфоксид, вода или их смеси, при температуре в пределах от -30C до температуры кипения с обратным холодильником,- 10015622 в присутствии агента конденсации, такого как N,N'-дициклогексилкарбодиимид, гидрохлорид N-этил-N'(3-диметиламинопропил)карбодиимида, SOCl2, POCl3 или PCl5, или соединения формулы (X) предварительно можно обработать SOCl2, POCl3, PCl5, необязательно, в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, триэтиламин, пиридин, или 4-диметиламинопиридин. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CR7 X(C=O)X', где R7 представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, X представляет собой O, S или NR8 и X' представляет собой NH, можно получить из соединений формулы (II), где Q представляет собой гидрокси, меркапто,NHR8 и Z представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, путем взаимодействия с соединениями общей формулы (XI) где W представляет собой R1H, PGN и R1, Y, m, n и B имеют значения, определенные выше, PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, с получением соединений общей формулы (I) непосредственно или после преобразования группы PGN. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан,толуол, ацетон, этилацетат, дихлорметан, хлороформ, N,N-диметилформамид, диметилсульфоксид, этанол, метанол, вода или их смеси, при температуре в пределах от -30C до температуры кипения с обратным холодильником. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CR7 X(C=O)X', где R7 представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, X представляет собой O, S или NR8 и X' представляет собой O, S, NR8, можно получить из соединений формулы (II), где Q представляет собой гидрокси, меркапто, NHR8 и Z представляет собой водород или C1-C6 линейную или разветвленную алкильную группу,путем взаимодействия с соединениями общей формулы (XII) где W представляет собой R1N, PGN, и R1, Y, m, n, B и X' имеют значения, определенные выше, PG представляет собой защитную группу, такую как, например, бензил, Boc, Cbz, ацетил, с получением соединений общей формулы (I) непосредственно или после преобразования группы PGN. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксизтан,толуол, ацетон, этилацетат, дихлорметан, хлороформ, N,N-диметилформамид, диметилсульфоксид или их смеси, при температуре в пределах от -60C до температуры кипения с обратным холодильником с использованием карбонил-донорной группы, такой как, например, карбонилдиимидазол, фосген, трифосген, в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, триэтиламин, пиридин, или 4-диметиламинопиридин. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и имеют значения, определенные выше, и A представляет собой CH X, CR7 XC=O, CR7 XC(=O)X', где X и X' представляют собой NR8 и R8 представляет собой C1-C6 линейную или разветвленную алкильную группу, можно получить из соединений формулы (I), где A представляет собой CH X, CR7 XC=O, CR7 XC(=O) X', гдеX и X' представляют собой NH, путем алкилирования при помощи C1-C6 алкил-LG, где LG представляет собой удаляемую группу, такую как, например, хлор, бром, иод, мезилокси, п-толуолсульфонилокси,трифторметансульфонилокси. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир,диоксан, тетрагидрофуран, 1,2-диметоксиэтан, N,N-диметилформамид, диметилсульфоксид, толуол или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником, необязательно, в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, гидрид натрия или калия, метоксид натрия или калия,трет-бутоксид натрия или калия, и, необязательно, соли, такой как, например, иодид натрия или калия. Реакцию можно осуществить также в смеси органического растворителя, такого как, например, дихлорметан, хлорбензол, толуол, гексан и вода, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, например, тетрабутиламмонийхлорид, или бромид, или иодид, или бисульфат, при температуре в пределах от 0C до температуры кипения смеси с обратным холодильником. имеют значения, опредеСоединения общей формулы (I), где символы R1, R2, R3, R4, R5, B, Y и ленные выше, и A представляет собой CH X, где X представляет собой NR8 и R8 представляет собойC1-C6 линейную или разветвленную алкильную группу, можно получить из соединений формулы (I), гдеA представляет собой CH X и X представляет собой NH, путем взаимодействия с CH2O или C1-C5 ли- 11015622 нейным или разветвленным алкилом-СНО в растворителе, таком как диоксан, тетрагидрофуран, 1,2 диметоксиэтан, метанол, этанол, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником, в присутствии восстановителя, такого как,например, борогидрид натрия или цианоборогидрид натрия. Реакцию можно осуществить в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как хлористо-водородная кислота, бромисто-водородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, вторичный кислый фосфат натрия или калия, первичный кислый фосфат натрия или калия, вплоть до достижения желаемого значения pH. Соединения общей формулы (I), где символы R1, R2, R3, R4, R5, B и имеют значения, определенные выше, и A представляет собой CH X, где X представляет собой S(O)x и х имеет значение 1 или 2, можно получить из соединений формулы (I), где A представляет собой CH X, где X представляет собой S(O)x и x имеет значение 0, с использованием одного из реагентов, описанных в литературе для такого типа окисления, такого как, например, пероксид водорода, метапериодат натрия, третбутилгипохлорит, хлорит натрия, гипохлорит натрия, перборат натрия, N-метилморфолин-N-оксид и периодат тетрапропиламмония, гидроперсульфат калия и перкислоты; в соответствии с реакционными условиями, такими как температура и эквиваленты окислителя, окисление может дать соединения общей формулы (I), описанной выше, где X имеет значение 1 или 2. Соединения общей формулы (I), где символы A, B, R1, R2, R3, R4, R5 и Y имеют значения, определенные выше, и представляет собой простую связь, можно получить путем восстановления соответствующих соединений общей формулы (I), где символ представляет собой двойную связь, путем каталитического гидрирования либо с использованием газообразного водорода, либо в условиях переноса водорода, в присутствии металлического катализатора, такого как Pd/C, PtO2, Pt, Pt/C, никель Ренея. В качестве агента переноса водорода можно использовать формиат аммония, гипосульфит натрия или циклогексадиен. Реакцию можно осуществлять в растворителе, таком как, например, этанол, метанол, этилацетат, диоксан, тетрагидрофуран, уксусная кислота, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником, при давлении в пределах от атмосферного давления до 10 атм. В соответствии с используемым субстратом и условиями гидрирование может селективно воздействовать на одну или несколько двойных связей. Соединения общей формулы (I), где символы B, R1, R2, R3, R4, R5, Y и имеют значения, определенные выше, и A представляет собой CR6 CH=CH , CR6 CH2, где R6 представляет собой водород,можно получить из соответствующих соединений общей формулы (I), где R6 представляет собой гидрокси, путем деоксигенирования с использованием одного из способов, описанных в литературе для реакций такого типа, таких как, например, взаимодействие с тиокарбонилдиимидазолом и три-нбутилстаннаном, дисульфидом углерода в присутствии основания, с последующим взаимодействием с метилиодидом и обработкой три-н-бутилстаннаном, NaBH3CN и ZnI2, NaBH4 в уксусной кислоте. имеют значения, опСоединения общей формулы (I), где символы A, B, R1, R2, R3, R4, R5, Y и ределенные выше, R1 представляет собой C(=NR9)NHR10, где R9 и R10 имеют значения, указанные выше,можно получить из соответствующих соединений общей формулы (I), где R1 представляет собой водород, путем взаимодействия с соединениями общей формулы (XIII)TC(=NR9)NHR10 (XIII) 9 10 где R и R имеют значения, указанные выше, и T представляет собой удаляемую группу, такую как,например, метилтио, 1-пиразолил. Реакцию можно осуществить в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником, необязательно в присутствии основания, такого как гидроксид натрия или калия, триэтиламин, диэтилизопропиламин. Соединения общей формулы (I), где символы A, B, R1, R2, R5, Y и имеют значения, определенные выше, и R3 и R4 независимо представляют собой N OR12, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, независимо представляют собой двойные связи, можно получить из соответствующих соединений общей формулы (I),где R3 и R4, при условии, что указанные R3 и R4 являются одинаковыми или отличными друг от друга,представляют собой O, со значением кетогруппы, с использованием одного из способов, описанных в литературе для таких взаимодействий, таких как, например, посредством взаимодействия с соединениями общей формулы H2NOR12, где R12 имеет значения, определенные выше, в форме свободного основания или соли, такой как, например, гидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран,1,2-диметоксиэтан, метанол, этанол, N,N-диметилформамид, пиридин, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником. Реакцию можно осуществлять в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как хлористо-водородная кислота, бромистоводородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, вторичный кислый фосфат натрия или калия, первичный кислый фосфат натрия или калия.- 12015622 имеют значения, определенСоединения общей формулы (I), где символы A, B, R1, R2, R5, Y и ные выше, и R3 и R4 независимо представляют собой CR13R14, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, можно получить из соответствующих соединений общей формулы (I), где R3 и R4,при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой O, со значением кетогруппы, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с соединениями общей формулы (XIV) илиR13R14CH-P(=O)(OR19)2 (XV) 13 14 19 где R , R и R имеют значения, определенные выше, и Hal представляет собой галоген, такой как, например, хлор, бром, иод. Взаимодействие с соединениями общей формулы (XIV) или (XV) можно осуществить в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан,толуол, N,N-диметилформамид, диметилсульфоксид, н-пентан или их смеси, при температуре в пределах от -78C до температуры кипения с обратным холодильником. Реакцию осуществляют в присутствии основания, такого как, например, гидрид натрия или калия, метоксид натрия или калия, трет-бутоксид натрия или калия. Реакцию можно осуществить также в смеси органического растворителя, такого как,например, дихлорметан, хлорбензол, толуол, гексан, пентан, и воды, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, например, тетрабутиламмонийхлорид или бромид или иодид или бисульфат, при температуре в пределах от 0C до температуры кипения с обратным холодильником смеси. Взаимодействие с соединениями общей формулы (XV) можно осуществить также в воде или в смеси указанных выше растворителей с водой, при температуре в пределах от 0C до температуры кипения с обратным холодильником. Эти взаимодействия можно осуществить в присутствии основания, такого как, например, гидроксид натрия или калия, гидрокарбонат натрия или калия, карбонат натрия или калия, триэтиламин, диизопропилэтиламин, необязательно в присутствии соли, такой как хлорид лития. Соединения общей формулы (I), где символы A, B, R1, R2, R5, Y и имеют значения, определенные выше, и R3 и R4 независимо представляют собой C1-C6 линейные или разветвленные алкильные группы, замещенные гидроксигруппой, в частности, представляют собой гидроксиметил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соответствующих соединений общей формулы (I), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга,представляют собой CR13R14, где R13 и R14 представляют собой атомы водорода, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4,представляют собой двойные связи, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с бораном, таким как, например,боран или его комплексы с диметиламином или диметилдисульфидом, 9-борабициклононан, диизопиноканфенилборан, диизоамилборан, в эфирном растворителе, таком как, например, диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, с последующей обработкой водно-щелочным раствором пероксида водорода или перборатом натрия. С использованием таких же способов, также могут быть получены соединения общей формулы (I),где символы A, B, R1, R2, R5, Y и имеют значения, определенные выше, и R3 и R4 независимо представляют собой C1-C6 линейные или разветвленные алкильные группы, замещенные гидроксигруппой, в частности гидроксиэтил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, исходя из соответствующих соединений общей формулы (I), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой винил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи. Соединения общей формулы (I), где заместители R3 и R4 независимо представляют собой винил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить путем взаимодействия соединений общей формулы (I), где R3 и R4 независимо представляют собой CHO, с метилтрифенилфосфонийхлоридом или бромидом или иодидом, с использованием тех же реакционных условий, которые были описаны выше, используя соединения общей формулы (XIV) или (XV). Соединения общей формулы (I), где символы A, B, R1, R2, R5, Y и имеют значения, определенные выше, и R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, независимо представляют собой O, со значением кетогруппы, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, можно получить из соответствующих соединений общей формулы (I), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой гидрокси, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом- 13015622 углерода в положении 7 с R4, представляют собой простые связи, с использованием одного из реагентов,описанных в литературе для таких окислений, такого как, например, иодоксибензойная кислота, периодинан Dess-Martin, оксалилхлорид и триэтиламин, CrO3 в пиридине или в серной кислоте и ацетоне,хлорхромат пиридиния, дихромат пиридиния. Соединения общей формулы (II), определенной выше, можно получить, исходя из известных соединений с подходящей функциональной группой в разных положениях, которые уже были описаны в литературе, или из коммерчески доступных соединений, таких как, например, 3-гидроксиандрост-5-ен 17-он, 3-гидроксиандрост-5-ен-7,17-дион, следуя общим процедурам, указанным ниже. Следующий перечень соединений является примером, не ограничивающим объем настоящего изобретения, описанных в литературе способов получения соединений (II): андростан-3,6,17-трион, 6-гидроксиандростан 3,17-дион, 6-гидроксиандростан-3,17-дион, 3,3:17,17-бис(этилендиокси)андростан-6-ол и 3,3:17,17 бис(этилендиокси)андростан-6-он, описанные в S. De Munari et al., J. Med. Chem., 2003, 3644; 3 ацетоксиандрост-5-ен-7,17-дион, описанный в E.S. Arsenou et al., Steroids 68 (2003) 407-4143; 3,3:17,17 бис(этилендиокси)-5-андростен-7-он, описанный в Pui-Kai Li and R. W. Brueggemeier, J. Med. Chem. 1990,33, 101-105. Соединения общей формулы (II), где R2 и R4 независимо представляют собой C1-C6 линейный или разветвленный алкил, можно получить из соединений общей формулы (II), где R2 и R4 представляют собой водород и R3 представляет собой кислород, когда символ, связывающий R3 с андростановым скелетом, представляет собой двойную связь, символ, связывающий R4 с андростановым скелетом,представляет собой простую связь, и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, путем обработки основанием, таким как, например, гидрид натрия или калия, метоксид натрия или калия, трет-бутоксид натрия или калия, диизопропиламид лития, в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол, N,N-диметилформамид, диметилсульфоксид или их смеси, при температуре в пределах от -78C до температуры кипения с обратным холодильником, с последующим гашением C1-C6 линейным или разветвленным алкилом-LG, где LG представляет собой удаляемую группу, такую как, например, хлор, бром, иод, мезилокси, птолуолсульфонилокси, трифторметансульфонилокси, при температуре в пределах от -78C до температуры кипения с обратным холодильником. Реакцию можно осуществить также в смеси органического растворителя, такого как, например, дихлорметан, хлорбензол, толуол, гексан, и воды, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, например, тетрабутиламмонийхлорид или бромид или иодид или бисульфат, при температуре в пределах от 0C до температуры кипения смеси с обратным холодильником. С использованием таких же реакций, которые описаны выше, можно получить соединения общей формулы (II), где R3 представляет собой C1-C6 линейный или разветвленный алкил, путем обработки соответствующих соединений общей формулы (II), где R3 представляет собой водород и R4 представляет собой кислород, когда символ, связывающий R3 с андростановым скелетом, представляет собой простую связь, символ, связывающий R4 с андростановым скелетом, представляет собой двойную связь,и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи. Соединения общей формулы (II), где R2 представляет собой OR11, можно получить путем обработки соединения общей формулы (II), где R2 представляет собой гидрокси, когда символы в положениях 4-5 и 5-6 представляют собой простые связи, соединениями общей формулы R11-LG, где LG представляет собой удаляемую группу, такую как, например, хлор, бром, иод, мезилокси, п-толуолсульфонилокси,трифторметансульфонилокси. Реакцию можно осуществить в растворителе, таком как диэтиловый эфир,диоксан, тетрагидрофуран, 1,2-диметоксиэтан, N,N-диметилформамид, диметилсульфоксид, толуол или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником, необязательно в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, гидрид натрия или калия, метоксид натрия или калия,трет-бутоксид натрия или калия, и, необязательно, соли, такой как, например, иодид натрия или калия. Реакцию можно осуществить также в смеси органического растворителя, такого как, например, дихлорметан, хлорбензол, толуол, гексан, и воды, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, например, тетрабутиламмонийхлорид или бромид или иодид или бисульфат, при температуре в пределах от 0C до температуры кипения смеси с обратным холодильником. С использованием таких же реакций, которые описаны выше, можно получить соединения общей формулы (II), где R3 и R4 независимо представляют собой OR18, путем обработки соединений общей формулы (II), где R3 и R4 представляют собой гидрокси, когда символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, соединениями общей формулы R18-LG. С использованием таких же реакций, которые описаны выше, можно получить соединения общей формулы (II), где R5 представляет собой C1-C6 линейную или разветвленную алкильную группу, путем обработки соединений общей формулы (II), где R5 представляет собой H, когда символ в положениях 17 представляет собой простую связь, соединениями общей формулы C1-C6 линейный или разветвленный алкил-LG.- 14015622 Соединения общей формулы (II), где R2, R3 и R4 независимо представляют собой ONO2 можно получить путем обработки соединений общей формулы (II), где R2, R3 и R4 независимо представляют собой гидрокси, когда символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, азотной кислотой в уксусном ангидриде или уксусной кислоте, азотной кислотой и серной кислотой в дихлорметане, нитрозилфторидом или тетрафлуоборат в ацетонитриле. Соединения общей формулы (II), где заместители R3 и R4 независимо представляют собой N OR12,где связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, можно получить путем обработки соединений общей формулы (II), где R3 и R4 независимо представляют собой кислород, со значением кетогрупп, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, путем взаимодействия с соединениями общей формулы H2NOR12, где R12 имеет значения, определенные выше, в форме свободного основания или соли, такой как, например, гидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2 диметоксиэтан, метанол, этанол, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником. Реакцию можно осуществлять в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как хлористо-водородная кислота, бромисто-водородная кислота,уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, вторичный кислый фосфат натрия или калия, первичный кислый фосфат натрия или калия. Соединения общей формулы (II), где заместители R3 и R4 независимо представляют собой CR13R14 и связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, можно получить путем взаимодействия соединений общей формулы (II),где R3 и R4 независимо представляют собой кислород, со значением кетогрупп, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, с соединениями общей формулы (XIV) или (XV)R13R14CH-P(=O)(OR19)2 (XV) 13 14 19 где R , R и R имеют значения, определенные выше и Hal представляет собой галоген, такой как, например, хлор, бром, иод, в тех же реакционных условиях, которые были описаны выше для соединений общей формулы (XIV) или (XV). Соединения общей формулы (II), где заместители R3 и R4 независимо представляют собой C1-C6 линейные или разветвленные алкильные группы, замещенные гидроксигруппой, в частности, представляют собой гидроксиметил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой CR13R14, где R13 и R14 представляют собой атомы водорода, ко, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в гда связи положении 7 с R4, представляют собой двойные связи, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, способ с использованием борана, такого как, например, боран или его комплексы с диметиламином или диметилдисульфидом, 9 борабициклононан, диизопиноканфенилборан, диизоамилборан, в эфирном растворителе, таком как, например, диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, с последующей обработкой водно-щелочным раствором пероксида водорода или перборатом натрия. С использованием таких же способов, также могут быть получены соединения общей формулы (II),где заместители R3 и R4 независимо представляют собой C1-C6 линейные или разветвленные алкильные группы, замещенные гидроксигруппой, в частности, представляют собой гидроксиэтил, когда связиR4, представляют собой простые связи, исходя из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой винил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи. Соединения общей формулы (II), где заместители R3 и R4 независимо представляют собой винил,когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить путем взаимодействия соединений общей формулы (II), где R3 и R5 независимо представляют собой CHO, с метилтрифенилфосфонийхлоридом или бромидом или иодидом с использованием тех же реакционных условий, которые были описаны выше, используя соединения общей формулы (XIV) или (XV). Соединения общей формулы (II), где заместители R3 и R4 независимо представляют собой этинил,когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить путем взаимодействия соединений общей формулы (II), где R3 и R4 независимо представляют собой CHO, с хлорметилтрифенил- 15015622 фосфонийхлоридом, или бромидом, или иодидом и н-бутилитием, при температуре от -78C до комнатной температуры с последующей дальнейшей обработкой н-бутиллитием. Соединения общей формулы (II), где заместители R3 и R4 независимо представляют собой C1-C6 линейные или разветвленные алкильные группы, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой CR13R14, где R13 и R14 представляют собой водород или C1-C5 линейные или разветвленные алкильные группы, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4,представляют собой двойные связи, с использованием одного из способов, описанных в литературе для таких взаимодействий, например, путем каталитического гидрирования, в реакционных условиях, описанных выше для подобного преобразования соединений общей формулы (I). Соединения общей формулы (II), где R3 и R4 независимо представляют собой C1-C6 линейные или разветвленные алкильные группы, в частности метил и этил, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой гидроксиметил и 2 гидроксиэтил, с использованием одного из способов, описанных в литературе для таких взаимодействий,например, путем обработки мезил или тозилхлоридом, в присутствии основания, с последующим восстановлением при помощи гидрида, такого как, например, борогидрид натрия или литийалюминийгидрид,или гидрокси путем деоксигенирования с использованием одного из способов, описанных в литературе для реакций такого типа, такого как, например, взаимодействие с тиокарбонилдиимидазолом и три-нбутилстаннаном, дисульфидом углерода в присутствии основания, с последующим взаимодействием с метилиодидом и обработкой три-н-бутилстаннаном, NaBH3CN и ZnI2, NaBH4 в уксусной кислоте. Соединения общей формулы (II), где R3 и R4 независимо представляют собой COOR15, где R15 представляет собой водород, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой гидроксиметил, путем окисления при помощи одного из реагентов, описанных в литературе для таких окислений, такого как, например, иодоксибензойная кислота,периодинан Dess-Martin, оксалилхлорид и триэтиламин и диметилсульфоксид в метиленхлориде, CrO3 в пиридине или в серной кислоте и ацетоне, пиридинийхлорхромат, пиридинийдихромат, с получением промежуточного альдегида, где R3 и R4 независимо представляют собой CHO, с последующим дальнейшим окислением до карбоновой кислоты с использованием одного из реагентов, описанных в литературе для таких окислений, такого как, например, перманганат калия, ангидрид хромовой кислоты в серной кислоте/ацетоне, пиридинийдихромат в N,N-диметилформамиде. Соединения общей формулы (II), где R3 и R4 независимо представляют собой COOR15 илиCONR16R17, где R15 представляет собой C1-C6 линейную или разветвленную алкильную группу и R16 и R17 имеют значения, определенные выше, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой COOH, путем обработки соединением общей формулы R15OH или HNR16R17 с использованием одного из способов, описанных в литературе для таких преобразований, такого как, например, конденсация в присутствии агента конденсации, такого как, N,N'дициклогексилкарбодиимид, гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида, SOCl2POCl3 или PCl5, или соединения формулы (II) можно предварительно обработать SOCl2, POCl3, PCl5, необязательно в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, триэтиламин, пиридин, или 4-диметиламинопиридин. Соединения общей формулы (II), где R3 и R4 независимо представляют собой CONR16R17, где и R16 17 и R имеют значения, определенные выше, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи,можно получить из соединений общей формулы (II), где R3 и R4, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой COOR15, где R15 представляет собой C1-C6 линейную или разветвленную алкильную группу, путем обработки соединением общей формулыHNR16R17 с использованием одного из способов, описанных в литературе для таких преобразований, такого как, например, в воде, метаноле или этаноле, если это необходимо, в присутствии каталитического количества метоксида натрия. Соединения общей формулы (II), где R3 и R4 независимо представляют собой CH=N OH, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы(II), где R3 и R4 , при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, представляют собой CHO, путем обработки гидроксиламином в форме свободного основания или в форме- 16015622 соли, такой как гидрохлорид, сульфат, фосфат, в растворителе, таком как диоксан, тетрагидрофуран, 1,2 диметоксиэтан, метанол, этанол, N,N-диметилформамид, вода или их смеси, при температуре в пределах от 0C до температуры кипения с обратным холодильником. Реакцию можно осуществить в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как хлористо-водородная кислота, бромисто-водородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, вторичный кислый фосфат натрия или калия, первичный кислый фосфат натрия или калия. Соединения общей формулы (II), где R3 и R4 независимо представляют собой CN, когда связиR4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4 представляют собой кислород, со значением кетогрупп, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, где связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, с использованием одного из способов, описанных в литературе для таких преобразований, такого как, например, обработка тозилметилизоцианидом в присутствии основания. Соединения общей формулы (II), где R3 и R4 независимо представляют собой NHCHO и NHCOCH3,когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4 представляют собой N OR12, где R12 представляет собой водород, при условии,что R3 и R4 являются одинаковыми или отличными друг от друга, где связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, с использованием одного из способов, описанных в литературе для таких восстановлений, такого как, например, обработка литийалюминийгидридом, каталитическое гидрирование или обработка спиртовым раствором натрия, или лития, или магния с последующим формилированием с использованием муравьиной кислоты или ацетилированием с использованием уксусного ангидрида, необязательно, в присутствии основания, такого как, например, триэтиламин, пиридин или 4-диметиламинопиридин, или с использованием уксусной кислоты в присутствии агента конденсации, такого как, например, N,N'дициклогексилкарбодиимид, гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида. Соединения общей формулы (II), где R3 и R4 независимо представляют собой спироксиран, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулыR3 и R4 являются одинаковыми или отличными друг от друга, где связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, с испольдвойные связи, и символы зованием одного из реагентов, описанных в литературе для таких взаимодействий, такого как, например пербензойная кислота, м-хлорпербензойная кислота, перфталат магния, перфталевая кислота, перуксусная кислота или пероксид водорода и гидроксид натрия в ацетонитриле. Соединения общей формулы (II), где R3 и R4 независимо представляют собой спирооксиран, когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы(II), где R3 и R4 независимо представляют собой O, со значением кетогрупп, где связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, с использованием одного из реагентов, описанных в литературе для таких взаимодействий, такого как, например, триметилсульфонийиодид или триметилсульфоксонийиодид, в присутствии основания, такого как гидрид натрия,метоксид натрия, трет-бутоксид калия. Соединения общей формулы (II), где R3 и R4 независимо представляют собой спироциклопропан,когда связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой простые связи, можно получить из соединений общей формулы (II), где R3 и R4 представляют собой CR13R14, где R13 и R14 представляют собой водород, при условии, что R3 и R4 являются одинаковыми или отличными друг от друга, где связи, связывающие атом углерода в положении 6 андростанового скелета с R3 и атом углерода в положении 7 с R4, представляют собой двойные связи, и символы в положениях 4-5, 5-6 и 6-7 представляют собой простые связи, с использованием одного из реагентов, описанных в литературе для таких взаимодействий, такого как,например, дииодметан и диэтилолово или сплав олова-меди. Соединения общей формулы (II), где R5 представляет собой C2-C6 ацильную группу, когда связь в положении 17 андростанового скелета представляет собой простую связь, можно получить из соединений общей формулы (II), где R5 представляет собой водород, с использованием одного из способов,- 17015622 описанных в литературе для таких взаимодействий, такого как, например, взаимодействие с соединениями общей формулы C1-C5 линейный или разветвленный алкил-COOH в присутствии агента конденсации,такого как, N,N'-дициклогексилкарбодиимид, гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида, SOCl2 POCl3 или PCl5, или соединения формулы C1-C5 линейный или разветвленный алкилCOOH можно предварительно обработать SOCl2, POCl3, PCl5, необязательно в присутствии основания,такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, триэтиламин, пиридин или 4-диметиламинопиридин. Соединения общей формулы (II), где Q представляет собой меркапто, где символы R2, R3, R4, R5 и имеют значения, определенные выше, и Z представляет собой водород или C1-C6 линейную или разветвленную алкильную группу, можно получить из соединений общей формулы (II), где Q представляет собой гидрокси, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, взаимодействие с тиокарбоновыми кислотами, такими как тиоуксусная кислота, в присутствии диэтил- или диизопропилазодикарбоксилата и трибутилфосфина или трифенилфосфина, с последующим отщеплением тиоэфирной группы при помощи аммиака, метантиолата или пропантиолата натрия. Соединения общей формулы (II), где Q представляет собой NHR8, где символы R2, R3, R4, R5, R8 и имеют значения, определенные выше, и Z представляет собой водород, можно получить из соединений общей формулы (II), где Q и Z вместе представляют собой кетогруппу (=O), когда символы взяты вместе со значением двойной связи, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с соединениями общей формулыNH2R8 в присутствии восстановителя, такого как, например, борогидрид натрия или цианоборогидрид натрия, при соответствующем значении pH. Соединения общей формулы (II), где Q представляет собой NHR8, где символы R2, R3, R4, R5 и имеют значения, определенные выше, R8 представляет собой водород и Z представляет собой водород,можно получить из соединений общей формулы (II), где Q и Z вместе представляют собой кетогруппу(=O), когда символы взяты вместе со значением двойной связи, с использованием одного из способов,описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с соединениями общей формулы HONH2 с получением оксима с последующим восстановлением с использованием восстановителя, такого как, например, спиртовой раствор натрия, литийалюминийгидрид, или путем гидрирования над металлическим катализатором, таким как, например, Pt, Pd или никель Ренея. Соединения общей формулы (II), где Q представляет собой CHO, где символы R2, R3, R4, R5 и имеют значения, определенные выше, и Z представляет собой водород, можно получить из соединений общей формулы (II), где Q и Z вместе представляют собой кетогруппу (=O), когда символы взяты вместе со значением двойной связи, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с метоксиметилтрифенилфосфонийхлоридом в присутствии сильного основания, такого как, например, гидрид натрия или трет-бутоксид калия, с последующим кислотным гидролизом промежуточного метилененольного эфира; путем взаимодействия с триметилсульфонийиодидом или триметилсульфоксонийиодидом в присутствии основания,такого как гидрид натрия, метоксид натрия, трет-бутоксид калия, с последующей обработкой этератом трифторида бора; путем взаимодействия с метилтрифенилфосфонийиодидом в присутствии основания,такого как гидрид натрия, метоксид натрия, трет-бутоксид калия, с получением метиленового производного, которое при обработке бораном и перборатом натрия или щелочным раствором пероксида водорода дает гидроксиметильное производное, которое может быть окислено до желаемого карбоксальдегида при помощи одного из реагентов, описанных в литературе для таких окислений, такого как, например,иодоксибензойная кислота, периодинан Dess-Martin, оксалилхлорид и триэтиламин, CrO3 в пиридине или в серной кислоте и ацетоне, хлорхромат пиридиния, дихромат пиридиния. Соединения общей формулы (II), где Q представляет собой гидрокси, где символы R2, R3, R4, R5 и имеют значения, определенные выше, и Z представляет собой C1-C6 линейную или разветвленную алкильную группу, можно получить из соединений общей формулы (II), где Q и Z вместе представляют собой кетогруппу (=O), когда символы взяты вместе со значением двойной связи, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с соединением общей формулы C1-C6 алкил MetT, где Met представляет собой атом металла и T может отсутствовать или представляет собой галоген или атом другого металла, в зависимости от степени окисления атома металла Met, такого как, например, Li, MgCl, MgBr, MgI и CuLi. Соединения общей формулы (II), где Q представляет собой NHR8, где символы R2, R3, R4, R5 и имеют значения, определенные выше, R8 представляет собой водород и Z представляет собой C1-C6 линейную или разветвленную алкильную группу, можно получить из соединений общей формулы (II), гдеQ представляет собой гидрокси, с использованием одного из способов, описанных в литературе для таких взаимодействий, такого как, например, путем взаимодействия с гидроциановой кислотой в присутствии сильной кислоты, такой как, например, серная кислота, с последующим гидролизом промежуточного формамида. Соединения общей формулы (III)-(XV) являются коммерчески доступными, или их можно получить- 18015622 из коммерчески доступных соединений при помощи стандартных процедур. Во всех указанных преобразованиях любая реакционноспособная группа, препятствующая реакции,может быть защищена, а затем у нее может быть удалена защита в соответствии с общепринятыми процедурами, описанными в органической химии (см., например, T.W. Greene and P.G.M. Wuts "ProtectiveGroups in Organic Synthesis", J. WileySons, Inc., 3rd Ed., 1999), которые хорошо известны специалистам в данной области. Все указанные преобразования представлены только в качестве примеров общепринятых процедур,описанных в органической химии (см., например, J. March "Advanced Organic Chemistry", J. WileySons,Inc., 4th Ed., 1992), которые хорошо известны специалистам в данной области. Соединения формулы (I), определенные выше, являются полезными средствами для лечения сердечно-сосудистых расстройств, таких как сердечная недостаточность и гипертензия. Более того, указанные соединения демонстрируют сродство и ингибируют ферментную активность Na+, K+-АТФазы. Поскольку, как было показано, соединения по настоящему изобретению обладают способностью антагонизирования молекулярных эффектов, индуцированных наномолярными концентрациями уабаина,на Na-K-АТФазу, они будут эффективными для лечения заболеваний, вызванных гипертензивными эффектами эндогенного уабаина. В соответствии с предпочтительным вариантом воплощения настоящего изобретения заболевания,вызванные гипертензивными эффектами эндогенного уабаина, включают прогрессирование почечной недостаточности при аутосомальном доминантном поликистозном почечном заболевании (ADPKD),преэкламптической гипертензии и протеинурии и прогрессирование почечной недостаточности у пациентов с аддуциновым полиморфизмом. При аутосомальном доминантном поликистозном почечном заболевании (ADPKD), образование и рост кист происходит в результате клеточной пролиферации и трансэпителиальной секреции жидкостей,вызывая прогрессивное ухудшение почечной функции и почечную недостаточность. У 1 из 1000 субъектов наблюдается ADPKD, которое является первой генетической причиной почечной недостаточности. Почечная Na-K-АТФаза имеет существенное значение для ионного транспорта и транспорта жидкостей вADPKD клетках, и было описано изменение ее локализации и функции в этой патологии (Wilson P.D. etal. Am. J. Pathol 2000; 156:253-268). Уабаин, ингибитор Na-K-АТФазы, ингибирует секрецию жидкости вADPKD кистах (Grantham J.J. et al. I Clin. Invest. 1995; 95:195-202) при микромолярных концентрациях, и наоборот, при наномолярных концентрациях, которые являются аналогичными концентрациям циркулирующего эндогенного уабаина, уабаин стимулирует ADPKD клеточную пролиферацию, но не влияет на рост нормальных клеток почек человека (Nguyen A.N. et al. 2007; 18:46-57). Было продемонстрировано,что уабаин стимулирует ADPKD пролиферацию путем связывания с Na-K-АТФазой с высоким сродством и запуска активации пути MEK-ERK (Nguyen A.N. et al. 2007; 18:46-57). Преэклампсия представляет собой сильное истощающее гипертензивное расстройство при беременности, эффективное лечение которого еще не найдено. Были сообщения о повышенных уровнях циркуляции карденолидов и буфодиенолидов у преэкламптических пациентов и в моделях крыс с таким заболеванием (Lopatin D.A. et al. J. Hypertens. 1999;17:1179-1187; Graves S.V. et al. Am. J. Hypertens. 1995; 8:5-11; Adair C.D. et al. Am. J. Nephrol. 1996; 16:529-531). Имеющиеся в настоящее время данные говорят о том, что при преэклампсии повышенные концентрации в плазме ингибиторов Na-K-АТФазы приводят к сужению сосудов и злокачественной гипертензии (Vu H.V. et al. Am. J. Nephrol. 2005; 25:520-528). Недавно было обнаружено, что дигоксин-специфическое Fab (Дигибинд) снижает кровяное давление и повышает натриурез у преэкламптических пациентов (Pullen M.A. al. JPET 2004; 310:319-325). Связанная с гломерулосклерозом протеинурия возникает из-за нарушения щелевой пористой структуры, образованной подоцитными отростками в клубочках. В частности, белки щелевой мебраны, такие как нефрин, ZO1, подоцин, синаптодопин и другие, в дополнение к их структурным функциям, участвуют в общих сигнальных путях, регулируемых Fyn, тирозинкиназой из семейства киназ Src (Benzing T. J.Am. Soc. Nephrol 2004; 15:1382-1391). В последнее время ключевую роль в структуре щелевых пор приписывают -аддуцину, цитоскелетному белку под контролем Fyn (Gotoh H BBRC 2006; 346:600-605;Shima T. et al. JBC 2001; 276: 42233-42240). Было обнаружено, что аддуциновые полиморфизмы совместно с полиморфизмом АСЕ связаны с нарушением почечной функции у населения Европы и Китая (WangJ.G. et al. J. Mol. Med. 2004; 82:715-722; Wang J.G. et al. Am. J. Kidney Dis. 2001; 38: 1158-1168). Было описано, что ростафлуроксин и аналоги, как антагонисты эндогенного уабаина, способны оказывать антагонистическое действие в отношении молекулярного эффекта аддуцинового полиморфизма на сигнальную активность тирозинкиназы (Ferrandi M. et al. JBC, 2004; 279:33306-14; Ferrari et al. Am. J. PhysiolRegul 2006; 290:R529-535; Ferrari P. et al. Med. Hypothes. 2007; 68:1307-1314). Более того, соединения по настоящему изобретению обладают положительными инотропными характеристиками, как показано на примере медленной внутривенной инфузии находящимся под анестезией морским свинкам, в соответствии с Cerri (Cerri A. et al., J. Med. Chem. 2000, 43, 2332), и обладают низкой токсичностью по сравнению со стандартными кардиотоническими стероидами, например дигоксином. Фармацевтические композиции содержат по меньшей мере одно соединение формулы (I) в качестве- 19015622 активного ингредиента, в количестве, обеспечивающем существенный терапевтический эффект. Композиции, охватываемые настоящим изобретением, являются абсолютно традиционными, и их получают способами, являющимися общепринятыми в фармацевтической промышленности, такими как, например,способы, проиллюстрированные в Remington's Pharmaceutical Science Handbook, Mack Pub. N.Y. - последнее издание. В соответствии с выбранным способом введения композиции могут находиться в твердой или жидкой форме, подходящей для перорального, парентерального или внутривенного введения. Композиции по настоящему изобретению содержат наряду с активным ингредиентом по меньшей мере один фармацевтически приемлемый носитель или эксципиент. Это могут быть особенно полезные вспомогательные вещества для формулирования композиций, например солюбилизирующие вещества, диспергирующие вещества, суспендирующие вещества и эмульгаторы. В соответствии с еще одной целью настоящего изобретения фармацевтические композиции содержат по меньшей мере одно соединение формулы (I) в качестве активного ингредиента, в количестве,обеспечивающем существенный терапевтический эффект, не вызывая при этом сердечно-сосудистых побочных эффектов. Композиции, охватываемые настоящим изобретением, являются абсолютно традиционными, и их получают способами, являющимися общепринятыми в фармацевтической промышленности, такими как, например, способы, проиллюстрированные в Remington's Pharmaceutical ScienceHandbook, Mack Pub. N.Y. - последнее издание. В соответствии с выбранным способом введения композиции могут находиться в твердой или жидкой форме, подходящей для перорального, парентерального или внутривенного введения. Композиции по настоящему изобретению содержат наряду с активным ингредиентом по меньшей мере один фармацевтически приемлемый носитель или эксципиент. Это могут быть особенно полезные вспомогательные вещества для формулирования композиций, например солюбилизирующие вещества, диспергирующие вещества, суспендирующие вещества и эмульгаторы. Представленные ниже примеры более подробно иллюстрируют настоящее изобретение. Пример 1. (E) Гидрохлорид 3-(4-пиперидил)оксииминоандростан-6,17-диона (I-aa). К раствору дигидрохлорида 4-пиперидилоксиамин (III-a, получение 1, 100 мг) и Na2HPO412H2O(380 мг) в воде (1,6 мл) добавляли раствор андростан-3,6,17-триона (160 мг) в ТГФ (3,2 мл). После выдерживания в течение 2 ч при комнатной температуре добавляли NaCl (150 мг) и перемешивали в течение 15 мин. Смесь экстрагировали при помощи ТГФ (22 мл) и объединенные органические фазы промывали насыщенным солевым раствором (33 мл), сушили над Na2SO4 и упаривали досуха. Остаток очищали при помощи флэш-хроматографии (SiO2, CH2Cl2:MeOH:NH3 9:1:0,1). К концентрированным фракциям добавляли раствор 5 М HCl в EtOAc. После разбавления при помощи Et2O твердое вещество собирали фильтрованием с получением указанного в заголовке соединения I-aa (140 мг, 60%). 1I-ab (1,21 г, 80%) в виде белого твердого вещества. 1(19H, м), 0,79 (6H, с). Пример 3. Гидрохлорид (E) 3-[3-(RS)-пирролидинил]оксииминоандростан-6,17-диона (I-ac). Раствор дигидрохлорида 3-(RS)-пирролидинилоксиамина (III-с, получение 3, 227 мг) и андростан 3,6,17-триона (495 мг) в ТГФ:воде (2/1, 27 мл) перемешивали в течение 30 мин. Добавляли NaCl и перемешивали до тех пор, пока не происходило разделение двух фаз. После экстрагирования водного слоя при помощи ТГФ объединенные органические фазы промывали насыщенным солевым раствором, сушили и упаривали. Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CH2Cl2:MeOH:NH3 9:1:0,1). К концентрированным фракциям добавляли 5 М HCl в EtOAc. После разбавления при помощи Et2O твердое вещество собирали фильтрованием с получением указанного в заголовке соединения I-ac (464 мг, 60%). 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,59 (1H, 2 ушир.), 9,41 (1H, 2 ушир.), 4,74 (1H, м),3,80-2,90 (5H, м), 2,60-1,20 (21H, м), 0,78 (6H, с). Пример 4. Гидрохлорид (E,Z) 3-[3-(S)-пирролидинил]оксииминоандростан-6,17-диона (I-ad). Следуя процедуре, описанной в примере 1, и исходя из андростан-3,6,17-триона (605 мг) и дигидрохлорида 3-(S)-пирролидинилоксиамина (III-d, получение 4, 350 мг), получали указанное в заголовке соединение I-ad в виде белого твердого вещества из неочищенного продукта после выпаривания ТГФ, промывки остатка при помощи EtOAc и фильтрации (653 мг, 78%). 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,23 (2H, 2 ушир.), 4,74 (1H, м), 3,30-2,90 (5H, м), 2,601,20 (21H, м), 0,79 (3H, с), 0,78 (3H, с). Пример 5. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксииминоандростан-6,17-диона (I-ae). Следуя процедуре, описанной в примере 1, и исходя из андростан-3,6,17-триона (1,00 г) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 0,58 г), получали указанное в заголовке со- 20015622 единение I-ae в виде белого твердого вещества из неочищенного продукта после выпаривания ТГФ, промывки остатка при помощи EtOAc и фильтрации (1,00 г, 72%). 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,20 (2H, 2 ушир.), 4,74 (1H, м), 3,35-2,90 (5H, м), 2,601,20 (21H, м), 0,79 (6H, с). Пример 6. Гидрохлорид (E) 3-[3-(R)-пирролидинил]оксииминоандростан-6,17-дион (I-af). Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксииминоандростан-6,17-диона (I-ae, пример 5, 650 мг) суспендировали в EtOAc (150 мл) и перемешивали в течение 3 ч. После фильтрации процедуру повторяли на твердом веществе с получением указанного в заголовке соединения I-af (300 мг, 46%) в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,20 (2H, 2 ушир.), 4,74 (1H, м), 3,30-2,90 (5H, м), 2,601,20 (21H, м), 0,79 (3H, с), 0,78 (3H, с). Пример 7. Гидрохлорид (Z)-3-[3'-(R)-пирролидинил]оксииминоандростан-6,17-диона (I-ag). Маточный раствор первой фильтрации, описанный в примере 6, упаривали досуха. Остаток растворяли в EtOH, фильтровали с использованием активированного угля и фильтрат упаривали досуха с получением указанного в заголовке соединения I-ag (250 мг, 38%) в виде белого порошка. 1(1H, м), 2,95 (1H, м), 2,50-1,00 (18 Н, м), 0,76 (3H, с), 0,75 (3H, с). Пример 8. Гидрохлорид (E,Z) 3-[2-(R)-пирролидинил]метоксииминоандростан-6,17-диона (I-ah). Следуя процедуре, описанной в примере 1, и исходя из андростан-3,6,17-триона (100 мг) и дигидрохлорида 2-[(R)-пирролидинил]метоксиамина (III-f, получение 6, 150 мг), получали указанное в заголовке соединение I-ah (130 мг, 57%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,39 (1H, 2 ушир.), 8,80 (1H, 2 ушир.), 4,10 (2H, м),3,70 (1H, м), 3,30-2,90 (3H, м), 2,60-1,20 (23H, м), 0,79 (6H, с). Пример 9. Гидрохлорид (E,Z) 3-[2-(S)-пирролидинил]метоксииминоандростан-6,17-диона (I-ai). Следуя процедуре, описанной в примере 1, и исходя из андростан-3,6,17-триона (208 мг) и дигидрохлорида 2-[(S)-пирролидинил]метоксиамина (III-g, получение 7, 130 мг), получали указанное в заголовке соединение I-ai (172 мг, 55%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,56 (1H, 2 ушир.), 8,75 (1H, 2 ушир.), 4,11 (2H, м),3,68 (1H, м), 3,30-2,90 (3H, м), 2,60-1,20 (23H, м), 0,79 (6H, с). Пример 10. Гидрохлорид (E) 3-[3'-(R,S)-пиперидинил]оксииминоандростан-6,17-диона (I-aj). Следуя процедуре, описанной в примере 1, и исходя из андростан-3,6,17-триона (100 мг) и дигидрохлорида 3-(RS)-пиперидинилоксиамина (III-h, получение 8, 50 мг), получали указанное в заголовке соединение I-aj (110 мг, 76%) в виде белого твердого вещества. 1(II-aa, получение 11) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-am. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,00 (3H, 2 ушир.), 6,38 (2H, с), 5,01 (1H, с), 4,75 (0,5H,с), 4,68 (0,5H, с), 3,45-1,00 (27H, м), 0,97 (1,5H, с), 0,94 (1,5H, с), 0,76 (1,5H, с), 0,75 (1,5H, с). Пример 14. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-гидроксиандростан-17-она (I-an). Следуя процедуре, описанной в примере 1, и исходя из 6-гидроксиандростан-3,17-диона (278 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 160 мг), получали указанное в заголовке соединение I-an в виде белого твердого вещества из неочищенного продукта после выпаривания ТГФ, промывки остатка при помощи EtOAc, содержащего 10% EtOH, и фильтрации (270 мг, 70%).(6H, м), 2,60-0,60 (21H, м), 0,87 (1,5H, с), 0,85 (1,5H, с), 0,77 (3H, с). Пример 15. Гидрохлорид (E,Z) 3-[3-(S)-пирролидинил]оксиимино-6-гидроксиандростан-17-она (I-ao). Следуя процедуре, описанной в примере 1, и исходя из 6-гидроксиандростан-3,17-диона (209 мг) и дигидрохлорида 3-(S)-пирролидинилоксиамина (III-d, получение 4, 120 мг), получали указанное в заголовке соединение I-ao в виде белого твердого вещества из неочищенного продукта после выпаривания ТГФ, промывки остатка при помощи EtOAc/5% EtOH и фильтрации (204 мг, 70%). 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,01 (2H, 2 ушир.), 4,83 (0,5H, м), 4,81 (0,5H, ушир.с),4,74 (1H, м), 4,50 (1H, м), 4,09 (2H, м), 3,50-0,88 (26H, м), 0,77 (3H, с), 0,76 (3H, с). Пример 18. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-гидроксиметиландростан-17 она (I-ar). Следуя процедуре, описанной в примере 1, и исходя из 6-гидроксиметиландростан-3,17-диона (IIad, получение 14, 260 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 149 мг),получали указанное в заголовке соединение I-ar в виде белого твердого вещества из неочищенного продукта после промывки при помощи EtOAc и EtaO и фильтрации (190 мг, 57%). 1(7H, м), 2,50-0,60 (22H, м). Пример 19. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-метоксиметиландростан-17 она (I-as). Получали с выходом 60%, как описано в примере 1, исходя из 6-метоксиметиландростан-3,17 диона (II-ae, получение 15) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CH2Cl2:MeOH:NH3 9:1:0,1). Добавляли фумаровую кислоту к концентрированным фракциям с получением указанного в заголовке соединения I-as (0,43 г, 60%). 1(I-at). Получали с использованием таких же реакционных условий, как описано в примере 3, и исходя из 6-карбамоиландростан-3,17-диона (II-af, получение 16, 500 мг) и дигидрохлорида 3-(R)пирролидинилоксиамина (III-e, получение 5, 262 мг). После 3 ч взаимодействия смесь концентрировали с получением твердого вещества, которое промывали кипящим EtOAc. Твердое вещество фильтровали с получением после сушки указанного в заголовке соединения I-at (440 мг, 65%) в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):7,57 (2H, 2 ушир.), 7,38 (0,5H, 2 ушир.), 7,31 (0,5H, 2 ушир.), 6,92 (0,5H, 2 ушир.), 6,78 (0,5H, 2 ушир.), 4,62 (1H, м), 2,98 (5H, м), 2,45-0,63 (22H, м), 0,89 (3H,с), 0,78 (3H, с). Пример 21. Гидрохлорид (Z,E) 3-(3-(R)-пирролидинилоксиимино)-6-метоксикарбониландростан 17-она (I-au). Получали с использованием таких же реакционных условий, как описано в примере 3, и исходя из 6-метоксикарбониландростан-3,17-диона (II-ag, получение 17, 325 мг) и дигидрохлорида 3-(R)пирролидинилоксиамина (III-e, получение 5, 167 мг). После 1 ч взаимодействия смесь экстрагировали при помощи ТГФ. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4 и упаривали досуха. Полученное твердое вещество промывали при помощи Et2O и подвергали центрифугированию с получением после сушки указанного в заголовке соединения I-au (326 мг, 74%) в виде белого порошка. 1(II-ah, получение 18), 380 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 250 мг), получали указанное в заголовке соединение I-av в виде белого твердого вещества после фильтрации из ТГФ (404 мг, 77%). 1(1H, м), 3,40-3,00 (6H, м), 2,50-1,00 (20H, м), 0,78 (6H, с). Пример 23. (E) 3-[3-(R)-Пирролидинил]оксиимино-6-метиландростан-17-онфумарат (I-aw). Получали с выходом 84%, как описано в примере 1, исходя из 6-метиландростан-3,17-диона (II-ai,получение 19) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок растирали в порошок с Et2O с получением указанного в заголовке соединения I-aw. 1(5H, м), 2,45-0,60 (22H, м), 0,88 (3H, с), 0,81 (3H, с), 0,77 (3H, с). Пример 24. Гидрохлорид (Z) 3-[3-(R)-пирролидинил]оксиимино-6-метиландростан-17-она (I-ax). Получали с выходом 70%, как описано в примере 1, исходя из 6-метиландростан-3,17-диона (II-ai,получение 19) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт растворяли в H2O и подвергали сушке вымораживанием с получением указанного в заголовке соединения I-ax. 1(II-aj, получение 20) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт растворяли в H2O и подвергали сушке вымораживанием с получением указанного в заголовке соединения I-ay. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,38 (3H, 2 ушир.), 8,42-7,50 (2H, м), 4,76 (0,5H, м),4,71 (0,5H, м), 3,72 (1H, м), 3,29-2,93 (5H, м), 2,44-0,61 (21H, м), 0,93 (1,5H, с), 0,92 (1,5H, с), 0,78 (3H, с). Пример 26. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-дифторметиленандростан-17 она (I-az). Получали с выходом 71%, как описано в примере 1, исходя из 6-дифторметиленандростан-3,17 диона (II-ak, получение 21) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт растирали в порошок с EtOAc. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):9,10 (2H, 2 ушир.), 4,70 (1H, м), 3,20-2,90 (5H, м), 2,450,80 (21H, м), 0,89 (3H, с), 0,78 (3H, с). Пример 27. Гидрохлорид (Z,E) 3-(3-(R)-пирролидинилоксиимино)-6-(спироциклопропан)андростан 17-она (I-ba). Получали с выходом 91%, как описано в примере 1, исходя из 6-(спироциклопропан)андростан 3,17-диона (II-al, получение 22) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Объединенные органические экстракты сушили над Na2SO4, фильтровали и упаривали досуха с получением указанного в заголовке соединения I-ba. 1(I-be). Получали с выходом 50%, следуя процедуре, описанной в примере 1, исходя из 6-(E)метоксииминоандростан-3,17-диона (II-ao, получение 25, 400 мг) и дигидрохлорида 3-(S)пирролидинилоксиамина (III-d, получение 4, 210 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси(II-ao, получение 25, 386 мг) и дигидрохлорида 3-(S)-(1-метил)пирролидинилоксиамина (III-i, получение 9, 220 мг), получали указанное в заголовке соединение I-bf (220 мг, 41%) после сушки вымораживанием в виде белого порошка. 1(I-bi). Указанное в заголовке соединение I-bi получали, следуя процедуре, описанной в примере 1, исходя из 5-гидрокси-6-метиленандростан-3,17-диона (II-ap, получение 26, 125 мг) и дигидрохлорида 3-(S)пирролидинилоксиамина (III-d, получение 4, 55 мг). Неочищенный продукт очищали при помощи флэшхроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bi (64 мг,40%) в виде белого порошка. 1(I-bj). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 35. Добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bj (60 мг, 37%) в виде белого порошка. 1- 24015622 Пример 37. (Е,Z) 3-[3'-(S)-Пирролидинил]оксиимино-5-гидрокси-6-метиленандростан-17-онфумарат (I-bk). Выделяли из неразделенных фракций флэш-хроматографии, описанной в примере 35. К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bk после сушки вымораживанием в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):6,61 (с, 2H), 4,87 (0,5H, ушир.с), 4,84 (0,5H, ушир.с),4,75 (2H, м), 4,69 (0,5H, ушир.с), 4,67 (0,5H, ушир.с), 3,40-3,10 (6H, м), 3,15 (0,5H, м), 3,00 (0,5H, м), 2,701,00 (18H, м), 0,84 (1,5H, с), 0,82 (1,5H, с), 0,75 (3H, с). Пример 38. (Z) 3-[3'-(R)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-метиленандростан-17 онфумарат (I-bl). Указанное в заголовке соединение I-bl получали, следуя процедуре, описанной в примере 1, исходя из 5-гидрокси-6-метиленандростан-3,17-диона (II-ap, получение 26, 70 мг) и дигидрохлорида 3-(R)-(1 метил)пирролидинилоксиамина (III-j, получение 10, 42 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bl(1H, м), 3,30-3,20 (6H, м), 3,15-3,08 (1H, ушир.с), 2,80-1,10 (18H, м), 2,26 (3H, с), 0,82 (3H, с), 0,76 (3H, с). Пример 39. (E) 3-[3'-(R)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-метиленандростан-17 онфумарат (I-bm). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 38. Добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bm(2H, м), 3,30-3,20 (6H, м), 2,98-2,88 (1H, м), 2,80-1,10 (18H, м), 2,24 (3H, с), 0,83 (3H, с), 0,76 (3H, с). Пример 40. (Z) 3-[3'-(S)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-метиленандростан-17 онфумарат (I-bn). Указанное в заголовке соединение I-bn получали, следуя процедуре, описанной в примере 1, исходя из 5-гидрокси-6-метиленандростан-3,17-диона (II-ap, получение 26, 100 мг) и дигидрохлорида 3-(S)-1 метилпирролидинилоксиамина (III-i, получение 9, 60 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bn(2H, м), 3,40-3,20 (6H, м), 3,10-2,98 (1H, м), 2,80-1,10 (18H, м), 2,31 (3H, с), 0,81 (3H, с), 0,75 (3H, с). Пример 41. (E) 3-[3'-(S)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-метиленандростан-17 онфумарат (I-bo). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 40. Добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bo (70 мг, 41%). 1(2H, м), 3,40-3,20 (6H, м), 3,05-3,00 (1H, ушир.с), 2,90-1,10 (18H, м), 2,32 (3H, с), 0,79 (3H, с), 0,74 (3H, с). Пример 42. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-5-гидрокси-6-(E)-гидроксииминоандростан-17-она (I-bp). Получали с выходом 77%, как описано в примере 1, исходя из 5-гидрокси-6-(E)гидроксииминоандростан-3,17-диона (II-aq, получение 27) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Объединенные органические экстракты сушили над Na2SO4, фильтровали и упаривали досуха с получением указанного в заголовке соединения I-bp. 1(0,5H, с), 4,95 (0,5H, с), 4,73 (1H, м), 3,51-2,90 (6H, м), 2,62-1,10 (19H, м), 0,82 (3H, с), 0,76 (3H, с). Пример 43. Гидрохлорид (E,Z) 3-[3-(S)-пирролидинил]оксиимино-5-гидрокси-6-(E)-гидроксииминоандростан-17-она (I-bq). Следуя процедуре, описанной в примере 1, и исходя из 5-гидрокси-6-(E)-гидроксииминоандростан-3,17-диона (II-aq, получение 27, 100 мг) и дигидрохлорида 3-(S)-пирролидинилоксиамина (IIId, получение 4, 50 мг), получали указанное в заголовке соединение I-bq (90 мг, 68%) после сушки вымораживанием осажденного гидрохлорида в виде белого порошка.H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):10,72 (0,5H, ушир.с), 10,63 (0,5H, ушир.с), 9,02 (2H, 2 ушир.), 4,85 (1H, ушир.с), 4,73 (1H, ушир.с), 3,35-3,10 (6H, м), 3,15 (1H, м), 2,99 (1H, м), 2,70-1,00 (17H,м), 0,84 (1,5H, с), 0,83 (1,5H, с), 0,78 (3H, с). Пример 44. (Z) 3-[3'-(S)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-гидрокси-иминоандростан-17-онгемифумарат (I-br). Указанное в заголовке соединение I-cf получали, следуя процедуре, описанной в примере 1, и исходя из 5-гидрокси-6-(E)-гидроксииминоандростан-3,17-диона (II-aq, получение 27, 100 мг) и дигидрохлорида 3-(S)-(1-метил)пирролидинилоксиамина (III-i, получение 9, 55 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH с последующим добавлением 1/1 смеси EtOAc/Et2O. Осадок отфильтровывали с получением указанного в заголовке соединения I-br (70 мг, 48%) после сушки вымораживанием в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):10,62 (с, 1H), 6,39 (с, 1H), 5,00 (с, 1H), 4,70-4,60 (м,1H), 3,20-1,00 (м, 25H), 2,22 (с, 3H), 0,80 (с, 3H), 0,78 (с, 3H). Пример 45. (E) 3-[3'-(S)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-гидрокси-иминоандростан-17-онфумарат (I-bs). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 44. Добавляли стехиометрическое количество фумаровой кислоты в MeOH с последующим добавлением 1/1 смеси EtOAc/Et2O. Осадок отфильтровывали с получением указанного в заголовке соединения I-bs (50 мг, 32%) в виде белого твердого вещества. 1(Z) 3-[3'-(R)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат (I-bt). Указанное в заголовке соединение I-bt получали, следуя процедуре, описанной в примере 1, и исходя из 5-гидрокси-6-(E)-гидроксииминоандростан-3,17-диона (II-aq, получение 27, 100 мг) и дигидрохлорида 3-(R)-(1-метил)пирролидинилоксиамина (III-j, получение 10, 55 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты вMeOH с последующим добавлением 1/1 смеси EtOAc/Et2O. Осадок отфильтровывали с получением указанного в заголовке соединения I-bt (32 мг, 20%) после сушки вымораживанием в виде белого аморфного порошка. 1(E) 3-[3'-(R)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-гидроксииминоандростан-17-онфумарат (I-bu). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 46. Добавляли стехиометрическое количество фумаровой кислоты в MeOH с последующим добавлением 1/1 смеси EtOAc/Et2O. Осадок отфильтровывали с получением указанного в заголовке соединения I-bu (70 мг, 44%), в виде белого твердого вещества. 1(м, 1H), 3,20-1,00 (м, 25H), 2,32 (с, 3H), 0,82 (с, 3H), 0,78 (с, 3H). Пример 48. (Е,Z)-3-(3'-(S)-Пирролидинилоксиимино)-5-гидрокси-6-(E)-метоксииминоандростан 17-онфумарат (I-bv). Указанное в заголовке соединение I-bv получали с выходом 40%, следуя процедуре, описанной в примере 1, и исходя из 5-гидрокси-6-(E)-метоксииминоандростан-3,17-диона (II-ar, получение 28, 73 мг) и дигидрохлорида 3-(S)-пирролидинилоксиамина (III-d, получение 4, 37 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения Ibv в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):6,41 (с, 2H), 5,35 (ушир.с, 0,5H), 5,21 (ушир.с, 0,5H),4,70 (ушир.с, 1H), 3,73 (с, 1,5H), 3,71 (с, 1,5H), 3,30-2,90 (м, 7H), 2,41-1,00 (м, 18 Н), 0,81 (с, 3H), 0,72 (с,3H). Пример 49. (E,Z) 3-[3'-(R)-Пирролидинил]оксиимино-5-гидрокси-6-(E)-метоксииминоандростан 17-онфумарат (I-bw). Получали с выходом 40%, следуя процедуре, описанной в примере 1, исходя из 5-гидрокси-6-(E)метоксииминоандростан-3,17-диона (II-ar, получение 28, 420 мг) и дигидрохлорида 3-(R)пирролидинилоксиамина (III-e, получение 5, 210 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смесиEtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bw после сушки вымораживанием в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):6,41 (с, 2H), 5,30-5,20 (ушир.с, 1H), 4,76-4,65 (м, 1H),4,75 (с, 1,5H), 4,65 (с, 1,5H), 3,30-2,90 (м, 7H), 2,42-1,00 (м, 18 Н), 0,82 (с, 3H), 0,73 (с, 3H). Пример 50. (Z) 3-[3'-(S)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат (I-bx). Указанное в заголовке соединение I-bx получали, следуя процедуре, описанной в примере 1, исходя из 5-гидрокси-6-(E)-метоксииминоандростан-3,17-диона (II-ar, получение 28, 100 мг) и дигидрохлорида 3-(S)-(1-метил)пирролидинилоксиамина (III-i, получение 9, 55 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bx (49 мг, 30%) в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):6,41 (2H, с), 5,24 (1H, 2 ушир.), 4,67 (1H, м), 3,72 (3H,с), 3,15-2,75 (6H, м), 2,43 (3H, с), 2,65-1,00 (19H, м), 0,83 (3H, с), 0,75 (3H, с). Пример 51. (E) 3-[3'-(S)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат (I-by). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 50. Добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-by (50 мг, 30%) в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):6,41 (с, 2H), 5,20 (1H, 2 ушир.), 4,58 (1H, м), 3,76 (3H,с), 3,15-2,75 (6H, м), 2,33 (3H, с), 2,60-1,10 (19H, м), 0,83 (3H, с), 0,75 (3H, с). Пример 52. (Z) 3-[3'-(R)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат (I-bz). Указанное в заголовке соединение I-bz получали, следуя процедуре, описанной в примере 1, исходя из 5-гидрокси-6-(E)-метоксииминоандростан-3,17-диона (II-ar, получение 28, 70 мг) и дигидрохлорида 3-(R)-(1-метил)пирролидинилоксиамина (III-j, получение 10, 37 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным менее полярным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-bz (40 мг, 36%) в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):6,52 (с, 2H), 5,18 (1H, с), 4,58 (1H, м), 3,74 (3H, с),3,30-3,20 (6H, м), 3,15-3,02 (1H, м), 2,80-1,10 (18H, м), 2,24 (3H, с), 0,82 (3H, с), 0,76 (3H, с). Пример 53. (E) 3-[3'-(R)-(1-Метил)пирролидинил]оксиимино-5-гидрокси-6-(E)-метоксииминоандростан-17-онфумарат (I-ca). Выделяли из концентрированных более полярных фракций после флэш-хроматографии, описанной в примере 52. Добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-ca (56 мг, 50%) в виде белого порошка. 1(26H, м), 1,13 (3H, с), 0,78 (3H, с). Пример 55. (Е,Z) 3-[3'-(S)-Пирролидинил]оксииминоандростан-7,17-дионфумарат (I-cc). Получали с выходом 82%, следуя процедуре, описанной в примере 1, исходя из андростан-3,7,17 триона (II-as, получение 29, 122 мг) и дигидрохлорида 3-(S)-пирролидинилоксиамина (III-d, получение 4,75 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26%NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения 1-сс в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):8,00 (3H, 2 ушир.), 6,40 (2H, с), 4,69 (1H, м), 3,72 (3H,с), 3,22-2,78 (6H, м), 2,61-0,87 (20H, м) 1,00 (3H, с), 0,80 (3H, с). Пример 58. (E,Z) 3-[3'-(R)-Пирролидинил]оксиимино-7-(E)-аллилоксииминоандростан-17-онфумарат (I-cf). Получали с выходом 49%, как описано в примере 1, исходя из 7-(E)-аллилоксииминоандростан 3,17-диона (II-av, получение 32, 270 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 133 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2,CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-cf в виде белого порошка. 1(II-ax, получение 35, 210 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 120 мг). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-cj в виде белого порошка. 1(1H, м), 3,15-2,90 (5H, м), 2,40-1,00 (21H, м), 0,85 (3H, с), 0,72 (3H, с). Пример 63. Гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-она (I-ck). Следуя процедуре, описанной в примере 1, и исходя из 7-метиландростан-3,17-диона (II-ay, получение 36, 31 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 21 мг), получали указанное в заголовке соединение (40 мг, 93%) после сушки вымораживанием в виде белого порошка. 1(1H, м), 2,40-0,99 (20H, м), 0,92-0,83 (6H, м), 0,79 (3H, с). Пример 64. Гидрохлорид (E,Z) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-она (I-cl). Получали с выходом 92%, как описано в примере 1, исходя из 7-метиландростан-3,17-диона (II-az,получение 37, 512 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 282 мг). Органическую фазу экстрагировали при помощи ТГФ, промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и упаривали досуха с получением указанного в заголовке соединения I-cl в виде белого порошка. 1(0,5H, м), 2,78 (0,5H, м), 2,40-0,90 (19H, м), 0,99 (3H, д), 0,82 (3H, с), 0,78 (3H, с), 0,80-0,70 (1H, м). Пример 65. Гидрохлорид (E) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-она (I-cm). Следуя процедуре, описанной в примере 65, и исходя из 7-метиландростан-3,17-диона (II-az, получение 37, 90 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 50 мг), получали указанное в заголовке соединение I-cm (46 мг, 36%) после кристаллизации из MeOH/EtOAc в виде белого порошка. 1(1H, м), 2,40-0,95 (20H, м), 0,98 (3H, д), 0,84 (3H, с), 0,78 (3H, с). Пример 66. Гидрохлорид (Z) 3-[3'-(R)-пирролидинил]оксиимино-7-метиландростан-17-она (I-cn). Указанное в заголовке соединение I-cn (50 мг, 40%) получали из маточного раствора примера 65 после упаривания, растирания остатка в порошок с EtOAc в виде не совсем белого твердого вещества. 1(II-bc, получение 40, 60 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5, 30 мг),получали указанное в заголовке соединение I-cq (26 мг, 32%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, DMSO-d6, м.д. от TMS):10,72 (0,5H, ушир.с), 10,63 (0,5H, ушир.с), 9,02 (2H, 2 ушир.), 5,17 (1H, д), 5,02 (1H, ушир.с), 4,73 (1H, ушир.с), 3,35-3,10 (6H, м), 3,15 (1H, м), 2,99 (1H, м), 2,701,00 ( 16 Н, м), 0,89 (3H, с), 0, 88 (3H, с). Пример 71. (Е,Z) 3-[3'-(R)-Пирролидинил]оксиимино-6-гидроксиметиландростан-7,17-дионфумарат (I-cs). Получали с выходом 67%, как описано в примере 1, и исходя из 6-гидроксиметиландростан 3,7,17-триона (II-be, получение 42) и дигидрохлорида 3-(R)-пирролидинилоксиамина (III-e, получение 5). Неочищенный продукт очищали при помощи флэш-хроматографии (SiO2, CHCl3/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям добавляли стехиометрическое количество фумаровой кислоты в MeOH. После добавления 1/1 смеси EtOAc/Et2O осадок отфильтровывали с получением указанного в заголовке соединения I-cs в виде белого твердого вещества. 1
МПК / Метки
МПК: C07J 43/00, A61P 9/04, A61K 31/565, A61K 31/58
Метки: азагетероциклильные, андростенов, средств, сердечно-сосудистых, лекарственных, качестве, андростанов, производные, расстройств
Код ссылки
<a href="https://eas.patents.su/30-15622-azageterociklilnye-proizvodnye-androstanov-i-androstenov-v-kachestve-lekarstvennyh-sredstv-ot-serdechno-sosudistyh-rasstrojjstv.html" rel="bookmark" title="База патентов Евразийского Союза">Азагетероциклильные производные андростанов и андростенов в качестве лекарственных средств от сердечно-сосудистых расстройств</a>
Предыдущий патент: Способ водоотталкивающей обработки продукта на основе гипса, полученного из композиции на основе алебастра
Следующий патент: Комплексное удобрение для пивоваренного ячменя
Случайный патент: Замкнутое крыло


































