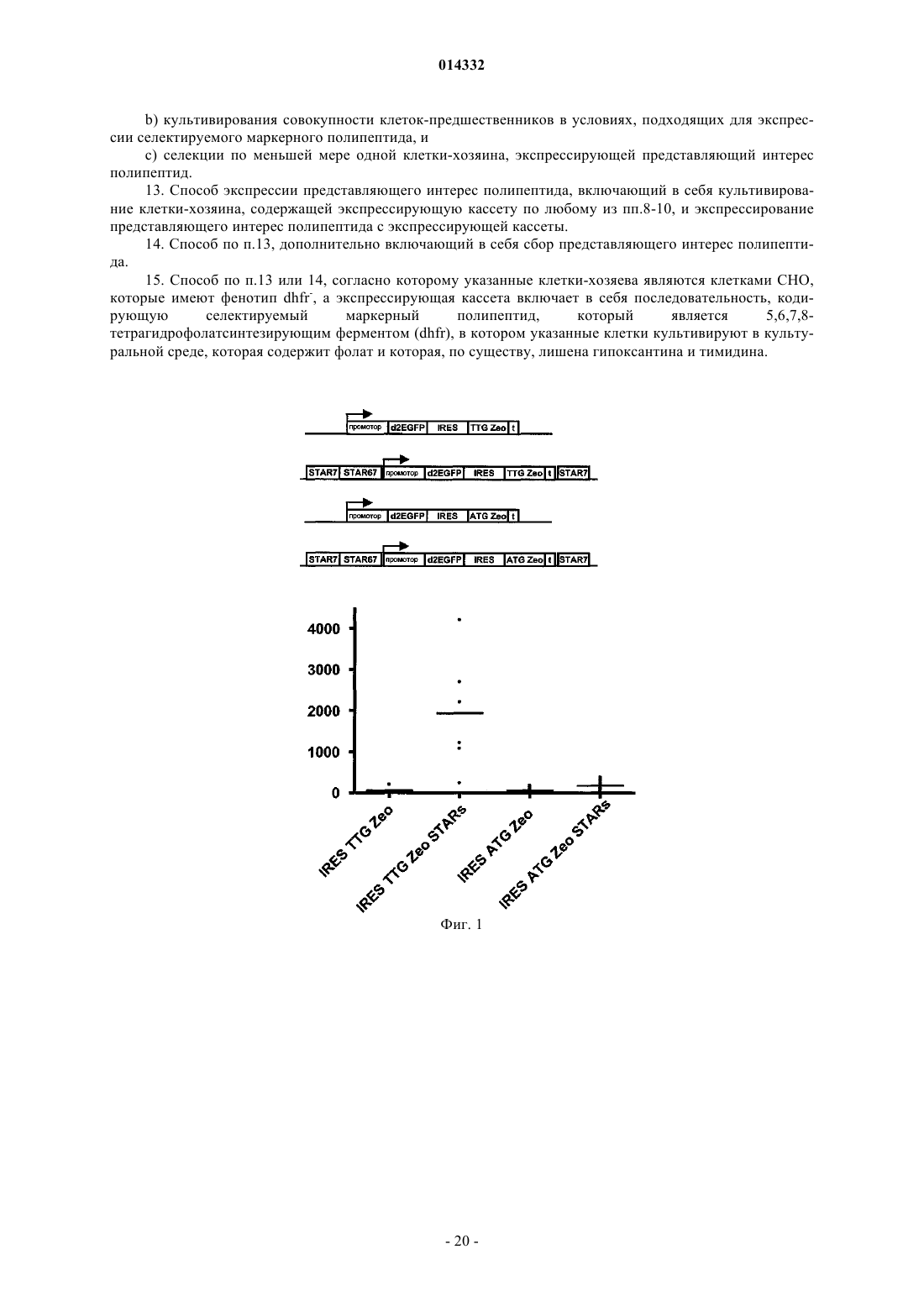
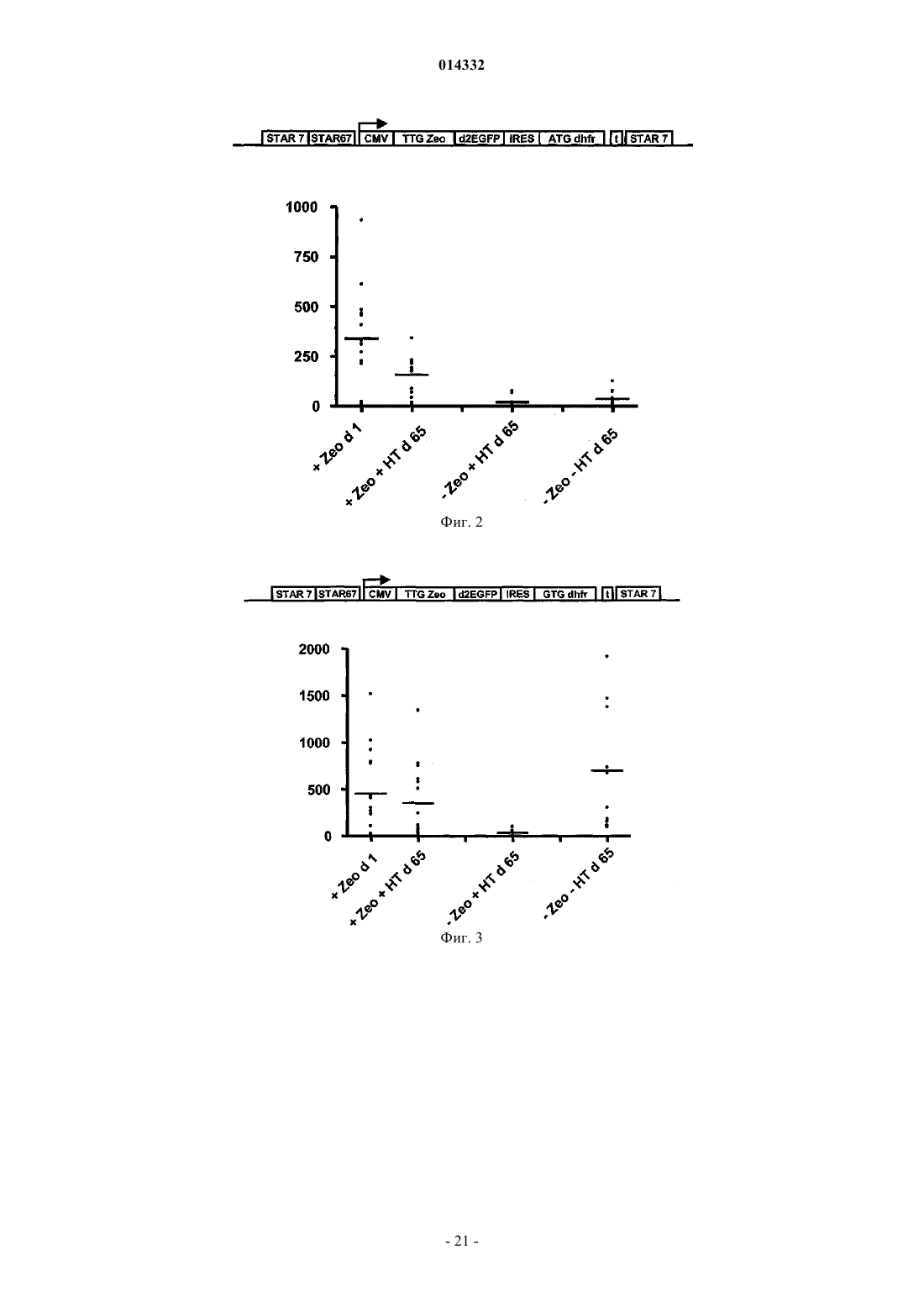
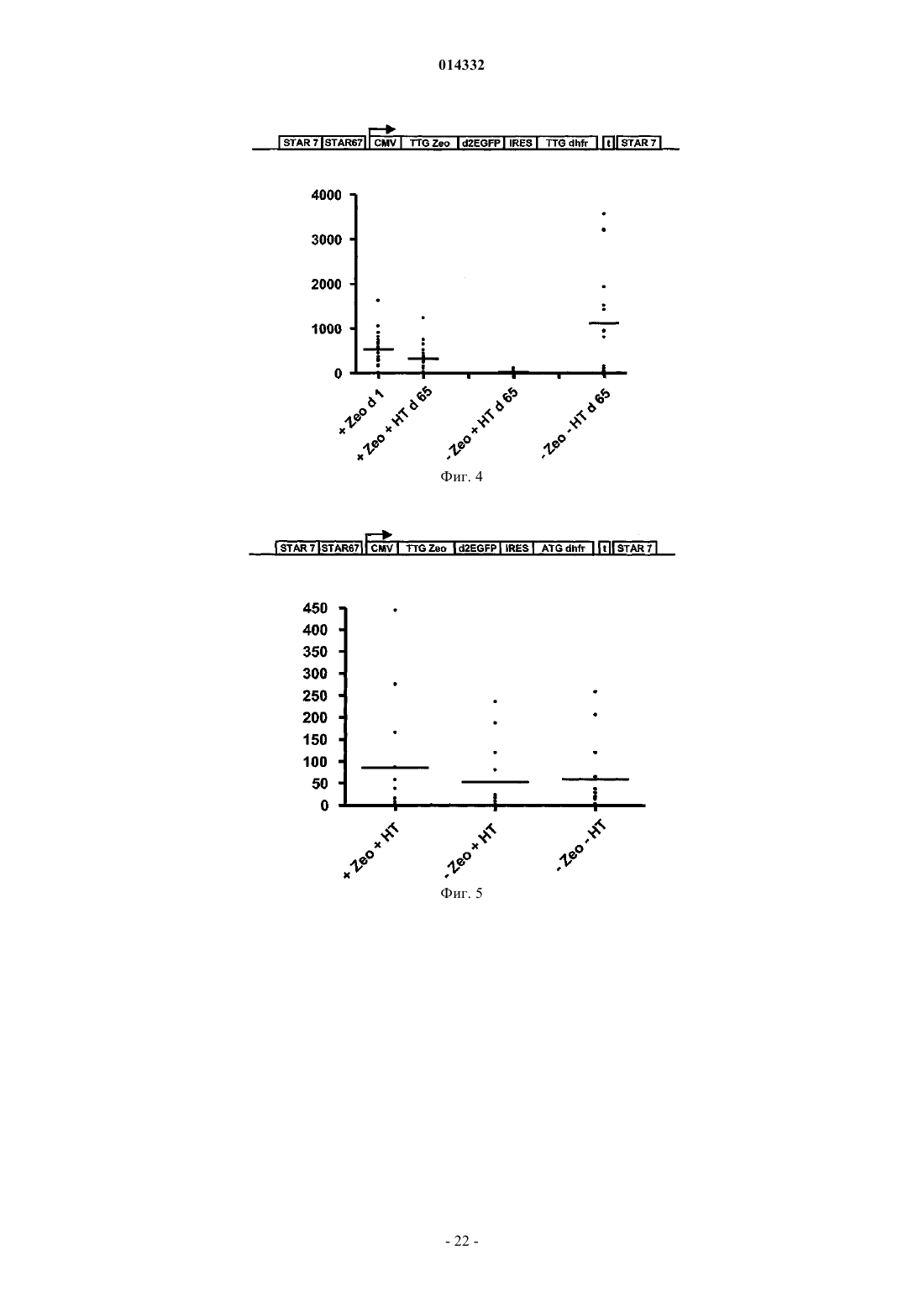
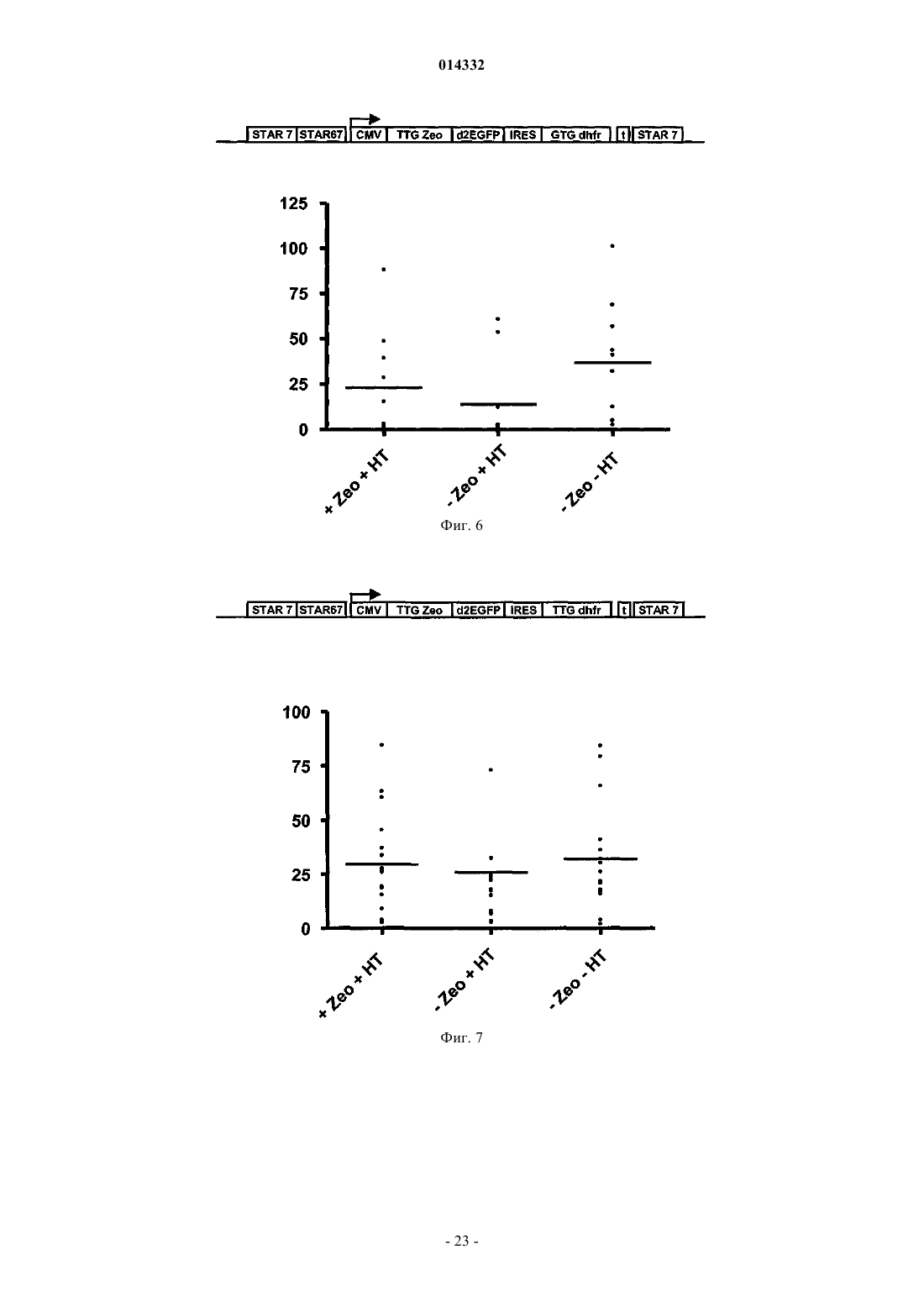
Селекция клеток-хозяев, экспрессирующих белок на высоких уровнях
Номер патента: 14332
Опубликовано: 29.10.2010
Авторы: Квакс Теодорус Хендрикус Якобус, Отте Ари Питер, Севалт Ричард Георг Антониус Бернардус, Ван Блокланд Хенрикус Йоханнес Мария
Формула / Реферат
1. Молекула ДНК, содержащая мультицистронную единицу транскрипции, включающую в себя по меньшей мере одну кодирующую последовательность, кодирующую
I) как представляющий интерес полипептид, так и
II) селектируемый маркерный полипептид, функциональный в эукариотической клетке-хозяине,
в которой представляющий интерес полипептид имеет последовательность инициации трансляции, отдельную от последовательности инициации трансляции селектируемого маркерного полипептида,
в которой по меньшей мере одна последовательность, кодирующая представляющий интерес полипептид, находится выше по меньшей мере одной последовательности, кодирующей селектируемый маркерный полипептид в указанной мультицистронной единице транскрипции,
в которой сайт внутреннего входа в рибосому (IRES) находится ниже по меньшей мере одной последовательности, кодирующей представляющий интерес полипептид, и выше по меньшей мере одной последовательности, кодирующей селектируемый маркерный полипептид,
и отличающаяся тем, что последовательность, кодирующая селектируемый маркерный полипептид, включает в себя последовательность старта трансляции, выбранную из группы, состоящей из:
a) старт-кодона GTG;
b) старт-кодона TTG;
c) старт-кодона CTG;
d) старт-кодона АТТ и
e) старт-кодона ACG.
2. Молекула ДНК по п.1, в которой последовательность старта трансляции селектируемого маркерного полипептида содержит старт-кодон GTG или старт-кодон TTG.
3. Молекула ДНК по любому из предшествующих пунктов, в которой селектируемый маркерный полипептид обеспечивает устойчивость против летальных или ингибирующих рост воздействий селективного агента.
4. Молекула ДНК по п.3, в которой указанный селективный агент выбран из группы, состоящей из зеоцина, пуромицина, бластицидина, гигромицина, неомицина, метотрексата, метионин-сульфоксимина и канамицина.
5. Молекула ДНК по п.3, в которой селективный агент является зеоцином.
6. Молекула ДНК по п.1 или 2, в которой селектируемый маркерный полипептид является 5,6,7,8-тетрагидрофолатсинтезирующим ферментом (dhfr).
7. Молекула ДНК по любому из предшествующих пунктов, в которой мультицистронная единица транскрипции дополнительно содержит последовательность, кодирующую второй селектируемый маркерный полипептид, функциональный в эукариотической клетке, в которой указанная последовательность, кодирующая второй селектируемый маркерный полипептид,
a) имеет последовательность инициации трансляции, отдельную от последовательности инициации трансляции представляющего интерес полипептида,
b) расположена выше указанной последовательности, кодирующей представляющий интерес полипептид,
c) не имеет никакой последовательности ATG в кодирующей цепи после старт-кодона указанного второго селектируемого маркерного полипептида и вплоть до старт-кодона представляющего интерес полипептида и
d) имеет старт-кодон GTG или старт-кодон TTG.
8. Экспрессирующая кассета, содержащая молекулу ДНК по любому из предшествующих пунктов, включающая в себя промотор выше указанной мультицистронной единицы транскрипции и последовательность терминации транскрипции ниже мультицистронной единицы транскрипции, где указанная экспрессирующая кассета является функциональной в эукариотической клетке-хозяине для инициации транскрипции мультицистронной единицы транскрипции.
9. Экспрессирующая кассета по п.8, дополнительно включающая в себя по меньшей мере один хроматиновый контрольный элемент, выбранный из группы, состоящей из матрикс- или скаффолд-ассоциированного участка (MAR/SAR), инсуляторной последовательности, universal chromatin opening element (UCOE) и антирепрессорной последовательности (STAR).
10. Экспрессирующая кассета по п.9, в которой указанный по меньшей мере один хроматиновый контрольный элемент является антирепрессорной последовательностью, выбранной из группы, состоящей из
a) любой последовательности от SEQ. ID. NO. 1 до SEQ. ID. NO. 66;
b) фрагментов любой последовательности от SEQ. ID. NO. 1 до SEQ. ID. NO. 66, где указанные фрагменты имеют антирепрессорную активность;
c) последовательностей, которые по меньшей мере на 70% идентичны нуклеотидной последовательности а) или b), где указанные последовательности имеют антирепрессорную активность; и
d) последовательность, комплементарную любой последовательности от а) до с).
11. Клетка-хозяин, содержащая молекулу ДНК по любому из пп.1-7 или экспрессирующую кассету по любому из пп.8-10, где клетка-хозяин предпочтительно является клеткой млекопитающего, предпочтительно клеткой яичника китайского хомячка (СНО).
12. Способ производства клетки-хозяина, способной экспрессировать представляющий интерес полипептид, включающий в себя стадии:
a) введения в совокупность клеток-предшественников молекулы ДНК по любому из пп.1-7 или экспрессирующей кассеты по любому из пп.8-10,
b) культивирования совокупности клеток-предшественников в условиях, подходящих для экспрессии селектируемого маркерного полипептида, и
c) селекции по меньшей мере одной клетки-хозяина, экспрессирующей представляющий интерес полипептид.
13. Способ экспрессии представляющего интерес полипептида, включающий в себя культивирование клетки-хозяина, содержащей экспрессирующую кассету по любому из пп.8-10, и экспрессирование представляющего интерес полипептида с экспрессирующей кассеты.
14. Способ по п.13, дополнительно включающий в себя сбор представляющего интерес полипептида.
15. Способ по п.13 или 14, согласно которому указанные клетки-хозяева являются клетками СНО, которые имеют фенотип dhfr-, а экспрессирующая кассета включает в себя последовательность, кодирующую селектируемый маркерный полипептид, который является 5,6,7,8-тетрагидрофолатсинтезирующим ферментом (dhfr), в котором указанные клетки культивируют в культуральной среде, которая содержит фолат и которая, по существу, лишена гипоксантина и тимидина.

Текст
СЕЛЕКЦИЯ КЛЕТОК-ХОЗЯЕВ, ЭКСПРЕССИРУЮЩИХ БЕЛОК НА ВЫСОКИХ УРОВНЯХ Изобретение связано с молекулой ДНК, содержащей мультицистронную единицу транскрипции,кодирующую: i) представляющий интерес полипептид и ii) селектируемый маркерный полипептид, функциональный в эукариотической клетке-хозяине, в которой представляющий интерес полипептид имеет последовательность инициации трансляции, отделенную от последовательности инициации трансляции селектируемого маркерного полипептида, и в которой последовательность, кодирующая представляющий интерес полипептид, находится выше последовательности, кодирующей селектируемый маркерный полипептид в указанной мультицистронной единице транскрипции, и в которой сайт внутреннего входа в рибосому (IRES) находится ниже последовательности, кодирующей представляющий интерес полипептид, и выше последовательности, кодирующей селектируемый маркерный полипептид, и в которой последовательность нуклеиновой кислоты, кодирующая селектируемый маркерный полипептид в кодирующей цепи,включает в себя старт-кодон GTG или TTG. Изобретение связано также со способами получения клеток-хозяев, экспрессирующих представляющий интерес полипептид и включающих в себя молекулы ДНК согласно изобретению. Изобретение дополнительно связано с продуцированием представляющих интерес полипептидов, предусматривающим культивирование клеток-хозяев,включающих в себя молекулы ДНК согласно изобретению. Отте Ари Питер, Ван Блокланд Хенрикус Йоханнес Мария, Квакс Теодорус Хендрикус Якобус, Севалт Ричард Георг Антониус Бернардус (NL) 014332 Область техники, к которой относится изобретение Изобретение относится к области молекулярной биологии и биотехнологии. Более определенно, настоящее изобретение относится к средствам и способам улучшения селекции клеток-хозяев, которые экспрессируют белки на высоких уровнях. Уровень техники Белки могут продуцироваться в различных клетках-хозяевах для широкого спектра применений в биологии и биотехнологии, например, в качестве биопрепаратов. Для этой цели эукариотические и особенно клетки-хозяева млекопитающих являются предпочтительными для экспрессии многих белков, например, когда такие белки имеют определенные посттрансляционные модификации, такие как гликозилирование. Способы такого производства являются общепринятыми и, как правило, вызывают экспрессию нуклеиновой кислоты (также называемой трансгеном), кодирующей представляющий интерес белок в клетке-хозяине. Обычно трансген вместе с селектируемым маркерным геном вводят в клеткупредшественник, клетки выбирают по экспрессии селектируемого маркерного гена, и определяют один или более клонов, которые экспрессируют представляющий интерес белок на высоких уровнях, и используют для экспрессии представляющего интерес белка. Одна проблема, связанная с экспрессией трансгенов, состоит в том, что экспрессия является непредсказуемой вследствие высокой вероятности того, что трансген станет неактивным из-за подавления транскрипции гена (McBurney et al., 2002), и поэтому клоны клеток-хозяев необходимо проверять на предмет высокой экспрессии трансгена. Способы селекции рекомбинантных клеток-хозяев, которые экспрессируют относительно высокие уровни желаемых белков, известны, и во введении международной заявки WO 2006/048459, приведенной здесь в качестве ссылки, обсуждается несколько таких способов. В некоторых эффективных способах предшествующего уровня техники бицистронные векторы экспрессии были описаны для быстрого и эффективного создания устойчивых клеточных линий млекопитающих, экспрессирующих рекомбинантный белок. Эти векторы содержат сайт внутреннего входа в рибосому (IRES) между лежащей выше последовательностью, кодирующей представляющий интерес белок, и низлежащей последовательностью, кодирующей маркер селекции (Rees et al., 1996). Такие векторы коммерчески доступны: например, векторы pIRESl от Clontech (CLONTECHniques, октябрь 1996). Используя такие векторы для введения в клетки-хозяева, производят селекцию клеток с достаточно высокой экспрессией лежащего ниже маркерного белка, автоматически получая высокие уровни транскрипции мультицистронной мРНК и, следовательно, с использованием таких векторов можно значительно повысить вероятность получения высокой экспрессии представляющего интерес белка. В таких способах предпочтительно, чтобы используемый IRES был таким IRES, который дает относительно низкий уровень трансляции маркерного гена селекции, для дальнейшего повышения шансов отбора клетокхозяев с высоким уровнем экспрессии представляющего интерес белка путем селекции по экспрессии маркерного белка селекции (см., например, WO 03/106684 и WO 2006/005718). Настоящее изобретение предоставляет улучшенные средства и способы селекции клеток-хозяев,экспрессирующих высокие уровни представляющих интерес белков. Сущность изобретения Заявка WO 2006/048459 была подана ранее, но опубликована после даты приоритета заявки, рассматриваемой в данный момент, и приведена здесь в качестве ссылки в полном объеме. В WO 2006/048459 раскрыта концепция селекции клеток-хозяев, экспрессирующих высокие уровни представляющих интерес полипептидов, концепция, упомянутая там как реципрокная взаимозависимая трансляция. В этой концепции используют мультицистронную единицу транскрипции, в которой последовательность, кодирующая селектируемый маркерный полипептид, находится выше последовательности,кодирующей представляющий интерес полипептид, и в которой трансляция селектируемого маркерного полипептида в указанном документе ослаблена в результате мутаций в нем, тогда как трансляция представляющего интерес полипептида очень высока (см., например, фиг. 13 в указанном документе для схематического представления). Настоящее изобретение предоставляет альтернативные средства и способы селекции клеток-хозяев, экспрессирующих высокие уровни полипептида. В одном аспекте изобретение связано с молекулой ДНК, кодирующей мультицистронную единицу транскрипции для i) представляющего интерес полипептида и для ii) селектируемого маркерного полипептида, функционального в эукариотической клетке-хозяине, в которой представляющий интерес полипептид и селектируемый маркерный полипептид имеют разные инициирующие трансляцию последовательности, и в которой последовательность, кодирующая представляющий интерес полипептид, находится выше последовательности, кодирующей селектируемый маркерный полипептид в указанной мультицистронной единице транскрипции, и в которой сайт внутреннего входа в рибосому (IRES) находится ниже последовательности, кодирующей представляющий интерес полипептид, и выше последовательности, кодирующей селектируемый маркерный полипептид, и в которой последовательность нуклеиновой кислоты, кодирующая селектируемый маркерный полипептид в кодирующей цепи, включает в себя последовательность старта трансляции, выбранную из группы, состоящей из а) старт-кодона GTG; b) старт-1 014332 кодона TTG; с) старт-кодона CTG; d) старт-кодона АТТ; и е) старт-кодона ACG. Последовательность старта трансляции в цепи, кодирующей селектируемый маркерный полипептид включает в себя старт-кодон, отличный от старт-кодона ATG, такой как один из последовательностиGTG, TTG, CTG, АТТ или ACG, первые два из них являются наиболее предпочтительными. Такие нeATG-старт-кодоны предпочтительно фланкируют последовательностями, предусматривающими относительно хорошее распознавание не-ATG-последовательностей в качестве старт-кодонов, такое, что по меньшей мере некоторые рибосомы начинают трансляцию с этих старт-кодонов, то есть последовательность старта трансляции предпочтительно включает в себя последовательность АСС[не-ATG-старткодон]G или GCC[нe-ATG-старт-кодон]G. В предпочтительных вариантах осуществления селектируемый маркерный белок обеспечивает устойчивость к летальным и/или ингибирующим рост эффектам селективного агента, такого как антибиотик. Кроме того, изобретение связано с экспрессирующими кассетами, содержащими молекулу ДНК согласно изобретению, экспрессирующие кассеты дополнительно включают в себя промотор, расположенный выше мультицистронной единицы экспрессии и функциональный в эукариотической клеткехозяине, для инициации транскрипции мультицистронной единицы экспрессии, и указанные экспрессирующие кассеты, дополнительно включающие последовательность завершения транскрипции, расположенную ниже мультицистронной единицы экспрессии. В предпочтительных вариантах осуществления данного изобретения такие экспрессирующие кассеты дополнительно включают по меньшей мере один хроматиновый контрольный элемент, выбранный из группы, состоящей из матрикс- или скаффолд-ассоциированного участка (MAR/SAR), инсуляторной последовательности, ubiquitous chromatin opener element (UCOE), и антирепрессорной последовательности. Антирепрессорные последовательности являются предпочтительными в данном аспекте, и в некоторых вариантах осуществления указанные антирепрессорные последовательности выбраны из группы, состоящей из а) любой последовательности от SEQ. ID. NO. 1 до SEQ. ID. NO. 66; b) фрагментов любой последовательности от SEQ. ID. N0. 1 до SEQ. ID. NO. 66, где указанные фрагменты имеют антирепрессорную активность; с) последовательности, которые по меньшей мере на 70% идентичны последовательностям нуклеотидов а) или b) , где указанные последовательности имеют антирепрессорную активность; и d) дополнение к любой последовательности от а) до с). Изобретение также относится к клеткам-хозяевам, включающим в себя молекулы ДНК согласно изобретению. Изобретение дополнительно относится к способу производства клеток-хозяев, экспрессирующих представляющий интерес полипептид, включающему в себя стадии введения в некоторое количество предшественников клеток-хозяев молекулы ДНК или экспрессирующей касссеты согласно изобретению,культивирования клеток в условиях, выбранных для экспрессии селектируемого маркерного полипептида, и отбора по меньшей мере одной клетки-хозяина, продуцирующей представляющий интерес полипептид. В еще одном аспекте изобретение относится к способам продуцирования представляющего интерес полипептида, включающим в себя культивирование клетки-хозяина, содержащей экспрессирующую кассету согласно изобретению, и экспрессию представляющего интерес полипептида с экспрессирующей кассеты. В предпочтительных вариантах осуществления данного изобретения представляющий интерес полипептид дополнительно выделяют из клеток-хозяев и/или из культуральной среды клеток-хозяев. Краткое описание чертежей Фиг. 1. Результаты, полученные с использованием экспрепрессирующих конструктов согласно изобретению. Экспрепрессирующий конструкт содержит последовательность, кодирующую представляющий интерес полипептид (примером которого здесь является d2EGFP), выше IRES, который расположен выше последовательности, кодирующей селектируемый маркер согласно изобретению (примером которого здесь является ген устойчивости к зеоцину со старт-кодоном TTG (TTG Zeo) (или - в контролях - с его нормальным старт-кодоном ATG (ATG Zeo. Подробнее см. пример 1. Точки соответствуют индивидуальным данным; линии показывают средние уровни экспрессии; используемые конструкты обозначены на горизонтальных осях, и схематически изображены выше графика; на вертикальной оси показан сигналd2EGFP. Фиг. 2. Результаты использования трицистронных экспрессирующих кассет с dhfr в качестве поддерживающего маркера. Экспрессирующий конструкт содержит зеоцин-селектируемый маркерный ген со старт-кодоном TTG и отсутствием внутренних последовательностей ATG выше последовательности,кодирующей представляющий интерес полипептид (примером которого здесь является d2EGFP), который дополнительно функционально связан посредством IRES с расположенным ниже метаболическим маркером селекции гена dhfr (со старт-колоном ATG). Точки соответствуют индивидуальным данным(сигнал флуоресценции GFP в колониях ZeoR на вертикальной оси), линии показывают средние уровни экспрессии. Используемый конструкт показан выше графика, условия обозначены на горизонтальной оси-2 014332 Фиг. 3 - как фиг. 2, но с геном dhfr, имеющим старт-кодон GTG. Фиг. 4 - как фиг. 2, но с геном dhfr, имеющим старт-кодон TTG. Фиг. 5 - число копий в клонах с ферментом dhfr (старт-кодон ATG), при различных условиях, подробнее см. пример 3. Фиг. 6 - как фиг. 5, но с геном dhfr, имеющим старт-кодон GTG. Фиг. 7 - как фиг. 5, но с геном dhfr, имеющим старт-кодон TTG. Подробное описание изобретения В одном аспекте изобретение предоставляет молекулу ДНК по п.1. Такая молекула ДНК может использоваться согласно изобретению для получения эукариотических клеток-хозяев, экспрессирующих высокие уровни представляющего интерес полипептида путем селекции по экспрессии селектируемого маркерного полипептида. Одна или более клеток-хозяев, экспрессирующих представляющий интерес полипептид, могут быть идентифицированы последовательно или одновременно и далее использоваться для экспрессии высоких уровней представляющего интерес полипептида. Термин моноцистронный ген определяют как ген, обеспечивающий молекулу РНК, которая кодирует один полипептид. Мультицистронную единицу транскрипции, также называемую мультицистронным геном, определяют как ген, обеспечивающий молекулу РНК, которая кодирует по меньшей мере два полипептида. Термин бицистронный ген определяют как ген, обеспечивающий молекулу РНК,которая кодирует два полипептида. Следовательно, бицистронный ген охватывается определением мультицистронного гена. Используемый здесь термин полипептид включает в себя по меньшей мере пять аминокислот, связанных пептидными связями, и может являться, например, белком или его частью, такой как субъединица. По большей части термины полипептид и белок используются здесь попеременно. Используемые в настоящем изобретении термины ген или единица транскрипции могут включать в себя хромосомную ДНК, кДНК, искусственную ДНК, их комбинации и т.п. Единицы транскрипции,включающие несколько цистронов, расшифровываются как отдельная мРНК. Мультицистронная единица транскрипции согласно изобретению предпочтительно является бицистронной единицей транскрипции, кодирующей от 5' к 3' представляющий интерес полипептид и селектируемый маркерный полипептид. Следовательно, представляющий интерес полипептид кодируется выше последовательности, кодирующей селектируемый маркерный полипептид. IRES функционально связан с последовательностью, кодирующей селектируемый маркерный полипептид, и, следовательно, селектируемый маркерный полипептид при его трансляции зависит от IRES. Предпочтительно использовать отдельные единицы транскрипции для экспрессии различных представляющих интерес полипептидов, также когда они являются частью мультимерного белка (см., например, пример 13 из WO 2006/048459, приведенного здесь в качестве ссылки: тяжелая и легкая цепь антитела каждая кодируется отдельной единицей транскрипции, и каждая из этих единиц экспрессии является бицистронной единицей экспрессии). Молекулы ДНК согласно изобретению могут присутствовать в форме двухцепочечной ДНК,имеющей относительно селектируемого маркерного полипептида и представляющего интерес полипептида кодирующую цепь и некодирующую цепь, кодирующая цепь является цепью с той же самой последовательностью, что и у транслируемой РНК, за исключением присутствия Т вместо U. Следовательно,старт-кодон AUG кодируется в кодирующей цепи последовательностью ATG, и цепь, содержащая эту последовательность ATG, соответствующую старт-кодону AUG в РНК, называется кодирующей цепью ДНК. Специалисту в данной области будет ясно, что старт-кодоны или последовательности инициации трансляции фактически присутствуют в молекуле РНК, но их можно считать в равной степени содержащимися в молекуле ДНК, кодирующей такую молекулу РНК; следовательно, везде, где настоящее изобретение относится к старт-кодону или последовательности инициации трансляции, соответствующая молекула ДНК, имеющая ту же самую последовательность, что и последовательность РНК, но содержащая Т вместо U в кодирующей цепи указанной молекулы ДНК, предусматривается включенной и наоборот, кроме случаев, где специально указано иначе. Другими словами, старт-кодон является, например,последовательностью AUG в РНК, но соответствующая последовательность ATG в кодирующей цепи ДНК также называется старт-кодоном в настоящем изобретении. То же самое используется и при указании на кодирование последовательностей внутри рамки, означая триплеты (3 основания) в молекуле РНК, которые транслируются в аминокислоту, но также и интерпретируются как соответствующие тринуклеотидные последовательности в кодирующей цепи молекулы ДНК. Селектируемый маркерный полипептид и представляющий интерес полипептид, кодируемые мультицистронным геном, имеют свои собственные последовательности инициации трансляции, и поэтому каждый имеет свой собственный старт-кодон (также как и стоп-кодон), то есть они кодируются отдельными открытыми рамками считывания. Термин маркер селекции, или селектируемый маркер, обычно используется в отношении гена и/или белка, присутствие которого может быть прямо или косвенно обнаружено в клетке, например полипептид, который инактивирует селективный агент и защищает клетку-хозяина от летальных или ингибирующих рост воздействий агента (например, ген и/или белок устойчивости к антибиотикам). Другая-3 014332 возможность состоит в том, что указанный маркер селекции вызывает флуоресценцию или цветовое депонирование (например, зеленый флуоресцирующий белок (GFP) и производные (например, d2EGFP),люцифераза, lacZ, щелочная фосфатаза и т.д.), что может использоваться для селекции клеток, экспрессирующих полипептид, вызывающий цветовое депонирование, например, с использованием клеточного сортера с активацией флуоресценции (FACS) для отбора клеток, экспрессирующих GFP. Предпочтительно, чтобы селектируемый маркерный полипептид согласно изобретению обеспечивал устойчивость против летальных и/или ингибирующих рост воздействий селективного агента. Селектируемый маркерный полипептид кодируется ДНК согласно изобретению. Селектируемый маркерный полипептид согласно изобретению должен быть функционален в эукариотической клетке-хозяине и, следовательно, должен обеспечивать селекцию в эукариотических клетках-хозяевах. Любой селектируемый маркерный полипептид, отвечающий этому критерию, в принципе может использоваться согласно настоящему изобретению. Такие селектируемые маркерные полипептиды хорошо известны в данной области и обычно используются, когда должны быть получены клоны эукариотической клетки-хозяина, и несколько таких примеров приведено в данном описании. В некоторых вариантах осуществления маркером селекции,используемым для изобретения, является зеоцин. В других вариантах осуществления используют бластицидин. Специалисту в данной области известно, что доступны и могут использовать также и другие маркеры селекции, например неомицин, пуромицин, блеомицин, гигромицин и т.д. В других вариантах осуществления используют канамицин. В еще других вариантах осуществления ген DHFR используют в качестве селектируемого маркера, который может быть отобран с помощью метотрексата, особенно путем увеличения концентрации метотрексата клетки могут быть отобраны для увеличения числа копий гена DHFR. Ген DHFR также может использоваться для того, чтобы служить для восполнения dhfrдефицита, например, в клетках СНО, которые имеют фенотип dhfr-, в культуральной среде с фолатом и недостатком глицина, гипоксантина и тимидина. Точно так же может использоваться ген глутаминсинтетазы (GS), для которого селекция возможна в клетках, имеющих недостаток GS (например, NS-Oклетки), путем культивирования в средах без глутамина или, альтернативно, в клетках, имеющих достаточный уровень GS (например, клетки СНО) путем добавления ингибитора GS метионинсульфоксимина(MSX). Другие селектируемые маркерные гены, которые могут использоваться, а также их селективные агенты, например, описаны в табл. 1 патента США 5561053, приведенного здесь в качестве ссылки; см. также Kaufman, Methods in Enzymology, 185:537-566 (1990), в качестве обзора. Если селектируемым маркерным полипептидом является dhfr, клетку-хозяина в преимущественных вариантах осуществления культивируют в культуральной среде, содержащей фолат, и культуральная среда является абсолютно лишенной гипоксантина и тимидина, а предпочтительно, также и глицина. В случае если две мультицистронные единицы транскрипции должны быть выбраны согласно изобретению в отдельной клетке-хозяине, каждая предпочтительно содержит последовательность, кодирующую различный селектируемый маркер, чтобы допустить селекцию для обеих мультицистронных единиц транскрипции. Конечно, обе мультицистронные единицы транскрипции могут присутствовать на отдельной молекуле нуклеиновой кислоты, или, альтернативно, каждая может присутствовать на отдельной молекуле нуклеиновой кислоты. Термин селекция обычно определяют как процесс использования маркера селекции/селектируемого маркера и селективного агента для идентификации клеток-хозяев с определенными генетическими свойствами (например, когда клетка-хозяин содержит трансген, интегрированный в ее геном). Специалисту в данной области понятно, что возможны многочисленные комбинации маркеров селекции. Одним антибиотиком, который является особенно предпочтительным, является зеоцин, потому что белок устойчивости к зеоцину (зеоцин-R) действует путем связывания лекарственного препарата и обезвреживания его. Поэтому легко титровать количество лекарственного препарата, которое уничтожает клетки с низкими уровнями экспрессии зеоцина-R, позволяя клеткам с высокой экспрессией выжить. Все другие повсеместно принятые белки антибиотической устойчивости являются ферментами, и таким образом действуют каталитически (не 1:1 с лекарственным препаратом). Следовательно, антибиотик зеоцин является предпочтительным маркером селекции. Другим предпочтительным маркером селекции является 5,6,7,8-тетрагидрофолатсинтезирующий фермент(dhfr). Однако изобретение работает также и с другими маркерами селекции. Селектируемый маркерный полипептид согласно изобретению является белком, который кодируется нуклеиновой кислотой согласно изобретению, полипептид может функционально использоваться для селекции, например, потому что он обеспечивает устойчивость к селективному агенту, такому как антибиотик. Следовательно, когда в качестве селективного агента используется антибиотик, ДНК кодирует полипептид, который придает устойчивость к селективному агенту, полипептид является селектируемым маркерным полипептидом. Известно кодирование последовательностей ДНК для таких селектируемых маркерных полипептидов, и здесь представлено несколько примеров последовательностей ДНК дикого типа,кодирующих селектируемые маркерные белки (например, фиг. 26-32 из WO 2006/048459, приведенного здесь в качестве ссылки). Очевидно, что мутанты или производные селектируемых маркеров также могут,соответственно, использоваться согласно изобретению, и поэтому они охватываются термином селектируемый маркерный полипептид, пока селектируемый маркерный белок остается функциональ-4 014332 ным. Для удобства и как общепринято специалистами, во многих публикациях, также как здесь, часто ген и белок, кодирующие устойчивость к селективному агенту, называются геном устойчивости к селективному агенту или белком устойчивости к селективному агенту, соответственно, хотя официальные названия могут быть отличными, например, ген, кодирующий белок, придающий устойчивость к неомицину (также как и к G418 и канамицину), часто называют геном устойчивости к неомицину (илиneor), в то время как официальным названием является ген аминогликозид-3'-фосфотрансферазы. Для целей настоящего изобретения выгодно иметь низкие уровни экспрессии селектируемого маркерного полипептида, так, чтобы была возможна жесткая селекция. В настоящем изобретении это осуществляют путем использования селектируемого маркера, кодирующего последовательность с не-ATGстарт-кодоном. После селекции будут выбраны только клетки, имеющие, тем не менее, достаточные уровни селектируемого маркерного полипептида, что означает, что такие клетки должны иметь достаточную транскрипцию мультицистронной единицы транскрипции и достаточную трансляцию селектируемого маркерного полипептида, который обеспечивает селекцию клеток, где мультицистронная единица транскрипции интегрирована или иначе представлена в клетках-хозяевах в месте, где уровни экспрессии от этой единицы транскрипции являются высокими. Молекулы ДНК согласно изобретению имеют последовательность, кодирующую селектируемый маркерный полипептид ниже последовательности, кодирующей представляющий интерес полипептид. Следовательно, мультицистронная единица транскрипции включает в себя в направлении от 5' к 3' (как в транскрибированной цепи ДНК, так и в полученной в результате транскрибированной РНК) последовательность, кодирующую представляющий интерес полипептид и последовательность, кодирующую селектируемый маркерный полипептид. IRES находится выше последовательности, кодирующей селектируемый маркерный полипептид. Согласно изобретению кодирующая область представляющего интерес гена предпочтительно транслируется с кэп-зависимой открытой рамкой считывания (ORF), и представляющий интерес полипептид продуцируется в большом количестве. Селектируемый маркерный полипептид транслируется сIRES. Для уменьшения трансляции цистрона селектируемого маркера, согласно изобретению, последовательность нуклеиновой кислоты, кодирующая селектируемый маркерный полипептид, включает в себя мутацию в старт-кодоне, которая уменьшает эффективность инициации трансляции селектируемого маркерного полипептида в эукариотической клетке-хозяине. Предпочтительно, чтобы старт-кодон GTG или более предпочтительно старт-кодон TTG был встроен в селектируемый маркерный полипептид. Эффективность трансляции ниже, чем трансляция соответствующей последовательности дикого типа в той же самой клетке, то есть мутация приводит к меньшему количеству полипептида на клетку в единицу времени и, следовательно, меньшему количеству селектируемого маркерного полипептида. Последовательность старта трансляции часто упоминается в данной области как последовательность Козака, и оптимальной последовательностью Козака является RCCATGG, старт-кодон подчеркнут, R является пурином, то есть А или G (см. М. Kozak, 1986, 1987, 1989, 1990, 1997, 2002) . Следовательно, помимо непосредственно старт-кодона, его окружение, в конкретных нуклеотидах от -3 до -1 и+4, является соответствующим, и оптимальная последовательность старта трансляции включает в себя оптимальный старт-кодон (то есть ATG) в оптимальном окружении (то есть ATG, которому непосредственно предшествует RCC и непосредственно за которым следует G). Трансляция посредством рибосом является самой эффективной, когда присутствует оптимальная последовательность Козака (см. М. Kozak,1986, 1987, 1989, 1990, 1997, 2002). Однако в небольшом проценте случаев неоптимальные последовательности инициации трансляции распознаются и используются рибосомой для старта трансляции. Настоящее изобретение использует этот принцип и дает возможность уменьшать и даже тонко регулировать уровень трансляции и, следовательно, экспрессии селектируемого маркерного полипептида, который поэтому может использоваться для увеличения жесткости системы селекции. Старт-кодон ATG селектируемого маркерного полипептида в изобретении был мутирован в другой кодон, который, как сообщалось, обеспечивает некоторую инициацию трансляции, например, в GTG,TTG, CTG, ATT или ACG (обобщенно упомянутые здесь как нe-ATG-старт-кодоны). В предпочтительных вариантах осуществления старт-кодон ATG был мутирован в старт-кодон GTG. Это обеспечивает еще более низкие уровни экспрессии (более низкая трансляция), чем с неповрежденным старт-кодономATG, но в неоптимальном окружении. Более предпочтительно, чтобы старт-кодон ATG был мутирован в старт-кодон TTG, который обеспечивает еще более низкие уровни экспрессии селектируемого маркерного полипептида, чем со старт-кодоном GTG (Kozak M., 1986, 1987, 1989, 1990, 1997, 2002; см. также примеры 9-13 в WO 2006/048459, приведенного здесь в качестве ссылки). Использование нe-ATG-старткодонов в последовательности, кодирующей селектируемый маркерный полипептид в мультицистронной единице транскрипции согласно настоящему изобретению, не было ни раскрыто, ни предложено в предшествующей области техники и предпочтительно в комбинации с хроматиновыми контрольными элементами, приводит к очень высоким уровням экспрессии представляющего интерес полипептида, что также показано в WO 2006/048459, приведенном здесь в качестве ссылки.-5 014332 Для использования нe-ATG-старт-кодона согласно изобретению весьма предпочтительно обеспечить оптимальное окружение для такого старт-кодона, то есть нe-ATG-старт-кодонам предпочтительно непосредственно предшествуют нуклеотиды RCC в положениях от -3 до -1, и непосредственно за ними следует нуклеотид G (положение +4). Однако сообщалось, что при использовании последовательностиTTTGTGG (старт-кодон подчеркнут), некоторую инициацию наблюдали, по меньшей мере, in vitro, таким образом, хотя это весьма предпочтительно, возможно, абсолютно не обязательно обеспечивать оптимальное окружение для нe-ATG-старт-кодонов. Последовательности ATG в пределах последовательности, кодирующей полипептид, за исключением старт-кодона ATG, называются внутренними ATG, и если они находятся внутри рамки с ORF и поэтому кодируют метионин, полученный метионин в полипептиде называется внутренним метионином. В изобретении WO 2006/048459 кодирующая область (следующая за старт-кодоном, необязательно включающая старт-кодон), кодирующая селектируемый маркерный полипептид, лишена последовательности ATG в кодирующей цепи ДНК вплоть до (но не включительно) старт-кодона представляющего интерес полипептида. В WO 2006/048459 описано, как это осуществить и как проверить полученный селектируемый маркерный полипептид на фунциональность. Для настоящего изобретения, где последовательность, кодирующая селектируемый маркерный полипептид, находится ниже IRES и ниже последовательности, кодирующей представляющий интерес полипептид, внутренние ATG в последовательности,кодирующей селектируемый маркерный полипептид, могут остаться интактными. Понятно, что, согласно настоящему изобретению, весьма предпочтительно, чтобы последовательность старта трансляции представляющего интерес полипептида включала в себя оптимальную последовательность старта трансляции, то есть имела консенсусную последовательность RCCATGG (старткодон подчеркнут). Это приведет к очень эффективной трансляции представляющего интерес полипептида. Строгость селекции может быть увеличена путем предоставления кодирующей последовательности маркера с различными мутациями, приводящими к нескольким уровням уменьшения эффективности трансляции. Тонкая настройка системы селекции, таким образом, возможна с использованием мультицистронных единиц транскрипции согласно изобретению: например, при использовании старт-кодонаGTG для маркерного полипептида селекции только немного рибосом будут транслировать с этого старткодона, что приводит к низким уровням селектируемого маркерного белка и, следовательно, к высокой жесткости селекции; при использовании старт-кодона TTG жесткость селекции еще больше увеличивается, потому что еще меньше рибосом будут транслировать селектируемый маркерный полипептид с этого старт-кодона. В WO 2006/048459, приведенном здесь в качестве ссылки, показано, что раскрытые там мультицистронные единицы экспрессии могут использоваться в очень надежной системе селекции, приводя к очень большому проценту клонов, которые экспрессируют представляющий интерес полипептид на высоких уровнях, что является желаемым. Кроме того, уровни экспрессии, полученные для представляющего интерес полипептида, оказываются значительно выше, чем полученные, когда даже большее число колоний проверяют с использованием известных до настоящего времени систем селекции. В дополнение к уменьшению эффективности инициации трансляции может быть выгодно также обеспечить уменьшение эффективности элонгации трансляции селектируемого маркерного полипептида,например, путем мутации его кодирующей последовательности так, чтобы она включала несколько непредпочтительных кодонов клетки-хозяина, чтобы дополнительно уменьшить уровни трансляции маркерного полипептида и сделать возможными еще более строгие условия селекции, если это желательно. В некоторых вариантах осуществления, помимо мутации(й), которые уменьшают эффективность трансляции согласно изобретению, селектируемый маркерный полипептид дополнительно включает мутацию,которая уменьшает активность селектируемого маркерного полипептида по сравнению с его аналогом дикого типа. Это можно использовать для дальнейшего увеличения строгости селекции. В качестве неограничивающих примеров, пролин в положении 9 в полипептиде устойчивости к зеоцину может мутировать, например, в Thr или Phe (см., например, пример 14 из WO 2006/048459, приведенного здесь в качестве ссылки), и для полипептида устойчивости к неомицину, остаток аминокислоты 182 или 261, или оба остатка могут быть дополнительно подвергнуты мутации (см., например, WO 01/32901). В некоторых вариантах осуществления изобретения так называемая спейсерная область помещена ниже последовательности, кодирующей старт-кодон селектируемого маркерного полипептида, спейсерная область предпочтительно является последовательностью внутри рамки со старт-кодоном и кодирует несколько аминокислот, и она не содержит вторичную структуру (Kozak, 1990). Такая спейсерная область может использоваться для дополнительного уменьшения частоты инициации трансляции, если вторичная структура присутствует в РНК (Kozak, 1990) селектируемого маркерного полипептида (например, для зеоцина, возможно, для бластицидина) и, следовательно, увеличения строгости системы селекции согласно изобретению (см., например, пример 14 из WO 2006/048459, приведенного здесь в качестве ссылки). Понятно, что любые молекулы ДНК, как описано, но имеющие мутации в последовательности ниже-6 014332 первого ATG (старт-кодон), кодирующие селектируемый маркерный белок, могут также быть использованы и, таким образом, также охвачены в изобретении, пока соответствующий кодируемый селектируемый маркерный белок все еще имеет активность. Например, любые молчащие мутации, которые не меняют кодируемый белок вследствие вырожденности генетического кода, также являются охваченными. Дальнейшие мутации, которые приводят к мутациям консервативных аминокислот или к другим мутациям, также являются охваченными, пока кодируемый белок все еще имеет активность, которая может быть или не быть ниже чем активность белка дикого типа, кодируемого указанными последовательностями. В частности, предпочтительно, чтобы кодируемый белок был по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95% идентичен белкам, кодируемым соответствующими указанными последовательностями (например, как предоставлено в SEQ ID NO 68-80 из списка последовательностей настоящей заявки). Тестирование активности селектируемых маркерных белков может быть проведено обычными способами. Предпочтительный аспект изобретения связан с экспрессирующей кассетой, содержащей молекулу ДНК согласно изобретению, содержащей мультицистронную единицу транскрипции. Такая экспрессирующая кассета используется для экспрессии представляющих интерес последовательностей, например,в клетках-хозяевах. Использующаяся здесь экспрессирующая кассета является последовательностью нуклеиновой кислоты, включающей в себя, по меньшей мере, промотор, функционально связанный с последовательностью, экспрессия которой требуется. Предпочтительно, чтобы экспрессирующая кассета дополнительно содержала последовательности терминации транскрипции и полиаденилирования. Другие регулирующие последовательности, такие как энхансеры, также могут быть включены. Следовательно, изобретение связано с экспрессирующей кассетой, включающей в себя, в следующем порядке, 5'промотор - мультицистронную единицу транскрипции согласно изобретению, кодирующую представляющий интерес полипептид, и ниже нее селектируемый маркерный полипептид - последовательность терминации транскрипции - 3'. Промотор должен быть функционирующим в эукариотической клеткехозяине, то есть он должен быть способен обеспечивать транскрипцию мультицистронной единицы транскрипции. Промотор, таким образом, функционально связан с мультицистронной единицей транскрипции. Экспрессирующая кассета дополнительно может содержать и другие элементы, известные в данной области, например сайты сплайсинга для включения интронов и т.п. В некоторых вариантах осуществления интрон находится за промотором и перед последовательностью, кодирующей представляющий интерес полипептид. IRES функционально связан с цистроном, который содержит последовательность, кодирующую селектируемый маркерный полипептид. В дальнейших вариантах осуществления последовательность, кодирующая второй селектируемый маркер, присутствует в мультицистронной единице транскрипции (то есть она является по меньшей мере трицистронной единицей транскрипции в этих вариантах осуществления). В предпочтительных вариантах осуществления изобретения указанная последовательность, кодирующая второй селектируемый маркерный полипептид, а) имеет последовательность инициации трансляции, отдельную от таковой представляющего интерес полипептида, b) находится выше указанной последовательности, кодирующей представляющий интерес полипептид, с) не имеет последовательности ATG в кодирующей цепи после старт-кодона указанного второго селектируемого маркерного полипептида вплоть до старт-кодона представляющего интерес полипептида, и d) имеет неоптимальную последовательность старта трансляции, например старт-кодон GTG или старт-кодонTTG. Для таких вариантов осуществления предпочтительным селектируемым маркерным полипептидом является 5,6,7,8-тетрагидрофолатсинтезирующий фермент (dhfr). Это дает возможность непрерывной селекции высоких уровней экспрессии представляющего интерес полипептида, как проиллюстрировано в примере 2. Для получения экспрессии последовательностей нуклеиновой кислоты, кодирующих белок, специалистам в данной области хорошо известно, что последовательности, способные к проведению такой экспрессии, могут быть функционально связаны с последовательностями нуклеиновой кислоты, кодирующими белок, что приводит к рекомбинантным молекулам нуклеиновой кислоты, кодирующим белок в экспрессируемом формате. В настоящем изобретении экспрессирующая кассета включает в себя мультицистронную единицу транскрипции. Как правило, последовательность промотора помещена выше последовательностей, которые должны экспрессироваться. Наиболее используемые векторы экспрессии доступны в данной области, например, группы векторов pcDNA и pEF от Invitrogen, pMSCV и pTK-Hyg от BD Sciences, pCMV-Script от Stratagene и т.д., которые можно использовать для получения подходящих промоторов и/или последовательностей терминатора транскрипции, polyA-последовательностей и т.п. В случае когда последовательность, кодирующую представляющий интерес полипептид, должным образом встраивают, со ссылкой на последовательности, управляющие транскрипцией и трансляцией кодируемого полипептида, получающаяся экспрессирующая кассета используется для продуцирования представляющего интерес полипептида, называемого экспрессией. Последовательности, управляющие экспрессией, могут включать в себя промоторы, энхансеры и т.п., и их комбинации. Они должны быть функциональными в клетке-хозяине, таким образом проводя экспрессию последовательностей нуклеи-7 014332 новой кислоты, которые функционально связаны с ними. Специалисту в данной области известно, что для получения экспрессии гена в клетках-хозяевах могут использоваться различные промоторы. Промоторы могут быть конститутивными или регулируемыми и могут быть получены из различных источников, включая вирусы, прокариотические или эукариотические источники, или искусственно разработаны. Экспрессия представляющих интерес нуклеиновых кислот может происходить от естественного промотора или его производного или от полностью гетерологичного промотора (Kaufman, 2000). Согласно настоящему изобретению предпочтительными являются сильные промоторы, которые дают высокие уровни транскрипции в эукариотических клетках. Подходящие промоторы известны и доступны специалистам, и некоторые описаны в WO 2006/048459 (например, стр. 28-29), приведенном здесь в качестве ссылки, включая предранний (IE) промотор CMV (упоминаемый здесь как CMV-промотор) (доступный,например, из pcDNA, Invitrogen) и многие другие. В некоторых вариантах осуществления молекула ДНК согласно изобретению является частью вектора, например, плазмидой. Такими векторами можно легко управлять способами, известными специалисту в данной области, и они могут быть, например, приспособлены к репликации в прокариотических и/или эукариотических клетках. Кроме того, многие векторы можно непосредственно или в виде их требуемого изолированного фрагмента использовать для преобразования эукариотических клеток и интегрировать полностью или частично в геном таких клеток, получая в результате устойчивые клеткихозяева, включающие требуемую нуклеиновую кислоту в своем геноме. Обычные системы экспрессии являются молекулами ДНК в виде рекомбинантной плазмиды или рекомбинантного вирусного генома. Плазмиду или вирусный геном вводят в (эукариотические) клетки(хозяева) и предпочтительно интегрируют в их геномы способами, известными в данной области, и некоторые аспекты этого были описаны в WO 2006/048459 (например, стр. 30-31), приведенном здесь в качестве ссылки. Широко известно, что хроматиновая структура и другие эпигенетические механизмы контроля могут влиять на экспрессию трансгенов в эукариотических клетках (например, Whitelaw et al., 2001). Мультицистронные единицы экспрессии согласно изобретению являются частью системы селекции с достаточно жесткими условиями селекции. Это, как правило, требует высоких уровней транскрипции в выбранных клетках-хозяевах. Для увеличения возможности обнаружения клонов клеток-хозяев, которые выдерживают жесткие условия селекции, и, возможно, увеличения стабильности экспрессии в полученных клонах обычно будет предпочтительно повысить степень прогнозируемости транскрипции. Поэтому в предпочтительных вариантах осуществления экспрессирующая кассета согласно изобретению дополнительно включает в себя по меньшей мере один хроматиновый контрольный элемент. Используемый здесь термин хроматиновый контрольный элемент является собирательным термином для последовательностей ДНК, которые могут так или иначе оказывать воздействие на хроматиновую структуру и вместе с тем на уровень экспрессии и/или стабильность экспрессии трансгенов в их соседстве (они функционируют in cis и, следовательно, размещены предпочтительно, в пределах 5 т.п.н., более предпочтительно, в пределах 2 т.п.н., еще более предпочтительно в пределах 1 т.п.н. от трансгена) в пределах эукариотических клеток. Такие элементы иногда использовали для увеличения числа клонов, имеющих желаемые уровни экспрессии трансгена. Несколько типов таких элементов, которые можно использовать в соответствии с настоящим изобретением, были описаны в WO 2006/048459 (например, стр. 32-34), приведенном здесь в качестве ссылки, и в целях настоящего изобретения хроматиновые контрольные элементы выбраны из группы, состоящей из матрикс- или скаффолд-ассоциированных участков(MAR/SAR), инсуляторов, таких как инсуляторный элемент бета-глобина (5' HS4 локус куриного бетаглобина), scs, scs' и т.п., ubiquitous chromatin opening element (UCOE) и антирепрессорные последовательности (также называемые STAR-последовательности). Предпочтительно, чтобы указанный хроматиновый контрольный элемент являлся антирепрессорной последовательностью, предпочтительно выбранной из группы, состоящей из а) любой последовательности от SEQ. ID. NO. 1 до SEQ. ID. NO. 66; b) фрагментов любой последовательности от SEQ. ID.NO. 1 до SEQ. ID. NO. 66, где указанные фрагменты имеют антирепрессорную активность (функциональные фрагменты); с) последовательности, которые по меньшей мере на 70% идентичны последовательности нуклеотидов а) или b), где указанные последовательности имеют антирепрессорную активность (функциональные производные); и d) дополнение к любой последовательности от а) до с). Предпочтительно, чтобы указанный хроматиновый контрольный элемент был выбран из группы, состоящей из STAR67 (SEQ. ID. NO. 66), STAR7 (SEQ. ID. NO. 7), STAR9 (SEQ. ID. NO. 9), STAR17 (SEQ. ID. NO. 17), STAR27 (SEQ. ID. NO. 27), STAR29 (SEQ. ID. NO. 29), STAR43 (SEQ. ID. NO. 43), STAR44 (SEQ. ID.NO. 44), STAR45 (SEQ. ID. NO. 45), STAR47 (SEQ. ID. NO. 47), STAR61 (SEQ. ID. NO. 61), или функционального фрагмента или производного указанных последовательностей STAR. В предпочтительном варианте осуществления указанная последовательность STAR является STAR 67 (SEQ. ID. NO. 66) или ее функциональным фрагментом или производным. В некоторых предпочтительных вариантах осуществления STAR 67 или ее функциональный фрагмент или производное помещены выше промотора, проводящего экспрессию мультицистронной единицы транскрипции. В других предпочтительных вариантах-8 014332 осуществления экспрессирующие кассеты согласно изобретению фланкируют с обеих сторон по меньшей мере одной антирепрессорной последовательностью, например одной из последовательностей отSEQ. ID. NO. 1 до SEQ. ID. NO. 65 с обеих сторон, предпочтительно, каждую с 3'-конца этих последовательностей, обращенных к единице транскрипции. В некоторых вариантах осуществления экспрессирующие кассеты предоставляют согласно изобретению, включая, в порядке от 5' к 3', антирепрессорную последовательность А - антирепрессорную последовательность В - [промотор - мультицистронную единицу транскрипции согласно изобретению (кодирующую представляющий интерес полипептид и ниже него функциональный селектируемый маркерный белок) последовательность терминации транскрипции]- антирепрессорную последовательность С, где А, В и С могут быть одинаковы или различны. Последовательности, имеющие антирепрессорную активность (антирепрессорные последовательности), и их характеристики, также как их функциональные фрагменты или производные, и их структурные и функциональные определения, и способы их получения и применения, такие последовательности,которые являются полезными для настоящего изобретения, были описаны в WO 2006/048459 (например,стр. 34-38), приведенном здесь в качестве ссылки. Для продуцирования мультимерных белков можно использовать две или более экспрессирующие кассеты. Предпочтительно, чтобы обе экспрессирующие кассеты являлись мультицистронными экспрессирующими кассетами согласно изобретению, и каждый кодировал различный селектируемый маркерный белок, так, чтобы селекция была возможна для обоих экспрессирующих кассет. Этот вариант осуществления, оказывается, дает хорошие результаты, например, при экспрессии тяжелой и легкой цепи антител. Будет понятно, что обе экспрессирующие кассеты можно поместить на одной молекуле нуклеиновой кислоты, или обе могут присутствовать на отдельной молекуле нуклеиновой кислоты, прежде чем их введут в клетки-хозяева. Преимущество размещения их на одной молекуле нуклеиновой кислоты состоит в том, что эти две экспрессирующие кассеты присутствуют в единственном заданном соотношении (например, 1:1) при введении в клетки-хозяева. С другой стороны, когда они присутствуют на двух различных молекулах нуклеиновой кислоты, это дает возможность изменять молярное отношение двух экспрессирующих кассет при их введении в клетки-хозяева, что может являться преимуществом, если предпочтительное молярное отношение отличается от 1:1 или когда заранее неизвестно, какое молярное отношение является предпочтительным, так, чтобы его изменение и обнаружение оптимума опытным путем могло быть легко выполнено специалистом. Согласно изобретению предпочтительно, чтобы по меньшей мере одна из экспрессирующих кассет, но, более предпочтительно, каждая из них включала хроматиновый контрольный элемент, более предпочтительно антирепрессорную последовательность. В другом варианте осуществления различные субъединицы или части мультимерного белка присутствуют на единственной экспрессирующей кассете. Полезные конфигурации антирепрессоров, объединенных с экспрессирующими кассетами, были описаны в WO 2006/048459 (например, стр. 40), приведенном здесь в качестве ссылки. В некоторых вариантах осуществления предоставляются единицы транскрипции или экспрессирующие кассеты согласно изобретению, дополнительно включая последовательность паузы транскрипции (TRAP), фактически как описано на стр. 40-41 WO 2006/048459, приведенного здесь в качестве ссылки. Один неограничивающий пример последовательности TRAP дается в SEQ. ID. NO. 81. Примеры других последовательностей TRAP, способы их обнаружения и их использования были описаны в WO 2004/055215. Молекулы ДНК, включающие в себя мультицистронные единицы транскрипции и/или экспрессирующие кассеты согласно настоящему изобретению, могут использоваться для улучшения экспрессии нуклеиновой кислоты, предпочтительно в клетках-хозяевах. Термины клетка/клетка-хозяин и клеточная линия/линия клеток-хозяев, соответственно, обычно определяются как клетка и ее гомогенные популяции, которые могут поддерживаться в клеточной культуре способами, известными в данной области, и которые способны экспрессировать гетерологичные или гомологичные белки. Несколько типичных клеток-хозяев, которые могут быть использованы, описаны в WO 2006/048459(например, стр. 41-42), приведенном здесь в качестве ссылки, и такие клетки включают в себя, например,клетки млекопитающих, включая, но не ограничиваясь ими, клетки СНО, например CHO-K1, CHO-S,СНО-DG44, CHO-DUKXB11, включая клетки СНО, имеющие фенотип dhfr-, также как клетки миеломы(например, Sp2/0, NSO), клетки HEK 293 и клетки PER.C6. Такие эукариотические клетки-хозяева могут экспрессировать требуемые полипептиды и часто используются с этой целью. Они могут быть получены путем введения в клетки молекулы ДНК согласно изобретению, предпочтительно в виде экспрессирующей кассеты. Предпочтительно, чтобы экспрессирующую кассету интегрировали в геном клеток-хозяев, который может находиться в различных положениях в различных клетках-хозяевах, и в результате селекции будет выявлен клон, в котором трансген интегрирован в подходящем положении, что даст клон клетки-хозяина с желательными свойствами в отношении уровней экспрессии, стабильности, характеристик роста и т.п. Альтернативно, мультицистронная единица транскрипции может быть нацелена или произвольно отобрана для интеграции в хромосомную область, которая является транскрипционно активной, например, после промотора, присутст-9 014332 вующего в геноме. Селекция клеток, содержащих ДНК согласно изобретению, может быть выполнена путем отбора селектируемого маркерного полипептида с использованием обычных способов, известных специалисту в данной области. Когда такую мультицистронную единицу транскрипции встраивают в геном после промотора, экспрессирующая кассета согласно изобретению может быть генерирована insitu, то есть в пределах генома клеток-хозяев. Предпочтительно, чтобы клетки-хозяева происходили от устойчивого клона, который может быть отобран и размножен согласно стандартным процедурам, известным специалистам. Культура такого клона способна продуцировать представляющий интерес полипептид, если клетки содержат мультицистронную единицу транскрипции согласно изобретению. Введение нуклеиновой кислоты, которая должна зкспрессироваться в клетке, может быть осуществлено одним или несколькими способами, также известными специалистам в данной области, зависящими также от формата нуклеиновой кислоты, которую будут вводить. Указанные способы включают в себя, но не ограничены перечисленными, трансфекцию, инфицирование, инъецирование, трансформацию и т.п. Подходящие клетки-хозяева, которые экспрессируют представляющий интерес полипептид,могут быть получены путем селекции. В предпочтительных вариантах осуществления молекулу ДНК, включающую мультицистронную единицу транскрипции согласно изобретению, предпочтительно в виде экспрессирующей кассеты, интегрируют в геном эукариотической клетки-хозяина согласно изобретению. Это обеспечит устойчивое наследование мультицистронной единицы транскрипции. Селекция по присутствию селектируемого маркерного полипептида и, следовательно, экспрессии может быть выполнена в течение начального периода получения клеток. В некоторых вариантах осуществления селективный агент присутствует в культуральной среде по меньшей мере часть времени культивирования, или в достаточных концентрациях для селекции клеток, экспрессирующих селектируемый маркерный полипептид, или в более низких концентрациях. В предпочтительных вариантах осуществления селективный агент уже не присутствует в культуральной среде во время промышленной фазы, когда экспрессируется полипептид. Представляющий интерес полипептид согласно изобретению может быть любым белком, мономерным белком или мультимерным белком (его частью). Мультимерный белок включает по меньшей мере две полипептидные цепи. Неограничивающими примерами представляющего интерес белка согласно изобретению являются ферменты, гормоны, иммуноглобулиновые цепи, терапевтические белки, такие как противораковые белки, белки свертывания крови, такие как фактор VIII, многофункциональные белки, такие как эритропоэтин, диагностические белки, или белки или их фрагменты, полезные в целях вакцинации, - все они известны специалистам в данной области. В некоторых вариантах осуществления экспрессирующая кассета согласно изобретению кодирует тяжелую или легкую иммуноглобулиновую цепь или антиген-связывающую часть, ее производное и/или аналог. В предпочтительном варианте осуществления предоставляется единица экспрессии белка согласно изобретению, в которой указанный представляющий интерес белок является тяжелой иммуноглобулиновой цепью. В еще одном предпочтительном варианте осуществления предоставляется единица экспрессии белка согласно изобретению, в которой указанный представляющий интерес белок является легкой иммуноглобулиновой цепью. Когда две указанные единицы экспрессии белка присутствуют в пределах одной клетки (хозяина), происходит сборка мультимерного белка, а более конкретно, иммуноглобулина. Следовательно, в некоторых вариантах осуществления представляющий интерес белок является иммуноглобулином, таким как антитело, которое является мультимерным белком. Предпочтительно,чтобы такое антитело было человеческим или гуманизированным антителом. В некоторых вариантах осуществления изобретения оно является антителом IgG, IgA или IgM. Тяжелые и легкие цепи иммуноглобулина могут кодироваться на различных экспрессирующих кассетах или на одной экспрессирующей кассете. Предпочтительно, чтобы и тяжелая, и легкая цепи присутствовали на отдельных экспрессирующих кассетах, чтобы каждая имела свой собственный промотор (который может быть одинаковым или различным для этих двух экспрессирующих кассет), чтобы каждая включала в себя мультицистронную единицу транскрипции согласно изобретению, чтобы тяжелая и легкая цепи являлись представляющим интерес полипептидом, и предпочтительно, чтобы каждая кодировала различный селектируемый маркерный белок, так чтобы селекция и экспрессирующей кассеты для тяжелой цепи, и экспрессирующей кассеты для легкой цепи могла быть выполнена, когда экспрессирующие кассеты вводят и/или они присутствуют в эукариотической клетке-хозяине. Представляющий интерес полипептид может происходить из любого источника, и в некоторых вариантах осуществления является белком млекопитающих, искусственным белком (например, слитым белком или мутантным белком), и предпочтительно является человеческим белком. Очевидно, конфигурации экспрессирующих кассет согласно настоящему изобретению могут также использоваться, когда окончательной целью является не продуцирование представляющего интерес полипептида, а непосредственно РНК, например, для того, чтобы продуцировать увеличенные количества РНК с экспрессирующей кассеты, что может использоваться в целях регуляции других генов (например,РНК-интерференция, антисмысловая РНК), генотерапии, продуцирования белка in vitro и т.д.- 10014332 В одном аспекте изобретение связано со способом производства клетки-хозяина, экспрессирующей представляющий интерес полипептид, включающим в себя введение в совокупность клетокпредшественников молекулы ДНК или экспрессирующей кассеты согласно изобретению, культивирование произведенных клеток в условиях селекции и отбор по меньшей мере одной клетки-хозяина, продуцирующей представляющий интерес полипептид. Преимущества этого нового способа подобны преимуществам, описанным для альтернативного способа, раскрытого в WO 2006/048459 (например, стр. 46-47), приведенном здесь в качестве ссылки. Несмотря на то, что могут быть получены клоны, имеющие относительно низкие числа копий мультицистронных единиц транскрипции и высокие уровни экспрессии, система селекции согласно изобретению может быть объединена со способами амплификации даже для дальнейшего улучшения уровней экспрессии. Это, например, может быть достигнуто путем амплификации коинтегрированного генаdhfr с использованием метотрексата, например, путем помещения dhfr на ту же самую молекулу нуклеиновой кислоты, что и мультицистронная единица транскрипции согласно изобретению, или путем котрансфекции, когда dhfr находится на отдельной молекуле ДНК. Ген dhfr также может быть частью мультицистронной единицы экспрессии согласно изобретению. Изобретение также связано со способами продуцирования одного или более представляющих интерес полипептидов, предусматривающими культивирование клеток-хозяев согласно изобретению. Культивирование клеток выполняют, чтобы дать им возможность метаболизировать и/или расти,и/или делиться, и/или продуцировать представляющие интерес рекомбинантные белки. Это может быть достигнуто способами, известными специалистам в данной области, и это включает в себя, но не ограничивается этим, обеспечение питательных веществ для клетки. Способы связаны с ростом на поверхностях, ростом в суспензии, или их комбинациями. Культивирование может быть выполнено, например, на планшетах, роллер-флаконах или в биореакторах с использованием порционных систем, систем порционной подпитки, непрерывных систем, таких как перфузионные системы, и т.п. Для достижения крупномасштабного (непрерывного) продуцирования рекомбинантных белков по мере развития клеточной культуры, предпочтительно иметь клетки, способные к росту в суспензии, и предпочтительно иметь клетки, способные к культивированию в отсутствие полученной от животного или человека сыворотки или компонентов полученной от животного или человека сыворотки. Условия для роста или размножения клеток (см., например, Tissue Culture, Academic Press, Kruseand Paterson, editors (1973 и условия для экспрессии рекомбинантного продукта известны специалистам в данной области. Как правило, принципы, протоколы и практические методы для того, чтобы максимализировать производительность клеточных культур млекопитающих, можно найти в Mammalian Cell Biotechnology: a Practical Approach (M. Butler, ed., IRL Press, 1991). В предпочтительном варианте осуществления экспрессированный белок собирают (изолируют) или из клеток, или из культуральной среды, или из того и из другого. Он тогда может быть дополнительно очищен с использованием известных способов, например фильтрации, колоночной хроматографии и т.д.,способами, известными специалистам в данной области. Способ селекции согласно изобретению пригоден и в отсутствие хроматиновых контрольных элементов, но улучшенные результаты получают, когда мультицистронные единицы экспрессии обеспечивают такими элементами. Способ селекции согласно изобретению особенно хорош, когда используют экспрессирующую кассету согласно изобретению, содержащую по меньшей мере одну антирепрессорную последовательность. В зависимости от селективного агента и условий, селекция в некоторых случаях может быть осуществлена настолько строго, что только незначительное количество клеток-хозяев выдерживает селекцию, если вообще какое-то количество ее выдерживает, если не присутствует антирепрессорная последовательность. Следовательно, комбинация нового способа селекции и антирепрессорной последовательности обеспечивает весьма привлекательный способ получения только ограниченного числа колоний со значительно улучшенной возможностью высокой экспрессии в них представляющего интерес полипептида,тогда как полученные в то же самое время клоны, содержащие экспрессирующую кассету с антирепрессорной последовательностью, обеспечивают устойчивую экспрессию представляющего интерес полипептида, то есть они менее склонны к сайленсингу или другим механизмам понижения экспрессии, чем обычные экспрессирующие кассеты. В одном аспекте изобретение предоставляет мультицистронную единицу транскрипции, имеющую альтернативную конфигурацию по сравнению с конфигурацией, раскрытой в WO 2006/048459: в альтернативной конфигурации согласно настоящему изобретению последовательность, кодирующая представляющий интерес полипептид находится выше последовательности, кодирующей селектируемый маркерный полипептид, и селектируемый маркерный полипептид является функционально связанным с кэпнезависимой последовательностью инициации трансляции, предпочтительно участком внутреннего входа в рибосому (IRES). Такие мультицистронные единицы транскрипции также были известны (например,Rees et al., 1996, WO 03/106684), но не были объединены с нe-ATG-старт-кодоном. Согласно альтернативному варианту настоящего изобретения старт-кодон селектируемого маркерного полипептида изменяют на нe-ATG-старт-кодон для дополнительного уменьшения величины инициации трансляции для- 11014332 селектируемого маркера. Это, таким образом, приводит к желательному снижению уровня экспрессии селектируемого маркерного полипептида и может привести к очень эффективной селекции клетокхозяев, экспрессирующих высокие уровни представляющего интерес полипептида, как с вариантами осуществления, раскрытыми в WO 2006/048459. Одно потенциальное преимущество этого альтернативного аспекта согласно настоящему изобретению, по сравнению с вариантами осуществления, изложенными в WO 2006/048459, состоит в том, что последовательность, кодирующая селектируемый маркерный полипептид, не нуждается ни в какой дальнейшей модификации внутренних последовательностейATG, потому что любые внутренние последовательности ATG в ней могут остаться неповрежденными,так как они больше не соответствуют трансляции дальнейших лежащих ниже полипептидов. Это может быть особенно выгодно, если последовательность, кодирующая селектируемый маркерный полипептид,содержит несколько внутренних последовательностей ATG, потому что для настоящего изобретения не нужно выполнять задачу их изменения и испытания получившегося конструкта на функциональность: в этом случае достаточно только мутации старт-кодона ATG. Здесь ниже показано (пример 1), что этот альтернативный вариант, созданный в соответствии с настоящим изобретением, также приводит к очень хорошим результатам. Последовательность, кодирующая селектируемый маркерный полипептид в молекулах ДНК согласно настоящему изобретению, находится под контролем трансляции IRES, тогда как последовательность, кодирующая представляющий интерес белок, предпочтительно транслируется кэп-зависимым образом. Последовательность, кодирующая представляющий интерес полипептид, включает стоп-кодон, так,чтобы трансляция первого цистрона закончилась выше IRES, где IRES функционально связан со вторым цистроном. Как будет понятно специалисту после ознакомления с настоящим описанием, большинство частей этих мультицистронных единиц экспрессии можно успешно варьировать по тем же самым принципам,что и мультицистронные единицы экспрессии, имеющие противоположный порядок последовательностей, кодирующих представляющий интерес полипептид и селектируемый маркерный полипептид (то есть мультицистронные единицы транскрипции согласно WO 2006/048459, приведенного здесь в качестве ссылки). Например, предпочтительные старт-кодоны для селектируемого маркерного полипептида,объединение в экспрессирующие кассеты, клетки-хозяева, промоторы, присутствие хроматиновых контрольных элементов и т.д. можно варьировать и использовать в предпочтительных вариантах осуществления, как описано выше. Также как и использование этих мультицистронных единиц экспрессии и экспрессирующих кассет, как описано выше. Поэтому этот аспект действительно является альтернативой средствам и способам, описанным в документе WO 2006/048459, в основном с той разницей, что порядок полипептидов в мультицистронных единицах экспрессии изменен на обратный, и что IRES теперь требуется для трансляции селектируемого маркерного полипептида. Используемый здесь термин сайт внутреннего входа в рибосому или IRES, относится к элементу, который облегчает непосредственный внутренний вход в рибосомы инициирующему кодону, обычно такому как ATG, но в данном изобретении это предпочтительно GTG или TTG, цистрона (область, кодирующая белок), таким образом приводя к кэп-независимой трансляции гена. См., например, Jackson R J,Howell M T, Kaminski A (1990) Trends Biochem Sci 15 (12): 477-83) и Jackson R J and Kaminski, A. (1995)RNA 1 (10): 985-1000. Настоящее изобретение распространяется на применение любой кэп-независимой последовательности инициации трансляции, в частности, любого элемента IRES, который способен ускорить инициирующему кодону цистрона прямой внутренний вход в рибосомы. Используемый здесь термин под трансляционным контролем IRES подразумевает, что трансляция связана с IRES и проходит кэп-независимым образом. Используемый здесь термин IRES охватывает функциональные варианты последовательностей IRES, которые способны облегчить инициирующему кодону цистрона прямой внутренний вход в рибосомы. Используемый здесь термин цистрон относится к полинуклеотидной последовательности, или гену, белка, полипептида или представляющего интерес пептида. Функционально связанный относится к ситуации, когда описанные компоненты находятся в отношениях, позволяющих им функционировать намеченным образом. Таким образом, например, промотор, функционально связанный с цистроном, лигирован таким образом, что экспрессия цистрона достигается в условиях, совместимых с промотором. Точно так же нуклеотидная последовательность IRES, функционально связанного с цистроном, лигирована таким образом, что трансляция цистрона достигается в условиях,совместимых с IRES. Элементы внутреннего сайта связывания рибосом (IRES) известны из генов вирусов и млекопитающих (Martinez-Salas, 1999), и также были идентифицированы при скрининге маленьких синтетических олигонуклеотидов (VenkatesanDasgupta, 2001). IRES из вируса энцефаломиокардита был подробно проанализирован (Mizuguchi et al., 2000). IRES является элементом, кодируемым в ДНК, что дает структуру в транскрибируемой РНК, при которой эукариотические рибосомы могут связываться и инициировать трансляцию. IRES позволяет двум или более белкам продуцироваться от одной молекулы РНК(первый белок транслируется на рибосомах, которые связываются с РНК в кэп-структуре на ее 5'-конце(Martinez-Salas, 1999. Трансляция белков из элементов IRES является менее эффективной, чем кэпзависимая трансляция: количество белка из IRES-зависимых открытых рамок считывания (ORF) колеблется от менее чем 20% до 50% количества от первой ORF (Mizuguchi et al., 2000). Пониженная эффективность IRES-зависимой трансляции обеспечивает то преимущество, которое эксплуатируется в этом варианте осуществления данного изобретения. Кроме того, мутация элементов IRES может уменьшить их активность и снизить экспрессию от IRES-зависимых ORF ниже чем до 10% от первой ORF (Lopez deQuintoMartinez-Salas, 1998, Rees et al., 1996). Поэтому специалисту в данной области понятно, что изменения в IRES могут, по существу, не менять функции IRES (следовательно, обеспечивая сайт инициации трансляции белка с меньшей эффективностью трансляции), приводя к модифицированному IRES. Поэтому применение модифицированного IRES, который продолжает обеспечивать маленький процент трансляции (по сравнению с 5'-кэп трансляцией) также включено в данное изобретение. В настоящем изобретении используют нe-ATG-старт-кодоны, чтобы дополнительно значительно уменьшить инициацию трансляции ORF селектируемого маркера, и к тому же дополнительно улучшить возможности получения предпочтительной клетки-хозяина, то есть клетки-хозяина, экспрессирующей высокие уровни представляющего интерес рекомбинантного белка. В патентах США 5648267 и 5733779 описано применение последовательности доминантного селектируемого маркера с нарушенной консенсусной последовательностью Козака ([Ру]xxATG[Py], где [Py] является пиримидиновым нуклеотидом (то есть С или Т), х является нуклеотидом (то есть G, А, Т или С),и старт-кодон ATG подчеркнут). В патенте США 6107477 описано применение неоптимальной последовательности Козака (AGATCTTTATGGACC, в которой старт-кодон ATG подчеркнут) для селектируемого маркерного гена. Ни в одном из этих патентов даже в виде предложения не сказано о применении HeATG-старт-кодона. Кроме того, в них не говорится о комбинациях с IRES. Кроме того, так как IRES сам по себе уже уменьшает инициацию трансляции по сравнению с кэп-зависимой трансляцией, до настоящего изобретения нельзя было предсказать, может ли комбинация IRES с нe-ATG-старт-кодоном для селектируемого маркера обеспечить достаточную трансляцию селектируемого маркерного полипептида для получения сколько-нибудь селектируемых уровней. Настоящее изобретение показывает, что это возможно и предоставляет неожиданно эффективные системы селекции. Изобретение связано также с молекулой ДНК, включающей в себя последовательность, кодирующую селектируемый маркерный полипептид, функционально связанную с последовательностью IRES, в которой последовательность, кодирующая селектируемый маркерный полипептид, включает в себя последовательность старта трансляции, выбранную из группы, состоящей из: а) старт-кодона GTG; b) старт-кодона TTG; с) старт-кодона CTG; d) старт-кодона ATT и е) старт-кодона ACG. Специалисту должно быть ясно, что возможны дальнейшие модификации изобретения, например,приведенные в US 2006/0195935, включенном в настоящее описание в качестве ссылки, в частности,примеры 20-27. В некоторых вариантах осуществления 5,6,7,8-тетрагидрофолатсинтезирующий фермент дигидрофолатредуктаза (dhfr) млекопитающих может использоваться в качестве маркера селекции в клетках,которые имеют фенотип dhfr- (например, клетки CHO-DG44), путем исключения гипоксантина и тимидина (и предпочтительно, также и глицина) из культуральной среды и включения фолата (или (дигидро)фолиевой кислоты) в культуральную среду (Simonsen et al., 1988). Ген dhfr можно получить, например, из мышиного генома или мышиной кДНК и можно использовать согласно изобретению, предпочтительно, путем обеспечения его старт-кодоном GTG или TTG (см. SEQ. ID. NO. 73 для последовательности гена dhfr). Во всех этих вариантах осуществления под "исключением из культуральной среды" подразумевается, что культуральная среда должна быть практически лишена указанного компонента(ов), что означает, что присутствующего в культуральной среде указанного компонента недостаточно для поддержания клеточного роста, так что хорошая селекция возможна, когда генетическая информация для указанного фермента экспрессируется в клетках, и указанный компонент-предшественник присутствует в культуральной среде. Например, указанный компонент присутствует в концентрации менее чем 0,1% концентрации этого компонента, которая обычно используется в культуральной среде для определенного типа клеток. Предпочтительно, чтобы указанный компонент отсутствовал в культуральной среде. Культуральная среда с недостатком указанного компонента может быть приготовлена специалистом согласно стандартным способам или может быть получена от коммерческих поставщиков сред. Потенциальное преимущество использования этих типов метаболических ферментов в качестве селектируемых маркерных полипептидов состоит в том, что их можно использовать для поддержания непрерывной селекции мультицистронных единиц транскрипции, которая может привести к более высокой экспрессии представляющего интерес полипептида. В другом аспекте в изобретении используется метаболический маркер селекции dhfr в качестве дополнительного маркера селекции в мультицистронной единице транскрипции согласно изобретению. В таких вариантах осуществления селекцию клонов клетки-хозяина с высокой экспрессией сначала устанавливают, например, при помощи антибиотика-маркера селекции, например зеоцина, неомицина и т.д,кодирующие последовательности которого будут иметь старт-кодон GTG или TTG согласно изобретению. После селекции подходящих клонов антибиотическую селекцию прекращают, и теперь непрерыв- 13014332 ная или периодическая селекция с использованием метаболического ферментного маркера селекции может быть выполнена путем культивирования клеток в среде с недостатком соответствующих идентифицированных компонентов, описанных выше и содержащей соответствующие компонентыпредшественники, описанные выше. В этом аспекте метаболический маркер селекции функционально связан с IRES и может иметь нормальное содержание ATG, и старт-кодон может быть, соответственно,выбран из GTG или TTG. Мультицистронные единицы транскрипции в этом аспекте являются, по меньшей мере, трицистронными. В практическом осуществлении изобретения будут использованы, если не указано иначе, обычные методы иммунологии, молекулярной биологии, микробиологии, цитобиологии и рекомбинантной ДНК,находящиеся в пределах компетентности специалистов в данной области. См., например, Sambrook,Fritsch and Maniatis, Molecular Cloning: A Laboratory Manual, 2nd edition, 1989; Current Protocols in Molecular Biology, Ausubel FM, et al, eds, 1987; the series Methods in Enzymology (Academic Press, Inc.); PCR2: APractical Approach, MacPherson MJ, Hams BD, Taylor GR, eds, 1995; Antibodies: A Laboratory Manual, Harlow and Lane, eds, 1988. Изобретение дополнительно разъясняется в следующих примерах. Эти примеры никоим образом не предназначены для ограничения изобретения. Они просто служат для его разъяснения. Примеры В примере 1 описана система селекции с мультицистронной единицей транскрипции согласно настоящему изобретению, и понятно, что варианты, описанные в примерах 8-26 из WO 2006/048459, приведенного здесь в качестве ссылки, также можно применять и тестировать в мультицистронных единицах транскрипции согласно настоящей заявке. То же самое верно и в отношении примеров 20-27 из US 2006/0195935. Пример 1. Жесткая селекция путем встраивания модифицированного гена устойчивости к зеоцину после последовательности IRES Примеры 8-26 из WO 2006/048459 (полностью приведенного здесь в качестве ссылки в полном объеме) показали систему селекции, где последовательность, кодирующая селектируемый маркерный белок находится выше последовательности, кодирующей представляющий интерес белок в мультицистронной единице транскрипции, и в которой последовательность инициации трансляции селектируемого маркера является неоптимальной, и в которой последующие внутренние ATG удалены из последовательности,кодирующей селектируемый маркер. Эта система приводит к системе селекции высокой жесткости. Например, показано, что маркер селекции Zeo, в котором кодон инициации трансляции изменяют на TTG,дает очень высокую жесткость селекции и очень высокие уровни экспрессии представляющего интерес белка, кодируемого ниже. В другой возможной системе селекции (то есть системе согласно настоящему изобретению) маркер селекции, например Zeo, помещают ниже последовательности IRES. Это создает мультицистронную мРНК, из которой генный продукт Zeo транслируется путем IRES-зависимой инициации. В обычном конструкте d2EGFP-IRES-Zeo (то есть конструкт, известный в предшествующем уровне техники, например, из WO 2006/005718), старт-кодоном Zeo является оптимальный ATG. Авторы проверили, дает ли замена старт-кодона Zeo ATG, например, на TTG (называемый TRES-TTG Zeo), результаты по увеличению жесткости селекции по сравнению с обычным IRES-ATG Zeo. Результаты Используемые конструкты схематично представлены на фиг. 1. Контрольный конструкт, состоящий из промотора CMV, гена d2EGFP, последовательности IRES (последовательность используемого IRES(Rees et al., 1996), в этом примере представлял собой следующее: И маркера селекции TTG Zeo, то есть гена устойчивости к зеоцину со старт-кодоном TTG(d2EGFP-IRES-TTG Zeo). Другой конструкт был таким же, но с комбинацией STAR 7 и STAR 67, помещенной выше экспрессирующей кассеты, и STAR 7 ниже кассеты (STAR7/67 d2EGFP-IRES-TTG ZeoSTAR7). Оба конструкта трансфицировали в клетки CHO-K1, и выполняли селекцию с использованием 100 мкг/мл зеоцина в культуральной среде. Четыре колонии появились после трансфекции контрольным конструктом и шесть - конструктом, содержащим STAR. Эти независимые колонии изолированно размножили перед анализом уровней экспрессии d2EGFP. Как представлено на фиг. 1, инкорпорация элементов STAR в конструкт привела к образованию колоний с высокими уровнями экспрессии d2EGFP. Из контрольных колоний без элементов STAR (d2EGFP-IRES-TTG Zeo) только одна колония показывала некоторую экспрессию d2EGFP. Уровни экспрессии также являются намного более высокими, чем полученные с другими контрольными конструктами, содержащими IRES с нормальным Zeo со стандартным старт-кодоном ATG или в присутствии или в отсутствие элементов STAR (d2EGFP-IRES-ATG Zeo иSTAR 7/67 d2EGFP-IRES-ATG Zeo STAR7; также в этих конструктах ATG Zeo наблюдается энхансерный эффект элементов STAR, но он является умеренным по сравнению с новым вариантом TTG Zeo) . Эти результаты показывают, что размещение маркера селекции Zeo со старт-кодоном TTG ниже последовательности IRES, в комбинации с элементами STAR, работает хорошо и образует систему жесткой селекции. Из этих данных и примеров 8-26 из WO 2006/048459 и 20-27 из US 2006/0195935 будет понятно, что маркер можно варьировать по тем же самым принципам согласно примерам 8-26 из WO 2006/048459 и 20-27 из US 2006/0195935. Например, вместо старт-кодона TTG можно использовать старт-кодон GTG, и маркер можно заменить с Zeo на другой маркер, например, Neo, Blas, dhfr, puro и т.д, все они имеют илиGTG, или TTG в качестве старт-кодона. Элементы STAR можно варьировать, используя различные последовательности STAR или их различное размещение, или путем замены ими других хроматиновых контрольных элементов, например последовательности MAR. Это приводит к усовершенствованиям относительно систем селекции предшествующей области техники, имеющих IRES в сочетании с маркером с нормальным старт-кодоном ATG. В качестве неограничивающего примера, вместо модифицированного гена устойчивости Zeo (TTGZeo) ниже последовательности IRES помещен модифицированный ген устойчивости к неомицину. Модификация состоит в замене инициирующего трансляцию кодона ATG кодирующей последовательностиNeo инициирующим трансляцию кодоном TTG, таким образом создавая TTG Neo. Конструкт CMVd2EGF-IRES-TTG Neo, либо окруженный элементами STAR, либо нет, трансфицировали в клетки CHOK1. Колонии отбирали, клетки размножали и измеряли величины d2EGFP. Это (IRES-TTG Neo) приводит к усовершенствованию относительно известной системы селекции, имеющей Neo со старт-кодономATG ниже IRES (IRES-ATG Neo). Усовершенствование особенно очевидно, когда конструкт TTG Neo включает в себя элементы STAR. Пример 2. Стабильность экспрессии путем встраивания модифицированного гена dhfr после последовательности IRES Модификация инициирующего трансляцию кодона маркера селекции зеоцина в инициирующий трансляцию кодон, который используется намного реже, чем обычный кодон ATG, приводит к системе селекции высокой жесткости. В описанной системе селекции согласно WO 2006/048459, TTG Zeo помещают выше представляющего интерес гена. В другой возможной системе селекции маркер селекции Zeo помещают ниже последовательности IRES (настоящая заявка, см. пример 1). Это создает бицистронную мРНК, из которой генный продукт Zeo транслируется из кодонов инициации трансляции в последовательности IRES. В этом эксперименте авторы объединили варианты осуществления этих двух систем. С этой целью маркер селекции TTG поместили выше гена-репортера и соединили модифицированный метаболический маркер GTG или TTG посредством IRES к гену-репортеру. Могут использоваться различные гены маркера селекции, такие как гены устойчивости к зеоцину и неомицину, а также dhfr. Здесь авторы поместили модифицированный ген устойчивости к зеоцину, TTG Zeo (см. WO 2006/048459), выше представляющего интерес гена, а ген селекции dhfr - ниже представляющего интерес гена, соединенных с помощью IRES (фиг. 2). Целью этой экспрессирующей кассеты было отобрать клон клеток млекопитающих,продуцирующий высокий уровень белка, сначала с помощью селекции на зеоцине. Конфигурация представляющего интерес гена TTG Zeo наиболее эффективно достигает этой цели. После этой начальной фазы селекции характеристики dhfr-белка использовали для поддержания высоких уровней экспрессии в отсутствие антибиотика зеоцина. Активное давление отбора представляется выгодным для поддержания уровней экспрессии белка в отобранной колонии TTG Zeo на том же самом высоком уровне в течение длительного промежутка времени. Это может быть достигнуто, например, путем поддержания минимального количества зеоцина в культуральной среде, но в промышленных масштабах это не выгодно как с точки зрения экономической,так и - потенциально - с точки зрения возможности осуществления контроля (зеоцин является и токсичным, и дорогим). Другой подход состоит в том, чтобы присоединить представляющий интерес ген к маркеру селекции, который является ферментом, метаболизирующим одну или более основных стадий в метаболическом пути. Под основным подразумевается, что клетка не в состоянии самостоятельно синтезировать- 15014332 определенные основные метаболические структурные элементы, подразумевается, что эти структурные элементы должны присутствовать в культуральной среде, чтобы позволить клетке выжить. Известными примерами являются незаменимые аминокислоты, которые не могут синтезироваться клеткой млекопитающих и должны присутствовать в культуральной среде, чтобы позволить клетке выжить. Другой пример связан с 5,6,7,8-тетрагидрофолатсинтезирующим геном dhfr. Соответствующий белок dhfr является ферментом в метаболическом пути фолата. Белок dhfr специфически преобразует фолат в 5,6,7,8 тетрагидрофолат, челнок метильной группы, требуемый для синтеза de novo пуринов (гипоксантин) ,тимидиловой кислоты (тимидин) и аминокислоты глицин. При этом в культуральной среде должно присутствовать нетоксичное вещество фолат (Urlaub et al., 1980). Кроме того, среда должна испытывать недостаток гипоксантина и тимидина, так как когда они доступны для клетки, потребности в ферменте dhfr не возникает. Клетки CHO-DG44 испытывают недостаток в гене dhfr, и поэтому эти клетки нуждаются в глицине, гипоксантине и тимидине в культуральной среде для выживания. Если, однако, конечные продукты глицин, гипоксантин и тимидин отсутствуют в культуральной среде, а фолат присутствует, а генdhfr обеспечен, поскольку он присутствует в клетке на экспрессирующей кассете, клетка может преобразовывать фолат в 5,6,7,8-тетрагидрофолат и может, таким образом, выжить в этой культуральной среде. Этот принцип использовался много лет как методика селекции для создания устойчивых трансфицированных клеточных линий млекопитающих. Здесь авторы используют этот принцип не для первоначальной селекции устойчивых клонов (это делается с помощью зеоцина), а для поддержания клеток в условиях метаболического давления отбора. Преимущество состоит в том, что начальная очень высокая экспрессия белка может быть достигнута посредством системы селекции TTG Zeo, и что эти высокие уровни экспрессии могут поддерживаться без потребности в поддержании зеоцина в культуральной среде. Вместо этого зеоцин может быть исключен из среды, и отсутствия глицина, гипоксантина и тимидина (GHT) или только гипоксантина и тимидина(НТ) в культуральной среде достаточно для поддержания условий достаточно высокого давления отбора,чтобы гарантировать высокие уровни экспрессии белка. Такая конфигурация требует присутствия двух маркеров селекции, и ген устойчивости к зеоцину и ген dhfr должны присутствовать на экспрессирующей кассете. Как уже указано выше, это эффективно достигается, когда оба гена присутствуют с представляющим интерес геном в такой конфигурации, что трицистронная мРНК транскрибируется с одного промотора. Когда модифицированный ген устойчивости к зеоцину (TTG Zeo) используют выше генаd2EGFP, ген dhfr должен быть подключен ниже гена d2EGFP, например, через последовательность IRES(фиг. 1). Результаты Авторы создали конструкты, в которых маркер селекции TTG Zeo помещали выше гена-репортераd2EGFP, а маркер селекции dhfr ниже гена d2EGFP, подключенного через последовательность IRES(фиг. 2). Эти конструкты были фланкированы элементами STAR 7/67/7. Были созданы три версии этих конструктов: ATG dhfr, GTG dhfr или TTG dhfr, в каждом из названий указан старт-кодон, используемый для гена dhfr. Конструкты трансфицировали в клетки CHO-DG44. ДНК трансфицировали с использованием Lipofectamine 2000 (Invitrogen), и клетки выращивали в присутствии 400 мкг/мл зеоцина в средеIMDM (Gibco) + 10% FBS (Gibco) + НТ-добавка. Среднее значение d2EGFP в 14 клонах TTG Zeo IRES ATG dhfr составляло 341 (1 день) при измерении в присутствии 400 мкг/мл зеоцина (фиг. 2). После этих измерений клетки разделяли и далее культивировали при трех различных условиях:(1) с 400 мкг/мл зеоцина и с гипоксантином и тимидином (НТ-добавка) в среде,(2) без зеоцина, но с НТ-добавкой в среде,(3) без зеоцина и без НТ-добавки. Таким образом, в условиях 1 клетки находятся только под зеоциновым давлением отбора, в условиях 2 клетки не находятся ни под каким давлением отбора, а в условиях 3 клетки остаются под давлением отбора DHFR. Последнее условие 3 требует, чтобы непрерывная экспрессия гена dhfr сделала возможной экспрессию белка dhfr и в результате - выживание клетки. Через 65 дней авторы снова измерили значения d2EGFP. Среднее значение d2EGFP в клонах TTGZeo IRES ATG dhfr при зеоциновой селекции составляло теперь 159 (фиг. 2). Среднее значение d2EGFP в клонах TTG Zeo IRES ATG dhfr без зеоцина и с НТ-добавкой составляло 20 (фиг. 2). Среднее значениеd2EGFP в клонах TTG Zeo IRES ATG dhfr без зеоциновой селекции и без НТ-добавки составляло 37(фиг. 2). Таким образом, повсюду наблюдалось снижение значений d2EGFP, но самым значительным оно было в отсутствие зеоцина, безотносительно к тому, присутствовала ли НТ-добавка или нет. Авторы изобретения следовали тому же самому протоколу с конструктом TTG Zeo IRES GTG dhfr. Среднее значение d2EGFP в клонах 15 TTG Zeo IRES GTG dhfr составляло 455 (1 день) при измерении в присутствии 400 мкг/мл зеоцина (фиг. 3). После этих измерений клетки разделяли и далее культивировали при описанных выше трех вариантах условий. Через 65 дней снова измеряли значения d2EGFP. Среднее значение d2EGFP в клонах TTG Zeo IRES GTG dhfr при зеоциновой селекции составляло теперь 356(фиг. 3). Среднее значение d2EGFP в клонах TTG Zeo IRES GTG dhfr без зеоциновой селекции и с НТдобавкой составляло 39 (фиг. 3). Среднее значение d2EGFP в клонах TTG Zeo IRES GTG dhfr без зеоци- 16014332 новой селекции и без НТ-добавки составляло 705 (фиг. 3). Таким образом, в этом случае наблюдалось снижение значений d2EGFP только в отсутствие зеоцина и в присутствии НТ-добавки (условие 2). В отсутствие зеоцина, но в отсутствие также и НТ-добавки,значения d2EGFP стали фактически значительно выше (условие 3). Это может указывать на то, что уровни экспрессии белка dhfr вследствие поврежденной частоты трансляции мРНК GTG dhfr достаточно низкие, чтобы обеспечить очень высокую жесткость селекции. Это давление отбора в отсутствие любых токсичных агентов является достаточно высоким для поддержания высоких уровней экспрессии белка с течением времени и, очевидно, даже повышает эти уровни экспрессии с течением времени. То же самое было выполнено с конструктом TTG Zeo IRES TTG dhfr. Среднее значение d2EGFP в 18 клонах TTG Zeo IRES TTG dhfr составляло 531 (1 день) при измерении в присутствии 400 мкг/мл зеоцина (фиг. 4). После этих измерений клетки разделяли и далее культивировали при описанных выше трех вариантах условий. Через 65 дней снова измеряли значения d2EGFP. Среднее значение d2EGFP в клонахTTG Zeo IRES TTG dhfr при зеоциновой селекции составляло теперь 324 (фиг. 4). Среднее значениеd2EGFP в клонах TTG Zeo IRES TTG dhfr без зеоциновой селекции и в присутствии НТ-добавки составляло 33 (фиг. 4). Среднее значение d2EGFP в клонах TTG Zeo IRES TTG dhfr без зеоциновой селекции и без НТ-добавки составляло 1124 (фиг. 4). Снова отмечали снижение значений d2EGFP только в отсутствии зеоцина и в присутствии НТдобавки (условие 2). В отсутствие зеоцина, но в отсутствии НТ-добавки значения d2EGFP стали еще выше, чем в случае конструкта TTG Zeo IRES GTG dhfr (условие 3). Так как вариант TTG является более жестким, чем вариант GTG, ожидается, что при использовании TTG dhfr будет транслировано даже меньше белка dhfr, чем при использовании варианта GTG dhfr. Увеличенное давление отбора, в отсутствии любых токсичных агентов, при использовании варианта TTG dhfr является достаточно высоким для поддержания высоких уровней экспрессии белка с течением времени и, по-видимому, даже дополнительно улучшает уровни экспрессии белка с течением времени. Данные показывают, что прикрепление варианта гена dhfr с не-ATG-старт-кодоном к гену d2EGFP посредством IRES делает возможной высокую степень стабильности высокой экспрессии d2EGFP в клетках CHO-DG44. Это происходит в культуральной среде без зеоцина и без незаменимых конечных продуктов метаболизма. Предшествующая селекция на зеоцине посредством модифицированного маркера селекции TTG Zeo дает возможность эффективной закладки колоний с высокими уровнями экспрессии d2EGFP. Теперь для поддержания высоких уровней экспрессии d2EGFP и даже улучшения этих уровней экспрессии необходимо только простое изменение культуральной среды (удаление зеоцина и НТ). Пример 3. Увеличенная экспрессия с помощью помещения модифицированного гена dhfr позади ослабленной последовательности IRES не является результатом амплификации гена. Использование гена dhfr в качестве маркера селекции в предшествующей области техники часто зависело от амплификации гена dhfr. Токсичный агент метотрексат использовали в таких системах для амплификации гена dhfr, и одновременно к тому же желательного трансгена, который в количестве до многих тысяч копий мог быть обнаружен интегрированным в геном клеток СНО после такой амплификации. Хотя эти высокие числа копий приводят к высоким уровням экспрессии, их также считают неудобством,потому что такое множество копий может приводить к увеличенной геномной неустойчивости, и последующее удаление метотрексата из культуральной среды приводит к быстрому удалению многих амплифицированных локусов. В примере 2 для ингибирования активности фермента dhfr не использовали метотрексата. Только гипоксантин и предшественник тимидина были удалены из культуральной среды, и этого было достаточно для достижения и стабильности экспрессии белка, и даже увеличенных уровней экспрессии. Таким образом авторам удалось определить, приводит ли применение фермента dhfr в данной системе к генной амплификации. Результаты ДНК изолировали из клонов, которые были описаны в примере 2, в тот же самый день (65), когда измеряли значения d2EGFP. С использованием этой ДНК определили число копий d2EGFP. Среднее число копий d2EGFP в клонах TTG Zeo IRES ATG dhfr при зеоциновой селекции составляло 86 (условие 1) (фиг. 5). Среднее число копий d2EGFP в клонах TTG Zeo IRES ATG dhfr без зеоциновой селекции и в присутствии НТ-добавки составляло 53 (условие 2) (фиг. 5). Среднее число копийd2EGFP в клонах TTG Zeo IRES ATG dhfr без зеоциновой селекции и без НТ-добавки составляло 59 (условие 3) (фиг. 5). Среднее число копий d2EGFP в клонах TTG Zeo IRES GTG dhfr при зеоциновой селекции составляло 23 (условие 1) (фиг. 6). Среднее число копий d2EGFP в клонах TTG Zeo IRES GTG dhfr без зеоциновой селекции и в присутствии НТ-добавки составляло 14 (условие 2) (фиг. 6). Среднее число копийd2EGFP в клонах TTG Zeo IRES GTG dhfr без зеоциновой селекции и без НТ-добавки составляло 37 (условие 3) (фиг. 6). Среднее число копий d2EGFP в клонах TTG Zeo IRES TTG dhfr при зеоциновой селекции составля- 17014332 ло 33 (условие 1) (фиг. 7). Среднее число копий d2EGFP в клонах TTG Zeo IRES TTG dhfr без зеоциновой селекции и в присутствии НТ-добавки составляло 26 (условие 2) (фиг. 7). Среднее число копийd2EGFP в клонах TTG Zeo IRES TTG dhfr без зеоциновой селекции и без НТ-добавки составляло 32 (условие 3) (фиг. 7). Ни в том, ни в другом случае не наблюдалось значительного увеличения числа копий d2EGFP после удаления НТ-добавки, которое привело к увеличению значений d2EGFP в случае вариантов GTG dhfr иTTG dhfr. Тот факт, что с использованием обоих конструктов значения d2EGFP оставались устойчивыми в течение долгого времени и даже значительно увеличивались, должен быть следствием действия белкаdhfr. Однако в клонах TTG Zeo TTG dhfr вообще не наблюдали увеличения чисел копий d2EGFP, и лишь небольшое увеличение наблюдали в клонах TTG Zeo GTG dhfr. Интересно, что общее число копийd2EGFP в самых низких продуцентах, клонах TTG Zeo ATG dhfr, было выше, чем в других двух вариантах, в то время как в этих клонах не поддерживались начальные высокие значения флуоресценцииd2EGFP (см. пример 2). С учетом этих данных можно сделать заключение, что общеизвестная амплификация гена, наблюдаемая при использовании белка dhfr в комбинации с добавлением метотрексата, не является ответственной за поддержание устойчивых уровней экспрессии d2EGFP с течением времени и за наблюдаемое увеличение этих уровней экспрессии. Вместо этого оказывается, что на генную копиюd2EGFP экспрессируется больше белка d2EGFP при использовании вариантов GTG и TTG dhfr. Дополнительный анализ уровней мРНК d2EGFP для различных клонов и при различных описанных выше условиях позволил выявить, что эти уровни мРНК во многом следовали тенденции значений флуоресценции d2EGFP. Поэтому можно сделать заключение, что увеличение значений флуоресценцииd2EGFP является следствием повышенных уровней мРНК, а не измененной эффективности трансляции. Список ссылокWhitelaw, E., Sutherland, H., Kearns, M., Morgan, H., Weaving, L. and Garrick, D. (2001) Epigenetic effects on transgene expression Methods Mol Biol 158, 351-68. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Молекула ДНК, содержащая мультицистронную единицу транскрипции, включающую в себя по меньшей мере одну кодирующую последовательность, кодирующуюI) как представляющий интерес полипептид, так иII) селектируемый маркерный полипептид, функциональный в эукариотической клетке-хозяине,в которой представляющий интерес полипептид имеет последовательность инициации трансляции,- 18014332 отдельную от последовательности инициации трансляции селектируемого маркерного полипептида,в которой по меньшей мере одна последовательность, кодирующая представляющий интерес полипептид, находится выше по меньшей мере одной последовательности, кодирующей селектируемый маркерный полипептид в указанной мультицистронной единице транскрипции,в которой сайт внутреннего входа в рибосому (IRES) находится ниже по меньшей мере одной последовательности, кодирующей представляющий интерес полипептид, и выше по меньшей мере одной последовательности, кодирующей селектируемый маркерный полипептид,и отличающаяся тем, что последовательность, кодирующая селектируемый маркерный полипептид,включает в себя последовательность старта трансляции, выбранную из группы, состоящей из:e) старт-кодона ACG. 2. Молекула ДНК по п.1, в которой последовательность старта трансляции селектируемого маркерного полипептида содержит старт-кодон GTG или старт-кодон TTG. 3. Молекула ДНК по любому из предшествующих пунктов, в которой селектируемый маркерный полипептид обеспечивает устойчивость против летальных или ингибирующих рост воздействий селективного агента. 4. Молекула ДНК по п.3, в которой указанный селективный агент выбран из группы, состоящей из зеоцина, пуромицина, бластицидина, гигромицина, неомицина, метотрексата, метионин-сульфоксимина и канамицина. 5. Молекула ДНК по п.3, в которой селективный агент является зеоцином. 6. Молекула ДНК по п.1 или 2, в которой селектируемый маркерный полипептид является 5,6,7,8 тетрагидрофолатсинтезирующим ферментом (dhfr). 7. Молекула ДНК по любому из предшествующих пунктов, в которой мультицистронная единица транскрипции дополнительно содержит последовательность, кодирующую второй селектируемый маркерный полипептид, функциональный в эукариотической клетке, в которой указанная последовательность, кодирующая второй селектируемый маркерный полипептид,a) имеет последовательность инициации трансляции, отдельную от последовательности инициации трансляции представляющего интерес полипептида,b) расположена выше указанной последовательности, кодирующей представляющий интерес полипептид,c) не имеет никакой последовательности ATG в кодирующей цепи после старт-кодона указанного второго селектируемого маркерного полипептида и вплоть до старт-кодона представляющего интерес полипептида иd) имеет старт-кодон GTG или старт-кодон TTG. 8. Экспрессирующая кассета, содержащая молекулу ДНК по любому из предшествующих пунктов,включающая в себя промотор выше указанной мультицистронной единицы транскрипции и последовательность терминации транскрипции ниже мультицистронной единицы транскрипции, где указанная экспрессирующая кассета является функциональной в эукариотической клетке-хозяине для инициации транскрипции мультицистронной единицы транскрипции. 9. Экспрессирующая кассета по п.8, дополнительно включающая в себя по меньшей мере один хроматиновый контрольный элемент, выбранный из группы, состоящей из матрикс- или скаффолдассоциированного участка (MAR/SAR), инсуляторной последовательности, universal chromatin openingelement (UCOE) и антирепрессорной последовательности (STAR). 10. Экспрессирующая кассета по п.9, в которой указанный по меньшей мере один хроматиновый контрольный элемент является антирепрессорной последовательностью, выбранной из группы, состоящей изa) любой последовательности от SEQ. ID. NO. 1 до SEQ. ID. NO. 66;b) фрагментов любой последовательности от SEQ. ID. NO. 1 до SEQ. ID. NO. 66, где указанные фрагменты имеют антирепрессорную активность;c) последовательностей, которые по меньшей мере на 70% идентичны нуклеотидной последовательности а) или b), где указанные последовательности имеют антирепрессорную активность; иd) последовательность, комплементарную любой последовательности от а) до с). 11. Клетка-хозяин, содержащая молекулу ДНК по любому из пп.1-7 или экспрессирующую кассету по любому из пп.8-10, где клетка-хозяин предпочтительно является клеткой млекопитающего, предпочтительно клеткой яичника китайского хомячка (СНО). 12. Способ производства клетки-хозяина, способной экспрессировать представляющий интерес полипептид, включающий в себя стадии:a) введения в совокупность клеток-предшественников молекулы ДНК по любому из пп.1-7 или экспрессирующей кассеты по любому из пп.8-10,- 19014332b) культивирования совокупности клеток-предшественников в условиях, подходящих для экспрессии селектируемого маркерного полипептида, иc) селекции по меньшей мере одной клетки-хозяина, экспрессирующей представляющий интерес полипептид. 13. Способ экспрессии представляющего интерес полипептида, включающий в себя культивирование клетки-хозяина, содержащей экспрессирующую кассету по любому из пп.8-10, и экспрессирование представляющего интерес полипептида с экспрессирующей кассеты. 14. Способ по п.13, дополнительно включающий в себя сбор представляющего интерес полипептида. 15. Способ по п.13 или 14, согласно которому указанные клетки-хозяева являются клетками СНО,которые имеют фенотип dhfr-, а экспрессирующая кассета включает в себя последовательность, кодирующую селектируемый маркерный полипептид,который является 5,6,7,8 тетрагидрофолатсинтезирующим ферментом (dhfr), в котором указанные клетки культивируют в культуральной среде, которая содержит фолат и которая, по существу, лишена гипоксантина и тимидина.
МПК / Метки
МПК: C12N 15/85
Метки: белок, уровнях, клеток-хозяев, высоких, селекция, экспрессирующих
Код ссылки
<a href="https://eas.patents.su/30-14332-selekciya-kletok-hozyaev-ekspressiruyushhih-belok-na-vysokih-urovnyah.html" rel="bookmark" title="База патентов Евразийского Союза">Селекция клеток-хозяев, экспрессирующих белок на высоких уровнях</a>
Предыдущий патент: Способ получения эзетимиба и промежуточных продуктов, используемых в этом способе
Следующий патент: Аминопроизводные в-гомоандростанов и в-гетероандростанов
Случайный патент: Синтетический дёрн