Композиции для ферментативного обесцвечивания хлорофилла и способы
Номер патента: 13993
Опубликовано: 30.08.2010
Авторы: Бартон Нельсон Роберт, Бурк Марк Дж., Уэйнер Дэвид, Лэм Дэвид, Хитчмэн Тимоти
Формула / Реферат
1. Выделенная синтетическая или рекомбинантная нуклеиновая кислота, содержащая:
(а) последовательность нуклеиновой кислоты, которая:
(i) по меньшей мере на 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или на 100% (полностью) идентична последовательности SEQ ID NO: 17,
где нуклеиновая кислота кодирует по меньшей мере один полипептид, обладающий активностью эстеразы, или
(ii) по меньшей мере на 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или на 100% (полностью) идентична последовательностям SEQ ID NO: 3, SEQ ID NO: 7 или SEQ ID NO: 15,
где нуклеиновая кислота кодирует по меньшей мере один полипептид, обладающий активностью эстеразы, или
(iii) по меньшей мере на 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или на 100% (полностью) идентична последовательностям SEQ ID NO: 5 или SEQ ID NO: 11,
где нуклеиновая кислота кодирует по меньшей мере один полипептид, обладающий активностью эстеразы, или
(iv) по меньшей мере на 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или на 100% (полностью) идентична последовательностям SEQ ID NO: 1, SEQ ID NO: 9 или SEQ ID NO: 13, или
(vi) по меньшей мере на 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или на 100% (полностью) идентична последовательности SEQ ID NO: 19,
где нуклеиновая кислота кодирует по меньшей мере один полипептид, обладающий активностью эстеразы, и необязательно идентичность последовательностей определяют анализом с помощью алгоритма сравнения последовательностей или визуальным исследованием, и необязательно алгоритм сравнения последовательностей представляет собой алгоритм BLAST версии 2.2.2, где установлены параметры фильтрования blastall -p blastp -d "nr pataa" -F F, и все другие параметры установлены по умолчанию;
где идентичность последовательностей существует на протяжении участка по меньшей мере приблизительно 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150 или более остатков, или на протяжении полной длины гена или транскрипта; или
(b) последовательность нуклеиновой кислоты, кодирующей пептид, имеющий последовательность SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18 или SEQ ID NO: 20; или
(c) нуклеиновую кислоту, содержащую последовательность, которая в жестких условиях гибридизуется с SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19, и длина нуклеиновой кислоты составляет по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 75, 100, 150, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более остатков, или полную длину гена или транскрипта, и жесткие условия включают стадию промывания, включающую промывание в 0,2Х SSC при температуре приблизительно 65°C в течение приблизительно 15 мин; или
(d) последовательность нуклеиновой кислоты по пп.(а), (b) или (с), но лишенную своей гомологичной секреторной сигнальной последовательности; или
(e) последовательность нуклеиновой кислоты по пп.(а), (b), (с) или (d), дополнительно содержащую гетерологичную секреторную сигнальную последовательность; или
(f) последовательность нуклеиновой кислоты по пп.(а), (b), (с), (d) или (е), дополнительно содержащую направляющую последовательность, N-концевой идентификационный пептид, транспортный пептид или последовательность, придающую желаемое свойство; или
(g) последовательность нуклеиновой кислоты по пп.(а), (b), (с), (d), (e) или (f), дополнительно содержащую гетерологичную последовательность; или
(h) последовательность нуклеиновой кислоты, полностью комплементарную последовательности по пп.(а), (b), (с), (d), (е), (f) или (g),
где активность эстеразы необязательно включает ферментативную модификацию молекулы хлорофилла, ферментативный катаболизм молекулы хлорофилла; активность хлорофиллазы, активность chlase или активность хлорофилл-хлорофиллидо-гидролазы;
где активность полипептида необязательно является термостабильной или термоустойчивой и необязательно полипептид сохраняет ферментативную активность в условиях, включающих диапазон температур приблизительно от 37 до приблизительно 95°С, или приблизительно от 55 до приблизительно 85°С, или приблизительно от 70 до приблизительно 75°С, или приблизительно от 70 до приблизительно 95°С, или приблизительно от 90 до приблизительно 95°С;
где активность полипептида необязательно является термоустойчивой и полипептид необязательно сохраняет ферментативную активность после воздействия температуры в диапазоне от более чем 37 до приблизительно 95°С, от более чем 55 до приблизительно 85°С, или приблизительно от 70 до приблизительно 75°С, или от более чем 90 до приблизительно 95°С.
2. Зонд нуклеиновой кислоты для идентификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью хлорофиллазы или вовлеченный в катаболизм молекулы хлорофилла, где зонд содержит:
(a) нуклеиновую кислоту, содержащую по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50 или более последовательно расположенных остатков последовательности нуклеиновой кислоты по п.1, или
(b) по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50 или более последовательно расположенных оснований последовательности, содержащей SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19,
и необязательно зонд содержит олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50, приблизительно от 20 до 60, приблизительно от 30 до 70, приблизительно от 40 до 80, приблизительно от 60 до 100 или приблизительно от 50 до 150 последовательно расположенных оснований.
3. Пара праймеров для амплификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью хлорофиллазы или вовлеченный в катаболизм молекулы хлорофилла, где пара праймеров для амплификации:
(a) способна амплифицировать нуклеиновую кислоту, содержащую последовательность по п.1, и необязательно член пары праймеров для амплификации содержит олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50 последовательно расположенных оснований последовательности или приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более последовательно расположенных оснований последовательности, или
(b) содержит первый член, имеющий последовательность, как указано, из приблизительно первых (5') 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более остатков SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13; SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19, и второй член, имеющий последовательность, как указано, из приблизительно первых (5') 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 2 9, 30 или более остатков, комплементарных цепи первого члена.
4. Нуклеиновая кислота, полученная амплификацией полинуклеотида с использованием пары праймеров для амплификации по п.3, где необязательно амплификацию осуществляют посредством полимеразной цепной реакции (ПЦР), или необязательно нуклеиновую кислоту получают посредством амплификации библиотеки генов, или необязательно библиотека генов представляет собой библиотеку окружающей среды.
5. Выделенный синтетический или рекомбинантный полипептид, кодируемый нуклеиновой кислотой по п.4, где полипептид обладает активностью хлорофиллазы или вовлечен в катаболизм молекулы хлорофилла.
6. Антисмысловой олигонуклеотид, содержащий последовательность нуклеиновой кислоты, комплементарную последовательности по п.1 или способную гибридизоваться с ними в жестких условиях, и необязательно длина антисмыслового олигонуклеотида составляет приблизительно от 10 до 50, приблизительно от 20 до 60, приблизительно от 30 до 70, приблизительно от 40 до 80, приблизительно от 60 до 100 или приблизительно от 75 до 125 или более оснований.
7. Выделенный синтетический или рекомбинантный полипептид
(i) имеющий:
(а) по меньшей мере 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или 100% (полную) идентичность с последовательностями SEQ ID NO: 2, SEQ ID NO: 8, SEQ ID NO: 16 или SEQ ID NO: 18 на протяжении участка по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 75 или 100, или более остатков или на протяжении полной длины SEQ ID NO: 2, SEQ ID NO: 8, SEQ ID NO: 16 или SEQ ID NO: 18, или
(b) по меньшей мере 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или 100% (полную) идентичность с последовательностями SEQ ID NO: 6, SEQ ID NO: 12 или SEQ ID NO: 14 на протяжении участка по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 75 или 100, или более остатков или на протяжении полной длины SEQ ID NO: 6, SEQ ID NO: 12 или SEQ ID NO: 14, или
(c) по меньшей мере 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или 100% (полную) идентичность с последовательностью SEQ ID NO: 4 на протяжении участка по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 75 или 100 или более остатков или на протяжении полной длины SEQ ID NO: 4, или
(d) по меньшей мере 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или 100% (полную) идентичность с последовательностью SEQ ID NO: 20 на протяжении участка по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 75 или 100, или более остатков или на протяжении полной длины SEQ ID NO: 20, или
(е) по меньшей мере 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более или 100% (полную) идентичность с последовательностью SEQ ID NO: 10 на протяжении участка по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 75 или 100 или более остатков или на протяжении полной длины SEQ ID NO: 10,
и необязательно идентичность последовательностей определяют анализом с помощью алгоритма сравнения последовательностей или визуальным наблюдением, и необязательно алгоритм сравнения последовательностей представляет собой алгоритм BLAST версии 2.2.2, где установлены параметры фильтрования blastall -p blastp -d "nr pataa" -F F, и все другие параметры установлены по умолчанию;
где идентичность последовательностей существует на протяжении участка по меньшей мере приблизительно 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150 или более остатков или на протяжении полной длины гена или транскрипта;
и полипептид обладает активностью эстеразы или содержит иммуногенный фрагмент, способный вызывать гуморальный антительный или клеточный иммунный ответ, характерный для SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18 или SEQ ID NO: 20, или
(ii) кодируемый нуклеиновой кислотой по п.1, или
(iii) полипептид по пп.(i) и (ii) и содержащий, по меньшей мере, консервативную замену аминокислотного остатка, где необязательно консервативная замена включает замену алифатической аминокислоты другой алифатической аминокислотой; замену серина треонином или наоборот; замену кислого остатка другим кислым остатком; замену остатка, несущего амидную группу, другим остатком, несущим амидную группу; замену основного остатка другим основным остатком, или замену ароматического остатка другим ароматическим остатком, или их комбинацию, и необязательно алифатический остаток включает аланин, валин, лейцин, изолейцин или их синтетический эквивалент, и необязательно кислый остаток включает аспарагиновую кислоту, глутаминовую кислоту или их синтетический эквивалент, и необязательно остаток, содержащий амидную группу, включает аспарагиновую кислоту, глутаминовую кислоту или их синтетический эквивалент, и необязательно основный остаток включает лизин, аргинин или их синтетический эквивалент, и необязательно ароматический остаток включает фенилаланин, тирозин или их синтетический эквивалент,
и полипептид сохраняет свою активность эстеразы или иммуногенную активность; или
(iv) полипептид по пп.(i) , (ii) или (iii), но лишенный своей гомологичной секреторной сигнальной последовательности; или
(v) полипептид по пп.(i), (ii), (iii) или (iv), дополнительно содержащий гетерологичную секреторную сигнальную последовательность (лидерную последовательность) или последовательность пробелка; или
(vi) полипептид по пп.(i), (ii), (iii), (iv) или (v), дополнительно содержащий направляющую последовательность, последовательность N-концевого идентификационного пептида или пептида для стабильности или очистки; или
(vii) полипептид по пп.(i), (ii), (iii), (iv), (v) или (vi), дополнительно содержащий гетерологичную последовательность,
где необязательно активность эстеразы включает ферментативную модификацию молекулы хлорофилла, ферментативный катаболизм молекулы хлорофилла, активность хлорофиллазы, активность chlase или активность хлорофилл-хлорофиллидо-гидролазы;
где необязательно активность полипептида является термостабильной и необязательно полипептид сохраняет ферментативную активность в условиях, включающих диапазон температур приблизительно от 37 до приблизительно 95°С, приблизительно от 55 до приблизительно 85°С, приблизительно от 70 до приблизительно 95°С, приблизительно от 70 до приблизительно 75°С или приблизительно от 90 до приблизительно 95°С;
где необязательно активность полипептида является термоустойчивой, и необязательно полипептид сохраняет ферментативную активность после воздействия температуры в диапазоне от более чем 37 до приблизительно 95°С, от более чем 55 до приблизительно 85°С, или приблизительно от 70 до приблизительно 75°С, или от более чем 90 до приблизительно 95°С или более, и необязательно термоустойчивость включает сохранение, по меньшей мере, половины специфичной активности фермента при 37°С после нагревания до повышенной температуры, и необязательно термоустойчивость включает сохранение специфичной активности в диапазоне приблизительно от 500 до приблизительно 1200 ед./мг белка при 37°С после нагревания до повышенной температуры,
где необязательно полипептид содержит по меньшей мере один участок гликозилирования, и необязательно гликозилирование представляет собой N-гликозилирование,
и необязательно полипептид гликозилирован после экспрессии в P. pastoris или S. pombe,
и необязательно полипептид сохраняет ферментативную активность в условиях, включающих приблизительно рН 6,8; 6,5; 6,0; 5,5; 5,0; 4,5 или 4,0 или менее (более кислый), или приблизительно рН от 6,8 до 3,0,
и необязательно полипептид сохраняет ферментативную активность в условиях, включающих приблизительно рН 7,5; 8,0; 8,5; 9; 9,5; 10; 10,5 и 11 или более щелочной, или приблизительно рН от 7,5 до 11,0.
8. Выделенный синтетический или рекомбинантный полипептид, содержащий полипептид по п.7, и
(а) лишенный сигнальной последовательности или препропоследовательности; или
(b) имеющий гетерологичную сигнальную последовательность или гетерологичную препропоследовательность.
9. Гетеродимер, содержащий полипептид по п.7 и второй домен или гомодимер, содержащий полипептид по п.7 или препарат белка, содержащий полипептид по п.7, где препарат белка включает жидкость, твердое вещество или гель или гомодимер, содержащий полипептид по п.7, где необязательно второй домен представляет собой полипептид, и гетеродимер представляет собой слитый белок и необязательно второй домен представляет собой эпитоп, иммуноген или таг.
10. Иммобилизованный полипептид, где полипептид содержит последовательность по п.7, или гетеродимер, или гомодимер по п.9, где необязательно полипептид иммобилизован на матрице, клетке, металле, смоле, полимере, керамике, стекле, микроэлектроде, графитовой частице, бусах, геле, планшете, матрице или капиллярной трубке, и необязательно матрица дополнительно содержит иммобилизованную нуклеиновую кислоту по п.1.
11. Выделенные синтетические или рекомбинантные антитела, которые специфично связываются с полипептидом по п.7, где необязательно антитела представляют собой моноклональные антитела.
12. Гибридома, содержащая антитела, которые специфично связываются с полипептидом по п.7.
13. Способ получения рекомбинантного полипептида, включающий стадии:
(а) получения нуклеиновой кислоты, функционально связанной с промотором, где нуклеиновая кислота содержит последовательность по п.1; и
(b) экспрессии нуклеиновой кислоты стадии (а) в условиях, которые делают возможной экспрессию полипептида, получая, таким образом, рекомбинантный полипептид,
и необязательно способ дополнительно включает трансформацию клетки-хозяина нуклеиновой кислотой стадии (а) с последующей экспрессией нуклеиновой кислоты стадии (а), получая, таким образом, рекомбинантный полипептид в трансформированной клетке.
14. Компьютерный считываемый носитель информации с сохраненной на нем последовательностью полипептида или последовательностью нуклеиновой кислоты, где последовательность полипептида содержит полипептид по п.7; где полипептид кодируется нуклеиновой кислотой по п.1.
15. Выделенная синтетическая или рекомбинантная сигнальная последовательность, состоящая из последовательности, как указано, с остатками 1-14, 1-15, 1-16, 1-17, 1-18, 1-19, 1-20, 1-21, 1-22, 1-23, 1-24, 1-25, 1-26, 1-27, 1-28, 1-28, 1-30, 1-31, 1-32, 1-33, 1-34, 1-35, 1-36, 1-37, 1-38, 1-40, 1-41, 1-42, 1-43 или 1-44 из
(a) SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18 или SEQ ID NO: 20; или
(b) подпоследовательности по п.7.
16. Химерный полипептид, содержащий по меньшей мере первый домен, содержащий сигнальный пептид (SP), имеющий последовательность по п.15, и по меньшей мере второй домен, содержащий гетерологичный полипептид или пептид, где гетерологичный полипептид или пептид искусственно ассоциирован с сигнальным пептидом (SP),
где необязательно гетерологичный полипептид или пептид не является эстеразой или хлорофиллазой или не вовлечен в ферментативную модификацию молекулы хлорофилла,
и необязательно гетерологичный полипептид или пептид является N-концевым, С-концевым или находится на обоих концах сигнального пептида (SP) или каталитического домена (CD).
17. Выделенная или рекомбинантная нуклеиновая кислота, кодирующая химерный полипептид, где химерный полипептид содержит по меньшей мере первый домен, содержащий сигнальный пептид (SP), имеющий последовательность по п.15, и по меньшей мере второй домен, содержащий гетерологичный полипептид или пептид, где гетерологичный полипептид или пептид искусственно ассоциирован с SP.
18. Способ ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающий следующие стадии:
(a) получение композиции, содержащей хлорофилл или с примесью хлорофилла;
(b) получение по меньшей мере одного полипептида с активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофилла; и
(c) проведение реакции композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла,
где полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1 или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит пищевой продукт, масло или корм, или композицию, полученную из растения, животного или водорослей, или их смесь, и необязательно пептид является иммобилизованным,
и необязательно полипептид иммобилизован на неорганической подложке или на органической подложке, и подложка необязательно содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно полипептид иммобилизован на неорганической подложке или органической подложке и подложка необязательно содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно неорганическая подложка или органическая подложка содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквивалент,
и необязательно по меньшей мере одну стадию проводят в реакционном сосуде, и необязательно реакционный сосуд содержит устройство для гравитационного удаления камедей или накопительную емкость,
и необязательно по меньшей мере одну стадию проводят в клеточном экстракте, или необязательно одну стадию осуществляют в цельной клетке,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит растительный материал, растительное масло или экстракт из растений, и необязательно растительный материал, растительное масло или экстракт из растений содержит растительное масло или масло из семян, и необязательно растительное масло включает пальмовое масло или масло канолы, и необязательно растительный материал, растительное масло или экстракт из растений содержит препарат из водорослей,
и необязательно способ дополнительно включает использование липоксигеназы,
и необязательно активность хлорофиллазы заключается в катализе расщепления тетрапиррольного полициклического кольца и расщеплении кислородом полициклического кольца,
и необязательно способ дополнительно включает удаление хлорофиллида, образующегося при ферментативной деградации хлорофилла посредством адсорбирования на силикагель или эквивалент,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит ткань или волокно, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит древесный или бумажный продукт или субпродукт, или необязательно древесный или бумажный продукт или субпродукт включают древесное волокно или бумажную волокнистую массу, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит недревесный бумажный продукт или субпродукт, или необязательно недревесный или бумажный продукт включает рисовую бумагу,
и необязательно способ дополнительно включает стадию нейтрализации щелочью,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
19. Промышленный способ ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающий следующие стадии:
(a) получение композиции, содержащей хлорофилл или с примесью хлорофилла;
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофилла; и
(c) проведение реакции композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла,
где полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит пищевой продукт, масло или корм, или композицию, полученную из растения, животного или водорослей, или их смесь, и необязательно пептид является иммобилизованным,
и необязательно полипептид иммобилизован на неорганической подложке или на органической подложке, и подложка необязательно содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно полипептид иммобилизован на неорганической подложке или органической подложке, и подложка необязательно включает диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно неорганическая подложка или органическая подложка включает диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквивалент,
и необязательно по меньшей мере одну стадию проводят в реакционном сосуде, и необязательно реакционный сосуд содержит устройство для гравитационного удаления камедей, или накопительную емкость,
и необязательно по меньшей мере одну стадию проводят в клеточном экстракте, или необязательно одну стадию осуществляют в цельной клетке,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит растительный материал, растительное масло или экстракт из растений, и необязательно растительный материал, растительное масло или экстракт из растений содержат растительное масло или масло из семян, и необязательно растительное масло включает пальмовое масло или масло канолы, и необязательно растительный материал, растительное масло или экстракт из растений содержат препарат из водорослей,
и необязательно способ дополнительно включает использование липоксигеназы,
и необязательно активность хлорофиллазы заключается в катализе расщепления тетрапиррольного полициклического кольца и расщепления кислородом полициклического кольца,
и необязательно способ дополнительно включает удаление хлорофиллида, образующегося при ферментативной деградации хлорофилла, посредством адсорбирования на силикагель или эквивалент,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит ткань или волокно, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит древесный или бумажный продукт или субпродукт, или необязательно древесный или бумажный продукт или субпродукт включают древесное волокно или бумажную волокнистую массу, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит недревесный бумажный продукт или субпродукт, или необязательно недревесный или бумажный продукт включает рисовую бумагу,
и необязательно способ дополнительно включает стадию нейтрализации щелочью,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
20. Способ рафинирования, включающий стадию ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающий следующие стадии:
(a) получение композиции, содержащей хлорофилл или с примесью хлорофилла;
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофилла; и
(c) проведение реакции композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла,
где полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1, или необязательно полипептид представляет собой фермент или каталитическое антитело, и необязательно полипептид иммобилизован на неорганической подложке или на органической подложке, и подложка необязательно содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно полипептид иммобилизован на неорганической подложке или органической подложке, и подложка необязательно содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно неорганическая подложка или органическая подложка содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквивалент,
и необязательно по меньшей мере одну стадию проводят в реакционном сосуде и необязательно реакционный сосуд содержит устройство для гравитационного удаления камедей или накопительную емкость,
и необязательно по меньшей мере одну стадию проводят в клеточном экстракте, или необязательно одну стадию осуществляют в цельной клетке,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит растительный материал, растительное масло или экстракт из растений, и необязательно растительный материал, растительное масло или экстракт из растений содержат растительное масло или масло из семян, и необязательно растительное масло включает пальмовое масло или масло канолы, и необязательно растительный материал, растительное масло или экстракт из растений содержат препарат из водорослей,
и необязательно способ дополнительно включает использование липоксигеназы,
и необязательно активность хлорофиллазы заключается в катализе расщепления тетрапиррольного полициклического кольца и расщепления кислородом полициклического кольца,
и необязательно способ дополнительно включает удаление хлорофиллида, образующегося при ферментативной деградации хлорофилла, посредством адсорбирования на силикагель или эквивалент,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит ткань или волокно, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит древесный или бумажный продукт или субпродукт, или необязательно древесный или бумажный продукт или субпродукт включают древесное волокно или бумажную волокнистую массу, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит недревесный бумажный продукт или субпродукт, или необязательно недревесный или бумажный продукт включает рисовую бумагу,
и необязательно способ дополнительно включает стадию нейтрализации щелочью,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С,
и необязательно растительное масло представляет собой неочищенное масло или очищенное масло, и необязательно растительное масло представляет собой препарат неразбавленного неочищенного масла.
21. Промышленное изделие, содержащее систему рафинирования для ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающую:
(a) устройство для очистки растительного масла и
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофиллазы, где активность заключается в катализе реакции модификации хлорофилла и где устройство для очистки растительного масла может осуществлять реакцию композиции, содержащей хлорофилл или с примесью хлорофилла, с полипептидом в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла,
и полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1,
и необязательно устройство для очистки растительного масла содержит експеллер для выхода масла, накопительную емкость или устройство для гравитационного удаления камедей,
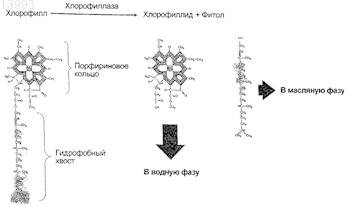
и необязательно реакция модификации хлорофилла включает образование хлорофиллида и фитола,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С,
и необязательно хлорофиллаза включает хлорофиллазу, иммобилизованную на диоксиде кремния, и необязательно диоксид кремния включает силикагель или эквивалент, и необязательно диоксид кремния включает диоксид кремния TriSyl Silica или SORBSIL RÔ.
22. Детергент для ферментативной обработки волокон, содержащих хлорофилл или с примесью хлорофилла, включающий:
(a) композицию детергента и
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или ферментативной активностью в отношении хлорофилла, где активность заключается в катализе реакции модификации хлорофилла,
и полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1,
и необязательно реакция модификации хлорофилла включает образование хлорофиллида и фитола,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
23. Способ ферментативной обработки волокон, содержащих хлорофилл или с примесью хлорофилла, включающий:
(a) получение композиции детергента, содержащей по меньшей мере один полипептид, обладающий активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофилла, где активность заключается в катализе реакции модификации хлорофилла, и
(b) контактирование композиции детергента с волокном, содержащим хлорофилл или с примесью хлорофилла, в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла,
и полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1,
и необязательно реакция модификации хлорофилла включает образование хлорофиллида и фитола,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
24. Способ ферментативной обработки композиций, содержащих феофитин или с примесью феофитина, включающий следующие стадии:
(a) получение композиции, содержащей феофитин или с примесью феофитина;
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или каталитической ферментативной активностью в отношении хлорофилла; и
(с) проведение реакции композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации феофитина,
и необязательно реакция модификации хлорофилла включает образование хлорофиллида и фитола,
и полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
25. Промышленный способ ферментативной обработки композиций, содержащих феофитин или с примесью феофитина, включающий следующие стадии:
(a) получение композиции, содержащей феофитин или с примесью феофитина;
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофилла; и
(c) проведение реакции композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации феофитина,
и полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1,
и необязательно способ дополнительно включает гидролиз эстеразой сложноэфирной связи хлорофилла с метильной группой,
и необязательно способ дополнительно включает гидролиз эстеразой сложноэфирной связи феофитина с метильной группой,
и необязательно способ дополнительно включает удаление модифицированного хлорофилла водной экстракцией,
и необязательно способ дополнительно включает модификацию рН для обеспечения водного удаления хлорофиллида,
и необязательно способ дополнительно включает удаление модифицированного феофитина водной экстракцией,
и необязательно способ дополнительно включает модификацию рН для обеспечения водного удаления феофитина,
и необязательно способ дополнительно включает стадию нейтрализации щелочью,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла,
и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
26. Способ ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающий следующие стадии:
(a) получение композиции, содержащей хлорофилл или в примесью хлорофилла;
(b) получение иммобилизованной на диоксиде кремния хлорофиллазы или фермента, участвующего в катаболизме хлорофилла; и
(c) проведение реакции композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла, и диоксид кремния может адсорбировать модифицированный хлорофилл,
и полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1,
и необязательно диоксид кремния включает силикагель или эквивалент, и необязательно диоксид кремния включает диоксид кремния TriSyl Silica или SORBSIL RÔ.
27. Растительное масло, полученное способом, включающим следующие стадии:
(a) получение композиции, содержащей хлорофилл или в примесью хлорофилла;
(b) получение по меньшей мере одного полипептида, обладающего активностью хлорофиллазы или ферментативной активностью в отношении катаболизма хлорофилла; и
(c) осуществление взаимодействия композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла,
где полипептид имеет последовательность по п.7 или кодируется нуклеиновой кислотой по п.1, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит пищевой продукт, масло или корм, или композицию, полученную из растения, животного или водорослей, или их смеси, и необязательно пептид является иммобилизованным,
и необязательно полипептид иммобилизован на неорганической подложке или на органической подложке, и подложка необязательно включает диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно полипептид иммобилизован на неорганической подложке или органической подложке, и подложка необязательно содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквиваленты, или необязательно неорганическая подложка или органическая подложка содержит диоксид алюминия, целит, хлорид Dowex-1, стеклянные бусы, силикагель, альгинатный гидрогель или альгинатные бусы или эквивалент,
и необязательно по меньшей мере одну стадию проводят в реакционном сосуде, и необязательно реакционный сосуд содержит устройство для гравитационного удаления камедей или накопительную емкость,
и необязательно по меньшей мере одну стадию проводят в клеточном экстракте, или необязательно одну стадию осуществляют в цельной клетке,
и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит растительный материал, растительное масло или экстракт из растений, и необязательно растительный материал, растительное масло или экстракт из растений включают растительное масло или масло из семян, и необязательно растительное масло включает пальмовое масло или масло канолы, и необязательно растительный материал, растительное масло или экстракт из растений включают препарат из водорослей,
и необязательно способ дополнительно включает использование липоксигеназы,
и необязательно активность хлорофиллазы заключается в катализе расщепления тетрапиррольного полициклического кольца и расщепления кислородом полициклического кольца,
и необязательно способ дополнительно включает удаление хлорофиллида, образующегося при ферментативной деградации хлорофилла, посредством адсорбирования на силикагель или эквивалент, и необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит ткань или волокно, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит древесный или бумажный продукт или субпродукт, или необязательно древесный или бумажный продукт или субпродукт включают древесное волокно или бумажную волокнистую массу, или необязательно композиция, содержащая хлорофилл или с примесью хлорофилла, содержит недревесный бумажный продукт или субпродукт, или необязательно недревесный или бумажный продукт включает рисовую бумагу,
и необязательно способ дополнительно включает добавление фосфолипазы, и необязательно фосфолипаза представляет собой фосфолипазу С.
28. Продукт по п.27, где способ дополнительно включает водное удаление хлорофиллида с последующей дезодорацией для получения очищенного, осветленного и дезодорированного (RBD) растительного масла,
и необязательно водное удаление хлорофиллида включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления хлорофиллида, образованного при ферментативной деградации хлорофилла, и необязательно способ дополнительно включает стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента для удаления феофорбида, образованного при ферментативной деградации феофитина,
и необязательно способ дополнительно включает стадию нейтрализации щелочью.
29. Выделенная синтетическая или рекомбинантная нуклеиновая кислота, содержащая нуклеиновую кислоту с последовательностью SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19, где нуклеиновая кислота кодирует по меньшей мере один полипептид с активностью эстеразы или его фрагмент с активностью эстеразы.
30. Выделенный, синтетический или рекомбинантный полипептид, содержащий последовательность SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18 или SEQ ID NO: 20, где полипептид обладает активностью эстеразы или его фрагмент обладает активностью эстеразы.
Текст
КОМПОЗИЦИИ ДЛЯ ФЕРМЕНТАТИВНОГО ОБЕСЦВЕЧИВАНИЯ ХЛОРОФИЛЛА И СПОСОБЫ Данное изобретение относится к композициям и способам ферментативной обработки ("осветлению" или "обесцвечиванию") композиций, содержащих хлорофилл или с примесью хлорофилла,например препаратов из водорослей, кормов, пищевых продуктов или масел, содержащих хлорофилл или с примесью хлорофилла, например растительных масел, включая масла, получаемые из семян масличных растений, таких как масло канолы (семян рапса), или соевое масло, или плодов масличных растений, таких как пальмовое масло. В одном аспекте данное изобретение относится к способам, в которых используется фермент хлорофиллаза для ферментативного гидролиза хлорофилла в препарате из водорослей, животного (например, рыбы) или растения, пищевого продукта или масла. В одном аспекте хлорофиллаза иммобилизована на диоксиде кремния. Данное изобретение также относится к промышленным композициям или детергентам. 013993 Область техники Данное изобретение относится к области промышленной обработки пищевых продуктов, кормов или растительных масел, продуктов растительного и животного происхождения и энзимологии. В частности, данное изобретение относится к композициям и способам ферментативной обработки ("осветлению" или "обесцвечиванию") содержащих хлорофилл композиций или композиций с примесью хлорофилла, например препаратов из водорослей, животных или растений, пищевых продуктов, кормов или масел, например растительных масел, включая масла, полученные из семян масличных растений, таких как масло канолы (семян рапса) или соевое масло, или плодов масличных растений, таких как пальмовое масло. В одном аспекте данное изобретение относится к способам, в которых используются ферменты,участвующие в катаболизме хлорофилла (например, хлорофиллаза) для ферментативной модификации хлорофилла, например, в препаратах, полученных из водорослей, животных или растений, или в пищевом продукте, корме или масле. Предпосылки Растительные масла, полученные из семян масличных растений, таких как канола или соя, или плодов масличных растений, таких как пальмовые, содержат хлорофилл. Хлорофилл удаляют в процессе многих стадий способа производства масла, включая стадии измельчения семян, экстракции масла, рафинирования, обработки щелочью и осветления. В последнем случае, в процессе осветления остаточный хлорофилл удаляют до достижения приемлемого уровня. Этот хлорофилл, как правило, удаляют из масла в процессе стадии осветления, включающем нагревание масла и прохождение его через адсорбент для удаления хлорофилла и других соединений, придающих окраску, которые влияют на внешний вид и/или стабильность обработанного масла. Также эту технологию используют для обработки других содержащих хлорофилл масел или препаратов из водорослей или растений, таких как масла, содержащие полиненасыщенные жирные кислоты (PUFA) (например, эйкозапентаеновую кислоту (ЕРА) и докозагексаеновую кислоту (DHA. Высокий уровень пигментов хлорофилла придает нежелательную окраску и вызывает окисление масла в процессе хранения, что приводит к ухудшению качества масла. В промышленности, связанной с обработкой пищевых масел, для снижения уровня хлорофилла до уровня, равного 0,1 ч.млн. для гарантии качества масла в отношении цвета и органолептических свойств используют стадию осветления. Как правило, желаемый уровень хлорофилла в обработанном масле составляет от 0,02 до 0,05 ч.млн. Эта стадия осветления повышает стоимость обработки и снижает выход масла вследствие того, что оно переходит в отбеливающую глину. У растений, хлорофиллаза (chlase) представляет собой первый фермент, вовлеченный в деградацию хлорофилла; она катализирует гидролиз сложноэфирной связи в хлорофилле с образованием хлорофиллида и фитола. Сущность Данное изобретение относится к композициям и способам ферментативной обработки ("осветления" или "обесцвечивания") композиций, содержащих хлорофилл или с примесью хлорофилла, таких как препараты из растений, животных (например, препараты из рыбы, мяса) или из водорослей, пищевые продукты, корма или масла, такие как масла, содержащие полиненасыщенные жирные кислоты (PUFA) или докозагексаеновую кислоту (DHA), или их смеси. В одном аспекте "ферментативное осветление" в соответствии с композициями и способами по данному изобретению включает использование модифицирующего хлорофилл фермента, например полипептида с активностью хлорофиллазы, включая chlase и хлорофилл-хлорофиллидо-гидролазу, и сходных полипептидов, или любого фермента, участвующего в катаболизме хлорофилла. Таким образом, как используется в данном описании, термин "ферментативное осветление" включает любую модификацию молекулы хлорофилла или его аналога, включая частичное или полное обесцвечивание. В одном аспекте композиции и способы по данному изобретению могут снижать потери выхода вследствие перехода в глину и расщепления жиров, характерного для катализа в условиях наличия глины/отбеливателя. В альтернативных аспектах методов и способов по данному изобретению хлорофиллазу, которая может представлять собой новую хлорофиллазу по данному изобретению, или известный фермент,включая chlase и хлорофилл-хлорофиллидо-гидролазы, и сходные полипептиды или их комбинацию, или любой фермент, участвующий в катаболизме хлорофилла, добавляют в любой момент времени или всюду в ходе осуществления способа или процесса, например, как описано в данном описании. Например, в одном аспекте хлорофиллаза (которая может представлять собой новую хлорофиллазу по данному изобретению, или известный фермент, или их комбинацию) и/или любой фермент, участвующий в катаболизме хлорофилла, может быть добавлена в композицию, такую как неочищенное масло, с другим ферментом или без него, например с фосфолипазой (например, с фосфолипазой С), на стадии смешивания или на стадии рафинирования, на стадии в резервуаре для обработки щелочью, в статическом смесителе,в расходной емкости или в смесителе для непрерывного смешения жидких потоков. Альтернативно, в одном аспекте способа или метода по данному изобретению хлорофиллаза (по данному изобретению или известная) и/или любой фермент, участвующий в катаболизме хлорофилла, могут быть добавлены в любую комбинацию из этих стадий или на всех этих стадиях.-1 013993 В одном аспекте данное изобретение относится к способам или методам ферментативной модификации хлорофилла для облегчения его удаления из композиции, например, посредством метода водного разделения, как проиллюстрировано на с. 1 приложения А, или метода гидрофобного разделения, или метода аффинного разделения и т.п. В одном аспекте данное изобретение относится к способам и методам, включающим ферментативную модификацию (например, катаболизм) хлорофилла или эквивалентных соединений в композиции(например, в пищевом продукте, корме, в композиции из растений, животных, водорослей и т.д.), кроме того, включающим удаление компонентов этой композиции (например, соединений, нежелательных для обработанного продукта), таких как остаточный хлорофилл (например, хлорофилл или эквивалентные соединения, не модифицированные хлорофиллазой), пестициды, полициклические ароматические углеводороды и т.д. Нежелательные компоненты, например остаточный хлорофилл, пестициды, полициклические ароматические углеводороды и т.п., могут быть удалены с помощью либо значительно меньших количеств отбеливающей глины, либо другого адсорбента, такого как диоксид кремния или эквивалентные соединения. В одном аспекте эти компоненты композиции удаляют с использованием отбеливающей глины, например с использованием отбеливающей глины на множестве стадий, где в одном аспекте компоненты композиции удаляют с помощью или значительно меньших количеств отбеливающей глины, и/или по меньшей мере одного другого адсорбента (например, диоксида кремния). В одном аспекте конечный уровень хлорофилла составляет приблизительно от 0,02 до 0,05 ч.млн. В этом иллюстративном способе стадия осветления может повысить стоимость обработки и уменьшить потери выхода вследствие перехода в отбеливающую глину. Композиции и способы по данному изобретению могут уменьшить потери выхода вследствие перехода в глину и расщепления жиров, характерного для катализа в условиях наличия глины/отбеливателя. В иллюстративно продемонстрированном способе (реакции) по данному изобретению хлорофиллаза катализирует гидролиз хлорофилла с образованием хлорофиллида, который в одном аспекте подвергают водной экстракции, и фитола, который остается в масляной фазе. В другом иллюстративном способе феофорбид может быть удален по методу, аналогичному для хлорофиллида. В одном аспекте при применении композиций и способов по данному изобретению метод водного разделения может частично или полностью снять необходимость в адсорбентах. Однако в другом аспекте способы включают частичную или полную экстракцию растворимого в воде хлорофиллида или феофорбида с использованием метода экстракции на основе диоксида кремния (например, очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента). В одном аспекте хлорофиллаза иммобилизована на диоксиде кремния (который затем адсорбирует хлорофиллид), например на силикагеле. В одном аспекте диоксид кремния включает диоксид кремния TriSyl Silica или SORBSIL R. Данное изобретение относится к способам, включая промышленные способы ферментативной обработки композиций, содержащих феофитин или с примесью феофитина, включающим следующие стадии: (а) получение композиции, содержащей феофитин или с примесью феофитина; (b) получение полипептида с активностью хлорофиллазы или феофитиназы (который может представлять собой новую хлорофиллазу по данному изобретению, или известный фермент, или их комбинацию); и (с) осуществление взаимодействия композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации феофитина. Производное хлорофилла без магния называется феофитином. Феофитин является окрашенным и часто обнаруживается в масле, особенно при использовании обработки кислотой. В некоторых областях применения желательно удалять феофитин. Продуктом обработки феофитина хлорофиллазой является феофорбид, который может быть удален по методу, аналогичному для удаления хлорофиллида. В одном аспекте композиции и способы по данному изобретению применяются на практике в качестве промышленных способов или совместно с ними, например с процессом осветления масла или нейтрализации щелочью, или рафинирования. В одном аспекте использование композиций и способов по данному изобретению облегчает снижение количества адсорбентов или устранение необходимости в них в ходе обработки для осветления, которая, как правило, включает нагревание масла или другой содержащей хлорофилл композиции и прохождение его через адсорбент для удаления хлорофилла и других придающих окраску соединений, что влияет на внешний вид и/или стабильность обработанного масла. Таким образом, при применении на практике этого аспекта изобретения, посредством частичного или полного устранения необходимости в адсорбентах, стоимость обработки может быть снижена, например могут быть снижены стоимость адсорбентов (например, глины), затраты на удаление отходов, стоимость воды, стоимость энергии, стоимость обработки паром. Другие преимущества применения на практике различных аспектов данного изобретения включают получение положительных изменений, например уменьшения перехода масел в сорбирующие субстраты, повышение конечного объема продукта, включая сохранение полезных микронутриентов, таких как бета-каротин, эффективность процесса, включая уменьшение количества стадий обработки, экономию капитала и пользу для окружающей среды, например снижение или устранение увеличения содержания осветляющих адсорбентов в почве. В одном аспекте при применении на практике композиций и способов по данному изобретению мо-2 013993 дифицирующие хлорофилл полипептиды (которые могут представлять собой новую хлорофиллазу по данному изобретению, или известный фермент, или их комбинацию) могут быть использованы на любой стадии процесса рафинирования (например, ферментативного рафинирования). Например, модифицирующие хлорофилл полипептиды могут быть добавлены до или после любой стадии способа, или до или после любой комбинации стадий, или до или после всех стадий, в способе, например, до, в течение или после механической и/или химической экстракции, и/или рафинирования, и/или нейтрализации щелочью, и/или осветления и т.п. В альтернативных аспектах любых способов по данному изобретению по меньшей мере одну стадию проводят в реакционном резервуаре, например в устройстве для рафинирования. В альтернативных аспектах любых способов по данному изобретению по меньшей мере одну стадию проводят в клеточном экстракте. В альтернативных аспектах любых способов по данному изобретению по меньшей мере одну стадию проводят в цельной клетке. Клетка может быть любого происхождения, например растительной клеткой, бактериальной клеткой, клеткой грибов, клеткой животных (например, клеткой млекопитающих, клеткой рыб) или клеткой дрожжей. Данное изобретение относится к способам ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающим следующие стадии: (а) получение композиции,содержащей хлорофилл или композиции с примесью хлорофилла; (b) получение полипептида с активностью хлорофиллазы (который может представлять собой новую хлорофиллазу по данному изобретению,или известный фермент, или их комбинацию); и (с) осуществление взаимодействия композиции стадии(а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла. Данное изобретение относится к промышленным способам ферментативной обработки ("осветления") композиций, содержащих хлорофилл или с примесью хлорофилла, включающим следующие стадии: (а) получение композиции, содержащей хлорофилл или с примесью хлорофилла; (b) получение полипептида с активностью хлорофиллазы (который может представлять собой новую хлорофиллазу по данному изобретению, или известный фермент, или их комбинацию); и (с) осуществление взаимодействия композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла. Данное изобретение относится к способам рафинирования, включающим стадию ферментативного осветления композиций, содержащих хлорофилл или с примесью хлорофилла, включающим следующие стадии: (а) получение композиции, содержащей хлорофилл или с примесью хлорофилла; (b) получение полипептида с активностью хлорофиллазы (который может представлять собой новую хлорофиллазу по данному изобретению, или известный фермент, или их комбинацию); и (с) осуществление взаимодействия композиции стадии (а) с полипептидом стадии (b) в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла. Хлорофиллы и феофитины обладают второй сложноэфирной связью - сложноэфирной связью с метильной группой. Способы по данному изобретению могут дополнительно включать гидролиз эстеразой этой сложноэфирной связи с метилом. Это может повысить склонность продукта реакции (уже двухосновной кислоты) к распределению в водный слой. В иллюстративном способе используется фосфолипаза, например фосфолипаза С, или другая гидролаза (например, целлюлаза, гемицеллюлаза, эстераза, протеаза и/или фосфатаза), например, для улучшения экстракции масла или рафинирования масла. В альтернативных аспектах способы и методы по данному изобретению могут дополнительно включать гидролиз сложноэфирной связи с метильной группой хлорофилла или феофитина эстеразой(которая может представлять собой новый фермент по данному изобретению, или известный фермент,или их комбинацию). В альтернативных аспектах способы по данному изобретению могут дополнительно включать удаление модифицированного хлорофилла водной экстракцией. Способы могут дополнительно включать изменение рН (например, повышение рН) для обеспечения водного выделения хлорофиллида. Ферменты, используемые в способах, например хлорофиллаза, могут быть добавлены при таком повышенном рН, или во время "щелочной" фазы процесса разделения. Кроме того, способы могут включать стадию нейтрализации щелочью. Кроме того, способы могут включать стадию очистки с диоксидом кремния без адсорбента или со сниженным количеством адсорбента, для удаления хлорофиллида,образованного при ферментативной деградации хлорофилла. Кроме того, способы могут включать использование гидролазы, например фосфолипазы C. В одном аспекте методов и способов полипептид представляет собой эстеразу (например, фермент по данному изобретению), например хлорофиллазу, или имеет подобную хлорофиллазе активность, или обладает активностью в отношении катаболизма хлорофилла. В одном аспекте способов полипептид является иммобилизованным. Полипептид может быть иммобилизован на неорганической подложке или органической подложке. Неорганическая подложка может включать оксид алюминия, целит, хлорид Dowex-1, стеклянные бусы или силикагель, или их эквиваленты. Полипептид может быть иммобилизован на альгинатном гидрогеле или альгинатных бусах, или их эквивалентах. В одном аспекте способов полипептид дополни-3 013993 тельно содержит липосому, гидрогель или гель. В одном аспекте способов для полипептида по меньшей мере одну стадию проводят в реакционном резервуаре, например в резервуаре, содержащем устройство для гравитационного удаления камедей, или в накопительной емкости, или подобных. В одном аспекте способы проводят по меньшей мере в одну стадию в клеточном экстракте или цельной клетке. Клетка может представлять собой растительную клетку, бактериальную клетку, клетку грибов, клетку дрожжей, клетку млекопитающих, клетку насекомых и т.п. В одном аспекте способов композиция, содержащая хлорофилл или с примесью хлорофилла, содержит растительный материал, растительное масло или экстракт из растения. Растительный материал,растительное масло или экстракт из растения могут содержать растительное масло или масло из семян. Растительное масло может включать пальмовое масло или масло канолы. Альтернативно, растительный материал, растительное масло или экстракт из растений могут содержать препарат из водорослей. В одном аспекте способов композиции, содержащие хлорофилл или композиции с примесью хлорофилла,содержат недревесный или древесный продукт. В одном аспекте способов композиции, содержащие хлорофилл или с примесью хлорофилла, содержат волокно или ткань. В одном аспекте способов композиции, содержащие хлорофилл или с примесью хлорофилла, содержат фармацевтический состав, пищевой продукт, масло, корм или диетическую добавку. Композиции и способы по данному изобретению могут быть использованы для обработки неочищенных или очищенных масел, например масел, полученных из растительных источников (например,растительное), из водорослей, из животных источников или рыбы, или синтетического происхождения. Композиции и способы по данному изобретению могут быть использованы для обработки неочищенных или очищенных масел при высоких концентрациях масла, или, в одном аспекте, используются для обработки неочищенных и неразбавленных неочищенных масел. В одном аспекте способы дополнительно включают удаление хлорофиллида, образующегося при ферментативной деградации хлорофилла, адсорбцией на силикагель или эквивалент. Композиции, содержащие хлорофилл или с примесью хлорофилла, могут содержать текстиль, ткань, нитку или волокно,или сходные композиции, продукты из древесной бумаги или субпродукты, такие как древесная масса,бумажная масса, крафт-масса, или продукты из недревесной бумаги или субпродукты, такие как рисовая бумага. Данное изобретение относится к промышленным изделиям, включающим систему рафинирования для ферментативной обработки композиций, содержащих хлорофилл или с примесью хлорофилла, включающую: (а) устройство для очистки растительного масла; и (b) полипептид, обладающий активностью хлорофиллазы (например, фермент по данному изобретению), где активность полипептида заключается в катализе реакции модификации хлорофилла, и в устройстве для очистки растительного масла можно проводить реакцию композиции, содержащей хлорофилл или с примесью хлорофилла, с полипептидом в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла. В одном аспекте промышленного изделия устройство для очистки растительного масла включает экспеллер для выхода масла, накопительную емкость или устройство для гравитационного удаления камедей. Реакции модификации хлорофилла могут включать образование хлорофиллида и фитола. Данное изобретение относится к детергентам, включающим ферментативную обработку волокон,содержащих хлорофилл или с примесью хлорофилла, включающим (а) композицию детергента и (b) полипептид, обладающий активностью хлорофиллазы (например, фермент по данному изобретению), где активность заключается в катализе реакции модификации хлорофилла. В одном аспекте реакция модификации хлорофилла включает образование хлорофиллида и фитола. Данное изобретение относится к способам ферментативной обработки волокон, содержащих хлорофилл или с примесью хлорофилла, включающим (а) получение композиции детергента, содержащего полипептид, обладающий активностью хлорофиллазы (например, фермент по данному изобретению), где активность заключается в катализе реакции модификации хлорофилла; и (b) осуществление взаимодействия композиции детергента с волокном, содержащим хлорофилл или с примесью хлорофилла, в условиях, при которых полипептид может катализировать реакцию модификации хлорофилла. В одном аспекте реакция модификации хлорофилла включает образование хлорофиллида и фитола. Данное изобретение относится к выделенным, синтетическим или рекомбинантным нуклеиновым кислотам, содержащим последовательность нуклеиновой кислоты по меньшей мере с приблизительно 50,51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80,81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более, или с полной (100%) идентичностью последовательностей с иллюстративной нуклеиновой кислотой по данному изобретению,например SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19, на протяжении участка по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550,600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500,1550, 1600, 1650, 1700, 1750, 1800, 1850, 1900, 1950, 2000, 2050, 2100, 2200, 2250, 2300, 2350, 2400, 2450,2500 или более остатков, последовательности, по существу, идентичные им, и последовательности, ком-4 013993 плементарные им, и кодирующим по меньшей мере один пептид, обладающий ферментативной активностью, как описано в данном описании, например активностью фермента эстеразы. В альтернативных аспектах идентичность последовательностей определяют анализом с помощью алгоритма сравнения последовательностей или визуальным исследованием. В одном аспекте алгоритм сравнения последовательностей представляет собой алгоритм BLAST, например алгоритм BLAST версии 2.2.2, где установлены параметры фильтров: -р blastp -d "nr pataa" -F F, и все другие параметры установлены по умолчанию. Иллюстративные нуклеиновые кислоты по данному изобретению также включают выделенные,синтетические или рекомбинантные нуклеиновые кислоты, кодирующие полипептид по данному изобретению, например пептид, имеющий последовательность, как указано в SEQ ID NO: 2, SEQ ID NO: 4, SEQID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18 или SEQ ID NO: 20 и его подпоследовательности, и его варианты. В альтернативных аспектах полипептид обладает ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase), или ферментативной активностью, включающей ферментативную модификацию молекулы хлорофилла, например, где ферментативная модификация заключается в катаболизме молекулы хлорофилла. В одном аспекте активность эстеразы включает хлорофиллхлорофиллидо-гидролазную активность. В одном аспекте выделенная синтетическая или рекомбинантная нуклеиновая кислота по данному изобретению кодирует пептид, обладающий ферментативной активностью, которая является термостабильной. Полипептид может сохранять ферментативную активность в условиях, включающих диапазон температур приблизительно от 37 до приблизительно 95 С; приблизительно от 55 до приблизительно 85 С, приблизительно от 70 до приблизительно 95 С или приблизительно от 90 до приблизительно 95 С. В другом аспекте выделенная синтетическая или рекомбинантная нуклеиновая кислота по данному изобретению кодирует пептид, обладающий ферментативной активностью, которая является термоустойчивой. Полипептид может сохранять ферментативную активность после воздействия температуры в диапазоне от более 37 до приблизительно 95 С или везде в диапазоне от более чем 55 до приблизительно 85 С. Полипептид может сохранять ферментативную активность после воздействия температуры в диапазоне приблизительно от 1 до приблизительно 5 С, приблизительно от 5 до приблизительно 15 С, приблизительно от 15 до приблизительно 25 С, приблизительно от 25 до приблизительно 37 С, приблизительно от 37 до приблизительно 95 С, приблизительно от 55 до приблизительно 85 С, приблизительно от 70 до приблизительно 75 С или приблизительно от 90 до приблизительно 95 С или более. В одном аспекте полипептид сохраняет ферментативную активность после воздействия температуры в диапазоне от более чем 90 до приблизительно 95 С при рН 4,5. Данное изобретение относится к выделенным, синтетическим или рекомбинантным нуклеиновым кислотам, содержащим последовательность, которая гибридизуется в жестких условиях с нуклеиновой кислотой, содержащей последовательность по данному изобретению, например последовательность, как указано в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19, или ее фрагменты или подпоследовательности (или комплементарные ей последовательности). В одном аспекте нуклеиновая кислота по данному изобретению кодирует пептид, обладающий ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase), или ферментативной активностью, включающей ферментативную модификацию молекулы хлорофилла, например, где ферментативная модификация заключается в катаболизме молекулы хлорофилла. В одном аспекте активность эстеразы включает активность хлорофилл-хлорофиллидогидролазы. Длина нуклеиновой кислоты может составлять по меньшей мере приблизительно 10, 15, 20,25, 30, 35, 40, 45, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900,950, 1000, 1050, 1100, 1150, 1200 или более остатков, или полную длину гена или транскрипта. В одном аспекте жесткие условия включают стадию промывания, включающую промывание в 0,2 Х SSC при температуре приблизительно 65 С в течение 15 мин. Данное изобретение относится к зонду нуклеиновой кислоты для идентификации нуклеиновой кислоты, кодирующей пептид, обладающий ферментативной активностью, как описано в данном описании,(например, с ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase, где зонд содержит по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85,90, 95, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000 или более последовательно расположенных оснований последовательности, содержащей последовательность по данному изобретению, или ее фрагменты или подпоследовательности, где зонд дает возможность идентифицировать нуклеиновую кислоту по связыванию или гибридизации. Зонд может включать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50, приблизительно от 20 до 60,приблизительно от 30 до 70, приблизительно от 40 до 80 или приблизительно от 60 до 100 последовательно расположенных оснований последовательности, содержащей последовательность по данному изобретению, или ее фрагменты, или подпоследовательности. Данное изобретение относится к зонду нуклеиновой кислоты для идентификации нуклеиновой кислоты, кодирующей полипептид, обладающий по меньшей мере одним видом ферментативной активно-5 013993 сти, как описано в данном описании, (например, ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase, где зонд содержит нуклеиновую кислоту, содержащую последовательность по меньшей мере из приблизительно 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350,400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000 или более остатков по меньшей мере с приблизительно 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75,76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более, или полной (100%) идентичностью последовательностей с нуклеиновой кислотой по данному изобретению, где идентичность последовательностей определяют анализом с использованием алгоритма сравнения последовательностей или визуальным исследованием. Зонд может включать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50,приблизительно от 20 до 60, приблизительно от 30 до 70, приблизительно от 40 до 80 или приблизительно от 60 до 100 последовательно расположенных оснований последовательности нуклеиновой кислоты по данному изобретению или ее подпоследовательности. Данное изобретение относится к паре праймеров для амплификации нуклеиновой кислоты, кодирующей полипептид, обладающий по меньшей мере одним видом ферментативной активности, как описано в данном описании, (например, ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase, где пара праймеров способна амплифицировать нуклеиновую кислоту, содержащую последовательность по данному изобретению, или ее фрагменты, или подпоследовательности. Один или каждый член пары последовательностей праймеров для амплификации может содержать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50 последовательных оснований последовательности или приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более последовательно расположенных оснований последовательности. Данное изобретение относится к паре праймеров для амплификации, где пара праймеров включает первый член, имеющий последовательность, как указано, из приблизительно первых (5') 12, 13, 14, 15,16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более остатков нуклеиновой кислоты по данному изобретению, и второй член, имеющий последовательность, как указано, из приблизительно первых (5') 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более остатков комплементарной цепи первого члена. Данное изобретение относится к нуклеиновым кислотам, кодирующим белки (например, ферменты), включая полипептиды по данному изобретению, полученным амплификацией, например, посредством полимеразной цепной реакции (ПЦР), с использованием пары праймеров для амплификации по данному изобретению. Данное изобретение относится к нуклеиновым кислотам, кодирующим полипептиды,обладающие по меньшей мере одним видом ферментативной активности, как описано в данном описании, (например, ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase,полученным с использованием пары праймеров для амплификации по данному изобретению. Данное изобретение относится к способам получения и/или идентификации ферментов амплификацией, например, посредством полимеразной цепной реакции (ПЦР), с использованием пары праймеров для амплификации по данному изобретению. В одном аспекте с помощью пары праймеров для амплификации амплифицируют нуклеиновую кислоту из библиотеки, например библиотеки генов, такой как библиотека окружающей среды. Данное изобретение относится к способам амплификации нуклеиновой кислоты, кодирующей пептид, обладающий ферментативной активностью, включающим амплификацию матричной нуклеиновой кислоты с помощью последовательностей пары праймеров для амплификации, способных амплифицировать последовательность нуклеиновой кислоты по данному изобретению, или ее фрагменты, или подпоследовательности. Данное изобретение относится к экспрессирующим кассетам, содержащим нуклеиновую кислоту по данному изобретению или ее подпоследовательность. В одном аспекте экспрессирующая кассета может содержать нуклеиновую кислоту, которая функционально связана с промотором. Промотор может представлять собой вирусный, бактериальный промотор, промотор млекопитающих или растений. В одном аспекте промотор растений может представлять собой промотор картофеля, риса, кукурузы, пшеницы,табака или ячменя. Промотор может представлять собой конститутивный промотор. Конститутивный промотор может включать CaMV35S. В другом аспекте промотор может представлять собой индуцибельный промотор. В одном аспекте промотор может представлять собой тканеспецифичный промотор или промотор, регулируемый окружающей средой, или промотор, регулируемый в зависимости от стадии развитии. Таким образом, промотор может представлять собой, например, промотор, специфичный для семян, специфичный для листьев, специфичный для корней, специфичный для стебля, или промотор,индуцируемый опаданием листвы. В одном аспекте экспрессирующая кассета может дополнительно содержать экспрессирующий вектор растений или вирусов растений. Данное изобретение относится к носителям для клонирования, включающим экспрессирующую кассету (например, вектор) по данному изобретению или нуклеиновую кислоту по данному изобретению. Носитель для клонирования может представлять собой вирусный вектор, плазмиду, фаг, фагмиду, космиду, фосмиду, бактериофаг или искусственную хромосому. Вирусный вектор может включать аденови-6 013993 русный вектор, ретровирусный вектор или аденоассоциированный вирусный вектор. Носитель для клонирования может включать бактериальную искусственную хромосому (ВАС), плазмиду, полученный из бактериофага Р 1 вектор (РАС), искусственную хромосому дрожжей (YAC) или искусственную хромосому млекопитающих (MAC). Данное изобретение относится к трансформированной клетке, содержащей нуклеиновую кислоту по данному изобретению или экспрессирующую кассету (например, вектор) по данному изобретению,или носитель для клонирования по данному изобретению. В одном аспекте трансформированная клетка может представлять собой бактериальную клетку, клетку млекопитающих, клетку грибов, клетку дрожжей, клетку насекомых или клетку растений. В одном аспекте клетка растений может представлять собой клетку злаковых, картофеля, пшеницы, риса, кукурузы, табака или ячменя. Данное изобретение относится к трансгенным животным, не относящимся к человеку, содержащим нуклеиновую кислоту по данному изобретению или экспрессирующую кассету (например, вектор) по данному изобретению. В одном аспекте животным является мышь. Данное изобретение относится к трансгенным растениям, содержащим нуклеиновую кислоту по данному изобретению или экспрессирующую кассету (например, вектор) по данному изобретению. Трансгенное растение может представлять собой растение злаковых, растение кукурузы, растение картофеля, растение томата, растение пшеницы, растение масличных культур, растение рапса, растение сои,растение риса, растение ячменя или растение табака. Данное изобретение относится к трансгенным семенам, содержащим нуклеиновую кислоту по данному изобретению или экспрессирующую кассету (например, вектор) по данному изобретению. Трансгенное семя может представлять собой семя злакового растения, семя кукурузы, зерно пшеницы, семя масличного растения, семя рапса, семя сои, ядро пальмы, семя подсолнечника, семя кунжута, орех или семя растения табака. Данное изобретение относится к антисмысловому олигонуклеотиду, содержащему последовательность нуклеиновой кислоты, комплементарную нуклеиновой кислоте по данному изобретению или способную гибридизоваться с ней в жестких условиях. Данное изобретение относится к способам ингибирования трансляции транскрипта фермента (фермента по данному изобретению) в клетке, включающим введение в клетку или экспрессию в клетке антисмыслового олигонуклеотида, содержащего последовательность нуклеиновой кислоты, комплементарную нуклеиновой кислоте по данному изобретению или способную гибридизоваться с ней в жестких условиях. В одном аспекте длина антисмыслового олигонуклеотида составляет приблизительно от 10 до 50, приблизительно от 20 до 60, приблизительно от 30 до 70, приблизительно от 40 до 80 или приблизительно от 60 до 100 оснований. Данное изобретение относится к способам ингибирования трансляции транскрипта фермента в клетке, включающим введение в клетку или экспрессию в клетке антисмыслового олигонуклеотида, содержащего последовательность нуклеиновой кислоты, комплементарную нуклеиновой кислоте по данному изобретению или способную гибридизоваться с ней в жестких условиях. Данное изобретение относится к молекулам двухцепочечных ингибиторных РНК (PHKi), содержащим подпоследовательность последовательности по данному изобретению. В одном аспекте длина PHKi составляет приблизительно 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более дуплексных нуклеотидов. Данное изобретение относится к способам ингибирования экспрессии полипептида (например, фермента по данному изобретению) в клетке, включающим введение в клетку или экспрессию в клетке двухцепочечной ингибиторной РНК(iPHK), где РНК содержит подпоследовательность последовательности по данному изобретению. Данное изобретение относится к выделенному синтетическому или рекомбинантному полипептиду,содержащему аминокислотную последовательность, имеющую по меньшей мере приблизительно 50, 51,52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81,82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более идентичность последовательностей, или полную (100%) идентичность последовательностей с иллюстративным полипептидом или пептидом по данному изобретению на протяжении участка по меньшей мере из приблизительно 20, 25,30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350 или более остатков,или на протяжении полной длины полипептида. В одном аспекте идентичность последовательностей определяют анализом с помощью алгоритма сравнения последовательностей или визуальным исследованием. Иллюстративные последовательности полипептида или пептида по данному изобретению включают SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ IDNO: 14, SEQ ID NO: 16, SEQ ID NO: 18 или SEQ ID NO: 20 и их подпоследовательности, и их варианты. Также иллюстративные полипептиды включают фрагменты фермента длиной по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 80, 85, 90, 95, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550,600 или более остатков, или полноразмерный фермент. Иллюстративные последовательности полипептида или пептида по данному изобретению включают последовательность, кодируемую нуклеиновой кислотой по данному изобретению. Иллюстративные последовательности полипептида или пептида по данному изобретению включают полипептиды или пептиды, специфически связываемые антителами по данному изобретению. Пептид может представлять собой, например, иммуногенный фрагмент, мотив(например, сайт связывания), сигнальную последовательность, препропоследовательность, каталитические домены (CD) или активный центр. В одном аспекте полипептид по данному изобретению обладает активностью эстеразы, такой как активность хлорофиллазы (chlase), или обладает ферментативной активностью, включающей ферментативную модификацию молекулы хлорофилла, например, где ферментативная модификация заключается в катаболизме молекулы хлорофилла. В одном аспекте активность эстеразы включает активность хлорофилл-хлорофиллидо-гидролазы. Другой аспект данного изобретения относится к выделенному, синтетическому или рекомбинантному полипептиду или пептиду, содержащему по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60,65, 70, 75, 80, 85, 90, 95 или 100, или более последовательно расположенных оснований последовательности полипептида или пептида по данному изобретению, последовательностей, по существу, ей идентичных, и комплементарных им последовательностей. Пептид может представлять собой, например, иммуногенный фрагмент, мотив (например, участок связывания), сигнальную последовательность, препропоследовательность или каталитические домены (CD) или активный центр. Данное изобретение относится к биосинтетическим системам, содержащим нуклеиновые кислоты и/или плазмиды по данному изобретению в клетке, например клетке дрожжей, клетке растений, клетке грибов или микробной (например, бактериальной) клетке. В одном аспекте биосинтетические системы по данному изобретению содержат кодирующие последовательности для всех ферментов или их подклассов, необходимых для катаболизма молекулы хлорофилла. В одном аспекте кодирующие последовательности могут представлять собой плазмиду, рекомбинантный вектор или вирус и т.п. В одном аспекте ферментативная активность полипептида по данному изобретению является термостабильной. Полипептид по данному изобретению может сохранять активность в условиях, включающих диапазон температур приблизительно от 1 до приблизительно 5 С, приблизительно от 5 до приблизительно 15 С, приблизительно от 15 до приблизительно 25 С, приблизительно от 25 до приблизительно 37 С, приблизительно от 37 до приблизительно 95 С, приблизительно от 55 до приблизительно 85 С,приблизительно от 70 до приблизительно 75 С или приблизительно от 90 до приблизительно 95 С или более. В другом аспекте ферментативная активность полипептида по данному изобретению является термоустойчивой. Полипептид может сохранять активность после воздействия температуры в диапазоне от более чем 37 до приблизительно 95 С или в диапазоне от более чем 55 до приблизительно 85 С. В одном аспекте полипептид может сохранять активность после воздействия температуры в диапазоне от более чем 90 до приблизительно 95 С при рН 4,5. В одном аспекте выделенный синтетический или рекомбинантный полипептид может содержать полипептид по данному изобретению, который лишен сигнальной последовательности. В одном аспекте выделенный синтетический или рекомбинантный полипептид может включать полипептид по данному изобретению, содержащий гетерологичную сигнальную последовательность. В одном аспекте данное изобретение относится к химерным белкам, включающим первый домен,содержащий сигнальную последовательность по данному изобретению, и по меньшей мере второй домен. Белок может представлять собой слитый белок. Второй домен может включать фермент. Химерный фермент может включать всю последовательность или подпоследовательность по меньшей мере одного полипептида с активностью, как описано в данном описании (например, ферментативной активностью эстеразы, включая активность хлорофиллазы (chlase. Данное изобретение относится к химерным полипептидам, включающим по меньшей мере первый домен, содержащий сигнальный пептид (SP), препропоследовательность и/или каталитический домен(CD) по данному изобретению, и по меньшей мере второй домен, содержащий гетерологичный полипептид или пептид, где гетерологичный полипептид или пептид искусственно ассоциирован с сигнальным пептидом (SP), препропоследовательностью и/ или каталитическим доменом (CD). В одном аспекте гетерологичный полипептид или пептид не является полипептидом, обладающим активностью, включающей ферментативную активность эстеразы или активность в отношении катаболизма хлорофилла. Гетерологичный полипептид или пептид может быть N-концевым, С-концевым или может находиться на обоих концах сигнального пептида (SP), препропоследовательности и/или каталитического домена (CD). Данное изобретение относится к выделенным синтетическим или рекомбинантным нуклеиновым кислотам, кодирующим химерный полипептид, где химерный полипептид включает по меньшей мере первый домен, содержащий сигнальный пептид (SP), препродомен и/или каталитический домен (CD) по данному изобретению, и по меньшей мере второй домен, содержащий гетерологичный полипептид или пептид, где гетерологичный полипептид или пептид искусственно ассоциирован с сигнальным пептидом(SP), препродоменом и/или каталитическим доменом (CD). Данное изобретение относится к выделенным синтетическим или рекомбинантным сигнальным последовательностям (например, сигнальным пептидам), состоящим из последовательности или содержащим последовательность, как указано, из остатков 1-14, 1-15, 1-16, 1-17, 1-18, 1-19, 1-20, 1-21, 1-22, 1-23,1-24, 1-25, 1-26, 1-27, 1-28, 1-28, 1-30, 1-31, 1-32, 1-33, 1-34, 1-35, 1-36, 1-37, 1-38, 1-40, 1-41, 1-42, 1-43 или 1-44 полипептида по данному изобретению, например SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6,SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18 илиSEQ ID NO: 20. Данное изобретение относится к выделенным синтетическим или рекомбинантным сигнальным последовательностям (например, сигнальным пептидам), состоящим из последовательности или содержащим последовательность, как указано ниже в табл. 1. В одном аспекте фермент по данному изобретению обладает специфичной активностью в диапазоне приблизительно от 1 до приблизительно 1200 ед./мг белка или приблизительно от 100 до приблизительно 1000 ед./мг белка при приблизительно 37 С. В другом аспекте фермент по данному изобретению обладает специфичной активностью приблизительно от 100 до приблизительно 1000 ед./мг белка или приблизительно от 500 до приблизительно 750 ед./мг белка. Альтернативно, фермент по данному изобретению обладает специфичной активностью в диапазоне приблизительно от 1 до приблизительно 750 ед./мг белка или приблизительно от 500 до приблизительно 1200 ед./мг белка при 37 С. В одном аспекте фермент по данному изобретению обладает специфичной активностью в диапазоне приблизительно от 1 до приблизительно 500 ед./мг белка или приблизительно от 750 до приблизительно 1000 ед./мг белка при 37 С. В другом аспекте фермент по данному изобретению обладает специфичной активностью в диапазоне приблизительно от 1 до приблизительно 250 ед./мг белка при 37 С. Альтернативно, фермент по данному изобретению обладает специфичной активностью в диапазоне приблизительно от 1 до приблизительно 100 ед./мг белка при 37 С. В другом аспекте термоустойчивость включает сохранение, по меньшей мере, половины специфичной активности фермента при 37C после нагревания до повышенной температуры. Альтернативно, термоустойчивость может включать сохранение специфичной активности в диапазоне приблизительно от 1 до приблизительно 1200 ед./мг белка или приблизительно от 500 до приблизительно 1000 ед./мг белка при 37C после нагревания до повышенной температуры. В другом аспекте термоустойчивость может включать сохранение специфичной активности диапазоне приблизительно от 1 до приблизительно 500 ед./мг белка при 37 С в после нагревания до повышенной температуры. Данное изобретение относится к выделенному синтетическому или рекомбинантному полипептиду по данному изобретению, где полипептид содержит по меньшей мере один участок гликозилирования. В одном аспекте гликозилирование может представлять собой N-гликозилирование. В одном аспекте полипептид может быть гликозилирован после того, как он экспрессируется в P. pastoris или S. pombe. В одном аспекте полипептид по данному изобретению может сохранять ферментативную активность в условиях, включающих приблизительно рН 6,5, 6, 5,5, 5, 4,5 или 4, или в более кислых условиях. В другом аспекте полипептид по данному изобретению сохраняет активность в условиях, включающих приблизительно рН 7, 7,5, 8,0, 8,5, 9, 9,5, 10, 10,5 или 11, или в более щелочных условиях. В одном аспекте полипептид по данному изобретению сохраняет активность в условиях, включающих приблизительно рН 6,5, 6, 5,5, 5, 4,5 или рН 4, или в более кислых условиях. В другом аспекте полипептид по данному изобретению сохраняет активность в условиях, включающих приблизительно рН 7, 7,5, 8,0, 8,5, 9,9,5, 10, 10,5 или 11, или в более щелочных условиях. Данное изобретение относится к белковым препаратам, содержащим полипептид по данному изобретению, где белковый препарат включает жидкость, твердое вещество или гель. Данное изобретение относится к гетеродимерам, содержащим полипептид по данному изобретению, и второй белок или домен. В одном аспекте второй член гетеродимера не является полипептидом по данному изобретению, но предпочтительно является отличным от него ферментом или другим белком. В одном аспекте второй домен может представлять собой полипептид и гетеродимер может представлять собой слитый белок. В одном аспекте второй домен может представлять собой эпитоп или таг. В одном аспекте данное изобретение относится к гомодимерам, содержащим полипептид по данному изобретению. Данное изобретение относится к иммобилизованным полипептидам по данному изобретению, полипептиду, кодируемому нуклеиновой кислотой по данному изобретению, или полипептиду, содержащему полипептид по данному изобретению и второй домен. В одном аспекте полипептид может быть иммобилизован на клетке, металле, смоле, полимере, керамике, стекле, микроэлектроде, частицах графита, бусах, геле, планшете, матрице или капиллярной трубке. Данное изобретение относится к матрицам, содержащим иммобилизованную нуклеиновую кислоту по данному изобретению. Данное изобретение относится к матрицам, содержащим антитела по данному изобретению. Данное изобретение относится к выделенным синтетическим или рекомбинантным антителам, которые специфически связываются с полипептидом по данному изобретению или с полипептидом, кодируемым нуклеиновой кислотой по данному изобретению. Антитела могут представлять собой моноклональные или поликлональные антитела. Данное изобретение относится к гибридомам, содержащим антитела по данному изобретению, например антитела, которые специфично связываются с полипептидом по данному изобретению или с полипептидом, кодируемым нуклеиновой кислотой по данному изобретению. Данное изобретение относится к способу выделения или идентификации полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы), включающий стадии (а) получения антител по данному изобретению; (b) получения образца, содержащего-9 013993 полипептиды; и (с) осуществления взаимодействия образца стадии (b) с антителами стадии (а) в условиях, при которых антитела могут специфически связываться с полипептидом, выделяя таким образом или идентифицируя полипептид. Данное изобретение относится к способам получения антител, которые специфично связываются с полипептидом по данному изобретению (например, ферментом или другим антителом по данному изобретению), включающим введение животному, не относящемуся к человеку, нуклеиновой кислоты по данному изобретению или полипептида по данному изобретению, или их подпоследовательностей в количестве, достаточном для развития гуморального иммунного ответа, таким образом развивая антительный ответ. Данное изобретение относится к способам получения гуморального или клеточного иммунного ответа, включающим введение животному, не относящемуся к человеку, нуклеиновой кислоты по данному изобретению, или полипептида по данному изобретению, или их подпоследовательностей в количестве, достаточном для развития иммунного ответа. Данное изобретение относится к способам получения рекомбинантного полипептида, включающим стадии (а) получения нуклеиновой кислоты по данному изобретению, функционально связанной с промотором; и (b) экспрессии нуклеиновой кислоты стадии (а) в условиях, которые делают возможной экспрессию полипептида, получая, таким образом, рекомбинантный полипептид. В одном аспекте способ может дополнительно включать трансформацию клетки-хозяина нуклеиновой кислотой стадии (а) с последующей экспрессией нуклеиновой кислоты стадии (а), получая таким образом рекомбинантный полипептид в трансформированной клетке. Данное изобретение относится к способам идентификации полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы), включающим следующие стадии: (а) получение полипептида по данному изобретению или полипептида, кодируемого нуклеиновой кислотой по данному изобретению; (b) получение соответствующего субстрата (например,субстрата полипептида); и (с) осуществление взаимодействия полипептида или его фрагмента, или варианта стадии (а) с субстратом стадии (b) и определение уменьшения количества субстрата или увеличения количества продукта реакции, где уменьшение количества субстрата или увеличение количества продукта реакции дает возможность выявить полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например, хлорофиллазы). Данное изобретение относится к способам идентификации субстрата полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы), где способ включает следующие стадии: (а) получение полипептида по данному изобретению или полипептида,кодируемого нуклеиновой кислотой по данному изобретению; (b) получение анализируемого субстрата и(с) осуществление взаимодействия полипептида стадии (а) с анализируемым субстратом стадии (b) и определение уменьшения количества субстрата или увеличения количества продукта реакции, где уменьшение количества субстрата или увеличение количества продукта реакции дает возможность идентифицировать анализируемый субстрат, как субстрат полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы). Данное изобретение относится к способам определения того, происходит ли специфическое связывание анализируемого соединения с полипептидом, включающим следующие стадии: (а) экспрессию нуклеиновой кислоты или вектора, содержащего нуклеиновую кислоту, в условиях, делающих возможной трансляцию нуклеиновой кислоты в полипептид, где нуклеиновая кислота содержит нуклеиновую кислоту по данному изобретению, или получение полипептида по данному изобретению; (b) получение анализируемого соединения; (с) осуществление взаимодействия полипептида с анализируемым соединением и (d) определение того, происходит ли специфическое связывание анализируемого соединения стадии (b) с полипептидом. Данное изобретение относится к способам идентификации модулятора полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы), включающим следующие стадии: (а) получение полипептида по данному изобретению или полипептида, кодируемого нуклеиновой кислотой по данному изобретению; (b) получение анализируемого соединения;(с) осуществление взаимодействия полипептида стадии (а) с анализируемым соединением стадии (b) и измерение активности полипептида, где изменение активности, измеренной в присутствии анализируемого соединения, по сравнению с активностью в отсутствии анализируемого соединения, дает возможность установить, что анализируемое соединение модулирует активность полипептида. В одном аспекте активность полипептида может быть измерена посредством получения соответствующего субстрата (например, субстрата полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы и определения уменьшения количества субстрата или увеличения количества продукта реакции, или увеличения количества субстрата или снижения количества продукта реакции. Уменьшение количества субстрата или увеличение количества продукта реакции в присутствии анализируемого соединения по сравнению с количеством субстрата или продукта реакции без анализируемого соединения дает возможность идентифицировать анализируемое соединение как активатор активности. Увеличение количества субстрата или уменьшение количества продукта реакции в присутствии анализируемого соединения по сравнению с количеством субстрата или продукта реакции без анали- 10013993 зируемого соединения дает возможность идентифицировать анализируемое соединение как ингибитор активности. Данное изобретение относится к компьютерным системам, включающим процессор и устройство для хранения данных, где на указанном устройстве для хранения данных хранится последовательность полипептида или последовательность нуклеиновой кислоты по данному изобретению (например, полипептида, кодируемого нуклеиновой кислотой по данному изобретению). В одном аспекте компьютерная система может дополнительно включать алгоритм для сравнения последовательностей и устройство для хранения данных по меньшей мере с одной хранящейся на нем контрольной последовательностью. В другом аспекте алгоритм сравнения последовательностей включает компьютерную программу, которая выявляет полиморфизмы. В одном аспекте компьютерная система может дополнительно включать идентификатор, который идентифицирует один или несколько элементов в указанной последовательности. Данное изобретение относится к компьютерным считываемым носителям информации, на которых хранится последовательность полипептида или последовательность нуклеиновой кислоты по данному изобретению. Данное изобретение относится к способам идентификации элементов последовательности,включающим стадии (а) считывания последовательности с использованием компьютерной программы,которая дает возможность установить один или несколько элементов последовательности, где последовательность включает последовательность полипептида или последовательность нуклеиновой кислоты по данному изобретению; и (b) идентификации одного или нескольких элементов в последовательности с помощью компьютерной программы. Данное изобретение относится к способам сравнения первой последовательности со второй последовательностью, включающим стадии (а) считывания первой последовательности и второй последовательности с использованием компьютерной программы, которая сравнивает последовательности, где первая последовательность содержит последовательность полипептида или последовательность нуклеиновой кислоты по данному изобретению; и (b) определения различий между первой последовательностью и второй последовательностью с помощью компьютерной программы. Стадия определения различий между первой последовательностью и второй последовательностью может дополнительно включать стадию идентификации полиморфизмов. В одном аспекте способ может дополнительно включать идентификатор, который идентифицирует один или несколько элементов в последовательности. В другом аспекте способ может включать считывание первой последовательности с использованием компьютерной программы и идентификацию одного или нескольких элементов в последовательности. Данное изобретение относится к способам выделения или извлечения нуклеиновой кислоты, кодирующей полипептид, обладающий ферментативной активностью, вовлеченной в катаболизм хлорофилла,или обладающий активностью эстеразы (например, хлорофиллазы) из образца из окружающей среды,включающим стадии (а) получения последовательностей пары праймеров для амплификации нуклеиновой кислоты, кодирующей полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например, хлорофиллазы), где пара праймеров способна амплифицировать нуклеиновую кислоту по данному изобретению; (b) выделения нуклеиновой кислоты из образца из окружающей среды или обработку образца из окружающей среды, так чтобы нуклеиновая кислота в образце была доступна для гибридизации с парой праймеров для амплификации; и (с) объединения нуклеиновой кислоты стадии (b) с парой праймеров для амплификации стадии (а) и амплификацию нуклеиновой кислоты из образца из окружающей среды, выделяя таким образом или извлекая нуклеиновую кислоту, кодирующую полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например, хлорофиллазы), из образца из окружающей среды. В одном аспекте один или каждый член пары праймеров для амплификации может включать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50 или более последовательно расположенных оснований последовательности по данному изобретению. В одном аспекте пара праймеров для амплификации представляет собой пару для амплификации по данному изобретению. Данное изобретение относится к способам выделения или извлечения нуклеиновой кислоты, кодирующей полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы(например, хлорофиллазы), из образца из окружающей среды, включающим стадии (а) получения полинуклеотидного зонда, включающего нуклеиновую кислоту по данному изобретению или ее подпоследовательность; (b) выделения нуклеиновой кислоты из образца из окружающей среды или обработку образца из окружающей среды, так чтобы нуклеиновая кислота была доступной для гибридизации с полинуклеотидным зондом стадии (а); (с) объединения выделенной синтетической нуклеиновой кислоты или обработанного образца из окружающей среды стадии (b) с образцом полинуклеотида стадии (а) и (d) выделения нуклеиновой кислоты, которая специфически гибридизуется с образцом полинуклеотида стадии(а), выделяя таким образом или извлекая нуклеиновую кислоту, кодирующую полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например, хлорофиллазы), из образца из окружающей среды. Природный образец может включать образец воды, образец жидкости, образец почвы, образец воздуха или биологический образец. В одном аспекте биологический образец может быть получен из бактериальной клетки, клетки простейших, клетки насекомых, клетки дрожжей, клетки растений, клетки грибов или клетки млекопитающих.- 11013993 Данное изобретение относится к способам получения варианта нуклеиновой кислоты, кодирующей полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например,хлорофиллазы), включающим стадии (а) получения матричной нуклеиновой кислоты, содержащей нуклеиновую кислоту по данному изобретению; и (b) модификации, делеции или вставки одного или нескольких нуклеотидов в матричной последовательности или их комбинацию с получением варианта матричной нуклеиновой кислоты. В одном аспекте способ может дополнительно включать экспрессию варианта нуклеиновой кислоты для получения варианта полипептида, вовлеченного в катаболизм хлорофилла или обладающего активностью эстеразы (например, хлорофиллазы). Модификации, вставки и делеции могут быть внесены способом, включающим ПЦР с пониженной точностью, шаффлинг, олигонуклеотид-направленный мутагенез, объединяющую ПЦР, мутагенез с помощью половой ПЦР, мутагенез in vivo, кассетный мутагенез, возвратно-множественный мутагенез, экспоненциально-множественный мутагенез, сайт-специфический мутагенез, повторную сборку гена, мутагенез с насыщением сайтов гена (GSSM), синтетическую повторную сборку лигированием (SLR) или их комбинацию. В другом аспекте модификации, вставки или делеции вносятся способом, включающим рекомбинацию, рекомбинацию возвратной последовательности, мутагенез с модификацией ДНК фосфотиоатом, мутагенез с содержащей урацил матрицей, мутагенез с содержащими разрывы дуплексами, мутагенез с репарацией точек несоответствия, мутагенез с дефектом репарации штамма-хозяина, химический мутагенез, мутагенез радиогенного происхождения, мутагенез с делецией, мутагенез с рестрикцией и селекцией, мутагенез с рестрикцией и исправлением ошибок, синтез искусственного гена, множественный мутагенез, получение химерного мультимера нуклеиновой кислоты и их комбинацию. В одном аспекте способ может быть многократно повторен до тех пор, пока не будет получен полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например, хлорофиллазы), с измененной или отличающейся активностью или с измененной или отличающейся стабильностью относительно активности и стабильности полипептида, кодируемого матричной нуклеиновой кислотой. В одном аспекте измененный полипептид является термоустойчивым и сохраняет некоторую активность после воздействия повышенной температуры. В другом аспекте измененный полипептид подвергается повышенному гликозилированию по сравнению с полипептидом, кодируемым матричной нуклеиновой кислотой. Альтернативно, измененный полипептид обладает активностью при высокой(или повышенной) температуре, где фермент, кодируемый матричной нуклеиновой кислотой, не является активным при высокой температуре. В одном аспекте способ может быть многократно повторен до тех пор, пока не будет получена кодирующая фермент последовательность, в которой используются кодоны, измененные по сравнению с кодонами матричной нуклеиновой кислоты. В другом аспекте способ может быть многократно повторен до тех пор, пока не будет получен ген, кодирующий фермент, с повышенным или пониженным уровнем экспрессии транскрипта или повышенной или пониженной стабильностью относительно уровня экспрессии или стабильности матричной нуклеиновой кислоты. Данное изобретение относится к способам модификации кодонов в нуклеиновой кислоте, кодирующей полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы(например, хлорофиллазы), для повышения ее экспрессии в клетке-хозяине, где способ включает следующие стадии: (а) получение нуклеиновой кислоты по данному изобретению, кодирующей полипептид,вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы (например, хлорофиллазы); и (b) идентификацию непредпочтительного или менее предпочтительного кодона в нуклеиновой кислоте стадии (а) и замену его предпочтительным или нейтрально используемым кодоном, кодирующим ту же аминокислоту, что и замененный кодон, где предпочтительный кодон представляет собой кодон, более часто встречающийся в кодирующих последовательностях генов в клетке-хозяине, а непредпочтительный или менее предпочтительный кодон представляет собой кодон, более редко встречающийся в кодирующих последовательностях генов в клетке-хозяине, модифицируя таким образом нуклеиновую кислоту для повышения ее экспрессии в клетке-хозяине. Данное изобретение относится к способам модификации кодонов в нуклеиновой кислоте, кодирующей полипептид, вовлеченный в катаболизм хлорофилла или обладающий активностью эстеразы(например, хлорофиллазы); где способ включает следующие стадии: (а) получение нуклеиновой кислоты по данному изобретению и (b) идентификацию кодона в нуклеиновой кислоте стадии (а) и замену его отличающимся кодоном, кодирующим ту же аминокислоту, что и замененный кодон, модифицируя таким образом кодоны в нуклеиновой кислоте, кодирующей полипептид. Данное изобретение относится к способам модификации кодонов в нуклеиновой кислоте, кодирующей полипептид, обладающий ферментативной активностью, вовлеченной в катаболизм хлорофилла,или обладающий активностью эстеразы (например, хлорофиллазы), для повышения ее экспрессии в клетке-хозяине, где способ включает следующие стадии: (а) получение нуклеиновой кислоты по данному изобретению, кодирующей полипептид, обладающий ферментативной активностью, вовлеченной в катаболизм хлорофилла, или обладающий активностью эстеразы (например, хлорофиллазы); и (b) идентификацию непредпочтительного или менее предпочтительного кодона в нуклеиновой кислоте стадии (а) и замену его предпочтительным или нейтрально используемым кодоном, кодирующим ту же аминокислоту, что и замененный кодон, где предпочтительный кодон представляет собой кодон, более часто встре- 12013993 чающийся в кодирующих последовательностях генов в клетке-хозяине, а непредпочтительный или менее предпочтительной кодон представляет собой кодон, более редко встречающийся в кодирующих последовательностях генов в клетке-хозяине, модифицируя таким образом нуклеиновую кислоту для повышения ее экспрессии в клетке-хозяине. Данное изобретение относится к способам модификации кодона в нуклеиновой кислоте, кодирующей полипептид, обладающий ферментативной активностью, вовлеченной в катаболизм хлорофилла,или обладающий активностью эстеразы (например, хлорофиллазы) для снижения экспрессии в клеткехозяине, где способ включает следующие стадии: (а) получение нуклеиновой кислоты по данному изобретению и (b) идентификацию по меньшей мере одного предпочтительного кодона в нуклеиновой кислоте стадии (а) и замену его непредпочтительным или менее предпочтительным кодоном, кодирующим ту же аминокислоту, что и замененный кодон, где предпочтительный кодон представляет собой кодон,более часто встречающийся в кодирующих последовательностях генов в клетке-хозяине, а непредпочтительный или менее предпочтительный кодон представляет собой кодон, более редко встречающийся в кодирующих последовательностях генов в клетке-хозяине, модифицируя таким образом нуклеиновую кислоту для снижения ее экспрессии в клетке-хозяине. В одном аспекте клетка-хозяин может представлять собой бактериальную клетку, клетку грибов, клетку насекомых, клетку дрожжей, клетку растений или клетку млекопитающих. Данное изобретение относится к способам получения библиотеки нуклеиновых кислот, кодирующих множество модифицированных активных центров полипептидов (каталитических доменов (CD или участков связывания субстрата полипептидов, обладающих ферментативной активностью, вовлеченной в катаболизм хлорофилла, или обладающих активностью эстеразы (например, хлорофиллазы),где модифицированные активные центры или участки связывания субстрата получают из первой нуклеиновой кислоты, содержащей последовательность, кодирующую первый активный центр или первый участок связывания субстрата, где способ включает следующие стадии: (а) получение первой нуклеиновой кислоты, кодирующей первый активный центр или первый участок связывания субстрата, где последовательность первой нуклеиновой кислоты содержит последовательность, которая гибридизуется в жестких условиях с нуклеиновой кислотой по данному изобретению, и нуклеиновая кислота кодирует активный центр или участок связывания субстрата; (b) получение набора мутагенных олигонуклеотидов,которые кодируют варианты природных аминокислот во множестве кодонов-мишеней первичной нуклеиновой кислоты; и (с) использование набора мутагенных олигонуклеотидов для получения набора вариантов, кодирующих активный центр или кодирующих участок связывания субстрата нуклеиновых кислот, кодирующих ряд вариантов аминокислот в каждом кодоне аминокислоты, который был подвергнут мутагенезу, получая таким образом библиотеку нуклеиновых кислот, кодирующих множество модифицированных активных центров или участков связывания субстрата полипептидов, обладающих ферментативной активностью, вовлеченной в катаболизм хлорофилла, или обладающих активностью эстеразы(например, хлорофиллазы). В одном аспекте способ включает внесение мутаций в первую нуклеиновую кислоту стадии (а) способом, включающим оптимизированную систему направленных изменений, мутагенез с насыщением сайтов гена (GSSM), синтетическую повторную сборку лигированием (SLR), ПЦР с пониженной точностью, шаффлинг, олигонуклеотид-направленный мутагенез, объединяющую ПЦР, мутагенез посредством половой ПЦР, мутагенез in vivo, кассетный мутагенез, возвратно-множественный мутагенез, экспоненциально-множественный мутагенез, сайт-специфический мутагенез, повторную сборку гена, синтетическую повторную сборку лигированием (SLR) и их комбинацию. В другом аспекте способ включает внесение мутаций в первую нуклеиновую кислоту стадии (а) или ее варианты способом,включающим рекомбинацию, рекомбинацию возвратной последовательности, мутагенез с модификацией ДНК фосфотиоатом, мутагенез с содержащей урацил матрицей, мутагенез с содержащими разрывы дуплексами, мутагенез с репарацией точек несоответствия, мутагенез с дефектом репарации штаммахозяина, химический мутагенез, мутагенез радиогенного происхождения, мутагенез с делецией, мутагенез с рестрикцией и селекцией, мутагенез с рестрикцией и исправлением ошибок, синтез искусственного гена, множественный мутагенез, получение химерного мультимера нуклеиновой кислоты и их комбинации. Данное изобретение относится к способам получения малой молекулы, включающим следующие стадии: (а) получение множества биосинтетических ферментов, способных синтезировать или модифицировать малую молекулу, где один из ферментов содержит полипептид по данному изобретению или кодируется нуклеиновой кислотой по данному изобретению; (b) получение субстрата по меньшей мере для одного из ферментов стадии (а) и (с) осуществление взаимодействия субстрата стадии (b) с ферментами в условиях, которые облегчают множество биокаталитических реакций с получением малой молекулы посредством серии биокаталитических реакций. Данное изобретение относится к способам модификации малой молекулы, включающим следующие стадии: (а) получение фермента, где фермент содержит полипептид по данному изобретению, или полипептида, кодируемого нуклеиновой кислотой по данному изобретению, или его подпоследовательности; (b) получение малой молекулы и (с) осуществление взаимодействия фермента стадии (а) с малой молекулой стадии (b) в условиях, которые облегчают ферментативную реакцию, катализируемую полипептидом по данному изобретению, или полипептидом,- 13013993 кодируемым нуклеиновой кислотой по данному изобретению, модифицируя таким образом малую молекулу. В одном аспекте способ может включать множество субстратов для получения малых молекул ферментом стадии (а), таким образом формируя библиотеку модифицированных малых молекул, получаемых по меньшей мере одной ферментативной реакцией, катализируемой ферментом по данному изобретению. В одном аспекте способ может включать множество дополнительных ферментов в условиях,которые облегчают множество биокаталитических реакций с участием ферментов для формирования библиотеки модифицированных малых молекул, получаемых множеством ферментативных реакций. В другом аспекте способ может дополнительно включать стадию исследования библиотеки для того, чтобы определить, существуют ли в библиотеке конкретные модифицированные малые молекулы, которые проявляют желаемую активность. Стадия исследования библиотеки может дополнительно включать стадии систематического удаления всех биокаталитических реакций кроме одной, используемых для получения части из множества модифицированных малых молекул из библиотеки, с исследованием части модифицированных малых молекул на наличие или отсутствие конкретной модифицированной малой молекулы с желаемой активностью, и идентификации по меньшей мере одной конкретной биокаталитической реакции, в результате которой образуется модифицированная малая молекула с желаемой активностью. Данное изобретение относится к способам определения функционального фрагмента полипептида по данному изобретению или полипептида, кодируемого нуклеиновой кислотой по данному изобретению, включающим стадии: (а) получения полипептида по данному изобретению или полипептида, кодируемого нуклеиновой кислотой по данному изобретению, или его подпоследовательности и (b) удаления множества аминокислотных остатков из последовательности стадии (а) и исследование оставшейся подпоследовательности на наличие ферментативной или связывающей активности, определяя таким образом функциональный фрагмент фермента. В одном аспекте активность измеряют получением субстрата и определением уменьшения количества субстрата или увеличения количества продукта реакции. Данное изобретение относится к способам инженерии всех цельных клеток с новыми или модифицированными фенотипами с использованием анализа метаболических изменений в режиме реального времени, где способ включает следующие стадии: (а) получение модифицированной клетки посредством модификации генетического набора клетки, где генетический набор модифицирован добавлением в клетку нуклеиновой кислоты по данному изобретению; (b) культивирование модифицированной клетки с получением множества модифицированных клеток; (с) измерение по меньшей мере одного параметра метаболизма клетки посредством контроля клеточной культуры стадии (b) в режиме реального времени и (d) анализ данных стадии (с) для определения наличия отличий измеренного параметра от сравнительного измерения в немодифицированной клетке в аналогичных условиях, идентифицируя таким образом полученный с помощью способов инженерии фенотип клетки с использованием анализа метаболических изменений в режиме реального времени. В одном аспекте генетический набор клетки может быть модифицирован способом, включающим удаление последовательности или модификацию последовательности в клетке, или нокаут экспрессии гена. В одном аспекте способ может дополнительно включать селекцию клетки, имеющий новый полученный способами инженерии фенотип. В другом аспекте может включать культивирование отобранной клетки, получая таким образом новый клеточный штамм, имеющий новый полученный способами генной инженерии фенотип. Данное изобретение относится к способам повышения термоустойчивости или термостабильности полипептида по данному изобретению или полипептида, кодируемого нуклеиновой кислотой по данному изобретению, где способ включает гликозилирование полипептида, содержащего по меньшей мере треть смежных аминокислот полипептида по данному изобретению, или полипептида, кодируемого последовательностью нуклеиновой кислоты по данному изобретению, повышая таким образом термоустойчивость или термостабильность полипептида. В одном аспекте специфичная активность может быть термостабильной или термоустойчивой при температуре в диапазоне от более чем приблизительно 37 до приблизительно 95 С. Данное изобретение относится к способам сверхэкспрессии рекомбинантного полипептида в клетке, включающим экспрессию вектора, содержащего нуклеиновую кислоту, включая нуклеиновую кислоту по данному изобретению или последовательность нуклеиновой кислоты по данному изобретению, где идентичность последовательностей определяют анализом с помощью алгоритма сравнения последовательностей или визуальным исследованием, где сверхэкспрессия осуществлена с использованием промотора с высокой активностью, бицистронного вектора или амплификации генов вектора. Данное изобретение относится к способам получения трансгенного растения, включающим следующие стадии: (а) введение гетерологичной последовательности нуклеиновой кислоты в клетку, где гетерологичная последовательность нуклеиновой кислоты содержит последовательность нуклеиновой кислоты по данному изобретению, получая таким образом трансформированную клетку растений; и (b) получение трансгенного растения из трансформированной клетки. В одном аспекте стадия (а) может дополнительно включать введение гетерологичной последовательности нуклеиновой кислоты электропорацией или микроинъекцией в протопласты клеток растений. В другом аспекте стадия (а) может дополнительно включать введение гетерологичной последовательности нуклеиновой кислоты непосредствен- 14013993 но в ткань растений бомбардировкой частицами с ДНК. Альтернативно, стадия (а) может дополнительно включать введение гетерологичной последовательности нуклеиновой кислоты в ДНК клетки растений с использованием хозяина Agrobacterium turnefaciens. В одном аспекте клетка растений может представлять собой клетку картофеля, кукурузы, риса, пшеницы, табака или ячменя. Данное изобретение относится к способам экспрессии гетерологичной последовательности нуклеиновой кислоты в клетке растений, включающим следующие стадии: (а) трансформацию в клетку растений гетерологичной последовательности нуклеиновой кислоты, функционально связанной с промотором,где гетерологичная последовательность нуклеиновой кислоты содержит нуклеиновую кислоту по данному изобретению; (b) выращивание растения в условиях, при которых гетерологичная последовательность нуклеиновой кислоты экспрессируется в клетке растений. Данное изобретение относится к способам экспрессии гетерологичной последовательности нуклеиновой кислоты в клетке растений, включающим следующие стадии: (а) трансформацию в клетку растений гетерологичной последовательности нуклеиновой кислоты, функционально связанной с промотором, где гетерологичная последовательность нуклеиновой кислоты содержит последовательность по данному изобретению; (b) выращивание растения в условиях, при которых гетерологичная последовательность нуклеиновых кислот экспрессируется в клетке растений. В другом аспекте фермент по данному изобретению может быть получен экспрессией полинуклеотида по данному изобретению в организме, таком как бактерия, дрожжевой организм, растение,насекомое, гриб или животное. Иллюстративными организмами для экспрессии полипептидов по данному изобретению могут быть S. pombe, S. cerevisiae, Pichia sp., например, P. pastoris, E. coli, Streptomycessp., Bacillus sp. и Lactobacillus sp. Другим аспектом данного изобретения является способ получения полипептида по данному изобретению. Способ включает введение нуклеиновой кислоты, кодирующей полипептид, в клетку-хозяина, где нуклеиновая кислота функционально связана с промотором, и культивирование клетки-хозяина в условиях, которые делают возможной экспрессию нуклеиновой кислоты. Другим аспектом данного изобретения является способ получения полипептида или пептида по данному изобретению. Способ включает введение нуклеиновой кислоты, кодирующей полипептид, в клетку-хозяина, где нуклеиновая кислота функционально связана с промотором, и культивирование клетки-хозяина в условиях, которые делают возможной экспрессию нуклеиновой кислоты, получая таким образом полипептид. Другим аспектом данного изобретения является способ получения варианта, включая получение нуклеиновой кислоты, имеющей последовательность по данному изобретению, последовательностей, по существу, ей идентичных, последовательностей, комплементарных последовательности по данному изобретению, и их фрагментов и замену одного или нескольких нуклеотидов в последовательности на другие нуклеотиды, удаление одного или нескольких нуклеотидов из последовательности или вставку одного или нескольких нуклеотидов в последовательность. Данное изобретение относится к биосинтетическим системам для катаболизма хлорофилла, включающим по меньшей мере один фермент по данному изобретению. Данное изобретение относится к биосинтетическим системам для катаболизма хлорофилла, включающим по меньшей мере одну нуклеиновую кислоту, кодирующую фермент, вовлеченный в катаболизм хлорофилла, где нуклеиновая кислота содержит последовательность по данному изобретению. В одном аспекте система включает множество кодирующих ферменты нуклеиновых кислот, где ферменты вовлечены в катаболизм хлорофилла. В одном аспекте множество кодирующих ферменты нуклеиновых кислот включает все ферменты в пути катаболизма хлорофилла. В одном аспекте множество кодирующих ферменты нуклеиновых кислот включает по меньшей мере одну плазмиду, экспрессирующую кассету или экспрессирующий вектор. В одном аспекте биосинтетическая система по данному изобретению находится (содержится) в клетке. Клетка может представлять собой бактериальную клетку, клетку млекопитающих, клетку грибов,клетку дрожжей, клетку насекомых или клетку растений. Клетка дрожжей может представлять собойPichia sp. или Saccharomyces sp., такие как Pichia pastoris, Saccharomyces cerevisiae или Schizosaccharomyces pombe. Подробное описание одного или нескольких вариантов осуществления данного изобретения представлено далее на прилагаемых ниже чертежах и описании. Другие свойства, цели и преимущества данного изобретения будут очевидны из описания и чертежей, и из формулы изобретения. Все публикации, патенты, патентные заявки, последовательности из GenBank и материалы АТСС,цитированные в данном описании для любых целей, включая приложение А, таким образом, полностью включены в данное описание посредством ссылок. Описание чертежей На фиг. 1 представлено схематическое изображение хлорофилла (фиг. 1 А), фитола (фиг. 1 В) и хлорофиллида (фиг. 1 С). На фиг. 2 и 3 представлены данные, демонстрирующие результаты анализа активности эстеразы(активности хлорофиллазы) с использованием иллюстративных ферментов по данному изобретению, как подробно описано ниже в примере 1. На фиг. 4 представлена принципиальная схема иллюстративной компьютерной системы по данному изобретению, как подробно описано ниже.- 15013993 На фиг. 5 представлена схема последовательности операций, иллюстрирующая один аспект способа по данному изобретению, для сравнения новой нуклеотидной или белковой последовательности с базой данных последовательностей в целях определения уровней гомологии между новой последовательностью и последовательностями в базе данных, как подробно описано ниже. На фиг. 6 представлена схема последовательности операций, иллюстрирующая один аспект процесса в компьютере, для определения того, являются ли две последовательности гомологичными, как подробно описано ниже. На фиг. 7 представлена схема последовательности операций, иллюстрирующая один аспект процесса идентификации 300, для определения наличия элемента в последовательности, как подробно описано ниже. На фиг. 8 представлена реакция деградации хлорофилла с иллюстративной эстеразой по данному изобретению, как подробно описано ниже. На фиг. 9 представлены и сравниваются традиционные способы и иллюстративная реакция ферментативного обесцвечивания (осветления) по данному изобретению, как подробно описано ниже. На фиг. 10 представлена иллюстративная реакция ферментативного обесцвечивания (осветления) по данному изобретению, как подробно описано ниже. На фиг. 11 представлен иллюстративный способ ферментативного обесцвечивания (осветления) по данному изобретению, который сочетает в себе стадии рафинирования, ферментативного осветления("обесцвечивания") и нейтрализации щелочью, как подробно описано ниже. На фиг. 12 представлен иллюстративный способ ферментативного обесцвечивания (осветления) по данному изобретению, как подробно описано ниже. На фиг. 13 представлена иллюстративная схема очистки семян масличного растения, включающая экстракцию, очистку и модификацию семян масличного растения с использованием эстеразы по данному изобретению, как подробно описано ниже. На фиг. 14 представлен иллюстративный промышленный способ по данному изобретению - процесс биологического рафинирования, включающий использование по меньшей мере одного полипептида по данному изобретению, как подробно описано ниже. На фиг. 15 представлен еще один иллюстративный промышленный способ по данному изобретению, включающий использование по меньшей мере одного полипептида по данному изобретению, как подробно описано ниже. На фиг. 16 представлен другой иллюстративный промышленный способ по данному изобретению,включающий использование по меньшей мере одного полипептида по данному изобретению с ферментативной активностью хлорофиллазы. Одинаковые указательные символы в различных рисунках показывают одинаковые элементы. Подробное описание Настоящее изобретение относится к новым композициям и способам ферментативной обработки("осветлению" или "обесцвечиванию") композиций, содержащих хлорофилл или с примесью хлорофилла, например, препаратов из растений, животных или водорослей, пищевых продуктов, кормов или масел. В одном аспекте обработка (или "ферментативное осветление", или "обесцвечивание") хлорофилла используется в композициях и способах по данному изобретению, включающих использование фермента хлорофиллазы или другого фермента, вовлеченного в катаболизм хлорофилла, для модификации хлорофилла, например, для облегчения удаления придающего окраску порфиринового кольца, например, водной экстракцией. Хлорофиллаза катализирует гидролиз хлорофилла с образованием хлорофиллида, который может быть экстрагирован в водный экстракт, и фитола, который остается в масляной фазе. Например, в одном аспекте данное изобретение относится к композициям и способам ферментативной обработки (например, гидролизу) хлорофилла в корме, пищевом продукте или масле, например в растительных маслах, включая масла, получаемые из семян масличных растений, такие как масло канолы (рапса) или соевое масло, или масло из плодов масличных растений, такое как пальмовое масло. В одном аспекте данное изобретение относится к способам ферментативного осветления с использованием фермента хлорофиллазы для ферментативного гидролиза хлорофилла или любого придающего цвет порфиринового кольца в масле животного или растительного происхождения, например в растительных маслах. Данное изобретение включает способы ферментативной обработки (например, "осветления") содержащих хлорофилл пищевых продуктов или масел с помощью технологий in vitro или in vivo, например протоколов для цельных клеток, таких как ферментация или другие биокаталитические процессы. Получение и обработка нуклеиновых кислот Данное изобретение относится к выделенным рекомбинантным и синтетическим нуклеиновым кислотам (например, к иллюстративной нуклеиновой кислоте по данному изобретению, включаяSEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17 или SEQ ID NO: 19), последовательностям, обладающим идентичностью последовательностей с иллюстративной нуклеиновой кислотой; нуклеиновым кислотам, кодирующим полипептиды по данному изобретению (например, иллюстративные аминокислотные последова- 16013993 тельности, как указано в SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ DD NO: 18 или SEQ ID NO: 20). Данное изобретение также относится к экспрессирующим кассетам, таким как экспрессирующие векторы, содержащие нуклеиновые кислоты по данному изобретению, которые включают полинуклеотиды, которые кодируют полипептиды по данному изобретению. Данное изобретение также относится к способам разработки новых полипептидных последовательностей с использованием нуклеиновых кислот по данному изобретению. Данное изобретение также относится к способам ингибирования экспрессии генов, транскриптов и полипептидов с использованием нуклеиновых кислот по данному изобретению. Также предполагаются способы модификации нуклеиновых кислот по данному изобретению, например, посредством синтетической повторной сборки лигированием, оптимизированной системы направленных изменений и/или мутагенеза с насыщением. Нуклеиновые кислоты по данному изобретению могут быть получены, выделены и/или обработаны,например, посредством клонирования и экспрессии библиотек кДНК, амплификации транскрипта или геномной ДНК посредством ПЦР и т.п. Для применения на практике способов по данному изобретению гомологичные гены могут быть модифицированы воздействием на матричную нуклеиновую кислоту, как описано в данном описании. Данное изобретение может применяться на практике совместно с любым способом или протоколом, или устройством, известными в данной области, которые полностью описаны в научной и патентной литературе. Один аспект данного изобретения относится к выделенной нуклеиновой кислоте, содержащей одну из последовательностей по данному изобретению или фрагмент, содержащий по меньшей мере 10, 15,20, 25, 30, 35, 40, 50, 75, 100, 150, 200, 300, 400 или 500 последовательно расположенных оснований нуклеиновой кислоты по данному изобретению. Выделенные нуклеиновые кислоты могут включать ДНК,включая кДНК, геномную ДНК и синтетическую ДНК. ДНК может быть двухцепочечной или одноцепочечной, и в случае одной цепи она может представлять собой кодирующую или некодирующую (антисмысловую) цепь. Альтернативно, выделенные нуклеиновые кислоты могут включать РНК. Выделенные нуклеиновые кислоты по данному изобретению могут быть использованы для получения одного из полипептидов по данному изобретению или фрагментов, содержащих по меньшей мере 5,10, 15, 20, 25, 30, 35, 40, 50, 75, 100 или 150 последовательно расположенных аминокислот одного из полипептидов по данному изобретению. Таким образом, другой аспект данного изобретения относится к нуклеиновой кислоте, которая кодирует один из полипептидов по данному изобретению или фрагменты, содержащие по меньшей мере 5,10, 15, 20, 25, 30, 35, 40, 50, 75, 100 или 150 последовательно расположенных аминокислот одного из полипептидов по данному изобретению. Кодирующие последовательности этих нуклеиновых кислот могут быть идентичными одной из кодирующих последовательностей одной из нуклеиновых кислот по данному изобретению или могут представлять собой отличающиеся кодирующие последовательности, которые кодируют один из полипептидов по данному изобретению, имеющих по меньшей мере 5, 10, 15, 20,25, 30, 35, 40, 50, 75, 100 или 150 последовательно расположенных аминокислот одного из полипептидов по данному изобретению, как результат избыточности или вырожденности генетического кода. Генетический код хорошо известен специалистам в данной области и может быть найден, например, на с. 214 в В. Lewin, Genes VI Oxford University Press, 1997. Выделенная нуклеиновая кислота, которая кодирует один из полипептидов по данному изобретению, включает, но не ограничивается ими: только кодирующую последовательность нуклеиновой кислоты по данному изобретению и дополнительные кодирующие последовательности, такие как лидерные последовательности или последовательности пробелков, и некодирующие последовательности, такие как интроны или 5'-и/или 3'-некодирующие последовательности кодирующей последовательности. Таким образом, как используется в данном описании, термин "полинуклеотид, кодирующий полипептид" включает полинуклеотид, который включает только кодирующую полипептид последовательность, а также полинуклеотид, который включает дополнительную кодирующую и/или некодирующую последовательности. Альтернативно, в последовательности нуклеиновых кислот по данному изобретению могут быть внесены мутации с использованием общепринятых технологий, таких как сайт-направленный мутагенез,или других технологий, известных специалистам в данной области, для введения "молчащих" изменений в полинуклеотиды по данному изобретению. Как используется в данном описании, "молчащие изменения" включают, например, изменения, которые не изменяют аминокислотную последовательность, кодируемую полинуклеотидом. Такие изменения могут быть необходимы для повышения уровня полипептида, продуцируемого клетками-хозяевами, содержащими кодирующий полипептид вектор, посредством введения кодонов или кодоновых пар, которые часто встречаются в организме хозяина. Данное изобретение также относится к полинуклеотидам, которые имеют нуклеотидные замены,которые приводят к аминокислотным заменам, вставкам, делециям, слияниям и укорочениям в полипептидах по данному изобретению. Такие нуклеотидные замены могут быть введены с использованием технологий, таких как сайт-направленный мутагенез, случайный химический мутагенез, делеция экзонук- 17013993 леазой III и других технологий рекомбинантных ДНК. Альтернативно, такие нуклеотидные замены могут представлять собой природные аллельные варианты, которые выделяют посредством идентификации нуклеиновых кислот, которые специфично гибридизуются с образцами, содержащими по меньшей мере 10, 15, 20, 25, 30, 35, 40, 50, 75, 100, 150, 200, 300, 400 или 500 последовательно расположенных оснований одной из последовательностей по данному изобретению (или комплементарной ей последовательности) в условиях высокой, умеренной и низкой жесткости, как представлено в данном описании. Как используется в данном описании, термин "выделенный" означает, что материал удаляется из его естественного окружения (например, из природного окружения, если он природного происхождения). Например, природный полинуклеотид или полипептид, находящийся в живом животном не является выделенным, но тот же полинуклеотид или полипептид, отделенный от некоторых или всех сосуществующих веществ в природной системе, является выделенным. Такие полинуклеотиды могут являться частью вектора и/или такие полинуклеотиды или полипептиды могут являться частью композиции и всетаки быть выделенными, поскольку такой вектор или композиция не являются частью их природного окружения. Как используется в данном описании, термин "очищенный" не подразумевает абсолютной чистоты; скорее, он подразумевается как относительное определение. Отдельные нуклеиновые кислоты,полученные из библиотеки, традиционно очищают до электрофоретической гомогенности. Последовательности, полученные из таких клонов, не могут быть получены непосредственно либо из библиотеки,либо из всей человеческой ДНК. Очищенные нуклеиновые кислоты по данному изобретению очищены от остальной геномной ДНК в организме по меньшей мере до 104-106-кратности. Однако термин "очищенный" также включает нуклеиновые кислоты, которые очищены от остальной геномной ДНК или от других последовательностей в библиотеке или других окружающих веществ по меньшей мере на один порядок величины, как правило, на два или более порядков и более, как правило, на четыре или пять порядков величины. Как используется в данном описании, термин "рекомбинантный" означает, что нуклеиновая кислота является смежной с "остовом" нуклеиновой кислоты, с которой она не является смежной в природном окружении. Кроме того, для того чтобы являться "обогащенными", нуклеиновые кислоты должны быть представлены на 5% или более числом вставок нуклеиновых кислот в совокупности молекул остова нуклеиновых кислот. Молекулы остова в соответствии с данным изобретением включают нуклеиновые кислоты, такие как экспрессирующие векторы, самореплицирующиеся нуклеиновые кислоты, вирусы,встраивающиеся нуклеиновые кислоты и другие векторы или нуклеиновые кислоты, используемые для хранения или манипуляции с представляющей интерес вставкой нуклеиновой кислоты. Как правило,обогащенные нуклеиновые кислоты представлены на 15% или более числом вставок нуклеиновых кислот в совокупности рекомбинантных молекул остова. Более конкретно, обогащенные нуклеиновые кислоты представлены на 50% или более числом вставок нуклеиновых кислот в совокупности рекомбинантных молекул остова. В одном аспекте обогащенные нуклеиновые кислоты представлены на 90% или числом вставок нуклеиновых кислот в совокупности рекомбинантных молекул остовов."Рекомбинантные" полипептиды или белки относятся к полипептидам или белкам, получаемым с помощью технологий рекомбинантных ДНК; т.е. получаемым из клеток, трансформированных конструкцией с экзогенной ДНК, кодирующей желаемый полипептид или белок. "Синтетические" полипептиды или белок представляет собой полипептиды и белок, полученные химическим синтезом. Твердофазные способы химического синтеза также могут быть использованы для синтеза полипептида или фрагментов по данному изобретению. Такой способ известен в данной области с начала 1960-х годов (Merrifield R.B., J. Am. Chem. Soc., 85:2149-2154, 1963) (см. также Stewart J.M. and Young J.D., Solid Phase Peptide Synthesis, 2nd Ed., Pierce Chemical Co., Rockford, 111, p. 11-12) и ранее использовался в коммерчески доступных лабораторных наборах для разработки и синтеза пептидов (Cambridge Research Biochemicals). В таких коммерчески доступных лабораторных наборах, главным образом, использовались идеи Н.М.Geysen et al., Proc. Natl. Acad. Set., USA, 81:3998 (1984), и они обеспечивали синтез пептидов от концов множества "стержней" или "булавок", все из которых соединены в одном планшете. При использовании такой системы планшет со стержнями или булавками переворачивали и вставляли во второй планшет с соответствующими лунками или резервуарами, которые содержали растворы для присоединения или заякоривания соответствующей аминокислоты на концах стержней или шпилек. При повторении указанной стадии процесса, т.е. переворачивания и помещения концов стержней и булавок в соответствующие растворы, из аминокислот выстраивались желаемые пептиды. Кроме того, является доступным ряд доступных систем для синтеза пептидов FMOC. Например, сборку полипептида или фрагмента можно осуществлять на твердой подложке с использованием устройства для автоматического синтеза пептидовApplied Biosystems., Inc. Model 431 А. Такое оборудование обеспечивает легкую доступность пептидов по данному изобретению либо непосредственным синтезом, либо синтезом ряда фрагментов, которые соединяют с использованием других известных способов. Последовательность промотора является "функционально связанной с" кодирующей последовательностью, если РНК-полимераза, которая инициирует транскрипцию в промоторе, транскрибирует кодирующую последовательность в мРНК."Плазмиды" обозначают строчной буквой "р" перед заглавными буквами и/или цифрами и/или по- 18013993 сле них. Исходные плазмиды в данном случае являются либо коммерчески доступными, общедоступными без ограничений, либо они могут быть сконструированы из доступных плазмид в соответствии с опубликованными методиками. Кроме того, плазмиды, эквивалентные плазмидам, описанным в данном описании, известны в данной области и будут понятны среднему специалисту в данной области."Расщепление" ДНК относится к каталитическому расщеплению ДНК ферментом рестрикции, который действует только в определенных последовательностях в ДНК. Различные ферменты рестрикции,используемые в данном описании, являются коммерчески доступными, и условия реакции для них, кофакторы и другие требования, используемые в данном описании, известны среднему специалисту в данной области. Для аналитических целей, как правило, 1 мкг плазмиды или фрагмента ДНК используется с приблизительно 2 ед. фермента в приблизительно 20 мкл буферного раствора. В целях выделения фрагментов ДНК для конструирования плазмиды, как правило, от 5 до 50 мкг ДНК расщепляются ферментом в количестве от 20 до 250 ед. в большем объеме. Соответствующие буферы и количества субстратов для конкретных ферментов рестрикции описаны производителем. Обычно используется время инкубации приблизительно 1 ч при 37 С, но оно может варьировать в соответствии с инструкциями поставщика. После расщепления для выделения желаемого фрагмента может быть проведан гель-электрофорез."Гибридизация" относится к процессу, при котором цепь нуклеиновой кислоты соединяется с комплементарной цепью посредством спаривания оснований. Реакции гибридизации могут быть чувствительными и селективными, так что конкретная представляющая интерес последовательность может быть определена даже в образцах, в которых она представлена в низких концентрациях. Подходящие жесткие условия могут быть определены, например, концентрациями соли или формамида в растворах для прегибридизации и гибридизации, или температурой гибридизации, и хорошо известны в данной области. В частности, жесткость можно увеличивать снижением концентрации соли, повышением концентрации формамида или повышением температуры гибридизации. В альтернативных аспектах нуклеиновые кислоты по данному изобретению определяют по их способности гибридизоваться в условиях различной жесткости (например, высокой, умеренной и низкой), как указано в данном описании. Например, гибридизация в условиях высокой жесткости может происходить приблизительно в 50% формамиде при приблизительно от 37 до 42 С. Гибридизация может происходить в условиях сниженной жесткости приблизительно в 35-25% формамиде при приблизительно от 30 до 35 С. В частности, гибридизация может происходить в условиях высокой жесткости при 42 С в 50% формамиде, 5 Х SSPE,0,3% SDS и 200 нг/мл расщепленной и денатурированной ДНК спермы лосося. Гибридизация может происходить в условиях сниженной жесткости, как описано выше, но в 35% формамиде при пониженной температуре до 35 С. Диапазон температур, соответствующий конкретному уровню жесткости, может быть дополнительно сужен посредством вычисления соотношения пуринов и пиримидинов представляющей интерес нуклеиновой кислоты и соответствующего подбора температуры. Варианты указанных выше диапазонов хорошо известны в данной области. Термин "вариант" относится к полинуклеотидам или полипептидам по данному изобретению, модифицированным по одной или нескольким парам оснований, кодонам, интронам, экзонам или аминокислотным остаткам (соответственно), которые все еще сохраняют биологическую активность фермента по данному изобретению. Варианты могут быть получены любым количеством способов, включающих способы, такие как, например, ПЦР с пониженной точностью, шаффлинг, олигонуклеотид-направленный мутагенез, объединяющая ПЦР, мутагенез с помощью половой ПЦР, мутагенез in vivo, кассетный мутагенез, возвратно-множественный мутагенез, экспоненциально-множественный мутагенез, сайт-специфический мутагенез, повторная сборка гена, GSSM и любая их комбинация. Термин "мутагенез с насыщением" или "мутагенез с насыщением сайта гена", или "GSSM" включает способ, в котором используются вырожденные олигонуклеотидные праймеры для введения точковых мутаций в полинуклеотид, как подробно описано ниже. Термин "оптимизированная система направленных изменений" или "оптимизированные направленные изменения" включает способ повторной сборки фрагментов сходных последовательностей нуклеиновых кислот, например сходных генов, и подробно пояснен ниже. Термин "синтетическая повторная сборка лигированием" или "SLR" включает способ лигирования фрагментов олигонуклеотидов нестохастическим образом и подробно объяснен ниже. Как используется в данном описании, термины "нуклеиновая кислота" или "последовательность нуклеиновой кислоты" относятся к олигонуклеотиду, нуклеотиду, полинуклеотиду или к фрагменту любого из них, к ДНК или РНК геномного или синтетического происхождения, которая может быть одноцепочечной или двухцепочечной и может быть представлена смысловой или антисмысловой (комплементарной) цепью, к пептидно-нуклеиновой кислоте (PNA) или любому ДНК-подобному или РНК-подобному веществу природного или синтетического происхождения. Термины "нуклеиновая кислота" или "последовательность нуклеиновой кислоты" включают олигонуклеотид, нуклеотид, полинуклеотид, или фрагмент любого из них, ДНК или РНК (например, мРНК, рРНК, тРНК, iРHK) геномного или синтетического происхождения, которая может быть одноцепочечной или двухцепочечной и может быть представлена смысловой или антисмысловой цепью, пептидно-нуклеиновую кислоту (PNA) или любое ДНК-подобное или РНК-подбное вещество природного или синтетического происхождения,- 19013993 включая, например, iPHK, рибонуклеопротеины (например, двухцепочечные iPHK, например iRNP). Термин включает нуклеиновые кислоты, т.е. олигонуклеотиды, содержащие известные аналоги природных нуклеотидов. Термин также включает структуры, подобные нуклеиновым кислотам, с синтетическими остовами, см., например, Mata (1997) Toxicol. Appl. Pharmacol., 144:18 9-197; Strauss-Soukup (1997)Biochemistry, 36:8692-8698; Samstag (1996) Antisense Nucleic Acid. Drug. Dev., 6:153-156. Термин "олигонуклеотид" включает либо одноцепочечный полидезоксинуклеотид, либо две комплементарные полидозоксинуклеотидные цепи, которые могут быть химически синтезированными. Такие синтетические олигонуклеотиды не имеют 5'-фосфата и, таким образом, не лигируются с другим олигонуклеотидом без добавления фосфата в виде АТР в присутствии киназы. Синтетический олигонуклеотид может лигироваться с фрагментом, который не является дефосфорилированным."Кодирующая последовательность" или "нуклеотидная последовательность, кодирующая" конкретный полипептид или белок, представляет собой последовательность нуклеиновой кислоты, которая транскрибируется и транслируется в полипептид или белок, при нахождении под контролем соответствующих регуляторных последовательностей. Термин "ген" означает сегмент ДНК, вовлеченный в продукцию полипептидной цепи; он включает участки, предшествующие кодирующей области и следующие за ней (лидер и конец), а также, где существуют, встроенные последовательности (интроны) между отдельными кодирующими сегментами (экзонами). Как используется в данном описании, термин "функционально связанный" относится к функциональной взаимосвязи между двумя или более сегментами нуклеиновых кислот (например, ДНК). В одном аспекте он относится к функциональной взаимосвязи регулирующей транскрипцию последовательности с транскрибируемой последовательностью. Например, промотор функционально связан с кодирующей последовательностью, такой как нуклеиновая кислота по данному изобретению, если он стимулирует или модулирует транскрипцию кодирующей последовательности в соответствующей клетке-хозяине или другой экспрессирующей системе. В одном аспекте регулирующие транскрипцию последовательности промотора, которые функционально связаны с транскрибируемой последовательностью, являются физически смежными с транскрибируемой последовательностью, т.е. они являются цис-регуляторными. Однако некоторые регулирующие транскрипцию последовательности, такие как энхансеры, не требуют физического присоединения или локализации, близкой к кодирующим последовательностям, транскрипцию которых они усиливают. Как используется в данном описании, термин "экспрессирующая кассета" относится к нуклеотидной последовательности, которая способна влиять на экспрессию структурного гена (т.е. последовательности, кодирующей белок, такой как фермент по данному изобретению) в хозяине, совместимом с такими последовательностями. Экспрессирующие кассеты включают, по меньшей мере, промотор, функционально связанный с кодирующей полипептид последовательностью; и, необязательно, с другими последовательностями, например, с сигналами терминации транскрипции. Также могут быть использованы дополнительные факторы, например энхансеры, необходимые или целесообразные для осуществления экспрессии. Таким образом, экспрессирующие кассеты также включают плазмиды, экспрессирующие векторы, рекомбинантные вирусы, любые формы вектора с рекомбинантной "депротеинизированной ДНК" и т.п. "Вектор" содержит нуклеиновую кислоту, которая может инфицировать, трансфецировать,временно или постоянно трансдуцировать клетку. Следует учитывать, что вектор может представлять собой депротеинизированную нуклеиновую кислоту или нуклеиновую кислоту в комплексе с белком или липидом. Вектор необязательно содержит вирусные или бактериальные нуклеиновые кислоты и/или белки, и/или мембраны (например, клеточную мембрану, вирусную липидную оболочку и т.д.). Векторы включают, но не ограничиваются ими, репликоны (например, РНК-репликоны, бактериофаги), с которыми фрагменты ДНК могут быть соединены и могут становиться реплицирующимися. Таким образом,векторы включают, но не ограничиваются ими, РНК, автономную самореплицирующуюся кольцевую или линейную ДНК или РНК (например, плазмиды, вирусы и т.п., см., например, патент США 5217879), и включают как экспрессирующие, так и неэкспрессирующие плазмиды. Если рекомбинантный микроорганизм или клеточная культура описаны как содержащие "экспрессирующий вектор",то в этом случае включают как экстрахромосомную кольцевую, так и линейную ДНК, и ДНК, которая встраивается в хромосому(ы) хозяина. В случае если вектор поддерживается в клетке-хозяине, вектор может либо стабильно реплицироваться клетками в процессе митоза в качестве автономной структуры,либо он является встроенным в геном хозяина. Как используется в данном описании, термин "промотор" включает все последовательности, способные запускать транскрипцию кодирующей последовательности в клетке, например в клетке растения. Таким образом, промоторы, используемые в конструкциях по данному изобретению, включают цисрегуляторные элементы контроля транскрипции и регулирующие последовательности, которые вовлечены в регуляцию или модуляцию времени запуска и/или скорости транскрипции гена. Например, промотор может представлять собой цис-регуляторный элемент контроля транскрипции, включающий промотор, терминатор транскрипции, ориджин репликации, встроенные в хромосому последовательности, 5'- и 3'-нетранслируемые области или последовательность интрона, который вовлечен в регуляцию транскрипции. Эти цис-регуляторные последовательности, как правило, взаимодействуют с белками или дру- 20013993 гими биологическими молекулами для осуществления (запуск/завершение, регуляция, модулирование и т.д.) транскрипции. "Конститутивные" промоторы представляет собой промоторы, которые осуществляют постоянную экспрессию в большинстве условий окружающей среды и стадий развития или дифференцировки клеток. "Индуцибельные" или "регулируемые" промоторы направляют экспрессию нуклеиновой кислоты по данному изобретению под влиянием условий окружающей среды или стадии развития. Примеры условий окружающей среды, которые могут влиять на транскрипцию с индуцибельными промоторами, включают анаэробные условия, повышенную температуру, сухость воздуха или наличие света."Тканеспецифичные" промоторы представляет собой элементы контроля транскрипции, которые активны только в конкретных клетках, или тканях, или органах, например, в растениях или в животных. Тканеспецифичной регуляции можно достигать с помощью определенных внутренних факторов, которые обеспечивают экспрессию генов, кодирующих белки, специфичные для данной ткани. Известно, что такие факторы существуют у млекопитающих и растений, что дает возможность развиваться конкретным тканям. Общие способы Настоящее изобретение относится к новым композициям и способам ферментативной обработки(например, "осветления"), содержащих хлорофилл композиций, таких как композиции из растений, водорослей, пищевых продуктов или масел. Специалисту в данной области будет очевидно, что соединения, используемые в способах по данному изобретению (например, каталитические, исходные или промежуточные соединения) могут быть синтезированы с использованием различных методик и способов,которые полностью описаны в научной и патентной литературе. Например, Organic Syntheses CollectiveVolumes, Gilman et al. (Eds.) John WileySons, Inc., NY; Venuti (1989) Pharm. Res., 6:867-873. Данное изобретение может быть применено на практике совместно с любым известным в данной области способом или методикой, которые полностью описаны в научной и патентной литературе. Нуклеиновые кислоты, используемые для осуществления данного изобретения, любые из РНК,iPHK, антисмысловой нуклеиновой кислоты, кДНК, геномной ДНК, векторов, вирусов или их гибридов,могут быть выделены из множества источников, могут быть получены способами генной инженерии,могут быть амплифицированы и/или экспрессированы/получены рекомбинантными способами. Рекомбинантные полипептиды (например, ферменты по данному изобретению), полученные из этих нуклеиновых кислот, могут быть индивидуально выделены или клонированы и могут быть исследованы на наличие желаемой активности. Могут быть использованы любые рекомбинантные экспрессирующие системы, включая экспрессирующие системы клеток бактерий, млекопитающих, дрожжей, насекомых или растений. Альтернативно, такие нуклеиновые кислоты могут быть синтезированы in vitro хорошо известными способами химического синтеза, как описано, например, в Adams (1983) J. Am. Chem. Soc., 105:661; Belousov (1997) Nucleic Acids. Res., 25:3440-3444; Frenkel (1995) Free Radic. Biol. Med., 19:373-380; Blommers (1994) Biochemistry, 33:7886-7896; Narang (1979) Meth. Enzymol., 68:90; Brown (1979) Meth. Enzymol., 68:109; Beaucage (1981) Terra. Lett., 22:1859; в патенте США 4458066. Способы для манипуляции с нуклеиновыми кислотами, такие как, например, субклонирование, введение зонда (например, мечение со случайными праймерами с использованием полимеразы Кленова,ник-трансляция, амплификация), секвенирование, гибридизация и т.п. полностью описаны в научной и патентной литературе, см., например, Sambrook, ed., MOLECULAR CLONING: A LABORATORY MANUAL (2ND ED.), v. 1-3, Cold Spring Harbor Laboratory, (1989); CURRENT PROTOCOLS IN MOLECULARBIOCHEMISTRY AND MOLECULAR BIOLOGY: HYBRIDIZATION WITH NUCLEIC ACID PROBES,Part I. Theory and Nucleic acid Preparation, Tijssen, ed. Elsevier, N.Y. (1993). Другими подходящими способами получения и манипуляции с нуклеиновыми кислотами, используемыми для осуществления способов по данному изобретению, является клонирование из геномных образцов и, если желательно, скрининг и повторное клонирование вставок, выделенных или амплифицированных из, например, геномных клонов или клонов кДНК. Источники нуклеиновой кислоты, используемой в способах по данному изобретению, включают геномные библиотеки или библиотеки кДНК,содержащиеся, например, в искусственных хромосомах млекопитающих (MAC), см., например, патенты США 5721118; 6025155; искусственных хромосомах человека, см., например, Rosenfeld (1997) Nat.Genet. 15:333-335; искусственных хромосомах дрожжей (YAC); искусственных хромосомах бактерий(ВАС); искусственных хромосомах Р 1, см., например, Woon (1998) Genomics, 50:306-316; векторах, полученных на основе P1 (PACs), см., например, Kern (1997) Biotechniques, 23:120-124; космидах, рекомбинантных вирусах, фагах или плазмидах. Настоящее изобретение относится к новым композициям и способам ферментативной обработки(например, "осветления"), содержащих хлорофилл композиций, таких как композиции из растений, водорослей, пищевых продуктов или масел. Специалисту в данной области будет очевидно, что соединения, используемые в способах по данному изобретению (например, каталитические, исходные или промежуточные соединения) могут быть синтезированы с использованием различных методик и способов,- 21013993 которые полностью описаны в научной и патентной литературе. Например, Organic Syntheses CollectiveVolumes, Gilman et al. (Eds.) John WileySons, Inc., NY; Venuti (1989) Pharm Res., 6:867-873. Данное изобретение может применяться на практике совместно с любым известным в данной области способом или методикой, которые полностью описаны в научной и патентной литературе. В одном аспекте нуклеиновая кислота, кодирующая полипептид по данному изобретению, соединена в соответствующем участке с лидерной последовательностью, способной направлять секрецию транслируемого полипептида или его фрагмента. Данное изобретение относится к слитым белкам и нуклеиновым кислотам, кодирующим их. Полипептид по данному изобретению может быть слитым с гетерологичным пептидом или полипептидом,таким как N-концевые идентификационные пептиды, которые придают желаемые свойства, такие как повышение стабильности или упрощение очистки. Пептиды и полипептиды по данному изобретению также могут быть синтезированы и экспрессированы в качестве слитых белков с одним или несколькими дополнительными доменами, связанными с ними, например, для получения более иммуногенного пептида, для упрощения выделения рекомбинантного синтезированного пептида, для идентификации и выделения антител и экспрессирующих антитела В-клеток и т.п. Облегчающие определение и очистку домены включают, например, пептиды, хелатирующие металлы, такие как полигистидиновые участки и молекулы гистидин-триптофана, которые делают возможной очистку на иммобилизованных металлах, домены белка А, которые делают возможной очистку на иммобилизованных иммуноглобулинах, и домен,используемый в системе очистки удлинения/аффинности FLAGS (Immunex Corp., Seattle WA). Добавление расщепляемых линкерных последовательностей, таких как фактор Ха или энтерокиназа (Invitrogen,San Diego CA), между доменом для очистки и пептидом или полипептидом, содержащим мотив, облегчает очистку. Например, экспрессирующий вектор может включать кодирующую эпитоп последовательность нуклеиновой кислоты, связанную с шестью остатками гистидина с последующим тиоредоксином и участком расщепления энтерокиназой (см., например, Williams (1995) Biochemistry, 34:1787-1797; Dobeli(1998) Protein Expr. Purif., 12:404-414). Остатки гистидина облегчают определение и очистку, в то время как участок расщепления энтерокиназой обеспечивает средство очистки эпитопа от остального слитого белка. Технология, относящаяся к векторам, кодирующим слитые белки, и применение слитых белков полностью описаны в научной и патентной литературе, см., например, Kroll (1993) DNA Cell. Biol.,12:441-53. Последовательности для контроля транскрипции и трансляции Данное изобретение относится к последовательностям нуклеиновых кислот (например, ДНК) по данному изобретению, функционально связанным с последовательностью(ями) для контроля экспрессии(например, транскрипционными или трансляционными), например, с промоторами или энхансерами, для управления и модулирования синтеза/экспрессии РНК. Последовательность для контроля экспрессии может находиться в экспрессирующем векторе. Иллюстративные бактериальные промоторы включаютlacI, lacZ, Т 3, T7, gpt, lambda PR, PL и trp. Иллюстративные эукариотические промоторы включают предранний промотор CMV, промотор HSV тимидинкиназы, ранний и поздний промотор SV40, LTR ретровирусов и промотор мышиного металлотионеина I. Промоторы, пригодные для экспрессии полипептида в бактериях, включают промоторы lac или trpE. coli, промотор lacI, промотор lacZ, промотор Т 3, промотор Т 7, промотор gpt, промотор lambda PR,промотор lambda PL, промоторы из оперонов, кодирующих гликолитические ферменты, такие как промотор 3-фосфоглицераткиназы (PGK) и кислой фосфатазы. Эукариотические промоторы включают предранний промотор CMV, промотор HSV тимидинкиназы, промоторы теплового шока, ранний и поздний промотор SV40, LTR ретровирусов и промотор мышиного металлотионеина-I. Также могут быть использованы другие промоторы, для которых известно, что они контролируют экспрессию генов в прокариотических или эукариотических клетках или их вирусах. Промоторы, пригодные для экспрессии полипептида или его фрагмента в бактериях, включают промоторы lac или trp Е. coli, промотор lacI, промоторlacZ, промотор Т 3, промотор Т 7, промотор gpt, промотор lambda PR, промотор lambda PL, промоторы из оперонов, кодирующих гликолитические ферменты, такие как промотор 3-фосфоглицераткиназы (PGK) и кислой фосфатазы. Промоторы грибов включают промотор фактора V. Эукариотические промоторы включают предранний промотор CMV, промотор HSV тимидинкиназы, промоторы теплового шока, ранний и поздний промотор SV40, LTR ретровирусов и промотор мышиного металотионеина-1. Также могут быть использованы другие промоторы, для которых известно, что они контролируют экспрессию генов в прокариотических или эукариотических клетках или их вирусах. Тканеспецифичные промоторы растений Данное изобретение относится к экспрессирующим кассетам, которые могут быть экспрессированы с тканевой специфичностью, например которые могут экспрессировать фермент по данному изобретению с тканевой специфичностью. Данное изобретение также относится к растениям или семенам, которые экспрессируют фермент по данному изобретению с тканевой специфичностью. Тканевая специфичность может представлять собой специфичность для семян, специфичность для стебля, специфичность для листьев, специфичность для корней, специфичность для плодов и т.п. В одном аспекте конститутивный промотор, такой как промотор CaMV 35S, может быть использо- 22013993 ван для экспрессии в отдельных частях растения или семени, или во всем растении. Например, для сверхэкспрессии может быть использован фрагмент промотора растения, который направляет экспрессию нуклеиновой кислоты в некоторых или всех тканях растения, например регенерирующего растения. Такие промоторы относятся в данном случае к "конститутивным" промоторам, и они являются активными при большинстве условий окружающей среды и стадий развития или дифференцировки клетки. Примеры конститутивных промоторов включают участок инициации транскрипции вируса мозаики цветной капусты (CaMV) 35S, 1'- или 2'-промотор, полученный из Т-ДНК Agrobacterium tumefaciens, и другие участки инициации транскрипции из различных генов растений, известных специалистам в данной области. Такие гены включают, например, АСТ 11 из Arabidopsis (Huang (1996) Plant Mol. Biol., 33:125-139);Plant Physiol., 104:1167-1176); GPc1 из маиса (GenBankX15596; Martinez (1989) J. Mol. Biol., 208:551565); Gpc2 из маиса (GenBankU45855, Manjunath (1997) Plant Mol. Biol., 33:97-112); промоторы растений, описанные в патентах США 4962028; 5633440. В соответствии с данным изобретением используются тканеспецифичные или конститутивные промоторы, полученные из вирусов, которые могут включать, например, субгеномный промотор тобамовируса (Kumagai (1995) Proc. Natl. Acad. Sci., USA, 92: 1679-1683; промотор, который запускает высокую экспрессию специфичного для флоэмы репортерного гена, палочковидного вируса риса (RTBV), который реплицируется только в клетках флоэмы инфицированных рисовых растений; промотор вируса мозаики жилок кассавы (CVMV) с наиболее высокой активностью в сосудистых элементах, в клетках мезофилла листьев и на концах корней (Verdaguer (1996) Plant Mol. Biol., 31:1129-1139). Альтернативно, промотор растений может направлять экспрессию нуклеиновой кислоты, экспрессирующей фермент, в конкретной ткани, органе, типе клеток (т.е. тканеспецифичные промоторы) или иначе экспрессия может находиться под более определенным контролем окружающей среды или стадии развития или под контролем индуцибельного промотора. Примеры окружающих условий, которые могут влиять на транскрипцию, включают анаэробные условия, повышенную температуру, наличие света или опрыскивание химическими реагентами/гормонами. Например, данное изобретение относится к промотору маиса, индуцируемому сухостью воздуха (Busk (1997) выше); промотору картофеля, индуцируемому холодом, сухостью воздуха и высоким содержанием соли (Kirch (1997) Plant Mol. Biol., 33:897 909). Тканеспецифичные промоторы могут обеспечивать транскрипцию только в течение определенных временных рамок стадии развития этой ткани. См., например, Blazquez (1998) Plant Cell., 10:791-800, где охарактеризован промотор гена LEAFY из Arabidopsis. См. также Cardon (1997) Plant J., 12:367-77, где описан транскрипционный фактор SPL3, который распознает консервативную последовательность мотива в промоторной области A. thaliana гена идентичности меристемы цветка API; и Mandel (1995) PlantMolecular Biology, vol. 29, p. 995-1004, где описан промотор меристемы eIF4. Могут быть использованы тканеспецифичные промоторы, которые активны в течение всего жизненного цикла конкретной ткани. В одном аспекте нуклеиновые кислоты по данному изобретению функционально связаны с промотором,изначально активном только в клетках хлопковых волокон. В одном аспекте нуклеиновые кислоты по данному изобретению функционально связаны с промотором, изначально активным в процессе стадий удлинения клеток хлопковых волокон, например, как описано Rinehart (1996) выше. Нуклеиновые кислоты могут быть функционально связаны с промотором гена Fbl2A для предпочтительной экспрессии в клетках хлопковых волокон (Ibid). См. также John (1997) Proc. Natl. Acad. Sci., USA, 89:5769-5773; John,et al., патенты США 5608148 и 5602321, где описаны промоторы, специфичные для хлопковых волокон, и способы конструирования трансгенных хлопковых растений. Также для экспрессии нуклеиновых кислот по данному изобретению могут быть использованы промоторы, специфичные для корней. Примеры промоторов, специфичных для корней, включают промотор гена алкогольдегидрогеназы (DeLisle(1990) Int. Rev. Cytol., 123:39-60). Другие промоторы, которые могут быть использованы для экспрессии нуклеиновых кислот по данному изобретению, включают, например, промоторы, специфичные для семяпочки, специфичные для зародыша, специфичные для эндосперма, специфичные для интегумента,специфичные для оболочки семени или некоторые их комбинации; промотор, специфичный для листьев(см., например, Busk (1997) Plant J., 11:1285-1295, где описан промотор маиса, специфичный для листьев); промотор ORF13 из Agrobacterium rhizogenes (который проявляет высокую активность в корнях, см.,например, Hansen (1997) выше); промотор, специфичный для пыльцы маиса (см., например, Guerrero(1990) Mol. Gen. Genet., 224:161-168); может быть использован промотор томатов, активный в процессе созревания плодов, при старении и опадании листвы и, в меньшей степени, в цветках (см., например,Blume (1997) Plant J., 12:731-746); промотор, специфичный для пестика, из гена картофеля SK2 (см., например, Ficker (1997) Plant Mol. Biol., 35:425-431); ген Вlес 4 из гороха, который активен в эпидермальной ткани вегетативных и цветочных верхушек побегов трансгенной люцерны, делая его ценным инструментом для направления экспрессии чужеродных генов в эпидермальный слой активно растущих побегов или волокон; ген, специфичный для семяпочки BEL1 (см., например, Reiser (1995) Cell., 83:735-742, GenBankU39944); и/или промотор в Klee, патент США 558 9583, где описан участок промотора растений, способный обеспечивать высокий уровень транскрипции в ткани меристемы и/или в быстроделя- 23013993 щихся клетках. Альтернативно, для экспрессии нуклеиновых кислот по данному изобретению используются промоторы растений, которые индуцируются под воздействием гормонов растений, таких как ауксины. Например, в соответствии с данным изобретением могут быть использованы отвечающие на ауксин элементы Е 1 фрагмента промотора (AuxREs) в сое (Glycine max L.) (Liu (1997) Plant Physiol., 115:397-407); отвечающий на ауксин промотор Arabidopsis GST6 (также отвечающий на салициловую кислоту и пероксид водорода) (Chen (1996) Plant J., 10:955-966); индуцируемый ауксином промотор parC из табака(Sakai (1996) 37:906-913); отвечающий на биотин элемент растений (Streit (1997) Mol. Plant Microbe Interact., 10:933-937) и промотор, отвечающий на гормон стресса - абсцизовую кислоту (Sheen (1996) Science,274:1900-1902). Также нуклеиновые кислоты по данному изобретению могут быть функционально связаны с промоторами растений, которые индуцируются под воздействием химических реагентов, которые могут быть нанесены на растения, таких как гербициды или противомикробные средства. Например, может быть использован промотор маиса In2-2, активируемый антидотами гербицидов на основе бензолсульфонамида (De Veylder (1997) Plant Cell. Physiol., 38:568-577); применение различных антидотов гербицидов приводит к индуцированию различных систем экспрессии генов, включая экспрессию в корне, гидатоде и в апикальной меристеме побега. Кодирующая последовательность может находиться по контролем, например, индуцируемого тетрациклином промотора, например, как описано для трансгенных растений табака, содержащих ген аргининдекарбоксилазы из Avena sativa L. (овес) (Masgrau (1997) Plant J.,11:465-473); или элемент, отвечающий на салициловую кислоту (Stange (1997) Plant J., 11:1315-1324). При использовании химически индуцируемых (например, индуцируемых гормонами или пестицидами) промоторов, т.е. промоторов, отвечающих на химический реагент, который может быть нанесен на трансгенное растение в поле, экспрессия полипептида по данному изобретению может быть индуцирована на конкретной стадии развития растения. Таким образом, данное изобретение также относится к трансгенным растениям, содержащим индуцибельный ген, кодирующий полипептиды по данному изобретению, диапазон растений-хозяев которых ограничивается видами растений-мишеней, такими как кукуруза, рис, ячмень, пшеница, картофель или другие зерновые культуры, индуцируемый на любой стадии развития зерновой культуры. Специалисту в данной области будет очевидно, что тканеспецифичный промотор растений может запускать экспрессию функционально связанной последовательности в тканях, отличных от тканимишени. Таким образом, тканеспецифичный промотор представляет собой промотор, который запускает экспрессию предпочтительно в намеченной ткани или типе клеток, но, кроме того, также может приводить к некоторой экспрессии в других тканях. Также нуклеиновые кислоты по данному изобретению могут быть функционально связанными с промоторами растений, которые индуцируются под воздействием химических реагентов. Эти реагенты включают, например, гербициды, синтетические ауксины или противомикробные средства, которые могут быть нанесены, например распылены, на трансгенные растения. Индуцируемая экспрессия продуцирующих фермент нуклеиновых кислот по данному изобретению даст возможность специалисту по выращиванию растений проводить селекцию растений с оптимальной экспрессией и/или активностью фермента. Таким образом, можно контролировать развитие частей растений. Таким образом, данное изобретение относится к способам облегчения выращивания растений и частей растений. Например, в различных вариантах осуществления используется промотор маиса In2-2, активируемый антидотами гербицидов на основе бензолсульфонамида (De Veylder (1997) Plant Cell. Physiol., 38:568-577); применение различных антидотов гербицидов приводит к индуцированию определенных систем экспрессии генов,включая экспрессию в корне, гидатоде и в апикальной меристеме побегов. Кодирующие последовательности по данному изобретению также находятся под контролем индуцируемого тетрациклином промотора, например, как описано для трансгенных растений табака, содержащих ген аргининдекарбоксилазы из Avena sativa L. (овес) (Masgrau (1997) Plant J., 11:465-473); или отвечающего на салициловую кислоту элемента (Stange (1997) Plant J., 11:1315-1324). В некоторых аспектах для должной экспрессии полипептида может быть необходим участок полиаденилирования на 3'-конце кодирующей области. Участок полиаденилирования может быть получен из природного гена, из множества других генов растений (или животных, или других генов) или из генов в Т-ДНК агробактерий. Термин "растение" включает целые растения, части растений (например, листья, стебли, цветы,корни и т.д.), протопласты растений, семена и клетки растений и их потомство. Класс растений, которые могут быть использованы в способе по данному изобретению, как правило, настолько же широк, что и класс высших растений, подходящих для технологий трансформации, включая покрытосемянные (однодольные и двудольные растения), а также голосемянные. Они включают растения с множеством уровней плоидности, включая полиплоидное, диплоидное, гаплоидное и гемизиготное состояния. Как используется в данном описании, термин "трансгенное растение" включает растения или клетки растений, в которые встроена гетерологичная последовательность нуклеиновой кислоты, например нуклеиновой кислоты и различных рекомбинантных конструкций (например, экспрессирующие кассеты) по данному изобрете- 24013993 нию. Экспрессирующие векторы и носители для клонирования Данное изобретение относится к экспрессирующим векторам и носителям для клонирования, содержащим нуклеиновые кислоты по данному изобретению, например последовательности, кодирующие ферменты по данному изобретению. Экспрессирующие векторы и носители для клонирования по данному изобретению могут содержать частицы вирусов, бакуловирус, фаг, плазмиды, фагмиды, космиды,фосмиды, искусственные бактериальные хромосомы, вирусную ДНК (например, ДНК вируса осповакцины, аденовируса, поксвируса птиц, вируса псевдобешенства и производных SV40), искусственные хромосомы на основе Р 1, дрожжевые плазмиды, искусственные хромосомы дрожжей и любые другие векторы, специфичные для конкретных представляющих интерес хозяев (таких как Bacillus, Aspergillus и дрожжи). Векторы по данному изобретению могут включать хромосомные, нехромосомные последовательности и синтетические последовательности ДНК. Большое количество подходящих векторов известно специалистам в данной области, и они являются коммерчески доступными. Иллюстративные векторы включают бактериальные: векторы pQE (Qiagen), плазмиды pBluescript, векторы pNH, (векторы lambdaZAP (Stratagene); ptrc99a, pKK223-3, pDR540, pRIT2T (Pharmacia); эукариотические: pXT1, pSG5(Stratagene), pSVK3, pBPV, pMSG, pSVLSV40 (Pharmacia). Однако может быть использована любая другая плазмида или другой вектор при условии, что они способны реплицироваться и являются устойчивыми в хозяине. В соответствии с настоящим изобретением могут быть использованы векторы с низкой копийностью или с высокой копийностью."Плазмиды" могут быть коммерчески доступными, общедоступными без ограничений, или они могут быть сконструированы на основе доступных плазмид в соответствии с опубликованными методиками. Плазмиды, эквивалентные описанным в данном описании плазмидам, известны в данной области и будут очевидны среднему специалисту в данной области. Экспрессирующий вектор может содержать промотор, участок связывания рибосомы для инициации трансляции и терминатор транскрипции. Также вектор может включать соответствующие последовательности для усиления экспрессии. Экспрессирующие векторы млекопитающих могут содержать ориджин репликации, любые необходимые участки связывания рибосом, участок полиаденилирования,доноры сплайсированных фрагментов и акцепторные участки, последовательности терминации транскрипции и фланкирующие 5'-конец нетранскрибируемые последовательности. В некоторых аспектах для получения требуемых нетранскрибируемых генетических элементов могут быть использованы ДНК последовательности, полученные из участков сплайсинга и полиаденилирования SV40. В одном аспекте экспрессирующие векторы содержат один или несколько генов селективных маркеров для обеспечения селекции клеток-хозяев, содержащих вектор. Такие селективные маркеры включают гены, кодирующие дигидрофолатредуктазу, или гены, придающие устойчивость к неомицину для культур эукариотических клеток, гены, придающие устойчивость к тетрациклину или ампициллину для Е. coli, и ген TRP1 S. cerevisiae. Могут быть выбраны промоторные участки из любых других желаемых генов с использованием векторов с хлорамфениколтрансферазой (CAT) или других векторов с селективными маркерами. Также для повышения уровня экспрессии векторы для экспрессии полипептида или его фрагмента в эукариотических клетках могут содержать энхансеры. Энхансеры представляют собой цис-регуляторные элементы ДНК длиной, как правило, приблизительно от 10 до приблизительно 300 п.о., которые воздействуют на промотор и повышают его транскрипцию. Примеры включают энхансер SV40 на поздней стороне ориджина репликации с 100-270 п.о., энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней стороне ориджина репликации и энхансеры аденовирусов. Последовательность нуклеиновой кислоты может быть встроена в вектор различными методами. Как правило, последовательность лигируется с вектором в желаемом положении после расщепления вставки и вектора соответствующими эндонуклеазами рестрикции. Альтернативно, могут быть лигированы тупые концы вставки и вектора. В данной области известно множество технологий клонирования,например, как описано Ausubel и Sambrook. Такие методики и другие входят в компетенцию специалистов в данной области. Вектор может быть в форме плазмиды, вирусной частицы или фага. Другие векторы включают хромосомные, нехромосомные и синтетические последовательности ДНК, производные SV40; бактериальные плазмиды, фаговую ДНК, бакуловирус, плазмиды дрожжей, векторы, полученные из комбинаций плазмидной и фаговой ДНК, вирусную ДНК, такую как ДНК вируса осповакцины, аденовируса, поксвируса птиц и вируса псевдобешенства. Разнообразие векторов для клонирования и экспрессирующих векторов для использования в прокариотических и эукариотических хозяевах описаны, например, Sambrook. Конкретные бактериальные векторы, которые могут быть использованы, включают коммерчески доступные плазмиды, содержащие генетические элементы хорошо известного вектора для клонирования- 25013993 рСМ 7. Конкретные эукариотические векторы включают pSV2CAT, pOG44, pXT1, pSG (Stratagene)pSVK3, pBPV, pMSG и pSVL (Pharmacia). Однако может быть использован любой другой вектор при условии, что он способен реплицироваться и является устойчивым в клетке-хозяине. Нуклеиновые кислоты по данному изобретению могут быть экспрессированы в экспрессирующих кассетах, векторах или вирусах и могут быть временно или постоянно экспрессированы в клетках растений и семян. В одной иллюстративной временной экспрессирующей системе используются эписомальные экспрессирующие системы, например вирусная РНК вируса мозаики цветной капусты (CaMV), которая образуется в ядре при транскрипции эписомальной мини-хромосомы, содержащей сверхскрученную ДНК, см., например, Covey (1990) Proc. Natl. Acad. Sci., USA, 87:1633-1637. Альтернативно, кодирующие последовательности, т.е. все последовательности по данному изобретению или их субфрагменты, могут быть встроены в геном растительной клетки-хозяина и становятся составляющими частями хромосомной ДНК хозяина. Таким образом, могут экспрессироваться смысловые и антисмысловые транскрипты. Вектор, содержащий последовательности (например, промоторы или кодирующие участки) нуклеиновых кислот по данному изобретению, может содержать маркерный ген, который придает селектируемый фенотип клетке растений или семени. Например, маркер может определять устойчивость к биоциду, в частности устойчивость к антибиотику, такую как устойчивость к канамицину, G418, блеомицину, гигромицину, или устойчивость к гербициду, такую как устойчивость к хлорсульфурону илиBasta. Экспрессирующие векторы, способные экспрессировать нуклеиновые кислоты и белки в растениях,хорошо известны в данной области и могут включать, например, векторы из Agrobacterium spp., вируса картофеля X (см., например, Angell (1997) EMBO J., 16:3675-3684), вируса табачной мозаики (см., например, Casper (1996) Gene, 173:69-73), вируса кустистой карликовости томатов (см., например, Hillman(1989) Virology, 169:42-50), вируса гравировки табака (см., например, Dolja (1997) Virology, 234:243-252),вируса желтой мозаики фасоли (см., например, Morinaga (1993) Microbiol Immunol., 37:471-476), вируса мозаики цветной капусты (см., например, Cecchini (1997) Mol. Plant Microbe Interact., 10:1094-1101), перемещающегося элемента маиса Ac/Ds (см., например, Rubin (1997) Mol. Cell. Biol., 17:6294-6302; Kunze(1996) Curr. Top. Microbiol. Immunol., 204:161-194) и перемещающегося элемента маиса супрессорамутатора (Spm) (см., например, Schlappi (1996) Plant Mol. Biol., 32:717-725); и их производных. В одном аспекте экспрессирующий вектор может иметь две системы репликации для того, чтобы иметь возможность поддерживаться в двух организмах, например в клетках млекопитающих или насекомых, для экспрессии и в прокариотическом хозяине для клонирования и размножения. Более того, в случае встраивающихся экспрессирующих векторов экспрессирующий вектор может содержать по меньшей мере одну последовательность, гомологичную геному клетки-хозяина. Он может содержать две гомологичных последовательности, которые фланкируют экспрессирующую конструкцию. Встраивающийся вектор может быть направлен в конкретный локус в клетке-хозяине посредством выбора соответствующей гомологичной последовательности для включения в вектор. Конструкции для встраивания векторов хорошо известны в данной области. Экспрессирующие векторы по данному изобретению также могут включать ген селектируемого маркера для обеспечения селекции бактериальных штаммов, в которых произошла трансформация, например гены, которые придают бактериям устойчивость к лекарственным средствам, таким как ампициллин, хлорамфеникол, эритромицин, канамицин, неомицин и тетрациклин. Селективные маркеры также могут включать гены, участвующие в биосинтезе, такие как гены, участвующие в каскадах биосинтеза гистидина, триптофана и лейцина. Последовательность ДНК в экспрессирующем векторе функционально связана с соответствующей последовательностью(ями) для контроля экспрессии (промотором) для управления синтезом РНК. Конкретные указанные бактериальные промоторы включают lacI, lacZ, Т 3, Т 7, gpt, lambda PR, PL и trp. Эукариотические промоторы включают предранний промотор CMV, промотор тимидинкиназы HSV, ранний и поздний промоторы SV40, LTR ретровирусов и промотор мышиного металлотеонеина-1. Выбор подходящего вектора и промотора находится в компетенции специалиста в данной области. Экспрессирующий вектор также содержит участок связывания рибосомы для инициации трансляции и терминатор транскрипции. Также вектор может включать соответствующие последовательности для усиления экспрессии. Промоторные участки могут быть выбраны из любого желаемого гена с использованием векторов с хлорамфениколтрансферазой (CAT) или других векторов с селектируемыми маркерами. Кроме того, в одном аспекте экспрессирующие векторы содержат один или несколько генов селективных маркеров для придания фенотипических особенностей для селекции трансформированных клеток-хозяев, таких как дигидрофолатредуктаза, или устойчивость к неомицину для культур эукариотических клеток, или таких как устойчивость к тетрациклину или ампициллину для Е. coli. Экспрессирующие векторы млекопитающих также могут содержать ориджин репликации, любой необходимый участок связывания рибосом, участок полиаденилирования, доноры сплайсированного фрагмента и акцепторные участки, последовательности терминации транскрипции и фланкирующие 5'-конец нетранскрибируемые последовательности. В некоторых аспектах для получения необходимых нетранскрибируемых генетических элементов могут быть использованы последовательности ДНК, полу- 26013993 ченные из участков сплайсинга и полиаденилирования SV40. Для повышения уровня экспрессии векторы для экспрессии полипептида или его фрагмента в эукариотических клетках также могут содержать энхансеры. Энхансеры представляют собой цис-регуляторные элементы ДНК с длиной, как правило, приблизительно от 10 до приблизительно 300 п.о., которые воздействуют на промотор и повышают его транскрипцию. Примеры включают SV40 энхансер на поздней стороне ориджина репликации с 100-270 п.о., энхансер раннего промотора цитомегаловируса,энхансер вируса полиомы на поздней стороне ориджина репликации и энхансеры аденовирусов. В дополнение, экспрессирующие векторы, как правило, содержат один или несколько генов селектируемых маркеров для обеспечения селекции клеток-хозяев, содержащих вектор. Такие селективные маркеры включают гены, кодирующие дигидрофолатредуктазу, или гены, придающие устойчивость к неомицину для культур эукариотических клеток, гены, придающие устойчивость к тетрациклину или ампициллину в Е. coli, и ген TRP1 S. cerevisiae. В некоторых аспектах нуклеиновая кислота, кодирующая один из полипептидов по данному изобретению или фрагменты, содержащие по меньшей мере приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 50,75, 100 или 150 его последовательно расположенных аминокислот, соединена в соответствующим участке с лидерной последовательностью, способной направлять секрецию транслированного полипептида или его фрагмента. Нуклеиновая кислота необязательно может кодировать слитый полипептид, в котором один из полипептидов по данному изобретению или фрагменты, содержащие по меньшей мере 5, 10,15, 20, 25, 30, 35, 40, 50, 75, 100 или 150 его последовательно расположенных аминокислот, являются слитыми с гетерологичными пептидами или полипептидами, такими как N-концевые идентификационные пептиды, которые придают желаемые свойства, такие как повышенная стабильность или упрощение очистки. Соответствующая последовательность ДНК может быть встроена в вектор различными методиками. Как правило, последовательность ДНК лигируется с вектором в желаемом положении после расщепления вставки и вектора соответствующими эндонуклеазами рестрикции. Альтернативно, могут быть лигированы тупые концы вставки и вектора. Различные технологии клонирования описаны Ausubel et al. в Current Protocols in Molecular Biology, John Wiley 503 Sons, Inc. 1997 и Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd Ed., Cold Spring Harbor Laboratory Press (1989). Такие методики и другие находятся в компетенции специалистов в данной области. Вектор может быть, например, в форме плазмиды, вирусной частицы или фага. Другие векторы включают хромосомные, нехромосомные и синтетические ДНК последовательности, производные SV40; бактериальные плазмиды, фаговую ДНК, бакуловирус, плазмиды дрожжей, векторы, полученные из комбинаций плазмидной и фаговой ДНК, вирусную ДНК, такую как ДНК вируса осповакцины, аденовируса, поксвируса птиц и вируса псевдобешенства. Различные векторы для клонирования и экспрессирующие векторы для использования в прокариотических и эукариотических хозяевах описаны Sambrook,et al., Molecular Cloning: A Laboratory Manual 2nd Ed., Cold Spring Harbor, N.Y., (1989). Клетки-хозяева и трансформированные клетки Данное изобретение также относится к трансформированной клетке, содержащей последовательность нуклеиновой кислоты по данному изобретению, например, последовательность, кодирующую фермент по данному изобретению или вектор по данному изобретению. Клетка-хозяин может представлять собой любую из клеток-хозяев, известных специалистам в данной области, включая прокариотические клетки, эукариотические клетки, такие как бактериальные клетки, клетки грибов, клетки дрожжей,клетки млекопитающих, клетки насекомых или клетки растений. Иллюстративные бактериальные клетки включают Е. coli, Lactococcus lactis, Streptomyces, Bacillus subtilis, Bacillus cereus, Salmonella typhimurium или любые виды из рода Bacillus, Streptomyces и Staphylococcus. Иллюстративные клетки насекомых включают Drosophila S2 и Spodoptera Sf9. Иллюстративные клетки дрожжей включают Pichia pastoris,Saccharomyces cerevisiae или Schizosaccharomyces pombe. Иллюстративные клетки животных включают СНО, COS или клетки меланомы Bowes или любые клеточные линии мыши или человека. Выбор подходящего хозяина находится в компетенции специалистов в данной области. Технологии трансформации для большинства различных видов высших растений хорошо известны и описаны в технической и научной литературе. См., например, Weising (1988) Ann. Rev. Genet., 22:421-477; патент США 5750870. Вектор может быть введен в клетку-хозяина с использованием любой из различных технологий,включая трансформацию, трансфекцию, трансдукцию, вирусную инфекцию, генные пушки илиTi-опосредованный перенос генов. Конкретные способы включают трансфекцию с фосфатом кальция,трансфекцию, опосредуемую DEAE-декстраном, липофекцию или электропорацию (Davis L., Dibner М.,Battey L. Basic Methods in Molecular Biology (1986. В одном аспекте нуклеиновые кислоты или векторы по данному изобретению вводят в клетки для скрининга так, чтобы нуклеиновые кислоты были введены в клетки подходящим образом для последующей экспрессии нуклеиновой кислоты. Способ введения, главным образом, определяется типом клетокмишеней. Иллюстративные способы включают осаждение с СаРО 4, слияние липосом, липофекцию (например,липофектин), электропорацию, вирусную инфекцию и т.д. Нуклеиновые кислоты-кандидаты могут- 27013993 стабильно встраиваться в геном клетки-хозяина (например, при ретровирусном введении) или могут существовать либо временно, либо постоянно в цитоплазме (т.е. при использовании традиционных плазмид с использованием стандартных регуляторных последовательностей, селективных маркеров и т.д.). Поскольку для многих фармацевтически важных исследований требуются клетки-мишени человека или модели клеток-мишеней млекопитающих, могут быть использованы ретровирусные векторы, способные трансфецировать такие мишени. Когда это целесообразно, клетки-хозяева, полученные способами инженерии, могут культивироваться на общепринятых питательных средах, модифицированных соответствующим образом для активации промоторов, селекции трансформантов или амплификации генов по данному изобретению. После трансформации подходящего штамма клеток-хозяев и выращивания штамма клеток-хозяев до приемлемой плотности клеток выбранный промотор может быть индуцирован соответствующими способами(например, сменой температуры или химическим индуцированием) и клетки могут культивироваться в течение дополнительного периода времени для того, чтобы получить возможность продуцировать желаемый полипептид или его фрагмент. Клетки могут быть собраны центрифугированием, разрушены физическими или химическими способами, и полученный неочищенный экстракт может быть сохранен для дальнейшей очистки. Микробные клетки, используемые для экспрессии белков, могут быть разрушены любым общепринятым способом, включая циклы замораживания и оттаивания, разрушение ультразвуком, механическое разрушение или использование средств для лизиса клеток. Такие способы хорошо известны специалистам в данной области. Экспрессированный полипептид или его фрагмент могут быть извлечены и очищены из культур рекомбинантных клеток методами, включающими осаждение сульфатом аммония или этанолом, экстрагирование кислотой, анионную или катионную обменную хроматографию, хроматографию с фосфоцеллюлозой, хроматографию гидрофобного взаимодействия, аффинную хроматографию, хроматографию с гидроксилапатитом и хроматографию с лектином. Если необходимо, для завершения конфигурации полипептида могут быть использованы стадии рефолдинга. Если необходимо, для конечной стадии очистки можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ). Конструкции в клетках-хозяевах могут быть использованы общепринятым образом для продуцирования продукта гена, кодируемого рекомбинантной последовательностью. В зависимости от хозяина,используемого в рекомбинантом продуцировании, полипептиды, продуцируемые клетками-хозяина, содержащими вектор, могут быть гликозилированными или могут быть негликозилированными. Полипептиды по данному изобретению также могут включать начальный аминокислотный остаток метионина или не включать его. Также для продукции полипептида по данному изобретению могут быть использованы бесклеточные системы трансляции. В бесклеточных системах трансляции могут быть использованы мРНК, транскрибируемые с конструкции ДНК, содержащей промотор, функционально связанный с нуклеиновой кислотой, кодирующей полипептид или его фрагмент. В некоторых аспектах перед проведением реакции транскрипции in vitro конструкция ДНК может быть линеаризована. Транскрибированную мРНК затем инкубируют с подходящим бесклеточным экстрактом для трансляции, таким как экстракт ретикулоцитов кролика, с получением желаемого полипептида или его фрагмента. Экспрессирующие векторы могут содержать один или несколько генов селектируемых маркеров для придания фенотипических особенностей для селекции трансформированных клеток-хозяев, таких как дигидрофолатредуктаза или устойчивость к неомицину для культуры эукариотических клеток, или таких как устойчивость к тетрациклину или ампициллину для Е. coli. Клетки-хозяева, содержащие представляющие интерес полинуклеотиды, например нуклеиновые кислоты по данному изобретению, могут культивироваться на общепринятых питательных средах, модифицированных соответствующим образом для активации промоторов, селекции трансформантов или амплификации генов по данному изобретению. Условия культивирования, такие как температура, рН и т.п., представляют собой условия, которые использовались ранее для клеток-хозяев, выбранных для экспрессии, и очевидны для среднего специалиста в данной области. Клоны, идентифицированные как имеющие требуемую ферментативную активность, затем могут быть секвенированы для идентификации полинуклеотидной последовательности, кодирующей фермент с повышенной активностью. Данное изобретение относится к способу сверхэкспрессии рекомбинантного фермента в клетке, содержащей вектор, содержащий нуклеиновую кислоту по данному изобретению, например нуклеиновую кислоту, содержащую последовательность нуклеиновой кислоты по меньшей мере с приблизительно 50,51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80,81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более идентичностью последовательностей с иллюстративной последовательностью по данному изобретению на протяжении участка длиной по меньшей мере приблизительно 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650,700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150 или более остатков, или на протяжении всей длины гена или транскрипта, где идентичность последовательностей определяется анализом с помощью алгоритма сравнения последовательностей или визуальным исследованием, или нуклеиновую кислоту, которая гибридизуется в жестких условиях с последовательностью нуклеиновой кислоты по данному изобре- 28013993 тению. Сверхэкспрессию можно осуществлять любыми способами, например, используя промотор с высокой активностью, бицистронный вектор, или амплификацией гена в векторе. Нуклеиновые кислоты по данному изобретению могут быть экспрессированы или сверхэкспрессированы в любой экспрессирующей системе in vitro или in vivo. Для экспрессии или сверхэкспрессии рекомбинантного белка может быть использована любая клеточная культура, включая бактериальные культуры, культуры насекомых, дрожжей, грибов или млекопитающих. Сверхэкспрессия может быть осуществлена посредством целесообразного выбора промоторов, энхансеров, векторов, (например, использованием векторов с репликоном, бицистронных векторов (см., например, Gurtu (1996) Biochem.Biophys. Res. Commun., 229:295-8), среды, культур и т.п. В одном аспекте для сверхэкспрессии полипептидов по данному изобретению используют амплификацию гена с использованием в клеточных системах маркеров для селекции, например глутаминсинтетазы (см., например, Sanders (1987) Dev. Biol. Stand.,66:55-63). Клетка-хозяин может представлять собой любую из клеток-хозяев, известных специалистам в данной области, включая прокариотические клетки, эукариотические клетки, клетки млекопитающих, клетки насекомых или клетки растений. В качестве репрезентативных примеров подходящих хозяев могут быть названы бактериальные клетки, такие как Е. coli, Streptomyces, Bacillus subtilis, Salmonella typhimurium и различные виды из рода Streptomyces и Staphylococcus, клетки грибов, такие как дрожжи, клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9, клетки животных, такие как СНО, COS или клетки меланомы Bowes и аденовирусы. Выбор подходящего хозяина находится в компетенции специалистов в данной области. Вектор может быть введен в клетки-хозяева с использованием любой из различных технологий,включая трансформацию, трансфекцию, трансдукцию, вирусную инфекцию, генные пушки или Tiопосредованный перенос генов. Конкретные способы включают трансфекцию с фосфатом кальция,трансфекцию, опосредуемую DEAE-декстраном, липофекцию или электропорацию (Davis L., Dibner M.,Battey I. Basic Methods in Molecular Biology, (1986. Когда это целесообразно, клетки-хозяева, полученные способами инженерии, могут культивироваться на общепринятых питательных средах, модифицированных соответствующим образом для активации промоторов, селекции трансформантов или амплификации генов по данному изобретению. После трансформации подходящего штамма клеток-хозяев и выращивания штамма клеток-хозяев до приемлемой плотности клеток выбранный промотор может быть индуцирован соответствующими способами(например, сменой температуры или химическим индуцированием) и клетки могут культивироваться в течение дополнительного периода времени для того, чтобы получить возможность продуцировать желаемый полипептид или его фрагмент. Как правило, клетки собирают центрифугированием, разрушают физическими или химическими способами, и полученный неочищенный экстракт сохраняют для дальнейшей очистки. Микробные клетки, используемые для экспрессии белков, могут быть разрушены любым общепринятым способом,включая циклы замораживания и оттаивания, разрушение ультразвуком, механическое разрушение или использование средств для лизиса клеток. Такие способы хорошо известны специалистам в данной области. Экспрессированный полипептид или его фрагмент может быть извлечен и очищен из культур рекомбинантных клеток методами, включающими осаждение сульфатом аммония или этанолом, экстрагирование кислотой, анионную или катионную обменную хроматографию, хроматографию с фосфоцеллюлозой, хроматографию гидрофобного взаимодействия, аффинную хроматографию, хроматографию с гидроксилапатитом и хроматографию с лектином. Если необходимо, для завершения конфигурации полипептида могут быть использованы стадии рефолдинга. Если необходимо, для конечной стадии очистки можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ). Различные системы клеточных культур млекопитающих также могут быть использованы для экспрессии рекомбинантного белка. Примеры систем экспрессии млекопитающих включают линии фибробластов почки обезьяны COS-7 (описанные Gluzman, Cell. 23:175, 1981) и другие клеточные линии, способные экспрессировать белки совместимого вектора, такие как клеточные линии С 127, 3 Т 3, СНО, HeLa и BHK. Конструкции в клетках-хозяевах могут быть использованы общепринятым образом для продуцирования продукта гена, кодируемого рекомбинантной последовательностью. В зависимости от хозяина,используемого в процессе рекомбинантного продуцирования, полипептиды, продуцируемые клеткойхозяином, содержащей вектор, могут быть гликозилированными или могут быть негликозилированными. Полипептиды по данному изобретению также могут включать начальный аминокислотный остаток метионина или не включать его. Альтернативно, полипептиды по данному изобретению или фрагменты, содержащие по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 50, 75, 100 или 150 или более их последовательно расположенных аминокислот, могут быть получены синтетически с помощью общепринятых устройств для синтеза пептидов. В других аспектах фрагменты или участки полипептидов могут быть использованы для получения соответствующего полноразмерного полипептида с помощью пептидного синтеза; таким образом, фраг- 29
МПК / Метки
МПК: C12N 11/00, C12N 9/16, C07K 19/00, C11B 3/00, C12N 15/11, C07K 16/00, C12N 15/55
Метки: композиции, способы, ферментативного, хлорофилла, обесцвечивания
Код ссылки
<a href="https://eas.patents.su/30-13993-kompozicii-dlya-fermentativnogo-obescvechivaniya-hlorofilla-i-sposoby.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции для ферментативного обесцвечивания хлорофилла и способы</a>
Предыдущий патент: Способ проведения трехмерной сейсморазведки с использованием диаграммы возмущений для обеспечения фракционирования внутри ячейки
Следующий патент: Белково-витаминно-минеральная добавка для свиней и способ откорма свиней
Случайный патент: Газовый клапан и эксплуатационная насосно-компрессорная колонна с газовым клапаном


































