Рекомбинантный вирус, содержащий ген теломелизина-gfp
Номер патента: 11880
Опубликовано: 30.06.2009
Авторы: Мизугучи Хиройуку, Хаякава Такао, Танака Нориака, Кио Сатору, Фудживара Тошийоши
Формула / Реферат
1. Реагент для выявления раковых клеток, отличающийся тем, что он включает рекомбинантный вирус, в котором репликационная кассета, включающая промотор из теломеразы человека, ген Е1А, последовательность IRES и ген Е1В в таком порядке, интегрирована в область Е1 генома вируса и маркировочная кассета, включающая ген, кодирующий маркировочный белок, и промотор, способный регулировать экспрессию гена, кодирующего маркировочный белок, интегрирована в область Е3 генома вируса.
2. Реагент для диагностирования рака, отличающийся тем, что он включает рекомбинантный вирус, в котором репликационная кассета, включающая промотор из теломеразы человека, ген Е1А, последовательность IRES и ген Е1В в таком порядке, интегрирована в область Е1 генома вируса и маркировочная кассета, включающая ген, кодирующий маркировочный белок, и промотор, способный регулировать экспрессию гена, кодирующего маркировочный белок, интегрирована в область Е3 генома вируса.
3. Реагент по пп.1 и 2, отличающийся тем, что реагент применяется для выявления или диагностирования рака in vivo или для навигационной хирургии.
4. Реагент по пп.1 и 2, отличающийся тем, что промотор из теломеразы человека представляет собой hTERT промотор.
5. Реагент по пп.1 и 2, отличающийся тем, что маркировочный белок представляет собой GFP.
6. Реагент по пп.1 и 2, отличающийся тем, что промотор, способный регулировать экспрессию гена, кодирующего маркировочный белок, представляет собой цитомегаловирусный промотор или hTERT-промотор.
7. Реагент по пп.1 и 2, отличающийся тем, что вирус представляет собой аденовирус.
8. Агент, индуцирующий гибель клеток, отличающийся тем, что он включает рекомбинантный вирус, в котором репликационная кассета, содержащая промотор из теломеразы человека, ген Е1А, последовательность IRES и ген Е1В в таком порядке, интегрирована в область Е1 генома вируса, и кассета, индуцирующая гибель клеток, включающая ген, кодирующий белок, ассоциированный с индукцией гибели клеток, и промотор, способный регулировать экспрессию гена, кодирующего белок, интегрирована в область Е3 генома вируса.
9. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что промотор из теломеразы человека представляет собой hTERT-промотор.
10. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что белок, ассоциированный с индукцией гибели клеток, представляет собой по крайней мере один из белков, выбранных из группы, состоящей из белка, ассоциированного с иммунитетом, белка, индуцирующего апоптоз, и белка, ассоциированного с теломеразой.
11. Агент, индуцирующий гибель клеток, по п.10, отличающийся тем, что белок, ассоциированный с иммунитетом, представляет собой РА28.
12. Агент, индуцирующий гибель клеток, по п.10, отличающийся тем, что белок, индуцирующий апоптоз, представляет собой TRAIL.
13. Агент, индуцирующий гибель клеток, по п.10, отличающийся тем, что белок, ассоциированный с теломеразой, представляет собой AU5.
14. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что промотор, способный регулировать ген, кодирующий белок, ассоциированный с индукцией гибели клеток, представляет собой цитомегаловирусный промотор или hTERT-промотор.
15. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что вирус представляет собой аденовирус.
16. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что клетка представляет собой раковую клетку.
17. Метод выявления раковых клеток, отличающийся тем, что он включает инфицирование раковых клеток реагентом по любому из пп.1 и 3-6 и выявление флюоресценции, излучаемой раковыми клетками.
18. Метод индуцирования клеточной гибели в целевой клетке, отличающийся тем, что он включает инфицирование целевой клетки агентом, индуцирующим клеточную гибель, по любому из пп.8-16.
Текст
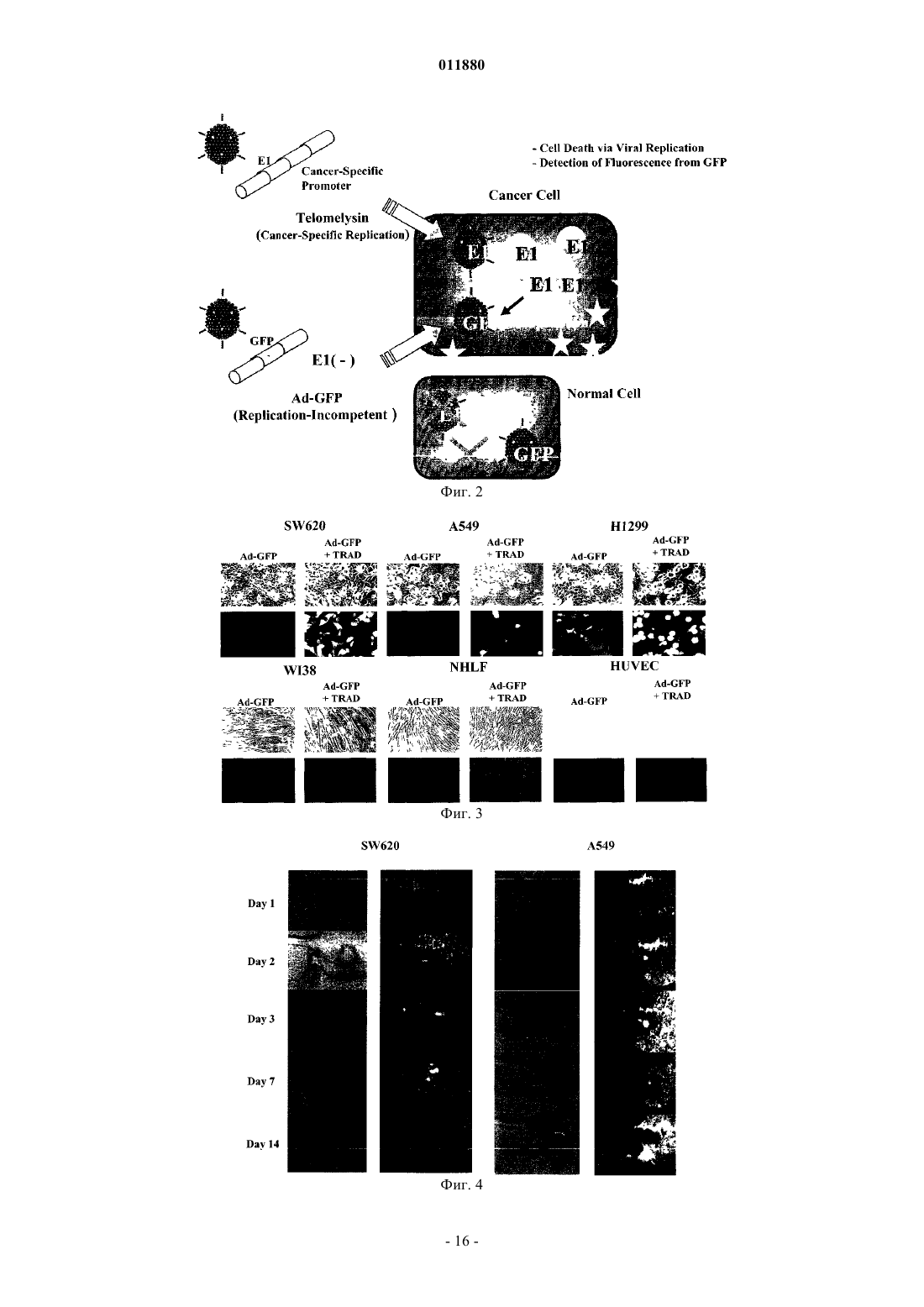
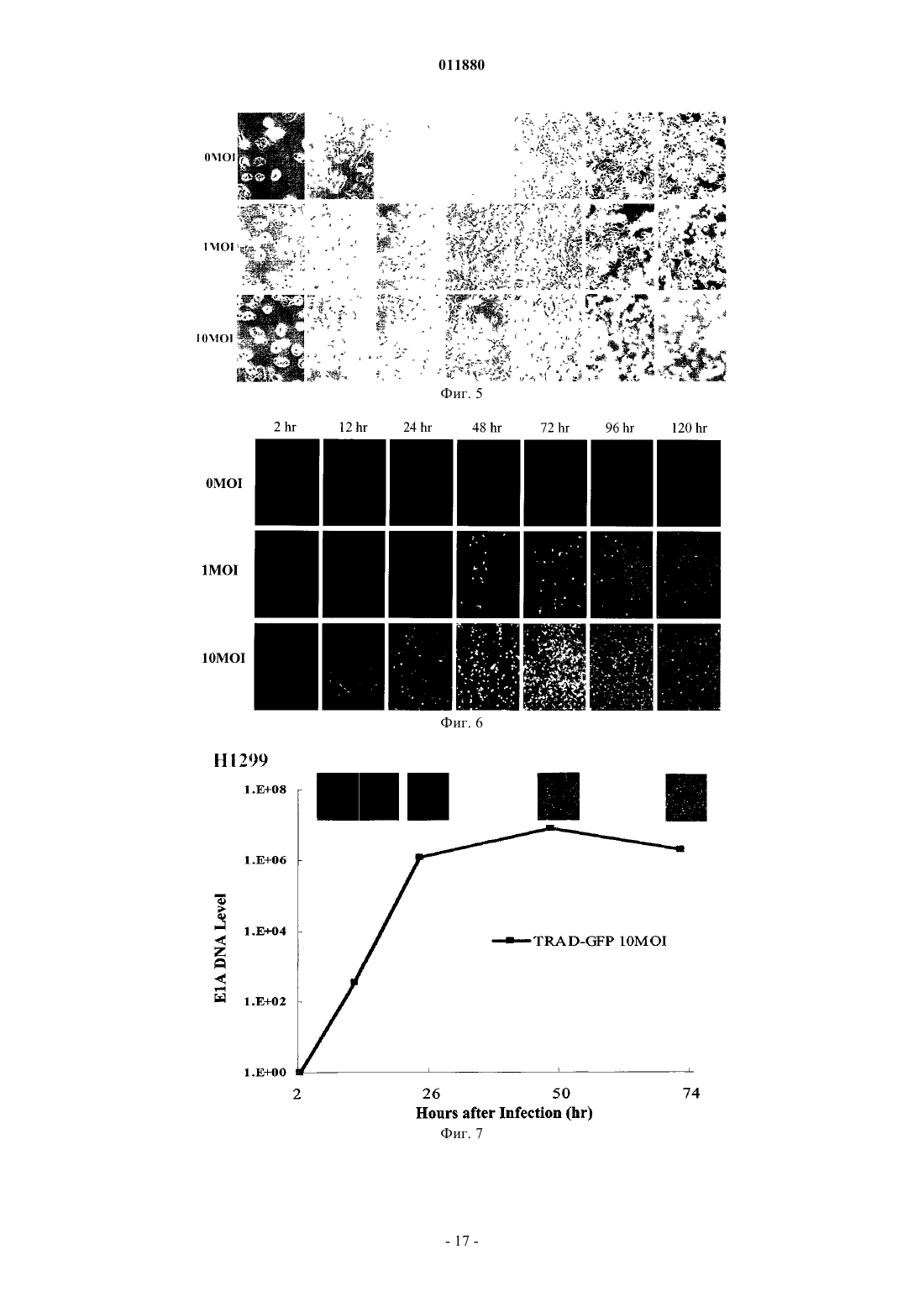
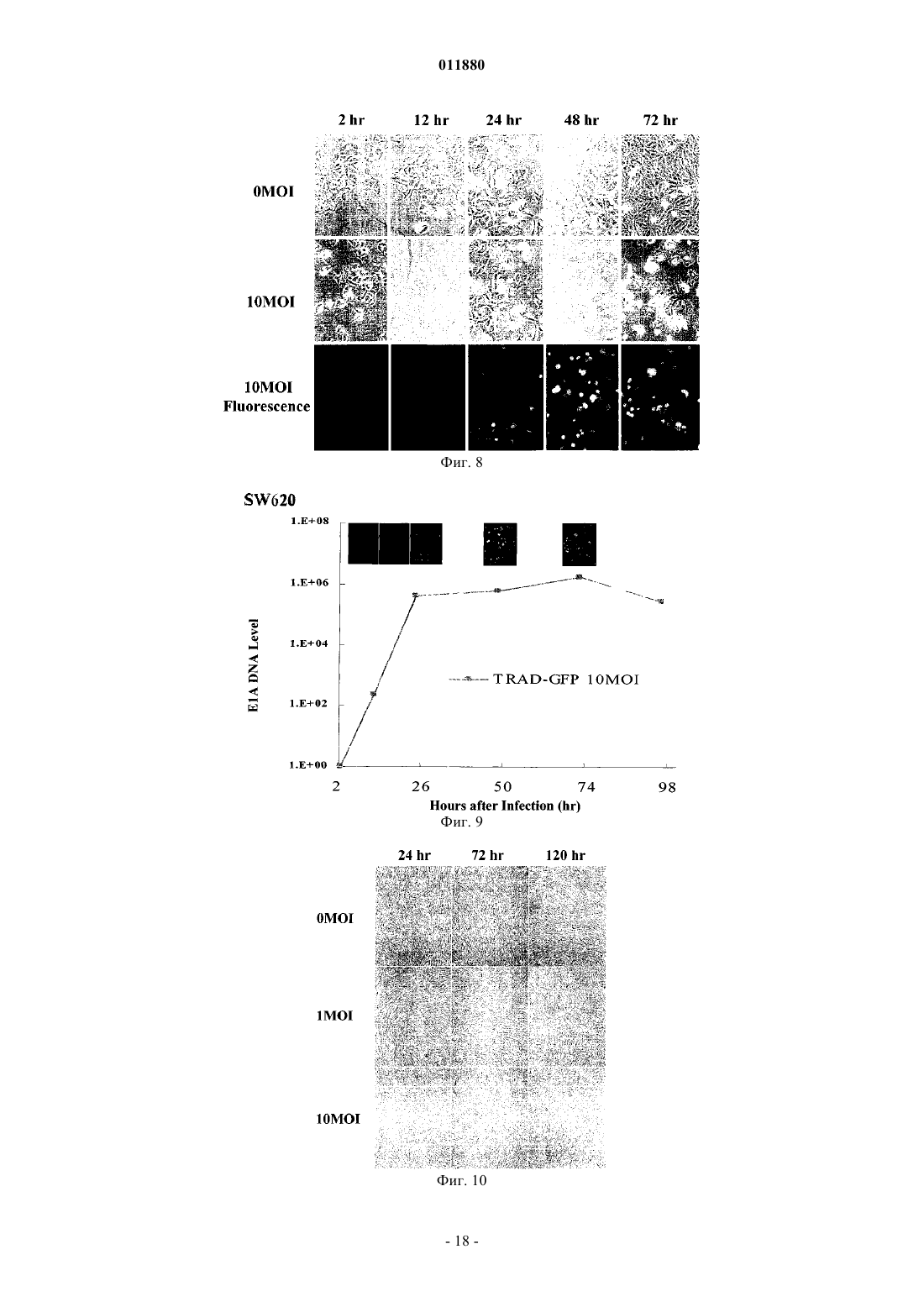
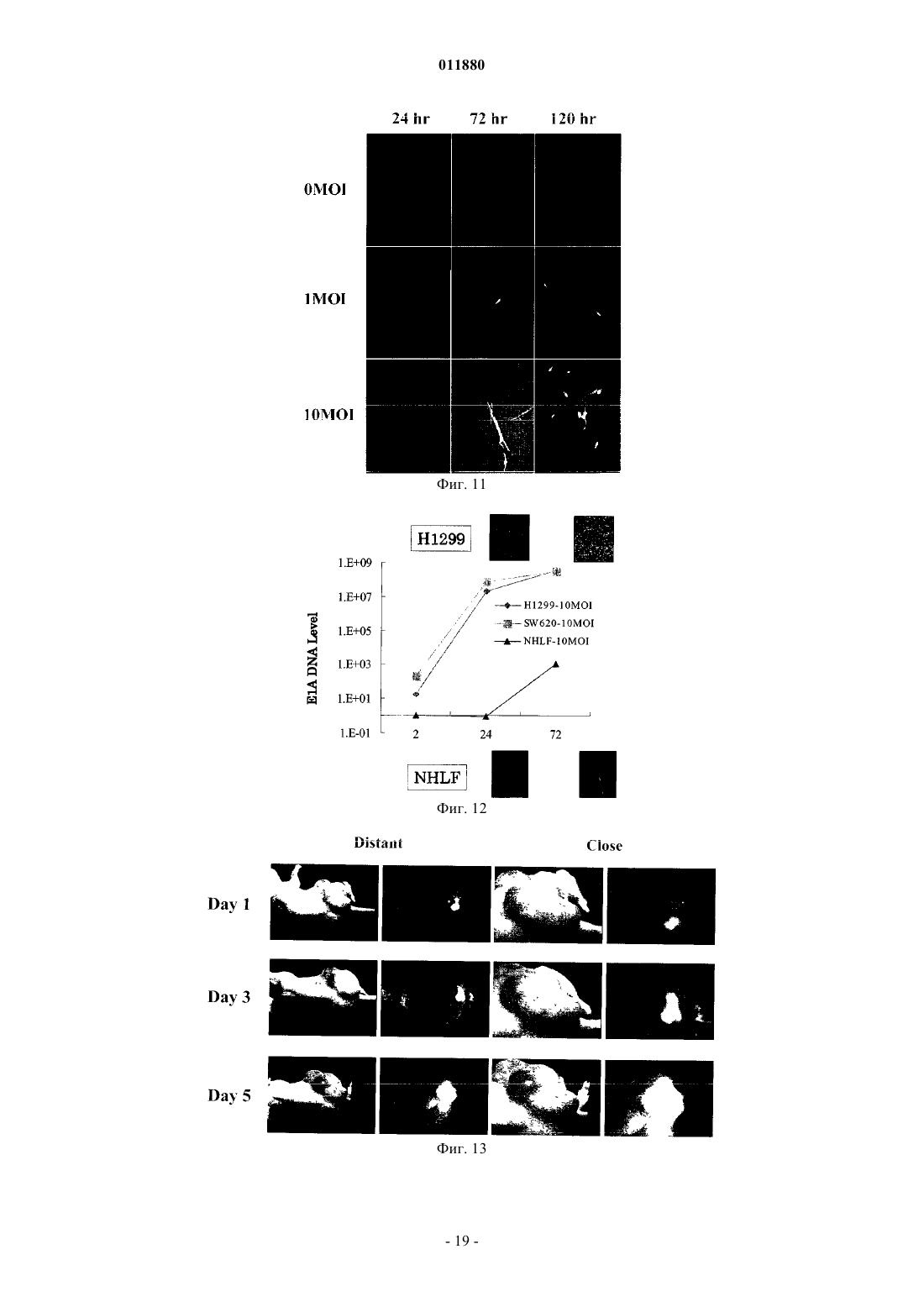
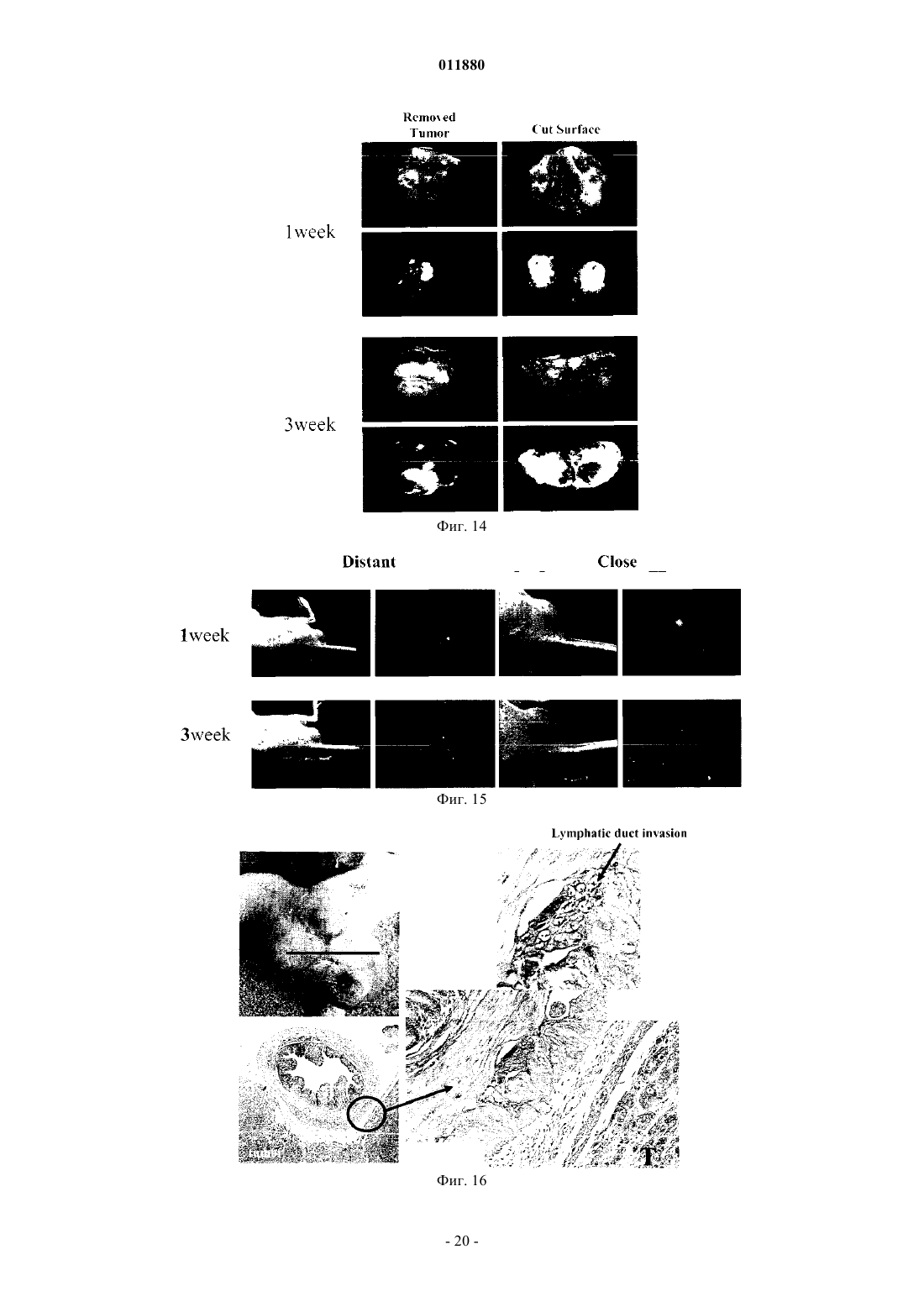
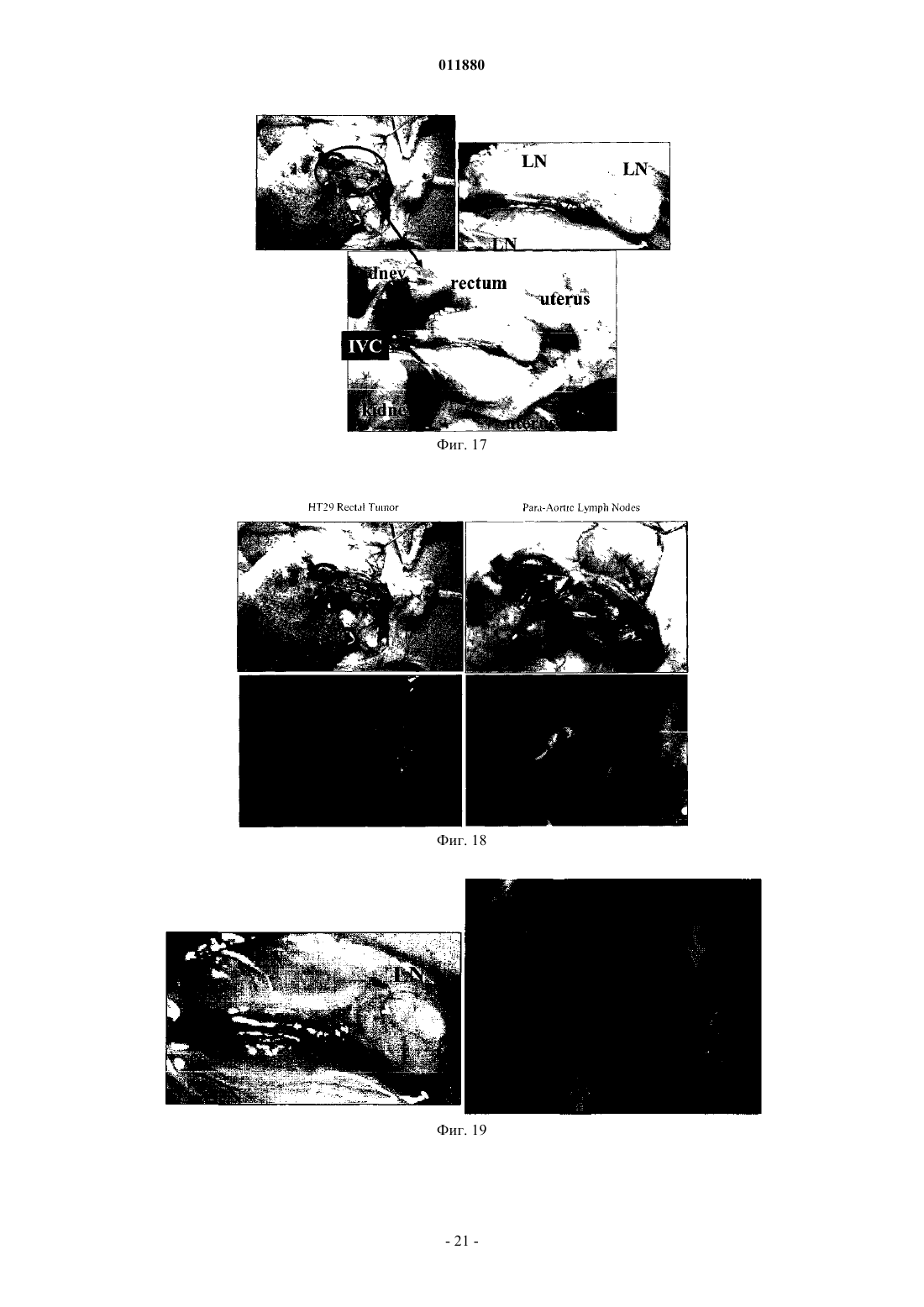
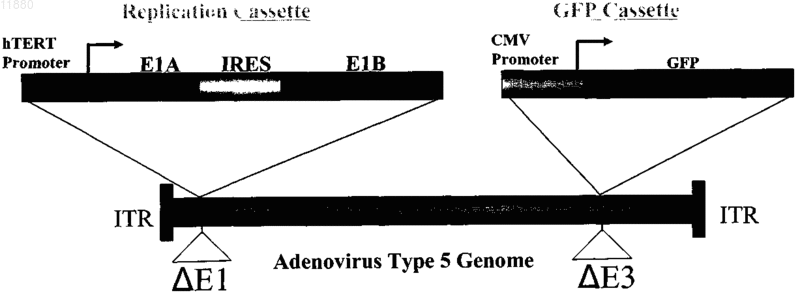
011880 Область изобретения Настоящее изобретение относится к реагенту для выявления раковых клеток или к диагностированию рака и фактору, индуцирующему гибель клеток. Известный уровень исследований Активность теломеразы часто бывает увеличена в клетках, подвергшихся злокачественному преобразованию или в иммортализованных клеточных линиях, причм активность теломеразы трудно определяема в нормальных соматических клетках за исключением клеток зародышевых линий, линий клеток крови и эпителиальных клеток. Поэтому были попытки определения рака на основе теломеразной активности, как индикатора (Shay J.W., Zou Y., Hiyama E., Wright W.E. Telomerase and Cancer. Hum Mol Genet 10 (7): 677-85, 2001). С другой стороны, выявление раковых тканей и метастатических лимфатических узлов in vivo интенсивно изучали в области диагностической визуализации. Например, сообщали о биологическом анализе с помощью PET и визуализационного анализа, полностью используя нервную сеть. Далее, сообщали об исследованиях антиопухолевой активности и безопасности вирусов с селективной репликацией(DeWeese T.L., van der Poel H., Li S., Mikhak В., Drew R., Goemann M., Hamper U., DeJong R., Detorie N.,Rodriguez R., Haulk T., DeMarzo A.M., Piantadosi S., Yu D.C., Chen Y., Henderson D.R., Carducci M.A., Nelson W.G., Simons J.W. A phase I trial of CV706, "A replication-competent, PSA selective oncolytic adenovirus,for the treatment of locally recurrent prostate cancer following radiation therapy", Cancer Res 61(20):7464-72,2001). Авторы настоящего изобретения также нашли, что инфицируя раковые клетки вирусом, обладающим теломеразным промотором и способностью к репликации, можно убивать раковые клетки посредством репликации вируса (Kawashima T., Kagawa S., Kobayashi N., Shirakiya Y., Umeoka T., Teraishi F., TakiM., Kyo S., Tanaka N., and Fujiwara Т., Related Articles, Links Abstract "Telomerase-specific replicationselective virotherapy for human cancer", Clin Cancer Res 10(l):285-92, 2004). Однако ещ не разработана система выявления рака in situ при хирургических операциях из-за трудностей целевого выявления раковых клеток. Далее, к настоящему времени не известно исследований, в которых организм инфицировали бы вирусом и кинетику вируса внутри раковых клеток действительно применяли бы для визуализации раковых тканей. Цели изобретения Как указано выше, желаемой целью была разработка реагента для выявления раковых клеток или для диагностирования рака и фактора, вызывающего гибель клеток, причм каждый реагент был бы способен визуализировать раковые клетки даже in vivo. В результате интенсивных и экстенсивных исследований, направленных на решение вышеуказанных проблем, авторы настоящего изобретения нашли, что возможно выявлять раковые клетки на чрезвычайно высокочувствительном уровне и даже in vivo путм интеграции гена, включающего меченный флюоресценцией белок, в область Е 3 генома вируса и интеграции репликационной кассеты с промотором теломеразы человека, геном Е 1 А, последовательностью IRES и геном Е 1 В в названном порядке в область Е 1, с последующим экспрессированием обеих кассет. Таким образом, цель настоящего изобретения была достигнута. Существо настоящего изобретения видно из нижеследующего его описания.(1) Реагент для выявления раковых клеток, включающий рекомбинанатный вирус, в котором репликационная кассета, включающая промотор из теломеразы человека, ген Е 1 А, последовательность IRES и ген Е 1 В в названном порядке, интегрирована в область Е 1 генома вируса и маркирующая кассета,включающая ген, кодирующий маркирующий белок и промотор, способный регулировать экспрессию гена, кодирующего маркирующий белок, интегрирована в область Е 3 генома вируса.(2) Реагент для диагноза рака, включающий рекомбинантный вирус, в котором репликационная кассета с промотором из теломеразы человека, геном Е 1 А, последовательностью IRES и геном Е 1 В в названном порядке интегрирована в область Е 1 генома вируса и маркирующая кассета, включающая ген,кодирующий маркирующий белок и промотор, способный регулировать экспрессию гена, кодирующего маркирующий белок, интегрирована в область Е 3 генома вируса. По вышеуказанным пп. (1) и (2), эти реагенты могут быть применены для выявления in vivo, диагностирования и навигационной хирургии. В качестве специфического примера может быть указан промотор теломеразы человека, hTERT. В качестве специфического примера маркирующего белка может быть назван GFP. В качестве промотора, способного регулировать экспрессию гена, кодирующего маркирующий белок, можно применить, например, цитомегаловирус-промотор или hTERT - промотор. В качестве вируса можно применить, например, аденовирус.(3) Фактор, вызывающий гибель клеток, включающий рекомбинантный вирус, в котором репликационная кассета с промотором из теломеразы человека, геном Е 1 А, последовательностью IRES и геном Е 1 В в названном порядке включены в область Е 1 генома вируса, а также кассета, вызывающая гибель клеток, с геном, кодирующим белок, ассоциированный с индукцией гибели клеток, и промотор, способный регулировать экспрессию гена, кодирующего белок, ассоциированный с индукцией гибели клеток,интегрированы в область Е 3 генома вируса. В данном факторе, индуцирующем гибель клеток, промотором из теломеразы человека может бытьhTERT-промотор. Примеры белков, ассоциированных с индукцией гибели клеток, включают ассоциированные с иммунитетом белки, индуцирующие апоптоз белки и ассоциированные с теломеразой белки. Более точно, можно назвать РА 28 как ассоциированный с иммунитетом белок, TRAIL можно назвать как индуцирующий апоптоз белок и AU5 можно назвать как ассоциированный с теломеразой белок. Промотором, способным регулировать экспрессию белка, ассоциированного с индукцией гибели клеток, может быть цитомегаловирус-промотор или hTERT-промотор; вирусом может быть аденовирус. Клеткой, составляющей предмет настоящего изобретения, может быть раковая клетка.(4) Метод выявления раковых клеток, включающий инфицирование раковых клеток реагентом по вышеуказанному п. (1) и определение флюоресценции, излучаемой раковыми клетками.(5) Метод диагностирования рака, включающий инфицирование раковых клеток реагентом по вышеуказанному п. (2) и определение флюоресценции, издаваемой раковыми клетками.(6) Метод индуцирования клеточной гибели целевой клетки, включающий инфицирование целевой клетки фактором, индуцирующим гибель клетки по вышеуказанному п. (3). Краткое описание фигур Фиг. 1 представляет собой схему, изображающую структуру теломелизина-GFP. Фиг. 2 представляет собой схему, изображающую репликацию нереплицирующего вируса. Фиг. 3 представляет собой схему, изображающую результаты выявления раковых клеток при помощи соинфицирования Ad-GFP in vitro. Фиг. 4 представляет собой схему, изображающую результаты выявления раковых тканей человека при помощи соинфицирования Ad-GFP in vivo. Фиг. 5 представляет собой схему, изображающую морфологические изменения в клетках рака лгких человека при инфицировании теломелизином-GFP. Фиг. 6 представляет собой схему, изображающую GFP-флюоресценцию раковых клеток лгких человека, инфицированных теломелизином-GFP. Фиг. 7 представляет собой схему, изображающую репликацию теломелизина-GFP, определнную при помощи количественной PCR (полимеразно-цепной реакции) в реальном масштабе времени. Фиг. 8 представляет собой схему, изображающую GFP-флюоресценцию раковых клеток толстой кишки человека, инфицированных теломелизином-GFP. Фиг. 9 представляет собой схему, изображающую репликацию теломелизина-GFP, определнную при помощи количественной PCR (полимеразно-цепной реакции) в реальном масштабе времени. Фиг. 10 представляет собой схему, изображающую морфологические изменения в нормальных клетках-фибробластах лгких человека (NHLF) при инфицировании теломелизином-GFP. Фиг. 11 представляет собой чертж, изображающий GFP-флюоресценцию нормальных клетокфибробластов лгких человека (NHLF) при инфицировании теломелизином-GFP. Фиг. 12 представляет собой схему, изображающую сравнение репликаций теломелизина-GFP, определнных при помощи количественной PCR (полимеразно-цепной реакции) в реальном масштабе времени. Фиг. 13 представляет собой схему, изображающую внутриопухолевую пролиферацию/репликацию теломелизина-GFP, наблюдаемую путм флюоресцентной визуализации. Фиг. 14 представляет собой схему, изображающую внутриопухолевую пролиферацию/репликацию теломелизина-GFP, наблюдаемую путм флюоресцентной визуализации. Фиг. 15 представляет собой схему, изображающую внутриопухолевую пролиферацию/репликацию теломелизина-GFP в модели метастаза в лимфатическом узле, наблюдаемую путм флюоресцентной визуализации. Фиг. 16 представляет собой схему, показывающую гистологический анализ модели ортотопического рака прямой кишки на безволосой мыши и раковых клетках НТ 29 рака толстой кишки человека. Фиг. 17 представляет собой схему, показывающую результаты вскрытия на модели ортотопического рака прямой кишки на безволосой мыши и раковых клетках НТ 29 толстой кишки человека. Фиг. 18 представляет собой схему, изображающую внутриопухолевую пролиферацию/репликацию теломелизина-GFP в ректальной НТ 29 опухоли и околоаортических лимфатических узлах, наблюдаемую путм флюоресцентной визуализации. Фиг. 19 представляет собой схему, изображающую внутриопухолевую пролиферацию/репликацию теломелизина-GFP в околоаортических лимфатических узлах, наблюдаемую путм флюоресцентной визуализации. Фиг. 20 представляет собой схему, изображающую внутриопухолевую пролиферацию/репликацию теломелизина-GFP в парааортических лимфатических узлах, наблюдаемую путм флюоресцентной визуализации. Предпочтительный способ осуществления изобретения Далее, следует подробное описание настоящего изобретения. Ссылки, цитированные в настоящей спецификации, включены в не в их полном виде. 1. Реагент для выявления раковой клетки и метод выявления. Настоящее изобретение относится к реагенту для выявления раковых клеток, включающему реком-2 011880 бинатный вирус, в котором репликационная кассета, включащая промотор из теломеразы человека, ген Е 1 А, последовательность IRES и ген Е 1 В в названном порядке, интегрирована в область Е 1 генома вируса и маркирующая кассета, включающая ген, кодирующий маркирующий белок и промотор, способный регулировать экспрессию гена, кодирующего маркирующий белок, интегрирована в область Е 3 генома вируса. Далее, настоящее изобретение относится к методу обнаружения раковых клеток, включающему инфицирование раковых клеток данным реагентом и выявление флюоресценции, излучаемой раковыми клетками. В данном изобретении термин рекомбинантный вирус означает вирус, в котором репликационная кассета и маркирующая кассета, описанная ниже, интегрированы в геном. Вирус, применяемый в настоящем изобретении, не жестко ограничен, но предпочтителен аденовирус с точки зрения безопасности. Среди аденовирусов аденовирус типа 5 особенно предпочтителен, поскольку с ним легче работать. Рекомбинантный вирус, применнный в настоящем изобретении, обладает репликационной кассетой, интегрированной в область, соответствующую области Е 1 генома аденовируса, и маркирующей кассетой, интегрированной в область, соответствующую области Е 4 генома аденовируса. Репликационная кассета включает промотор из теломеразы человека, ген Е 1 А, последовательность IRES и ген Е 1 В в названном порядке. Ген Е 1 А, последовательность IRES и ген Е 1 В активизируются промотором теломеразы человека, что приводит к специфической для раковых клеток и специфической для теломеразы пролиферации/репликации вируса. Маркирующая кассета включает промотор и ген, кодирующий маркирующий белок. Например, ген, кодирующий маркирующий белок, побуждается цитомегаловирусным (CMV) промотором или hTERT-промотором (фиг. 1). Теломеразный промотор определяет сайт инициации транскрипции для теломеразы и прямо регулирует частоту транскрипции. Теломераза представляет собой фермент, который поддерживает длину теломеров, препятствует укорочению теломеров в период репликации эукариотических хромосом. Тип такого теломеразного промотора не особенно ограничен и можно применять любой подходящий теломеразный промотор, совместимый с вирусом, выбранным для экспрессии интересующего нас гена. Например, предпочтителен промотор для транскриптазы человека обратная транскриптаза (hTERT). Ряд последовательностей, связывающих фактор транскрипции, подтверждн в области 1.4 kbp в обратном направлении от конца 5' гена hTERT. Полагают, что эта область и есть hTERT промотор. В частности, последовательность 181 bp (п.о. - пар оснований), размещнная в обратном направлении от сайта инициации транскипции, представляет собой сердцевинную область, важную для экспрессии гена, расположенного в прямом направлении. В настоящем изобретении можно применить любую последовательность, включающую эту сердцевинную область. Предпочтительно применить в качестве hTERT-промотора обратную последовательность из примерно 378 п.о., содержащую всю сердцевинную область. Было доказано,что эта последовательность из примерно 378 п.о. эквивалентна 181 п.о. сердцевинной области по эффективности генной экспрессии. Последовательность нуклеотидов hTERT промотора из 455 п.о. показана вSEQ ID NO: 1. Последовательность нуклеотидов hTERT-промотора не ограничена последовательностью, показанной в SEQ ID NO: 1. Последовательность нуклеотидов, которые при жестких условиях гибридизируют в ДНК, состоящую из нуклеотидной последовательности, дополнительной к ДНК, состоящей из SEQ IDNO: 1 и обладающей активностью hTERT-промотора, также можно включить в качестве последовательности для hTERT-промотора. Такие нуклеотиды можно получить из библиотек сДНК или библиотек геномов путм таких известных методов гибридизации, как гибридизация колоний, гибридизация бляшек,Сазерн-блоттинг и др., применяя полинуклеотиды, состоящие из нуклеотидной последовательности SEQID NO: 1 или е части, в качестве зонда. Библиотеки сДНК можно приготовить по методу, описанному вMolecular Cloning: A Laboratory Manual 2nd ed. (Cold Spring Harbor Press (1989. Другая возможность это применение коммерческих библиотек сДНК или библиотек геномов. При вышеуказанной гибридизации примеры жестких условий включают 1SSC - 2SSC, 0,1-0,5%SDS и 42-68 С. Более специфически, можно дать пример, в котором предгибридизация выполняется при 60-68 С в течение более 30 мин, а затем промывка выполняется в 2SSC, 0,1% SDS при комнатной температуре в течение 5-15 мин 4-6 раз. Детальные описания процедур гибридизации можно найти, например, в Molecular Cloning: A Laboratory Manual 2nd ed. (Cold Spring Harbor Press (1989, в особенности в разделе 9.47-9.58. Причина, почему ген Е 1 А, последовательность IRES и ген Е 1 В расположены в таком порядке, в настоящем изобретении заключается в том, что вставка последовательности IRES между геном Е 1 А и геном Е 1 В дат повышенную способность к репликации вируса, когда клетка-хозяин инфицирована им. Ген Е 1 А и ген Е 1 В - это гены, входящие в ген Е 1. Это один из ранних генов вирусов, которые имеют ранние (Е) гены и поздние (L) гены, который принимает участие в репликации их ДНК и кодирует белок,принимающий участие в транскрипции генома вируса. Белок Е 1 А, кодируемый геном E1A, активизирует транскрипцию группы генов (Е 1 В, Е 2, Е 4, etc.), необходимых для того, чтобы получился инфекционный вирус. Белок Е 1 В, кодируемый геном Е 1 В, способствует накоплению позднего гена (L гена) mДНК в цитоплазме инфицированной клетки-хозяина и при этом ингибирует синтез белка а клетке-хозяине. Та-3 011880 ким образом, белок Е 1 В способствует репликации вируса. Нуклеотидные последовательности гена Е 1 А и гена Е 1 В показаны в SEQ ID NO: 2 и SEQ ID NO: 3 соответственно.E1A и Е 1 В могут иметь кроме нуклеотидных последовательностей, показанных в SEQ ID NO: 2 иSEQ ID NO: 3, соответственно, нуклеотидные последовательности, которые гибридизируют при жестких условиях с образованием DNA, состоящей из SEQ ID NO: 2 или SEQ ID NO: 3, и кодируют белок с Е 1 А или Е 1 В активностью. Такие нуклеотидные последовательности могут быть получены из библиотек сДНК или библиотек геномов на основе известных методов, таких как гибридизация колоний, гибридизация бляшек, Саузерн-блоттинг и др., с применением полинуклеотида или его части, состоящей из нуклеотидной последовательности SEQ ID NO: 2 или SEQ ID NO: 3 в качестве зонда, с ДНК можно получить по методам, описанным в Molecular Cloning: A Laboratory Manual 2nd ed. (Cold Spring Harbor Press(1989. Или же возможно применить коммерческие библиотеки сДНК или библиотеки геномов. При вышеуказанной гибридизации варианты жестких условий включают lSSC - 2SSC, 0,1-0,5% SDS и 4268 С. Более специфически, можно дать пример, в котором предгибридизация выполняется при 60-68 С в течение более 30 мин, а затем промывка выполняется в 2SSC, 0,1% SDS при комнатной температуре в течение 5-15 мин 4-6 раз. Детальные описания процедур гибридизации можно найти, например, в Molecular Cloning: A Laboratory Manual 2nd ed. (Cold Spring Harbor Press (1989, в особенности в разделе 9.47-9.58.IRES (Internal Ribosome Entry Site - внутренний сайт входа в рибосому) - это сигнал инициации синтеза белка, специфический для пикорнавируса. Полагают, что сайт служит сайтом для связывания рибосомы, потому что он обладает дополнительной последовательностью к 3' терминальной последовательности 18S рибосомной ДНК. Показано, что mДНА, полученная из вируса, принадлежащего к picornaviridae, транслируется через эту последовательность. Трансляцонная эффективность через последовательность IRES высока. Даже из середины mДНК синтез белка происходит независимо от кэп-структуры. Поэтому в вирусе по настоящему изобретению как ген Е 1 А, так и ген Е 1 В (который расположен в прямом направлении от последовательности IRES) транслируются независимо промотором теломеразы человека. С применением IRES осуществляется контроль экспрессии посредством теломеразного промотора независимо на гене Е 1 А и гене Е 1 В. Поэтому в сравнении со случаями, где или ген Е 1 А, или Е 1 В контролируются теломеразным промотором, репликация вируса может быть более строго приурочена к клеткам, обладающим теломеразной активностью. Последовательность IRES показана в SEQ ID NO: 4.IRES может иметь, в отличие от нуклеотидных последовательностей, показанных в SEQ ID NO: 4,нуклеотидные последовательности, которые гибридизируют при жестких условиях в ДНК, состоящие из нуклеотидной последовательности SEQ ID NO: 4, и кодируют белок с IRES активностью. Такие нуклеотидные последовательности могут быть получены из библиотек сДНК или библиотек геномов путм таких известных методов гибридизации, как гибридизация колоний, гибридизация бляшек, Сазернблоттинг и др., применяя полинуклеотиды, состоящие из нуклеотидной последовательности SEQ ID NO: 1 или е части в качестве зонда. Библиотеки сДНК можно приготовить по методу, описанному в Molecular Cloning: A Laboratory Manual 2nd ed. (Cold Spring Harbor Press (1989. Другая возможность - это применение коммерческих библиотек сДНК или библиотек геномов. При вышеуказанной гибридизации примеры жестких условий включают 1SSC - 2SSC, 0,1-0,5% SDS и 42-68 С. Более специфически,можно дать пример, в котором предгибридизация выполняется при 60-68 С в течение более 30 мин, а затем промывка выполняется в 2SSC, 0,1% SDS при комнатной температуре в течение 5-15 мин 4-6 раз. Детальные описания процедур гибридизации можно найти, например, в Molecular Cloning: A LaboratoryManual 2nd ed. (Cold Spring Harbor Press (1989, в особенности в разделе 9.47-9.58. В настоящем изобретении промотор из теломеразы человека расположен в обратном направлении от гена Е 1, поскольку такой промотор может стимулировать репликацию клеток с теломеразной активностью. Гены, содержащие репликационные кассеты по настоящему изобретению, могут быть получены с помощью обычных методов генной инженерии. Например, в качестве метода генной инженерии можно применить метод синтеза нуклеиновой кислоты с обычно применяемым синтезатором ДНК. Или же, после выделения или синтезирования генетической последовательности, которую намерены использовать в виде матрицы, можно выработать праймеры, специфические для каждого гена, и генетическую последовательность можно амплифицировать с помощью аппарата PCR (метод PCR; Current Protocols in Molecular Biology, John WileySons (1987), Section 6.1-6.4); или можно применить метод амплификации гена с применением клонирующего вектора. При обычных навыках в этой области легко выполнить названные выше методы пользуясь, например, руководством Molecular Cloning 2nd Ed., Cold Spring Harbor Laboratory Press (1989). Очистку полученныхе продуктов PCR можно выполнить известными методами, такими как метод с бромистым этидием, метод с SYBR зелным I (молекулярные зонды), метод с GENECLEANDEAE-целлюлозы, метод замораживания-сдавливания или метод с применением диализной трубки. Когда применяют агарозный гель, продукты РСТ подвергают электрофорезу на агарозном геле и получаемые фрагменты ДНК вырезают из геля и очищают. При необходимости, возможно подтвердить обычны-4 011880 ми методами секвенирования, что получен ожидаемый ген. Например, с этой целью можно применить метод цепной дидеоксинуклеотидной терминации (Sanger et al. (1977) Proc. Natl. Acad. Sci. USA 74: 5463) или подобные методы. Иная возможность - можно также провести анализ последовательности подходящим секвенатором ДНК (например, ABI PRISM; Applied Biosystems). Далее, полученные индивидуальные гены подвергают лигированию в определнном порядке. Сначала вышеуказанные гены обрабатывают известными ферментами рестрикции и получаемые фрагменты ДНК вводят в известный вектор, в соответствии с известным методом лигирования. К примерам известных векторов относятся вектор pIRES включающий IRES (сайт внутреннего входа в рибосому в mДНК) вируса энцефаломиокардита (ECMV) и способный транслировать две открытые рамки считывания(ORFs) из одной mРНК; плазмиды, полученные из Escherichia coli (такие как pCR4, pCR2, pCR2.1,pBR322, pBR325, pUC12 и pUC13); плазмиды, полученные из Bacillus subtilis (такие как pUB110, pTP5 и рС 194); плазмиды, полученные из дрожжей (такие как pSH19 и pSH15); бактериофаги, такие какфаг; вирусы животных, такие как ретровирус, вирус осповакцины (vaccinia virus) и бакуловирус; рА 1-11,рХТ 1, pRc/CMV, pRc/RSV, pcDNAI/Neo и так далее. Для данного изобретения предпочтительно применение pIRES вектора. С этим вектором возможно приготовить репликационную кассету, содержащую промотор из теломеразы человека, ген Е 1 А, последовательность IRES sequence и ген Е 1 В в этом порядке, посредством вставки необходимых генов в мультиклонирующий сайт. Для лигирования ДНКислот можно применить лигазу ДНК. Далее, специально будет описан пример, в котором примененаhTERT в качестве теломеразы человека. Ген Е 1 А и ген Е 1 В могут быть амплифицированы в клетках с экспрессией гена Е 1, таких как клетки 293, путм проведения RT-PCR и/или DNA-PCR с применением таких праймеров как E1A-S, E1A-AS,E1B-S и E1B-AS. При необходимости, их последовательности можно подтвердить известным методом,таким как ТА клонироание. Затем, фрагменты Е 1 А и Е 1 В для ДНК можно вырезать, пользуясь известным ферментом рестрикции. Затем, можно приготовить репликационную кассету, состоящую из hTERT-E1A-IRES-E1B для применения в настоящем изобретении, вводя индивидуальные гены в мультиклонирующий сайт и аналогичный ему известный вектор (такой как вектор pIRES), чтобы был следующий порядок: hTERT промотор последовательность E1A-IRES-E1B. Или же, при необходимости, также возможно удалить цитомегаловирусный (CMV) промотор из известного вектора, такого как pShuttle, с помощью известных ферментов рестрикции и ввести в этот сайт последовательность, вырезанную из phTERT-E1A-IRES-E1B с помощью соответствующих ферментов рестрикции. Аденовирус для применения в настоящем изобретении, с единственной репликационной кассетой, состоящей из hTERT-E1A-IRES-E1B назван Теломелизин. Экспрессируя ген Е 1, необходимый для пролиферации аденовируса под контролем hTERTпромотора, возможно пролиферировать вирус в аспекте, специфическом для рака. В рекомбинантном вирусе, применнном в качестве реагента в данном изобретении, маркирующая кассета также включена вместе с репликационной кассетой. Маркирующая кассета включена в область Е 3 генома вируса. Здесь надо заметить, что первичная функция вирусного вектора, применнного в настоящем изобретении, заключается в цитотоксичности при репликации вируса. Поэтому, чтобы применить реагент по настоящему изобретению с целью диагностирования тканей с микрораком, цитотоксичность должна иметь место как можно позднее. Так обстоит дело, поскольку флюоресценция, вызываемая репликацией рекомбинантного вируса по данному изобретению, исчезает при разрушении клеток и определение места ткани, пораженной микрораком, становится затруднительным. С другой стороны, Е 3 А и Е 3 В существуют в области Е 3 аденовируса и 11.6 kDa ADP (белок гибели аденовируса) в области Е 3 А имеет функцию стимулировать цитотоксичность и распространение вируса. Поэтому в рекомбинантном вирусе, примененном по настоящему изобретению, области вирусного генома, кодирующие белки с функцией стимулировать цитотоксичность и дисперсию вируса (такие какADP-кодирующий область Е 3), удалены, чтобы тем самым отсрочить гибель клетки и облегчить определение раковых клеток на основе эмиссии GFP флюоресценции или ей подобной. Маркирующий белок, который составляет маркирующую кассету, представляет собой белок, который светится в тех клетках, в которых реплицировался и визуализирован описанный выше вирус. Предпочтительно употреблять вещество, которое издат флюоресценцию. Примеры таких веществ включают,но не исчерпываются ими, зелный флюоресцирующий белок (GFP), получаемый из светящихся зелных медуз, таких как Aequorea Victoria, GFP с повышенной люминисценцией (EGFP) или GFP со смещением в красную сторону (rsGFP), которые представляют собой видоизменнные варианты GFP (GFP variants). Также возможно применять желтый флюоресцирующий белок (YFP), циановый флюоресцирующий белок (CFP), синий флюоресцирующий белок (BFP) или GFP, полученный из Renilla reniformis. Ген, кодирующий каждый из этих белков, можно применять в настоящем изобретении. Промотором, способным регулировать экспрессию вышеописанного гена, может быть любой промотор, поскольку он совместим с вирусом, применнным для экспрессии вышеуказанного гена, представляющего интерес. Специфические примеры таких промоторов включают, но не ограничиваются ими,цитомегаловирусный (CMV) промотор, hTERT-промотор, SV40 поздний промотор, MMTV LTR промо-5 011880 тор, RSV LTR промотор и SR промотор. Предпочтительно, могут быть применены CMV промотор илиhTERT-промотор. Рекомбинантный ген, содержащийся в маркировочной кассете по настоящему изобретению, можно получить с помощью общепринятой методики генной инженерии. Например, в качестве метода генной инженерии можно применить метод синтеза нуклеиновой кислоты с помощью обычно применяемого синтезатора ДНК. Другой путь - после того как изолирована или синтезирована матрица, можно разработать праймеры, специфичные для каждого гена по методу, и генетическая последовательность может быть амплифицирована с помощью аппарата PCR (PCR метод; Current Protocols in Molecular Biology,John WileySons (1987), Section 6.1-6.4); или можно применить метод амплификации гена с помощью клонирующего вектора. При обычном навыке работы в этой области легко осуществить названные методы, руководствуясь, например, Molecular Cloning 2nd Ed., Cold Spring Harbor Laboratory Press (1989). Очистку полученного продукта PCR можно выполнить известными методами, такими как метод с бромидом этидия, метод с SYBR зелным I (молекулярные зонды), метод с GENECLEAN (Funakoshi), QIAGEN(QIAGEN), и др. с применением агарозного геля, метод с DEAE-целлюлозным фильтром, метод замораживания-сдавливания или метод с диализной трубкой. Когда применяют агарозный гель, продукты РСТ подвергают электрофорезу на агарозном геле и получаемые фрагменты ДНК вырезают из геля и очищают. При необходимости, возможно подтвердить обычными методами секвенирования, что получен ожидаемый ген. Например, с этой целью можно применить метод цепной дидеоксинуклеотидной терминации (Sanger et al. (1977) Proc. Natl. Acad. Sci. USA 74: 5463) или подобные методы. Иная возможность можно также провести анализ последовательности подходящим секвенатором ДНК (например, ABIPRISM; Applied Biosystems). Далее, полученные таким образом гены обрабатывают известными ферментами рестрикции. Рекомбинантный ген строится таким образом, что результирующий фрагмент ДНК,результат обработки (кодирующий маркировочный белок) располагается в прямом направлении от фрагмента гена, кодирующего описанный выше промотор. Здесь можно применить в качестве плазмиды бифункциональную (челночную) плазмиду. Два гена (для маркирования белка и промотора) лигитруют с помощью ДНК лигазы и вводят в вектор, чтобы таким образом приготовить рекомбинантный ген для маркирующей кассеты. В качестве известного вектора можно применить вектор pShuttle, плазмиду, полученную из Escherichia coli (такую как pCR4, pCR2, pCR2.1, pBR322, pBR325, pUC12 или pUC13); плазмиду, полученную из Bacillus subtilis (такую как pUBl10, pTP5 или рС 194); плазмиду, полученную из дрожжей (такую как pSH19 или pSH15); бактериофаг, такой как , фаг; вирус животных, такой как ретровирус, вирус вакцинии или бакуловирус; рА 1-11, рХТ 1, pRc/CMV, pRc/RSV, pcDNAI/Neo или им подобные. Далее, рекомбинантный ген, включающий описанную выше репликационную кассету и маркировочную кассету, вырезают с помощью соответствующих рестрикционных ферментов и вводят в соответствующий вектор вирусной экспрессии, чтобы таким образом приготовить рекомбинантный вирус. Примеры векторов вирусной экспрессии включают аденовирус, ретровирус, вирус вакцинии и бакуловирус. Как описано выше, аденовирус (в особенности аденовирус типа 5) предпочтителен. Для интегрирования кассеты в вирус можно применить такие методы, как электропорация, липосомный метод, сферопластный метод и метод с ацетатом лития. В данном изобретении, в особенности, рекомбинационный ген может быть приготовлен путм ввода CMV-EGFP-SV40P (А) из pEGFP-N1 (CLONTECH) в челночную плазмиду рНМ 11 и ввода фрагментаCsp45I этой плазмиды в сайт ClaI вектора pShuttle, в который интегрирован phTERT-E1A-IRES-E1B. В данном изобретении, в особенности, последовательность нужной области может быть вырезана рестрикционными ферментами из рекомбинантного гена, как приготовлялось выше, и введена в ДНК вируса в виде Adeno-X Viral ДНК с применением коммерческого набора, такого как Adeno-X ExpressionSystem (CLONTECH) (получаемый продукт обозначается как "AdenoX-hAIB"). Этот AdenoX-hAIB линеаризируют с помощью известного рестрикционного фермента и затем переносят в культивируемые клетки, такие как клетки 293, чтобы таким образом приготовить инфекционный рекомбинантный вирус. Диапазон целевых раковых клеток, подлежащих выявлению по данному изобретению, не ограничивается. Можно применять любые раковые клетки. Например, можно применять тврдые виды рака на голове и шее, в желудке, толстой кишке, лгком, печени, простате, поджелудочной железе, пищеводе,мочевом пузыре, жлчном пузыре/жлчном протоке, груди, матке, щитовидной железе, яичнике и т.д.; или лейкемию, лимфому, саркому, мезенхимальные опухоли или им подобные. Большинство раковых клеток, полученных из тканей человека, проявляют увеличение теломеразной активности. Настоящее изобретение может обнаруживать такие раковые клетки вообще там, где пролиферация активизируется такой теломеразной активностью. Поскольку экспрессия теломеразы в раковых клетках чрезвычайно велика по сравнению с нормальными клетками, в раковых клетках, содержащих теломеразу, экпрессирована hTERT и в них функционирует репликационная кассета. В результате вирус реплицируется, что в свою очередь увеличивает репликацию маркирующего белка. Таким путм экспрессируется и визуализуется маркирующий белок.-6 011880 Поэтому, когда реагент по настоящему изобретению не флюоресцирует в нормальных клетках, он дат флюоресценцию в раковых клетках. Таким образом, становится возможным визуально наблюдать раковые клетки. Для инфицирования клеток рекомбинантным вирусом можно применять, например, следующий метод. Во-первых, клетки, такие как раковые клетки SW620 толстой кишки человека, раковые клетки лгких человека А 549 и H1299, наносятся на культуральные планшеты с соответствующей культуральной средой и культивируются в присутствии газа СО 2 при 37 С. В качестве культуральной среды можно применять таковой, который обычно применяют для культивирования клеток животных, напримерDMEM, MEM или RPMI-1640. При необходимости к ней можно добавлять сыворотку, антибиотики, витамины или подобные им вещества. Культивируемые клетки инфицируются путм посева определнного количества (0,1-10 MOI (множественность инфекции), предпочтительно 1 MOI) рекомбинантного вируса по настоящему изобретению. MOI означает отношение между количеством вируса (инфекционная единица) и количеством клеток, когда определнное количество культивируемых клеток инфицируется определнным количеством частиц вируса. MOI применяют как индикатор при заражении клеток вирусом. Чтобы подтвердить репликацию вируса, клетки, инфицированные вирусом, извлекают и экстрагируют ДНК из них. Затем ДНК подвергают PCR в реальном масштабе времени, применяя праймеры, направленные на определнный ген, находящийся в вирусе по данному изобретению. Таким образом, возможен количественный анализ. В отношении выявления маркированных клеток: раковые клетки можно увидеть, потому что клетки с репликацией вируса излучают специфическую флюоресценцию (например, зелное свечение в случае применения GFP) при экспозиции на возбуждающее освещение. Например, когда клетки, инфицированные вирусом, наблюдают под флюоресцентным микроскопом, можно наблюдать, что клетки издают GFP флюоресценцию. Для наблюдения инфицированных клеток во времени, GFP флюоресценцию можно наблюдать с помощью CCD (Computer Controlled Display) камеры. Для маркирования в реальном времени и выявления интересующих нас клеток in vivo рекомбинантный вирус по настоящему изобретению можно вводить в живой организм. Реагент по настоящему изобретению можно применять непосредственно к пораженному месту. Другая возможность - реагент по настоящему изобретению можно вводить в живой организм (целевую клетку или орган) любым известным способом, например внутривенной, внутримышечной, интраабдоминальной или подкожной инъекцией; ингаляцией через носовую полость, ротовую полость или лгкие; через рот; введением внутрь сосудов с помощью катетера и т.д. Уровень доз выбирают соответственно, в зависимости от действующего компонента, пути введения, мишени введения, а также возраста, веса тела,пола, симптомов и других сторон состояния пациента. Обычно уровень доз может быть выбран так, что вирус по настоящему изобретению (активное начало) применяют в виде суточной дозы около 106-1011 БОЕ (PFU-бляшкообразующих единиц), предпочтительно около 109-1011 БОЕ. Такое количество дают раз в сутки или оно может быть разделено на несколько порций и дано несколько раз в сутки. Реагент по настоящему изобретению делает возможным наблюдать метку in vivo в истинном времени. Таким образом, реагент по настоящему изобретению имеет преимущество как применяемый invivo диагностический агент. Это полезно при так называемой навигационной хирургии. Если применяют широкое иссечение, включая пораженный орган, при хирургической операции,пациент, переживший хирургическую операцию, может рассчитывать на долгую жизнь. Однако частота осложнений, причиняемых самой хирургической операцией, остатся высокой. Далее, утрата функционирования иссечнного органа неизбежно влияет на каждодневную жизнь после хирургической операции. При лечении рака важно применять малоинвазивное лечение, что уменьшит тяжесть для пациента при сохранении длительного выживания. Когда ставят цель минимизировать площадь иссечения, необходимо иметь сведения о наличии или отсутствии метастатических лимфатическх узлов. В качестве метода получения такой информации привлекает внимание сторожевой лимфоузел (СУ - SN). СУ - это лимфатический узел, который первым принимает ток лимфы от опухолей, и имеется гипотеза, что первые микрометастазы образуются в таком лимфатическом узле. Эта гипотеза известна как теория СУ. Хотя уже начаты широкомасштабные клинические испытания по отношению к раку груди сначала в Европе и Соединенных Штатах, пока не известно, применима ли эта теория к другим плотным опухолям. Испытания только что начаты. Система диагноза рака in vivo с применением реагента по настоящему изобретению может привести к разработке технологии создания прямой экспрессии флюоресцентого белка в раковых клетках и определения опухолевых тканей или метастатических лимфатических узлов с помощью высокочувствительной системы флюоресцентного выявления при хирургической операции. Другими словами, можно создать технологию навигационной хирургии как метод более чувствительный, чем СУ. Рекомбинантный вирус по настоящему изобретению реплицируется в большом числе раковых клеток с теломеразной активностью, и эти клетки могут издавать, например, сильную зелную GFP флюоресценцию. При анализе метастазов в лимфатических узлах установлено, что около 10% перемещенных метастазов, то есть зарождающиеся метастазы во втором и последующих узлах сообщают о наступлении метастазов во второй группе или более отдалнных лимфатических узлах, переместились от лимфоузла-7 011880 первой группы, перескочивших через первую группу лимфатических узлов. На основании этого сообщения многие специалисты указывали на опасность навигации СУ. Однако система диагностирования ракаin vivo с применением реагента по настоящему изобретению определяет опухолевые ткани или метастатические лимфатические узлы непосредственно при хирургической операции в реальном масштабе времени и навигации во всм диапазоне иссечения. Эта система оригинальна и создат эпоху, а кроме того,она чрезвычайно практична для плавного хода хирургической операции. В частности, реагент по настоящему изобретению вводится эндоскопически в область опухоли (например, в слизистую желудка или толстой кишки вокруг рака желудка или рака толстой кишки; во внутреннюю область таких опухолей, как рак желудка, рак толстой кишки, рак лгких, рак поджелудочной железы) за несколько дней до хирургической операции тем же ручным способом, как при навигации СУ. Затем нужно достаточное время, чтобы вирус распределился по тканям, инфильтрированным опухолью, метастатическим опухолевым тканям или сопровождающим лимфатическим узлам и реплицировался в опухолевых местах или положительных на метастазы местах. В период проведения хирургии свет, возбуждающий GFP флюоресценцию, проецируется от источника света на хирургическое поле после чревосечения и изображения от специальной 3CCD камеры проецируются на дисплей (a face mount display). Применяя переносную лупу можно находить поле зрения в пределах действительного хирургического поля и возможно находить лимфатические узлы, положительные на метастазы, на перекрывающихся GFP изображениях. Далее, устанавливая специальный фильтр,можно отличать флюоресценцию зрительно, без применения камеры. 2. Реагент для диагностирования ex vivo Реагент по настоящему изобретению также применим в качестве агента для диагностирования exvivo с целью отбора. В текущей работе количественное определение маркров опухолей - это самый обычный метод выявления присутствия рака, который нельзя определить зрительно или нельзя определить его первичное место. Однако маркры опухолей не всегда удовлетворительны в отношении специфичности для рака. Кроме того, чрезвычайно трудно выявить все виды рака, применив один маркр. Было показано, что теломеразная активность злокачественных опухолей человека увеличивается на 85% или более и поэтому е специфичность по отношению к раку чрезвычайно высока. Диагностирование рака ex vivo с помощью реагента по настоящему изобретению можно выполнить,например, как описано ниже. Из общей пробы крови, взятой у пациента, отделяют эритроциты. К оставшейся жидкости со взвесью клеток добавляют реагент по настоящему изобретению в определнном отношении (0,1-10 MOI,предпочтительно 1 MOI) и смешивают в пробирке. Смесь оставляют на определенное время (например,12-48 ч), чтобы произошло заражение раковых клеток вирусом и для последующей репликации вируса. Затем, количественно анализируют GFP экспрессию во фракции клеток с помощью проточной цитометрии. С применением этой системы становится возможно выявить свободные раковые клетки, присутствующие в периферической крови, с высокой степенью чувствительности. Этот метод можно применять для выявления свободных раковых клеток, присутствующих в периферической крови, в очень малом количестве. 3. Агент, индуцирующий гибель клеток, и метод индуцирования гибели клеток Один из результатов настоящего изобретения - это агент, индуцирующий гибель клеток, включающий рекомбинантный вирус, в котором репликационная кассета с промотором из теломеразы человека,ген Е 1 А, последовательность IRES и ген Е 1 В в таком порядке включены в отдел Е 1 генома вируса и кассета, индуцирующая гибель, с геном, кодирующим белок, связанным с индукцией гибели клеток, и промотором, способным регулировать экспрессию гена, кодирующего белок, интегрированы в отдел Е 3 генома вируса. Предпочтительно использовать агент, индуцирующий гибель клеток, по данному изобретению в генной терапии раковых заболеваний как агент, индуцирующий гибель раковых клеток, а также для профилактики рецидивов, угнетения и/или профилактики метастазов после хирургии раковых заболеваний. В кассету, индуцирующую гибель клеток, рекомбинантного вируса, содержащегося в агенте, индуцирующем гибель клеток, по данному изобретению интегрирован ген, которым оперирует промотор и который кодирует белок, способный индуцировать гибель клеток. В этой кассете, индуцирующей гибель клеток, применнной в составе рекомбинантного вируса, содержатся ген, кодирующий белок, ассоциированный с индукцией гибели клеток, и промотор, способный регулировать экспрессию гена. Поэтому, когда агент, индуцирующий гибель клеток по данному изобретению, вводится в раковые клетки, вирус реплицируется специально в раковых клетках. В результате уровень экспрессии внутри клеток белка, ассоциированного с индукцией гибели клеток, повышается и индукция гибели клеток происходит только в раковых клетках без повреждения нормальных клеток. Ген, кодирующий белок, ассоциированный с индукцией гибели клеток, соответствует гену, кодирующему белок, ассоциированный с индукцией клеточной гибели в определнной клетке. Частные примеры белков, ассоциированных с индукцией клеточной гибели, включают следующие белки, но не ограничиваются ими. В данном изобретении может быть введн ген, кодирующий любой из-8 011880 этих белков. Как частный пример белка, ассоциированного с иммунитетом, можно назвать РА 28. РА 28 - это белок, который активирует внутриклеточные протеасомы. При сверхэкспрессии этот белок вызывает иммунологические реакции и в то же время индуцирует гибель клеток. Как частный пример белка, вызывающего апоптоз, можно назвать TRAIL. TRAIL - это молекула, которая индуцирует гибель апоптозных клеток, связывая рецептор на клеточной поверхности. Как частный пример белка, ассоциированного с теломеразой, можно назвать AU5. AU5 имеет последовательность, способную индуцировать клеточную гибель клеток с теломеразной активностью. Гены этих белков, ассоциированных с индукцией гибели клеток, могут быть получены методами обычной генетической инженерии. Например, как метод генетической инженерии можно назвать метод синтеза нуклеиновой кислоты с помощью обычно употребляемого синтезатора ДНК. Другой вариант после того как выделена или синтезирована нужная в качестве матрицы генетическая последовательность, можно разработать праймеры, специфические для каждого гена, и генетическая последовательность может быть амплифицирована с помощью PCR аппарата (PCR метод; Current Protocols in MolecularBiology, John WileySons (1987), Section 6.1-6.4); или можно применить метод амплификации генов с применением клонирующего вектора. При обычном навыке работы в этой области легко выполнить вышеуказанные методы, руководствуясь, например, Molecular Cloning 2nd Ed., Cold Spring Harbor LaboratoryPress (1989). Очистку полученных продуктов PCR можно выполнить известными методами, таким как метод с бромистым этидием, метод с SYBR зелным I (молекулярные зонды), метод с GENECLEAN (Funakoshi), QIAGEN (QIAGEN) и др., применяя агарозный гель, метод с применением фильтра из DEAEцеллюлозы, метод замораживания-сдавливания или метод с применением диализной трубки. Когда применяют агарозный гель, продукты PCR подвергают электрофорезу на агарозном геле и получаемые фрагменты ДНК вырезают из геля и очищают. При необходимости, возможно подтвердить обычными методами секвенирования, что получен ожидаемый ген. Например, с этой целью можно применить метод цепной дидеоксинуклеотидной терминации (Sanger et al. (1977) Proc. Natl. Acad. Sci. USA 74: 5463) или подобные методы. Иная возможность - можно также провести анализ последовательности подходящим секвенатором ДНК (например, ABI PRISM; Applied Biosystems). Антионкогены также входят в число веществ, индуцирующих гибель раковых клеток, поскольку антионкогены имеют функцию угнетения репликации раковых клеток. С этой целью можно перечислить следующие антионкогены, применяемые в обычной генной терапии: р 53 (SEQ ID NO: 11; Accession No. /номер депонирования/ M14694): разные виды рака; р 15 (SEQ ID NO: 12; Accession No. L36844): разные виды рака; р 16 (SEQ ID NO: 13; Accession No. L27211): разные виды рака;WT-1 (SEQ ID NO: 24; Accession No. NM 000378): опухоль Вильмса. Эти антионкогены могут быть получены обычными методами генетической инженерии. Например,в качестве метода генетической инженерии можно применить метод синтеза нуклеиновой кислоты с помощью обычного синтезатора ДНК. Другой вариант - после того как изолирована или синтезирована генетическая последовательность для применения в качестве матрицы, праймеры, специфические для каждого гена, могут быть разработаны и генетическая последовательность может быть амплифицирована с помощью PCR аппарата (метод PCR); или можно применить метод амплификации гена с применением клонирующего вектора. При необходимости, возможно подтвердить обычными методами секвенирования, что получен ожидаемый ген. В качестве промотора, способного регулировать экспрессию вышеуказанного гена, можно применить любой промотор, поскольку он представляет собой подходящий промотор, совместимый с вирусом,употреблнным для экспрессии интересующего нас гена. Предпочтительно употребить CMV промотор или hTERT промотор. Однако другие промоторы, такие как SV40 поздний промотор, MMTV LTR промотор, RSV LTR промотор и SR промотор также можно применить. Агент, индуцирующий гибель клеток по настоящему изобретению можно применить прямо к пораженному месту. Другой вариант - агент по настоящему изобретению можно ввести в живой организм(целевую клетку или орган) любым известным способом, например внутривенной, внутримышечной,внутриабдоминальной или подкожной инъекцией; ингаляцией через носовую полость, ротовую полость-9 011880 или лгкие; через рот; через сосуды с помощью катетера и т.п. К агенту, индуцирующему гибель клеток по настоящему изобретению, можно применять, например, такие методы, как замораживание, чтобы легче с ним было обращаться и затем применять в отдельности или приготовить фармацевтические составы, смешивая с известными фармацевтическими приемлемыми носителями, такими как наполнители, фильтры, бинты, смазки; или известные добавки (такие как буферы, изотонические агенты, хелатирующие агенты, красители, консерванты, ароматизаторы, вкусовые и подслащивающие вещества). Агент, индуцирующий гибель клеток по настоящему изобретению, можно применять перорально или парэнтерально в зависимости от формы агента, например перорально в виде таблеток, порошков,гранул, пилюль, жидкостей, сиропов и т.п. и парэнтерально в виде инъекций, наружно в виде суппозиториев, глазных капель и т.п. Предпочтительны местная инъекция в мышцы или брюшную полость или внутривенная инъекция. Уровень дозы выбирают в зависимости от активного ингредиента, пути применения, цели применения, возраста, веста тела, пола, симптомов и других сторон состояния пациента. Обычно уровень дозы может быть выбран так, чтобы вирус по настоящему изобретению (активный ингредиент) принимали в виде суточной дозы около 106-1011 БОЕ (БОЕ - PFU, бляшкобразующих единиц), предпочтительно около 109-1011 БОЕ. Это количество принимают раз в сутки или оно может быть разделено на несколько порций и тогда его принимают несколько раз в сутки. При приме вируса по настоящему изобретению возможно также принимать известный иммунодепрессант или аналог для подавления иммунитета живого организма и облегчения инфицирования вирусом. Далее, вирус по настоящему изобретению можно применять вместе по крайней мере с одним противораковым агентом, выбранным из группы, состоящей из известных противораковых агентов, и радиации. Отдельные примеры противораковых агентов включают следующие агенты, но не ограничиваются ими.(1) Алкилирующие агенты: эти агенты вызывают цитотоксичность, вводя алкильные группы в нуклеиновую кислоту/белок раковых клеток. Примеры включают карбокон, бусульфан (горчичные лекарства) и мимустин (нитромочевины).(2) Антиметаболические агенты: эти агенты оказывают эффект, угнетающий клеточный синтез через влияние антагонистических ферментов в процессах метаболизма. Примеры включают метоторексат(3) Антибиотики: эти агенты имеют противораковое действие. Примеры включают актиномицин D,блеомицин, адриамицин и митомицин С.(4) Антимикротрубочковые агенты: эти агенты действуют на микротрубочки и проявляют противораковое действие. Примеры включают доцетаксел, паклитаксел (таксаны) и винорелбин, винкристин,винбластин (алкалоиды).(5) Препараты платины: эти препараты угнетают синтез ДНК, образуя перекрстные связи внутри или между нитями ДНК или поперечные связи ДНК-белок. Примеры включают цисплатин, карбоплатин и недаплатин.(6) Топоизомеразные ингибиторы: к ним можно отнести иринотекан (ингибитор топоизомеразы I),производные подофиллотоксина (ингибитор топоизомеразы II) и т. п. Топоизомераза - это фермент, который катализирует реакцию изменения числа связей ДНК путм временного обрезания одной или обеих нитей ДНК. Полагают, что вероятность того, что агент, индуцирующий гибель клеток по данному изобретению,вызовет побочные эффекты, крайне мала по причинам, описанным ниже. Таким образом, агент, индуцирующий гибель клеток по данному изобретению, представляет собой очень безопасный препарат.(1) Теломеразная активность в нормальных клетках очень мала и вирус по настоящему изобретению едва ли будет инфекционным в поддерживающих клетках, таких как кроветворные клетки.(2) Поскольку вирус по настоящему изобретению способен к репликации, возможно применять этот вирус при концентрации ниже, чем таковая у обычного, не реплицирующегося компетентного вируса,применяемого в обычной генной терапии.(3) Даже когда вирус по настоящему изобретению дан в избытке, антивирусное действие происходит через обычную иммунную реакцию живого организма. Индуцировать клеточную гибель в целевой клетке возможно путм инфицирования целевой клетки рекомбинантным вирусом по настоящему изобретению. Виды целевых клеток не особенно ограничены. Например, можно применять клетки опухолей, клетки с активной репликацией, клетки, чья теломеразная активность увеличена, и т.п. Заражение клеток рекомбинантным вирусом имеет значение, описанное выше. Чтобы подтвердить, индуцирована или нет гибель клеток, можно провести морфологическое исследование, как описано ниже. Вкратце, клетки, прикреплнные ко дну культурального планшета, инфицируют рекомбинантным вирусом по настоящему изобретению. Через определнное время форма клеток становится округлой, и они переходят во взвесь в культуральной среде в виде блестящих клеток, открепившихся от дна. К этому- 10011880 времени механизм, поддерживающий жизнь этих клеток, нарушен, и можно отметить, что индуцирована гибель клеток. Иначе также возможно подтвердить гибель клеток с помощью коммерческого набораопределителя жизнеспособных клеток с применением солей тетразолия (например, МТТ, ХТТ). Ниже настоящее изобретение будет описано более детально на основе следующих примеров. Однако настоящее изобретение не ограничено этими примерами. Пример 1. Визуализация раковых клеток путм коинфекции in vitro. В этом примере предварительно выяснено, может или нет флюоресценция иметь место in vitro, когда раковые клетки коинфицированы теломелизин-вирусом, содержащим репликационную кассету и нереплицирующий Ad-GFP вирус, включающий маркировочную кассету. Раковые клетки толстой кишки человека SW620 и раковые клетки лгких человека А 549 и H1299 были инфицированы 0,1 MOI (множественность инфекции) от Ad-GFP (фиг. 2). В результате, тенденция к позеленению была едва различима, когда раковые клетки толстой кишки человека SW620 и раковые клетки лгких человека А 549 и H1299 были инфицированы 0,1 MOI (множественность инфекции) от Ad-GFP. Однако, когда применили совместно 1 MOI от TRAD, флюоресценцию можно было различить только в раковых клетках и не было обнаружено флюоресценции в нормальных клетках, таких как клетки-фибробласты человека WI38 и NHLF и клетки эндотелия сосудов пупка человека (HUVEC) (фиг. 3). Пример 2. Визуализация раковых тканей путм соинфекции in vivo теломелизином и Ad-GFP. В этом примере предварительно выясняли, будет ли присутствовать флюоресценция in vivo, когда раковые ткани соинфицированы теломелизин-вирусом, содержащим репликационную кассету и нереплицирующий вирус Ad-GFP, содержащий маркировочную кассету.Ad-GFP (8105 БОЕ) и TRAD (8106 БОЕ) были введены внутрь опухолей в раковую опухоль толстой кишки человека SW5620 и в раковую опухоль лгких человека А 549, предварительно пересаженные в дорсальную сторону безволосых (голых) мышей. Затем наблюдали флюоресценцию по прошествии некоторого времени. Во всех опухолях флюоресценция пятнами начала наблюдаться со второго дня введения и исчезала к 14 дню (фиг. 4). Пример 3. Обнаружение раковых клеток с помощью теломелизина-GFP. 1. Приготовление экспрессирующего GFP, репликационно компетентного вируса (теломелизинGFP), который включает репликационную кассету с теломеразным промотором и ген E1 и маркировочную кассету с геном, кодирующим GFP в единичном вирусе. Очертание теломелизин-GFP показано на фиг. 1. Теломелизин пролиферирует/реплицирует раковые клетки специфически и теломеразу специфически, поскольку E1A/IRES/E1B управляется hTERTпромотором. Далее, теломелизин-GFP также имеет GFP ген, полученный из Aequorea Victoria, интегрированный в свою Е 3 область, который управляется промотором. Поэтому клетки, в которых наблюдается репликация вируса, издают зелную флюоресценцию при возбуждающем освещении, что позволяет визуализировать раковые клетки. Такой репликационно инкомпетентный вирус был приготовлен, как описано ниже. 2. Приготовление рекомбинантного вируса Из РНК, извлечнной из клеток 293, амплифицировали ген Е 1 А из 897 п.о. с помощью RT-PCR,применяя специфические праймеры (E1A-S и E1A-AS) и PCR условия, описанные ниже. Состав PCR раствора: 1PCR буфер Из ДНК, извлечнной из клеток 293, ген Е 1 В из 1822 п.о. был амплифицирован с помощью DNAPCR с применением следующих праймеров E1B-S и E1B-AS. Применнный состав PCR раствора и условия реакции (циклы, температура) были те же, как применнные для амплификации гена Е 1 А. Каждый продукт PCR был подвергнут ТА клонированию (набор ТА Cloning Kit Dual Promoter; Invitrogen), чтобы тем самым подтвердить их последовательность. Затем фрагменты ДНК из 911 п.о. (Е 1 А) и- 11011880 1836 п.о. (Е 1 В) были вырезаны, соответственно, с помощью рестрикционного фермента EcoRI.E1A и Е 1 В были введены в сайт M1uI и сайт SalI, соответственно, вектора pIRES vector (CLONTECH) в нормальном положении (E1A-IRES-E1B). Последовательность hTERT промотора из 455 п.о., которая была вырезана с помощью рестрикционных ферментов MluI и BglII была введена в сайт XhoI, расположенный в обратном направлении от Е 1 А в E1A-IRES-E1B при нормальной ориентировке (phTERT-E1A-IRES-E1B). Цитомегаловирусный (CMV) промотор, содержащийся в pShuttle векторе, был удалн посредством обработки рестрикционными ферментами MfeI и NheI. Затем, последовательность 3828 п.о., вырезанная из phTERT-E1A-IRES-Е 1 В с помощью рестрикционных ферментов NheI и NotI, была введена в этот сайтpEGFP-N1 (CLONTECH) был обработан с помощью AgeI/NheI, затупленного с помощью фрагмента Клнова и самолигированного (pEGFP-N2). Этот pEGFP-N2 был обработан NsiI/AflII и затуплен с помощью Т 4 DNA полимеразы, за чем следовало приготовление сайта BglII с применением линкера BglII. Этот фрагмент BglII был введн в сайтphTERT-E1A-IRES-E1B был интегрирован (pSh-hAIB). Последовательность А 4381 п.о. была вырезана из таким образом приготовленного рекомбинантого гена (pSh-hAIB) с применением рестрикционных ферментов I-CeuI и PI-SceI и введена в Adeno-X вирусной ДНК системы экспрессии Adeno-X (CLONTECH) (AdenoX-hAIB). Данный AdenoX-hAIB был обработан рестрикционным ферментом PacI для линеаризации и затем перемещн в клетки 293, чтобы тем самым приготовить инфекционный рекомбинантный аденовирус (здесь и далее именуемый теломелизин-GFP). Пример 4. Выявление клеток рака лгких человека. 1. Морфологические изменения в клетках рака лгких человека, вызванные инфекцией теломелизином-GFP. Клетки, извлеченные из немелкоклеточого рака лгких, H1299 культивировали in vitro и инфицировали теломелизином-GFP в дозе 1 MOI или 10 MOI. Конкретно, клетки H1299 помещали на планшеты с 24 лунками, по 5104 клеток на лунку. Через 24 ч клетки подсчитывали и добавляли вирус в культуральной среде до концентрации 1 MOI или 10 MOI. Затем наблюдали морфологию клеток под обращенным микроскопом по прошествии времени, достаточном, чтобы наблюдалась цитотоксическая активность вируса. В результате, репликация вируса вызывала гибель клеток в зависимости от концентрации и от времени. Через 120 ч после инфицирования 10 MOI большинство клеток становились круглыми и при рассмотрении в обращенный микроскоп были во взвеси (фиг. 5). 2. Эмиссия GFP флюоресценции клетками рака лгких человека, вызванная инфицированием теломелизином-GFP. Изображения под обращенным (инвертированным) микроскопом, показанные на фиг. 6, наблюдали под флюоресцентным микроскопом. Наблюдалась зелная флюоресценция GFP, указывающая на репликацию вируса в зависимости от концентрации и времени (фиг. 6). Через 72 ч после инфицирования 10MOI экспрессия GFP наблюдалась в максимальном числе клеток. Затем число GFP-позитивных клеток понижалось и индуцировалась гибель клеток (фиг. 6). 3. Верификация теломелизин-GFP репликации на основе количественной PCR в реальном времени. Клетки рака лгких человека H1299 инфицировали теломелизином-GFP в концентрации 10 MOI. Пробы клеток отбирали через 2, 26, 50 и 74 ч после инфицирования и из них извлекали ДНК. ПроводилиPCR в реальном времени, применяя следующие праймеры, нацеленные на ген Е 1 А теломелизина-GFP,чтобы количественно анализировать пролиферацию/репликацию вируса. Праймеры и применнные условия указаны ниже. Результаты показали, что теломелизин-GFP уже реплицирован в 1,000,000 раз через 26 ч после инфекции (фиг. 7). Затем репликация достигает плато, но GFP флюоресценция также слегка усиливается- 12011880 после репликации (фиг. 7). Пример 5. Выявление клеток рака толстой кишки человека. 1. Эмиссия GFP флюоресценции клеток рака толстой кишки человека, вызванная инфицированием теломелизином-GFP. Клетки, извлечнные из рака толстой кишки человека, SW620 были инфицированы теломелизиномGFP на уровне 10 MOI. Изменения в клетках наблюдали по прошествии времени под обращенным микроскопом и флюоресцентным микроскопом. В результате обнаружена GFP зелная флюоресценция, указывающая на репликацию вируса в зависимости от времени, как и в случае клеток H1299 (фиг. 8). 2. Верификация теломелизин-GFP репликации с помощью количественной PCR в реальном времени. Тем же способом, как и с клетками H1299, клетки рака толстой кишки человека были инфицированы теломелизином-GFP на уровне 10 MOI. Пробы клеток отбирали через 2, 26, 50, 74 и 98 ч после инфицирования и их низ извлекали ДНК. Затем репликацию вируса количественно анализировали с помощьюPCR в реальном масштабе времени. PCR в реальном масштабе времени выполняли с помощью следующих праймеров, направленных на ген Е 1 А теломелизина-GFP, чтобы таким образом количественно проанализировать репликацию вируса. Условия PCR в реальном масштабе времени (состав реакционного раствора, цикл, период времени и т.д.) были те же, что и для клеток H1299. Результаты показали, что теломелизин-GFP уже реплицирован в 1,000,000 раз через 26 ч после инфекции и почти достигал плато через 98 ч после инфицирования (фиг. 9). Пример 6. 1. Морфологические изменения в нормальных клетках-фибробластах лгких человека (NHLF), вызванные инфицированием теломелизином-GFP. Нормальные клетки-фибробласты лгких человека (NHLF) культивировали in vitro и инфицировали теломелизином-GFP на уровне 1 MOI или 10 MOI. Изменения наблюдали под обращенным микроскопом в течение до 120 ч после инфицирования. Результатом оказалось, что морфологические изменения не отмечены и гибель клеток не была индуцирована (фиг. 10). 2. Эмиссия GFP флюоресценции нормальными клетками-фибробластами лгких человека под воздействием инфицирования теломелизином-GFP Когда изображения под обращенным микроскопом, показанные на фиг. 10, рассматривали под флюоресцентным микроскопом, в некоторых клетках была обнаружена эмиссия GFP флюоресценции. Однако, принимая во внимание густоту клеток, эмиссия была чрезвычайно слабой по сравнению с таковой, издаваемой раковыми клетками. Поэтому полагают, что теломелизин-GFP едва ли пролиферирует/реплициует в нормальных клетках (фиг. 11). 3. Верификация теломелизин-GFP репликации с помощью количественной PCR в реальном времени. Клетка рака лгких человека H1299, клетка рака толстой кишки человека SW620 и нормальная клетка-фибробласт лгких человека (NHLF) были инфицированы теломелизином-GFP на уровне 10 MOI,как описано выше. По прошествии времени отбирали пробы клеток и из них извлекали ДНК. Затем количественно анализировали вирусную репликацию с помощью PCR в реальном масштабе времени. Результаты показали, что теломелизин-GFP уже реплицировался примерно в 1,000,000 раз в раковых клетках через 24 ч поле инфицирования и издавал заметную GFP флюоресценцию через 72 ч после инфицирования (фиг. 12). С другой стороны, репликация была лишь около 1000 раз у NHLF клеток даже через 72 ч после инфицирования и GFP флюоресценция была едва заметна (фиг. 12). Пример 7. Выявление пролиферации/репликации теломелизина-GFP внутри опухоли с помощью флюоресцентной визуализации. 1. Теломелизин-GFP (107 БОЕ) вводили в опухоль рака лгких человека H1299, трансплантированную в безволосых мышей. Затем наблюдали эмиссию GFP флюоресценции с течением времени с помощью CCD камеры. Результаты показали, что эмиссию GFP флюоресценции, вызванной теломелизин-GFP репликацией,можно было обнаружить через 24 ч после инфицирования и что уровень свечения постепенно увеличивался через 3 и 5 дней после инфицирования (фиг. 13). 2. Тем же способом, как описано выше, теломелизин-GFP (107 БОЕ) вводили в опухоль рака лгких человека H1299, трансплантированную в безволосых мышей. Через неделю и через три недели подкожную опухоль удаляли. Эмиссию GFP флюоресценции наблюдали на целой опухоли и на разрезе с помощью CCD камеры. В результате, даже когда флюоресценция была слабой на поверхности удалнной опухоли, репликацию теломелизина-GFP можно было наблюдать в широком диапазоне на поверхности разреза (фиг. 14). В тканях через три недели после инфицирования флюоресцеция была заметна почти по всей поверхности опухоли (фиг. 14). 3. Тем же способом, как описано выше, клетки рака толстой кишки человека НТ 29 были трансплан- 13011880 тированы в стенку прямой кишки безволосых мышей в качестве ортопической модели и теломелизинGFP (107 БОЕ) был введн, когда сформировалась большая опухоль. Эмиссия GFP флюоресценции, вызванной репликацией теломелизина-GFP, была отмечена через неделю после инфицирования с помощьюCCD камеры (фиг. 15). Флюоресценция продолжалась даже через три недели после инфицирования (фиг. 15). Пример 8. 1. Гистологический анализ орторопной модели ректального рака с помощью безволосых мышей и клеток рака толстой кишки человека НТ 29. Клетка рака толстой кишки человека НТ 29 была трасплантирована в стенку прямой кишки безволосой мыши. Когда образовалась большая опухоль, она была удалена и изучена после окрашивания гематоксилином-эозином (НЕ). В результате вокруг прямой кишки образовалась опухоль и массу опухолевых клеток можно было обнаружить в лимфатических сосудах стенки прямой кишки (фиг. 16). 2. Результаты вскрытия ортотопической модели рака прямой кишки на безволосых мышах и клетках рака толстой кишки человека НТ 29. Клетка рака толстой кишки человека НТ 29 была трансплантирована в стенку прямой кишки и, когда образовалась большая опухоль, было произведено вскрытие. В результате в трх лимфатических узлах (LN) была обнаружена припухлость вокруг аорты (фиг. 17). 3. Обнаружение внутриопухолевой пролиферации/репликации теломелизина-GFP в ректальной опухоли НТ 29 и лимфатических узлах около аорты с помощью флюоресцентной визуализации. Эмиссия GFP флюоресценции была выявлена на основе флюоресцентной визуализации с помощьюCCD камеры в трансплантированной ректальной опухоли НТ 29 и в одном из трх околоаортных лимфатических узлов (фиг. 18). 4. Выявление внутриопухолевой пролиферации/репликации теломилизина-GFP в околоаортных лимфатических узлах с помощью флюоресцентной визуализации. Эмиссия GFP флюоресценции была обнаружена на основе флюоресцентной визуализации с помощью CCD камеры только в одном из трх околоаортных лимфатических узлов (фиг. 19). 5. Выявление внутриопухолевой пролиферации/репликации теломилизина-GFP в околоаортных лимфатических узлах с помощью флюоресцентной визуализации. Гистологический анализ околоаортных лимфатических узлов выявил метастатическую опухолевую ткань только в одном лимфатическом узле, который дал позитивную реакцию на GFP флюоресценцию при флюоресцентной визуализации с помощью CCD камеры. Таким образом, было подтверждено, что теломелизин-GFP реплицирует только в положительных на метастаз лимфатических узлах (фиг. 20). Цитированная литература(dl1520): phase II viral, immunologic, and clinical endpoints. Cancer Res 62 (21): 6070-9, 2002. Возможность для промышленного использования В соответствии с настоящим изобретением созданы реагент для выявления раковых клеток и агент,индуцирующий гибель клеток. Поскольку реагент по настоящему изобретению может выявлять раковые клетки с чрезвычайно высокой чувствительностью даже в живом организме, реагент полезен в области так называемой навигационной хирургии и подобных областях. Свободный текст с перечислением последовательностей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Реагент для выявления раковых клеток, отличающийся тем, что он включает рекомбинантный вирус, в котором репликационная кассета, включающая промотор из теломеразы человека, ген Е 1 А, последовательность IRES и ген Е 1 В в таком порядке, интегрирована в область Е 1 генома вируса и маркировочная кассета, включающая ген, кодирующий маркировочный белок, и промотор, способный регулировать экспрессию гена, кодирующего маркировочный белок, интегрирована в область Е 3 генома вируса. 2. Реагент для диагностирования рака, отличающийся тем, что он включает рекомбинантный вирус,в котором репликационная кассета, включающая промотор из теломеразы человека, ген Е 1 А, последовательность IRES и ген Е 1 В в таком порядке, интегрирована в область Е 1 генома вируса и маркировочная кассета, включающая ген, кодирующий маркировочный белок, и промотор, способный регулировать экспрессию гена, кодирующего маркировочный белок, интегрирована в область Е 3 генома вируса. 3. Реагент по пп.1 и 2, отличающийся тем, что реагент применяется для выявления или диагности- 14011880 рования рака in vivo или для навигационной хирургии. 4. Реагент по пп.1 и 2, отличающийся тем, что промотор из теломеразы человека представляет собой hTERT промотор. 5. Реагент по пп.1 и 2, отличающийся тем, что маркировочный белок представляет собой GFP. 6. Реагент по пп.1 и 2, отличающийся тем, что промотор, способный регулировать экспрессию гена,кодирующего маркировочный белок, представляет собой цитомегаловирусный промотор или hTERTпромотор. 7. Реагент по пп.1 и 2, отличающийся тем, что вирус представляет собой аденовирус. 8. Агент, индуцирующий гибель клеток, отличающийся тем, что он включает рекомбинантный вирус, в котором репликационная кассета, содержащая промотор из теломеразы человека, ген Е 1 А, последовательность IRES и ген Е 1 В в таком порядке, интегрирована в область Е 1 генома вируса, и кассета,индуцирующая гибель клеток, включающая ген, кодирующий белок, ассоциированный с индукцией гибели клеток, и промотор, способный регулировать экспрессию гена, кодирующего белок, интегрирована в область Е 3 генома вируса. 9. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что промотор из теломеразы человека представляет собой hTERT-промотор. 10. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что белок, ассоциированный с индукцией гибели клеток, представляет собой по крайней мере один из белков, выбранных из группы,состоящей из белка, ассоциированного с иммунитетом, белка, индуцирующего апоптоз, и белка, ассоциированного с теломеразой. 11. Агент, индуцирующий гибель клеток, по п.10, отличающийся тем, что белок, ассоциированный с иммунитетом, представляет собой РА 28. 12. Агент, индуцирующий гибель клеток, по п.10, отличающийся тем, что белок, индуцирующий апоптоз, представляет собой TRAIL. 13. Агент, индуцирующий гибель клеток, по п.10, отличающийся тем, что белок, ассоциированный с теломеразой, представляет собой AU5. 14. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что промотор, способный регулировать ген, кодирующий белок, ассоциированный с индукцией гибели клеток, представляет собой цитомегаловирусный промотор или hTERT-промотор. 15. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что вирус представляет собой аденовирус. 16. Агент, индуцирующий гибель клеток, по п.8, отличающийся тем, что клетка представляет собой раковую клетку. 17. Метод выявления раковых клеток, отличающийся тем, что он включает инфицирование раковых клеток реагентом по любому из пп.1 и 3-6 и выявление флюоресценции, излучаемой раковыми клетками. 18. Метод индуцирования клеточной гибели в целевой клетке, отличающийся тем, что он включает инфицирование целевой клетки агентом, индуцирующим клеточную гибель, по любому из пп.8-16.- 22011880 СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ НУКЛЕОТИДОВ И/ИЛИ АМИНОКИСЛОТ
МПК / Метки
МПК: C12N 15/09, C12Q 1/04, A61P 35/00, A61K 48/00, C12N 7/00
Метки: содержащий, теломелизина-gfp, ген, вирус, рекомбинантный
Код ссылки
<a href="https://eas.patents.su/30-11880-rekombinantnyjj-virus-soderzhashhijj-gen-telomelizina-gfp.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантный вирус, содержащий ген теломелизина-gfp</a>
Предыдущий патент: Молекулы с модифицированным fс фрагментом
Следующий патент: Лиофилизация виросом
Случайный патент: Управление локализованным медиа-контентом